Mündliche Anhörung. gemäß 5. Kapitel 19 Abs. 2 Verfahrensordnung des Gemeinsamen. hier: Wirkstoff Tofacitinib (CU)
|
|
|
- Minna Weiner
- vor 5 Jahren
- Abrufe
Transkript
1 Mündliche Anhörung gemäß 5. Kapitel 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses hier: Wirkstoff Tofacitinib (CU) Sitzung im Hause des Gemeinsamen Bundesausschusses in Berlin am 7. Januar 2019 von 15:15 Uhr bis 15:35 Uhr Stenografisches Wortprotokoll
2 Angemeldete Teilnehmer der Firma AbbVie Deutschland GmbH: Herr Dr. Holland Frau Dr. Sternberg Angemeldete Teilnehmer der Firma AMGEN GmbH: Herr Franke Frau Dr. Herrmann Angemeldete Teilnehmer der Firma Medac GmbH: Herr Bahr Herr Dr. Erdmann Angemeldete Teilnehmer der Firma MSD SHARP & DOHME GmbH: Herr Dr. Gladbach Frau Dr. Steck Angemeldete Teilnehmer der Firma Pfizer Pharma GmbH: Herr Dr. Behmer Frau Dr. Dietz Frau Dr. Kisser Herr Leverkus Angemeldete Teilnehmer der Firma Takeda Pharma Vertrieb GmbH& Co. KG: Herr Dr. Batra Frau Gruß Angemeldeter Teilnehmer der Deutschen Dermatologischen Gesellschaft e. V. (DDG): Herr Prof. Dr. Augustin Angemeldeter Teilnehmer der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS): Herr Prof. Dr. Atreya Angemeldete Teilnehmer des Verbandes Forschender Arzneimittelhersteller e. V. (vfa): Herr Dr. Rasch Herr Dr. Werner
3 Beginn der Anhörung: 15:15 Uhr (Die angemeldeten Teilnehmer betreten den Raum) Herr Prof. Hecken (Vorsitzender): Meine sehr verehrten Damen und Herren! Herzlich willkommen im Unterausschuss Arzneimittel des G-BA. Zu Beginn des neuen Jahres wünschen wir auch denjenigen, die jetzt neu sind, noch ein frohes neues Jahr. Wir sind im Stellungnahmeverfahren Tofacitinib, hier Anwendungsgebiet Colitis ulcerosa. Basis der heutigen Anhörung ist die Dossierbewertung des IQWiG vom 28. November 2018, zu der Stellung genommen haben zum einen Pfizer als pharmazeutischer Unternehmer, zum anderen die Arzneimittelkommission der Deutschen Ärzteschaft, dann die DGVS, die Fachgruppe CED im Berufsverband Niedergelassener Gastroenterologen, des Weiteren AMGEN, Medac, MSD Sharp & Dohme, Takeda, AbbVie und der vfa. Wir haben eine ganze Reihe von Teilnehmern, die wir zunächst für das Protokoll hier begrüßen müssen. Für Pfizer ist wieder Herr Leverkus da er war eben schon da, außerdem Frau Dr. Kisser, Frau Dr. Dietz und Herr Dr. Behmer jawohl. Herr Professor Dr. Augustin für die Deutsche Dermatologische Gesellschaft ist nicht da. Es müsste aber für die DGVS Herr Professor Dr. Atreya da sein jawohl. Dann haben wir für AbbVie Herrn Dr. Holland und Frau Dr. Sternberg ja, weiter Herrn Franke und Frau Dr. Hermann für AMGEN ja, dann die Herren Bahr und Dr. Erdmann für Medac, die wir schon den ganzen Morgen hier haben, außerdem Herrn Dr. Gladbach sowie Frau Dr. Steck von MSD ja, Herrn Dr. Batra und Frau Gruß von Takeda ja und die Herren Rasch und Werner vom vfa. Seien Sie herzlich willkommen! Wir führen wieder Wortprotokoll. Bitte benutzen Sie das Mikrofon und nennen sie Ihren Namen, da wir die Schilder aufgrund der Distanz nicht lesen können. Ich gebe zunächst dem pharmazeutischen Unternehmer die Möglichkeit zur einleitenden Stellungnahme. Für uns wäre wichtig, dass wir uns vor allem über die Frage unterhalten, inwieweit die Einleitung einer Remission ohne Daten zur weiteren Remissionserhaltung eine notwendige Fragestellung für die Versorgung ist; das ist ja auch in verschiedenen Stellungnahmen adressiert worden. Dann ist eine relevante Frage, die an den Praktiker geht: Inwieweit sind Placebo-kontrollierte Studien in diesem Anwendungsgebiet für die klinische Praxis aussagekräftig? Außerdem ist folgende Frage spannend: Gibt es in der klinischen Praxis abgrenzende Kriterien zur Differenzierung sowie einheitliche Therapieempfehlungen für Patienten, die auf jegliche biologische Therapie versagt haben? Das sind Fragestellungen, die wir nach der Einleitung auf alle Fälle erörtern müssen. Wer fängt an? Herr Leverkus, bitte schön. Herr Leverkus (Pfizer): Vielen Dank für die einleitenden Worte, Herr Vorsitzender. Bevor wir über Tofacitinib in der neuen Indikation sprechen, möchte ich meine Kollegen vorstellen, die mit mir hier sind. Rechts neben mir sitzt Frau Dr. Anke Kisser; Frau Kisser ist in meinem Team für das Dossier zuständig. Rechts daneben sehen Sie Frau Dr. Dietz; sie ist aus der Abteilung Medizin für Tofacitinib UC zuständig. Rechts neben ihr sitzt Herr Dr. Behmer, der ebenso in der Medizin für Tofacitinib UC zuständig ist. Mit Ihrem Einverständnis würde ich jetzt das Wort an Herrn Dr. Behmer geben, der über die medizinischen Hintergründe referieren wird. Danke. Herr Prof. Hecken (Vorsitzender): Jawohl! Herr Behmer, bitte. 3
4 Herr Dr. Behmer (Pfizer): Vielen Dank. Die Colitis ulcerosa ist eine meist schubweise verlaufende chronisch entzündliche Darmerkrankung. Die betroffenen Patienten leiden unter häufigen blutig-schleimigen Durchfällen, im akuten Schub bis zu zehnmal am Tag und öfter, schmerzhaftem Stuhldrang sowie krampfartigen Schmerzen im Unterbauch. Abhängig vom Schweregrad der Erkrankung kommt es zusätzlich oft zu Gewichtsverlust, chronischer Müdigkeit, Blutarmut, Fieber und Flüssigkeitsverlust. Ausgeprägte rektale Blutungen, Darmperforationen sowie das Auftreten eines sogenannten toxischen Megacolons sind schwerwiegende Komplikationen der Erkrankung. Langfristige Folgen sind vor allem ein erhöhtes Risiko für Dickdarmkrebs sowie die mögliche Notwendigkeit einer operativen Entfernung des Dickdarms, häufig als letzte Behandlungsmöglichkeit nach Ausschöpfen der konservativen Therapieoptionen. Die Lebensqualität der Patienten ist durch den hohen Leidensdruck oft deutlich eingeschränkt, und es kommt nicht selten zur Entwicklung von Ängsten und Depressionen. Aufgrund der hohen Krankheitslast haben diese eher jüngeren Patienten, die mitten in den produktiven Jahren ihres Lebens stehen, daher häufig große Schwierigkeiten, ein normales berufliches und privates Leben zu führen. Neben konventionellen Therapien wie Aminosalizylaten, Thiopurinen und Glucocorticoiden haben in den letzten Jahren insbesondere die Biologika wie die TNF-Inhibitoren Infliximab und Adalimumab die Behandlung mittelschwer bis schwer betroffener Patienten mit aktiver Colitis ulcerosa deutlich verbessert. Allerdings spricht mindestens jeder dritte Patient primär auf die Behandlung mit TNF-Inhibitoren nicht oder nur unzureichend an. Außerdem kommt es bei fast jedem zweiten Patienten, der initial von der Behandlung profitiert, im Laufe der Zeit zu einem Nachlassen der Wirkung. Ein wichtiger Grund hierfür ist die Entwicklung von sogenannten neutralisierenden Antikörpern, die die Wirkung der Biologika reduzieren oder aufheben. Oft ist in solchen Fällen eine Erhöhung der Dosis des Biologikums oder der Wechsel auf ein anderes Präparat erforderlich. Ein weiterer Nachteil dieser Substanzen ist, dass sie entweder intravenös oder subkutan verabreicht werden müssen. Neben den drei in Deutschland für die Behandlung der Colitis ulcerosa zugelassenen TNF-Inhibitoren existiert mit der Substanz Vedolizumab lediglich eine weitere Therapieoption mit einem anderen Wirkmechanismus. Allerdings erreicht auch unter diesen weiterführenden Therapien weniger als die Hälfte der Patienten eine Langzeitremission. Daher besteht nach wie vor ein hoher Bedarf an weiteren effektiven Behandlungsmöglichkeiten dieser Erkrankung. Das Medikament Tofacitinib stellt eine solche Therapiealternative für die Behandlung von Patienten mit Colitis ulcerosa dar. Zunächst einmal handelt es sich hier um einen völlig neuartigen Wirkansatz für die Behandlung dieser Erkrankung. Anders als die Biologika ist Tofacitinib ein relativ kleines Molekül, das in die Zellen eindringen kann. Dort unterbindet es durch die Hemmung der sogenannten Januskinasen Signalübertragungswege, die den Entzündungsprozess bei der Colitis ulcerosa unterhalten. Ein großer Vorteil für die Patienten ist, dass Tofacitinib aufgrund seiner geringen Molekülgröße das ist ein großer Unterschied zu den Biologika oral verabreicht werden kann. Dies wird von vielen Patienten gegenüber der subkutanen oder der intravenösen Gabe bevorzugt. Außerdem werden hierdurch unerwünschte Reaktionen vermieden, die durch eine Injektion bedingt sind. Wichtig ist auch das Fehlen von neutralisierenden Antikörpern unter der Therapie mit Tofacitinib. Diese führen, wie gesagt, bei Biologika oft zu einem sekundären Wirkverlust. Eine weitere positive Eigenschaft von Tofacitinib ist seine kurze Halbwertszeit von nur circa drei Stunden, im Gegensatz zu den Biologika, bei denen diese mehrere Wochen beträgt. Hierdurch ist das mögliche Auftreten von Nebenwirkungen, Infektionen oder akut notwendigen operativen Eingriffen unter Tofacitinib besser steuer- und beherrschbar. 4
5 Die Europäische Kommission hat im Juli letzten Jahres den Wirkstoff Tofacitinib als ersten Januskinase-Inhibitor in den Dosierungen 5 und 10 mg zweimal täglich zur Behandlung erwachsener Patienten mit mittelschwerer bis schwerer aktiver Colitis ulcerosa zugelassen. Die Patienten müssen zuvor entweder auf eine konventionelle Therapie oder ein Biologikum unzureichend angesprochen haben, nicht mehr darauf ansprechen oder diese Präparate nicht vertragen haben. In seiner Zulassungsentscheidung hat der Ausschuss für Humanarzneimittel der Europäischen Arzneimittelagentur EMA explizit einen signifikanten klinischen Nutzen von Tofacitinib für Patienten mit Colitis ulcerosa gegenüber den vier existierenden biologischen Therapieoptionen festgestellt. Wesentliche Grundlage für die Zulassung von Tofacitinib war das OCTAVE-Programm, in dem die Substanz bei einer signifikant höheren Zahl an Patienten eine sogenannte steroidfreie Remission induzierte und aufrechterhielt. Hierbei profitierten sowohl TNF-Hemmer-naive Patienten als auch solche nach TNF- Inhibitor-Versagen von der Therapie mit Tofacitinib. Gerade für die letztere Patientengruppe existieren bislang nur sehr wenige Therapieoptionen. Ein weiterer wichtiger Aspekt ist der schnelle Wirkeintritt von Tofacitinib. Eine signifikante Verbesserung bei den patientenrelevanten Parametern Stuhlfrequenz und rektale Blutungen wurde bereits drei Tage nach Therapiebeginn beobachtet. Neben der Wirksamkeit wurde natürlich auch die Sicherheit und Verträglichkeit von Tofacitinib untersucht. So zeigten sich in einer Analyse von Sicherheitsdaten von Patienten mit Colitis ulcerosa, die bis zu 4,4 Jahre mit Tofacitinib behandelt wurden, keine neuen oder unerwarteten unerwünschten Ereignisse im Vergleich zu bereits vorhandenen Daten aus anderen Indikationen. Zum Thema Sicherheit liegen darüber hinaus bereits umfangreiche Erfahrungen mit Tofacitinib in der Indikation rheumatoide Arthritis vor, für die das Präparat seit 2017 in Deutschland zugelassen ist. Diese Daten stammen unter anderem aus einem umfangreichen Studienprogramm mit mehr als Patientenbehandlungsjahren und mehr als neun Jahren Dauer. Zusätzlich sind weltweit nach Zulassung bereits mehr als RA-Patienten mit Tofacitinib behandelt worden. Auch wenn die Daten aus der rheumatoiden Arthritis nur mittelbar auf die Colitis ulcerosa übertragbar sind, bestätigen sie dennoch die grundsätzliche Sicherheit und Verträglichkeit der Substanz. Zusammenfassend möchte ich festhalten, dass Tofacitinib für die Versorgung von Patienten mit Colitis ulcerosa einen klinisch relevanten Zusatznutzen bietet, der allerdings aus methodischen Gründen in unserem Dossier nicht abgebildet werden konnte. Herr Vorsitzender, meine Damen und Herren, ich bedanke mich für Ihre Aufmerksamkeit. Herr Prof. Hecken (Vorsitzender): Danke schön, Herr Dr. Behmer, Herr Leverkus, für diese Einleitung. Fragen? Wer möchte? Niemand; alle glücklich und zufrieden. Frau Sander. Frau Dr. Sander: Wir finden Folgendes ausgesprochen schade: Sie haben ja ich adressiere gleich den pharmazeutischen Unternehmer dargestellt, dass Sie anscheinend Vorteile gegenüber TNF-α- Hemmern sehen. Dass Sie sie aus methodischen Gründen nicht darlegen können, ist wirklich schwierig für Patienten, weil es eine neue Wirkstoffklasse ist und wir natürlich gern den Stellenwert innerhalb des Therapieregimes für die Menschen sehen möchten. Können Sie vielleicht noch mal ganz kurz sagen, warum Sie nicht einmal die Induktionsstudien als vergleichende Studien genutzt haben, um da einen Zusatznutzen ableiten zu können? Herr Prof. Hecken (Vorsitzender): Bitte schön. 5
6 Frau Dr. Kisser (Pfizer): Wir haben die Induktionsstudie aus dem Grund nicht dargestellt, weil auch die Induktionsstudien nur gegen Placebo und auch nur über den Zeitraum von acht Wochen geführt worden sind. Von daher war klar, dass wir die Fragestellung damit nicht vollständig beantworten können. Das war im Prinzip der Grund, warum wir sie nicht dargestellt haben. Zudem hätten wir immer noch einen indirekten Vergleich durchführen müssen, was natürlich auch methodisch, also von der Aussagekraft her, nicht so hochwertig ist wie eine direkt vergleichende Studie. Herr Prof. Hecken (Vorsitzender): Nachfrage Frau Sander. Frau Dr. Sander: Aber gerade für die TNF-α-Hemmer hätten doch acht Wochen schon ausgereicht. Bei Vedolizumab sehe ich das auch; das hat ein längerfristiges Wirkprinzip. Aber bei den TNF-α- Hemmern wäre das doch möglich gewesen, oder nicht? Herr Prof. Hecken (Vorsitzender): Wer macht das? Bitte schön. Herr Dr. Behmer (Pfizer): Als die Studien damals aufgelegt wurden, war es uns insbesondere wichtig, zu zeigen, dass die Substanz eine hohe Wirksamkeit bei Patienten hat, die bereits einen TNF-α-Blocker bekommen und auf diesen nicht ausreichend angesprochen haben, also bei den TNF-Versagern. Zu diesem Zeitpunkt gab es keine Substanz, die für diese Patienten zugelassen war. Alle drei TNF-Blocker sind nicht für die Behandlung von TNF-refraktären Patienten zugelassen. Auch das Vedolizumab, das damals, als die Studien begannen, noch nicht verfügbar war, erreichte in den Studien zumindest in der Induktionsphase keine signifikanten Ergebnisse in den Endpunkten. Deswegen war eine valide Vergleichssubstanz zu dieser Zeit nicht verfügbar. Herr Prof. Hecken (Vorsitzender): Wenn ich es richtig sehe, haben wir keine irgendwie geplanten direkt vergleichenden Studien. Ich habe noch eine Frage an Herrn Professor Atreya. Sie schreiben in Ihrer Stellungnahme, dass Tofacitinib eine wichtige therapeutische Alternative für Patienten mit unzureichendem Ansprechen auf derzeitige Therapieoptionen sei, also unmet need ; die Zulassungsstudie zeige Wirksamkeit hinsichtlich der wichtigen klinischen Parameter, unter anderem Einleitung der Remission, Erhaltung der Remission versus Placebo. Sie sagen dann zwar, dass keine direkt vergleichenden Studien vorliegen, sodass ein Zusatznutzen eben hier als nicht belegt anzusehen ist. Aber das führt mich zu der Frage, die ich einleitend gestellt habe, inwieweit die Einleitung einer Remission ohne Daten zur weiteren Remissionserhaltung eine praxisrelevante Fragestellung ist; denn die Remissionserhaltung ist doch wohl ein ganz wichtiger Faktor. Inwieweit sind Placebo-kontrollierte Studien hierzu aussagekräftig? Das wäre ja vielleicht auch eine Anregung, irgendwann einmal eine direkt vergleichende Studie zu haben. Weitere Frage: Gibt es in der klinischen Praxis abgrenzende Kriterien zur Differenzierung sowie zur einheitlichen Therapieempfehlung für Patienten, die auf jegliche biologische Therapie dann eben versagt haben? Das sind meines Erachtens die drei Punkte, um die wir uns jetzt noch so ein bisschen kümmern müssten. Bitte schön, Herr Professor Atreya. Herr Prof. Dr. Atreya (DGVS): Vielen Dank für diese relevanten Fragen. Zum einen gründet die Zulassung ja letztendlich auf Induktionsstudien und dann noch Remissionserhaltung. Das heißt, alle Medikamente, die jetzt in diesem Fachgebiet zugelassen werden, müssen eigentlich Daten sowohl zur Induktion als auch zur Remissionserhaltung vorweisen. 6
7 Sicherlich ganz wichtig sind diese Induktionsdaten, weil für uns Folgendes bedeutsam ist: Wie schnell wirkt das Medikament, zeigt es eine Wirkung in einem absehbaren Zeitraum? Sicherlich sind die Placebo-kontrollierten Studien vom Studiendesign her nicht perfekt; aber sie sind immer noch Standard bei uns in dem Therapiegebiet und werden daher auch angewandt. Meines Erachtens sind sie trotz aller Kritikpunkte immer noch das gängige Verfahren zur Zulassung von Medikamenten. Natürlich würden wir als Praktiker ich glaube, da darf ich an dem Punkt von Frau Sander anknüpfen uns direkte Head-to-Head-, also direkte Vergleichsstudien wünschen, gerade wenn wir Zulassungen für verschiedene Substanzklassen in der gleichen Indikation haben, beispielsweise bei Patienten, die auf konventionelle Therapie nicht ansprechen, bei denen man dann die Auswahl zwischen Biologika und jetzt dem zugelassenen JAK-Inhibitor hat. In solchen Fällen zeigen uns nur solche Vergleichsstudien zumindest einen gewissen Zusatznutzen. Dabei muss man sicherlich schauen, wie groß dann dieses Delta in solchen Vergleichsstudien ist, wobei ich ein bisschen skeptisch bin, ob es wirklich am Ende des Tages den entscheidenden Zusatznutzen bringt oder nicht. Aber ich glaube, das kann man auch separat noch einmal diskutieren. An Ihre Fragen anknüpfend: Ich glaube, Placebo-kontrollierte Studien sind der Standard; sie verwenden wir noch immer. Induktionsstudien sind wichtig. Aber es werden dann auch immer gleich Erhaltungsstudien nachgeliefert. Zu dem dritten Punkt, wenn ich es richtig verstanden habe: Wir brauchen Therapiealternativen, weil wir auch mit den vorhandenen Biologika selbst bei Patienten, die auf konventionelle Therapie nicht ansprechen, beispielsweise wegen Unverträglichkeiten oder aus anderen Gründen, noch Therapiealternativen benötigen und wir damit gerade bei Biologika-refraktären Patienten eine zusätzliche therapeutische Alternative haben. Frau Dr. Sander: Ich komme noch mal auf Ihre Gruppe von Patienten zurück, die auf konventionelle Therapien versagt haben. Nun haben wir keine Head-to-Head-Studie. Auch wenn alle nur Placebokontrollierte Studien machen, finden wir das nicht gut. Aber wie gehen Sie denn jetzt in der Praxis vor? Bei welchem Patienten, der auf eine konventionelle Therapie versagt hat, entscheiden Sie sich für TNFα, und wer kriegt Tofacitinib? Herr Prof. Dr. Atreya (DGVS): Eine ganz klassische Frage, die uns alle im Moment bewegt, worauf wir ganz klar sagen müssen: Wir haben keine Biomarker, die uns irgendeine Prädiktion erlauben, oder irgendwelche anderen Verfahren, die uns prädiktive Methoden liefern, um zu sagen, welcher Patient auf welche Therapien anspricht. Das heißt, wir richten uns letztendlich zum einen nach der Entzündungsaktivität ist sie sehr hoch oder eher moderat?, zum anderen natürlich nach der Präferenz des Patienten subkutane, intravenöse Anwendung oder orale Anwendung sowie nach Komorbiditäten des Patienten, beispielsweise Infektionsanfälligkeiten, weil es da doch Unterschiede im Nebenwirkungsprofil gibt. Das sind die Hauptparameter, zudem selbstverständlich die Schnelligkeit der Induktion, die uns eine gewisse Auswahl ermöglichen. Aber das sind letztendlich patientenindividuelle Faktoren oder krankheitsbasierte Faktoren, die unsere Entscheidung führen. Aber es ist ein Bereich, so muss man sagen, in dem es in Ermangelung von Head-to-Head-Studien keine wirklich rational nachvollziehbaren Entscheidungen gibt, sondern es sind wirklich klinische Parameter, die jeder behandelnde Arzt entsprechend wichtet. Herr Prof. Hecken (Vorsitzender): Danke. Wer möchte noch eine Frage stellen? Niemand mehr. Ja, gut. Da gibt es auch nicht mehr viel. Das tut mir leid. Wir machen es ja gleich noch einmal, in anderer Besetzung. Wir müssen jetzt nur wegen der Stenografen zwei, drei Minuten Pause machen. Ich würde 7
8 diese Anhörung an der Stelle beenden, nachdem Herr Leverkus noch mal kurz zusammengefasst hat, dass er auf sein Einleitungsstatement Bezug nimmt. Herr Leverkus (Pfizer): Ich kann mich nur noch einmal ganz herzlich für die offene und konstruktive Diskussion bedanken. Vielen Dank. Herr Prof. Hecken (Vorsitzender): Es gab ja nicht viel zu diskutieren. Wir unterbrechen jetzt für zehn Minuten, damit die Stenografen hier klarkommen, und dann nehmen wir in leicht unterschiedlicher Besetzung die Beratung wieder auf. Schluss der Anhörung: 15:35 Uhr 8
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben?
 Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Dossierbewertung A14-23 Nutzenbewertung gemäß 35a SGB V Version 1.0 Vedolizumab Colitis ulcerosa
 I 2 Nutzenbewertung I 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Vedolizumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
I 2 Nutzenbewertung I 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Vedolizumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V
Mesalazin bei Colitis ulcerosa Sind alle therapeutischen Möglichkeiten ausgereizt?
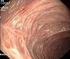 Mesalazin bei Colitis ulcerosa Sind alle therapeutischen Möglichkeiten ausgereizt? Von Prof. Dr. med. Stefan Schreiber Berlin (3. Oktober 2008) - Seit 1940 erstmals Sulfasalazine zur Therapie der entzündlichen
Mesalazin bei Colitis ulcerosa Sind alle therapeutischen Möglichkeiten ausgereizt? Von Prof. Dr. med. Stefan Schreiber Berlin (3. Oktober 2008) - Seit 1940 erstmals Sulfasalazine zur Therapie der entzündlichen
Dossierbewertung A14-26 Version 1.0 Empagliflozin Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Empagliflozin gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Empagliflozin gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
Mündliche Anhörung. gemäß 5. Kapitel, 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses. hier: Entricitabin/Tenofoviralafenamid/Rilpivirin
 Mündliche Anhörung gemäß 5. Kapitel, 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses hier: Entricitabin/Tenofoviralafenamid/Rilpivirin Sitzung im Hause des Gemeinsamen Bundesausschussesin
Mündliche Anhörung gemäß 5. Kapitel, 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses hier: Entricitabin/Tenofoviralafenamid/Rilpivirin Sitzung im Hause des Gemeinsamen Bundesausschussesin
Arzneimittel Kiel,
 Mitglieder-Info 012/2015 Arzneimittel Kiel, 20.01.2015 GBA-Beschlüsse zur frühen Nutzenbewertung Der G-BA hat am 8. Januar 2015 drei Beschlüsse zur frühen Nutzenbewertung von Arzneimitteln nach 35a SGB
Mitglieder-Info 012/2015 Arzneimittel Kiel, 20.01.2015 GBA-Beschlüsse zur frühen Nutzenbewertung Der G-BA hat am 8. Januar 2015 drei Beschlüsse zur frühen Nutzenbewertung von Arzneimitteln nach 35a SGB
Gastrohighlights 2016: Chronisch entzündliche Darmerkrankungen
 29. Oktober 2016, Wien Gastrohighlights 2016: Chronisch entzündliche Darmerkrankungen Gerhard Rogler, Klinik für Gastroenterologie und Hepatologie, UniversitätsSpital Zürich Neues zur Therapie Morbus Crohn
29. Oktober 2016, Wien Gastrohighlights 2016: Chronisch entzündliche Darmerkrankungen Gerhard Rogler, Klinik für Gastroenterologie und Hepatologie, UniversitätsSpital Zürich Neues zur Therapie Morbus Crohn
Dossierbewertung A15-20 Version 1.0 Secukinumab Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Secukinumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Secukinumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
Mündliche Anhörung. gemäß 5. Kapitel 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses
 Mündliche Anhörung gemäß 5. Kapitel 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses hier: Wirkstoff Secukinumab (neues Anwendungsgebiet) Sitzung im Hause des Gemeinsamen Bundesausschusses
Mündliche Anhörung gemäß 5. Kapitel 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses hier: Wirkstoff Secukinumab (neues Anwendungsgebiet) Sitzung im Hause des Gemeinsamen Bundesausschusses
Tragende Gründe zum Beschluss. des Gemeinsamen Bundesausschusses über die Änderung der Arzneimittel-Richtlinie (AM-RL):
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage 1 (OTC-Übersicht) Nr. 20 Ginkgo-biloba-Blätter-Extrakt Vom 14. April 2011 Inhaltsverzeichnis
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage 1 (OTC-Übersicht) Nr. 20 Ginkgo-biloba-Blätter-Extrakt Vom 14. April 2011 Inhaltsverzeichnis
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Daratumumab wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Vedolizumab wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Dossierbewertung A14-28 Version 1.0 Apixaban (neues Anwendungsgebiet) Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Apixaban (neues Anwendungsgebiet) gemäß 35a SGB V beauftragt. Die Bewertung
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Apixaban (neues Anwendungsgebiet) gemäß 35a SGB V beauftragt. Die Bewertung
Crohn. Entyvio (Vedolizumab) erste darmselektive Therapie bei mittelschweren bis schweren Formen von Col
 Entyvio (Vedolizumab) erste darmselektive Therapie bei mittelschweren bis schweren Formen von Col Entyvio (Vedolizumab) Erste darmselektive Therapie bei mittelschweren bis schweren Formen von Colitis ulcerosa
Entyvio (Vedolizumab) erste darmselektive Therapie bei mittelschweren bis schweren Formen von Col Entyvio (Vedolizumab) Erste darmselektive Therapie bei mittelschweren bis schweren Formen von Colitis ulcerosa
Dossierbewertung A16-13 Version 1.0 Empagliflozin/Metformin Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung der Wirkstoffkombination Empagliflozin/Metformin gemäß 35a SGB V beauftragt. Die Bewertung
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung der Wirkstoffkombination Empagliflozin/Metformin gemäß 35a SGB V beauftragt. Die Bewertung
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Vedolizumab (Entyvio ) Takeda GmbH Modul 1 Zusammenfassung der Aussagen im Dossier Stand: 10.07.2014 Inhaltsverzeichnis
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Vedolizumab (Entyvio ) Takeda GmbH Modul 1 Zusammenfassung der Aussagen im Dossier Stand: 10.07.2014 Inhaltsverzeichnis
Studien-Update 2017: Vedolizumab
 Studien-Update 2017 Neue Analysedaten bestätigen Langzeit-Sicherheit und -Wirksamkeit von Vedolizumab in der Therapie von Colitis ulcerosa und Morbus Crohn bei Erwachsenen Berlin (30. Januar 2018) Für
Studien-Update 2017 Neue Analysedaten bestätigen Langzeit-Sicherheit und -Wirksamkeit von Vedolizumab in der Therapie von Colitis ulcerosa und Morbus Crohn bei Erwachsenen Berlin (30. Januar 2018) Für
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Tofacitinib (Colitis ulcerosa)
 IQWiG-Berichte Nr. 683 Tofacitinib (Colitis ulcerosa) Nutzenbewertung gemäß 35a SGB V Dossierbewertung Auftrag: A18-52 Version: 1.0 Stand: 28.11.2018 Impressum Herausgeber: Institut für Qualität und Wirtschaftlichkeit
IQWiG-Berichte Nr. 683 Tofacitinib (Colitis ulcerosa) Nutzenbewertung gemäß 35a SGB V Dossierbewertung Auftrag: A18-52 Version: 1.0 Stand: 28.11.2018 Impressum Herausgeber: Institut für Qualität und Wirtschaftlichkeit
Tragende Gründe. Vom 8. Januar 2015
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
Dossierbewertung A16-12 Version 1.0 Empagliflozin Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Empagliflozin gemäß 35a SGB V beauftragt. Der pu hat für den zu bewertenden
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Empagliflozin gemäß 35a SGB V beauftragt. Der pu hat für den zu bewertenden
Decitabin Beschluss vom: 2. Mai 2013 gültig bis: unbefristet In Kraft getreten am: 2. Mai 2013 BAnz AT B6
 Beschluss vom: 2. Mai 2013 gültig bis: unbefristet In Kraft getreten am: 2. Mai 2013 BAnz AT 29.05.2013 B6 Zugelassenes Anwendungsgebiet Dacogen ist indiziert zur Behandlung erwachsener Patienten ab einem
Beschluss vom: 2. Mai 2013 gültig bis: unbefristet In Kraft getreten am: 2. Mai 2013 BAnz AT 29.05.2013 B6 Zugelassenes Anwendungsgebiet Dacogen ist indiziert zur Behandlung erwachsener Patienten ab einem
Mündliche Anhörung. gemäß 5. Kapitel 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses. hier: Wirkstoff Tofacitinib (PsA)
 Mündliche Anhörung gemäß 5. Kapitel 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses hier: Wirkstoff Tofacitinib (PsA) Sitzung im Hause des Gemeinsamen Bundesausschusses in Berlin am 7. Januar
Mündliche Anhörung gemäß 5. Kapitel 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses hier: Wirkstoff Tofacitinib (PsA) Sitzung im Hause des Gemeinsamen Bundesausschusses in Berlin am 7. Januar
Vedolizumab Nutzenbewertung gemäß 35a SGB V Dossierbewertung
 IQWiG-Berichte Nr. 247 Vedolizumab Nutzenbewertung gemäß 35a SGB V Dossierbewertung Auftrag: A14-23 Version: 1.0 Stand: 13.10.2014 Dossierbewertung A14-23 Version 1.0 Vedolizumab Nutzenbewertung gemäß
IQWiG-Berichte Nr. 247 Vedolizumab Nutzenbewertung gemäß 35a SGB V Dossierbewertung Auftrag: A14-23 Version: 1.0 Stand: 13.10.2014 Dossierbewertung A14-23 Version 1.0 Vedolizumab Nutzenbewertung gemäß
Information zur Anfrage einer neuen Untersuchungs- und Behandlungsmethode entsprechend der Vorgabe des InEK
 Hinweis: Stellen Sie NUB-Anfragen für 2017 über das InEK-Datenportal: http://www.g-drg.de/cms/inek_datenportal Auf der Homepage des InEK finden Sie sämtliche Hintergrundinformation zu dem Verfahren der
Hinweis: Stellen Sie NUB-Anfragen für 2017 über das InEK-Datenportal: http://www.g-drg.de/cms/inek_datenportal Auf der Homepage des InEK finden Sie sämtliche Hintergrundinformation zu dem Verfahren der
Dossierbewertung A14-01 Version 1.0 Trastuzumab Emtansin Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Trastuzumab Emtansin gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Trastuzumab Emtansin gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf
Dossierbewertung A16-64 Version 1.1 Idelalisib (chronische lymphatische Leukämie)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Idelalisib für das im September 2016 neu zugelassene Anwendungsgebiet gemäß
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Idelalisib für das im September 2016 neu zugelassene Anwendungsgebiet gemäß
Datenlage und Therapieerfahrungen sprechen für Pentasa Xtend 2g
 Zwischen Evidenz und Empirie die Versorgungssituation bei chronisch entzündlichen Darmerkrankungen in Deutschland Datenlage und Therapieerfahrungen sprechen für Pentasa Xtend 2g Wiesbaden (20. April 2009)
Zwischen Evidenz und Empirie die Versorgungssituation bei chronisch entzündlichen Darmerkrankungen in Deutschland Datenlage und Therapieerfahrungen sprechen für Pentasa Xtend 2g Wiesbaden (20. April 2009)
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss vom: 8. Januar 2015 gültig bis: unbefristet In Kraft getreten am: 8. Januar 2015 BAnz AT B5
 Vedolizumab Beschluss vom: 8. Januar 2015 gültig bis: unbefristet In Kraft getreten am: 8. Januar 2015 BAnz AT 09.02.2015 B5 Zugelassenes Anwendungsgebiet: Colitis ulcerosa Vedolizumab (Entyvio ) ist indiziert
Vedolizumab Beschluss vom: 8. Januar 2015 gültig bis: unbefristet In Kraft getreten am: 8. Januar 2015 BAnz AT 09.02.2015 B5 Zugelassenes Anwendungsgebiet: Colitis ulcerosa Vedolizumab (Entyvio ) ist indiziert
DAUER DER STUDIE: Läuft seit Nov mindestens bis 2017.
 KLINISCHE STUDIE: Swiss Inflammatory Bowel Disease Cohort Study (SIBDCS) Multizentrische Beobachtungsstudie in der ganzen Schweiz (Basel, Bern, Genf, Lausanne, St-Gallen, Zürich) mit Patient die an einem
KLINISCHE STUDIE: Swiss Inflammatory Bowel Disease Cohort Study (SIBDCS) Multizentrische Beobachtungsstudie in der ganzen Schweiz (Basel, Bern, Genf, Lausanne, St-Gallen, Zürich) mit Patient die an einem
Dossierbewertung A17-61 Version 1.0 Perampanel (Epilepsie)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Perampanel gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis eines
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Perampanel gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis eines
Ihre Therapie verstehen Fragen und Antworten zu Remsima kurz und verständlich
 Ihre Therapie verstehen Fragen und Antworten zu Remsima kurz und verständlich 1 2 Bei welchen Erkrankungen wird Remsima eingesetzt? Remsima ist ein Arzneimittel, das bei chronischent zündlichen Erkrankungen
Ihre Therapie verstehen Fragen und Antworten zu Remsima kurz und verständlich 1 2 Bei welchen Erkrankungen wird Remsima eingesetzt? Remsima ist ein Arzneimittel, das bei chronischent zündlichen Erkrankungen
Dossierbewertung A17-18 Version 1.0 Tofacitinib (Rheumatoide Arthritis)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Tofacitinib gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis eines
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Tofacitinib gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis eines
Therapie 2018: Was ist gesichert, was ist obsolet? bei chronisch entzündlicher Darmerkrankungen (CED)
 Therapie 2018: Was ist gesichert, was ist obsolet? bei chronisch entzündlicher Darmerkrankungen (CED) ao Univ.Prof. Dr. Christoph Högenauer Klinische Abteilung für Gastroenterologie und Hepatologie Universitätsklinik
Therapie 2018: Was ist gesichert, was ist obsolet? bei chronisch entzündlicher Darmerkrankungen (CED) ao Univ.Prof. Dr. Christoph Högenauer Klinische Abteilung für Gastroenterologie und Hepatologie Universitätsklinik
Tragende Gründe. Anlage I (OTC-Übersicht) Vom 2. November Inhaltsverzeichnis. 1. Rechtsgrundlagen. 2. Eckpunkte der Entscheidung
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einleitung eines Stellungnahmeverfahrens zur Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage I (OTC-Übersicht) Vom 2. November
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einleitung eines Stellungnahmeverfahrens zur Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage I (OTC-Übersicht) Vom 2. November
Entyvio (Vedolizumab) Der darmselektiv wirkende Integrin-Hemmer bei Colitis ulcerosa und Morbus Crohn 1 4
 Entyvio (Vedolizumab) Der darmselektiv wirkende Integrin-Hemmer bei Colitis ulcerosa und Morbus Crohn 1 4 INTERAKTIVES PDF Gelangen Sie per Klick auf die gewünschte Seite. NUR FÜR ACROBAT Chronisch-entzündliche
Entyvio (Vedolizumab) Der darmselektiv wirkende Integrin-Hemmer bei Colitis ulcerosa und Morbus Crohn 1 4 INTERAKTIVES PDF Gelangen Sie per Klick auf die gewünschte Seite. NUR FÜR ACROBAT Chronisch-entzündliche
Dossierbewertung A14-29 Version 1.0 Propranolol Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Propranolol gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Propranolol gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
Frühe Nutzenbewertung aus Sicht des IQWiG. Jürgen Windeler
 Frühe Nutzenbewertung aus Sicht des IQWiG Jürgen Windeler AMNOG, aus der Begründung Die Datenlage für neue Wirkstoffe (insbesondere in der Onkologie) wird von Experten als unbefriedigend bezeichnet. Die
Frühe Nutzenbewertung aus Sicht des IQWiG Jürgen Windeler AMNOG, aus der Begründung Die Datenlage für neue Wirkstoffe (insbesondere in der Onkologie) wird von Experten als unbefriedigend bezeichnet. Die
Dossierbewertung A14-36 Version 1.0 Albiglutid Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Albiglutid gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis eines
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Albiglutid gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis eines
Dossierbewertung A18-71 Version 1.0 Erenumab (Migräne)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Erenumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis eines
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Erenumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis eines
BAnz AT B1. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Diagnostik und Behandlung des Morbus Crohn nach SONIC. PD Dr. med. Andreas Lügering Medizinische Klinik B Universitätsklinikum Münster
 Diagnostik und Behandlung des Morbus Crohn nach SONIC PD Dr. med. Andreas Lügering Medizinische Klinik B Universitätsklinikum Münster Klinische Wirkung von anti-tnf Der erste Fall 12 jährige Patientin
Diagnostik und Behandlung des Morbus Crohn nach SONIC PD Dr. med. Andreas Lügering Medizinische Klinik B Universitätsklinikum Münster Klinische Wirkung von anti-tnf Der erste Fall 12 jährige Patientin
Dossierbewertung A18-23 Version 1.0 Bezlotoxumab (Clostridium-difficile-Infektion)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Bezlotoxumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Bezlotoxumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis
Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten
 Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten Arzneimittelmarktneuordnungsgesetz (AMNOG) 35a Bewertung des Nutzens von Arzneimitteln
Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten Arzneimittelmarktneuordnungsgesetz (AMNOG) 35a Bewertung des Nutzens von Arzneimitteln
Bewertung von Arzneimitteln. Überblick über den AMNOG Prozess
 Bewertung von Arzneimitteln Überblick über den AMNOG Prozess Was erwartet Sie? Ablauf und Prinzip der frühen Nutzenbewertung nach 35a SGB V (Bewertung des Nutzens von Arzneimitteln mit neuen Wirkstoffen)
Bewertung von Arzneimitteln Überblick über den AMNOG Prozess Was erwartet Sie? Ablauf und Prinzip der frühen Nutzenbewertung nach 35a SGB V (Bewertung des Nutzens von Arzneimitteln mit neuen Wirkstoffen)
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V
Antidepressiva: Nutzen von Reboxetin ist nicht belegt Von Bupropion XL und Mirtazapin können Menschen mit Depressionen aber profitieren
 Antidepressiva: Nutzen von Reboxetin ist nicht belegt Von Bupropion XL und Mirtazapin können Menschen mit Depressionen aber profitieren Berlin (24. November 2009) - Dass Menschen mit Depressionen vom Wirkstoff
Antidepressiva: Nutzen von Reboxetin ist nicht belegt Von Bupropion XL und Mirtazapin können Menschen mit Depressionen aber profitieren Berlin (24. November 2009) - Dass Menschen mit Depressionen vom Wirkstoff
Dossierbewertung A16-60 Version 1.0 Ibrutinib (chronische lymphatische Leukämie)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ibrutinib in Kombination mit Bendamustin und Rituximab (Ibrutinib + BR) gemäß
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ibrutinib in Kombination mit Bendamustin und Rituximab (Ibrutinib + BR) gemäß
Herzlich Willkommen zum
 Herzlich Willkommen zum 1 Chronisch entzündliche Darmerkrankungen Medikamentöse Therapie Dr. M. Geppert SHG MC-CU 17.05.2013 Die chronisch entzündlichen Darmerkrankungen (CED) sind: Morbus Crohn Colitis
Herzlich Willkommen zum 1 Chronisch entzündliche Darmerkrankungen Medikamentöse Therapie Dr. M. Geppert SHG MC-CU 17.05.2013 Die chronisch entzündlichen Darmerkrankungen (CED) sind: Morbus Crohn Colitis
Mündliche Anhörung. gemäß 5. Kapitel 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses. hier: Wirkstoff Sofosbuvir
 Mündliche Anhörung gemäß 5. Kapitel 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses hier: Wirkstoff Sofosbuvir Sitzung im Hause des Gemeinsamen Bundesausschusses in Berlin am 19. Februar
Mündliche Anhörung gemäß 5. Kapitel 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses hier: Wirkstoff Sofosbuvir Sitzung im Hause des Gemeinsamen Bundesausschusses in Berlin am 19. Februar
Pasireotid Beschluss vom: 6. Dezember 2012 gültig bis: unbefristet In Kraft getreten am: 6. Dezember 2012 BAnz AT B3
 Beschluss vom: 6. Dezember 01 gültig bis: unbefristet In Kraft getreten am: 6. Dezember 01 BAnz AT 1.01.013 B3 Zugelassenenes Anwendungsgebiet Signifor ist indiziert für die Behandlung von erwachsenen
Beschluss vom: 6. Dezember 01 gültig bis: unbefristet In Kraft getreten am: 6. Dezember 01 BAnz AT 1.01.013 B3 Zugelassenenes Anwendungsgebiet Signifor ist indiziert für die Behandlung von erwachsenen
Dossierbewertung A13-33 Version 1.0 Enzalutamid Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Enzalutamid gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Enzalutamid gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
Dossierbewertung A18-80 Version 1.0 Enzalutamid (Prostatakarzinom)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Enzalutamid gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis eines
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Enzalutamid gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis eines
Zulassung für Herceptin SC Mehr Freiraum für Frauen mit HER2-positivem Mammakarzinom
 Zulassung für Herceptin SC Mehr Freiraum für Frauen mit HER2-positivem Mammakarzinom Hamburg (12. September 2013) - Seit Ende August 2013 ist der Antikörper Herceptin (Trastuzumab, Roche) als subkutane
Zulassung für Herceptin SC Mehr Freiraum für Frauen mit HER2-positivem Mammakarzinom Hamburg (12. September 2013) - Seit Ende August 2013 ist der Antikörper Herceptin (Trastuzumab, Roche) als subkutane
ICLUSIG erweitert die Therapieoptionen der Chronischen Myeloischen Leukämie und der Philadelphia-C
 ICLUSIG erweitert die Therapieoptionen der Chronischen Myeloischen Leukämie und der Philadelphia-C ICLUSIG erweitert die Therapieoptionen der Chronischen Myeloischen Leukämie und der Philadelphia-Chromosom
ICLUSIG erweitert die Therapieoptionen der Chronischen Myeloischen Leukämie und der Philadelphia-C ICLUSIG erweitert die Therapieoptionen der Chronischen Myeloischen Leukämie und der Philadelphia-Chromosom
Dossierbewertung A11-30 Version 1.0 Apixaban Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat mit Schreiben vom 14.12.2011 das IQWiG mit der Nutzenbewertung des Wirkstoffs Apixaban gemäß 35a SGB V beauftragt. Die Bewertung
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat mit Schreiben vom 14.12.2011 das IQWiG mit der Nutzenbewertung des Wirkstoffs Apixaban gemäß 35a SGB V beauftragt. Die Bewertung
Zulassung für JANUMET (Sitagliptin/Metformin) zur Behandlung des Typ-2-Diabetes in der Europäischen Union
 Zulassung für JANUMET (Sitagliptin/Metformin) zur Behandlung des Typ-2-Diabetes in der Europäischen Union Haar (23. Juli 2008) JANUMET (Sitagliptin/Metformin, MSD) hat von der Europäischen Kommission die
Zulassung für JANUMET (Sitagliptin/Metformin) zur Behandlung des Typ-2-Diabetes in der Europäischen Union Haar (23. Juli 2008) JANUMET (Sitagliptin/Metformin, MSD) hat von der Europäischen Kommission die
Beschluss vom: 7. Februar 2013 gültig bis: unbefristet In Kraft getreten am: 7. Februar 2013 BAnz AT B1
 Beschluss vom: 7. Februar 2013 gültig bis: unbefristet In Kraft getreten am: 7. Februar 2013 BAnz AT 05.03.2013 B1 Zugelassenes Anwendungsgebiet (Kalydeco ) von Vertex Pharmaceuticals wird angewendet zur
Beschluss vom: 7. Februar 2013 gültig bis: unbefristet In Kraft getreten am: 7. Februar 2013 BAnz AT 05.03.2013 B1 Zugelassenes Anwendungsgebiet (Kalydeco ) von Vertex Pharmaceuticals wird angewendet zur
Tragende Gründe. Vom 21. August 2014
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Clopidogrel, Gruppe 1, in Stufe 1 nach 35 Absatz
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Clopidogrel, Gruppe 1, in Stufe 1 nach 35 Absatz
Zusammenfassende Dokumentation
 Zusammenfassende Dokumentation zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage II - (Lifestyle Arzneimittel) (SPEDRA ) Vom 16. Oktober 2014
Zusammenfassende Dokumentation zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage II - (Lifestyle Arzneimittel) (SPEDRA ) Vom 16. Oktober 2014
Dossierbewertung A15-28 Version 1.0 Netupitant/Palonosetron Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Netupitant/Palonosetron gemäß 35a SGB V beauftragt. Die Bewertung erfolgte
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Netupitant/Palonosetron gemäß 35a SGB V beauftragt. Die Bewertung erfolgte
Dossierbewertung A17-14 Version 1.0 Baricitinib (Rheumatoide Arthritis)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Baricitinib gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Baricitinib gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
Aflibercept (Zaltrap) bei metastasiertem Darmkrebs
 verstehen abwägen entscheiden Aflibercept (Zaltrap) bei metastasiertem Darmkrebs Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) Inhaltsverzeichnis Überblick Einleitung Anwendung
verstehen abwägen entscheiden Aflibercept (Zaltrap) bei metastasiertem Darmkrebs Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) Inhaltsverzeichnis Überblick Einleitung Anwendung
Aktionstag Chronisch entzündliche Darmerkrankungen : Morbus Crohn-Patienten brauchen individuelle
 Aktionstag Chronisch entzündliche Darmerkrankungen Morbus Crohn-Patienten brauchen individuelle Therapie Berlin (19. Mai 2015) Deutet sich bei Morbus Crohn ein komplizierter Krankheitsverlauf an, sollten
Aktionstag Chronisch entzündliche Darmerkrankungen Morbus Crohn-Patienten brauchen individuelle Therapie Berlin (19. Mai 2015) Deutet sich bei Morbus Crohn ein komplizierter Krankheitsverlauf an, sollten
Dossierbewertung A14-34 Version 1.0 Dolutegravir/Abacavir/Lamivudin Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung der Wirkstoffkombination Dolutegravir/Abacavir/Lamivudin (DTG/ABC/3TC) gemäß 35a SGB V beauftragt.
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung der Wirkstoffkombination Dolutegravir/Abacavir/Lamivudin (DTG/ABC/3TC) gemäß 35a SGB V beauftragt.
Eine Möglichkeit der direkten Kontaktaufnahme mit unseren IBD-Spezialisten besteht unter folgender - Adresse:
 Klinikdirektor Prof. Dr. med. Dr. phil. Gerhard Rogler Nr. 01/2019 vom 09.04.2019 UniversitätsSpital Zürich Gastroenterologie und Rämistrasse 100 CH-8091 Zürich Direktionssekretariat Tel. +41 44 255 43
Klinikdirektor Prof. Dr. med. Dr. phil. Gerhard Rogler Nr. 01/2019 vom 09.04.2019 UniversitätsSpital Zürich Gastroenterologie und Rämistrasse 100 CH-8091 Zürich Direktionssekretariat Tel. +41 44 255 43
Tragende Gründe. Vom 16. April 2015
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Selektive Serotonin-Wiederaufnahmehemmer, Gruppe
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Selektive Serotonin-Wiederaufnahmehemmer, Gruppe
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION
 ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION Diese Änderungen von SPC und Packungsbeilage treten zum Zeitpunkt der Kommissionsentscheidung in Kraft.
ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION Diese Änderungen von SPC und Packungsbeilage treten zum Zeitpunkt der Kommissionsentscheidung in Kraft.
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Anhaltspunkt für einen Zusatznutzen mit kurzwirksamem Insulin
 Dulaglutid bei Typ-2-Diabetes: Anhaltspunkt für einen Zusatznutzen mit kurzwirksamem Insulin Köln (4. Mai 2015) - Dulaglutid ist seit 2014 allein oder in Kombination mit anderen Wirkstoffen zur Behandlung
Dulaglutid bei Typ-2-Diabetes: Anhaltspunkt für einen Zusatznutzen mit kurzwirksamem Insulin Köln (4. Mai 2015) - Dulaglutid ist seit 2014 allein oder in Kombination mit anderen Wirkstoffen zur Behandlung
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Ponatinib wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL) Anlage IV: Therapiehinweis Omalizumab
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL) Anlage IV: Therapiehinweis Omalizumab Vom 17. Dezember 2015 Der Gemeinsame Bundesausschuss (G-BA) hat
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL) Anlage IV: Therapiehinweis Omalizumab Vom 17. Dezember 2015 Der Gemeinsame Bundesausschuss (G-BA) hat
Besondere Anforderungen an Studien für Kinderarzneimittel (PUMA) aus Sicht der Nutzenbewertung des G-BA
 Besondere Anforderungen an Studien für Kinderarzneimittel (PUMA) aus Sicht der Nutzenbewertung des G-BA More Medicines for Minors - Bonn, 8. Juni 2015 Dr. Wiebke Löbker Abteilung Arzneimittel des Gemeinsamen
Besondere Anforderungen an Studien für Kinderarzneimittel (PUMA) aus Sicht der Nutzenbewertung des G-BA More Medicines for Minors - Bonn, 8. Juni 2015 Dr. Wiebke Löbker Abteilung Arzneimittel des Gemeinsamen
Chicago News: Aktuelles vom ACR 2011: B-Zell-Therapie bei Rheumatoider Arthritis Medizin nach Maß
 Chicago News: Aktuelles vom ACR 2011 B-Zell-Therapie bei Rheumatoider Arthritis Medizin nach Maß Frankfurt am Main (22. November 2011) - Auf dem diesjährigen ACR-Kongress untermauerten gleich drei Studien
Chicago News: Aktuelles vom ACR 2011 B-Zell-Therapie bei Rheumatoider Arthritis Medizin nach Maß Frankfurt am Main (22. November 2011) - Auf dem diesjährigen ACR-Kongress untermauerten gleich drei Studien
Dossierbewertung A15-13 Version 1.0 Ruxolitinib Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ruxolitinib gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ruxolitinib gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
RoACTEMRA (Tocilizumab) i.v. und s.c. Patientenpass
 RoACTEMRA (Tocilizumab) i.v. und s.c. Patientenpass Dieser Patientenpass enthält wichtige Sicherheitsinformationen, über die Patienten bzw. deren Eltern/ Erziehungsberechtigte Bescheid wissen müssen, bevor,
RoACTEMRA (Tocilizumab) i.v. und s.c. Patientenpass Dieser Patientenpass enthält wichtige Sicherheitsinformationen, über die Patienten bzw. deren Eltern/ Erziehungsberechtigte Bescheid wissen müssen, bevor,
Mündliche Anhörung. gemäß 5. Kapitel 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses
 Mündliche Anhörung gemäß 5. Kapitel 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses hier: Insulin degludec/liraglutid (neues Anwendungsgebiet) Sitzung im Hause des Gemeinsamen Bundesausschusses
Mündliche Anhörung gemäß 5. Kapitel 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses hier: Insulin degludec/liraglutid (neues Anwendungsgebiet) Sitzung im Hause des Gemeinsamen Bundesausschusses
Mündliche Anhörung. gemäß 5. Kapitel 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses. hier: Wirkstoff Vedolizumab
 Mündliche Anhörung gemäß 5. Kapitel 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses hier: Wirkstoff Vedolizumab Sitzung im Hause des Gemeinsamen Bundesausschusses in Berlin am 25. November
Mündliche Anhörung gemäß 5. Kapitel 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses hier: Wirkstoff Vedolizumab Sitzung im Hause des Gemeinsamen Bundesausschusses in Berlin am 25. November
Zulassungsüberschreitende Anwendung von Arzneimitteln im Rahmen klinischer Studien ( 35c SGB V)
 Zulassungsüberschreitende Anwendung von Arzneimitteln im Rahmen klinischer Studien ( 35c SGB V) Berlin, 22. September 2009 Dr. Regina Skavron Abteilung Arzneimittel, Gemeinsamer Bundesausschuss Zulassungsüberschreitende
Zulassungsüberschreitende Anwendung von Arzneimitteln im Rahmen klinischer Studien ( 35c SGB V) Berlin, 22. September 2009 Dr. Regina Skavron Abteilung Arzneimittel, Gemeinsamer Bundesausschuss Zulassungsüberschreitende
Tragende Gründe. Vom 19. Juni 2014
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage VI Off-Label-Use Venlafaxin bei neuropathischen Schmerzen Vom 19. Juni 2014
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage VI Off-Label-Use Venlafaxin bei neuropathischen Schmerzen Vom 19. Juni 2014
Beim Vermeiden von Folgekomplikationen sind Diuretika keiner anderen Wirkstoffgruppe unterlegen
 Blutdrucksenker im Vergleich: Nutzen der Diuretika ist am besten belegt Beim Vermeiden von Folgekomplikationen sind Diuretika keiner anderen Wirkstoffgruppe unterlegen Berlin (16. September 2009) - Für
Blutdrucksenker im Vergleich: Nutzen der Diuretika ist am besten belegt Beim Vermeiden von Folgekomplikationen sind Diuretika keiner anderen Wirkstoffgruppe unterlegen Berlin (16. September 2009) - Für
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V
1. Zusatznutzen des Arzneimittels im Verhältnis zur zweckmäßigen Vergleichstherapie
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
behördlich genehmigtes Schulungsmaterial (Adalimumab) Patientenpass für Erwachsene
 behördlich genehmigtes Schulungsmaterial HUMIRA (Adalimumab) Patientenpass für Erwachsene Juli 2017 Liebe Patienten, lieber Patient, Ihr behandelnder Arzt hat Ihnen HUMIRA verordnet. Dieser Patientenpass
behördlich genehmigtes Schulungsmaterial HUMIRA (Adalimumab) Patientenpass für Erwachsene Juli 2017 Liebe Patienten, lieber Patient, Ihr behandelnder Arzt hat Ihnen HUMIRA verordnet. Dieser Patientenpass
TVT-Therapie. Bayer HealthCare: Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Präventio
 Bayer HealthCare: Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Präventio Bayer HealthCare Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Prävention
Bayer HealthCare: Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Präventio Bayer HealthCare Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Prävention
Dimethylfumarat (Tecfidera) bei Multipler Sklerose
 verstehen abwägen entscheiden Dimethylfumarat (Tecfidera) bei Multipler Sklerose Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) Inhaltsverzeichnis Überblick Einleitung Anwendung
verstehen abwägen entscheiden Dimethylfumarat (Tecfidera) bei Multipler Sklerose Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) Inhaltsverzeichnis Überblick Einleitung Anwendung
Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen
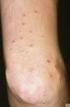 Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen München (1. Mai 2009) Die europäische Arzneimittelagentur EMEA hat mit Wirkung zum 1. Mai 2009 Protopic
Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen München (1. Mai 2009) Die europäische Arzneimittelagentur EMEA hat mit Wirkung zum 1. Mai 2009 Protopic
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Aktuelle klinische Studien bei CED 2015
 Aktuelle klinische Studien bei CED 2015 Stand: 04. Juni 2015 Carsten Schmidt Klinik für Innere Medizin IV Universitätsklinikum Jena Anwendungsbeobachtungen M. Crohn C. ulcerosa Akuter Schub Akuter Schub
Aktuelle klinische Studien bei CED 2015 Stand: 04. Juni 2015 Carsten Schmidt Klinik für Innere Medizin IV Universitätsklinikum Jena Anwendungsbeobachtungen M. Crohn C. ulcerosa Akuter Schub Akuter Schub
Dossierbewertung A16-10 Version 1.0 Ramucirumab (Kolorektalkarzinom)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ramucirumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ramucirumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
Die frühe Nutzenbewertung und ihre rechtlichen Herausforderungen
 und ihre rechtlichen Herausforderungen Rechtssymposium Die frühe Nutzenbewertung von Arzneimitteln nach AMNOG G-BA, Berlin Referent: Dr. jur. Rainer Hess, G-BA Seite 1 16. November 2010 Rechtssymposium
und ihre rechtlichen Herausforderungen Rechtssymposium Die frühe Nutzenbewertung von Arzneimitteln nach AMNOG G-BA, Berlin Referent: Dr. jur. Rainer Hess, G-BA Seite 1 16. November 2010 Rechtssymposium
