Purity is a strength. Immunglobulin (10 %), gebrauchsfertig
|
|
|
- Marcus Seidel
- vor 7 Jahren
- Abrufe
Transkript
1 Purity is a strength Immunglobulin (10 %), gebrauchsfertig
2 INDEX Hohe biologische Sicherheit und gutes Verträglich - keitsprofil durch Quality by Design (QbD)... 4 Nachgewiesene Wirksamkeit und Verträglichkeit bei primären Immundefekten... 6 Nachgewiesene Wirksamkeit und Verträglichkeit bei primärer Immunthrombozytopenie... 8 IQYMUNE, Verträglichkeit und Infusionsrate IQYMUNE, Praktische Informationen IQYMUNE, Indikationen Quellennachweis Basisinformation IQYMUNE... 15
3 HOHE BIOLOGISCHE SICHERHEIT UND GUTES VERTRÄGLICHKEITSPROFIL DURCH QUALITY BY DESIGN (QBD) 1 LFB-Expertise: Das einzigartige, bewährte und patentierte Herstellungsverfahren wurde entwickelt, um hochreine Immunglobuline herzustellen. Der Quality by Design-Ansatz des Herstellungsverfahrens beinhaltet 3 WICHTIGE Maßnahmen zur Verträglichkeit von IQYMUNE 3,4,5, Erstes Unternehmen, das die Nanofiltration einführt 2006 Affinitätschromatographie 2007 Quality by Design 2 (seit 2011 von EMA & FDA empfohlen) PLASMA LFB ein innovatives Unternehmen FUNKTION DER VERSCHIEDENEN SCHRITTE Kontrolliertes Risiko Parameter IQYMUNE * Thrombose Faktor XIa TGT** ACF*** Unter der Nachweisgrenze Keine thrombogene Aktivität Anaphylaktische Reaktionen IgA 0,009 mg/ml (max < 0,028 mg/ml) Hämolyse Hämagglutinine Anti-A Anti-B Keine Hämagglutination nach Verdünnung zwischen 1:8 und 1:16 1:4 und 1:8 Normen der Europäischen Pharmakopöe, Verdünnung 1:64 KRYO-SEPERATION ETHANOL-FRAKTIONIERUNG Entfernung von VWF-/FVIII-Komplex Entfernung von Albumin Ergebnisse von 3 Chargen. **TGT = Thrombingenerierungstest. ***ACF = Aktivierter Gerinnungsfaktor Hohe Reinheit = 99 % (Bereich %) 6 (Forderung der Europäischen Pharmakopöe > 95 %.) Normale Verteilung von IgG-Subklassen 7 CAPRYLSÄURE FRAKTIONIERUNG Entfernung von nicht-ig Proteinen + TIEFENFILTRATION MIT AKTIVKOHLE einschließlich prokoagulatorischer Faktoren 4 Das Verfahren besitzt mehrere wirksame Schritte zur BIOLOGISCHEN 5 ULTRAFILTRATION Reinigungsprozess SICHERHEIT gegen Prionen, umhüllte und nicht-umhüllte Viren 8,9 SOLVENT-DETERGENT-VERFAHREN Patent Biologische Sicherheit gegen Risiko durch Viren und Prionen Risiko durch Viren ANIONENAUSTAUSCH- CHROMATOGRAPHIE AFFINITÄTS-CHROMATOGRAPHIE FILTRATION 20 NM NANOFILTRATION ULTRAFILTRATION FORMULIERUNG UND ABFÜLLUNG Inaktivierung von umhüllten Viren Reduzierung von IgA und IgM Entfernung von anti-a und anti-b Hämagglutininen Reduzierung von Polymeren und Aggregaten Eliminierung möglicher Viren und/oder Prionen Produktkonzentrierung auf 10 % Hinzufügen von Hilfsstoffen Das Verfahren beinhaltet 5 Patente, die in dem Herstellungsprozess wirksam miteinander verbunden sind. Umhüllte Viren Nicht-umhüllte Viren Virus HBV HCV HIV HAV Parvovirus B19 Gesamtreduktionsfaktor (log 10) 14,1 16,9 14,8 12,8 11,0 HBV: Hepatitis-B-Virus, HCV: Hepatitis-C-Virus, HIV: Humanes Immundefizienz-Virus HIV, HAV: Hepatitis-A-Virus. 2 allgemeine- und 2 spezifische Virusreduktionsschritte Schritte zur Sicherheit gegen Prionen Western Blot Bioassay Caprylsäure Fraktionierung 4,0 5,2 Anionenaustausch-Chromatographie 3,7 3,9 20 nm Nanofiltration 3,8 Nicht getestet Gesamtreduktionsfaktor (log 10) 12,9 3 wirksame Schritte gegen Prionen IQYMUNE wird durch Quality by Design hergestellt und ist ein hochreines IVIg-geeignet für alle Patienten, unabhängig von ihren Risikofaktoren oder Begleiterkrankungen 15 * Standardmethoden zur Vermeidung von Infektionen, die aus der Anwendung von Arzneimitteln, welche aus menschlichem Blut oder Plasma hergestellt sind, resultieren, beinhalten die Auswahl von Spendern, das Screening von individuellen Spenden und Plasmapools auf spezifische Marker von Infektionen und die Einbeziehung effektiver Herstellungsschritte zur Inaktivierung/ Entfernung von Viren.
4 NACHGEWIESENE WIRKSAMKEIT UND VERTRÄG- LICHKEIT BEI PRIMÄREN IMMUNDFEKTEN (PID), MODELL FÜR EINE IMMUNGLOBULIN-ERSATZ- THERAPIE 12,13,14 Methodik Sekundäre Endpunkte Multinationale, prospektive, multizentrische, offene, internationale, unkontrollierte, einarmige Studie der Phase II/III. 5 Länder, 26 Zentren, 62 Patienten (26 Kinder, 36 Erwachsene) PID Patientencharakteristika Insgesamt n = 62 (36 Erwachsene, 26 Kinder oder Jugendliche) Durchschnittsalter (y) (Bereich) 27,4 (2 6 y) Geschlecht n (%) Männlich Weiblich Gewicht (kg) Mittelwert (Bereich) Typ von PID n (%) XLA CVID Vorherige Therapie n (%) IVIg SCIG Nicht vorbehandelte Patienten 43 (69,4 %) 19 (30,6 %) 55,9 (12 95 kg) 20 (32,3 %) 42 (67,7 %) 57 (91,9 %) 1 (1,6 %) 4 (6,5 %) Mittlere jährliche Infektionsrate per Patient = 3,79 (n = 62) Erreichter Mittelwert der IgG-Konzentration bei der 6. Infusion Verabreichte IQYMUNE -Dosis (g/kg) während der Studie Mittelwert 0, Mittelwert der IgG- Bereich (0,26, 0,85) 8,1 Konzentration (g/l) 7,64 7,20 7,53 IV-Infusionen jede 3. Woche 5 Patienten (8 %) 8 - Bereich (5,06/10,78) (2,59/ 9,69) Verabreichung der Behandlung oder jede 4. Woche 57 Patienten (92 %) XLA: X-chromosomale Agammaglobulinämie, 5,79 Für IgG-Konzentrationen > 4 bis 8 g/l CVID: common variable immunodeficiency 6 - beträgt die mittlere Anzahl von SBI 0,0 Primärer Endpunkt Wirksamkeit zur Verhinderung von schweren bakteriellen Infektionen (SBI)* Mittlere jährliche Infektionsrate Pädiatrische Patienten 4,88* (95 % CI: 3,31, 6,45) Erwachsene Patienten 3,01 (95 % CI: 1,91, 4,10) * In der pädiatrischen Gruppe war ein hoher Anteil von Patienten mit chronischen Infektionen in der Vorgeschichte. 224 Infektionen, 99 % davon waren von leichter bis mäßiger Intensität, bei denen eine Krankenhausaufnahme notwendig war. Mittelwert der IgG-Konzentration (g/l) während der ganzen Studie (n = 62) IgG-Konzentration Ausgangswert 6-prozentige Infusion 0.58 g/kg Ende der Studie 0,61 g/kg Infusionen Bei nur 7 % der Infektionen war eine längere Abwesenheit vom Arbeitsplatz/von der Schule notwendig Nur bei 5 Patienten (für 6 Infektionen) war eine Krankenhausaufnahme notwendig Pädiatrische Erwachsene Patienten Patienten Grafische Darstellung der SBI-Rate/Patientenjahr von IQYMUNE vs. FDA-/EMA-Forderung 10,11 SBI-Rate/Patientenjahr 1, ,8-0,6-0,4-0, ,0 FDA-/EMA- Forderung IQYMUNE p < 0,001 * SBI s sind hier: Bakteriämie oder Sepsis, bakterielle Meningitis, Osteomyelitis/septische Arthritis, bakterielle Pneumonie, viszerale Abszesse Weit über der FDA-/EMA-Forderung Mittlere Anzahl von SBI bei der pädiatrischen Population 0,017 SBI-Rate Erhaltung der physiologischen IgG-Halbwertszeit = 33,6 Tage Verträglichkeit 13 (n = 62) Alle UAW** Insgesamt Arzneimittelbedingte UAW** Inzidenz von arzneimittelbedingten UAW** bei Patienten > 5 % (43%) Schüttelfrost, Fieber, Kopfschmerzen, Neutropenie***, Rückenschmerzen, (51 Patienten) (33 Patienten) Hypertonie 100 % arzneimittelbedingte UAW von leichter bis mäßiger Intensität ** UAW: Unerwünschte Arzneimittelwirkung: Ein UE (Unerwünschtes Ereignis), das vom Tage an der ersten IVIg-Infusion bis zu Ende der Studie (Visite inklusive). Alle UAW verschwanden spontan ohne klinische Auswirkung oder Infektion. *** Neutropenie wurde als mild bis mäßig betrachtet, verschwand spontan ohne klinische Auswirkung oder Infektion und stimmte mit den Literaturdaten überein. IQYMUNE als Ersatztherapie: Nachgewiesene Wirksamkeit zur Verhinderung von SBI s bei PID-Patienten (Erwachsene, Kinder und Jugendliche).
5 NACHGEWIESENE WIRKSAMKEIT UND VERTRÄG- LICHKEIT BEI PRIMÄRER IMMUNTHROMBOZYTO- PENIE, MODELL FÜR DIE IMMUNMODULATION Methodik Sekundäre Endpunkte Prospektive, multizentrische, multinationale, offene, unkontrollierte und einarmige Studie der Phase III. 8 Länder, 19 Zentren, 38 Patienten im Alter zwischen 18 bis zu 64 Jahren. ITP Patientencharakteristika Insgesamt n = 38 Durchschnittsalter (y) (Bereich) 37,2 (18 60 y) Geschlecht n (%) Männlich Weiblich 14 (36,8 %) 24 (63,2 %) Präinfusion: Thrombozytenzahl 10 9 / l Mittelwert (Bereich) 16,8 (1 29) Vorherige Therapie n (%) Kortikosteroid Immunglobuline Verabreichte IQYMUNE-Dosis (g/kg): (an 2 aufeinanderfolgende Tagen mit 1 g/kg pro Tag) Mittelwert Maximum 32 (84,2 %) 11 (28,9 %) 1,89 g/kg 2,4 g/kg Wirksamkeit im Vergleich zu den früheren EMA-Richtlinien Reaktionszeit und maximale Thrombozytenzahl Mittlere Reaktionszeit (R) = 1,6 Tage Mediane Zeit = 1 Tag (Bereich 1-6 Tage) 1 Tag für 70,8 % der Responder 8 Reaktionsdauer = 13,5 Tage (95 % CI: 10,2 Tage) 9 Primärer Endpunkt Maximale Thrombozytenzahl = /l Mediane Zeit = 4 Tage (Bereich 1 29 Tage) Thrombozytenzahl (10 9 /l) Vorherige EMA-Kriterien Thrombozytenzahl / l bis zu Tag 5 Nur für Patienten mit einem Ausgangswert /l Schwelle 20 - Ausgangswert Zeit (Tage) Responderrate von 82,6 % (95 % CI: 61,2 ; 95,0) Thrombozytenzahl (x 10 9 /l) Wirksamkeit zum Anstieg der Thrombozytenzahl Neue EMA-Kriterien Tage + Keine neuen Blutungen Schwelle Thrombozytenzahl / l + 2-facher Anstieg vom Ausgangswert für 7 Tage Responderrate von 63,2 % (95 % CI 46, 78,2) Zeit (Tage) Alle UAW* Wirksamkeit zur Prophylaxe von Blutungen Beurteilung der Blutungen gemäß Blutungs-Score der Weltgesundheitsorganisation (WHO) Grad 0 = keine Blutungen Grad 1 = petechiale Blutungen Grad 2 = leichter Blutverlust Verträglichkeit 13 (n = 38) Insgesamt Arzneimittelbedingte UAW* Arzneimittelbedingte UAW** UE-Inzidenz > 5 % (75%) Fieber, Kopfschmerzen, Absenkung der Kreatinin-Clearance**, (31 Patienten) (26 Patienten) Blutdruckerhöhung, Erbrechen % der Patienten ,3 73 Tag 1 n = 37 2,7 0 Ende der Studie n = 29 Die Anzahl der Patienten ohne Blutungen steigt, während die Anzahl der Patienten mit petechialen Blutungen abnimmt 98,5 % Arzneimittelbedingte UAW von leichter bis mäßiger Intensität * UAW = Unerwünschte Arzneimittelwirkung: Eine UAW wurde vom Prüfer als nicht durch die Studienmedikation bedingt und vom Sponsor als nicht arzneimittelbedingt betrachtet. ** Die Absenkung der Kreatinin-Clearance verschwand spontan ohne klinische Auswirkung 62,1 37,9 IQYMUNE hat sowohl seine Wirksamkeit (höherer, schneller Anstieg der gemäß den neuen, strengeren EMA-Kriterien bewiesen Thrombozytenzahl und Prophylaxe von Blutungen) als auch seine Verträglichkeit
6 VERTRÄG LICHKEIT UND INFUSIONSRATE 13,15 Verträglichkeitsergebnisse für PID- und ITP-Patienten während der beiden klinischen Studien Optimierte Infusionsgeschwindigkeit von je 43 % (PID) und 29 % (ITP) 13, 14 der Infusionen 100 Patienten erhielten 839 IQYMUNE -Infusionen Fast alle beobachteten, arzneimittel- und therapiebedingten, unerwünschten Arzneimittelwirkungen (UAW) waren von leichter bis mäßiger Intensität (99,5 %) Kein Fall von Nierenversagen, Thrombose oder von hämolytischer Anämie Häufigkeit von UAW: System/Organ Häufige UAW (>1/100, <1/10) Allgemeine Erkrankungen Schüttelfrost, Müdigkeit, Fieber Gefäßerkrankungen Hypertonie Erkrankungen des Nervensystems Kopfschmerzen Erkrankungen des Blutes und des Lymphsystems Neutropenie * Erkrankungen des Blutes und des Lymphsystems Immunsystem Erkrankungen des Nervensystems Absenkung der Kreatinin-Clearance, erhöhter Kreatininwert im Blut**, Untersuchungen erhöhte Körpertemperatur Verletzungen, Vergiftungen und Folgekomplikationen Infusionsbedingte Reaktion * Neutropenie wurde als mild bis mäßig betrachtet, verschwand spontan ohne klinische Auswirkung oder Infektion und stimmte mit den Literaturdaten überein ** Die Absenkung der renalen Clearance verschwand spontan ohne klinische Auswirkung Andere unerwünschte Arzneimittelwirkungen von IVIg * : Nebenwirkungen, wie z. B. Schüttelfrost, Kopfschmerzen, Schwindel, Fieber, Erbrechen, allergische Reaktionen, Übelkeit, Arthralgie, niedriger Blutdruck und mittelschwere Rückenschmerzen können gelegentlich auftreten. Normales Immunglobulin vom Menschen führt selten zu einem plötzlichen Blutdruckabfall und in einzelnen Fällen zu einem anaphylaktischen Schock, auch wenn der Patient auf die letzte Verabreichung nicht empfindlich reagiert hat. Fälle von reversibler aseptischer Meningitis und seltene Fälle vorübergehender Hautveränderungen wurden unter der Verabreichung von normalem Immunglobulin vom Menschen beobachtet. Während einer immunmodulatorischen Behandlung wurden hämolytische Reaktionen bei einigen Patienten beobachtet insbesondere bei Patienten mit Blutgruppen A, B und AB. Selten kann sich eine hämolytische Anämie, die eine Transfusion erfordert, nach einer hochdosierten IVIg-Behandlung entwickeln. Ein Anstieg des Serumkreatininspiegels und/oder akutes Nierenversagen wurde beobachtet Sehr selten: Thromboembolische Reaktionen, wie z. B. Herzinfarkt, Schlaganfall, Lungenembolie, tiefe Venenthrombosen. * Für detaillierte Informationen siehe die Fachinformation Gelegentliche UAW (>1/100, <1/100) Leukopenie, Lymphopenie, Monozytopenie Anaphylaktische Reaktionen Aseptische Meningitis, Schwindel Erkrankungen des Ohrs und des Labyrinths Schwindel Gefäßerkrankungen Ischämische Gefäßerkrankungen Zeitersparnis (%) für die gesamte Infusionsdauer Gastrointestinale Störungen Übelkeit, Erbrechen, Bauchschmerzen Erkrankungen der Haut und des Unterhautzellgewebes Ausschlag, Schwitzen, Hautschmerzen Allgemeine Aufteilung (%) für die Infusion bei ITP-Patienten gemäß Infusionsrate (ml/kg pro Stunde) Skelettmuskulatur-, Bindegewebs- und Rückenschmerzen, Arthralgie, Schmerzen in den Extremitäten, Knochenerkrankungen Knochenschmerzen, muskuloskelettale Schmerzen im Brustraum Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Unwohlsein, grippeartige Erkrankung, Kältegefühl, Schmerzen an der Katheterstelle, periphere Ödemen Allgemeine Aufteilung der Infusionsrate (%) bei PID-Patienten (ml/kg pro Stunde) Dosisregime (% des Gesamtwertes) für die ersten 3 Infusionen 4 ml/kg pro Stunde Infusionsrate 4 ml/kg pro Stunde Infusionsrate > 4 bis 6 ml/kg/h pro Stunde Maximale Infusionsrate > 6-8 ml/kg/pro Stunde 0,65 % (nur 5) mussten die Behandlung abbrechen, und bei 1,3 % (10) musste die Infusionsrate gesenkt werden 2 Std.17 Min. Dosisregime (% des Gesamtwertes) D1 (38 Patienten) 4 ml/kg pro Stunde 4 Std. 45 Min % Infusionsrate 4 ml/kg pro Stunde Infusionsrate > 4 bis 6 ml/kg/h pro Stunde Maximale Infusionsrate > 6-8 ml/kg/h pro Stunde 4 % (nur 3) mussten die Behandlung abbrechen oder die Infusionsrate musste gesenkt werden 57 % Mittlere Dauer 2 Std. 17 Min. 71% Mittlere Dauer 4 Std.45 Min % 24 % 52 % 766 Infusionen (62 Patienten) 33 % 1 Std. 42 Min. 73 Infusionen (38 Patienten) 3 Std. 34 Min. Zeitersparnis (%) für die gesamte Infusionsdauer 22 % 43 % Mittlere Dauer 1 Std. 42 Min. 14 % 19 % 21 % 15 % 29 % Mittlere Dauer 3 Std. 34 Min. IQYMUNE zeigte ein gutes Verträglichkeitsprofil bei PID- und ITP-Patienten auch mit einer höheren Infusionsrate bis zu 8 ml/kg pro Stunde
7 PRAKTISCHE INFORMATIONEN UND INDIKATIONEN: IMMUNGLOBULIN (10 %) DER NEUESTEN GENERA- TION, GEBRAUCHSFERTIG Produktinformation Indikationen Lösung 100 mg/ml zur intravenösen Anwendung (10-prozentige Konzentration) Stabilisierende Formulierung Polysorbat 80 Glycin Zuckerfrei Natriumfrei (< 1 mmol Na/Dosis) Latexfrei ph = 4,6-5,0 Osmolalität 1 = mosmol/kg (Plasma mit mosmol/kg) Verabreichung Normales Immunglobulin vom Menschen sollte bei einer anfänglichen Infusionsrate von 0,5 ml/kg Körpergewicht pro Stunde 30 Min. intravenös infundiert werden. Falls es gut vertragen wird, kann die Verabreichungsrate allmählich bis zu maximal 6 ml/kg pro Stunde erhöht werden. Die klinisch erhobenen Daten bei einer begrenzten Anzahl von PID- und ITP-Patienten zeigen außerdem, dass Erwachsene und Kinder eine Infusionsrate bis zu 8 ml/kg Körpergewicht pro Stunde vertragen können. Ersatztherapie bei Erwachsenen, Kindern und Jugendlichen (0 18 Jahre) gegen Primäre Immunmangelsyndrome (PID) mit verminderter Antikörperproduktion. Hypogammaglobulinämie und rezidivierende bakterielle Infektionen bei Patienten mit chronischer lymphatischer Leukämie, die auf die prophylaktische Anwendung von Antibiotika nicht angesprochen haben. Hypogammaglobulinämie und rezidivierende bakterielle Infektionen bei Patienten mit Multiplem Myelom in der Plateauphase, die auf eine Pneumokokken-Impfung nicht angesprochen haben. Hypogammaglobulinämie bei Patienten nach einer allogenen, hämatopoetischen Stammzelltransplantation (HSCT). Kongenitales AIDS mit rezidivierenden bakteriellen Infektionen. Immunmodulation bei Erwachsenen, Kindern und Jugendlichen (0 18 Jahre) gegen: Primäre Immunthrombozytopenie (ITP) bei Patienten mit einem erhötem Blutungsrisiko oder zur Korrektur der Thrombozytenzahl vor einem operativen Eingriff. Guillain-Barré-Syndrom. Morbus Kawasaki. Ersatztherapie bei primären Immundefekten Indikation Dosis Häufigkeit der Infusionen - Anfangsdosis: 0,4 0,8 g/kg - Danach: 0,2 0,8 g/kg Alle Woche, um eine IgG-Talspiegel von mindestens 5 6 g/l zu erreichen 12 4 Packungsgrößen, um alle Patientenbedürfnisse in der klinischen Praxis Ersatztherapie Alle Woche, um eine IgG-Talspiegel von 0,2 0,4 g/kg 13 bei sekundären Immundefekten mindestens 5 6 g/l zu erreichen abzudecken. Farbcodes je nach Größe zur Dosierungsbestimmung Kongenitales AIDS 0,2 0,4 g/kg Alle Woche Hypogammaglobulinämie (< 4 g/l) bei Patienten nach einer allogenen, hämatopoetischen Stammzelltransplantation Immunmodulation: 0,2 0,4 g/kg Alle Woche, um eine IgG-Talspiegel über 5 g/l zu erreichen Primäre Immunthrombozytopenie 0,8 1 g/kg oder 0,4 g/kg pro Tag Am 1. Tag, ggf. innerhalb von 3 Tagen einmal wiederholen für 2 5 Tage Guillain-Barré-Syndrom 0,4 g/kg pro Tag an 5 aufeinanderfolgenden Tagen Morbus Kawasaki 1,6 2 g/kg oder 2 g/kg Als geteilte Dosen zusammen mit Acetylsalicylsäure über 2 5 Tage Als Einzeldosis zusammen mit Acetylsalicylsäure Lagerbedingungen 24 Monate bei Raumtemperatur Nicht über 25 C lagern Nicht einfrieren Die Durchstechflasche im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen Pädiatrische Population Da die Dosierung bei jeder Indikation durch das Körpergewicht bestimmt und gemäß den oben genannten Bedingungen dem klinischen Ergebnis angepasst wird, unterscheidet sie sich nicht bei Kindern und Jugendlichen (0 18 Jahre) von der Erwachsenen-Dosierung. Kontraindikationen Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile. Überempfindlichkeit gegen Immunglobulin vom Menschen, insbesondere bei Patienten mit IgA-Antikörpern.
8 QUELLENNACHWEIS UND BASISINFORMATION Quellennachweis Basisinformation 1. I10 Registration files. Manufacturing process development Conclusions of FDA-EMA Parallel assessment of Quality-by-Design Elements of Marketing Applications. Update of 12/19/ I10 Study report / Drug substance / Assay of anti-a and anti-b haemagglutinins (dilutions) 4. I10 Study report / Procoagulant activities / Assay of coagulation factor activity & Overall tests for activation markers 5. I10 Study report / Drug product / drug product release specifications 6. I10 Study report / Process-related impurities / Purity of I10 batches (Ph. Eur. Monograph 0918 operating conditions) 7. I10 Study report / Elucidation of structure and other characteristics / Structural characterisation/igg subclasses 8. I10 Study report/identification of the specific steps of virus inactivation according to the Note for Guidance on viral validation studies (CPMP/BWP/268/95 revised) QOS- Export report- Adjuvant agents safety evaluation Blutgruppen A, B und AB beobachtet, die wegen einer Immunmodulation in Behandlung waren. In seltenen Fällen kann sich nach einer 10. FDA Center for Biologics Evaluation and Research. Guidance for Industry: Safety, Efficacy, and Pharmacokinetic hochdosierten IVIg-Behandlung eine transfusionsbedürftige hämolytische Anämie entwickeln. Ein Anstieg des Serum-Kreatininspiegels 15 Studies to Support Marketing of Immune Globulin Intravenous (Human) as Replacement und/oder akutes Nierenversagen wurden beobachtet. Sehr selten: Thromboembolische Reaktionen wie Myokardinfarkt, Schlaganfall, Therapy for Primary Humoral Immunodeficiency. June 2008 Lungenembolie und tiefe Venenthrombosen. WARNHINWEIS: Aus menschlichem Plasma gewonnenes Arzneimittel. Arzneimittel für Kinder unzugänglich aufbewahren. Verschreibungspflichtig. 11. EMA Guideline on the clinical investigation of human normal immunoglobulin for subcutaneous and/or intramuscular administration (SCIg/IMIg) July I10 Study report / Clinical efficacy 13. I10 Study report / Clinical safety 14. I10 Study report / Clinical pharmacology 15. Basisinformation IQYMUNE IQYMUNE 100 mg/ml Infusionslösung zur intravenösen Anwendung. ZUSAMMENSETZUNG: Normales Immunglobulin vom Menschen, 100 mg/ml enthalten 10 % menschliches Protein, davon mindestens 95 % Immunglobulin G (IgG). Bestandteil der IgG-Subklassen: IgG %; IgG %; IgG3 2 %; IgG4 1 2 %. Maximaler IgA-Gehalt 28 µg/ml. Sonstige Bestandteile: Glycin, Polysorbat 80, Wasser für Injektionszwecke. ANWENDUNGSGEBIETE: Substitutionstherapie bei Erwachsenen sowie Kindern und Jugendlichen (0 18 Jahre) bei: Primären Immunmangelsyndromen (PID) mit beeinträchtigter Antikörperproduktion; Hypogammaglobulinämie und rezidivierenden bakteriellen Infektionen bei Patienten mit chronischer lymphatischer Leukämie, bei denen prophylaktisch verabreichte Antibiotika nicht angeschlagen haben; Hypogammaglobulinämie und rezidivierenden bakteriellen Infektionen bei Patienten mit in der Plateauphase befindlichem multiplen Myelom, die nicht auf eine Immunisierung gegen Pneumokokken angesprochen haben; Hypogammaglobulinämie bei Patienten nach einer allogenen, hämatopoetischen Stammzellentransplantation (allogene HSZT); kongenitales AIDS mit rezidivierenden bakteriellen Infektionen. Immunmodulation bei Erwachsenen sowie Kindern und Jugendlichen (0 18 Jahre) bei: Primärer Immunthrombozytopenie (ITP) bei Patienten mit hohem Blutungsrisiko oder vor Operationen zur Korrektur der Thrombozytenzahl; Guillain-Barré-Syndrom; Kawasaki-Syndrom. GEGENANZEIGEN: IQYMUNE darf NICHT angewendet werden bei Überempfindlichkeit gegen den Wirkstoff oder sonstige Bestandteile des Produkts, insbesondere bei Patienten mit Antikörpern gegen IgA. NEBENWIRKUNGEN: Gelegentlich: Schüttelfrost, Kopfschmerzen, Schwindelgefühl, Fieber, Erbrechen, allergische Reaktionen, Übelkeit, Arthralgie, niedriger Blutdruck und mäßige Schmerzen im unteren Rücken. Selten: Überempfindlichkeitsreaktion mit plötzlichem Blutdruckabfall u. in Einzelfällen anaphylaktischer Schock, auch wenn der Patient bei früheren Verabreichungen keine Überempfindlichkeit gezeigt hat. Fälle von reversibler aseptischer Meningitis und seltene Fälle von vorübergehenden Hautveränderungen wurden unter der Verabreichung von normalem Immunglobulin vom Menschen beobachtet. Reversible hämolytische Reaktionen wurden vor allem bei Patienten mit den Stand 09/2015. Inhaber der Zulassung u. Vertrieb: LFB Biomedicaments 3, avenue des Tropiques, Courtaboeuf Cedex, Frankreich.
9 Hoher Reinheitsgrad = 99 % Optimiertes Verträglichkeitsprofil Nachgewiesene Wirksamkeit Zeitersparnis Für alle Patienten geeignet, unabhängig von ihren Risikofaktoren oder Begleiterkrankungen* * Siehe Fachinformation Stand der Informationen: Juli 2016 LFB GmbH An der Alten Ziegelei Münster Deutschland Telefon 0251/ Fax 0251/
Neues subkutanes Immunglobulin. Hochkonzentriert. High-Speed. Hizentra. Immune Globulin Subcutaneous (Human) 20%Liquid
 Neues subkutanes Immunglobulin Hochkonzentriert. High-Speed. Hizentra. Hizentra bietet Hohe Konzentration und geringes Infusionsvolumen Kurze Infusionsdauer Exzellenten Infektionsschutz Sehr gute Verträglichkeit
Neues subkutanes Immunglobulin Hochkonzentriert. High-Speed. Hizentra. Hizentra bietet Hohe Konzentration und geringes Infusionsvolumen Kurze Infusionsdauer Exzellenten Infektionsschutz Sehr gute Verträglichkeit
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
Gebrauchsinformation: Information für Anwender. Panzyga 100 mg/ml Infusionslösung Normales Immunglobulin vom Menschen (IVIg)
 Gebrauchsinformation: Information für Anwender Panzyga 100 mg/ml Infusionslösung Normales Immunglobulin vom Menschen (IVIg) Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht
Gebrauchsinformation: Information für Anwender Panzyga 100 mg/ml Infusionslösung Normales Immunglobulin vom Menschen (IVIg) Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht
Gebrauchsinformation: Information für Anwender. Intratect 100 g/l Infusionslösung Wirkstoff: Normales Immunglobulin vom Menschen (IVIg)
 Gebrauchsinformation: Information für Anwender Intratect 100 g/l Infusionslösung Wirkstoff: Normales Immunglobulin vom Menschen (IVIg) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
Gebrauchsinformation: Information für Anwender Intratect 100 g/l Infusionslösung Wirkstoff: Normales Immunglobulin vom Menschen (IVIg) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
Intratect 50 g/l, Infusionslösung
 1. BEZEICHNUNG DES ARZNEIMITTELS Intratect, 50 g/l, Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin vom Menschen (IVIg) Ein ml enthält: Normales Immunglobulin vom
1. BEZEICHNUNG DES ARZNEIMITTELS Intratect, 50 g/l, Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin vom Menschen (IVIg) Ein ml enthält: Normales Immunglobulin vom
Flebogamma DIF 50 mg/ml Infusionslösung
 1. BEZEICHNUNG DES ARZNEIMITTELS 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales (IVIg) Ein ml enthält: Normales Immunglobulin vom Menschen..... 50 mg (Reinheit von mindestens 97 % IgG) Jede Flasche
1. BEZEICHNUNG DES ARZNEIMITTELS 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales (IVIg) Ein ml enthält: Normales Immunglobulin vom Menschen..... 50 mg (Reinheit von mindestens 97 % IgG) Jede Flasche
Pressemitteilungen 2013
 Pressemitteilungen 2013 15.04.2013 IgPro10 (Privigen ) erhält EU-Zulassung zur Therapie der CIDP Die Europäische Kommission hat am 26. März 2013 das 10prozentige intravenöse Immunglobulin (IVIG) IgPro10
Pressemitteilungen 2013 15.04.2013 IgPro10 (Privigen ) erhält EU-Zulassung zur Therapie der CIDP Die Europäische Kommission hat am 26. März 2013 das 10prozentige intravenöse Immunglobulin (IVIG) IgPro10
IgPro10 (Privigen ) erhält EU-Zulassung zur Therapie der Chronisch inflammatorischen demyelinisierenden Polyneuropathie (CIDP)
 P R E S S E I N F O R M A T I O N IgPro10 (Privigen ) erhält EU-Zulassung zur Therapie der Chronisch inflammatorischen demyelinisierenden Polyneuropathie (CIDP) Hattersheim, 15. April 2013 Die Europäische
P R E S S E I N F O R M A T I O N IgPro10 (Privigen ) erhält EU-Zulassung zur Therapie der Chronisch inflammatorischen demyelinisierenden Polyneuropathie (CIDP) Hattersheim, 15. April 2013 Die Europäische
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Flebogamma DIF 50 mg/ml Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Flebogamma DIF 50 mg/ml Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin
Gebrauchsinformation: Information für Anwender
 : Information für Anwender Intratect 50 g/l Infusionslösung Normales Immunglobulin vom Menschen (IVIg) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
: Information für Anwender Intratect 50 g/l Infusionslösung Normales Immunglobulin vom Menschen (IVIg) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Biseko 50 g/l Infusionslösung Plasmaproteine vom Menschen
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Biseko 50 g/l Infusionslösung Plasmaproteine vom Menschen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Biseko 50 g/l Infusionslösung Plasmaproteine vom Menschen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Cytomegalie-Immunglobulin vom Menschen
 Immunglobuline Prophylaxe klinischer Manifestationen einer Cytomegalie-Virus-Infektion bei Patienten unter immunsuppressiver Therapie, insbesondere Transplantat-Empfängern. CMV-Infektion (Prophylaxe) Kdr.,
Immunglobuline Prophylaxe klinischer Manifestationen einer Cytomegalie-Virus-Infektion bei Patienten unter immunsuppressiver Therapie, insbesondere Transplantat-Empfängern. CMV-Infektion (Prophylaxe) Kdr.,
Parameter. Gesamtprotein [mg/ml] 21,83 ± 1,18 21,75 (20,1 23,4) 33,16 ± 0,55 33,20 (32,6 33,8)
![Parameter. Gesamtprotein [mg/ml] 21,83 ± 1,18 21,75 (20,1 23,4) 33,16 ± 0,55 33,20 (32,6 33,8) Parameter. Gesamtprotein [mg/ml] 21,83 ± 1,18 21,75 (20,1 23,4) 33,16 ± 0,55 33,20 (32,6 33,8)](/thumbs/80/80984754.jpg) Herstellungsprozess 1,2 Auf einen Blick Der fibryga -Herstellungsprozess beinhaltet neben drei schritten zwei Schritte zur Pathogen- abreicherung. Hohe Reinheit Zweifach virusinaktiviert/-abgereichert
Herstellungsprozess 1,2 Auf einen Blick Der fibryga -Herstellungsprozess beinhaltet neben drei schritten zwei Schritte zur Pathogen- abreicherung. Hohe Reinheit Zweifach virusinaktiviert/-abgereichert
CUVITRU wurde von Swissmedic per 14. Oktober 2016 mit folgender Indikation zugelassen:
 Eidgenössisches Departement des Innern EDI Bundesamt für Gesundheit BAG Direktionsbereich Kranken- und Unfallversicherung (20571) CUVITRU, Baxalta Schweiz AG Neuaufnahme in Spezialitätenliste (SL) per
Eidgenössisches Departement des Innern EDI Bundesamt für Gesundheit BAG Direktionsbereich Kranken- und Unfallversicherung (20571) CUVITRU, Baxalta Schweiz AG Neuaufnahme in Spezialitätenliste (SL) per
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Cytomegalie-Immunglobulin vom Menschen zur intravenösen Anwendung
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Cytotect CP Biotest 100 E/ml Infusionslösung Cytomegalie-Immunglobulin vom Menschen zur intravenösen Anwendung Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Cytotect CP Biotest 100 E/ml Infusionslösung Cytomegalie-Immunglobulin vom Menschen zur intravenösen Anwendung Lesen Sie die gesamte Packungsbeilage sorgfältig
Neues Subkutan-Immunglobulin IgPro20 zeigt in Studien gute Wirksamkeit und Sicherheit
 P R E S S E I N F O R M A T I O N Jahrestagung der European Society for Immunodeficiencies (ESID) Neues Subkutan-Immunglobulin IgPro20 zeigt in Studien gute Wirksamkeit und Sicherheit Istanbul/Hattersheim,
P R E S S E I N F O R M A T I O N Jahrestagung der European Society for Immunodeficiencies (ESID) Neues Subkutan-Immunglobulin IgPro20 zeigt in Studien gute Wirksamkeit und Sicherheit Istanbul/Hattersheim,
Gebrauchsinformation: Information für Anwender. Privigen 100 mg/ml (10 %) Infusionslösung Normales Immunglobulin vom Menschen (IVIg)
 Gebrauchsinformation: Information für Anwender Privigen 100 mg/ml (10 %) Infusionslösung Normales Immunglobulin vom Menschen (IVIg) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Gebrauchsinformation: Information für Anwender Privigen 100 mg/ml (10 %) Infusionslösung Normales Immunglobulin vom Menschen (IVIg) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Gebrauchsinformation: Information für Patienten
 Gebrauchsinformation: Information für Patienten 160 mg/ml Injektionslösung zur Anwendung unter die Haut oder in einen Muskel Normales Immunglobulin vom Menschen Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Patienten 160 mg/ml Injektionslösung zur Anwendung unter die Haut oder in einen Muskel Normales Immunglobulin vom Menschen Lesen Sie die gesamte Packungsbeilage sorgfältig
Hypogammaglobulinämie und rezidivierende bakterielle Infektionen bei Patienten mit chronischlymphatischer
 Intratect 50 g/l-infusionslösung 2. Qualitative und quantitative Zusammensetzung Normales Immunglobulin vom Menschen (IVIg) Ein ml enthält: Normales Immunglobulin vom Menschen 50 mg (Reinheit mindestens
Intratect 50 g/l-infusionslösung 2. Qualitative und quantitative Zusammensetzung Normales Immunglobulin vom Menschen (IVIg) Ein ml enthält: Normales Immunglobulin vom Menschen 50 mg (Reinheit mindestens
Privigen 100 mg/ml Infusionslösung
 1. BEZEICHNUNG DES ARZNEIMITTELS 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin vom (IVIg). Ein Milliliter enthält: Normales Immunglobulin vom 100 mg (Reinheit von mindestens 98
1. BEZEICHNUNG DES ARZNEIMITTELS 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin vom (IVIg). Ein Milliliter enthält: Normales Immunglobulin vom 100 mg (Reinheit von mindestens 98
MULTIGAM 5% Infusionslösung Normales Immunglobulin vom Menschen (IVIg)
 GEBRAUCHSINFORMATION : INFORMATION FÜR ANWENDER MULTIGAM 5% Infusionslösung Normales Immunglobulin vom Menschen (IVIg) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
GEBRAUCHSINFORMATION : INFORMATION FÜR ANWENDER MULTIGAM 5% Infusionslösung Normales Immunglobulin vom Menschen (IVIg) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
MULTIGAM 5% Infusionslösung Normales Immunglobulin vom Menschen (IVIg)
 GEBRAUCHSINFORMATION : INFORMATION FÜR ANWENDER MULTIGAM 5% Infusionslösung Normales Immunglobulin vom Menschen (IVIg) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
GEBRAUCHSINFORMATION : INFORMATION FÜR ANWENDER MULTIGAM 5% Infusionslösung Normales Immunglobulin vom Menschen (IVIg) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Gebrauchsinformation: Information für Patienten
 Gebrauchsinformation: Information für Patienten Beriglobin P * Fertigspritze Injektionslösung zur subkutanen oder intramuskulären Anwendung Normales Immunglobulin vom Menschen Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Patienten Beriglobin P * Fertigspritze Injektionslösung zur subkutanen oder intramuskulären Anwendung Normales Immunglobulin vom Menschen Lesen Sie die gesamte Packungsbeilage
PHV-issue: Anti-Human-Thymozyten-Immunglobulin vom Kaninchen
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 28.09.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 28.09.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Octagam 50 mg/ml Infusionslösung Wirkstoff: Normales Immunglobulin vom Menschen (IVIg) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Octagam 50 mg/ml Infusionslösung Wirkstoff: Normales Immunglobulin vom Menschen (IVIg) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Wirkstoff: Normales Immunglobulin vom Menschen (IVIg)
 1. BEZEICHNUNG DES ARZNEIMITTELS Gamunex 10% - Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Wirkstoff: Normales Immunglobulin vom Menschen (IVIg) Ein ml enthält: normales Immunglobulin
1. BEZEICHNUNG DES ARZNEIMITTELS Gamunex 10% - Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Wirkstoff: Normales Immunglobulin vom Menschen (IVIg) Ein ml enthält: normales Immunglobulin
Gamunex 10 % Infusionslösung
 September 2018 9029433 1. BEZEICHNUNG DES ARZNEIMITTELS 014157-36678 Gamunex 10 % 100 mg/ml, Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG (IVIg) Ein ml enthält: Normales Immunglobulin
September 2018 9029433 1. BEZEICHNUNG DES ARZNEIMITTELS 014157-36678 Gamunex 10 % 100 mg/ml, Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG (IVIg) Ein ml enthält: Normales Immunglobulin
Privigen 100 mg/ml Infusionslösung
 1. BEZEICHNUNG DES ARZNEIMITTELS 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin vom (IVIg)* Ein Milliliter enthält: Normales Immunglobulin vom 100 mg (Reinheit von mindestens 98
1. BEZEICHNUNG DES ARZNEIMITTELS 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin vom (IVIg)* Ein Milliliter enthält: Normales Immunglobulin vom 100 mg (Reinheit von mindestens 98
Gamunex 10 % Infusionslösung
 November 2016 9029092 1. BEZEICHNUNG DES ARZNEIMITTELS 014157-24764 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Wirkstoff: Normales Immunglobulin vom Menschen (IVIg) Ein ml enthält: normales Immunglobulin
November 2016 9029092 1. BEZEICHNUNG DES ARZNEIMITTELS 014157-24764 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Wirkstoff: Normales Immunglobulin vom Menschen (IVIg) Ein ml enthält: normales Immunglobulin
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Privigen 100 mg/ml Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin vom
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Privigen 100 mg/ml Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin vom
Gebrauchsinformation: Information für Anwender. KIOVIG 100 mg/ml Infusionslösung Normales Immunglobulin vom Menschen
 Gebrauchsinformation: Information für Anwender KIOVIG 100 mg/ml Infusionslösung Normales Immunglobulin vom Menschen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
Gebrauchsinformation: Information für Anwender KIOVIG 100 mg/ml Infusionslösung Normales Immunglobulin vom Menschen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Fovepta 200 I.E. Injektionslösung in einer Fertigspritze Hepatitis-B-Immunglobulin vom Menschen
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Fovepta 200 I.E. Injektionslösung in einer Fertigspritze Hepatitis-B-Immunglobulin vom Menschen Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Fovepta 200 I.E. Injektionslösung in einer Fertigspritze Hepatitis-B-Immunglobulin vom Menschen Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Die Verteilung der IgG-Subklassen ist ca. 65 % IgG1, 30 % IgG2, 3 % IgG3, 2 % IgG4.
 1. BEZEICHNUNG DES ARZNEIMITTELS Cytotect CP Biotest 100 E/ml Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Cytomegalie-Immunglobulin vom Menschen 50 mg/ml Plasmaproteine vom Menschen
1. BEZEICHNUNG DES ARZNEIMITTELS Cytotect CP Biotest 100 E/ml Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Cytomegalie-Immunglobulin vom Menschen 50 mg/ml Plasmaproteine vom Menschen
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Ig Vena 50 g/l Infusionslösung Normales Immunglobulin (IVIG) vom Menschen zur intravenösen Anwendung
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Ig Vena 50 g/l Infusionslösung Normales Immunglobulin (IVIG) vom Menschen zur intravenösen Anwendung Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Ig Vena 50 g/l Infusionslösung Normales Immunglobulin (IVIG) vom Menschen zur intravenösen Anwendung Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Gamunex 10% mg/ml Infusionslösung Normales Immunglobulin G vom Menschen (IVIg)
 1/10 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Gamunex 10% - 100 mg/ml Infusionslösung Normales Immunglobulin G vom Menschen (IVIg) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
1/10 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Gamunex 10% - 100 mg/ml Infusionslösung Normales Immunglobulin G vom Menschen (IVIg) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
Gebrauchsinformation: Information für Anwender. Privigen 100 mg/ml (10 %) Infusionslösung Normales Immunglobulin vom Menschen (IVIg)
 Gebrauchsinformation: Information für Anwender Privigen 100 mg/ml (10 %) Infusionslösung Normales Immunglobulin vom Menschen (IVIg) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Gebrauchsinformation: Information für Anwender Privigen 100 mg/ml (10 %) Infusionslösung Normales Immunglobulin vom Menschen (IVIg) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Gebrauchsinformation: Information Für Anwender. PNEUMO 23, Injektionslösung Pneumokokken-Polysaccharid-Impfstoff
 Gebrauchsinformation: Information Für Anwender PNEUMO 23, Injektionslösung Pneumokokken-Polysaccharid-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem Impfstoff geimpft
Gebrauchsinformation: Information Für Anwender PNEUMO 23, Injektionslösung Pneumokokken-Polysaccharid-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem Impfstoff geimpft
KIOVIG 100 mg/ml Infusionslösung
 1. BEZEICHNUNG DES ARZNEIMITTELS 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG (IVIg) Ein ml enthält: Normales Immunglobulin vom Menschen.................... 100 mg (Reinheitsgrad von mindestens 98 %
1. BEZEICHNUNG DES ARZNEIMITTELS 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG (IVIg) Ein ml enthält: Normales Immunglobulin vom Menschen.................... 100 mg (Reinheitsgrad von mindestens 98 %
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Privigen 100 mg/ml Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin vom
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Privigen 100 mg/ml Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin vom
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Privigen 100 mg/ml Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin vom
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Privigen 100 mg/ml Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin vom
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS KIOVIG 100 mg/ml Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin vom Menschen
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS KIOVIG 100 mg/ml Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin vom Menschen
Gamunex 10% mg/ml Infusionslösung Wirkstoff: Normales Immunglobulin vom Menschen (IVIg)
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Gamunex 10% - 100 mg/ml Infusionslösung Wirkstoff: Normales Immunglobulin vom Menschen (IVIg) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Gamunex 10% - 100 mg/ml Infusionslösung Wirkstoff: Normales Immunglobulin vom Menschen (IVIg) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS KIOVIG 100 mg/ml Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin vom Menschen
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS KIOVIG 100 mg/ml Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin vom Menschen
FACHINFORMATION. Eine Durchstechflasche von 200 ml enthält: 10 g normales Immunglobulin vom Menschen
 FACHINFORMATION 1 BEZEICHNUNG DES ARZNEIMITTELS Ig Vena 50 g/l Infusionslösung 2 QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin vom Menschen (IVIg). Ein ml Lösung enthält: Normales
FACHINFORMATION 1 BEZEICHNUNG DES ARZNEIMITTELS Ig Vena 50 g/l Infusionslösung 2 QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin vom Menschen (IVIg). Ein ml Lösung enthält: Normales
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Privigen 100 mg/ml Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin vom
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Privigen 100 mg/ml Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin vom
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Gammanorm 165 mg/ml Injektionslösung Wirkstoff: Normales Immunglobulin vom Menschen
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Gammanorm 165 mg/ml Injektionslösung Wirkstoff: Normales Immunglobulin vom Menschen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Gammanorm 165 mg/ml Injektionslösung Wirkstoff: Normales Immunglobulin vom Menschen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
Ig Vena 50 g/l Infusionslösung Normales Immunglobulin (IVIG) vom Menschen zur intravenösen Anwendung
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Ig Vena 50 g/l Infusionslösung Normales Immunglobulin (IVIG) vom Menschen zur intravenösen Anwendung Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Ig Vena 50 g/l Infusionslösung Normales Immunglobulin (IVIG) vom Menschen zur intravenösen Anwendung Lesen Sie die gesamte Packungsbeilage sorgfältig
Ig Vena 50 g/l Infusionslösung Normales Immunglobulin (IVIG) vom Menschen zur intravenösen Anwendung
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Ig Vena 50 g/l Infusionslösung Normales Immunglobulin (IVIG) vom Menschen zur intravenösen Anwendung Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Ig Vena 50 g/l Infusionslösung Normales Immunglobulin (IVIG) vom Menschen zur intravenösen Anwendung Lesen Sie die gesamte Packungsbeilage sorgfältig
FACHINFORMATION. 4.2 Dosierung und Art der Anwendung. Die Substitutionstherapie sollte unter Aufsicht eines Arztes mit Erfahrung in der Behandlung
 1. BEZEICHNUNG DES ARZNEIMITTELS 50 mg/ml Lösung zur intravenösen Infusion 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG (IVIg) 1 ml Infusionslösung enthält 50 mg Protein, davon mindestens 95 % normales
1. BEZEICHNUNG DES ARZNEIMITTELS 50 mg/ml Lösung zur intravenösen Infusion 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG (IVIg) 1 ml Infusionslösung enthält 50 mg Protein, davon mindestens 95 % normales
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 BEZEICHNUNG DES ARZNEIMITTELS Octagam 100 mg/ml Infusionslösung 2 QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin vom Menschen (IVIg)*
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 BEZEICHNUNG DES ARZNEIMITTELS Octagam 100 mg/ml Infusionslösung 2 QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin vom Menschen (IVIg)*
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
 Seite 1/5 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Humanalbumin Octapharma 200 g/l Infusionslösung Wirkstoff: Humanalbumin aus menschlichem Plasma Lesen Sie die gesamte Packungsbeilage sorgfältig
Seite 1/5 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Humanalbumin Octapharma 200 g/l Infusionslösung Wirkstoff: Humanalbumin aus menschlichem Plasma Lesen Sie die gesamte Packungsbeilage sorgfältig
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige
Zusammenfassung der Merkmale des Arzneimittels
 Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Pentaglobin 50 g/l Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Immunglobulin vom Menschen zur intravenösen
Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Pentaglobin 50 g/l Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Immunglobulin vom Menschen zur intravenösen
GEBRAUCHSINFORMATION: INFORMATIONEN FÜR DEN ANWENDER
 GEBRAUCHSINFORMATION: INFORMATIONEN FÜR DEN ANWENDER OCTAGAM, 50 mg/ml, Infusionslösung Normales Human-Immunoglobulin (IVIg) Lesen Sie vor der Verwendung dieses Medikaments die nachstehenden Gebrauchsinformationen
GEBRAUCHSINFORMATION: INFORMATIONEN FÜR DEN ANWENDER OCTAGAM, 50 mg/ml, Infusionslösung Normales Human-Immunoglobulin (IVIg) Lesen Sie vor der Verwendung dieses Medikaments die nachstehenden Gebrauchsinformationen
Bendamustin. eine (Substanz) Klasse für sich. Neueste Daten zum Wirkmechanismus einer bewährten Substanz. Bendamustin
 eine (Substanz) Klasse für sich Neueste Daten zum Wirkmechanismus einer bewährten Substanz NCI-Screening: einzigartiges Aktivitätsprofil zeigt im NCI-Screening ein anderes Aktivitätsprofil als die klassischen
eine (Substanz) Klasse für sich Neueste Daten zum Wirkmechanismus einer bewährten Substanz NCI-Screening: einzigartiges Aktivitätsprofil zeigt im NCI-Screening ein anderes Aktivitätsprofil als die klassischen
Harnblasenkarzinom. Diagnostik & Primärtherapie Systemische Therapie Neue Daten und klinische Erfahrung
 Einladung zum Symposium Wichtige Aspekte der ersten Diagnostik & Primärtherapie Systemische Therapie Neue Daten und klinische Erfahrung Im Herbst 2016 wird die erste zum veröffentlicht. Dies bedeutet einen
Einladung zum Symposium Wichtige Aspekte der ersten Diagnostik & Primärtherapie Systemische Therapie Neue Daten und klinische Erfahrung Im Herbst 2016 wird die erste zum veröffentlicht. Dies bedeutet einen
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben?
 Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Beschluss vom: 5. Juli 2018 gültig bis: In Kraft getreten am: 5. Juli 2018 BAnz AT B2
 Allogene, genetisch modifizierte T-Zellen Beschluss vom: 5. Juli 2018 gültig bis: 01.04.2021 In Kraft getreten am: 5. Juli 2018 BAnz AT 27.08.2018 B2 Zugelassenes Anwendungsgebiet (laut Zulassung vom 18.
Allogene, genetisch modifizierte T-Zellen Beschluss vom: 5. Juli 2018 gültig bis: 01.04.2021 In Kraft getreten am: 5. Juli 2018 BAnz AT 27.08.2018 B2 Zugelassenes Anwendungsgebiet (laut Zulassung vom 18.
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Hepatect CP 50 I.E./ml Infusionslösung Hepatitis-B-Immunglobulin vom Menschen zur intravenösen Anwendung Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Anwender Hepatect CP 50 I.E./ml Infusionslösung Hepatitis-B-Immunglobulin vom Menschen zur intravenösen Anwendung Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für den Anwender. Varizella-Zoster-Immunglobulin vom Menschen
 Gebrauchsinformation: Information für den Anwender Varitect CP 25 I.E./ml Infusionslösung Varizella-Zoster-Immunglobulin vom Menschen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Gebrauchsinformation: Information für den Anwender Varitect CP 25 I.E./ml Infusionslösung Varizella-Zoster-Immunglobulin vom Menschen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Hizentra 200 mg/ml Injektionslösung zur subkutanen Anwendung Normales Immunglobulin vom Menschen (SCIg = Subkutanes Immunglobulin). Lesen Sie die gesamte
Gebrauchsinformation: Information für Anwender Hizentra 200 mg/ml Injektionslösung zur subkutanen Anwendung Normales Immunglobulin vom Menschen (SCIg = Subkutanes Immunglobulin). Lesen Sie die gesamte
Flebogamma DIF 100 mg/ml Infusionslösung
 1. BEZEICHNUNG DES ARZNEIMITTELS 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG (IVIg) Ein ml enthält: Normales Immunglobulin vom Menschen... 100 mg (Reinheit von mindestens 97 % IgG) Jede Flasche mit
1. BEZEICHNUNG DES ARZNEIMITTELS 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG (IVIg) Ein ml enthält: Normales Immunglobulin vom Menschen... 100 mg (Reinheit von mindestens 97 % IgG) Jede Flasche mit
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS Hizentra 1. BEZEICHNUNG DES ARZNEIMITTELS Hizentra, 200 mg/ml Lösung zur subkutanen Injektion Hizentra, 200 mg/ml Lösung zur subkutanen Injektion in Fertigspritzen
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS Hizentra 1. BEZEICHNUNG DES ARZNEIMITTELS Hizentra, 200 mg/ml Lösung zur subkutanen Injektion Hizentra, 200 mg/ml Lösung zur subkutanen Injektion in Fertigspritzen
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Haemocomplettan P 1g/2g Pulver und Lösungsmittel zur Herstellung einer Injektions-/Infusionslösung Wirkstoff: Fibrinogen vom Menschen Lesen Sie die gesamte
Gebrauchsinformation: Information für Anwender Haemocomplettan P 1g/2g Pulver und Lösungsmittel zur Herstellung einer Injektions-/Infusionslösung Wirkstoff: Fibrinogen vom Menschen Lesen Sie die gesamte
Primäre Immundefekte: frühzeitige Diagnose und Therapie entscheidend für Behandlungserfolg
 P R E S S E I N F O R M A T I O N 108. Jahrestagung der Deutschen Gesellschaft für Kinder- und Jugendmedizin (DGKJ) in Hamburg Primäre Immundefekte: frühzeitige Diagnose und Therapie entscheidend für Behandlungserfolg
P R E S S E I N F O R M A T I O N 108. Jahrestagung der Deutschen Gesellschaft für Kinder- und Jugendmedizin (DGKJ) in Hamburg Primäre Immundefekte: frühzeitige Diagnose und Therapie entscheidend für Behandlungserfolg
1. WAS IST PARACETAMOL MYLAN 500 MG TABLETTEN UND WOFÜR WIRD ES ANGEWENDET?
 Gebrauchsinformation: Information für Anwender Paracetamol Mylan 500 mg Tabletten Paracetamol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Anwender Paracetamol Mylan 500 mg Tabletten Paracetamol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Myositis - Erfahrungen mit Immunglobulintherapie
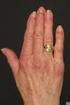 Myositis - Erfahrungen mit Immunglobulintherapie Dr. med. S. Geisenhof Klinikum Dritter Orden, München Städtisches Klinikum München - Klinikum Schwabing 1 Portkatheter - Was ist das? Reservoir (Port) dauerhaft
Myositis - Erfahrungen mit Immunglobulintherapie Dr. med. S. Geisenhof Klinikum Dritter Orden, München Städtisches Klinikum München - Klinikum Schwabing 1 Portkatheter - Was ist das? Reservoir (Port) dauerhaft
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Hizentra, 200 mg/ml Lösung zur subkutanen Injektion in Durchstechflaschen Hizentra, 200 mg/ml Lösung zur subkutanen
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Hizentra, 200 mg/ml Lösung zur subkutanen Injektion in Durchstechflaschen Hizentra, 200 mg/ml Lösung zur subkutanen
Fachinformation. Gammagard S/D. 4.2 Dosierung, Art und Dauer der Anwendung
 Fachinformation 1. BEZEICHNUNG DES ARZNEIMITTELS 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin G vom Menschen (IgG) liegt als Pulver und Lösungsmittel zur Infusion vor, und enthält
Fachinformation 1. BEZEICHNUNG DES ARZNEIMITTELS 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin G vom Menschen (IgG) liegt als Pulver und Lösungsmittel zur Infusion vor, und enthält
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Allogene, genetisch modifizierte T-Zellen wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM- RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM- RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Gebrauchsinformation: Information für Anwender. Replagal 1 mg/ml Konzentrat zur Herstellung einer Infusionslösung Agalsidase alfa
 Gebrauchsinformation: Information für Anwender Replagal 1 mg/ml Konzentrat zur Herstellung einer Infusionslösung Agalsidase alfa Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Gebrauchsinformation: Information für Anwender Replagal 1 mg/ml Konzentrat zur Herstellung einer Infusionslösung Agalsidase alfa Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Hizentra, 200 mg/ml Lösung zur subkutanen Injektion Hizentra, 200 mg/ml Lösung zur subkutanen Injektion in Fertigspritzen
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Hizentra, 200 mg/ml Lösung zur subkutanen Injektion Hizentra, 200 mg/ml Lösung zur subkutanen Injektion in Fertigspritzen
GEBRAUCHSINFORMATION UND FACHINFORMATION 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG. Wirkstoff: Hepatitis B Immunglobulin vom Menschen
 GEBRAUCHSINFORMATION UND FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Injektionslösung zur intramuskulären Anwendung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Wirkstoff: Hepatitis B Immunglobulin
GEBRAUCHSINFORMATION UND FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Injektionslösung zur intramuskulären Anwendung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Wirkstoff: Hepatitis B Immunglobulin
GEBRAUCHSINFORMATION. HUMAN ALBUMIN 200 g/l IMMUNO, Infusionslösung. Infusionslösung. Wirkstoff: Albuminlösung vom Menschen
 GEBRAUCHSINFORMATION HUMAN ALBUMIN 200 g/l IMMUNO, Infusionslösung Infusionslösung Wirkstoff: Albuminlösung vom Menschen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
GEBRAUCHSINFORMATION HUMAN ALBUMIN 200 g/l IMMUNO, Infusionslösung Infusionslösung Wirkstoff: Albuminlösung vom Menschen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Ergebnisse aus einer multizentrischen Beobachtungsstudie mit Privigen. DÖSGHO 2017, Stuttgart
 Wirksamkeit verschiedener Immunglobulin- Dosierungen in der Prävention von schweren und schwerwiegenden Infektionen bei Patienten mit sekundären Immundefekten Ergebnisse aus einer multizentrischen Beobachtungsstudie
Wirksamkeit verschiedener Immunglobulin- Dosierungen in der Prävention von schweren und schwerwiegenden Infektionen bei Patienten mit sekundären Immundefekten Ergebnisse aus einer multizentrischen Beobachtungsstudie
Gamunex 10 % Infusionslösung
 1. BEZEICHNUNG DES ARZNEIMITTELS 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Wirkstoff: Normales Immunglobulin vom Menschen (IVIg) Ein ml enthält: normales Immunglobulin vom Menschen... 100 mg (IgG-Reingehalt
1. BEZEICHNUNG DES ARZNEIMITTELS 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Wirkstoff: Normales Immunglobulin vom Menschen (IVIg) Ein ml enthält: normales Immunglobulin vom Menschen... 100 mg (IgG-Reingehalt
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG. Eine Fertigspritze mit 0,4 ml enthält Hepatitis-B-Immunglobulin vom Menschen 200 I.E..
 1. BEZEICHNUNG DES ARZNEIMITTELS Fovepta 200 I.E. Injektionslösung in einer Fertigspritze 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Eine Fertigspritze mit 0,4 ml enthält Hepatitis-B-Immunglobulin
1. BEZEICHNUNG DES ARZNEIMITTELS Fovepta 200 I.E. Injektionslösung in einer Fertigspritze 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Eine Fertigspritze mit 0,4 ml enthält Hepatitis-B-Immunglobulin
Td-IMMUN, Injektionssuspension, Einzeldosis-Fertigspritze. Diphtherie- und Tetanus-Impfstoff (adsorbiert, mit reduziertem Antigenhalt)
 Zusammenfassung der Merkmale des Arzneimittels 1 Bezeichnung des Arzneimittels Td-IMMUN, Injektionssuspension, Einzeldosis-Fertigspritze. Diphtherie- und Tetanus-Impfstoff (adsorbiert, mit reduziertem
Zusammenfassung der Merkmale des Arzneimittels 1 Bezeichnung des Arzneimittels Td-IMMUN, Injektionssuspension, Einzeldosis-Fertigspritze. Diphtherie- und Tetanus-Impfstoff (adsorbiert, mit reduziertem
Anhang III. Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen
 Anhang III Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen Anmerkung: Diese Änderungen der entsprechenden Abschnitte der Zusammenfassung
Anhang III Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen Anmerkung: Diese Änderungen der entsprechenden Abschnitte der Zusammenfassung
FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels)
 FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels) Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die
FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels) Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige
PACKUNGSBEILAGE Carprogesic 50mg/ml Injektionslösung für Hunde und Katzen
 B. PACKUNGSBEILAGE PACKUNGSBEILAGE Carprogesic 50mg/ml Injektionslösung für Hunde und Katzen 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE
B. PACKUNGSBEILAGE PACKUNGSBEILAGE Carprogesic 50mg/ml Injektionslösung für Hunde und Katzen 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE
My power of resistance A decision for a lifetime.
 Humanes Normales Immunglobulin (IVIg), 10 %ige Lösung My power of resistance A decision for a lifetime. Power of resistance Kiovig ist eine besondere Kombination aus schneller, hochwirksamer Behandlung
Humanes Normales Immunglobulin (IVIg), 10 %ige Lösung My power of resistance A decision for a lifetime. Power of resistance Kiovig ist eine besondere Kombination aus schneller, hochwirksamer Behandlung
1. Was ist Cluvot und wofür wird es angewendet?
 Gebrauchsinformation: Information für Anwender Cluvot 250 IE Pulver und Lösungsmittel zur Herstellung einer Injektions-/Infusionslösung Konzentrat von Gerinnungsfaktor XIII aus Humanplasma Dieses Arzneimittel
Gebrauchsinformation: Information für Anwender Cluvot 250 IE Pulver und Lösungsmittel zur Herstellung einer Injektions-/Infusionslösung Konzentrat von Gerinnungsfaktor XIII aus Humanplasma Dieses Arzneimittel
lymphatischer Leukämie, bei denen prophylaktisch verabreichte Antibiotika nicht angeschlagen
 KIOVIG 100 mg/ml-infusionslösung 2. Qualitative und quantitative Zusammensetzung Normales Immunglobulin vom Menschen (IVIg). Ein ml enthält: Normales Immunglobulin vom Menschen 100 mg (Reinheitsgrad von
KIOVIG 100 mg/ml-infusionslösung 2. Qualitative und quantitative Zusammensetzung Normales Immunglobulin vom Menschen (IVIg). Ein ml enthält: Normales Immunglobulin vom Menschen 100 mg (Reinheitsgrad von
Fachinformation Beriglobin P
 Fachinformation Beriglobin P (Zusammenfassung der Merkmale des Arzneimittels) 1. BEZEICHNUNG DES ARZNEIMITTELS Beriglobin P * Fertigspritze Injektionslösung zur subkutanen oder intramuskulären Anwendung
Fachinformation Beriglobin P (Zusammenfassung der Merkmale des Arzneimittels) 1. BEZEICHNUNG DES ARZNEIMITTELS Beriglobin P * Fertigspritze Injektionslösung zur subkutanen oder intramuskulären Anwendung
Gebrauchsinformation: Information für Anwender. Paracetamol Mylan 500 mg Tabletten Paracetamol
 Gebrauchsinformation: Information für Anwender Paracetamol Mylan 500 mg Tabletten Paracetamol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Anwender Paracetamol Mylan 500 mg Tabletten Paracetamol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Fachinformation. Gammagard S/D. Guillain-Barré-Syndrom Kawasaki Syndrom. 4.2 Dosierung, Art und Dauer der Anwendung
 1. BEZEICHNUNG DES ARZNEIMITTELS 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin G vom Menschen (IgG) liegt als Pulver und Lösungsmittel zur Infusion vor, und enthält in der Durchstechflasche
1. BEZEICHNUNG DES ARZNEIMITTELS 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin G vom Menschen (IgG) liegt als Pulver und Lösungsmittel zur Infusion vor, und enthält in der Durchstechflasche
Arzneimittel aus Blut
 Arzneimittel aus Blut WS 06/07 Referenten: Ines Minderhoud Karima Nait Belaid Johan van Oppen Timo Osiewacz Julia Paweltschik Michael Plöger Übersicht Blutspende Arten Vollblutspende, Plasmaspende, Thrombozytenspende,
Arzneimittel aus Blut WS 06/07 Referenten: Ines Minderhoud Karima Nait Belaid Johan van Oppen Timo Osiewacz Julia Paweltschik Michael Plöger Übersicht Blutspende Arten Vollblutspende, Plasmaspende, Thrombozytenspende,
Von Hüsteln, Schnupfen und ELVIS hereditäre Immundefekte im Erwachsenenalter
 Von Hüsteln, Schnupfen und ELVIS hereditäre Immundefekte im Erwachsenenalter PD Dr. Matthias Wahle Abteilung Rheumatologie, Medizinische Klinik II Klinikum der JW Goethe-Universität Frankfurt Frau Doktor/
Von Hüsteln, Schnupfen und ELVIS hereditäre Immundefekte im Erwachsenenalter PD Dr. Matthias Wahle Abteilung Rheumatologie, Medizinische Klinik II Klinikum der JW Goethe-Universität Frankfurt Frau Doktor/
Decitabin Beschluss vom: 2. Mai 2013 gültig bis: unbefristet In Kraft getreten am: 2. Mai 2013 BAnz AT B6
 Beschluss vom: 2. Mai 2013 gültig bis: unbefristet In Kraft getreten am: 2. Mai 2013 BAnz AT 29.05.2013 B6 Zugelassenes Anwendungsgebiet Dacogen ist indiziert zur Behandlung erwachsener Patienten ab einem
Beschluss vom: 2. Mai 2013 gültig bis: unbefristet In Kraft getreten am: 2. Mai 2013 BAnz AT 29.05.2013 B6 Zugelassenes Anwendungsgebiet Dacogen ist indiziert zur Behandlung erwachsener Patienten ab einem
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
 1. BEZEICHNUNG DES ARZNEIMITTELS Biseko 50 g/l Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1000 ml Infusionslösung enthalten 50 g Plasmaproteine vom Menschen, davon Albumin ca. 31 g
1. BEZEICHNUNG DES ARZNEIMITTELS Biseko 50 g/l Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1000 ml Infusionslösung enthalten 50 g Plasmaproteine vom Menschen, davon Albumin ca. 31 g
Remedium Febrogrippale comp EKF Homöopathisches Arzneimittel
 Gebrauchsinformation: Information für den Anwender Remedium Febrogrippale comp EKF Homöopathisches Arzneimittel Darreichungsform: Wirkstoffe: Mischung zum Einnehmen Cinchona pubescens, Echinacea, Eupatorium
Gebrauchsinformation: Information für den Anwender Remedium Febrogrippale comp EKF Homöopathisches Arzneimittel Darreichungsform: Wirkstoffe: Mischung zum Einnehmen Cinchona pubescens, Echinacea, Eupatorium
