Facharbeit. Schuljahr 2003/2004
|
|
|
- Swen Schulze
- vor 7 Jahren
- Abrufe
Transkript
1 Berufsbildende Schulen 1 Goslar - Am Stadtgarten Fachgymnasium Wirtschaft Facharbeit im Fach Chemie Schuljahr 2003/2004 Thema : Bestimmung des Vitamin C-Gehaltes einer Brausetablette durch eine maßanalytische Untersuchung Verfasser/-in : Niklas Rappmann Fachlehrer : Herr Pfüller
2 Gliederung 1. Einleitung 2 2. Maßanalytische Untersuchung Versuchaufbau einer maßanalytischen Untersuchung Zu beachtende Faktoren bei der Durchführung Ablauf einer maßanalytischen Untersuchung Spezielle Maßanalyse von Ascorbinsäure 5 3. Vitamin C 6 4. Praktische Durchführungen einer maßanalytischen Untersuchung Säure-Base Titration von Natronlauge gegen Salzsäure Säure-Base Titration von Natronlauge gegen Ascorbinsäure Säure-Base Titration von Natronlauge gegen Vitamin C-Brausetablette aufgelöst in Wasser Analyse des Ergebnisses von Fazit 12
3 1. Einleitung In dieser Facharbeit werde ich mich mit der Bestimmung des Vitamin C- Gehaltes einer Brausetablette mit Hilfe der maßanalytischen Untersuchung auseinandersetzten. Dazu werde ich Versuche selbst durchführen. Hierzu werden Herr Pfüller und ich uns einen Nachmittag treffen, um im Schullabor maßanalytische Untersuchungen (Titration) durchzuführen. Anschließend werde ich das Ergebnis mit Hilfe chemischer Formeln errechnen. 2. Maßanalytische Untersuchung Die ersten Grundlagen einer maßanalytischen Untersuchung (Titration) werden Antoine Laurent Lavoisier ( ) zugesprochen. Justus Freiherr von Liebig verfeinerte die Maßanalyse. Louis Joseph Gay-Lussac untermauerte die Maßanalyse wissenschaftlich. Wie schon Justus Freiherr von Liebig verfeinerte Karl Friedrich Mohr die Maßanalyse weiter. Er entwickelte die Normallösung und die Büretten. Carl Remigius Fresenius führte dann die kompletten Analysegänge ein. Maßanalytische Untersuchungen dienen der quantitativen Bestimmung der Menge einer Substanz in einer Lösung. Das bedeutet, dass man einen bekannten Stoff in einer bekannten Lösung hat und wissen möchte, wie viel von diesem Stoff in der Lösung enthalten ist. Die Lösung mit unbekannter Konzentration nennt man Maßlösung, die Lösung mit bekannter Konzentration nennt man Probelösung. Die Probelösung wird der Maßlösung zugefügt, bis diese PH-neutral ist. Diesen Punkt nennt man Äquivalenzpunkt. (Siehe Grafik grün markierte Fläche) Mit Hilfe der festgestellten Menge an verbrauchter Probelösung kann man
4 die Konzentration der Maßlösung nach folgender Formel errechnen: abgeleitet von Man setzt die bekannten Zahlen ein und hat dann die Konzentration der Maßlösung in Mol errechnet. Um das Ergebnis in Gramm zu bekommen rechnet man einfach mit dieser Formel: Man stellt diese Formel nach m um hat so die Konzentration in Gramm. Es muss darauf geachtet werden, das mit der gleichen Maßeinheit titriert und gerechnet wird. 2.1 Versuchaufbau einer maßanalytischen Untersuchung Um eine maßanalytische Untersuchung durchzuführen, benötigt man einen Titrierkolben oder ein Becherglas, in dem sich die zu bestimmende Maßlösung befindet. Über die Öffnung des Titrierkolbens wird eine Bürette so an einem Ständer befestigt, dass aus ihr die Probelösung in die Maßlösung tröpfeln kann. Um die verbrauchte Menge an
5 Probelösung bestimmen zu können, muss sich an der Bürette eine Maßskala befinden. Um eine optimale Verteilung der Probelösung zu gewährleisten, benötigt man etwas, um die Maßlösung umzurühren. Dies kann mit einem Magnetrührgerät oder mit einem Glasstab geschehen. Ist beides nicht vorhanden, schwengt man das Gefäß einfach. Das Magnetrührgerät wird so platziert, dass das Becherglas mittig auf ihm steht, damit der Magnet im Becherglas korrekt angebracht werden kann. Zur weiteren Vorbereitung des Versuchs gibt man die Probelösung in die Bürette und die Maßlösung in den Titrierkolben. Um den Äquivalenzpunkt durch Farbumschlag sichtbar zu machen, fügt man der Maßlösung einen flüssigen Indikator zu. Durch den Indikator erkennt man ob sich der Äquivalenzpunkt nähert. Bei jedem Tropfen Probelösung, den man in die Maßlösung hinzugibt verfärbt sich der Indikator. Je länger es dauert bis sich die Verfärbung aufgelöst hat desto näher befindet man sich am Äquivalenzpunkt. 2.2 Zu beachtende Faktoren bei der Durchführung Die Geräte müssen gründlich gesäubert und frei von anderen chemischen Stoffen sein, da das Ergebnis sonst verfälscht sein kann. Um Ungenauigkeiten oder Fehler auszuschließen, muss der Versuch mehrmals durchgeführt werden. Es muss also eine ausreichende Menge beider Lösungen vorhanden sein. Der Ablauf des Titrierens darf nicht zu schnell gehen, da man den genauen Äquivalenzpunkt verpassen könnte und die Berechnungen falsch werden. Beim ersten Versuchsablauf wird der Äquivalenzpunkt ungefähr bestimmt. Beim zweiten Versuchsablauf soll der Äquivalenzpunkt genauer bestimmt werden. Dazu wird kurz vor dem wahrscheinlichen Äquivalenzpunkt die Menge der zugeführten Probelösung reduziert.
6 2.3 Ablauf einer maßanalytischen Untersuchung Hat man die Geräte so aufgestellt wie bei Punkt 2.1 beschrieben, kann man mit dem Titrieren beginnen. Man gibt die Lösung mit bekannter Konzentration (Probelösung) in die Bürette, in das Becherglas bzw. den Titrierkolben gibt man die Lösung mit unbekannter Konzentration (Maßlösung). Außerdem gibt man den Flüssigindikator hinzu. Nun öffnet man das Ventil der Bürette und lässt die Lösung langsam in das Becherglas bzw. den Titrierkolben laufen. Der Indikator färbt sich um. Jetzt wird das Ventil geschlossen und die verbrauchte Menge an Probelösung abgelesen. 2.4 Spezielle Maßanalyse von Ascorbinsäure Zunächst muss man die Geräte so aufbauen wie in Punkt 2.1 beschrieben. Nun muss man die Ascorbinsäure in Wasser auflösen. Da Ascorbinsäure die Molare Masse von 176,1 g/mol hat, löst man 17,61g in 1000 ml Wasser auf, um eine 0,1 Molare Lösung zu bekommen. Als Probelösung wird Natronlauge genommen. Falls nur eine 1 Molare Natronlauge zur Verfügung steht, muss 10 ml von ihr in 100ml Wasser gegeben werden, um eine 0,1 Molare Lösung zu erhalten. Die Natronlauge wird in die Bürette gefüllt. Nun nimmt man 10 ml der Maßlösung und gibt sie in einen Titrierkolben. Zu der Maßlösung gibt man außerdem noch einen flüssigen Indikator. Um den Äquivalenzpunkt besser zu erkennen kann man destilliertes Wasser hinzugeben. Normales Leitungswasser ist hierfür nicht zu verwenden, da dieses im chemischen Sinne nicht rein ist und das Ergebnis verfälschen würde. Nun öffnet man das Ventil der Bürette und lässt die Probelösung langsam in die Maßlösung tropfen. Ist der Äquivalenzpunkt erreicht, schließt man das Ventil sofort. Nun muss man die Menge der verbrauchten Probelösung an der Bürette ablesen. Die nun bekannten Zahlen setzt man
7 in die in Punkt 2 beschriebene Formel ein: Maßlösung (c) = 10ml Probelösung x 0,1g/mol Probelösung / 10ml Maßlösung Das Ergebnis ist 0,1 g/mol. 3. Vitamin C Vitamin C (auch Ascorbinsäure genannt) ist ein Glucosederviat, welches nur über den Glucosestoffwechsel in den menschlichen Körper gelangen kann. Da der Mensch, so wie das Meerschweinchen oder Primaten, das Vitamin nicht selbst im Körper herstellen und nicht lange Speichern kann, muss es täglich eingenommen werden. Vitamin C befindet sich hauptsächlich in Obst und Gemüse und hat mehrere Aufgaben im Körper. Es beteiligt sich an: der Wundheilung, der Bildung der (Stress-) Hormone der Nebenniere Adrenalin und Noradrenalin, der Bildung des Botenstoffs Serotonin, der für Empfindungen wie Müdigkeit und Sättigung verantwortlich ist, antioxidativen Vorgängen im Körper. Es "fängt" freie Radikale ein, und beugt somit bei bestimmten Krebskrankheiten (Mund-, Kehlkopf- und Speiseröhrenkrebs) vor, einer verbesserten Eisenresorption (-aufnahme) im Dünndarm, Abtransport giftiger Schwermetalle wie Blei, Nickel und Cadmium. Es bindet sie an sich und schwemmt sie aus unserem Körper, Bildung von Carnitin zusammen mit den Enzymen Lysin und Methionin, der enzymatischen Umwandlung von Cholesterin in Gallensäure
8 oder Vitamin D, Verbesserung des Immunsystems, indem es vermehrt Abwehrzellen mit erhöhter Aktivität bildet. Die Deutsche Gesellschaft für Ernährung (DGE) empfiehlt eine Tagesration von 75mg Vitamin C. Bei Rauchern, Alkoholikern, Frauen, die die Pille nehmen, und bei Leuten, die Schmerzmittel mit dem Inhaltsstoff Acetyl nehmen, wird eine höhere Dosierung empfohlen. Mehr als mg pro Tag kann der Körper nicht aufnehmen, es tritt bei dieser Konzentration eine Sättigung des Gewebes ein. Dieses ist allerdings nicht schädlich, im Gegenteil, in letzter Zeit sind immer mehr Wissenschaftler der Meinung, dass sich die Mehreinnahme von Vitamin C positiv auf den Körper auswirkt. Man sagt, dass sich bei den Menschen, die täglich mehr Vitamin C als nötig einnehmen, das Krebsrisiko und die Anfälligkeit für andere Krankheiten wie zum Beispiel reduziert. Skorbut war bis ins 19. Jahrhundert eine Seefahrerkrankheit. Sie machte sich durch Zahn-, und Nägelausfall bemerkbar. Der Grund hierfür war der Mangel an Vitamin C. Die Seefahrer wussten damals nicht, dass diese Krankheit durch diesen Mangel auftritt. Später wurden Sauerkraut und Zitrusfrüchte als hohe Vitamin C Lieferanten entdeckt. Durch ungünstige Lagerung, dass heißt wenn man sie Sonnenstrahlung aussetzt oder nicht Trocken lagert, verringert sich der Vitamin C-Gehalt. Eine leichte Verfärbung beeinträchtigt die Wirkung nicht. Nun zu den chemischen Aspekten von Vitamin C. In der Chemie wird Vitamin C auch Ascorbinsäure (griech. Skorbut) genannt. Sie schmilzt bei einer Temperatur von C. In gelöster Form hält sich Ascorbinsäure nur wenn es nicht in Berührung mit Sauerstoff steht, da es ein starkes Reduktionsmittel ist. Sie reduziert ammoniakalische Lösungen, Jod und andere Oxidationsmittel bereits bei Raumtemperatur.
9 Bei der Oxidation entsteh bei der Zugabe von 2 H + und e - die antiskorbutische Dehydor-L-Ascorbinsäure. Die Strukturformel ähnelt Strukturformel eines Kohlehydrates, da es von ihm abstammt. Grund für den festen Aggregatzustand sind vielen OH-Gruppen und Ringstruktur. Diese Konstellation ermöglicht die Bildung mehrerer Wasserstoffbrücken. Zwischen Wasserstoffbrücken herrschen die stärksten Anziehungskräfte. Dadurch bildet sich auch die kristallisierte Form der Ascorbinsäure. der die die Wenn man Ascorbinsäure längere Zeit ungünstig lagert, dass heißt wenn man sie Sonnenstrahlung aussetzt oder nicht trocken lagert, dann verfärbt sie sich. Im früheren Stadium färbt sie sich gelblich. Nach längerer Zeit bräunlich. Eine leichte Verfärbung beeinträchtigt die Wirkung aber nicht. 4. Praktische Durchführungen einer maßanalytischen Untersuchung Am habe ich mich mit meinem Chemielehrer, Herrn Pfüller, in unserem Schullabor getroffen, um unterschiedliche Versuche zur der maßanalytischen Untersuchung durchzuführen. Herr Pfüller hatte alle Geräte und Lösungen vorbereitet. Zuerst habe ich Natronlauge gegen Salzsäure, danach gegen Ascorbinsäure und zum Schluss gegen eine in einem Liter aufgelöste Brausetablette titriert. In den folgenden Punkten werde ich die Versuche und ihre Ergebnisse näher erläutern. 4.1 Säure-Base Titration von Natronlauge gegen Salzsäure
10 Der erste Versuch war lediglich dafür bestimmt, Erfahrungen im Umgang mit den Geräten und dem Ablauf zu sammeln. Mir standen eine 1 Molare Natronlauge, sowie eine 1 Molare Salzsäure zur Verfügung. Ich habe diese Lösungen je zu einer 0,1 Molaren Lösung verdünnt. Die Natronlauge habe ich in die Bürette gefüllt. Die Salzsäure (10 ml) habe ich mit fünf Tropfen Flüssigindikator in einen Titrierkolben gegeben und mit destilliertem Wasser aufgefüllt. Dann habe ich die Probelösung in die Maßlösung tropfen lassen. Dabei habe ich den Titrierkolben mit meiner rechten Hand geschwenkt und die linke Hand immer am Ventil der Bürette gelassen, um den Äquivalenzpunkt nicht zu verpassen. Als dieser erreicht war, habe ich das Ventil geschlossen und die verbrauchte Menge an Probelösung abgelesen. Es waren 9,9 ml. Die bekannten Zahlen habe ich dann in die bekannte Formel eingesetzt. (siehe Punkt 2) Mit meinen Zahlen bekam ich eine Konzentration von 0,099 g/mol. Es ist eine leichte Abweichung von der korrekten Konzentration. Mögliche Gründe ergeben sich aus unter Punkt 2.2 genannten Faktoren. 4.2 Säure-Base Titration von Natronlauge gegen Ascorbinsäure Der zweite Versuch war dafür gedacht, dass ich mich schon einmal mit Ascorbinsäure im Versuch auseinandergesetzt habe. Hierzu standen mir eine 1 Molare Natronlauge zur Verfügung und Ascorbinsäure (Pulver). Ich habe 17,6 g der Ascorbinsäure in einem Liter Wasser aufgelöst, um eine 0,1 Molare Lösung zu bekommen. Die Natronlauge habe ich wieder wie im vorherigen Versuch zu einer 0,1 Molaren Lösung verdünnt. Ich gab die Natronlauge in die Bürette und 10 ml der Ascorbinsäure mit fünf Tropfen Flüssigindikator in einen Titrierkolben. Dann habe ich die Natronlauge in die Maßlösung tropfen lassen. Dabei habe ich den
11 Titrierkolben mit meiner rechten Hand geschwenkt und die linke Hand immer am Ventil der Bürette gelassen, um den Äquivalenzpunkt nicht zu verpassen. Als dieser erreicht war, habe ich das Ventil geschlossen und die verbrauchte Menge an Probelösung abgelesen. Es waren 9,8 ml. Die bekannten Zahlen habe ich dann in die bekannte Formel eingesetzt. (siehe Punkt 2) Mit meinen Zahlen habe ich eine Konzentration von 0,098 g/mol errechnet. Es gab eine leichte Abweichung von der korrekten Konzentration. Mögliche Gründe ergeben sich aus unter Punkt 2.2 genannten Faktoren. 4.3 Säure-Base Titration von Natronlauge gegen Vitamin C-Brausetablette aufgelöst in Wasser In dem dritten Versuch sollte ich dann den Vitamin C-Gehalt einer Brausetablette herausfinden. Hierzu habe ich eine Brausetablette (4,55 Gramm) in einem Liter Wasser gelöst. Als Probelösung nahm ich wie schon in den vorherigen Versuchen Natronlauge (1 Molar). Die Natronlauge habe ich zu einer 0,1 Molaren Lösung verdünnt und in die Bürette gegeben. Von dem Liter Vitamin C-Brause habe ich 10 ml genommen und als Maßlösung mit fünf Tropfen Indikator in einen Titrierkolben gegeben. Dann habe ich die Natronlauge in die Maßlösung tropfen lassen. Dabei habe ich den Titrierkolben mit meiner rechten Hand geschwenkt und die linke Hand immer am Ventil der Bürette gelassen, um den Äquivalenzpunkt nicht zu verpassen. Als dieser erreicht war, habe ich Versuch 1 Versuch 2 Mittelwert Volumen der Maßlösung in ml Konzentration der Probelösung 0,1 0,1 0,1 Volumen der verbrauchten Probelösung in ml 1,95 1,9 1,925 Konzentration in mol 0,0195 0,019 0,01925 in gramm 3, , ,35181 das Ventil geschlossen und die verbrauchte Menge an Probelösung abgelesen. Diesen Ablauf habe ich zweimal durchgeführt und die Ergebnisse in folgende Tabelle eingefügt:
12 4.4 Analyse des Ergebnisses von 4.3 In dem ersten Versuch habe ich eine Konzentration von 0,0195 g/mol errechnet. Das wären 3,395 Gramm. Bei dem zweiten Versuch habe ich eine Konzentration von 0,019 g/mol errechnet. Das wären 3,308 Gramm. Aufgrund dieser Angaben habe ich mich entschlossen, keinen dritten Versuch durchzuführen, da die Ergebnisse sehr nah beieinander liegen. Aus den Versuchen habe ich den Mittelwert gebildet und dieses als Ergebnis meiner Untersuchung festgelegt. Daraus folgt, dass sich laut meiner Untersuchung 3,352 Gramm Ascorbinsäure in der untersuchten Brausetablette befand. Dieses Ergebnis hat mich allerdings nicht überzeugt. Ich habe mir überlegt, dass 3,352 Gramm Ascorbinsäure in einer Brausetablette mit einem Gewicht von 4,55 Gramm sehr hoch sei. Ich denke, dass sich in der Brausetablette noch eine zweite Säure befindet. Da die untersuchte Tablette einen Zitronegeschmack hat, habe ich auf die Verpackung geschaut und mir die Zusammensetzung der Brausetablette durchgelesen. Aufgrund der Angaben auf der Verpackung haben sich meine Vermutungen bestätigt. Neben der Ascorbinsäure befindet sich auch noch Zitronensäure in der untersuchten Tablette. Dies ist dann auch die Erklärung, dass ich so eine hohe Konzentration an Säuregehalt heraus bekommen habe. 5. Fazit Ich habe mit der Untersuchung einer Brausetablette auf ihren Vitamin C- Gehalt nur den Gehalt an Säure ermitteln können. Dies liegt daran, dass die Säure-Base Titration nur den Gehalt an Säure in einer Lösung bestimmen kann. Sie kann nicht bestimmen, wie viel von verschiedenen Säuren in einer Lösung vorhanden ist. Ich denke, dass ich trotz ungenauem Ergebnis viel über die Maßanalytik gelernt habe. Aufgrund der praktischen Durchführungen im Schullabor habe ich erfahren, dass die Chemie sehr vielfältig ist und immer genaue Angaben benötigt. Die Maßanalytik ist eine sehr interessante Wissenschaft, die, denke ich, eine große Zukunft hat. Denn je weiter die Menschen ins Weltall vordringen
13 werden, desto öfter werden sie auf Stoffe stoßen, die sie vielleicht noch gar nicht kennen. In Verbindung mit Biologie und Physik können sich immer neue Möglichkeiten an Wissenschaft und Forschung ergeben.
Protokoll Tag 4, Teil 1
 Protokoll Tag 4, Teil 1 D. Titrationsverfahren D.1. Einführung in die quantitative Analyse; D.2. Acidimetrie (Bestimmung der Konzentration einer Säure) Am heutigen letzten Tag des Praktikums geht es um
Protokoll Tag 4, Teil 1 D. Titrationsverfahren D.1. Einführung in die quantitative Analyse; D.2. Acidimetrie (Bestimmung der Konzentration einer Säure) Am heutigen letzten Tag des Praktikums geht es um
PARACETAMOL ein Medikamentenwirkstoff
 Julia Seidel, 8B PARACETAMOL ein Medikamentenwirkstoff EINLEITUNG Ich hatte mich für das Arbeiten mit Arzneimitteln entschieden und durchsuchte darum den familiären Medikamentenschrank. Dabei kamen mir
Julia Seidel, 8B PARACETAMOL ein Medikamentenwirkstoff EINLEITUNG Ich hatte mich für das Arbeiten mit Arzneimitteln entschieden und durchsuchte darum den familiären Medikamentenschrank. Dabei kamen mir
WEGE ZUR BESTIMMUNG EINER SÄURE:
 WEGE ZUR BESTIMMUNG EINER SÄURE: "BESTIMMUNG DES SÄUREGEHALTS IN EINEM HAUSHALTSESSIG" Bestimmung des Säuregehalts in Haushaltsessig In den letzten Chemiestunden versuchten wir, anhand von mehreren Möglichkeiten
WEGE ZUR BESTIMMUNG EINER SÄURE: "BESTIMMUNG DES SÄUREGEHALTS IN EINEM HAUSHALTSESSIG" Bestimmung des Säuregehalts in Haushaltsessig In den letzten Chemiestunden versuchten wir, anhand von mehreren Möglichkeiten
Handbuch zum Chemischen Praktikum für Studierende der Human- und Zahnmedizin. Steffen Blaurock Thomas Zimmermann
 Handbuch zum Chemischen Praktikum für Studierende der Human- und Zahnmedizin Steffen Blaurock Thomas Zimmermann 1.1 Einleitung Titrationen werden in der chemischen Analytik durchgeführt, um die Stoffmenge
Handbuch zum Chemischen Praktikum für Studierende der Human- und Zahnmedizin Steffen Blaurock Thomas Zimmermann 1.1 Einleitung Titrationen werden in der chemischen Analytik durchgeführt, um die Stoffmenge
Protokoll 2. Labor für Physikalische Chemie. Modul IV. Versuch 6
 Protokoll 2 Labor für Physikalische Chemie Modul IV Versuch 6 Herstellung einer Titerbestimmung von 500mL einer Salzsäure Maßlösung mit der Äquivalentkonzentration c(hcl) = 0,1 mol/l Fachbereich MT 1 Wintersemester
Protokoll 2 Labor für Physikalische Chemie Modul IV Versuch 6 Herstellung einer Titerbestimmung von 500mL einer Salzsäure Maßlösung mit der Äquivalentkonzentration c(hcl) = 0,1 mol/l Fachbereich MT 1 Wintersemester
AnC I Protokoll: 5.5 Simultanbestimmung von Bi/Pb! SS Analytische Chemie I. Versuchsprotokoll. 5.5 Simultanbestimmung von Bi/Pb
 Analytische Chemie I Versuchsprotokoll 5.5 Simultanbestimmung von Bi/Pb.! Theoretischer Hintergrund Bi 3+ und Pb 2+ werden nebeneinander bestimmt. Bismut(III) bildet bereits im Sauren einen EDTA-Komplex,
Analytische Chemie I Versuchsprotokoll 5.5 Simultanbestimmung von Bi/Pb.! Theoretischer Hintergrund Bi 3+ und Pb 2+ werden nebeneinander bestimmt. Bismut(III) bildet bereits im Sauren einen EDTA-Komplex,
Analytische Chemie. B. Sc. Chemieingenieurwesen. 10. Juli Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 10. Juli 2009 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 10. Juli 2009 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Anorganische Chemie. Versuch 16 Titration einer schwachen Säure gegen eine starke Base. Versuchsteil 16.1 Potentiometrische Titration
 Georg-August-Universität Göttingen Fakultät für Biologie und Psychologie Anorganische Chemie Versuch 16 Titration einer schwachen Säure gegen eine starke Base Versuchsteil 16.1 Potentiometrische Titration
Georg-August-Universität Göttingen Fakultät für Biologie und Psychologie Anorganische Chemie Versuch 16 Titration einer schwachen Säure gegen eine starke Base Versuchsteil 16.1 Potentiometrische Titration
Es soll eine schriftliche Ausarbeitung abgegeben werden (1 Exemplar pro Gruppe).
 Gruppe 1 Thema: Wissenswertes über Essig 1. Bestimme den ph-wert von Haushaltsessig. 2. Wie viel Essigsäure (in mol/l und in g/l) ist in Haushaltsessig enthalten? 3. Wie wird Essigsäure hergestellt (Ausgangsstoffe,
Gruppe 1 Thema: Wissenswertes über Essig 1. Bestimme den ph-wert von Haushaltsessig. 2. Wie viel Essigsäure (in mol/l und in g/l) ist in Haushaltsessig enthalten? 3. Wie wird Essigsäure hergestellt (Ausgangsstoffe,
Chemisches Grundpraktikum für Ingenieure. 2. Praktikumstag. Andreas Rammo
 Chemisches Grundpraktikum für Ingenieure. Praktikumstag Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de Das chemische Gleichgewicht Säure-Base-Reaktionen
Chemisches Grundpraktikum für Ingenieure. Praktikumstag Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de Das chemische Gleichgewicht Säure-Base-Reaktionen
Konzentrationsbestimmung mit Lösungen
 Kapitel 5 Konzentrationsbestimmung mit Lösungen Abb. 5.1: Die Farben von Universalindikatoren sind nützlich für Konzentrationsbestimmungen. Sie lernen auf den folgenden Seiten eine sehr nützliche Methode
Kapitel 5 Konzentrationsbestimmung mit Lösungen Abb. 5.1: Die Farben von Universalindikatoren sind nützlich für Konzentrationsbestimmungen. Sie lernen auf den folgenden Seiten eine sehr nützliche Methode
Säure-Base Titrationen
 Chemie Praktikum Säure-Base Titrationen WS 2006/2007 Verfasser: Lorenz Germann, Lukas Bischoff Versuchsteilnehmer: Lorenz Germann, Lukas Bischoff Datum: 29.11.2006 Assistent: Lera Tomasic E-mail: lukas-bischoff@student.ethz.ch
Chemie Praktikum Säure-Base Titrationen WS 2006/2007 Verfasser: Lorenz Germann, Lukas Bischoff Versuchsteilnehmer: Lorenz Germann, Lukas Bischoff Datum: 29.11.2006 Assistent: Lera Tomasic E-mail: lukas-bischoff@student.ethz.ch
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 2,
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr., 6.04.11 1. Sie legen 100 ml einer 0, mol/l Natronlauge vor. Als Titrant verwenden Sie eine 0,8 mol/l Salzsäure. Berechnen
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr., 6.04.11 1. Sie legen 100 ml einer 0, mol/l Natronlauge vor. Als Titrant verwenden Sie eine 0,8 mol/l Salzsäure. Berechnen
Analytische Chemie. B. Sc. Chemieingenieurwesen. 11. September Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 11. September 2013 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 11. September 2013 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
SÄUR E. BASE oder LAU GE SAUE R BASI SCH
 SÄUR E BASE oder LAU GE SAUE R BASI SCH INDIKATOR (Ital. indicare, heißt zeigen oder anzeigen) Das Forscherlabor Wir treiben es bunt im Forscherlabor Rechtenthal in Tramin! Datum: Name:. Klasse: Lehrpersonen:
SÄUR E BASE oder LAU GE SAUE R BASI SCH INDIKATOR (Ital. indicare, heißt zeigen oder anzeigen) Das Forscherlabor Wir treiben es bunt im Forscherlabor Rechtenthal in Tramin! Datum: Name:. Klasse: Lehrpersonen:
Maßanalytische Bestimmung von Formaldehyd und Acetaldehyd
 Illumina-Chemie.de - Artikel Analytik Maßanalytische Bestimmung von Formaldehyd und Acetaldehyd Im Folgenden beschreibe ich eine Methode, den Gehalt einer Formaldehyd- oder Acetaldehyd-Lösung durch Titration
Illumina-Chemie.de - Artikel Analytik Maßanalytische Bestimmung von Formaldehyd und Acetaldehyd Im Folgenden beschreibe ich eine Methode, den Gehalt einer Formaldehyd- oder Acetaldehyd-Lösung durch Titration
Vitamin C: Das Power-Vitamin
 Vitamin C: Das Power-Vitamin Vitamin des Lebens Vitamin C ist an vielen Vorgängen im menschlichen Körper beteiligt und erfüllt wichtige Aufgaben, z. B. in folgenden Organen: Gehirn Augenlinse Herz Nieren
Vitamin C: Das Power-Vitamin Vitamin des Lebens Vitamin C ist an vielen Vorgängen im menschlichen Körper beteiligt und erfüllt wichtige Aufgaben, z. B. in folgenden Organen: Gehirn Augenlinse Herz Nieren
V 2 Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration und der Temperatur bei der Reaktion von Kaliumpermanganat mit Oxalsäure in Lösung
 V 2 Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration und der Temperatur bei der Reaktion von Kaliumpermanganat mit Oxalsäure in Lösung Bei diesem Versuch geht es darum, die Geschwindigkeit
V 2 Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration und der Temperatur bei der Reaktion von Kaliumpermanganat mit Oxalsäure in Lösung Bei diesem Versuch geht es darum, die Geschwindigkeit
Anorganisch-chemisches Praktikum für Human- und Molekularbiologen
 Anorganisch-chemisches Praktikum für uman- und Molekularbiologen. Praktikumstag Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de Säure-Base-Definition
Anorganisch-chemisches Praktikum für uman- und Molekularbiologen. Praktikumstag Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de Säure-Base-Definition
H1 Bestimmung des Löslichkeitsprodukts von Magnesiumhydroxid
 H Löslichkeitsprodukt und Komplexgleichgewichte Auch bei den Komplex-Reaktionen beschäftigen wir uns im Wesentlichen mit Gleichgewichtsreaktionen, in denen Liganden ausgetauscht werden. Dabei sollen Kriterien
H Löslichkeitsprodukt und Komplexgleichgewichte Auch bei den Komplex-Reaktionen beschäftigen wir uns im Wesentlichen mit Gleichgewichtsreaktionen, in denen Liganden ausgetauscht werden. Dabei sollen Kriterien
Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10. V1/3: Iodometrie Iodometrische Bestimmung von Iodat und Kupfer
 Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10 V1/: Iodometrie Iodometrische Bestimmung von Iodat und Kupfer Versuchsdurchführung: 26.02.2010 Protokollabgabe: 01.0.2010 durchgeführt von:
Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10 V1/: Iodometrie Iodometrische Bestimmung von Iodat und Kupfer Versuchsdurchführung: 26.02.2010 Protokollabgabe: 01.0.2010 durchgeführt von:
G1 pk S -Wert Bestimmung der Essigsäure
 G1 pk S -Wert Bestimmung der Essigsäure Bürette Rührer, Rührfisch ph-meter mit Einstabmesskette Stativ Becherglas Essigsäure H: 226, 314 P: 210, 260, 280.1+3, 303+361+353, 304+340, 305+351+338, 310 Phenolphthalein
G1 pk S -Wert Bestimmung der Essigsäure Bürette Rührer, Rührfisch ph-meter mit Einstabmesskette Stativ Becherglas Essigsäure H: 226, 314 P: 210, 260, 280.1+3, 303+361+353, 304+340, 305+351+338, 310 Phenolphthalein
Titration einer starken Säure mit einer starken Base unter Verwendung verschiedener Indikatoren
 Lehrer-/Dozentenblatt Titration einer starken Säure mit einer starken Base unter Verwendung verschiedener Indikatoren (Artikelnr.: P7510600) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe:
Lehrer-/Dozentenblatt Titration einer starken Säure mit einer starken Base unter Verwendung verschiedener Indikatoren (Artikelnr.: P7510600) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe:
Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10. V1/4: Komplexometrische Bestimmung von Cobalt durch Rücktitration
 Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10 V1/4: Komplexometrische Bestimmung von Cobalt durch Rücktitration Versuchsdurchführung: 18.01.2010 Protokollabgabe: 22.02.2010 durchgeführt
Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10 V1/4: Komplexometrische Bestimmung von Cobalt durch Rücktitration Versuchsdurchführung: 18.01.2010 Protokollabgabe: 22.02.2010 durchgeführt
Anorganisches Praktikum 1. Semester. FB Chemieingenieurwesen. Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften
 Anorganisches Praktikum 1. Semester FB Chemieingenieurwesen Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften 1 Gravimetrie Bestimmung von Nickel Sie erhalten eine Lösung, die 0.1-0.2g
Anorganisches Praktikum 1. Semester FB Chemieingenieurwesen Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften 1 Gravimetrie Bestimmung von Nickel Sie erhalten eine Lösung, die 0.1-0.2g
Bestimmung von Chlorid nach MOHR
 Illumina-Chemie.de - Artikel Analytik Bestimmung von Chlorid nach MOHR Die maßanalytische Bestimmung von Chlorid nach Friedrich Mohr (1806-1879) ist eines der ältesten titrimetrischen Verfahren. Es ist
Illumina-Chemie.de - Artikel Analytik Bestimmung von Chlorid nach MOHR Die maßanalytische Bestimmung von Chlorid nach Friedrich Mohr (1806-1879) ist eines der ältesten titrimetrischen Verfahren. Es ist
Gefahrenstoffe. 2 Bechergläser (230 ml), Bürette, Magnetrührer, Trichter, Rührschwein, Pipette, Stativ, Muffe, ph-meter
 1.1 V1 Titration von Cola In diesem Versuch wird die in Cola enthaltene Phosphorsäure mittels Säure-Base-Titration titriert und bestimmt. Ebenfalls wird mit den erhaltenen Werten gerechnet um das chemische
1.1 V1 Titration von Cola In diesem Versuch wird die in Cola enthaltene Phosphorsäure mittels Säure-Base-Titration titriert und bestimmt. Ebenfalls wird mit den erhaltenen Werten gerechnet um das chemische
Schulversuchspraktikum. Jans Manjali. Sommersemester Klassenstufen 9 & 10. Titration. Kurzprotokoll
 Schulversuchspraktikum Jans Manjali Sommersemester 2015 Klassenstufen 9 & 10 Titration Kurzprotokoll Auf einen Blick: Die hier vorgestellte Argentometrie ist eine Fällungstitration, bei der Silberionen
Schulversuchspraktikum Jans Manjali Sommersemester 2015 Klassenstufen 9 & 10 Titration Kurzprotokoll Auf einen Blick: Die hier vorgestellte Argentometrie ist eine Fällungstitration, bei der Silberionen
3. Mitarbeit (Praxis): 8a Namen:
 3. Mitarbeit (Praxis): 8a Namen: Bestimme die Milchsäurekonzentration in der vorliegenden Milch mit 0,1molarer Natronlauge. Verwende Phenolphthalein als Indikator zur Endpunktbestimmung; V S = 40mL Milch.
3. Mitarbeit (Praxis): 8a Namen: Bestimme die Milchsäurekonzentration in der vorliegenden Milch mit 0,1molarer Natronlauge. Verwende Phenolphthalein als Indikator zur Endpunktbestimmung; V S = 40mL Milch.
LF - Leitfähigkeit / Überführung
 Verfasser: Matthias Ernst, Tobias Schabel Gruppe: A 11 Betreuer: G. Heusel Datum: 18.11.2005 Aufgabenstellung LF - Leitfähigkeit / Überführung 1) Es sind die Leitfähigkeiten von zwei unbekanten Elektrolyten
Verfasser: Matthias Ernst, Tobias Schabel Gruppe: A 11 Betreuer: G. Heusel Datum: 18.11.2005 Aufgabenstellung LF - Leitfähigkeit / Überführung 1) Es sind die Leitfähigkeiten von zwei unbekanten Elektrolyten
Vorpraktikum Grundoperationen im chemischen Laboratorium
 Vorpraktikum Grundoperationen im chemischen Laboratorium Stand: 23. April 2019 Inhalt: Volumetrische Messgeräte Säure-Base-Titration Analysenwaagen Fest-Flüssig-Trennverfahren Wasserlöslichkeit Verdünnung
Vorpraktikum Grundoperationen im chemischen Laboratorium Stand: 23. April 2019 Inhalt: Volumetrische Messgeräte Säure-Base-Titration Analysenwaagen Fest-Flüssig-Trennverfahren Wasserlöslichkeit Verdünnung
AnC I Protokoll: 3.4 Iodometrische Bestimmung von Ascorbinsäure (Vitamin C)" SS Analytische Chemie I. Versuchsprotokoll
 Analytische Chemie I Versuchsprotokoll 3.4 Iodometrische Bestimmung von Ascorbinsäure (Vitamin C) 1.! Theoretischer Hintergrund Bei dieser Redoxtitration wird Ascorbinsäure mit Hilfe von Triiodid oxidiert.
Analytische Chemie I Versuchsprotokoll 3.4 Iodometrische Bestimmung von Ascorbinsäure (Vitamin C) 1.! Theoretischer Hintergrund Bei dieser Redoxtitration wird Ascorbinsäure mit Hilfe von Triiodid oxidiert.
Vitamine und Vitaminpräparate kooperatives Lernen über Internetforen VORANSICHT. Kooperativer Austausch über Vitaminpräparate in einem Forum!
 1 von 28 Vitamine und Vitaminpräparate kooperatives Lernen über Internetforen Johanna Dittmar, Lisa Krasowka, Ingo Eilks, Bremen Foto: Grigory Sind vitaminangereicherte Süßigkeiten, wie zum Beispiel Vitaminbonbons,
1 von 28 Vitamine und Vitaminpräparate kooperatives Lernen über Internetforen Johanna Dittmar, Lisa Krasowka, Ingo Eilks, Bremen Foto: Grigory Sind vitaminangereicherte Süßigkeiten, wie zum Beispiel Vitaminbonbons,
Quantitativer, selektiver, eindeutiger, stöchiometrisch einheitlicher und rascher Reaktionsverlauf.
 Grundlage der Maßanalyse Quantitativer, selektiver, eindeutiger, stöchiometrisch einheitlicher und rascher Reaktionsverlauf. Was ist eine Maßlösung? Eine Lösung mit genau bekannter Konzentration mithilfe
Grundlage der Maßanalyse Quantitativer, selektiver, eindeutiger, stöchiometrisch einheitlicher und rascher Reaktionsverlauf. Was ist eine Maßlösung? Eine Lösung mit genau bekannter Konzentration mithilfe
ESSENTIAL. mit Mangostan, Acai & Aloe Vera 900ml
 ESSENTIAL mit Mangostan, Acai & Aloe Vera 900ml 2/16 3/16 01 MANCHE MENSCHEN BLEIBEN GESÜNDER; LEBEN LÄNGER UND ALTERN LANGSAMER; DA SIE IN IHRER ERNÄHRUNG NÄHRSTOFFMÄNGEL VERMEIDEN: EQ Essential ist die
ESSENTIAL mit Mangostan, Acai & Aloe Vera 900ml 2/16 3/16 01 MANCHE MENSCHEN BLEIBEN GESÜNDER; LEBEN LÄNGER UND ALTERN LANGSAMER; DA SIE IN IHRER ERNÄHRUNG NÄHRSTOFFMÄNGEL VERMEIDEN: EQ Essential ist die
Volumetrische Bestimmungsverfahren
 9 Die Titrimetrie oder Maßanalyse wurde 1830 von J.L. GAY-LUSSAC in die analytische Chemie eingeführt. Hierunter versteht man ein Verfahren zur quantitativen Bestimmung eines gelösten Stoffes durch Zugabe
9 Die Titrimetrie oder Maßanalyse wurde 1830 von J.L. GAY-LUSSAC in die analytische Chemie eingeführt. Hierunter versteht man ein Verfahren zur quantitativen Bestimmung eines gelösten Stoffes durch Zugabe
Abb. 5.1: Die Farben von Universalindikatoren sind nützlich für Konzentrationsbestimmungen.
 Kapitel 5 Bestimmung von unbekannten Konzentrationen Abb. 5.1: Die Farben von Universalindikatoren sind nützlich für Konzentrationsbestimmungen. Die stöchiometrischen Verhältnisse eine bekannten Reaktion
Kapitel 5 Bestimmung von unbekannten Konzentrationen Abb. 5.1: Die Farben von Universalindikatoren sind nützlich für Konzentrationsbestimmungen. Die stöchiometrischen Verhältnisse eine bekannten Reaktion
Übungsaufgabe 1. Photometrische Bestimmung von Chrom als Chromat Chemikalien: H 2 O 2, Natronlauge, Chrom-(III)-salz
 Übungsaufgabe 1 Photometrische Bestimmung von Chrom als Chromat Chemikalien: H 2 O 2, Natronlauge, Chrom-(III)-salz Versuchsbeschreibung: 20 ml der erhaltenen Probelösung werden in ein 150 ml Becherglas
Übungsaufgabe 1 Photometrische Bestimmung von Chrom als Chromat Chemikalien: H 2 O 2, Natronlauge, Chrom-(III)-salz Versuchsbeschreibung: 20 ml der erhaltenen Probelösung werden in ein 150 ml Becherglas
Kultusministerium. Name, Vorname: Klasse: Schule: Seite 1 von 6
 Kultusministerium Name, Vorname: Klasse: Schule: Seite 1 von 6 Aufgabe 1: Stoffe und ihre Eigenschaften a) Die Chemie ist wie die Biologie und die Geschichte eine auf Erfahrungen und Befragungen beruhende
Kultusministerium Name, Vorname: Klasse: Schule: Seite 1 von 6 Aufgabe 1: Stoffe und ihre Eigenschaften a) Die Chemie ist wie die Biologie und die Geschichte eine auf Erfahrungen und Befragungen beruhende
Beispiele zu Neutralisationsreaktionen
 Beispiele zu Neutralisationsreaktionen Einleitung: Im Zuge des folgenden Blocks wird die Titration als Beispiel einer gängigen quantitativen Bestimmungsmethode in der Chemie genauer besprochen und für
Beispiele zu Neutralisationsreaktionen Einleitung: Im Zuge des folgenden Blocks wird die Titration als Beispiel einer gängigen quantitativen Bestimmungsmethode in der Chemie genauer besprochen und für
Nehmen Sie ausreichend. Vitamin C. zu sich? Magenfreundlich. ph-neutral. Gratis Hotline: Für Ihr Immunsystem
 Nehmen Sie ausreichend Vitamin C zu sich? Magenfreundlich und ph-neutral Gratis Hotline: 0800 112 25 25 Für Ihr Immunsystem Warum benötigen wir Vitamin C? Eines der wichtigsten Vitamine für uns Menschen
Nehmen Sie ausreichend Vitamin C zu sich? Magenfreundlich und ph-neutral Gratis Hotline: 0800 112 25 25 Für Ihr Immunsystem Warum benötigen wir Vitamin C? Eines der wichtigsten Vitamine für uns Menschen
Analytische Chemie. B. Sc. Chemieingenieurwesen. 13. September 2016, Uhr. Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc.
 Analytische Chemie B. Sc. Chemieingenieurwesen 13. September 2016, 8.00 11.00 Uhr Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe
Analytische Chemie B. Sc. Chemieingenieurwesen 13. September 2016, 8.00 11.00 Uhr Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe
LICHTENERGIE SOLARZELLE BASIEREND AUF KÜNSTLICHER FOTOSYNTHESE
 LICHTENERGIE SOLARZELLE BASIEREND AUF KÜNSTLICHER FOTOSYNTHESE 15. MAI 2008 - ANTWORTBOGEN 1-1. Land und Team:.. Name: Name:. Name:. Page 1 of 13 EXPERIMENT 1: Vorgehensweise zur Herstellung nanokristalliner
LICHTENERGIE SOLARZELLE BASIEREND AUF KÜNSTLICHER FOTOSYNTHESE 15. MAI 2008 - ANTWORTBOGEN 1-1. Land und Team:.. Name: Name:. Name:. Page 1 of 13 EXPERIMENT 1: Vorgehensweise zur Herstellung nanokristalliner
Mehrprotonige Säuren; als Beispiel Cola
 Mehrprotonige Säuren; als Beispiel Cola Arbeitsauftrag: Führe den nachstehenden Versuch Titration von Cola gemäß der Durchführung durch und notiere deine Messwerte: Materialien: 2 Bechergläser (230 ml),
Mehrprotonige Säuren; als Beispiel Cola Arbeitsauftrag: Führe den nachstehenden Versuch Titration von Cola gemäß der Durchführung durch und notiere deine Messwerte: Materialien: 2 Bechergläser (230 ml),
Titration mit dem Tropfenzähler
 Mit Hilfe des Tropfenzählers kann die Zahl von Tropfen gemessen werden. Hat man in einem Vorversuch das Volumen eines Tropfens bestimmt, kann über eine Formel in CASSY Lab das Volumen der zugetropften
Mit Hilfe des Tropfenzählers kann die Zahl von Tropfen gemessen werden. Hat man in einem Vorversuch das Volumen eines Tropfens bestimmt, kann über eine Formel in CASSY Lab das Volumen der zugetropften
Pascorbin Das Power-Vitamin
 Pascorbin Das Power-Vitamin Vitamin des Lebens Vitamin C ist an vielen Vorgängen im menschlichen Körper beteiligt und erfüllt wichtige Aufgaben z. B. in folgenden Organen: Gehirn Augenlinse Herz Nieren
Pascorbin Das Power-Vitamin Vitamin des Lebens Vitamin C ist an vielen Vorgängen im menschlichen Körper beteiligt und erfüllt wichtige Aufgaben z. B. in folgenden Organen: Gehirn Augenlinse Herz Nieren
Titration kleiner Chloridmengen mit Quecksilber(II)-nitrat
 Illumina-Chemie.de - Artikel Analytik Mit der hier dargestellten maßanalytischen Bestimmung von Chlorid über eine eingestellte Quecksilber(II)-nitrat-Lösung können noch sehr geringe Mengen, bis etwa 0,5
Illumina-Chemie.de - Artikel Analytik Mit der hier dargestellten maßanalytischen Bestimmung von Chlorid über eine eingestellte Quecksilber(II)-nitrat-Lösung können noch sehr geringe Mengen, bis etwa 0,5
Maßanalytische Bestimmung von Halogeniden nach Fajans
 Illumina-Chemie.de - Artikel Analytik Die Titration nach Fajans bedient sich organischer Farbstoffe als sogen. Adsorptionsindikatoren. Sie ist eine Alternative zu dem Vorgehen nach Mohr. Außerdem wird
Illumina-Chemie.de - Artikel Analytik Die Titration nach Fajans bedient sich organischer Farbstoffe als sogen. Adsorptionsindikatoren. Sie ist eine Alternative zu dem Vorgehen nach Mohr. Außerdem wird
Praktikum Quantitative Analysen
 Praktikum Quantitative Analysen Wintersemester 2009/10 Arbeitsmethoden der Quantitativen Analyse A: klassische Methoden vorwiegend chemische Arbeitsmethoden Bestimmung der Bestandteile durch eine chemische
Praktikum Quantitative Analysen Wintersemester 2009/10 Arbeitsmethoden der Quantitativen Analyse A: klassische Methoden vorwiegend chemische Arbeitsmethoden Bestimmung der Bestandteile durch eine chemische
Analytische Chemie. B. Sc. Chemieingenieurwesen. 23. März Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 23. März 2009 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 23. März 2009 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Bestimmung des pks-wertes einer schwachen Säure durch Halbtitration (Artikelnr.: P )
 Lehrer-/Dozentenblatt Bestimmung des pks-wertes einer schwachen Säure durch Halbtitration (Artikelnr.: P7511100) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema:
Lehrer-/Dozentenblatt Bestimmung des pks-wertes einer schwachen Säure durch Halbtitration (Artikelnr.: P7511100) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema:
Thema: Säure-Base-Reaktionen, Puffersysteme und Säure-Base-Titrationen
 Kurs CH-GK2, Q1 1. Klausur 27.03.2019 Thema: Säure-Base-Reaktionen, Puffersysteme und Säure-Base-Titrationen Aufgabenstellungen: 1. Erläutere auf Basis der Beispiele 1 und 2, was man unter einer Neutralisation
Kurs CH-GK2, Q1 1. Klausur 27.03.2019 Thema: Säure-Base-Reaktionen, Puffersysteme und Säure-Base-Titrationen Aufgabenstellungen: 1. Erläutere auf Basis der Beispiele 1 und 2, was man unter einer Neutralisation
Vitamin C ist aktiv beteiligt an rund Stoffwechselabläufen im Menschen! So ist es als Coenzym für viele Stoffwechselvorgänge erforderlich:
 Vitamin C Dem menschlichen Körper ist im Laufe der Evolution das Enzym für die Biosynthese von Vitamin C verloren gegangen. Daher kann er das lebensnotwendige Vitamin C nicht mehr selber herstellen oder
Vitamin C Dem menschlichen Körper ist im Laufe der Evolution das Enzym für die Biosynthese von Vitamin C verloren gegangen. Daher kann er das lebensnotwendige Vitamin C nicht mehr selber herstellen oder
Maßanalyse. Bestimmung einer Schwefelsäure mit einer NaOH Maßlösung: bzw. n(naoh * 1 = n(h 2 SO 4 ) * 2 V [ml] * * t * 1 = n(h 2 SO 4 ) * 2
![Maßanalyse. Bestimmung einer Schwefelsäure mit einer NaOH Maßlösung: bzw. n(naoh * 1 = n(h 2 SO 4 ) * 2 V [ml] * * t * 1 = n(h 2 SO 4 ) * 2 Maßanalyse. Bestimmung einer Schwefelsäure mit einer NaOH Maßlösung: bzw. n(naoh * 1 = n(h 2 SO 4 ) * 2 V [ml] * * t * 1 = n(h 2 SO 4 ) * 2](/thumbs/79/78929570.jpg) Maßanalyse Bei der Maßanalyse (Volumetrie) wird zu der zu analysierenden Lösung unbekannten Gehaltes soviel einer Lösung bekannter Konzentration der Maßlösung zugegeben, bis ein Indikationssystem den Endpunkt
Maßanalyse Bei der Maßanalyse (Volumetrie) wird zu der zu analysierenden Lösung unbekannten Gehaltes soviel einer Lösung bekannter Konzentration der Maßlösung zugegeben, bis ein Indikationssystem den Endpunkt
Der Einfluss der Lagerung und Verarbeitung auf den Vitamin C Gehalt von Äpfeln
 Der Einfluss der Lagerung und Verarbeitung auf den Vitamin C Gehalt von Äpfeln Anika Flüs Beatrice Meier Michael-Ende-Gymnasium St.Tönis Klasse 7 Schüler experimentieren Chemie 1 Inhaltsverzeichnis 1.
Der Einfluss der Lagerung und Verarbeitung auf den Vitamin C Gehalt von Äpfeln Anika Flüs Beatrice Meier Michael-Ende-Gymnasium St.Tönis Klasse 7 Schüler experimentieren Chemie 1 Inhaltsverzeichnis 1.
Chemie für Zahnmediziner Arbeitsheft Woche 4.
 Chemie für Zahnmediziner Arbeitsheft Woche 4. Zusammenstellung einer Infusionslösung Taschenrechner ist erforderlich Verfasser: Attila Agócs, Zoltán Berente, Gergely Gulyás, Péter Jakus, Tamás Lóránd,
Chemie für Zahnmediziner Arbeitsheft Woche 4. Zusammenstellung einer Infusionslösung Taschenrechner ist erforderlich Verfasser: Attila Agócs, Zoltán Berente, Gergely Gulyás, Péter Jakus, Tamás Lóránd,
AnC I Protokoll: 7.1 Synthese und Charakterisierung von Tetraamminkupfer(II)-sulfat! SS Analytische Chemie I.
 Analytische Chemie I Versuchsprotokoll 7.1 Synthese und Charakterisierung der Komplexverbindung Tetraamminkupfer(II)-sulfat 1.! Theoretischer Hintergrund Aus Kupfer(II)-sulfat und Ammoniak wird zunächst
Analytische Chemie I Versuchsprotokoll 7.1 Synthese und Charakterisierung der Komplexverbindung Tetraamminkupfer(II)-sulfat 1.! Theoretischer Hintergrund Aus Kupfer(II)-sulfat und Ammoniak wird zunächst
Seminar zum anorganisch-chemischen Praktikum I. Quantitative Analyse. Prof. Dr. M. Scheer Patrick Schwarz
 Seminar zum anorganisch-chemischen Praktikum I Quantitative Analyse Prof. Dr. M. Scheer Patrick Schwarz Termine und Organisatorisches Immer Donnerstag, 11:00 12:00 in HS 44 Am Semesteranfang zusätzlich
Seminar zum anorganisch-chemischen Praktikum I Quantitative Analyse Prof. Dr. M. Scheer Patrick Schwarz Termine und Organisatorisches Immer Donnerstag, 11:00 12:00 in HS 44 Am Semesteranfang zusätzlich
ph-zusammensetzungsdiagramm zweiwertiger Säuren
 LMPG2 B 14 zweiwertige Säuren Lösungen Seite 1 von 7 p-zusammensetzungsdiagramm zweiwertiger Säuren Aufgabe 1: Wir betrachten die Phthalsäure. a) Formulieren Sie die Protolysegleichgewichte für diese Säure.
LMPG2 B 14 zweiwertige Säuren Lösungen Seite 1 von 7 p-zusammensetzungsdiagramm zweiwertiger Säuren Aufgabe 1: Wir betrachten die Phthalsäure. a) Formulieren Sie die Protolysegleichgewichte für diese Säure.
Rein oder nicht rein?
 Station 1: Rein oder nicht rein? Versuche: 1 Bestimmen Sie experimentell die Löslichkeit von Kochsalz. [Hinweis: Unter der Löslichkeit versteht man die Masse eines Stoffes in Gramm, die sich gerade noch
Station 1: Rein oder nicht rein? Versuche: 1 Bestimmen Sie experimentell die Löslichkeit von Kochsalz. [Hinweis: Unter der Löslichkeit versteht man die Masse eines Stoffes in Gramm, die sich gerade noch
Beispiele: Monocarbonsäuren, Di- und Tricarbonsäuren, gesättigte und ungesättigte Säuren, Hydroxycarbonsäuren
 Carbonsäuren (=> 6-8 Std.) Beispiele: Monocarbonsäuren, Di- und Tricarbonsäuren, gesättigte und ungesättigte Säuren, Hydroxycarbonsäuren Quellen: CD-Römpp http://www.chemieunterricht.de/dc2/facharbeit/alkansau.html
Carbonsäuren (=> 6-8 Std.) Beispiele: Monocarbonsäuren, Di- und Tricarbonsäuren, gesättigte und ungesättigte Säuren, Hydroxycarbonsäuren Quellen: CD-Römpp http://www.chemieunterricht.de/dc2/facharbeit/alkansau.html
Technische Universität Chemnitz Chemisches Grundpraktikum
 Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP5 - Massanalytische Bestimmungsverfahren (Volumetrie)» Martin Wolf Betreuerin: Frau Sachse Datum:
Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP5 - Massanalytische Bestimmungsverfahren (Volumetrie)» Martin Wolf Betreuerin: Frau Sachse Datum:
Säure-Base-Titrationen
 Martin Raiber Chemie Protokoll Nr.3 19.2.2006 Säure-Base-Titrationen 1. Titration von Salzsäure mit Natronlauge Chemikalien: Salzsäure (100ml; c(hcl)=0,1 mol/l) Natronlauge (c(naoh)=1 mol/l) Bromthymolblau
Martin Raiber Chemie Protokoll Nr.3 19.2.2006 Säure-Base-Titrationen 1. Titration von Salzsäure mit Natronlauge Chemikalien: Salzsäure (100ml; c(hcl)=0,1 mol/l) Natronlauge (c(naoh)=1 mol/l) Bromthymolblau
Martin Raiber Chemie Protokoll Nr Gruppe 2 (Schrankseite) Untersuchung von Glycin
 Martin Raiber Chemie Protokoll Nr.4 5.3.2006 Gruppe 2 (Schrankseite) Untersuchung von Glycin Chemikalien: Glycin ( c=0,1 mol/l ) Essigsäure ( c=0,1 mol/l ) 0,75g Glycin Salzsäure ( 100ml, c=0,1 mol/l )
Martin Raiber Chemie Protokoll Nr.4 5.3.2006 Gruppe 2 (Schrankseite) Untersuchung von Glycin Chemikalien: Glycin ( c=0,1 mol/l ) Essigsäure ( c=0,1 mol/l ) 0,75g Glycin Salzsäure ( 100ml, c=0,1 mol/l )
1. Manganometrie 1.1. E 0 (MnO 4 - /MnO 2 ) = +1,68V. Das violette Permanganat wird hierbei zu braunem Mangandioxid (Braunstein) umgewandelt.
 1. Manganometrie 1.1 Manganometrie 1 Die Manganometrie ist ein wichtiges Analyseverfahren zur Bestimmung der Konzentration von reduzierenden Substanzen. Bei der Manganometrischen Konzentrationsbestimmung
1. Manganometrie 1.1 Manganometrie 1 Die Manganometrie ist ein wichtiges Analyseverfahren zur Bestimmung der Konzentration von reduzierenden Substanzen. Bei der Manganometrischen Konzentrationsbestimmung
AnC I Protokoll: 2.2 Potenziometrische Titration von Essigsäure mit NaOH-Lösung! SS Analytische Chemie I. Versuchsprotokoll
 Analytische Chemie I Versuchsprotokoll 2.2 Potenziometrische Titration von Essigsäure mit NaOH-Lösung 1.! Theoretischer Hintergrund Die Potenziometrische Bestimmung wird mit einem ph-meter durchgeführt.
Analytische Chemie I Versuchsprotokoll 2.2 Potenziometrische Titration von Essigsäure mit NaOH-Lösung 1.! Theoretischer Hintergrund Die Potenziometrische Bestimmung wird mit einem ph-meter durchgeführt.
Thermochemie Neutralisationswärme
 Thermochemie Neutralisationswärme Einleitung zum Ziel und Verlauf: Bereits bei der Bearbeitung des Kapitels Atombau und PSE haben die Schüler exotherme Reaktionen kennen gelernt. Allerdings hinterließen
Thermochemie Neutralisationswärme Einleitung zum Ziel und Verlauf: Bereits bei der Bearbeitung des Kapitels Atombau und PSE haben die Schüler exotherme Reaktionen kennen gelernt. Allerdings hinterließen
Analytische Chemie. B. Sc. Chemieingenieurwesen. 7. März 2016, Uhr. Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer:
 Analytische Chemie B. Sc. Chemieingenieurwesen 7. März 2016, 8.00 11.00 Uhr Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Analytische Chemie B. Sc. Chemieingenieurwesen 7. März 2016, 8.00 11.00 Uhr Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
HERFORD. Dichte - Ein spannendes oder langweiliges Thema. ZfP-Sonderpreis der DGZfP beim Regionalwettbewerb Jugend forscht.
 ZfP-Sonderpreis der DGZfP beim Regionalwettbewerb Jugend forscht HERFORD Dichte - Ein spannendes oder langweiliges Thema Jannik Rönsch Schule: Königin-Mathilde-Gymnasium Vlothoer Straße 1 32049 Herford
ZfP-Sonderpreis der DGZfP beim Regionalwettbewerb Jugend forscht HERFORD Dichte - Ein spannendes oder langweiliges Thema Jannik Rönsch Schule: Königin-Mathilde-Gymnasium Vlothoer Straße 1 32049 Herford
Analytische Chemie. B. Sc. Chemieingenieurwesen. 11. Februar Prof. Dr. T. Jüstel, Stephanie Möller M.Sc. Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 11. Februar 2014 Prof. Dr. T. Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der
Analytische Chemie B. Sc. Chemieingenieurwesen 11. Februar 2014 Prof. Dr. T. Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der
Analytische Chemie. B. Sc. Chemieingenieurwesen. 02. Februar Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 02. Februar 2011 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 02. Februar 2011 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
2. Teilklausur zum Chemischen Grundpraktikum im WS 2016/17 vom
 2. Teilklausur zum Chemischen Grundpraktikum im WS 2016/17 vom 25.01.2017 A1 A2 A3 F4 R5 E6 Note 10 10 5 8 9 8 50 NAME/VORNAME:... Matrikelnummer:... Pseudonym für Ergebnisveröffentlichung Schreiben Sie
2. Teilklausur zum Chemischen Grundpraktikum im WS 2016/17 vom 25.01.2017 A1 A2 A3 F4 R5 E6 Note 10 10 5 8 9 8 50 NAME/VORNAME:... Matrikelnummer:... Pseudonym für Ergebnisveröffentlichung Schreiben Sie
Katalysator vor und nach der Reaktion
 Katalysator vor und nach der Reaktion Braunstein als Katalysator bei der Zersetzung von Wasserstoffperoxid Wasserstoffperoxid ist wenig stabil und zerfällt leicht. Dabei entsteht Sauerstoff, der mit Hilfe
Katalysator vor und nach der Reaktion Braunstein als Katalysator bei der Zersetzung von Wasserstoffperoxid Wasserstoffperoxid ist wenig stabil und zerfällt leicht. Dabei entsteht Sauerstoff, der mit Hilfe
Säure-Base-Titrationen
 Säure-Base-Titrationen Dieses Skript gehört: Säure Base - Titrationen Seite 2 Hinweis: Mit den Säuren und Basen ist vorsichtig umzugehen, um Verätzungen zu vermeiden! Versuch 1: Herstellen einer Natronlauge
Säure-Base-Titrationen Dieses Skript gehört: Säure Base - Titrationen Seite 2 Hinweis: Mit den Säuren und Basen ist vorsichtig umzugehen, um Verätzungen zu vermeiden! Versuch 1: Herstellen einer Natronlauge
Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2004/
 Nachklausur zum Anorganisch-Chemischen Grundpraktikum, 28.04.05 Seite 1 von 10 Punkte: von 90 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2004/2005 28.04.2005 Matrikelnummer: Name:
Nachklausur zum Anorganisch-Chemischen Grundpraktikum, 28.04.05 Seite 1 von 10 Punkte: von 90 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2004/2005 28.04.2005 Matrikelnummer: Name:
Versuch 3: Säure-Base Titrationen Chemieteil, Herbstsemester 2008
 Versuch 3: Säure-Base Titrationen Chemieteil, Herbstsemester 2008 Verfasser: Zihlmann Claudio Teammitglied: Knüsel Philippe Datum: 29.10.08 Assistent: David Weibel E-Mail: zclaudio@student.ethz.ch 1. Abstract
Versuch 3: Säure-Base Titrationen Chemieteil, Herbstsemester 2008 Verfasser: Zihlmann Claudio Teammitglied: Knüsel Philippe Datum: 29.10.08 Assistent: David Weibel E-Mail: zclaudio@student.ethz.ch 1. Abstract
Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2004/
 Klausur zum Anorganisch-Chemischen Grundpraktikum vom 08.04.05 Seite 1 von 10 Punkte: von 84 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2004/2005 08.04.2005 Matrikelnummer: Name:
Klausur zum Anorganisch-Chemischen Grundpraktikum vom 08.04.05 Seite 1 von 10 Punkte: von 84 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2004/2005 08.04.2005 Matrikelnummer: Name:
Arbeitskreis Titration von Glycin mit Salzsäure und Natronlauge F 08 Kappenberg Seite 1 / 5
 Kappenberg Seite 1 / 5 Prinzip: Die Aminosäure Glycin wird mit Natronlauge titriert. Durch Ermittlung des Äquivalenzpunktes lässt sich der Gehalt der Säure berechnen, durch Ermittlung des Halbäquivalenzpunktes
Kappenberg Seite 1 / 5 Prinzip: Die Aminosäure Glycin wird mit Natronlauge titriert. Durch Ermittlung des Äquivalenzpunktes lässt sich der Gehalt der Säure berechnen, durch Ermittlung des Halbäquivalenzpunktes
2. Teilklausur zum Chemischen Grundpraktikum im WS 2013/14 vom
 2. Teilklausur zum Chemischen Grundpraktikum im WS 2013/14 vom 29.01.2014 A1 A2 A3 R4 F5 E6 Σ Note 8 7 10 50 NAME/VORNAME:... Matrikelnummer: STICHPUNKTE ZU DEN LÖSUNGEN Pseudonym für Ergebnisveröffentlichung
2. Teilklausur zum Chemischen Grundpraktikum im WS 2013/14 vom 29.01.2014 A1 A2 A3 R4 F5 E6 Σ Note 8 7 10 50 NAME/VORNAME:... Matrikelnummer: STICHPUNKTE ZU DEN LÖSUNGEN Pseudonym für Ergebnisveröffentlichung
Bundesrealgymnasium Imst. Chemie Klasse 7. Säuren und Basen
 Bundesrealgymnasium Imst Chemie 2010-11 Klasse 7 Säuren und Basen Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
Bundesrealgymnasium Imst Chemie 2010-11 Klasse 7 Säuren und Basen Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
Analytische Chemie. B. Sc. Chemieingenieurwesen. 8. Juli 2015, Uhr. Prof. Dr. T. Jüstel, Stephanie Möller M. Sc.
 Analytische Chemie B. Sc. Chemieingenieurwesen 8. Juli 2015, 12.30 15.30 Uhr Prof. Dr. T. Jüstel, Stephanie Möller M. Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Analytische Chemie B. Sc. Chemieingenieurwesen 8. Juli 2015, 12.30 15.30 Uhr Prof. Dr. T. Jüstel, Stephanie Möller M. Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Analytische Chemie. B. Sc. Chemieingenieurwesen. 13. Juli 2017, Uhr. Prof. Dr. T. Jüstel, Dr. Stephanie Möller.
 Analytische Chemie B. Sc. Chemieingenieurwesen 13. Juli 2017, 8.30 11.30 Uhr Prof. Dr. T. Jüstel, Dr. Stephanie Möller Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Analytische Chemie B. Sc. Chemieingenieurwesen 13. Juli 2017, 8.30 11.30 Uhr Prof. Dr. T. Jüstel, Dr. Stephanie Möller Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Harnstoffspaltung durch Urease
 Martin Raiber Chemie Protokoll Nr.5 Harnstoffspaltung durch Urease Versuch 1: Materialien: Reagenzglasgestell, Reagenzgläser, Saugpipetten, 100 ml-becherglas mit Eiswasser, 100 ml-becherglas mit Wasser
Martin Raiber Chemie Protokoll Nr.5 Harnstoffspaltung durch Urease Versuch 1: Materialien: Reagenzglasgestell, Reagenzgläser, Saugpipetten, 100 ml-becherglas mit Eiswasser, 100 ml-becherglas mit Wasser
Molare Masse. 3. Reaktionsgleichung 2Cu + O 2 2CuO. 6. Molares Volumen. Stoffumsatz bei chemischen Reaktionen
 Molare Masse 1. Wortgleichung Kupfer + Sauerstoff Kupfer(II)-oxid 2. Relative Atommassen Periodensystem relative Atommasse Cu 63,55 u relative Atommasse O 16,00 u relative Atommasse Cu 63,55 u 3. Reaktionsgleichung
Molare Masse 1. Wortgleichung Kupfer + Sauerstoff Kupfer(II)-oxid 2. Relative Atommassen Periodensystem relative Atommasse Cu 63,55 u relative Atommasse O 16,00 u relative Atommasse Cu 63,55 u 3. Reaktionsgleichung
Qualitative Kationen und Anionenanalyse
 Qualitative Kationen und Anionenanalyse Die Aufgabe: Die Proben: Ihr müsst mindestens zwei unbekannte Salze mit Hilfe von verschiedenen Tests identifizieren. Die Salze die ihr identifizieren müsst, können
Qualitative Kationen und Anionenanalyse Die Aufgabe: Die Proben: Ihr müsst mindestens zwei unbekannte Salze mit Hilfe von verschiedenen Tests identifizieren. Die Salze die ihr identifizieren müsst, können
Säuren und Basen. Der ph-wert Zur Feststellung, ob eine Lösung sauer oder basisch ist genügt es, die Konzentration der H 3 O H 3 O + + OH -
 Der ph-wert Zur Feststellung, ob eine Lösung sauer oder basisch ist genügt es, die Konzentration der H 3 O + (aq)-ionen anzugeben. Aus der Gleichung: H 2 O + H 2 O H 3 O + + OH - c(h 3 O + ) c(oh - ) K
Der ph-wert Zur Feststellung, ob eine Lösung sauer oder basisch ist genügt es, die Konzentration der H 3 O + (aq)-ionen anzugeben. Aus der Gleichung: H 2 O + H 2 O H 3 O + + OH - c(h 3 O + ) c(oh - ) K
1.1 V 1 Überprüfung des Satzes von Hess mit der Reaktion von Calcium und Salzsäure
 1.1 V 1 Überprüfung des Satzes von Hess mit der Reaktion von Calcium und Salzsäure In diesem Versuch soll der Satz von Hess (die umgesetzte Wärmemenge ist bei einer chemischen Reaktion unabhängig vom Weg)
1.1 V 1 Überprüfung des Satzes von Hess mit der Reaktion von Calcium und Salzsäure In diesem Versuch soll der Satz von Hess (die umgesetzte Wärmemenge ist bei einer chemischen Reaktion unabhängig vom Weg)
Nachklausur zum Praktikum Allgemeine und Anorganische Chemie für Naturwissenschaftler Sommersemester 2007
 Nachklausur zum Praktikum Allgemeine und Anorganische Chemie für Naturwissenschaftler Sommersemester 2007 Name: Matr. Nr.: Studiengang (Bachelor/Diplom): Ergebnis: Punkte/Note: Aufg 1 2 3 4 5 6 7 8 9 10
Nachklausur zum Praktikum Allgemeine und Anorganische Chemie für Naturwissenschaftler Sommersemester 2007 Name: Matr. Nr.: Studiengang (Bachelor/Diplom): Ergebnis: Punkte/Note: Aufg 1 2 3 4 5 6 7 8 9 10
wird titriert mit Salzsäure der Konzentration c(hcl) = 1 mol/l.
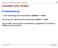 1 Problemstellung 1 Liter Natronlauge der Konzentration c(naoh) = 1 mol/l wird titriert mit Salzsäure der Konzentration c(hcl) = 1 mol/l. Der ph-wert Lösung soll für verschiedene zugegebene HCl-Volumina
1 Problemstellung 1 Liter Natronlauge der Konzentration c(naoh) = 1 mol/l wird titriert mit Salzsäure der Konzentration c(hcl) = 1 mol/l. Der ph-wert Lösung soll für verschiedene zugegebene HCl-Volumina
Analytische Chemie. B. Sc. Chemieingenieurwesen. 6. Juli 2016, Uhr. Prof. Dr. T. Jüstel & Stephanie Möller M.Sc.
 Analytische Chemie B. Sc. Chemieingenieurwesen 6. Juli 2016, 10.30 13.30 Uhr Prof. Dr. T. Jüstel & Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Analytische Chemie B. Sc. Chemieingenieurwesen 6. Juli 2016, 10.30 13.30 Uhr Prof. Dr. T. Jüstel & Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Fette, Öle und Tenside
 Schulversuchspraktikum Thomas Polle Sommersemester 2015 Klassenstufen 11 & 12 Fette, Öle und Tenside Kurzprotokoll Inhalt Inhaltsverzeichnis 1Weitere Lehrerversuche... 3 V1 Verseifungszahl... 3 2Weitere
Schulversuchspraktikum Thomas Polle Sommersemester 2015 Klassenstufen 11 & 12 Fette, Öle und Tenside Kurzprotokoll Inhalt Inhaltsverzeichnis 1Weitere Lehrerversuche... 3 V1 Verseifungszahl... 3 2Weitere
Vorpraktikum Grundoperationen im chemischen Laboratorium
 Vorpraktikum Grundoperationen im chemischen Laboratorium Stand: 09. April 2018 Inhalt: Volumetrische Messgeräte Analysenwaagen Fest-Flüssig-Trennverfahren Flüssig-Flüssig-Trennverfahren Wasserlöslichkeit
Vorpraktikum Grundoperationen im chemischen Laboratorium Stand: 09. April 2018 Inhalt: Volumetrische Messgeräte Analysenwaagen Fest-Flüssig-Trennverfahren Flüssig-Flüssig-Trennverfahren Wasserlöslichkeit
Analytische Chemie. B. Sc. Chemieingenieurwesen. 22. September 2017, 13 bis 16 Uhr. Dr. Stephanie Möller & Prof. Dr. Thomas Jüstel.
 Analytische Chemie B. Sc. Chemieingenieurwesen 22. September 2017, 13 bis 16 Uhr Dr. Stephanie Möller & Prof. Dr. Thomas Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des
Analytische Chemie B. Sc. Chemieingenieurwesen 22. September 2017, 13 bis 16 Uhr Dr. Stephanie Möller & Prof. Dr. Thomas Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des
CHEMIE KAPITEL 4 SÄURE-BASE. Timm Wilke. Georg-August-Universität Göttingen. Wintersemester 2013 / 2014
 CHEMIE KAPITEL 4 SÄURE-BASE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Aufgaben In einen Liter Wasser werden 2 g NH - 2 (starke Base) eingeleitet welchen ph-wert hat
CHEMIE KAPITEL 4 SÄURE-BASE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Aufgaben In einen Liter Wasser werden 2 g NH - 2 (starke Base) eingeleitet welchen ph-wert hat
2.Klausur Chemisches Rechnen 21. Januar 2013
 2.Klausur Chemisches Rechnen 21. Januar 2013 Name: Matrikelnr.: Dauer: 90 min. Maximal erreichbare Punkte: 40 Punkte 1 Sehr gut: 40 35.5 Punkte 2 Gut: 35 30.5 Punkte 3 Befriedigend: 30 25.5 Punkte 4 Genügend:
2.Klausur Chemisches Rechnen 21. Januar 2013 Name: Matrikelnr.: Dauer: 90 min. Maximal erreichbare Punkte: 40 Punkte 1 Sehr gut: 40 35.5 Punkte 2 Gut: 35 30.5 Punkte 3 Befriedigend: 30 25.5 Punkte 4 Genügend:
Komplex: Säure-Base-Titration. 1 Aufgabenstellung. 2 Theoretische Grundlagen. Chemisches Praktikum: Energietechnik
 Hochschule für Technik, Wirtschaft und Kultur Leipzig (FH) Fb Informatik, Mathematik und Naturwissenschaften - Chemie - Chemisches Praktikum: Energietechnik Komplex: Säure-Base-Titration 1 Aufgabenstellung
Hochschule für Technik, Wirtschaft und Kultur Leipzig (FH) Fb Informatik, Mathematik und Naturwissenschaften - Chemie - Chemisches Praktikum: Energietechnik Komplex: Säure-Base-Titration 1 Aufgabenstellung
Übungsklausur Sommer 2007
 AC 2, Anorganische Chemie in Lösung Übungsklausur Sommer 2007 1) In einem Becherglas befinden sich 100 ml einer 1 M a 4 EDTA Lösung (a). Zu dieser Lösung gibt man festes Radiumsulfat bis zur Sättigung,
AC 2, Anorganische Chemie in Lösung Übungsklausur Sommer 2007 1) In einem Becherglas befinden sich 100 ml einer 1 M a 4 EDTA Lösung (a). Zu dieser Lösung gibt man festes Radiumsulfat bis zur Sättigung,
Analytische Chemie. B. Sc. Chemieingenieurwesen. 05. Februar Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 05. Februar 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 05. Februar 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
