Robert-Bosch-Gymnasium
|
|
|
- Daniela Junge
- vor 9 Jahren
- Abrufe
Transkript
1 Robert-Bosch-Gymnasium NWT Klassenstufe 10 Versuch 1 Regenerative Energien: Brennstoffzelle Albert Pfänder, Brennstoffzellen-Praktikum, Versuch 1 Kennlinie des Elektrolyseurs Versuchszweck Beim vorliegenden Versuch soll zunächst die I-U-Kennlinie des Elektrolyseurs aufgenommen und daraus die Zersetzungsspannung ermittelt werden. Hieraus erhält man durch Vergleich mit den theoretischen Werten die Überspannung (an der Sauerstoffseite, Ru- /Ir-Elektrode). Durch Messung der Stromstärke und der Zeit bei der Produktion einer definierten Wasserstoff- bzw. Sauerstoffgasmenge kann die Avogadro-Konstante ermittelt und mit dem Literaturwert verglichen werden. Das Experiment wird dazu in zwei Teilen durchgeführt. Versuchsaufbau / Materialien / Durchführung Nachfolgend die Beschreibung der Materialien und des grundsätzlichen Versuchsaufbaus nach den Vorgaben des Herstellers Heliocentris; siehe auch die beiliegende Gerätekarte zum Versuch! Seite 1 von 5
2 Aufbau und Befüllung des Elektrolyseurs: Zur Aufnahme der Kennlinie des Elektrolyseurs verwenden wir als Stromquelle nicht das Solarmodul, sondern ein regelbares Netzgerät, bei dem sich die Spannung in feinen Stufen einstellen lässt. Die Stromstärke am Elektrolyseur darf nicht über 400 ma ansteigen, sonst kann die PEM durch die Wärmeentwicklung irreversiblen Schaden nehmen!! ACHTUNG Sicherheitshinweis: Wasserstoffgas ist leicht entzündlich; bei Kontakt mit Luft bzw. bei Durchmischung mit Luft kann es bei Zündung zu einer Explosion kommen. Daher: kein offenes Feuer verwenden oder Funken erzeugen. Bitte Schutzbrille tragen! Seite 2 von 5
3 Hinweise bei der Versuchsanleitung genau beachten! Maximale Stromstärke des Elektrolyseurs (400 ma) nicht überschreiten! Kennlinie des Elektrolyseurs Geräte Elektrolyseur mit Überlaufrohren auf Sauerstoff- und Wasserstoffseite zwei Silikonschläuche (mit Stopfen) Spritzflasche mit (unbedingt!!) destilliertem Wasser Messkabel Netzgerät, regelbar 2 Digitalmultimeter (zur Strom- und Spannungsmessung) Stoppuhr Aufbau Der Elektrolyseur wird über Messkabel unter Einschleifung eines Amperemeters mit dem Netzgerät verbunden; dieses ist zunächst noch ausgeschaltet. Dabei ist der Pluspol des Netzgerätes mit dem Pluspol (rot) des Elektrolyseurs zu verbinden, der Minuspol des Netzgerätes mit dem Minuspol des Elektrolyseurs. Bei falscher Polung (und zu hoher Spannung) kann die Membran des Elektrolyseurs Schaden nehmen. Direkt an den Anschlusspolen des Elektrolyseurs schließt man dann noch ein zweites Digitalmultimeter als Spannungsmessgerät an. Nun wird in beide Seiten des Elektrolyseurs mit Hilfe einer Spritzflasche destilliertes Wasser eingefüllt, bis der Wasserspiegel jeweils die 0 ml-marke erreicht. Dann schließt man bei 2g und 2d (Gasauslass Sauerstoff und Gasauslass Wasserstoff) Silikonschläuche an (zunächst ohne Stopfen!). Durchführung Bei unverschlossenen Silikonschläuchen schaltet man das Netzgerät nun ein und erhöht die Spannung von Null Volt aus so lange, bis ein deutlicher Strom fließt, z. B. 200 ma. Die Stromstärke darf in KEINEM Fall 400 ma überschreiten, sonst kann die Polymerelektrolytmembran zerstört werden. Diesen Strom (200 ma) behält man nun ca. 1 min bei. Dann ist der Silikonschlauch mit den entstandenen Gasen gespült; man dreht die Spannung am Netzgerät nun auf Null Volt zurück und verschließt nun die beiden Schläuche mit Stopfen. Der Wasserstand (0 ml) wird nochmals kontrolliert, ggf. auch korrigiert. Nun beginnt die eigentliche Messung der Kennlinie. Dazu erhöht man die Spannung zunächst in größeren, ab der erwarteten Zersetzungsspannung dann in kleineren Schritten. Man notiert die Spannungswerte und die zugehörigen Stromstärkewerte. Die Messung wird so weit geführt, bis die Stromstärke 400 ma erreicht. Dann ist sie beendet. Es wird ständig kontrolliert, dass die Gasspeicher nicht zu voll werden (Wasserstoffseite beachten!! Nicht mehr als 10 ml Wasserstoffgas erzeugen!). Seite 3 von 5
4 Auswertung Die Messwerte werden in eine Excel-Tabelle eingetragen. Dann wird mit Excel ein I-U-Diagramm erzeugt (I aufgetragen über der Spannung U). Legt man an den linear ansteigenden Zweig der Kennlinie eine Tangente, schneidet diese die U-Achse bei der Zersetzungsspannung. Diese ist zu ermitteln. Es wird eine Größtfehlerberechnung durchgeführt. Bestimmung der Faraday-Konstanten Geräte (wie oben) Elektrolyseur mit Überlaufrohren auf Sauerstoff- und Wasserstoffseite zwei Silikonschläuche (mit Stopfen) Spritzflasche mit (unbedingt!!) destilliertem Wasser Messkabel Netzgerät, regelbar Digitalmultimeter (zur Spannungsmessung) Stoppuhr Aufbau (wie oben) Der Elektrolyseur wird über Messkabel unter Einschleifung eines Amperemeters mit dem Netzgerät verbunden; dieses ist zunächst noch ausgeschaltet. Dabei ist der Pluspol des Netzgerätes mit dem Pluspol (rot) des Elektrolyseurs zu verbinden, der Minuspol des Netzgerätes mit dem Minuspol des Elektrolyseurs. Bei falscher Polung (und zu hoher Stromstärke) kann die Membran des Elektrolyseurs Schaden nehmen. Nun wird in beide Seiten des Elektrolyseurs mit Hilfe einer Spritzflasche destilliertes Wasser eingefüllt, bis der Wasserspiegel jeweils die 0 ml-marke erreicht. Dann schließt man bei 2g und 2d (Gasauslass Sauerstoff und Gasauslass Wasserstoff) Silikonschläuche an (zunächst ohne Stopfen). Durchführung Man schaltet das Netzgerät ein und regelt die Stromstärke auf einen Wert von z. B ma. Die Stromstärke sollte im höheren Bereich (kurz unterhalb der 400 ma-grenze) liegen. Diese Stromstärke behält man ca. 1 Minute bei; dann sind die Schläuche mit den entstehenden Gasen gespült. Nun schaltet man das Netzgerät aus und verschließt den Schlauch an der Wasserstoffseite mit einem Stopfen. Es können auch beide Seiten verschlossen werden, d.h. auch die Sauerstoffseite. Verbrauchtes Wasser füllt man wieder bis zur 0 ml-marke auf. Beim Wieder-Einschalten des Netzgerätes startet man auch eine Stoppuhr. Man kontrolliert fortlaufend, ob die Stromstärke den eingestellten Wert konstant beibehält; andernfalls muss man die Spannung etwas nachregeln. Diese Stromstärke behält man so lange bei, bis 10 ml Wasserstoffgas im Vorratsbehälter (Gasspeicher) des Elektrolyseurs entstanden sind. Dann bricht man die Elektrolyse ab und liest die benötigte Zeit ab. Nach Beendigung der Messung entfernt man den Stopfen vom Schlauch am Wasserstoffspeicher und lässt das Wasserstoffgas entweichen. Seite 4 von 5
5 Um ein Molekül Wasserstoff durch Elektrolyse zu erzeugen, müssen 2 Protonen H + entladen werden; dazu benötigt man 2 Elektronen. Auswertung Mit Hilfe des molaren Volumens V mol = 22,4 l/mol kann man mit Hilfe der Gleichung V = n V mol ausrechnen, wieviel Mol Wasserstoff die 10 ml darstellen. Zusammen mit den obigen Informationen kann man berechnen, welche elektrische Ladung benötigt wird, um die berechnete Stoffmenge an Wasserstoffkationen (Protonen) zu entladen. Umgekehrt kann man aus der während der Elektrolyse herrschenden Stromstärke und der Elektrolysedauer die tatsächlich geflossene Ladung ermitteln (Q = I t). Die beiden Werte sind miteinander zu vergleichen; es ist eine Größtfehlerrechnung durchzuführen und die Abweichung des ermittelten Ladungswertes vom errechneten Wert zu bestimmen. Die Faradaykonstante F gibt den Quotienten aus der Ladung von N L Elementarladungen (Elektronen, Protonen) und der Stoffmenge n = 1 mol an (wobei: N L = Loschmidtzahl: N L = 6, F = 9, C/mol Bestimme die Faraday-Konstante aus der Messung von Gasvolumen (daraus ergibt sich die Stoffmenge) und geflossener Ladung. Vergleiche mit dem Literaturwert! (Prozentuale Abweichung). Überprüfe, ob der ermittelte und der erwartete Wert der Faraday-Konstanten im Rahmen der bei der Messung herrschenden Messgenauigkeit übereinstimmen! Seite 5 von 5
Robert-Bosch-Gymnasium
 Robert-Bosch-Gymnasium NWT Klassenstufe 10 Versuch 1 Regenerative Energien: Brennstoffzelle Albert Pfänder, 22.4.2014 Brennstoffzellen-Praktikum, Versuch 3 Wirkungsgrad der Brennstoffzelle Versuchszweck
Robert-Bosch-Gymnasium NWT Klassenstufe 10 Versuch 1 Regenerative Energien: Brennstoffzelle Albert Pfänder, 22.4.2014 Brennstoffzellen-Praktikum, Versuch 3 Wirkungsgrad der Brennstoffzelle Versuchszweck
Robert-Bosch-Gymnasium
 Robert-Bosch-Gymnasium NWT Klassenstufe 10 Versuch 2 Regenerative Energien: Brennstoffzelle Albert Pfänder, 22.4.2014 Brennstoffzellen-Praktikum, Versuch 2 Kennlinien der Brennstoffzelle Versuchszweck
Robert-Bosch-Gymnasium NWT Klassenstufe 10 Versuch 2 Regenerative Energien: Brennstoffzelle Albert Pfänder, 22.4.2014 Brennstoffzellen-Praktikum, Versuch 2 Kennlinien der Brennstoffzelle Versuchszweck
Faradayscher und energetischer Wirkungsgrad einer PEM Brennstoffzelle
 Faradayscher und energetischer Wirkungsgrad einer PEM Brennstoffzelle Aufgabe und Material Lehrerinformation Zusatzinformationen Der Wirkungsgrad der Brennstoffzelle ist ein Indikator für die Effizienz
Faradayscher und energetischer Wirkungsgrad einer PEM Brennstoffzelle Aufgabe und Material Lehrerinformation Zusatzinformationen Der Wirkungsgrad der Brennstoffzelle ist ein Indikator für die Effizienz
Experimentiertag. Datum: Name: Klasse: Schule:
 Experimentiertag Datum: Name: Klasse: Schule: E1 V 1 Generator, Propeller, Solarmodul Wovon hängt die Spannung ab? 1.) Spannung aus dem Generator: (Taucht in der Spannungsanzeige kein Minuszeichen auf,
Experimentiertag Datum: Name: Klasse: Schule: E1 V 1 Generator, Propeller, Solarmodul Wovon hängt die Spannung ab? 1.) Spannung aus dem Generator: (Taucht in der Spannungsanzeige kein Minuszeichen auf,
Untersuchung der Abhängigkeit des Photostroms von der Entfernung zur Lichtquelle
 E1 S 3 Untersuchung der Abhängigkeit des Photostroms von der Entfernung zur Lichtquelle Name: Datum: Aufgaben: a) Miss die Höhe des Photostroms in Abhängigkeit von der Entfernung zur Lampe. b) Zeichne
E1 S 3 Untersuchung der Abhängigkeit des Photostroms von der Entfernung zur Lichtquelle Name: Datum: Aufgaben: a) Miss die Höhe des Photostroms in Abhängigkeit von der Entfernung zur Lampe. b) Zeichne
Strom-Spannungs-Kennlinie einer PEM Brennstoffzelle
 Lehrer-/Dozentenblatt Strom-Spannungs-Kennlinie einer PEM Brennstoffzelle Aufgabe und Material Lehrerinformationen Zusatzinformationen Eine PEM Brennstoffzelle besitzt keine lineare Leistungskurve, sondern
Lehrer-/Dozentenblatt Strom-Spannungs-Kennlinie einer PEM Brennstoffzelle Aufgabe und Material Lehrerinformationen Zusatzinformationen Eine PEM Brennstoffzelle besitzt keine lineare Leistungskurve, sondern
TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg
 TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg PROTOKOLL SEKUNDARSTUFE II Modul: Versuch: Elektrochemie 1 Abbildung 1:
TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg PROTOKOLL SEKUNDARSTUFE II Modul: Versuch: Elektrochemie 1 Abbildung 1:
TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg
 TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg GRUNDLAGEN Modul: Versuch: Elektrochemie 1 Abbildung 1: I. VERSUCHSZIEL
TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg GRUNDLAGEN Modul: Versuch: Elektrochemie 1 Abbildung 1: I. VERSUCHSZIEL
Erzeugung elektrischer Energie mit einer PEM Brennstoffzelle
 Lehrer-/Dozentenblatt Erzeugung elektrischer Energie mit einer PEM Brennstoffzelle Aufgabe und Material Lehrerinformationen Zusätzliche Informationen Alle Brennstoffzellen bestehen prinzipiell aus zwei
Lehrer-/Dozentenblatt Erzeugung elektrischer Energie mit einer PEM Brennstoffzelle Aufgabe und Material Lehrerinformationen Zusätzliche Informationen Alle Brennstoffzellen bestehen prinzipiell aus zwei
Strom-Spannungs-Kennlinie und Leistung einer PEM Brennstoffzelle
 Strom-Spannungs-Kennlinie und Leistung ENT Schlüsselworte Brennstoffzelle, Protonen-Austausch-Membran, Kennlinie, elektrische Leistung, Innenwiderstand, Wasserstoff Prinzip In reagieren Wasserstoff und
Strom-Spannungs-Kennlinie und Leistung ENT Schlüsselworte Brennstoffzelle, Protonen-Austausch-Membran, Kennlinie, elektrische Leistung, Innenwiderstand, Wasserstoff Prinzip In reagieren Wasserstoff und
1.) Skizzierieren Sie den Aufbau einer PEM Brennstoffzelle und erläutern Sie deren Funktionsweise.
 E50 Name: Brennstoffzelle Matrikelnummer: Fachrichtung: Mitarbeiter/in: Assistent/in: Versuchsdatum: Gruppennummer: Endtestat: Dieser Fragebogen muss von jedem Teilnehmer eigenständig (keine Gruppenlösung!)
E50 Name: Brennstoffzelle Matrikelnummer: Fachrichtung: Mitarbeiter/in: Assistent/in: Versuchsdatum: Gruppennummer: Endtestat: Dieser Fragebogen muss von jedem Teilnehmer eigenständig (keine Gruppenlösung!)
Kennlinie der Brennstoffzelle
 E z1 Kennlinie der Material: Zerlegbare mit Membran,3 mg/cm Pt sowie Wasserstoff- und Sauerstoffendplatte montiert nach Aufbauanleitung Komponenten aus Schülerkasten Solar-Wasserstoff-Technologie: Solarmodul
E z1 Kennlinie der Material: Zerlegbare mit Membran,3 mg/cm Pt sowie Wasserstoff- und Sauerstoffendplatte montiert nach Aufbauanleitung Komponenten aus Schülerkasten Solar-Wasserstoff-Technologie: Solarmodul
Brennstoffzelle. Versuch im Physikalischen Praktikum des Mathematik/Informatik-Gebäudes. Schüler-Skript und Versuchsanleitung
 Versuch im Physikalischen Praktikum des Mathematik/Informatik-Gebäudes Bearbeitet von Markus Beckert, Sheila Sabock Stand 12.09.2013 Inhaltsverzeichnis 1 Einführung... 3 1.1 Vorbereitung, Vorwissen, Vorüberlegungen...
Versuch im Physikalischen Praktikum des Mathematik/Informatik-Gebäudes Bearbeitet von Markus Beckert, Sheila Sabock Stand 12.09.2013 Inhaltsverzeichnis 1 Einführung... 3 1.1 Vorbereitung, Vorwissen, Vorüberlegungen...
PEM-Elektrolyseur Betriebsanleitung
 R PEM-Elektrolyseur Betriebsanleitung 2 1 3 5 4 Fig. 1: PEM-Elektrolyseur 1 ZWECK UND BESCHREIBUNG Bei einem PEM-Elektrolyseur besteht der Elektrolyt aus einer protonenleitfähigen Membran und Wasser (PEM
R PEM-Elektrolyseur Betriebsanleitung 2 1 3 5 4 Fig. 1: PEM-Elektrolyseur 1 ZWECK UND BESCHREIBUNG Bei einem PEM-Elektrolyseur besteht der Elektrolyt aus einer protonenleitfähigen Membran und Wasser (PEM
Physikalisches Anfaengerpraktikum. Brennstoffzelle
 Physikalisches Anfaengerpraktikum Brennstoffzelle Ausarbeitung von Marcel Engelhardt & David Weisgerber (Gruppe 37) Freitag, 25. Februar 2005 I. Versuchsaufbau und -beschreibung Die Versuchsapparatur bestand
Physikalisches Anfaengerpraktikum Brennstoffzelle Ausarbeitung von Marcel Engelhardt & David Weisgerber (Gruppe 37) Freitag, 25. Februar 2005 I. Versuchsaufbau und -beschreibung Die Versuchsapparatur bestand
1. Messungen an einer Modell-Windanlage
 1. Messungen an einer Modell-Windanlage Georg Begusch, Leopold Mathelitsch, Gerhard Rath, Erich Reichel, Eduard Schittelkopf Zuerst sollen Sie einige physikalische Eigenschaften von Windenergieanlagen
1. Messungen an einer Modell-Windanlage Georg Begusch, Leopold Mathelitsch, Gerhard Rath, Erich Reichel, Eduard Schittelkopf Zuerst sollen Sie einige physikalische Eigenschaften von Windenergieanlagen
E7 Elektrolyse. Versuchsprotokoll von Thomas Bauer und Patrick Fritzsch. Münster, den
 E7 Elektrolyse Versuchsprotokoll von Thomas Bauer und Patrick Fritzsch Münster, den 18.12.2000 INHALTSVERZEICHNIS 1. Einleitung 2. Theoretische Grundlagen 2.1 Elektrolyse 2.2 Die FARADAYschen Gesetze der
E7 Elektrolyse Versuchsprotokoll von Thomas Bauer und Patrick Fritzsch Münster, den 18.12.2000 INHALTSVERZEICHNIS 1. Einleitung 2. Theoretische Grundlagen 2.1 Elektrolyse 2.2 Die FARADAYschen Gesetze der
PROTOKOLL ZUM ANFÄNGERPRAKTIKUM. Bestimmung der FARADAY-Konstanten durch Elektrolyse. Sebastian Finkel Sebastian Wilken
 PROTOKOLL ZUM ANFÄNGERPRAKTIKUM PHYSIK Bestimmung der FARADAY-Konstanten durch Elektrolyse Sebastian Finkel Sebastian Wilken Versuchsdurchführung: 6. Juni 006 0. Inhalt 1. Einleitung. Theoretischer Teil.1.
PROTOKOLL ZUM ANFÄNGERPRAKTIKUM PHYSIK Bestimmung der FARADAY-Konstanten durch Elektrolyse Sebastian Finkel Sebastian Wilken Versuchsdurchführung: 6. Juni 006 0. Inhalt 1. Einleitung. Theoretischer Teil.1.
Energiediagramme! Energie strömt nicht alleine, sie braucht immer einen Träger. Beispiele: 1) Glühlampe
 Kompetenztage 7 diagramme! strömt nicht alleine, sie braucht immer einen Träger. umwandler träger sind zum Beispiel: Benzin, Nahrungsmittel für chemische, r Strom für diagramm Licht für Lichtenergie fließende
Kompetenztage 7 diagramme! strömt nicht alleine, sie braucht immer einen Träger. umwandler träger sind zum Beispiel: Benzin, Nahrungsmittel für chemische, r Strom für diagramm Licht für Lichtenergie fließende
Wind-Wasserstoff-Anlage
 Wind-Wasserstoff-Anlage ENT Schlüsselworte Elektrolyse, Protonen-Austausch-Membran, Brennstoffzelle, Windkraftanlage, Wasserstoff, Energieumwandlung Prinzip Windenergie kann mit Hilfe eines Windgenerators
Wind-Wasserstoff-Anlage ENT Schlüsselworte Elektrolyse, Protonen-Austausch-Membran, Brennstoffzelle, Windkraftanlage, Wasserstoff, Energieumwandlung Prinzip Windenergie kann mit Hilfe eines Windgenerators
Robert-Bosch-Gymnasium
 Robert-Bosch-Gymnasium NWT Klassenstufe 10 Info Regenerative Energien: Brennstoffzelle Albert Pfänder, 22.4.2014 Physikalische und elektrochemische Grundlagen von Elektrolyseur und Polymerelektrolytmembran-Brennstoffzelle
Robert-Bosch-Gymnasium NWT Klassenstufe 10 Info Regenerative Energien: Brennstoffzelle Albert Pfänder, 22.4.2014 Physikalische und elektrochemische Grundlagen von Elektrolyseur und Polymerelektrolytmembran-Brennstoffzelle
JUFOTech. wko.at/tirol/jufotech DATENBLATT. Jugend forscht in der Technik. Titel der Projektarbeit: Fachgebiet:
 Datenblatt (dient als Titelblatt für die Projektarbeit) Seite 1/2 JUFOTech Jugend forscht in der Technik wko.at/tirol/jufotech DATENBLATT Wir nehmen am Wettbewerb Jugend forscht in der Technik Auf den
Datenblatt (dient als Titelblatt für die Projektarbeit) Seite 1/2 JUFOTech Jugend forscht in der Technik wko.at/tirol/jufotech DATENBLATT Wir nehmen am Wettbewerb Jugend forscht in der Technik Auf den
Dunkel- und Hellkennlinie des Solarmoduls. Beachten Sie die Anweisungen aus der Bedienungsanleitung! Messgerät + V + A. Solarmodul
 P s1 Dunkel- und Hellkennlinie des Solarmoduls Material: Solarmodul Verbrauchermodul Strom- und Spannungsmessgeräte 5 Kabel Zusätzliche Komponenten: Schwarze Pappe (Teil 1) Netzteil (Teil 1) Lampe 100-150
P s1 Dunkel- und Hellkennlinie des Solarmoduls Material: Solarmodul Verbrauchermodul Strom- und Spannungsmessgeräte 5 Kabel Zusätzliche Komponenten: Schwarze Pappe (Teil 1) Netzteil (Teil 1) Lampe 100-150
1. Strom-Spannungs-Kennlinie, Leistungskurve und Wirkungsgrad des Solarmoduls
 1. Strom-Spannungs-Kennlinie, Leistungskurve und Wirkungsgrad des Solarmoduls Hintergrund: Gegeben ist ein Datenblatt eines Solarpanels. Der Schüler soll messtechnisch die Daten eines kleinen Solarmoduls
1. Strom-Spannungs-Kennlinie, Leistungskurve und Wirkungsgrad des Solarmoduls Hintergrund: Gegeben ist ein Datenblatt eines Solarpanels. Der Schüler soll messtechnisch die Daten eines kleinen Solarmoduls
E5: Faraday-Konstante
 E5: Faraday-Konstante Theoretische Grundlagen: Elektrischer Strom ist ein Fluss von elektrischer Ladung; in Metallen sind Elektronen die Ladungsträger, in Elektrolyten übernehmen Ionen diese Aufgabe. Befinden
E5: Faraday-Konstante Theoretische Grundlagen: Elektrischer Strom ist ein Fluss von elektrischer Ladung; in Metallen sind Elektronen die Ladungsträger, in Elektrolyten übernehmen Ionen diese Aufgabe. Befinden
Brennstoffzelle und Solar-Wasserstoff-Technologie
 Brennstoffzelle und Solar-Wasserstoff-Technologie Seite 1 von 21 Seite 2 von 21 Seite 3 von 21 Seite 4 von 21 2.4. Zugelassene Bediener Mit der Anlage dürfen Sie nur arbeiten, wenn Sie die Bedienungsanleitung
Brennstoffzelle und Solar-Wasserstoff-Technologie Seite 1 von 21 Seite 2 von 21 Seite 3 von 21 Seite 4 von 21 2.4. Zugelassene Bediener Mit der Anlage dürfen Sie nur arbeiten, wenn Sie die Bedienungsanleitung
Bedienungsanleitung. T126 TutorialBasic
 Bedienungsanleitung T126 TutorialBasic H-TEC EDUCATION GmbH Maria-Goeppert-Str. 9a 23562 Lübeck Tel: +49 (0) 451-3 99 41-0 Fax: +49 (0) 451-3 99 41-798 E-mail: [email protected] Website: www.h-tec-education.com
Bedienungsanleitung T126 TutorialBasic H-TEC EDUCATION GmbH Maria-Goeppert-Str. 9a 23562 Lübeck Tel: +49 (0) 451-3 99 41-0 Fax: +49 (0) 451-3 99 41-798 E-mail: [email protected] Website: www.h-tec-education.com
Das Brennstoffzellen-Radio
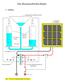 Das Brennstoffzellen-Radio 1. Aufbau Auffangbehälter (Haushaltstrichter) Solarpaneel (KOSMOS) 10 10 20 20 30 30 40 50 destilliertes Wasser Gastanks (Einwegspritzen) 40 50 60 70 80 60 Plexiglas 90 ml 100
Das Brennstoffzellen-Radio 1. Aufbau Auffangbehälter (Haushaltstrichter) Solarpaneel (KOSMOS) 10 10 20 20 30 30 40 50 destilliertes Wasser Gastanks (Einwegspritzen) 40 50 60 70 80 60 Plexiglas 90 ml 100
Robert-Bosch-Gymnasium
 Robert-Bosch-Gymnasium NWT Klassenstufe 10 Info Regenerative Energien: Brennstoffzelle Albert Pfänder, 26.8.2014 Physikalische und elektrochemische Grundlagen von Elektrolyseur und Polymerelektrolytmembran-Brennstoffzelle
Robert-Bosch-Gymnasium NWT Klassenstufe 10 Info Regenerative Energien: Brennstoffzelle Albert Pfänder, 26.8.2014 Physikalische und elektrochemische Grundlagen von Elektrolyseur und Polymerelektrolytmembran-Brennstoffzelle
Bedienungsanleitung. E207 Electrolyser H2/O E206 Electrolyser H2/O2 65
 Bedienungsanleitung E207 Electrolyser H2/O2 230 E206 Electrolyser H2/O2 65 H-TEC EDUCATION GmbH Maria-Goeppert-Str. 9a 23562 Lübeck Deutschland Tel: +49 451 39941-0 Fax: +49 451 39941-798 E-Mail: [email protected]
Bedienungsanleitung E207 Electrolyser H2/O2 230 E206 Electrolyser H2/O2 65 H-TEC EDUCATION GmbH Maria-Goeppert-Str. 9a 23562 Lübeck Deutschland Tel: +49 451 39941-0 Fax: +49 451 39941-798 E-Mail: [email protected]
E000 Ohmscher Widerstand
 E000 Ohmscher Widerstand Gruppe A: Collin Bo Urbon, Klara Fall, Karlo Rien Betreut von Elektromaster Am 02.11.2112 Inhalt I. Einleitung... 1 A. Widerstand und ohmsches Gesetz... 1 II. Versuch: Strom-Spannungs-Kennlinie...
E000 Ohmscher Widerstand Gruppe A: Collin Bo Urbon, Klara Fall, Karlo Rien Betreut von Elektromaster Am 02.11.2112 Inhalt I. Einleitung... 1 A. Widerstand und ohmsches Gesetz... 1 II. Versuch: Strom-Spannungs-Kennlinie...
Wirkungsgrad einer Elektrolyseur-Brennstoffzellen-Anlage
 Wirkungsgrad einer Elektrolyseur-Brennstoffzellen-Anlage ENT Schlüsselworte Elektrolyse, Protonen-Austausch-Membran, Ladungstrennung, Wasserstoffverbrennung, Brennstoffzelle, Wirkungsgrad Prinzip Bei jeder
Wirkungsgrad einer Elektrolyseur-Brennstoffzellen-Anlage ENT Schlüsselworte Elektrolyse, Protonen-Austausch-Membran, Ladungstrennung, Wasserstoffverbrennung, Brennstoffzelle, Wirkungsgrad Prinzip Bei jeder
Grundpraktikum Physikalische Chemie
 Grundpraktikum Physikalische Chemie Versuch 10: Elektrische Leitfähigkeit von Elektrolyten überarbeitet: Tobias Staut, 2014.07 Inhaltsverzeichnis 1 Vorbereitung und Eingangskolloquium 3 2 Messung der Überführungszahlen
Grundpraktikum Physikalische Chemie Versuch 10: Elektrische Leitfähigkeit von Elektrolyten überarbeitet: Tobias Staut, 2014.07 Inhaltsverzeichnis 1 Vorbereitung und Eingangskolloquium 3 2 Messung der Überführungszahlen
IIE2. Modul Elektrizitätslehre II. Dielektrika
 IIE2 Modul Elektrizitätslehre II Dielektrika Ziel dieses Versuches ist, die Funktionsweise eines Kondensators mit Dielektrikum zu verstehen. Des weiteren soll die Kapazität des Kondensators und die relative
IIE2 Modul Elektrizitätslehre II Dielektrika Ziel dieses Versuches ist, die Funktionsweise eines Kondensators mit Dielektrikum zu verstehen. Des weiteren soll die Kapazität des Kondensators und die relative
Bedienungsanleitung. E205 Electrolyser H2 10
 Bedienungsanleitung E205 Electrolyser H2 10 Inhaltsverzeichnis 03 04 04 05 07 08 10 12 13 14 15 15 15 Einleitung Zu dieser Anleitung Sicherheitshinweise Inhalt Überblick Inbetriebnahme Bedienung Technische
Bedienungsanleitung E205 Electrolyser H2 10 Inhaltsverzeichnis 03 04 04 05 07 08 10 12 13 14 15 15 15 Einleitung Zu dieser Anleitung Sicherheitshinweise Inhalt Überblick Inbetriebnahme Bedienung Technische
 Experimente www.fuelcellbox-nrw.de H-TEC EDUCATION GmbH 2016 www.h-tec-education.com Inhalt 1.1. Zersetzung von Wasser unter Betrachtung des entstehenden Wasserstoff- und Sauerstoff-Gasvolumens 4 1.2.
Experimente www.fuelcellbox-nrw.de H-TEC EDUCATION GmbH 2016 www.h-tec-education.com Inhalt 1.1. Zersetzung von Wasser unter Betrachtung des entstehenden Wasserstoff- und Sauerstoff-Gasvolumens 4 1.2.
Thema/Kontext: Von der Wasserelektrolyse zur Brennstoffzelle. Inhaltsfeld: Elektrochemie
 Thema/Kontext: Von der Wasserelektrolyse zur Brennstoffzelle Inhaltsfeld: Elektrochemie Inhaltliche Schwerpunkte: Mobile Energiequellen Elektrochemische Gewinnung von Stoffen Zeitbedarf: ca. 5 Std. à 45
Thema/Kontext: Von der Wasserelektrolyse zur Brennstoffzelle Inhaltsfeld: Elektrochemie Inhaltliche Schwerpunkte: Mobile Energiequellen Elektrochemische Gewinnung von Stoffen Zeitbedarf: ca. 5 Std. à 45
Photoeffekt: Bestimmung von h/e
 I. Physikalisches Institut der Universität zu Köln Physikalisches Praktikum B Versuch 1.4 Photoeffekt: Bestimmung von h/e (Stand: 25.07.2008) 1 Versuchsziel: In diesem Versuch soll der äußere photoelektrische
I. Physikalisches Institut der Universität zu Köln Physikalisches Praktikum B Versuch 1.4 Photoeffekt: Bestimmung von h/e (Stand: 25.07.2008) 1 Versuchsziel: In diesem Versuch soll der äußere photoelektrische
LEISTUNGSTEST ELEKTROLYSE-STACK
 LEISTUNGSTEST ELEKTROLYSE-STACK Energetischer und Faradayscher Wirkungsgrad Plus, (Thorsten Müller) Bandit, Rubberduck, (Saša Smolčić) 20140225 Dieses Material steht unter der Creative-Commons-Lizenz Namensnennung
LEISTUNGSTEST ELEKTROLYSE-STACK Energetischer und Faradayscher Wirkungsgrad Plus, (Thorsten Müller) Bandit, Rubberduck, (Saša Smolčić) 20140225 Dieses Material steht unter der Creative-Commons-Lizenz Namensnennung
Abiturprüfung Physik, Grundkurs
 Seite 1 von 6 Abiturprüfung 2012 Physik, Grundkurs Aufgabenstellung: Aufgabe: Entladung eines Kondensators In dieser Aufgabe geht es um die Entladung eines Kondensators. Im ersten Teil (Teilaufgabe 1)
Seite 1 von 6 Abiturprüfung 2012 Physik, Grundkurs Aufgabenstellung: Aufgabe: Entladung eines Kondensators In dieser Aufgabe geht es um die Entladung eines Kondensators. Im ersten Teil (Teilaufgabe 1)
Physik-Übung * Jahrgangsstufe 8 * Elektrische Widerstände Blatt 1
 Physik-Übung * Jahrgangsstufe 8 * Elektrische Widerstände Blatt 1 Geräte: Netzgerät mit Strom- und Spannungsanzeige, 2 Vielfachmessgeräte, 4 Kabel 20cm, 3 Kabel 10cm, 2Kabel 30cm, 1 Glühlampe 6V/100mA,
Physik-Übung * Jahrgangsstufe 8 * Elektrische Widerstände Blatt 1 Geräte: Netzgerät mit Strom- und Spannungsanzeige, 2 Vielfachmessgeräte, 4 Kabel 20cm, 3 Kabel 10cm, 2Kabel 30cm, 1 Glühlampe 6V/100mA,
LF - Leitfähigkeit / Überführung
 Verfasser: Matthias Ernst, Tobias Schabel Gruppe: A 11 Betreuer: G. Heusel Datum: 18.11.2005 Aufgabenstellung LF - Leitfähigkeit / Überführung 1) Es sind die Leitfähigkeiten von zwei unbekanten Elektrolyten
Verfasser: Matthias Ernst, Tobias Schabel Gruppe: A 11 Betreuer: G. Heusel Datum: 18.11.2005 Aufgabenstellung LF - Leitfähigkeit / Überführung 1) Es sind die Leitfähigkeiten von zwei unbekanten Elektrolyten
Bedienungsanleitung. D103 Fuel Cell Concept Car & Gas Station.
 Bedienungsanleitung D103 Fuel Cell Concept Car & Gas Station www.h-tec.com h-tec Wasserstoff-Energie-Systeme GmbH Lindenstrasse 48a 23558 Lübeck Telefon +49 (0) 451-49 89 5-0 Telefax +49 (0) 451-49 89
Bedienungsanleitung D103 Fuel Cell Concept Car & Gas Station www.h-tec.com h-tec Wasserstoff-Energie-Systeme GmbH Lindenstrasse 48a 23558 Lübeck Telefon +49 (0) 451-49 89 5-0 Telefax +49 (0) 451-49 89
Dr FuelCell Model Car Experimentieranleitung
 Dr FuelCell Model Car Experimentieranleitung www.heliocentris.com. Inhalt Vorwort... 5 2 Zu diesem Dokument... 7 2.1 Die Experimente im Unterricht... 8 2.2 Hinweise und Symbole... 9 2.3 Mitgeltende Unterlagen...
Dr FuelCell Model Car Experimentieranleitung www.heliocentris.com. Inhalt Vorwort... 5 2 Zu diesem Dokument... 7 2.1 Die Experimente im Unterricht... 8 2.2 Hinweise und Symbole... 9 2.3 Mitgeltende Unterlagen...
Inhalt. 1. Erläuterungen zum Versuch 1.1. Aufgabenstellung und physikalischer Hintergrund 1.2. Messmethode und Schaltbild 1.3. Versuchdurchführung
 Versuch Nr. 02: Bestimmung eines Ohmschen Widerstandes nach der Substitutionsmethode Versuchsdurchführung: Donnerstag, 28. Mai 2009 von Sven Köppel / Harald Meixner Protokollant: Harald Meixner Tutor:
Versuch Nr. 02: Bestimmung eines Ohmschen Widerstandes nach der Substitutionsmethode Versuchsdurchführung: Donnerstag, 28. Mai 2009 von Sven Köppel / Harald Meixner Protokollant: Harald Meixner Tutor:
Elektrischer Widerstand
 Dr Angela Fösel & Dipl Phys Tom Michler Revision: 21092018 Abbildung 1: Ohms Drehwage, mit der er den Stromfluss in Drähten messen und daraus ihren Widerstand bestimmen konnte Die elektrische Ladung war
Dr Angela Fösel & Dipl Phys Tom Michler Revision: 21092018 Abbildung 1: Ohms Drehwage, mit der er den Stromfluss in Drähten messen und daraus ihren Widerstand bestimmen konnte Die elektrische Ladung war
Bedienungsanleitung ECO H2/Air
 Bedienungsanleitung 1935 ECO H2/Air H-TEC EDUCATION GmbH Maria-Goeppert-Str. 9a 23562 Lübeck Deutschland Tel: +49 451 39941-0 Fax: +49 451 39941-798 E-Mail: [email protected] Webseite: www.h-tec-education.com
Bedienungsanleitung 1935 ECO H2/Air H-TEC EDUCATION GmbH Maria-Goeppert-Str. 9a 23562 Lübeck Deutschland Tel: +49 451 39941-0 Fax: +49 451 39941-798 E-Mail: [email protected] Webseite: www.h-tec-education.com
Bedienungsanleitung. D101 Exhibition Set.
 Bedienungsanleitung D101 Exhibition Set www.h-tec.com www.h-tec.com Inhalt Einleitung 4 Bestimmungsgemäße Verwendung 5 Allgemeine Sicherheitshinweise 6 Geräte und Material 8 Funktion des Premium Exhibition
Bedienungsanleitung D101 Exhibition Set www.h-tec.com www.h-tec.com Inhalt Einleitung 4 Bestimmungsgemäße Verwendung 5 Allgemeine Sicherheitshinweise 6 Geräte und Material 8 Funktion des Premium Exhibition
LEISTUNGSTEST ELEKTROLYSE-STACK
 LEISTUNGSTEST ELEKTROLYSE-STACK Energetischer und Faradayscher Wirkungsgrad HHO-Generator HG21 Elektrolyse-Stack von Alexander Weis Travelnova TN-S1 Elektrolyse-Stack von Saša Smolčić Dieses Material steht
LEISTUNGSTEST ELEKTROLYSE-STACK Energetischer und Faradayscher Wirkungsgrad HHO-Generator HG21 Elektrolyse-Stack von Alexander Weis Travelnova TN-S1 Elektrolyse-Stack von Saša Smolčić Dieses Material steht
Messung der Leitfähigkeit wässriger Elektrolytlösungen
 Versuch Nr. 10: Messung der Leitfähigkeit wässriger Elektrolytlösungen 1. Ziel des Versuchs In diesem Versuch sollen die Leitfähigkeiten von verschiedenen Elektrolyten in verschiedenen Konzentrationen
Versuch Nr. 10: Messung der Leitfähigkeit wässriger Elektrolytlösungen 1. Ziel des Versuchs In diesem Versuch sollen die Leitfähigkeiten von verschiedenen Elektrolyten in verschiedenen Konzentrationen
Verwandte Begriffe Maxwell-Gleichungen, elektrisches Wirbelfeld, Magnetfeld von Spulen, magnetischer Fluss, induzierte Spannung.
 Verwandte Begriffe Maxwell-Gleichungen, elektrisches Wirbelfeld, Magnetfeld von Spulen, magnetischer Fluss, induzierte Spannung. Prinzip In einer langen Spule wird ein Magnetfeld mit variabler Frequenz
Verwandte Begriffe Maxwell-Gleichungen, elektrisches Wirbelfeld, Magnetfeld von Spulen, magnetischer Fluss, induzierte Spannung. Prinzip In einer langen Spule wird ein Magnetfeld mit variabler Frequenz
PRAKTIKUM DER TECHNISCHEN CHEMIE I PRAKTIKUMSPROTOKOLL. WiSe 2015/2016. Versuch 6. Brennstoffzelle. Rami Saoudi (356563) Guido Petri () Gruppe 29
 PRAKTIKUM DER TECHNISCHEN CHEMIE I PRAKTIKUMSPROTOKOLL WiSe 2015/2016 Versuch 6 Brennstoffzelle Rami Saoudi (356563) Guido Petri () Gruppe 29 1. EINFÜHRUNG Ziel des Versuchs war es die Funktionsweise einer
PRAKTIKUM DER TECHNISCHEN CHEMIE I PRAKTIKUMSPROTOKOLL WiSe 2015/2016 Versuch 6 Brennstoffzelle Rami Saoudi (356563) Guido Petri () Gruppe 29 1. EINFÜHRUNG Ziel des Versuchs war es die Funktionsweise einer
Umgang mit Formeln Was kann ich?
 Umgang mit ormeln Was kann ich? ufgabe 1 (Quelle: DV Ph 010 5) In der Grafik werden einige Messpunkte der I-U- Kennlinie einer elektrischen Energiequelle dargestellt. a) Bei welchem der Messpunkte, B,
Umgang mit ormeln Was kann ich? ufgabe 1 (Quelle: DV Ph 010 5) In der Grafik werden einige Messpunkte der I-U- Kennlinie einer elektrischen Energiequelle dargestellt. a) Bei welchem der Messpunkte, B,
Zersetzung von Wasser LI
 Die Zersetzung von Wasser Zersetzung von Wasser LI Im Folgenden finden sich drei Ansätze zum Experiment Zersetzung von Wasser. Der Versuch eignet sich als Alternative zur Reaktion von Wasserdampf mit Magnesium.
Die Zersetzung von Wasser Zersetzung von Wasser LI Im Folgenden finden sich drei Ansätze zum Experiment Zersetzung von Wasser. Der Versuch eignet sich als Alternative zur Reaktion von Wasserdampf mit Magnesium.
Versuch 5: Zersetzungsspannung
 Gruppe : Christina Sauermann und Johannes Martin 1 Versuch 5: Zersetzungsspannung 1 Darstellung der theoretischen Hintergründe Wird an die beiden Elektroden einer galvanischen Zelle eine Gleichspannung
Gruppe : Christina Sauermann und Johannes Martin 1 Versuch 5: Zersetzungsspannung 1 Darstellung der theoretischen Hintergründe Wird an die beiden Elektroden einer galvanischen Zelle eine Gleichspannung
Versuch: h-bestimmung mit Leuchtdioden
 Lehrer-/Dozentenblatt Gedruckt: 22.08.207 2:35:42 P4800 Versuch: h-bestimmung mit Leuchtdioden Aufgabe und Material Lehrerinformationen Zusätzliche Informationen Das plancksche Wirkungsquantum h ist eine
Lehrer-/Dozentenblatt Gedruckt: 22.08.207 2:35:42 P4800 Versuch: h-bestimmung mit Leuchtdioden Aufgabe und Material Lehrerinformationen Zusätzliche Informationen Das plancksche Wirkungsquantum h ist eine
Selbstlerneinheit Elektrizitätslehre
 Selbstlerneinheit Elektrizitätslehre. Aufgaben zur Wiederholung Aufgabe 1 Skizziere den Schaltplan eines Stromkreises mit (a) einer Batterie als Spannungsquelle und einer Lampe (L) als Verbraucher. (b)
Selbstlerneinheit Elektrizitätslehre. Aufgaben zur Wiederholung Aufgabe 1 Skizziere den Schaltplan eines Stromkreises mit (a) einer Batterie als Spannungsquelle und einer Lampe (L) als Verbraucher. (b)
Die Brennstoffzelle. Inhaltsverzeichnis. 12. November 2014. 1 Was versteht man unter Wasserstofftechnologie? 2
 Die Brennstoffzelle 12. November 2014 Inhaltsverzeichnis 1 Was versteht man unter Wasserstofftechnologie? 2 2 Funktionsprinzipien der Komponenten 3 2.1 Der Elektrolyseur...................................
Die Brennstoffzelle 12. November 2014 Inhaltsverzeichnis 1 Was versteht man unter Wasserstofftechnologie? 2 2 Funktionsprinzipien der Komponenten 3 2.1 Der Elektrolyseur...................................
Brenstoffzelle (BRZ)
 Seite 1 Themengebiet: Thermodynamik 1 Literatur A. Macdonald, M. Berry, Wasserstoff: Energie für morgen, Band 4, Heliocentris, Berlin, 2007 A.J. Bard, L.R. Faulkner, Electrochemical Methods Fundamentals
Seite 1 Themengebiet: Thermodynamik 1 Literatur A. Macdonald, M. Berry, Wasserstoff: Energie für morgen, Band 4, Heliocentris, Berlin, 2007 A.J. Bard, L.R. Faulkner, Electrochemical Methods Fundamentals
Bedienungsanleitung. J101 JUNIOR Basic
 Bedienungsanleitung J101 JUNIOR Basic H-TEC EDUCATION GmbH Maria-Goeppert-Str. 9a 23562 Lübeck Deutschland Tel: +49 451 39941-0 Fax: +49 451 39941-798 E-Mail: [email protected] Webseite: www.h-tec-education.com
Bedienungsanleitung J101 JUNIOR Basic H-TEC EDUCATION GmbH Maria-Goeppert-Str. 9a 23562 Lübeck Deutschland Tel: +49 451 39941-0 Fax: +49 451 39941-798 E-Mail: [email protected] Webseite: www.h-tec-education.com
Physik 4 Praktikum Auswertung Hall-Effekt
 Physik 4 Praktikum Auswertung Hall-Effekt Von J.W., I.G. 2014 Seite 1. Kurzfassung......... 2 2. Theorie.......... 2 2.1. Elektrischer Strom in Halbleitern..... 2 2.2. Hall-Effekt......... 3 3. Durchführung.........
Physik 4 Praktikum Auswertung Hall-Effekt Von J.W., I.G. 2014 Seite 1. Kurzfassung......... 2 2. Theorie.......... 2 2.1. Elektrischer Strom in Halbleitern..... 2 2.2. Hall-Effekt......... 3 3. Durchführung.........
Robert-Bosch-Gymnasium
 Seite - 1 - L-C-Schwingkreis niedriger Frequenz in Meißner-Schaltung 1. Theoretische Grundlagen Eine Parallelschaltung von Kondensator und Spule wirkt, nachdem der Kondensator aufgeladen wurde, als elektromagnetischer
Seite - 1 - L-C-Schwingkreis niedriger Frequenz in Meißner-Schaltung 1. Theoretische Grundlagen Eine Parallelschaltung von Kondensator und Spule wirkt, nachdem der Kondensator aufgeladen wurde, als elektromagnetischer
Grundlagen: Galvanische Zellen:
 E1 : Ionenprodukt des Wassers Grundlagen: Galvanische Zellen: Die Galvanische Zelle ist eine elektrochemische Zelle. In ihr laufen spontan elektrochemische Reaktionen unter Erzeugung von elektrischer Energie
E1 : Ionenprodukt des Wassers Grundlagen: Galvanische Zellen: Die Galvanische Zelle ist eine elektrochemische Zelle. In ihr laufen spontan elektrochemische Reaktionen unter Erzeugung von elektrischer Energie
Aufnahme von Kennlinien eines liniaren Bauelementes
 TFH Berlin Messtechnik Labor Seite1 von 6 Aufnahme von Kennlinien eines liniaren Bauelementes Ort: TFH Berlin Datum: 29.09.03 Uhrzeit: von 8.00h bis 11.30h Dozent: Arbeitsgruppe: Prof. Dr.-Ing. Klaus Metzger
TFH Berlin Messtechnik Labor Seite1 von 6 Aufnahme von Kennlinien eines liniaren Bauelementes Ort: TFH Berlin Datum: 29.09.03 Uhrzeit: von 8.00h bis 11.30h Dozent: Arbeitsgruppe: Prof. Dr.-Ing. Klaus Metzger
Spule, Kondensator und Widerstände
 Spule, Kondensator und Widerstände Schulversuchspraktikum WS 00 / 003 Jetzinger Anamaria Mat.Nr.: 975576 Inhaltsverzeichnis. Vorwissen der Schüler. Lernziele 3. Theoretische Grundlagen 3. Der elektrische
Spule, Kondensator und Widerstände Schulversuchspraktikum WS 00 / 003 Jetzinger Anamaria Mat.Nr.: 975576 Inhaltsverzeichnis. Vorwissen der Schüler. Lernziele 3. Theoretische Grundlagen 3. Der elektrische
Das ohmsche Gesetz (Artikelnr.: P )
 Das ohmsche Gesetz (Artikelnr.: P1381000) Curriculare Themenzuordnung Fachgebiet: Physik Bildungsstufe: Klasse 7-10 Lehrplanthema: Elektrizitätslehre Unterthema: Der elektrische Widerstand Experiment:
Das ohmsche Gesetz (Artikelnr.: P1381000) Curriculare Themenzuordnung Fachgebiet: Physik Bildungsstufe: Klasse 7-10 Lehrplanthema: Elektrizitätslehre Unterthema: Der elektrische Widerstand Experiment:
IIE1. Modul Elektrizitätslehre II. Cavendish-Experiment
 IIE1 Modul Elektrizitätslehre II Cavendish-Experiment Ziel dieses Experiments ist es, dich mit dem Phänomen der elektrischen Influenz vertraut zu machen. Des weiteren sollen Eigenschaften wie Flächenladungsdichte,
IIE1 Modul Elektrizitätslehre II Cavendish-Experiment Ziel dieses Experiments ist es, dich mit dem Phänomen der elektrischen Influenz vertraut zu machen. Des weiteren sollen Eigenschaften wie Flächenladungsdichte,
Experimente Experimente
 Experimente www.fuelcellbox-nrw.de Inhalt 1.1. Zersetzung von Wasser unter Betrachtung des entstehenden Wasserstoff- und Sauerstoff-Gasvolumens 4 1.2. Strom-Spannungs-Kennlinie, Leistungskurve und Wirkungsgrad
Experimente www.fuelcellbox-nrw.de Inhalt 1.1. Zersetzung von Wasser unter Betrachtung des entstehenden Wasserstoff- und Sauerstoff-Gasvolumens 4 1.2. Strom-Spannungs-Kennlinie, Leistungskurve und Wirkungsgrad
Physikalisch-Chemisches Praktikum für Fortgeschrittene V 12. Dynamische Elektrochemie. Brennstoffzelle
 Physikalisch-Chemisches Praktikum für Fortgeschrittene V 12 Dynamische Elektrochemie Brennstoffzelle Kurzbeschreibung: Dieser Versuch befasst sich mit dem Wechselspiel von elektrochemischen Potentialen,
Physikalisch-Chemisches Praktikum für Fortgeschrittene V 12 Dynamische Elektrochemie Brennstoffzelle Kurzbeschreibung: Dieser Versuch befasst sich mit dem Wechselspiel von elektrochemischen Potentialen,
Praktikum Physikalische Chemie I 30. Januar Aktivierungsenergie. Guido Petri Anastasiya Knoch PC111/112, Gruppe 11
 Praktikum Physikalische Chemie I 30. Januar 2016 Aktivierungsenergie Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1 Aufgabenstellung Für die Reaktion von Saccharose mit Wasser zu Glucose und Fructose
Praktikum Physikalische Chemie I 30. Januar 2016 Aktivierungsenergie Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1 Aufgabenstellung Für die Reaktion von Saccharose mit Wasser zu Glucose und Fructose
Wasserstoffgenerator HYDRIFILL PRO
 Wasserstoffgenerator HYDRIFILL PRO 1. Sicherheitshinweise Zerlegen Sie HYDROFILL PRO niemals oder versuchen bei einem Defekt das Gerät nicht in Eigenregie zu reparieren. Halten Sie das Gerät von Flammen,
Wasserstoffgenerator HYDRIFILL PRO 1. Sicherheitshinweise Zerlegen Sie HYDROFILL PRO niemals oder versuchen bei einem Defekt das Gerät nicht in Eigenregie zu reparieren. Halten Sie das Gerät von Flammen,
Physikalisches Praktikum, FH Münster Prof. Dr.H.-Ch.Mertins / Dipl.-Ing. M. Gilbert
 Physikalisches Praktikum, FH Münster Prof. Dr.H.-Ch.Mertins / Dipl.-ng. M. Gilbert 6.08.008 Ohmsches Gesetz & nnenwiderstand ersuch Nr.: E0 (Pr_E_E0_nnenwiderstand) Praktikum: FB 0 Plätze: 3. Ziel n diesem
Physikalisches Praktikum, FH Münster Prof. Dr.H.-Ch.Mertins / Dipl.-ng. M. Gilbert 6.08.008 Ohmsches Gesetz & nnenwiderstand ersuch Nr.: E0 (Pr_E_E0_nnenwiderstand) Praktikum: FB 0 Plätze: 3. Ziel n diesem
Ü b u n g s a r b e i t z. Th. S c h a l t u n g e n
 Ü b u n g s a r b e i t z. Th. S c h a l t u n g e n Aufgabe 1 An der Stromquelle liegt die Spannung 100 V an. Die Einzelwiderstände haben die folgenden Größen: R 1 20 Ω, R 2 30 Ω, R 3 25 Ω, R 4 48 Ω,
Ü b u n g s a r b e i t z. Th. S c h a l t u n g e n Aufgabe 1 An der Stromquelle liegt die Spannung 100 V an. Die Einzelwiderstände haben die folgenden Größen: R 1 20 Ω, R 2 30 Ω, R 3 25 Ω, R 4 48 Ω,
B7 Kondensator, Wasserstoff, Redox-Flow Wir speichern
 B7 Kondensator, Wasserstoff, Redox-Flow Wir speichern regenerative Energie Energiespeicher sind immer dann notwendig, wenn Ort oder Zeitpunkt der Energieerzeugung und der Energienutzung auseinander liegen.
B7 Kondensator, Wasserstoff, Redox-Flow Wir speichern regenerative Energie Energiespeicher sind immer dann notwendig, wenn Ort oder Zeitpunkt der Energieerzeugung und der Energienutzung auseinander liegen.
TU Ilmenau Chemisches Praktikum Versuch Kennlinie der Brennstoffzelle in. Reihenschaltung/Parallelschaltung
 TU Ilmenau Chemisches Praktikum Versuch Kennlinie der Brennstoffzelle in V17 Fachgebiet Chemie Reihenschaltung/Parallelschaltung 1. Aufgabe Bauen Sie die Anordnung nach Bild 1 oder Bild 2 auf. Nehmen Sie
TU Ilmenau Chemisches Praktikum Versuch Kennlinie der Brennstoffzelle in V17 Fachgebiet Chemie Reihenschaltung/Parallelschaltung 1. Aufgabe Bauen Sie die Anordnung nach Bild 1 oder Bild 2 auf. Nehmen Sie
Elektrische Grundlagen der Informationstechnik. Laborprotokoll: Nichtlineare Widerstände
 Fachhochschule für Technik und Wirtschaft Berlin Elektrische Grundlagen der Informationstechnik Laborprotokoll: Nichtlineare Widerstände Mario Apitz, Christian Kötz 2. Januar 21 Inhaltsverzeichnis 1 Vorbeitung...
Fachhochschule für Technik und Wirtschaft Berlin Elektrische Grundlagen der Informationstechnik Laborprotokoll: Nichtlineare Widerstände Mario Apitz, Christian Kötz 2. Januar 21 Inhaltsverzeichnis 1 Vorbeitung...
Praktikum Physikalische Chemie I 26. November Zersetzungsspannung. Guido Petri Anastasiya Knoch PC111/112, Gruppe 11
 Praktikum Physikalische Chemie I 26. November 2015 Zersetzungsspannung Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 Aufgabenstellung Die Zersetzungsspannung von HCl und HI wird mit Hilfe einer Strom-Spannungskurve
Praktikum Physikalische Chemie I 26. November 2015 Zersetzungsspannung Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 Aufgabenstellung Die Zersetzungsspannung von HCl und HI wird mit Hilfe einer Strom-Spannungskurve
Das Ohmsche Gesetz (Artikelnr.: P )
 Lehrer-/Dozentenblatt Gedruckt: 22.08.207 0:42:56 P372400 Das Ohmsche Gesetz (Artikelnr.: P372400) Curriculare Themenzuordnung Fachgebiet: Physik Bildungsstufe: Klasse 7-0 Lehrplanthema: Elektrizitätslehre
Lehrer-/Dozentenblatt Gedruckt: 22.08.207 0:42:56 P372400 Das Ohmsche Gesetz (Artikelnr.: P372400) Curriculare Themenzuordnung Fachgebiet: Physik Bildungsstufe: Klasse 7-0 Lehrplanthema: Elektrizitätslehre
Grundlagen: Die Zersetzung von Ameisensäure in konzentrierter Schwefelsäure verläuft nach folgendem Mechanismus:
 A 35: Zersetzung von Ameisensäure Aufgabe: Für die Zersetzung von Ameisensäure in konzentrierter Schwefelsäure sind die Geschwindigkeitskonstante bei 30 und 40 C sowie der präexponentielle Faktor und die
A 35: Zersetzung von Ameisensäure Aufgabe: Für die Zersetzung von Ameisensäure in konzentrierter Schwefelsäure sind die Geschwindigkeitskonstante bei 30 und 40 C sowie der präexponentielle Faktor und die
Schülerexperiment: Messen elektrischer Größen und Erstellen von Kennlinien
 Schülerexperiment: Messen elektrischer Größen und Erstellen von Kennlinien Stand: 26.08.2015 Jahrgangsstufen 7 Fach/Fächer Natur und Technik/ Schwerpunkt Physik Benötigtes Material Volt- und Amperemeter;
Schülerexperiment: Messen elektrischer Größen und Erstellen von Kennlinien Stand: 26.08.2015 Jahrgangsstufen 7 Fach/Fächer Natur und Technik/ Schwerpunkt Physik Benötigtes Material Volt- und Amperemeter;
Die elektrische Ladung
 Die elektrische Ladung e - p + Die Grundbausteine der Atome (und damit aller Materie) sind Elektronen und Protonen Elektronen besitzen untrennbar eine negative elektrische Ladung von -1,602 10-19 C (Coulomb),d.h.
Die elektrische Ladung e - p + Die Grundbausteine der Atome (und damit aller Materie) sind Elektronen und Protonen Elektronen besitzen untrennbar eine negative elektrische Ladung von -1,602 10-19 C (Coulomb),d.h.
Motorrad umrüsten auf LED Blinker
 Motorrad umrüsten auf LED Blinker Besitzer eines Motorrades stehen vielleicht vor der Entscheidung herkömmliche Blinker mit Glühlampen auf LED (Light Emitting Diode) umzurüsten. Wird bei einem lastabhängigen
Motorrad umrüsten auf LED Blinker Besitzer eines Motorrades stehen vielleicht vor der Entscheidung herkömmliche Blinker mit Glühlampen auf LED (Light Emitting Diode) umzurüsten. Wird bei einem lastabhängigen
Experimente mit Brennstoffzellen - Kennlinienaufnahme
 Experimente mit Brennstoffzellen - Kennlinienaufnahme Ziel dieses Unterrichtsentwurfes ist es, die Funktionsweise von Brennstoffzellen näher kennen zu lernen. Die Strom-Spannungs-Kennlinie eines Elektrolyseurs
Experimente mit Brennstoffzellen - Kennlinienaufnahme Ziel dieses Unterrichtsentwurfes ist es, die Funktionsweise von Brennstoffzellen näher kennen zu lernen. Die Strom-Spannungs-Kennlinie eines Elektrolyseurs
Gefahrenstoffe H:
 V1 Verseifungsgeschwindigkeit eines Esters In diesem Versuch wird die Reaktionsgeschwindigkeit quantitativ ermittelt. Da dies anhand einer Verseifung eines Esters geschieht, sollten die Schülerinnen und
V1 Verseifungsgeschwindigkeit eines Esters In diesem Versuch wird die Reaktionsgeschwindigkeit quantitativ ermittelt. Da dies anhand einer Verseifung eines Esters geschieht, sollten die Schülerinnen und
Der spezifische Widerstand von Drähten (Artikelnr.: P )
 Lehrer-/Dozentenblatt Der spezifische Widerstand von Drähten (Artikelnr.: P1372700) Curriculare Themenzuordnung Fachgebiet: Physik Bildungsstufe: Klasse 7-10 Lehrplanthema: Elektrizitätslehre Unterthema:
Lehrer-/Dozentenblatt Der spezifische Widerstand von Drähten (Artikelnr.: P1372700) Curriculare Themenzuordnung Fachgebiet: Physik Bildungsstufe: Klasse 7-10 Lehrplanthema: Elektrizitätslehre Unterthema:
E-Labor im WS / SS. Gruppe: BITTE ANKREUZEN. Messprotokoll Versuchsbericht. Datum der Durchführung:
 Abteilung Maschinenbau im WS / SS ersuch Gruppe: Name orname Matr.-Nr. Semester erfasser(in) Teilnehmer(in) Teilnehmer(in) Professor(in) / Lehrbeauftragte(r): BITTE ANKEZEN Messprotokoll ersuchsbericht
Abteilung Maschinenbau im WS / SS ersuch Gruppe: Name orname Matr.-Nr. Semester erfasser(in) Teilnehmer(in) Teilnehmer(in) Professor(in) / Lehrbeauftragte(r): BITTE ANKEZEN Messprotokoll ersuchsbericht
GALVANISCHE ELEMENTE, BATTERIEN UND BRENNSTOFFZELLEN
 10. Einheit: GALVANISCHE ELEMENTE, BATTERIEN UND BRENNSTOFFZELLEN Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 17 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Galvanische Elemente, Batterien und
10. Einheit: GALVANISCHE ELEMENTE, BATTERIEN UND BRENNSTOFFZELLEN Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 17 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Galvanische Elemente, Batterien und
PEM-Brennstoffzelle Betriebsanleitung. 1 auf der Rückseite auf der 6. Rückseite
 R PEM-Brennstoffzelle Betriebsanleitung 3 1 auf der Rückseite 5 4 2 auf der 6 Rückseite Fig. 1: PEM-Brennstoffzelle 1 ZWECK UND BESCHREIBUNG Eine PEM-Brennstoffzelle erzeugt elektrische Energie aus Wasserstoff
R PEM-Brennstoffzelle Betriebsanleitung 3 1 auf der Rückseite 5 4 2 auf der 6 Rückseite Fig. 1: PEM-Brennstoffzelle 1 ZWECK UND BESCHREIBUNG Eine PEM-Brennstoffzelle erzeugt elektrische Energie aus Wasserstoff
Schülerexperimente mit Solarzellen
 Elektrodynamik: D. 7. 8 Schülerexperimente mit Solarzellen Die Schüler werden in 4 bzw. 8 Kleingruppen (ca. 3 4 Schüler pro Gruppe) eingeteilt. Jede Kleingruppe wird einem der Experimente zugeteilt, die
Elektrodynamik: D. 7. 8 Schülerexperimente mit Solarzellen Die Schüler werden in 4 bzw. 8 Kleingruppen (ca. 3 4 Schüler pro Gruppe) eingeteilt. Jede Kleingruppe wird einem der Experimente zugeteilt, die
ACHTUNG! Nur zum Gebrauch für Kinder über
 P ROFI FUEL CELL KIT BEDIENUNGSANLEITUNG D ACHTUNG! Nur zum Gebrauch für Kinder über 10 Jahren. Benutzung nur unter der genauen Aufsicht von Erwachsenen, die sich mit den im Experimentierkasten beschriebenen
P ROFI FUEL CELL KIT BEDIENUNGSANLEITUNG D ACHTUNG! Nur zum Gebrauch für Kinder über 10 Jahren. Benutzung nur unter der genauen Aufsicht von Erwachsenen, die sich mit den im Experimentierkasten beschriebenen
IIE3. Modul Elektrizitätslehre II. Faraday-Konstante
 IIE3 Modul Elektrizitätslehre II Faraday-Konstante Bei diesem Versuch soll mit Hilfe eines Coulombmeters die FARADAY- Konstante bestimmt werden. Das Coulombmeter besteht aus drei Kupferelektroden die in
IIE3 Modul Elektrizitätslehre II Faraday-Konstante Bei diesem Versuch soll mit Hilfe eines Coulombmeters die FARADAY- Konstante bestimmt werden. Das Coulombmeter besteht aus drei Kupferelektroden die in
Praktikumsprotokoll. Grundlagen der Chemie Teil II SS Praktikum vom
 Grundlagen der Chemie Teil II SS 2002 Praktikumsprotokoll Praktikum vom 02.05.2002 Versuch 11: Herstellung einer Pufferlösung von definiertem ph Versuch 12: Sauer und alkalisch reagierende Salzlösungen
Grundlagen der Chemie Teil II SS 2002 Praktikumsprotokoll Praktikum vom 02.05.2002 Versuch 11: Herstellung einer Pufferlösung von definiertem ph Versuch 12: Sauer und alkalisch reagierende Salzlösungen
Inhaltsverzeichnis. 1 Einführung Versuchsbeschreibung und Motivation Physikalische Grundlagen... 3
 Inhaltsverzeichnis 1 Einführung 3 1.1 Versuchsbeschreibung und Motivation............................... 3 1.2 Physikalische Grundlagen...................................... 3 2 Messwerte und Auswertung
Inhaltsverzeichnis 1 Einführung 3 1.1 Versuchsbeschreibung und Motivation............................... 3 1.2 Physikalische Grundlagen...................................... 3 2 Messwerte und Auswertung
Elektrizitätslehre. Elektrolyse. Ladungstransport und Strom BESTIMMUNG DER FARADAY-KONSTANTE. ALLGEMEINE GRUNDLAGEN
 Elektrizitätslehre Ladungstransport und Strom Elektrolyse BESTIMMUNG DER FARADAY-KONSTANTE. Erzeugung von Wasserstoff durch Elektrolyse und Messung des Wasserstoffvolumens V. Bestimmung der Ladung Q aus
Elektrizitätslehre Ladungstransport und Strom Elektrolyse BESTIMMUNG DER FARADAY-KONSTANTE. Erzeugung von Wasserstoff durch Elektrolyse und Messung des Wasserstoffvolumens V. Bestimmung der Ladung Q aus
