Apremilast. Indikation. Empfehlungen zur wirtschaftlichen Verordnungsweise. Plaque-Psoriasis. Psoriasis-Arthritis
|
|
|
- Anneliese Kolbe
- vor 7 Jahren
- Abrufe
Transkript
1 Ausgabe 4/2016 Wirkstoff Aktuell Eine Information der kbv im rahmen des 73 (8) sgb v in zusammenarbeit mit der arzneimittelkommission der deutschen ärzteschaft online unter: Plaque-Psoriasis Patienten mit Plaque-Psoriasis stehen nach Versagen einer topischen Behandlung und puva (Psoralen und UVA-Licht) systemische Immunsuppressiva zur Verfügung. Als Wirkstoffe für die systemische Therapie kommen zunächst Ciclosporin, Methotrexat oder Fumarsäureester infrage. Ohne ausreichenden Therapieerfolg, bei Unverträglichkeiten oder Kontraindikationen für die konventionellen systemischen Therapien ist eine Behandlung mit biologischen Immuntherapeutika (Tumornekrosefaktor-alpha(TNF-α)-Antagonisten, Ustekinumab, Secukinumab) indiziert. kann eine Alternative sein. Valide Daten für einen direkten Vergleich mit biologischen Immuntherapeutika liegen aber bisher nicht vor. Psoriasis-Arthritis Die symptomatische Therapie der Psoriasis-Arthritis erfolgt in Anlehnung an die Therapie der rheumatoiden Arthritis initial mit nichtsteroidalen Antirheumatika (NSAR). Wenn der Einsatz von NSAR keinen ausreichenden Erfolg zeigt, ist bei zunehmender Krankheitsaktivität und schlechter Prognose eine Behandlung mit nicht-biologischen DMARDs (Disease Modifying Antirheumatic Drugs) indiziert. kann bei Unverträglichkeiten oder unzureichendem Ansprechen von nicht-biologischen DMARDs eingesetzt werden. TNF-α-Antagonisten, Secukinumab oder Ustekinumab können bei Patienten, die trotz eines nicht-biologischen DMARD weiterhin eine hohe Krankheitsaktivität aufweisen, eine Alternative sein. Indikation Plaque-Psoriasis Zur Behandlung der mittelschweren bis schweren chronischen Plaque-Psoriasis bei erwachsenen Patienten, die auf eine andere systemische Therapie, wie Ciclosporin oder Methotrexat oder Psoralen in Kombination mit UVA-Licht (PUVA), nicht angesprochen haben oder bei denen eine solche Therapie kontraindiziert ist oder die diese nicht vertragen haben. Psoriasis-Arthritis Allein oder in Kombination mit krankheitsmodifizierenden antirheumatischen Arzneimitteln (DMARDs) zur Behandlung der aktiven Psoriasis- Arthritis (PsA) bei erwachsenen Patienten, die auf eine vorangegangene DMARD-Therapie unzureichend angesprochen oder diese nicht vertragen haben. Allgemein Empfehlungen zur wirtschaftlichen Verordnungsweise bei Patienten mit Plaque-Psoriasis und Psoriasis- Arthritis sollte die Wahl des systemischen Immuntherapeutikums in Abstimmung mit einem Rheumatologen erfolgen. die Anwendung von biologischen systemischen Immuntherapeutika sollte von Ärzten mit Erfahrung in der Behandlung der Psoriasis bzw. Psoriasis-Arthritis eingeleitet und überwacht werden. Plaque-Psoriasis (1-9) vor dem Einsatz biologischer systemischer Immuntherapeutika ist das erhöhte Infektions- und Tumorrisiko zu berücksichtigen und mit dem Patienten zu erörtern. Eine systemische Therapie der mittelschweren bis schweren Plaque-Psoriasis ist ab einem PASI (Psoriasis Area and Severity Index) und/oder DLQI (Dermatology Life Quality Index) > 10 bzw. einem
2 Befall von > 10 % der Körperoberfläche (KOF) indiziert. Therapieziel ist die bestmögliche Reduktion der Symptomatik und Steigerung der Lebensqualität (DLQI), wobei eine nachhaltige Wirkung bei akzeptablem Verträglichkeitsprofil und einer guten Anwendbarkeit angestrebt wird. vor Beginn einer systemischen Therapie sollten der Impfstatus überprüft und (latente) chronische Infektionen (HIV, Hepatitis B und C, Tuberkulose) mittels Screening-Tests ausgeschlossen werden. Vor und während der Behandlung mit Fumarsäureestern sind Blutbildkontrollen durchzuführen, um das mögliche Risiko einer schweren anhaltenden Lymphopenie zu minimieren. Patienten mit schweren anhaltenden Lymphopenien haben ein potenzielles Risiko für opportunistische Infektionen (u. a. progressive multifokale Leukenzephalopathie) (10). bei einem Einstieg in die systemische Therapie sollten initial konventionelle systemische Immuntherapeutika eingesetzt werden. Dazu gehören die Immunsuppressiva Ciclosporin, Fumarsäureester und Methotrexat. Zusätzlich zu der systemischen Therapie ist eine Kombination mit einer topischen Therapie erforderlich. ciclosporin und Methotrexat sind Mittel der Wahl, insbesondere wenn ein rascher Wirkeintritt notwendig ist oder wenn das Ansprechen und die Wirksamkeit unter Fumarsäureester unbefriedigend sind. Bei Nichtansprechen kann ein Wechsel von Ciclosporin auf Methotrexat und umgekehrt eine Therapieoption sein. Fumarsäureester eignen sich insbesondere für die Langzeittherapie, das pasi-75-ansprechen (eine mindestens 75-prozentige Reduktion des PASI-Wertes) beträgt nach 16 Wochen %. ciclosporin sollte möglichst nur intermediär zur akuten Intervention für maximal drei bis sechs Monate eingesetzt werden. Bei einer Langzeittherapie, spätestens nach ein bis zwei Jahren, ist vor allem wegen der Nephrotoxizität und der Blutdruckerhöhung und eines erhöhten Malignomrisikos, das bei allen systemischen Immunsuppressiva besteht, die Indikation zur Fortsetzung der Therapie kritisch zu überprüfen. vor einer Behandlung mit Methotrexat ist der Patient über die potenziellen hepatotoxischen Risiken (Transaminasenanstieg, Leberfibrose) aufzuklären. Regelmäßige Leberfunktionstest sind durchzuführen und der Patient ist hinsichtlich weiterer Risiken (Übergewicht, Alkoholabusus, Diabetes mellitus) zu überwachen. retinoide in niedriger Dosierung werden als Monotherapie bei Plaque-Psoriasis aufgrund mangelnder Wirksamkeit nicht empfohlen. orale Kortikosteroide sollten nicht zur Therapie der Psoriasis eingesetzt werden. Sie können die Hauterscheinungen einer Psoriasis zwar bessern, jedoch nach Dosisreduktion oder nach Ende der Behandlung zu einer Verschlechterung der dermatologischen Symptome führen. nach Ausschöpfen der konventionellen systemischen Therapieoptionen ohne ausreichenden Therapieerfolg oder bei Unverträglichkeiten oder Kontraindikationen für die konventionellen systemischen Therapien ist eine Behandlung mit biologischen systemischen Immuntherapeutika indiziert. Bei der Beurteilung des Therapieansprechens ist die unterschiedliche Dauer der Induktionsphase (12 16 Wochen) zu beachten. Wird nach der Induktionsphase keine mindestens 50-prozentige Reduktion des PASI-Scores erreicht, sollte eine individuelle Therapieoptimierung stattfinden. als biologische systemische Immuntherapeutika können die zur Behandlung der Psoriasis zugelassenen TNF-α-Antagonisten (Adalimumab, Etanercept, Infliximab) oder Interleukin-Inhibitoren (Secukinumab, Ustekinumab) eingesetzt werden. Die Wirksamkeit von Etanercept ist in der Induktionsphase hinsichtlich der mittleren Ansprechrate geringer. Alternativ kann Ustekinumab eingesetzt werden. Die Sicherheitshinweise zu Ustekinumab (Auftreten einer exfoliativen Dermatitis (Erythrodermie) und Exfoliation der Haut) sind zu beachten (11). Adalimumab und Secukinumab sind auch für eine First-line-Therapie zugelassen. bei nicht ausreichendem Therapieerfolg mit einem biologischen systemischen Immuntherapeutikum ist eine Umstellung auf ein anderes Biologikum in Erwägung zu ziehen. Im Rahmen der frühen Nutzenbewertung nach 35a SGB V zeigte Secukinumab gegenüber der jeweiligen zweckmäßigen Vergleichstherapie (zvt) für die Teilpopulation A (erwachsene Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis, die für eine systemische und/oder Phototherapie geeignet sind) keinen Zusatznutzen und für die Teilpopulation B (er-
3 wachsene Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis, die auf andere systemische Therapien einschließlich Ciclosporin, Methotrexat oder PUVA nur unzureichend angesprochen haben oder bei denen eine Kontraindikation oder Unverträglichkeit vorliegt) einen Hinweis auf einen beträchtlichen Zusatznutzen bei Patienten mit Biologika-Vorbehandlung und einen Hinweis auf einen geringen Zusatznutzen bei Patienten ohne Biologika-Vorbehandlung (12;13). apremilast kann zu den biologischen systemischen Immuntherapeutika eine therapeutische Alternative sein. sollte der Zulassung entsprechend aber nur dann eingesetzt werden, wenn die Patienten auf Ciclosporin oder Methotrexat oder PUVA nicht angesprochen haben oder eine solche Therapie kontraindiziert ist oder die Patienten diese nicht vertragen haben. valide Daten für einen direkten Vergleich liegen aber bisher nicht vor. Im Rahmen der frühen Nutzenbewertung ( 35a SGB V) von wurden Adalimumab, Infliximab oder Ustekinumab als zvt festgelegt. Für diese Indikation lagen nur placebokontrollierte Studien sowie eine Studie gegenüber Etanercept vor. Etanercept wurde jedoch wegen der geringeren Wirksamkeit im Vergleich zu Adalimumab, Infliximab und Ustekinumab nicht als zvt festgelegt. Zudem hat der pharmazeutische Unternehmer auch für dieses Anwendungsgebiet keinen indirekten Vergleich gegenüber der zvt durchgeführt. Der Zusatznutzen ist damit laut Beschluss des Gemeinsamen Bundesausschusses (G-BA) nicht belegt (14;15). Psoriasis-Arthritis (8;14;16-18) die Therapie der Gelenkmanifestationen orientiert sich an den Regeln für die Behandlung der rheumatoiden Arthritis bzw. der Spondylitis ankylosans. Variationen ergeben sich durch die außerordentlich unterschiedlichen Verläufe der Erkrankung sowie durch die Möglichkeit, dass Therapien die Hautsymptome verschlechtern können und dass aggressivere Behandlungsmethoden sowohl Haut- als auch Gelenksymptome beeinflussen. die symptomatische Therapie der Psoriasis-Arthritis erfolgt in Anlehnung an die Therapie der rheumatoiden Arthritis initial mit NSAR. Diese zeigen zwar einen Nutzen hinsichtlich muskuloskelettaler Symptome, auf die Hautläsionen haben sie allerdings kaum einen Einfluss. Ihre Gabe sollte auch aufgrund der kardiovaskulären und gastrointestinalen Risiken auf eine kurze Behandlungsdauer beschränkt bleiben. Wenn der Einsatz von NSAR keinen ausreichenden Erfolg zeigt, ist bei zunehmender Krankheitsaktivität (u. a. schmerzempfindliche Gelenke, Enthesitis) und schlechter Prognose (u. a. fortschreitende Gelenkzerstörung, radiologische Progression) eine Behandlung mit nicht-biologischen DMARDs indiziert: mit der Gabe von Methotrexat kann bei Patienten mit Psoriasis-Arthritis eine Verbesserung der Gelenk- und Hautsymptomatik erreicht werden. Leflunomid zeigt ebenfalls eine Wirksamkeit auf die Polyarthritis und die Psoriasis-Arthritis. lokale Injektionen von Kortikosteroiden können ergänzend verabreicht werden. biologische systemische Immuntherapeutika (TNF-α-Antagonisten (Etanercept, Infliximab, Adalimumab, Golimumab) oder Interleukin- Inhibitoren (Ustekinumab oder Secukinumab)) können bei Patienten, die trotz eines nicht-biologischen DMARD weiterhin eine hohe Krankheitsaktivität aufweisen, eine Alternative sein. Es liegt keine Evidenz für die Überlegenheit eines TNF-α-Antagonisten gegenüber einem anderen oder gegenüber einem Interleukin-Inhibitor oder umgekehrt vor. Im Rahmen der frühen Nutzenbewertung nach 35a SGB V ist ein Zusatznutzen von Secukinumab gegenüber der zvt (TNF-α- Antagonisten) nicht belegt (19;20). apremilast sollte entsprechend der Zulassung nur bei Unverträglichkeiten oder unzureichendem Ansprechen einer DMARD-Therapie eingesetzt werden. Im Rahmen der frühen Nutzenbewertung ( 35a SGB V) von wurde als zvt ein TNF-α-Antagonist (Etanercept, Adalimumab, Infliximab oder Golimumab) ggf. in Kombination mit Methotrexat bestimmt. Als Zulassungsstudien lagen nur placebokontrollierte Studien und damit keine Studien gegenüber der zvt vor. Auch die europäische Zulassungsbehörde kritisierte, dass keine direkt vergleichenden Studien existieren. Darüber hinaus führte der pharmazeutische Unternehmer in seinem Dossier keinen indirekten Vergleich durch. Der Zusatznutzen von in der genannten Indikation ist damit laut Beschluss des G-BA nicht belegt (14;15).
4 Kosten Wirkstoff Prednisolon Präparat Otezla 30 mg Filmtabletten Generikum 10 mg, 20 mg Tabletten PDE-4-Hemmer Kortikosteroid TNF-α-Antagonisten DDD-Angaben (mg) 1 Dosis 2,3 Kosten für 1 Jahr [ ] 4,5,6, mg / Tag p.o , , mg / Tag p.o. 54,31 134,47 Adalimumab Humira 40 mg Injektionslösung im Fertigpen/in Fertigspritze 2, mg / 2 Wochen s.c ,50 9 Certolizumab Pegol Etanercept Cimzia 200 mg Injektionslösung in 200 mg / 2 Wochen 14 Fertigspritze s.c. Enbrel 25 mg Injektionslösung in Fertigspritze , mg / Woche s.c ,01 9 Etanercept Biosimilar (Benepali ), 50 mg Injektionslösung in Fertigspritze/im Fertigpen mg / Woche s.c ,37 Golimumab Simponi 50 mg Injektionslösung in Fertigspritze 11 1, mg / Monat s.c ,36 9 Infliximab Remicade 100 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung 3, mg / kg / 8 Wochen i.v ,15 9,12,13 Infliximab Secukinumab Ustekinumab Ciclosporin Leflunomid Methotrexat Biosimilar (Inflectra ), 100 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung Cosentyx 150 mg Injektionslösung im Fertigpen Stelara 45 mg Injektionslösung in Fertigspritze Interleukin-Inhibitoren 3, mg / kg / 8 Wochen i.v Calcineurin-Inhibitor 150 mg / Monat s.c mg / Monat s.c. 15 0, mg / 12 Wochen 16 s.c. Generikum 100 mg Weichkapseln ,10 2,5 mg / kg / Tag p.o. Antimetabolite Generikum 20 mg Filmtabletten mg / Tag p.o. Lantarel 7,5 mg 15 mg / Woche 2,5 Tabletten 8 18 p.o ,05 9,12, , , , , ,27 86,63 Methotrexat Generikum 15 mg Injektionslösung in Fertigspritze 15 mg / Woche s.c./i.m./i.v. 726,87 Sonstige Fumarsäureester Fumaderm (120/87/5/3 mg), magensaftresistente Tabletten 17 6 x 120/87/5/3 mg / Tag p.o. ( 3 x 2 Tabletten / Tag) 5984,39
5 Stand Lauertaxe: Nach (21); 2 Dosierung für Erhaltungstherapie gemäß Fachinformation (FI); 3 die Dosierungen für die Induktions-/Aufsättigungs-/Testdosis sind für die jeweiligen Indikationsgebiete den FI zu entnehmen; 4 Kostenberechnung bezogen auf die Tagesdosis der FI anhand des kostengünstigsten Präparates einschließlich Import; gesetzliche Pflichtrabatte der Apotheken und pharmazeutischen Unternehmen wurden berücksichtigt; 5 bei Erhaltungstherapie können Kosten für die Induktions-/Aufsättigungs-/Testdosis hinzukommen; 6 Kosten für Begleittherapien wurden nicht berücksichtigt; 7 zur besseren Vergleichbarkeit der Kosten wurden Therapiekosten für ein Jahr berechnet, das jedoch nicht die tatsächliche Therapiedauer wiederspiegelt, die jeweilige Therapiedauer ist der FI zu entnehmen; 8 oral; 9 preisgünstiger Import; 10 parenteral; 11 nur für Indikation Psoriasis-Arthritis zugelassen; 12 Berechnung für eine 70 kg schwere Person; 13 Kosten für Spritzen, Nadeln und Infusionsbesteck nicht enthalten; 14 Patienten mit Psoriasis-Arthritis; 15 Patienten mit Plaque-Psoriasis sowie Patienten mit Psoriasis- Arthritis mit gleichzeitiger mittelschwerer bis schwerer Plaque-Psoriasis oder unzureichendem Ansprechen auf TNF-α-Inhibitoren; 16 Dosis für Patienten 100 kg; Patienten > 100 kg: 90 mg / 12 Wochen; 17 nur für Indikation Psoriasis zugelassen; 18 teurere Generika vorhanden. Neben den dargestellten Wirkstärken/Darreichungsformen stehen noch weitere zur Verfügung. Weitere Angaben zu Dosierungen/Dosierungsschemata sind den Fachinformationen zu entnehmen. Die Kostendarstellung erhebt keinen Anspruch auf Vollständigkeit. Wirkungsweise (8) ist ein oraler Phosphodiesterase- 4(PDE-4)-Inhibitor und wirkt intrazellulär durch Modulation eines Netzwerks pro- und antiinflammatorischer Mediatoren. PDE 4 ist eine für zyklisches Adenosinmonophosphat (camp) spezifische und in Entzündungszellen dominante PDE. Durch PDE- 4-Hemmung werden die intrazellulären camp- Spiegel angehoben. Dies führt durch Modulation der Expression von TNF-α, IL-23, IL-17 und anderen inflammatorischen Zytokinen zur Downregulation der Entzündungsreaktion. Zyklisches AMP moduliert zudem die Konzentrationen antiinflammatorischer Zytokine wie IL-10. Es wird angenommen, dass diese pro- und antiinflammatorischen Mediatoren am Krankheitsgeschehen der Psoriasis und der Psoriasis-Arthritis beteiligt sind. Wirksamkeit (8) Plaque-Psoriasis In der Indikation Plaque-Psoriasis ist in zwei Doppelblindstudien (ESTEEM 1 und 2) im Vergleich zu untersucht worden. An diesen Studien nahmen insgesamt 1257 Personen mit Psoriasis, die für eine Phototherapie oder eine systemische Behandlung geeignet erschienen, teil. Primärer Endpunkt dieser Studien war eine mindestens 75-prozentige Reduktion des PASI-Wertes (PASI-75) nach 16 Wochen Behandlung. Dieser wurde unter signifikant häufiger erreicht (s. Tabelle 1). Tabelle 1 Studienergebnisse Studie ESTEEM 1 ESTEEM 2 30 mg 30 mg n PASI-75 5,3 % (15/282) 1 p < 0,0001 für alle Vergleiche versus 33,1 % 1 (186/562) 5,8 % (8/137) 28,8 % 1 (79/274) Psoriasis-Arthritis In der Indikation Psoriasis-Arthritis wurden drei placebokontrollierte Doppelblindstudien (PALACE 1, 2, 3) bei Personen mit einer aktiven Psoriasis-Arthritis durchgeführt. Erwachsene, die trotz vorausgehender Therapie mit nicht-biologischen oder biologischen DMARDs mindestens drei geschwollene und mindestens drei schmerzhafte Gelenke hatten, wurden in die Studien eingeschlossen. Insgesamt 1493 Patienten erhielten für 24 Wochen (2 x 20 mg oder 2 x 30 mg) oder zusätzlich zu ihrer bisherigen Behandlung. Primärer Endpunkt war die Zahl der Patienten, die nach 16 Wochen eine mindestens 20-prozentige Besserung ihrer Gelenksymptome (ACR 20) hatten. Dieser Endpunkt wurde unter signifikant häufiger als unter erreicht. Der Unterschied zwischen den beiden -Dosierungen war nicht signifikant (s. Tabelle 2).
6 Tabelle 2 Studienergebnisse Studie PALACE 1 PALACE 2 PALACE 3 20 mg 30 mg 20 mg 30 mg 20 mg 30 mg n ACR 20 1 Woche 16 19,0 % (32/168) 30,4 % (51/168) 38,1 % (64/168) 18,9 % (30/159) 37,4 % (61/163) 32,1 % (52/162) 18,3 % (31/169) 28,4 % (48/169) 40,7 % (68/167) p-wert vs. 0,0166 0,001 0,0002 0,006 0,0295 < 0, Kriterien des American College of Rheumatology (ACR) für den Krankheitsverlauf der Psoriasis-Arthritis Nebenwirkungen, Risiken und Vorsichtsmaßnahmen 1 Kontraindikationen Überempfindlichkeit gegen den Wirkstoff oder einen der Bestandteile des Fertigarzneimittels Schwangerschaft Warnhinweise und Vorsichtsmaßnahmen Patienten mit der seltenen hereditären Galaktose-Intoleranz, Laktase-Mangel oder Glukose- Galaktose-Malabsorption sollten dieses Arzneimittel nicht einnehmen. Bei Patienten mit stark eingeschränkter Nierenfunktion sollte die Dosis von auf 30 mg einmal täglich reduziert werden. Bei zu Beginn der Behandlung untergewichtigen Patienten sollte das Körpergewicht regelmäßig kontrolliert werden. Bei ungeklärtem und klinisch relevantem Gewichtsverlust sollte bei diesen Patienten eine ärztliche Abklärung erfolgen und das Absetzen der Behandlung erwogen werden. Wechselwirkungen Die -Exposition nimmt bei gleichzeitiger Anwendung mit starken CYP3A4-Induktoren (z. B. Rifampicin) ab und kann zu einem geringeren klinischen Ansprechen führen. Zwischen Ketoconazol und besteht keine klinisch bedeutsame Arzneimittelwechselwirkung: kann zusammen mit einem potenten CYP3A4-Inhibitor wie Ketoconazol angewendet werden. Bei Patienten mit Psoriasis-Arthritis besteht zwischen und Methotrexat keine pharmakokinetische Arzneimittelwechselwirkung: kann zusammen mit Methotrexat angewendet werden. Zwischen und oralen Kontrazeptiva, welche Ethinylestradiol und Norgestimat enthalten, besteht keine pharmakokinetische Arzneimittelwechselwirkung: kann zusammen mit oralen Kontrazeptiva angewendet werden. Nebenwirkungen 2 sehr häufig ( 1/10) Diarrhoe, Übelkeit häufig ( 1/100, < 1/10) gelegentlich ( 1/1000, < 1/100) Bronchitis, Infektion der oberen Atemwege, Nasopharyngitis, verminderter Appetit, Schlaflosigkeit, Migräne, Spannungskopfschmerz, Kopfschmerz, Husten, Erbrechen, Dyspepsie, häufiger Stuhlgang, Oberbauchschmerzen, gastroösophageale Refluxkrankheit, Rückenschmerzen, Fatigue Überempfindlichkeit, Hautausschlag, Gewichtsverlust 1 Die Informationen zu Nebenwirkungen, Risiken und Vorsichtsmaßnahmen erheben keinen Anspruch auf Vollständigkeit. Weitere Informationen sind der Fachinformation zu entnehmen. Aktuelle Warnhinweise wie z. B. Rote-Hand-Briefe sind zu beachten. 2 Fettgedruckte Nebenwirkungen: im Rahmen des Zulassungsverfahrens identifizierte Risiken (Evidenz für Zusammenhang zwischen Arzneimittel und Bestehen eines Risikos liegt vor) (8).
7 Hinweise zu besonderen Patientengruppen Ältere Patienten Kinder und Jugendliche Patienten mit eingeschränkter Nierenfunktion Patienten mit eingeschränkter Leberfunktion Fertilität, Schwangerschaft und Stillzeit Keine Dosisanpassung erforderlich. Für Kinder und Jugendliche nicht zugelassen. Bei Patienten mit leicht und mäßig eingeschränkter Nierenfunktion ist keine Dosisanpassung erforderlich. Bei Patienten mit stark eingeschränkter Nierenfunktion (Kreatinin-Clearance < 30 ml/min, geschätzt nach der Cockroft-Gault-Formel) sollte die Dosis von auf 30 mg einmal täglich reduziert werden. Für die initiale Dosistitration wird in dieser Patientengruppe empfohlen, nur mit dem in Tabelle 1 der Fachinformation angegebenen Schema für morgens zu titrieren und die Abenddosen auszulassen. Keine Dosisanpassung erforderlich. Bevor mit der Behandlung begonnen werden kann, ist eine Schwangerschaft auszuschließen. Frauen im gebärfähigen Alter müssen eine zuverlässige Verhütungsmethode anwenden, um während der Behandlung eine Schwangerschaft zu verhindern. Kontraindiziert in der Schwangerschaft. Keine Anwendung während der Stillzeit. Sie finden das Fortbildungsportal der KBV im sicheren Netz der Kassenärztlichen Vereinigungen. Sollten Sie dafür noch keinen Anschluss haben, wenden Sie sich bitte an Ihre KV. Nähere Informationen finden Sie auch online unter
8 1. Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften: S-3 Leitlinie: Leitlinie zur Therapie der Psoriasis vulgaris: AWMF-Leitlinien-Register Nr 013/001; Stand: Zuletzt geprüft: 23. September von Kiedrowski R, Dirschka T, Kirchesch H et al.: Psoriasis vulgaris ein praxisnaher Behandlungspfad. Der Deutsche Dermatologe 2011; Heft 9: Pathirana D, Ormerod AD, Saiag P et al.: European S3-guidelines on the systemic treatment of psoriasis vulgaris. J Eur Acad Dermatol Venereol 2009; 23 Suppl 2: Müller S, Ivanova K, Itin P, Häusermann P: Therapie der Plaque- Psoriasis, Teil 2. Schweiz Med Forum 2013; 13(7): Müller S, Ivanova K, Itin P, Häusermann P: Therapie der Plaque- Psoriasis, Teil 1. Schweiz Med Forum 2013; 13(6): National Institute for Health and Clinical Excellence: Psoriasis: assessment and management: guidance/cg153/resources/psoriasis-assessment-andmanagement NICE clinical guideline 153. Published 24 October Zuletzt geprüft: 23. September Scottish Medicines Consortium: (Otezla ) - Plaque Psoriasis: apremilast Otezla plaque_psoriasis_final_may_2015_ REVISED_010615_for_website.pdf. Date Advice Published: Zuletzt geprüft: 23. September EMA: Otezla European Public Assessment Report (EPAR): EPAR_-_Public_assessment_report/human/003746/ WC pdf. Stand: 20 November Zuletzt geprüft: 23. September Canadian Agency for Drugs and Technologies in Health: CADTH Common Drug Review - CDEC Final Recommendation APREMILAST (Otezla Celgene) Indication: Moderate to Severe Plaque Psoriasis: cdr/complete/sr0400-otezla-aug e.pdf. Notice of final recommendation. July 22, Zuletzt geprüft: 23. September Arzneimittelkommission der deutschen Ärzteschaft: Rote-Hand- Brief zu Fumaderm initial / Fumaderm (Fumarsäurederivate): Vermeidung des Risikos opportunistischer Infektionen: html. AkdÄ Drug Safety Mail vom 26. Juni Arzneimittelkommission der deutschen Ärzteschaft: Rote-Hand- Brief zu Stelara : DSM/Archiv/ html. AkdÄ Drug Safety vom 21. November Kassenärztliche Bundesvereinigung (KBV): Frühe Nutzenbewertung Secukinumab Plaque Psoriasis: html/17903.php. Zuletzt geprüft: 23. September Literatur 13. Gemeinsamer Bundesausschuss (G-BA): Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V Secukinumab: XII_Secukinumab_ D167_BAnz.pdf. Berlin, 27. November Zuletzt geprüft: 23. September Kassenärztliche Bundesvereinigung (KBV): Frühe Nutzenbewertung : Zuletzt geprüft: 23. September Gemeinsamer Bundesausschuss (G-BA): Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V : downloads/ / _am-rl-xii D-151_BAnz.pdf. Berlin, 12. Oktober Zuletzt geprüft: 23. September Gossec L, Smolen JS, Ramiro S et al.: European League Against Rheumatism (EULAR) recommendations for the management of psoriatic arthritis with pharmacological therapies: 2015 update. Ann Rheum Dis 2016; 75: Scottish Medicines Consortium: (Otezla ) Psoriatic Arthritis: apremilast Otezla psoriatic_arthritis_final_may_2015_ REVISED_010615_for_website.pdf. Date Advice Published: Zuletzt geprüft: 23. September Canadian Agency for Drugs and Technologies in Health: CADTH Drug Expert Review Committee - Final Recommendation APREMILAST (Otezla Celgene) Indication: Psoriatic Arthritis: SR0437_complete_Otezla_PsA-Dec-21-15_e.pdf. Notice of final recommendation. December 17, Zuletzt geprüft: 23. September Kassenärztliche Bundesvereinigung (KBV): Frühe Nutzenbewertung Secukinumab Psoriasis-Arthritis: de/html/23455.php. Zuletzt geprüft: 23. September Gemeinsamer Bundesausschuss (G-BA): Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V - Secukinumab (neues Anwendungsgebiet): RL-XII_Secukinumab-nAWG_D-202_BAnz.pdf. Berlin, 2. Juni Zuletzt geprüft: 23. September GKV-Arzneimittelindex im Wissenschaftlichen Institut der AOK (WIdO): Deutsches Institut für Medizinische Dokumentation und Information (DIMDI) (Hrsg.): Anatomisch-therapeutischchemische Klassifikation mit Tagesdosen. Amtliche Fassung des ATC-Index mit DDD-Angaben für Deutschland im Jahre Berlin: DIMDI, Wirkstoff AKTUELL ist eine Information der KBV in Kooperation mit der Arzneimittelkomission der deutschen ärzteschaft Stand:
Dossierbewertung A15-20 Version 1.0 Secukinumab Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Secukinumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Secukinumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Vedolizumab wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Stelara ist ein Arzneimittel, das zur Behandlung der folgenden Erkrankungen angewendet wird:
 EMA/636854/2016 EMEA/H/C/000958 Zusammenfassung des EPAR für die Öffentlichkeit Ustekinumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
EMA/636854/2016 EMEA/H/C/000958 Zusammenfassung des EPAR für die Öffentlichkeit Ustekinumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
EINLADUNG zur Fortbildung Stelara bei Morbus Crohn
 EINLADUNG zur Fortbildung Stelara bei Morbus Crohn Dienstag, 3. Oktober 2017 Datum: Dienstag, 03.10.2017 Ort: Cityhotel Design & Classic Völklplatz 1 3100 St. Pölten www.cityhotel-dc.at Wir freuen uns
EINLADUNG zur Fortbildung Stelara bei Morbus Crohn Dienstag, 3. Oktober 2017 Datum: Dienstag, 03.10.2017 Ort: Cityhotel Design & Classic Völklplatz 1 3100 St. Pölten www.cityhotel-dc.at Wir freuen uns
BAnz AT 07.07.2016 B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneitel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneiteln neuen Wirkstoffen nach 35a SGB V Ixekizumab
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneitel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneiteln neuen Wirkstoffen nach 35a SGB V Ixekizumab
1. Zusatznutzen des Arzneimittels im Verhältnis zur zweckmäßigen Vergleichstherapie
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT 12.10.2015 B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B5. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Cosentyx 1/ 2 Fertigspritze/n 150mg/1 ml, Cosentyx/ -SensoReady 1/ 2 Auto-Injektor 150mg/1 ml
 Eidgenössisches Departement des Innern EDI Bundesamt für Gesundheit BAG Direktionsbereich Kranken- und Unfallversicherung (20311/ 20316) Cosentyx/ -SensoReady Cosentyx 1/ 2 Fertigspritze/n 150mg/1 ml,
Eidgenössisches Departement des Innern EDI Bundesamt für Gesundheit BAG Direktionsbereich Kranken- und Unfallversicherung (20311/ 20316) Cosentyx/ -SensoReady Cosentyx 1/ 2 Fertigspritze/n 150mg/1 ml,
BAnz AT B7. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
ausschließen. Keine Impfung mit Lebendimpfstoffen. Kombinationstherapie mit MTX. Nicht mit TNF-Alpha-Blockern kombinieren.
 Abatacept (Blocker der T- Lymphozyten Aktivierung) Orencia 10 mg pro kg Körpergewicht zur intravenösen Infusion. Wiederholung nach 2 und 4 Wochen, dann alle 4 Lebendimpfstoffen. Kombinationstherapie mit
Abatacept (Blocker der T- Lymphozyten Aktivierung) Orencia 10 mg pro kg Körpergewicht zur intravenösen Infusion. Wiederholung nach 2 und 4 Wochen, dann alle 4 Lebendimpfstoffen. Kombinationstherapie mit
Infektionen, insbesondere Tuberkulose, ausschließen. Keine Impfung mit Lebendimpfstoffen. Kombination mit MTX empfohlen.
 Abatacept (Blocker der T- Lymphozyten Aktivierung) Orencia 10 mg pro kg Körpergewicht zur intravenösen Infusion. Wiederholung nach 2 und 4 Wochen, dann alle 4 Lebendimpfstoffen. Kombinationstherapie mit
Abatacept (Blocker der T- Lymphozyten Aktivierung) Orencia 10 mg pro kg Körpergewicht zur intravenösen Infusion. Wiederholung nach 2 und 4 Wochen, dann alle 4 Lebendimpfstoffen. Kombinationstherapie mit
Ivermectin. Die wichtigsten Fakten auf einen Blick (Drug Facts)
 Ausgabe 6/2016 Wirkstoff Aktuell Eine Information der kbv im rahmen des 73 (8) sgb v in zusammenarbeit mit der arzneimittelkommission der deutschen ärzteschaft online unter: http://ais.kbv.de Ivermectin
Ausgabe 6/2016 Wirkstoff Aktuell Eine Information der kbv im rahmen des 73 (8) sgb v in zusammenarbeit mit der arzneimittelkommission der deutschen ärzteschaft online unter: http://ais.kbv.de Ivermectin
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um die Wirkstoffkombination Dapagliflozin/Metformin wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Versorgung der Psoriasis in Deutschland Neue Daten und Erkenntnisse
 Versorgung der Psoriasis in Deutschland Neue Daten und Erkenntnisse Prof. Dr. med. Ulrich Mrowietz Psoriasis-Zentrum Abt. Dermatologie Universitätsklinikum Schleswig-Holstein Campus Kiel Versorgung der
Versorgung der Psoriasis in Deutschland Neue Daten und Erkenntnisse Prof. Dr. med. Ulrich Mrowietz Psoriasis-Zentrum Abt. Dermatologie Universitätsklinikum Schleswig-Holstein Campus Kiel Versorgung der
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Daratumumab wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Nutzenbewertung nach 35a SGB V: Beschlüsse des Gemeinsamen Bundesausschusses (G-BA) im 3. Quartal 2015
 Foto: istockphoto.com Verordnung Aktuell Arzneimittel Eine Information der Kassenärztlichen Vereinigung Bayerns Verordnungsberatung@kvb.de www.kvb.de/verordnungen Stand: Nutzenbewertung nach 35a SGB V:
Foto: istockphoto.com Verordnung Aktuell Arzneimittel Eine Information der Kassenärztlichen Vereinigung Bayerns Verordnungsberatung@kvb.de www.kvb.de/verordnungen Stand: Nutzenbewertung nach 35a SGB V:
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Behandlungsstrategien bei Psoriasis
 Behandlungsstrategien bei Psoriasis Nikhil Yawalkar Universitätsklinik für Dermatologie Inselspital, Bern Psoriasis Mild (70-75%) Mittelschwer bis schwer (25-30%) PASI BSA DLQI > 10 % Mrowietz et al. Arch
Behandlungsstrategien bei Psoriasis Nikhil Yawalkar Universitätsklinik für Dermatologie Inselspital, Bern Psoriasis Mild (70-75%) Mittelschwer bis schwer (25-30%) PASI BSA DLQI > 10 % Mrowietz et al. Arch
1. Zusatznutzen des Arzneimittels im Verhältnis zur zweckmäßigen Vergleichstherapie
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Patienten Pass. Plaque-Psoriasis / Psoriasis-Arthritis. Dokumentation und Unterstützung AUSGANGSBEFUND THERAPIEVERLAUF PATIENTEN-TAGEBUCH
 Patienten Pass Plaque-Psoriasis / Psoriasis-Arthritis Dokumentation und Unterstützung Janssen-Cilag GmbH www.janssen.com/germany AUSGANGSBEFUND THERAPIEVERLAUF PATIENTEN-TAGEBUCH 2 Patienten Pass 3 Liebe
Patienten Pass Plaque-Psoriasis / Psoriasis-Arthritis Dokumentation und Unterstützung Janssen-Cilag GmbH www.janssen.com/germany AUSGANGSBEFUND THERAPIEVERLAUF PATIENTEN-TAGEBUCH 2 Patienten Pass 3 Liebe
Tragende Gründe. Vom 2. Juni Inhalt 1. Rechtsgrundlage Eckpunkte der Entscheidung Bürokratiekosten Verfahrensablauf...
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
Patienten Pass. Plaque-Psoriasis / Psoriasis-Arthritis. Dokumentation und Unterstützung AUSGANGSBEFUND THERAPIEVERLAUF PATIENTEN-TAGEBUCH
 Patienten Pass Plaque-Psoriasis / Psoriasis-Arthritis Dokumentation und Unterstützung Janssen-Cilag GmbH www.janssen.com/germany AUSGANGSBEFUND THERAPIEVERLAUF PATIENTEN-TAGEBUCH 2 Liebe Patientin, lieber
Patienten Pass Plaque-Psoriasis / Psoriasis-Arthritis Dokumentation und Unterstützung Janssen-Cilag GmbH www.janssen.com/germany AUSGANGSBEFUND THERAPIEVERLAUF PATIENTEN-TAGEBUCH 2 Liebe Patientin, lieber
1. Die Angaben zu Perampanel in der Fassung des Beschlusses vom 7. März 2013 (BAnz AT B4) werden aufgehoben.
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B5. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Hauptverband der österreichischen Sozialversicherungsträger
 Freigabe zur Abfrage: 2017-08-30 Verlautbarung Nr.: 119/2017 Amtliche Verlautbarung der österreichischen Sozialversicherung im Internet Hauptverband der österreichischen Sozialversicherungsträger Der Hauptverband
Freigabe zur Abfrage: 2017-08-30 Verlautbarung Nr.: 119/2017 Amtliche Verlautbarung der österreichischen Sozialversicherung im Internet Hauptverband der österreichischen Sozialversicherungsträger Der Hauptverband
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Pasireotid (neues Anwendungsgebiet) wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der ArzneimittelRichtlinie (AMRL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V Pasireotid
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der ArzneimittelRichtlinie (AMRL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V Pasireotid
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um die Wirkstoffkombination Insulin degludec/liraglutid wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B1. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um die Wirkstoffkombination Tafluprost/Timolol wie folgt ergänzt:
 BAnz AT 1.07.201 B4 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
BAnz AT 1.07.201 B4 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
DOKUMENTATIONSBLOCK LABOR DOKUMENTATION VON LABORKONTROLLEN ZUR FUMADERM -THERAPIE
 DOKUMENTATIONSBLOCK LABOR DOKUMENTATION VON LABORKONTROLLEN ZUR FUMADERM -THERAPIE HANDHABUNG VON LABORWERTVERÄNDERUNGEN Bitte beachten Sie ergänzend auch die Angaben in der Fachinformation.4 MONITORING
DOKUMENTATIONSBLOCK LABOR DOKUMENTATION VON LABORKONTROLLEN ZUR FUMADERM -THERAPIE HANDHABUNG VON LABORWERTVERÄNDERUNGEN Bitte beachten Sie ergänzend auch die Angaben in der Fachinformation.4 MONITORING
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben?
 Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um die Wirkstoffkombination Indacaterol/Glycopyrronium wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um die Wirkstoffkombination Netupitant/Palonosetron wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Patienteninformation zur Behandlung der Psoriasis mit Ustekinumab
 Praxis Dr. Ralph von Kiedrowski Patienteninformation zur Behandlung der Psoriasis mit Ustekinumab Liebe Patientin, lieber Patient, dieses Informationsblatt soll Ihnen die vorgesehene Behandlung mit Ustekinumab
Praxis Dr. Ralph von Kiedrowski Patienteninformation zur Behandlung der Psoriasis mit Ustekinumab Liebe Patientin, lieber Patient, dieses Informationsblatt soll Ihnen die vorgesehene Behandlung mit Ustekinumab
Dossierbewertung A15-15 Version 1.0 Insulin degludec/liraglutid Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung der Wirkstoffkombination Insulin degludec/liraglutid gemäß 35a SGB V beauftragt. Die Bewertung
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung der Wirkstoffkombination Insulin degludec/liraglutid gemäß 35a SGB V beauftragt. Die Bewertung
Humira jetzt bei polyartikulärer juveniler idiopathischer Arthritis für Kinder ab vier Jahren zugelassen
 EU-Zulassungserweiterung für Adalimumab (Humira ) Humira jetzt bei polyartikulärer juveniler idiopathischer Arthritis für Kinder ab vier Jahren zugelassen Wiesbaden/Ludwigshafen (1. Juli 2011) Die Europäische
EU-Zulassungserweiterung für Adalimumab (Humira ) Humira jetzt bei polyartikulärer juveniler idiopathischer Arthritis für Kinder ab vier Jahren zugelassen Wiesbaden/Ludwigshafen (1. Juli 2011) Die Europäische
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Secukinumab wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
1. Die Angaben zu Crizotinib in der Fassung des Beschlusses vom 2. Mai 2013 (BAnz AT B2) werden aufgehoben.
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Zulassung für JANUMET (Sitagliptin/Metformin) zur Behandlung des Typ-2-Diabetes in der Europäischen Union
 Zulassung für JANUMET (Sitagliptin/Metformin) zur Behandlung des Typ-2-Diabetes in der Europäischen Union Haar (23. Juli 2008) JANUMET (Sitagliptin/Metformin, MSD) hat von der Europäischen Kommission die
Zulassung für JANUMET (Sitagliptin/Metformin) zur Behandlung des Typ-2-Diabetes in der Europäischen Union Haar (23. Juli 2008) JANUMET (Sitagliptin/Metformin, MSD) hat von der Europäischen Kommission die
Dossierbewertung A16-24 Version 1.0 Nivolumab (Nierenzellkarzinom)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Nivolumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis eines
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Nivolumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis eines
PRESSEMITTEILUNG. Patientenindividuelle Psoriasis-Therapie mit Apremilast (OTEZLA)
 Celgene GmbH Joseph-Wild-Straße 20 81829 München Telefon: (089) 451519-010 info@celgene.de www.celgene.de PRESSEMITTEILUNG Thema auf der Münchner Fortbildungswoche 2016: 18 Monate Praxiserfahrung mit Apremilast
Celgene GmbH Joseph-Wild-Straße 20 81829 München Telefon: (089) 451519-010 info@celgene.de www.celgene.de PRESSEMITTEILUNG Thema auf der Münchner Fortbildungswoche 2016: 18 Monate Praxiserfahrung mit Apremilast
BAnz AT 11.11.2014 B1. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Teduglutid wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Lurasidon wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Leflunomid - 1 A Pharma 10 mg / 20 mg Filmtabletten
 Spezielle Informationen zur Sicherheit Leflunomid - 1 A Pharma 10 mg / 20 mg Filmtabletten Wirkstoff: Leflunomid Leflunomid - 1 A Pharma 10 mg / 20 mg Filmtabletten (Leflunomid) ist als antirheumatisches
Spezielle Informationen zur Sicherheit Leflunomid - 1 A Pharma 10 mg / 20 mg Filmtabletten Wirkstoff: Leflunomid Leflunomid - 1 A Pharma 10 mg / 20 mg Filmtabletten (Leflunomid) ist als antirheumatisches
1. Zusatznutzen des Arzneimittels im Verhältnis zur zweckmäßigen Vergleichstherapie
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM- RL):Anlage XII Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM- RL):Anlage XII Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V
BAnz AT B5. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B6. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
1. Zusatznutzen des Arzneimittels im Verhältnis zur zweckmäßigen Vergleichstherapie
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Management der frühen rheumatoiden Arthritis
 publiziert bei: AWMF-Register Nr. 060/002 Klasse: S3 Kurzfassung und Abstimmungsergebnisse Management der frühen rheumatoiden Arthritis Empfohlene Diagnostik: s. Kap. 2.4 GCP Stellen Sie Patienten mit
publiziert bei: AWMF-Register Nr. 060/002 Klasse: S3 Kurzfassung und Abstimmungsergebnisse Management der frühen rheumatoiden Arthritis Empfohlene Diagnostik: s. Kap. 2.4 GCP Stellen Sie Patienten mit
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Ponatinib wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Gebrauchsinformation: Information für Patienten. Otezla 10 mg Filmtabletten Otezla 20 mg Filmtabletten Otezla 30 mg Filmtabletten Apremilast
 Gebrauchsinformation: Information für Patienten Otezla 10 mg Filmtabletten Otezla 20 mg Filmtabletten Otezla 30 mg Filmtabletten Apremilast Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung.
Gebrauchsinformation: Information für Patienten Otezla 10 mg Filmtabletten Otezla 20 mg Filmtabletten Otezla 30 mg Filmtabletten Apremilast Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung.
Neue Methotrexat-Fertigspritzen erleichtern Rheumapatienten die Selbstinjektion
 Weniger Volumen, mehr Funktionalität Neue Methotrexat-Fertigspritzen erleichtern Rheumapatienten die Selbstinjektion Holzkirchen (26. April 2013) Von MTX HEXAL stehen jetzt neue Fertigspritzen in der Konzentration
Weniger Volumen, mehr Funktionalität Neue Methotrexat-Fertigspritzen erleichtern Rheumapatienten die Selbstinjektion Holzkirchen (26. April 2013) Von MTX HEXAL stehen jetzt neue Fertigspritzen in der Konzentration
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Zugelassenes Anwendungsgebiet (laut Zulassung vom 11. Mai 2016):
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Bundesministerium für Gesundheit
 BAnz. Nr. (S. 54) vom 9.0.0 Bundesministerium für Gesundheit Bekanntmachung [40 A] eines Beschlusses des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII
BAnz. Nr. (S. 54) vom 9.0.0 Bundesministerium für Gesundheit Bekanntmachung [40 A] eines Beschlusses des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Secukinumab (Cosentyx ) Novartis Pharma GmbH Modul 1 Zusammenfassung der Aussagen im Dossier Stand: 27.02.2017 Inhaltsverzeichnis
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Secukinumab (Cosentyx ) Novartis Pharma GmbH Modul 1 Zusammenfassung der Aussagen im Dossier Stand: 27.02.2017 Inhaltsverzeichnis
TNF-alpha-Blocker: Versorgungssituation und regionale Unterschiede
 TNF-alpha-Blocker: Versorgungssituation und regionale Unterschiede Dr. Roland Windt Universität Bremen Zentrum für Sozialpolitik - Kein Interessenkonflikt im Sinne der Uniform Requirements for Manuscripts
TNF-alpha-Blocker: Versorgungssituation und regionale Unterschiede Dr. Roland Windt Universität Bremen Zentrum für Sozialpolitik - Kein Interessenkonflikt im Sinne der Uniform Requirements for Manuscripts
BAnz AT B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V
Dossierbewertung A15-28 Version 1.0 Netupitant/Palonosetron Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Netupitant/Palonosetron gemäß 35a SGB V beauftragt. Die Bewertung erfolgte
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Netupitant/Palonosetron gemäß 35a SGB V beauftragt. Die Bewertung erfolgte
Epidemiologie: Zirka 2 bis 4 Prozent der Bevölkerung sind von Psoriasis vulgaris betroffen.
 Mehr als nur ein Hautproblem: Schuppenflechte betrifft auch Gelenke und Organe welche neuen Therapien helfen? Professor Dr. med. Jens Gert Kuipers, Tagungspräsident DGRh, Chefarzt der Klinik für internistische
Mehr als nur ein Hautproblem: Schuppenflechte betrifft auch Gelenke und Organe welche neuen Therapien helfen? Professor Dr. med. Jens Gert Kuipers, Tagungspräsident DGRh, Chefarzt der Klinik für internistische
Vom 28. Mai I. Die Anlage IV wird um den folgenden Therapiehinweis ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über die Einleitung eines Stellungnahmeverfahrens zur Änderung der Arzneimittel-Richtlinie (AM-RL) in Anlage IV: Therapiehinweise zu Aliskiren Vom 28. Mai 2009
Beschluss des Gemeinsamen Bundesausschusses über die Einleitung eines Stellungnahmeverfahrens zur Änderung der Arzneimittel-Richtlinie (AM-RL) in Anlage IV: Therapiehinweise zu Aliskiren Vom 28. Mai 2009
Chronische Polyarthritis - CP Diagnose Behandlungsmöglichkeiten
 Chronische Polyarthritis - CP Diagnose Behandlungsmöglichkeiten Dr.Thomas Müller FA f. Innere Medizin u. Rheumatologie Pestalozzistr.6, 8010 Graz ordination@rheumadoc.at www.rheumadoc.at Chronische Polyarthritis
Chronische Polyarthritis - CP Diagnose Behandlungsmöglichkeiten Dr.Thomas Müller FA f. Innere Medizin u. Rheumatologie Pestalozzistr.6, 8010 Graz ordination@rheumadoc.at www.rheumadoc.at Chronische Polyarthritis
1. Die Angaben zu Vismodegib in der Fassung des Beschlusses vom 6. Februar 2014 (BAnz AT 27. Februar 2014) werden aufgehoben.
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Verordnungen innovativer Arzneimittel in der Rheumatologie
 Verordnungen innovativer Arzneimittel in der Rheumatologie Was bedeutet dies für den Arzt? Satelliten-Symposium Abbvie Berlin, 04.05.2013 Dr. med. Ulrich v. Hinüber, Praxis für Rheumatologie und Osteologie
Verordnungen innovativer Arzneimittel in der Rheumatologie Was bedeutet dies für den Arzt? Satelliten-Symposium Abbvie Berlin, 04.05.2013 Dr. med. Ulrich v. Hinüber, Praxis für Rheumatologie und Osteologie
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Apremilast (Otezla ) Celgene GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete Stand: 13.02.2015
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Apremilast (Otezla ) Celgene GmbH Modul 2 Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete Stand: 13.02.2015
BAnz AT B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Fragebogen zur Versorgung von Kindern und Jugendlichen mit Psoriasis
 Alfried Krupp von Bohlen und Halbach-Stiftungslehrstuhl für Medizinmanagement Fragebogen zur Versorgung von Kindern und Jugendlichen mit Psoriasis Survey A: Ärzte 27. August 2010 Finale Version Prof. Dr.
Alfried Krupp von Bohlen und Halbach-Stiftungslehrstuhl für Medizinmanagement Fragebogen zur Versorgung von Kindern und Jugendlichen mit Psoriasis Survey A: Ärzte 27. August 2010 Finale Version Prof. Dr.
Ruxolitinib vs. BAT RR [95%-KI] p-wert Mortalität Gesamtmortalität (0) (0) k. A. Morbidität. Patienten mit Ereignis n (%)
![Ruxolitinib vs. BAT RR [95%-KI] p-wert Mortalität Gesamtmortalität (0) (0) k. A. Morbidität. Patienten mit Ereignis n (%) Ruxolitinib vs. BAT RR [95%-KI] p-wert Mortalität Gesamtmortalität (0) (0) k. A. Morbidität. Patienten mit Ereignis n (%)](/thumbs/72/67190652.jpg) Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Akute venösen Thromboembolien (VTE) oder VTE in der Vorgeschichte, einschließlich tiefer Venenthrombose und Lungenembolie.
 Aktualisierte Indikation Behandlung der schweren Osteoporose: bei postmenopausalen Frauen, bei erwachsenen Männern, mit hohem Frakturrisiko, für die eine Behandlung mit anderen für die Osteoporosetherapie
Aktualisierte Indikation Behandlung der schweren Osteoporose: bei postmenopausalen Frauen, bei erwachsenen Männern, mit hohem Frakturrisiko, für die eine Behandlung mit anderen für die Osteoporosetherapie
WICHTIGE INFORMATIONEN FÜR PATIENTEN. denen STELARA zur Behandlung des mittelschweren bis schweren aktiven Morbus Crohn verschrieben wurde
 WICHTIGE INFORMATIONEN FÜR PATIENTEN denen STELARA zur Behandlung des mittelschweren bis schweren aktiven Morbus Crohn verschrieben wurde 2 Version 2 (Stand: Februar 2017) Erstellt in Abstimmung mit dem
WICHTIGE INFORMATIONEN FÜR PATIENTEN denen STELARA zur Behandlung des mittelschweren bis schweren aktiven Morbus Crohn verschrieben wurde 2 Version 2 (Stand: Februar 2017) Erstellt in Abstimmung mit dem
BAnz AT B1. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Chicago News: Aktuelles vom ACR 2011: B-Zell-Therapie bei Rheumatoider Arthritis Medizin nach Maß
 Chicago News: Aktuelles vom ACR 2011 B-Zell-Therapie bei Rheumatoider Arthritis Medizin nach Maß Frankfurt am Main (22. November 2011) - Auf dem diesjährigen ACR-Kongress untermauerten gleich drei Studien
Chicago News: Aktuelles vom ACR 2011 B-Zell-Therapie bei Rheumatoider Arthritis Medizin nach Maß Frankfurt am Main (22. November 2011) - Auf dem diesjährigen ACR-Kongress untermauerten gleich drei Studien
Ansatz: Bessere Therapie rechnet sich
 9. Kongress des BDRh Tim Steimle, Fachbereichsleiter Arzneimittel, 17. Mai 2014 Ansatz: Bessere Therapie rechnet sich 2 Rheumavertrag der TK mit dem Berufsverband Deutscher Rheumatologen (BDRh) - Tim Steimle,
9. Kongress des BDRh Tim Steimle, Fachbereichsleiter Arzneimittel, 17. Mai 2014 Ansatz: Bessere Therapie rechnet sich 2 Rheumavertrag der TK mit dem Berufsverband Deutscher Rheumatologen (BDRh) - Tim Steimle,
Bundesministerium für Gesundheit. Bekanntmachung
 Seite 1 7 Bundesministerium für Gesundheit eines Beschlusses des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung Arzneimitteln
Seite 1 7 Bundesministerium für Gesundheit eines Beschlusses des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung Arzneimitteln
Anhang III. Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage
 Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
BAnz AT B1. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Behandlung mit Biologika (Biologicals), Stand 01/2011
 Stadtspital Triemli Zürich Klinik für Rheumatologie Birmensdorferstrasse 497 8063 Zürich www.triemli.ch KD Dr. med. Marcel Weber Chefarzt PATIENTENINFORMATION Chefarztsekretariat 044 466 23 02 Fax 044
Stadtspital Triemli Zürich Klinik für Rheumatologie Birmensdorferstrasse 497 8063 Zürich www.triemli.ch KD Dr. med. Marcel Weber Chefarzt PATIENTENINFORMATION Chefarztsekretariat 044 466 23 02 Fax 044
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Langzeit-Sicherheitsdaten für oral verabreichtes Apremilast bei Plaque- Psoriasis und Psoriasis-Arthritis auf dem EADV-Kongress vorgestellt
 Langzeit-Sicherheitsdaten für oral verabreichtes Apremilast bei Plaque- Psoriasis und Psoriasis-Arthritis auf dem EADV-Kongress vorgestellt Gepoolte 3-Jahres-Daten der Studien ESTEEM-1 und -2 sowie PALACE-1
Langzeit-Sicherheitsdaten für oral verabreichtes Apremilast bei Plaque- Psoriasis und Psoriasis-Arthritis auf dem EADV-Kongress vorgestellt Gepoolte 3-Jahres-Daten der Studien ESTEEM-1 und -2 sowie PALACE-1
Antrag auf Freistellung aus der Verschreibungspflicht für Omeprazol 20 mg
 Antrag auf Freistellung aus der Verschreibungspflicht für Omeprazol 20 mg Sachverständigen-Ausschuss für Verschreibungspflicht 13. Januar 2009 Rationale des Antrags Omeprazol ist eine der effektivsten
Antrag auf Freistellung aus der Verschreibungspflicht für Omeprazol 20 mg Sachverständigen-Ausschuss für Verschreibungspflicht 13. Januar 2009 Rationale des Antrags Omeprazol ist eine der effektivsten
96-Wochen-Daten zeigen langanhaltende Wirksamkeit und Verträglichkeit von Certolizumab Pegol bei Spondyloarthritiden
 Pressemitteilung EULAR 2014: Aktuelle Daten zum PEGylierten anti-tnf bei axspa und PsA 96-Wochen-Daten zeigen langanhaltende Wirksamkeit und Verträglichkeit von Certolizumab Pegol bei Spondyloarthritiden
Pressemitteilung EULAR 2014: Aktuelle Daten zum PEGylierten anti-tnf bei axspa und PsA 96-Wochen-Daten zeigen langanhaltende Wirksamkeit und Verträglichkeit von Certolizumab Pegol bei Spondyloarthritiden
Die frühe Nutzenbewertung und ihre rechtlichen Herausforderungen
 und ihre rechtlichen Herausforderungen Rechtssymposium Die frühe Nutzenbewertung von Arzneimitteln nach AMNOG G-BA, Berlin Referent: Dr. jur. Rainer Hess, G-BA Seite 1 16. November 2010 Rechtssymposium
und ihre rechtlichen Herausforderungen Rechtssymposium Die frühe Nutzenbewertung von Arzneimitteln nach AMNOG G-BA, Berlin Referent: Dr. jur. Rainer Hess, G-BA Seite 1 16. November 2010 Rechtssymposium
Behandlung mit Biologika und small molecules
 1/6 PATIENTENINFORMATION Behandlung mit Biologika und small molecules 1999 wurde eine neuartige Medikamentengruppe (Biologika) zur Behandlung entzündlichrheumatischer Erkrankungen zugelassen. Diese Medikamente
1/6 PATIENTENINFORMATION Behandlung mit Biologika und small molecules 1999 wurde eine neuartige Medikamentengruppe (Biologika) zur Behandlung entzündlichrheumatischer Erkrankungen zugelassen. Diese Medikamente
Mündliche Anhörung. gemäß 5. Kapitel 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses
 Mündliche Anhörung gemäß 5. Kapitel 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses hier: Wirkstoff Secukinumab (neues Anwendungsgebiet) Sitzung im Hause des Gemeinsamen Bundesausschusses
Mündliche Anhörung gemäß 5. Kapitel 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses hier: Wirkstoff Secukinumab (neues Anwendungsgebiet) Sitzung im Hause des Gemeinsamen Bundesausschusses
Frühe Nutzenbewertung aus Sicht des IQWiG. Jürgen Windeler
 Frühe Nutzenbewertung aus Sicht des IQWiG Jürgen Windeler AMNOG, aus der Begründung Die Datenlage für neue Wirkstoffe (insbesondere in der Onkologie) wird von Experten als unbefriedigend bezeichnet. Die
Frühe Nutzenbewertung aus Sicht des IQWiG Jürgen Windeler AMNOG, aus der Begründung Die Datenlage für neue Wirkstoffe (insbesondere in der Onkologie) wird von Experten als unbefriedigend bezeichnet. Die
Patienteninformation zur Behandlung der Psoriasis mit Methotrexat
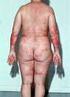 Praxis Dr. Ralph von Kiedrowski Patienteninformation zur Behandlung der Psoriasis mit Methotrexat Liebe Patientin, lieber Patient, dieses Informationsblatt soll Ihnen die vorgesehene Behandlung mit Methotrexat
Praxis Dr. Ralph von Kiedrowski Patienteninformation zur Behandlung der Psoriasis mit Methotrexat Liebe Patientin, lieber Patient, dieses Informationsblatt soll Ihnen die vorgesehene Behandlung mit Methotrexat
