Eigenschaften von ungesättigten Kohlenwasserstoffen
|
|
|
- Tomas Frank
- vor 6 Jahren
- Abrufe
Transkript
1 Schulversuchspraktikum Sommersemester 2016 Klassenstufen 11 & 12 Eigenschaften von ungesättigten Kohlenwasserstoffen
2 Auf einen Blick: In dem Protokoll Eigenschaften von ungesättigten Kohlenwasserstoffen werden drei Lehrerversuche und ein Schülerversuch beschrieben. In den Lehrerversuchen werden die Doppelbindungen von Verbindungen durch eine elektrophile Addition von Brom nachgewiesen, es wird das einfachste Alkin, das Ethin, mittels Calciumcarbid hergestellt und eine Polymerisation von Styrol durchgeführt. In dem Schülerversuch werden Lebensmittel auf das Vorkommen von β- Carotin untersucht. Inhalt 1 Beschreibung des Themas und zugehörige Lernziele Relevanz des Themas für SuS der 11./12. Klassenstufe und didaktische Reduktion Lehrerversuche V1 Nachweis von Doppelbindungen V2 Polymerisation von Styrol V3 Herstellung von Ethin Schülerversuche V4 β- Carotin-Nachweis Didaktischer Kommentar zum Schülerarbeitsblatt Erwartungshorizont (Kerncurriculum) Erwartungshorizont (inhaltlich)... 14
3 1 Beschreibung des Themas und zugehörige Lernziele 1 Beschreibung des Themas und zugehörige Lernziele Kohlenwasserstoffe sind Verbindungen, die nur aus Kohlenstoff und Wasserstoff bestehen. Ungesättigte Kohlenwasserstoffe (Alkene und Alkine) enthalten eine C-C-Doppelbindung oder C-C- Dreifachbindung. Im Kerncurriculum werden Alkene explizit genannt. Im Basiskonzept Stoff- Teilchen heißt es, dass die Molekülstuktur der Alkane beschrieben werden soll. Um dies aber erfolgreich leisten zu können, sollte zuerst zwischen anorganischen und organischen Stoffen unterschieden werden. Im Rahmen der Erkenntnisgewinnung sollen die SuS Verbindungen begründet einer Stoffgruppe zuordnen können. Dazu müssen allerdings Eigenschaften der Kohlenwasserstoffe behandelt werden, wie z.b. Reaktivitäten und Bindungsverhältnisse. Im Kerncurriculum ist ausdrücklich die Nachweisreaktion von Doppelbindungen mit Brom vorgesehen (V1), worüber die SuS zwischen Einfach- und Mehrfachbindungen unterscheiden können. Um diesen Nachweis allerdings in der Tiefe zu verstehen, muss auf das Basiskonzept Struktur und Eigenschaften zurückgegriffen werden. In diesem ist vorgesehen, dass die SuS auch die elektrophile Addition beschreiben können, welche für den Nachweis der Doppelbindungen mit Brom genutzt wird. Auch dazu müssen erst Voraussetzungen geschaffen werden. Dazu sollen die SuS zunächst radikalische, elektrophile und nucleophile Teilchen unterscheiden können. Um den Erkenntnisgewinn der SuS zu steigern, führen sie selbst Nachweisreaktionen durch, wie z.b. den Nachweis von β-carotin (V4). Im Kerncurriculum wird die Beschreibung der Polymerisation, als Reaktionstyp zur Bildung von Makromolekülen, genannt. Daher wird beispielhafte die Polymerisation von Styrol (V2) demonstriert. Die einzelnen Reaktionsschritte werden besprochen. 2 Relevanz des Themas für SuS der 11./12. Klassenstufe und didaktische Reduktion Alkene spielen in der Biologie viele wichtige Rollen. Pflanzen bilden das Pflanzenhormon Ethen, Alkene sind in menschlichen Stoffkreisläufen beteiligt oder sind in Lebensmitteln als Fettsäuren enthalten. Aber auch als Brennstoffe oder als Basis vieler Industriestoffe sind sie von Bedeutung. So werden Kunststoffe aus Alkenen hergestellt und Ethin wird zum Schweißen genutzt. Durch die vielseitigen Themengebiete, in denen ungesättigte Kohlenwasserstoffe zum Tragen kommen, kann ein fächerübergreifender Unterricht ermöglicht werden. Das Kerncurriculum sieht in diesem Rahmen auch vor, dass die SuS die gesellschaftliche Relevanz und die Bedeutung von Stoffen in ihrer Umwelt erkennen und beschreiben. Durch die Auseinandersetzung mit der alltäglichen Nutzung und dem Vorkommen der ungesättigten Kohlenwasserstoffe kann die Bewertungskompetenz gefördert werden. Innerhalb der Jahrgangsstufe können die ausgewählten Reaktionsmechanismen, die bei Syntheseschritten oder Nachweisen entscheidend sind, im Detail besprochen werden. Jedoch sollten je nach Leistungsniveau der Klasse die Wissenslücken für 1
4 2 Relevanz des Themas für SuS der 11./12. Klassenstufe und didaktische Reduktion das Verständnis der Reaktionsmechanismen gefüllt werden, damit darauf aufgebaut werden kann. 2
5 3 Lehrerversuche 3 Lehrerversuche 3.1 V1 Nachweis von Doppelbindungen In diesem Versuch werden die Doppelbindungen eines Alkens mittels Bromwasser nachgewiesen. Er kann als Einstieg in die Stoffgruppe der Alkene genutzt werden, aber auch um den Reaktionsmechanismus einer elektrophilen Addition zu behandeln. Die SuS sollten bereits Kenntnisse über Bindungsarten besitzen und mit der Lewisschreibweise vertraut sein. Der Versuch ist als Lehrerversuch ausgelegt, da Bromwasser giftig wirkt und daher ein hohes Gefahrenpotenzial besitzt. Gefahrenstoffe Bromwasser H: P: Cyclohexan H: P: Cyclohexen H: P: ,2-Dibromcyclohexan - S: 24/25 Materialien: Chemikalien: Durchführung: Reagenzgläser, Reagenzglasständer, Stopfen, Pipette Brommwasser, Cyclohexan, Cyclohexen, Tomatensaft, Speiseöl In 4 Reagenzgläsern werden jeweils 2-3 ml Tomatensaft, Cyclohexan, Cyclohexen und Speiseöl gegeben. Anschließend wird etwas Bromwasser hinzu getropft. Beobachtung: Im Reagenzglas mit Cyclohexan entfärbt sich das Bromwasser nicht. Im Reagenzglas mit dem Cyclohexen entfärbt sich die bräunliche Färbung des Bromwassers. Im Reagenzglas mit dem Tomatensaft ist eine Farbveränderung zu beobachten. Nachdem Bromwasser hinzugegeben wurde ist ein Farbumschlag nach gelb zu beobachten, diese Farbe ändert sich allmählich grün. Im Reagenzglas mit dem Speiseöl entfärbt sich das bräunliche Bromwasser ebenfalls. 3
6 3 Lehrerversuche Abbildung 1 Links: (v.l.n.r.) Tomatensaft, Cyclohexen, Cyclohexan, jeweils mit Bromwasser versetzt. Rechts: Speiseöl. Deutung: Zur Vereinfachung wird der Reaktionsmechanismus der elektrophilen Addition anhand vom Brom-Molekül und nicht vom Bromwasser dargestellt. Das Brom-Molekül kann sich über eine elektrophile Addition an die Doppelbindung des Cyclohexens anlagern. Durch die Reaktion entfärbt sich die Lösung. Cyclohexan reagiert nicht über diesen Mechanismus, da es keine Doppelbindungen besitzt und die bräunliche Farbe des Bromwassers bleibt erhalten. Auf diesem Wege können somit Doppelbindungen in einer Verbindung nachgewiesen werden. Dadurch, dass sich Tomatensaft und Speiseöl ebenfalls entfärben, kann darauf geschlossen werden, dass Kohlenwasserstoffe mit Doppelbindungen in den Flüssigkeiten vorhanden sind. Bei einer elektrophilen Addition tritt die Doppelbindung des Alkens in Wechselwirkung mit dem Brom-Molekül, wodurch das Brom-Molekül polarisiert wird, es entsteht ein induzierter, temporärer Dipol. Diese Polarisierung geschieht aufgrund der hohen Elektronendichte der Doppelbindung, da sich die Elektronenräume der π-bindung und des Brommoleküls überlappen. Das Brom-Molekül wird heterolytisch gespalten. Ein Bromatom übernimmt die Bindungselektronen und wird zum Bromanion. Das so entstandene Bromkation ist sehr reaktiv und greift elektrophil die Doppelbindung an. Als Zwischenstufe bildet sich das cyclische Bromoniumion, welches auch oft σ-komplex genannt wird. Im Folgeschritt erfolgt der nucleophile Angriff des abgespaltenen Bromanions von der dem Komplex abgewandten Seite, da durch den Komplex der Angriff auf der einen Seite sterisch gehindert ist. Je nachdem, wohin sich das Bromanion orientiert, lockert sich die π-br + -Bindung und geht an das entsprechende Nachbar- Kohlenstoffatom und es entsteht ein trans-additionsprodukt. 4
7 3 Lehrerversuche Reaktionsmechanismus: Entsorgung: Literatur: Die Lösungen der Halogene werden mit Natriumthiosulfat-Lösung zu den entsprechenden Halogeniden reduziert. Das Reaktionsgemisch gibt man nach einer Neutralisation mit Natriumhydrogencarbonat ins Abwasser. Blume, R., (zuletzt abgerufen am , um Uhr) Anmerkungen: Es sollte unter dem Abzug gearbeitet werden, da Bromwasser verwendet wird. Unterrichtsanschlüsse: Dieser Versuch eignet sich zum Einstieg in die ungesättigten Kohlenwasserstoffe. Da die Beobachtungen bei der radikalischen Substitution von Brom ähnlich sind, sollten hier Unterschiede besprochen werden, da sonst Missverständnisse entstehen können. Mit steigendem Leistungsniveau kann auch die Stereochemie der Reaktion betrachtet und die Entstehung der Isomere behandelt werden. 5
8 3 Lehrerversuche 3.2 V2 Polymerisation von Styrol In diesem Versuch soll eine kationische Polymerisation von Styrol demonstriert werden. Diese Reaktion kann zur Erarbeitung von Polymeren behandelt werden. Die SuS sollten ein Vorwissen über Alkene haben und schon einfache Reaktionsmechanismen in Lewisschreibweise kennengelernt haben. Es handelt sich um einen Lehrerversuch, da Styrol gesundheitsschädlich ist. Gefahrenstoffe Eisen(III)-chlorid-Hexahydrat H: Styrol H: d-372 P: P: Polystyrol H: - P: - Materialien: Chemikalien: Durchführung: Beobachtung: Reagenzglas, Reagenzglashalter, Gasbrenner, Aluminiumfolie, Siedesteine Eisen(III)-chlorid-Hexahydrat, Styrol Es wird im Abzug gearbeitet. In ein Reagenzglas werden eine Spatelspitze Eisen(III)-chlorid-Hexahydrat, Siedesteine und 2 ml Styrol gegeben. Mit kleiner Flamme wird das Reagenzglas bis zum Sieden erhitzt. Wenn die Lösung anfängt zu sieden, wird das Reagenzglas aus der Flamme genommen und überprüft, ob das Styrol von alleine weiter siedet. Sollte dies nicht der Fall sein, wird das Gemisch erneut erhitzt. Die noch siedende Lösung wird in eine aus Aluminiumfolie geformte Schale überführt. Die kalte gelbliche Lösung aus Eisen(III)-chlorid-Hexahydrat und Styrol färbt sich beim Erhitzen grünlich. Die Flüssigkeit wird zunehmend zäher. Nach dem Abkühlen ist das Gemisch fest, spröde, transparent und grünlich gefärbt. 6
9 3 Lehrerversuche Abbildung 2 (v.l.n.r.) Erwärmtes Reaktionsgemisch, siedendes Reaktionsgemisch, erstarrtes Reaktionsgemisch. Deutung: Bei der Polymerisation der Alkene werden Doppelbindungen ungesättigter Monomere geöffnet und mit anderen Doppelbindungssystemen verknüpft. Das entstandene Produkt ist das Polymer Polystyrol, das aus einzelnen Styrol-Molekülen besteht. Es handelt sich hierbei um eine kationische Polymerisation. Die verwendete Lewissäure, Eisen(III)-chlorid-Hexahydrat wirkt als Initiator. Da es sich um einen Hexahyratkomplex handelt, welcher dann unter Abspaltung eines Protons zerfällt. Dieses Proton greift die Doppelbindung elektrophil an, wodurch die Polymerisation ausgelöst wird. Dieser Schritt wird Kettenstart genannt. Als startendes Kation lagert sich das Proton an das endständige Kohlenstoffatom der Doppelbindung des Styrols an. Die Doppelbindung bricht auf und es entsteht ein Carbokation, welches nun eine weitere Styrol-Doppelbindung angreifen kann. Die Kettenwachstumsreaktion erfolgt also durch sukzessive Addition von Styrol-Monomeren an die Makrokationen. Es gibt mehrere Möglichkeiten des Kettenabbruchs. Die Polymerisation schreitet solange vorwärts, bis alle Monomere in Bindung gegangen sind oder das Carbokation auf ein Anion trifft, z.b. das, das bei der Initiation entstanden ist. Eine andere Möglichkeit ist, dass das Kettenwachstum durch eine Eliminierungsreaktion beendet wird, indem ein Proton auf eine neue Monomereinheit übertragen wird. Das Wachstum der Kette ist unterbrochen und ein Proton steht für eine weitere Startreaktion zur Verfügung. 7
10 3 Lehrerversuche Reaktionsmechanismus: Entsorgung: Literatur: Das Produkt kann in den Feststoffabfall entsorgt werden. Blume, R., (zuletzt abgerufen am um Uhr) Anmerkungen: Für Styrol herrscht eine Tätigkeitsbeschränkung für gebärfähige Frauen, werdende und stillende Mütter. Unterrichtsanschlüsse: Im Anschluss an diesen Versuch kann der Reaktionsmechanismus erarbeitet und die verschiedenen Arten von Polymerisationen behandelt werden. Dieser Versuch ist ein guter Einstieg in das Thema Kunststoffe und Polymere. 8
11 3 Lehrerversuche 3.3 V3 Herstellung von Ethin Mit diesem Versuch wird eine Möglichkeit der Darstellung von Ethin demonstriert. Ethin ist sehr reaktiv und dies kann anschaulich durch das Anzündens des gasförmigen Ethins gezeigt werden. Es kann als Einstieg in die Stoffgruppe der Alkine genutzt werden, da Ethin das einfachste Alkin ist. Die SuS sollten bereits die Stoffgruppen Alkane und Alkene behandelt haben, sodass darauf aufgebaut werden kann. Gefahrenstoffe Calciumcarbid H: P: dest. Wasser H: - P: - Calciumhydroxid H: P: Materialien: Chemikalien: Durchführung: Beobachtung: Reagenzglas, Stativ mit Klemme, Lochstopfen, Flammenfalle, Feuerzeug Calciumcarbid, dest. Wasser Ein Reagenzglas wird an einem Stativ befestigt. Es wird eine Spatelspitze Calciumcarbid in das Reagenzglas gefüllt und ca. 1 ml Wasser hinzugegeben. Das Reagenzglas wird mit einem Lochstopfen und Flammenfalle verschlossen. Bei der Reaktion wird die Spitze des Glasrohrs mit einem Feuerzeug entzündet. Das Calciumcarbid beginnt bei Wasserzugabe stark aufzuschäumen und es bildet sich ein Gas. Das Gas brennt mit gelber Flamme, die nach einer gewissen Zeit erlischt. Zudem ist eine starke Rußentwicklung zu beobachten. 9
12 3 Lehrerversuche Abbildung 3 Aufbau für die Darstellung von Ethin. Deutung: Die Reaktion von Calciumcarbid und Wasser ist stark exotherm. Es bilden sich Ethin und Calciumhydroxid. Da Ethin wegen Sauerstoffmangels unvollständig verbrennt, entsteht bei der Verbrennung viel Ruß. Reaktionsgleichung: CaC 2(s) + 2H 2 O (l) Ca(OH) 2(s) + C 2 H 2(g) Entsorgung: Literatur: Das Calciumhydroxid wird in dest. Wasser gelöst. Die Lösung kann im anorganischen Abfall mit Schwermetallen entsorgt werden. Es sollte auf einen alkalischen ph-wert geachtet werden. R. Blume, zuletzt abgerufen am , um Uhr. Anmerkungen: Alternativ kann in eine Porzellanschale eine kleine Menge Calciumcarbid gegeben und dest. Wasser hinzu getropft werden. Es bildet sich Ethin, welches mit einem Brennspan angezündet werden kann. Es sollten allerdings keine großen Mengen verwendet werden, da das Ethin-Luft-Gemisch sehr explosiv sein kann. Unterrichtsanschlüsse: Dieser Versuch eignet sich um die Stoffklasse der Alkine zu besprechen, da mit wenigen und einfachen Mitteln selbst das einfachste Alkin hergestellt wurde. Es können im Anschluss Nachweisreaktionen von Ethin bzw. Eigenschaften von Alkinen besprochen werden. 10
13 4 Schülerversuche 4 Schülerversuche 4.1 V4 β- Carotin-Nachweis In diesem Versuch soll den SuS die Alltagsrelevanz von ungesättigten Kohlenwasserstoffe anhand von β-carotin vermittelt werden. Es wird β-carotin in verschiedenen Lebensmitteln mittels Schwefelsäure nachgewiesen. Die SuS sollten bereits eine Einführung in die Stoffklasse der Alkene gehabt haben und wissen, worin der Unterschied zwischen gesättigten und ungesättigten Kohlenwasserstoffen besteht. Gefahrenstoffe Ethanol H: 225 P: 210 Schwefelsäure (verdünnt. w<25%) H: P: β-carotin H: - P: - Materialien: Chemikalien: Durchführung: 4 Mörser mit Pistill, Messer, Gemüsereibe, 4 Petrischalen, Messpipette (10 ml), Peleusball, Aluminiumfolie Ethanol, verdünnte Schwefelsäure, β-carotin-kapseln, Karotte, rote und grüne Paprika Die Extrakte der Lebensmittel werden getrennt hergestellt. Ein Viertel der roten bzw. grünen Paprika wird in kleine Stücke geschnitten. Diese werden in einen Mörser gegeben und mit dem Pistill unter Zugabe von etwa 5 ml Ethanol zerdrückt. Die Karotte wird mit der Reibe fein geraspelt. Die Karottenstücke werden ebenfalls mit 5 ml Ethanol in einem Mörser zerdrückt, bis ein Brei entstanden ist. Von dem β-carotin werden 2-3 Spatelspitzen in dem Mörser gegeben und in 2 ml Ethanol gelöst. Die einzelnen Flüssigkeiten werden separat in die Petrischalen abdekantiert, so dass der Boden gerade bedeckt ist. Die Extrakte werden auf der Heizung oder auf einer Heizplatte mit sehr geringer Temperatur vorsichtig erwärmt. Sie sollten mit Aluminiumfolie vor Licht geschützt werden. Nachdem das Ethanol abgedampft ist wird etwas verdünnte Schwefelsäure auf die Extrakte getropft. 11
14 4 Schülerversuche Ein kleiner Teil der Petrischalen sollte dabei unbehandelt bleiben, damit die Originalfarben zum Vergleich erhalten bleiben. Beobachtung: Die Stellen, auf dem die Schwefelsäure getropft wird, verändern ihre Farbe. Zuerst verfärben sich die stellen nur leicht blau und nach kurzer Zeit sogar fast schwarz. Das reine β-carotin weißt die schnellste Farbveränderung vor, gefolgt von den Extrakten der Karotte und der roten Paprika. Am längsten benötigt das Extrakt der grünen Paprika um sich zu verfärben. Außerdem ist die Farbintensität nicht so stark, wie bei den anderen. Abbildung 3 (v.l.n.r) β-carotin-kapsel, Karotte, rote Paprika, grüne Paprika. Deutung: Wir sehen verschiedene Farben, da einige Moleküle aufgrund ihrer Struktur die Fähigkeit haben Licht einer bestimmten Wellenlänge zu absorbieren. Die nicht absorbierten Wellenlängen werden von unserem Auge als Farbe wahrgenommen. β-carotin erscheint uns orange, da es Licht im blauen bis grünen Spektralbereichs des sichtbaren Lichts zwischen 415 und 500 nm absorbiert. β-carotin, welches zu den Tetraterpenen gehört, ist ein natürlich vorkommender Farbstoff. Die Möglichkeit Licht zu absorbieren beruht auf der Anwesenheit eines delokalisierten π-elektronensystems. In langkettigen Alkenen, die abwechselnd Einfach- und Doppelbindungen enthalten, können diese Elektronen über alle senkrecht stehenden p- Orbitale der benachbarten C-Atome verteilt werden. Solche Doppelbindungen, die durch nur eine Einfachbindung voneinander getrennt sind, heißen konjugierte Doppelbindungen. β-carotin besitzt 11 konjugierte Doppelbindungen. π-elektronen können viel leichter angeregt werden als die σ- Elektronen der gesättigten Kohlenwasserstoffe. β-carotin bildet mit Schwefelsäure einen charakteristisch blau-schwarz gefärbten Komplex, da sie Eigenschaft der Lichtabsorption verändert wird. Aufgrund der Reaktionszeit der Farbveränderung und der Farbintensität lässt sich ein Rückschluss auf die Menge von β-carotin in den getesteten Lebensmitteln ziehen. 12
15 4 Schülerversuche Strukturformel von β-carotin: Entsorgung: Literatur: Reste können im Säure-Base-Abfall entsorgt werden. Es sollte auf den ph- Wert geachtet werden. Blume, R., (zuletzt abgerufen am , um Uhr) Unterrichtsanschlüsse: In diesem Versuch können noch weitere Lebensmittel auf β-carotin untersucht und auch die Farbintensität des farbigen Komplexes diskutiert werden. Im Anschluss können noch weitere Verbindungen mit Doppelbindungen in der Natur oder im Menschen besprochen werden. Somit wird eine Verknüpfung zur Biologie geschaffen und vernetz- 13
16 Arbeitsblatt zum Versuch: Unterscheidung Alkane und Alkene Aufgabe 1: Nenne die allgemeinen Summenformeln der Alkane und Alkene und beschreibe jeweils ihre Molekülstrukur und welche Eigenschaften sich dadurch ergeben Aufgabe 2: Erkläre den Unterschied zwischen der Bromierung von Alkanen und Alkenen, indem du die untere Tabelle ausfüllst. Nutzung der Bromierung Reaktionsablauf Produkte Reaktionstyp Bromierung von Hexan Bromierung von Hexen Aufgabe 3: Formuliere den Reaktionsmechanismus der elektrophilen Addition von Brom mit Cyclohexen in der Lewisschreibweise.
17 5 Didaktischer Kommentar zum Schülerarbeitsblatt 5 Didaktischer Kommentar zum Schülerarbeitsblatt Mit Hilfe dieses Arbeitsblattes sollen die Eigenschaften und die Reaktivität von Alkanen und Alkenen unterschieden werden. Außerdem sollen die bereits kennengelernten Reaktionsmechanismen der radikalische Substitution und elektrophile Addition differenziert werden. 5.1 Erwartungshorizont (Kerncurriculum) Das Kerncurriculum gibt vor, dass die SuS den Reaktionsmechanismus der radikalischen Substitution und den der elektrophilen Addition von symmetrischen Verbindungen beschreiben können. Da die SuS beide Reaktionen mit Brom kennengelernt haben, bietet es sich an diese miteinander zu vergleichen. Aufgabe 1 entspricht dem Anforderungsbereich I. Es geht darum Wissen zu reproduzieren und die einfache Unterscheidung von Alkanen und Alkenen zu treffen. Außerdem geht es um grundlegende Unterschiede in der Molekülstruktur, da das Kerncurriculum auch hier die Beschreibung von Molekülstrukturen von Stoffklassen explizit vorgibt. Aufgabe 2 soll den Anforderungsbereich II bedienen. Sie SuS erklären die wesentlichen Unterschiede einer Bromierung von einem Alkan und einer Bromierung von einem Alken. Dazu füllen sie eine vorbereitete Tabelle aus. Sie treffen Aussagen über den generellen Nutzen der Bromierung, über den Reaktionsablauf, über die entstehenden Produkte und die Reaktionstypen. Aufgabe 3 entspricht dem Anforderungsbereich III. Hier sollen sie den detaillierten Reaktionsmechanismus der elektrophilen Addition aufzeichnen. Hierzu müssen sie die Begriffe radikalische, elektrophile und nucleophile Teilchen unterscheiden. Ohne den Mechanismus ist ein tiefgreifendes Verständnis der Abläufe nicht gewährleistet. Im Hinblick auf das Abitur handelt es sich auch eine gute Vorbereitung, da das Kerncurriculum diesen Reaktionstyp voraussetzt. 5.2 Erwartungshorizont (inhaltlich) Aufgabe 1: Die allgemeine Summenformel der Alkane ist C n H 2n+2 und für die Alkene C n H 2n. Alkane haben nur C-C-Einfachbindungen und sind relativ reaktionsträge. Alkene weisen mindestens eine C-C- Doppelbindung auf. Durch die hohe Elektronendichte an der Doppelbindung, sind Alkene sehr reaktiv und dadurch für viele Synthesen interessant. 14
18 5 Didaktischer Kommentar zum Schülerarbeitsblatt Aufgabe 2: Bromierung von Hexan Bromierung von Hexen Nutzung der Bromierung Zur Herstellung eines Halogenalkans. Primär zum Nachweis von Doppelbindungen. Reaktionsablauf Produkte Reaktionstyp Einsetzen der Reaktion Zwei Produkte: Radikalische erst nach Bromhexan und Substitution Energiezufuhr Hydrogenbromid (Belichten); vergleichseise (HBr). (Hinweis: Ein lang- mögliches Neben- same Reaktion produkt ist n- Dodecan, das sich aus zwei Hexylradikalen bildet.) Sofortige, schnelle Ein Produkt: 1,2- Elektrophile Reaktion beim Dibromcyclohexan. Addition Zusammengeben; (Hinweis: Es gibt keine Belichtung keine Nebenprodukte.) (bzw. andere Energiezufuhr) erforderlich Aufgabe 3: 15
Vom Alkohol zum Alken
 Schulversuchspraktikum Sabine Wolff SoSe 2013 Klassenstufen 9 & 10 Vom Alkohol zum Alken 2 Auf einen Blick: Im Folgenden werden zwei Lehrerversuche vorgestellt, die die Darstellung von gasförmigen Alkenen
Schulversuchspraktikum Sabine Wolff SoSe 2013 Klassenstufen 9 & 10 Vom Alkohol zum Alken 2 Auf einen Blick: Im Folgenden werden zwei Lehrerversuche vorgestellt, die die Darstellung von gasförmigen Alkenen
Vom Alkohol zum Alken
 1 Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufe 9 & 10 Vom Alkohol zum Alken 2 Auf einem Blick: Diese Unterrichtseinheit für die Klasse 9 & 10 enthält Lehrerversuche und 1 Schülerversuch
1 Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufe 9 & 10 Vom Alkohol zum Alken 2 Auf einem Blick: Diese Unterrichtseinheit für die Klasse 9 & 10 enthält Lehrerversuche und 1 Schülerversuch
Arbeitsblatt Wie entstehen Farben?
 Arbeitsblatt Wie entstehen Farben? Der für das menschliche Auge sichtbare Wellenlängenbereich liegt bei 380-750 nm. Farbstoffe sind in der Lage bestimmte Wellenlängen des Lichts zu absorbieren und eine
Arbeitsblatt Wie entstehen Farben? Der für das menschliche Auge sichtbare Wellenlängenbereich liegt bei 380-750 nm. Farbstoffe sind in der Lage bestimmte Wellenlängen des Lichts zu absorbieren und eine
Summenformel Elektronenstrichformel Name Siedepunkt
 Die homologe Reihe der Alkene Summenformel Elektronenstrichformel Name Siedepunkt C 2 H 4 Ethen -104 C C 3 H 6 Propen -47 C C 4 H 8 1-Buten -6 C C 5 H 10 (...) 1-Penten 30 C C 6 H 12 (...) 1-Hexen 63 C
Die homologe Reihe der Alkene Summenformel Elektronenstrichformel Name Siedepunkt C 2 H 4 Ethen -104 C C 3 H 6 Propen -47 C C 4 H 8 1-Buten -6 C C 5 H 10 (...) 1-Penten 30 C C 6 H 12 (...) 1-Hexen 63 C
Vom Alkan zum Alkohol
 Schulversuchspraktikum Sommersemester 2016 Klassenstufen 9 & 10 Vom Alkan zum Alkohol Auf einen Blick: Das Protokoll Vom Alkan zum Alkohol enthält zwei Lehrerversuche und zwei Schülerversuche. Die Lehrerversuche
Schulversuchspraktikum Sommersemester 2016 Klassenstufen 9 & 10 Vom Alkan zum Alkohol Auf einen Blick: Das Protokoll Vom Alkan zum Alkohol enthält zwei Lehrerversuche und zwei Schülerversuche. Die Lehrerversuche
Aggregatzustände und deren Temperaturabhängigkeit
 Name: Sissy Freund Semester: Sommersemester 2013 Klassenstufen: 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Dieses Protokoll
Name: Sissy Freund Semester: Sommersemester 2013 Klassenstufen: 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Dieses Protokoll
Qualitativer Nachweis von Säuren und Basen
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen Kurzprotokoll Auf einen Blick: In diesem Protokoll wird ein Lehrerversuch, der
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen Kurzprotokoll Auf einen Blick: In diesem Protokoll wird ein Lehrerversuch, der
Schulversuchspraktikum. Name Thomas Polle. Sommersemester Klassenstufen 5 & 6. Feuer und Kerzen
 Schulversuchspraktikum Name Thomas Polle Sommersemester 2015 Klassenstufen 5 & 6 Feuer und Kerzen 2 Auf einen Blick: Es werden je ein Schüler- und Lehrerversuch zum Thema Kerzen und Feuer für den 5. und
Schulversuchspraktikum Name Thomas Polle Sommersemester 2015 Klassenstufen 5 & 6 Feuer und Kerzen 2 Auf einen Blick: Es werden je ein Schüler- und Lehrerversuch zum Thema Kerzen und Feuer für den 5. und
Reaktionen von Metallen mit Sauerstoff und mit Luft
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die
Versuch: Bromierung von n-hexan. Chemikalien Menge R-Sätze S-Sätze Gefahrensymbol Bemerkung
 Philipps-Universität Marburg 25.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 2: Alkane Versuch: omierung von n-hexan Zeitbedarf: Vorbereitung:
Philipps-Universität Marburg 25.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 2: Alkane Versuch: omierung von n-hexan Zeitbedarf: Vorbereitung:
Die elektrophile Addition
 Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
4. Alkene und Alkine : Reaktionen und Darstellung
 Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
n Pentan 2- Methylbutan 2,2, dimethylpropan ( Wasserstoffatome sind nicht berücksichtigt )
 Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Kohlenwasserstoffe. Alkane. Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind.
 2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
Qualitativer Nachweis von Säuren und Basen
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll
Reaktionstypen der Aliphate
 Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
4. Alkene und Alkine : Reaktionen und Darstellung
 Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Gruppe 2 vorgegebener Versuch Darstellung und Bromierung von Ethen
 Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: err Dr. Reiß Datum: 15.05.09 SS 09 Gruppe 2 vorgegebener Versuch Darstellung und omierung
Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: err Dr. Reiß Datum: 15.05.09 SS 09 Gruppe 2 vorgegebener Versuch Darstellung und omierung
Schulversuchspraktikum. Name: Tobias Piotrowski. Semester: Sommersemester 2013. Klassenstufen 9 & 10. ph-wert
 Schulversuchspraktikum Name: Tobias Piotrowski Semester: Sommersemester 2013 Klassenstufen 9 & 10 ph-wert 1 Beschreibung des Themas und zugehörige Lernziele (Max. 1 Seite) 2 Auf einen Blick: Dieses Protokoll
Schulversuchspraktikum Name: Tobias Piotrowski Semester: Sommersemester 2013 Klassenstufen 9 & 10 ph-wert 1 Beschreibung des Themas und zugehörige Lernziele (Max. 1 Seite) 2 Auf einen Blick: Dieses Protokoll
Schulversuchspraktikum. Michaela Micke. Sommersemester Klassenstufen 9 & 10. Chemie der Kohlenwasserstoffe. Methan & Erdgas
 Schulversuchspraktikum Michaela Micke Sommersemester 2012 Klassenstufen 9 & 10 Chemie der Kohlenwasserstoffe Methan & Erdgas 1 Konzept und Ziele 1 Auf einen Blick: Die vorliegende Unterrichtseinheit für
Schulversuchspraktikum Michaela Micke Sommersemester 2012 Klassenstufen 9 & 10 Chemie der Kohlenwasserstoffe Methan & Erdgas 1 Konzept und Ziele 1 Auf einen Blick: Die vorliegende Unterrichtseinheit für
Kunststoffe (Polykondensation)
 Kunststoffe (Polykondensation) Herstellung eines Phenoplasts 7. Stunde (13 15 14 00 Uhr) am Donnerstag, den 27. Januar 2011 Ein Chemieprotokoll von Sebastian Huber, Maximilian Mayer, Robert Bozsak und
Kunststoffe (Polykondensation) Herstellung eines Phenoplasts 7. Stunde (13 15 14 00 Uhr) am Donnerstag, den 27. Januar 2011 Ein Chemieprotokoll von Sebastian Huber, Maximilian Mayer, Robert Bozsak und
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Alkane. homologe Reihe. homologe Reihe der Alkane Nomenklatur. Isomerie. Gesättigte, kettenförmige Kohlenwasserstoffe
 Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
+ MnO MnO 3. Oxidierbarkeit primärer, sekundärer und tertiärer Alkohole. Chemikalien. Materialien
 DaChS xidierbarkeit primärer, sekundärer und tertiärer Alkohole 1 Versuch Nr. 005 xidierbarkeit primärer, sekundärer und tertiärer Alkohole C 3 Mn - 4 (violett) 3 C Mn 2 (braun) 3 C C 3 Mn - 4 (violett)
DaChS xidierbarkeit primärer, sekundärer und tertiärer Alkohole 1 Versuch Nr. 005 xidierbarkeit primärer, sekundärer und tertiärer Alkohole C 3 Mn - 4 (violett) 3 C Mn 2 (braun) 3 C C 3 Mn - 4 (violett)
Versuch: Qualitativer Nachweis von Kohlenstoff und Wasserstoff
 Philipps-Universität Marburg 20.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 1, Einführung in die OC Versuch: Qualitativer Nachweis
Philipps-Universität Marburg 20.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 1, Einführung in die OC Versuch: Qualitativer Nachweis
KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen
 KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen Ketone werden nicht weiter oxidiert Ether R1 - O - R2 R-O- ersetzt H bei einem Alkan Ether: MTBE (Antiklopfmittel) Tertiäre Alkohole
KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen Ketone werden nicht weiter oxidiert Ether R1 - O - R2 R-O- ersetzt H bei einem Alkan Ether: MTBE (Antiklopfmittel) Tertiäre Alkohole
Schulversuchspraktikum. Name: Jennifer Kölling. Sommersemester: Klassenstufen: 7/8. Sauerstoff. Das Gas des Lebens
 Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 7/8 Sauerstoff Das Gas des Lebens 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. Die Themeneinheit
Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 7/8 Sauerstoff Das Gas des Lebens 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. Die Themeneinheit
Beschreiben Sie den Aufbau und die Eigenschaften der Kohlenwasserstoffe. Beschreiben Sie die Alkane allgemein.
 den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
REAKTIONEN DER ORGANISCHEN CHEMIE
 REAKTIONEN DER ORGANISCHEN CHEMIE 1) ÜBERSICHT VON DEN REAKTIONEN AUSGEHEND: Die Reaktion der OC lassen sich auf 4 Grundtypen zurückführen: Grundtyp Addition Substitution Eliminierung Umlagerung allg A
REAKTIONEN DER ORGANISCHEN CHEMIE 1) ÜBERSICHT VON DEN REAKTIONEN AUSGEHEND: Die Reaktion der OC lassen sich auf 4 Grundtypen zurückführen: Grundtyp Addition Substitution Eliminierung Umlagerung allg A
Gruppe 13: Mischpolymerisation von Styrol und Maleinsäureanhydrid
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Reaktion: Gruppe 13: Mischpolymerisation von Styrol und Maleinsäureanhydrid
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Reaktion: Gruppe 13: Mischpolymerisation von Styrol und Maleinsäureanhydrid
Metalle und Nichtmetalle
 Schulversuchspraktium Bastian Hollemann Sommersemester 2015 Klassenstufen 9 & 10 Metalle und Nichtmetalle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Diese Unterrichtseinheit für
Schulversuchspraktium Bastian Hollemann Sommersemester 2015 Klassenstufen 9 & 10 Metalle und Nichtmetalle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Diese Unterrichtseinheit für
Kohlenhydrate in Lebensmitteln Schokolade ist nicht gleich Schokolade!
 Kohlenhydrate in Lebensmitteln ist nicht gleich! Einführung Sicher hast du schon davon gehört, dass es verschiedene Zuckerarten gibt. So gibt es Traubenzucker (Glucose), Fruchtzucker (Fructose) und natürlich
Kohlenhydrate in Lebensmitteln ist nicht gleich! Einführung Sicher hast du schon davon gehört, dass es verschiedene Zuckerarten gibt. So gibt es Traubenzucker (Glucose), Fruchtzucker (Fructose) und natürlich
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Beschreiben Sie den Aufbau und die Eigenschaften der Kohlenwasserstoffe.
 den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
Schulversuchspraktikum. Anne Bergmann. Sommersemester Klassenstufen 11 & 12. Kunststoffe
 Schulversuchspraktikum Anne Bergmann Sommersemester 2015 Klassenstufen 11 & 12 Kunststoffe 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll werden zwei Versuche erklärt,
Schulversuchspraktikum Anne Bergmann Sommersemester 2015 Klassenstufen 11 & 12 Kunststoffe 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll werden zwei Versuche erklärt,
Alkane als Kraftstoffe
 Alkane als Kraftstoffe Du hast bereits gelernt, dass bei der fraktionierten Destillation Alkane erhalten werden können, die geeignet sind als Kraftstoffe eingesetzt zu werden. Unterschiedliche Motoren
Alkane als Kraftstoffe Du hast bereits gelernt, dass bei der fraktionierten Destillation Alkane erhalten werden können, die geeignet sind als Kraftstoffe eingesetzt zu werden. Unterschiedliche Motoren
Energie und Energieumwandlung
 Schulversuchspraktikum Maximilian Wolf Sommersemester Klassenstufen 7 & 8 Energie und Energieumwandlung Kurzprotokoll Auf einen Blick: In Versuch 1 werden Lycopodium-Sporen (Bärlapp) in der Gasbrennerflamme
Schulversuchspraktikum Maximilian Wolf Sommersemester Klassenstufen 7 & 8 Energie und Energieumwandlung Kurzprotokoll Auf einen Blick: In Versuch 1 werden Lycopodium-Sporen (Bärlapp) in der Gasbrennerflamme
Qualitative Nachweise von Säuren und Basen
 Schulversuchspraktikum Miriam Jarrar Sommersemester 2012 Klassenstufen 9 & 10 Qualitative Nachweise von Säuren und Basen Auf einen Blick: Dieses Protokoll beinhaltet 3 Lehrerversuche und 2 Schülerversuche
Schulversuchspraktikum Miriam Jarrar Sommersemester 2012 Klassenstufen 9 & 10 Qualitative Nachweise von Säuren und Basen Auf einen Blick: Dieses Protokoll beinhaltet 3 Lehrerversuche und 2 Schülerversuche
4.1 Vergleich von physikalischem Vorgang und chemischer Reaktion. Aufgabe. Woran lassen sich chemische Reaktionen erkennen? (1)
 Naturwissenschaften - Chemie - Allgemeine Chemie - 4 Chemische Reaktionen (P75200) 4. Vergleich von physikalischem Vorgang und chemischer Reaktion Experiment von: Phywe Gedruckt:.0.203 2:58:37 intertess
Naturwissenschaften - Chemie - Allgemeine Chemie - 4 Chemische Reaktionen (P75200) 4. Vergleich von physikalischem Vorgang und chemischer Reaktion Experiment von: Phywe Gedruckt:.0.203 2:58:37 intertess
Versuch: Kohlenhydrate in Lebensmitteln Nachweis von Zucker
 Name: Datum: Versuch: Kohlenhydrate in Lebensmitteln Nachweis von Zucker Geräte Heizplatte, Bechergläser, Reagenzgläser, Reagenzglasständer, Spatel, Faltenfilter, Trichter Materialien Lebensmittel: Glucose,
Name: Datum: Versuch: Kohlenhydrate in Lebensmitteln Nachweis von Zucker Geräte Heizplatte, Bechergläser, Reagenzgläser, Reagenzglasständer, Spatel, Faltenfilter, Trichter Materialien Lebensmittel: Glucose,
Säuren und Laugen im Haushalt
 Schulversuchspraktikum Maximilian Konrad Sommersemester 2012 Klassenstufen 9 & 10 Säuren und Laugen im Haushalt Auf einen Blick: Diese Unterrichtseinheit für die Klassen 9 und 10 enthält 2 Lehrerversuche,
Schulversuchspraktikum Maximilian Konrad Sommersemester 2012 Klassenstufen 9 & 10 Säuren und Laugen im Haushalt Auf einen Blick: Diese Unterrichtseinheit für die Klassen 9 und 10 enthält 2 Lehrerversuche,
Versuchsprotokoll:Stärkespaltung
 Versuchsprotokoll:Stärkespaltung Zeitaufwand: Aufbau: 5 Minuten Durchführung: 20 Minuten Abbau/Entsorgung:: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz Pentahydrat
Versuchsprotokoll:Stärkespaltung Zeitaufwand: Aufbau: 5 Minuten Durchführung: 20 Minuten Abbau/Entsorgung:: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz Pentahydrat
Schulversuchspraktikum. Michaela Micke. Sommersemester Klassenstufen 11 & 12. Chemie der Kohlenwasserstoffe. Ether & Ester
 Schulversuchspraktikum Michaela Micke Sommersemester 2012 Klassenstufen 11 & 12 Chemie der Kohlenwasserstoffe Ether & Ester Auf einen Blick: Die vorliegende Unterrichtseinheit für die Klassen 11 & 12 enthält
Schulversuchspraktikum Michaela Micke Sommersemester 2012 Klassenstufen 11 & 12 Chemie der Kohlenwasserstoffe Ether & Ester Auf einen Blick: Die vorliegende Unterrichtseinheit für die Klassen 11 & 12 enthält
Quantitative Analyse von Kohlenwasserstoffen
 Schulversuchspraktikum SoSe 2013 Klassenstufen 11 & 12 Quantitative Analyse von Kohlenwasserstoffen 2 Auf einen Blick: Im Folgenden werden zunächst drei Versuche vorgestellt, welche die benötigten Teilschritte
Schulversuchspraktikum SoSe 2013 Klassenstufen 11 & 12 Quantitative Analyse von Kohlenwasserstoffen 2 Auf einen Blick: Im Folgenden werden zunächst drei Versuche vorgestellt, welche die benötigten Teilschritte
Untersuche an einigen Beispielen, welche Grundstoffe am Aufbau unserer Nahrung beteiligt sind.
 Naturwissenschaften - Biologie - Allgemeine Biologie - 4 Unsere Nahrungsmittel und ihre Verdauung (P802200) 4. Nahrungsmittel und Nährstoffe Experiment von: Phywe Gedruckt: 07.0.203 5:36:8 intertess (Version
Naturwissenschaften - Biologie - Allgemeine Biologie - 4 Unsere Nahrungsmittel und ihre Verdauung (P802200) 4. Nahrungsmittel und Nährstoffe Experiment von: Phywe Gedruckt: 07.0.203 5:36:8 intertess (Version
Allgemeines schulinternes Curriculum für die gymnasiale Oberstufe. Einführungsphase (EF):
 Allgemeines schulinternes Curriculum für die gymnasiale Oberstufe Einführungsphase (EF): Themenfeld A : Reaktionsfolge aus der organischen Chemie: Vom Alkohol zum Aromastoff Themenfeld B : Ein technischer
Allgemeines schulinternes Curriculum für die gymnasiale Oberstufe Einführungsphase (EF): Themenfeld A : Reaktionsfolge aus der organischen Chemie: Vom Alkohol zum Aromastoff Themenfeld B : Ein technischer
Versuchsprotokoll: Reaktion von Zucker mit Schwefelsäure
 Versuchsprotokoll: Reaktion von Zucker mit Schwefelsäure Zeitaufwand: Aufbau: Durchführung: Abbau/Entsorgung: 5 Minuten 10 Minuten 5 Minuten Chemikalien: Chemikalie Menge RSätze SSätze Gefahrensymbol Schwefelsäure
Versuchsprotokoll: Reaktion von Zucker mit Schwefelsäure Zeitaufwand: Aufbau: Durchführung: Abbau/Entsorgung: 5 Minuten 10 Minuten 5 Minuten Chemikalien: Chemikalie Menge RSätze SSätze Gefahrensymbol Schwefelsäure
Organische Chemie 10C1. Funktionelle Gruppen 10C2. Homologe Reihe der Alkane 10C3. Nomenklatur der Alkane (gesättigte Kohlenwasserstoffe) 10C4
 Organische Chemie 10C1 Chemie der Kohlenstoffverbindungen (C und v.a. H, N, O, S) C-Atome immer vierbindig Funktionelle Gruppen 10C2 Alkan: nur Einfachbindungen Alken: mindestens eine Doppelbindung Alkin:
Organische Chemie 10C1 Chemie der Kohlenstoffverbindungen (C und v.a. H, N, O, S) C-Atome immer vierbindig Funktionelle Gruppen 10C2 Alkan: nur Einfachbindungen Alken: mindestens eine Doppelbindung Alkin:
Chemie der Kohlenwasserstoffe
 hemie der Kohlenwasserstoffe Alkane Gesättigte, kettenförmige Kohlenwasserstoffe gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane
hemie der Kohlenwasserstoffe Alkane Gesättigte, kettenförmige Kohlenwasserstoffe gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane
Schulversuchspraktikum. Julia Müller. Klassenstufen 5/6. Feuer und Kerzen
 Schulversuchspraktikum Name Julia Müller Semester SoSe 2012 Klassenstufen 5/6 Feuer und Kerzen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Diese Unterrichtseinheit für die Klassenstufen
Schulversuchspraktikum Name Julia Müller Semester SoSe 2012 Klassenstufen 5/6 Feuer und Kerzen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Diese Unterrichtseinheit für die Klassenstufen
Gruppe 01: Elementarnachweis: Kohlenstoff- und Wasserstoffnachweis
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 01: Elementarnachweis: Kohlenstoff- und Wasserstoffnachweis Reaktion:
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 01: Elementarnachweis: Kohlenstoff- und Wasserstoffnachweis Reaktion:
Gruppe 04: Kern- und Seitenkettenbromierung von Toluol
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 04: Kern- und Seitenkettenbromierung von Toluol Reaktion: Chemikalien:
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 04: Kern- und Seitenkettenbromierung von Toluol Reaktion: Chemikalien:
Grundwissenkarten Hans-Carossa-Gymnasium
 Grundwissenkarten Hans-Carossa-Gymnasium Oberstufe Chemie SG Es sind insgesamt 27 Karten für die Oberstufe erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Grundwissenkarten Hans-Carossa-Gymnasium Oberstufe Chemie SG Es sind insgesamt 27 Karten für die Oberstufe erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Schulversuchspraktikum. Rainer Mucha. Sommersemester Klassenstufen 11 & 12. Kunststoffe
 Schulversuchspraktikum Rainer Mucha Sommersemester 2013 Klassenstufen 11 & 12 Kunststoffe Auf einen Blick: Dieses Protokoll behandelt den alltäglich genutzten Kunststoff in verschiedenen Variationen. Aufgrund
Schulversuchspraktikum Rainer Mucha Sommersemester 2013 Klassenstufen 11 & 12 Kunststoffe Auf einen Blick: Dieses Protokoll behandelt den alltäglich genutzten Kunststoff in verschiedenen Variationen. Aufgrund
Inhaltsverzeichnis. 3 Gesättigte Kohlenwasserstoffe (Alkane) 3.1 Offenkettige Alkane 3.2 Cyclische Alkane
 Inhaltsverzeichnis 1 Chemische Bindung in organischen Verbindungen 1.1 Einleitung 1.2 Grundlagen der chemischen Bindung 1.3 Die Atombindung (kovalente oder homöopolare Bindung) 1.4 Bindungslängen und Bindungsenergien
Inhaltsverzeichnis 1 Chemische Bindung in organischen Verbindungen 1.1 Einleitung 1.2 Grundlagen der chemischen Bindung 1.3 Die Atombindung (kovalente oder homöopolare Bindung) 1.4 Bindungslängen und Bindungsenergien
Reaktionen von Metallen mit Sauerstoff und mit Luft; Zerteilungsgrad
 Schulversuchspraktikum Mona-Christin Maaß Sommersemester 2013 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft; Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele
Schulversuchspraktikum Mona-Christin Maaß Sommersemester 2013 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft; Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele
Schulversuchspraktikum. Sina Bachsmann. Sommersemester. Klassenstufen 11 &12. Kosmetikartikel
 Schulversuchspraktikum Sina Bachsmann Sommersemester Klassenstufen 11 &12 Kosmetikartikel 1 Lehrerversuche 1 Auf einen Blick: Dieses Protokoll enthält einen Lehrerversuch und vier Schülerversuche zum Thema
Schulversuchspraktikum Sina Bachsmann Sommersemester Klassenstufen 11 &12 Kosmetikartikel 1 Lehrerversuche 1 Auf einen Blick: Dieses Protokoll enthält einen Lehrerversuch und vier Schülerversuche zum Thema
Wir untersuchen Mineralwasser
 Wir untersuchen Mineralwasser Jeder von uns kennt es: Mineralwasser. Im Geschäft wird es mit viel, wenig oder gar keiner Kohlensäure angeboten. Kohlensäure beschreibt die Form, in der das Gas Kohlenstoffdioxid
Wir untersuchen Mineralwasser Jeder von uns kennt es: Mineralwasser. Im Geschäft wird es mit viel, wenig oder gar keiner Kohlensäure angeboten. Kohlensäure beschreibt die Form, in der das Gas Kohlenstoffdioxid
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Die Nomenklatur organischer Verbindungen - ein Übungszirkel
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die Nomenklatur organischer Verbindungen - ein Übungszirkel Das komplette Material finden Sie hier: School-Scout.de 2 von 28 4. Nomenklatur
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die Nomenklatur organischer Verbindungen - ein Übungszirkel Das komplette Material finden Sie hier: School-Scout.de 2 von 28 4. Nomenklatur
Schulversuchspraktikum. Sommersemester 2014 Klassenstufen 7 & 8. Reaktionen von Metallen mit Sauerstoff und mit Luft.
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum. Dirk Schlemme. Sommersemester Klassenstufen 11 & 12. Alkanone
 Schulversuchspraktikum Dirk Schlemme Sommersemester 2012 Klassenstufen 11 & 12 Alkanone 1 Konzept und Ziele 1 Auf einen Blick: Die Alkanone spielen im alltäglichen Leben nur noch eine untergeordnete Rolle.
Schulversuchspraktikum Dirk Schlemme Sommersemester 2012 Klassenstufen 11 & 12 Alkanone 1 Konzept und Ziele 1 Auf einen Blick: Die Alkanone spielen im alltäglichen Leben nur noch eine untergeordnete Rolle.
Schulversuchspraktikum. Name: Jennifer Kölling. Sommersemester: 2012. Klassenstufen: 11/12. Tenside
 Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 11/12 Tenside 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. Die Themeneinheit der Tenside in der
Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 11/12 Tenside 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. Die Themeneinheit der Tenside in der
Versuchsprotokoll: Fehling- Spaltung von Saccharose
 Versuchsprotokoll: Fehling- Spaltung von Saccharose Zeitaufwand: Vorbereitung: 5 Minuten Durchführung: 15 Minuten Abbau/Entsorgung: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol
Versuchsprotokoll: Fehling- Spaltung von Saccharose Zeitaufwand: Vorbereitung: 5 Minuten Durchführung: 15 Minuten Abbau/Entsorgung: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol
Welche Elemente außer Kohlenstoff und Wasserstoff können in Polymeren enthalten sein?
 Naturwissenschaften - Chemie - Polymerchemie - Der Polymerbegriff (P78000).2 Polymerbestandteile (2) - Nachweis von Polymerbestandteilen - Beilsteinprobe Experiment von: Seb Gedruckt: 24.03.204 3:09:20
Naturwissenschaften - Chemie - Polymerchemie - Der Polymerbegriff (P78000).2 Polymerbestandteile (2) - Nachweis von Polymerbestandteilen - Beilsteinprobe Experiment von: Seb Gedruckt: 24.03.204 3:09:20
Vorlesung Organische Chemie II Reaktionsmechanismen (3. Sem.)
 Vorlesung Organische Chemie II Reaktionsmechanismen (3. Sem.) Gliederung Grundlagen der physikalisch-organischen Chemie Radikalreaktionen Nukleophile und elektrophile Substitution am gesättigten C-Atom
Vorlesung Organische Chemie II Reaktionsmechanismen (3. Sem.) Gliederung Grundlagen der physikalisch-organischen Chemie Radikalreaktionen Nukleophile und elektrophile Substitution am gesättigten C-Atom
Säuren und Basen im Haushalt
 Schulversuchspraktikum Lars Lichtenberg Sommersemester 2015 Klassenstufen 9 & 10 Säuren und Basen im Haushalt 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die Unterrichtseinheit,,Säuren
Schulversuchspraktikum Lars Lichtenberg Sommersemester 2015 Klassenstufen 9 & 10 Säuren und Basen im Haushalt 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die Unterrichtseinheit,,Säuren
Was versteht man unter "ungesättigten" Kohlenwasserstoffen?
 Naturwissenschaften - Chemie - Organische Chemie - 2 Kohlenwasserstoffe (P77000) 2.4 Ethendarstellung Experiment von: PHYWE Gedruckt: 0.02.206 :0:32 intertess (Version 3.2 B24, Export 2000) Aufgabe Aufgabe
Naturwissenschaften - Chemie - Organische Chemie - 2 Kohlenwasserstoffe (P77000) 2.4 Ethendarstellung Experiment von: PHYWE Gedruckt: 0.02.206 :0:32 intertess (Version 3.2 B24, Export 2000) Aufgabe Aufgabe
Schulversuchspraktikum. Name: Jennifer Kölling. Sommersemester: Klassenstufen: 5/6. Die Luft. Das unsichtbare Gasgemisch
 Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 5/6 Die Luft Das unsichtbare Gasgemisch 1Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. In dieser
Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 5/6 Die Luft Das unsichtbare Gasgemisch 1Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. In dieser
Definiere den Begriff Orbital. Erkläre den ph-wert! Erkläre die Autoprotolyse des Wassers mit Hilfe der Reaktionsgleichung.
 Definiere den Begriff rbital. Das rbital ist ein Bereich, in dem sich ein Elektron mit großer Wahrscheinlichkeit befindet. In jedem rbital befinden sich maximal zwei Elektronen. Erkläre den pwert! Der
Definiere den Begriff rbital. Das rbital ist ein Bereich, in dem sich ein Elektron mit großer Wahrscheinlichkeit befindet. In jedem rbital befinden sich maximal zwei Elektronen. Erkläre den pwert! Der
Versuch: Darstellung eines Azofarbstoffes (Methylorange)
 PhilippsUniversität Marburg 02.02.2008 rganisches Grundpraktikum (LA) Katrin ohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß W 2007/08 Gruppe 12, Farbstoffe, Wirkstoffe Versuch: Darstellung eines
PhilippsUniversität Marburg 02.02.2008 rganisches Grundpraktikum (LA) Katrin ohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß W 2007/08 Gruppe 12, Farbstoffe, Wirkstoffe Versuch: Darstellung eines
Grundwissenkarten Hans-Carossa- Gymnasium
 Grundwissenkarten Hans-Carossa- Gymnasium 10. Klasse Chemie SG Es sind insgesamt 20 Karten für die 10. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Grundwissenkarten Hans-Carossa- Gymnasium 10. Klasse Chemie SG Es sind insgesamt 20 Karten für die 10. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Arbeitsblatt Wasserkreislauf der Erde
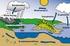 Arbeitsblatt Wasserkreislauf der Erde Aufgabe 1) Du hast im Unterricht bereits den Begriff des Aggregatzustands kennengelernt. Benenne die Übergänge zwischen den Aggregatzuständen, indem du die Pfeile
Arbeitsblatt Wasserkreislauf der Erde Aufgabe 1) Du hast im Unterricht bereits den Begriff des Aggregatzustands kennengelernt. Benenne die Übergänge zwischen den Aggregatzuständen, indem du die Pfeile
3002 Addition von Brom an Fumarsäure zu meso-dibrombernsteinsäure
 32 Addition von Brom an Fumarsäure zu meso-dibrombernsteinsäure OOC COO Br 2 OOC Br Br COO C 4 4 O 4 (6.) (59.8) C 4 4 Br 2 O 4 (275.9) Literatur A. M. McKenzie, J. Chem. Soc., 92,, 96 M. Eissen, D. Lenoir,
32 Addition von Brom an Fumarsäure zu meso-dibrombernsteinsäure OOC COO Br 2 OOC Br Br COO C 4 4 O 4 (6.) (59.8) C 4 4 Br 2 O 4 (275.9) Literatur A. M. McKenzie, J. Chem. Soc., 92,, 96 M. Eissen, D. Lenoir,
Farbenspiel der Redoxreaktionen
 Schulversuchspraktikum Name: Christoph Biesemann Semester: Sommersemester 2012 Klassenstufe 7-8 Farbenspiel der Redoxreaktionen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In
Schulversuchspraktikum Name: Christoph Biesemann Semester: Sommersemester 2012 Klassenstufe 7-8 Farbenspiel der Redoxreaktionen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In
Schulversuchspraktikum. Sommersemester 2013. Klassenstufen 7 & 8. Katalysatoren
 Schulversuchspraktikum Sommersemester 2013 Klassenstufen 7 & 8 Katalysatoren 2 Auf einen Blick: In diesem Protokoll werden sechs Versuche dargestellt, die drei inhaltliche Lernziele verfolgen: Sie zeigen,
Schulversuchspraktikum Sommersemester 2013 Klassenstufen 7 & 8 Katalysatoren 2 Auf einen Blick: In diesem Protokoll werden sechs Versuche dargestellt, die drei inhaltliche Lernziele verfolgen: Sie zeigen,
Grundwissen Chemie Jahrgangsstufe 10, naturwissenschaftlicher Zweig. Methan Ethan Propan Butan Pentan Hexan Heptan Octan Nonan Decan
 Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Vorprüfung in Chemie für Studierende des Maschinenbaus und des Gewerbelehramts Studiengang Bachelor
 Grundlagen der Chemie für Studierende des Maschinenbaus, Prof. Deutschmann Vorprüfung in Chemie für Studierende des Maschinenbaus und des Gewerbelehramts Studiengang Bachelor Freitag, 20. März 2009, 14:00-17:00
Grundlagen der Chemie für Studierende des Maschinenbaus, Prof. Deutschmann Vorprüfung in Chemie für Studierende des Maschinenbaus und des Gewerbelehramts Studiengang Bachelor Freitag, 20. März 2009, 14:00-17:00
CHE 172.1: Organische Chemie für die Life Sciences
 1 E 172.1: Organische hemie für die Life Sciences Prof Dr. J. A. Robinson 4. Alkene und Alkine : Reaktionen und erstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken
1 E 172.1: Organische hemie für die Life Sciences Prof Dr. J. A. Robinson 4. Alkene und Alkine : Reaktionen und erstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken
Schulversuchspraktikum. Anne Bergmann. Sommersemester Klassenstufen 9 & 10. Alkalimetalle
 Schulversuchspraktikum Anne Bergmann Sommersemester 2015 Klassenstufen 9 & 10 Alkalimetalle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll wird zunächst fachlich
Schulversuchspraktikum Anne Bergmann Sommersemester 2015 Klassenstufen 9 & 10 Alkalimetalle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll wird zunächst fachlich
3.11 Zerlegung von Wasser durch Reduktionsmittel. Aufgabe. Aus welchen Elementen besteht Wasser?
 Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P755500) 3. Zerlegung von Wasser durch Reduktionsmittel Experiment von: Seb Gedruckt: 24.03.204 :42:33
Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P755500) 3. Zerlegung von Wasser durch Reduktionsmittel Experiment von: Seb Gedruckt: 24.03.204 :42:33
Reinstoffe und Stoffgemische
 Schulversuchspraktikum Dörte Hartje Sommersemester 2013 Klassenstufen 5 & 6 Reinstoffe und Stoffgemische Auf einen Blick: Dieses Versuchsprotokoll enthält zwei Lehrer- und vier SchülerInnenexperimente
Schulversuchspraktikum Dörte Hartje Sommersemester 2013 Klassenstufen 5 & 6 Reinstoffe und Stoffgemische Auf einen Blick: Dieses Versuchsprotokoll enthält zwei Lehrer- und vier SchülerInnenexperimente
Erftgymnasium der Stadt Bergheim. Schulinternes Curriculum für das Fach Chemie in der Sekundarstufe II
 Erftgymnasium der Stadt Bergheim Schulinternes Curriculum für das Fach Chemie in der Sekundarstufe II Als Fortführung des Unterrichts in der Sekundarstufe I wird Schülerinnen und Schülern ein anwendungs-
Erftgymnasium der Stadt Bergheim Schulinternes Curriculum für das Fach Chemie in der Sekundarstufe II Als Fortführung des Unterrichts in der Sekundarstufe I wird Schülerinnen und Schülern ein anwendungs-
Endersch, Jonas 26./ Praktikum Allgemeine Chemie 2, Saal G1, Platz 53
 Endersch, Jonas 26./27.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.4a: Herstellung von 2,5 Dibrombenzochinon Reaktionsgleichung: Einleitung und Theorie: In diesem
Endersch, Jonas 26./27.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.4a: Herstellung von 2,5 Dibrombenzochinon Reaktionsgleichung: Einleitung und Theorie: In diesem
Becherglas mit Wasser, 4 Reagenzgläser, Thermometer, Brenner. Proben von Schweineschmalz, Butter, Kokosfett, Sonnenblumenöl
 Station 1: Schmelztemperatur der Fette Becherglas mit Wasser, 4 Reagenzgläser, Thermometer, Brenner Proben von Schweineschmalz, Butter, Kokosfett, Sonnenblumenöl Geben Sie Proben verschiedener Fette in
Station 1: Schmelztemperatur der Fette Becherglas mit Wasser, 4 Reagenzgläser, Thermometer, Brenner Proben von Schweineschmalz, Butter, Kokosfett, Sonnenblumenöl Geben Sie Proben verschiedener Fette in
1. Qualitativer Nachweis von Anionen und Sodaauszug
 Anionennachweis 1 1. Qualitativer Nachweis von Anionen und Sodaauszug Die moderne Analytische Chemie unterscheidet zwischen den Bereichen der qualitativen und quantitativen Analyse sowie der Strukturanalyse.
Anionennachweis 1 1. Qualitativer Nachweis von Anionen und Sodaauszug Die moderne Analytische Chemie unterscheidet zwischen den Bereichen der qualitativen und quantitativen Analyse sowie der Strukturanalyse.
Decan Homologe Reihe der Alkane, unterschiedlich lange C-Ketten mit C- C (sp 3 /sp 3 ) und C-H (sp 3 /s)-bindungen (σ-bindungen) Beispiele: Butan
 1 30.09.005 0.1 Alkane Eine einfache Stoffgruppe der organischen Chemie sind die Alkane. Dabei handelt es sich um eine spezielle Gruppe der Kohlenwasserstoffe (KW). Alle Alkane gehorchen folgendem Prinzip:
1 30.09.005 0.1 Alkane Eine einfache Stoffgruppe der organischen Chemie sind die Alkane. Dabei handelt es sich um eine spezielle Gruppe der Kohlenwasserstoffe (KW). Alle Alkane gehorchen folgendem Prinzip:
Grundwissen Chemie 10 WSG/SG
 Grundwissen Chemie 10 WSG/SG Orbital Unter einem Orbital versteht man einen Raum, in dem sich ein Elektron mit einer bestimmten Wahrscheinlichkeit aufhält. Valenzelektronenpaarabstoßungsmodell (VEPA-Modell)
Grundwissen Chemie 10 WSG/SG Orbital Unter einem Orbital versteht man einen Raum, in dem sich ein Elektron mit einer bestimmten Wahrscheinlichkeit aufhält. Valenzelektronenpaarabstoßungsmodell (VEPA-Modell)
Welche Eigenschaften besitzen Calcium- und Magnesiumlaugen?
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P758900) 2.5 Herstellung und Eigenschaften von Kalkwasser (Magnesiumhydroxidlösung) Experiment von: Phywe Gedruckt: 5.0.203 2:3:05 intertess
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P758900) 2.5 Herstellung und Eigenschaften von Kalkwasser (Magnesiumhydroxidlösung) Experiment von: Phywe Gedruckt: 5.0.203 2:3:05 intertess
6.1 Nachweis von Vitamin C. Aufgabe. Welche Lebensmittel enthalten Vitamin C? Naturwissenschaften - Chemie - Lebensmittelchemie - 6 Vitamine
 Naturwissenschaften - Chemie - Lebensmittelchemie - 6 Vitamine (P787800) 6. Nachweis von Vitamin C Experiment von: Anouch Gedruckt: 28.02.204 :2:46 intertess (Version 3.2 B24, Export 2000) Aufgabe Aufgabe
Naturwissenschaften - Chemie - Lebensmittelchemie - 6 Vitamine (P787800) 6. Nachweis von Vitamin C Experiment von: Anouch Gedruckt: 28.02.204 :2:46 intertess (Version 3.2 B24, Export 2000) Aufgabe Aufgabe
Alkohole und deren Eigenschaften
 Schulversuchspraktikum Dirk Schlemme Sommersemester 2012 Klassenstufen 9 & 10 Alkohole und deren Eigenschaften 1 Konzept und Ziele 1 Auf einen Blick: Die homologe Reihe der Alkohole grenzt sich durch einige
Schulversuchspraktikum Dirk Schlemme Sommersemester 2012 Klassenstufen 9 & 10 Alkohole und deren Eigenschaften 1 Konzept und Ziele 1 Auf einen Blick: Die homologe Reihe der Alkohole grenzt sich durch einige
Homogene und Heterogene Gemische
 Schulversuchspraktikum Name Nicolai ter Horst Semester SS 2013 Klassenstufen 7 & 8 Homogene und Heterogene Gemische 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll
Schulversuchspraktikum Name Nicolai ter Horst Semester SS 2013 Klassenstufen 7 & 8 Homogene und Heterogene Gemische 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll
Homologe Reihe der Alkane. Benennung der Alkane. Konstitutionsisomerie. Isomerie. Was versteht man unter der Homologen Reihe der Alkane?
 Grundwissen hemie: NTG 10 1/24 omologe eihe der Alkane Was versteht man unter der omologen eihe der Alkane? Grundwissen hemie: NTG 10 2/24 Benennung der Alkane Benenne die ersten zwölf Vertreter aus der
Grundwissen hemie: NTG 10 1/24 omologe eihe der Alkane Was versteht man unter der omologen eihe der Alkane? Grundwissen hemie: NTG 10 2/24 Benennung der Alkane Benenne die ersten zwölf Vertreter aus der
Organische Chemie. 1. Formuliere die Startreaktion und die Reaktionskette bei der Umsetzung von Ethan mit Chlor. Wie heisst dieser Reaktionstyp?
 Organische Chemie 1. Formuliere die Startreaktion und die Reaktionskette bei der Umsetzung von Ethan mit Chlor. Wie heisst dieser Reaktionstyp? 2. Chlorwasserstoff reagiert mit 1-Buten. Formuliere den
Organische Chemie 1. Formuliere die Startreaktion und die Reaktionskette bei der Umsetzung von Ethan mit Chlor. Wie heisst dieser Reaktionstyp? 2. Chlorwasserstoff reagiert mit 1-Buten. Formuliere den
Aktivierungsenergie und Katalyse
 1 Beschreibung des Themas und zugehörige Lernziele Schulversuchspraktikum Marie-Lena Gallikowski Sommersemester 2015 Klassenstufen 7 & 8 Aktivierungsenergie und Katalyse 1 Beschreibung des Themas und zugehörige
1 Beschreibung des Themas und zugehörige Lernziele Schulversuchspraktikum Marie-Lena Gallikowski Sommersemester 2015 Klassenstufen 7 & 8 Aktivierungsenergie und Katalyse 1 Beschreibung des Themas und zugehörige
Reaktion zwischen Aluminiumpulver und Iod
 Reaktionsgleichung 2 Al (s) + 3 2 (s) Al 2 6 (s) Zeitbedarf Vorbereitung: 5 min. Durchführung: 15 min. Nachbereitung: 20 min. Chemikalienliste Edukte Chemikalien Summenformel Menge R-Sätze S-Sätze Gefahrensymbole
Reaktionsgleichung 2 Al (s) + 3 2 (s) Al 2 6 (s) Zeitbedarf Vorbereitung: 5 min. Durchführung: 15 min. Nachbereitung: 20 min. Chemikalienliste Edukte Chemikalien Summenformel Menge R-Sätze S-Sätze Gefahrensymbole
Grundwissen Chemie. 8. Jahrgangsstufe, Gruppe I
 Grundwissen Chemie 8. Jahrgangsstufe, Gruppe I Stoffe, Experimente - Stoffe und Stoffgemische unterscheiden Stoffeigenschaften, Reinstoffe, Gemische, Trennverfahren - Teilchenmodell: Atome und Moleküle
Grundwissen Chemie 8. Jahrgangsstufe, Gruppe I Stoffe, Experimente - Stoffe und Stoffgemische unterscheiden Stoffeigenschaften, Reinstoffe, Gemische, Trennverfahren - Teilchenmodell: Atome und Moleküle
Kommentierter Themenschwerpunkt 3: Halogenierte Kohlenwasserstoffe als Zwischen- und Endprodukte der chemischen Industrie
 Kommentierter Themenschwerpunkt 3: Halogenierte Kohlenwasserstoffe als Zwischen- und Endprodukte der chemischen Industrie Vorgabe Stoffklassen: Halogene Halogenwas- Stoffklassen: serstoffe Stoffklassen:
Kommentierter Themenschwerpunkt 3: Halogenierte Kohlenwasserstoffe als Zwischen- und Endprodukte der chemischen Industrie Vorgabe Stoffklassen: Halogene Halogenwas- Stoffklassen: serstoffe Stoffklassen:
Versuchsprotokoll: Zuckerwürfel in Kaliumchlorat
 Versuchsprotokoll: Zuckerwürfel in Kaliumchlorat Zeitaufwand: Aufbau: 5 Minuten Durchführung: 10 Minuten Entsorgung: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz
Versuchsprotokoll: Zuckerwürfel in Kaliumchlorat Zeitaufwand: Aufbau: 5 Minuten Durchführung: 10 Minuten Entsorgung: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz
3 150 ml-bechergläser als Wasserbäder Thermometer 2 ml-plastikpipetten Parafilm
 Nachweis der Enzymaktivität und Enzymhemmung Chemikalien: Harnstofflösung (10% w/v) Phenolphtalein-Lösung Urease rohe Kartoffel Wasserstoffperoxid-Lösung (30 % w/v) Bäckerhefe verdünnte Lösung von Methylenblau
Nachweis der Enzymaktivität und Enzymhemmung Chemikalien: Harnstofflösung (10% w/v) Phenolphtalein-Lösung Urease rohe Kartoffel Wasserstoffperoxid-Lösung (30 % w/v) Bäckerhefe verdünnte Lösung von Methylenblau
Schweizerische Maturitätsprüfung Gruppe / Kandidat/in Nr:... Winter 2010, Zürich Name/Vorname:...
 Gruppe / Kandidat/in Nr:... Name/Vorname:... Grundlagenfach Bereich Teil: NATURWISSENSCHAFTEN Chemie Verfasser: Richtzeit: Hilfsmittel: Hinweise: R. Guenin, J. Lipscher, S. Steiner 80 Minuten (von total
Gruppe / Kandidat/in Nr:... Name/Vorname:... Grundlagenfach Bereich Teil: NATURWISSENSCHAFTEN Chemie Verfasser: Richtzeit: Hilfsmittel: Hinweise: R. Guenin, J. Lipscher, S. Steiner 80 Minuten (von total
