Tabelle 1: Empfohlene postexpositionelle Prophylaxe in Abhängigkeit von der Expositionsart Kategorie der Exposition
|
|
|
- Arnim Maus
- vor 6 Jahren
- Abrufe
Transkript
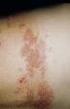
1 Rabipur-Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Tollwut-Impfstoff, inaktiviert 2. Qualitative und quantitative Zusammensetzung Nach Auflösen enthält 1 Durchstechflasche (1,0 ml): Tollwutvirus* (inaktiviert, Stamm Flury LEP) 2,5 I.E. * hergestellt in gereinigten Hühnerembryo-Zellen (PCEC) Dieser Impfstoff enthält Reste von Polygelin, Hühnereiweiß (z. B. Ovalbumin), humanes Serumalbumin und kann Spuren von Neomycin, Chlortetracyclin und Amphotericin B enthalten. Siehe Abschnitte 4.3 und 4.4. Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt Darreichungsform Pulver und Lösungsmittel zur Herstellung einer Injektionslösung. Das Pulver ist weiß. Das Lösungsmittel ist klar und farblos. 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete Rabipur ist indiziert für die aktive Immunisierung gegen Tollwut bei Personen jeden Alters. Dies umfasst die präexpositionelle Prophylaxe (d. h. vor einem möglichen Tollwut- Expositionsrisiko) mit Grundimmunisierung und Auffrischimpfung sowie die postexpositionelle Prophylaxe (d. h. nach vermuteter oder erwiesener Tollwut-Exposition). Rabipur ist basierend auf den offiziellen Empfehlungen zu verwenden. 4.2 Dosierung und Art der Anwendung Dosierung Dosierung bei Erwachsenen, Jugendlichen und Kindern Die empfohlene intramuskuläre (i.m.) Einzeldosis beträgt für jede Altersgruppe 1,0 ml. Präexpositionelle Prophylaxe (PrEP) Grundimmunisierung Für bisher ungeimpfte Personen besteht die Grundimmunisierung für die präexpositionelle Prophylaxe aus drei Impfstoffgaben (je 1,0 ml), die an den Tagen 0, 7 und 21 (oder 28) i.m. verabreicht werden. Auffrischimpfungen Die Einzel-Auffrischimpfung beträgt 1,0 ml i.m. Rabipur kann als Auffrischdosis nach erfolgter Grundimmunisierung mit einem humanen diploiden Tollwutvakzin (HDCV) verwendet werden. Die Notwendigkeit regelmäßiger serologischer Kontrollen zur Überprüfung des Antikörpertiters 0,5 I.E./ml, sowie die Notwendigkeit von Auffrischimpfungen sind entsprechend den offiziellen Empfehlungen zu beurteilen. Die Erfahrung zeigt, dass eine Auffrischimpfung im Allgemeinen alle 2-5 Jahre erforderlich ist. Postexpositionelle Prophylaxe (PEP) Die postexpositionelle Prophylaxe besteht aus: lokaler Behandlung der Wunde möglichst bald nach der Exposition, einer Impfserie mit Tollwutimpfstoff und der Verabreichung des Tollwut-Immunoglobulin, falls indiziert. Die Indikation für die postexpositionelle Prophylaxe ist abhängig von der Art des Kontakts mit dem vermutlich erkrankten Tier gemäß der Tabelle 1, Empfohlene postexpositionelle Prophylaxe in Abhängigkeit von der Expositionsart. Mit der postexpositionellen Immunisierung muss sobald wie möglich nach Exposition begonnen werden. Tabelle 1: Empfohlene postexpositionelle Prophylaxe in Abhängigkeit von der Expositionsart Kategorie der Exposition I II Art der Exposition durch ein tollwutverdächtiges oder tollwütiges Haus- oder Wild a tier oder durch ein Tier, welches nicht zur Untersuchung zur Verfügung steht Berühren oder Füttern von Tieren Ablecken der intakten Haut Kontakt der intakten Haut mit Sekreten oder Exkrementen eines erkrankten Tieres oder Menschen Knabbern an der unbedeckten Haut Kleinere, nicht blutende Kratzer oder Abschürfungen Empfohlene postexpositionelle Prophylaxe Keine, sofern ein zuverlässiger Fallbericht vorliegt. Sofortige Impfstoffgabe b) Behandlung beenden, wenn das Tier während eines Beobachtungszeitraums von 10 Tagen c) gesund bleibt oder falls ein negativer Nachweis auf Tollwut für das Tier mit geeigneten diagnostischen Verfahren durch ein zuverlässiges Labor vorliegt.
2 III Einzelne oder multiple transdermale Bissverletzungen d) oder Kratzwunden, Ablecken der und Tollwut-Immunglobulin, vorzugsweise Sofortige Verabreichung von Tollwut- Impfstoff nicht-intakten Haut. ehest möglich nach Beginn der postexpositionellen Prophylaxe. Kontamination von Schleimhäuten mit Speichel (z. B. Lecken) Tollwut-Immunglobulin kann bis zu 7 Tage Exposition durch Fledermäuse e). nach Verabreichung der ersten Impfdosis injiziert werden. Behandlung beenden, wenn das Tier während eines Beobachtungszeitraums von 10 Tagen gesund bleibt oder falls ein negativer Nachweis auf Tollwut für das Tier mit geeigneten diagnostischen Verfahren durch ein zuverlässiges Labor vorliegt. a) Nach Exposition durch Nagetiere, Kaninchen oder Feldhasen ist eine postexpositionelle Prophylaxe gegen Tollwut nicht routinemäßig erforderlich. b) Sofern gesund erscheinende Hunde oder Katzen in oder aus einem Gebiet mit niedrigem Tollwutrisiko unter Beobachtung gestellt werden, kann die Behandlung. verschoben werden. c) Dieser Beobachtungszeitraum gilt nur für Hunde und Katzen. Außer im Falle einer bedrohten oder gefährdeten Tierart sollten andere tollwutverdächtige Haus- oder Wildtiere eingeschläfert werden und ihr Gewebe mithilfe geeigneter Laborverfahren auf Tollwutantigene untersucht werden. d) Bissverletzungen besonders im Kopf-, Hals-, Gesichts-, Hand- oder Genitalbereich sind aufgrund der starken Innervation dieser Bereiche Expositionen der Kategorie III. e) Eine postexpositionelle Prophylaxe muss erwogen werden, wenn Kontakt zwischen einem Menschen und einer Fledermaus bestand, es sei denn, die exponierte Person kann einen Biss, Kratzer oder die Exposition der Schleimhäute ausschließen. Postexpositionelle Prophylaxe bei ungeimpften Personen Essen-Impfschema mit 5 Dosen ( ): je eine Injektion von 1,0 ml i.m. an den Tagen 0, 3, 7, 14 und 28 Zagreb-Impfschema mit 4 Dosen (2-1-1): zwei Injektionen von je 1,0 ml i.m. am Tag 0 (je eine in jeden M. deltoideus oder seitlich in jeden Oberschenkel) und danach je eine Injektion von 1,0 ml i.m. Injektion an den Tagen 7 und 21. Postexpositionelle Prophylaxe bei geimpften Personen Bei zuvor geimpften Personen besteht die postexpositionelle Prophylaxe aus je zwei Dosen (mit je 1,0 ml) i.m. an den Tagen 0 und 3. Tollwut-Immunglobulin ist in solchen Fällen nicht indiziert. Kinder und Jugendliche Kinder und Jugendliche erhalten dieselbe Dosis von 1,0 ml i.m. wie Erwachsene. Ältere Patienten Ältere Patienten erhalten dieselbe Dosis von 1,0 ml i.m. wie Erwachsene. Immungeschwächte Personen Bei immungeschwächten Personen mit Exposition der Kategorien II und III ist eine vollständige Abfolge von 5-Dosen nach dem Essen-Impfschema ( an den Tagen 0, 3, 7, 14 und 28) in Kombination mit umfassender Wundversorgung und lokaler Infiltration mit Tollwut- Immunoglobulin erforderlich. Alternativ können am Tag 0 zwei Impfdosen verabreicht werden, also je eine Dosis (1,0 ml) in den rechten und linken M. deltoideus. Bei kleinen Kindern ist je eine Dosis in die anterolaterale Zone des rechten bzw. linken Oberschenkels zu verabreichen. Dadurch ergeben sich insgesamt 6 Dosen ( an den Tagen 0, 3, 7, 14 und 28). Wenn möglich, ist 2 bis 4 Wochen (vorzugsweise am Tag 14) nach Beginn der Impfung die virus- neutralisierende Antikörperreaktion zu bestimmen, um festzustellen, ob eine zusätzliche Impfdosis erforderlich ist. Immunsuppressiva dürfen während der postexpositionellen Therapie nicht verabreicht werden, wenn dies nicht zur Behandlung anderer Erkrankungen notwendig ist (siehe Abschnitt 4.5). Art der Anwendung Bei Erwachsenen, Jugendlichen und Kindern ab 2 Jahren wird der Impfstoff intramuskulär in den M. deltoideus verabreicht; bei Kindern unter 2 Jahren wird die Injektion in den anterolateralen Bereich des Oberschenkels empfohlen. Der Impfstoff darf nicht intravasal injiziert werden, siehe Abschnitt 4.4. Tollwutimpfstoffe dürfen nicht intraglutäal oder subkutan injiziert werden, siehe Abschnitt 4.4. Zur Rekonstitution des Impfstoffes vor der Verabreichung, siehe Abschnitt Gegenanzeigen Präexpositionelle Prophylaxe PrEP) Bei einer Vorgeschichte von schwerer Überempfindlichkeit gegen den Wirkstoff, einen der in Abschnitt 6.1 genannten sonstigen Bestandteile oder eine der in Abschnitt 2 aufgeführten Spuren. Personen mit akuten, behandlungsbedürftigen Erkrankungen dürfen frühestens 2 Wochen nach Genesung
3 geimpft werden. Banale Infekte sind keine Kontraindikation zur Impfung. Postexpositionelle Prophylaxe (PEP) Angesichts des fast immer tödlichen Ausgangs von Tollwut gibt es keine Kontraindikation für die postexpositionelle Prophylaxe, einschließlich Schwangerschaft. 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Es liegen Berichte über das Auftreten von anaphylaktischen Reaktionen, einschließlich anaphylaktischem Schock nach Impfung mit Rabipur vor. Wie bei allen zu injizierenden Impfstoffen müssen für den Fall seltener anaphylaktischer Reaktionen nach Verabreichung des Impfstoffes immer geeignete Sofortmaßnahmen zur Behandlung und Überwachung zur Verfügung stehen. Patienten mit möglicher schwerer Überempfindlichkeit gegen den Impfstoff oder einen seiner Bestandteile müssen einen alternativen Tollwut-Impfstoff erhalten, sofern ein geeignetes Produkt zur Verfügung steht. Enzephalitis und Guillain-Barré-Syndrom sind in einem zeitlichen Zusammenhang mit einer Gabe von Rabipur berichtet worden (siehe auch Abschnitt 4.8). Die Anwendung von Kortikosteroiden zur Behandlung solcher Nebenwirkungen kann die Entwicklung einer Immunität gegen Tollwut hemmen (siehe Abschnitt 4.5). Eine Entscheidung gegen die Fortsetzung der Impfung muss sorgfältig gegen das Risiko des Patienten abgewogen werden, an Tollwut zu erkranken. Eine unbeabsichtigte intravasale Injektion kann systemische Reaktionen, einschließlich Schock, zur Folge haben. Nicht intravasal injizieren. Der Impfstoff darf nicht mit anderen Arzneimitteln in derselben Spritze vermischt werden. Wenn zusätzlich zum Impfstoff Rabipur die Anwendung von Tollwut-Immunglobulin indiziert ist, muss dieses an einer von der Impfstelle entfernten Körperstelle verabreicht werden (siehe Abschnitt 4.5). Im Zusammenhang mit Impfungen können angstbedingte Reaktionen wie z.b. vasovagale Reaktionen (Synkope), Hyperventilation oder stressbedingte Reaktionen als psychogene Antwort auf die Nadelinjektion auftreten (siehe Abschnitt 4.8). Es ist wichtig, Vorkehrungen zu treffen, um Verletzungen durch Bewusstlosigkeit vorzubeugen. Tollwut-Impfstoff darf nicht intraglutäal oder subkutan injiziert werden, da hierdurch möglicherweise eine ausreichende Immunantwort nicht zuverlässig erzielt werden kann. Die Anwendung des Arzneimittels Rabipur kann bei Dopingkontrollen zu positiven Ergebnissen führen. 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Die Anwendung von Immunsuppressiva kann der Entwicklung einer ausreichenden Reaktion auf den Tollwutimpfstoff entgegenwirken. Daher wird empfohlen, die serologische Immunantwort bei diesen Patienten zu kontrollieren und wenn nötig, zusätzliche Dosen zu verabreichen (siehe Abschnitt 4.2). Wenn Tollwut-Immunglobulin verabreicht wird, muss die gesamte Menge oder so viel wie (unter Vermeidung des möglichen Kompartmentsyndroms) anatomisch möglich in oder um die Wunde oder Wunden verabreicht werden. Etwa verbleibendes Immunglobulin ist intramuskulär an einer Stelle zu injizieren, die von der Impfstelle entfernt liegt, um mögliche Wechselwirkungen mit dem gleichzeitig verabreichten Tollwut-Impfstoff zu vermeiden. Andere inaktivierte Impfstoffe können zusammen mit Rabipur verabreicht werden. Gleichzeitig verabreichte, andere Impfstoffe müssen immer an anderen Injektionsstellen verabreicht werden, die vorzugsweise in kontralateralen Extremitäten liegen. 4.6 Fertilität, Schwangerschaft und Stillzeit Schwangerschaft Es wurden keine Fälle von Schädigungen beobachtet, die auf die Anwendung von Rabipur während der Schwangerschaft zurückzuführen sind. Rabipur kann an Schwangere verabreicht werden, wenn eine postexpositionelle Prophylaxe erforderlich ist. Der Impfstoff kann auch für eine präexpositionelle Prophylaxe während der Schwangerschaft verabreicht werden, wenn der potenzielle Nutzen größer erscheint als ein mögliches Risiko für den Fötus. Stillzeit Obwohl nicht bekannt ist, ob Rabipur in die Muttermilch übergeht, konnte kein Risiko für den Säugling festgestellt werden. Rabipur kann während der Stillzeit verabreicht werden, wenn eine postexpositionelle Prophylaxe erforderlich ist. Der Impfstoff kann auch für eine präexpositionelle Prophylaxe während der Stillzeit verabreicht werden, wenn der potenzielle Nutzen größer erscheint als ein mögliches Risiko für den Säugling. Fertilität Es wurden keine präklinischen Studien zur Reproduktions- und Entwicklungstoxizität durchgeführt. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Es wurden keine Studien mit Rabipur zur Beurteilung der Auswirkungen auf die Verkehrstüchtigkeit oder die Fähigkeit zum Bedienen von Maschinen durchgeführt (siehe auch Abschnitt 4.8). Einige der in Abschnitt 4.8 beschriebenen Nebenwirkungen können Einfluss auf die Verkehrstüchtigkeit oder die Fähigkeit zum Bedienen von Maschinen haben. 4.8 Nebenwirkungen Zusammenfassung des Sicherheitsprofils
4 Anaphylaktische Reaktionen einschließlich eines anaphylaktischen Schocks, die sehr seltene, aber klinisch schwerwiegende und potentiell tödliche systemische allergische Reaktionen sind, können nach einer Impfung mit Rabipur auftreten. Anaphylaxie wurde in klinischen Studien mit Rabipur nicht beobachtet. Die am häufigsten berichteten, angesprochenen Nebenwirkungen waren Schmerzen an der Injektionsstelle (30 85%; im Wesentlichen Schmerzen aufgrund der Injektion) oder Verhärtung an der Injektionsstelle (15 35%). Die meisten Reaktionen an der Injektionsstelle waren nicht schwerwiegend und klangen innerhalb von 24 bis 48 Stunden nach der Injektion ab. Leichte allergische Reaktionen auf Rabipur (z.b. Überempfindlichkeit), einschließlich Hautausschlägen und Urtikaria können nach der Impfung vorkommen. Hautausschläge können bei mehr als einer von zehn Personen auftreten und Urtikaria kann zwischen einer von hundert und einer von zehn Personen auftreten. Diese Reaktionen sind üblicherweise leicht und klingen typischerweise innerhalb von ein paar Tagen ab. Wenige Personen berichteten von Symptomen einer Enzephalitis und einem Guillain-Barré- Syndrom nach einer Impfung mit Rabipur. Tabellarische Übersicht der Nebenwirkungen Die folgenden Impfnebenwirkungen wurden bei klinischen Studien und der Anwendung nach Markteinführung berichtet. Nach der Markteinführung wurden Nebenwirkungen freiwillig von einer Population unbekannter Größe gemeldet, wobei keine Angaben zur Häufigkeit gemacht werden können. Diese Ereignisse wurden aufgrund ihres Schweregrades, der Häufigkeit der Meldung, des kausalen Zusammenhangs mit Rabipur o- der einer Kombination dieser Gründe aufgenommen. Innerhalb jeder Häufigkeitskategorie werden die Nebenwirkungen nach abnehmendem Schweregrad gereiht. Zusätzlich beruht die entsprechende Häufigkeitskategorie für jede Nebenwirkung auf den folgenden Definitionen (CIOMS III): sehr häufig ( 1/10); häufig ( 1/100, <1/10); gelegentlich ( 1/1.000, <1/100); selten ( 1/10.000, <1/1.000); sehr selten (<1/10.000). Systemorganklasse Häufigkeit Nebenwirkung Erkrankungen des Blutes und Häufig Lymphadenopathie des Lymphsystems Erkrankungen des Immunsystems Selten Überempfindlichkeit Sehr selten Anaphylaxie einschließlich anaphylaktischem Schock * Stoffwechsel- und Ernährungsstörungen Häufig Verminderter Appetit Erkrankungen des Nervensystems Sehr häufig Kopfschmerzen, Schwindel Selten Parästhesie Sehr selten Enzephalitis *, Guillain-Barré- Syndrom *, Präsynkope *, Synkope *, Vertigo * Erkrankungen des Gastrointesti- Häufig Übelkeit, Erbrechen, Diarrhoe, Bauchschmerzen/- naltrakts Erkrankungen der Haut und des Unterhautzellgewebes Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen Allgemeine Erkrankungen und Beschwerden am Verabreichungsort beschwerden Sehr häufig Ausschlag Häufig Urtikaria Selten Hyperhidrosis (Schwitzen) Sehr selten Angioödem * Häufig Myalgie, Arthralgie Sehr häufig Reaktionen an der Injektionsstelle, Unwohlsein, Müdigkeit, Asthenie, Fieber Selten Schüttelfrost * Nebenwirkungen aus Spontanmeldungen Beschreibung ausgewählter Nebenwirkungen Kopfschmerzen und Schwindel wurden hauptsächlich nach Markteinführung berichtet, diese waren vorrübergehender Art und klangen ohne Behandlung ab. Die Nebenwirkung Hautauschlag wurde auch nach Markteinführung beobachtet, die meisten Berichte waren mit wenigen Einzelheiten ohne genaue Beschreibung. Einige Fälle von Ausschlag wurden jedoch im Zusammenhang mit einer möglichen Überempfindlichkeitsreaktion berichtet. Reaktionen an der Injektionsstelle wurden unterschiedlich und hauptsächlich mit folgenden Nebenwirkungsbegriffen berichtet: Schmerzen/Beschwerden/Verhärtung/Schwellung/Erythem und Ödem an der Injektionsstelle. Alle diese entwickelten sich günstig, auch dann wenn eine Behandlung begonnen wurde. Keine dieser Reaktionen konnte als Zellgewebsentzündung an der Injektionsstelle ausgewiesen werden und war somit von kurzer Dauer. Allgemein wurden Reaktionen an der Impfstelle in klinischen Studien mit Rabipur häufig
5 berichtet und die Daten nach Markteinführung bestätigen dies. Zur Behandlung von Überempfindlichkeits- (allergischen) Reaktionen siehe Abschnitt 4.4. Nach Beginn der postexpositionellen Prophylaxe darf das Impfschema nicht wegen lokaler oder leichter systemischer Nebenwirkungen gegen den Tollwut-Impfstoff unterbrochen oder abgebrochen werden. Kinder und Jugendliche Es wird erwartet, dass die Häufigkeit, Art und der Schweregrad der Nebenwirkungen bei Kindern und Jugendlichen denen bei Erwachsenen entsprechen. Andere besondere Patientengruppen Rabipur wurde nie ausschließlich in einer bestimmten Patientengruppe wie älteren Patienten, Patienten mit Nierenerkrankungen, Patienten mit Lebererkrankungen, älteren Patienten mit anderen Erkrankungen oder einem bestimmten Genotyp getestet, da die Risikofaktoren dieselben bei allen Gruppen sind. Diese besonderen Gruppen wurden jedoch nicht explizit in den klinischen Studien mit Rabipur ausgeschlossen und es wurden keine klinisch relevanten Unterschiede (z.b. Art, Häufigkeit, Schweregrad oder Reversibilität von Nebenwirkungen oder die Notwendigkeit einer Kontrolle) gezielt beobachtet. Meldung des Verdachts auf Nebenwirkungen Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das nationale Meldesystem anzuzeigen. Bundesamt für Sicherheit im Gesundheitswesen Traisengasse Wien Österreich Fax: + 43 (0) Website: Überdosierung Es sind keine Symptome von Überdosierung bekannt. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften ATC-Code: J07B G01 Der von der WHO als Nachweis einer ausreichenden Immunantwort nach Impfung empfohlene Mindestwert des Tollwutvirus-Antikörpertiters beträgt 0,5 I.E./ml. Von den meisten gesunden Geimpften sollte dieser Wert mit oder ohne gleichzeitige Verabreichung von Tollwut- Immunglobulin und unabhängig vom Alter bis zum Tag 14 eines postexpositionellen Impfschemas erreicht werden. Präexpositionelle Prophylaxe In klinischen Studien mit ungeimpften Personen erreichten fast alle Personen eine ausreichende Immunantwort (RVNAs 0,5 I.E./ml) 3 bis 4 Wochen nach der Grundimmunisierung mit drei Gaben von Rabipur, die intramuskulär nach dem empfohlenen Impfschema verabreicht wurden. Die Persistenz einer angemessenen Immunantwort (RVNAs 0,5 I.E./ml) über einen Zeitraum von zwei Jahren nach Impfung mit Rabipur ohne zusätzliche Auffrischimpfung konnte in klinischen Studien nachgewiesen werden. Da Antikörperkonzentrationen langsam abfallen, können Auffrischimpfungen erforderlich sein, um den Antikörpertiter über 0,5 I.E./ml zu halten. Der Bedarf und Zeitpunkt von Auffrischimpfungen unter Einbeziehung der offiziellen Empfehlungen muss im Einzelfall bewertet werden (siehe auch Abschnitt 4.2). In einer klinischen Prüfung rief eine Auffrischung mit Rabipur, die 1 Jahr nach der Grundimmunisierung verabreicht wurde, einen 10fachen oder höheren Anstieg des geometrischen Mittels der Titer (GMT) bis zum Tag 30 hervor. Weiterhin wurde gezeigt, dass Personen, die zuvor mit einem HDC-Impfstoff (Human Diploid Cell Culture Vaccine) immunisiert waren, eine schnelle anamnestische Antwort nach Auffrischung mit Rabipur entwickelten. Postexpositionelle Prophylaxe In klinischen Studien rief Rabipur bei fast allen Geimpften an Tag 14 oder 30 ausreichend neutralisierende Antikörper ( 0,5 I.E./ml) hervor, wenn es nach dem von der WHO empfohlenen Essen-Impfschema von 5- Dosen* (je 1,0 ml i.m. an den Tagen 0, 3, 7, 14, 28) oder dem von der WHO empfohlenen Zagreb- Impfschema von 4 Dosen (je 1,0 ml i.m. an den Tagen 0 [2 Dosen], 7, 21) verabreicht wurde. * Das vorherige von der WHO empfohlene Essen-Schema bestand aus 6 Dosen (je 1,0 ml i.m. an den Tagen 0, 3, 7, 14, 28, 90). Die simultane Verabreichung von Tollwut-Immunglobulin vom Menschen (HRIG) mit der ersten Dosis des Tollwut-Impfstoffes verursachte leicht niedrigere GMCs/(Essen-Impfschema), das jedoch weder als klinisch relevant noch statistisch signifikant erachtet wurde. 5.2 Pharmakokinetische Eigenschaften Nicht zutreffend. 5.3 Präklinische Daten zur Sicherheit Daten aus präklinischen Studien mit Ein-Dosen-Schema, Mehrdosen-Schema und lokale Verträglichkeits-
6 studien zeigten keine unerwarteten Ergebnisse und keine gezielte Organtoxizität. Es wurden keine Studien zur Gentoxizität, Kanzerogenität und reproduktiven Toxizität durchgeführt. 6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile Pulver: Trometamol Natriumchlorid Dinatriumedetat Kalium-L-glutamat Polygelin Saccharose Lösungsmittel: Wasser für Injektionszwecke 6.2 Inkompatibilitäten Aufgrund fehlender Kompatibilitätsstudien darf Rabipur nicht in der gleichen Spritze mit anderen Arzneimitteln vermischt werden. 6.3 Dauer der Haltbarkeit 4 Jahre Nach der Rekonstitution ist der Impfstoff sofort zu verwenden. 6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Im Kühlschrank lagern (2 C 8 C). Nicht einfrieren. Die Durchstechflaschen im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen. Informationen zur den Lagerungsbedingungen nach der Rekonstitution des Arzneimittels siehe Abschnitt 6.3. Der Impfstoff darf nach dem auf der Verpackung und dem Behältnis angegebenen Verfalldatum nicht verwendet werden. 6.5 Art und Inhalt des Behältnisses Packung mit: 1 Durchstechflasche (Typ I Glas) mit gefriergetrocknetem Pulver, mit Stopfen (Chlorobutyl) 1 ml steriles Lösungsmittel zur Rekonstitution in einer Ampulle (Typ I Glas) mit/ohne Injektionsspritze (Polypropylen mit Polyäthylen Spritzenkolben) mit separater Nadel Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht. 6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung Der Impfstoff muss vor und nach der Rekonstitution visuell auf Fremdpartikel und/oder Veränderung des Aussehens geprüft werden. Der Impfstoff darf bei verändertem Aussehen nicht verwendet werden. Der rekonstituierte Impfstoff ist klar bis leicht schimmernd und farblos bis schwach rosa. Das Pulver muss vor Injektion in dem beigefügten Lösungsmittel rekonstituiert und vorsichtig geschüttelt werden. Nach der Rekonstitution ist der Impfstoff sofort zu verwenden. Während der Herstellung wird die Durchstechflasche unter Vakuum versiegelt. Um Probleme beim Entnehmen des rekonstituierten Impfstoffs aus der Durchstechflasche nach der Rekonstitution zu vermeiden, wird empfohlen, die Spritze von der Nadel abzuschrauben, um den Unterdruck auszugleichen. Danach kann der Impfstoff mühelos aus der Durchstechflasche entnommen werden. Es wird nicht empfohlen, Überdruck anzuwenden, da Überdruck zu Problemen bei der Entnahme der korrekten Menge Impfstoff führt. Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen. 7. Inhaber der Zulassung GSK Vaccines GmbH Emil-von-Behring-Str Marburg Deutschland Vertrieb: GlaxoSmithKline Pharma GmbH, Wien 8. Zulassungsnummer Datum der Erteilung der Zulassung/Verlängerung der Zulassung 30. September 2003 / 12. Mai Stand der Information August 2017 Verschreibungspflicht/Apothekenpflicht Rezept-und apothekenpflichtig, wiederholte Abgabe verboten.
FACHINFORMATION ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS. Rabipur
 FACHINFORMATION ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS Rabipur 1. BEZEICHNUNG DES ARZNEIMITTELS Rabipur Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in Fertigspritze. Tollwut-Impfstoff,
FACHINFORMATION ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS Rabipur 1. BEZEICHNUNG DES ARZNEIMITTELS Rabipur Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in Fertigspritze. Tollwut-Impfstoff,
FACHINFORMATION. Die Erfahrung zeigt, dass Auffrischimpfungen im Allgemeinen alle 2 5 Jahre erforderlich
 1. BEZEICHNUNG DES ARZNEIMITTELS Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze. Tollwut-Impfstoff, inaktiviert. 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1. BEZEICHNUNG DES ARZNEIMITTELS Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze. Tollwut-Impfstoff, inaktiviert. 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Vi-Polysaccharid von Salmonella typhi (Ty2 Stamm)
 Zusammenfassung der Merkmale des Arzneimittels 1. Bezeichnung des Arzneimittels Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff 2. Qualitative und quantitative Zusammensetzung
Zusammenfassung der Merkmale des Arzneimittels 1. Bezeichnung des Arzneimittels Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff 2. Qualitative und quantitative Zusammensetzung
Expositionsart. Empfohlene postexpositionelle Prophylaxe. Wild- oder Haustier, oder durch ein Tier, welches nicht zur Unter-
 Rabipur Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Tollwut-Impfstoff, inaktiviert 2. Qualitative und quantitative Zusammensetzung Nach Auflösen enthält 1 Impfdosis (1 ml): Tollwutvirus*
Rabipur Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Tollwut-Impfstoff, inaktiviert 2. Qualitative und quantitative Zusammensetzung Nach Auflösen enthält 1 Impfdosis (1 ml): Tollwutvirus*
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Tollwutvirus (inaktiviert, Stamm Flury LEP) Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Tollwutvirus (inaktiviert, Stamm Flury LEP) Lesen Sie die gesamte Packungsbeilage sorgfältig
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 1. BEZEICHNUNG DES ARZNEIMITTELS Mencevax ACWY - Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Meningokokken-Polysaccharid-Gruppe-A, C, Y und W 135 -Impfstoff 2.
1. BEZEICHNUNG DES ARZNEIMITTELS Mencevax ACWY - Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Meningokokken-Polysaccharid-Gruppe-A, C, Y und W 135 -Impfstoff 2.
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Fluarix Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert) 2. QUALITATIVE UND QUANTITATIVE
Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Fluarix Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert) 2. QUALITATIVE UND QUANTITATIVE
Mencevax ACWY Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einem Mehrdosenbehältnis
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Mencevax ACWY Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einem Mehrdosenbehältnis Polysaccharid-Impfstoff
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Mencevax ACWY Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einem Mehrdosenbehältnis Polysaccharid-Impfstoff
Td-RIX Injektionssuspension Diphtherie-Tetanus-Kombinationsimpfstoff (adsorbiert) mit reduziertem Antigengehalt
 1 FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Td-RIX Injektionssuspension Diphtherie-Tetanus-Kombinationsimpfstoff (adsorbiert) mit reduziertem Antigengehalt 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Td-RIX Injektionssuspension Diphtherie-Tetanus-Kombinationsimpfstoff (adsorbiert) mit reduziertem Antigengehalt 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Tollwutvirus (inaktiviert, Stamm Flury LEP) Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Tollwutvirus (inaktiviert, Stamm Flury LEP) Lesen Sie die gesamte Packungsbeilage
Hepatyrix, Injektionssuspension Hepatitis-A- (inaktiviert) und Typhus-Polysaccharid-Impfstoff (adsorbiert)
 1 FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Hepatyrix, Injektionssuspension Hepatitis-A- (inaktiviert) und Typhus-Polysaccharid-Impfstoff (adsorbiert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Hepatyrix, Injektionssuspension Hepatitis-A- (inaktiviert) und Typhus-Polysaccharid-Impfstoff (adsorbiert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
FACHINFORMATION. 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen
 FACHINFORMATION Mencevax ACWY März 2014 493134PD502J 1. BEZEICHNUNG DES ARZNEIMITTELS Mencevax ACWY Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Meningokokken-Polysaccharid-Gruppe-A,
FACHINFORMATION Mencevax ACWY März 2014 493134PD502J 1. BEZEICHNUNG DES ARZNEIMITTELS Mencevax ACWY Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Meningokokken-Polysaccharid-Gruppe-A,
WAS IST RABIPUR UND WOFÜR WIRD ES ANGEWENDET?
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Rabipur Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Tollwut-Impfstoff, inaktiviert Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Rabipur Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Tollwut-Impfstoff, inaktiviert Lesen Sie die gesamte Packungsbeilage sorgfältig
1 Impfdosis (0,5 ml) enthält: inaktivierte Influenza-Virus Spaltantigene* der folgenden Stämme:
 Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Fluarix Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert) 2. QUALITATIVE UND QUANTITATIVE
Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Fluarix Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert) 2. QUALITATIVE UND QUANTITATIVE
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS AFLUBIN- Grippetropfen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 100 ml enthalten: 1 ml Gentiana lutea D1, 10 ml Aconitum
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS AFLUBIN- Grippetropfen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 100 ml enthalten: 1 ml Gentiana lutea D1, 10 ml Aconitum
F A C H I N F O R M A T I O N (Zusammenfassung der Produkteigenschaften)
 F A C H I N F O R M A T I O N (Zusammenfassung der Produkteigenschaften) 1. BEZEICHNUNG DES ARZNEIMITTELS Influvac - Injektionssuspension in einer Fertigspritze (Influenza-Impfstoff aus inaktivierten Oberflächenantigenen)
F A C H I N F O R M A T I O N (Zusammenfassung der Produkteigenschaften) 1. BEZEICHNUNG DES ARZNEIMITTELS Influvac - Injektionssuspension in einer Fertigspritze (Influenza-Impfstoff aus inaktivierten Oberflächenantigenen)
1. BEZEICHNUNG DES ARZNEIMITTELS Havrix 1440 Injektionssuspension Hepatitis A Impfstoff (inaktiviert, adsorbiert)
 1. BEZEICHNUNG DES ARZNEIMITTELS Havrix 1440 Injektionssuspension Hepatitis A Impfstoff (inaktiviert, adsorbiert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Dosis (1,0 ml) enthält: Hepatitis A Virus
1. BEZEICHNUNG DES ARZNEIMITTELS Havrix 1440 Injektionssuspension Hepatitis A Impfstoff (inaktiviert, adsorbiert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Dosis (1,0 ml) enthält: Hepatitis A Virus
F A C H I N F O R M A T I O N (Zusammenfassung der Produkteigenschaften)
 F A C H I N F O R M A T I O N (Zusammenfassung der Produkteigenschaften) 1. BEZEICHNUNG DES ARZNEIMITTELS FluVaccinol Subunit Impfstoff - Injektionssuspension in einer Fertigspritze (Influenza-Impfstoff
F A C H I N F O R M A T I O N (Zusammenfassung der Produkteigenschaften) 1. BEZEICHNUNG DES ARZNEIMITTELS FluVaccinol Subunit Impfstoff - Injektionssuspension in einer Fertigspritze (Influenza-Impfstoff
Mencevax ACWY Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einem Einzeldosisbehältnis
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einem Einzeldosisbehältnis Polysaccharid-Impfstoff gegen
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einem Einzeldosisbehältnis Polysaccharid-Impfstoff gegen
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS. HBVAXPRO 5 Mikrogramm, Injektionssuspension in einer Fertigspritze Hepatitis B-Impfstoff (rdns)
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS HBVAXPRO 5 Mikrogramm, Injektionssuspension in einer Fertigspritze Hepatitis B-Impfstoff (rdns) 2. QUALITATIVE UND QUANTITATIVE
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS HBVAXPRO 5 Mikrogramm, Injektionssuspension in einer Fertigspritze Hepatitis B-Impfstoff (rdns) 2. QUALITATIVE UND QUANTITATIVE
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Daflon 500 mg Filmtabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Filmtablette enthält 500 mg gereinigte, mikronisierte
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Daflon 500 mg Filmtabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Filmtablette enthält 500 mg gereinigte, mikronisierte
Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem
Bewilligungsantrag Nucala (Mepolizumab) - Erstdokumentation
 Bewilligungsantrag - Erstdokumentation Sozialversicherungsnummer: Anwendungsgebiet: ist angezeigt als Zusatzbehandlung bei schwerem refraktärem eosinophilem Asthma bei erwachsenen Patienten (siehe Fachinformation
Bewilligungsantrag - Erstdokumentation Sozialversicherungsnummer: Anwendungsgebiet: ist angezeigt als Zusatzbehandlung bei schwerem refraktärem eosinophilem Asthma bei erwachsenen Patienten (siehe Fachinformation
5 bis 10 Jahre: 0,5 ml Td-pur
 Td-pur für Erwachsene und Heranwachsende Tetanus-Diphtherie-Impfstoff (inaktiviert, adsorbiert, reduzierter Antigengehalt) Injektionssuspension in Fertigspritze 2. Qualitative und quantitative Zusammensetzung
Td-pur für Erwachsene und Heranwachsende Tetanus-Diphtherie-Impfstoff (inaktiviert, adsorbiert, reduzierter Antigengehalt) Injektionssuspension in Fertigspritze 2. Qualitative und quantitative Zusammensetzung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG. Influenzavirus Oberflächenantigene (Hämagglutinin und Neuroaminidase) der folgenden Stämme*:
 1. BEZEICHNUNG DES ARZNEIMITTELS Sandovac Injektionssuspension in einer Fertigspritze Influenzaimpfstoff (Oberflächenantigene, inaktiviert) (2014/2015) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Influenzavirus
1. BEZEICHNUNG DES ARZNEIMITTELS Sandovac Injektionssuspension in einer Fertigspritze Influenzaimpfstoff (Oberflächenantigene, inaktiviert) (2014/2015) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Influenzavirus
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Neurobion 100 mg 100 mg 1 mg / 3 ml Injektionslösung Vitamine B 1 + B 6 + B 12
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Neurobion 100 mg 100 mg 1 mg / 3 ml Injektionslösung Vitamine B 1 + B 6 + B 12 Lesen Sie die gesamte Packungsbeilage sorgfältig durch bevor Sie mit der Anwendung
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Neurobion 100 mg 100 mg 1 mg / 3 ml Injektionslösung Vitamine B 1 + B 6 + B 12 Lesen Sie die gesamte Packungsbeilage sorgfältig durch bevor Sie mit der Anwendung
1. BEZEICHNUNG DES ARZNEIMITTELS 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 3. DARREICHUNGSFORM 4. KLINISCHE ANGABEN
 1. BEZEICHNUNG DES ARZNEIMITTELS Havrix 720 Kinder Injektionssuspension Hepatitis-A-Impfstoff (inaktiviert, adsorbiert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Dosis (0,5ml) enthält: Hepatitis-A-Virus
1. BEZEICHNUNG DES ARZNEIMITTELS Havrix 720 Kinder Injektionssuspension Hepatitis-A-Impfstoff (inaktiviert, adsorbiert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Dosis (0,5ml) enthält: Hepatitis-A-Virus
FACHINFORMATION IPV Mérieux 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 FACHINFORMATION IPV Mérieux 1. BEZEICHNUNG DES ARZNEIMITTELS IPV Mérieux Injektionssuspension in einer Fertigspritze Inaktivierter Poliomyelitis-Impfstoff 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
FACHINFORMATION IPV Mérieux 1. BEZEICHNUNG DES ARZNEIMITTELS IPV Mérieux Injektionssuspension in einer Fertigspritze Inaktivierter Poliomyelitis-Impfstoff 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Fachinformation. Internationale Einheiten, untere Vertrauensgrenze (p=0,95) der nach der Methode der Ph.Eur. ermittelten Wirksamkeit
 1. Bezeichnung des Arzneimittels Injektionssuspension in einer Fertigspritze Tetanus-Diphtherie-Poliomyelitis (inaktiviert)-adsorbat-impfstoff (reduzierter Antigengehalt) 2. Qualitative und quantitative
1. Bezeichnung des Arzneimittels Injektionssuspension in einer Fertigspritze Tetanus-Diphtherie-Poliomyelitis (inaktiviert)-adsorbat-impfstoff (reduzierter Antigengehalt) 2. Qualitative und quantitative
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Tetanol pur Injektionssuspension in einer Fertigspritze 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Wirkstoff: Tetanus-Toxoid
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Tetanol pur Injektionssuspension in einer Fertigspritze 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Wirkstoff: Tetanus-Toxoid
FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels)
 FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels) 1. BEZEICHNUNG DES ARZNEIMITTELS Epaxal - Suspension zur Injektion in einer Fertigspritze Hepatitis A-Impfstoff (inaktiviert, virosomal)
FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels) 1. BEZEICHNUNG DES ARZNEIMITTELS Epaxal - Suspension zur Injektion in einer Fertigspritze Hepatitis A-Impfstoff (inaktiviert, virosomal)
Zusammenfassung der Merkmale des Arzneimittels
 Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Stieprox 1,5%-Shampoo 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 100 g Shampoo enthalten 1,5 g Ciclopirox-Olamin (1,5
Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Stieprox 1,5%-Shampoo 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 100 g Shampoo enthalten 1,5 g Ciclopirox-Olamin (1,5
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Tussamag Hustensirup
 Seite 1 von 5 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tussamag Hustensirup Wirkstoff: Flüssigextrakt aus Thymiankraut Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
Seite 1 von 5 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tussamag Hustensirup Wirkstoff: Flüssigextrakt aus Thymiankraut Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
Anhang III. Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage
 Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
GEBRAUCHSINFORMATION Eurican Lmulti Injektionssuspension
 GEBRAUCHSINFORMATION Eurican Lmulti Injektionssuspension 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE VERANTWORTLICH IST Zulassungsinhaber:
GEBRAUCHSINFORMATION Eurican Lmulti Injektionssuspension 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE VERANTWORTLICH IST Zulassungsinhaber:
ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS. Enduracell T, Injektionssuspension für Hunde, Katzen, Rinder und Pferde
 Enduracell T ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS 1. BEZEICHNUNG DES TIERARZNEIMITTELS Enduracell T, Injektionssuspension für Hunde, Katzen, Rinder und Pferde 2. QUALTITATIVE UND QUANTITATIVE
Enduracell T ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS 1. BEZEICHNUNG DES TIERARZNEIMITTELS Enduracell T, Injektionssuspension für Hunde, Katzen, Rinder und Pferde 2. QUALTITATIVE UND QUANTITATIVE
Gebrauchsinformation: Information für Patienten. Osanit Blähungskügelchen Wirkstoff: Matricaria recutita (Chamomilla) D12
 Seite 1 von 5 Gebrauchsinformation: Information für Patienten Osanit Blähungskügelchen Wirkstoff: Matricaria recutita (Chamomilla) D12 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
Seite 1 von 5 Gebrauchsinformation: Information für Patienten Osanit Blähungskügelchen Wirkstoff: Matricaria recutita (Chamomilla) D12 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS 2. QUALTITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 Primucell FIP ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS 1. BEZEICHNUNG DES TIERARZNEIMITTELS Primucell FIP, Lyophilisat und Lösungsmittel zur Herstellung einer intranasalen Suspension für Katzen
Primucell FIP ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS 1. BEZEICHNUNG DES TIERARZNEIMITTELS Primucell FIP, Lyophilisat und Lösungsmittel zur Herstellung einer intranasalen Suspension für Katzen
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Trosyd 1 % Creme 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 g Creme enthält 10 mg Tioconazol. Sonstiger Bestandteil
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Trosyd 1 % Creme 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 g Creme enthält 10 mg Tioconazol. Sonstiger Bestandteil
GEBRAUCHSINFORMATION UND FACHINFORMATION 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG. Wirkstoff: Hepatitis B Immunglobulin vom Menschen
 GEBRAUCHSINFORMATION UND FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Injektionslösung zur intramuskulären Anwendung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Wirkstoff: Hepatitis B Immunglobulin
GEBRAUCHSINFORMATION UND FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Injektionslösung zur intramuskulären Anwendung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Wirkstoff: Hepatitis B Immunglobulin
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS: FLUAD, Injektionssuspension in einer Fertigspritze Influenza-Impfstoff, Oberflächenantigene, inaktiviert, mit MF59C.1 als
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS: FLUAD, Injektionssuspension in einer Fertigspritze Influenza-Impfstoff, Oberflächenantigene, inaktiviert, mit MF59C.1 als
GEBRAUCHSINFORMATION. VERSIFEL CVR, Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension für Katzen
 GEBRAUCHSINFORMATION VERSIFEL CVR, Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension für Katzen 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS,
GEBRAUCHSINFORMATION VERSIFEL CVR, Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension für Katzen 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS,
Fachinformation. 32 D-Antigen²-Einheiten³. Antigenmenge im Endprodukt (Final Bulk Product), gemäß WHO (TRS 673, 1982) 3
 1. Bezeichnung des Arzneimittels Injektionssuspension in einer Fertigspritze Inaktivierter Poliomyelitis-Impfstoff 2. Qualitative und quantitative Zusammensetzung 1 Impfdosis (0,5 ml) enthält: Wirkstoffe:
1. Bezeichnung des Arzneimittels Injektionssuspension in einer Fertigspritze Inaktivierter Poliomyelitis-Impfstoff 2. Qualitative und quantitative Zusammensetzung 1 Impfdosis (0,5 ml) enthält: Wirkstoffe:
Berirab Update zum Passivimpfstoff. Berirab Anwendung Berirab Produktupdate Berirab in Österreich
 Berirab Anwendung Berirab Produktupdate Berirab in Österreich Berirab Anwendung Prophylaxe der Tollwut nach Exposition durch: Kratz- oder Bisswunden oder andere Verletzungen verursacht durch Tollwut-verdächtige
Berirab Anwendung Berirab Produktupdate Berirab in Österreich Berirab Anwendung Prophylaxe der Tollwut nach Exposition durch: Kratz- oder Bisswunden oder andere Verletzungen verursacht durch Tollwut-verdächtige
Meningokokken-Gruppen A, C, W-135 und Y-Konjugatimpfstoff
 Gebrauchsinformation: Information für Patienten und Anwender Nimenrix - Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Meningokokken-Gruppen A, C, W-135 und Y-Konjugatimpfstoff
Gebrauchsinformation: Information für Patienten und Anwender Nimenrix - Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Meningokokken-Gruppen A, C, W-135 und Y-Konjugatimpfstoff
Sanofi Pasteur MSD GmbH 1. BEZEICHNUNG DES ARZNEIMITTELS
 1. BEZEICHNUNG DES ARZNEIMITTELS REVAXiS Injektionssuspension in einer Fertigspritze Tetanus-Diphtherie-Poliomyelitis(inaktiviert)-Adsorbat-Impfstoff (reduzierter Antigengehalt) 2. QUALITATIVE UND QUANTITATIVE
1. BEZEICHNUNG DES ARZNEIMITTELS REVAXiS Injektionssuspension in einer Fertigspritze Tetanus-Diphtherie-Poliomyelitis(inaktiviert)-Adsorbat-Impfstoff (reduzierter Antigengehalt) 2. QUALITATIVE UND QUANTITATIVE
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS. HBVAXPRO 5 Mikrogramm, Injektionssuspension in einer Fertigspritze Hepatitis B-Impfstoff (rdns)
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS HBVAXPRO 5 Mikrogramm, Injektionssuspension in einer Fertigspritze Hepatitis B-Impfstoff (rdns) 2. QUALITATIVE UND QUANTITATIVE
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS HBVAXPRO 5 Mikrogramm, Injektionssuspension in einer Fertigspritze Hepatitis B-Impfstoff (rdns) 2. QUALITATIVE UND QUANTITATIVE
FACHINFORMATION. 1 Hartkapsel enthält: 6 mg lysierte immunaktive Fraktionen aus ausgewählten Escherichia-coli-Stämmen.
 FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Uro-Vaxom 6 mg Hartkapseln Wirkstoff: E. coli-fraktionen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Hartkapsel enthält: 6 mg lysierte immunaktive
FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Uro-Vaxom 6 mg Hartkapseln Wirkstoff: E. coli-fraktionen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Hartkapsel enthält: 6 mg lysierte immunaktive
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Selenase 100 Mikrogramm/2 ml Lösung zum Einnehmen 100 Mikrogramm Selen in 2 ml Lösung zum Einnehmen
 biosyn Arzneimittel GmbH Schorndorfer Straße 32, 70734 Fellbach, Deutschland GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Selenase 100 Mikrogramm/2 ml Lösung zum Einnehmen 100 Mikrogramm Selen in 2
biosyn Arzneimittel GmbH Schorndorfer Straße 32, 70734 Fellbach, Deutschland GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Selenase 100 Mikrogramm/2 ml Lösung zum Einnehmen 100 Mikrogramm Selen in 2
Gebrauchsinformation: Information für Anwender. Meditonsin Tropfen Aconitinum D5/ Atropinum sulfuricum D5/ Hydrargyrum bicyanatum D8
 Gebrauchsinformation: Information für Anwender Meditonsin Tropfen Aconitinum D5/ Atropinum sulfuricum D5/ Hydrargyrum bicyanatum D8 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Gebrauchsinformation: Information für Anwender Meditonsin Tropfen Aconitinum D5/ Atropinum sulfuricum D5/ Hydrargyrum bicyanatum D8 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Gebrauchsinformation: Information für Anwender. HBVAXPRO 40 Mikrogramm, Injektionssuspension Hepatitis B-Impfstoff (rdns)
 Gebrauchsinformation: Information für Anwender HBVAXPRO 40 Mikrogramm, Injektionssuspension Hepatitis B-Impfstoff (rdns) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem Impfstoff
Gebrauchsinformation: Information für Anwender HBVAXPRO 40 Mikrogramm, Injektionssuspension Hepatitis B-Impfstoff (rdns) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem Impfstoff
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Medivitan iv Fertigspritze 5mg, 1mg, 1,05mg Injektionslösung Wirkstoffe: Pyridoxinhydrochlorid / Cyanocobalamin / Folsäure Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Anwender Medivitan iv Fertigspritze 5mg, 1mg, 1,05mg Injektionslösung Wirkstoffe: Pyridoxinhydrochlorid / Cyanocobalamin / Folsäure Lesen Sie die gesamte Packungsbeilage
ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS 1. RIKA-VACC Duo Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension, für Kaninchen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS 1. RIKA-VACC Duo Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension, für Kaninchen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1.3.1 SPC, LABELLING AND PACKAGE LEAFLET
 1.3.1 SPC, LABELLING AND PACKAGE LEAFLET Beschriftungsentwurf der Fachinformation Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Bronchoverde Hustenlöser 100 mg Brausetabletten
1.3.1 SPC, LABELLING AND PACKAGE LEAFLET Beschriftungsentwurf der Fachinformation Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Bronchoverde Hustenlöser 100 mg Brausetabletten
Gebrauchsinformation: Information für den Anwender. Hepatyrix Injektionssuspension
 Gebrauchsinformation: Information für den Anwender Hepatyrix Injektionssuspension Kombinierter Hepatitis A (inaktiviert) und Typhus-Vi- Polysaccharid Impfstoff (adsorbiert) Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für den Anwender Hepatyrix Injektionssuspension Kombinierter Hepatitis A (inaktiviert) und Typhus-Vi- Polysaccharid Impfstoff (adsorbiert) Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information Für Anwender
 Gebrauchsinformation: Information Für Anwender Tollwut-Impfstoff Mérieux HDCV inaktiviert, Pulver und Lösungsmittel zur Herstellung einer Injektionssuspension Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information Für Anwender Tollwut-Impfstoff Mérieux HDCV inaktiviert, Pulver und Lösungsmittel zur Herstellung einer Injektionssuspension Lesen Sie die gesamte Packungsbeilage sorgfältig
2 QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 Page 1 of 8 FACHINFORMATION 1 BEZEICHNUNG DES ARZNEIMITTELS Tuberkulin PPD RT23 SSI 2 T.E./0,1 ml, Injektionslösung. Tuberkulin PPD RT23 SSI 10 T.E./0,1 ml, Injektionslösung. 2 QUALITATIVE UND QUANTITATIVE
Page 1 of 8 FACHINFORMATION 1 BEZEICHNUNG DES ARZNEIMITTELS Tuberkulin PPD RT23 SSI 2 T.E./0,1 ml, Injektionslösung. Tuberkulin PPD RT23 SSI 10 T.E./0,1 ml, Injektionslösung. 2 QUALITATIVE UND QUANTITATIVE
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige
FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels)
 FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels) 1. BEZEICHNUNG DES ARZNEIMITTELS Condrosulf 800 mg-tabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Tablette enthält 800 mg Natriumchondroitinsulfat
FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels) 1. BEZEICHNUNG DES ARZNEIMITTELS Condrosulf 800 mg-tabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Tablette enthält 800 mg Natriumchondroitinsulfat
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER AFLUBIN chronisch- Hustentropfen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER AFLUBIN chronisch- Hustentropfen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS HBVAXPRO 5 Mikrogramm, Injektionssuspension in einer Fertigspritze Hepatitis B-Impfstoff (rdns) 2. QUALITATIVE UND QUANTITATIVE
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS HBVAXPRO 5 Mikrogramm, Injektionssuspension in einer Fertigspritze Hepatitis B-Impfstoff (rdns) 2. QUALITATIVE UND QUANTITATIVE
Sonstige Bestandteile: Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
 1. BEZEICHNUNG DES ARZNEIMITTELS MUTAGRIP 2013/2014 Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Impfdosis (0,5 ml)
1. BEZEICHNUNG DES ARZNEIMITTELS MUTAGRIP 2013/2014 Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Impfdosis (0,5 ml)
Vollständige Auflistung der sonstigen Bestandteile siehe, Abschnitt 6.1.
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Baldriparan für die Nacht überzogene Tabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Jede überzogene Tablette enthält
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Baldriparan für die Nacht überzogene Tabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Jede überzogene Tablette enthält
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Meningokokken-Impfstoff A + C Mérieux
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Meningokokken-Impfstoff A + C Mérieux Lyophilisat (Trockensubstanz) und Lösungsmittel zur Herstellung einer Injektionssuspension Lesen Sie die gesamte
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Meningokokken-Impfstoff A + C Mérieux Lyophilisat (Trockensubstanz) und Lösungsmittel zur Herstellung einer Injektionssuspension Lesen Sie die gesamte
Fachinformation IPV Mérieux Stand: Juli 2010
 Fachinformation IPV Mérieux Stand: Juli 2010 1. BEZEICHNUNG DES ARZNEIMITTELS IPV Mérieux Injektionssuspension in einer Fertigspritze Inaktivierter Poliomyelitis-Impfstoff 2. QUALITATIVE UND QUANTITATIVE
Fachinformation IPV Mérieux Stand: Juli 2010 1. BEZEICHNUNG DES ARZNEIMITTELS IPV Mérieux Injektionssuspension in einer Fertigspritze Inaktivierter Poliomyelitis-Impfstoff 2. QUALITATIVE UND QUANTITATIVE
Mumpsviren, Stamm RIT , abgeleitet vom Stamm Jeryl Lynn (lebend, attenuiert) mindestens 10 3,7 ZKID 50
 1. BEZEICHNUNG DES ARZNEIMITTELS MMR-PRIORIX - Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Masern-Mumps-Röteln-Lebendimpfstoff 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Dosis
1. BEZEICHNUNG DES ARZNEIMITTELS MMR-PRIORIX - Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Masern-Mumps-Röteln-Lebendimpfstoff 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Dosis
GEBRAUCHSINFORMATION FÜR. Eurican LR Injektionssuspension
 PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION FÜR Eurican LR Injektionssuspension 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE VERANTWORTLICH
PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION FÜR Eurican LR Injektionssuspension 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE VERANTWORTLICH
Versiguard Rabies-Injektionssuspension für Hunde, Katzen, Rinder, Schweine, Schafe, Ziegen, Pferde und Frettchen
 1. BEZEICHNUNG DES TIERARZNEIMITTELS Versiguard Rabies-Injektionssuspension für Hunde, Katzen, Rinder, Schweine, Schafe, Ziegen, Pferde und Frettchen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Dosis
1. BEZEICHNUNG DES TIERARZNEIMITTELS Versiguard Rabies-Injektionssuspension für Hunde, Katzen, Rinder, Schweine, Schafe, Ziegen, Pferde und Frettchen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Dosis
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 Seite 1 von 5 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER CORASAN Tropfen Wirkstoffe: Crataegus D1, Selenicereus grandiflorus (Cactus) D2, Digitalis purpurea D6, Strophanthus gratus D6. Lesen Sie die
Seite 1 von 5 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER CORASAN Tropfen Wirkstoffe: Crataegus D1, Selenicereus grandiflorus (Cactus) D2, Digitalis purpurea D6, Strophanthus gratus D6. Lesen Sie die
Twinrix Kinder, Injektionssuspension Hepatitis-A (inaktiviert)- und Hepatitis-B (rdna) (HAB)-Impfstoff (adsorbiert)
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Twinrix Kinder, Injektionssuspension Hepatitis-A (inaktiviert)- und Hepatitis-B (rdna) (HAB)-Impfstoff (adsorbiert) 2. QUALITATIVE
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Twinrix Kinder, Injektionssuspension Hepatitis-A (inaktiviert)- und Hepatitis-B (rdna) (HAB)-Impfstoff (adsorbiert) 2. QUALITATIVE
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Tetanus-Impfstoff Mérieux, mind. 40 I.E. Injektionssuspension in einer Fertigspritze Injektionssuspension Tetanus-Adsorbat-Impfstoff Für Säuglinge, Kinder
Gebrauchsinformation: Information für Anwender Tetanus-Impfstoff Mérieux, mind. 40 I.E. Injektionssuspension in einer Fertigspritze Injektionssuspension Tetanus-Adsorbat-Impfstoff Für Säuglinge, Kinder
Engerix -B Erwachsene Injektionssuspension in einer Durchstechflasche oder in einer Fertigspritze Hepatitis-B (rdna)-impfstoff (adsorbiert) (HBV)
 1 FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Engerix -B Erwachsene Injektionssuspension in einer Durchstechflasche oder in einer Fertigspritze Hepatitis-B (rdna)-impfstoff (adsorbiert) (HBV) 2. QUALITATIVE
1 FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Engerix -B Erwachsene Injektionssuspension in einer Durchstechflasche oder in einer Fertigspritze Hepatitis-B (rdna)-impfstoff (adsorbiert) (HBV) 2. QUALITATIVE
StroVac Injektionssuspension
 Gebrauchsinformation: Information für den Anwender StroVac Injektionssuspension Wirkstoff: Inaktivierte Keime spezifizierter Enterobakterien Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor
Gebrauchsinformation: Information für den Anwender StroVac Injektionssuspension Wirkstoff: Inaktivierte Keime spezifizierter Enterobakterien Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. TYPHIM Vi, 25 Microgramm/ dosis, Injektionslösung. Typhus-Polysaccharid-Impfstoff
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER TYPHIM Vi, 25 Microgramm/ dosis, Injektionslösung Typhus-Polysaccharid-Impfstoff Lesen Sie die Packungsbeilage sorgfältig durch, bevor Sie oder Ihr Kind
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER TYPHIM Vi, 25 Microgramm/ dosis, Injektionslösung Typhus-Polysaccharid-Impfstoff Lesen Sie die Packungsbeilage sorgfältig durch, bevor Sie oder Ihr Kind
GEBRAUCHSINFORMATION Bovalto Respi 3 Injektionssuspension für Rinder
 GEBRAUCHSINFORMATION Bovalto Respi 3 Injektionssuspension für Rinder 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE VERANTWORTLICH
GEBRAUCHSINFORMATION Bovalto Respi 3 Injektionssuspension für Rinder 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE VERANTWORTLICH
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 Sinupret Tropfen GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Flüssigextrakt aus Enzianwurzel, Schlüsselblumenblüte mit Kelch, Gartensauerampferkraut, Holunderblüte und Eisenkraut Lesen Sie die gesamte
Sinupret Tropfen GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Flüssigextrakt aus Enzianwurzel, Schlüsselblumenblüte mit Kelch, Gartensauerampferkraut, Holunderblüte und Eisenkraut Lesen Sie die gesamte
GEBRAUCHSINFORMATION. RIVAC SHPPi+3LT Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension für Hunde
 GEBRAUCHSINFORMATION RIVAC SHPPi+3LT Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension für Hunde 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS,
GEBRAUCHSINFORMATION RIVAC SHPPi+3LT Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension für Hunde 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS,
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Fovepta 200 I.E. Injektionslösung in einer Fertigspritze Hepatitis-B-Immunglobulin vom Menschen
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Fovepta 200 I.E. Injektionslösung in einer Fertigspritze Hepatitis-B-Immunglobulin vom Menschen Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Fovepta 200 I.E. Injektionslösung in einer Fertigspritze Hepatitis-B-Immunglobulin vom Menschen Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Osanit Schnupfenkügelchen Wirkstoff: Sambucus nigra D3
 Gebrauchsinformation: Information für Anwender Osanit Schnupfenkügelchen Wirkstoff: Sambucus nigra D3 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Anwender Osanit Schnupfenkügelchen Wirkstoff: Sambucus nigra D3 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS HBVAXPRO 5 Mikrogramm, Injektionssuspension Hepatitis B-Impfstoff (rdns) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS HBVAXPRO 5 Mikrogramm, Injektionssuspension Hepatitis B-Impfstoff (rdns) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Gebrauchsinformation: Information für Anwender. Inaktivierter Poliomyelitis-Impfstoff
 Gebrauchsinformation: Information für Anwender IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Gebrauchsinformation: Information für Anwender IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Zovirax 5%-Creme Wirkstoff: Aciclovir
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Zovirax 5%-Creme Wirkstoff: Aciclovir Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Zovirax 5%-Creme Wirkstoff: Aciclovir Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Zovirax 5%-Creme Wirkstoff: Aciclovir
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Zovirax 5%-Creme Wirkstoff: Aciclovir Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Zovirax 5%-Creme Wirkstoff: Aciclovir Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn
Gebrauchsinformation: Information für Anwender. Choleodoron Tropfen Wirkstoffe: Chelidonium majus (Schöllkraut) Ø, Curcuma xanthorrhiza (Gelbwurz) Ø
 1 Gebrauchsinformation: Information für Anwender Choleodoron Tropfen Wirkstoffe: Chelidonium majus (Schöllkraut) Ø, Curcuma xanthorrhiza (Gelbwurz) Ø Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
1 Gebrauchsinformation: Information für Anwender Choleodoron Tropfen Wirkstoffe: Chelidonium majus (Schöllkraut) Ø, Curcuma xanthorrhiza (Gelbwurz) Ø Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Gebrauchsinformation: Information für Anwender. Euphrasia D3 Augentropfen Weleda
 1/5 Gebrauchsinformation: Information für Anwender Euphrasia D3 Augentropfen Weleda Wirkstoff: Euphrasia D3 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
1/5 Gebrauchsinformation: Information für Anwender Euphrasia D3 Augentropfen Weleda Wirkstoff: Euphrasia D3 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Encepur 0,25 ml für Kinder Injektionssuspension in einer Fertigspritze 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Inaktivierter
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Encepur 0,25 ml für Kinder Injektionssuspension in einer Fertigspritze 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Inaktivierter
FACHINFORMATION ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS. Rabipur 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 FACHINFORMATION ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS Rabipur 1. BEZEICHNUNG DES ARZNEIMITTELS Rabipur Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Tollwut-Impfstoff, inaktiviert
FACHINFORMATION ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS Rabipur 1. BEZEICHNUNG DES ARZNEIMITTELS Rabipur Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Tollwut-Impfstoff, inaktiviert
Gebrauchsinformation: Information für Anwender. Typhim Vi 25 Mikrogramm Injektionslösung in einer Fertigspritze Typhus-Polysaccharid-Impfstoff
 Gebrauchsinformation: Information für Anwender Typhim Vi 25 Mikrogramm Injektionslösung in einer Fertigspritze Typhus-Polysaccharid-Impfstoff Für Kinder ab 2 Jahren und Erwachsene Lesen Sie die gesamte
Gebrauchsinformation: Information für Anwender Typhim Vi 25 Mikrogramm Injektionslösung in einer Fertigspritze Typhus-Polysaccharid-Impfstoff Für Kinder ab 2 Jahren und Erwachsene Lesen Sie die gesamte
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER CRIMAX Haarvitaltropfen Wirkstoffe: Acidum hydrofluoricum Dil. D12, Graphites Dil. D8, Pel talpae Dil. D8, Selenium amorphum Dil. D12 Lesen Sie die gesamte
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER CRIMAX Haarvitaltropfen Wirkstoffe: Acidum hydrofluoricum Dil. D12, Graphites Dil. D8, Pel talpae Dil. D8, Selenium amorphum Dil. D12 Lesen Sie die gesamte
Gebrauchsinformation: Information für den Anwender. Polio-Salk Mérieux - Fertigspritze Poliomyelitis-Impfstoff (inaktiviert)
 Gebrauchsinformation: Information für den Anwender Polio-Salk Mérieux - Fertigspritze Poliomyelitis-Impfstoff (inaktiviert) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem
Gebrauchsinformation: Information für den Anwender Polio-Salk Mérieux - Fertigspritze Poliomyelitis-Impfstoff (inaktiviert) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem
Gebrauchsinformation: Information für Anwender. Apozema Dreiklang Globuli zur Aktivierung nach grippalen Infekten Sulfur D12/D18/D30
 Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli zur Aktivierung nach grippalen Infekten Sulfur D12/D18/D30 Wirkstoff: Sulfur D12/D18/D30 Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli zur Aktivierung nach grippalen Infekten Sulfur D12/D18/D30 Wirkstoff: Sulfur D12/D18/D30 Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION Purevax RCP Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension
 GEBRAUCHSINFORMATION Purevax RCP Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR
GEBRAUCHSINFORMATION Purevax RCP Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Encepur 0,5 ml Injektionssuspension in einer Fertigspritze 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Inaktivierter
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Encepur 0,5 ml Injektionssuspension in einer Fertigspritze 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Inaktivierter
GEBRAUCHSINFORMATION Purevax RCPCh Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension
 GEBRAUCHSINFORMATION Purevax RCPCh Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR
GEBRAUCHSINFORMATION Purevax RCPCh Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR
