Energie, Energieumwandlung, exotherme und endotherme Reaktionen
|
|
|
- Hetty Beckenbauer
- vor 6 Jahren
- Abrufe
Transkript
1 Schulversuchspraktikum Tatjana Müller Sommersemester 2017 Klassenstufen 7 & 8 Energie, Energieumwandlung, exotherme und endotherme Reaktionen
2 Auf einen Blick: In diesem Protokoll werden verschiedene Versuche zum Thema Energie, Energieumwandlung, endotherme und exotherme Reaktion dargestellt. Versuch 1 ist ein Modellversuch zur Verdeutlichung der thermischen Energie. Versuch 2 zeigt, durch das Verbrennen von Streichholzköpfen und der entstehenden Lichtenergie sowie Volumenarbeit, dass Energie in verschiedene Formen umgewandelt werden kann. Das Lösen von Salzen (Versuch 3) zeigt endotherme und exotherme Reaktionen. Versuch 4 zeigt einen weiteren endothermen Versuch, in dem die Temperatur von Eiswasser durch die Zugabe von Salz weiter gesenkt wird. Inhalt 1 Beschreibung des Themas und zugehörige Lernziele Relevanz des Themas für SuS der (jeweiligen Klassenstufe) und didaktische Reduktion Lehrerversuche V1 Versuch zur thermischen Energie V2 Lichtenergie und Volumenarbeit Schülerversuche V3 Lösen von Salzen V4 Gefrierpunktserniedrigung von Eiswasser Didaktischer Kommentar zum Schülerarbeitsblatt Erwartungshorizont (Kerncurriculum) Erwartungshorizont (Inhaltlich)... 13
3 1 Beschreibung des Themas und zugehörige Lernziele 1 1 Beschreibung des Themas und zugehörige Lernziele Das Thema der unten aufgeführten Experimente ist Energie, Energieumwandlung, endotherme und exotherme Reaktionen. Die Energie umfasst im Kerncurriculum ein eigenes Basiskonzept. Demnach sollen die SuS im Bereich des Fachwissens den prinzipiellen Zusammenhang zwischen Bewegungsenergie der Teilchen/Bausteine und der Temperatur beschreiben. Im Bereich der Erkenntnisgewinnung soll die Wärme (thermische Energie) als Teilchenbewegung erklärt werden (Niedersächsisches Kultusministerium, 2015). Der erste Versuch (V1) zielt darauf ab, diese beiden Kompetenzen mittels eines Modellversuchs zu fördern und den Sachverhalt der thermischen Energie somit anschaulich zu präsentieren und den SuS zugänglich zu machen. Des Weiteren heißt es im Curriculum, dass die SuS beschreiben sollen, dass Systeme bei chemischen Reaktionen Energie mit der Umgebung, z.b. in Form von Wärme, austauschen können und dadurch ihren Energiegehalt verändern. Zudem sollen die SuS zwischen endothermen und exothermen Reaktionen unterscheiden können (Niedersächsisches Kultusministerium, 2015). Versuch 2 zeigt hierfür die Umwandlung von Wärmeenergie in Lichtenergie und Volumenarbeit. Hierbei wird den SuS verdeutlicht, dass die Energie umgewandelt und mit der Umgebung ausgetauscht wird. Zudem wird ersichtlich, dass die Systeme ihren Energiegehalt ändern. Die Versuche 3 und 4 zielen dann auf die Beschreibung der Reaktionen als endotherm bzw. exotherm ab. In Versuch 4 wird hierfür Eiswasser unter Zuhilfenahme von Salz weiter abgekühlt. In Versuch 3 wird Calciumchlorid, bzw. Calciumchlorid-Hexahydrat in Wasser gelöst, wobei es zu einer exothermen bzw. endothermen Reaktion kommt. 2 Relevanz des Themas für SuS der (jeweiligen Klassenstufe) und didaktische Reduktion Das Thema Energie begegnet den SuS in ihrem alltäglichen Leben ständig. Die SuS kommen regelmäßig mit verschiedenen Energieformen wie Lichtenergie, elektrischer Energie oder Wärmeenergie in Berührung. Auch das Absenken des Gefrierpunktes durch Salz, das Lösen einer Brausetablette oder aber der Taschenwärmer stellen Alltagsbezüge und Anknüpfungspunkte an Erfahrungen von SuS und ihrem Vorwissen dar. Somit gelingt es über das Thema Energie viele Alltagsphänomene zu erklären. Zusätzlich zu dem Alltagsbezug eignet sich das Thema Energie auch sehr gut, um Verknüpfungen zu den Bereichen der Biologie und der Physik herzustellen. So wird beispielsweise die Nutzung von Lichtenergie im Zuge der Photosynthese im Biologieunterricht besprochen. Im Bereich der Jahrgangstufe 7/8 müssen dennoch einige didaktische Reduktionen vorgenommen werden. Die innere Energie U eines jeden Stoffes, kann hierbei als Energie eines Stoffes bezeichnet werden. Dabei sollte jedoch verdeutlicht werden, dass jeder Stoff seine eigene Energie hat, und dass wenn ein neuer Stoff bei einer Reaktion entsteht, auch dieser wieder eine eigene
4 3 Lehrerversuche 2 Energie hat. Im Bereich der Lösung von Salzen und der damit verbundenen freiwerdenden Energie müssen ebenfalls Reduktionen gemacht werden. Die Begriffe Gitterenergie und Hydratationsenergie werden laut dem niedersächsischen Kerncurriculum erst in der Jahrgangsstufe 9/10 eingeführt. Somit müssen diese Energiebegriffe umschrieben werden, um die vorgestellten Versuche dennoch deuten zu können. Die Gitterenergie könnte als Energie bezeichnet werden, die benötigt wird, um die Salzteilchen aus ihrer Struktur oder ihrem Kristall zu lösen. Die Hydratationsenergie kann beschrieben werden als die Energie, die frei wird, wenn sich Wasserteilchen um die herausgelösten Salzteilchen lagern. Setzt man diese beiden Energien nun in Bezug zueinander, kann hiermit die Wärmeabgabe bzw. -aufnahme bei den durchgeführten Versuchen erklärt werden. 3 Lehrerversuche 3.1 V1 Versuch zur thermischen Energie Der aufgeführte Versuch soll den Zusammenhang zwischen der Temperatur und der Bewegung der Teilchen verdeutlichen. Die thermische Energie kann zuvor bereits bekannt gemacht worden sein, oder aber im Anschluss an den Versuch, als Erklärung, eingeführt werden. Gefahrenstoffe Wasser H: - P: - Materialien: 2 Bechergläser, 2 Teebeutel (Früchtetee), Wasserkocher Chemikalien: Wasser Durchführung: In das erste Becherglas werden 200 ml Leitungswasser gegeben. In das zweite Becherglas werden ebenfalls 200 ml Leitungswasser gegeben, welches zuvor mit dem Wasserkocher erhitzt wurde. Nun wird gleichzeitig in jedes Becherglas ein Teebeutel gehangen.
5 3 Lehrerversuche 3 Beobachtung: In dem Becherglas mit dem heißen Wasser ist direkt nach dem Hinzugeben des Teebeutels eine rote Färbung zu erkennen. In dem Becherglas mit dem kalten Wasser beginnt sich das Wasser erst einige Momente nach der Zugabe des Teebeutels zu verfärben. Deutung: Die thermische Energie beschreibt im Besonderen die kinetische Energie eines Körpers. Die thermische Energie ist dabei umso größer, je höher die Temperatur eines Körpers ist. Folglich ist die Teilchenbewegung bei einer höheren Temperatur schneller. Didaktisch reduziert könnte man folglich darstellen, dass die Teilchen sich bei einer höheren Temperatur, schneller bewegen. Abbildung 1: Teebeutel in kaltem (links) und warmem (rechts) Wasser kurz nach dem hinzufügen (oben) und nach einigen Augenblicken (unten). Entsorgung: Die Lösungen können in den Ausguss gegeben werden. Die Teebeutel werden über den Hausmüll entsorgt. Unterrichtsanschlüsse: Der Versuch kann im Unterricht zur Einführung der thermischen Energie verwendet werden. Alternativ kann der Versuch auch mit Kaliumpermanganat durchgeführt werden. 3.2 V2 Lichtenergie und Volumenarbeit Der Versuch verdeutlicht, dass bei einer Reaktion Lichtenergie und auch Volumenarbeit freigesetzt werden kann. Gefahrenstoffe Streichhölzer H: - P: - Antimonsulfid H: 228, 302, 332, 411 P: 210, 273 Kaliumchlorat H: 271, 332, 302, 411 P: 210, 221, 273 Materialien: Reagenzglas, Gasbrenner, Luftballon, Parafilm, Stativ mit Klemme und Muffe
6 3 Lehrerversuche 4 Chemikalien: Streichholzköpfe (2 große) Durchführung: Die Streichholzköpfe werden in das Reagenzglas gegeben. Der Luftballon wird auf das Reagenzglas gezogen und mit Parafilm fixiert, so dass das System so dicht wie möglich ist. Mit dem Gasbrenner werden die Streichholzköpfe nun entzündet. Beobachtung: Wenn die Streichholzköpfe entzündet werden, ist ein helles Leuchten zu sehen. Der Luftballon wird aufgeblasen. Abbildung 2: Versuchsaufbau zur Energieumwandlung. Deutung: Bei der Reaktion handelt es sich um eine Verbrennung. Der Gasbrenner bietet die nötige Aktivierungsenergie in Form von Wärme, um die Reaktion von Schwefel und Kaliumchlorat ablaufen zu lassen. Dabei wird wiederum Energie in Form von Licht und Volumenarbeit frei. Die Lichtenergie ist durch das helle Aufleuchten, die Volumenarbeit durch das aufblasen des Luftballons sichtbar. Für die SuS könnte eine Deutung dann folgendermaßen aussehen: Bei der Verbrennung des Streichholzes wird Energie in Form von Licht sowie Volumenarbeit frei. Entsorgung: Die Reaktionsprodukte können in den Feststoffabfall gegeben werden. Literatur: [1] T. Seilnacht, (Zuletzt abgerufen am , 21:58 Uhr). Unterrichtsanschlüsse: Der Versuch kann im Unterricht zum Thema Energie und Energieumwandlung verwendet werden. Dabei kann dieser Versuch dazu verdeutlicht werden, dass Energie, die in Form von Wärme zugegeben wird, dann in Form von Lichtenergie oder Volumenarbeit wieder abgegeben werden kann. Thematisiert werden sollte hierbei auch, dass eine Volumenänderung auch durch die zugeführte Wärme des Gasbrenners zustande kommen kann.
7 4 Schülerversuche 5 4 Schülerversuche 4.1 V3 Lösen von Salzen Der Versuch zeigt eine exotherme und eine endotherme Reaktion. Hierfür werden Calciumchlorid und Calciumchlorid-Hexahydrat jeweils in Wasser gelöst. Gefahrenstoffe Destilliertes Wasser H: - P: - Calciumchlorid H: 319 P: 305, 351, 338 Calciumchlorid-Hexahydrat H: 319 P: 305, 351, 338 Materialien: Adiabatisches System (Styropor), Magnetrührer und Magnetrührstäbchen, Becherglas, Thermometer Chemikalien: Dest. Wasser, Calciumchlorid, Calciumchlorid-Hexahydrat Durchführung: Zunächst wird das Becherglas mit 40 ml Wasser befüllt. Das Becherglas wird in das abgeschlossene System gegeben. Zeigt das Thermometer eine konstante Wassertemperatur an, werden 11 g Calciumchlorid hinzugegeben und das System so schnell wie möglich wieder geschlossen. Sofort wird im Abstand von 5 Sekunden die Temperatur gemessen. Insgesamt sollte die Veränderung der Temperatur über einen Zeitraum von etwa 100 Sekunden gemessen werden. Wichtig ist es, dass der Magnetrührer die ganze Zeit eingeschaltet ist, damit sich das gesamte Calciumchlorid löst. Abbildung 3: Aufbau zum Versuch Lösen verschiedener Salze) Der gleiche Versuch soll dann nochmals mit Calciumchlorid-Hexahydrat durchgeführt werden. Beobachtung:
8 4 Schülerversuche 6 Tabelle 1: Messwerte V3. Gemessen wurde die Temperaturentwicklung nach Zugabe von Calciumchlorid im Zeitintervall von 5 Sekunden. Zeit [sek] Temp. [ C] ,0 42,9 58,6 62,7 63,9 65,1 68,1 71,4 73,0 Zeit [sek] Temp. [ C] ,1 74,0 73,4 73,0 72,1 71,0 70,7 69,4 69,0 Zeit [sek] Temp. [ C] ,0 67,3 66,4 Tabelle 2: Messwerte V3. Gemessen wurde die Temperaturentwicklung nach Zugabe von Calciumchlorid-Hexahydrat im Zeitintervall von 5 Sekunden. Zeit [sek] Temp. [ C] ,8 17,1 16,9 15,2 14,1 13,0 11,8 11,4 11,3 Zeit [sek] Temp. [ C] ,9 12,7 13,4 13,6 13,8 14,0 14,2 14,5 14,7 Zeit [sek] Temp. [ C] ,9 15,1 15,2
9 Temperatur/ C Temperatur/ C 4 Schülerversuche 7 Deutung: Zeit/ sek Abbildung 4: Auftragung der Messwerte von V3. Aufgetragen ist hier die Temperaturentwicklung bei dem Lösen von Calciumchlorid in Wasser Zeit/ sek Berechnung der Wärmemenge (Q) für Calciumchlorid (c p beschreibt hier die Wärmekapazität des Wassers): Abbildung 5: Auftragung der Messwerte von V3. Aufgetragen ist hier die Temperaturentwicklung bei dem Lösen von Calciumchlorid-Hexahydrat in Wasser. Q = m H2 O c p T Q = 40 g 4,18 J g 1 K 1 50 K = 8,36 kj Berechnung der Wärmemenge (Q) für Calciumchlorid-Hexahydrat (c p beschreibt hier die Wärmekapazität des Wassers): Q = m H2 O c p T Q = 40 g 4,18 J g 1 K 1 10,5 K = 1,76 kj Es lässt sich hieraus also ableiten, dass bei der Lösung von Calciumchlorid in Wasser 8,36 kj Energie in Form von Wärme frei werden. Daraus lässt sich ebenfalls folgern, dass die Hydratationse-
10 4 Schülerversuche 8 nergie größer ist als die Gitterenergie. Bei der Reaktion von Calciumchlorid-Hexahydrat und Wasser müssen 1,76 kj Energie in Form von Wärme aufgewendet werden. Die Hydratationsenergie ist hierbei kleiner als die Gitterenergie. Für die SuS könnte hier die Deutung wie folgt lauten: Bei dem Lösen von Calciumchlorid in Wasser steigt die Temperatur um 50 C. Es wird Energie in Form von Wärme abgegeben, daher ist die Reaktion exotherm. Beim Lösen von Calciumchlorid-Hexahydrat in Wasser sinkt die Temperatur um 10,5 C. Es wird also Energie in Form von Wärme aufgenommen, daher ist die Reaktion endotherm. Entsorgung: Die Lösungen sollten neutralisiert und anschließend in den Ausguss gegeben werden. Literatur: [1] H. Schmidtkunz, W. Rentzsch, Chemische Freihandversuche, kleine Versuche mit großer Wirkung, Band 1, Aulis Verlag (2011), S. 80. [2] R. Herbst-Irmer, Praktikumsskirpt zum anorganisch-chemischen Fortgeschrittenenpraktikum für Lehramtskandidaten, Göttingen (2017), S. 9. Unterrichtsanschlüsse: Anhand des Versuches können sowohl exotherme als auch endotherme Reaktionen behandelt werden. Der Versuch kann ebenfalls mit Kupfersulfat und Kupfersulfat-Pentahydrat durchgeführt werden. 4.2 V4 Gefrierpunktserniedrigung von Eiswasser Bei diesem Versuch wird Eiswasser mithilfe von Kochsalz unter 0 C abgekühlt. Gefahrenstoffe Wasser H: - P: - Natriumchlorid H: - P: - Materialien: 2 Bechergläser, 2 Thermometer, Glasstab
11 4 Schülerversuche 9 Chemikalien: Wasser, Eis, Natriumchlorid Durchführung: In beide Bechergläser wird die gleiche Menge an Eis und dazu etwas Wasser gegeben. In jedes Becherglas wird ein Thermometer gegeben um die Temperatur zu kontrollieren. Das erste Becherglas wird so stehen gelassen. Wenn die Temperatur stabil ist, wird in das zweite Becherglas eine ordentliche Menge Speisesalz gegeben. Mit einem Glasstab kann die Mischung etwas umgerührt werden. Wenn der Effekt noch nicht deutlich genug ist, muss etwas mehr Salz hinzugegeben werden. Beobachtung: Während die Temperatur in dem ersten Becherglas bei 0 C bleibt, sinkt die Temperatur in dem zweiten Becherglas nach Zugabe des Salzes auf -4,5 C ab. Deutung: Wird Salz in das Eiswasser gegeben, löst sich dieses. Um die Natriumchlorid-Ionen aus dem Kristallgitter zu lösen, muss die Gitterenergie aufgebracht werden. Die Wassermoleküle bilden dann anschließend eine Hydrathülle um die Salzionen, wodurch die Hydratationsenergie frei wird. Im Falle von Natriumchlorid und Wasser ist die Gitterenergie die aufgebracht werden muss größer, als die Hydratationsenergie die gewonnen wird, sodass zusätzlich Energie in Form von Wärme aus der Umgebung aufgenommen wird. Die Temperatur sinkt folglich. Für die Jahrgangsstufe 7/8 könnte die Deutung dahingehend reduziert werden, dass die Erklärung wie folgt lautet: Abbildung 6: Bechergläser mit Eiswasser und Thermometer. Im rechten Becherglas ist zusätzlich Salz enthalten. Die Temperatur senkt sich auf -4,5 C ab. Dies liegt daran, dass das Salz in einer festen Struktur, in einem Kristall vorliegt. Wenn das Salz nun im vorhandenen Wasser gelöst wird, muss es aus dieser Struktur herausgelöst werden, wofür Energie benötigt wird. Wenn die Salzteilchen aus ihrer Struktur herausgelöst wurden, lagern sich Wasserteilchen um sie herum. Dabei wird Energie frei. Wenn die Energie, die durch das Anlagern der Wasserteilchen an den Salzteilchen frei wird, geringer ist als die Energie, die für das Herauslösen der Salzteilchen aus ihrer Struktur benötigt wird, muss zusätzlich Energie in Form von Wärme aus der Umgebung aufgenommen werden. Das Eiswasser kühlt sich weiter ab. Es handelt sich hierbei folglich um eine endotherme Reaktion.
12 4 Schülerversuche 10 Entsorgung: Die Lösungen können in den Ausguss gegeben werden. Literatur: [1] H. Schmidtkunz, W. Rentzsch, Chemische Freihandversuche, kleine Versuche mit großer Wirkung, Band 1, Aulis Verlag (2011), S. 90. Unterrichtsanschlüsse: Dieser Versuch kann unter dem Stichwort der endothermen Reaktionen durchgeführt werden. Eine Alternative ist das Auflösen einer Brausetablette in Wasser. Auch dabei lässt sich eine Temperaturverringerung beobachten. Als Alltagsbezug könnte hier diskutiert werden, warum im Winter Salz gestreut wird. Das Salz setzt den Gefrierpunkt von Wasser herunter, wodurch es erst bei tieferen Temperaturen gefriert.
13 Name: Endotherme Reaktionen Datum: Eiswasser mit Salz Material: 2 Bechergläser, 2 Thermometer, Glasstab Chemikalien: Durchführung: Wasser, Eis, Speisesalz Gebe in beide Bechergläser die gleiche Menge Eis mit ein wenig Wasser. Stelle nun je ein Thermometer in jedes der beiden Bechergläser. Wenn die Temperatur in beiden Bechergläsern stabil ist, wird eine ordentliche Portion Speisesalz in das zweite Becherglas gegeben und etwas umgerührt um. Abbildung 1: Bechergläser mit Eiswasser und Thermometer. Beobachtung: Aufgabe 1: Führe den Versuch durch und protokolliere deine Beobachtungen. Aufgabe 2: Deute deine Beobachtungen. Aufgabe 3: Tom möchte für sich und seine Schwester Nudeln kochen. Da seine Schwester lieber die Schmetterlingsnudeln isst, Tom aber gerne Spaghetti haben möchte, beschließt er, einfach beide Sorten von Nudeln in zwei unterschiedlichen Töpfen zu kochen. Er füllt also die beiden gleichgroßen Töpfe mit der gleichen Menge an Wasser und fängt an, dass Wasser bei gleicher Intensität zu erhitzen. Er hat gerade das Salz in den ersten Topf gegeben, als das Telefon klingelt. Als er zurück in die Küche kommt stellt er fest, dass das Wasser in dem zweiten Topf bereits kocht, während das Wasser in dem ersten Topf noch nicht kocht. Stelle eine Hypothese auf, warum das Wasser in dem zweiten Topf bereits kocht, in dem ersten jedoch noch nicht.
14 5 Didaktischer Kommentar zum Schülerarbeitsblatt 12 5 Didaktischer Kommentar zum Schülerarbeitsblatt Das Arbeitsblatt behandelt eine endotherme Reaktion, nämlich das Lösen von Natriumchlorid. Dieses geschieht hier im Kontext einer Temperaturerniedrigung von Eiswasser durch die Zugabe von Natriumchlorid. Die SuS sollten bereits mit dem Konzept vertraut sein, dass Wärme als Energie bei verschiedenen Reaktionen entweder abgegeben oder aufgenommen werden kann. Zusätzlich sollten die SuS schon eine vereinfachte Erklärung dafür erhalten haben, dass beim Lösen von Salzen die Gitterenergie und die Hydratationsenergie beeinflussen, ob Energie in Form von Wärme abgegeben oder aufgenommen wird. Der Begriff der endothermen Reaktion kann hierfür bereits eingeführt worden sein, ist aber nicht zwingend erforderlich. Neben der Vertiefung und Verfestigung des Fachwissens, soll mit diesem Arbeitsblatt die Experimentierkompetenz der SuS geschult werden. Die SuS sollen eine Beobachtung tätigen und diese dann auch genau deuten. Abschließend sollen die SuS eine eigene Hypothese generieren. Hierfür ist es zusätzlich erforderlich, dass sie das Konzept der Wärmeenergie verstanden haben und anwenden können. 5.1 Erwartungshorizont (Kerncurriculum) Aufgabe 1 entspricht dem Anforderungsbereich 1. Hierbei sollen die SuS das genannte Experiment durchführen und ihre Beobachtungen notieren. Sie führen hiermit Untersuchungen zur Energieübertragung zwischen Systemen durch. Dies wird innerhalb der prozessbezogenen Kompetenz im Bereich der Erkenntnisgewinnung erwartet. Zudem sollen die SuS sachgerecht nach Anleitung experimentieren und die Bedeutung der Protokollführung erkennen. Dies wird herbei gefördert, da die SuS nach einer Anleitung den Versuch eigenständig durchführen sollen. Durch das notieren ihrer Beobachtungen wird wiederum die Protokollführung geschult. In Aufgabe 2 sollen diese Beobachtungen dann gedeutet werden. Um eine sachgerechte Deutung durchzuführen, müssen die Beobachtungen zuvor genau notiert worden sein, wodurch die Bedeutung der Protokollführung erneut verdeutlicht wird. Die Aufgabe entspricht dem Anforderungsbereich II, da die SuS hierbei ihre Beobachtungen deuten und somit in einen Zusammenhang bringen sollen. Je nach Kenntnisstand ist hier zu erwarten, dass die SuS entweder den Austausch von Wärmeenergie mit der Umgebung beschreiben, oder aber bereits, die Reaktion als endotherme Reaktion bezeichnen. Aufgabe 3 entspricht dann auch dem Anforderungsbereich III. Hierbei sollen die SuS einen Transfer von bereits gelerntem auf einen ähnlichen Sachverhalt herstellen. Dies geschieht hier, indem die SuS eine Hypothese aufstellen sollen. Neben dem fachlichen Transfer der geleistet werden muss, kann hiermit auch die Kompetenz zur Hypothesenbildung geschult werden. Da Hypothesen begründete Vermutungen sind, sollten die SuS hier eine oder mehrere Vermutungen äußern und diese auch begründen.
15 5 Didaktischer Kommentar zum Schülerarbeitsblatt Erwartungshorizont (Inhaltlich) In Aufgabe 1 wird erwartet, dass die SuS den Versuch korrekt durchführen und die Beobachtung notieren, dass das Eiswasser durchgängig eine Temperatur von um die 0 C aufweist, während das Eiswasser im zweiten Becherglas nach Zugabe von Salz eine Temperatur von etwa -4 C aufweist (die gemessene Temperatur kann hier, je nach zugegebener Menge Salz, schwanken, sollte aber deutlich unter 0 C liegen). Eine konkrete mögliche Beobachtung wäre also: Die Temperatur des Eiswassers ohne Salz beträgt die ganze Zeit über 0 C, während das Eiswasser nach Zugabe von Salz eine Temperatur von -4,5 C aufweist. Bei Aufgabe 2 wird erwartet, dass die SuS erkennen, dass bei der Reaktion, dem Lösen des Salzes, Wärmeenergie aus der Umgebung aufgenommen wird, wodurch sich die Umgebung abkühlt. Wenn der Begriff der endothermen Reaktion bereits eingeführt wurde, sollte auch dieser hier genannt werden. Die Begründung dafür, dass es sich hierbei um eine endotherme Reaktion handelt, sollte ebenfalls in reduzierter Weise genannt werden. Hierbei sollten die SuS das Aufnehmen der Wärmeenergie damit in Zusammenhang bringen, dass weniger Energie durch das Anlagern der Wasserteilchen an die Salzteilchen entsteht, als dass Energie benötigt wird, um die Salzteilchen aus ihrer Struktur zu lösen. Dadurch muss dann weitere Energie aufgewendet werden, die aus der Umgebung zugeführt wird. Eine mögliche Erklärung wäre also: Die Temperatur senkt sich durch die Zugabe von Salz ab. Dies liegt daran, dass das Salz in einer festen Struktur, in einem Kristall vorliegt. Wenn das Salz nun im vorhandenen Wasser gelöst wird, muss es aus dieser Struktur herausgelöst werden, wofür Energie benötigt wird. Wenn die Salzteilchen aus ihrer Struktur herausgelöst wurden, lagern sich Wasserteilchen um sie herum. Dabei wird Energie frei. Wenn die Energie, die durch das Anlagern der Wasserteilchen an den Salzteilchen frei wird, geringer ist als die Energie, die für das Herauslösen der Salzteilchen aus ihrer Struktur benötigt wird, muss zusätzlich Energie in Form von Wärme aus der Umgebung aufgenommen werden. Diese Wärme wird somit dem Wasser entzogen. Bei dem Lösen des Salzes in dem Wasser handelt es sich also um eine endotherme Reaktion. In der dritten Aufgabe wird erwartet, dass die SuS die Hypothese aufstellen, dass das Salz dafür verantwortlich ist, dass das Wasser in dem ersten Topf noch nicht kocht. Hierbei sollte eben wieder die bereits genannte Erklärung als Begründung herangezogen werden. Eine mögliche Hypothese wäre: Durch das Salz, dass in den ersten Topf gegeben wurde, kocht das Wasser noch nicht, weil durch das Lösen des Salzes Energie in Form von Wärme aus seiner Umgebung aufgenommen wird. Dadurch nimmt die Temperatur des Wassers ab und das Wasser ist etwas kälter als das Wasser im zweiten Topf, wodurch es länger dauert, bis das Wasser anfängt zu kochen.
Energie und Energieumwandlung
 Schulversuchspraktikum Maximilian Wolf Sommersemester Klassenstufen 7 & 8 Energie und Energieumwandlung Kurzprotokoll Auf einen Blick: In Versuch 1 werden Lycopodium-Sporen (Bärlapp) in der Gasbrennerflamme
Schulversuchspraktikum Maximilian Wolf Sommersemester Klassenstufen 7 & 8 Energie und Energieumwandlung Kurzprotokoll Auf einen Blick: In Versuch 1 werden Lycopodium-Sporen (Bärlapp) in der Gasbrennerflamme
Reaktionen von Metallen mit Sauerstoff und mit Luft
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die
Schulversuchspraktikum. Name Thomas Polle. Sommersemester Klassenstufen 5 & 6. Feuer und Kerzen
 Schulversuchspraktikum Name Thomas Polle Sommersemester 2015 Klassenstufen 5 & 6 Feuer und Kerzen 2 Auf einen Blick: Es werden je ein Schüler- und Lehrerversuch zum Thema Kerzen und Feuer für den 5. und
Schulversuchspraktikum Name Thomas Polle Sommersemester 2015 Klassenstufen 5 & 6 Feuer und Kerzen 2 Auf einen Blick: Es werden je ein Schüler- und Lehrerversuch zum Thema Kerzen und Feuer für den 5. und
Aggregatzustände und deren Temperaturabhängigkeit
 Name: Sissy Freund Semester: Sommersemester 2013 Klassenstufen: 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Dieses Protokoll
Name: Sissy Freund Semester: Sommersemester 2013 Klassenstufen: 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Dieses Protokoll
Wir untersuchen Mineralwasser
 Wir untersuchen Mineralwasser Jeder von uns kennt es: Mineralwasser. Im Geschäft wird es mit viel, wenig oder gar keiner Kohlensäure angeboten. Kohlensäure beschreibt die Form, in der das Gas Kohlenstoffdioxid
Wir untersuchen Mineralwasser Jeder von uns kennt es: Mineralwasser. Im Geschäft wird es mit viel, wenig oder gar keiner Kohlensäure angeboten. Kohlensäure beschreibt die Form, in der das Gas Kohlenstoffdioxid
Schulversuchspraktikum. Name: Tobias Piotrowski. Semester: Sommersemester 2013. Klassenstufen 9 & 10. ph-wert
 Schulversuchspraktikum Name: Tobias Piotrowski Semester: Sommersemester 2013 Klassenstufen 9 & 10 ph-wert 1 Beschreibung des Themas und zugehörige Lernziele (Max. 1 Seite) 2 Auf einen Blick: Dieses Protokoll
Schulversuchspraktikum Name: Tobias Piotrowski Semester: Sommersemester 2013 Klassenstufen 9 & 10 ph-wert 1 Beschreibung des Themas und zugehörige Lernziele (Max. 1 Seite) 2 Auf einen Blick: Dieses Protokoll
Schulversuchspraktikum. Sommersemester Klassenstufen 5 & 6. Feuer und Kerzen
 Schulversuchspraktikum Sommersemester 2013 Klassenstufen 5 & 6 Feuer und Kerzen Text zuzuweisen, der hier Fehler! Verwenden Sie 2 Auf einen Blick: In diesem Protokoll werden sechs Versuche dargestellt,
Schulversuchspraktikum Sommersemester 2013 Klassenstufen 5 & 6 Feuer und Kerzen Text zuzuweisen, der hier Fehler! Verwenden Sie 2 Auf einen Blick: In diesem Protokoll werden sechs Versuche dargestellt,
Wie wirkt sich die Zugabe von Salz auf den Schmelz- und Siedepunkt von Wasser aus?
 Naturwissenschaften - Chemie - Allgemeine Chemie - 7 Chemische Bindung (P752400) 7.4 Schmelzpunktserniedrigung und Siedepunktserhöhung Experiment von: Phywe Gedruckt:.0.203 3:5:43 intertess (Version 3.06
Naturwissenschaften - Chemie - Allgemeine Chemie - 7 Chemische Bindung (P752400) 7.4 Schmelzpunktserniedrigung und Siedepunktserhöhung Experiment von: Phywe Gedruckt:.0.203 3:5:43 intertess (Version 3.06
Qualitativer Nachweis von Säuren und Basen
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll
Schwimmen, Schweben, Sinken
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 5 & 6 Schwimmen, Schweben, Sinken Auf einen Blick: Diese Unterrichtseinheit für die Klassen 5 & 6 beinhaltet einen Lehrer- und vier Schülerversuche.
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 5 & 6 Schwimmen, Schweben, Sinken Auf einen Blick: Diese Unterrichtseinheit für die Klassen 5 & 6 beinhaltet einen Lehrer- und vier Schülerversuche.
Basiskonzept: Stoff-Teilchen (3/7)
 Basiskonzept: Stoff-Teilchen (3/7) 1 Schuljahrgänge 7 und 8 Stoffe besitzen quantifizierbare Eigenschaften Die Schülerinnen und Schüler... unterscheiden Stoffe anhand von Schmelz- und Siedetemperatur.
Basiskonzept: Stoff-Teilchen (3/7) 1 Schuljahrgänge 7 und 8 Stoffe besitzen quantifizierbare Eigenschaften Die Schülerinnen und Schüler... unterscheiden Stoffe anhand von Schmelz- und Siedetemperatur.
Qualitativer Nachweis von Säuren und Basen
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen Kurzprotokoll Auf einen Blick: In diesem Protokoll wird ein Lehrerversuch, der
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen Kurzprotokoll Auf einen Blick: In diesem Protokoll wird ein Lehrerversuch, der
Endotherm und Exotherm
 Schulversuchspraktikum Anne Steinkuhle Sommersemester 2013 Klassenstufen 7 & 8 Endotherm und Exotherm 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In dem folgenden Protokoll sind
Schulversuchspraktikum Anne Steinkuhle Sommersemester 2013 Klassenstufen 7 & 8 Endotherm und Exotherm 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In dem folgenden Protokoll sind
Metalle und Nichtmetalle
 Schulversuchspraktium Bastian Hollemann Sommersemester 2015 Klassenstufen 9 & 10 Metalle und Nichtmetalle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Diese Unterrichtseinheit für
Schulversuchspraktium Bastian Hollemann Sommersemester 2015 Klassenstufen 9 & 10 Metalle und Nichtmetalle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Diese Unterrichtseinheit für
Reaktionen von Metallen mit Sauerstoff und mit Luft; Zerteilungsgrad
 Schulversuchspraktikum Mona-Christin Maaß Sommersemester 2013 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft; Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele
Schulversuchspraktikum Mona-Christin Maaß Sommersemester 2013 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft; Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele
Teilchenmodell, Brown sche Molekularbewegung,
 Schulversuchspraktikum Axel Wuttke Sommersemester 2013 Klassenstufen 7&8 Teilchenmodell, Brown sche Molekularbewegung, Diffusion 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Dieses
Schulversuchspraktikum Axel Wuttke Sommersemester 2013 Klassenstufen 7&8 Teilchenmodell, Brown sche Molekularbewegung, Diffusion 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Dieses
Mehrprotonige Säuren; als Beispiel Cola
 Mehrprotonige Säuren; als Beispiel Cola Arbeitsauftrag: Führe den nachstehenden Versuch Titration von Cola gemäß der Durchführung durch und notiere deine Messwerte: Materialien: 2 Bechergläser (230 ml),
Mehrprotonige Säuren; als Beispiel Cola Arbeitsauftrag: Führe den nachstehenden Versuch Titration von Cola gemäß der Durchführung durch und notiere deine Messwerte: Materialien: 2 Bechergläser (230 ml),
Vom Alkohol zum Alken
 1 Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufe 9 & 10 Vom Alkohol zum Alken 2 Auf einem Blick: Diese Unterrichtseinheit für die Klasse 9 & 10 enthält Lehrerversuche und 1 Schülerversuch
1 Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufe 9 & 10 Vom Alkohol zum Alken 2 Auf einem Blick: Diese Unterrichtseinheit für die Klasse 9 & 10 enthält Lehrerversuche und 1 Schülerversuch
Schulversuchspraktikum. Sommersemester 2014 Klassenstufen 7 & 8. Reaktionen von Metallen mit Sauerstoff und mit Luft.
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Haushaltsreiniger und Waschmittel
 Schulversuchspraktikum Name: Tobias Piotrowski Semester: Sommersemester 2013 Klassenstufen: 5 & 6 Haushaltsreiniger und Waschmittel 3 Schülerversuche 2 Auf einen Blick: Dieses Protokoll befasst sich mit
Schulversuchspraktikum Name: Tobias Piotrowski Semester: Sommersemester 2013 Klassenstufen: 5 & 6 Haushaltsreiniger und Waschmittel 3 Schülerversuche 2 Auf einen Blick: Dieses Protokoll befasst sich mit
Aggregatszustände und deren Temperaturabhängigkeit
 Schulversuchspraktikum Name: Christoph Biesemann Semester: Sommersemester 2012 Klassenstufe 5/6 Aggregatszustände und deren Temperaturabhängigkeit 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf
Schulversuchspraktikum Name: Christoph Biesemann Semester: Sommersemester 2012 Klassenstufe 5/6 Aggregatszustände und deren Temperaturabhängigkeit 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf
Licht und Farben. Kurzprotokoll
 Schulversuchspraktikum Name: Annika Münch Semester: 2. Mastersemester Klassenstufen 5/6 Licht und Farben Kurzprotokoll Auf einen Blick: Für eine Unterrichtseinheit zum Thema Licht und Farben im naturwissenschaftlichen
Schulversuchspraktikum Name: Annika Münch Semester: 2. Mastersemester Klassenstufen 5/6 Licht und Farben Kurzprotokoll Auf einen Blick: Für eine Unterrichtseinheit zum Thema Licht und Farben im naturwissenschaftlichen
Experimente Lehrerinformation
 Lehrerinformation 1/7 Arbeitsauftrag Die SuS experimentieren mit Salz und lernen es von der chemischen Seite her besser kennen. Dabei lernen sie in Modellversuchen wichtige Merkmale von Salz kennen. Ziel
Lehrerinformation 1/7 Arbeitsauftrag Die SuS experimentieren mit Salz und lernen es von der chemischen Seite her besser kennen. Dabei lernen sie in Modellversuchen wichtige Merkmale von Salz kennen. Ziel
Schulversuchspraktikum. Name: Jennifer Kölling. Sommersemester: Klassenstufen: 7/8. Sauerstoff. Das Gas des Lebens
 Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 7/8 Sauerstoff Das Gas des Lebens 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. Die Themeneinheit
Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 7/8 Sauerstoff Das Gas des Lebens 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. Die Themeneinheit
Schulversuchspraktikum. Anna Hille. Sommersemester 2013. Klassenstufen 9 & 10. Salz und Salzbildung
 Schulversuchspraktikum Anna Hille Sommersemester 2013 Klassenstufen 9 & 10 Salz und Salzbildung 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Dieses Protokoll enthält verschiedene
Schulversuchspraktikum Anna Hille Sommersemester 2013 Klassenstufen 9 & 10 Salz und Salzbildung 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Dieses Protokoll enthält verschiedene
Schulversuchspraktikum. Name: Jennifer Kölling. Sommersemester: Klassenstufen: 5/6. Die Luft. Das unsichtbare Gasgemisch
 Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 5/6 Die Luft Das unsichtbare Gasgemisch 1Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. In dieser
Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 5/6 Die Luft Das unsichtbare Gasgemisch 1Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. In dieser
Der Schmelzpunkt von Salzen
 Der Schmelzpunkt von Salzen Vergleich die Smp. der Salze (links). Welche Rolle könnten die Ionenradien bzw. die Ladung der enthaltenen Ionen spielen? Der Schmelzpunkt von Salzen ist i.d.r. sehr hoch. Er
Der Schmelzpunkt von Salzen Vergleich die Smp. der Salze (links). Welche Rolle könnten die Ionenradien bzw. die Ladung der enthaltenen Ionen spielen? Der Schmelzpunkt von Salzen ist i.d.r. sehr hoch. Er
Schmelz- und Siedetemperatur
 Schulversuchspraktikum Name: Bastian Engelke Semester: Sommersemester 2012 Klassenstufen 5 & 6 Schmelz- und Siedetemperatur 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Das vorgestellte
Schulversuchspraktikum Name: Bastian Engelke Semester: Sommersemester 2012 Klassenstufen 5 & 6 Schmelz- und Siedetemperatur 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Das vorgestellte
Reinstoffe und Stoffgemische
 Schulversuchspraktikum Dörte Hartje Sommersemester 2013 Klassenstufen 5 & 6 Reinstoffe und Stoffgemische Auf einen Blick: Dieses Versuchsprotokoll enthält zwei Lehrer- und vier SchülerInnenexperimente
Schulversuchspraktikum Dörte Hartje Sommersemester 2013 Klassenstufen 5 & 6 Reinstoffe und Stoffgemische Auf einen Blick: Dieses Versuchsprotokoll enthält zwei Lehrer- und vier SchülerInnenexperimente
Arbeitsblatt Wasserkreislauf der Erde
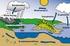 Arbeitsblatt Wasserkreislauf der Erde Aufgabe 1) Du hast im Unterricht bereits den Begriff des Aggregatzustands kennengelernt. Benenne die Übergänge zwischen den Aggregatzuständen, indem du die Pfeile
Arbeitsblatt Wasserkreislauf der Erde Aufgabe 1) Du hast im Unterricht bereits den Begriff des Aggregatzustands kennengelernt. Benenne die Übergänge zwischen den Aggregatzuständen, indem du die Pfeile
Schulversuchspraktikum. Till Beuermann. Sommersemester Klassenstufen 11 & 12. Batterien und Akkus
 Schulversuchspraktikum Till Beuermann Sommersemester 2013 Klassenstufen 11 & 12 Batterien und Akkus 1 Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Dieses Protokoll beschäftigt sich
Schulversuchspraktikum Till Beuermann Sommersemester 2013 Klassenstufen 11 & 12 Batterien und Akkus 1 Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Dieses Protokoll beschäftigt sich
Schulversuchspraktikum. Sommersemester 2013. Klassenstufen 7 & 8. Katalysatoren
 Schulversuchspraktikum Sommersemester 2013 Klassenstufen 7 & 8 Katalysatoren 2 Auf einen Blick: In diesem Protokoll werden sechs Versuche dargestellt, die drei inhaltliche Lernziele verfolgen: Sie zeigen,
Schulversuchspraktikum Sommersemester 2013 Klassenstufen 7 & 8 Katalysatoren 2 Auf einen Blick: In diesem Protokoll werden sechs Versuche dargestellt, die drei inhaltliche Lernziele verfolgen: Sie zeigen,
Aktivierungsenergie und Katalyse
 1 Beschreibung des Themas und zugehörige Lernziele Schulversuchspraktikum Marie-Lena Gallikowski Sommersemester 2015 Klassenstufen 7 & 8 Aktivierungsenergie und Katalyse 1 Beschreibung des Themas und zugehörige
1 Beschreibung des Themas und zugehörige Lernziele Schulversuchspraktikum Marie-Lena Gallikowski Sommersemester 2015 Klassenstufen 7 & 8 Aktivierungsenergie und Katalyse 1 Beschreibung des Themas und zugehörige
1 Beschreibung des Themas und zugehörige Lernziele 1. Schulversuchspraktikum. Till Beuermann. Sommersemester 2013. Klassenstufen 7 & 8.
 1 Beschreibung des Themas und zugehörige Lernziele 1 Schulversuchspraktikum Till Beuermann Sommersemester 2013 Klassenstufen 7 & 8 Strom aus Obst 1 Beschreibung des Themas und zugehörige Lernziele 2 Auf
1 Beschreibung des Themas und zugehörige Lernziele 1 Schulversuchspraktikum Till Beuermann Sommersemester 2013 Klassenstufen 7 & 8 Strom aus Obst 1 Beschreibung des Themas und zugehörige Lernziele 2 Auf
Tiere in Polarregionen
 Tiere in Polarregionen Warum es Eisbären gibt, aber keine Eismäuse Bergmannsche Regel Verwandte Tiere sind in kalten Regionen generell als in warmen Regionen. Mit der Größe eines Tieres wächst die im Quadrat,
Tiere in Polarregionen Warum es Eisbären gibt, aber keine Eismäuse Bergmannsche Regel Verwandte Tiere sind in kalten Regionen generell als in warmen Regionen. Mit der Größe eines Tieres wächst die im Quadrat,
Homogene und Heterogene Gemische
 Schulversuchspraktikum Name Nicolai ter Horst Semester SS 2013 Klassenstufen 7 & 8 Homogene und Heterogene Gemische 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll
Schulversuchspraktikum Name Nicolai ter Horst Semester SS 2013 Klassenstufen 7 & 8 Homogene und Heterogene Gemische 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll
Schulversuchspraktikum. Julia Müller. Klassenstufen 5/6. Feuer und Kerzen
 Schulversuchspraktikum Name Julia Müller Semester SoSe 2012 Klassenstufen 5/6 Feuer und Kerzen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Diese Unterrichtseinheit für die Klassenstufen
Schulversuchspraktikum Name Julia Müller Semester SoSe 2012 Klassenstufen 5/6 Feuer und Kerzen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Diese Unterrichtseinheit für die Klassenstufen
Experimentelle Ermittlung der molaren Lösungswärme von Kaliumchlorid
 Experimentelle Ermittlung der molaren Lösungswärme von Kaliumchlorid Versuchsaufbau : Um den Versuch durchzuführen, benötigen wir 180 g Wasser, welches in ein Becherglas gefüllt wird. Die Temperatur ermitteln
Experimentelle Ermittlung der molaren Lösungswärme von Kaliumchlorid Versuchsaufbau : Um den Versuch durchzuführen, benötigen wir 180 g Wasser, welches in ein Becherglas gefüllt wird. Die Temperatur ermitteln
1 Stoffe in Alltag und Technik
 Schülerband Blickpunkt Chemie 1 Niedersachsen (978-3-507-77292-2) Basiskonzept inhaltsbezogene Kompetenzen: Fachwissen prozessbezogene Kompetenzen: Erkenntnisgewinnung, Kommunikation, Bewertung Die Schülerinnen
Schülerband Blickpunkt Chemie 1 Niedersachsen (978-3-507-77292-2) Basiskonzept inhaltsbezogene Kompetenzen: Fachwissen prozessbezogene Kompetenzen: Erkenntnisgewinnung, Kommunikation, Bewertung Die Schülerinnen
Korrosion und Korrosionsschutz
 Schulversuchspraktikum Sommersemester 2013 Klassenstufen 11 & 12 Korrosion und Korrosionsschutz 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch
Schulversuchspraktikum Sommersemester 2013 Klassenstufen 11 & 12 Korrosion und Korrosionsschutz 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch
Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen
 Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 7 & 8 Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen 1 Beschreibung des Themas und zugehörige Lernziele
Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 7 & 8 Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen 1 Beschreibung des Themas und zugehörige Lernziele
Arbeitsblatt Wie entstehen Farben?
 Arbeitsblatt Wie entstehen Farben? Der für das menschliche Auge sichtbare Wellenlängenbereich liegt bei 380-750 nm. Farbstoffe sind in der Lage bestimmte Wellenlängen des Lichts zu absorbieren und eine
Arbeitsblatt Wie entstehen Farben? Der für das menschliche Auge sichtbare Wellenlängenbereich liegt bei 380-750 nm. Farbstoffe sind in der Lage bestimmte Wellenlängen des Lichts zu absorbieren und eine
Schulversuchspraktikum. Sommersemester 2014. Klassenstufen 11 & 12. Batterien und Akkus
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 11 & 12 Batterien und Akkus Auf einen Blick: In der folgenden Unterrichtseinheit Batterien und Akkus werden Schüler- und Lehrerversuche für die
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 11 & 12 Batterien und Akkus Auf einen Blick: In der folgenden Unterrichtseinheit Batterien und Akkus werden Schüler- und Lehrerversuche für die
Praktikum Physik. Protokoll zum Versuch 5: Spezifische Wärme. Durchgeführt am Gruppe X
 Praktikum Physik Protokoll zum Versuch 5: Spezifische Wärme Durchgeführt am 10.11.2011 Gruppe X Name 1 und Name 2 (abc.xyz@uni-ulm.de) (abc.xyz@uni-ulm.de) Betreuer: Wir bestätigen hiermit, dass wir das
Praktikum Physik Protokoll zum Versuch 5: Spezifische Wärme Durchgeführt am 10.11.2011 Gruppe X Name 1 und Name 2 (abc.xyz@uni-ulm.de) (abc.xyz@uni-ulm.de) Betreuer: Wir bestätigen hiermit, dass wir das
Erwartete Kompetenzen. Kompetenzbereich Erkenntnisgewinnung Die Schülerinnen und Schüler E1 E2 E3 E4 E5 E6 E7 E8 E9 E10 E11 E12 E13 E14 E15 E16 E17
 Stoffverteilungsplan Kerncurriculum für die Oberschule in Niedersachsen (Schuljahrgänge 7/8) PRISMA Chemie Niedersachsen Differenzierende Ausgabe Band 7/8 Schule: Klettbuch ISBN 978-3-12-068537-1 Lehrer:
Stoffverteilungsplan Kerncurriculum für die Oberschule in Niedersachsen (Schuljahrgänge 7/8) PRISMA Chemie Niedersachsen Differenzierende Ausgabe Band 7/8 Schule: Klettbuch ISBN 978-3-12-068537-1 Lehrer:
Reaktion von Nichtmetallen mit Sauerstoff
 Schulversuchspraktikum Name: Benjamin Heuer Semester: SS2013 Klassenstufen 7&8 Reaktion von Nichtmetallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum Name: Benjamin Heuer Semester: SS2013 Klassenstufen 7&8 Reaktion von Nichtmetallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Säuren und Basen im Haushalt
 Schulversuchspraktikum Lars Lichtenberg Sommersemester 2015 Klassenstufen 9 & 10 Säuren und Basen im Haushalt 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die Unterrichtseinheit,,Säuren
Schulversuchspraktikum Lars Lichtenberg Sommersemester 2015 Klassenstufen 9 & 10 Säuren und Basen im Haushalt 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die Unterrichtseinheit,,Säuren
Schulversuchspraktikum. Lars Lichtenberg. Sommersemester Klassenstufen 5 und 6. Einfache Kraftwerke
 Schulversuchspraktikum Lars Lichtenberg Sommersemester 2015 Klassenstufen 5 und 6 Einfache Kraftwerke 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die Unterrichtseinheit,,Einfache
Schulversuchspraktikum Lars Lichtenberg Sommersemester 2015 Klassenstufen 5 und 6 Einfache Kraftwerke 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die Unterrichtseinheit,,Einfache
Schulversuchspraktikum. Lars Lichtenberg. Sommersemester Klassenstufen 5 und 6. Einfache Kraftwerke. Kurzprotokoll
 Schulversuchspraktikum Lars Lichtenberg Sommersemester 2015 Klassenstufen 5 und 6 Einfache Kraftwerke Kurzprotokoll Auf einen Blick: Die Versuche des Kurzprotokolls sind als Schülerversuche vorgesehen.
Schulversuchspraktikum Lars Lichtenberg Sommersemester 2015 Klassenstufen 5 und 6 Einfache Kraftwerke Kurzprotokoll Auf einen Blick: Die Versuche des Kurzprotokolls sind als Schülerversuche vorgesehen.
PÄDAGOGISCHES LANDESINSTITUT VIER VERSUCHE FÜR DEN CHEMIEUNTERRICHT AB SEKUNDARSTUFE I
 PÄDAGOGISCHES LANDESINSTITUT VIER VERSUCHE FÜR DEN CHEMIEUNTERRICHT AB SEKUNDARSTUFE I Passend zu den Versuchsanleitungen sind Videoaufnahmen im Rahmen eines Weiterbildungslehrgangs des Pädagogischen Landesinstituts
PÄDAGOGISCHES LANDESINSTITUT VIER VERSUCHE FÜR DEN CHEMIEUNTERRICHT AB SEKUNDARSTUFE I Passend zu den Versuchsanleitungen sind Videoaufnahmen im Rahmen eines Weiterbildungslehrgangs des Pädagogischen Landesinstituts
Versuchsprotokoll: Fehling- Spaltung von Saccharose
 Versuchsprotokoll: Fehling- Spaltung von Saccharose Zeitaufwand: Vorbereitung: 5 Minuten Durchführung: 15 Minuten Abbau/Entsorgung: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol
Versuchsprotokoll: Fehling- Spaltung von Saccharose Zeitaufwand: Vorbereitung: 5 Minuten Durchführung: 15 Minuten Abbau/Entsorgung: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol
Säuren und Laugen im Haushalt
 Schulversuchspraktikum Maximilian Konrad Sommersemester 2012 Klassenstufen 9 & 10 Säuren und Laugen im Haushalt Auf einen Blick: Diese Unterrichtseinheit für die Klassen 9 und 10 enthält 2 Lehrerversuche,
Schulversuchspraktikum Maximilian Konrad Sommersemester 2012 Klassenstufen 9 & 10 Säuren und Laugen im Haushalt Auf einen Blick: Diese Unterrichtseinheit für die Klassen 9 und 10 enthält 2 Lehrerversuche,
Kernaussagen zum Teilchenmodell
 Kernaussagen zum Teilchenmodell Lernbereich 2: Stoffe und ihre Eigenschaften Von beobachtbaren Stoffeigenschaften zum Teilchenmodell Kompetenzerwartung 8 (NTG) und 9 (SG): Die Schülerinnen und Schüler
Kernaussagen zum Teilchenmodell Lernbereich 2: Stoffe und ihre Eigenschaften Von beobachtbaren Stoffeigenschaften zum Teilchenmodell Kompetenzerwartung 8 (NTG) und 9 (SG): Die Schülerinnen und Schüler
Schulversuchspraktikum. Dörte Hartje. Sommersemester 2013. Klassenstufen 7 & 8. Vom Erz zum Metall
 Schulversuchspraktikum Dörte Hartje Sommersemester 2013 Klassenstufen 7 & 8 Vom Erz zum Metall Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Dieses Protokoll enthält drei Lehrer- und
Schulversuchspraktikum Dörte Hartje Sommersemester 2013 Klassenstufen 7 & 8 Vom Erz zum Metall Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Dieses Protokoll enthält drei Lehrer- und
HTBL-PINKAFELD Arbeitsblatt A4/1 Wasser
 HTBL-PINKAFELD Arbeitsblatt A4/1 Wasser DIE ZERDRÜCKTE ALUDOSE LEERE Alu-Getränkedose (1/2 Liter!) Tiegelzange Schüssel mit kaltem Wasser 1. Fülle die leere Getränkedose mit wenig Wasser 2. Stelle die
HTBL-PINKAFELD Arbeitsblatt A4/1 Wasser DIE ZERDRÜCKTE ALUDOSE LEERE Alu-Getränkedose (1/2 Liter!) Tiegelzange Schüssel mit kaltem Wasser 1. Fülle die leere Getränkedose mit wenig Wasser 2. Stelle die
Schulversuchspraktikum. SoSe 2013. Klassenstufen 7 & 8. Dichte
 Schulversuchspraktikum SoSe 2013 Klassenstufen 7 & 8 Dichte 2 Auf einen Blick: Im Folgenden werden zwei Lehrerversuche und vier Schülerversuche vorgestellt, die sich mit der Dichte von Gasen und Flüssigkeiten,
Schulversuchspraktikum SoSe 2013 Klassenstufen 7 & 8 Dichte 2 Auf einen Blick: Im Folgenden werden zwei Lehrerversuche und vier Schülerversuche vorgestellt, die sich mit der Dichte von Gasen und Flüssigkeiten,
Vom Alkohol zum Alken
 Schulversuchspraktikum Sabine Wolff SoSe 2013 Klassenstufen 9 & 10 Vom Alkohol zum Alken 2 Auf einen Blick: Im Folgenden werden zwei Lehrerversuche vorgestellt, die die Darstellung von gasförmigen Alkenen
Schulversuchspraktikum Sabine Wolff SoSe 2013 Klassenstufen 9 & 10 Vom Alkohol zum Alken 2 Auf einen Blick: Im Folgenden werden zwei Lehrerversuche vorgestellt, die die Darstellung von gasförmigen Alkenen
Nach uns die Sintflut?
 Nach uns die Sintflut? Interdisziplinäre Untersuchungen zum Thema Wasser Modul: Analytik Jahrgangsstufe 9 Autor: SEITE 1 Abstract Das experimentelle Arbeiten in den Vordergrund stellen. Mit einem Portfolio
Nach uns die Sintflut? Interdisziplinäre Untersuchungen zum Thema Wasser Modul: Analytik Jahrgangsstufe 9 Autor: SEITE 1 Abstract Das experimentelle Arbeiten in den Vordergrund stellen. Mit einem Portfolio
Elektrische Leitfähigkeit; magnetische Eigenschaften
 Schulversuchspraktikum Sommersemester 2013 Klassenstufen 5 & 6 Elektrische Leitfähigkeit; magnetische Eigenschaften 1 Konzept und Lernziele 1 Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch
Schulversuchspraktikum Sommersemester 2013 Klassenstufen 5 & 6 Elektrische Leitfähigkeit; magnetische Eigenschaften 1 Konzept und Lernziele 1 Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch
Das ist ja nicht normal!
 1 Das ist ja nicht normal! Warum bekommen Straßen ständig neue Schlaglöcher? Warum geht eine Wasserflasche kaputt, wenn sie vollgefüllt ins Tiefkühlfach liegt? Warum schwimmt Eis auf Wasser? Und warum
1 Das ist ja nicht normal! Warum bekommen Straßen ständig neue Schlaglöcher? Warum geht eine Wasserflasche kaputt, wenn sie vollgefüllt ins Tiefkühlfach liegt? Warum schwimmt Eis auf Wasser? Und warum
Hurrikan, Taifun und Co.
 Hurrikan, Taifun und Co. Wirbelstürme als Thema für den fachübergreifenden Unterricht zwischen Physik und Geografie S. I S. I + II S. II LAURA RUESS SANDRA SPRENGER IRENE NEUMANN Online-Ergänzung MNU 68/1
Hurrikan, Taifun und Co. Wirbelstürme als Thema für den fachübergreifenden Unterricht zwischen Physik und Geografie S. I S. I + II S. II LAURA RUESS SANDRA SPRENGER IRENE NEUMANN Online-Ergänzung MNU 68/1
Der Zustand eines Systems ist durch Zustandsgrößen charakterisiert.
 Grundbegriffe der Thermodynamik Die Thermodynamik beschäftigt sich mit der Interpretation gegenseitiger Abhängigkeit von stofflichen und energetischen Phänomenen in der Natur. Die Thermodynamik kann voraussagen,
Grundbegriffe der Thermodynamik Die Thermodynamik beschäftigt sich mit der Interpretation gegenseitiger Abhängigkeit von stofflichen und energetischen Phänomenen in der Natur. Die Thermodynamik kann voraussagen,
Vom Schwefel zur Schwefelsäure
 Schulversuchspraktikum Patricia Hiller Sommersemester 2015 Klassenstufen 9 & 10 Vom Schwefel zur Schwefelsäure 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll wird
Schulversuchspraktikum Patricia Hiller Sommersemester 2015 Klassenstufen 9 & 10 Vom Schwefel zur Schwefelsäure 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll wird
Schulversuchspraktikum. Anne Steinkuhle. Sommersemester 2013. Klassenstufen 5 & 6. Kosmetikartikel
 Schulversuchspraktikum Anne Steinkuhle Sommersemester 2013 Klassenstufen 5 & 6 Kosmetikartikel 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In dem Protokoll zum Thema Kosmetikartikel
Schulversuchspraktikum Anne Steinkuhle Sommersemester 2013 Klassenstufen 5 & 6 Kosmetikartikel 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In dem Protokoll zum Thema Kosmetikartikel
Von Arrhenius zu Brønsted
 Schulversuchspraktikum Annika Münch Sommersemester 2015 Klassenstufe 9/10 Von Arrhenius zu Brønsted 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll zum Thema Von
Schulversuchspraktikum Annika Münch Sommersemester 2015 Klassenstufe 9/10 Von Arrhenius zu Brønsted 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll zum Thema Von
Untersuche die Wirkung von Seife auf Trinkwasser und destilliertes Wasser.
 Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P755200) 3.8 Wasserhärte Experiment von: Seb Gedruckt: 24.03.204 :37:47 intertess (Version 3.2 B24,
Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P755200) 3.8 Wasserhärte Experiment von: Seb Gedruckt: 24.03.204 :37:47 intertess (Version 3.2 B24,
+ MnO MnO 3. Oxidierbarkeit primärer, sekundärer und tertiärer Alkohole. Chemikalien. Materialien
 DaChS xidierbarkeit primärer, sekundärer und tertiärer Alkohole 1 Versuch Nr. 005 xidierbarkeit primärer, sekundärer und tertiärer Alkohole C 3 Mn - 4 (violett) 3 C Mn 2 (braun) 3 C C 3 Mn - 4 (violett)
DaChS xidierbarkeit primärer, sekundärer und tertiärer Alkohole 1 Versuch Nr. 005 xidierbarkeit primärer, sekundärer und tertiärer Alkohole C 3 Mn - 4 (violett) 3 C Mn 2 (braun) 3 C C 3 Mn - 4 (violett)
Schulversuchspraktikum. Miriam Jarrar. Sommersemester Klassenstufen 7 & 8. Korrosion
 Schulversuchspraktikum Miriam Jarrar Sommersemester 2012 Klassenstufen 7 & 8 Korrosion 1 Kontext und Ziele 1 Auf einen Blick: Dieses Protokoll beinhaltet 2 Lehrerversuche und 4 Schülerversuche für die
Schulversuchspraktikum Miriam Jarrar Sommersemester 2012 Klassenstufen 7 & 8 Korrosion 1 Kontext und Ziele 1 Auf einen Blick: Dieses Protokoll beinhaltet 2 Lehrerversuche und 4 Schülerversuche für die
Natriumchlorid - mehr als ein Gewürz
 Schulversuchspraktikum Name: Nicolai ter Horst Semester: SS 2013 Klassenstufen: 5 & 6 Natriumchlorid - mehr als ein Gewürz 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Diese Unterrichtseinheit
Schulversuchspraktikum Name: Nicolai ter Horst Semester: SS 2013 Klassenstufen: 5 & 6 Natriumchlorid - mehr als ein Gewürz 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Diese Unterrichtseinheit
Gruppe 01: Elementarnachweis: Kohlenstoff- und Wasserstoffnachweis
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 01: Elementarnachweis: Kohlenstoff- und Wasserstoffnachweis Reaktion:
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 01: Elementarnachweis: Kohlenstoff- und Wasserstoffnachweis Reaktion:
Metalle. Dieses Skript gehört
 Metalle Metalle prägen unseren Alltag. Doch wo kommen sie eigentlich her und wofür werden sie verwendet? Metalle werden aus Erzen gewonnen. Das sind Mineralien, die in der Erdkruste enthalten sind. Die
Metalle Metalle prägen unseren Alltag. Doch wo kommen sie eigentlich her und wofür werden sie verwendet? Metalle werden aus Erzen gewonnen. Das sind Mineralien, die in der Erdkruste enthalten sind. Die
Fit beim Aufstellen von Reaktionsgleichungen eine Trainingseinheit. Karin Keller, Bad Salzulen VORSCHAU VORANSICHT
 1 von 22 Fit beim Aufstellen von Reaktionsgleichungen eine Trainingseinheit Karin Keller, Bad Salzulen Reaktionsgleichungen sind ein für die Lehrkraft oft frustrierendes Thema. Häuig steigen die Lernenden
1 von 22 Fit beim Aufstellen von Reaktionsgleichungen eine Trainingseinheit Karin Keller, Bad Salzulen Reaktionsgleichungen sind ein für die Lehrkraft oft frustrierendes Thema. Häuig steigen die Lernenden
Versuchsprotokoll: Reaktion von Zucker mit Schwefelsäure
 Versuchsprotokoll: Reaktion von Zucker mit Schwefelsäure Zeitaufwand: Aufbau: Durchführung: Abbau/Entsorgung: 5 Minuten 10 Minuten 5 Minuten Chemikalien: Chemikalie Menge RSätze SSätze Gefahrensymbol Schwefelsäure
Versuchsprotokoll: Reaktion von Zucker mit Schwefelsäure Zeitaufwand: Aufbau: Durchführung: Abbau/Entsorgung: 5 Minuten 10 Minuten 5 Minuten Chemikalien: Chemikalie Menge RSätze SSätze Gefahrensymbol Schwefelsäure
Trennverfahren auf Basis der Dichte
 Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufen 7 & 8 Dichte und dessen Abhängigkeit von der Temperatur; Trennverfahren auf Basis der Dichte 2 Auf einen Blick: Diese Unterrichtseinheit
Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufen 7 & 8 Dichte und dessen Abhängigkeit von der Temperatur; Trennverfahren auf Basis der Dichte 2 Auf einen Blick: Diese Unterrichtseinheit
Die Kleinsten unter den Kleinen. - Einführung eines Teilchenmodells
 Carl-von-Ossietzky-Universität Oldenburg Fakultät V Institut für reine und angewandte Chemie Didaktik der Chemie Arbeitsmaterialien Chemie Die Kleinsten unter den Kleinen - Einführung eines Teilchenmodells
Carl-von-Ossietzky-Universität Oldenburg Fakultät V Institut für reine und angewandte Chemie Didaktik der Chemie Arbeitsmaterialien Chemie Die Kleinsten unter den Kleinen - Einführung eines Teilchenmodells
Experimente zu den Themen Energie und Klimawandel
 Experimente zu den Themen Energie und Klimawandel Station 6: Kohlenstoffdioxid Schulfach: Biologie/Naturwissenschaften Sekundarstufe 1 Dieses Material ist im Rahmen des Projekts Bildung für einen nachhaltige
Experimente zu den Themen Energie und Klimawandel Station 6: Kohlenstoffdioxid Schulfach: Biologie/Naturwissenschaften Sekundarstufe 1 Dieses Material ist im Rahmen des Projekts Bildung für einen nachhaltige
Oliver Gerdau FOS-T Lerngebiert: Energieressourcen schonen
 Oliver Gerdau FOS-T Lerngebiert: Energieressourcen schonen 15.05.2011 1 Energiespeicherung (Versuch) Latentwärmespeicher Phasenwechselmaterialien (PCM) Versuch Phasenumwandlung eines Wärmekissens Anwendungsgebiete
Oliver Gerdau FOS-T Lerngebiert: Energieressourcen schonen 15.05.2011 1 Energiespeicherung (Versuch) Latentwärmespeicher Phasenwechselmaterialien (PCM) Versuch Phasenumwandlung eines Wärmekissens Anwendungsgebiete
Die vorliegenden Arbeitsblätter enthalten vor allem experimentelle Zugänge zum Projektthema.
 Hinweise für die Lehrkräfte Der Inhalt der Arbeitsblätter orientiert sich vor allem am Lehrplan des G8 für die 8. und 9. Klasse Chemie im Rahmen der Unterrichtsgegenstände Teilchenmodell und Aggregatzustandsänderungen
Hinweise für die Lehrkräfte Der Inhalt der Arbeitsblätter orientiert sich vor allem am Lehrplan des G8 für die 8. und 9. Klasse Chemie im Rahmen der Unterrichtsgegenstände Teilchenmodell und Aggregatzustandsänderungen
Sonne Wetter Jahreszeiten
 Schulversuchspraktikum Maximilian Wolf Sommersemester 2015 Klassenstufen 5 & 6 Sonne Wetter Jahreszeiten 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Sonne, Wetter und Jahreszeit
Schulversuchspraktikum Maximilian Wolf Sommersemester 2015 Klassenstufen 5 & 6 Sonne Wetter Jahreszeiten 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Sonne, Wetter und Jahreszeit
Untersuche, ob Wasser gelöste Gase enthält und wovon die Löslichkeit der Gase abhängt.
 Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P754700) 3.3 Löslichkeit von Gasen in Wasser Experiment von: Seb Gedruckt: 24.03.204 :24:34 intertess
Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P754700) 3.3 Löslichkeit von Gasen in Wasser Experiment von: Seb Gedruckt: 24.03.204 :24:34 intertess
Versuchsprotokoll:Stärkespaltung
 Versuchsprotokoll:Stärkespaltung Zeitaufwand: Aufbau: 5 Minuten Durchführung: 20 Minuten Abbau/Entsorgung:: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz Pentahydrat
Versuchsprotokoll:Stärkespaltung Zeitaufwand: Aufbau: 5 Minuten Durchführung: 20 Minuten Abbau/Entsorgung:: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz Pentahydrat
E2-1-2 Beispiel Experiment Biologie 1/6 Entwicklung von kompetenzorientiertem Unterricht am Beispiel eines Experiments
 E2-1-2 Beispiel Experiment Biologie 1/6 Entwicklung von kompetenzorientiertem Unterricht am Beispiel eines Experiments Nachweis von Stärke in Blättern: (aus Westermann; BIO 2 Rheinlandpfalz, Saarland;
E2-1-2 Beispiel Experiment Biologie 1/6 Entwicklung von kompetenzorientiertem Unterricht am Beispiel eines Experiments Nachweis von Stärke in Blättern: (aus Westermann; BIO 2 Rheinlandpfalz, Saarland;
Umsetzung des Kernlehrplans Physik (G8) Stoffverteilungsplan für die Klassen 8 und 9 ( beschlossen am , Red. Sti) Klassenstufe 8.
 Das Thema Geschwindigkeit wird im Rahmen der Labortage (Anfang 8.2) bearbeitet. Umsetzung des Kernlehrplans Physik (G8) Stoffverteilungsplan für die Klassen 8 und 9 ( beschlossen am 6.10.2011, Red. Sti)
Das Thema Geschwindigkeit wird im Rahmen der Labortage (Anfang 8.2) bearbeitet. Umsetzung des Kernlehrplans Physik (G8) Stoffverteilungsplan für die Klassen 8 und 9 ( beschlossen am 6.10.2011, Red. Sti)
Schulversuchspraktikum. Anne Bergmann. Sommersemester Klassenstufen 9 & 10. Alkalimetalle
 Schulversuchspraktikum Anne Bergmann Sommersemester 2015 Klassenstufen 9 & 10 Alkalimetalle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll wird zunächst fachlich
Schulversuchspraktikum Anne Bergmann Sommersemester 2015 Klassenstufen 9 & 10 Alkalimetalle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll wird zunächst fachlich
Schulversuchspraktikum. Klassenstufen 5 & 6. Licht und Farbe
 Schulversuchspraktikum Klassenstufen 5 & 6 Licht und Farbe 1 Konzept und Ziele 1 Auf einen Blick: Diese Unterrichtseinheit für die Klassen 5 & 6 enthält 2 Schüler- und 2 Lehrerversuche zum Thema Licht
Schulversuchspraktikum Klassenstufen 5 & 6 Licht und Farbe 1 Konzept und Ziele 1 Auf einen Blick: Diese Unterrichtseinheit für die Klassen 5 & 6 enthält 2 Schüler- und 2 Lehrerversuche zum Thema Licht
Lösungen zu den Zusatzübungen zur Physik für Ingenieure (Maschinenbau) (WS 13/14)
 Lösungen zu den Zusatzübungen zur hysik für Ingenieure (Maschinenbau) (WS 13/14) rof. W. Meyer Übungsgruppenleiter: A. Berlin & J. Herick (NB 2/28) Zusatzübung (Lösung) alle Angaben ohne Gewähr Zusatzaufgabe
Lösungen zu den Zusatzübungen zur hysik für Ingenieure (Maschinenbau) (WS 13/14) rof. W. Meyer Übungsgruppenleiter: A. Berlin & J. Herick (NB 2/28) Zusatzübung (Lösung) alle Angaben ohne Gewähr Zusatzaufgabe
Nährstoffe und Nahrungsmittel
 Schulversuchspraktikum Mona-Christin Maaß Sommersemester 2013 Klassenstufen 5 & 6 Nährstoffe und Nahrungsmittel 1 Lernziele 1 Auf einen Blick: Ein Lehrerversuch und fünf Schülerversuche vermitteln SuS
Schulversuchspraktikum Mona-Christin Maaß Sommersemester 2013 Klassenstufen 5 & 6 Nährstoffe und Nahrungsmittel 1 Lernziele 1 Auf einen Blick: Ein Lehrerversuch und fünf Schülerversuche vermitteln SuS
- Chemie und Energie -
 Name: Datum: - Chemie und Energie - Eine Einführung zum 1. Hauptsatz der Thermodynamik 1: Heißer Kaffee aber wie?! Versuch 1: Kaffeetasse to go Becher Isolierbecher Sie haben heute Morgen verschlafen,
Name: Datum: - Chemie und Energie - Eine Einführung zum 1. Hauptsatz der Thermodynamik 1: Heißer Kaffee aber wie?! Versuch 1: Kaffeetasse to go Becher Isolierbecher Sie haben heute Morgen verschlafen,
Aufgaben verändern Beispiele zur Chemie
 A2-2-2 Aufgaben verändern Beispiele zur Chemie 1 Aufgaben verändern Beispiele zur Chemie Die folgenden beiden Varianten einer Aufgabe zeigen exemplarisch, wie unterschiedlich Frage- und Aufgabenstellungen,
A2-2-2 Aufgaben verändern Beispiele zur Chemie 1 Aufgaben verändern Beispiele zur Chemie Die folgenden beiden Varianten einer Aufgabe zeigen exemplarisch, wie unterschiedlich Frage- und Aufgabenstellungen,
2.2 Spezifische und latente Wärmen
 1 Einleitung Physikalisches Praktikum für Anfänger - Teil 1 Gruppe 2 Wärmelehre 2.2 Spezifische und latente Wärmen Die spezifische Wärme von Wasser gibt an, wieviel Energie man zu 1 kg Wasser zuführen
1 Einleitung Physikalisches Praktikum für Anfänger - Teil 1 Gruppe 2 Wärmelehre 2.2 Spezifische und latente Wärmen Die spezifische Wärme von Wasser gibt an, wieviel Energie man zu 1 kg Wasser zuführen
Titel: Physik in der Küche
 Titel: Physik in der Küche Themen: Temperaturmessungen, Effizienz Zeit: 90 Minuten Alter: 13-16 Differenzierung: Richtlinien, IKT Unterstützung etc.: Wenn möglich, verwende eine Wärmebildkamera die Bilder
Titel: Physik in der Küche Themen: Temperaturmessungen, Effizienz Zeit: 90 Minuten Alter: 13-16 Differenzierung: Richtlinien, IKT Unterstützung etc.: Wenn möglich, verwende eine Wärmebildkamera die Bilder
Vom Schwefel zur Schwefelsäure
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 9&10 Vom Schwefel zur Schwefelsäure 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll wurde die Herstellung
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 9&10 Vom Schwefel zur Schwefelsäure 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll wurde die Herstellung
Physik für Mediziner im 1. Fachsemester
 Physik für Mediziner im 1. Fachsemester #10 30/10/2008 Vladimir Dyakonov dyakonov@physik.uni-wuerzburg.de Thermisches Gleichgewicht Soll die Temperatur geändert werden, so muss dem System Wärme (kinetische
Physik für Mediziner im 1. Fachsemester #10 30/10/2008 Vladimir Dyakonov dyakonov@physik.uni-wuerzburg.de Thermisches Gleichgewicht Soll die Temperatur geändert werden, so muss dem System Wärme (kinetische
Titrationen mit Alltagschemikalien
 Schulversuchspraktikum - Sommersemester 2014 Klassenstufen 9 & 10 Titrationen mit Alltagschemikalien 1 Auf einen Blick: Dieses Protokoll beschreibt 4 Versuche zum Thema Titrationen mit Alltagschemikalien.
Schulversuchspraktikum - Sommersemester 2014 Klassenstufen 9 & 10 Titrationen mit Alltagschemikalien 1 Auf einen Blick: Dieses Protokoll beschreibt 4 Versuche zum Thema Titrationen mit Alltagschemikalien.
350³ Wärmedämmung an Gebäuden als Beitrag zum Klimaschutz Wärmeparcours Lehrerinformationen Teil 1 Vorbereitung der Experimente
 350³ - 1-350³ Wärmedämmung an Gebäuden als Beitrag zum Klimaschutz Wärmeparcours Lehrerinformationen Teil 1 Vorbereitung der Experimente An fünf Stationen führen die Schüler einfache Experimente aus uns
350³ - 1-350³ Wärmedämmung an Gebäuden als Beitrag zum Klimaschutz Wärmeparcours Lehrerinformationen Teil 1 Vorbereitung der Experimente An fünf Stationen führen die Schüler einfache Experimente aus uns
Schulversuchspraktikum. Dirk Schlemme. Sommersemester Klassenstufen 11 & 12. Alkanone
 Schulversuchspraktikum Dirk Schlemme Sommersemester 2012 Klassenstufen 11 & 12 Alkanone 1 Konzept und Ziele 1 Auf einen Blick: Die Alkanone spielen im alltäglichen Leben nur noch eine untergeordnete Rolle.
Schulversuchspraktikum Dirk Schlemme Sommersemester 2012 Klassenstufen 11 & 12 Alkanone 1 Konzept und Ziele 1 Auf einen Blick: Die Alkanone spielen im alltäglichen Leben nur noch eine untergeordnete Rolle.
Vom Erz zum Metall (oxidische Erze)
 Schulversuchspraktikum Name: Bastian Engelke Semester: Sommersemester 2012 Klassenstufen 7&8 Vom Erz zum Metall (oxidische Erze) 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Das
Schulversuchspraktikum Name: Bastian Engelke Semester: Sommersemester 2012 Klassenstufen 7&8 Vom Erz zum Metall (oxidische Erze) 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Das
Qualitative Nachweise von Säuren und Basen
 Schulversuchspraktikum Miriam Jarrar Sommersemester 2012 Klassenstufen 9 & 10 Qualitative Nachweise von Säuren und Basen Auf einen Blick: Dieses Protokoll beinhaltet 3 Lehrerversuche und 2 Schülerversuche
Schulversuchspraktikum Miriam Jarrar Sommersemester 2012 Klassenstufen 9 & 10 Qualitative Nachweise von Säuren und Basen Auf einen Blick: Dieses Protokoll beinhaltet 3 Lehrerversuche und 2 Schülerversuche
Kommentierte Aufgabenbeispiele Biologie Jahrgangsstufe 10
 Kommentierte Aufgabenbeispiele Biologie Jahrgangsstufe 10 Kompetenzen werden an Inhalten erworben. Für den Mittleren Schulabschluss werden die Inhalte im Fach Biologie in den folgenden drei Basiskonzepten
Kommentierte Aufgabenbeispiele Biologie Jahrgangsstufe 10 Kompetenzen werden an Inhalten erworben. Für den Mittleren Schulabschluss werden die Inhalte im Fach Biologie in den folgenden drei Basiskonzepten
Farbenspiel der Redoxreaktionen
 Schulversuchspraktikum Name: Christoph Biesemann Semester: Sommersemester 2012 Klassenstufe 7-8 Farbenspiel der Redoxreaktionen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In
Schulversuchspraktikum Name: Christoph Biesemann Semester: Sommersemester 2012 Klassenstufe 7-8 Farbenspiel der Redoxreaktionen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In
