Perampanel Nutzenbewertung gemäß 35a SGB V Dossierbewertung
|
|
|
- Bettina Lehmann
- vor 6 Jahren
- Abrufe
Transkript
1 IQWiG-Berichte Nr. 146 Perampanel Nutzenbewertung gemäß 35a SGB V Dossierbewertung Auftrag: A12-12 Version: 1.0 Stand:
2 Impressum Herausgeber: Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen Thema: Perampanel Nutzenbewertung gemäß 35a SGB V Auftraggeber: Gemeinsamer Bundesausschuss Datum des Auftrags: Interne Auftragsnummer: A12-12 Anschrift des Herausgebers: Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) Im Mediapark 8 (KölnTurm) Köln Tel.: +49 (0) Fax: +49 (0) berichte@iqwig.de Internet: ISSN: Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) - i -
3 Medizinisch-fachliche Beratung: Rüdiger Mielke, Lehrstuhl für Neurowissenschaften & Rehabilitation der Universität zu Köln Das IQWiG dankt dem medizinisch-fachlichen Berater für seinen Beitrag zur Dossierbewertung. Der Berater war jedoch nicht in die Erstellung der Dossierbewertung eingebunden. Daher geben einzelne Passagen und Schlussfolgerungen in der Dossierbewertung nicht notwendigerweise die Meinung des Beraters wieder. An der Dossierbewertung beteiligte Mitarbeiter des IQWiG 1 : Michael Köhler Ulrich Grouven Thomas Kaiser Stefan Lhachimi Frank Sandmann Volker Vervölgyi Siw Waffenschmidt Schlagwörter: Perampanel, Epilepsien Partielle, Nutzenbewertung Keywords: Perampanel, Epilepsies Partial, Benefit Assessment 1 Aufgrund gesetzlicher Datenschutzbestimmungen haben Mitarbeiter das Recht, ihrer Namensnennung nicht zuzustimmen. Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) - ii -
4 Inhaltsverzeichnis Seite Tabellenverzeichnis... vi Abbildungsverzeichnis... vii Abkürzungsverzeichnis... viii 1 Hintergrund Verlauf des Projekts Verfahren der frühen Nutzenbewertung Erläuterungen zum Aufbau des Dokuments Nutzenbewertung Kurzfassung der Nutzenbewertung Fragestellung Informationsbeschaffung und Studienpool Ergebnisse zum Zusatznutzen Ausmaß und Wahrscheinlichkeit des Zusatznutzens Liste der eingeschlossenen Studien Kommentare zum Dossier des pharmazeutischen Unternehmers Kommentar zur zweckmäßigen Vergleichstherapie (Modul 3, Abschnitt 3.1) Kommentar zur Darstellung von Nutzen und Zusatznutzen (Modul 4) Fragestellung / Einschlusskriterien Methodik zur Bewertung der Aussagekraft der Nachweise sowie zur Informationssynthese und -analyse Methodik und Ergebnisse der Informationsbeschaffung Informationsbeschaffung Studienpool Ergebnisse Kommentar zur abschließenden Bewertung der Unterlagen zum Nachweis des Zusatznutzens Beurteilung der Aussagekraft der Nachweise Beschreibung des Zusatznutzens einschließlich dessen Wahrscheinlichkeit und Ausmaß / Angabe der Patientengruppen, für die ein therapeutisch bedeutsamer Zusatznutzen besteht Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) - iii -
5 Kommentar zur Begründung für die Vorlage weiterer Unterlagen und Surrogatendpunkte Begründung für die Vorlage indirekter Vergleiche Begründung für die Vorlage nicht randomisierter vergleichender Studien und weiterer Untersuchungen Begründung für die Bewertung auf Grundlage der verfügbaren Evidenz, da valide Daten zu patientenrelevanten Endpunkten noch nicht vorliegen Verwendung von Surrogatendpunkten Kosten der Therapie Kommentar zur Anzahl der Patienten mit therapeutisch bedeutsamem Zusatznutzen (Modul 3, Abschnitt 3.2) Beschreibung der Erkrankung und Charakterisierung der Zielpopulation Therapeutischer Bedarf Prävalenz und Inzidenz Anzahl der Patienten mit therapeutisch bedeutsamem Zusatznutzen Kommentar zu den Kosten der Therapie für die gesetzliche Krankenversicherung (Modul 3, Abschnitt 3.3) Behandlungsdauer Verbrauch Kosten Kosten für zusätzlich notwendige Leistungen Jahrestherapiekosten Versorgungsanteile Konsequenzen für die Bewertung Kommentare zu sonstigen Angaben im Dossier des pharmazeutischen Unternehmers Kommentar zur Zusammenfassung der Aussagen im Dossier (Modul 1) Kommentar zu allgemeinen Angaben zum Arzneimittel und zu den zugelassenen Anwendungsgebieten (Modul 2) Kommentar zur qualitätsgesicherten Anwendung (Modul 3, Abschnitt 3.4) Zusammenfassung der Dossierbewertung Zugelassene Anwendungsgebiete Medizinischer Nutzen und medizinischer Zusatznutzen im Verhältnis zur zweckmäßigen Vergleichstherapie Anzahl der Patienten in den für die Behandlung infrage kommenden Patientengruppen Kosten der Therapie für die gesetzliche Krankenversicherung Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) - iv -
6 5.5 Anforderungen an eine qualitätsgesicherte Anwendung Literatur Anhang A Darlegung potenzieller Interessenkonflikte (externe Sachverständige sowie Patientinnen und Patienten bzw. Patientenorganisationen) Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) - v -
7 Tabellenverzeichnis Seite Tabelle 1: Erläuterungen zum Aufbau des Dokuments... 2 Tabelle 2: Anzahl der GKV-Patienten in der Zielpopulation Tabelle 3: Jahrestherapiekosten für die GKV für das zu bewertende Arzneimittel und die zweckmäßige Vergleichstherapie pro Patient Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) - vi -
8 Abbildungsverzeichnis Seite Abbildung 1: Mögliche Vergleiche zu Perampanel anhand der vom G-BA festgelegten zweckmäßigen Vergleichstherapie Abbildung 2: Vorgehen des pu für direkten Vergleich Perampanel vs. Lamotrigin Abbildung 3: Vorgehen des pu für den indirekten Vergleich Perampanel vs. Lamotrigin Abbildung 4: Möglicher indirekter Vergleich von Perampanel und Lamotrigin, jeweils als Zusatztherapie Abbildung 5: Möglicher indirekter Vergleich von Perampanel und Topiramat, jeweils als Zusatztherapie Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) - vii -
9 Abkürzungsverzeichnis Abkürzung AM-NutzenV AOK DDD G-BA GKV IQWiG KI pu RCT SGB WIdO Bedeutung Arzneimittel-Nutzenbewertungsverordnung Allgemeine Ortskrankenkassen Defined Daily Dose Gemeinsamer Bundesausschuss Gesetzliche Krankenversicherung Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen Konfidenzintervall Pharmazeutischer Unternehmer Randomisierte kontrollierte Studie (Randomised Controlled Trial) Sozialgesetzbuch Wissenschaftliches Institut der AOK Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) - viii -
10 1 Hintergrund 1.1 Verlauf des Projekts Der Gemeinsame Bundesausschuss (G-BA) hat das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) mit der Nutzenbewertung des Wirkstoffs Perampanel gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis eines Dossiers des pharmazeutischen Unternehmers (pu). Das Dossier wurde dem IQWiG am übermittelt. Die Verantwortung für die vorliegende Bewertung und für das Bewertungsergebnis liegt ausschließlich beim IQWiG. Die Bewertung wird zur Veröffentlichung an den G-BA übermittelt, der die Nutzenbewertung zur Anhörung stellt. Die Beschlussfassung über den Zusatznutzen erfolgt durch den G-BA im Anschluss an die Anhörung. Die vorliegende Bewertung wurde unter Einbindung externer Sachverständiger (einer Beraterin / eines Beraters zu medizinisch-fachlichen Fragen) erstellt. Diese Beratung beinhaltete die schriftliche Beantwortung von Fragen zu den Themenbereichen Krankheitsbild / Krankheitsfolgen, Therapieziele, Patienten im deutschen Versorgungsalltag, Therapieoptionen, therapeutischer Bedarf und Stand der medizinischen Praxis. Darüber hinaus konnte eine Einbindung im Projektverlauf zu weiteren spezifischen Fragen erfolgen. Für die Bewertung war zudem die Einbindung von Patientinnen und Patienten bzw. Patientenorganisationen vorgesehen. Diese Einbindung sollte die schriftliche Beantwortung von Fragen zu den Themenbereichen Erfahrungen mit der Erkrankung, Notwendigkeit der Betrachtung spezieller Patientengruppen, Erfahrungen mit den derzeit verfügbaren Therapien für das Anwendungsgebiet, Erwartungen an eine neue Therapie und ggf. zusätzliche Informationen umfassen. Im Rahmen der vorliegenden Dossierbewertung gingen keine Rückmeldungen von Patientinnen und Patienten bzw. Patientenorganisationen ein. Die Beteiligten außerhalb des IQWiG, die in das Projekt eingebunden wurden, erhielten keine Einsicht in das Dossier des pu. 1.2 Verfahren der frühen Nutzenbewertung Die vorliegende Dossierbewertung ist Teil des Gesamtverfahrens zur frühen Nutzenbewertung. Sie wird gemeinsam mit dem Dossier des pu (Module 1 bis 4) auf der Website des G-BA veröffentlicht. Im Anschluss daran führt der G-BA ein Stellungnahmeverfahren zu dieser Bewertung durch. Der G-BA trifft seinen Beschluss zur frühen Nutzenbewertung nach Abschluss des Stellungnahmeverfahrens. Durch den Beschluss des G-BA werden ggf. die in der Dossierbewertung dargestellten Informationen ergänzt. Weitere Informationen zum Stellungnahmeverfahren und zur Beschlussfassung des G-BA sowie das Dossier des pharmazeutischen Unternehmers finden sich auf der Website des G-BA ( Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) - 1 -
11 1.3 Erläuterungen zum Aufbau des Dokuments Die vorliegende Dossierbewertung gliedert sich in 6 Kapitel plus Anhänge. In Kapitel 2 bis 5 sind die wesentlichen Inhalte der Dossierbewertung dargestellt. Die nachfolgende Tabelle 1 zeigt den Aufbau des Dokuments im Detail. Tabelle 1: Erläuterungen zum Aufbau des Dokuments Kapitel 2 Nutzenbewertung Abschnitt 2.1 Zusammenfassung der Ergebnisse der Nutzenbewertung Abschnitte 2.2 bis 2.6 Darstellung des Ergebnisses der Nutzenbewertung im Detail Angabe, ob und inwieweit die vorliegende Bewertung von der Einschätzung des pu im Dossier abweicht Abschnitt 2.7 Kommentare zu folgenden Modulen des Dossiers des pu: Modul 3, Abschnitt 3.1 (Bestimmung der zweckmäßigen Vergleichstherapie) Modul 4 (Medizinischer Nutzen und medizinischer Zusatznutzen, Patientengruppen mit therapeutisch bedeutsamem Zusatznutzen) Kapitel 3 Kosten der Therapie Abschnitte 3.1 und 3.2 Kommentare zu folgenden Modulen des Dossiers des pu: Modul 3, Abschnitt 3.2 (Anzahl der Patienten mit therapeutisch bedeutsamem Zusatznutzen) Modul 3, Abschnitt 3.3 (Kosten der Therapie für die gesetzliche Krankenversicherung) Abschnitt 3.3 Zusammenfassung der daraus entstehenden Konsequenzen für die Bewertung Kapitel 4 Kommentare zu sonstigen Angaben im Dossier Abschnitte 4.1 bis 4.3 Kommentare zu folgenden Modulen des Dossiers des pu: Modul 1 (Zusammenfassung der Aussagen im Dossier) Modul 2 (Allgemeine Angaben zum Arzneimittel, zugelassene Anwendungsgebiete) Modul 3, Abschnitt 3.4 (Anforderungen an eine qualitätsgesicherte Anwendung) Kapitel 5 Zusammenfassung der Dossierbewertung Abschnitte 5.1 bis 5.5 Zusammenfassung der wesentlichen Aussagen als Bewertung der Angaben im Dossier des pu nach 4 Absatz 1 AM-NutzenV [1] AM-NutzenV: Arzneimittel-Nutzenbewertungsverordnung, pu: pharmazeutischer Unternehmer Die Kommentierung der Angaben im Dossier des pu erfolgte unter Berücksichtigung der Anforderungen, die in den vom G-BA bereitgestellten Dossiervorlagen beschrieben sind (siehe Verfahrensordnung des G-BA [2]). Bei Abschnittsverweisen, die sich auf Abschnitte im Dossier des pu beziehen, ist zusätzlich das betroffene Modul des Dossiers angegeben. Abschnittsverweise ohne Angabe eines Moduls beziehen sich auf den vorliegenden Bericht zur Nutzenbewertung. Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) - 2 -
12 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Perampanel gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis eines Dossiers des pharmazeutischen Unternehmers (pu). Das Dossier wurde dem IQWiG am übermittelt. Fragestellung Die Bewertung des Zusatznutzens von Perampanel gemäß Zulassung wurde für folgende Indikation durchgeführt: Zusatztherapie fokaler Anfälle mit oder ohne sekundäre Generalisierung bei Epilepsiepatienten ab 12 Jahren. Der G-BA hat folgende zweckmäßige Vergleichstherapie festgelegt: Lamotrigin In den Fällen, in denen Lamotrigin als Monotherapie angewandt wird, stellt Topiramat als Zusatztherapie die zweckmäßige Vergleichstherapie dar. Der pu schließt sich der zweckmäßigen Vergleichstherapie des G-BA an, jedoch mit der Einschränkung, dass Topiramat als zweckmäßige Vergleichstherapie für die Ableitung des Zusatznutzens von Perampanel nicht betrachtet wird. Dieses Vorgehen begründet der pu mit der Feststellung des G-BA aus dem Beratungsgespräch, ein Vergleich gegen Lamotrigin als Monotherapie sei aufgrund des geplanten Anwendungsgebietes für Perampanel als Zusatztherapie nicht zielführend. Da Topiramat nur in dem spezifischen Fall zweckmäßige Vergleichstherapie sein soll, in dem Lamotrigin als Monotherapie angewendet wird, sei ein Vergleich mit Topiramat ebenfalls nicht zielführend. Diesem Vorgehen wird nicht gefolgt. Die Zweckmäßigkeit von Topiramat als Vergleichstherapie ist gegeben, wenn es als Zusatztherapie zu einer lamotriginhaltigen Basistherapie verabreicht wird, sofern auch Perampanel als Zusatztherapie zu einer lamotriginhaltigen Basistherapie gegeben wird. Die Bewertung erfolgte somit ohne Einschränkung gegenüber der zweckmäßigen Vergleichstherapie gemäß Festlegung des G-BA. Die Bewertung wurde bezüglich patientenrelevanter Endpunkte vorgenommen. Ergebnisse Der pu schließt keine direkt vergleichenden Studien mit Perampanel versus Lamotrigin ein. Alle zu Perampanel identifizierten randomisierten kontrollierten Studien (RCT) sind placebokontrolliert und allein nicht ausreichend für den Nachweis eines Zusatznutzens im Vergleich zur zweckmäßigen Vergleichstherapie. Der pu führt dennoch auf Basis dieser Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) - 3 -
13 Studien einen direkten Vergleich mit einer Teilpopulation von Patienten durch, die als Teil ihrer Basistherapie Lamotrigin erhalten haben. Dabei werden Patienten, die Perampanel zusätzlich zu einer Lamotrigin enthaltenden Basistherapie einnahmen, mit Patienten verglichen, die Placebo zusätzlich zu einer Lamotrigin enthaltenden Basistherapie erhalten haben. Die präsentierten Daten stellen einen Vergleich mit Placebo dar und sind nicht geeignet, die Fragestellung der Nutzenbewertung zu beantworten. Der pu führt weiterhin einen adjustierten indirekten Vergleich zwischen Perampanel und der zweckmäßigen Vergleichstherapie Lamotrigin als Zusatztherapie durch. Als Brückenkomparator wählt der pu Placebo. Für Perampanel schließt er wiederum jene Teilpopulation von Patienten aus den 3 placebokontrollierten Zulassungsstudien ein, die Perampanel oder Placebo zusätzlich zu einer Lamotrigin enthaltenden Basistherapie erhielten. Für Lamotrigin schließt der pu 2 placebokontrollierte randomisierte Studien ein, in denen Lamotrigin oder Placebo zusätzlich zu einer Basistherapie gegeben wurde. Auch der indirekte Vergleich ist nicht zur Beantwortung der Fragestellung geeignet. Zum einen handelt es sich nicht um einen laut Festlegung der zweckmäßigen Vergleichstherapie geforderten Vergleich von Perampanel und Lamotrigin, jeweils als Zusatztherapie zu einer Basistherapie. Vielmehr wird hier die Kombination aus Perampanel und Lamotrigin mit Lamotrigin, jeweils als Zusatztherapie zu einer Basistherapie aus antiepileptischen Medikamenten verglichen. Weiter ist zu beachten, dass in den Studien zu Perampanel die Patienten in der Placebogruppe als Teil ihrer Basistherapie Lamotrigin erhielten, was in den Placebogruppen der Studien zu Lamotrigin nicht der Fall war. Somit ist auch die Ähnlichkeit des Brückenkomparators infrage zu stellen. Die vom pu vorgelegten Daten sind für die Bewertung des Zusatznutzens von Perampanel gegenüber der zweckmäßigen Vergleichstherapie Lamotrigin als Zusatztherapie nicht relevant. Einen Vergleich von Perampanel und Topiramat führt der pu nicht durch. Er führt zwar eine entsprechende Suche nach Studien zu Topiramat durch und präsentiert Ergebnisse zu 2 placebokontrollierten Studien zu Topiramat, schließt diese jedoch nicht in einen indirekten Vergleich mit Perampanel ein. Für die Fragestellung der Nutzenbewertung liegen im Dossier zusammenfassend keine relevanten Daten vor, weder für einen direkten Vergleich noch für einen indirekten Vergleich mit Lamotrigin oder Topiramat. Damit ergibt sich kein Beleg für einen Zusatznutzen von Perampanel gegenüber der vom G-BA festgelegten zweckmäßigen Vergleichstherapie. Wahrscheinlichkeit und Ausmaß des Zusatznutzens, Patientengruppen mit therapeutisch bedeutsamem Zusatznutzen Auf Basis der dargestellten Ergebnisse werden das Ausmaß und die Wahrscheinlichkeit des Zusatznutzens des Wirkstoffs Perampanel wie folgt bewertet: Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) - 4 -
14 Aus den vorliegenden Daten ergibt sich kein Beleg für einen Zusatznutzen von Perampanel im Vergleich zu der vom G-BA festgelegten zweckmäßigen Vergleichstherapie. Demzufolge gibt es keine Patientengruppen, für die sich ein therapeutisch bedeutsamer Zusatznutzen ableiten lässt. Über den Zusatznutzen beschließt der G-BA. Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) - 5 -
15 2.2 Fragestellung Die Bewertung des Zusatznutzens von Perampanel gemäß Zulassung [3] wurde für folgende Indikation durchgeführt: Zusatztherapie fokaler Anfälle mit oder ohne sekundäre Generalisierung bei Epilepsiepatienten ab 12 Jahren. Der G-BA hat folgende zweckmäßige Vergleichstherapie festgelegt: Lamotrigin In den Fällen, in denen Lamotrigin als Monotherapie angewandt wird, stellt Topiramat als Zusatztherapie die zweckmäßige Vergleichstherapie dar. Der pu schließt sich der zweckmäßigen Vergleichstherapie des G-BA an, jedoch mit der Einschränkung, dass Topiramat als zweckmäßige Vergleichstherapie für die Ableitung des Zusatznutzens von Perampanel nicht betrachtet wird. Dieses Vorgehen begründet der pu mit der Feststellung des G-BA aus dem Beratungsgespräch, ein Vergleich gegen Lamotrigin als Monotherapie sei aufgrund des geplanten Anwendungsgebietes für Perampanel als Zusatztherapie nicht zielführend (siehe Dossier Modul 3, Abschnitt 3.1). Da Topiramat nur in dem spezifischen Fall zweckmäßige Vergleichstherapie sein soll, in dem Lamotrigin als Monotherapie angewendet wird, sei ein Vergleich mit Topiramat ebenfalls nicht zielführend. Diesem Vorgehen wird nicht gefolgt. Die Zweckmäßigkeit von Topiramat als Vergleichstherapie ist gegeben, wenn es als Zusatztherapie zu einer lamotriginhaltigen Basistherapie verabreicht wird, sofern auch Perampanel als Zusatztherapie zu einer lamotriginhaltigen Basistherapie gegeben wird (siehe dazu Abschnitt der vorliegenden Bewertung). Die Bewertung erfolgte somit ohne Einschränkung gegenüber der zweckmäßigen Vergleichstherapie gemäß Festlegung des G-BA. Die Bewertung erfolgte bezüglich patientenrelevanter Endpunkte. Weitere Informationen zur Fragestellung befinden sich in Modul 3, Abschnitt 3.1 sowie Modul 4, Abschnitt des Dossiers und in Abschnitt sowie der vorliegenden Dossierbewertung. 2.3 Informationsbeschaffung und Studienpool Der Studienpool der Bewertung wurde anhand der folgenden Angaben zusammengestellt: Bis zum abgeschlossene Studien des pu zu Perampanel (Studienliste des pu), Ergebnisse einer bibliografischen Literaturrecherche und einer Recherche in Studienregistern zu Perampanel (letzte Suche in bibliografischen Datenbanken bzw in Studienregistern, Recherchen des pu), Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) - 6 -
16 Ergebnisse einer bibliografischen Literaturrecherche und einer Recherche in Studienregistern zur zweckmäßigen Vergleichstherapie Lamotrigin (letzte Suche in bibliografischen Datenbanken bzw in Studienregistern, Recherchen des pu). Aus den genannten Schritten zur Informationsbeschaffung wurde für die vorliegende Fragestellung keine relevante direkt vergleichende Studie identifiziert. Auch die vom pu vorgelegten Daten für einen indirekten Vergleich von Perampanel mit Lamotrigin sind nicht geeignet, die vorliegende Fragestellung zu beantworten. Dies ist wie folgt begründet: Der pu legt keine direkt vergleichenden Studien von Perampanel und der zweckmäßigen Vergleichstherapie vor. Der pu schließt dennoch Daten aus 3 placebokontrollierten randomisierten kontrollierten Studien (RCT) ein, in denen Perampanel als Zusatztherapie bei Epilepsiepatienten ab 12 Jahren mit fokalen Anfällen untersucht wurde. Aufgrund der Placebokontrolle sind die Studien allein nicht ausreichend für den Nachweis eines Zusatznutzens im Vergleich zur zweckmäßigen Vergleichstherapie [4-7]. Um auf Basis dieser Studien Aussagen zum Zusatznutzen von Perampanel im Vergleich zu Lamotrigin treffen zu können, zieht der pu Ergebnisse von Teilpopulationen dieser Studien heran. Diese setzen sich zusammen aus denjenigen Patienten, die in der Basistherapie bereits Lamotrigin plus mindestens ein weiteres Antiepileptikum erhielten. Dabei werden Patienten, die Perampanel zusätzlich zu einer Lamotrigin enthaltenden Basistherapie erhielten, mit Patienten verglichen, die Placebo zusätzlich zu einer Lamotrigin enthaltenden Basistherapie erhielten. Dieser Vergleich ist für die Bewertung eines Zusatznutzens gegenüber der zweckmäßigen Vergleichstherapie Lamotrigin ungeeignet, da er einem Vergleich von Perampanel versus Placebo entspricht (siehe Abschnitt ). Im Übrigen stellt in dieser Situation (Lamotrigin ist Teil der Basistherapie) Topiramat die zweckmäßige Vergleichstherapie dar. Der pu führt weiterhin einen adjustierten indirekten Vergleich zwischen Perampanel und der zweckmäßigen Vergleichstherapie Lamotrigin als Zusatztherapie durch. Als Brückenkomparator wählt der pu Placebo (zusätzlich zu einer Basistherapie aus einem oder mehreren Antiepileptika). Für Perampanel schließt der pu wie schon für den direkten Vergleich jene Teilpopulation von Patienten aus den 3 placebokontrollierten Zulassungsstudien ein, die Perampanel oder Placebo zusätzlich zu einer Lamotrigin enthaltenden Basistherapie erhielten. Aufseiten von Lamotrigin schließt der pu 2 placebokontrollierte Studien ein. In diesen Studien werden Lamotrigin und Placebo, jeweils zusätzlich zu einer Basistherapie, bei Epilepsiepatienten mit fokalen Anfällen verglichen [8,9]. Auch dieser indirekte Vergleich ist nicht geeignet, die Fragestellung der Nutzenbewertung zu beantworten (siehe auch Abschnitt ). Zum einen gelten die gleichen Argumente wie für den oben beschriebenen direkten Vergleich. Der indirekte Vergleich untersucht nicht, wie gemäß Festlegung der zweckmäßigen Vergleichstherapie gefordert, den Vergleich von Perampanel und Lamotrigin, jeweils als Zusatztherapie zu einer Basistherapie. Vielmehr wird hier die Kombination aus Perampanel und Lamotrigin mit Lamotrigin, jeweils als Zusatztherapie zu einer Basistherapie aus mindestens einem anderen Antiepileptikum, verglichen. Weiterhin gilt, dass für die Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) - 7 -
17 eingeschlossenen Patienten auf der Perampanelseite Topiramat die zweckmäßige Vergleichstherapie darstellt und nicht Lamotrigin. Darüber hinaus ist zu beachten, dass in den Studien zu Perampanel die Patienten in der Placebogruppe als Teil der Basistherapie Lamotrigin erhielten (siehe auch Modul 4, Abschnitt des Dossiers), während das in den Placebogruppen der Studien zu Lamotrigin nicht der Fall war. Die Ähnlichkeit des gemeinsamen Komparators ( Placebo ) ist deshalb infrage zu stellen. Indirekte Vergleiche von Perampanel mit Topiramat wurden vom pu im Rahmen des Dossiers nicht durchgeführt. Obwohl der pu Topiramat als zweckmäßige Vergleichstherapie gemäß Festlegung des G-BA ablehnt (siehe Abschnitt 2.2), werden in Anhang 4-H, Abschnitt des Dossiers jedoch Ergebnisse von zwei Studien zu Topiramat [10,11] präsentiert. Da diese Studien vom pu nicht für einen indirekten Vergleich genutzt werden und aus den von ihm vorgelegten Angaben nicht deutlich wird, ob oder wie viele der dort eingeschlossenen Patienten mit Lamotrigin in der Basistherapie behandelt wurden, können sie für die Nutzenbewertung nicht berücksichtigt werden. Insgesamt legt der pu keine Studiendaten vor, die für die Fragestellung der Nutzenbewertung relevant sind. Auf eine Überprüfung der Vollständigkeit des vom pu vorgelegten Studienpools wurde daher verzichtet. Weitere Informationen zu den Einschlusskriterien für Studien in die vorliegende Nutzenbewertung und zur Methodik der Informationsbeschaffung befinden sich in Modul 4, Abschnitte sowie des Dossiers und in den Abschnitten sowie der vorliegenden Dossierbewertung. 2.4 Ergebnisse zum Zusatznutzen Für die Fragestellung der Nutzenbewertung lagen keine relevanten Daten vor, weder für einen direkten Vergleich noch für einen indirekten Vergleich. Damit ergibt sich kein Beleg für einen Zusatznutzen von Perampanel gegenüber der vom G-BA festgelegten zweckmäßigen Vergleichstherapie. Dies weicht vom Ergebnis des pu ab, der aus den von ihm vorgelegten Vergleichsdaten einen Zusatznutzen von Perampanel als Zusatztherapie ableitet. Weitere Informationen zu den Ergebnissen zum Zusatznutzen befinden sich in Modul 4, Abschnitt des Dossiers. 2.5 Ausmaß und Wahrscheinlichkeit des Zusatznutzens Aus den vorliegenden Daten ergibt sich kein Beleg für einen Zusatznutzen von Perampanel gegenüber der vom G-BA festgelegten zweckmäßigen Vergleichstherapie. Folglich gibt es auch keine Patientengruppen, für die sich ein therapeutisch bedeutsamer Zusatznutzen ableiten lässt. Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) - 8 -
18 Dies weicht von der Einschätzung des pu ab, der gegenüber der zweckmäßigen Vergleichstherapie einen erheblichen Zusatznutzen von Perampanel als Zusatztherapie bei Anfällen fokalen Ursprungs mit und ohne sekundäre Generalisierung ableitet. Über den Zusatznutzen beschließt der G-BA. Weitere Informationen zum Ausmaß und zur Wahrscheinlichkeit des Zusatznutzens befinden sich in Modul 4, Abschnitt 4.4 des Dossiers und in Abschnitt der vorliegenden Dossierbewertung. 2.6 Liste der eingeschlossenen Studien Entfällt, da der pu in seinem Dossier keine Studiendaten vorgelegt hat, aus denen sich ein Zusatznutzen von Perampanel gegenüber der vom G-BA festgelegten zweckmäßigen Vergleichstherapie ermitteln lässt. Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) - 9 -
19 2.7 Kommentare zum Dossier des pharmazeutischen Unternehmers Kommentar zur zweckmäßigen Vergleichstherapie (Modul 3, Abschnitt 3.1) Die Angaben des pu zur zweckmäßigen Vergleichstherapie befinden sich in Modul 3 (Abschnitt 3.1) des Dossiers. Der pu benennt folgende zweckmäßige Vergleichstherapie: Als zweckmäßige Vergleichstherapie für den Wirkstoff Perampanel in dem angegebenen Anwendungsgebiet als Zusatztherapie fokaler Anfälle mit oder ohne sekundäre Generalisierung bei Epilepsiepatienten ab 12 Jahren wurde vom G-BA Lamotrigin bestimmt. In den Fällen, in denen Lamotrigin als Monotherapie angewandt wird, stellt Topiramat als Zusatztherapie die zweckmäßige Vergleichstherapie dar (siehe Modul 3, Abschnitt 3.1 des Dossiers). Demzufolge lassen sich zwei Situationen unterscheiden, in denen Perampanel als Zusatztherapie mit der jeweiligen zweckmäßigen Vergleichstherapie verglichen werden kann. In Abbildung 1 sind die sich aus der Festlegung der zweckmäßigen Vergleichstherapie ergebenden möglichen Vergleiche schematisch dargestellt. In der ersten Situation (a), in der Patienten eine antiepileptische Basistherapie ohne Verwendung von Lamotrigin erhalten, soll Perampanel als Zusatztherapie mit Lamotrigin als Zusatztherapie zu der bestehenden Basistherapie verglichen werden. Sollte jedoch Lamotrigin bereits Bestandteil der Basistherapie sein, so ist der Vergleich Perampanel als Zusatztherapie mit Topiramat als Zusatztherapie zu einer lamotriginhaltigen Basistherapie durchzuführen (Situation b). Weiße Kästen symbolisieren randomisiert zugewiesene Therapien, graue Kästen die zugrundeliegende Basistherapie; Doppelpfeile symbolisieren den Vergleich Abbildung 1: Mögliche Vergleiche zu Perampanel anhand der vom G-BA festgelegten zweckmäßigen Vergleichstherapie Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG)
20 Der pu schließt sich zunächst der zweckmäßigen Vergleichstherapie des G-BA an, macht in den Erläuterungen allerdings die Einschränkung, dass Topiramat als zweckmäßige Vergleichstherapie für die Ableitung des Zusatznutzens von Perampanel nicht betrachtet wird. Dieses Vorgehen begründet der pu mit der Feststellung des G-BA aus dem Beratungsgespräch, ein Vergleich gegen Lamotrigin als Monotherapie sei aufgrund des geplanten Anwendungsgebietes für Perampanel als Zusatztherapie nicht zielführend (siehe Dossier Modul 3, Abschnitt 3.1). Da Topiramat nur in dem spezifischen Fall zweckmäßige Vergleichstherapie sein soll, in dem Lamotrigin als Monotherapie angewendet wird, sei ein Vergleich mit Topiramat ebenfalls nicht zielführend. Somit schränkt der pu die zweckmäßige Vergleichstherapie auf Lamotrigin als Zusatztherapie ein. Dennoch führt der pu eine Recherche nach placebokontrollierten Studien zu Topiramat durch und stellt die aus seiner Sicht relevanten Studien einschließlich ihrer Charakteristika und Ergebnisse in Modul 4, Anhang 4-H des Dossiers dar, ohne jedoch eine konkrete Nutzenbewertung mittels eines indirekten Vergleiches durchzuführen. Dieser Einschränkung der zweckmäßigen Vergleichstherapie wird nicht gefolgt. Zwar ist die Aussage des G-BA, Lamotrigin als Monotherapie sei als alleiniger Komparator nicht zielführend, aufgrund der Zulassung von Perampanel als Zusatztherapie gut begründet [3]. Daraus folgt jedoch nicht, dass ein Vergleich mit Topiramat ebenfalls nicht zielführend ist. Denn Topiramat ist in dem Fall, in dem Lamotrigin Bestandteil der Basistherapie ist, die zweckmäßige Vergleichstherapie. Ein Vergleich ist wie in Abbildung 1 (Situation b) dargestellt möglich. Es ergeben sich folgende Konsequenzen für die Nutzenbewertung: Für die vorliegende Nutzenbewertung von Perampanel wird die vom G-BA festgelegte zweckmäßige Vergleichstherapie herangezogen (vgl. Abschnitt 2.2) Kommentar zur Darstellung von Nutzen und Zusatznutzen (Modul 4) Fragestellung / Einschlusskriterien Die Angaben des pu zur Fragestellung und zu Einschlusskriterien für die Studienauswahl befinden sich in Modul 4 (Abschnitte 4.2.1, 4.2.2) des Dossiers. Die Fragestellung des pu entspricht im Hinblick auf die Patientenpopulation und die Intervention der Zulassung von Perampanel. Untersucht wurden ausschließlich RCTs, sowohl für einen direkten als auch für einen indirekten Vergleich. Hinsichtlich der zweckmäßigen Vergleichstherapie weicht der pu von der Festlegung des G-BA ab. Der pu berücksichtigt ausschließlich Lamotrigin als zweckmäßige Vergleichstherapie. Einen Vergleich von Perampanel mit Topiramat in Fällen, in denen Lamotrigin bei Behandlung mit Perampanel bereits Bestandteil der Basistherapie ist, hält der pu für nicht Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG)
21 zielführend und führt ihn deshalb nicht durch. Dem wird in der vorliegenden Bewertung nicht gefolgt (siehe Abschnitt 2.7.1). Weiterhin beschreibt der pu an dieser Stelle kurz, auf welche Weise er den Zusatznutzen von Perampanel gegenüber Lamotrigin nachweisen will. Der pu wählt dazu einen zweigleisigen Ansatz, einerseits einen direkten Vergleich auf Basis einer Teilpopulation seiner placebokontrollierten Zulassungsstudien und andererseits einen indirekten Vergleich mit Placebo als Brückenkomparator. Der pu erläutert sein Vorgehen detailliert in Modul 4, Abschnitte und Dies wird im Folgenden ausführlich kommentiert. Direkter Vergleich von Perampanel und Lamotrigin auf Basis der Zulassungsstudien Für den direkten Vergleich zieht der pu seine 3 pivotalen Zulassungsstudien E2007-G , E2007-G und E2007-G [4-7] heran. In diesen RCTs wurde jeweils Perampanel als Zusatztherapie zu einer bestehenden Basistherapie aus 1 bis 3 Antiepileptika mit Placebo plus entsprechender Basistherapie bei Epilepsiepatienten ab 12 Jahren mit fokalen Anfällen verglichen. Bei ca. 30 % der Patienten in diesen Studien war Lamotrigin Bestandteil der Basistherapie. Die Studien als Ganzes führt der pu zum Nachweis des Nutzens an. Für den Nachweis des Zusatznutzens zieht der pu jeweils Teilpopulationen der Studien heran. Diese setzen sich zusammen aus denjenigen Patienten, die in der Basistherapie bereits Lamotrigin plus mindestens ein weiteres Antiepileptikum erhielten (siehe Modul 4, Abschnitt des Dossiers). Folglich werden Patienten, die Perampanel zusätzlich zu einer lamotriginhaltigen Basistherapie erhalten, mit Patienten verglichen, die Placebo zusätzlich zu einer lamotriginhaltigen Basistherapie erhalten. Die folgende Abbildung 2 soll das Vorgehen des pu veranschaulichen: Abbildung 2: Vorgehen des pu für direkten Vergleich Perampanel vs. Lamotrigin Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG)
22 Da die Basistherapie (also auch die Therapie mit Lamotrigin) in beiden Behandlungsgruppen der untersuchten Teilpopulation identisch ist, unterscheiden sich die beiden Behandlungsgruppen also lediglich in der Behandlung mit Perampanel bzw. Placebo. In dem vom pu durchgeführten Vergleich der Teilpopulation handelt es sich somit immer noch um einen placebokontrollierten Vergleich. Ein beobachteter Effekt in einem solchen Vergleich wäre demnach auf einen Unterschied zwischen Perampanel und Placebo zurückzuführen und nicht auf einen Unterschied zwischen Perampanel und Lamotrigin. Für einen adäquaten direkten randomisierten Vergleich mit Lamotrigin als aktiver Kontrolle wäre es jedoch erforderlich, dass alle Patienten eine Basistherapie ohne Lamotrigin erhalten und randomisiert werden auf eine Zusatztherapie mit Perampanel bzw. Lamotrigin (siehe Situation a in Abbildung 1). Der vom pu vorgelegte und in Abbildung 2 dargestellte Vergleich ist daher nicht zur Beantwortung der Fragestellung der Nutzenbewertung geeignet. Darüber hinaus ist noch ein weiterer Aspekt relevant: Bei allen Patienten der vom pu selektierten Teilpopulation war Lamotrigin Teil der Basistherapie. Diese Population entspricht somit der in Abbildung 1 (Abschnitt 2.7.1) beschriebenen Situation b. Somit stellt für diese Patienten nicht Lamotrigin die zweckmäßige Vergleichstherapie dar, sondern Topiramat. Demnach wäre die vom pu selektierte Teilpopulation der Zulassungsstudien für einen indirekten Vergleich mit Topiramat prinzipiell geeignet gewesen. Indirekter Vergleich von Perampanel und Lamotrigin Neben dem direkten Vergleich auf Basis der Zulassungsstudien führt der pu einen adjustierten indirekten Vergleich zwischen Perampanel als Zusatztherapie und Lamotrigin als Zusatztherapie zu einer bestehenden Basistherapie durch. Als gemeinsamer Brückenkomparator dient nach Angaben des pu Placebo (ebenfalls zusätzlich zu einer Basistherapie). Für die Perampanelseite des indirekten Vergleiches schließt der pu, wie schon für den direkten Vergleich, ausschließlich jene Teilpopulation von Patienten aus den 3 Zulassungsstudien ein, die in der Basistherapie Lamotrigin plus mindestens ein weiteres Antiepileptikum erhielten (siehe Modul 4, Abschnitte und des Dossiers). Aufseiten von Lamotrigin schließt der pu zwei placebokontrollierte Studien ein [8,9]. Für diese kann ausgeschlossen werden, dass Lamotrigin in der Basistherapie eingesetzt wurde, da Lamotrigin zum einen die zu untersuchende Therapie darstellt und zum anderen zum Zeitpunkt der Studiendurchführung noch nicht zugelassen war. Das Vorgehen des pu wird in der folgenden Abbildung 3 schematisch veranschaulicht. Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG)
23 Abbildung 3: Vorgehen des pu für den indirekten Vergleich Perampanel vs. Lamotrigin Auch dieser indirekte Vergleich ist nicht geeignet, die Fragestellung der Nutzenbewertung zu beantworten. Dafür sind folgende Gründe ausschlaggebend: Zum einen gelten die gleichen Argumente wie schon für den direkten Vergleich. In den indirekten Vergleich gehen aufseiten von Perampanel ausschließlich solche Patienten in die Analysen ein, die gleichzeitig auch Lamotrigin als Teil der Basistherapie erhalten hatten. Für diese Patienten ist nicht Lamotrigin, sondern Topiramat die zweckmäßige Vergleichstherapie. Aufgrund der Tatsache, dass in den Perampanelarmen der Studien zu Perampanel alle Patienten zusätzlich auch Lamotrigin erhalten hatten, handelt es sich bei dem indirekten Vergleich zum anderen nicht um einen Vergleich von Perampanel als Zusatztherapie und Lamotrigin als Zusatztherapie. Vielmehr wird hier die Kombination aus Perampanel und Lamotrigin mit Lamotrigin, jeweils als Zusatztherapie zu einer Basistherapie aus antiepileptischen Medikamenten, verglichen. Da davon ausgegangen werden muss, dass ein Behandlungseffekt von Lamotrigin in der Perampanelgruppe zum Tragen kommt, ist es mit diesem Vergleich nicht möglich, den Effekt von Perampanel als Zusatztherapie gegenüber Lamotrigin als Zusatztherapie abzuschätzen. Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG)
24 Als problematisch ist darüber hinaus die Verschiedenheit des gemeinsamen Komparators aus den Studien zu Perampanel bzw. aus denjenigen zu Lamotrigin zu sehen. Für die Placebogruppen der eingeschlossenen Lamotrigin-Studien [8,9] kann ausgeschlossen werden, dass Lamotrigin Teil der Basistherapie war. In den Placebogruppen der Zulassungsstudien zu Perampanel, die in den indirekten Vergleich eingegangen sind (vom pu gewählte Teilpopulationen), war Lamotrigin jedoch Bestandteil der Basistherapie. Aus diesem Grund ist fraglich, ob der vom pu gewählte Brückenkomparator adäquat ist. Zusammenfassend sind weder der direkte noch der indirekte Vergleich geeignet, die Fragestellung der Nutzenbewertung des Dossiers zu beantworten. Grundsätzliche Eignung der vorgelegten Studien zu Perampanel für einen indirekten Vergleich mit Lamotrigin beziehungsweise Topiramat Wie oben beschrieben, ist der indirekte Vergleich hauptsächlich aus folgendem Grund nicht zur Beantwortung der Fragestellung geeignet: Auf der Perampanelseite des indirekten Vergleichs wurden ausschließlich Patienten aus einer Teilpopulation der Zulassungsstudien eingeschlossen, nämlich diejenigen, bei denen Lamotrigin (also die zweckmäßige Vergleichstherapie) Teil der Basistherapie war. Vor diesem Hintergrund wurden die vom pu eingeschlossenen Studien zu Perampanel ergänzend auf ihre grundsätzliche Eignung für die Bewertung eines Zusatznutzens von Perampanel gegenüber der zweckmäßigen Vergleichstherapie innerhalb eines indirekten Vergleiches überprüft. Dabei wurde insbesondere unter Berücksichtigung der untersuchten Populationen und Interventionen analysiert, inwieweit entsprechend auswertbare Patientendaten vorliegen, die einen adäquaten Vergleich zwischen Perampanel als Zusatztherapie mit Lamotrigin als Zusatztherapie ermöglichen würden. Bei den 3 Studien zu Perampanel (E2007-G , E2007-G und E2007-G [4-7]) handelt es sich um multizentrische randomisierte placebokontrollierte Parallelgruppenstudien. Die Studiendauer betrug jeweils 19 Wochen. In alle drei Studien wurden Patienten ab 12 Jahren mit diagnostizierter Epilepsie eingeschlossen, die trotz der Einnahme von bis zu 3 verschiedenen Antiepileptika in gleichbleibender Dosierung weiterhin an fokalen Anfällen litten. Die eingeschlossenen Patienten entsprechen daher vollständig dem zugelassenen Anwendungsgebiet von Perampanel. Perampanel wurde jeweils als Zusatztherapie zu einer Basistherapie von mindestens 1 bis maximal 3 verschiedenen Antiepileptika in festen Dosierungen eingenommen. Folglich war die Einnahme von Lamotrigin allein oder als Bestandteil einer Kombinationstherapie in der Basistherapie der Studienintervention möglich. Vorbehaltlich einer genauen Bewertung der in den Studien erhobenen Endpunkte und der zulassungskonformen Verabreichung von Perampanel (z. B. hinsichtlich Dosierung) sind die Studien zu Perampanel hinsichtlich der untersuchten Populationen und hinsichtlich der verabreichten Therapien geeignet für einen indirekten Vergleich mit Lamotrigin bzw. Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG)
25 Topiramat. Je nach zweckmäßiger Vergleichstherapie (Lamotrigin oder Topiramat) sind allerdings Teilpopulationen dieser Studien zu bilden. Für den indirekten Vergleich mit Lamotrigin ist diejenige Teilpopulation der Studien 304, 305 und 306 relevant, bei denen Lamotrigin nicht Teil der Basistherapie war. Diese Teilpopulation umfasst ca. 70 % der Patienten der gepoolten ITT-Populationen der Studien 304, 305 und 306, die eine therapeutisch wirksame Dosierung von Perampanel erhalten haben. Aufseiten von Lamotrigin wären Studien heranzuziehen, in denen Lamotrigin mit Placebo verglichen wird, jeweils als Zusatztherapie zu einer Basistherapie mit anderen Antiepileptika (ohne Lamotrigin). Der resultierende indirekte Vergleich ist in Abbildung 4 schematisch dargestellt. Abbildung 4: Möglicher indirekter Vergleich von Perampanel und Lamotrigin, jeweils als Zusatztherapie In einer Situation, in der Lamotrigin Teil der Basistherapie ist, stellt gemäß Festlegung des G-BA Topiramat die zweckmäßige Vergleichstherapie dar. Für einen indirekten Vergleich mit Topiramat ist die Teilpopulation der Patienten aus den Studien 304, 305 und 306 relevant, bei Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG)
26 denen Lamotrigin Teil der Basistherapie war oder bei denen Lamotrigin die alleinige Basistherapie darstellt und bei denen Topiramat gleichzeitig nicht Teil der Basistherapie war. Wie viele Patienten diese Kriterien in den Studien erfüllen, ist anhand der vorliegenden Informationen nicht festzustellen. Aufseiten von Topiramat wären Studien heranzuziehen, in denen Topiramat mit Placebo verglichen wird, jeweils als Zusatztherapie zu einer lamotriginhaltigen Basistherapie. Der mögliche resultierende indirekte Vergleich mit Topiramat ist in Abbildung 5 schematisch dargestellt. Abbildung 5: Möglicher indirekter Vergleich von Perampanel und Topiramat, jeweils als Zusatztherapie Konsequenzen für die Nutzenbewertung Insgesamt ergeben sich folgende Konsequenzen für die Nutzenbewertung: Die vom pu vorgelegten direkten und indirekten Vergleiche auf Basis der ausgewählten Vergleichsgruppen sind nicht geeignet, die Fragestellung zu beantworten. Demnach liegen keine relevanten Ergebnisse für die Nutzenbewertung vor. Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG)
27 Methodik zur Bewertung der Aussagekraft der Nachweise sowie zur Informationssynthese und -analyse Die Angaben des pu zur Methodik für die Bewertung der Aussagekraft der Nachweise sowie für die Informationssynthese und -analyse befinden sich in Modul 4 (Abschnitte 4.2.4, 4.2.5) des Dossiers. Da für die Bewertung des Zusatznutzens von Perampanel gegenüber der zweckmäßigen Vergleichstherapie keine relevanten Daten vorliegen (siehe Abschnitte und ), wird die Methodik zur Bewertung der Aussagekraft der Nachweise sowie zur Informationssynthese und -analyse nicht kommentiert Methodik und Ergebnisse der Informationsbeschaffung Die Kommentierung der Methodik und der Ergebnisse der Informationsbeschaffung wird nachfolgend in 2 Themenbereiche aufgeteilt: Informationsbeschaffung Studienpool Informationsbeschaffung Die Angaben des pu zur Informationsbeschaffung befinden sich in Modul 4 (Abschnitte 4.2.3, , , Anhang 4-A bis 4-C) des Dossiers. Studien zu Perampanel Studienliste des pu Der pu benennt 9 Studien, von denen er 3 pivotale Zulassungsstudien (E2007-G , E2007-G und E2007-G [4-7]), in denen jeweils Perampanel plus Basistherapie mit Placebo plus Basistherapie verglichen wird, als relevant erachtet. Es ergibt sich aus den weiteren, vorgelegten Unterlagen kein Hinweis darauf, dass diese Studienliste unvollständig ist. Bibliografische Literaturrecherche Zur Identifizierung von relevanten Studien zu Perampanel war keine bibliografische Literaturrecherche gefordert, da keine Zulassungen vorliegen, die mehr als 12 Monate vor Einreichung des Dossiers erteilt wurden. Ungeachtet dessen hat der pu eine bibliografische Literaturrecherche zu Perampanel durchgeführt, mit der 1 Publikation zu einer in der Studienliste des pu bereits aufgeführten und vom pu eingeschlossenen Studie identifiziert wurde. Auf eine Überprüfung der nicht geforderten bibliografischen Literaturrecherche wurde verzichtet. Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG)
28 Studienregister Die laut Dossiervorlagen geforderte Suche in Studienregistern (RCT mit dem zu bewertenden Arzneimittel) wurde vom pu durchgeführt. Aus der Prüfung der Suche in Studienregistern ergaben sich keine Mängel. Zusammenfassung und Konsequenzen Es ergeben sich keine Konsequenzen für die Nutzenbewertung. Studien zu indirekten Vergleichen Da nach Angaben des pu keine direkt vergleichende Studie zu Perampanel und der zweckmäßigen Vergleichstherapie vorlag, wurde zur Identifizierung relevanter Studien für einen indirekten Vergleich durch den pu eine Recherche zu Lamotrigin durchgeführt. Bibliografische Literaturrecherche Aus der Prüfung der bibliografischen Literaturrecherche ergaben sich folgende Mängel: Es ist fraglich, ob die Suchstrategien in ausreichender Sensitivität umgesetzt wurden. So wurden die Freitextbegriffe zur Beschreibung der Indikation nur im Titel gesucht (siehe z.b. Modul 4, S. 648, Suchzeile 2 der Suchstrategie MEDLINE (OVID)). Ein Hinweis auf die nicht ausreichende Sensitivität der Suchstrategien zeigt sich beispielsweise dadurch, dass von den ein- bzw. ausgeschlossenen in MEDLINE indexierten Referenzen nicht alle über die MEDLINE-Suchstrategie gefunden wurden. Zudem wurden in den Suchstrategien zur Indikation zum Teil falsche Schlagwörter ausgewählt. Darüber hinaus wurde aber in den Datenbanken der Cochrane Library (Suchoberfläche OVID) das falsche Schlagwort zusätzlich noch in nicht ausreichender Sensitivität umgesetzt. Hier hätte das (falsche oder richtige) Schlagwort auf alle Untergruppen erweitert werden müssen. Bei Anwendung der Suchstrategie des pu wird das relevante Schlagwort Epilesies, Partial nicht abgesucht. Studienregister Die Suche in Studienregistern (RCTs mit der zweckmäßigen Vergleichstherapie Lamotrigin) wurde vom pu durchgeführt. Aus der Prüfung der Suche in Studienregistern ergaben sich keine Mängel. Zusammenfassung und Konsequenzen Es ergeben sich folgende Konsequenzen für die Nutzenbewertung: Aufgrund der oben beschriebenen Mängel der Informationsbeschaffung ist fraglich, ob mit ausreichender Sicherheit die für die Nutzenbewertung relevanten Studien identifiziert werden konnten. Auf eine Vollständigkeitsprüfung wurde dennoch aufgrund der bereits in Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG)
29 den vorhergehenden Abschnitten 2.3 und dargelegten Mängel verzichtet, da auch im Falle der Existenz weiterer relevanter Studien mit der Methodik des pu die Fragestellung nicht beantwortet werden kann. Weitere Recherchen Da nach Angaben des pu keine direkt vergleichende Studie zu Perampanel und der zweckmäßigen Vergleichstherapie vorlag, wurde zur Identifizierung relevanter Studien für einen indirekten Vergleich durch den pu eine weitere Recherche zu Topiramat im Anhang 4-H von Modul 4 vorgestellt. Bibliografische Literaturrecherche Die Prüfung der bibliografischen Literaturrecherche ergab die identischen Mängel, die bereits bei der Recherche zu Lamotrigin beschrieben wurden. Die dort beschriebenen Mängel beziehen sich ausschließlich auf den Indikationsblock, und dieser wurde auch bei der Suche zu Topiramat genutzt. Studienregister Es wurde eine Suche in Studienregistern (RCTs zu Topiramat) vom pu durchgeführt. Aus der Prüfung der Suche in Studienregistern ergaben sich keine Mängel. Zusammenfassung und Konsequenzen Es ergeben sich folgende Konsequenzen für die Nutzenbewertung: Aufgrund der oben beschriebenen Mängel der Informationsbeschaffung ist fraglich, ob mit ausreichender Sicherheit die für die Nutzenbewertung relevanten Studien identifiziert werden konnten. Da der pu, wie in Abschnitt 2.3 beschrieben, die Studien zu Topiramat nicht für einen indirekten Vergleich mit Perampanel heranzieht, erfolgt keine Prüfung auf Vollständigkeit Studienpool Die Angaben des pu zum Studienpool befinden sich in Modul 4 (Abschnitte , , , Anhang 4-D, 4-E) des Dossiers. Direkter und indirekter Vergleich von Perampanel und Lamotrigin Direkt vergleichende Studien zwischen Perampanel und der zweckmäßigen Vergleichstherapie liegen nicht vor. Dennoch führt der pu einen direkten Vergleich zum Zusatznutzen von Perampanel auf Basis placebokontrollierter RCTs sowie einen indirekten Vergleich durch. In beiden Fällen wird kein geeigneter Vergleich durchgeführt, wie er in Abbildung 1 in Abschnitt im Vergleich zu Lamotrigin dargestellt ist. Das gewählte Vorgehen ist daher nicht geeignet, einen Zusatznutzen von Perampanel als Zusatztherapie gegenüber Lamotrigin Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG)
Insgesamt erfüllten 30 Studien die definierten Einschlusskriterien. Davon konnten 8 Studien in die Nutzenbewertung eingeschlossen werden.
 Kurzfassung Das wurde vom Gemeinsamen Bundesausschuss (G-BA) beauftragt, eine Nutzenbewertung der allogenen Stammzelltransplantation mit nicht verwandtem Spender bei der Indikation Hodgkin- Lymphom (HL)
Kurzfassung Das wurde vom Gemeinsamen Bundesausschuss (G-BA) beauftragt, eine Nutzenbewertung der allogenen Stammzelltransplantation mit nicht verwandtem Spender bei der Indikation Hodgkin- Lymphom (HL)
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Mirabegron (Betmiga) Astellas Pharma GmbH Modul 4 A Symptomatische Therapie der überaktiven Blase bei Erwachsenen Medizinischer
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Mirabegron (Betmiga) Astellas Pharma GmbH Modul 4 A Symptomatische Therapie der überaktiven Blase bei Erwachsenen Medizinischer
Methodische Fragen zur frühen Nutzenbewertung nach 35a SGB V
 Die frühe Nutzenbewertung nach AMNOG Rechtssymposium des G-BA, Berlin, 16. Nov. 2010 Methodische Fragen zur frühen Nutzenbewertung nach 35a SGB V Jürgen Windeler AMNOG Nutzenbewertung für Arzneimittel
Die frühe Nutzenbewertung nach AMNOG Rechtssymposium des G-BA, Berlin, 16. Nov. 2010 Methodische Fragen zur frühen Nutzenbewertung nach 35a SGB V Jürgen Windeler AMNOG Nutzenbewertung für Arzneimittel
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Apixaban wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT 20.11.2014 B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT 25.04.2014 B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Eingangsformel. 1 Geltungsbereich. 2 Begriffsbestimmungen. AM-NutzenV. Ausfertigungsdatum: 28.12.2010. Vollzitat:
 Verordnung über die Nutzenbewertung von Arzneimitteln nach 35a Absatz 1 SGB V für Erstattungsvereinbarungen nach 130b SGB V (Arzneimittel-Nutzenbewertungsverordnung - AM- NutzenV) AM-NutzenV Ausfertigungsdatum:
Verordnung über die Nutzenbewertung von Arzneimitteln nach 35a Absatz 1 SGB V für Erstattungsvereinbarungen nach 130b SGB V (Arzneimittel-Nutzenbewertungsverordnung - AM- NutzenV) AM-NutzenV Ausfertigungsdatum:
BAnz AT 11.11.2014 B1. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Bedeutung der frühen Nutzenbewertung auf die Versorgung von Patienten mit Diabetes
 Gesundheit Mobilität Bildung Bedeutung der frühen Nutzenbewertung auf die Versorgung von Patienten Hans-Holger Bleß, IGES Institut Diabetes im Dialog Berlin, 26. November 2013 IGES Institut. Ein Unternehmen
Gesundheit Mobilität Bildung Bedeutung der frühen Nutzenbewertung auf die Versorgung von Patienten Hans-Holger Bleß, IGES Institut Diabetes im Dialog Berlin, 26. November 2013 IGES Institut. Ein Unternehmen
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 20.01.2011 Dossier zur Nutzenbewertung gemäß 35a SGB V Dapagliflozin (Forxiga 5 mg/10 mg Filmtabletten) Bristol-Myers Squibb GmbH & Co KGaA und AstraZeneca GmbH Modul 4 D Zur
Dokumentvorlage, Version vom 20.01.2011 Dossier zur Nutzenbewertung gemäß 35a SGB V Dapagliflozin (Forxiga 5 mg/10 mg Filmtabletten) Bristol-Myers Squibb GmbH & Co KGaA und AstraZeneca GmbH Modul 4 D Zur
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Vortioxetin wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Eine Initiative der Kassenärztlichen Bundesvereinigung zur Einführung von patientenrelevanten Innovationen in die vertragsärztliche Versorgung
 Eine Initiative der Kassenärztlichen Bundesvereinigung zur Einführung von patientenrelevanten Innovationen in die vertragsärztliche Versorgung Innovationsservice IMPRESSUM Herausgeber: Kassenärztliche
Eine Initiative der Kassenärztlichen Bundesvereinigung zur Einführung von patientenrelevanten Innovationen in die vertragsärztliche Versorgung Innovationsservice IMPRESSUM Herausgeber: Kassenärztliche
Eine Studie was ist das? Grundlagen klinischer Studien
 Eine Studie was ist das? Grundlagen klinischer Studien Grundlagen klinischer Studien Eine Studie ist eine systematische Sammlung von Daten, die dazu dient, eine oder mehrere Fragen zu beantworten. Eine
Eine Studie was ist das? Grundlagen klinischer Studien Grundlagen klinischer Studien Eine Studie ist eine systematische Sammlung von Daten, die dazu dient, eine oder mehrere Fragen zu beantworten. Eine
Verfahrenstechnische und methodische Anforderungen an die Bewertung einer Untersuchungs- u. Behandlungsmethode
 Informationsblatt Verfahrenstechnische und methodische Anforderungen an die Bewertung einer Untersuchungs- u. Behandlungsmethode (Bezug zu 2. Kapitel der Verfahrensordnung des G-BA (VerfO), Anlage II,
Informationsblatt Verfahrenstechnische und methodische Anforderungen an die Bewertung einer Untersuchungs- u. Behandlungsmethode (Bezug zu 2. Kapitel der Verfahrensordnung des G-BA (VerfO), Anlage II,
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Aflibercept (Eylea ) Bayer Vital GmbH Modul 4 D Erwachsene mit Visusbeeinträchtigung aufgrund eines Makulaödems infolge
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Aflibercept (Eylea ) Bayer Vital GmbH Modul 4 D Erwachsene mit Visusbeeinträchtigung aufgrund eines Makulaödems infolge
2. Anzahl der Patienten bzw. Abgrenzung der für die Behandlung infrage kommenden Patientengruppen
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Bedeutung der frühen Nutzenbewertung für die Preisverhandlungen nach 130b SGB V
 Bedeutung der frühen Nutzenbewertung für die Preisverhandlungen nach 130b SGB V Dr. iur. Susanne Götting LL.M. 15. DGRA Jahreskongress Bonn, 20.06. 1 AGENDA o o o o o o Die Kriterien zur Verhandlung des
Bedeutung der frühen Nutzenbewertung für die Preisverhandlungen nach 130b SGB V Dr. iur. Susanne Götting LL.M. 15. DGRA Jahreskongress Bonn, 20.06. 1 AGENDA o o o o o o Die Kriterien zur Verhandlung des
Erstellung und Einreichung eines Dossiers zur Kosten-Nutzen- Bewertung
 Erstellung und Einreichung eines Dossiers zur Kosten-Nutzen- Bewertung Format und Gliederung des Dossiers, einzureichende Unterlagen, Vorgaben für technische Standards Stand: 14.11.2013 Inhaltsverzeichnis
Erstellung und Einreichung eines Dossiers zur Kosten-Nutzen- Bewertung Format und Gliederung des Dossiers, einzureichende Unterlagen, Vorgaben für technische Standards Stand: 14.11.2013 Inhaltsverzeichnis
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Daclatasvir wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT 12.10.2015 B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
 I. II. I. II. III. IV. I. II. III. I. II. III. IV. I. II. III. IV. V. I. II. III. IV. V. VI. I. II. I. II. III. I. II. I. II. I. II. I. II. III. I. II. III. IV. V. VI. VII. VIII.
I. II. I. II. III. IV. I. II. III. I. II. III. IV. I. II. III. IV. V. I. II. III. IV. V. VI. I. II. I. II. III. I. II. I. II. I. II. I. II. III. I. II. III. IV. V. VI. VII. VIII.
BAnz AT 23.04.2015 B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um die Wirkstoffkombination Ledipasvir/Sofosbuvir wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
1. Rechtsgrundlage. 2. Eckpunkte der Entscheidung
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Verfahrensordnung (VerfO):Änderung im 5.Kapitel Anpassung der Regelungen zur frühen Nutzenbewertung an Gesetzesänderungen
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Verfahrensordnung (VerfO):Änderung im 5.Kapitel Anpassung der Regelungen zur frühen Nutzenbewertung an Gesetzesänderungen
Einführung in die Literaturrecherche WS 2013 /2014. Dr. Rebecca Jahn
 Einführung in die Literaturrecherche WS 2013 /2014 Dr. Rebecca 1 Gliederung Motivation für eine systematische Literaturrecherche? Suchstrategien Suchbeispiel MEDLINE Suchbeispiel SSCI Suchbeispiel WISO
Einführung in die Literaturrecherche WS 2013 /2014 Dr. Rebecca 1 Gliederung Motivation für eine systematische Literaturrecherche? Suchstrategien Suchbeispiel MEDLINE Suchbeispiel SSCI Suchbeispiel WISO
ebm info.at ärzteinformationszentrum Manuelle Lymphdrainage bei Krebserkrankungen
 ebm info.at ärzteinformationszentrum EbM Ärzteinformationszentrum www.ebm info.at Department für Evidenzbasierte Medizin und Klinische Epidemiologie Donau-Universität Krems Antwortdokument zur Anfrage
ebm info.at ärzteinformationszentrum EbM Ärzteinformationszentrum www.ebm info.at Department für Evidenzbasierte Medizin und Klinische Epidemiologie Donau-Universität Krems Antwortdokument zur Anfrage
Hyperbare Sauerstofftherapie beim Hörsturz
 Hyperbare Sauerstofftherapie beim Hörsturz Ergebnisbericht Recherche Datum der Suche: 01.09.2011 PICO-Fragestellung: Population: Personen mit einem Hörsturz mit/ ohne Tinnitus Intervention: Hyperbare Sauerstofftherapie
Hyperbare Sauerstofftherapie beim Hörsturz Ergebnisbericht Recherche Datum der Suche: 01.09.2011 PICO-Fragestellung: Population: Personen mit einem Hörsturz mit/ ohne Tinnitus Intervention: Hyperbare Sauerstofftherapie
Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU - Kombination mit Sulfonylharnstoff n
 Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU Kombination mit Sulfonylharnstoff nun ebenfalls zugelassen Haar (März 2008) - Die europäische Arzneimittelbehörde EMEA hat JANUVIA für
Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU Kombination mit Sulfonylharnstoff nun ebenfalls zugelassen Haar (März 2008) - Die europäische Arzneimittelbehörde EMEA hat JANUVIA für
Risikomanagement für IT-Projekte: Vergleich von Risiken und Methoden
 Sperrvermerk Risikomanagement für IT-Projekte: Vergleich von Risiken und Methoden Bachelorarbeit Zur Erlangung des akademischen Grades Bachelor of Science (B.Sc.) im Studiengang Wirtschaftswissenschaft
Sperrvermerk Risikomanagement für IT-Projekte: Vergleich von Risiken und Methoden Bachelorarbeit Zur Erlangung des akademischen Grades Bachelor of Science (B.Sc.) im Studiengang Wirtschaftswissenschaft
Beschluss des Gemeinsamen Bundesausschusses gemäß 2. Kapitel 14 Absatz 4 Spiegelstrich 2 der Verfahrensordnung des Gemeinsamen Bundesausschusses
 Beschluss des Gemeinsamen Bundesausschusses gemäß 2. Kapitel 14 Absatz 4 Spiegelstrich 2 der Verfahrensordnung des Gemeinsamen Bundesausschusses Der Gemeinsame Bundesausschuss hat im Rahmen der Bewertung
Beschluss des Gemeinsamen Bundesausschusses gemäß 2. Kapitel 14 Absatz 4 Spiegelstrich 2 der Verfahrensordnung des Gemeinsamen Bundesausschusses Der Gemeinsame Bundesausschuss hat im Rahmen der Bewertung
Akupunktur in der Schwangerschaft
 EVIDENZ KOMPAKT Akupunktur in der Schwangerschaft EVIDENZ KOMPAKT - Akupunktur in der Schwangerschaft Autoren Dr. Barbara Buchberger, MPH Laura Krabbe, MA EsFoMed GmbH das Essener Forschungsinstitut für
EVIDENZ KOMPAKT Akupunktur in der Schwangerschaft EVIDENZ KOMPAKT - Akupunktur in der Schwangerschaft Autoren Dr. Barbara Buchberger, MPH Laura Krabbe, MA EsFoMed GmbH das Essener Forschungsinstitut für
Kriterien zur Bestimmung der zweckmäßigen Vergleichstherapie
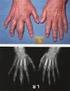 Kriterien zur Bestimmung der zweckmäßigen Vergleichstherapie und Recherche und Synopse der Evidenz zur Bestimmung der zweckmäßigen Vergleichstherapie nach 35a SGB V 2014-01-15-D-098 Retigabin Stand: August
Kriterien zur Bestimmung der zweckmäßigen Vergleichstherapie und Recherche und Synopse der Evidenz zur Bestimmung der zweckmäßigen Vergleichstherapie nach 35a SGB V 2014-01-15-D-098 Retigabin Stand: August
Evaluationskonzepte bei neuen Methoden. Analyse und Konsequenz des GKV.SV
 Evaluationskonzepte bei neuen Methoden Analyse und Konsequenz des GKV.SV Dr. Diedrich Bühler Dr. Diedrich Bühler Überblick I) Situation und Position des GKV SV II) Methodenbewertung, Selbstverwaltung /
Evaluationskonzepte bei neuen Methoden Analyse und Konsequenz des GKV.SV Dr. Diedrich Bühler Dr. Diedrich Bühler Überblick I) Situation und Position des GKV SV II) Methodenbewertung, Selbstverwaltung /
BAnz AT 04.04.2014 B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Dossier zur Nutzenbewertung gemäß 35a SGB V
 60Dokumentvorlage, Version vom 20.01.2011 Dossier zur Nutzenbewertung gemäß 35a SGB V Boceprevir (VICTRELIS ) MSD SHARP & DOHME GmbH Modul 4 A Chronische Hepatitis C Medizinischer Nutzen und medizinischer
60Dokumentvorlage, Version vom 20.01.2011 Dossier zur Nutzenbewertung gemäß 35a SGB V Boceprevir (VICTRELIS ) MSD SHARP & DOHME GmbH Modul 4 A Chronische Hepatitis C Medizinischer Nutzen und medizinischer
Themen. Insulinanaloga - Fragen und Antworten
 Themen Insulinanaloga - Fragen und Antworten Was sind Insulinanaloga? Als Humaninsulin wird die synthetische Nachbildung des körpereigenen, natürlichen Hormons Insulin bezeichnet. Insulinanaloga sind Abwandlungen
Themen Insulinanaloga - Fragen und Antworten Was sind Insulinanaloga? Als Humaninsulin wird die synthetische Nachbildung des körpereigenen, natürlichen Hormons Insulin bezeichnet. Insulinanaloga sind Abwandlungen
Zusammenfassende Dokumentation
 Zusammenfassende Dokumentation über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V Nalmefen Vom
Zusammenfassende Dokumentation über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V Nalmefen Vom
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 20.01.2011 Dossier zur Nutzenbewertung gemäß 35a SGB V Sitagliptin (Januvia, Xelevia ) MSD SHARP & DOHME GMBH Modul 3 C Als orale Zweifachtherapie in Kombination mit einem
Dokumentvorlage, Version vom 20.01.2011 Dossier zur Nutzenbewertung gemäß 35a SGB V Sitagliptin (Januvia, Xelevia ) MSD SHARP & DOHME GMBH Modul 3 C Als orale Zweifachtherapie in Kombination mit einem
Akupunktur zur Spannungskopfschmerzprophylaxe
 Akupunktur zur Spannungskopfschmerzprophylaxe Ergebnisbericht Recherche Datum der Suche: 31.10.2011 PICO-Fragestellung: Population: erwachsene Patienten mit chronischem oder episodischem Spannungskopfschmerz
Akupunktur zur Spannungskopfschmerzprophylaxe Ergebnisbericht Recherche Datum der Suche: 31.10.2011 PICO-Fragestellung: Population: erwachsene Patienten mit chronischem oder episodischem Spannungskopfschmerz
ebm info.at ärzteinformationszentrum Spinal Cord Stimulation
 ebm info.at ärzteinformationszentrum EbM Ärzteinformationszentrum www.ebm info.at Department für Evidenzbasierte Medizin und Klinische Epidemiologie Donau-Universität Krems Antwortdokument zur Anfrage
ebm info.at ärzteinformationszentrum EbM Ärzteinformationszentrum www.ebm info.at Department für Evidenzbasierte Medizin und Klinische Epidemiologie Donau-Universität Krems Antwortdokument zur Anfrage
Vorbericht V09-02 Behandlung der Adipositas bei Patienten mit Diabetes mellitus Typ 2
 Kurzfassung Hintergrund Der Gemeinsame Bundesausschuss (G-BA) hat mit Beschluss vom 12.11.2009 das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen beauftragt, eine Leitlinienrecherche
Kurzfassung Hintergrund Der Gemeinsame Bundesausschuss (G-BA) hat mit Beschluss vom 12.11.2009 das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen beauftragt, eine Leitlinienrecherche
Publikationskonzept Prävalenzmessung Sturz & Dekubitus
 Publikationskonzept Prävalenzmessung Sturz & Dekubitus Anhang 1 September 2013, Version 2.0 Das vorliegende Publikationskonzept der Prävalenzmessung Sturz & Dekubitus V.2.0 ist Bestandteil des Grundlagendokumentes
Publikationskonzept Prävalenzmessung Sturz & Dekubitus Anhang 1 September 2013, Version 2.0 Das vorliegende Publikationskonzept der Prävalenzmessung Sturz & Dekubitus V.2.0 ist Bestandteil des Grundlagendokumentes
vom 15. März 2012 Der Gemeinsame Bundesausschuss hat in seiner Sitzung am 15. März 2012 beschlossen:
 Beschluss des Gemeinsamen Bundesausschusses über eine Beauftragung der Institution nach 137a SGB V: Entwicklung eines sektorenübergreifenden Qualitätssicherungsverfahrens zur Versorgung bei psychischen
Beschluss des Gemeinsamen Bundesausschusses über eine Beauftragung der Institution nach 137a SGB V: Entwicklung eines sektorenübergreifenden Qualitätssicherungsverfahrens zur Versorgung bei psychischen
Langwirksame Insulinanaloga zur Behandlung des Diabetes mellitus Typ 1 Abschlussbericht
 IQWiG-Berichte Jahr: 2010 Nr. 70 Langwirksame Insulinanaloga zur Behandlung des Diabetes mellitus Typ 1 Abschlussbericht Auftrag A05-01 Stand: Impressum Herausgeber: Institut für Qualität und Wirtschaftlichkeit
IQWiG-Berichte Jahr: 2010 Nr. 70 Langwirksame Insulinanaloga zur Behandlung des Diabetes mellitus Typ 1 Abschlussbericht Auftrag A05-01 Stand: Impressum Herausgeber: Institut für Qualität und Wirtschaftlichkeit
Tragende Gründe. Vom 21. Mai 2015. Inhalt 1. Rechtsgrundlage... 2 2. Eckpunkte der Entscheidung... 3 3. Bürokratiekosten... 9 4. Verfahrensablauf...
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der -Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von n mit neuen Wirkstoffen nach 35a SGB V -
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der -Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von n mit neuen Wirkstoffen nach 35a SGB V -
Der Beschluss des G-BA ist zum 3. Januar 2015 in Kraft getreten.
 Qualifikationsanforderungen für die Erbringung einer EMDR-Behandlung im Rahmen einer Richtlinienpsychotherapie bei Patienten mit einer Posttraumatischen Belastungsstörung Hintergrund: Der Wissenschaftliche
Qualifikationsanforderungen für die Erbringung einer EMDR-Behandlung im Rahmen einer Richtlinienpsychotherapie bei Patienten mit einer Posttraumatischen Belastungsstörung Hintergrund: Der Wissenschaftliche
Versorgung, Diffusion & Finanzierung intelligent optimieren: Das AMNOG zum Erfolgsmodell machen
 Versorgung, Diffusion & Finanzierung intelligent optimieren: Das AMNOG zum Erfolgsmodell machen Berlin, 15. Januar 2016 Dr. Markus Frick, MPH Arzneimittelausgaben: Keine Explosion BILD vom 05.01.2016,
Versorgung, Diffusion & Finanzierung intelligent optimieren: Das AMNOG zum Erfolgsmodell machen Berlin, 15. Januar 2016 Dr. Markus Frick, MPH Arzneimittelausgaben: Keine Explosion BILD vom 05.01.2016,
Faktenblatt: Traditionelle Chinesische Medizin. (Siehe auch: Mind-Body-Therapien und Medizinische Pilze) Methode/Substanz
 Faktenblatt: Traditionelle Chinesische Medizin Mai 2015 Verantwortlich: PD Dr. J. Hübner, Prof. K. Münstedt, Prof. O. Micke, PD Dr. R. Mücke, Prof. F.J. Prott, Prof. J. Büntzel, Prof. V. Hanf, Dr. C. Stoll
Faktenblatt: Traditionelle Chinesische Medizin Mai 2015 Verantwortlich: PD Dr. J. Hübner, Prof. K. Münstedt, Prof. O. Micke, PD Dr. R. Mücke, Prof. F.J. Prott, Prof. J. Büntzel, Prof. V. Hanf, Dr. C. Stoll
5 Jahre AMNOG in Deutschland - was könnte die Schweiz besser machen?
 5 Jahre AMNOG in Deutschland - was könnte die Schweiz besser machen? Dr. Katrin Engemann Health Insurance Days Interlaken, 23. April 2015 23.04.2015 SPM PharmaBusiness 1 Die Situation in Deutschland vor
5 Jahre AMNOG in Deutschland - was könnte die Schweiz besser machen? Dr. Katrin Engemann Health Insurance Days Interlaken, 23. April 2015 23.04.2015 SPM PharmaBusiness 1 Die Situation in Deutschland vor
Wissenschaftliche Bewertung verschiedener Untersuchungsmethoden zur Diagnosestellung eines Asthma bronchiale bei Kindern im Alter von 2 bis 5 Jahren
 Wissenschaftliche Bewertung verschiedener Untersuchungsmethoden zur Diagnosestellung eines Asthma bronchiale bei Kindern im Alter von 2 bis 5 Jahren Dokumentation und Würdigung der Stellungnahmen zum Berichtsplan
Wissenschaftliche Bewertung verschiedener Untersuchungsmethoden zur Diagnosestellung eines Asthma bronchiale bei Kindern im Alter von 2 bis 5 Jahren Dokumentation und Würdigung der Stellungnahmen zum Berichtsplan
Prinzipien gerechter Verteilung Onkologie, quo vadis? Arbeitsgruppe 3. Routinedaten
 Arbeitsgruppe 3 Versorgungsforschung mit Versorgungsforschung mit Routinedaten Beginnen wir mit der guten Nachricht ht Allgemeine Einigkeit bestand über die Interpretation t ti des Begriffes mit Weitgehende
Arbeitsgruppe 3 Versorgungsforschung mit Versorgungsforschung mit Routinedaten Beginnen wir mit der guten Nachricht ht Allgemeine Einigkeit bestand über die Interpretation t ti des Begriffes mit Weitgehende
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 20.01.2011 Dossier zur Nutzenbewertung gemäß 35a SGB V Sitagliptin (Januvia, Xelevia ) MSD SHARP & DOHME GMBH Modul 3 E Zusätzlich zu Insulin mit oder ohne Metformin Zweckmäßige
Dokumentvorlage, Version vom 20.01.2011 Dossier zur Nutzenbewertung gemäß 35a SGB V Sitagliptin (Januvia, Xelevia ) MSD SHARP & DOHME GMBH Modul 3 E Zusätzlich zu Insulin mit oder ohne Metformin Zweckmäßige
Kriterien zur Förderung klinischer Krebsregister des GKV-Spitzenverbandes vom 20.12.2013
 Kriterien zur Förderung klinischer Krebsregister des GKV-Spitzenverbandes vom 20.12.2013 gemäß 65c SGB V (KFRG) Hintergrund und methodisches Vorgehen Seite 2 von 5 I. Hintergrund Krebs ist eine der häufigsten
Kriterien zur Förderung klinischer Krebsregister des GKV-Spitzenverbandes vom 20.12.2013 gemäß 65c SGB V (KFRG) Hintergrund und methodisches Vorgehen Seite 2 von 5 I. Hintergrund Krebs ist eine der häufigsten
AMNOG und die Folgen. PharmaDays 08.07.2011 Peter von Czettritz, Preu Bohlig & Partner
 PharmaDays 08.07.2011 Peter von Czettritz, Preu Bohlig & Partner I. Substitution gemäß 129 Abs. 1 Satz 2 SGB V 1. Erweiterung der Substitutionsvoraussetzungen a) ein gleiches Anwendungsgebiet b) identische
PharmaDays 08.07.2011 Peter von Czettritz, Preu Bohlig & Partner I. Substitution gemäß 129 Abs. 1 Satz 2 SGB V 1. Erweiterung der Substitutionsvoraussetzungen a) ein gleiches Anwendungsgebiet b) identische
