Hämovigilanzbericht Institut Inspektionen, Medizinprodukte & Hämovigilanz. pharmmed
|
|
|
- Dominic Albrecht
- vor 5 Jahren
- Abrufe
Transkript
1 Hämovigilanzbericht 8 Bundesamt für Sicherheit im Gesundheitswesen /AGES PharmMed Institut Inspektionen, Medizinprodukte & Hämovigilanz pharmmed
2 Inhaltsverzeichnis Hämovigilanz 3 Formulare der Hämovigilanz 3 Übersicht der Meldungen 8 4 Transfusionsreaktionen 5 Fehltransfusionen 5 Transfusionszahlen und Underreporting 6 Impressum Hämovigilanzbericht 8
3 Hämovigilanz Der vorliegende Hämovigilanzbericht des Jahres 8 ist der erste des Bundesamts für Sicherheit im Gesundheitswesen (BASG)/AGES PharmMed. Mit 1..8 übergab die Gesundheit Österreich GmbH/Geschäftsbereich ÖBIG das Hämovigilanz-Register an das BASG/AGES PharmMed. Die operativen Arbeiten werden seitdem vom AGES PharmMed-Institut Inspektionen, Medizinprodukte & Hämovigilanz wahrgenommen. Der nationale Grundstein der Hämovigilanz wurde 5 durch den Paragraphen 5d des Arzneimittelgesetzes und Paragraphen 3,11 und 15 des Blutsicherheitsgesetzes gelegt. Im Jahre folgte ergänzend die Hämovigilanzverordnung, die festlegt, dass alle vermuteten unerwünschten Ereignisse und Reaktionen, die entlang der Transfusionskette (Gewinnung bis Transfusion) detektiert, aufgezeichnet und gemeldet werden müssen. Dabei steht immer die Produkt- und Patientensicherheit im Zentrum des Interesses. Das Hämovigilanzregister sieht sich dabei als Sentinel node im Netzwerk des Informationsflusses. Werden Risken aufgedeckt, kann vielseitig darauf reagiert werden. Das Spektrum reicht von Sicherheitswarnungen des BASG/AGES PharmMed bis zu Chargensperrung und anlassbezogenen Inspektionen durch das Institut Inspektionen, Medizinprodukte & Hämovigilanz. Die Hämovigilanz ist im Vergleich zu anderen Vigilanzsystemen (z. B. Pharmakovigilanz) eine sehr junge Disziplin, die ein reges internationales Interesse auslöst. Bereits seit 1998 existiert das europäisches Expertenforum (IHN - International Haemovigilance Network) mit 3 TeilnehmerInnen aus europäischen Staaten. Es dient dem internationalen Austausch und der Ausarbeitung von Standards. Formulare der Hämovigilanz Meldepflichtig sind Hersteller und Anwender von labilen Blutprodukten. Zur Meldung existieren drei unterschiedliche Formulare, um die aufgetretenen Vorfälle gezielt zu übermitteln. Formulartyp Formular P Formular E Formular A Anzuwenden bei Meldungen im Fall von ernsten unerwünschten Reaktionen im Rahmen der Spende/Apherese Meldungen von ernsten Zwischenfällen im Rahmen des Herstellungsprozesses Meldungen von (vermuteten) Reaktionen im Rahmen einer Transfusion Derzeit werden Mitteilungen über aufgetretene Reaktionen und Zwischenfälle via Fax übermittelt und unmittelbar an das Gutachterteam des Vigilanzregisters weitergeleitet. Künftig soll eine elektronische Übermittlung möglich sein. Ab 1 soll die so genannte aktive Vigilanz für MelderInnen gelten. Transparenz und Effizienz sollen dabei das Meldewesen nachhaltig verbessern. Das erwähnte elektronische Meldewesen soll Teil der aktiven Vigilanz sein. 3
4 Übersicht der Meldungen 8 Im Jahr 8 sind insgesamt unerwünschte Zwischenfälle, Reaktionen und Near Miss Events (Beinahe-fehler) beim Hämovigilanzregister gemeldet worden. HämovigilanzMeldungen Aufteilung der Fälle nach Kategorien Kategorie Anzahl Anzahl der gemeldeten unerwünschten Zwischenfälle im Jahr 8 98 Anzahl der gemeldeten unerwünschten Reaktionen im Jahr 8 45 Near Miss Events (Beinahefehler) 4 4
5 Transfusionsreaktionen Die Meldung von ernsten unerwünschten Reaktionen ist weiterhin steigend und kann wie folgt kategorisiert werden: Klassifizierung* Anzahl In Prozent Bakterielle/virale Kontamination 3,6 Nicht immunologisch ehämolyse,4 Verzögerte hämolytische Transfusionsreaktion 11,3 Anaphylaxie/Hypersensitivität 16 3,3 Transfusions-assoziierte akute Lungenerkrankung (TRALI) 5 1 Purpura post transfusionem (PTP) Transfusions-assoziierte Graft-versus-Host-Disease (GvHD) Akute nicht-hämolytische febrile Transfusionsreaktionen 14 36,6 Akute nicht-hämolytische allergische Transfusionsreaktionen 1 45,6 Fehltransfusionen 1,5 Andere 35,3 * Dabei wurden nur jene Transfusionsreaktionen dargestellt, deren Verdacht sich bestätigte. Je nach Produktart können die oben dargelegten Fälle in autologe und homologe Produkte gegliedert werden. Eine Häufung tritt im Bereich der homologen Erythrozytenspende (,8 Prozent der Fälle) auf. Fehltransfusionen Im Jahre 8 wurden lediglich Fehltransfusionen, die durch Verwechslung bei der Transfusion (am Patienten) stattfanden verzeichnet. Fehltransfusionen nach ProduktART Ery autolog Plasma autolog Ery homolog FFP homolog Octaplas Thrombozyten homolog
6 Transfusionszahlen und Underreporting Laut Blutverbrauchserhebung der GÖG/ÖBIG ist der Blutverbrauch im Jahr 8 leicht gesunken Transfusionen absolut absolut +/- ) absolut +/- ) absolut +/- ) absolut +/- ) Ery ,5% 41. +,6% ,% ,5% FFP ,3% ,% 3.6 +,4% ,% S/D-Plasma ,9% ,6% ,1% 5.3-6,% Thrombo-Pool ,6% 8. -5,4% ,9% 9.1 -,% Thrombo-Apherese ,5%. +8,9% 9.1 +,8% 8.5 -,1% ZS Fremdblut ,1% ,3% ,9% 58. -,1% Ery Eigenblut ,1% ,8% 4.8 -,% ,4% Plasma Eigenblut ,% ,3% -41,% 4-4,9% Summe ) ) -3,4% ) +1,1% ) +,6% ) -,4% 1) Rundungsdifferenzen ) Veränderung Quelle: GÖG/ÖBIG-eigene Erhebungen Der Rückgang ist auf einen geringen Eigenblutverbrauch zurückzuführen; der Fremdblutverbrauch ist relativ konstant geblieben. Internationale wissenschaftliche Untersuchungen haben den Zusammenhang von verabreichten Blutprodukten und den dabei auftretenden Reaktionen näher untersucht. Demnach zeigen fünf von 1. verabreichten Transfusionen Reaktionen beim Empfänger. Gemessen an der österreichischen Blutverbrauchserhebung bedeutet dies rund.6 erwartete Transfusionsmeldungen pro Jahr und daher ein österreichisches Underreporting von 8 Prozent. 6
7 Impressum Medieninhaber und Herausgeber: AGES Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH, Bereich PharmMed Schnirchgasse 9, 13 Wien Für den Inhalt verantwortlich: Marcus Müllner, Bereichsleiter AGES PharmMed Publikation: Jänner 1 Konzept und Grafische Gestaltung: c/o care of agency, Thomas Proksch, Schellinggasse 1, 11 Wien Bildnachweis: c/o care of agency, Thomas Proksch Kontakt: AGES PharmMed Bereichsleitung Tel.: +43 () Fax: +43 ()
Gesetzliche Grundlagen und Meldepflicht
 Gesetzliche Grundlagen und Meldepflicht Mag. Doris Datlinger Institut Inspektionen, Medizinprodukte & Hämovigilanz AGES Gespräch Hämovigilanz Wien, 09.06.2010 www.basg.at Österreichische Agentur für Gesundheit
Gesetzliche Grundlagen und Meldepflicht Mag. Doris Datlinger Institut Inspektionen, Medizinprodukte & Hämovigilanz AGES Gespräch Hämovigilanz Wien, 09.06.2010 www.basg.at Österreichische Agentur für Gesundheit
Gesetzliche Grundlagen der Gewebevigilanz
 Gesetzliche Grundlagen der Gewebevigilanz Dr. Robert Pilacek Institut Inspektionen, Medizinprodukte & Hämovigilanz Der Inhalt dieser Präsentation spiegelt die Meinung des Vortragenden wider und repräsentiert
Gesetzliche Grundlagen der Gewebevigilanz Dr. Robert Pilacek Institut Inspektionen, Medizinprodukte & Hämovigilanz Der Inhalt dieser Präsentation spiegelt die Meinung des Vortragenden wider und repräsentiert
Hämovigilanzbericht Bundesamt für Sicherheit im Gesundheitswesen AGES Medizinmarktaufsicht. Institut Überwachung
 Bundesamt für Sicherheit im Gesundheitswesen AGES Medizinmarktaufsicht Institut Überwachung 1 Inhaltsverzeichnis 1 Vorwort... 3 2 Einleitung... 3 2.1 Allgemeine Grundlagen der Hämovigilanz... 4 2.1.1 Rechtliche
Bundesamt für Sicherheit im Gesundheitswesen AGES Medizinmarktaufsicht Institut Überwachung 1 Inhaltsverzeichnis 1 Vorwort... 3 2 Einleitung... 3 2.1 Allgemeine Grundlagen der Hämovigilanz... 4 2.1.1 Rechtliche
Hämovigilanzbericht Bundesamt für Sicherheit im Gesundheitswesen AGES Medizinmarktaufsicht. Institut Überwachung
 Hämovigilanzbericht 2016 Bundesamt für Sicherheit im Gesundheitswesen AGES Medizinmarktaufsicht Institut Überwachung 1 Inhaltsverzeichnis 1 Vorwort... 3 2 Einleitung... 3 2.1 Allgemeine Grundlagen der
Hämovigilanzbericht 2016 Bundesamt für Sicherheit im Gesundheitswesen AGES Medizinmarktaufsicht Institut Überwachung 1 Inhaltsverzeichnis 1 Vorwort... 3 2 Einleitung... 3 2.1 Allgemeine Grundlagen der
Hämovigilanzbericht Bundesamt für Sicherheit im Gesundheitswesen / AGES PharmMed Institut Inspektionen, Medizinprodukte & Hämovigilanz
 Bundesamt für Sicherheit im Gesundheitswesen / AGES PharmMed Institut Inspektionen, Medizinprodukte & Hämovigilanz Inhaltsverzeichnis 1 Einleitung... 3 1.1 Das Österreichische Hämovigilanzregister... 3
Bundesamt für Sicherheit im Gesundheitswesen / AGES PharmMed Institut Inspektionen, Medizinprodukte & Hämovigilanz Inhaltsverzeichnis 1 Einleitung... 3 1.1 Das Österreichische Hämovigilanzregister... 3
Hämovigilanzbericht Bundesamt für Sicherheit im Gesundheitswesen AGES Medizinmarktaufsicht. Institut Überwachung
 Bundesamt für Sicherheit im Gesundheitswesen AGES Medizinmarktaufsicht Institut Überwachung 1 Inhaltsverzeichnis 1 Vorwort... 3 2 Einleitung... 3 2.1 Allgemeine Grundlagen der Hämovigilanz... 4 2.1.1 Rechtliche
Bundesamt für Sicherheit im Gesundheitswesen AGES Medizinmarktaufsicht Institut Überwachung 1 Inhaltsverzeichnis 1 Vorwort... 3 2 Einleitung... 3 2.1 Allgemeine Grundlagen der Hämovigilanz... 4 2.1.1 Rechtliche
Hämovigilanzbericht Bundesamt für Sicherheit im Gesundheitswesen AGES Medizinmarktaufsicht. Institut Überwachung
 Bundesamt für Sicherheit im Gesundheitswesen AGES Medizinmarktaufsicht Institut Überwachung 1 Inhaltsverzeichnis 1 Vorwort... 3 2 Einleitung... 3 2.1 Allgemeine Grundlagen der Hämovigilanz... 4 2.1.1 Rechtliche
Bundesamt für Sicherheit im Gesundheitswesen AGES Medizinmarktaufsicht Institut Überwachung 1 Inhaltsverzeichnis 1 Vorwort... 3 2 Einleitung... 3 2.1 Allgemeine Grundlagen der Hämovigilanz... 4 2.1.1 Rechtliche
Hämovigilanzbericht Bundesamt für Sicherheit im Gesundheitswesen AGES Medizinmarktaufsicht. Institut Überwachung
 Bundesamt für Sicherheit im Gesundheitswesen AGES Medizinmarktaufsicht Institut Überwachung 1 Inhaltsverzeichnis 1 Vorwort... 3 2 Einleitung... 3 2.1 Allgemeine Grundlagen der Hämovigilanz... 4 2.1.1 Rechtliche
Bundesamt für Sicherheit im Gesundheitswesen AGES Medizinmarktaufsicht Institut Überwachung 1 Inhaltsverzeichnis 1 Vorwort... 3 2 Einleitung... 3 2.1 Allgemeine Grundlagen der Hämovigilanz... 4 2.1.1 Rechtliche
ÖSTERREICHISCHES BUNDESINSTITUT FÜR GESUNDHEITSWESEN. Hämovigilanz. Hämovigilanz. Jahresbericht. Jahresbericht
 ÖSTERREICHISCHES BUNDESINSTITUT FÜR GESUNDHEITSWESEN Hämovigilanz Hämovigilanz Jahresbericht Jahresbericht 2003 2003 IM AUFTRAG DES BUNDESMINISTERIUMS FÜR GESUNDHEIT UND FRAUEN Österreichisches Bundesinstitut
ÖSTERREICHISCHES BUNDESINSTITUT FÜR GESUNDHEITSWESEN Hämovigilanz Hämovigilanz Jahresbericht Jahresbericht 2003 2003 IM AUFTRAG DES BUNDESMINISTERIUMS FÜR GESUNDHEIT UND FRAUEN Österreichisches Bundesinstitut
Hämovigilanz Jahresbericht 2006
 GESUNDHEIT ÖSTERREICH GMBH GESCHÄFTSBEREICH ÖBIG Hämovigilanz Jahresbericht 2006 IM AUFTRAG DES BUNDESMINISTERIUMS FÜR GESUNDHEIT, FAMILIE UND JUGEND Gesundheit Österreich GmbH Geschäftsbereich ÖBIG Hämovigilanz-Jahresbericht
GESUNDHEIT ÖSTERREICH GMBH GESCHÄFTSBEREICH ÖBIG Hämovigilanz Jahresbericht 2006 IM AUFTRAG DES BUNDESMINISTERIUMS FÜR GESUNDHEIT, FAMILIE UND JUGEND Gesundheit Österreich GmbH Geschäftsbereich ÖBIG Hämovigilanz-Jahresbericht
Meldungen unerwünschter Wirkungen an das PEI
 Meldungen unerwünschter Wirkungen an das PEI Brigitte Keller-Stanislawski Markus Funk Annette Lohmann Paul-Ehrlich-Str. 5-59 635 Langen arzneimittelsicherheit@pei.de http://www.pei.de Hämovigilanz in Deutschland
Meldungen unerwünschter Wirkungen an das PEI Brigitte Keller-Stanislawski Markus Funk Annette Lohmann Paul-Ehrlich-Str. 5-59 635 Langen arzneimittelsicherheit@pei.de http://www.pei.de Hämovigilanz in Deutschland
HÄMOVIGILANZ IN ÖSTERREICH
 ÖSTERREICHISCHES BUNDESINSTITUT FÜR GESUNDHEITSWESEN HÄMOVIGILANZ IN ÖSTERREICH Neue Regelung ab 1.1.2003 BUNDESMINISTERIUM FÜR SOZIALE SICHERHEIT UND GENERATIONEN ÖSTERREICHISCHES BUNDESINSTITUT FÜR GESUNDHEITSWESEN
ÖSTERREICHISCHES BUNDESINSTITUT FÜR GESUNDHEITSWESEN HÄMOVIGILANZ IN ÖSTERREICH Neue Regelung ab 1.1.2003 BUNDESMINISTERIUM FÜR SOZIALE SICHERHEIT UND GENERATIONEN ÖSTERREICHISCHES BUNDESINSTITUT FÜR GESUNDHEITSWESEN
ÖSTERREICHISCHES BUNDESINSTITUT FÜR GESUNDHEITSWESEN. Hämovigilanz Jahresbericht IM AUFTRAG DES BUNDESMINISTERIUMS FÜR GESUNDHEIT UND FRAUEN
 ÖSTERREICHISCHES BUNDESINSTITUT FÜR GESUNDHEITSWESEN Hämovigilanz Jahresbericht 2004 IM AUFTRAG DES BUNDESMINISTERIUMS FÜR GESUNDHEIT UND FRAUEN Österreichisches Bundesinstitut für Gesundheitswesen ÖBIG
ÖSTERREICHISCHES BUNDESINSTITUT FÜR GESUNDHEITSWESEN Hämovigilanz Jahresbericht 2004 IM AUFTRAG DES BUNDESMINISTERIUMS FÜR GESUNDHEIT UND FRAUEN Österreichisches Bundesinstitut für Gesundheitswesen ÖBIG
Haemovigilance. Swisstransfusion, Fribourg M. Rüesch, M. Jutzi Clinical Reviewer Haemovigilance, Swissmedic
 Haemovigilance Swisstransfusion, Fribourg 2011 M. Rüesch, M. Jutzi Clinical Reviewer Haemovigilance, Swissmedic Swissmedic Schweizerisches Heilmittelinstitut Hallerstrasse 7 CH-3000 Bern www.swissmedic.ch
Haemovigilance Swisstransfusion, Fribourg 2011 M. Rüesch, M. Jutzi Clinical Reviewer Haemovigilance, Swissmedic Swissmedic Schweizerisches Heilmittelinstitut Hallerstrasse 7 CH-3000 Bern www.swissmedic.ch
Hämovigilanzbericht 2009 Bundesamt für Sicherheit im Gesundheitswesen / AGES PharmMed Institut Inspektionen, Medizinprodukte & Hämovigilanz
 Bundesamt für Sicherheit im Gesundheitswesen / AGES PharmMed Institut Inspektionen, Medizinprodukte & Hämovigilanz Seite 1 von 37 Inhaltsverzeichnis 1. Einleitung... 3 Das Österreichische Hämovigilanzregister...
Bundesamt für Sicherheit im Gesundheitswesen / AGES PharmMed Institut Inspektionen, Medizinprodukte & Hämovigilanz Seite 1 von 37 Inhaltsverzeichnis 1. Einleitung... 3 Das Österreichische Hämovigilanzregister...
Rückblick und aktuelle Daten Haemovigilance
 Haemovigilance Workshop, 9. Mai 204 Rückblick und aktuelle Daten Haemovigilance Lorenz Amsler, Markus Jutzi, Clinical Reviewer Haemovigilance Swissmedic Schweizerisches Heilmittelinstitut Hallerstrasse
Haemovigilance Workshop, 9. Mai 204 Rückblick und aktuelle Daten Haemovigilance Lorenz Amsler, Markus Jutzi, Clinical Reviewer Haemovigilance Swissmedic Schweizerisches Heilmittelinstitut Hallerstrasse
Daten Haemovigilance
 Rückblick und aktuelle Daten Haemovigilance 203 Workshop Haemovigilance Swissmedic 06.05.203 Markus Jutzi, Morven Rüesch Clinicali l Reviewer Haemovigilance, il Swissmedic Swissmedic Schweizerisches Heilmittelinstitut
Rückblick und aktuelle Daten Haemovigilance 203 Workshop Haemovigilance Swissmedic 06.05.203 Markus Jutzi, Morven Rüesch Clinicali l Reviewer Haemovigilance, il Swissmedic Swissmedic Schweizerisches Heilmittelinstitut
Arzneimittelnebenwirkungen melden leicht(er) gemacht
 Die Rolle des Arztes in der Pharmakovigilanz Arzneimittelnebenwirkungen melden leicht(er) gemacht Patient Apotheker Spitalsarzt Niedergelassener Arzt Krankenhausapotheker BASG/AGES PharmMed 2 Gesetzliche
Die Rolle des Arztes in der Pharmakovigilanz Arzneimittelnebenwirkungen melden leicht(er) gemacht Patient Apotheker Spitalsarzt Niedergelassener Arzt Krankenhausapotheker BASG/AGES PharmMed 2 Gesetzliche
Qualitätsmängel bei Arzneimitteln
 AGES PharmMed - Institut Inspektionen, Medizinprodukte & Hämovigilanz Qualitätsmängel bei Arzneimitteln Mag. Martina Unteregger Medizinmarktüberwachung 2 AGES PharmMed - Institut Inspektionen, Medizinprodukte
AGES PharmMed - Institut Inspektionen, Medizinprodukte & Hämovigilanz Qualitätsmängel bei Arzneimitteln Mag. Martina Unteregger Medizinmarktüberwachung 2 AGES PharmMed - Institut Inspektionen, Medizinprodukte
Mit dem Meldebogen (1b) sollen solche Ereignisse erfasst werden, bei denen eines oder mehrere der folgenden Kriterien erfüllt sind:
 Meldeverpflichtungen von schwerwiegenden Zwischenfällen und schwerwiegenden unerwünschten Transfusionsreaktionen gem. 63i Absatz 1 7 Arzneimittelgesetz (AMG) vom 23. Juli 2009, geändert am 01.03.2013 Das
Meldeverpflichtungen von schwerwiegenden Zwischenfällen und schwerwiegenden unerwünschten Transfusionsreaktionen gem. 63i Absatz 1 7 Arzneimittelgesetz (AMG) vom 23. Juli 2009, geändert am 01.03.2013 Das
Differentialdiagnose und Abklärung der wichtigsten Transfusionsreaktionen
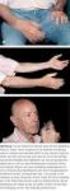 Haemovigilance Workshop, 26. Oktober 2015 Differentialdiagnose und Abklärung der wichtigsten Transfusionsreaktionen Lorenz Amsler, Markus Jutzi, Clinical Reviewer Haemovigilance Swissmedic Schweizerisches
Haemovigilance Workshop, 26. Oktober 2015 Differentialdiagnose und Abklärung der wichtigsten Transfusionsreaktionen Lorenz Amsler, Markus Jutzi, Clinical Reviewer Haemovigilance Swissmedic Schweizerisches
EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR)
 EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR) IM ZUSAMMENHANG MIT BLUTKOMPONENTEN nach 63i Abs. 4 AMG Allgemeines: Durch
EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR) IM ZUSAMMENHANG MIT BLUTKOMPONENTEN nach 63i Abs. 4 AMG Allgemeines: Durch
Hämovigilanz. Erfahrungen in einem Universitätsspital. A. Egger Dr. med. Susanne Christen
 Hämovigilanz Erfahrungen in einem Universitätsspital A. Egger Dr. med. Susanne Christen Agenda Wie Alles begann Funktionierendes Meldesystem und Etablierung der Hämovigilanz (HV) Installiertes Qualitätsmanagementsystem
Hämovigilanz Erfahrungen in einem Universitätsspital A. Egger Dr. med. Susanne Christen Agenda Wie Alles begann Funktionierendes Meldesystem und Etablierung der Hämovigilanz (HV) Installiertes Qualitätsmanagementsystem
Gesamte Rechtsvorschrift für Arzneimittel aus menschlichem Blut, Fassung vom
 Gesamte Rechtsvorschrift für Arzneimittel aus menschlichem Blut, Fassung vom 02.04.2015 Langtitel Verordnung der Bundesministerin für Gesundheit und Frauen betreffend Arzneimittel aus menschlichem Blut
Gesamte Rechtsvorschrift für Arzneimittel aus menschlichem Blut, Fassung vom 02.04.2015 Langtitel Verordnung der Bundesministerin für Gesundheit und Frauen betreffend Arzneimittel aus menschlichem Blut
Laborhandbuch Hämovigilanz
 Laborhandbuch Hämovigilanz Allgemein Seit dem 1.1.2002 besteht die Meldepflicht für unerwünschte Reaktionen bei der Transfusion von labilen Blutprodukten (Hämovigilanz). Meldepflichtig sind nicht nur schwerwiegende,
Laborhandbuch Hämovigilanz Allgemein Seit dem 1.1.2002 besteht die Meldepflicht für unerwünschte Reaktionen bei der Transfusion von labilen Blutprodukten (Hämovigilanz). Meldepflichtig sind nicht nur schwerwiegende,
Risikokommunikation der Behörden Risiken und Nutzen von Arzneimitteln
 Risikokommunikation der Behörden Risiken und Nutzen von Arzneimitteln Marcus Müllner AGES PharmMed / Bundesamt für Sicherheit im Gesundheitswesen 21.11.2011 www.basg.at Österreichische Agentur für Gesundheit
Risikokommunikation der Behörden Risiken und Nutzen von Arzneimitteln Marcus Müllner AGES PharmMed / Bundesamt für Sicherheit im Gesundheitswesen 21.11.2011 www.basg.at Österreichische Agentur für Gesundheit
Ausgabe 2. Quartal Aktuelle Informationen dazu finden Sie auf der Homepage des Bundesministeriums für Gesundheit unter nachfolgendem Link.
 Ausgabe 2. Quartal 2009 Pandemie Neuer Influenzavirus A(H1N1) Aktuelle Informationen dazu finden Sie auf der Homepage des Bundesministeriums für Gesundheit unter nachfolgendem Link. http://www.bmg.gv.at/cms/site/news_detail.html?channel=ch0525&doc=cms1240819590724
Ausgabe 2. Quartal 2009 Pandemie Neuer Influenzavirus A(H1N1) Aktuelle Informationen dazu finden Sie auf der Homepage des Bundesministeriums für Gesundheit unter nachfolgendem Link. http://www.bmg.gv.at/cms/site/news_detail.html?channel=ch0525&doc=cms1240819590724
Patient Blood Management auch ein Thema der QS? Jochen Bredehöft
 Patient Blood Management auch ein Thema der QS? Jochen Bredehöft Agenda Warum überhaupt etwas verändern? Was sind Ziele und Instrumente? Wo stehen wir? Was können wir beeinflussen? Seite 2 Warum brauchen
Patient Blood Management auch ein Thema der QS? Jochen Bredehöft Agenda Warum überhaupt etwas verändern? Was sind Ziele und Instrumente? Wo stehen wir? Was können wir beeinflussen? Seite 2 Warum brauchen
STANDARDISIERTE DEFINITIONEN VON UNERWÜNSCHTEN TRANSFUSIONS-EREIGNISSEN
 STANDARDISIERTE DEFINITIONEN VON UNERWÜNSCHTEN TRANSFUSIONS-EREIGNISSEN Pierre Robillard MD Nationales Gesundheitsamt Quebec McGill Universität, Abteilung Epidemiologie, Biostatistik und Arbeitsmedizin
STANDARDISIERTE DEFINITIONEN VON UNERWÜNSCHTEN TRANSFUSIONS-EREIGNISSEN Pierre Robillard MD Nationales Gesundheitsamt Quebec McGill Universität, Abteilung Epidemiologie, Biostatistik und Arbeitsmedizin
Leitfaden für die Qualitätssicherung in der Transfusionspraxis
 Fribourg, 08. September 2017 Leitfaden für die Qualitätssicherung in der Transfusionspraxis Markus Jutzi, Leiter Medizin Standort Bern, Interregionale Blutspende SRK Lorenz Amsler, Clinical Reviewer, Haemovigilance,
Fribourg, 08. September 2017 Leitfaden für die Qualitätssicherung in der Transfusionspraxis Markus Jutzi, Leiter Medizin Standort Bern, Interregionale Blutspende SRK Lorenz Amsler, Clinical Reviewer, Haemovigilance,
Liechtensteinisches Landesgesetzblatt Jahrgang 2016 Nr... ausgegeben am
 Referendumsvorlage Liechtensteinisches Landesgesetzblatt Jahrgang 2016 Nr.... ausgegeben am... 2016 Abkommen zwischen der Regierung des Fürstentums Liechtenstein und der Österreichischen Bundesregierung
Referendumsvorlage Liechtensteinisches Landesgesetzblatt Jahrgang 2016 Nr.... ausgegeben am... 2016 Abkommen zwischen der Regierung des Fürstentums Liechtenstein und der Österreichischen Bundesregierung
Durch diese Verordnung werden nachstehende Richtlinien der Europäischen Gemeinschaft umgesetzt:
 9HURUGQXQJ GHU %XQGHVPLQLVWHULQ I U *HVXQGKHLW XQG )UDXHQ EHWUHIIHQG $U]QHLPLWWHO DXV PHQVFKOLFKHP%OXW Gemäß 5 und 62a des Arzneimittelgesetzes, BGBl. Nr. 185/1983, zuletzt geändert durch BGBl. I Nr. xx/2004,
9HURUGQXQJ GHU %XQGHVPLQLVWHULQ I U *HVXQGKHLW XQG )UDXHQ EHWUHIIHQG $U]QHLPLWWHO DXV PHQVFKOLFKHP%OXW Gemäß 5 und 62a des Arzneimittelgesetzes, BGBl. Nr. 185/1983, zuletzt geändert durch BGBl. I Nr. xx/2004,
Böses Blut? Übersicht über die aktuelle Literatur Malte Ziemann Institut für Transfusionsmedizin
 UNIVERSITÄTSKLINIKUM Schleswig-Holstein Böses Blut? Übersicht über die aktuelle Literatur Malte Ziemann Institut für Transfusionsmedizin Blut und Infektionen ARD, 24.11.2014 Warum ist Blut böse? Patienten
UNIVERSITÄTSKLINIKUM Schleswig-Holstein Böses Blut? Übersicht über die aktuelle Literatur Malte Ziemann Institut für Transfusionsmedizin Blut und Infektionen ARD, 24.11.2014 Warum ist Blut böse? Patienten
Das BASG / AGES PharmMed
 CMI-WORKSHOP Dipl.-Ing. Meinrad Guggenbichler Institut Inspektionen, Medizinprodukte und Hämovigilanz Das BASG / AGES PharmMed Das Bundesamt für Sicherheit im Gesundheitswesen (BASG) ist die Aufsichtsbehörde
CMI-WORKSHOP Dipl.-Ing. Meinrad Guggenbichler Institut Inspektionen, Medizinprodukte und Hämovigilanz Das BASG / AGES PharmMed Das Bundesamt für Sicherheit im Gesundheitswesen (BASG) ist die Aufsichtsbehörde
Transfusionsmedizin Grundlagen und praktisches Vorgehen
 Transfusionsmedizin Grundlagen und praktisches Vorgehen Antrittsvorlesung zum Abschluss des Habilitationsverfahrens an der Universität Ulm Franz F. Wagner Abt. Transfusionsmedizin, Universitätsklinikum
Transfusionsmedizin Grundlagen und praktisches Vorgehen Antrittsvorlesung zum Abschluss des Habilitationsverfahrens an der Universität Ulm Franz F. Wagner Abt. Transfusionsmedizin, Universitätsklinikum
Sicherheit von Medizinprodukten. Vigilanzsystem und Meldepflichten
 Sicherheit von Medizinprodukten Vigilanzsystem und Meldepflichten Dr. Reinhard Berger PharmMed Austria Institut Medizinprodukte & Haemovigilanz 5. Mai 2007 Disclaimer: Die Inhalte dieses Vortrages sind
Sicherheit von Medizinprodukten Vigilanzsystem und Meldepflichten Dr. Reinhard Berger PharmMed Austria Institut Medizinprodukte & Haemovigilanz 5. Mai 2007 Disclaimer: Die Inhalte dieses Vortrages sind
Österreichische Gesellschaft für Blutgruppenserologie, Transfusionsmedizin, regenerative Medizin und Immungenetik Hersteller Statistik: 2006 2009
 Österreichische Gesellschaft für Blutgruppenserologie, Transfusionsmedizin, regenerative Medizin und Immungenetik Hersteller Statistik: 2006 2009 Prim. i.r. Univ.-Prof. Dr. Barbara Blauhut Hersteller Statistik:
Österreichische Gesellschaft für Blutgruppenserologie, Transfusionsmedizin, regenerative Medizin und Immungenetik Hersteller Statistik: 2006 2009 Prim. i.r. Univ.-Prof. Dr. Barbara Blauhut Hersteller Statistik:
Klinische Prüfung für Medizinprodukte und Leistungsbewertungsprüfungen für In-Vitro-Diagnostika in Österreich: Statistik 2018
 Klinische Prüfung für Medizinprodukte und Leistungsbewertungsprüfungen für In-Vitro-Diagnostika in Österreich: Statistik 2018 Abteilung Klinische Prüfung (CLTR) Die Tradition des jährlichen Newsletters
Klinische Prüfung für Medizinprodukte und Leistungsbewertungsprüfungen für In-Vitro-Diagnostika in Österreich: Statistik 2018 Abteilung Klinische Prüfung (CLTR) Die Tradition des jährlichen Newsletters
Time-to-onset bei Transfusionsreaktionen
 Haemovigilance Workshop Bern, 26. Oktober 215 Time-to-onset bei Transfusionsreaktionen Lorenz Amsler, Markus Jutzi, Clinical Reviewer Haemovigilance, Abteilung Arzneimittelsicherheit Swissmedic Schweizerisches
Haemovigilance Workshop Bern, 26. Oktober 215 Time-to-onset bei Transfusionsreaktionen Lorenz Amsler, Markus Jutzi, Clinical Reviewer Haemovigilance, Abteilung Arzneimittelsicherheit Swissmedic Schweizerisches
Kapitel 23 A: Vigilanz
 REFERENZEN Bundesgesetz über Arzneimittel und Medizinprodukte (HMG) - Art. 59 Verordnung über die Bewilligungen im Arzneimittelbereich (AMBV) - Art. 16 und Art. 25 Verordnung über die Arzneimittel (VAM)
REFERENZEN Bundesgesetz über Arzneimittel und Medizinprodukte (HMG) - Art. 59 Verordnung über die Bewilligungen im Arzneimittelbereich (AMBV) - Art. 16 und Art. 25 Verordnung über die Arzneimittel (VAM)
Erfahrungen mit dem Hämovigilanzsystem aus Sicht des Qualitätsbeauftragten eines Universitätsklinikums
 Erfahrungen mit dem Hämovigilanzsystem aus Sicht des Qualitätsbeauftragten eines Universitätsklinikums Prof. Dr. Robert Zimmermann Transfusionsmedizinische und Hämostaseologische Abteilung Universitätsklinikum
Erfahrungen mit dem Hämovigilanzsystem aus Sicht des Qualitätsbeauftragten eines Universitätsklinikums Prof. Dr. Robert Zimmermann Transfusionsmedizinische und Hämostaseologische Abteilung Universitätsklinikum
Inhaltsverzeichnis. Vorwort Einleitung 1
 Vorwort V Einleitung 1 Erster Teil: Unionsrecht als ursprüngliche Quelle gewebesicherheitsrechtlicher Vorschriften 3 I. Kompetenzfrage 3 A. Ist Art AEUV 152 EGV) eine taugliche Kompetenzgrundlage für die
Vorwort V Einleitung 1 Erster Teil: Unionsrecht als ursprüngliche Quelle gewebesicherheitsrechtlicher Vorschriften 3 I. Kompetenzfrage 3 A. Ist Art AEUV 152 EGV) eine taugliche Kompetenzgrundlage für die
Internes Meldesystem Erfahrungen des Universitätsspitals Genf (HUG)
 Internes Meldesystem Erfahrungen des Universitätsspitals Genf (HUG) Universitätsspital Genf Abteilung Hämatologie Haemovigilance Dr. Loredana Pizzi Bosman Haemovigilance-Verantwortliche HUG Bern, 11. September
Internes Meldesystem Erfahrungen des Universitätsspitals Genf (HUG) Universitätsspital Genf Abteilung Hämatologie Haemovigilance Dr. Loredana Pizzi Bosman Haemovigilance-Verantwortliche HUG Bern, 11. September
Risiken der Transfusion von Blut und Blutprodukten
 Risiken der Transfusion von Blut und Blutprodukten Volker Kretschmer Institut für Transfusionsmedizin und Hämostaseologie, Universitätsklinikum Marburg Blut und Blutprodukte 1 Blut und Blutkomponenten
Risiken der Transfusion von Blut und Blutprodukten Volker Kretschmer Institut für Transfusionsmedizin und Hämostaseologie, Universitätsklinikum Marburg Blut und Blutprodukte 1 Blut und Blutkomponenten
Inhalt. Vorstellung. Historisches. Rechtliche Grundlagen. Meldung von Nebenwirkungen. Kontaktangaben
 Inhalt Vorstellung Historisches Rechtliche Grundlagen Meldung von Nebenwirkungen Kontaktangaben 2 Wer sind wir Institut Pharmakovigilanz Gruppe KIVE (Kommunikation, Implementierung und Veterinär) 3 Definition
Inhalt Vorstellung Historisches Rechtliche Grundlagen Meldung von Nebenwirkungen Kontaktangaben 2 Wer sind wir Institut Pharmakovigilanz Gruppe KIVE (Kommunikation, Implementierung und Veterinär) 3 Definition
BUNDESGESETZBLATT FÜR DIE REPUBLIK ÖSTERREICH
 1 von 7 BUNDESGESETZBLATT FÜR DIE REPUBLIK ÖSTERREICH Jahrgang 2011 Ausgegeben am 15. September 2011 Teil II 311. Verordnung: Änderung der Verordnung betreffend Arzneimittel aus menschlichem Blut [CELEX-Nr.:
1 von 7 BUNDESGESETZBLATT FÜR DIE REPUBLIK ÖSTERREICH Jahrgang 2011 Ausgegeben am 15. September 2011 Teil II 311. Verordnung: Änderung der Verordnung betreffend Arzneimittel aus menschlichem Blut [CELEX-Nr.:
ISBT 128. Eine international einheitliches Kennzeichnungssystem für r Blutprodukte
 ISBT 128 Eine international einheitliches Kennzeichnungssystem für r Blutprodukte Schulungsunterlagen zur Umstellung auf die Kennzeichnungsnorm für f r Blutprodukte C. Jungbauer ÖRK, 2007 Rechtliche Grundlagen
ISBT 128 Eine international einheitliches Kennzeichnungssystem für r Blutprodukte Schulungsunterlagen zur Umstellung auf die Kennzeichnungsnorm für f r Blutprodukte C. Jungbauer ÖRK, 2007 Rechtliche Grundlagen
Medizinprodukte-Branche für den Erhalt des Forschungsstandortes Österreich
 Medizinprodukte-Branche für den Erhalt des Forschungsstandortes Österreich AUSTROMED ist die Interessensvertretung von Unternehmen, die in der Entwicklung, der Produktion, Instandhaltung, Aufbereitung
Medizinprodukte-Branche für den Erhalt des Forschungsstandortes Österreich AUSTROMED ist die Interessensvertretung von Unternehmen, die in der Entwicklung, der Produktion, Instandhaltung, Aufbereitung
OFIS-Schulungsunterlage
 OFIS-Schulungsunterlage OFIS-Termin vom 16.11.2018, 9:30 13:00 Uhr in Linz Johann Hummel und Angelika Gaschler OFIS-Salzburg und Geschäftsstelle gemäß 5 EU-QuaDG Vorgabedokumente VA, Formulare VA Informationsaustausch
OFIS-Schulungsunterlage OFIS-Termin vom 16.11.2018, 9:30 13:00 Uhr in Linz Johann Hummel und Angelika Gaschler OFIS-Salzburg und Geschäftsstelle gemäß 5 EU-QuaDG Vorgabedokumente VA, Formulare VA Informationsaustausch
QUALITÄTS- UND SICHERHEITSANFORDERUNGEN AN BLUT UND BLUTBESTANDTEILE 1. BLUTBESTANDTEILE. 1.5 Erythrozyten, buffy-coat-frei, in Additivlösung
 BGBl. II Ausgegeben am 22. Juni 2005 Nr. 187 1 von 7 QUALITÄTS- UND SICHERHEITSANFORDERUNGEN AN BLUT UND BLUTBESTANDTEILE 1. BLUTBESTANDTEILE Anhang A 1. Erythrozytenzubereitungen Die unter 1.1 bis 1.8
BGBl. II Ausgegeben am 22. Juni 2005 Nr. 187 1 von 7 QUALITÄTS- UND SICHERHEITSANFORDERUNGEN AN BLUT UND BLUTBESTANDTEILE 1. BLUTBESTANDTEILE Anhang A 1. Erythrozytenzubereitungen Die unter 1.1 bis 1.8
Hämovigilanz: Beteiligte, Meldeinhalte, Ergebnisse
 Hämovigilanz: Beteiligte, Meldeinhalte, Ergebnisse Margarethe Heiden, Birgit Haschberger, Janina Hesse, Annette Graul, Brigitte Keller- Stanislawski Paul-Ehrlich-Institut 63225 Langen GERMANY http://www.pei.de
Hämovigilanz: Beteiligte, Meldeinhalte, Ergebnisse Margarethe Heiden, Birgit Haschberger, Janina Hesse, Annette Graul, Brigitte Keller- Stanislawski Paul-Ehrlich-Institut 63225 Langen GERMANY http://www.pei.de
USUTU-VIRUS. AGES - Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH
 USUTU-VIRUS AGES - Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH www.ages.at WAS IST DAS USUTU-VIRUS? Das Usutu-Virus ist ein Flavivirus und gehört zum Antigenkomplex des Japan-Enzephalitis
USUTU-VIRUS AGES - Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH www.ages.at WAS IST DAS USUTU-VIRUS? Das Usutu-Virus ist ein Flavivirus und gehört zum Antigenkomplex des Japan-Enzephalitis
GVP Module VIII Post-authorisation safety studies
 GVP Module VIII Post-authorisation safety studies Dr. Susanne Wolf Institut für Pharmakovigilanz AGES - Gespräche Wien, 26.04.2012 Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH Guideline
GVP Module VIII Post-authorisation safety studies Dr. Susanne Wolf Institut für Pharmakovigilanz AGES - Gespräche Wien, 26.04.2012 Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH Guideline
DAS BLUTPRODUKT PLASMA. Peter Hellstern Institut für Hämostaseologie und Transfusionsmedizin Klinikum Ludwigshafen
 DAS BLUTPRODUKT PLASMA Peter Hellstern Institut für Hämostaseologie und Transfusionsmedizin Klinikum Ludwigshafen Conflicts of interest - nö 7 Plasmatypen GFP, FFP LyoPlas N OctaplasLG Uniplas TheraflexMB
DAS BLUTPRODUKT PLASMA Peter Hellstern Institut für Hämostaseologie und Transfusionsmedizin Klinikum Ludwigshafen Conflicts of interest - nö 7 Plasmatypen GFP, FFP LyoPlas N OctaplasLG Uniplas TheraflexMB
Bericht des Rechnungshofes
 Bericht des Rechnungshofes Blutversorgung durch die Universitätsklinik für Blutgruppenserologie und Transfusionsmedizin in Wien; Follow up Überprüfung Wien 2014/2 3 4 Wien 2014/2 Inhalt Inhaltsverzeichnis
Bericht des Rechnungshofes Blutversorgung durch die Universitätsklinik für Blutgruppenserologie und Transfusionsmedizin in Wien; Follow up Überprüfung Wien 2014/2 3 4 Wien 2014/2 Inhalt Inhaltsverzeichnis
Die Mitteilungspflicht gemäß 109 a EStG
 Quick NEWS (19. JÄNNER 2009) Die Mitteilungspflicht gemäß 109 a EStG Das EStG sieht im 109 a eine kalenderjahrbezogene Mitteilungsverpflichtung für bestimmte Leistungen vor. Wer muss melden? Jeder Unternehmer
Quick NEWS (19. JÄNNER 2009) Die Mitteilungspflicht gemäß 109 a EStG Das EStG sieht im 109 a eine kalenderjahrbezogene Mitteilungsverpflichtung für bestimmte Leistungen vor. Wer muss melden? Jeder Unternehmer
Pro und Contra: Eigen- vs. Fremdblut bei elektiven orthopädischen Eingriffen
 Pro und Contra: Eigen- vs. Fremdblut bei elektiven orthopädischen Eingriffen Dietrich G., Biscoping J. PD Dr. Gerald Dietrich Chefarzt der Anästhesie-Abteilung Kreiskrankenhaus Simonsöder Allee 20 84307
Pro und Contra: Eigen- vs. Fremdblut bei elektiven orthopädischen Eingriffen Dietrich G., Biscoping J. PD Dr. Gerald Dietrich Chefarzt der Anästhesie-Abteilung Kreiskrankenhaus Simonsöder Allee 20 84307
Haemovigilance Jahresbericht 2008
 Haemovigilance Jahresbericht 2008 Herbst 2009 1 Haemovigilance- Bericht 2008 Der Jahresbericht wurde erstellt durch: Med. pract. Morven Rüesch und Dr. med. Markus Jutzi Clinical Reviewer Haemovigilance/Swissmedic
Haemovigilance Jahresbericht 2008 Herbst 2009 1 Haemovigilance- Bericht 2008 Der Jahresbericht wurde erstellt durch: Med. pract. Morven Rüesch und Dr. med. Markus Jutzi Clinical Reviewer Haemovigilance/Swissmedic
L 256/32 Amtsblatt der Europäischen Union
 L 256/32 Amtsblatt der Europäischen Union 1.10.2005 RICHTLINIE 2005/61/EG DER KOMMISSION vom 30. September 2005 zur Durchführung der Richtlinie 2002/98/EG des Europäischen Parlaments und des Rates in Bezug
L 256/32 Amtsblatt der Europäischen Union 1.10.2005 RICHTLINIE 2005/61/EG DER KOMMISSION vom 30. September 2005 zur Durchführung der Richtlinie 2002/98/EG des Europäischen Parlaments und des Rates in Bezug
Leitfaden für die Qualitätssicherung in der Transfusionspraxis: Vorbereitung und Durchführung auf Station
 Haemovigilance Workshop Bern, 20. März 2017 Leitfaden für die Qualitätssicherung in der Transfusionspraxis: Vorbereitung und Durchführung auf Station Lorenz Amsler,, Clinical Reviewer, Abteilung Arzneimittelsicherheit
Haemovigilance Workshop Bern, 20. März 2017 Leitfaden für die Qualitätssicherung in der Transfusionspraxis: Vorbereitung und Durchführung auf Station Lorenz Amsler,, Clinical Reviewer, Abteilung Arzneimittelsicherheit
Qualitätsbericht Hämotherapie. Dokumentationsbogen (Berichtsjahr 2018)
 Qualitätssicherung Hämotherapie Qualitätsbericht Hämotherapie Dokumentationsbogen (Berichtshr 2018) (einzureichen bis zum 1. März 2019 an die Landesärztekammer und zeitgleich an die Leitung der Einrichtung)
Qualitätssicherung Hämotherapie Qualitätsbericht Hämotherapie Dokumentationsbogen (Berichtshr 2018) (einzureichen bis zum 1. März 2019 an die Landesärztekammer und zeitgleich an die Leitung der Einrichtung)
// HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS //
 // HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2015 Auswertung der Meldungen von schwerwiegenden Reaktionen und Zwischenfällen nach 63i AMG // Impressum // Herausgeber Paul-Ehrlich-Institut (PEI,
// HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2015 Auswertung der Meldungen von schwerwiegenden Reaktionen und Zwischenfällen nach 63i AMG // Impressum // Herausgeber Paul-Ehrlich-Institut (PEI,
// HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2011/12. Auswertung der Meldungen von schwerwiegenden Transfusionsreaktionen nach 63 c AMG
 // HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2011/12 Auswertung der Meldungen von schwerwiegenden Transfusionsreaktionen nach 63 c AMG // Impressum // Herausgeber Paul-Ehrlich-Institut (PEI, Langen)
// HÄMOVIGILANZ-BERICHT DES PAUL-EHRLICH-INSTITUTS // 2011/12 Auswertung der Meldungen von schwerwiegenden Transfusionsreaktionen nach 63 c AMG // Impressum // Herausgeber Paul-Ehrlich-Institut (PEI, Langen)
Bedeutung der Norm EN ISO GCP für Medizinprodukte in der Praxis -
 Bedeutung der Norm EN ISO 14155 - GCP für Medizinprodukte in der Praxis - Dr. Violetta Zmuda AGES MEA, Institut Überwachung, Abteilung Klinische Prüfung violetta.zmuda@ages.at AGES-Gespräch Wien, 12. Oktober
Bedeutung der Norm EN ISO 14155 - GCP für Medizinprodukte in der Praxis - Dr. Violetta Zmuda AGES MEA, Institut Überwachung, Abteilung Klinische Prüfung violetta.zmuda@ages.at AGES-Gespräch Wien, 12. Oktober
Marktzugang - Vigilanz und PMS
 Marktzugang - Vigilanz und PMS Dr. Reinhard Berger Institut Inspektionen, Medizinprodukte & Hämovigilanz AGES Medizinmarktaufsicht 2012 07.03.2012 Disclaimer: Die Inhalte dieses Vortrages sind die Privatmeinung
Marktzugang - Vigilanz und PMS Dr. Reinhard Berger Institut Inspektionen, Medizinprodukte & Hämovigilanz AGES Medizinmarktaufsicht 2012 07.03.2012 Disclaimer: Die Inhalte dieses Vortrages sind die Privatmeinung
Erythrozytensubstitution M.Neuss Quelle: UptoDate 14.1 (4.2006)
 Erythrozytensubstitution 2006 M.Neuss Quelle: UptoDate 14.1 (4.2006) Physiologie Sauerstoffangebot DO 2 = kardialer Output * O 2 -Gehalt O 2 -Gehalt gelöst Hämoglobin-gebunden DO 2 = kardialer Output *
Erythrozytensubstitution 2006 M.Neuss Quelle: UptoDate 14.1 (4.2006) Physiologie Sauerstoffangebot DO 2 = kardialer Output * O 2 -Gehalt O 2 -Gehalt gelöst Hämoglobin-gebunden DO 2 = kardialer Output *
AW-Merkblatt Klassierung und Abklärung von Transfusionsreaktionen
 Hämolytische Transfusionsreaktion (HTR) Auftreten von Zeichen eines gesteigerten Erythrozytenabbaus nach Transfusion in Klinik und/oder Labor. Ursache: Immunologische Inkompatibilität zwischen Spender
Hämolytische Transfusionsreaktion (HTR) Auftreten von Zeichen eines gesteigerten Erythrozytenabbaus nach Transfusion in Klinik und/oder Labor. Ursache: Immunologische Inkompatibilität zwischen Spender
Das EPDG tritt in Kraft. Und jetzt?
 Das EPDG tritt in Kraft. Und jetzt? 9. März 2017 Dr. Stefan Spycher Digitalisierung Wir rücken ins Zentrum Kommentieren auf News-Portalen ebanking Online- Reisebuchung Online-Einkaufen Gesundheitswesen
Das EPDG tritt in Kraft. Und jetzt? 9. März 2017 Dr. Stefan Spycher Digitalisierung Wir rücken ins Zentrum Kommentieren auf News-Portalen ebanking Online- Reisebuchung Online-Einkaufen Gesundheitswesen
Praxisbeispiel Wirkungsorientierung in der AGES
 Praxisbeispiel Wirkungsorientierung in der AGES Mag. Wolfgang Hermann Geschäftsführer Wirkungsorientierte Steuerung und Wirkungserfassung in der öffentlichen Verwaltung Berlin, 23. Januar 2015 Österreichische
Praxisbeispiel Wirkungsorientierung in der AGES Mag. Wolfgang Hermann Geschäftsführer Wirkungsorientierte Steuerung und Wirkungserfassung in der öffentlichen Verwaltung Berlin, 23. Januar 2015 Österreichische
Erythrozytentransfusion, kritische Indikationsstellung
 Klinik für Anästhesiologie, Intensiv-, Notfall-, Transfusionsmedizin und Schmerztherapie (Bethel) Prof. Dr. med. F. Mertzlufft Erythrozytentransfusion, kritische Indikationsstellung Dr. med. K. Leimkühler
Klinik für Anästhesiologie, Intensiv-, Notfall-, Transfusionsmedizin und Schmerztherapie (Bethel) Prof. Dr. med. F. Mertzlufft Erythrozytentransfusion, kritische Indikationsstellung Dr. med. K. Leimkühler
Applikation. gegeben von / bis. Anlage 1
 BERICHT ÜBER UNERWÜNSCHTE ARZNEIMITTELWIRKUNGEN (auch Verdachtsfälle) Bundesinstitut für Arzneimittel und Medizinprodukte, Kurt-Georg-Kiesinger-Allee 3, 53175 Bonn, Tel.: 0228/207-30, FAX: 0228/207-5207
BERICHT ÜBER UNERWÜNSCHTE ARZNEIMITTELWIRKUNGEN (auch Verdachtsfälle) Bundesinstitut für Arzneimittel und Medizinprodukte, Kurt-Georg-Kiesinger-Allee 3, 53175 Bonn, Tel.: 0228/207-30, FAX: 0228/207-5207
Qualitätsbericht Hämotherapie
 Qualitätssicherung Hämotherapie Qualitätsbericht Hämotherapie Berichtszeitraum 20 Vorlage für den Qualitätsbericht gemäß Abschnitt 6.4.2.3 der Richtlinien zur Gewinnung von Blut und Blutbestandteilen und
Qualitätssicherung Hämotherapie Qualitätsbericht Hämotherapie Berichtszeitraum 20 Vorlage für den Qualitätsbericht gemäß Abschnitt 6.4.2.3 der Richtlinien zur Gewinnung von Blut und Blutbestandteilen und
Aktuelles zu Neuartigen Therapien (ATMPs)
 Aktuelles zu Neuartigen Therapien (ATMPs) I. Reischl, PhD Institut Überwachung AGES/MEA Traisengasse 5, 1200 Wien Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH Themen Klassifizierung
Aktuelles zu Neuartigen Therapien (ATMPs) I. Reischl, PhD Institut Überwachung AGES/MEA Traisengasse 5, 1200 Wien Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH Themen Klassifizierung
AGES Medizinmarktaufsicht (MEA) steht für sichere und wirksame Arzneimittel und Medizinprodukte ein Überblick des Aufgabenbereichs
 AGES Medizinmarktaufsicht (MEA) steht für sichere und wirksame Arzneimittel und Medizinprodukte ein Überblick des Aufgabenbereichs DI., Dr. Christa Wirthumer-Hoche Geschäftsfeldleiterin AGES Medizinmarktaufsicht
AGES Medizinmarktaufsicht (MEA) steht für sichere und wirksame Arzneimittel und Medizinprodukte ein Überblick des Aufgabenbereichs DI., Dr. Christa Wirthumer-Hoche Geschäftsfeldleiterin AGES Medizinmarktaufsicht
September 2017 Version 2-0
 September 207 Version 2-0 Haemovigilance Jahresbericht 206 Der Jahresbericht wurde erstellt durch Swissmedic, Schweizerisches Heilmittelinstitut Abteilung Arzneimittelsicherheit Einheit Haemovigilance
September 207 Version 2-0 Haemovigilance Jahresbericht 206 Der Jahresbericht wurde erstellt durch Swissmedic, Schweizerisches Heilmittelinstitut Abteilung Arzneimittelsicherheit Einheit Haemovigilance
IAKH. Meldeauswertung des IAKH-Fehlerregisters. Fehlerregisterformular IAKH 2014 vs.1.1. Transfusionszwischenfall auf Normalstation
 Meldeauswertung des IAKH-Fehlerregisters IAKH in Zusammenarbeit mit der DIVI und dem CIRSmedical Anästhesiologie von BDA/DGAI und ÄZQ Meldung über IAKH Fehlerregister CIRSmedical AINS von BDA/DGAI und
Meldeauswertung des IAKH-Fehlerregisters IAKH in Zusammenarbeit mit der DIVI und dem CIRSmedical Anästhesiologie von BDA/DGAI und ÄZQ Meldung über IAKH Fehlerregister CIRSmedical AINS von BDA/DGAI und
Akute hämolytische TR. Schmerzen in der Nierengegend Hypotonie Übelkeit, Erbrechen RR-Abfall Blutiger Urin (auch bei Schock) Nierenversagen Schock
 Patient 73 Jahre Hüftendoprothesen OP Postoperative Nachblutung, Notfall-OP Hämorrhagischer Schock, Notfalltransfusion Nach 3 EK, Blutdruckabfall, Temperaturanstieg um 2 C Blutiger Urin Akute hämolytische
Patient 73 Jahre Hüftendoprothesen OP Postoperative Nachblutung, Notfall-OP Hämorrhagischer Schock, Notfalltransfusion Nach 3 EK, Blutdruckabfall, Temperaturanstieg um 2 C Blutiger Urin Akute hämolytische
Label und Off-Label Use von Medikamenten bei Kindern und Jugendlichen in Österreich
 Label und Off-Label Use von Medikamenten bei Kindern und Jugendlichen in Österreich AGES Gespräch 04.10.2007 Dr. Doris Tschabitscher AGES PharmMed, National Contact Point Paediatrics Erkenntnis Kinder
Label und Off-Label Use von Medikamenten bei Kindern und Jugendlichen in Österreich AGES Gespräch 04.10.2007 Dr. Doris Tschabitscher AGES PharmMed, National Contact Point Paediatrics Erkenntnis Kinder
Klinische Prüfungen: Statistik 2017
 BASG / AGES Institut Überwachung/Abteilung Klinische Prüfung Traisengasse 5, 1200 Wien, Österreich Klinische Prüfungen: Statistik 2017 Aktuelle Statistik der Klinischen Prüfung für Arzneimittel in Österreich
BASG / AGES Institut Überwachung/Abteilung Klinische Prüfung Traisengasse 5, 1200 Wien, Österreich Klinische Prüfungen: Statistik 2017 Aktuelle Statistik der Klinischen Prüfung für Arzneimittel in Österreich
Ausgabe 2. Quartal 2010
 Ausgabe 2. Quartal 2010 Aktuelles Poliomyelitis in Tadschikistan Keine Gefahr für Österreich Seit 2002 ist die WHO-EURO-Region als Polio-frei zertifiziert. Im Mai 2010 berichtete nun die WHO von einem
Ausgabe 2. Quartal 2010 Aktuelles Poliomyelitis in Tadschikistan Keine Gefahr für Österreich Seit 2002 ist die WHO-EURO-Region als Polio-frei zertifiziert. Im Mai 2010 berichtete nun die WHO von einem
Erfahrungen mit der neuen Variation Regulation
 Erfahrungen mit der neuen Variation Regulation Angela Schütz, Alexandra Beranek AGES PharmMed, Institut Zulassung & Lifecycle Management AGES Gespräch Am Pulsschlag des Arzneimittelwesens Das Institut
Erfahrungen mit der neuen Variation Regulation Angela Schütz, Alexandra Beranek AGES PharmMed, Institut Zulassung & Lifecycle Management AGES Gespräch Am Pulsschlag des Arzneimittelwesens Das Institut
GlucoChat und SMARTY: Verschlüsselte Gruppenkommunikation zwischen Leistungserbringern, Patienten und Angehörigen
 GlucoChat und SMARTY: Verschlüsselte Gruppenkommunikation zwischen Leistungserbringern, Patienten und Angehörigen 3. Bayerischer Tag der Telemedizin, 25. März 2015 Dr. Guido W. Weber, careon GmbH careon
GlucoChat und SMARTY: Verschlüsselte Gruppenkommunikation zwischen Leistungserbringern, Patienten und Angehörigen 3. Bayerischer Tag der Telemedizin, 25. März 2015 Dr. Guido W. Weber, careon GmbH careon
Leitfaden für die QS in der Transfusionspraxis Erste Erfahrungen bei der Umsetzung im Inselspital
 Leitfaden für die QS in der Transfusionspraxis Erste Erfahrungen bei der Umsetzung im Inselspital Behrouz Mansouri Taleghani Universitätsklinik für Hämatologie und Hämatologisches Zentrallabor Bereich
Leitfaden für die QS in der Transfusionspraxis Erste Erfahrungen bei der Umsetzung im Inselspital Behrouz Mansouri Taleghani Universitätsklinik für Hämatologie und Hämatologisches Zentrallabor Bereich
Meldung von Serious Adverse Events (SAE) innerhalb von klinischen Studien
 Meldung von Serious Adverse Events (SAE) innerhalb von klinischen Studien Marga Lang-Welzenbach Strahlenklinik Warum dieses Thema beim Studientreffen? Ethikkommissionen empfehlen einen Qualifikationsnachweis
Meldung von Serious Adverse Events (SAE) innerhalb von klinischen Studien Marga Lang-Welzenbach Strahlenklinik Warum dieses Thema beim Studientreffen? Ethikkommissionen empfehlen einen Qualifikationsnachweis
Lumpy Skin Disease (LSD)
 Lumpy Skin Disease (LSD) Archiv der ADNS-Meldungen 2016 Berichtszeitraum: 2016-01-01 bis 2016-12-31 Stand: 2017-07-10 AGES DSR Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH www.ages.at
Lumpy Skin Disease (LSD) Archiv der ADNS-Meldungen 2016 Berichtszeitraum: 2016-01-01 bis 2016-12-31 Stand: 2017-07-10 AGES DSR Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH www.ages.at
HEIZWERTE HANDELSÜBLICHER ENERGIEHOLZSORTIMENTE
 HEIZWERTE HANDELSÜBLICHER ENERGIEHOLZSORTIMENTE -- 2 -- IMPRESSUM Das Programm energieholz ist Teil der Klimaschutzinitiative klimaaktiv des Bundesministeriums für Land- und Forstwirtschaft, Umwelt und
HEIZWERTE HANDELSÜBLICHER ENERGIEHOLZSORTIMENTE -- 2 -- IMPRESSUM Das Programm energieholz ist Teil der Klimaschutzinitiative klimaaktiv des Bundesministeriums für Land- und Forstwirtschaft, Umwelt und
Anlage V zum 2. Kapitel VerfO
 Formular zur Übermittlung von Informationen über den Stand der wissenschaftlichen Erkenntnisse für die Bewertung einer neuen Untersuchungs- oder Behandlungsmethode mit Medizinprodukten hoher Risikoklasse
Formular zur Übermittlung von Informationen über den Stand der wissenschaftlichen Erkenntnisse für die Bewertung einer neuen Untersuchungs- oder Behandlungsmethode mit Medizinprodukten hoher Risikoklasse
Lumpy Skin Disease (LSD)
 Lumpy Skin Disease (LSD) Auswertung der ADNS-Meldungen seit 07/2016 Berichtszeitraum: 2016-07-01 bis 2017-06-25 Stand: 2017-06-26 AGES DSR Österreichische Agentur für Gesundheit und Ernährungssicherheit
Lumpy Skin Disease (LSD) Auswertung der ADNS-Meldungen seit 07/2016 Berichtszeitraum: 2016-07-01 bis 2017-06-25 Stand: 2017-06-26 AGES DSR Österreichische Agentur für Gesundheit und Ernährungssicherheit
CIRS-Netz Deutschland
 Aus Fehlern CIRSmedical lernen das der DGGG Krankenhaus- CIRS-Netz Deutschland Mögliche Kooperation zwischen DGGG und ÄZQ Barbara Hoffmann und Christina Gunkel Fehler vermeiden: Knackpunkt Kommunikation
Aus Fehlern CIRSmedical lernen das der DGGG Krankenhaus- CIRS-Netz Deutschland Mögliche Kooperation zwischen DGGG und ÄZQ Barbara Hoffmann und Christina Gunkel Fehler vermeiden: Knackpunkt Kommunikation
Massentransfusion (MT)
 Massentransfusion (MT) Fallbeispiel aus dem Jahr 1994, 15-jähriger Patient, Blutgruppe 0-neg. Mathies Andreas 2 Mathies Andreas 3 Diagnosen Ruptur des linken Leberlappens, Verschluss beider Nierenarterien,
Massentransfusion (MT) Fallbeispiel aus dem Jahr 1994, 15-jähriger Patient, Blutgruppe 0-neg. Mathies Andreas 2 Mathies Andreas 3 Diagnosen Ruptur des linken Leberlappens, Verschluss beider Nierenarterien,
plättchenreiches plasma (PRP)
 plättchenreiches plasma (PRP) effektive regeneration durch körpereigenes plasma Informationen für Patienten und Leistungssportler Die Selbstheilung effektiv ankurbeln Plättchenreiches Plasma was steckt
plättchenreiches plasma (PRP) effektive regeneration durch körpereigenes plasma Informationen für Patienten und Leistungssportler Die Selbstheilung effektiv ankurbeln Plättchenreiches Plasma was steckt
Infektiöse und nicht-infektiöse Transfusionskomplikationen
 Infektiöse und nicht-infektiöse Transfusionskomplikationen Christof Weinstock, Ulm DRK-Blutspendedienst Baden-Württemberg Hessen, Institut Ulm Institut für Klinische Transfusionsmedizin und Immungenetik
Infektiöse und nicht-infektiöse Transfusionskomplikationen Christof Weinstock, Ulm DRK-Blutspendedienst Baden-Württemberg Hessen, Institut Ulm Institut für Klinische Transfusionsmedizin und Immungenetik
Bauwirtschaft gewinnt an Schwung
 Im vorliegenden Spezialthema finden Sie eine detaillierte Darstellung Jänner 2017 eines aktuellen Arbeitsmarktthemas inklusive Grafiken und Tabellen. Monatlich aktuelle Kennzahlen in tabellarischer Form
Im vorliegenden Spezialthema finden Sie eine detaillierte Darstellung Jänner 2017 eines aktuellen Arbeitsmarktthemas inklusive Grafiken und Tabellen. Monatlich aktuelle Kennzahlen in tabellarischer Form
Inhalt des Leitfadens. Wo wird der neue Leitfaden zu finden sein?
 NEU! LEITFADEN Klinische Prüfung von Medizinprodukten (MP) und Leistungsbewertungsprüfung von In-vitro-Diagnostika (IVD) Einreichung und Durchführung Dr. med. Violetta Zmuda AGES MEA, Institut Überwachung,
NEU! LEITFADEN Klinische Prüfung von Medizinprodukten (MP) und Leistungsbewertungsprüfung von In-vitro-Diagnostika (IVD) Einreichung und Durchführung Dr. med. Violetta Zmuda AGES MEA, Institut Überwachung,
RECHNUNGSHOFBERICHT BLUTVERSORGUNG DURCH DIE UNIVERSITÄTSKLINIK FÜR BLUTGRUPPENSEROLOGIE UND TRANSFUSIONSMEDIZIN IN WIEN; FOLLOW UP ÜBERPRÜFUNG
 RECHNUNGSHOFBERICHT VORLAGE VOM 19. MÄRZ 2014 REIHE WIEN 2014/2 BLUTVERSORGUNG DURCH DIE UNIVERSITÄTSKLINIK FÜR BLUTGRUPPENSEROLOGIE UND TRANSFUSIONSMEDIZIN IN WIEN; FOLLOW UP ÜBERPRÜFUNG Seite 2 / 7 INHALTSVERZEICHNIS
RECHNUNGSHOFBERICHT VORLAGE VOM 19. MÄRZ 2014 REIHE WIEN 2014/2 BLUTVERSORGUNG DURCH DIE UNIVERSITÄTSKLINIK FÜR BLUTGRUPPENSEROLOGIE UND TRANSFUSIONSMEDIZIN IN WIEN; FOLLOW UP ÜBERPRÜFUNG Seite 2 / 7 INHALTSVERZEICHNIS
AGES-Gespräche Medizinprodukte Inspektionen von Herstellern
 1 AGES-Gespräche Medizinprodukte Inspektionen von Herstellern DI Meinrad Guggenbichler AGES PharmMed Institut Inspektionen, Medizinprodukte & Haemovigilanz Disclaimer: Die Inhalte dieses Vortrages sind
1 AGES-Gespräche Medizinprodukte Inspektionen von Herstellern DI Meinrad Guggenbichler AGES PharmMed Institut Inspektionen, Medizinprodukte & Haemovigilanz Disclaimer: Die Inhalte dieses Vortrages sind
Transfusionsmedizin. Urs Schanz Klinik für Hämatologie UniversitätsSpital Zürich
 Transfusionsmedizin Urs Schanz Klinik für Hämatologie UniversitätsSpital Zürich Inhalt der Transfusionsmedizin Herstellung, Lagerung, Bereitstellung und Verabreichung von Blutprodukten Erkennung und Behandlung
Transfusionsmedizin Urs Schanz Klinik für Hämatologie UniversitätsSpital Zürich Inhalt der Transfusionsmedizin Herstellung, Lagerung, Bereitstellung und Verabreichung von Blutprodukten Erkennung und Behandlung
Zeit für einen Wechsel? Widersprüche zwischen Klinikdaten und Meldungen an die Ärztekammer
 Zeit für einen Wechsel? Widersprüche zwischen Klinikdaten und Meldungen an die Ärztekammer Überwachung der Qualitätssicherungssysteme nach den Hämotherapierichtlinien 6. Erfahrungsaustausch für Qualitätsbeauftragte
Zeit für einen Wechsel? Widersprüche zwischen Klinikdaten und Meldungen an die Ärztekammer Überwachung der Qualitätssicherungssysteme nach den Hämotherapierichtlinien 6. Erfahrungsaustausch für Qualitätsbeauftragte
