Die 3 Stoffklassen der Elemente
|
|
|
- Friederike Schulze
- vor 7 Jahren
- Abrufe
Transkript
1 Die Art der Bindung hängt davon ab, wie stark die Atome ihre Valenzelektronen anziehen. Elektronegativität (Abb. 17, S. 114) Qualitative Angabe, wie stark die Atomrümpfe die Elektronen in der Valenzschale oder in einer Bindung anziehen. Bsp.: Li: EN = 1.0 : EN = 2.1 : EN = 2.5 F: EN = 4.0 schwache Anziehung starke Anziehung Die Elektronegativität hängt von der Ionisierungsenergie und von der Elektronenaffinität ab. 1 Wie verhält sich die EN im Periodensystem? Die 3 Stoffklassen der Elemente Atome unten links im PSE schwache Anziehung der Valenzelektronen Metall albmetall 2 Atome oben rechts im PSE starke Anziehung der Valenzelektronen Nichtmetalle 1
2 Polare Bindungen (Buch: Kap , S. 113 ff) O=O Br-Br - l-l N N unpolare / apolare Bindung? l? Partialladung δ 3 polare Bindungen Polarisierung Dipole Polare Bindungen δ+ l EN δ- Das bindende Elektronenpaar verschiebt sich zum Atom mit der höheren EN. Je grösser der EN-Unterschied ΔEN, umso polarer die Bindung ΔEN > 0.4 Polarität unpolar schwach polar polar 4 2
3 Kapitel 7: Polare Bindungen Moleküle mit mehreren polaren Bindungen: δ+ δ- O - + Ladungsschwerpunkte fallen nicht zusammen: Permanenter Dipol δ+ = δ- δ+ δ- O - + O Ladungsschwerpunkte fallen zusammen: Kein permanenter Dipol 5 Lesen Sie das Kapitel 7.4 Dipol-Moleküle Lösen Sie die Aufgabe A11 im Buch (Seite 115) 6 3
4 Aufgabe A11 7 Aufgabe A11 8 4
5 Wann ist ein Molekül ein Dipol? 1. at es polare Bindungen? Nein: kein Dipol Beispiele: O 2, 2 Falls Ja: 2. Ist die Ladung symmetrisch verteilt? Ja: kein Dipol (Ladungsschwerpunkte + und gleich) Beispiele: Br 4, O 2 Nein: Dipol Beispiele: 2 O, N 3 9 Die 3 zwischenmolekularen Kräfte Van der Waals - Kräfte Dipol-Kräfte Wasserstoffbrücken 10 5
6 7. Zwischenmolekulare Kräfte 7.1 Van-der-Waals-Kräfte Van-der-Waals-Kräfte: schwache Kräfte Kleine Bindungsenergie: kj/mol Starke Abstandsabhängigkeit (1/r 4 ) Johannes Diderik van der Waals ( ), niederländischer Physiker und Nobelpreisträger 1910, untersuchte die Anziehungskräfte, die zwischen Molekülen wirken. Diese zwischenmolekularen Kräfte, die so genannten Van-der-Waals-Kräfte, wurden später nach ihm benannt Van der Waals-Kräfte Siedepunkte von Edelgasen Atomgrösse Edelgase e (elium) Ne (Neon) Ar (Argon) Kr (Krypton) Siedetemp
7 7. Zwischenmolekulare Kräfte 7.1 Van der Waals-Kräfte Polarisierbarkeit von Atomen / Moleküle (Abb. 25, S. 116) Temporäre Verschiebung der Ladungsschwerpunkte e e e Ein Teilchen ist umso polarisierbarer, je mehr Elektronen es hat und je ausgedehnter das Elektronensystem ist. Temporäre und induzierte Dipole Zwischenmolekulare Kräfte 7.1 Van der Waals-Kräfte Stärke von Van-der-Waals-Kräften: starke Abstandsabhängigkeit (1/r 4 ) Grosse gemeinsame Oberfläche: starke v.d.w. Kräfte Kleine gemeinsame Oberfläche: schwache v.d.w Kräfte 14 7
8 7. Zwischenmolekulare Kräfte 7.2 Dipol-Wechselwirkungen 7.2 Dipol-Wechselwirkungen (Buch S. 116) Wirken zwischen permanenten Dipolen (Dipolmolekülen). Beruhen auf der gegenseitigen Anziehung der entgegengesetzt geladenen Pole. Die Dipole richten sich gegeneinander aus. Die relativ starken Dipol-Dipol-Kräfte hängen ab von: Polarität der Bindung (ΔEN) Molekülgestalt (Ladungsschwerpunkte) Wasserstoffbrücken (Buch S ) Die Siedetemperaturen von 2 O, N 3 und F sind deutlich höher als jene homologer Verbindungen. 16 8
9 Wasserstoffbrücken F F O N N N O O N Wasserstoffbrücken bilden sich zwischen den freien Elektronenwolken der Atome Fluor, Sauerstoff und Stickstoff und den -Atomen, die an diese Elemente gebunden sind, aus. Starke zwischenmolekulare Kraft à ca. 20 KJ/mol. 17 Schneekristalle Quelle: Snowrystals.com 18 9
10 Schneekristalle Quelle: Snowrystals.com 19 Struktur von Eis und Schnee interaktiv/jmoleis/ 20 10
11 Wasser Olivenöl fest flüssig flüssig fest 21 Wissenscha) Kultur Krea0vität Bildung 18g Schnee: Moleküle 22 Wissenscha) Kultur Krea0vität Bildung 11
12 1020 Temperaturabhängigkeit der Dichte von Eis und Wasser 1000 Dichte (kg/m 3 ) Temperatur ( ) 0 fest Temperatur ( ) 0 flüssig 4 flüssig 95 flüssig Dichte (kg/m 3 ) Vorgang anomal anomal normal 23 Aufgabe 1: Wie lassen sich die Dichteänderungen von Eis zu Wasser, sowie von Wasser zwischen 0 und 4 bzw. zwischen 4 und 95 erklären? a) Das Gitter bricht zusammen, Moleküle dringen in die ohlräume ein. b, c) Die Molekülverbände werden kleiner, mehr Moleküle in den ohlräumen. Die Teilchen bewegen sich schneller und driften auseinander
13 Anomalie des Wassers (Buch S ) Im Gegensatz zu den meisten Flüssigkeiten hat Wasser bei 0 die grössere Dichte als Eis bei 0. Flüssiges Wasser zeigt bei 4 sogar ein Dichtemaximum. Abb. 34, S. 120 Abb. 36, S Sommer erbst und Frühling Winter Eis Stagnation Zirkulation Stagnation Auswirkungen der Dichteanomalie in Seen 26 13
14 Oberflächenspannung des Wassers 27 Oberflächenspannung des Wassers im Teilchenmodell 28 14
15 Ein Molekül im Innern wird allseitig angezogen. Resultierende Kraft: 0 Ein Molekül an der Oberfläche erfährt eine senkrecht nach innen gerichtete Kraft. Wasser verhält sich, als hätte es eine gespannte, elastische aut. Die Oberflächenspannung einer Flüssigkeit ist umso grösser, je stärker die Kräfte zwischen den Stoffteilchen Die grosse Oberflächenspannung des Wassers bewirkt, dass Wassertropfen Kugelform annehmen flache Gegenstände mit Dichte > 1000 g/l auf dem Wasser schwimmen. 29 Bedeutung der Wasserstoffbrücken Räumliche Struktur von Proteinen und DNA (Abb. 68 S. 380, Abb. 76 S. 385) Reissfestigkeit von Fasern (z.b. Nylon) 30 15
16 7. Zwischenmolekulare Kräfte Links ScW 31 16
Polare Bindungen. Die Elektronen eines bindenden. Elektronenpaares sind in Wirklichkeit eher zwei Elektronen, die sich mehrheitlich
 Moleküle Polare Bindungen Die Elektronen eines bindenden (gemeinsamen) Elektronenpaares sind in Wirklichkeit eher zwei Elektronen, die sich mehrheitlich zwischen den beiden Atomkernen der Bindungspartner
Moleküle Polare Bindungen Die Elektronen eines bindenden (gemeinsamen) Elektronenpaares sind in Wirklichkeit eher zwei Elektronen, die sich mehrheitlich zwischen den beiden Atomkernen der Bindungspartner
Kovalenzbindungen und zwischenmolekulare Kräfte
 Chemie Kovalenzbindungen und zwischenmolekulare Kräfte Zusammenfassungen Prüfung Donnerstag, 11. Mai 2017 _ Kovalenzbindungen 1 _ Elektronenpaar-Abstossungsmodell 2 _ Polare und apolare Bindungen 3 _ Dipolmoleküle
Chemie Kovalenzbindungen und zwischenmolekulare Kräfte Zusammenfassungen Prüfung Donnerstag, 11. Mai 2017 _ Kovalenzbindungen 1 _ Elektronenpaar-Abstossungsmodell 2 _ Polare und apolare Bindungen 3 _ Dipolmoleküle
Gruppenarbeit : Zwischenmolekulare Kräfte
 Expertengruppe A Zwischenmolekulare Kräfte Allgemeines Zwischenmolekulare Kräfte dürfen nicht mit der Kovalenzbindung verwechselt werden. Bei der Kovalenzbindung geht es um Kräfte innerhalb der Moleküle
Expertengruppe A Zwischenmolekulare Kräfte Allgemeines Zwischenmolekulare Kräfte dürfen nicht mit der Kovalenzbindung verwechselt werden. Bei der Kovalenzbindung geht es um Kräfte innerhalb der Moleküle
2.3 Intermolekulare Anziehungskräfte und Molekülkristalle
 2.3 Intermolekulare Anziehungskräfte und Molekülkristalle Kinetische Energie der Moleküle / Aggregatzustand Bau und Struktur der Moleküle Intermolekulare Anziehungskräfte Kräfte zwischen Molekülen Van-der-Waals-Kräfte
2.3 Intermolekulare Anziehungskräfte und Molekülkristalle Kinetische Energie der Moleküle / Aggregatzustand Bau und Struktur der Moleküle Intermolekulare Anziehungskräfte Kräfte zwischen Molekülen Van-der-Waals-Kräfte
10. Jahrgangsstufe Organische Chemie Skript Einführungsklasse
 4. Die Eigenschaften von Alkanen 4.1 Der Aggregatszustand bzw. die Siedetemperatur Der Aggregatszustand von Alkanen bei Raumtemperatur ist von der Siedetemperatur abhängig und steht in Zusammenhang mit
4. Die Eigenschaften von Alkanen 4.1 Der Aggregatszustand bzw. die Siedetemperatur Der Aggregatszustand von Alkanen bei Raumtemperatur ist von der Siedetemperatur abhängig und steht in Zusammenhang mit
Kinetische Energie der Moleküle / Aggregatzustand
 2.3 Intermolekulare Anziehungskräfte und Molekülkristalle Kräfte zwischen Molekülen - Van-der-Waals-Kräfte Orientierungskräfte bzw. Dipol-Dipol-Kräfte Induktionskräfte bzw. induzierte Dipole Dispersionskräfte
2.3 Intermolekulare Anziehungskräfte und Molekülkristalle Kräfte zwischen Molekülen - Van-der-Waals-Kräfte Orientierungskräfte bzw. Dipol-Dipol-Kräfte Induktionskräfte bzw. induzierte Dipole Dispersionskräfte
Posten 1a. Wie sieht das Kugelwolkenmodell aus von einem Sauerstoffatom? Antworten: a) (=> Posten 9o) b) (=> Posten 16l) c) (=> Posten 8k)
 Posten 1a Wie sieht das Kugelwolkenmodell aus von einem Sauerstoffatom? a) (=> Posten 9o) b) (=> Posten 16l) c) (=> Posten 8k) d) (=> Posten 13f) Posten 1d Welcher der beiden Stoffe hat den tieferen Siedepunkt?
Posten 1a Wie sieht das Kugelwolkenmodell aus von einem Sauerstoffatom? a) (=> Posten 9o) b) (=> Posten 16l) c) (=> Posten 8k) d) (=> Posten 13f) Posten 1d Welcher der beiden Stoffe hat den tieferen Siedepunkt?
Vom Atom zum Molekül
 Vom Atom zum Molekül Ionenverbindungen Na + Cl NaCl lebensgefährlich giftig lebensgefährlich giftig lebensessentiell Metall + Nichtmetall Salz Beispiel Natriumchlorid Elektronenkonfiguration: 11Na: 1s(2)
Vom Atom zum Molekül Ionenverbindungen Na + Cl NaCl lebensgefährlich giftig lebensgefährlich giftig lebensessentiell Metall + Nichtmetall Salz Beispiel Natriumchlorid Elektronenkonfiguration: 11Na: 1s(2)
2. Chemische Bindungen 2.1
 2. Chemische Bindungen 2.1 Chemische Bindungen Deutung von Mischungsversuchen Benzin und Wasser mischen sich nicht. Benzin ist somit eine hydrophobe Flüssigkeit. Auch die Siedepunkte der beiden Substanzen
2. Chemische Bindungen 2.1 Chemische Bindungen Deutung von Mischungsversuchen Benzin und Wasser mischen sich nicht. Benzin ist somit eine hydrophobe Flüssigkeit. Auch die Siedepunkte der beiden Substanzen
Aufgaben zu intermolekularen Kräften
 Aufgaben zu intermolekularen Kräften 1L ummerierung und Inhalte der gedruckten Version mit der Download-Version abgleichen! Evtl. gibt es Unterschiede. äufig enthält die Download-Version noch Bonusaufgaben.
Aufgaben zu intermolekularen Kräften 1L ummerierung und Inhalte der gedruckten Version mit der Download-Version abgleichen! Evtl. gibt es Unterschiede. äufig enthält die Download-Version noch Bonusaufgaben.
Bau der Metalle Eigenschaften plastisch verformbar elektrisch leitfähig hohe Siede- und Schmelztemperaturen
 Metallbindungen Bau der Metalle bestehen aus positiv geladene Atomrümpfe (= Atomkern und alle Elektrone auβer den Vallenzelektronen) + frei beweglichen Auβenelektronen Atomrümpfe sind sehr fest angeordnet
Metallbindungen Bau der Metalle bestehen aus positiv geladene Atomrümpfe (= Atomkern und alle Elektrone auβer den Vallenzelektronen) + frei beweglichen Auβenelektronen Atomrümpfe sind sehr fest angeordnet
Ionisierungsenergie und Elektronenaffinität. Bindigkeit Valenzstrichformel Molekülgeometrie
 Tendenzen im Periodensystem Ionisierungsenergie und Elektronenaffinität Atombindung (Elektronenpaarbindung) Bindigkeit Valenzstrichformel Molekülgeometrie Räumlicher Bau einfacher Moleküle Polare Atombindung
Tendenzen im Periodensystem Ionisierungsenergie und Elektronenaffinität Atombindung (Elektronenpaarbindung) Bindigkeit Valenzstrichformel Molekülgeometrie Räumlicher Bau einfacher Moleküle Polare Atombindung
Grundwissen 9.Klasse NTG 1 Grundwissen 9.Klasse NTG 1. Bsp.: Grundwissen 9.Klasse NTG 2 Grundwissen 9.Klasse NTG 2
 Grundwissen 9.Klasse NTG 1 Grundwissen 9.Klasse NTG 1 Die Stoffmenge n = 1mol ist die Stoffportion, die 6,022 10 23 Teilchen enthält. Die Stoffmenge n n(he) = 1 mol n(h 2 ) = 1 mol enthält 6,022 10 23
Grundwissen 9.Klasse NTG 1 Grundwissen 9.Klasse NTG 1 Die Stoffmenge n = 1mol ist die Stoffportion, die 6,022 10 23 Teilchen enthält. Die Stoffmenge n n(he) = 1 mol n(h 2 ) = 1 mol enthält 6,022 10 23
Learn4Med. Es gibt in der Chemie drei verschiedene Arten von Bindungen: Metallische Bindung: zwischen zwei Metallen, es entsteht ein Metall
 6. Chemische Bindung Es gibt in der Chemie drei verschiedene Arten von Bindungen: Metallische Bindung: zwischen zwei Metallen, es entsteht ein Metall Atombindung: zwischen zwei Nichtmetallen, es entsteht
6. Chemische Bindung Es gibt in der Chemie drei verschiedene Arten von Bindungen: Metallische Bindung: zwischen zwei Metallen, es entsteht ein Metall Atombindung: zwischen zwei Nichtmetallen, es entsteht
2.2 Intermolekulare Wechselwirkungen
 2.2 Intermolekulare Wechselwirkungen -15-2.2 Intermolekulare Wechselwirkungen Die Bildung der hier vorgestellten molekularen Aggregate beruht auf schwachen Wechselwirkungen zwischen Atomen oder Molekülen.
2.2 Intermolekulare Wechselwirkungen -15-2.2 Intermolekulare Wechselwirkungen Die Bildung der hier vorgestellten molekularen Aggregate beruht auf schwachen Wechselwirkungen zwischen Atomen oder Molekülen.
1/5. Symbol des Elements
 1/5 Wasser aus der Sicht der Chemie Das Wassermolekül Factsheet 1 Einführung Die Summenformel von Wasser 2 wurde vom italienischen Wissenschaftler Cannizzarro 1860 bestimmt. Sie bedeutet, dass ein Wasserteilchen
1/5 Wasser aus der Sicht der Chemie Das Wassermolekül Factsheet 1 Einführung Die Summenformel von Wasser 2 wurde vom italienischen Wissenschaftler Cannizzarro 1860 bestimmt. Sie bedeutet, dass ein Wasserteilchen
Zusammenfassung Prüfung Chemie vom
 Zusammenfassung Prüfung Chemie vom 27.10.10 Eigenheiten und Merkmale des Kugelwolkenmodells erklären können Ort und Zeit des Elektrons können nicht exakt bestimmt werden. Der Aufenthaltsort eines Elektrons
Zusammenfassung Prüfung Chemie vom 27.10.10 Eigenheiten und Merkmale des Kugelwolkenmodells erklären können Ort und Zeit des Elektrons können nicht exakt bestimmt werden. Der Aufenthaltsort eines Elektrons
VL 22 VL Homonukleare Moleküle VL Heteronukleare Moleküle VL Molekülschwingungen
 VL 22 VL 21 21.1. Homonukleare Moleküle VL 22 22.1. Heteronukleare Moleküle VL 23 23.1. Molekülschwingungen Wim de Boer, Karlsruhe Atome und Moleküle, 04.07.2013 1 Zum Mitnehmen Moleküle: Wellenfunktion
VL 22 VL 21 21.1. Homonukleare Moleküle VL 22 22.1. Heteronukleare Moleküle VL 23 23.1. Molekülschwingungen Wim de Boer, Karlsruhe Atome und Moleküle, 04.07.2013 1 Zum Mitnehmen Moleküle: Wellenfunktion
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Biologie Arbeitsblätter mit Lösungen - Biochemie
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Biologie Arbeitsblätter mit Lösungen - Biochemie Das komplette Material finden Sie hier: Download bei School-Scout.de B201 LÖSUNG:
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Biologie Arbeitsblätter mit Lösungen - Biochemie Das komplette Material finden Sie hier: Download bei School-Scout.de B201 LÖSUNG:
Chemie für Bauingenieure Uebung 2
 Chemie für Bauingenieure Uebung 2 Aufgabe 1 i. Bestimmen Sie mithilfe des Periodensystems für folgende Elemente die Anzahl Elektronen, Protonen und Neutronen. ii. Bestimmen Sie dann für die jeweiligen
Chemie für Bauingenieure Uebung 2 Aufgabe 1 i. Bestimmen Sie mithilfe des Periodensystems für folgende Elemente die Anzahl Elektronen, Protonen und Neutronen. ii. Bestimmen Sie dann für die jeweiligen
1. Vervollständigen Sie folgende Tabelle:
 Die Zwischenmolekularen Kräfte LÖSUG Seite 1 von 8 ÜBUGE 1. Vervollständigen Sie folgende Tabelle: e e Ar Kr Xe Elektronenzahl 2 10 18 36 54 Stärke der Van der Waals Kräfte nimmt in Pfeilrichtung zu Siede-
Die Zwischenmolekularen Kräfte LÖSUG Seite 1 von 8 ÜBUGE 1. Vervollständigen Sie folgende Tabelle: e e Ar Kr Xe Elektronenzahl 2 10 18 36 54 Stärke der Van der Waals Kräfte nimmt in Pfeilrichtung zu Siede-
Grundpraktikum für Biologen 2016
 Grundpraktikum für Biologen 2016 31.03.2016 Übersicht # 2 Kovalente Bindung Freies Elektronenpaar Einzelnes Elektron Oktett erfüllt Einzelne Chloratome haben einen Elektronenmangel Reaktion zu Cl 2 erfüllt
Grundpraktikum für Biologen 2016 31.03.2016 Übersicht # 2 Kovalente Bindung Freies Elektronenpaar Einzelnes Elektron Oktett erfüllt Einzelne Chloratome haben einen Elektronenmangel Reaktion zu Cl 2 erfüllt
Alkane. Name: Summenformel: vereinfachte Formel: Zustand: Methan CH 4 CH 4 g (gaseous) Ethan C 2 H 6 CH 3 CH 3 g. Propan C 3 H 8 CH 3 CH 2 CH 3 g
 Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
bestimmte mehratomige Anionen mit Sauerstoff werden mit dem lateinischen Namen benannt und enden auf at.
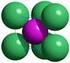 DIE BINDUNGSARTEN UND DAS PERIODENSYSTEM 1) IONISCHE VERBINDUNGEN SALZE Wenn die Atome Ionen bilden, haben sie meist die gleiche Elektronenzahl, wie das nächstgelegene neutrale Edelgas. Na bildet dann
DIE BINDUNGSARTEN UND DAS PERIODENSYSTEM 1) IONISCHE VERBINDUNGEN SALZE Wenn die Atome Ionen bilden, haben sie meist die gleiche Elektronenzahl, wie das nächstgelegene neutrale Edelgas. Na bildet dann
Übungsaufgaben zur Atombindung, zum EPA-Modell und zur Polarität
 Übungsaufgaben zur Atombindung, zum EPA-Modell und zur Polarität 1. Strukturformeln aufstellen, Grundlagen zu polaren Bindungen 1.1 a) Weshalb ist Wasserstoff in Molekülverbindungen einbindig (d.h. geht
Übungsaufgaben zur Atombindung, zum EPA-Modell und zur Polarität 1. Strukturformeln aufstellen, Grundlagen zu polaren Bindungen 1.1 a) Weshalb ist Wasserstoff in Molekülverbindungen einbindig (d.h. geht
Auf der rechten Seite sind Beispiele für kovalente Bindungen.
 Bei einem Gemisch aus Natrium und Chlorid wird einen Ionenverbindung entstehen und sich ein Ionengitter ausbilden. Wenn Natrium nicht vorhanden ist, hat Chlorid aber natürlich noch immer das Bedürfnis,
Bei einem Gemisch aus Natrium und Chlorid wird einen Ionenverbindung entstehen und sich ein Ionengitter ausbilden. Wenn Natrium nicht vorhanden ist, hat Chlorid aber natürlich noch immer das Bedürfnis,
6. Bindungslehre 6.1 Eigenschaften des PSE
 6. Bindungslehre 6.1 Eigenschaften des PSE 1. Berechnen sie die mittlere Atommasse von Chlor (Cl) und vergleichen sie ihren Wert mit dem PSE im Buch. Natürliche Isotope und ihr Anteil: 35 Cl: 75.8%, 37
6. Bindungslehre 6.1 Eigenschaften des PSE 1. Berechnen sie die mittlere Atommasse von Chlor (Cl) und vergleichen sie ihren Wert mit dem PSE im Buch. Natürliche Isotope und ihr Anteil: 35 Cl: 75.8%, 37
Ionenbindungen. Chemie. Library
 Chemie Ionenbindungen Library IONENBINDUNGEN Begriffserklärung 1 Formeltabelle 1 Ladungsermittlung 2 Formale Ladung 3 Hydrogen-Ionen 3 Verhältnisformeln 4 Nomenklatur 4 Gitterenthalpie 4 Eigenschaften
Chemie Ionenbindungen Library IONENBINDUNGEN Begriffserklärung 1 Formeltabelle 1 Ladungsermittlung 2 Formale Ladung 3 Hydrogen-Ionen 3 Verhältnisformeln 4 Nomenklatur 4 Gitterenthalpie 4 Eigenschaften
Fachdidaktik Chemie ETH Zwischenmolekulare Kräfte S. 1
 Fachdidaktik Chemie ETH Zwischenmolekulare Kräfte S. 1 Polare Bindungen Ziele Schülerinnen können Partialladungen bestimmen In kurzer Zeit eine Basis für die Erklärung von Wasserstoffbrücken legen Die
Fachdidaktik Chemie ETH Zwischenmolekulare Kräfte S. 1 Polare Bindungen Ziele Schülerinnen können Partialladungen bestimmen In kurzer Zeit eine Basis für die Erklärung von Wasserstoffbrücken legen Die
Bindungstypen und zwischenmolekulare Kräfte
 Bindungstypen und zwischenmolekulare Kräfte 1 Metallbindung a) Eigenschaften der Metalle c silbriger Glanz d elektrische Leitfähigkeit e Verformbarkeit b) Elektronengasmodell 1 Kraft 3 A 2 Freie Elektronen:
Bindungstypen und zwischenmolekulare Kräfte 1 Metallbindung a) Eigenschaften der Metalle c silbriger Glanz d elektrische Leitfähigkeit e Verformbarkeit b) Elektronengasmodell 1 Kraft 3 A 2 Freie Elektronen:
4.2 Kovalente Bindung. Theorie der kovalenten Bindung, Gilbert Newton Lewis (1916)
 4.2 Kovalente Bindung Theorie der kovalenten Bindung, Gilbert Newton Lewis (1916) Treten Atome von Nichtmetallen miteinander in Wechselwirkung, kommt es nicht zu einer Übertragung von Elektronen. Nichtmetallatome
4.2 Kovalente Bindung Theorie der kovalenten Bindung, Gilbert Newton Lewis (1916) Treten Atome von Nichtmetallen miteinander in Wechselwirkung, kommt es nicht zu einer Übertragung von Elektronen. Nichtmetallatome
Chemie für Biologen WS 2005/6 Arne Lützen Institut für Organische Chemie der Universität Duisburg-Essen (Teil 5: )
 Chemie für Biologen WS 2005/6 Arne Lützen Institut für rganische Chemie der Universität Duisburg-Essen (Teil 5: 23.11.2005) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung von Bindungen
Chemie für Biologen WS 2005/6 Arne Lützen Institut für rganische Chemie der Universität Duisburg-Essen (Teil 5: 23.11.2005) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung von Bindungen
n = V Lsg m n l mol Grundwissen 9. Klasse Chemie (NTG) Analytische Chemie Stoffmenge n Molare Masse M Molares Volumen V M Stoffmengenkonzentration c
 Grundwissen 9. Klasse Chemie (NTG) 1. Analytische Chemie und Stöchiometrie Analytische Chemie Untersuchung von Reinstoffen und Stoffgemischen mit dem Ziel diese eindeutig zu identifizieren (= qualitativer
Grundwissen 9. Klasse Chemie (NTG) 1. Analytische Chemie und Stöchiometrie Analytische Chemie Untersuchung von Reinstoffen und Stoffgemischen mit dem Ziel diese eindeutig zu identifizieren (= qualitativer
3. Bausteine der Materie: Atomhülle. Form der Atomorbitale. s-orbitale kugelsymmetrische Elektronendichteverteilung
 3. Bausteine der Materie: Atomhülle Form der Atomorbitale s-orbitale kugelsymmetrische Elektronendichteverteilung 1s 2s 3d - Orbitale 3. Bausteine der Materie: Atomhülle 3. Bausteine der Materie: Atomhülle
3. Bausteine der Materie: Atomhülle Form der Atomorbitale s-orbitale kugelsymmetrische Elektronendichteverteilung 1s 2s 3d - Orbitale 3. Bausteine der Materie: Atomhülle 3. Bausteine der Materie: Atomhülle
Chemische Stoffe und Verbindungen
 hemische Stoffe und Verbindungen hemische Verbindungen entstehen durch Vorgänge in der Atomhülle, genauer der Valenzschale. Andere Elektronen und der Atomkern sind nicht beteiligt! hemische Verbindungen
hemische Stoffe und Verbindungen hemische Verbindungen entstehen durch Vorgänge in der Atomhülle, genauer der Valenzschale. Andere Elektronen und der Atomkern sind nicht beteiligt! hemische Verbindungen
4.Teil Kovalente Bindung
 4.Teil Kovalente Bindung Lewis-Konzept, Valenstrichformel, Oktettregel Polare Elektronenpaarbindung und Elektronegativität Gebrochene Bindungsordnung und Mesomerie Valenzschalen-Elektronenpaar-Abstoßungsmodell
4.Teil Kovalente Bindung Lewis-Konzept, Valenstrichformel, Oktettregel Polare Elektronenpaarbindung und Elektronegativität Gebrochene Bindungsordnung und Mesomerie Valenzschalen-Elektronenpaar-Abstoßungsmodell
Chemie für Biologen SS Georg Jansen AG Theoretische Organische Chemie Universität Duisburg Essen. (Teil 3: Kovalente Bindungen)
 Chemie für Biologen SS 2007 Georg Jansen AG Theoretische rganische Chemie Universität Duisburg Essen (Teil 3: Kovalente Bindungen) (3) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung
Chemie für Biologen SS 2007 Georg Jansen AG Theoretische rganische Chemie Universität Duisburg Essen (Teil 3: Kovalente Bindungen) (3) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung
Wie sind Atome aufgebaut Welche Informationen enthält das Periodensystem?
 2. DIE KLEINSTEN TEILCHEN ARBEITSBLATT 2.1 DER ATOMAUFBAU FRAGE Wie sind Atome aufgebaut Welche Informationen enthält das Periodensystem? Bausteine der Atome Ladung (+, -, 0) Masse (hoch, sehr gering)
2. DIE KLEINSTEN TEILCHEN ARBEITSBLATT 2.1 DER ATOMAUFBAU FRAGE Wie sind Atome aufgebaut Welche Informationen enthält das Periodensystem? Bausteine der Atome Ladung (+, -, 0) Masse (hoch, sehr gering)
Nachweis molekularer Stoffe. Nachweis von Kationen. Nachweis von Halogenid-Ionen. Nachweis von Sulfat- bzw. Carbonat-Ionen 1 GW 9 NTG 2 GW 9 NTG
 1 1 Glimmspanprobe: Sauerstoff-Nachweis Verbrennung in reinem Sauerstoff ist heftiger als in Luft à glimmender Holzspan glüht auf bzw. entzündet sich wieder Nachweis molekularer Stoffe Knallgasprobe: Wasserstoff-Nachweis
1 1 Glimmspanprobe: Sauerstoff-Nachweis Verbrennung in reinem Sauerstoff ist heftiger als in Luft à glimmender Holzspan glüht auf bzw. entzündet sich wieder Nachweis molekularer Stoffe Knallgasprobe: Wasserstoff-Nachweis
Grundtypen der Bindung. Grundtypen chemischer Bindung. Oktettregel. A.8.1. Atombindung
 Grundtypen der Bindung Grundtypen chemischer Bindung Oktettregel A.8.1. Atombindung 1 A.8.1 Atombindung Valenz (Zahl der Bindungen) Atombindung auch: kovalente Bindung, ElektronenpaarBindung Zwei Atome
Grundtypen der Bindung Grundtypen chemischer Bindung Oktettregel A.8.1. Atombindung 1 A.8.1 Atombindung Valenz (Zahl der Bindungen) Atombindung auch: kovalente Bindung, ElektronenpaarBindung Zwei Atome
Lösungen III Silizium; von innen nach außen: 2 bzw. 8 bzw. 4 Elektronen auf den Schalen
 Lösungen III.1 1. wenn man für die Atomgröße 10-10 m und für die Kerngröße 10-15 m annimmt, ergibt sich: a) 16 000 km (also größer als die Erde!) bzw. 0,4 m, also ist der Kern nicht sichtbar b) der gezeigte
Lösungen III.1 1. wenn man für die Atomgröße 10-10 m und für die Kerngröße 10-15 m annimmt, ergibt sich: a) 16 000 km (also größer als die Erde!) bzw. 0,4 m, also ist der Kern nicht sichtbar b) der gezeigte
18 UE Präsenz - Selbststudium 1,5 ECTS
 18 UE Präsenz - Selbststudium 1,5 ECTS 1. Chemische Bindungen Überblick 2. Modelle der chemischen Bindung 3. Intermolekulare Wechselwirkungen 4. Mischbarkeiten und Löslichkeiten 5. Praktische Beispiele
18 UE Präsenz - Selbststudium 1,5 ECTS 1. Chemische Bindungen Überblick 2. Modelle der chemischen Bindung 3. Intermolekulare Wechselwirkungen 4. Mischbarkeiten und Löslichkeiten 5. Praktische Beispiele
Übungsaufgaben zur Atombindung, zum EPA-Modell und zur Polarität
 Übungsaufgaben zur Atombindung, zum EPA-Modell und zur Polarität 1. Strukturformeln aufstellen, Grundlagen zu polaren Bindungen 1.1 a) Weshalb ist Wasserstoff in Molekülverbindungen einbindig (d.h. geht
Übungsaufgaben zur Atombindung, zum EPA-Modell und zur Polarität 1. Strukturformeln aufstellen, Grundlagen zu polaren Bindungen 1.1 a) Weshalb ist Wasserstoff in Molekülverbindungen einbindig (d.h. geht
Welche beiden Metalle prägten eine Epoche?
 Posten 1a Welche beiden Metalle prägten eine Epoche? a) Silber / Gold (=> Posten 2a) b) Bronze / Eisen (=> Posten 3d) c) Eisen / Gold (=> Posten 4j) d) Silber / Bronze (=> Posten 5s) Posten 2d Welcher
Posten 1a Welche beiden Metalle prägten eine Epoche? a) Silber / Gold (=> Posten 2a) b) Bronze / Eisen (=> Posten 3d) c) Eisen / Gold (=> Posten 4j) d) Silber / Bronze (=> Posten 5s) Posten 2d Welcher
Musterprüfung Welche der Elemente Lithium, Kohlenstoff, Wasserstoff, Sauerstoff, Magnesium, Aluminium und Calcium sind Nichtmetalle?
 1 Module: Atombau und Periodensystem Chemische Bindungen Chemische Reaktionen Musterprüfung 1. Teil: Atombau und Periodensystem 1.1. Welche Art von Teilchen befinden sich a) im Atomkern b) in der Elektronenhülle
1 Module: Atombau und Periodensystem Chemische Bindungen Chemische Reaktionen Musterprüfung 1. Teil: Atombau und Periodensystem 1.1. Welche Art von Teilchen befinden sich a) im Atomkern b) in der Elektronenhülle
Grundwissen Chemie Jahrgangsstufe 9, naturwissenschaftlicher Zweig
 Grundwissen Chemie Jahrgangsstufe 9, Qualitative Analysemethoden nachzuweisendes Molekül / Ion Nachweisverfahren Beobachtung Halogenide Fällung mit Silbernitrat weißer bis gelber Niederschlag Metallkationen
Grundwissen Chemie Jahrgangsstufe 9, Qualitative Analysemethoden nachzuweisendes Molekül / Ion Nachweisverfahren Beobachtung Halogenide Fällung mit Silbernitrat weißer bis gelber Niederschlag Metallkationen
1. Nennen Sie die drei wichtigen Bindungstypen und die zwei wichtigen Typen von Atomverbänden.
 6. Bindungslehre 6.2 Wie verbinden sich Atome? 1. Nennen Sie die drei wichtigen Bindungstypen und die zwei wichtigen Typen von Atomverbänden. 6.3 Metallbindung 1. Nennen Sie fünf charakteristische Eigenschaften
6. Bindungslehre 6.2 Wie verbinden sich Atome? 1. Nennen Sie die drei wichtigen Bindungstypen und die zwei wichtigen Typen von Atomverbänden. 6.3 Metallbindung 1. Nennen Sie fünf charakteristische Eigenschaften
1 Chemie des Wassers. 1.1 Eigenschaften des Wassers. Bindung und Struktur H + O + H H O H
 1 Chemie des Wassers 1.1 Eigenschaften des Wassers Bindung und Struktur - Molekül mit der Summenformel H 2 O - kovalente Bindung (Atombindung) zwischen O- und H-Atomen - Modell der kovalenten Bindung Oktettregel
1 Chemie des Wassers 1.1 Eigenschaften des Wassers Bindung und Struktur - Molekül mit der Summenformel H 2 O - kovalente Bindung (Atombindung) zwischen O- und H-Atomen - Modell der kovalenten Bindung Oktettregel
ZWISCHENMOLEKULARE KRÄFTE GF
 KS ZWISEMLEKULARE KRÄFTE GF Skript Zwischenmolekulare Kräfte (GF) V1.0 12/12 MMo, edited by Bor 1 IALTSVERZEIIS "ZWISEMLEKULARE KRÄFTE" 1. Repetition Moleküle / Elektronenpaarbindung... 02 2. Polare und
KS ZWISEMLEKULARE KRÄFTE GF Skript Zwischenmolekulare Kräfte (GF) V1.0 12/12 MMo, edited by Bor 1 IALTSVERZEIIS "ZWISEMLEKULARE KRÄFTE" 1. Repetition Moleküle / Elektronenpaarbindung... 02 2. Polare und
NH 3. CCl 4 CO 2. Lösungen zur Lernzielkontrolle Sekunda. Hilfsmittel: PSE, Taschenrechner
 Lösungen zur Lernzielkontrolle Sekunda Hilfsmittel: PSE, Taschenrechner 1 Stoffklassen / Bindungslehre / Zwischenmolekulare Kräfte (1) 1.1 Elektrische Leitfähigkeit verschiedener Stoffe (3) leitfähig,
Lösungen zur Lernzielkontrolle Sekunda Hilfsmittel: PSE, Taschenrechner 1 Stoffklassen / Bindungslehre / Zwischenmolekulare Kräfte (1) 1.1 Elektrische Leitfähigkeit verschiedener Stoffe (3) leitfähig,
1.9. Zwischenmolekulare Kräfte
 1.9. Zwischenmolekulare Kräfte 1.9.1. Schmelzen und Verdampfen von Stoffen fester Zustand geordnetes Kristallgitter Teilchen schwingen um Ruhelage flüssiger Zustand Teilchen sind im Tropfen frei beweglich
1.9. Zwischenmolekulare Kräfte 1.9.1. Schmelzen und Verdampfen von Stoffen fester Zustand geordnetes Kristallgitter Teilchen schwingen um Ruhelage flüssiger Zustand Teilchen sind im Tropfen frei beweglich
Atomaufbau. Elektronen e (-) Atomhülle
 Atomaufbau Institut für Elementarteilchen Nukleonen Protonen p (+) Neutronen n (o) Elektronen e (-) Atomkern Atomhülle Atom WIBA-NET 2005 Prof. Setzer 1 Elementarteilchen Institut für Name Symbol Masse
Atomaufbau Institut für Elementarteilchen Nukleonen Protonen p (+) Neutronen n (o) Elektronen e (-) Atomkern Atomhülle Atom WIBA-NET 2005 Prof. Setzer 1 Elementarteilchen Institut für Name Symbol Masse
Lösungsbeispiel Oberflächenspannung. Schwimmende Büroklammer
 Lösungsbeispiel Oberflächenspannung Schwimmende Büroklammer Svens Klasse geht einmal im Monat in ein Schülerlabor, um Versuche zu Themen durchzuführen, die im Unterricht theoretisch behandelt wurden. Im
Lösungsbeispiel Oberflächenspannung Schwimmende Büroklammer Svens Klasse geht einmal im Monat in ein Schülerlabor, um Versuche zu Themen durchzuführen, die im Unterricht theoretisch behandelt wurden. Im
Musterprüfung Welche der Elemente Lithium, Kohlenstoff, Wasserstoff, Sauerstoff, Magnesium, Aluminium und Calcium sind Nichtmetalle?
 Module: Atombau und Periodensystem Chemische Bindungen Chemische Reaktionen 1 Musterprüfung 1. Teil: Atombau und Periodensystem 1.1. Welche Art von Teilchen befinden sich a) im Atomkern b) in der Elektronenhülle
Module: Atombau und Periodensystem Chemische Bindungen Chemische Reaktionen 1 Musterprüfung 1. Teil: Atombau und Periodensystem 1.1. Welche Art von Teilchen befinden sich a) im Atomkern b) in der Elektronenhülle
Rückblick. 1 Elemente Chemie Oberstufe Einführungsphase NRW Ernst Klett Verlag GmbH, Stuttgart Lösungen zu den Aufgaben. Rückblick Aufgaben
 Lösungen zu den Aufgaben Rückblick Aufgaben A1 Je stärker die Anziehungskräfte zwischen den kleinsten Teilchen eines Stoffes sind, desto höher ist die Siedetemperatur des Stoffes, denn zum Verdampfen müssen
Lösungen zu den Aufgaben Rückblick Aufgaben A1 Je stärker die Anziehungskräfte zwischen den kleinsten Teilchen eines Stoffes sind, desto höher ist die Siedetemperatur des Stoffes, denn zum Verdampfen müssen
Bohrsches Atommodell
 Atome und ihre Bindungen Atomaufbau Im Atomkern befinden sich die Protonen (positiv geladen) und die Neutronen (neutral). P und N sind ungefähr gleich schwer und machen 99% der Atommasse aus. Um den Kern
Atome und ihre Bindungen Atomaufbau Im Atomkern befinden sich die Protonen (positiv geladen) und die Neutronen (neutral). P und N sind ungefähr gleich schwer und machen 99% der Atommasse aus. Um den Kern
Chemische Bindung. Wie halten Atome zusammen? Welche Atome können sich verbinden? Febr 02
 Chemische Bindung locker bleiben Wie halten Atome zusammen? positiv Welche Atome können sich verbinden? power keep smiling Chemische Bindung Die chemischen Reaktionen spielen sich zwischen den Hüllen der
Chemische Bindung locker bleiben Wie halten Atome zusammen? positiv Welche Atome können sich verbinden? power keep smiling Chemische Bindung Die chemischen Reaktionen spielen sich zwischen den Hüllen der
1) Welche Aussagen über die Hauptgruppenelemente im Periodensystem sind richtig?
 1) Welche Aussagen über die Hauptgruppenelemente im Periodensystem sind richtig? 1) Es sind alles Metalle. 2) In der äußeren Elektronenschale werden s- bzw. s- und p-orbitale aufgefüllt. 3) Sie stimmen
1) Welche Aussagen über die Hauptgruppenelemente im Periodensystem sind richtig? 1) Es sind alles Metalle. 2) In der äußeren Elektronenschale werden s- bzw. s- und p-orbitale aufgefüllt. 3) Sie stimmen
In reiner Form bestehen sie aus 6,022 10 23 Atomen. Sie können weder chemisch noch physikalisch zerlegt werden.
 1. Welches der folgenden Gemische ist ein Gemenge? Kalkmilch Granit Rauch 2. Wodurch sind chemische Elemente charakterisiert? In reiner Form bestehen sie aus 6,022 10 23 Atomen. Sie sind unteilbar. Sie
1. Welches der folgenden Gemische ist ein Gemenge? Kalkmilch Granit Rauch 2. Wodurch sind chemische Elemente charakterisiert? In reiner Form bestehen sie aus 6,022 10 23 Atomen. Sie sind unteilbar. Sie
Grundlagen der Allgemeinen und Anorganischen Chemie. Atome. Chemische Reaktionen. Verbindungen
 Grundlagen der Allgemeinen und Anorganischen Chemie Atome Elemente Chemische Reaktionen Energie Verbindungen 92 Grundlagen der Allgemeinen und Anorganischen Chemie 3. Das Periodensystem der Elemente 93
Grundlagen der Allgemeinen und Anorganischen Chemie Atome Elemente Chemische Reaktionen Energie Verbindungen 92 Grundlagen der Allgemeinen und Anorganischen Chemie 3. Das Periodensystem der Elemente 93
1/7. Abb Ordnung polarer Moleküle im flüssigen Zustand.
 1/7 aus der Sicht der Chemie Die physikalischen Eigenschaften von Factsheet 1 Einführung besitzt viele ausserordentliche physikalische Eigenschaften (sehr hohe Schmelz- und Siedepunkte, niedrigere Dichte
1/7 aus der Sicht der Chemie Die physikalischen Eigenschaften von Factsheet 1 Einführung besitzt viele ausserordentliche physikalische Eigenschaften (sehr hohe Schmelz- und Siedepunkte, niedrigere Dichte
Atome und Bindungen. Was sollen Sie mitnehmen?
 Was sollen Sie mitnehmen? Elementare Grundlagen: Atome und Bindungen Schalenmodell Orbitalmodell Periodensystem der Elemente Typische Eigenschaften der Elemente Die vier Bindungstypen Kovalente Bindung
Was sollen Sie mitnehmen? Elementare Grundlagen: Atome und Bindungen Schalenmodell Orbitalmodell Periodensystem der Elemente Typische Eigenschaften der Elemente Die vier Bindungstypen Kovalente Bindung
Die chemische Bindung: Erklärt was die Atome in den Atomverbänden zusammenhält. A. Soi
 Die chemische Bindung: Erklärt was die Atome in den Atomverbänden zusammenhält. A. Soi 2017 18 187 Tip II: Wie gelange ich von der Molekülformel zur Lewis Formel? Das Bauprinzip von Molekülen. i) Ein Zentralatom,
Die chemische Bindung: Erklärt was die Atome in den Atomverbänden zusammenhält. A. Soi 2017 18 187 Tip II: Wie gelange ich von der Molekülformel zur Lewis Formel? Das Bauprinzip von Molekülen. i) Ein Zentralatom,
Schuleigener Arbeitsplan für das Fach Chemie (vorläufige Fassung, gültig ab Schuljahr 2008/09)
 Laurentius-Siemer-Gymnasium Saterland Schuleigener Arbeitsplan für das Fach Chemie (vorläufige Fassung, gültig ab Schuljahr 2008/09) Jahrgangsstufe: 9 Lehrwerke / Hilfsmittel: Elemente Chemie 1, Klett
Laurentius-Siemer-Gymnasium Saterland Schuleigener Arbeitsplan für das Fach Chemie (vorläufige Fassung, gültig ab Schuljahr 2008/09) Jahrgangsstufe: 9 Lehrwerke / Hilfsmittel: Elemente Chemie 1, Klett
Atome und Bindungen. Was sollen Sie mitnehmen?
 Was sollen Sie mitnehmen? Elementare Grundlagen: Atome und Bindungen Schalenmodell Orbitalmodell Periodensystem der Elemente Typische Eigenschaften der Elemente Die vier Bindungstypen Kovalente Bindung
Was sollen Sie mitnehmen? Elementare Grundlagen: Atome und Bindungen Schalenmodell Orbitalmodell Periodensystem der Elemente Typische Eigenschaften der Elemente Die vier Bindungstypen Kovalente Bindung
08.12.2013. Wichtige Stoffgruppen. Stoffgruppe. Atomverband. Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Metall Metall:
 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter) - Salze Nichtmetall Nichtmetall:
1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter) - Salze Nichtmetall Nichtmetall:
10. Klasse / Infoblatt 1. Grundwissen: Periodensystem
 Grundwissen: Periodensystem Metalle / Metallcharakter Nichtmetalle / Nichtmetallcharakter Elektronenaffinität Reaktivität der Halogene Reaktivität der Alkalimetalle 10. Klasse / Infoblatt 1 Eigenschaft
Grundwissen: Periodensystem Metalle / Metallcharakter Nichtmetalle / Nichtmetallcharakter Elektronenaffinität Reaktivität der Halogene Reaktivität der Alkalimetalle 10. Klasse / Infoblatt 1 Eigenschaft
Bindungsarten. Edelgaskonfiguration. Elektronegativität
 Bindungsarten Einführende Erklärung des Kugelwolkenmodells und der Elektronenpaarschreibweise siehe Seiten 6 10 des Kapitels Historische Entwicklung des Atommodells. Elemente können bei chemischen Reaktionen
Bindungsarten Einführende Erklärung des Kugelwolkenmodells und der Elektronenpaarschreibweise siehe Seiten 6 10 des Kapitels Historische Entwicklung des Atommodells. Elemente können bei chemischen Reaktionen
Materialien für den sprachsensiblen Unterricht Textrekonstruktion: Die Eigenschaften des Wassers
 Materialien für den sprachsensiblen Unterricht Textrekonstruktion: Die Eigenschaften des Wassers Unterrichtsfach Themenbereich/e Chemie Wasser als ohstoff und Lösungsmittel Schulstufe (Klasse) 8. (4.)
Materialien für den sprachsensiblen Unterricht Textrekonstruktion: Die Eigenschaften des Wassers Unterrichtsfach Themenbereich/e Chemie Wasser als ohstoff und Lösungsmittel Schulstufe (Klasse) 8. (4.)
Kapitel 15: Die Atombindung (Elektronenpaarbindung)
 Kapitel 15: Die Atombindung (Elektronenpaarbindung) 1 Kapitel 15: Die Atombindung (Elektronenpaarbindung) Strukturmodell von Diamant Kapitel 15: Die Atombindung (Elektronenpaarbindung) 2 Inhalt Kapitel
Kapitel 15: Die Atombindung (Elektronenpaarbindung) 1 Kapitel 15: Die Atombindung (Elektronenpaarbindung) Strukturmodell von Diamant Kapitel 15: Die Atombindung (Elektronenpaarbindung) 2 Inhalt Kapitel
Modul: Allgemeine Chemie
 Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Dipolmomente + - a ohne Feld b mit Feld. δ + δ- δ + δ - δ + δ - δ + δ - δ + δ - δ + Dipolmoment: µ = q * d
 CI_folie29 Dipolmomente δ- + - a ohne Feld b mit Feld + + + + + + - - - - - - Effekt eines elektrostatischen Feldes auf die rientierung polarer Moleküle. Dipolmoment: µ = q * d d: Abstand zwischen den
CI_folie29 Dipolmomente δ- + - a ohne Feld b mit Feld + + + + + + - - - - - - Effekt eines elektrostatischen Feldes auf die rientierung polarer Moleküle. Dipolmoment: µ = q * d d: Abstand zwischen den
Chemie Technische BerufsmaturitÄt BMS AGS Basel
 A AtomverbÄnde Mit Ausnahme der Edelgase bilden die Atome in allen Stoffen gråssere VerbÄnde: MolekÇle oder Gitter. Die Atome werden dabei durch chemische Bindungen zusammengehalten. Chemische Bindungen
A AtomverbÄnde Mit Ausnahme der Edelgase bilden die Atome in allen Stoffen gråssere VerbÄnde: MolekÇle oder Gitter. Die Atome werden dabei durch chemische Bindungen zusammengehalten. Chemische Bindungen
11. Elektrodynamik Das Gaußsche Gesetz 11.2 Kraft auf Ladungen Punktladung im elektrischen Feld Dipol im elektrischen Feld
 Inhalt 11. Elektrodynamik 11.1 Das Gaußsche Gesetz 11.2 Kraft auf Ladungen 11.2.1 Punktladung im elektrischen Feld 11. Elektromagnetische Kraft 11 Elektrodynamik 11. Elektrodynamik (nur Vakuum = Ladung
Inhalt 11. Elektrodynamik 11.1 Das Gaußsche Gesetz 11.2 Kraft auf Ladungen 11.2.1 Punktladung im elektrischen Feld 11. Elektromagnetische Kraft 11 Elektrodynamik 11. Elektrodynamik (nur Vakuum = Ladung
... ... a) Ladungsschwerpunkte der Ionen b) Raumerfüllung der Ionen
 4 Chemische Bindung Elemente ohne Edelgaszustand sind energetisch instabil und versuchen, diesen Zustand durch das Eingehen einer Bindung zu erreichen. Dies geschieht grundsätzlich auf drei Arten. Lesen
4 Chemische Bindung Elemente ohne Edelgaszustand sind energetisch instabil und versuchen, diesen Zustand durch das Eingehen einer Bindung zu erreichen. Dies geschieht grundsätzlich auf drei Arten. Lesen
Die Einheit der Atommasse m ist u. Das ist der 12. Teil der Masse eines Kohlenstoffatoms. 1 u = 1,6608 * 10-27 kg m(h) = 1 u
 Analytische Chemie Stöchiometrie Absolute Atommasse Die Einheit der Atommasse m ist u. Das ist der 12. Teil der Masse eines Kohlenstoffatoms. 1 u = 1,6608 * 10-27 kg m() = 1 u Stoffmenge n Die Stoffmenge
Analytische Chemie Stöchiometrie Absolute Atommasse Die Einheit der Atommasse m ist u. Das ist der 12. Teil der Masse eines Kohlenstoffatoms. 1 u = 1,6608 * 10-27 kg m() = 1 u Stoffmenge n Die Stoffmenge
Kantonsschule Freudenberg. Chemie. Aufgaben zum Grundlagenfach. Übungen zum Unterricht von A. Bärtsch
 Kantonsschule Freudenberg Chemie Aufgaben zum Grundlagenfach Übungen zum Unterricht von A. Bärtsch Dez. 2013 Inhalt 1. Atombau 2. Radioaktivität 3. Kovalente Bindungen 4. Salze 5. Polarität und zwischenmolekulare
Kantonsschule Freudenberg Chemie Aufgaben zum Grundlagenfach Übungen zum Unterricht von A. Bärtsch Dez. 2013 Inhalt 1. Atombau 2. Radioaktivität 3. Kovalente Bindungen 4. Salze 5. Polarität und zwischenmolekulare
Thema heute: Chemische Bindungen, Teil I
 Wiederholung der letzten Vorlesungsstunde: Periodensystem, Anordnung der Elemente nach steigender Ordnungszahl, Hauptgruppen, Nebengruppen, Lanthanoide + Actinoide, Perioden, Döbereiner, Meyer, Medelejew
Wiederholung der letzten Vorlesungsstunde: Periodensystem, Anordnung der Elemente nach steigender Ordnungszahl, Hauptgruppen, Nebengruppen, Lanthanoide + Actinoide, Perioden, Döbereiner, Meyer, Medelejew
Grundwissen C8 NTG. 1. Stoffe und Reaktionen. Reinstoff
 Grundwissen C8 NTG 1. Stoffe und Reaktionen Reinstoff Stoffgemisch - besitzt unter bestimmten Bedingungen (z.b. Temperatur, Druck ) kennzeichnende Eigenschaften, z.b. Farbe, Geruch, Geschmack, Dichte,
Grundwissen C8 NTG 1. Stoffe und Reaktionen Reinstoff Stoffgemisch - besitzt unter bestimmten Bedingungen (z.b. Temperatur, Druck ) kennzeichnende Eigenschaften, z.b. Farbe, Geruch, Geschmack, Dichte,
Grundlagen des Periodensystems der Elemente
 Aus der regelmäßigen Wiederholung ähnlicher Eigenschaften der Elemente leitete Mendelejew das Gesetz der Periodizität ab. Diese Periodizität liegt im Aufbau der Atomhülle begründet. Atomradius Als Atomradius
Aus der regelmäßigen Wiederholung ähnlicher Eigenschaften der Elemente leitete Mendelejew das Gesetz der Periodizität ab. Diese Periodizität liegt im Aufbau der Atomhülle begründet. Atomradius Als Atomradius
Grundwissen Chemie 10 MNT
 Grundwissen Chemie 10 MNT 09/2008 StR Reitbauer Gym VIB Inhalt : Grundwissen Klasse 10 M NT (G9) 2 1 Die Alkalimetalle 2 2 Die Halogene 2 3 Das PSE : Periodensystem der Elemente 2 4 Die Atombindung (Elektronenpaarbindung)
Grundwissen Chemie 10 MNT 09/2008 StR Reitbauer Gym VIB Inhalt : Grundwissen Klasse 10 M NT (G9) 2 1 Die Alkalimetalle 2 2 Die Halogene 2 3 Das PSE : Periodensystem der Elemente 2 4 Die Atombindung (Elektronenpaarbindung)
Grundwissen Chemie 9. Jahrgangsstufe G8
 Grundwissen Chemie 9. Jahrgangsstufe G8 Ionennachweise Man nutzt die Schwerlöslichkeit vieler Salze (z. B. AgCl) zum Nachweis und zur quantitativen Bestimmung der Ionen. Nachweis molekular gebauter Stoffe
Grundwissen Chemie 9. Jahrgangsstufe G8 Ionennachweise Man nutzt die Schwerlöslichkeit vieler Salze (z. B. AgCl) zum Nachweis und zur quantitativen Bestimmung der Ionen. Nachweis molekular gebauter Stoffe
1.8. Aufgaben zur Elektronenpaarbindung
 1.8. Aufgaben zur Elektronenpaarbindung Aufgabe 1: Elektronenpaarbindung a) Welche anderen Bezeichnungen gibt es für die Elektronenpaarbindung? b) Wie erreichen Nichtmetallatome die Edelgaskonfiguration,
1.8. Aufgaben zur Elektronenpaarbindung Aufgabe 1: Elektronenpaarbindung a) Welche anderen Bezeichnungen gibt es für die Elektronenpaarbindung? b) Wie erreichen Nichtmetallatome die Edelgaskonfiguration,
1.8. Aufgaben zur Elektronenpaarbindung
 1.8. Aufgaben zur Elektronenpaarbindung Aufgabe 1: Elektronenpaarbindung a) Welche anderen Bezeichnungen gibt es für die Elektronenpaarbindung? b) Wie erreichen Nichtmetallatome die Edelgaskonfiguration,
1.8. Aufgaben zur Elektronenpaarbindung Aufgabe 1: Elektronenpaarbindung a) Welche anderen Bezeichnungen gibt es für die Elektronenpaarbindung? b) Wie erreichen Nichtmetallatome die Edelgaskonfiguration,
Chemische Bindungsarten
 Die Chemie unterscheidet zwischen zwei verschiedenen Bindungsarten: I) Primärbindungen und II) Sekundärbindungen I. Primärbindungen II. Sekundärbindungen 1. Ionenbindung 4. Wasserstoffbrückenbindung 2.
Die Chemie unterscheidet zwischen zwei verschiedenen Bindungsarten: I) Primärbindungen und II) Sekundärbindungen I. Primärbindungen II. Sekundärbindungen 1. Ionenbindung 4. Wasserstoffbrückenbindung 2.
Chemie Zusammenfassung III
 Chemie Zusammenfassung III Inhaltsverzeichnis Atombau & Kernphysik... 2 Aufbau der Atome... 2 Atomkern... 2 Atomhülle... 2 Atomgrösse und Kernladung... 3 Reaktivität und Gruppen des Periodensystems...
Chemie Zusammenfassung III Inhaltsverzeichnis Atombau & Kernphysik... 2 Aufbau der Atome... 2 Atomkern... 2 Atomhülle... 2 Atomgrösse und Kernladung... 3 Reaktivität und Gruppen des Periodensystems...
Atome und Periodensystem
 Kapitel 1 Atome und Periodensystem Lernziele Aufbau und Bestandteile der Atome Isotope Periodensystem der chemischen Elemente Atomaufbau und Isotope Nach dem Atommodell von Rutherford besteht das Atom
Kapitel 1 Atome und Periodensystem Lernziele Aufbau und Bestandteile der Atome Isotope Periodensystem der chemischen Elemente Atomaufbau und Isotope Nach dem Atommodell von Rutherford besteht das Atom
7. Hydratation 19 7.1. Versuche 19 7.2. Der Lösungsvorgang 19 AB: Hydratation 20 Folie: Lösungsvorgang eines Salzes in Wasser 21
 D i e A t o m b i n d u n g 1. Die Atombindung 2 1.1. Die Bindung im 2 -Molekül 2 1.2. Die Bindungsenergie 2 1.3. Weitere Beispiele 2 1.4. Die ktett-regel 2 Folie: Gemeinsam genutzte Elektronenpaare 3
D i e A t o m b i n d u n g 1. Die Atombindung 2 1.1. Die Bindung im 2 -Molekül 2 1.2. Die Bindungsenergie 2 1.3. Weitere Beispiele 2 1.4. Die ktett-regel 2 Folie: Gemeinsam genutzte Elektronenpaare 3
Jetzt wird s undurchsichtig: Der "Louche"-Effekt
 age fotostock / LOOK-foto Jetzt wird s undurchsichtig: Der "Louche"-Effekt Bild 1: Urlaub auf den Kykladen in Griechenland Bild 2: Ouzo (frz.: louche undurchsichtig, verdächtig, anrüchig) Bild 3: Ouzo
age fotostock / LOOK-foto Jetzt wird s undurchsichtig: Der "Louche"-Effekt Bild 1: Urlaub auf den Kykladen in Griechenland Bild 2: Ouzo (frz.: louche undurchsichtig, verdächtig, anrüchig) Bild 3: Ouzo
22. Chemische Bindungen
 .05.03. Chemische Bindungen Molekül: System aus zwei oder mehr Atomen Kleinste Einheit einer Substanz, die deren chemische Eigenschaften ausweist Quantenmechanisches Vielteilchensystem: Exakte explizite
.05.03. Chemische Bindungen Molekül: System aus zwei oder mehr Atomen Kleinste Einheit einer Substanz, die deren chemische Eigenschaften ausweist Quantenmechanisches Vielteilchensystem: Exakte explizite
11. Elektrodynamik Das Gaußsche Gesetz 11.2 Kraft auf Ladungen Punktladung im elektrischen Feld Dipol im elektrischen Feld
 11. Elektrodynamik Physik für ETechniker 11. Elektrodynamik 11.1 Das Gaußsche Gesetz 11.2 Kraft auf Ladungen 11.2.1 Punktladung im elektrischen Feld 11.2.2 Dipol im elektrischen Feld 11. Elektrodynamik
11. Elektrodynamik Physik für ETechniker 11. Elektrodynamik 11.1 Das Gaußsche Gesetz 11.2 Kraft auf Ladungen 11.2.1 Punktladung im elektrischen Feld 11.2.2 Dipol im elektrischen Feld 11. Elektrodynamik
Exkurs: Wasser Das Elixier des Lebens
 Exkurs: Wasser Das Elixier des Lebens Wasser Anatomie eines Moleküls VSEPR-Modell sp3-hybridorbital Sigma-Bindung Elektronenkonfiguration Sauerstoff Das vollbesetzte 2s-Orbital sowie die drei p-orbitale
Exkurs: Wasser Das Elixier des Lebens Wasser Anatomie eines Moleküls VSEPR-Modell sp3-hybridorbital Sigma-Bindung Elektronenkonfiguration Sauerstoff Das vollbesetzte 2s-Orbital sowie die drei p-orbitale
Aktuelle Beispiele aus der Forschung
 Vorlesung: Allgemeine Chemie Organische Chemie 05.12.; 08.12.; Prof. Dr. C. Meier Eine Einführung in die Organische Chemie Themen: Elektronenstruktur, kovalente Bindung, Säure-Basen-Eigenschaften in Abhängigkeit
Vorlesung: Allgemeine Chemie Organische Chemie 05.12.; 08.12.; Prof. Dr. C. Meier Eine Einführung in die Organische Chemie Themen: Elektronenstruktur, kovalente Bindung, Säure-Basen-Eigenschaften in Abhängigkeit
Besetzung der Orbitale
 Frage Beim Wiederholen des Stoffes bin ich auf die Rechnung zur Energie gestoßen. Warum und zu welchem Zweck haben wir das gemacht? Was kann man daran jetzt erkennen? Was beschreibt die Formel zu E(n),
Frage Beim Wiederholen des Stoffes bin ich auf die Rechnung zur Energie gestoßen. Warum und zu welchem Zweck haben wir das gemacht? Was kann man daran jetzt erkennen? Was beschreibt die Formel zu E(n),
Stoffgemisch. Reinstoff. Homogenes Gemisch. Heterogenes Gemisch. ( 8. Klasse NTG 1 / 48 ) ( 8. Klasse NTG 2 / 48 ) ( 8. Klasse NTG 3 / 48 )
 Stoffgemisch ( 8. Klasse NTG 1 / 48 ) besteht aus zwei oder mehr verschiedenen Reinstoffen Gemisch unterschiedlicher kleinster Teilchen Trennung durch physikalische Methoden möglich Reinstoff ( 8. Klasse
Stoffgemisch ( 8. Klasse NTG 1 / 48 ) besteht aus zwei oder mehr verschiedenen Reinstoffen Gemisch unterschiedlicher kleinster Teilchen Trennung durch physikalische Methoden möglich Reinstoff ( 8. Klasse
