Sie kann auf biologischen oder auf chemischen Untersuchungen des Gewässers beruhen:
|
|
|
- Ernst Adenauer
- vor 7 Jahren
- Abrufe
Transkript
1 Wasser und Abwasser Wiederholung: Gewässereutrophierung und Gewässergüteklassen Gewässergütebestimmung Sie kann auf biologischen oder auf chemischen Untersuchungen des Gewässers beruhen: Die Gewässergüte: Sie wird durch einer 5-stufigen Skala definiert, wobei sich die 5 Gewässergüteklassen in verschiedenen Faktoren unterscheiden, z.b.: Sauerstoffgehalt Gehalt an anderen chemischen Stoffen ph-wert Durchschnittstemperatur Artenvielfalt/Individuenzahl Die biologische Gewässergütebestimmung Sie beruht auf einer Untersuchung des Gewässers auf die durchschnittliche Zusammensetzung seiner Fauna bzw. Flora. Die dafür jeweils typischen Lebewesen nennt man Bioindikatoren: Beispiel für die Entwicklung von Artenzahl/Individuenzahl im Zuge einer Eutrophierung: Artenzahl Individuenzahl Güteklasse Güteklasse Artenzahl Individuenzahl
2
3
4 Die Chemische Gewässergütebestimmung Der Sauerstoffgehalt des Wassers Er sollte möglichst nahe dem jeweiligen Sättigungswert sein (Temperaturabhängigkeit!). Bei Sauerstoffmangel reagieren Fische beispielsweise mit verminderter Nahrungsaufnahme bzw. Verweigerung jeglicher Nahrung. Zusätzlich werden bevorzugt die oberflächennahen Regionen aufgesucht. Probenentnahme: Der O2 Gehalt darf sich während der Probenentnahme möglichst wenig ändern.: Für Oberflächenwasser Winklerflasche mit doppelt durchbohrtem Verschluss
5 Für Tiefenwasser Mayer sche Schöpfflasche / Ruttner-Schöpfer Probenauswertung: Entweder Sauerstoffmesselektroden oder: WINKLER-Methode: Probe mit Manganchlorid und KJ-hältiger Natronlauge mischen: I) MnCl2 + 2 NaOH Mn(OH)2 + 2 NaCl 2 Mn(OH)2 + O2 2 MnO(OH)2 (Manganoxihydrat) Das Manganoxihydrat enthält den gesamten gelösten Sauerstoff und bildet einen braunen Niederschlag Niederschlag wird mit konz. Salzsäure gelöst: II) MnO(OH)2 + 4 HCl MnCl2 + 3 H2O + Cl2 Cl2 + 2 KJ 2 KCl + J2 Die Menge des jetzt im Wasser gelösten Jods ist proportional zur anfangs vorhandenen Sauerstoffmenge. Sie kann durch Titration mit Natriumthiosulfat genau erfasst werden: III) 2 Na2 S2 O3 + J2 2 Na J + Na2 S4 O6 Natriumtetrathionat) Nachweis der Jodbindung durch Umfärbung (kann durch Zugabe von Stärkelösung noch verdeutlicht werden!) Der Verbrauch an Natriumthiosulfat ist proportional zum ursprünglichen Sauerstoffgehalt der Wasserprobe!
6 Der biochemische Sauerstoffbedarf (BSB-Wert): Er zeigt den Zusammenhang zwischen Gewässerverschmutzung und der Abbautätigkeit durch Mikroorganismen. Wird dem alleinigen Probenwasser während einer Beobachtungsphase in Dunkelheit und bei konstanter Temperatur viel Sauerstoff entzogen, muss die Belastung des Wassers groß gewesen sein. Der am häufigsten verwendete BSB ist der BSB5-Wert, der den Sauerstoffbedarf in 5 Tagen ermittelt. Richtwerte: 0 2 mg/l Klasse 1 2,1 4 mg/l Klasse 2 4,1 10 mg/l Klasse 3 über 10 mg/l Klasse 4 von vorn herein sauerstofffrei Klasse 5 (Verödung) Gereinigte Abwässer aus Kläranlagen dürfen in der Regel BSB5-Wert bis zu 25 mg/l aufweisen, obwohl sie eine Reinigungseffizienz von 95% aufweisen. Haushaltsabwässer: BSB5-Wert ca. 300 mg/l (Abfallstoffe, Ausscheidungen + ca. 200 Liter Wasser pro Kopf und Tag. Extremwert: Silosickersäfte: BSB5 zwischen und mg/l Wasserhärte und Säurebindungsvermögen (SBV) Für die Wasserhärte ist in erster Linie der Gehalt an Calziumhydrogencarbonat verantwortlich. Dieses entsteht durch Reaktion von Kalkstein mit dem Kohlensäuregehalt des Regenwassers. Reaktionsgleichung: (Entstehung von Kalziumhydrogencarbonat, Rückreaktion beim Erhitzen von hartem Wasser) Einheit: 1 Grad deutscher Härte = 1 d 18 mg Kalk/Liter Wasser Hartes Wasser kann einem plötzlichen ph-wert-anstieg durch Säurezufuhr (Saurer Regen, Sickerwässer aus Waldbeständen auf kalkarmen Böden) deutlich abbremsen. Beispiel: Wirkungsweise bei Schwefelsäure: Ca (HCO3)2 + H2SO4 Ca SO4 + 2 H2CO3 Die Bestimmung des SBV erfolgt durch einfache Titration mit Salzsäure unter Zuhilfenahme von Indikatoren (z.b. Methylorange Umschlag von gelb auf rot) Je nach benötigter Salzsäuremenge ergibt sich ein bestimmter SBV-Wert, der sich proportional zur Carbonathärte verhält: Carbonathärte ( d) : 2,8 = SBV (z.b. Carbonathärte 5,6 d SBV = 2)
7 Der SBV ist also als Maß für die Belastungsfähigkeit des Gewässers hinsichtlich Versauerung zu wertem. Bestimmte Wasserlebewesen sind bezüglich des ph-wertes außerordentlich empfindlich ( <6 und >9 sind allgemein sehr kritische Werte) In Skandinavien konnten Seen, die wegen Versauerung bereits völlig fischfrei waren durch Kalkdüngung wieder erfolgreich mit Fischen besiedelt werden. Stickstoffverbindungen: Die Entstehung zahlreicher N-Verbindungen in Gewässern kann am besten über den Stickstoffkreislauf beschrieben werden: Das größte N-Reservoir ist die Luft mit 78% N. Dieser Luftstickstoff gelangt über Sauren - und Salmiakhaltigen (= wässrige Lösung von NH3) Regen in den Erdboden wo sich Nitrate bilden können. Eine andere Möglichkeit verläuft über die Tätigkeit der Mikroorganismen (Knöllchenbakterien) in Symbiose mit Hülsenfrüchtlern. Auf diesen Wegen wird also N über die Nahrungskette in Organsimen eingebracht! Die Ammonifikanten: Sterben diese Organismen ab, bzw. werden von ihnen N-haltige Ausscheidungen abgegeben (Harnstoff OC(NH2)2 / Harnsäure), so werden diese N- Verbindungen von den Ammonifikanten abgebaut, wobei Ammonium bzw. Ammoniak entstehen!
8 Dabei ist das Verhältnis zwischen dem hochgiftigen Ammoniak und dem relativ harmlosen Ammonium vom ph-wert der Umgebung (des Wassers) abhängig: NH4 + OH < > NH3 + H2O Bei stark alkalischen Werten steigt der Anteil an Ammoniak deutlich an! Das bedeutet, dass Ammonium-Ammoniakmessungen immer gemeinsam mit ph-wert- Messungen durchgeführt werden müssen um eine praxisgerechte Aussage zu ermöglichen: Misst man zum Beispiel bei ph = 6 einen Ammoniakgehalt von 5 mg/l, so ist dies für Fische völlig unbedenklich. Wird der ph-wert plötzlich auf 10 erhöht (z.b. durch Kalkdüngung Siehe SBV ), so sterben alle Fische blitzartig ab. Dabei ist nicht der kurzzeitig hohe ph-wert tödlich, sondern die dadurch hervorgerufene hohe Ammoniakkonzentration. Die Nitrifikation: NH3 und NH4 werden von speziellen Bakterien, den Nitrifikanten, über Nitrit zu Nitrat oxidiert. Der dafür erforderliche Sauerstoff wird unmittelbar dem Wasser entzogen (Sauerstoffzehrung!). Die Denitrifikation: Wenn in dem betroffenen Gewässer kein ausreichender Sauerstoff für die Nitrifikation zur Verfügung steht, erfolgt der Abbau bis zum Molekularen Stickstoff, der dann in die Atmosphäre entweicht.
9 Während Nitrit als eindeutig toxisch eingestuft wird, gilt dies für Nitrat nicht. Allerdings wird Nitrit im Organismus teils zu Nitrit umgebaut und wirkt sich so dennoch schädlich aus. Trinkwassergrenzwerte: Nitrit < 0,01 mg/l Nitrat < 50 mg/l (vor dem EU-Beitritt 100 mg/l) Die diesbezüglich größten Probleme bereiten Trinkwasserversorgungsanlagen in einem landwirtschaftlich intensiv genutzten Einzugsgebiet. Die jahreszeitliche Dynamik stehender Gewässer: Sommer (Teilzirkulation) Herbst (Vollzirkulation) Winter (Stagnation) Frühjahr (Vollzirkulation) Durch diesen Kreislauf ist es nur sehr schwer möglich, einmal in ein stehendes Gewässer eingebrachte Mineralstoffe zu eliminieren. Nachdem dies nur durch den Abtransport der Mineralstoffe oder der aufgebauten Biomasse möglich ist, kann meist nur in Fließgewässern von einer effektiven Selbstreinigung (Verdünnung?) gesprochen werden.
Bericht Zur Chemischen, Biologischen und Ökologischen Untersuchung der mittleren " Aisch" zwischen Dietersheim und Landkreisgrenze b.
 1 Bericht Zur Chemischen, Biologischen und Ökologischen Untersuchung der mittleren " Aisch" zwischen Dietersheim und Landkreisgrenze b. Mailach 2015 2 Sauerstoff-Gehalt O² Sättigung in % 3 ANMERKUNGEN:
1 Bericht Zur Chemischen, Biologischen und Ökologischen Untersuchung der mittleren " Aisch" zwischen Dietersheim und Landkreisgrenze b. Mailach 2015 2 Sauerstoff-Gehalt O² Sättigung in % 3 ANMERKUNGEN:
Analyse der Chemischen Wasseruntersuchungen der Aisch 2009
 Analyse der Chemischen Wasseruntersuchungen der Aisch 2009 Gemessen wurde an 3 verschiedenen Stellen der Aisch (Meßstellen lagen an der Brücke Birkenfeld/Schauerheim, oberhalb Wehr Pahres, Trafo Dachsbach)
Analyse der Chemischen Wasseruntersuchungen der Aisch 2009 Gemessen wurde an 3 verschiedenen Stellen der Aisch (Meßstellen lagen an der Brücke Birkenfeld/Schauerheim, oberhalb Wehr Pahres, Trafo Dachsbach)
Was bedeutet das für den See:
 Es wird viel über Düngung Phosphat, Nitrat, NOx und was sonst noch unsere Umwelt bedroht geredet. Hier wird ein Versuch gemacht die Wirkung von Phosphat und den Stickstoffweg über die Gülle ins Wasser
Es wird viel über Düngung Phosphat, Nitrat, NOx und was sonst noch unsere Umwelt bedroht geredet. Hier wird ein Versuch gemacht die Wirkung von Phosphat und den Stickstoffweg über die Gülle ins Wasser
Schnellbericht Elbe. Sächsischer Elbe - Längsschnitt. Dresden
 Abteilung Wasser, Boden, Wertstoffe Zur Wetterwarte 11, 01109 Dresden Internet: http://www.smul.sachsen.de/lfulg Schnellbericht Elbe Sächsischer Elbe - Längsschnitt Zehren/ Dresden Ausgewählte Untersuchungsergebnisse
Abteilung Wasser, Boden, Wertstoffe Zur Wetterwarte 11, 01109 Dresden Internet: http://www.smul.sachsen.de/lfulg Schnellbericht Elbe Sächsischer Elbe - Längsschnitt Zehren/ Dresden Ausgewählte Untersuchungsergebnisse
Fact Sheet Beurteilung der Wasserqualität
 bericht 2008 Fact Sheet Beurteilung der Wasserqualität Inhalt Entwicklung der Wasserqualität 1984-2008 Gesamtbeurteilung der Wasserqualität 2004-2008 Beurteilung BSB 5 2004-2008 Beurteilung DOC 2004-2008
bericht 2008 Fact Sheet Beurteilung der Wasserqualität Inhalt Entwicklung der Wasserqualität 1984-2008 Gesamtbeurteilung der Wasserqualität 2004-2008 Beurteilung BSB 5 2004-2008 Beurteilung DOC 2004-2008
Natürliche ökologische Energie- und Stoffkreisläufe
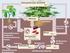 Informationsmaterialien über den ökologischen Landbau für den Unterricht an allgemein bildenden Schulen. Initiiert durch das Bundesministerium für Verbraucherschutz, Ernährung und Landwirtschaft im Rahmen
Informationsmaterialien über den ökologischen Landbau für den Unterricht an allgemein bildenden Schulen. Initiiert durch das Bundesministerium für Verbraucherschutz, Ernährung und Landwirtschaft im Rahmen
DEFINITIONEN REINES WASSER
 SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
Methoden der Hydrobiologie Süßwasserbiologie
 Jürgen Schwoerbel Methoden der Hydrobiologie Süßwasserbiologie i 4., neubearbeitete Auflage 134 Abbildungen und 39 Tabellen Gustav Fischer Verlag Stuttgart Jena 1 Einige physikalische und chemische Methoden
Jürgen Schwoerbel Methoden der Hydrobiologie Süßwasserbiologie i 4., neubearbeitete Auflage 134 Abbildungen und 39 Tabellen Gustav Fischer Verlag Stuttgart Jena 1 Einige physikalische und chemische Methoden
Praktische Übungen Chemie. Versuch 6
 Bauhaus-Universität Weimar Professur Bauchemie Prof. Dr. rer. nat. habil. Christian Kaps Praktische Übungen Chemie Versuch 6 Bestimmung der Wasserhärte Stand: April 2008 1. Grundlagen und Zielstellung
Bauhaus-Universität Weimar Professur Bauchemie Prof. Dr. rer. nat. habil. Christian Kaps Praktische Übungen Chemie Versuch 6 Bestimmung der Wasserhärte Stand: April 2008 1. Grundlagen und Zielstellung
der Jahre 1978 bis 2011 Betreiber: Landesamt für Umwelt, Wasserwirtschaft und Gewerbeaufsicht Rheinland-Pfalz
 der Jahre 1978 bis 2011 Betreiber: Landesamt für Umwelt, Wasserwirtschaft und Gewerbeaufsicht Rheinland-Pfalz Die Rheinwasser-Untersuchungsstation (RUSt) Mainz-Wiesbaden befindet sich unmittelbar neben
der Jahre 1978 bis 2011 Betreiber: Landesamt für Umwelt, Wasserwirtschaft und Gewerbeaufsicht Rheinland-Pfalz Die Rheinwasser-Untersuchungsstation (RUSt) Mainz-Wiesbaden befindet sich unmittelbar neben
Akkreditierungsumfang der Prüfstelle (EN ISO/IEC 17025:2005) K+U Umwelttechnik, Labor und Hydrologie GmbH / (Ident.Nr.: 0323)
 1 2 3 4 5 6 BGBl. II 304/2001 DIN 38402-11 DIN 38402-12 DIN 38402-13 DIN 38402-15 DIN 38402-19 2001-08 Verordnung des Bundesministers für soziale Sicherheit und Generationen über die Qualität von Wasser
1 2 3 4 5 6 BGBl. II 304/2001 DIN 38402-11 DIN 38402-12 DIN 38402-13 DIN 38402-15 DIN 38402-19 2001-08 Verordnung des Bundesministers für soziale Sicherheit und Generationen über die Qualität von Wasser
Analyse der Chemischen Wasseruntersuchungen der mittleren Aisch 2013
 Analyse der Chemischen Wasseruntersuchungen der mittleren Aisch 2013 Meßstellen: Pegel-Birkenfeld Flß/km 60,7 ; oberhalb Wehr Pahres Flß/km49,1; Trafo vor Dachsbach Flß./km 43,1 Anlagen: Diagramme und
Analyse der Chemischen Wasseruntersuchungen der mittleren Aisch 2013 Meßstellen: Pegel-Birkenfeld Flß/km 60,7 ; oberhalb Wehr Pahres Flß/km49,1; Trafo vor Dachsbach Flß./km 43,1 Anlagen: Diagramme und
Skriptum zur Laborübung Wasser und Umwelt
 Skriptum zur Laborübung Wasser und Umwelt 1 1 Wasser und Umwelt 2 1.1 Allgemein Tabelle 2.1: Inhaltsstoffe natürlicher Gewässer (Quelle: L. A. Hütter, Wasser und Wasseruntersuchung, Salle und Sauerländer)
Skriptum zur Laborübung Wasser und Umwelt 1 1 Wasser und Umwelt 2 1.1 Allgemein Tabelle 2.1: Inhaltsstoffe natürlicher Gewässer (Quelle: L. A. Hütter, Wasser und Wasseruntersuchung, Salle und Sauerländer)
Stoffe oder Teilchen, die Protonen abgeben kånnen, werden als SÄuren bezeichnet (Protonendonatoren).
 5 10 15 20 25 30 35 40 45 O C 50 Chemie Technische BerufsmaturitÄt BMS AGS Basel Kapitel 6 SÄuren und Basen Baars, Kap. 12.1; 12.2; 13 Versuch 1 Ein Becherglas mit Thermometer enthält violette FarbstofflÅsung
5 10 15 20 25 30 35 40 45 O C 50 Chemie Technische BerufsmaturitÄt BMS AGS Basel Kapitel 6 SÄuren und Basen Baars, Kap. 12.1; 12.2; 13 Versuch 1 Ein Becherglas mit Thermometer enthält violette FarbstofflÅsung
Die Qualität der Fliessgewässer im Kanton Schaffhausen. Übersicht 2002 Publikation zum UNO-Jahr des Süsswassers
 Die Qualität der Fliessgewässer im Kanton Schaffhausen Übersicht 2002 Publikation zum UNO-Jahr des Süsswassers Die Schaffhauser Fliessgewässer Gesetzlicher Auftrag des ALU s Das Amt für Lebensmittelkontrolle
Die Qualität der Fliessgewässer im Kanton Schaffhausen Übersicht 2002 Publikation zum UNO-Jahr des Süsswassers Die Schaffhauser Fliessgewässer Gesetzlicher Auftrag des ALU s Das Amt für Lebensmittelkontrolle
Nitratsanierung WASSER GEOTHERMIE MARKIERVERSUCHE SCHADSTOFFE FILTERTECHNIK LEBENSMITTEL NACHWACHSENDE ROHSTOFFE ISOTOPE
 Nitratsanierung WASSER GEOTHERMIE MARKIERVERSUCHE SCHADSTOFFE FILTERTECHNIK LEBENSMITTEL NACHWACHSENDE ROHSTOFFE HYDROISOTOP GMBH Woelkestraße 9 85301 Schweitenkirchen Tel. +49 (0)8444 / 92890 Fax +49
Nitratsanierung WASSER GEOTHERMIE MARKIERVERSUCHE SCHADSTOFFE FILTERTECHNIK LEBENSMITTEL NACHWACHSENDE ROHSTOFFE HYDROISOTOP GMBH Woelkestraße 9 85301 Schweitenkirchen Tel. +49 (0)8444 / 92890 Fax +49
HA + B A - + HB + Säuren und Basen. Definition nach Brønsted: Eine Säure ist ein Protonen-Donor, eine Base ein Protonen-Akzeptor!
 Säuren und Basen Definition nach Brønsted: Eine Säure ist ein Protonen-Donor, eine Base ein Protonen-Akzeptor! Die Tendenz ein Proton abzuspalten (Säure) bzw. aufzunehmen (Base) bezeichnet man als Säure-
Säuren und Basen Definition nach Brønsted: Eine Säure ist ein Protonen-Donor, eine Base ein Protonen-Akzeptor! Die Tendenz ein Proton abzuspalten (Säure) bzw. aufzunehmen (Base) bezeichnet man als Säure-
Zusammenfassung: Säure Base Konzept
 Zusammenfassung: Säure Base Konzept 1. Grundlegende Eigenschaften von Säuren und Laugen Säure und Laugen ätzen sie werden durch Indikatoren für uns erkenntlich gemacht. Oft verwendet man Universalindikator.
Zusammenfassung: Säure Base Konzept 1. Grundlegende Eigenschaften von Säuren und Laugen Säure und Laugen ätzen sie werden durch Indikatoren für uns erkenntlich gemacht. Oft verwendet man Universalindikator.
Essigsäure färbt ph-papier rot. Natronlauge färbt ph-papier blau
 5. SÄUREN UND BASEN ARBEITSBLATT 5.1 WAS SIND INDIKATOREN? DER PH-WERT SÄUREN und BASEN sind Stoffe die sich gegenseitig in ihrer Wirkung aufheben. INDIKATOREN sind Farbstoffe, die über Farbänderungen
5. SÄUREN UND BASEN ARBEITSBLATT 5.1 WAS SIND INDIKATOREN? DER PH-WERT SÄUREN und BASEN sind Stoffe die sich gegenseitig in ihrer Wirkung aufheben. INDIKATOREN sind Farbstoffe, die über Farbänderungen
Analyse der Chemischen Wasseruntersuchungen der mittleren Aisch 2012
 Analyse der Chemischen Wasseruntersuchungen der mittleren Aisch 2012 Meßstellen: Pegel-Birkenfeld Flß/km60,7 ; oberhalb Wehr Pahres Flß/km49,1 ; Trafo vor Dachsbach Flß/km43,1 Anlagen: Diagramme Chem.
Analyse der Chemischen Wasseruntersuchungen der mittleren Aisch 2012 Meßstellen: Pegel-Birkenfeld Flß/km60,7 ; oberhalb Wehr Pahres Flß/km49,1 ; Trafo vor Dachsbach Flß/km43,1 Anlagen: Diagramme Chem.
Holzsee. Sauerstoff-Profile Die Sauerstoff-Bedingungen in der oberflächennahen
 Seen-Monographien Gewässersystem Schwentine Einzugsgebiet (km ), Uferlänge (km), Wasserfläche (km ), Mittlere Tiefe, Maximale Tiefe,9 Theoret. Erneuerungszeit, Jahre Auswertung 99-9: Edith Reck-Mieth Temperatur-Profile
Seen-Monographien Gewässersystem Schwentine Einzugsgebiet (km ), Uferlänge (km), Wasserfläche (km ), Mittlere Tiefe, Maximale Tiefe,9 Theoret. Erneuerungszeit, Jahre Auswertung 99-9: Edith Reck-Mieth Temperatur-Profile
Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2007/
 Klausur zum Anorganisch-Chemischen Grundpraktikum vom 28.03.08 Seite 1 von 12 Punkte: von 94 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2007/2008 28.03.2008 Matrikelnummer: Name:
Klausur zum Anorganisch-Chemischen Grundpraktikum vom 28.03.08 Seite 1 von 12 Punkte: von 94 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2007/2008 28.03.2008 Matrikelnummer: Name:
Geplanter Verlauf. Einführung Beurteilung nach abiotischen Faktoren Pause Beurteilung nach biotischen Faktoren Auswertung und Diskussion
 Ökosystem See Geplanter Verlauf Einführung Beurteilung nach abiotischen Faktoren Pause Beurteilung nach biotischen Faktoren Auswertung und Diskussion Schulbiologiezentrum Hannover - Ökologie stehender
Ökosystem See Geplanter Verlauf Einführung Beurteilung nach abiotischen Faktoren Pause Beurteilung nach biotischen Faktoren Auswertung und Diskussion Schulbiologiezentrum Hannover - Ökologie stehender
7. Chemische Reaktionen
 7. Chemische Reaktionen 7.1 Thermodynamik chemischer Reaktionen 7.2 Säure Base Gleichgewichte Grundlagen Lösung: homogene Phase aus Lösungsmittel und gelösten Stoff Lösungsmittel liegt im Überschuss vor
7. Chemische Reaktionen 7.1 Thermodynamik chemischer Reaktionen 7.2 Säure Base Gleichgewichte Grundlagen Lösung: homogene Phase aus Lösungsmittel und gelösten Stoff Lösungsmittel liegt im Überschuss vor
Gewässeruntersuchung im Bienhorntal
 Gewässeruntersuchung im Bienhorntal Am Morgen des 4.7., eines Donnerstags, brachen wir gemeinsam zur zweiten Stunde auf. Unser Ziel war das Bienhorntal in Pfaffendorf. Als wir dort angekommen waren, verteilten
Gewässeruntersuchung im Bienhorntal Am Morgen des 4.7., eines Donnerstags, brachen wir gemeinsam zur zweiten Stunde auf. Unser Ziel war das Bienhorntal in Pfaffendorf. Als wir dort angekommen waren, verteilten
Boden- und Gewässerverschmutzung Seite 1 von 7. Ihr könnt den Aufbau un die Funktionsweise einer Pflanzenkläranalge beschreiben...
 Boden- und Gewässerverschmutzung Seite 1 von 7 SPF BCH. 3. Kanti Lernblatt zur Prüfung am 15.09.2011 Autor: Version: Veröffentlichung: Linus Metzler 1.0b 11.09.2011 BODEN- UND ZUNG GEWÄSSERVERSCHMUT- INHALTSVERZEICHNIS
Boden- und Gewässerverschmutzung Seite 1 von 7 SPF BCH. 3. Kanti Lernblatt zur Prüfung am 15.09.2011 Autor: Version: Veröffentlichung: Linus Metzler 1.0b 11.09.2011 BODEN- UND ZUNG GEWÄSSERVERSCHMUT- INHALTSVERZEICHNIS
I feel goo o d! Wissenschaftliche Grundlagen für klares Wasser. in tropischen Süßwasseraquarien
 I feel goo o d! Wissenschaftliche Grundlagen für klares Wasser in tropischen Süßwasseraquarien Philips hat diesen Wasserreiniger für tropische Aquarien in enger Zusammenarbeit mit Aquarien- und Wasserexperten
I feel goo o d! Wissenschaftliche Grundlagen für klares Wasser in tropischen Süßwasseraquarien Philips hat diesen Wasserreiniger für tropische Aquarien in enger Zusammenarbeit mit Aquarien- und Wasserexperten
Interpretation der chemischen und physikalischen Untersuchungen
 Interpretation der chemischen und physikalischen Untersuchungen in Fliessgewässern Für die Interpretation der chemischen (ph, Nitrat, Sauerstoff, Alkalinität), physikalischen (Temperatur, Transparenz,
Interpretation der chemischen und physikalischen Untersuchungen in Fliessgewässern Für die Interpretation der chemischen (ph, Nitrat, Sauerstoff, Alkalinität), physikalischen (Temperatur, Transparenz,
Fließgewässer - Lungwitzbach. BIOEXKURSION am BIO I
 Fließgewässer - Lungwitzbach BIOEXKURSION am 16.06.2008 BIO I Gliederung Allgemeines Gewässerstruktur Die biologische Wassergüte Chemische Parameter Anhang Allgemeines über den Lungwitzbach Am 16.06.2008
Fließgewässer - Lungwitzbach BIOEXKURSION am 16.06.2008 BIO I Gliederung Allgemeines Gewässerstruktur Die biologische Wassergüte Chemische Parameter Anhang Allgemeines über den Lungwitzbach Am 16.06.2008
Chemie aquatischer Systeme. Herbstsemester 2013
 Chemie aquatischer Systeme Herbstsemester 2013 Ziele der Vorlesung Verständnis der chemischen Zusammensetzung der Gewässer aufgrund chemischer Prozesse Verknüpfung chemischer Prozesse mit biologischen
Chemie aquatischer Systeme Herbstsemester 2013 Ziele der Vorlesung Verständnis der chemischen Zusammensetzung der Gewässer aufgrund chemischer Prozesse Verknüpfung chemischer Prozesse mit biologischen
ph-wert ph-wert eine Kenngröße für saure, neutrale oder basische Lösungen
 ph-wert ph-wert eine Kenngröße für saure, neutrale oder basische Lösungen ChemikerInnen verwenden den ph-wert um festzustellen, wie sauer oder basisch eine Lösung ist. Man verwendet eine Skala von 0-14:
ph-wert ph-wert eine Kenngröße für saure, neutrale oder basische Lösungen ChemikerInnen verwenden den ph-wert um festzustellen, wie sauer oder basisch eine Lösung ist. Man verwendet eine Skala von 0-14:
Themengebiet: 1 HA + H 2 O A - + H 3 O + H 3 O + : Oxonium- oder Hydroxoniumion. Themengebiet: 2 B + H 2 O BH + + OH - OH - : Hydroxidion
 1 1 Säuren sind Protonendonatoren, d.h. Stoffe, die an einen Reaktionspartner ein oder mehrere Protonen abgeben können; Säuredefinition nach Brönsted Im Falle von Wasser: HA + H 2 O A - + H 3 O + H 3 O
1 1 Säuren sind Protonendonatoren, d.h. Stoffe, die an einen Reaktionspartner ein oder mehrere Protonen abgeben können; Säuredefinition nach Brönsted Im Falle von Wasser: HA + H 2 O A - + H 3 O + H 3 O
Zur Klassifizierung von Säuren und Basen eignen sich daher andere Definitionen besser. Wasser. z.b. HCl H + (aq) + Cl - (aq).
 Wiederholungsthema: Säuren und Basen Zusammenfassung: Äpfel und Zitronen schmecken sauer; Milch wird sauer, wenn sie zu lange steht. Verantwortlich dafür sind Fruchtsäuren bzw. Milchsäure. Als Gegenspieler
Wiederholungsthema: Säuren und Basen Zusammenfassung: Äpfel und Zitronen schmecken sauer; Milch wird sauer, wenn sie zu lange steht. Verantwortlich dafür sind Fruchtsäuren bzw. Milchsäure. Als Gegenspieler
STÖCHIOMETRIE. die Lehre von der mengenmäßigen Zusammensetzung chemischer Verbindungen und den Mengenverhältnissen bei chemischen Reaktionen
 1 STÖCHIOMETRIE die Lehre von der mengenmäßigen Zusammensetzung chemischer Verbindungen und den Mengenverhältnissen bei chemischen Reaktionen 1) STOFFMENGE n(x) reine Zählgröße Menge der Elementarteilchen
1 STÖCHIOMETRIE die Lehre von der mengenmäßigen Zusammensetzung chemischer Verbindungen und den Mengenverhältnissen bei chemischen Reaktionen 1) STOFFMENGE n(x) reine Zählgröße Menge der Elementarteilchen
3.2. Aufgaben zu Säure-Base-Gleichgewichten
 .. Aufgaben zu Säure-Base-Gleichgewichten Aufgabe : Herstellung saurer und basischer Lösungen Gib die Reaktionsgleichungen für die Herstellung der folgenden Lösungen durch Reaktion der entsprechenden Oxide
.. Aufgaben zu Säure-Base-Gleichgewichten Aufgabe : Herstellung saurer und basischer Lösungen Gib die Reaktionsgleichungen für die Herstellung der folgenden Lösungen durch Reaktion der entsprechenden Oxide
Die Qualität der Fliessgewässer im Kanton Schaffhausen. Übersicht 2007/08
 Die Qualität der Fliessgewässer im Kanton Schaffhausen Übersicht 2007/08 Die Schaffhauser Fliessgewässer Gesetzlicher Auftrag Nitrat Das Qualitätsziel für Fliessgewässer beträgt max. 25 mg Nitrat pro Liter.
Die Qualität der Fliessgewässer im Kanton Schaffhausen Übersicht 2007/08 Die Schaffhauser Fliessgewässer Gesetzlicher Auftrag Nitrat Das Qualitätsziel für Fliessgewässer beträgt max. 25 mg Nitrat pro Liter.
CHEMIE KAPITEL 4 SÄURE-BASE. Timm Wilke. Georg-August-Universität Göttingen. Wintersemester 2013 / 2014
 CHEMIE KAPITEL 4 SÄURE-BASE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Aufgaben In einen Liter Wasser werden 2 g NH - 2 (starke Base) eingeleitet welchen ph-wert hat
CHEMIE KAPITEL 4 SÄURE-BASE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Aufgaben In einen Liter Wasser werden 2 g NH - 2 (starke Base) eingeleitet welchen ph-wert hat
Abschätzung der Gewässergüte mit Hilfe Chemischer Indices
 Abschätzung der Gewässergüte mit Hilfe Chemischer Indices Dr. Claus Kuhnhardt, Agenda 21 Oranienburg e.v. Aufgabenstellung Die Europäische Wasserrahmenrichtlinie fordert, dass Gewässer den guten ökologischen
Abschätzung der Gewässergüte mit Hilfe Chemischer Indices Dr. Claus Kuhnhardt, Agenda 21 Oranienburg e.v. Aufgabenstellung Die Europäische Wasserrahmenrichtlinie fordert, dass Gewässer den guten ökologischen
Gewässerüberwachung im Bereich der Kaliindustrie durch das HLUG Stand
 Gewässerüberwachung im Bereich der Kaliindustrie durch das HLUG Stand 31.12.2008 Inhaltsverzeichnis Gewässerüberwachung im Bereich der Kaliindustrie durch das HLUG - Erläuterungen. Übersichtskarte HLUG-Messstellen
Gewässerüberwachung im Bereich der Kaliindustrie durch das HLUG Stand 31.12.2008 Inhaltsverzeichnis Gewässerüberwachung im Bereich der Kaliindustrie durch das HLUG - Erläuterungen. Übersichtskarte HLUG-Messstellen
Säurekapazität in der Belebung einer Kläranlage
 LV Bayern, Besprechung der Lehrer Kläranlagen-Nachbarschaft 2014 Säurekapazität in der Belebung einer Kläranlage Dipl.-Ing. Annette Schlicher, Struktur- und Genehmigungsdirektion Süd, Regionalstelle Wasserwirtschaft,
LV Bayern, Besprechung der Lehrer Kläranlagen-Nachbarschaft 2014 Säurekapazität in der Belebung einer Kläranlage Dipl.-Ing. Annette Schlicher, Struktur- und Genehmigungsdirektion Süd, Regionalstelle Wasserwirtschaft,
Stickstoff-Kreislauf. Ökopedologie I + II
 StickstoffKreislauf Ökopedologie I II Nährstoffkreislauf in Ökosystemen Stickstoffkreislauf Stickstoffkreislauf Ammonifikation und Nitrifikation Stickstoffmineralisation Ammoniak Ammonium Nitrit Nitrat
StickstoffKreislauf Ökopedologie I II Nährstoffkreislauf in Ökosystemen Stickstoffkreislauf Stickstoffkreislauf Ammonifikation und Nitrifikation Stickstoffmineralisation Ammoniak Ammonium Nitrit Nitrat
C Säure-Base-Reaktionen
 -V.C1- C Säure-Base-Reaktionen 1 Autoprotolyse des Wassers und ph-wert 1.1 Stoffmengenkonzentration Die Stoffmengenkonzentration eines gelösten Stoffes ist der Quotient aus der Stoffmenge und dem Volumen
-V.C1- C Säure-Base-Reaktionen 1 Autoprotolyse des Wassers und ph-wert 1.1 Stoffmengenkonzentration Die Stoffmengenkonzentration eines gelösten Stoffes ist der Quotient aus der Stoffmenge und dem Volumen
Elektrochemie und Sauerstoffmessung mit LDO. Der gelöste Sauerstoff
 Elektrochemie und Sauerstoffmessung mit LDO Der gelöste Sauerstoff 2 Was ist gelöster Sauerstoff? Gelöster Sauerstoff beschreibt die Konzentration von freiem (nicht chemisch gebundenem) molekularem Sauerstoff
Elektrochemie und Sauerstoffmessung mit LDO Der gelöste Sauerstoff 2 Was ist gelöster Sauerstoff? Gelöster Sauerstoff beschreibt die Konzentration von freiem (nicht chemisch gebundenem) molekularem Sauerstoff
Aufgabe 1: Geben Sie die korrespondierenden Basen zu folgenden Verbindungen an: a) H 3 PO 4 b) H 2 PO 4
 Übungsaufgaben zum Thema Säuren, Basen und Puffer Säure/Base Definition nach Brǿnsted: Säuren sind Stoffe, die Protonen abgeben können (Protonendonatoren). Basen sind Stoffe, die Protonen aufnehmen können
Übungsaufgaben zum Thema Säuren, Basen und Puffer Säure/Base Definition nach Brǿnsted: Säuren sind Stoffe, die Protonen abgeben können (Protonendonatoren). Basen sind Stoffe, die Protonen aufnehmen können
Geplanter Verlauf. Einführung Beurteilung nach biotischen Faktoren Pause Beurteilung nach abiotischen Faktoren Auswertung und Diskussion
 Ökosystem See Geplanter Verlauf Einführung Beurteilung nach biotischen Faktoren Pause Beurteilung nach abiotischen Faktoren Auswertung und Diskussion Schulbiologiezentrum Hannover - Ökologie stehende Gewässer
Ökosystem See Geplanter Verlauf Einführung Beurteilung nach biotischen Faktoren Pause Beurteilung nach abiotischen Faktoren Auswertung und Diskussion Schulbiologiezentrum Hannover - Ökologie stehende Gewässer
Säure/Base - Reaktionen. 6) Titration starker und schwacher Säuren/Basen
 Säure/Base - Reaktionen 1) Elektrolytische Dissoziation 2) Definitionen Säuren Basen 3) Autoprotolyse 4) ph- und poh-wert 5) Stärke von Säure/Basen 6) Titration starker und schwacher Säuren/Basen 7) Puffersysteme
Säure/Base - Reaktionen 1) Elektrolytische Dissoziation 2) Definitionen Säuren Basen 3) Autoprotolyse 4) ph- und poh-wert 5) Stärke von Säure/Basen 6) Titration starker und schwacher Säuren/Basen 7) Puffersysteme
Name: Punktzahl: von 57 Note:
 Testen Sie Ihr Wissen! Übungsprobe zu den Tertia-Themen und Säure-Base-Reaktionen Name: Punktzahl: von 57 Note: Für die folgenden Fragen haben Sie 60 Minuten Zeit. Viel Erfolg! Hilfsmittel: das ausgeteilte
Testen Sie Ihr Wissen! Übungsprobe zu den Tertia-Themen und Säure-Base-Reaktionen Name: Punktzahl: von 57 Note: Für die folgenden Fragen haben Sie 60 Minuten Zeit. Viel Erfolg! Hilfsmittel: das ausgeteilte
STS-Verzeichnis Akkreditierungsnummer: STS 0451
 Internationale Norm: ISO/IEC 17025:2005 Schweizer Norm: SN EN ISO/IEC 17025:2005 Amt für Umwelt des Kantons Thurgau Abteilung Gewässerqualität Bahnhofstrasse 55 8510 Frauenfeld Leiter: Heinz Ehmann MS-Verantwortlicher:
Internationale Norm: ISO/IEC 17025:2005 Schweizer Norm: SN EN ISO/IEC 17025:2005 Amt für Umwelt des Kantons Thurgau Abteilung Gewässerqualität Bahnhofstrasse 55 8510 Frauenfeld Leiter: Heinz Ehmann MS-Verantwortlicher:
allgemeine Aussagen zum Wasser Aufgaben des Wassers Aggregatzustände Aufbau des Wassermoleküls
 Gliederung allgemeine Aussagen zum Wasser Aufgaben des Wassers Aggregatzustände Aufbau des Wassermoleküls physikalische Eigenschaften Lichtdurchlässigkeit Wassertemperatur, Wärmespeichervermögen Dichte,
Gliederung allgemeine Aussagen zum Wasser Aufgaben des Wassers Aggregatzustände Aufbau des Wassermoleküls physikalische Eigenschaften Lichtdurchlässigkeit Wassertemperatur, Wärmespeichervermögen Dichte,
Zusammenfassung vom
 Zusammenfassung vom 20.10. 09 Löslichkeitsprodukt = quantitative Aussage über die Löslichkeit einer schwerlöslichen Verbindung bei gegebener Temperatur A m B n m A n+ + n B m- K L = (c A n+ ) m (c B m-
Zusammenfassung vom 20.10. 09 Löslichkeitsprodukt = quantitative Aussage über die Löslichkeit einer schwerlöslichen Verbindung bei gegebener Temperatur A m B n m A n+ + n B m- K L = (c A n+ ) m (c B m-
Abschlussklausur Anorganische Chemie für Geowissenschaftler II Modul BGEO2.5.1
 Abschlussklausur Anorganische Chemie für Geowissenschaftler II Modul BGEO2.5.1 Name, Vorname:... MatrikelNr.:... 1. Bei der Anionenanalyse (Analyse 4) gab es eine wichtige Vorprobe, nämlich die Probe darauf,
Abschlussklausur Anorganische Chemie für Geowissenschaftler II Modul BGEO2.5.1 Name, Vorname:... MatrikelNr.:... 1. Bei der Anionenanalyse (Analyse 4) gab es eine wichtige Vorprobe, nämlich die Probe darauf,
Limnochemisches Praktikum
 TU Dresden Institut für Wasserchemie Bestimmung des m-wertes sowie des CSB verschiedener Wässer Theoretische Grundlagen Limnochemisches Praktikum 1. Theoretische Grundlagen zur Bestimmung des m-wertes
TU Dresden Institut für Wasserchemie Bestimmung des m-wertes sowie des CSB verschiedener Wässer Theoretische Grundlagen Limnochemisches Praktikum 1. Theoretische Grundlagen zur Bestimmung des m-wertes
Schülerpraktikum und Girlsday
 Hochschule RheinMain University of Applied Sciences Schülerpraktikum und Girlsday im Labor für Siedlungswasserwirtschaft Thema Umweltmonitoring Fließgewässer" Dipl.-Ing. Paul Guckelsberger DownloadInfos:
Hochschule RheinMain University of Applied Sciences Schülerpraktikum und Girlsday im Labor für Siedlungswasserwirtschaft Thema Umweltmonitoring Fließgewässer" Dipl.-Ing. Paul Guckelsberger DownloadInfos:
Gülle und CO. Hohenems 6. April Unsere Land- und Forstwirtschaft. Wertvoll fürs Land. Ing. Christian Meusburger/ Folie 1
 Gülle und CO Hohenems 6. April 2016 Ing. Christian Meusburger/ Folie 1 Ing. Christian Meusburger/ Folie 2 Stickstoff Ab-Um-Aufbau Als Nitrifikation bezeichnet man die bakterielle Oxidation von Ammoniak
Gülle und CO Hohenems 6. April 2016 Ing. Christian Meusburger/ Folie 1 Ing. Christian Meusburger/ Folie 2 Stickstoff Ab-Um-Aufbau Als Nitrifikation bezeichnet man die bakterielle Oxidation von Ammoniak
Analyse der Chemischen/Biologischen Wasseruntersuchungen der mittleren Aisch 2011
 Analyse der Chemischen/Biologischen Wasseruntersuchungen der mittleren Aisch 2011 Meßstellen: Pegel-Birkenfeld Flß/km60,7 ; oberhalb Wehr Pahres Flß/km49,1 ; Trafo vor Dachsbach Flß/km43,1 Anlagen: Diagramme
Analyse der Chemischen/Biologischen Wasseruntersuchungen der mittleren Aisch 2011 Meßstellen: Pegel-Birkenfeld Flß/km60,7 ; oberhalb Wehr Pahres Flß/km49,1 ; Trafo vor Dachsbach Flß/km43,1 Anlagen: Diagramme
Übungsaufgaben zu Ionenreaktionen in wässriger Lösung
 Übungsaufgaben zu Ionenreaktionen in wässriger Lösung 1) Berechnen Sie den phwert von folgenden Lösungen: a) 0.01 M HCl b) 3 10 4 M KOH c) 0.1 M NaOH d) 0.1 M CH 3 COOH (*) e) 0.3 M NH 3 f) 10 8 M HCl
Übungsaufgaben zu Ionenreaktionen in wässriger Lösung 1) Berechnen Sie den phwert von folgenden Lösungen: a) 0.01 M HCl b) 3 10 4 M KOH c) 0.1 M NaOH d) 0.1 M CH 3 COOH (*) e) 0.3 M NH 3 f) 10 8 M HCl
Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2005/
 Klausur zum Anorganisch-Chemischen Grundpraktikum vom 07.04.06 Seite 1 von 10 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2005/2006 07.04.2006 Matrikelnummer: Name: Vorname: Bitte
Klausur zum Anorganisch-Chemischen Grundpraktikum vom 07.04.06 Seite 1 von 10 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2005/2006 07.04.2006 Matrikelnummer: Name: Vorname: Bitte
SÄUREN, BASEN, ph-wert
 8. Einheit: SÄUREN, BASEN, ph-wert Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 23 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Säuren, Basen, ph-wert.. können Sie die Begriffe Säure und Base in
8. Einheit: SÄUREN, BASEN, ph-wert Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 23 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Säuren, Basen, ph-wert.. können Sie die Begriffe Säure und Base in
Lösung Sauerstoff: 1s 2 2s 2 2p 4, Bor: 1s 2 2s 2 2p 1, Chlor: 1s 2 2s 2 2p 6 3s 2 3p 5 Neon: 1s 2 2s 2 2p 6
 1 of 6 10.05.2005 10:56 Lösung 1 1.1 1 mol Natrium wiegt 23 g => 3 mol Natrium wiegen 69 g. 1 mol Na enthält N A = 6.02 x 10 23 Teilchen => 3 mol enthalten 1.806 x 10 24 Teilchen. 1.2 Ein halbes mol Wasser
1 of 6 10.05.2005 10:56 Lösung 1 1.1 1 mol Natrium wiegt 23 g => 3 mol Natrium wiegen 69 g. 1 mol Na enthält N A = 6.02 x 10 23 Teilchen => 3 mol enthalten 1.806 x 10 24 Teilchen. 1.2 Ein halbes mol Wasser
Analyse der Chemischen Wasseruntersuchungen der mittleren Aisch zwischen Flß. km 60,7 und Flß. km 43,1 im Jahr 2014
 Analyse der Chemischen Wasseruntersuchungen der mittleren Aisch zwischen Flß. km 60,7 und Flß. km 43,1 im Jahr 2014 Meßstellen: Brücke Birkenfeld Flß.km 60,7 und Trafo oberhalb Dachsbach Anlagen: Diagramme
Analyse der Chemischen Wasseruntersuchungen der mittleren Aisch zwischen Flß. km 60,7 und Flß. km 43,1 im Jahr 2014 Meßstellen: Brücke Birkenfeld Flß.km 60,7 und Trafo oberhalb Dachsbach Anlagen: Diagramme
Nitrifikation Nitritoxidation. Von Patrycja Kosnik und Nico Tennigkeit
 Nitrifikation Nitritoxidation Von Patrycja Kosnik und Nico Tennigkeit Als Nitrifikation bezeichnet man die Oxidation von Ammoniak über Nitrit zu Nitrat Die Oxidation ist in zwei Schritte unterteilt, wobei
Nitrifikation Nitritoxidation Von Patrycja Kosnik und Nico Tennigkeit Als Nitrifikation bezeichnet man die Oxidation von Ammoniak über Nitrit zu Nitrat Die Oxidation ist in zwei Schritte unterteilt, wobei
VL Limnochemie. Grundlegendes zu Gasen in Lösungen wie Sauerstoff in einer Wasserprobe bestimmt werden kann Sauerstoff in Gewässern
 Sauerstoff VL Limnochemie Und heute Grundlegendes zu Gasen in Lösungen wie Sauerstoff in einer Wasserprobe bestimmt werden kann Sauerstoff in Gewässern 1 Inhalt Wiederholung Henry-Gesetz Sauerstoffmessung
Sauerstoff VL Limnochemie Und heute Grundlegendes zu Gasen in Lösungen wie Sauerstoff in einer Wasserprobe bestimmt werden kann Sauerstoff in Gewässern 1 Inhalt Wiederholung Henry-Gesetz Sauerstoffmessung
2. Teilklausur zum Chemischen Grundpraktikum im WS 2012/13 vom
 2. Teilklausur zum Chemischen Grundpraktikum im WS 2012/13 vom 30.01.2013 A1 A2 A3 R4 F5 E6 Σ Note 8 9 8 9 8 8 50 NAME/VORNAME:... Matrikelnummer: Stichpunkte zu den Lösungen/AC... Pseudonym für Ergebnisveröffentlichung
2. Teilklausur zum Chemischen Grundpraktikum im WS 2012/13 vom 30.01.2013 A1 A2 A3 R4 F5 E6 Σ Note 8 9 8 9 8 8 50 NAME/VORNAME:... Matrikelnummer: Stichpunkte zu den Lösungen/AC... Pseudonym für Ergebnisveröffentlichung
Ei ne P ä r sentati ti on vo n T om D ro t s e, P t e er Haak k und Patrick Schürmann
 Ei P ä tti T D t P t H k d Eine Präsentation von Tom Droste, Peter Haak und Patrick Schürmann Inhaltsverzeichnis Allgemein: Was ist Stickstofffixierung? Welche Arten der Fixierung gibt es? Welchen Zweck
Ei P ä tti T D t P t H k d Eine Präsentation von Tom Droste, Peter Haak und Patrick Schürmann Inhaltsverzeichnis Allgemein: Was ist Stickstofffixierung? Welche Arten der Fixierung gibt es? Welchen Zweck
Angewandte Hydrobiologie
 Otto/Klee Angewandte Hydrobiologie Trinkwasser - Abwasser - Gewässerschutz 112 Abbildungen, 28 Tabellen UNIVERSITÄTS- BIBLIOTHEK 1985 Georg Thieme Verlag Stuttgart New York Inhaltsverzeichnis 1. Einführung
Otto/Klee Angewandte Hydrobiologie Trinkwasser - Abwasser - Gewässerschutz 112 Abbildungen, 28 Tabellen UNIVERSITÄTS- BIBLIOTHEK 1985 Georg Thieme Verlag Stuttgart New York Inhaltsverzeichnis 1. Einführung
Anlage zur Akkreditierungsurkunde D-PL nach DIN EN ISO/IEC 17025:2018
 Deutsche Akkreditierungsstelle GmbH Anlage zur Akkreditierungsurkunde D-PL-19140-01-00 nach DIN EN ISO/IEC 17025:2018 Urkundeninhaber: bioplan Institut für angewandte Biologie und Landschaftsplanung GmbH
Deutsche Akkreditierungsstelle GmbH Anlage zur Akkreditierungsurkunde D-PL-19140-01-00 nach DIN EN ISO/IEC 17025:2018 Urkundeninhaber: bioplan Institut für angewandte Biologie und Landschaftsplanung GmbH
Dauerüberwachung der Fliessgewässer in den Urkantonen
 Ein gemeinsames Projekt der Kantone Uri, Schwyz, Obwalden, Nidwalden und Luzern Dauerüberwachung der Fliessgewässer in den Urkantonen Datenanhang Kanton Luzern 2000 bis 2003 nhaltsverzeichnis ÜBERSCHT
Ein gemeinsames Projekt der Kantone Uri, Schwyz, Obwalden, Nidwalden und Luzern Dauerüberwachung der Fliessgewässer in den Urkantonen Datenanhang Kanton Luzern 2000 bis 2003 nhaltsverzeichnis ÜBERSCHT
Themen heute: Säuren und Basen, Redoxreaktionen
 Wiederholung der letzten Vorlesungsstunde: Massenwirkungsgesetz, Prinzip des kleinsten Zwangs, Löslichkeitsprodukt, Themen heute: Säuren und Basen, Redoxreaktionen Vorlesung Allgemeine Chemie, Prof. Dr.
Wiederholung der letzten Vorlesungsstunde: Massenwirkungsgesetz, Prinzip des kleinsten Zwangs, Löslichkeitsprodukt, Themen heute: Säuren und Basen, Redoxreaktionen Vorlesung Allgemeine Chemie, Prof. Dr.
Aufgabe 1.1 Welche der folgenden Aussagen in Bezug auf nachfolgende Reaktionsgleichung ist falsch? HCl + NH3 NH4 + + Cl -
 1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen in Bezug auf nachfolgende Reaktionsgleichung ist falsch? HCl + NH3 NH4 + + Cl - A) Salzsäure ist eine stärkere
1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen in Bezug auf nachfolgende Reaktionsgleichung ist falsch? HCl + NH3 NH4 + + Cl - A) Salzsäure ist eine stärkere
Jana Platz, Hanna Vogler & Sarah Bach OHG Bi L1, Herr Kohlhepp Protokoll. Meerfelder Maar und Windsborn Kratersee Chemische Untersuchungen
 Jana Platz, Hanna Vogler & Sarah Bach OHG Bi L1, Herr Kohlhepp 11.11.212 Protokoll und Chemische Untersuchungen Windbsorn Datum: 16.8.212 Datum: 16.8.212 Uhrzeit: 1 Uhr Uhrzeit: 1:3 Uhr Analyse am 16.8.212
Jana Platz, Hanna Vogler & Sarah Bach OHG Bi L1, Herr Kohlhepp 11.11.212 Protokoll und Chemische Untersuchungen Windbsorn Datum: 16.8.212 Datum: 16.8.212 Uhrzeit: 1 Uhr Uhrzeit: 1:3 Uhr Analyse am 16.8.212
Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2005/
 Nachklausur zum Anorganisch-Chemischen Grundpraktikum vom 21.04.06 Seite 1 von 10 Punkte: von 98 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2005/2006 21.04.2006 Matrikelnummer:
Nachklausur zum Anorganisch-Chemischen Grundpraktikum vom 21.04.06 Seite 1 von 10 Punkte: von 98 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2005/2006 21.04.2006 Matrikelnummer:
Nachklausur zum Praktikum Allgemeine und Anorganische Chemie für Naturwissenschaftler Sommersemester 2007
 Nachklausur zum Praktikum Allgemeine und Anorganische Chemie für Naturwissenschaftler Sommersemester 2007 Name: Matr. Nr.: Studiengang (Bachelor/Diplom): Ergebnis: Punkte/Note: Aufg 1 2 3 4 5 6 7 8 9 10
Nachklausur zum Praktikum Allgemeine und Anorganische Chemie für Naturwissenschaftler Sommersemester 2007 Name: Matr. Nr.: Studiengang (Bachelor/Diplom): Ergebnis: Punkte/Note: Aufg 1 2 3 4 5 6 7 8 9 10
Wasser. Flora und Fauna. Wichtigste chemische Verbindung in Lebewesen. Menschen benötigt mindestens 1kg H 2 O pro Tag
 Wasser Flora und Fauna Wichtigste chemische Verbindung in Lebewesen Menschen benötigt mindestens 1kg H 2 O pro Tag Löslichkeit von Sauerstoff in Wasser in Abhängigkeit von der Temperatur mg/l Zustandsdiagramm
Wasser Flora und Fauna Wichtigste chemische Verbindung in Lebewesen Menschen benötigt mindestens 1kg H 2 O pro Tag Löslichkeit von Sauerstoff in Wasser in Abhängigkeit von der Temperatur mg/l Zustandsdiagramm
Chemie Mathematik * Jahrgangsstufe 10 * ph-wert und Logarithmen
 Chemie Mathematik * Jahrgangsstufe 10 * p-wert und Logarithmen Vorkenntnisse über Säuren und Basen Säuren sind Protonendonatoren: Cl 2 O Cl O Salzsäure Cl Clor-Ion Cl Oxonium-Ion O Basen sind Protonenakzeptoren:
Chemie Mathematik * Jahrgangsstufe 10 * p-wert und Logarithmen Vorkenntnisse über Säuren und Basen Säuren sind Protonendonatoren: Cl 2 O Cl O Salzsäure Cl Clor-Ion Cl Oxonium-Ion O Basen sind Protonenakzeptoren:
Angewandte Hydrobiologie
 Angewandte Hydrobiologie Trinkwasser - Abwasser - Gewässerschutz Otto Klee 2., neubearbeitete und erweiterte Auflage 151 Abbildungen, 29 Tabellen Technische Hochschule Darmstadt FACHBEREICH 10 - BIOLOGIE
Angewandte Hydrobiologie Trinkwasser - Abwasser - Gewässerschutz Otto Klee 2., neubearbeitete und erweiterte Auflage 151 Abbildungen, 29 Tabellen Technische Hochschule Darmstadt FACHBEREICH 10 - BIOLOGIE
Das chemische Gleichgewicht, Massenwirkungsgesetz, Löslichkeit von Salzen in Flüssigkeiten, Löslichkeitsprodukt, Chemische Gleichgewichte, Säuren und
 Wiederholung der letzten Vorlesungsstunde: Das chemische Gleichgewicht, Massenwirkungsgesetz, Löslichkeit von Salzen in Flüssigkeiten, Löslichkeitsprodukt, Thema heute: Chemische Gleichgewichte, Säuren
Wiederholung der letzten Vorlesungsstunde: Das chemische Gleichgewicht, Massenwirkungsgesetz, Löslichkeit von Salzen in Flüssigkeiten, Löslichkeitsprodukt, Thema heute: Chemische Gleichgewichte, Säuren
Einteilung der Maßanalyse
 Einteilung der Maßanalyse Neutralisation (Säure-Base-Titration Acidimetrie Alkalimetrie Fällungstitration Redoxtitration Iodometrie Dichromatometrie Manganometrie etc. Komplexometrie Säure/Basen Theorien
Einteilung der Maßanalyse Neutralisation (Säure-Base-Titration Acidimetrie Alkalimetrie Fällungstitration Redoxtitration Iodometrie Dichromatometrie Manganometrie etc. Komplexometrie Säure/Basen Theorien
Inhalt und Einsatz im Unterricht
 Inhalt und Einsatz im Unterricht "Ökosystem Fließgewässer II" 2 (Biologie Sek. II) Diese DVD behandelt das Unterrichtsthema Ökosystem Fließgewässer II für die Sekundarstufe II. Im DVD-Hauptmenü finden
Inhalt und Einsatz im Unterricht "Ökosystem Fließgewässer II" 2 (Biologie Sek. II) Diese DVD behandelt das Unterrichtsthema Ökosystem Fließgewässer II für die Sekundarstufe II. Im DVD-Hauptmenü finden
Biologische Abwasserreinigung und Belüftung Auswirkungen auf den Betrieb von KKA
 Biologische Abwasserreinigung und Belüftung Auswirkungen auf den Betrieb von KKA Prof. Dr.-Ing. Jens Nowak FH Potsdam AKUT Umweltschutz Ingenieure Burkard und Partner Berlin Prof. Dr.-Ing. Jens Nowak Obmann
Biologische Abwasserreinigung und Belüftung Auswirkungen auf den Betrieb von KKA Prof. Dr.-Ing. Jens Nowak FH Potsdam AKUT Umweltschutz Ingenieure Burkard und Partner Berlin Prof. Dr.-Ing. Jens Nowak Obmann
A B - AB K D. Elektrolytische Dissoziation. AB(aq) Stoffe, die in Lösung Ionen bilden, heißen Elektrolyte. Es gilt das Massenwirkungsgesetz
 Elektrolytische Dissoziation AB(aq) A + (aq) + B - (aq) Stoffe, die in Lösung Ionen bilden, heißen Elektrolyte. Es gilt das Massenwirkungsgesetz K D A B - AB K D : Dissoziationskonstante Dissoziation ist
Elektrolytische Dissoziation AB(aq) A + (aq) + B - (aq) Stoffe, die in Lösung Ionen bilden, heißen Elektrolyte. Es gilt das Massenwirkungsgesetz K D A B - AB K D : Dissoziationskonstante Dissoziation ist
3.1.2 Oberflächenwasser
 3.1.2 Oberflächenwasser - Die chemische Zusammensetzung hängt vom Untergrund des Einzugsgebietes, von der Zusammensetzung und der Menge des Niederschlages sowie von Zu- und Abfluss ab. - Flusswasser hat
3.1.2 Oberflächenwasser - Die chemische Zusammensetzung hängt vom Untergrund des Einzugsgebietes, von der Zusammensetzung und der Menge des Niederschlages sowie von Zu- und Abfluss ab. - Flusswasser hat
Chemie wässriger Lösungen
 Probenaufbereitung Aufschlusstechniken Beispiel: Nasse Veraschung mit Königswasser KönigswasserAufschluss HNO 3 + 3 HCl NOCl + 2Cl + 2 H 2 O Au + 3 Cl + Cl [AuCl 4 ] Tetrachloroaurat(III) Pt + 4 Cl + 2Cl
Probenaufbereitung Aufschlusstechniken Beispiel: Nasse Veraschung mit Königswasser KönigswasserAufschluss HNO 3 + 3 HCl NOCl + 2Cl + 2 H 2 O Au + 3 Cl + Cl [AuCl 4 ] Tetrachloroaurat(III) Pt + 4 Cl + 2Cl
Fragen zum Thema chemische Reaktionen Klasse 4 1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion
 1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion vorliegen? 3. Wie nennt man die Stoffe, die nach der Reaktion vorliegen? 4. Womit wird die Richtung
1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion vorliegen? 3. Wie nennt man die Stoffe, die nach der Reaktion vorliegen? 4. Womit wird die Richtung
Laborbücher Chemie. Wasser und Wasseruntersuchung. Leonhard A. Hütter. Verlag Moritz Diesterweg Otto Salle Verlag. Verlag Sauerländer
 Laborbücher Chemie W. A. R. - Bibliothek.-Nr. O. OC Wasser und Wasseruntersuchung Methodik, Theorie und Praxis chemischer, chemisch-physikalischer und bakteriologischer Untersuchungsverfahren Leonhard
Laborbücher Chemie W. A. R. - Bibliothek.-Nr. O. OC Wasser und Wasseruntersuchung Methodik, Theorie und Praxis chemischer, chemisch-physikalischer und bakteriologischer Untersuchungsverfahren Leonhard
Anorganische-Chemie. Michael Beetz Arbeitskreis Prof. Bein. Grundpraktikum für Biologen 2017
 Michael Beetz Arbeitskreis Prof. Bein Butenandstr. 11, Haus E, E 3.027 michael.beetz@cup.uni-muenchen.de Anorganische-Chemie Grundpraktikum für Biologen 2017 Trennungsgänge und Nachweise # 2 Trennungsgänge
Michael Beetz Arbeitskreis Prof. Bein Butenandstr. 11, Haus E, E 3.027 michael.beetz@cup.uni-muenchen.de Anorganische-Chemie Grundpraktikum für Biologen 2017 Trennungsgänge und Nachweise # 2 Trennungsgänge
Wiederholungen. Puffergleichung (Henderson-Hasselbalch) Ionenprodukt des Wassers. ph-wert-berechnungen. Titrationskurvenberechnung
 Vorlesung 22: Wiederholungen Puffergleichung (Henderson-Hasselbalch) Ionenprodukt des Wassers ph-wert-berechnungen Titrationskurvenberechnung Säuren und Basen Hydroxonium + Chlorid Ammonium + Hydroxid
Vorlesung 22: Wiederholungen Puffergleichung (Henderson-Hasselbalch) Ionenprodukt des Wassers ph-wert-berechnungen Titrationskurvenberechnung Säuren und Basen Hydroxonium + Chlorid Ammonium + Hydroxid
Abschlussklausur Allgemeine und Anorganische Chemie Teil 2 (Geologie, Geophysik und Mineralogie)
 Abschlussklausur Allgemeine und Anorganische Chemie Teil 2 (Geologie, Geophysik und Mineralogie) Teilnehmer/in:... Matrikel-Nr.:... - 1. Sie sollen aus NaCl und Wasser 500 ml einer Lösung herstellen, die
Abschlussklausur Allgemeine und Anorganische Chemie Teil 2 (Geologie, Geophysik und Mineralogie) Teilnehmer/in:... Matrikel-Nr.:... - 1. Sie sollen aus NaCl und Wasser 500 ml einer Lösung herstellen, die
Rein oder nicht rein?
 Station 1: Rein oder nicht rein? Versuche: 1 Bestimmen Sie experimentell die Löslichkeit von Kochsalz. [Hinweis: Unter der Löslichkeit versteht man die Masse eines Stoffes in Gramm, die sich gerade noch
Station 1: Rein oder nicht rein? Versuche: 1 Bestimmen Sie experimentell die Löslichkeit von Kochsalz. [Hinweis: Unter der Löslichkeit versteht man die Masse eines Stoffes in Gramm, die sich gerade noch
Nachhaltige Fließgewässerbewirtschaftung, Funktion eines Klärwerks
 V Kurzbeschreibung Die SuS erarbeiten sich in dieser Stunde in Partnerarbeit die Funktionsweise eines Klärwerks durch Auswertung eines Faltblattes und eines Informationstextes. Zur Sicherung sollen die
V Kurzbeschreibung Die SuS erarbeiten sich in dieser Stunde in Partnerarbeit die Funktionsweise eines Klärwerks durch Auswertung eines Faltblattes und eines Informationstextes. Zur Sicherung sollen die
A) Bei zweiprotonigen Säuren wird zur vollständigen Neutralisation exakt ein
 1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen ist richtig? A) Bei zweiprotonigen Säuren wird zur vollständigen Neutralisation exakt ein Äquivalent an Natronlauge
1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen ist richtig? A) Bei zweiprotonigen Säuren wird zur vollständigen Neutralisation exakt ein Äquivalent an Natronlauge
Claudia Frank. Nitrifikation und N-Mineralisation in sauren und Dolomit-gekalkten Nadelwaldböden im Fichtelgebirge
 Claudia Frank Nitrifikation und N-Mineralisation in sauren und Dolomit-gekalkten Nadelwaldböden im Fichtelgebirge Dissertation aus dem Institut für Mikrobiologie der Universität Bayreuth Mai 1996 gefördert
Claudia Frank Nitrifikation und N-Mineralisation in sauren und Dolomit-gekalkten Nadelwaldböden im Fichtelgebirge Dissertation aus dem Institut für Mikrobiologie der Universität Bayreuth Mai 1996 gefördert
Dauerüberwachung der Fliessgewässer in den Urkantonen
 Ein gemeinsames Projekt der Kantone Uri, Schwyz, Obwalden, Nidwalden und Luzern Dauerüberwachung der Fliessgewässer in den Urkantonen Datenanhang Kanton Nidwalden 000 bis 003 Inhaltsverzeichnis ÜBERSICHT
Ein gemeinsames Projekt der Kantone Uri, Schwyz, Obwalden, Nidwalden und Luzern Dauerüberwachung der Fliessgewässer in den Urkantonen Datenanhang Kanton Nidwalden 000 bis 003 Inhaltsverzeichnis ÜBERSICHT
Analytische Chemie. B. Sc. Chemieingenieurwesen. 02. Februar Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 02. Februar 2011 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 02. Februar 2011 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Protokoll Tag 4, Teil 1
 Protokoll Tag 4, Teil 1 D. Titrationsverfahren D.1. Einführung in die quantitative Analyse; D.2. Acidimetrie (Bestimmung der Konzentration einer Säure) Am heutigen letzten Tag des Praktikums geht es um
Protokoll Tag 4, Teil 1 D. Titrationsverfahren D.1. Einführung in die quantitative Analyse; D.2. Acidimetrie (Bestimmung der Konzentration einer Säure) Am heutigen letzten Tag des Praktikums geht es um
Das MINT-Profil stellt sich vor...
 Das MINT-Profil stellt sich vor... Was heißt überhaupt? Mathematik Informatik Naturwissenschaften(Chemie, Biologie, Physik) Technik Was haben wir bis jetzt gemacht? Gewässerökologische Untersuchung der
Das MINT-Profil stellt sich vor... Was heißt überhaupt? Mathematik Informatik Naturwissenschaften(Chemie, Biologie, Physik) Technik Was haben wir bis jetzt gemacht? Gewässerökologische Untersuchung der
Analytische Chemie. B. Sc. Chemieingenieurwesen. 17. März Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 17. März 2010 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 17. März 2010 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Prüfstelle. Eduard-Bodem-Gasse 5-7, 6020 Innsbruck. Standort K+U Umwelttechnik, Labor und Hydrologie GmbH Eduard-Bodem-Gasse 5-7, 6020 Innsbruck
 Prüfstelle Rechtsperson K+U Umwelttechnik, Labor und Hydrologie GmbH Eduard-Bodem-Gasse 5-7, 6020 Innsbruck Internet www.k-u.at Ident 0323 Standort K+U Umwelttechnik, Labor und Hydrologie GmbH Eduard-Bodem-Gasse
Prüfstelle Rechtsperson K+U Umwelttechnik, Labor und Hydrologie GmbH Eduard-Bodem-Gasse 5-7, 6020 Innsbruck Internet www.k-u.at Ident 0323 Standort K+U Umwelttechnik, Labor und Hydrologie GmbH Eduard-Bodem-Gasse
CHEMIE KAPITEL 4 SÄURE- BASE. Timm Wilke. Georg- August- Universität Göttingen. Wintersemester 2013 / 2014
 CHEMIE KAPITEL 4 SÄURE- BASE Timm Wilke Georg- August- Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Historisches Im 17. Jahrhundert wurden von Robert Boyle Gemeinsamkeiten verschiedener Verbindungen
CHEMIE KAPITEL 4 SÄURE- BASE Timm Wilke Georg- August- Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Historisches Im 17. Jahrhundert wurden von Robert Boyle Gemeinsamkeiten verschiedener Verbindungen
