Titrimetrische Analyse von Konfitüren, Frucht- und Gemüsesäften und deren Konzentraten
|
|
|
- Erich Mann
- vor 7 Jahren
- Abrufe
Transkript
1 Titrimetrische Analyse von Konfitüren, Frucht- und Gemüsesäften und deren Konzentraten Von Interesse für: Lebensmittel und Getränke A, G 7 Zusammenfassung Das Bulletin beschreibt Analysenmethoden zur Bestimmung der folgenden Parameter: ph-wert, titrierbare Gesamtsäure, Aschenalkalität, Formolzahl, gesamte schweflige Säure, Chlorid, Sulfat, Calcium und Magnesium. Die Methoden eignen sich für die Analyse von Konfitüren, Frucht- und Gemüsesäften und deren Konzentraten. Geräte und Zubehör Titrino oder Titrando mit Dosino oder Dosimat Magnetrührer Wechseleinheit(en) (für NaOH eventuell mit PE- Reagenzflasche ) Unitrode , kombinierte ph-glaselektrode mit Festschliffdiaphragma und Pt-1000-Temperaturfühler Doppel-Pt-Blech-Elektrode Ag-Titrode Ionenselektive Calcium-Elektrode (Ca-ISE) LL ISE Reference , Double-Junction- Ag/AgCl-Bezugselektrode mit Festschliffdiaphragma Elektrodenkabel und Eventuell Drucker und Druckerkabel 1. ph-wert Pufferlösungen ph = 4.0 und ph = 7.0 (Metrohm Nr und ) Die Angabe des ph-werts erfolgt mit einer Dezimalstelle. 2. Titrierbare Gesamtsäure c(naoh) = 0.1 mol/l c(naoh) = 1 mol/l a) Konfitüren 10 g Probe werden mit 90 ml dest. Wasser versetzt und bis zum beginnenden Sieden erhitzt. Nach dem Abkühlen wird im SET-Modus mit c(naoh) = 0.1 mol/l auf ph = 8.5 titriert. b) Frucht- und Gemüsesäfte 10 ml Probe werden mit 40 ml dest. Wasser versetzt und bis zum beginnenden Sieden erhitzt. Nach dem Abkühlen wird im SET-Modus mit c(naoh) = 1 mol/l auf ph = 8.5 titriert. Die Resultatangabe erfolgt in meq./100 g (Konfitüren) bzw. in meq./l (Säfte). a) meq./100 g = EP1 * C01 / C00 b) meq./l = EP1 * C02 / C00 C00 = 10 [Probenmasse in g (a) bzw. Probenvolumen in ml (b)] C01 = 10 (Umrechnungsfaktor) C02 = 1000 (Umrechnungsfaktor) Messung Die kombinierte ph-glaselektrode wird mit den Pufferlösungen ph = 4.0 und ph = 7.0 kalibriert. Man taucht sie in die Konfitüre und liest den ph-wert bei Driftkonstanz ab. Bei Frucht- und Gemüsesäften wird in der unverdünnten Probe unter Rühren gemessen.
2 Seite 2/8 3. Aschenalkalität c(hcl) = 0.1 mol/l c(naoh) = 0.1 mol/l Probenvorbereitung und 25 ml Saft werden in einer Porzellanschale im Trockenschrank bei 110 C eingedampft. Nach Zugabe von 1 Tropfen Paraffinöl wird über der Flamme vorverascht und die Probe anschliessend im Muffelofen bei 520 ± 25 C vollständig verascht. (Sind noch schwarze Kohleteilchen vorhanden, wird die Asche nach dem Abkühlen mit einem Pistill zerrieben, mit dest. Wasser angefeuchtet und die Veraschung im Muffelofen wiederholt. Dies so lange, bis eine rein weisse Asche übrigbleibt.) Nach dem Abkühlen spült man die Asche zuerst mit 20 ml c(hcl) = 0.1 mol/l und dann mit wenig dest. Wasser in ein Becherglas und erwärmt anschliessend für 15 min auf dem siedenden Wasserbad. Nach erneutem Abkühlen wird im SET-Modus mit c(naoh) = 0.1 mol/l auf ph = 4.5 zurücktitriert. Die Aschenalkalität wird in meq./l mit einer Dezimalstelle angegeben. meq./l = C01 * (A B) A = 20 [vorgelegtes Volumen an c(hcl) = 0.1 mol/l in ml] B = Verbrauch an c(naoh) = 0.1 mol/l für die Rücktitration in ml C01 = 4 (Umrechnungsfaktor) 4. Formolzahl c(naoh) = 1 mol/l c(naoh) = 0.1 mol/l Formaldehyd-Lösung: w(hcho) = 35%, mit NaOH auf ph = 8.5 eingestellt 25 ml Saft werden in ein Becherglas pipettiert und mit c(naoh) = 1 mol/l im SET-Modus auf ph = 8.5 titriert. Unter Rühren versetzt man mit 15 ml Formaldehyd- Lösung, wartet 1 min und titriert die freigesetzte Säure in einer zweiten SET- mit c(naoh) = 0.1 mol/l wiederum auf ph = 8.5 (EP1). Die Formolzahl wird als ml c(naoh) = 0.1 mol/l pro 100 ml Saft ohne Dezimalstelle angegeben. Formolzahl = EP1 * C01 C01 = 4 (Umrechnungsfaktor) 5. Gesamte schweflige Säure Iodid/Iodat-Lösung: g KIO 3, bei maximal 150 C getrocknet, werden in ca. 700 ml dest. Wasser gelöst. Man gibt 3.5 g KI zu, löst dieses und füllt mit dest. Wasser auf 1 L auf. w(h 2 SO 4 ) = 25% KI-Lösung: w(ki) = 5% c(naoh) = 1 mol/l 25 ml Saft (a) oder 10 g homogenisierte Konfitüre plus 50 ml dest. Wasser (b) werden im Becherglas mit 25 ml c(naoh) = 1 mol/l gemischt und für 15 min stehen gelassen. Dann versetzt man mit je 10 ml H 2 SO 4 und KI-Lösung und titriert im MET-I pol -Modus (I pol = 1 µa) mit der Iodid/Iodat-Lösung unter Verwendung der Doppel-Pt-Blech-Elektrode. Die Resultatangabe erfolgt in mg/l SO 2 (Säfte) bzw. in mg SO 2 /100 g (Konfitüren). a) mg/l SO 2 = EP1 * C01 b) mg SO 2 /100 g = EP1 * C02 C01 = 20 (Umrechnungsfaktor) C02 = 5 (Umrechnungsfaktor) 6. Chloridgehalt c(agno 3 ) = 0.1 mol/l c(h 2 SO 4 ) = 1 mol/l 10 ml Saft, 15 ml dest. Wasser und 2 ml H 2 SO 4 werden in ein Becherglas pipettiert. Anschliessend titriert man das Chlorid mit c(agno 3 ) = 0.1 mol/l unter Verwendung der Ag-Titrode.
3 Seite 3/8 Die Resultatangabe erfolgt in mg/l Cl ohne Dezimalstelle. 1 ml c(agno 3 ) = 0.1 mol/l entspricht mg Cl mg/l Cl = EP1 * C01 * C02 / C00 C00 = 10 (Probenvolumen in ml) C01 = C02 = 1000 (Umrechnungsfaktor) 7. Sulfatgehalt c(bacl 2 ) = 0.05 mol/l: g BaCl 2 x 2 H 2 O (99%) werden in c(hcl) = 0.1 mol/l gelöst und damit auf 1 L aufgefüllt. c(egta) = 0.05 mol/l: 19.4 g Ethylenglykol-bis-(2- aminoethyl)-tetraessigsäure werden in ca. 200 ml dest. Wasser aufgeschlämmt. Unter Rühren versetzt man mit c(naoh) = 10 mol/l, bis sich alles gelöst hat. Nach dem Abkühlen wird mit dest. Wasser auf 1 L aufgefüllt. Ca-Standard: c(cacl 2 ) = 0.1 mol/l (Metrohm Nr ) Pufferlösung ph = 10: 9 g NH 4 Cl und 60 ml w(nh 3 ) = 25% werden in dest. Wasser gelöst und auf 1 L aufgefüllt. c(hcl) = 2 mol/l 20 ml Saft werden mit 30 ml dest. Wasser versetzt und der ph-wert wenn nötig mit HCl auf 3.5 eingestellt. Dann gibt man 0.5 ml Ca-Standard sowie 5.00 ml BaCl 2 -Lösung zu und lässt unter Rühren 3 min reagieren. Man versetzt mit 10 ml Pufferlösung ph = 10 und titriert im MET-Modus mit c(egta) = 0.05 mol/l unter Verwendung der Ca-ISE. Man erhält zwei Äquivalenzpunkte: EP1 entspricht dem Ca, die Differenz zwischen EP1 und EP2 dem Ba- Überschuss. Anhand einer Blindprobe (ohne Sulfat), die in gleicher Weise vorbereitet und titriert wird, ermittelt man zunächst den EGTA-Verbrauch für das BaCl 2. Dieser Blindwertverbrauch wird als Common Variable C31 im Titrator gespeichert. Die Resultatangabe erfolgt in g/l K 2 SO 4 mit einer Dezimalstelle. 1 ml c(egta) = 0.05 mol/l entspricht mg K 2 SO 4 RS1 = EP2 EP1; ml RS2 = g/l K 2 SO 4 = (C31 RS1) * C01 / C00 C00 = 20 (Probenvolumen in ml) C01 = C31 = Blindwertverbrauch in ml [gleiche Menge an c(bacl 2 ) = 0.05 mol/l verwenden wie für die Probe (5.00 ml)!] 8. Calcium und Magnesium In diesen Lebensmitteln liegen Ca und Mg nur zum Teil als freie Ionen vor, der Rest ist komplex an organische Inhaltsstoffe gebunden. Für die Bestimmung der Gesamtgehalte muss deshalb verascht werden. Titriermittel: c(na 2 EDTA) = 0.05 mol/l in c(koh) = 0.1 mol/l Hilfskomplexlösung: c(acetylaceton) = 0.1 mol/l in c(tris) = 0.2 mol/l [TRIS = Tris(hydroxymethyl)- aminomethan] w(hcl) = 20% und w(naoh) = 20% Probenvorbereitung und 25 ml Saft werden in eine Porzellanschale pipettiert und im Trockenschrank bei 120 C eingedampft. Danach glüht man im Muffelofen bei 600 C, bis eine weisse Asche übrig bleibt. Nach dem Abkühlen gibt man 2 ml HCl zu, erwärmt, um die Asche zu lösen und spült mit dest. Wasser in ein Becherglas. Der ph- Wert dieser Lösung wird mit NaOH auf 8.5 eingestellt. Man gibt 20 ml Hilfskomplexlösung zu und titriert mit c(na 2 EDTA) = 0.05 mol/l unter Verwendung der Ca- ISE. Man erhält zwei Äquivalenzpunkte: EP1 entspricht dem Ca, die Differenz zwischen EP1 und EP2 dem Mg. Die Resultatangaben erfolgen in mg/l ohne Dezimalstelle. 1 ml c(na 2 EDTA) = 0.05 mol/l entspricht mg Ca 2+ bzw mg Mg 2+ mg/l Ca 2+ = EP1 * C01 * C03 / C00 mg/l Mg 2+ = (EP2 EP1) * C02 * C03 / C00 C00 = 25 (Probenvolumen in ml) C01 = C02 = C03 = 1000 (Umrechnungsfaktor)
4 Seite 4/8 Bemerkung Bei Konfitüren wird der Calcium- und Magnesiumgehalt in mg/100 g angegeben. In diesem Fall werden 25 g homogenisierte Probe verascht. Bei der gilt: C00 = 25 (Probenmasse in g) C03 = 100 (Umrechnungsfaktor) Abbildungen Abb. 1: Titrino-Parameterreport für die Bestimmung der titrierbaren Gesamtsäure und der Formolzahl (SET- auf ph = 8.5). Abb. 2: Parameterreport für die Bestimmung der Aschenalkalität (SET- auf ph = 4.5).
5 Seite 5/8 Abb. 3: Parameterreport und skurve für die Bestimmung der gesamten schwefligen Säure.
6 Seite 6/8 Abb. 4: Parameterreport, Resultatreport und skurve für die Bestimmung von Chlorid in Tomatensaft.
7 Seite 7/8 Abb. 5: Parameterreport, Resultatreport und skurve für die Bestimmung von Sulfat in Traubensaft.
8 Seite 8/8 Abb. 6: Parameterreport, Resultatreport und skurve für die Bestimmung von Calcium und Magnesium in Grapefruitsaft.
Application Bulletin
 Application Bulletin Von Interesse für: Allgemein analytische Laboratorien; Wasseranalytik A 1, 2, 4, 7, 8 Getränke Simultanbestimmung von Calcium und Magnesium in Wässern und Getränken sowie der verschiedenen
Application Bulletin Von Interesse für: Allgemein analytische Laboratorien; Wasseranalytik A 1, 2, 4, 7, 8 Getränke Simultanbestimmung von Calcium und Magnesium in Wässern und Getränken sowie der verschiedenen
Potentiometrische Analyse von Messingund Bronzebädern
 Potentiometrische von Messingund Bronzebädern Von Interesse für: Metalle, Galvanik A 10 Zusammenfassung Es werden titrimetrische Methoden zur Bestimmung der folgenden Badkomponenten beschrieben: Messingbad:
Potentiometrische von Messingund Bronzebädern Von Interesse für: Metalle, Galvanik A 10 Zusammenfassung Es werden titrimetrische Methoden zur Bestimmung der folgenden Badkomponenten beschrieben: Messingbad:
Application Bulletin
 Nr. 249/1 d Application Bulletin Von Interesse für: Allgemein analytische Laboratorien A G 1, 2, 7, 10, 13 Trink- und Brauchwasseranalytik Titrimetrische Bestimmung von Total- und Restchlor in Trink- und
Nr. 249/1 d Application Bulletin Von Interesse für: Allgemein analytische Laboratorien A G 1, 2, 7, 10, 13 Trink- und Brauchwasseranalytik Titrimetrische Bestimmung von Total- und Restchlor in Trink- und
Application Bulletin
 Nr. 225/2 d Application Bulletin Von Interesse für: Weinanalyse, Lebensmittel A G 1, 7 Einfache Weinanalyse mit dem Titrino Zusammenfassung Das Bulletin beschreibt die Bestimmung der folgenden Parameter
Nr. 225/2 d Application Bulletin Von Interesse für: Weinanalyse, Lebensmittel A G 1, 7 Einfache Weinanalyse mit dem Titrino Zusammenfassung Das Bulletin beschreibt die Bestimmung der folgenden Parameter
Application Bulletin
 Application Bulletin Von Interesse für: Allgemein analytische Laboratorien; Lebensmittel A D 1, 2, 3, 4, 7, 8, 11 Umweltschutz; Dünger Bestimmung von Ammonium oder Kjeldahl- Stickstoff Zusammenfassung
Application Bulletin Von Interesse für: Allgemein analytische Laboratorien; Lebensmittel A D 1, 2, 3, 4, 7, 8, 11 Umweltschutz; Dünger Bestimmung von Ammonium oder Kjeldahl- Stickstoff Zusammenfassung
Application Bulletin
 Von Interesse für: Umweltschutz; Galvanik A 1, 2, 10 Potentiometrische Cyanidbestimmung Zusammenfassung Der Bestimmung von Cyanid kommt in galvanischen Bädern, bei der Entgiftung von (Galvanik-)Abwässern,
Von Interesse für: Umweltschutz; Galvanik A 1, 2, 10 Potentiometrische Cyanidbestimmung Zusammenfassung Der Bestimmung von Cyanid kommt in galvanischen Bädern, bei der Entgiftung von (Galvanik-)Abwässern,
Application Bulletin
 Nr. 87/2 d Application Bulletin Von Interesse für: Lebensmittel, Milchprodukte A E 1, 7 Analyse von Molkereiprodukten Zusammenfassung In diesem Bulletin werden potentiometrische Titrationsmethoden zur
Nr. 87/2 d Application Bulletin Von Interesse für: Lebensmittel, Milchprodukte A E 1, 7 Analyse von Molkereiprodukten Zusammenfassung In diesem Bulletin werden potentiometrische Titrationsmethoden zur
Zubehör zu
 Zubehör zu 2.907.1020 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Zubehör zu 2.907.1020 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Zubehör zu
 Zubehör zu 2.888.0110 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Zubehör zu 2.888.0110 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Zubehör zu
 Zubehör zu 2.848.1010 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Zubehör zu 2.848.1010 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Anorganisches Praktikum 1. Semester. FB Chemieingenieurwesen. Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften
 Anorganisches Praktikum 1. Semester FB Chemieingenieurwesen Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften 1 Gravimetrie Bestimmung von Nickel Sie erhalten eine Lösung, die 0.1-0.2g
Anorganisches Praktikum 1. Semester FB Chemieingenieurwesen Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften 1 Gravimetrie Bestimmung von Nickel Sie erhalten eine Lösung, die 0.1-0.2g
Zubehör zu
 Zubehör zu 2.842.0010 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Zubehör zu 2.842.0010 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Säure-Base Titrationen
 Chemie Praktikum Säure-Base Titrationen WS 2006/2007 Verfasser: Lorenz Germann, Lukas Bischoff Versuchsteilnehmer: Lorenz Germann, Lukas Bischoff Datum: 29.11.2006 Assistent: Lera Tomasic E-mail: lukas-bischoff@student.ethz.ch
Chemie Praktikum Säure-Base Titrationen WS 2006/2007 Verfasser: Lorenz Germann, Lukas Bischoff Versuchsteilnehmer: Lorenz Germann, Lukas Bischoff Datum: 29.11.2006 Assistent: Lera Tomasic E-mail: lukas-bischoff@student.ethz.ch
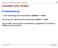
Maßanalyse. Bestimmung einer Schwefelsäure mit einer NaOH Maßlösung: bzw. n(naoh * 1 = n(h 2 SO 4 ) * 2 V [ml] * * t * 1 = n(h 2 SO 4 ) * 2
![Maßanalyse. Bestimmung einer Schwefelsäure mit einer NaOH Maßlösung: bzw. n(naoh * 1 = n(h 2 SO 4 ) * 2 V [ml] * * t * 1 = n(h 2 SO 4 ) * 2 Maßanalyse. Bestimmung einer Schwefelsäure mit einer NaOH Maßlösung: bzw. n(naoh * 1 = n(h 2 SO 4 ) * 2 V [ml] * * t * 1 = n(h 2 SO 4 ) * 2](/thumbs/79/78929570.jpg) Maßanalyse Bei der Maßanalyse (Volumetrie) wird zu der zu analysierenden Lösung unbekannten Gehaltes soviel einer Lösung bekannter Konzentration der Maßlösung zugegeben, bis ein Indikationssystem den Endpunkt
Maßanalyse Bei der Maßanalyse (Volumetrie) wird zu der zu analysierenden Lösung unbekannten Gehaltes soviel einer Lösung bekannter Konzentration der Maßlösung zugegeben, bis ein Indikationssystem den Endpunkt
Zubehör zu
 Zubehör zu 2.916.3010 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Zubehör zu 2.916.3010 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Zubehör zu
 Zubehör zu 2.1002.0010 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu
Zubehör zu 2.1002.0010 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu
Zubehör zu
 Zubehör zu 2.841.0010 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Zubehör zu 2.841.0010 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Arbeitskreis Titration von Mineralwässern bzw F 10 Kappenberg COLA-Getränken Seite 1 / 6. Prinzip:
 Kappenberg COLA-Getränken Seite 1 / 6 Prinzip: Zum Nachweis von Kohlensäure bzw. Phosphorsäure werden Mineralwasser bzw. COLA- Getränke zum einen direkt, zum anderen nach einem etwa 15 minütigem Verkochen
Kappenberg COLA-Getränken Seite 1 / 6 Prinzip: Zum Nachweis von Kohlensäure bzw. Phosphorsäure werden Mineralwasser bzw. COLA- Getränke zum einen direkt, zum anderen nach einem etwa 15 minütigem Verkochen
Ionenanalytik. Titrotherm 859. Thermometrischer Titrator die ideale Ergänzung zur potentiometrischen Titration
 Ionenanalytik Titrotherm 859 Thermometrischer Titrator die ideale Ergänzung zur potentiometrischen Titration Was ist thermometrische Titration? Die Titration ist die älteste und am weitesten verbreitete
Ionenanalytik Titrotherm 859 Thermometrischer Titrator die ideale Ergänzung zur potentiometrischen Titration Was ist thermometrische Titration? Die Titration ist die älteste und am weitesten verbreitete
Application Bulletin
 Application Bulletin Von Interesse für: Allgemein analytische Laboratorien; Wasseranalytik A B E G I K 1, 2, 7 Normierte Methoden in der Wasseranalytik Einsatz von Metrohm-Geräten Zusammenfassung In diesem
Application Bulletin Von Interesse für: Allgemein analytische Laboratorien; Wasseranalytik A B E G I K 1, 2, 7 Normierte Methoden in der Wasseranalytik Einsatz von Metrohm-Geräten Zusammenfassung In diesem
Fette, Öle und Tenside
 Schulversuchspraktikum Thomas Polle Sommersemester 2015 Klassenstufen 11 & 12 Fette, Öle und Tenside Kurzprotokoll Inhalt Inhaltsverzeichnis 1Weitere Lehrerversuche... 3 V1 Verseifungszahl... 3 2Weitere
Schulversuchspraktikum Thomas Polle Sommersemester 2015 Klassenstufen 11 & 12 Fette, Öle und Tenside Kurzprotokoll Inhalt Inhaltsverzeichnis 1Weitere Lehrerversuche... 3 V1 Verseifungszahl... 3 2Weitere
Seminar zum Quantitativen Anorganischen Praktikum WS 2011/12
 Seminar zum Quantitativen Anorganischen Praktikum WS 2011/12 Teil des Moduls MN-C-AlC Dr. Matthias Brühmann Dr. Christian Rustige Inhalt Montag, 09.01.2012, 8-10 Uhr, HS III Allgemeine Einführung in die
Seminar zum Quantitativen Anorganischen Praktikum WS 2011/12 Teil des Moduls MN-C-AlC Dr. Matthias Brühmann Dr. Christian Rustige Inhalt Montag, 09.01.2012, 8-10 Uhr, HS III Allgemeine Einführung in die
Zubehör zu
 Zubehör zu 2.756.0110 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Zubehör zu 2.756.0110 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Zubehör zu
 Zubehör zu 2.848.2010 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Zubehör zu 2.848.2010 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
wird titriert mit Salzsäure der Konzentration c(hcl) = 1 mol/l.
 1 Problemstellung 1 Liter Natronlauge der Konzentration c(naoh) = 1 mol/l wird titriert mit Salzsäure der Konzentration c(hcl) = 1 mol/l. Der ph-wert Lösung soll für verschiedene zugegebene HCl-Volumina
1 Problemstellung 1 Liter Natronlauge der Konzentration c(naoh) = 1 mol/l wird titriert mit Salzsäure der Konzentration c(hcl) = 1 mol/l. Der ph-wert Lösung soll für verschiedene zugegebene HCl-Volumina
Application Bulletin
 Nr. 275/1 d Application Bulletin Von Interesse für: Waschmittelanalyse A 1, 3, 12 Potentiometrische Zweiphasen-Titration anionischer Tenside in Waschpulvern und Flüssigwaschmitteln Zusammenfassung Die
Nr. 275/1 d Application Bulletin Von Interesse für: Waschmittelanalyse A 1, 3, 12 Potentiometrische Zweiphasen-Titration anionischer Tenside in Waschpulvern und Flüssigwaschmitteln Zusammenfassung Die
Protokoll für den 6. Praktikumstag
 Protokoll für den 6. Praktikumstag http://www.biomedizinischechemie.de Autor: Werner Schwalbach Version 2.0 Quellen: Anorganisches Grundpraktikum kompakt von Gertrud Kiel Versuch 4.1 des Permanganations
Protokoll für den 6. Praktikumstag http://www.biomedizinischechemie.de Autor: Werner Schwalbach Version 2.0 Quellen: Anorganisches Grundpraktikum kompakt von Gertrud Kiel Versuch 4.1 des Permanganations
Säure-Base-Titrationen
 Martin Raiber Chemie Protokoll Nr.3 19.2.2006 Säure-Base-Titrationen 1. Titration von Salzsäure mit Natronlauge Chemikalien: Salzsäure (100ml; c(hcl)=0,1 mol/l) Natronlauge (c(naoh)=1 mol/l) Bromthymolblau
Martin Raiber Chemie Protokoll Nr.3 19.2.2006 Säure-Base-Titrationen 1. Titration von Salzsäure mit Natronlauge Chemikalien: Salzsäure (100ml; c(hcl)=0,1 mol/l) Natronlauge (c(naoh)=1 mol/l) Bromthymolblau
Antrieb mit Schreib /Lesehardware für intelligente Dosiereinheiten. Mit fest montiertem Kabel (Länge 150 cm).
 Zubehör zu MATi 06 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Zubehör zu MATi 06 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
E3: Potentiometrische Titration
 Theoretische Grundlagen Als potentiometrische Titration bezeichnet man ein Analyseverfahren, bei dem durch Messung der Gleichgewichtsspannung einer galvanischen Kette auf die Menge des zu titrierenden
Theoretische Grundlagen Als potentiometrische Titration bezeichnet man ein Analyseverfahren, bei dem durch Messung der Gleichgewichtsspannung einer galvanischen Kette auf die Menge des zu titrierenden
Protokoll 2. Labor für Physikalische Chemie. Modul IV. Versuch 6
 Protokoll 2 Labor für Physikalische Chemie Modul IV Versuch 6 Herstellung einer Titerbestimmung von 500mL einer Salzsäure Maßlösung mit der Äquivalentkonzentration c(hcl) = 0,1 mol/l Fachbereich MT 1 Wintersemester
Protokoll 2 Labor für Physikalische Chemie Modul IV Versuch 6 Herstellung einer Titerbestimmung von 500mL einer Salzsäure Maßlösung mit der Äquivalentkonzentration c(hcl) = 0,1 mol/l Fachbereich MT 1 Wintersemester
Zubehör zu
 Zubehör zu 2.848.0010 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Zubehör zu 2.848.0010 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Anorganisches Praktikum 1. Semester. FB Chemieingenieurwesen. Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften
 Anorganisches Praktikum 1. Semester FB Chemieingenieurwesen Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften 1 Gravimetrie Bestimmung von Nickel Sie erhalten eine Lösung, die 0.1-0.2g
Anorganisches Praktikum 1. Semester FB Chemieingenieurwesen Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften 1 Gravimetrie Bestimmung von Nickel Sie erhalten eine Lösung, die 0.1-0.2g
Zubehör zu
 Zubehör zu 2.876.0110 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Zubehör zu 2.876.0110 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Leonardo da Vinci Innovationstransferprojekt TraWi. Projektnummer: DE/13/LLP-LdV/TOI/147629
 ŠPŠCH Pardubice Erarbeitung berufspädagogischer Konzepte für das berufliche Handlungsfeld Operator Chemist operator LEE 2b: 2. ph-wert-bestimmung Sie sind chemischer Operator in einem chemischen Betrieb,
ŠPŠCH Pardubice Erarbeitung berufspädagogischer Konzepte für das berufliche Handlungsfeld Operator Chemist operator LEE 2b: 2. ph-wert-bestimmung Sie sind chemischer Operator in einem chemischen Betrieb,
Praktische Übungen Chemie. Versuch 6
 Bauhaus-Universität Weimar Professur Bauchemie Prof. Dr. rer. nat. habil. Christian Kaps Praktische Übungen Chemie Versuch 6 Bestimmung der Wasserhärte Stand: April 2008 1. Grundlagen und Zielstellung
Bauhaus-Universität Weimar Professur Bauchemie Prof. Dr. rer. nat. habil. Christian Kaps Praktische Übungen Chemie Versuch 6 Bestimmung der Wasserhärte Stand: April 2008 1. Grundlagen und Zielstellung
Schulversuchspraktikum. Jans Manjali. Sommersemester Klassenstufen 9 & 10. Titration. Kurzprotokoll
 Schulversuchspraktikum Jans Manjali Sommersemester 2015 Klassenstufen 9 & 10 Titration Kurzprotokoll Auf einen Blick: Die hier vorgestellte Argentometrie ist eine Fällungstitration, bei der Silberionen
Schulversuchspraktikum Jans Manjali Sommersemester 2015 Klassenstufen 9 & 10 Titration Kurzprotokoll Auf einen Blick: Die hier vorgestellte Argentometrie ist eine Fällungstitration, bei der Silberionen
Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10. V1/4: Komplexometrische Bestimmung von Cobalt durch Rücktitration
 Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10 V1/4: Komplexometrische Bestimmung von Cobalt durch Rücktitration Versuchsdurchführung: 18.01.2010 Protokollabgabe: 22.02.2010 durchgeführt
Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10 V1/4: Komplexometrische Bestimmung von Cobalt durch Rücktitration Versuchsdurchführung: 18.01.2010 Protokollabgabe: 22.02.2010 durchgeführt
Protokoll Tag 4, Teil 1
 Protokoll Tag 4, Teil 1 D. Titrationsverfahren D.1. Einführung in die quantitative Analyse; D.2. Acidimetrie (Bestimmung der Konzentration einer Säure) Am heutigen letzten Tag des Praktikums geht es um
Protokoll Tag 4, Teil 1 D. Titrationsverfahren D.1. Einführung in die quantitative Analyse; D.2. Acidimetrie (Bestimmung der Konzentration einer Säure) Am heutigen letzten Tag des Praktikums geht es um
Praktikum: Grundlagen der Hydrochemie
 TU Dresden Institut für Wasserchemie Chemische Entsäuerung mittels Calciumcarbonat und halbgebranntem Dolomit Praktikum: Grundlagen der Hydrochemie V 1 Lernziel: Es sollen Verfahren mit unterschiedlichen
TU Dresden Institut für Wasserchemie Chemische Entsäuerung mittels Calciumcarbonat und halbgebranntem Dolomit Praktikum: Grundlagen der Hydrochemie V 1 Lernziel: Es sollen Verfahren mit unterschiedlichen
CHEMIE-PRAKTIKUM FÜR MEDIZINER WS 2010/2011
 Universität Duisburg-Essen - Institut für Organische Chemie 1 CHEMIE-PRAKTIKUM FÜR MEDIZINER WS 2010/2011 1. Tag: Maßanalyse I Datum: Name: Kurs: Saal: Platz Nr. Theoret. Grundlagen: 1. Aufgabe: Titerstellung
Universität Duisburg-Essen - Institut für Organische Chemie 1 CHEMIE-PRAKTIKUM FÜR MEDIZINER WS 2010/2011 1. Tag: Maßanalyse I Datum: Name: Kurs: Saal: Platz Nr. Theoret. Grundlagen: 1. Aufgabe: Titerstellung
Protokolle zu den Analysen
 Qualitative Analysen Protokolle zu den Analysen Namen, Datum und Analysennummer angeben Möglicherweise enthaltene Ionen angeben Merkmale wie Farbe, Homogenität, (Geruch) feststellen Vorproben wie, Flammenfärbung,
Qualitative Analysen Protokolle zu den Analysen Namen, Datum und Analysennummer angeben Möglicherweise enthaltene Ionen angeben Merkmale wie Farbe, Homogenität, (Geruch) feststellen Vorproben wie, Flammenfärbung,
Der Messkolben wird mit dest. Wasser auf 250 ml aufgefüllt und gut geschüttelt, damit die
 Versuch 1: Acidimetrie Titration von NaOH Der Messkolben wird mit dest. Wasser auf 250 ml aufgefüllt und gut geschüttelt, damit die Lösung homogen wird. Mit einer 50 ml Vollpipette werden 50 ml in einen
Versuch 1: Acidimetrie Titration von NaOH Der Messkolben wird mit dest. Wasser auf 250 ml aufgefüllt und gut geschüttelt, damit die Lösung homogen wird. Mit einer 50 ml Vollpipette werden 50 ml in einen
¾ Kb / A. Analyse von Bier
 Analyse von Bier Zielsetzung: Bestimmung des Aschegehalts, des Dichte - und Alkohol- und Maltosegehaltes, des ph-wertes, der flüchtigen Säure sowie der Extrakte und Stammwürze durch jene im Schweizer Lebensmittelbuch
Analyse von Bier Zielsetzung: Bestimmung des Aschegehalts, des Dichte - und Alkohol- und Maltosegehaltes, des ph-wertes, der flüchtigen Säure sowie der Extrakte und Stammwürze durch jene im Schweizer Lebensmittelbuch
Zubehör zu
 Zubehör zu 2.876.0010 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Zubehör zu 2.876.0010 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Lösungen zu den ph-berechnungen II
 Lösungen zu den ph-berechnungen II 1.) a.) Ges.: 2500 L HCl; ph 1.4 Geg.: 6000 L KOH; c(koh) = 0.017 mol/l Skizze: V tot = V HCl + V KOH = 8500 L Das Gesamtvolumen wird später während der Lösung benötigt
Lösungen zu den ph-berechnungen II 1.) a.) Ges.: 2500 L HCl; ph 1.4 Geg.: 6000 L KOH; c(koh) = 0.017 mol/l Skizze: V tot = V HCl + V KOH = 8500 L Das Gesamtvolumen wird später während der Lösung benötigt
Arbeitskreis Bestimmung des Gehaltes und des F 04 Kappenberg pks - Wertes der Essigsäure Seite 1 / 6. Prinzip: Versuchsaufbau: Materialliste:
 Kappenberg pks - Wertes der Essigsäure Seite 1 / 6 Prinzip: Essigsäure wird mit Natronlauge titriert. Durch Ermittlung des Äquivalenzpunktes läßt sich der Gehalt der Säure berechnen, durch Ermittlung des
Kappenberg pks - Wertes der Essigsäure Seite 1 / 6 Prinzip: Essigsäure wird mit Natronlauge titriert. Durch Ermittlung des Äquivalenzpunktes läßt sich der Gehalt der Säure berechnen, durch Ermittlung des
Application Bulletin
 Nr. 82/3 d Application Bulletin Von Interesse für: Allgemein analytische Laboratorien A 1, 2, 4, 7, 10, 12 Bestimmung von Fluorid mit der ionenselektiven Elektrode Zusammenfassung Dieses Bulletin beschreibt
Nr. 82/3 d Application Bulletin Von Interesse für: Allgemein analytische Laboratorien A 1, 2, 4, 7, 10, 12 Bestimmung von Fluorid mit der ionenselektiven Elektrode Zusammenfassung Dieses Bulletin beschreibt
Praktikum: Grundlagen der Hydrochemie
 TU Dresden Institut für Wasserchemie Chemische Entsäuerung mittels Calciumcarbonat und halbgebranntem Dolomit Praktikum: Grundlagen der Hydrochemie V 1 1. Thema: Kalk-Kohlensäure-Gleichgewicht Chemische
TU Dresden Institut für Wasserchemie Chemische Entsäuerung mittels Calciumcarbonat und halbgebranntem Dolomit Praktikum: Grundlagen der Hydrochemie V 1 1. Thema: Kalk-Kohlensäure-Gleichgewicht Chemische
Qualitative und quantitative Analysen
 Qualitative und quantitative Analysen Dichtebestimmung: [1] 15.02.2003 Elisabeth Haas, Patrick Dijkstra Durchführung: Pyknometer beschriften (1a, 1b, 1c, 5a, 5b, 5c) Einzelne Pyknometer wiegen -Sorten
Qualitative und quantitative Analysen Dichtebestimmung: [1] 15.02.2003 Elisabeth Haas, Patrick Dijkstra Durchführung: Pyknometer beschriften (1a, 1b, 1c, 5a, 5b, 5c) Einzelne Pyknometer wiegen -Sorten
Quantitative Analyse. und Präparate Arbeitsvorschriften. Quantitative Analyse. Anorganisch-chemisches Praktikum I für W. Ing. Fachrichtung Chemie
 TU Kaiserslautern, WS 2015/16 Quantitative Analyse 1. Pufferkapazität Quantitative Analyse und Präparate Arbeitsvorschriften Aufgabenstellung: 1.1 Berechnung einer Pufferlösung 1.2 Herstellung der Pufferlösung
TU Kaiserslautern, WS 2015/16 Quantitative Analyse 1. Pufferkapazität Quantitative Analyse und Präparate Arbeitsvorschriften Aufgabenstellung: 1.1 Berechnung einer Pufferlösung 1.2 Herstellung der Pufferlösung
Protokoll Tag 3. C. Kationennachweise. C.1. Nachweis von Na +, Mg 2+, Ca 2+, Sr 2+, BA 2+ sowie NH + 4
 Protokoll Tag 3 C. Kationennachweise C.1. Nachweis von Na +, Mg 2+, Ca 2+, Sr 2+, BA 2+ sowie NH + 4 V16 Nachweis von Na +, K +, Ca 2+, Sr 2+ und Ba 2+ durch Flammenfärbung Bei der Flammenprobe geht es
Protokoll Tag 3 C. Kationennachweise C.1. Nachweis von Na +, Mg 2+, Ca 2+, Sr 2+, BA 2+ sowie NH + 4 V16 Nachweis von Na +, K +, Ca 2+, Sr 2+ und Ba 2+ durch Flammenfärbung Bei der Flammenprobe geht es
Zubehör zu
 Zubehör zu 2.862.2010 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Zubehör zu 2.862.2010 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Stoffe oder Teilchen, die Protonen abgeben kånnen, werden als SÄuren bezeichnet (Protonendonatoren).
 5 10 15 20 25 30 35 40 45 O C 50 Chemie Technische BerufsmaturitÄt BMS AGS Basel Kapitel 6 SÄuren und Basen Baars, Kap. 12.1; 12.2; 13 Versuch 1 Ein Becherglas mit Thermometer enthält violette FarbstofflÅsung
5 10 15 20 25 30 35 40 45 O C 50 Chemie Technische BerufsmaturitÄt BMS AGS Basel Kapitel 6 SÄuren und Basen Baars, Kap. 12.1; 12.2; 13 Versuch 1 Ein Becherglas mit Thermometer enthält violette FarbstofflÅsung
Tris(acetylacetonato)eisen(III)
 Praktikum rg. und Anorg. Chemie II DCHAB Wintersemester 04/05 Zürich, den 15. November 2004 Tris(acetylacetonato)eisen(III) [Fe(acac) 3 ] Fe 1 1. SYNTHESE 1.1 Methode [1] Eisen(III)chlorid wird mit Ammoniak
Praktikum rg. und Anorg. Chemie II DCHAB Wintersemester 04/05 Zürich, den 15. November 2004 Tris(acetylacetonato)eisen(III) [Fe(acac) 3 ] Fe 1 1. SYNTHESE 1.1 Methode [1] Eisen(III)chlorid wird mit Ammoniak
Arbeitskreis Bestimmung des Gehalts und der pks-werte F 06 Kappenberg der Phosphorsäure Seite 1 / 6. Prinzip:
 Kappenberg der Phosphorsäure Seite 1 / 6 Prinzip: Phosphorsäure wird mit Natronlauge titriert. Durch Ermittlung eines Äquivalenzpunktes lässt sich der Gehalt der Säure berechnen, durch Ermittlung der Halbäquivalenzpunkte
Kappenberg der Phosphorsäure Seite 1 / 6 Prinzip: Phosphorsäure wird mit Natronlauge titriert. Durch Ermittlung eines Äquivalenzpunktes lässt sich der Gehalt der Säure berechnen, durch Ermittlung der Halbäquivalenzpunkte
Chromatographie von Acetylsalicylsäure. Gefährdungsbeurteilung. Schülerexperiment. Lehrerexperiment
 Chromatographie von Acetylsalicylsäure Brandgefahr! Cyclohexan R-Sätze: 11-38-65-67-50/53 S-Sätze: 9-16-25-33-60-61-62 Acetylsalicylsäure R-Sätze: 22 S-Sätze: 26-37/39-45 Aceton R-Sätze: 11-36-66-67 S-Sätze:
Chromatographie von Acetylsalicylsäure Brandgefahr! Cyclohexan R-Sätze: 11-38-65-67-50/53 S-Sätze: 9-16-25-33-60-61-62 Acetylsalicylsäure R-Sätze: 22 S-Sätze: 26-37/39-45 Aceton R-Sätze: 11-36-66-67 S-Sätze:
7. Chemische Reaktionen
 7. Chemische Reaktionen 7.1 Thermodynamik chemischer Reaktionen 7.2 Säure Base Gleichgewichte Grundlagen Lösung: homogene Phase aus Lösungsmittel und gelösten Stoff Lösungsmittel liegt im Überschuss vor
7. Chemische Reaktionen 7.1 Thermodynamik chemischer Reaktionen 7.2 Säure Base Gleichgewichte Grundlagen Lösung: homogene Phase aus Lösungsmittel und gelösten Stoff Lösungsmittel liegt im Überschuss vor
Titrationskurve einer starken Säure (HCl) mit einer starken Base (NaOH)
 Titrationskurve einer starken Säure (HCl) mit einer starken Base (NaOH) Material 250 mlbecherglas 100 ml Messzylinder 50 mlbürette, Magnetrührer, Magnetfisch, Stativmaterial phmeter Chemikalien Natronlauge
Titrationskurve einer starken Säure (HCl) mit einer starken Base (NaOH) Material 250 mlbecherglas 100 ml Messzylinder 50 mlbürette, Magnetrührer, Magnetfisch, Stativmaterial phmeter Chemikalien Natronlauge
Zubehör zu
 Zubehör zu 2.914.0220 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Zubehör zu 2.914.0220 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Übungsaufgaben pk S / pk B / ph
 Übungsaufgaben pk S / pk B / ph 1.) Man gibt 20 ml Salzsäure der Konzentration 0,3 mol/l in ein Gefäß mit 50 ml Wasser. Anschließend gibt man 30 ml Salpetersäure der Konzentration 0,2 mol/l hinzu. Berechne
Übungsaufgaben pk S / pk B / ph 1.) Man gibt 20 ml Salzsäure der Konzentration 0,3 mol/l in ein Gefäß mit 50 ml Wasser. Anschließend gibt man 30 ml Salpetersäure der Konzentration 0,2 mol/l hinzu. Berechne
915 KF Ti-Touch / 916 Ti-Touch. Kompakt-Titrator für die Routineanalytik
 915 KF Ti-Touch / 916 Ti-Touch Kompakt-Titrator für die Routineanalytik Technische Daten 02 916 Ti-Touch 915 KF Ti-Touch Dosierelemente mit intelligenter Wechseleinheit oder Max. 2 x 800 Dosino oder Dosiereinheit
915 KF Ti-Touch / 916 Ti-Touch Kompakt-Titrator für die Routineanalytik Technische Daten 02 916 Ti-Touch 915 KF Ti-Touch Dosierelemente mit intelligenter Wechseleinheit oder Max. 2 x 800 Dosino oder Dosiereinheit
Aufgaben Berechnungen zum Ansetzen von Lösungen :
 Übungsblatt Seite 1 von 6 Aufgaben Berechnungen zum Ansetzen von Lösungen : Berechnen Sie die Einwaagen bzw. Mischvolumina zum Ansetzen folgender Stammlösungen. Es sollen jeweils 100 ml Lösung hergestellt
Übungsblatt Seite 1 von 6 Aufgaben Berechnungen zum Ansetzen von Lösungen : Berechnen Sie die Einwaagen bzw. Mischvolumina zum Ansetzen folgender Stammlösungen. Es sollen jeweils 100 ml Lösung hergestellt
Vorlesung Analytische Chemie I
 ALBERT-LUDWIGS- UNIVERSITÄT FREIBURG Vorlesung Analytische Chemie I Prof. Dr. Christoph Janiak Literatur: Jander,Blasius (blau), Einführung in das anorganisch-chemische Praktikum, 14. Auflage, Hirzel-Verlag,
ALBERT-LUDWIGS- UNIVERSITÄT FREIBURG Vorlesung Analytische Chemie I Prof. Dr. Christoph Janiak Literatur: Jander,Blasius (blau), Einführung in das anorganisch-chemische Praktikum, 14. Auflage, Hirzel-Verlag,
Praktikum Anorganische Chemie für Lehramt Bachelor (Modul 2) Quantitative Analyse
 Kaiserslautern, den 21. Juni 2017 2. Redoxtitration Praktikum Anorganische Chemie für Lehramt Bachelor (Modul 2) Quantitative Analyse C 2 O 4 2- mit MnO 4 - Reaktion: 5 C 2 O 4 2- + 2 MnO 4 - + 16 H +
Kaiserslautern, den 21. Juni 2017 2. Redoxtitration Praktikum Anorganische Chemie für Lehramt Bachelor (Modul 2) Quantitative Analyse C 2 O 4 2- mit MnO 4 - Reaktion: 5 C 2 O 4 2- + 2 MnO 4 - + 16 H +
QUALITATIVE UNTERSUCHUNGEN
 QUALITATIVE UNTERSUCHUNGEN Allgemeiner Alkaloid-Nachweis Cinchonae cortex 0.5 g gepulverte Droge werden mit 10 ml 0.2 M Schwefelsäure geschüttelt und abfiltriert. 2 ml aus den Extrakten werden in Reagenzgläser
QUALITATIVE UNTERSUCHUNGEN Allgemeiner Alkaloid-Nachweis Cinchonae cortex 0.5 g gepulverte Droge werden mit 10 ml 0.2 M Schwefelsäure geschüttelt und abfiltriert. 2 ml aus den Extrakten werden in Reagenzgläser
2. Teilklausur zum Chemischen Grundpraktikum im WS 2012/13 vom
 2. Teilklausur zum Chemischen Grundpraktikum im WS 2012/13 vom 30.01.2013 A1 A2 A3 R4 F5 E6 Σ Note 8 9 8 9 8 8 50 NAME/VORNAME:... Matrikelnummer: Stichpunkte zu den Lösungen/AC... Pseudonym für Ergebnisveröffentlichung
2. Teilklausur zum Chemischen Grundpraktikum im WS 2012/13 vom 30.01.2013 A1 A2 A3 R4 F5 E6 Σ Note 8 9 8 9 8 8 50 NAME/VORNAME:... Matrikelnummer: Stichpunkte zu den Lösungen/AC... Pseudonym für Ergebnisveröffentlichung
Anorganisch-Chemisches Praktikum für Physiker:
 Anorganisch-Chemisches Praktikum für Physiker: Quantitative Analyse (Teil 1) Dr. Christopher Anson INSTITUT FÜR ANORGANISCHE CHEMIE KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum
Anorganisch-Chemisches Praktikum für Physiker: Quantitative Analyse (Teil 1) Dr. Christopher Anson INSTITUT FÜR ANORGANISCHE CHEMIE KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum
Metrohm Water Solutions II
 Metrohm Water Solutions II Gratis für Sie bis 31. Dezember 2012 1 x Titrationssoftware tiamo 2 x Dosiersystem 800 Dosino 1 Komplettpakete für die titrimetrische Wasseranalytik 1 Bei Bestellung von Komplettpaket
Metrohm Water Solutions II Gratis für Sie bis 31. Dezember 2012 1 x Titrationssoftware tiamo 2 x Dosiersystem 800 Dosino 1 Komplettpakete für die titrimetrische Wasseranalytik 1 Bei Bestellung von Komplettpaket
Arbeitskreis Titration von Glycin mit Salzsäure und Natronlauge F 08 Kappenberg Seite 1 / 5
 Kappenberg Seite 1 / 5 Prinzip: Die Aminosäure Glycin wird mit Natronlauge titriert. Durch Ermittlung des Äquivalenzpunktes lässt sich der Gehalt der Säure berechnen, durch Ermittlung des Halbäquivalenzpunktes
Kappenberg Seite 1 / 5 Prinzip: Die Aminosäure Glycin wird mit Natronlauge titriert. Durch Ermittlung des Äquivalenzpunktes lässt sich der Gehalt der Säure berechnen, durch Ermittlung des Halbäquivalenzpunktes
Anorganische Chemie. Versuch 16 Titration einer schwachen Säure gegen eine starke Base. Versuchsteil 16.1 Potentiometrische Titration
 Georg-August-Universität Göttingen Fakultät für Biologie und Psychologie Anorganische Chemie Versuch 16 Titration einer schwachen Säure gegen eine starke Base Versuchsteil 16.1 Potentiometrische Titration
Georg-August-Universität Göttingen Fakultät für Biologie und Psychologie Anorganische Chemie Versuch 16 Titration einer schwachen Säure gegen eine starke Base Versuchsteil 16.1 Potentiometrische Titration
Kapitel 1 Stöchiometrie
 106 Kapitel 1 Stöchiometrie 1.1.1 2 FeC 2 O 4 + 3 H 2 O 2 + 1 H 2 SO 4 Fe 2 (SO 4 ) 3 + 4 CO 2 + 6 H 2 O 1.1.2 2 KMnO 4 + 10 HCl + 3 H 2 SO 4 K 2 SO 4 + 2 MnSO 4 + 5 Cl 2 + 8 H 2 O 1.1.3 3 Na 2 S 2 O 3
106 Kapitel 1 Stöchiometrie 1.1.1 2 FeC 2 O 4 + 3 H 2 O 2 + 1 H 2 SO 4 Fe 2 (SO 4 ) 3 + 4 CO 2 + 6 H 2 O 1.1.2 2 KMnO 4 + 10 HCl + 3 H 2 SO 4 K 2 SO 4 + 2 MnSO 4 + 5 Cl 2 + 8 H 2 O 1.1.3 3 Na 2 S 2 O 3
Säure-Base-Titrationen
 Säure-Base-Titrationen Dieses Skript gehört: Säure Base - Titrationen Seite 2 Hinweis: Mit den Säuren und Basen ist vorsichtig umzugehen, um Verätzungen zu vermeiden! Versuch 1: Herstellen einer Natronlauge
Säure-Base-Titrationen Dieses Skript gehört: Säure Base - Titrationen Seite 2 Hinweis: Mit den Säuren und Basen ist vorsichtig umzugehen, um Verätzungen zu vermeiden! Versuch 1: Herstellen einer Natronlauge
!!! NEUE ÖAB-MONOGRAPHIE!!!
 !!! NEUE ÖAB-MONOGRAPHIE!!! Die folgende neue Monographie ist für die Aufnahme in das ÖAB (österreichisches Arzneibuch) vorgesehen. Stellungnahmen zu diesem Gesetzesentwurf sind bis zum 31.01.2015 an folgende
!!! NEUE ÖAB-MONOGRAPHIE!!! Die folgende neue Monographie ist für die Aufnahme in das ÖAB (österreichisches Arzneibuch) vorgesehen. Stellungnahmen zu diesem Gesetzesentwurf sind bis zum 31.01.2015 an folgende
Beispiele zu Neutralisationsreaktionen
 Beispiele zu Neutralisationsreaktionen Einleitung: Im Zuge des folgenden Blocks wird die Titration als Beispiel einer gängigen quantitativen Bestimmungsmethode in der Chemie genauer besprochen und für
Beispiele zu Neutralisationsreaktionen Einleitung: Im Zuge des folgenden Blocks wird die Titration als Beispiel einer gängigen quantitativen Bestimmungsmethode in der Chemie genauer besprochen und für
Es soll eine schriftliche Ausarbeitung abgegeben werden (1 Exemplar pro Gruppe).
 Gruppe 1 Thema: Wissenswertes über Essig 1. Bestimme den ph-wert von Haushaltsessig. 2. Wie viel Essigsäure (in mol/l und in g/l) ist in Haushaltsessig enthalten? 3. Wie wird Essigsäure hergestellt (Ausgangsstoffe,
Gruppe 1 Thema: Wissenswertes über Essig 1. Bestimme den ph-wert von Haushaltsessig. 2. Wie viel Essigsäure (in mol/l und in g/l) ist in Haushaltsessig enthalten? 3. Wie wird Essigsäure hergestellt (Ausgangsstoffe,
Titrationen. Experimentiermappe zum Thema. Lernwerkstatt Schülerlabor Chemie
 Lernwerkstatt Schülerlabor Chemie Experimentiermappe zum Thema Titrationen Friedrich-Schiller-Universität Jena Arbeitsgruppe Chemiedidaktik August-Bebel-Straße 6-8 07743 Jena Fonds der Chemischen Industrie
Lernwerkstatt Schülerlabor Chemie Experimentiermappe zum Thema Titrationen Friedrich-Schiller-Universität Jena Arbeitsgruppe Chemiedidaktik August-Bebel-Straße 6-8 07743 Jena Fonds der Chemischen Industrie
Versuche zum Thema Aminosäuren
 Versuche zum Thema Aminosäuren und Proteine 1/5 Versuche zum Thema Aminosäuren ❶ ph-abhängigkeit der Löslichkeit von Tyrosin 1) In zwei Reagenzgläser gibt man je eine Spatelspitze Tyrosin und etwa 2 cm
Versuche zum Thema Aminosäuren und Proteine 1/5 Versuche zum Thema Aminosäuren ❶ ph-abhängigkeit der Löslichkeit von Tyrosin 1) In zwei Reagenzgläser gibt man je eine Spatelspitze Tyrosin und etwa 2 cm
KULTUSMINISTERIUM DES LANDES SACHSEN-ANHALT. Abitur April/Mai Chemie (Leistungskurs)
 KULTUSMINISTERIUM DES LANDES SACHSEN-ANHALT Abitur April/Mai 2003 Chemie (Leistungskurs) Einlesezeit: Bearbeitungszeit: 30 Minuten 300 Minuten Thema 1 Silber Thema 2 Chemisches Gleichgewicht Thema 3 Reaktionsarten
KULTUSMINISTERIUM DES LANDES SACHSEN-ANHALT Abitur April/Mai 2003 Chemie (Leistungskurs) Einlesezeit: Bearbeitungszeit: 30 Minuten 300 Minuten Thema 1 Silber Thema 2 Chemisches Gleichgewicht Thema 3 Reaktionsarten
Praktikum Advanced Inorganic Chemistry. Praktikumsanleitung Version 10/2012. Graetzel Zelle
 Praktikum Advanced Inorganic Chemistry Praktikumsanleitung Version 10/2012 Graetzel Zelle Synthese von cis-ru II (dcbpy) 2 (CS) 2 Chemikalien: RuCl 3 x H 2 5,5 -Dicarboxyl-2,2`-bipyridin (Herstellung s.
Praktikum Advanced Inorganic Chemistry Praktikumsanleitung Version 10/2012 Graetzel Zelle Synthese von cis-ru II (dcbpy) 2 (CS) 2 Chemikalien: RuCl 3 x H 2 5,5 -Dicarboxyl-2,2`-bipyridin (Herstellung s.
Zubehör zu
 Zubehör zu 2.865.0010 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
Zubehör zu 2.865.0010 Das Zubehör ist nachfolgend in die Bereiche Lieferumfang und Optionales Zubehör aufgeteilt. Halten Sie diesen Ausdruck zur Bestellung von Ersatzmaterialien bereit. Änderungen zu diesen
ScienceLine ph-einstabmessketten
 Scienceine ph-einstabmessketten ph-einstabmessketten mit Steckkopf und Festkabel Referenzsystem: Silamid Schaftmaterial: Glas Nullpunkt: ph = 7,0 ± 0,3 Elektrolyt: KCl 3 mol/l (außer N 6250: KCl 4,2 mol/l
Scienceine ph-einstabmessketten ph-einstabmessketten mit Steckkopf und Festkabel Referenzsystem: Silamid Schaftmaterial: Glas Nullpunkt: ph = 7,0 ± 0,3 Elektrolyt: KCl 3 mol/l (außer N 6250: KCl 4,2 mol/l
!!! NEUE ÖAB-MONOGRAPHIE!!!
 !!! NEUE ÖAB-MONOGRAPHIE!!! Die folgende neue Monographie ist für die Aufnahme in das ÖAB (österreichisches Arzneibuch) vorgesehen. Stellungnahmen zu diesem Gesetzesentwurf sind bis zum 31.05.2014 an folgende
!!! NEUE ÖAB-MONOGRAPHIE!!! Die folgende neue Monographie ist für die Aufnahme in das ÖAB (österreichisches Arzneibuch) vorgesehen. Stellungnahmen zu diesem Gesetzesentwurf sind bis zum 31.05.2014 an folgende
Ein Puffer ist eine Mischung aus einer schwachen Säure/Base und ihrer Korrespondierenden Base/Säure.
 2.8 Chemische Stoßdämpfer Puffersysteme V: ph- Messung eines Gemisches aus HAc - /AC - nach Säure- bzw Basen Zugabe; n(naac) = n(hac) > Acetat-Puffer. H2O Acetat- Puffer H2O Acetat- Puffer Die ersten beiden
2.8 Chemische Stoßdämpfer Puffersysteme V: ph- Messung eines Gemisches aus HAc - /AC - nach Säure- bzw Basen Zugabe; n(naac) = n(hac) > Acetat-Puffer. H2O Acetat- Puffer H2O Acetat- Puffer Die ersten beiden
Titration kleiner Chloridmengen mit Quecksilber(II)-nitrat
 Illumina-Chemie.de - Artikel Analytik Mit der hier dargestellten maßanalytischen Bestimmung von Chlorid über eine eingestellte Quecksilber(II)-nitrat-Lösung können noch sehr geringe Mengen, bis etwa 0,5
Illumina-Chemie.de - Artikel Analytik Mit der hier dargestellten maßanalytischen Bestimmung von Chlorid über eine eingestellte Quecksilber(II)-nitrat-Lösung können noch sehr geringe Mengen, bis etwa 0,5
Application Bulletin
 Nr. 6/ d Application Bulletin Von Interesse für: Allgemein analytische Laboratorien I L,, 3, 4, 5, 7, 8, 9,, 6 IC-Säule Metrosep Anion Dual (6.006.00) für die Bestimmung von Anionen mit und ohne chemische
Nr. 6/ d Application Bulletin Von Interesse für: Allgemein analytische Laboratorien I L,, 3, 4, 5, 7, 8, 9,, 6 IC-Säule Metrosep Anion Dual (6.006.00) für die Bestimmung von Anionen mit und ohne chemische
Technische Universität Chemnitz Chemisches Grundpraktikum
 Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP5 - Massanalytische Bestimmungsverfahren (Volumetrie)» Martin Wolf Betreuerin: Frau Sachse Datum:
Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP5 - Massanalytische Bestimmungsverfahren (Volumetrie)» Martin Wolf Betreuerin: Frau Sachse Datum:
DEFINITIONEN REINES WASSER
 SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
Konduktometrische und potenziometrische Titration von Salzsäure mit Natronlauge 2 Kanalmessung (normale Bürette)
 Prinzip Da sich bei der Neutralisation die Leitfähigkeit und der ph Wert ändern, kann man die Titration sowohl konduktometrisch wie auch potenziometrisch verfolgen. Mit Fourier Einstein / Milab (App für
Prinzip Da sich bei der Neutralisation die Leitfähigkeit und der ph Wert ändern, kann man die Titration sowohl konduktometrisch wie auch potenziometrisch verfolgen. Mit Fourier Einstein / Milab (App für
Lernzirkel WAS Station 1 Herstellung von Seife aus Kokosfett
 Station 1 Herstellung von Seife aus Kokosfett Zeitbedarf: 35 min. Durchführung 10 g Kokosfett und 5 ml destilliertes Wasser werden langsam in einem Becherglas erhitzt. Unter Rühren werden 10 ml Natronlauge
Station 1 Herstellung von Seife aus Kokosfett Zeitbedarf: 35 min. Durchführung 10 g Kokosfett und 5 ml destilliertes Wasser werden langsam in einem Becherglas erhitzt. Unter Rühren werden 10 ml Natronlauge
Argentometrische Titration nach Volhard
 Illumina-Chemie.de - Artikel Analytik Die massanalytische Methode nach Volhard, wobei die zu bestimmende Substanz mit Silbernitratlösung im Überschuss versetzt und dann das überschüssige Silber mit Ammoniumthiocyanatlösung
Illumina-Chemie.de - Artikel Analytik Die massanalytische Methode nach Volhard, wobei die zu bestimmende Substanz mit Silbernitratlösung im Überschuss versetzt und dann das überschüssige Silber mit Ammoniumthiocyanatlösung
Säuren, Basen und Puffersysteme
 Säuren, Basen und Puffersysteme Aufgabe: o Titrimetrische Bestimmung einer Säure und einer Base mit Indikatoren o Potentiometrische Bestimmung von 2 Säuren mittels ph-elektrode o Bestimmung der Säurekapazität
Säuren, Basen und Puffersysteme Aufgabe: o Titrimetrische Bestimmung einer Säure und einer Base mit Indikatoren o Potentiometrische Bestimmung von 2 Säuren mittels ph-elektrode o Bestimmung der Säurekapazität
Konduktometrische Titration von Salzsäure mit Natronlauge
 Prinzip Da sich bei der Neutralisation die Leitfähigkeit ändert, kann man die Titration auch konduktometrisch verfolgen. Die Qualität der Endpunkterkennung soll anhand der Neutralisation von Reaktionspartnern
Prinzip Da sich bei der Neutralisation die Leitfähigkeit ändert, kann man die Titration auch konduktometrisch verfolgen. Die Qualität der Endpunkterkennung soll anhand der Neutralisation von Reaktionspartnern
