SUMMENPARAMETER. Dr. K. Maly
|
|
|
- Theodor Rudolf Bachmeier
- vor 6 Jahren
- Abrufe
Transkript
1 SUMMENPARAMETER Begriff: Summenparameter liefern Information über komplex zusammengesetzte Probelösungen auf Grund einer Größe. Diese Größe geht von gemeinsamen physikalischen, chemischen oder Wirkungs-Eigenschaften der zu erfassenden Inhaltsstoffe des Wassers/Abwassers aus. Vorteile: - Schnell durchführbar - Geringer Aufwand - Übersichtsartige Aussage Nachteile: - Keine differenzierte Aussage (toxisch/nicht toxisch ) - Unspezifische Verfahren (Querempfindlichkeit!) Bedeutung: - schnelle, einfache Charakterisierung von Wasserproben - Regelgröße für Dimensionierung und Optimierung von Kläranlagen - Festlegung/Überprüfung von Grenzwerten
2 SUMMENPARAMETER Parameter CSB BSB TOC CSB/TOC AOX POX EOX Angabe in mg O 2 /L mg O 2 /L nach n Tagen mg C/L mg O 2 /mg C mg Cl/L mg Cl/L mg Cl/L Aussage Verunreinigung mit chemisch oxidierbaren organischen Substanzen Verunreinigung mit biochemisch abbaubaren Substanzen Kohlenstoffgehalt der organischen Verunreinigungen Wieviel mg O 2 für die Oxidation von 1 mg C nötig ist. Spezifischer Sauerstoffbedarf. Verunreinigung mit organischen Halogenverbindungen Verunreinigung mit leichtflüchtigen organischen Halogenverbindungen Verunreinigung mit extrahierbaren organischen Halogenverbindungen
3 CSB (Chemischer Sauerstoff-Bedarf) COD (Chemical Oxygen Demand) Aussage: - Summenparameter für die Verschmutzung von Wasser/Abwasser mit oxidierbaren, organischen Stoffen - keine Aussage über Art der Verbindung - Kein Rückschluss auf die Masse an organischer Substanz möglich, da der Sauerstoffbedarf von der Oxidationszahl des Kohlenstoffs in der Verbindung abhängt (560mg Oxalsäure und 48mg Ethanol haben den gleichen CSB von 100mg O 2 /L) Typische Werte für den CSB (in mg O 2 /L): - Trinkwasser 0,1-2 - Unbelastetes Oberflächengewässer Belastetes Oberflächengewässer Kommunales Abwasser
4 CSB (Chemischer Sauerstoff-Bedarf) COD (Chemical Oxygen Demand) Chemische Grundlagen: Organische Substanzen werden in stark H 2 SO 4 -saurem Milieu mit K 2 Cr 2 O 7 zu CO 2 und H 2 O oxidiert. Die Angabe des Ergebnisses erfolgt in mgo 2 /L. Theoretisch: C 2 H 5 OH + 3 O 2 2CO 2 + 3H 2 O Praxis: C 2 H 5 OH + 2Cr 2 O H + 2CO H 2 O + 4Cr 3+ Daraus folgt: 1mol K 2 Cr 2 O 7 = 1,5 mol O 2 Störungen: Alle durch Cr 2 O 7 2- oxidierbaren anorganischen Verbindungen: Chlorid, Nitrit, Sulfid Cr 2 O Cl H + 2Cr Cl 2 + 7H 2 O Abhilfe: Bis 1g Cl - /L: Zusatz von HgCl 2 : Hg Cl - [HgCl 4 ] - Komplex ist nicht oxidierbar Höhere Chlorid-Konzentrationen: Verdünnen oder abdestillieren als HCl nach H 2 SO 4 -Zusatz
5 CSB (Chemischer Sauerstoff-Bedarf) COD (Chemical Oxygen Demand) Normmethode (DIN H41): - Probelösung + H 2 SO 4 konz. + K 2 Cr 2 O 7 (definierter Überschuss) + HgSO 4 (Chlorid!) + Ag 2 SO 4 (Oxidationskatalysator) - 2h Rückflusskochen oder bei 4-facher Ag 2 SO 4 -Menge nur 10 Minuten kochen (Kurzzeitmethode) - Verbrauch an Cr 2 O 7 2- bestimmen: Indirekt durch Titration des überschüssigen Dichromats mit (NH 4 ) 2 Fe(SO 4 ) 2 und Ferroin als Redoxindikator: Cr O 7 + Fe + H Cr + Fe + H 2 O Schnelltest ( Küvettentest ) - Chemikalien liegen in verschraubbaren Rundküvetten vor. Probelösung wird zupipettiert - Erhitzen im Heizblock - Photometrische Bestimmung: a) indirekt: überschüssiges Dichromat bei 435nm (orange). Messbereich: mg O 2 /L b) direkt: entstandenes Cr 3+ wird bei 620nm gemessen. Messbereich: mg O 2 /L Beide Methoden liefern sehr problematische Abfälle!
6 Permanganatindex Chemische Grundlagen: Ähnlich CSB: organische Substanzen werden in stark H 2 SO 4 -saurem Milieu mit KMnO 4 zu CO 2 und H 2 O oxidiert. MnO e - + 8H + Mn H 2 O Die Angabe des Ergebnisses erfolgt in mg O 2 /L. Aussage: Permanganatindex ist nur für die Beurteilung von Trinkund Oberflächengewässer (Badegewässer) geeignet. In gewerblichen oder Industrieabwässern enthaltene Stoffe (Fette, Öle, diverse Industriechemikalien..) werden durch Permanganat (im Gegensatz zur Oxidation mit K 2 Cr 2 O 7 ) nicht oder nur teilweise oxidiert. Durchführung: - Probe + H 2 SO 4 + KMnO 4 (in definiertem Überschuss) - 10 Minuten am Wasserbad erhitzen - Zugabe einer, der KMnO 4 -Menge äquivalenten Menge an Oxalsäure (Na-Oxalat) - Titration des Oxalsäureüberschusses mit einer KMnO 4 -Maßlösung - Auswertung/Berechnung: analog CSB
7 BSB (Biochemischer Sauerstoff-Bedarf) Begriff: Masse an Sauerstoff, die von Mikroorganismen bei der biochemischen Oxidation von in 1L Wasser enthaltenen organischen Substanzen bei 20 o C im Verlauf von n Tagen verbraucht wird. Angabe des Ergebnisses erfolgt in mg O 2 /L. Biochemische Grundlagen: Mikroorganismen verwerten Wasserinhaltsstoffe als Nahrung. Dabei werden organische Makromoleküle (Kohlehydrate, Fette, Eiweiß) in niedermolekulare Einheiten abgebaut (Monosaccaride, Glycerin, Fettsäuren, Aminosäuren). Aus diesen werden wieder arteigene Makromoleküle (neue Zellsubstanz) aufgebaut. Ab- und Aufbau benötigt Energie, die durch Oxidation gewonnen wird: z.b.: C 6 H 12 O O 2 6 CO H 2 O + Energie Den für die Oxidation nötigen Sauerstoff entziehen die Mikroorganismen dem Wasser (Löslichkeit: 8-9mg O 2 /L) Die eigentlichen biochemischen Oxidationsreaktionen erfolgen in der Atmungskette. Dabei wird freiwerdenden Energie als ATP gespeichert: ADP (Adenosindiphosphat) + Energie ATP(Adenosintriphosphat) Neben der Gewinnung von Energie durch Oxidation organischer Substanzen können spezielle Mikroorganismen auch durch biochemische Oxidation von NH 4+ -Ionen zu NO 2- bzw. NO 3 - Energie gewinnen und dabei O 2 verbrauchen. Diesen Vorgang bezeichnet man als Nitrifikation. NH O 2 NO 3- + H 2 O + 2 H + + Energie Die Nitrifikation setzt meist erst nach mehreren Tagen ein. Sie kann bei der BSB-Bestimmung durch Zugabe von Hemmstoffen unterbunden werden.
8 BSB (Biochemischer Sauerstoff-Bedarf) Störungen: - Anorganische Substanzen, die durch O 2 oxidiert werden können und somit O 2 verbrauchen: Fe 2+, SO 3 2-, S Toxische Stoffe oder Stoffe, die die biochemische Aktivität der Bakterien hemmen. Aussage: - Summenparameter für die Verunreinigung eines Wassers mit biochemisch abbaubaren Stoffen - Maßzahl für die zu erwartende Belastung des Sauerstoffhaushaltes eines Gewässers - Wichtiger Parameter zur Berechnung des notwendigen Sauerstoffeintrages für die biologische Abwasserreinigung (Belebtschlammverfahren) - Je nach Aufgabenstellung wird die Nitrifikation miterfasst oder unterbunden - Leicht abbaubare Verbindungen, wie sie in kommunalem Abwasser hauptsächlich vorkommen, werden in 5 Tagen zu ca. 70% abgebaut (BSB 5 = 0,7 x CSB). Nach 20 Tagen ist der Abbau nahezu vollständig (BSB 20 = CSB) - Neben dem Absolutwert für den BSB ist die Angabe des Verhältnisses BSB/CSB sinnvoll (abbaubarer Anteil zu Gesamtmenge an oxidierbaren Stoffen)
9 BSB (Biochemischer Sauerstoff-Bedarf) Bestimmungsmethoden: Prinzip: - Probe wird mit Überschuss an Sauerstoff in Kontakt gebracht (je nach Methode mit 0 2 -gesättigtem Wasser, Luft oder reinem 0 2 ) - Der Sauerstoffverbrauch für eine bestimmte Zeitspanne (z.b.: 5 Tage) wird ermittelt - Keimarmes Wasser muss beimpft werden. Als Impflösung (Inoculum) werden Erdextrakte, Abwässer einer Kläranlage etc. verwendet - Eine ausreichende Versorgung der Mikroorganismen mit anorganischen Nährsalzen und Spurenelementen muss sichergestellt sein (N, P, K, Ca, Mg, Fe..) Varianten der BSB-Bestimmung: - Verdünnungsmethode - Manometrisches Verfahren - Coulometrische Methode
10 BSB (Biochemischer Sauerstoff-Bedarf) Prinzip: Verdünnungsmethode (nach ÖNORM ISO 5815) Der für die mikrobielle Oxidation organischer Stoffe nötige Sauerstoff liegt im Wasser gelöst vor. Der BSB ist die Differenz des Anfangs- und Endsauerstoffgehaltes der luftdicht verschlossenen Probe. Bei 20 o C und 101,3 kpa sind ca. 9,1mg 0 2 /L gelöst. Da nach n-tagen mindestens 2mg 0 2 /L vorliegen sollten, stehen für die Oxidation maximal nur ca. 7mg 0 2 /L zur Verfügung. Durch entsprechende Verdünnung der Probe mit 0 2 -gesättigtem Wasser kann der Messbereich erweitert werden. Durchführung: - Die Probe wird mit 0 2 -gesättigtem Verdünnungswasser in unterschiedlichen Verhältnissen verdünnt und luftblasenfrei in Glasflaschen eingefüllt - Der Sauerstoffgehalt am Anfang (0. Tag) wird ermittelt - Die luftblasenfrei und gasdicht verschlossenen Glasflaschen (bevorzugt 250mL Erlenmeyerkolben mit Schliffstopfen) werden für n-tage (meist n=5) bei 20 o C im Dunklen aufgewahrt - Nach n-tagen wird der Sauerstoffgehalt erneut bestimmt. Er sollte mindestens 2mg 0 2 /L betragen - Parallel dazu wird ein Blindwert (0 2 -gesättigtes Verdünnungswasser mit allen Zusätzen) angesetzt und am 0. Tag und nach n-tagen der Sauerstoffgehalt bestimmt. Der Blindwert (Sauerstoffabnahme nach n-tagen) darf maximal 1mg 0 2 /L betragen - Zusätzlich ist eine Kontrolllösung zu bereiten (150mg Glucose und 150mg Glutaminsäure auf 1L). 20 ml dieser Lösung sind mit beimpftem, 0 2 -gesättigten Verdünnungswasser auf 1L aufzufüllen. Die weitere Bestimmung verläuft analog zu den Proben bzw. dem Blindwert. Die Kontrolllösung muss (nach Berücksichtigung der Verdünnung) einen BSB 5 zwischen mg 0 2 /L ergeben. Verdünnungswasser: Bei Verwendung von Leitungswasser als Verdünnungswasser ist eine Filtration über Aktivkohle empfehlenswert, um Substanzen aus der Trinkwasserdesinfektion, die die biologische Aktivität der Bakterien hemmen können, zu entfernen. Das Wasser wird mit Nährsalzen und Spurenelementen (Phosphate, Fe-Salze) versetzt und ausreichend belüftet (Aquarienpumpe), gegebenenfalls auch mit Impflösung versetzt (inkubiert). Bei Verwendung von Leitungswasser ist der in der Norm vorgesehene Zusatz von Ca- und Mg-Salzen nicht nötig.
11 BSB (Biochemischer Sauerstoff-Bedarf) Prinzip: Manometrisches Verfahren Der für die mikrobielle Oxidation organischer Stoffe nötige Sauerstoff wird aus dem Luftraum, der sich im Probengefäß über der Probe befindet, nachgeliefert. Um den Gasaustausch zu gewährleisten, wird die Probe ständig gerührt. Durch Verkleinerung des Probenaliquots kann in einer bestehenden Apparatur der Messbereich vergrößert werden. Durchführung: Ein definiertes Probenvolumen wird in die Flasche eingefüllt und diese gasdicht mit dem Quecksilbermanometer verbunden Die Probelösung wird permanent gerührt (Gasaustausch) Der bei der biochemischen Oxidation dem Wasser entzogene Sauerstoff wird aus der überstehenden Luft ständig nachgeliefert Das entstehende Kohlendioxid wird in Natronlauge absorbiert Je nach Sauerstoffverbrauch in der Probe entsteht in der Gasphase ein Unterdruck, der nach Kalibrierung des Manometers direkt in mg 0 2 /L ablesbar ist Vorteile: Sehr einfache Bedienung Großer Messbereich ( mg 0 2 /L) Aufnahme von Sauerstoffverbrauchskurven möglich Nachteil:: Präzision +5-10%
12 BSB (Biochemischer Sauerstoff-Bedarf) Prinzip: Coulometrisches Verfahren ( Sapromat ) Der für die mikrobielle Oxidation organischer Stoffe nötige Sauerstoff wird aus dem Luftraum, der sich im thermostatisierten Probengefäß über der Probe befindet, nachgeliefert. Um den Gasaustausch zu gewährleisten, wird die Probe ständig gerührt. Entstehendes CO 2 wird absorbiert. Ein Drucksensor registriert den Unterdruck und schaltet die elektrolytische O 2 - Erzeugung solange ein, bis wieder der Ausgangsdruck herrscht. Auswertung: Die gemessene Strommenge in Coulomb C [A s] ist der Sauerstoffmenge äquivalent. Für die Umsetzung von 1 Mol Elektronen werden C benötigt (Faraday-Äquivalent) 1 Mol e - = C Bei der Erzeugung von 1 Mol O 2 werden 4 Mol Elektronen umgesetzt: 2 OH - O H e - Vorteile: - Aufnahme von O 2 -Verbrauchskurven möglich - Sehr präzise Messung - Großer Messbereich Nachteil: - Apparativ aufwendig, teuer
13 SAPROMAT
14 Titrimetrische Sauerstoffbestimmung nach WINKLER 3 Arbeitsschritte: - Fixieren: In Wasser gelöster Sauerstoff wird in einer WINKLER- Flasche in Form von Mn(OH) 3 fixiert. (Zusatz einer Mn 2+ - Lösung und einer alkalischen KJ- Lösung) O Mn OH H 2 O 4 Mn(OH) 3 Je nach O 2 -Gehalt bildet sich dabei ein hell- bis dunkelbrauner Niederschlag - Freisetzen: Durch H 2 SO 4 -Zugabe wird der Niederschlag aufgelöst. Mn-III oxidiert J - zu J 2 4 Mn(OH) H J - 4 Mn J H 2 O - Titrieren: Freigesetztes J 2 wird mit Na 2 S 2 O 3 - Maßlösung titriert (Indikator: Stärke) 2 J S 2 O J S 4 O Mol O 2 = 4 Mol S 2 O ml 0,01M Na 2 S 2 O 3 = 0,08 mg O 2 Probleme: Winklerflaschen müssen luftblasenfrei gefüllt und nach Zusatz der Fixierlösung luftdicht verschlossen werden. Das Wasser in der Winklerflasche ist nach der Fixierung O 2 -frei. Jeder O 2 -Eintrag (Luftblasen im Gefäß...) verfälscht das Ergebnis.
15 Amperometrische Sauerstoffbestimmung nach CLARK Prinzip: Zwischen einer Kathode aus Pt (oder Au) und einer Ag-Anode wird eine Spannung von 0.8-1,5V angelegt. Der durch eine dünne PTFE-Membran in das Innere der Elektrode diffundierende O 2 wird an der Kathode reduziert. Die Diffusionsgeschwindigkeit und damit auch der gemessene Strom ist der O 2 -Konzentration in der Probe proportional. Da die Flüssigkeitsschicht zwischen Membran und Kathode sehr dünn ist (ca. 10 µm) stellt sich das Diffusionsgleichgewicht rasch ein. Der Messwert ist temperaturabhängig. Daher erfolgt eine automatische Temperaturkompensation über einen integrierten Thermofühler. Aufbau eines CLARK-Sensors: Kathodenreaktion: O 2 + 4H + + 4e - 2 H 2 O Anodenreaktion: Ag + Cl - AgCl + e - Vorteile: Einfache Bedienung Batteriegespeiste Geräte für vor Ort Messung Probleme: Verschmutzungen der Membran (Fette, Öle..) beeinflussen den Messwert stark
16 TOC (Total Organic Carbon) Begriffe: TOC: Summe des Gehaltes an ungelöstem und gelöstem organisch gebundenen Kohlenstoffs DOC: Dissolved Organic Carbon Gehalt an gelöstem organisch gebundenen Kohlenstoff (TOC einer filtrierten Probe) TIC: Total Inorganic Carbon Summe des Gehaltes an ungelöstem und gelöstem anorganisch gebundenen Kohlenstoffs (CO 2-3, HCO 3-, CO 2 ) TC: Total Carbon = TOC + TIC NPOC: Non Purgeable Organic Carbon Nicht ausblasbarer (schwerflüchtiger) organisch gebundener Kohlenstoff
17 TOC (Total Organic Carbon) Chemische Grundlagen: TIC-Bestimmung: Ansäuern der Probelösung (mit H 3 PO 4 ): CO H + CO 2 + H 2 O CO 2 wird mit Inertgas ausgetrieben und quantitativ bestimmt (NDIR-Detektor) TOC-Bestimmung: Oxidation des organisch gebundenen Kohlenstoffs zu CO 2 und anschließende quantitative Bestimmung. Variante 1: KOROLEFF-Aufschluss: Oxidation mit Peroxodisulfat bei 70 0 C in saurem Medium unter UV-Bestrahlung: S 2 O H + + 2e - 2HSO 4 - VT: Hohe Empfindlichkeit (große Probenaliquote möglich) NT: Nicht für feststoffhaltige Proben Variante 2: Verbrennung Im O 2 -Strom bei 850 o C (Katalysatoren) VT: auch für feststoffhaltige Proben NT: Aliquote begrenzt (500µL)
18 TOC (Total Organic Carbon) Aussage: Summenparameter für die Verschmutzung eines Wassers mit organischen Verbindungen Prinzipiell gleiche Aussage wie CSB, aber: CSB gibt den O 2 -Bedarf für die Oxidation organischer Verbindungen an TOC gibt den C-Gehalt der organischen Verbindungen an Es gibt keine konstante Beziehung zwischen CSB und TOC: Verbindung C-Gehalt OZ des C CSB CSB/TOC 1mg Oxalsäure 1mg Ethanol 0,27mg +III 0,18mg O 2 0,67 0,52mg -II 2,1mg O 2 4,0 Das Verhältnis CSB/TOC nennt man spezifischer Sauerstoffbedarf (gibt an, wieviel mg O 2 für die Oxidation von 1mg C benötigt wird) Für kommunales Abwasser gilt: Spezifischer Sauerstoffbedarf: 2,5-3,5mgO 2 /mgc
19 TOC (Total Organic Carbon) Bestimmungsmethoden: A) Direkte Bestimmung (nasschemisches Verfahren) Schritt 1: TIC-Messung Trägergas Probelösung + Säure CO 2 TIC-Signal Schritt 2: TOC-Messung (Probelösung von Schritt 1): Trägergas Probelösung CO 2 TOC-Signal KOROLEFF B) Differenzverfahren (Verbrennung) Schritt 1: TC-Messung Trägergas (O 2 ) Probelösung CO 2 TC-Signal Ofen, 850 o C, Katal. Schritt 2: TIC-Messung (separates Aliquot!) Trägergas Probelösung + Säure CO 2 TIC-Signal TOC wird rechnerisch ermittelt: TOC = TC -TIC Problem: bei hohem TIC im Vergleich zum TOC (z. B. Trinkwasser) nicht präzise Abhilfe: NPOC-Messung: Nach Entfernen des TIC wird ein Aliquot in den Ofen eingebracht. Beim Ausblasen des TIC gehen aber leichtflüchtige organische Substanzen verloren.
20 AOX Adsorbierbare organisch gebundene Halogene Begriff: Menge an organisch gebundenen Halogenen (Cl, Br, I), die in einem Liter Wasser enthalten und an Aktivkohle adsorbierbar sind. Angabe erfolgt in µg Cl/L Chemische Grundlagen: Adsorption: - Saures Medium (ph=2) - Adsorption von Chlorid wird durch Zugabe großer Mengen an Nitrat verhindert - Aktivkohle adsorbiert prinzipiell alle organischen Verbindungen (aber: Adsorptionsvermögen der Aktivkohle nimmt mit steigender Polarität der Verbindungen ab, z.b. wird Chloressigsäure nur teilweise adsorbiert). Verbrennung: Organisch gebundene Halogen werden im O 2 - Strom bei o C verbrannt. Es entstehen die Halogenwasserstoffsäuren (HCl, HBr, HI). Zum Beispiel: C 4 H 9 Cl +6O 2 HCl + 4CO 2 +4H 2 O
21 AOX Adsorbierbare organisch gebundene Halogene Chemische Grundlagen: Trocknung der Verbrennungsgase: Verbrennungsgase werden zur Trocknung durch H 2 SO 4 konz. geleitet. An kühlen Rohrwänden kondensierende Feuchtigkeit würde zu Minderbefunden führen (Absorption von HX) HX-Bestimmung: - Die bei der Verbrennung entstandenen gasförmigen Halogenverbindungen (HX) werden in eine coulometrische Zelle mit definierter Ag + - Konzentration eingeleitet: X - + Ag + AgX - die zur Fällung benötigte Ag + -Menge wird durch die elektrochemische Oxidation von metallischem Ag wieder ersetzt: Ag Ag + + e - - die dabei umgesetzte Strommenge ist die Messgröße. FARADAY - 1F = Coulomb (A s) = 1mol e -
22 AOX Adsorbierbare organisch gebundene Halogene Schematische Darstellung des Verfahrens: Coulometrische Zelle:
23 AOX Adsorbierbare organisch gebundene Halogene Störungen: - Gelöstes Cl 2, ClO -, ClO 2-, ClO 3-, führen zu Mehrbefunden (Abhilfe: Reduktion mit Na 2 SO 3 ) - Hoher DOC-Gehalt (>10mg/L) kann zu unvollständiger Adsorption der halogenhaltigen Verbindungen führen (Abhilfe: Probe verdünnen) - Halogengehalt von Feststoffen (egal, ob organisch oder anorganisch gebunden) wird miterfasst (weil Feststoffe mit der Aktivkohle gemeinsam abfiltriert werden) - Chloridgehalt >1gCl - /L (Abhilfe: Probe verdünnen) Typische Werte in µgcl/l: Oberflächenwasser unbelastet: 0-5 Oberflächenwasser belastet: Trinkwasser ( gechlort ): 1-50 Kommunales Abwasser: * Industrieabwässer bis 1000 *Hauptmenge gelangt in Form iodierter Verbindungen (Röntgenkontrastmittel, Arzneimittel) in das Abwasser
24 EOX und POX Extrahierbare organisch gebundene Halogene Purgeable Organic Halogens EOX: Die Probe wird mit einem unpolaren Lösemittel (Hexan) extrahiert und der Extrakt im Ofen verbrannt. Die HX-Bestimmung erfolgt wie bei der AOX-Bestimmung. POX: Die in der Probe enthaltenen, leicht flüchtigen Halogenverbindungen werden bei 60 o C mit O 2 ausgetrieben und in den Verbrennungsofen geleitet. Die HX- Bestimmung erfolgt wie bei der AOX- Bestimmung.
3.1.2 Oberflächenwasser
 3.1.2 Oberflächenwasser - Die chemische Zusammensetzung hängt vom Untergrund des Einzugsgebietes, von der Zusammensetzung und der Menge des Niederschlages sowie von Zu- und Abfluss ab. - Flusswasser hat
3.1.2 Oberflächenwasser - Die chemische Zusammensetzung hängt vom Untergrund des Einzugsgebietes, von der Zusammensetzung und der Menge des Niederschlages sowie von Zu- und Abfluss ab. - Flusswasser hat
Ist der Aufschluss für eine Gesamtphosphatbestimmung auch im Hochtemperaturthermostat (HT) möglich?
 FAQ Laboranalytik Chemie Parameter Phosphat Was bedeutet in der Formel PO4 P der Buchstabe P? Ist eine Berechnung von PO4 ( Phosphat Phosphor) nach PO4 3- ( Phosphat) möglich? Gesamt- oder Orthophosphat?
FAQ Laboranalytik Chemie Parameter Phosphat Was bedeutet in der Formel PO4 P der Buchstabe P? Ist eine Berechnung von PO4 ( Phosphat Phosphor) nach PO4 3- ( Phosphat) möglich? Gesamt- oder Orthophosphat?
Analysenservice FM-VEA-AS
 Analysenservice FM-VEA-AS Preisliste 2015 Analytik von Wasser, Abwasser, Böden, Schlämmen, Abfällen, Sonderproben Art der Leistung Probennahme nach Aufwand nach Aufwand Aufbereitung von Feststoffen Brechen
Analysenservice FM-VEA-AS Preisliste 2015 Analytik von Wasser, Abwasser, Böden, Schlämmen, Abfällen, Sonderproben Art der Leistung Probennahme nach Aufwand nach Aufwand Aufbereitung von Feststoffen Brechen
Analytische Chemie. B. Sc. Chemieingenieurwesen. 14. März Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 14. März 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 14. März 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Reduktion und Oxidation. Oxidationszahlen (OZ)
 Redox-Reaktionen Reduktion und Oxidation Oxidationszahlen (OZ) REDOX Reaktionen / - Gleichungen Das elektrochemische Potential Die Spannungsreihe der Chemischen Elemente Die Nernstsche Gleichung Definitionen
Redox-Reaktionen Reduktion und Oxidation Oxidationszahlen (OZ) REDOX Reaktionen / - Gleichungen Das elektrochemische Potential Die Spannungsreihe der Chemischen Elemente Die Nernstsche Gleichung Definitionen
Analytische Chemie. B. Sc. Chemieingenieurwesen. 02. Februar Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 02. Februar 2011 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 02. Februar 2011 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Redox- und Fällungstitration P 3
 Hochschule für Technik, Wirtschaft und Kultur Leipzig Fakultät Informatik, Mathematik und Naturwissenschaften Chemisches Praktikum Energie- und Umwelttechnik Redox- und Fällungstitration P 3 1 Aufgabenstellung
Hochschule für Technik, Wirtschaft und Kultur Leipzig Fakultät Informatik, Mathematik und Naturwissenschaften Chemisches Praktikum Energie- und Umwelttechnik Redox- und Fällungstitration P 3 1 Aufgabenstellung
Online-CSB und reagenzienfrei in 3 Minuten
 12. Berliner Wasserwerkstatt Online-CSB - vollständig und reagenzienfrei in 3 Minuten Vorstellung einer neuen alten Methode Dr. Werner Arts, LAR AG - Berlin 1 Summenparameter Glühverlust des Eindampfrückstandes
12. Berliner Wasserwerkstatt Online-CSB - vollständig und reagenzienfrei in 3 Minuten Vorstellung einer neuen alten Methode Dr. Werner Arts, LAR AG - Berlin 1 Summenparameter Glühverlust des Eindampfrückstandes
Technische Universität Chemnitz Chemisches Grundpraktikum
 Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP5 - Massanalytische Bestimmungsverfahren (Volumetrie)» Martin Wolf Betreuerin: Frau Sachse Datum:
Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP5 - Massanalytische Bestimmungsverfahren (Volumetrie)» Martin Wolf Betreuerin: Frau Sachse Datum:
4. Quantitative Bestimmung von Eisen(II) durch Redoxtitration mit Kaliumpermanganat
 Redoxtitration 29. Quantitative Bestimmung von Eisen(II) durch Redoxtitration mit Kaliumpermanganat Einleitung Eisen ist das mit Abstand wichtigste Gebrauchsmetall. Aufgrund seines elektrochemisch sehr
Redoxtitration 29. Quantitative Bestimmung von Eisen(II) durch Redoxtitration mit Kaliumpermanganat Einleitung Eisen ist das mit Abstand wichtigste Gebrauchsmetall. Aufgrund seines elektrochemisch sehr
AnC I Protokoll: 7.1 Synthese und Charakterisierung von Tetraamminkupfer(II)-sulfat! SS Analytische Chemie I.
 Analytische Chemie I Versuchsprotokoll 7.1 Synthese und Charakterisierung der Komplexverbindung Tetraamminkupfer(II)-sulfat 1.! Theoretischer Hintergrund Aus Kupfer(II)-sulfat und Ammoniak wird zunächst
Analytische Chemie I Versuchsprotokoll 7.1 Synthese und Charakterisierung der Komplexverbindung Tetraamminkupfer(II)-sulfat 1.! Theoretischer Hintergrund Aus Kupfer(II)-sulfat und Ammoniak wird zunächst
Akkreditierungsumfang der Prüfstelle (EN ISO/IEC 17025:2005) ARGE Umwelt-Hygiene Ges.m.b.H. / (Ident.Nr.: 0233)
 1 2 3 4 5 6 7 AA 032 DIN 38402-11 DIN 38402-13 DIN 38402-18 DIN 38402-19 DIN 38404-3 DIN 38404-4 2006-02 Bestimmung des Kaliumpermanganat-Index mit Fließanalyse und spektrometrischer Detektion 2009-02
1 2 3 4 5 6 7 AA 032 DIN 38402-11 DIN 38402-13 DIN 38402-18 DIN 38402-19 DIN 38404-3 DIN 38404-4 2006-02 Bestimmung des Kaliumpermanganat-Index mit Fließanalyse und spektrometrischer Detektion 2009-02
4. Anorganisch-chemische Versuche
 4. Anorganisch-chemische Versuche o 4.4 Redoxreaktionen 4.4.1 Reduktion von Mangan(VII) in schwefelsaurer Lsg. 4.4.2 Oxidation von Mangan(II) in salpetersaurer Lsg. 4.4.3 Oxidation von Chrom(III) in alkalischer
4. Anorganisch-chemische Versuche o 4.4 Redoxreaktionen 4.4.1 Reduktion von Mangan(VII) in schwefelsaurer Lsg. 4.4.2 Oxidation von Mangan(II) in salpetersaurer Lsg. 4.4.3 Oxidation von Chrom(III) in alkalischer
Themen heute: Säuren und Basen, Redoxreaktionen
 Wiederholung der letzten Vorlesungsstunde: Massenwirkungsgesetz, Prinzip des kleinsten Zwangs, Löslichkeitsprodukt, Themen heute: Säuren und Basen, Redoxreaktionen Vorlesung Allgemeine Chemie, Prof. Dr.
Wiederholung der letzten Vorlesungsstunde: Massenwirkungsgesetz, Prinzip des kleinsten Zwangs, Löslichkeitsprodukt, Themen heute: Säuren und Basen, Redoxreaktionen Vorlesung Allgemeine Chemie, Prof. Dr.
Sie kann auf biologischen oder auf chemischen Untersuchungen des Gewässers beruhen:
 Wasser und Abwasser Wiederholung: Gewässereutrophierung und Gewässergüteklassen Gewässergütebestimmung Sie kann auf biologischen oder auf chemischen Untersuchungen des Gewässers beruhen: Die Gewässergüte:
Wasser und Abwasser Wiederholung: Gewässereutrophierung und Gewässergüteklassen Gewässergütebestimmung Sie kann auf biologischen oder auf chemischen Untersuchungen des Gewässers beruhen: Die Gewässergüte:
Redoxtitrationen. Redox-Reaktionen Oxidation und Reduktion
 RedoxReaktionen Oxidation und Reduktion Redoxtitrationen Beschreibung der Lage von Redoxgleichgewichten Standardpotentiale, Spannungsreihe Nernst sche Gleichung Berechnung von Titrationskurven Indikationen
RedoxReaktionen Oxidation und Reduktion Redoxtitrationen Beschreibung der Lage von Redoxgleichgewichten Standardpotentiale, Spannungsreihe Nernst sche Gleichung Berechnung von Titrationskurven Indikationen
Fragen zum Analytischen Grundpraktikum für Chemiker/LAK
 1 Fragen zum Analytischen Grundpraktikum für Chemiker/LAK Allgemeine Arbeitsoperationen 1. Was versteht man unter der Empfindlichkeit einer Waage? 2. Welche Empfindlichkeit besitzt die Waage, mit welcher
1 Fragen zum Analytischen Grundpraktikum für Chemiker/LAK Allgemeine Arbeitsoperationen 1. Was versteht man unter der Empfindlichkeit einer Waage? 2. Welche Empfindlichkeit besitzt die Waage, mit welcher
Oxidation und Reduktion
 Seminar RedoxReaktionen 1 Oxidation und Reduktion Definitionen: Oxidation: Abgabe von Elektronen Die Oxidationszahl des oxidierten Teilchens wird größer. Bsp: Na Na + + e Reduktion: Aufnahme von Elektronen
Seminar RedoxReaktionen 1 Oxidation und Reduktion Definitionen: Oxidation: Abgabe von Elektronen Die Oxidationszahl des oxidierten Teilchens wird größer. Bsp: Na Na + + e Reduktion: Aufnahme von Elektronen
MgO. Mg Mg e ½ O e O 2. 3 Mg 3 Mg e N e 2 N 3
 Redox-Reaktionen Mg + ½ O 2 MgO 3 Mg + N 2 Mg 3 N 2 Mg Mg 2+ + 2 e ½ O 2 + 2 e O 2 3 Mg 3 Mg 2+ + 6 e N 2 + 6 e 2 N 3 Redox-Reaktionen Oxidation und Reduktion Eine Oxidation ist ein Elektronenverlust Na
Redox-Reaktionen Mg + ½ O 2 MgO 3 Mg + N 2 Mg 3 N 2 Mg Mg 2+ + 2 e ½ O 2 + 2 e O 2 3 Mg 3 Mg 2+ + 6 e N 2 + 6 e 2 N 3 Redox-Reaktionen Oxidation und Reduktion Eine Oxidation ist ein Elektronenverlust Na
Themengebiet: 1 HA + H 2 O A - + H 3 O + H 3 O + : Oxonium- oder Hydroxoniumion. Themengebiet: 2 B + H 2 O BH + + OH - OH - : Hydroxidion
 1 1 Säuren sind Protonendonatoren, d.h. Stoffe, die an einen Reaktionspartner ein oder mehrere Protonen abgeben können; Säuredefinition nach Brönsted Im Falle von Wasser: HA + H 2 O A - + H 3 O + H 3 O
1 1 Säuren sind Protonendonatoren, d.h. Stoffe, die an einen Reaktionspartner ein oder mehrere Protonen abgeben können; Säuredefinition nach Brönsted Im Falle von Wasser: HA + H 2 O A - + H 3 O + H 3 O
Akkreditierungsumfang der Prüfstelle (ISO/IEC 17025) Amt der Tiroler Landesregierung, Chemisch-technische Umweltschutzanstalt / (Ident.Nr.
 Amt der Tiroler Landesregierung, Chemisch-technische Umweltschutzanstalt / (Ident.: 0100) Titel 1 BGBl. II 292/2001 2001-08 Verordnung des Bundesministers für Land- und Forstwirtschaft, Umwelt und Wasserwirtschaft
Amt der Tiroler Landesregierung, Chemisch-technische Umweltschutzanstalt / (Ident.: 0100) Titel 1 BGBl. II 292/2001 2001-08 Verordnung des Bundesministers für Land- und Forstwirtschaft, Umwelt und Wasserwirtschaft
Musterklausur 1 zur Allgemeinen und Anorganischen Chemie
 Musterklausur 1 zur Allgemeinen und Anorganischen Chemie Achtung: Taschenrechner ist nicht zugelassen. Aufgaben sind so, dass sie ohne Rechner lösbar sind. Weitere Hilfsmittel: Periodensystem der Elemente
Musterklausur 1 zur Allgemeinen und Anorganischen Chemie Achtung: Taschenrechner ist nicht zugelassen. Aufgaben sind so, dass sie ohne Rechner lösbar sind. Weitere Hilfsmittel: Periodensystem der Elemente
Zusammenfassung: Säure Base Konzept
 Zusammenfassung: Säure Base Konzept 1. Grundlegende Eigenschaften von Säuren und Laugen Säure und Laugen ätzen sie werden durch Indikatoren für uns erkenntlich gemacht. Oft verwendet man Universalindikator.
Zusammenfassung: Säure Base Konzept 1. Grundlegende Eigenschaften von Säuren und Laugen Säure und Laugen ätzen sie werden durch Indikatoren für uns erkenntlich gemacht. Oft verwendet man Universalindikator.
Abituraufgaben Manganometrie 1979/I/4 1980/I/1 1982/I/1 1983/III/1 1984/I/1
 Abituraufgaben Manganometrie 1979/I/4 4. Die Konzentration einer schwefelsauren Wasserstoffperoxidlösung soll manganometrisch bestimmt werden. 4.1 Leiten Sie die grundlegende Redoxgleichung aus Teilgleichungen
Abituraufgaben Manganometrie 1979/I/4 4. Die Konzentration einer schwefelsauren Wasserstoffperoxidlösung soll manganometrisch bestimmt werden. 4.1 Leiten Sie die grundlegende Redoxgleichung aus Teilgleichungen
7. Chemische Reaktionen
 7. Chemische Reaktionen 7.1 Thermodynamik chemischer Reaktionen 7.2 Säure Base Gleichgewichte 7. Chemische Reaktionen 7.1 Thermodynamik chemischer Reaktionen 7.2 Säure Base Gleichgewichte 7.3 Redox - Reaktionen
7. Chemische Reaktionen 7.1 Thermodynamik chemischer Reaktionen 7.2 Säure Base Gleichgewichte 7. Chemische Reaktionen 7.1 Thermodynamik chemischer Reaktionen 7.2 Säure Base Gleichgewichte 7.3 Redox - Reaktionen
Redoxgleichungen. 1. Einrichten von Reaktionsgleichungen
 Redoxgleichungen 1. Einrichten von Reaktionsgleichungen Reaktionsgleichungen in der Chemie beschreiben den Verlauf einer Reaktion. Ebenso, wie bei einer Reaktion keine Masse verloren gehen kann von einem
Redoxgleichungen 1. Einrichten von Reaktionsgleichungen Reaktionsgleichungen in der Chemie beschreiben den Verlauf einer Reaktion. Ebenso, wie bei einer Reaktion keine Masse verloren gehen kann von einem
AnC I Protokoll: 3.4 Iodometrische Bestimmung von Ascorbinsäure (Vitamin C)" SS Analytische Chemie I. Versuchsprotokoll
 Analytische Chemie I Versuchsprotokoll 3.4 Iodometrische Bestimmung von Ascorbinsäure (Vitamin C) 1.! Theoretischer Hintergrund Bei dieser Redoxtitration wird Ascorbinsäure mit Hilfe von Triiodid oxidiert.
Analytische Chemie I Versuchsprotokoll 3.4 Iodometrische Bestimmung von Ascorbinsäure (Vitamin C) 1.! Theoretischer Hintergrund Bei dieser Redoxtitration wird Ascorbinsäure mit Hilfe von Triiodid oxidiert.
STÖCHIOMETRIE. die Lehre von der mengenmäßigen Zusammensetzung chemischer Verbindungen und den Mengenverhältnissen bei chemischen Reaktionen
 1 STÖCHIOMETRIE die Lehre von der mengenmäßigen Zusammensetzung chemischer Verbindungen und den Mengenverhältnissen bei chemischen Reaktionen 1) STOFFMENGE n(x) reine Zählgröße Menge der Elementarteilchen
1 STÖCHIOMETRIE die Lehre von der mengenmäßigen Zusammensetzung chemischer Verbindungen und den Mengenverhältnissen bei chemischen Reaktionen 1) STOFFMENGE n(x) reine Zählgröße Menge der Elementarteilchen
EinFaCh 1. Studienvorbereitung Chemie. Einstieg in Freibergs anschauliches Chemiewissen Teil 1: Redoxreaktionen und Elektrochemie.
 Studienvorbereitung Chemie EinFaCh 1 Einstieg in Freibergs anschauliches Chemiewissen Teil 1: Redoxreaktionen und Elektrochemie www.tu-freiberg.de http://tu-freiberg.de/fakultaet2/einfach Was ist eine
Studienvorbereitung Chemie EinFaCh 1 Einstieg in Freibergs anschauliches Chemiewissen Teil 1: Redoxreaktionen und Elektrochemie www.tu-freiberg.de http://tu-freiberg.de/fakultaet2/einfach Was ist eine
7. Woche. Gesamtanalyse (Vollanalyse) einfacher Salze. Qualitative Analyse anorganischer Verbindungen
 7. Woche Gesamtanalyse (Vollanalyse) einfacher Salze Qualitative Analyse anorganischer Verbindungen Die qualitative Analyse ist ein Teil der analytischen Chemie, der sich mit der qualitativen Zusammensetzung
7. Woche Gesamtanalyse (Vollanalyse) einfacher Salze Qualitative Analyse anorganischer Verbindungen Die qualitative Analyse ist ein Teil der analytischen Chemie, der sich mit der qualitativen Zusammensetzung
Elektrochemie und Sauerstoffmessung mit LDO. Der gelöste Sauerstoff
 Elektrochemie und Sauerstoffmessung mit LDO Der gelöste Sauerstoff 2 Was ist gelöster Sauerstoff? Gelöster Sauerstoff beschreibt die Konzentration von freiem (nicht chemisch gebundenem) molekularem Sauerstoff
Elektrochemie und Sauerstoffmessung mit LDO Der gelöste Sauerstoff 2 Was ist gelöster Sauerstoff? Gelöster Sauerstoff beschreibt die Konzentration von freiem (nicht chemisch gebundenem) molekularem Sauerstoff
Physikalische und chemische Wasseranalytik Bestimmung von BSB, CSB, TOD, TOC
 Physikalische und chemische Wasseranalytik Bestimmung von BSB, CSB, TOD, TOC Probenahme und Aufbereitung Lernziel: In diesem Abschnitt soll dem Schüler bewusst gemacht werden, dass die richtige Probenentnahme
Physikalische und chemische Wasseranalytik Bestimmung von BSB, CSB, TOD, TOC Probenahme und Aufbereitung Lernziel: In diesem Abschnitt soll dem Schüler bewusst gemacht werden, dass die richtige Probenentnahme
Leiter: MS-Verantwortlicher: Telefon: Telefax: E-Mail: Internet: Erstakkreditierung: Letzte Akkreditierung: Aktuellste Version:
 Seite 1 von 8 Prüfstelle für Umweltanalytik ENVILAB AG Mühlethalstrasse 25 CH-4800 Zofingen Leiter: MS-Verantwortlicher: Telefon: Telefax: E-Mail: Internet: Erstakkreditierung: Letzte Akkreditierung: Aktuellste
Seite 1 von 8 Prüfstelle für Umweltanalytik ENVILAB AG Mühlethalstrasse 25 CH-4800 Zofingen Leiter: MS-Verantwortlicher: Telefon: Telefax: E-Mail: Internet: Erstakkreditierung: Letzte Akkreditierung: Aktuellste
Seminar zum Praktikum Quantitative Analyse
 Seminar zum Praktikum Quantitative Analyse Dr. Dietmar Stephan Tel.: 089-289-13167 Raum: CH 57105 E-Mail: dietmar.stephan@bauchemie-tum.de Stärke von Säuren und Basen Stärke von Säuren und Basen Dissoziationskonstanten
Seminar zum Praktikum Quantitative Analyse Dr. Dietmar Stephan Tel.: 089-289-13167 Raum: CH 57105 E-Mail: dietmar.stephan@bauchemie-tum.de Stärke von Säuren und Basen Stärke von Säuren und Basen Dissoziationskonstanten
Rein oder nicht rein?
 Station 1: Rein oder nicht rein? Versuche: 1 Bestimmen Sie experimentell die Löslichkeit von Kochsalz. [Hinweis: Unter der Löslichkeit versteht man die Masse eines Stoffes in Gramm, die sich gerade noch
Station 1: Rein oder nicht rein? Versuche: 1 Bestimmen Sie experimentell die Löslichkeit von Kochsalz. [Hinweis: Unter der Löslichkeit versteht man die Masse eines Stoffes in Gramm, die sich gerade noch
Praktikumsrelevante Themen
 Praktikumsrelevante Themen Lösungen Der Auflösungsprozess Beeinflussung der Löslichkeit durch Temperatur und Druck Konzentration von Lösungen Dampfdruck, Siede- und Gefrierpunkt von Lösungen Lösungen von
Praktikumsrelevante Themen Lösungen Der Auflösungsprozess Beeinflussung der Löslichkeit durch Temperatur und Druck Konzentration von Lösungen Dampfdruck, Siede- und Gefrierpunkt von Lösungen Lösungen von
Universität des Saarlandes - Fachrichtung Anorganische Chemie C h e m i s c h e s E i n f ü h r u n g s p r a k t i k u m.
 Universität des Saarlandes - Fachrichtung Anorganische Chemie C h e m i s c h e s E i n f ü h r u n g s p r a k t i k u m Elektrochemie Elektrochemie bezeichnet mehrere verschiedene Teilgebiete innerhalb
Universität des Saarlandes - Fachrichtung Anorganische Chemie C h e m i s c h e s E i n f ü h r u n g s p r a k t i k u m Elektrochemie Elektrochemie bezeichnet mehrere verschiedene Teilgebiete innerhalb
Chemie für Biologen. Vorlesung im. WS 2004/05 V2, Mi 10-12, S04 T01 A02. Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen
 Chemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul Rademacher Institut für rganische Chemie der Universität Duisburg-Essen (Teil 6: 17.11.2004) MILESS: Chemie für Biologen 102 Reduktion
Chemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul Rademacher Institut für rganische Chemie der Universität Duisburg-Essen (Teil 6: 17.11.2004) MILESS: Chemie für Biologen 102 Reduktion
Bestimmung des Biochemischen Sauerstoffbedarfs im Abwasser
 Bestimmung des Biochemischen Sauerstoffbedarfs im Abwasser 1 Einleitung Das Wasser, das in großen Mengen in den verschiedensten Lebensbereichen verwenden wird, ist nach der Nutzung verschmutzt, zumeist
Bestimmung des Biochemischen Sauerstoffbedarfs im Abwasser 1 Einleitung Das Wasser, das in großen Mengen in den verschiedensten Lebensbereichen verwenden wird, ist nach der Nutzung verschmutzt, zumeist
Praktikumsprotokoll. Grundlagen der Chemie Teil II SS Praktikum vom
 Grundlagen der Chemie Teil II SS 2002 Praktikumsprotokoll Praktikum vom 02.05.2002 Versuch 11: Herstellung einer Pufferlösung von definiertem ph Versuch 12: Sauer und alkalisch reagierende Salzlösungen
Grundlagen der Chemie Teil II SS 2002 Praktikumsprotokoll Praktikum vom 02.05.2002 Versuch 11: Herstellung einer Pufferlösung von definiertem ph Versuch 12: Sauer und alkalisch reagierende Salzlösungen
Allgemeine Chemie für r Studierende der Medizin
 Allgemeine Chemie für r Studierende der Medizin Allgemeine und Anorganische Chemie Teil 7 Dr. Ulrich Schatzschneider Institut für Anorganische und Angewandte Chemie, Universität Hamburg Lehrstuhl für Anorganische
Allgemeine Chemie für r Studierende der Medizin Allgemeine und Anorganische Chemie Teil 7 Dr. Ulrich Schatzschneider Institut für Anorganische und Angewandte Chemie, Universität Hamburg Lehrstuhl für Anorganische
Seminar zum Quantitativen Anorganischen Praktikum WS 2013/14
 Seminar zum Quantitativen Anorganischen Praktikum WS 2013/14 Teil des Moduls MN-C-AlC S. Sahler, M. Wolberg Inhalt Mittwoch, 08.01.2014, Allgemeine Einführung in die Quantitative Analyse Glasgeräte und
Seminar zum Quantitativen Anorganischen Praktikum WS 2013/14 Teil des Moduls MN-C-AlC S. Sahler, M. Wolberg Inhalt Mittwoch, 08.01.2014, Allgemeine Einführung in die Quantitative Analyse Glasgeräte und
EINZELPREISLISTE / UNTERSUCHUNGSPROGRAMME
 EINZELPREISLISTE / UNTERSUCHUNGSPROGRAMME LANDWIRTSCHAFT UND GARTENBAU Boden Seite 1 Analysenprogramme zur Düngeberatung für Obst-, Beerenund Weinbau sowie Gemüsebau Kompost Seite 2 Hofdünger Seite 3 Gärprozess,
EINZELPREISLISTE / UNTERSUCHUNGSPROGRAMME LANDWIRTSCHAFT UND GARTENBAU Boden Seite 1 Analysenprogramme zur Düngeberatung für Obst-, Beerenund Weinbau sowie Gemüsebau Kompost Seite 2 Hofdünger Seite 3 Gärprozess,
DEFINITIONEN REINES WASSER
 SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
Chemisches Rechnen für Bauingenieure
 Chemisches Rechnen für Bauingenieure PD Dr. Martin Denecke Sprechstunde: Freitag, 13.30 14.30 martin.denecke@uni-due.de ++49 201 183 2742 Raum: V15 R05 H18 Periodensystem der Elemente Chemie im Netz http://www.arnold-chemie.de/downloads/molrechnen.pdf
Chemisches Rechnen für Bauingenieure PD Dr. Martin Denecke Sprechstunde: Freitag, 13.30 14.30 martin.denecke@uni-due.de ++49 201 183 2742 Raum: V15 R05 H18 Periodensystem der Elemente Chemie im Netz http://www.arnold-chemie.de/downloads/molrechnen.pdf
(Atommassen: Ca = 40, O = 16, H = 1;
 1.) Welche Molarität hat eine 14,8%ige Ca(OH) 2 - Lösung? (Atommassen: Ca = 40, O = 16, H = 1; M: mol/l)! 1! 2! 2,5! 3! 4 M 2.) Wieviel (Gewichts)%ig ist eine 2-molare Salpetersäure der Dichte 1,100 g/cm
1.) Welche Molarität hat eine 14,8%ige Ca(OH) 2 - Lösung? (Atommassen: Ca = 40, O = 16, H = 1; M: mol/l)! 1! 2! 2,5! 3! 4 M 2.) Wieviel (Gewichts)%ig ist eine 2-molare Salpetersäure der Dichte 1,100 g/cm
Photometrische Bestimmung von Phosphat in Nahrungsmitteln
 Photometrische Bestimmung von Phosphat in Nahrungsmitteln Grundlagen Die photometrische Bestimmung erfolgt nach der DIN EN 1189, D11-1 beziehungsweise nach dem DVGW W 504- Verfahren Die Vorteile der Vanadat-
Photometrische Bestimmung von Phosphat in Nahrungsmitteln Grundlagen Die photometrische Bestimmung erfolgt nach der DIN EN 1189, D11-1 beziehungsweise nach dem DVGW W 504- Verfahren Die Vorteile der Vanadat-
Bestimmung der Stoffmenge eines gelösten Stoffes mit Hilfe einer Lösung bekannter Konzentration (Titer, Maßlösung).
 Zusammenfassung: Titration, Maßanalyse, Volumetrie: Bestimmung der Stoffmenge eines gelösten Stoffes mit Hilfe einer Lösung bekannter Konzentration (Titer, Maßlösung). Bei der Titration lässt man so lange
Zusammenfassung: Titration, Maßanalyse, Volumetrie: Bestimmung der Stoffmenge eines gelösten Stoffes mit Hilfe einer Lösung bekannter Konzentration (Titer, Maßlösung). Bei der Titration lässt man so lange
Chemie. Schwerpunktfach. Bitte lesen Sie die folgenden Hinweise sorgfältig durch bevor Sie mit dem Lösen der Aufgaben beginnen.
 Maturitätsprüfung 2006 Klasse 4B + 4AB Gymnasium Muttenz Chemie Schwerpunktfach Name: Vorname: Klasse: Bitte lesen Sie die folgenden Hinweise sorgfältig durch bevor Sie mit dem Lösen der Aufgaben beginnen.
Maturitätsprüfung 2006 Klasse 4B + 4AB Gymnasium Muttenz Chemie Schwerpunktfach Name: Vorname: Klasse: Bitte lesen Sie die folgenden Hinweise sorgfältig durch bevor Sie mit dem Lösen der Aufgaben beginnen.
Zusammenfassung vom
 Zusammenfassung vom 20.10. 09 Löslichkeitsprodukt = quantitative Aussage über die Löslichkeit einer schwerlöslichen Verbindung bei gegebener Temperatur A m B n m A n+ + n B m- K L = (c A n+ ) m (c B m-
Zusammenfassung vom 20.10. 09 Löslichkeitsprodukt = quantitative Aussage über die Löslichkeit einer schwerlöslichen Verbindung bei gegebener Temperatur A m B n m A n+ + n B m- K L = (c A n+ ) m (c B m-
Klausur : Allgemeine und Anorganische Chemie. Name...Fachrichtung... Matr.-Nr...
 Klausur : Allgemeine und Anorganische Chemie Mo. 1.03.11 : 13.30 16.30 Uhr 1 Beantworten Sie maximal zehn Fragen. Für jede Frage gibt es maximal 10 Punkte; die Klausur gilt als bestanden, wenn 50 Punkte
Klausur : Allgemeine und Anorganische Chemie Mo. 1.03.11 : 13.30 16.30 Uhr 1 Beantworten Sie maximal zehn Fragen. Für jede Frage gibt es maximal 10 Punkte; die Klausur gilt als bestanden, wenn 50 Punkte
Analytische Chemie. B. Sc. Chemieingenieurwesen. 9. September 2015, Uhr. Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc.
 Analytische Chemie B. Sc. Chemieingenieurwesen 9. September 2015, 13.30 16.30 Uhr Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe
Analytische Chemie B. Sc. Chemieingenieurwesen 9. September 2015, 13.30 16.30 Uhr Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe
3.2. Aufgaben zu Säure-Base-Gleichgewichten
 .. Aufgaben zu Säure-Base-Gleichgewichten Aufgabe : Herstellung saurer und basischer Lösungen Gib die Reaktionsgleichungen für die Herstellung der folgenden Lösungen durch Reaktion der entsprechenden Oxide
.. Aufgaben zu Säure-Base-Gleichgewichten Aufgabe : Herstellung saurer und basischer Lösungen Gib die Reaktionsgleichungen für die Herstellung der folgenden Lösungen durch Reaktion der entsprechenden Oxide
Elektrochemische Wasserdesinfektion: Hocheffektiv ohne Chemikalienzugabe und mit Depotwirkung
 Elektrochemische Wasserdesinfektion: Hocheffektiv ohne Chemikalienzugabe und mit Depotwirkung Alexander Kraft, Dieter Kreysig und Maja Wünsche Wasser ist nicht nur die Lebensgrundlage für Menschen, Tiere
Elektrochemische Wasserdesinfektion: Hocheffektiv ohne Chemikalienzugabe und mit Depotwirkung Alexander Kraft, Dieter Kreysig und Maja Wünsche Wasser ist nicht nur die Lebensgrundlage für Menschen, Tiere
Säure-Base Titrationen. (Seminar zu den Übungen zur quantitativen Bestimmung von Arznei-, Hilfs- und Schadstoffen)
 Säure-Base Titrationen (Seminar zu den Übungen zur quantitativen Bestimmung von Arznei-, Hilfs- und Schadstoffen) 1. Gehaltsbestimmung von Salzsäure HCl ist eine starke Säure (fast zu 100% dissoziiert)
Säure-Base Titrationen (Seminar zu den Übungen zur quantitativen Bestimmung von Arznei-, Hilfs- und Schadstoffen) 1. Gehaltsbestimmung von Salzsäure HCl ist eine starke Säure (fast zu 100% dissoziiert)
Analysenprotokoll zur Bestimmung der NaOH-Konzentration durch Neutralisationstitration
 Bestimmung von NaOH durch Neutralisationstitration Seite 1 Studiengang: (bitte ankreuzen) CHE LEB BC MBT Bestimmung der NaOH-Konzentration durch Neutralisationstitration Note Ergebnis: Reaktionsgleichung(en):
Bestimmung von NaOH durch Neutralisationstitration Seite 1 Studiengang: (bitte ankreuzen) CHE LEB BC MBT Bestimmung der NaOH-Konzentration durch Neutralisationstitration Note Ergebnis: Reaktionsgleichung(en):
Säuren und Basen. Dr. Torsten Beweries AC I - Allgemeine Chemie LAC-CH01 WS 2016/17.
 Säuren und Basen Dr. Torsten Beweries AC I - Allgemeine Chemie LAC-CH01 WS 2016/17 torsten.beweries@catalysis.de http://www.catalysis.de/forschung/koordinationschemische-katalyse/koordinationschemische-wasserspaltung/
Säuren und Basen Dr. Torsten Beweries AC I - Allgemeine Chemie LAC-CH01 WS 2016/17 torsten.beweries@catalysis.de http://www.catalysis.de/forschung/koordinationschemische-katalyse/koordinationschemische-wasserspaltung/
Praktikum Quantitative Analysen
 Praktikum Quantitative Analysen Wintersemester 2010/11 A: klassische Methoden vorwiegend chemische Arbeitsmethoden Bestimmung der Bestandteile durch eine chemische Reaktion Gravimetrie Die zu bestimmende
Praktikum Quantitative Analysen Wintersemester 2010/11 A: klassische Methoden vorwiegend chemische Arbeitsmethoden Bestimmung der Bestandteile durch eine chemische Reaktion Gravimetrie Die zu bestimmende
Grundwissen Chemie Mittelstufe (9 MNG)
 Grundwissen Chemie Mittelstufe (9 MNG) Marie-Therese-Gymnasium Erlangen Einzeldateien: GW8 Grundwissen für die 8. Jahrgangsstufe GW9 Grundwissen für die 9. Jahrgangsstufe (MNG) GW9a Grundwissen für die
Grundwissen Chemie Mittelstufe (9 MNG) Marie-Therese-Gymnasium Erlangen Einzeldateien: GW8 Grundwissen für die 8. Jahrgangsstufe GW9 Grundwissen für die 9. Jahrgangsstufe (MNG) GW9a Grundwissen für die
TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg
 TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg GRUNDLAGEN Modul: Versuch: Elektrochemie 1 Abbildung 1: I. VERSUCHSZIEL
TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg GRUNDLAGEN Modul: Versuch: Elektrochemie 1 Abbildung 1: I. VERSUCHSZIEL
Praktikum Chemie für Biologen, SS 2003/Kurse SS
 1 Praktikum Chemie für Biologen, SS 2003/Kurse SS Klausur in Anorganischer Chemie (KlAC) - Sa 14.06.2003 Name:... Vorname:... Wenn Nachschreiber aus einem der Vorkurse, bitte eintragen: Matrikel-Nr. Semester
1 Praktikum Chemie für Biologen, SS 2003/Kurse SS Klausur in Anorganischer Chemie (KlAC) - Sa 14.06.2003 Name:... Vorname:... Wenn Nachschreiber aus einem der Vorkurse, bitte eintragen: Matrikel-Nr. Semester
Crashkurs Säure-Base
 Crashkurs Säure-Base Was sind Säuren und Basen? Welche Eigenschaften haben sie?` Wie reagieren sie mit Wasser? Wie reagieren sie miteinander? Wie sind die Unterschiede in der Stärke definiert? Was ist
Crashkurs Säure-Base Was sind Säuren und Basen? Welche Eigenschaften haben sie?` Wie reagieren sie mit Wasser? Wie reagieren sie miteinander? Wie sind die Unterschiede in der Stärke definiert? Was ist
Natürliche ökologische Energie- und Stoffkreisläufe
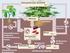 Informationsmaterialien über den ökologischen Landbau für den Unterricht an allgemein bildenden Schulen. Initiiert durch das Bundesministerium für Verbraucherschutz, Ernährung und Landwirtschaft im Rahmen
Informationsmaterialien über den ökologischen Landbau für den Unterricht an allgemein bildenden Schulen. Initiiert durch das Bundesministerium für Verbraucherschutz, Ernährung und Landwirtschaft im Rahmen
Grundlagen. Instrumentation und Techniken der Summenparameteranalytik
 Grundlagen Instrumentation und Techniken der Summenparameteranalytik Grundlagen, Instrumentation und Techniken der Summenparameteranalytik 2/ 44 Inhalt 1 Einleitung...5 1.1 Definition der Summenparameter...5
Grundlagen Instrumentation und Techniken der Summenparameteranalytik Grundlagen, Instrumentation und Techniken der Summenparameteranalytik 2/ 44 Inhalt 1 Einleitung...5 1.1 Definition der Summenparameter...5
Titrationen. Experimentiermappe zum Thema. Lernwerkstatt Schülerlabor Chemie
 Lernwerkstatt Schülerlabor Chemie Experimentiermappe zum Thema Titrationen Friedrich-Schiller-Universität Jena Arbeitsgruppe Chemiedidaktik August-Bebel-Straße 6-8 07743 Jena Fonds der Chemischen Industrie
Lernwerkstatt Schülerlabor Chemie Experimentiermappe zum Thema Titrationen Friedrich-Schiller-Universität Jena Arbeitsgruppe Chemiedidaktik August-Bebel-Straße 6-8 07743 Jena Fonds der Chemischen Industrie
Elektrolyse. Zelle.. Bei der Elektrolyse handelt es sich im Prinzip um eine Umkehrung der in einer galvanischen Zelle Z ablaufenden Redox-Reaktion
 (Graphit) Cl - Abgabe von Elektronen: Oxidation Anode Diaphragma H + Elektrolyse Wird in einer elektrochemischen Zelle eine nicht-spontane Reaktion durch eine äußere Stromquelle erzwungen Elektrolyse-Zelle
(Graphit) Cl - Abgabe von Elektronen: Oxidation Anode Diaphragma H + Elektrolyse Wird in einer elektrochemischen Zelle eine nicht-spontane Reaktion durch eine äußere Stromquelle erzwungen Elektrolyse-Zelle
allgemeine Aussagen zum Wasser Aufgaben des Wassers Aggregatzustände Aufbau des Wassermoleküls
 Gliederung allgemeine Aussagen zum Wasser Aufgaben des Wassers Aggregatzustände Aufbau des Wassermoleküls physikalische Eigenschaften Lichtdurchlässigkeit Wassertemperatur, Wärmespeichervermögen Dichte,
Gliederung allgemeine Aussagen zum Wasser Aufgaben des Wassers Aggregatzustände Aufbau des Wassermoleküls physikalische Eigenschaften Lichtdurchlässigkeit Wassertemperatur, Wärmespeichervermögen Dichte,
Photometrische Ammoniumbestimmung
 Analytisches Grundpraktikum Teil II Photometrische Ammoniumbestimmung Aufgabe Ammonium ist einerseits ein wichtiger Pflanzennährstoff, andererseits als Produkt des anaeroben Abbaus von Biomasse in Gewässern
Analytisches Grundpraktikum Teil II Photometrische Ammoniumbestimmung Aufgabe Ammonium ist einerseits ein wichtiger Pflanzennährstoff, andererseits als Produkt des anaeroben Abbaus von Biomasse in Gewässern
Oxidation = Elektronenabgabe Erhöhung der Oxidationszahl. Reduktion = Elektronenaufnahme Erniedrigung der Oxidationszahl
 Oxidation = Elektronenabgabe Erhöhung der Oxidationszahl Reduktion = Elektronenaufnahme Erniedrigung der Oxidationszahl Oxidans = Oxidationsmittel System, das Elektronen aufnehmen kann Reduktor = Reduktionsmittel
Oxidation = Elektronenabgabe Erhöhung der Oxidationszahl Reduktion = Elektronenaufnahme Erniedrigung der Oxidationszahl Oxidans = Oxidationsmittel System, das Elektronen aufnehmen kann Reduktor = Reduktionsmittel
Allgemeine Chemie für r Studierende der Zahnmedizin
 Allgemeine Chemie für r Studierende der Zahnmedizin Allgemeine und Anorganische Chemie Teil 6 Dr. Ulrich Schatzschneider Institut für Anorganische und Angewandte Chemie, Universität Hamburg Lehrstuhl für
Allgemeine Chemie für r Studierende der Zahnmedizin Allgemeine und Anorganische Chemie Teil 6 Dr. Ulrich Schatzschneider Institut für Anorganische und Angewandte Chemie, Universität Hamburg Lehrstuhl für
4. Redox- und Elektrochemie
 4. Redox und Elektrochemie 4. Redox und Elektrochemie 4.1 Oxidationszahlen Eine Oxidation ist ein Vorgang, wo ein Teilchen Elektronen abgibt. Eine Reduktion ist ein Vorgang, wo ein Teilchen ein Elektron
4. Redox und Elektrochemie 4. Redox und Elektrochemie 4.1 Oxidationszahlen Eine Oxidation ist ein Vorgang, wo ein Teilchen Elektronen abgibt. Eine Reduktion ist ein Vorgang, wo ein Teilchen ein Elektron
1. Bedeutung der Oxidationszahlen
 1. Bedeutung der Oxidationszahlen Unterschiedliche Atome geben eine unterschiedliche Zahl an Elektronen ab: Dann hat das Atom eine positive Oxidationsstufe; das Atom ist mit weniger Elektronen als Protonen
1. Bedeutung der Oxidationszahlen Unterschiedliche Atome geben eine unterschiedliche Zahl an Elektronen ab: Dann hat das Atom eine positive Oxidationsstufe; das Atom ist mit weniger Elektronen als Protonen
Es soll eine schriftliche Ausarbeitung abgegeben werden (1 Exemplar pro Gruppe).
 Gruppe 1 Thema: Wissenswertes über Essig 1. Bestimme den ph-wert von Haushaltsessig. 2. Wie viel Essigsäure (in mol/l und in g/l) ist in Haushaltsessig enthalten? 3. Wie wird Essigsäure hergestellt (Ausgangsstoffe,
Gruppe 1 Thema: Wissenswertes über Essig 1. Bestimme den ph-wert von Haushaltsessig. 2. Wie viel Essigsäure (in mol/l und in g/l) ist in Haushaltsessig enthalten? 3. Wie wird Essigsäure hergestellt (Ausgangsstoffe,
Übungsblatt zu Säuren und Basen
 1 Übungsblatt zu Säuren und Basen 1. In einer wässrigen Lösung misst die Konzentration der Oxoniumionen (H 3 O + ) 10 5 M. a) Wie gross ist der ph Wert? b) Ist die Konzentration der OH Ionen grösser oder
1 Übungsblatt zu Säuren und Basen 1. In einer wässrigen Lösung misst die Konzentration der Oxoniumionen (H 3 O + ) 10 5 M. a) Wie gross ist der ph Wert? b) Ist die Konzentration der OH Ionen grösser oder
Was sagt mein Wasserbefund aus?
 Was sagt mein Wasserbefund aus? Themen Formale Anforderungen Dimensionen Parameter und deren Bedeutung Ergebnisse Volluntersuchungen 2008/2009 Formale Anforderungen Anschrift Auftraggeber Datum Ausfertigung
Was sagt mein Wasserbefund aus? Themen Formale Anforderungen Dimensionen Parameter und deren Bedeutung Ergebnisse Volluntersuchungen 2008/2009 Formale Anforderungen Anschrift Auftraggeber Datum Ausfertigung
Sofortmaßnahmen bei kritischen Stoffen im Kläranlagen-Zulauf Karl Svardal. Institut für Wassergüte und Abfallwirtschaft Technische Universität Wien
 Sofortmaßnahmen bei kritischen Stoffen im Kläranlagen-Zulauf Karl Svardal Institut für Wassergüte und Abfallwirtschaft Technische Universität Wien Schadstoffgruppen Leicht brennbare und explosive Gase
Sofortmaßnahmen bei kritischen Stoffen im Kläranlagen-Zulauf Karl Svardal Institut für Wassergüte und Abfallwirtschaft Technische Universität Wien Schadstoffgruppen Leicht brennbare und explosive Gase
Anorganisch-chemisches Praktikum für Human- und Molekularbiologen
 Anorganischchemisches Praktikum für Human und Molekularbiologen 3. Praktikumstag Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes EMail: a.rammo@mx.unisaarland.de RedoxReaktionen
Anorganischchemisches Praktikum für Human und Molekularbiologen 3. Praktikumstag Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes EMail: a.rammo@mx.unisaarland.de RedoxReaktionen
Magnesium + Sauerstoff + Aktivierungsenergie 2 Mg + O 2 + E A. Oxidation = Reaktion mit Sauerstoff. Magnesiumoxid + Energie 2 MgO + E
 Chemie. Redoxreaktionen 1. Redoxreaktionen 1. Definition der Redoxbegriffe Versuch: Verbrennung eines Stücks Magnesiumband Es entsteht ein weißes Pulver mit Namen Magnesiumoxid Magnesium Sauerstoff Aktivierungsenergie
Chemie. Redoxreaktionen 1. Redoxreaktionen 1. Definition der Redoxbegriffe Versuch: Verbrennung eines Stücks Magnesiumband Es entsteht ein weißes Pulver mit Namen Magnesiumoxid Magnesium Sauerstoff Aktivierungsenergie
Winterthurer Trinkwasser. Chemisch-physikalische Zusammensetzung des Tössgrundwassers. Mittelwerte der Jahre
 Winterthurer Trinkwasser Chemisch-physikalische Zusammensetzung des Tössgrundwassers Mittelwerte der Jahre 2008 2012 Seite 2 von 5 Chemisch-physikalische Zusammensetzung des Trinkwassers in Winterthur
Winterthurer Trinkwasser Chemisch-physikalische Zusammensetzung des Tössgrundwassers Mittelwerte der Jahre 2008 2012 Seite 2 von 5 Chemisch-physikalische Zusammensetzung des Trinkwassers in Winterthur
Aufgabe 1: Geben Sie die korrespondierenden Basen zu folgenden Verbindungen an: a) H 3 PO 4 b) H 2 PO 4
 Übungsaufgaben zum Thema Säuren, Basen und Puffer Säure/Base Definition nach Brǿnsted: Säuren sind Stoffe, die Protonen abgeben können (Protonendonatoren). Basen sind Stoffe, die Protonen aufnehmen können
Übungsaufgaben zum Thema Säuren, Basen und Puffer Säure/Base Definition nach Brǿnsted: Säuren sind Stoffe, die Protonen abgeben können (Protonendonatoren). Basen sind Stoffe, die Protonen aufnehmen können
+ O. Die Valenzelektronen der Natriumatome werden an das Sauerstoffatom abgegeben.
 A Oxidation und Reduktion UrsprÄngliche Bedeutung der Begriffe UrsprÅnglich wurden Reaktionen, bei denen sich Stoffe mit Sauerstoff verbinden, als Oxidationen bezeichnet. Entsprechend waren Reaktionen,
A Oxidation und Reduktion UrsprÄngliche Bedeutung der Begriffe UrsprÅnglich wurden Reaktionen, bei denen sich Stoffe mit Sauerstoff verbinden, als Oxidationen bezeichnet. Entsprechend waren Reaktionen,
Laborbericht. Wasserhärte Leitfähigkeit. Anna Senn Bianca Theus
 Laborbericht Wasserhärte Leitfähigkeit Anna Senn Bianca Theus 14.09. 2004 03.11. 2004 Inhaltsverzeichnis 1. Ziel... 1 2. Theorie... 1 2.1 Leitfähigkeit... 1 2.2 Wasserhärte... 2 2.3 Entstehung von Wasserhärte...
Laborbericht Wasserhärte Leitfähigkeit Anna Senn Bianca Theus 14.09. 2004 03.11. 2004 Inhaltsverzeichnis 1. Ziel... 1 2. Theorie... 1 2.1 Leitfähigkeit... 1 2.2 Wasserhärte... 2 2.3 Entstehung von Wasserhärte...
Elektrolytische Leitfähigkeit
 Elektrolytische Leitfähigkeit 1 Elektrolytische Leitfähigkeit Gegenstand dieses Versuches ist der Zusammenhang der elektrolytischen Leitfähigkeit starker und schwacher Elektrolyten mit deren Konzentration.
Elektrolytische Leitfähigkeit 1 Elektrolytische Leitfähigkeit Gegenstand dieses Versuches ist der Zusammenhang der elektrolytischen Leitfähigkeit starker und schwacher Elektrolyten mit deren Konzentration.
LN Vortermin SS 02. PC Teil
 LN Vortermin SS 02 PC Teil 1. 15g Magnesium werden mit Salzsäure im Überschuß versetzt. Folgende Standardbildungsenthalpien bei 198K sind dazu gegeben: Mg 2+ -466,85 kj/mol Cl - aq -167,16 kj/mol a) Berechnen
LN Vortermin SS 02 PC Teil 1. 15g Magnesium werden mit Salzsäure im Überschuß versetzt. Folgende Standardbildungsenthalpien bei 198K sind dazu gegeben: Mg 2+ -466,85 kj/mol Cl - aq -167,16 kj/mol a) Berechnen
Lösung Sauerstoff: 1s 2 2s 2 2p 4, Bor: 1s 2 2s 2 2p 1, Chlor: 1s 2 2s 2 2p 6 3s 2 3p 5 Neon: 1s 2 2s 2 2p 6
 1 of 6 10.05.2005 10:56 Lösung 1 1.1 1 mol Natrium wiegt 23 g => 3 mol Natrium wiegen 69 g. 1 mol Na enthält N A = 6.02 x 10 23 Teilchen => 3 mol enthalten 1.806 x 10 24 Teilchen. 1.2 Ein halbes mol Wasser
1 of 6 10.05.2005 10:56 Lösung 1 1.1 1 mol Natrium wiegt 23 g => 3 mol Natrium wiegen 69 g. 1 mol Na enthält N A = 6.02 x 10 23 Teilchen => 3 mol enthalten 1.806 x 10 24 Teilchen. 1.2 Ein halbes mol Wasser
Anlage zur Akkreditierungsurkunde D-PL-18463-01-00 nach DIN EN ISO/IEC 17025:2005
 Deutsche Akkreditierungsstelle GmbH Anlage zur Akkreditierungsurkunde D-PL-18463-01-00 nach DIN EN ISO/IEC 17025:2005 Gültigkeitsdauer: 06.06.2016 bis 21.05.2018 Ausstellungsdatum: 06.06.2016 Urkundeninhaber:
Deutsche Akkreditierungsstelle GmbH Anlage zur Akkreditierungsurkunde D-PL-18463-01-00 nach DIN EN ISO/IEC 17025:2005 Gültigkeitsdauer: 06.06.2016 bis 21.05.2018 Ausstellungsdatum: 06.06.2016 Urkundeninhaber:
Oxidation und Reduktion Redoxreaktionen Blatt 1/5
 Oxidation und Reduktion Redoxreaktionen Blatt 1/5 1 Elektronenübertragung, Oxidation und Reduktion Gibt Natrium sein einziges Außenelektron an ein Chloratom (7 Außenelektronen) ab, so entsteht durch diese
Oxidation und Reduktion Redoxreaktionen Blatt 1/5 1 Elektronenübertragung, Oxidation und Reduktion Gibt Natrium sein einziges Außenelektron an ein Chloratom (7 Außenelektronen) ab, so entsteht durch diese
Reduktion und Oxidation Redoxreaktionen
 Reduktion und Oxidation Redoxreaktionen Stahlkonstruktionen die weltberühmt wurden: Eiffelturm Blaues Wunder in Dresden (die grüne Farbe der Brücke wandelte sich durch das Sonnenlicht in Blau um) OXIDATION
Reduktion und Oxidation Redoxreaktionen Stahlkonstruktionen die weltberühmt wurden: Eiffelturm Blaues Wunder in Dresden (die grüne Farbe der Brücke wandelte sich durch das Sonnenlicht in Blau um) OXIDATION
Mikrobiologie des Abwassers
 Mikrobiologie des Abwassers Kläranlage (Belebtschlamm und Faulturm) www.klaeranlage-online.de Aufbau einer Kläranlage Kläranlage Schwerte Abbildung aus Mudrack, 1988 Daten zur Kläranlage Oldenburg (Wehdestraße
Mikrobiologie des Abwassers Kläranlage (Belebtschlamm und Faulturm) www.klaeranlage-online.de Aufbau einer Kläranlage Kläranlage Schwerte Abbildung aus Mudrack, 1988 Daten zur Kläranlage Oldenburg (Wehdestraße
Kleines Wasserlexikon
 Kleines Wasserlexikon Lösung von Kohlenstoffdioxid. Kohlenstoffdioxid CO 2 ist leicht wasserlöslich und geht mit manchen Inhaltsstoffen des Wassers auch chemische Reaktionen ein. In einem ersten Schritt
Kleines Wasserlexikon Lösung von Kohlenstoffdioxid. Kohlenstoffdioxid CO 2 ist leicht wasserlöslich und geht mit manchen Inhaltsstoffen des Wassers auch chemische Reaktionen ein. In einem ersten Schritt
Die Aufbereitung von Trinkwasser
 Die Aufbereitung von Trinkwasser Desinfektion Vorlesung IEL WS 2006 / 2007 Dr. rer. nat. H. Färber Hygiene-Institut für Hygiene und der Öffentliche Universität Gesundheit Bonn der Universität Bonn Abschließende
Die Aufbereitung von Trinkwasser Desinfektion Vorlesung IEL WS 2006 / 2007 Dr. rer. nat. H. Färber Hygiene-Institut für Hygiene und der Öffentliche Universität Gesundheit Bonn der Universität Bonn Abschließende
2. Klausur zum Chemischen Grundpraktikum im WS 2011/12 vom
 2. Klausur zum Chemischen Grundpraktikum im WS 2011/12 vom 30.03.2012 A1 A2 A3 A4 A5 A6 A7 PC PC PC Σ Note 10 10 10 10 10 10 10 10 10 10 100 NAME/VORNAME:... STICHPUNKTE ZU DEN LÖSUNGEN Pseudonym für Ergebnisveröffentlichung
2. Klausur zum Chemischen Grundpraktikum im WS 2011/12 vom 30.03.2012 A1 A2 A3 A4 A5 A6 A7 PC PC PC Σ Note 10 10 10 10 10 10 10 10 10 10 100 NAME/VORNAME:... STICHPUNKTE ZU DEN LÖSUNGEN Pseudonym für Ergebnisveröffentlichung
3. Seminar zum Quantitativen Anorganischen Praktikum WS 2013/14
 3. Seminar zum Quantitativen Anorganischen Praktikum WS 2013/14 Teil des Moduls MN-C-AlC S. Sahler, M. Wolberg 20.01.14 Titrimetrie (Volumetrie) Prinzip: Messung des Volumenverbrauchs einer Reagenslösung
3. Seminar zum Quantitativen Anorganischen Praktikum WS 2013/14 Teil des Moduls MN-C-AlC S. Sahler, M. Wolberg 20.01.14 Titrimetrie (Volumetrie) Prinzip: Messung des Volumenverbrauchs einer Reagenslösung
Bearbeiten Sie eines der beiden Themen! Thema I:
 Bearbeiten Sie eines der beiden Themen! Thema I: Chlor kommt in der Natur in verschiedenen Verbindungen vor. Die wichtigsten Chlorverbindungen in der Natur sind Chloride. Natriumchlorid zum Beispiel ist
Bearbeiten Sie eines der beiden Themen! Thema I: Chlor kommt in der Natur in verschiedenen Verbindungen vor. Die wichtigsten Chlorverbindungen in der Natur sind Chloride. Natriumchlorid zum Beispiel ist
Säuren und Basen. Der ph-wert Zur Feststellung, ob eine Lösung sauer oder basisch ist genügt es, die Konzentration der H 3 O H 3 O + + OH -
 Der ph-wert Zur Feststellung, ob eine Lösung sauer oder basisch ist genügt es, die Konzentration der H 3 O + (aq)-ionen anzugeben. Aus der Gleichung: H 2 O + H 2 O H 3 O + + OH - c(h 3 O + ) c(oh - ) K
Der ph-wert Zur Feststellung, ob eine Lösung sauer oder basisch ist genügt es, die Konzentration der H 3 O + (aq)-ionen anzugeben. Aus der Gleichung: H 2 O + H 2 O H 3 O + + OH - c(h 3 O + ) c(oh - ) K
1.5 Säuren und Basen und der ph-wert
 Seite 14 1.5 Säuren und Basen und der ph-wert 1.5.1 Säuren Geschichtlich bedingte Definition: Eine Säure ist ein Stoff, dessen wässrige Lösung sauer schmeckt oder ätzend wirkt, bzw. andere Stoffe angreift.
Seite 14 1.5 Säuren und Basen und der ph-wert 1.5.1 Säuren Geschichtlich bedingte Definition: Eine Säure ist ein Stoff, dessen wässrige Lösung sauer schmeckt oder ätzend wirkt, bzw. andere Stoffe angreift.
Technische Universität Chemnitz Chemisches Grundpraktikum
 Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP4 - Gesamtanalyse» Martin Wolf Betreuerin: Frau Sachse Datum: 05.05.2006 8:00 Uhr bis 12:00 Uhr
Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP4 - Gesamtanalyse» Martin Wolf Betreuerin: Frau Sachse Datum: 05.05.2006 8:00 Uhr bis 12:00 Uhr
Abb. 1: Exotherme und endotherme Reaktionen Quelle: http://www.seilnacht.com/lexikon/aktivi.htm#diagramm
 Energie bei chemischen Reaktionen Chemische Reaktionen sind Stoffumwandlungen bei denen Teilchen umgeordnet und chemische Bindungen gespalten und neu geknüpft werden, wodurch neue Stoffe mit neuen Eigenschaften
Energie bei chemischen Reaktionen Chemische Reaktionen sind Stoffumwandlungen bei denen Teilchen umgeordnet und chemische Bindungen gespalten und neu geknüpft werden, wodurch neue Stoffe mit neuen Eigenschaften
Säure-Base-Titrationen
 Säure-Base-Titrationen Dieses Skript gehört: Säure Base - Titrationen Seite 2 Hinweis: Mit den Säuren und Basen ist vorsichtig umzugehen, um Verätzungen zu vermeiden! Versuch 1: Herstellen einer Natronlauge
Säure-Base-Titrationen Dieses Skript gehört: Säure Base - Titrationen Seite 2 Hinweis: Mit den Säuren und Basen ist vorsichtig umzugehen, um Verätzungen zu vermeiden! Versuch 1: Herstellen einer Natronlauge
2. Teilklausur zum Chemischen Grundpraktikum im WS 2010/11 vom
 2. Teilklausur zum Chemischen Grundpraktikum im WS 2010/11 vom 02.02.2011 A1 A2 A3 F1 F2 R1 R2 E1 Σ Note 8 7 10 4 5 3 6 7 NAME/VORNAME:... LÖSUNGEN Matrikelnummer:... Schreiben Sie bitte gut leserlich:
2. Teilklausur zum Chemischen Grundpraktikum im WS 2010/11 vom 02.02.2011 A1 A2 A3 F1 F2 R1 R2 E1 Σ Note 8 7 10 4 5 3 6 7 NAME/VORNAME:... LÖSUNGEN Matrikelnummer:... Schreiben Sie bitte gut leserlich:
