CHE 172.1: Organische Chemie für die Life Sciences
|
|
|
- Fritzi Dorothea Thomas
- vor 6 Jahren
- Abrufe
Transkript
1 1 CHE 172.1: Organische Chemie für die Life Sciences Prof Dr. J. A. Robinson Inhaltsangabe 1. Struktur und Bindung organischer Moleküle 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen. 3. Organische Reaktionen - Einordnung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen. 4. Alkene und Alkine : Reaktionen und Herstellung 5. Aromatische Kohlenwasserstoffe 6. Heterocyclische Verbindungen 7. Stereochemie 8. Halogenalkane : Nucleophile Substitutionen und Eliminationsreaktionen 9. Alkohole, Ether und Phenole 10. Die Carbonylgruppe : Aldehyde und Ketone - Nucleophile Additionen 11. Die Carbonylgruppe : Carbonsäuren und ihre Derivate - Nucleophile Substitutionen 12. Die Carbonylgruppe : Substitutionen und Kondensationen in α-stellung 13. Amine und ihre Derivate 14. Biomoleküle : Kohlenhydrate 15. Biomoleküle : Aminosäuren, Peptide und Proteine 16. Biomoleküle : Nucleinsäuren 17. Biomoleküle : Lipoide, Terpene, Steroide, Alkaloide. Web-Version mit Aufgaben, Videos und Lösungen Für das Bauen von Computer-Modellen organischer Verbindungen wird "ChemMagic" empfohlen: Lehrbücher: 1. Paula Y. Bruice, Organic Chemistry. 8th Edition, Pearson Hall, 2016 ISBN 13: CHF Oder Deutsche-Version: Organische Chemie - Studieren Kompakt, Pearson Studium, 2011, CHF 104 ( 2. K. P. C. Vollhardt & N. E. Schore, Organische Chemie. 5. Auflage, Wiley-VCH, D-6940 Weinheim, 2011, ISBN 13: CHF J. E. McMurry, Organic Chemistry, 9th Ed., Cengage Learning, ISBN-13: CHF 320.
2 2 Warum organische Chemie? Die Chemie beschäftigt sich mit der Beschreibung der Struktur von Molekülen und mit den Gesetzmässigkeiten, nach denen sie miteinander wechselwirken. Als "Organische Chemie" bezeichnet man aus historischen Gründen die Chemie der Kohlenstoffverbindungen. Der Ausdruck "organisch" weist darauf hin, dass viele dieser Moleküle aus pflanzlichen oder tierischen Organismen isoliert wurden. Zahlreiche organische Verbindungen jedoch haben nichts mit Lebewesen zu tun, sondern sind rein synthetisch. Ausserdem existierten organische Verbindungen zweifellos schon auf der Erde, bevor das Leben entstand. In der Biologie und Medizin wird heutzutage zunehmend versucht, Ereignisse in lebenden Organismen und Zellen auf molekularer Ebene zu verstehen. Als Beispiele seien enzymatische Umsetzungen, Genexpression oder die chemische Kommunikation zwischen den Zellen genannt. Ein wichtiges Ziel ist dabei immer die Aufklärung von Struktur und Eigenschaften der beteiligten Moleküle, meistens von "organischen" Molekülen. Auf diesem Gebiet trägt die Chemie durch Fortschritte in Organisch-Chemischen Synthesen oder analytischen und spektroskopischen Methoden viel zum Verständnis biologischer Phänomene bei, und bilden die Grundlage für die Entwicklung neue Medikamente. 1. Struktur und Bindung organischer Moleküle 1.1 Atomstruktur : Die Ordnungszahl (oder Atomzahl /Atomnummer = Atomic number) ist die Zahl der Protonen im Atomkern. Die Massenzahl (oder Mass number) ist die Summe der Protonen und Neutronen zusammen. Besonders wichtig für die Chemie sind die Elektronen. Wo befinden sich die Elektronen? Aus der Quantenchemie weisst man, dass das Quadrat der Wellenfunktion (Ψ 2 ) für jeden Punkt des Raumes um den Kern die Wahrscheinlichkeit beschreibt, ein Elektron an einem bestimmten Punkt zu finden (Die Schrödinger-Gleichung verbindet die Funktion Ψ, die Wellenfunktion des Elektrons, mit seiner Energie und den Raumkoordinaten, welche zur Beschreibung des Systems notwendig sind). Also - in etwas salopper Ausdrucksweise - die Elektronen befinden sich in bestimmten Orbitalen. Atomorbitale haben eine charakteristische Gestalt (Symmetrie; Shape). Z.B. für C-Atome sind nur s - und p- Orbitale wichtig : s-orbital p x -Orbital p y -Orbital p z -Orbital y z x Die Energie-Verhältnisse für die verschiedenen s, p, und d Orbitalen können in einem Energieniveauschema dargestellt werden :
3 Energie 3. Schale (max. 18e - ) 3d 3p 3s 3 Quantenzahlen charakterisieren: Hauptenergie u. Abstand des Elektrons vom Atomkern (n); orbital shape (l); Orientierung (m); und Spin (s): 2. Schale (max. 8e - ) 1. Schale (max. 2e - ) 2p 2s 1s n = Hauptquantenzahl l = Neben- oder Orbital- Quantenzahl (l=0,1, n-1) m = mag. Quantenzahl (m= -l..0..+l) s = Spin-Quatenzahl (s=± 1 / 2 ) Die erste Schale kann bis zu maximal 2 Elektronen aufnehmen, die zweite Schale max. 8 Elektronen, und die 3. Schale bis zu max. 18. Elektronen. 1.2 Elektronenkonfiguration Bei der "Auffüllung" des möglichen Energienniveaus ist folgendes zu beachten: 1) Die Orbitale mit der niedrigsten Energie werden zuerst aufgefüllt; 2) jedes AO kann mit maximal zwei Elektronen besetzt werden, die entgegengesetzten Spin haben müssen (Pauli-Prinzip); 3) Falls zwei oder mehr Orbitale mit dem gleichen Energie unbesetzt sind, werden alle Orbitale zuerst mit einem Elektron besetzt wobei alle Elektronenspins parallel sind, bis alle Orbitale halb besetzt sind (Hundschen Regel). Die Elektronenkonfigurationen für verschiedene Elemente können jetzt beschrieben werden. Z.B.: Element Ordnungszahl Elektron. Konfig. H 1 Element Ordnungszahl Elektron. Konfig. 2p 6 Ne 10 2s 2 Li 3 C 6 Cl 17 1s 2 3p 5 3s 2 2p 6 2s 2 1s 2 Es ist leicht zu erkennen warum Elektronen-Oktetts und -Duetts besonders stabile Konfigurationen darstellen (Die Edelgasregel). Diese Zahlen von Elektronen ergeben abgeschlossene Konfigurationen mit vollständig besetzten Orbitalen (vgl. He, Ne Ar, Kr, Xe, Rn). 1.3 Ionen- und kovalente- Bindungen : Warum bilden Atome Bindungen miteinander? Grob gesagt, weil das resultierende Produkt stabiler ist (besitzt weniger Energie) als die getrennten Atome. Eine einfache Ionenbindung entsteht zwischen einem elektronegativen Atom (elektronegatives Atom bedeutet ein Atom, das eine Tendenz besitzt, Elektronen an sich zu ziehen) und einem elektropositiven Atom ( d.h. einem Atom, das die Tendenz hat, Elektronen zu übertragen). Z.B.: Li (Elektropositiv) 1s 2 2s 1 Cl (Elektronegativ) 3s 2 3p 5
4 4 Eine Ionenbindung kommt durch elektrostatische Anziehungskräfte zwischen den geladenen Ionen zustande. Elemente an der ganz rechten und an der ganz linken Seiten des Periodensystems bilden also Ionenbindungen durch den Verlust beziehungsweise Gewinn von Elektronen. Das Kohlenstoffatom (1s 2 2s 2 2p 2 ) jedoch kann nicht 4e - gewinnen oder verlieren, um eine Edelgaskonfiguration zu erlangen. Deshalb bilden C-Atome Bindungen zu anderen Atomen, indem die aneinander gebundenen Atome Elektronen miteinander teilen. Jedes Atom erhält damit formal ein äuseres Elektronenoktett. z.b.: Derartige Bindungen bezeichnet man als kovalente Einfachbindungen. Bei den Zeichnungen nach Lewis werden die Valenzelektronen durch Punkte dargestellt. Einfach dargestellt, werden aneinander gebundene Atome durch gerade Striche zwischen den Atomen symbolisiert. Einsame Elektronenpaare (lone pairs of electrons) stellt man als Doppelpunkte dar, oder lässt sie einfach weg (Kekulé Strukturen). Die Anzahl der Bindungen, welche ein Atom eingehen kann, wird durch die Zahl seiner Aussenelektronen in Verbindung mit der Edelgasregel festgelegt. 1.4 Die Kovalenzbindung Wie entstehen Kovalenzbindungen? Bindungen entstehen durch In-Phase-Überlappung von Atomorbitalen. z.b. Energie H + H H H H H H-H Sigma (σ)-bindung Durch In-Phase-Überlappung der beiden 1s-Orbitale entsteht ein neues Orbital mit niedrigerer Energie als die beiden ursprünglichen Atomorbitale - das bindende Molekülorbital.
5 5 Bringt man zwei Wasserstoffatome so nahe zusammen, dass zwischen ihnen eine Bindung geknüpft wird, wird eine Energie von 435 KJ/mol frei. Entsprechend ist zum Aufbrechen einer solche Bindung Energie erforderlich, und zwar ebenfalls 435 KJ/mol (104 Kcal/mol). Diese Energie bezeichnet man als Bindungsdissoziationsenergie ΔH. Dissoziationsenergien beziehen sich ausschliesslich auf homolytische Spaltungen. Je nach Art der Bindung und der miteinander verbundenen Atome besitzen sie einen charakteristischen Wert. Wie sehen die Kovalenzbindungen in komplexeren Molekülen, z.b. im Methan aus? 1.5 Hybridisierung von Orbitalen Die Bindungsbildung im H 2 Molekül lässt sich einfach beschreiben, schwieriger wird die Situation in komplexen organischen Molekälen mit tetravalentem Kohlenstoff. Das soll am Beispiel des Methans demonstriert werden: Kohlenstoff besitzt als Atom der 4. Hauptgruppe des PSE vier Elektronen in seiner Valenzschale (2s 2, 2p 2 ) und kann somit vier kovalente Bindungen z.b. mit Wasserstoff eingehen. 2p 2s Energie 2p 2s 1s 1s In dieser Elektronenkonfiguration ist C in der Lage vier chemische Bindungen einzugehen. In Lewis Strukturen : Wie kann man nun die vier C-H-Bindungen beschreiben? Da Kohlenstoff Elektronen aus zwei Orbialtypen (2s und 2p) zur Bindungsbildung verwendet, könnte man annehmen, dass Methan zwei Typen von C-H-Bindungen aufweist. Tatsächlich sind aber alle vier C-H-Bindungen identisch und weisen in die vier Ecken eines regulären Tetraeders. Wie kann man diesen Sachverhalt erklären? Die Antwort wurde 1931 von Linus Pauling gegeben, indem er zeigte, dass ein s Orbital und drei p Orbitale kombiniert (hybridiziert) werden können, um vier gleichwertige Atomorbitale mit tetraedrischer Orientierung zu erhalten. Diese tetraedrischen Orbitale nennt man sp 3 -Hybridorbitale, wobei der Exponent 3 angibt, wieviele Atomorbitale des jeweiligen Typs an der Bildung des Hybridorbitals beteiligt sind (formal s 1 p 3 oder sp 3 ). Das Konzept der Hybridisierung beschreibt nun wie Kohlenstoff vier gleichwertige tetraedrische Bindungen ausbildet, erklärt jedoch nicht warum. Was ist unter "Hybridisierung" zu verstehen?
6 6 Methan besteht aus 5 Atome und nicht einem. Damit können die Welleneigenschaften der Elektronen an allen Atomen miteinander interagieren, was durch Interferenz zu einem neuen Wellenfeld führt (wie "ripples on a pond"). Die neue Elektronendichte-Verteilung wird nun durch die sp 3 -Hybridorbitalen beschrieben. Wenn ein s-orbital mit drei p-orbitalen hybridisiert, sind die resultierenden Hybridorbitale unsymmetrisch hinsichtlich des Atomkerns. Eine der beiden Keulen wird grösser gegenüber der anderen und kann somit besser mit einem anderen Orbital überlappen, um eine Bindung zu bilden. Überlappen nun die vier identischen Orbitale eines sp 3 hybridisierten Kohlenstoffatoms mit den 1s Orbitalen von vier Wasserstoffatomen, dann werden vier identische C-H-Bindungen gebildet und ein Methanmolekül liegt vor. sp 3 Hybridorbital 1.1 Å º Die C-H-Bindung hat eine Bindungsdissoziationsenergie von 105 kcal/mol und eine Bindungslänge von 1.1 Å. Der H-C-H Bindungswinkel, auch Tetraederwinkel genannt, beträgt Die Struktur von Ethan Die sp 3 -Hybridorbitale können auch mit anderen Orbitalen überlappen. Durch Überlappung mit vier Chlor-p-Orbitalen entsteht beispielsweise Tetrachlormethan CCl 4. Auch C-C Bindungen werden durch Überlappung zweier Hybridorbitale gebildet :
7 7 Im Ethan beträgt die C-C Bindungslänge 1.54 Å, die C-C Bindungsdissoziationsenergie 88 Kcal/mol und die Bindungswinkeln sind fast alle o. 1.7 Die Strukturen von Ammoniak und Wasser Mit welchen Typen von Orbitalen lässt sich nun die Bindung im Ammoniak und im Wassermolekül beschreiben? Aus der Elektronenkonfiguration 1s 2 2s 2 2p 3 des Stickstoffes, ergibt sich dessen Dreibindigkeit. Drei kovalente Bindungen sind zur Erreichung eines Elektronenoktetts nötig. Um mit der beobachteten Molekülstruktur (ein angenäherter Tetraeder) übereinzustimmen, nimmt man eine sp 3 - Hybridisierung am Stickstoff an. N-Atom sp 3 -Hybrid-Orbitale 2p 2s N 1s Im vierten sp 3 -Orbital befindet sich das freie Elektronenpaar. Die N-H Bindungsdissoziationsenergie beträgt 391 KJ/mol (93 Kcal/mol), die Bindungslänge 1.0 Å, und der HNH - Bindungswinkel o. Ein Ammonium-Kation (NH 4 + ) hat auch eine tetraedrischer Geometrie (Bindungswinkel o ). Das freie Elektronenpar im Ammoniak kann für der Bildung der vierten Bindung gebraucht werden und das N-atom erhält eine positive Ladung. Entsprechend lassen sich auch die Bindungen im Wassermolekül am einfachsten mit sp 3 - Hybridorbitalen beschreiben. Wenn es darum geht, nur die Elektronendichte-Verteilung im Wassermolekül zu beschrieben, ist das sp 3 -Hybridisierungs-Modell sehr nützlich, und auch anwendbar auf verwandte Moleküle wie den Alkoholen (Vgl. später). Das O-Atom besitzt zwei freie Elektronenpaare mit identischen Energien. Der Bindungswinkel ist o ; O-H Bindungsdissoziationsenergie = 463 KJ/mol (110 Kcal/mol); O-H Bindungslänge = 0.96 Å. O-Atom sp 3 -Hybrid-Orbitale 2p 2s O 1s
8 8 1.8 sp 2 -Hybride zur Darstellung trigonaler Strukturen Im Ethylen (=Ethen) teilen die zwei C-Atome vier Elektronen. Sie werden durch eine Doppelbindung verknüpft: Eine sp 3 -Hybridisierung kann diese Struktur nicht erklären. Statt dessen wird das 2s-Orbital am C mit nur zwei 2p-Orbitalen hybridisiert, um drei sp 2 Hybridorbitale zu bilden. Ein p-orbital bleibt unverändert: drei sp 2 Orbitale von oben angesehen Wenn zwei sp 2 -hybridisierte C-Atome sich annähern kann durch Überlappung von zwei sp 2 - Orbitalen eine σ-bindung entstehen. Gleichzeitig nähern sich die zwei nicht-hybridisierte p-orbitale von der Seite an und bilden dadurch eine neue pi (π) Bindung. Durch die Überlappung von p-orbitalen entstehen pi (π)-bindungen. Die Überlappung der vier übrigen sp 2 -Hybridorbitale mit 1s Orbitalen des Wasserstoffes ergibt dann das Ethylenmolekül : Ethylen besitzt eine flache Struktur mit HCH- und HCC-Bindungswinkeln von 120 o. Die C-H Bindungslänge beträgt Å und die C-H Bindungsdissoziationsenergie 103 Kcal/mol. Die C=C Bindungslänge ist 1.33 Å (vgl Ethan 1.54 Å) und die Bindungsdissoziationsenergie beträgt 152 Kcal/mol (vgl. Ethan 88 Kcal/mol). Die Doppelbindung ist damit wie erwartet kürzer und stärker als eine C-C Einfachbindung.
9 9 Die Carbonylgruppe in Aldehyden, Ketonen und Carbonsäuren enthält eine C=O Doppelbindung. Das Carbonyl-C ist auch sp 2 -hybridisiert und bildet drei σ-bindungen. Das vierte Valenzelektron bleibt in einem p-orbital und wird an einer pi-bindung zu Sauerstoff beteiligt : C O Wie Alkene haben Carbonylgruppen eine flache Struktur und einen Bindungswinkel von X- Ray und Neutronen-Beugungsexperimenten zeigen das die Elektronendichte in den nicht-bindenden Orbitalen am O-Atom ein planar trigonal Geometrie haben. 1.9 sp-hybride zur Darstellung von Acetylen Kohlenstoff kann auch Dreifachbindungen bilden. Im Acetylen teilen zwei C-Atome sechs Elektronen. Hier entstehen andere Hybridorbitale durch die Mischung von dem 2s-Orbital und einem 2p-Orbital. Zwei sp-hydridorbitale entstehen und bilden eine lineare Geometrie. Die anderen p- Orbitale stehen senkrecht zueinander : y p-orbital x sp-hybridorbital Wenn zwei sp-hybridisierte C-Atome sich annähern, entsteht durch die Überlappung der sp- Hybridorbitale eine starke σ-bindung und durch die Überlappung der zwei p-orbitalen zwei π- Bindungen (d.h. eine Dreifachbindung). Die übrigen sp-hybridorbitale können wieder σ-bindungen mit dem 1s-Orbital des Wasserstoffes bilden. Auf Grund der sp-hybridisierung ist Acetylen ein lineares Molekül mit einem HCC Bindungswinkel von 180 o, einer C-H Bindungslänge von 1.06 Å, einer C-C Bindungslänge von 1.2 Å und Bindungsdissoziationsenergien von 125 Kcal/mol (C-H) und 200 Kcal/mol (C-C) Polarität kovalenter Bindungen Sind zwei gleiche Atome durch eine Bindung verknüpft (H-H, CH 3 -CH 3 usw.) so verteilt sich das Bindungselektronenpaar gleichmässig auf beide Atome. Sind dagegen die verknüpften Atome
10 10 verschieden (z.b. H-Cl, CH 3 -Cl), so entsteht eine unsymmetrische Elektronenwolke, da eines der Atome die Bindungselektronen stärker an sich zieht als das andere: Man nennt das Bestreben eines Atoms, Bindungselektronen anzuziehen, Elektronegativität. Im Periodensystem nimmt die Elektronegativität von "links nach rechts" und von "unten nach oben" zu:. Group IA H 2.2 2A 7A Li 1.0 Na 0.9 Be 1.6 Mg 1.3 3A B 2.0 Al 1.6 4A C 2.5 Si 1.9 5A N 3.0 P 2.2 6A O 3.4 S 2.6 F 4.0 Cl 3.1 Br 3.0 I 2.6 Die Pauling-Elektronegativitäten beziehen sich auf das elektronegativste Atom Fluor, welchem willkürlich der Wert 4 zugeordnet wird. Z.B. die C-Cl Bindung im Chlormethan ist eine polare Kovalenzbindung: Polarisationseffekte, die durch elektronenanziehende oder -abstossende Atome oder Atomgruppen bewirkt und über σ-bindungen übertragen werden, heissen induktive Effekte. Je nachdem, ob das "Schlüsselatom" d.h. das elektronen-anziehende bzw. -abstossende Atom eine negative oder positive Partialladung erhält, spricht man von -I oder +I-Effekten. Die "Schlüsselatome" werden oft auch als σ-akzeptoren (elektronenanziehend) oder σ-donatoren (elektronen-abstossend) bezeichnet z.b. Mit wachsender Zahl der Bindungen, d.h. mit zunehmendem Abstand vom Schlüsselatom, nimmt die Wirkung des induktiven Effektes sehr stark ab. Auch p-bindungen werden polarisiert, wenn die zwei an der Doppelbindung beteiligten Atome unterschiedliche Elektronegativitäten aufweisen. In der Carbonylgruppe ist die π-bindung stark polarisiert. Dieser Polarisierung hat wichtige Konsequenzen für die Reaktivität der Carbonylgruppe.
CHE 172.1: Organische Chemie für die Life Sciences
 1 CHE 172.1: Organische Chemie für die Life Sciences Prof Dr. J. A. Robinson 1. Struktur und Bindung organischer Moleküle 1.1 Atomstruktur : Die Ordnungszahl (oder Atomzahl /Atomnummer = Atomic number)
1 CHE 172.1: Organische Chemie für die Life Sciences Prof Dr. J. A. Robinson 1. Struktur und Bindung organischer Moleküle 1.1 Atomstruktur : Die Ordnungszahl (oder Atomzahl /Atomnummer = Atomic number)
1. Struktur und Bindung organischer Moleküle (Siehe Kapitel 6. in Allgemeine Chemie B, I. Teil)
 Tuesday, January 30, 2001 Allgemeine Chemie B II. Kapitel 1 Page: 1 Inhalt Index 1. Struktur und Bindung organischer Moleküle (Siehe Kapitel 6. in Allgemeine Chemie B, I. Teil) 1.1 Atomstruktur Die Ordnungszahl
Tuesday, January 30, 2001 Allgemeine Chemie B II. Kapitel 1 Page: 1 Inhalt Index 1. Struktur und Bindung organischer Moleküle (Siehe Kapitel 6. in Allgemeine Chemie B, I. Teil) 1.1 Atomstruktur Die Ordnungszahl
Chemische Bindungen Atombindung
 Atombindung Das Lewis Modell der kovalenten Bindung Die Entstehung von Molekülen beruht auf der Bildung von gemeinsamen, bindenden Elektronenpaaren in dem Bestreben der Atome, eine energetisch stabile
Atombindung Das Lewis Modell der kovalenten Bindung Die Entstehung von Molekülen beruht auf der Bildung von gemeinsamen, bindenden Elektronenpaaren in dem Bestreben der Atome, eine energetisch stabile
Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie,
 Wiederholung der letzten Vorlesungsstunde: Thema: Chemische h Bindungen Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie, unterschiedliche Arten chemischer Bindungen, Atombindung, kovalente
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische h Bindungen Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie, unterschiedliche Arten chemischer Bindungen, Atombindung, kovalente
Organische Chemie. Kapitel 1. Organic Chemistry 4 th Edition Paula Yurkanis Bruice. Organische Verbindungen enthalten Kohlenstoff
 rganic Chemistry 4 th Edition Paula Yurkanis Bruice Kapitel 1 Elektronische Struktur und Bindung Säuren und Basen rganische Chemie rganische Verbindungen enthalten Kohlenstoff Kohlenstoff ist weder ein
rganic Chemistry 4 th Edition Paula Yurkanis Bruice Kapitel 1 Elektronische Struktur und Bindung Säuren und Basen rganische Chemie rganische Verbindungen enthalten Kohlenstoff Kohlenstoff ist weder ein
Valenz-Bindungstheorie H 2 : s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie
 Valenz-Bindungstheorie Beschreibung von Molekülen mit Hilfe von Orbitalen H H H 2 : H 2 s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie um die interatomare
Valenz-Bindungstheorie Beschreibung von Molekülen mit Hilfe von Orbitalen H H H 2 : H 2 s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie um die interatomare
Vom Atom zum Molekül
 Vom Atom zum Molekül Ionenverbindungen Na + Cl NaCl lebensgefährlich giftig lebensgefährlich giftig lebensessentiell Metall + Nichtmetall Salz Beispiel Natriumchlorid Elektronenkonfiguration: 11Na: 1s(2)
Vom Atom zum Molekül Ionenverbindungen Na + Cl NaCl lebensgefährlich giftig lebensgefährlich giftig lebensessentiell Metall + Nichtmetall Salz Beispiel Natriumchlorid Elektronenkonfiguration: 11Na: 1s(2)
Die elektrophile Addition
 Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Bindungskonzepte in der. Organischen Chemie. 1.1 Hybridisierung
 O:/Wiley/Organische_Chemie_Aufl_1/3d/c01.3d from 19.07.2012 09:18:28 1 Bindungskonzepte in der 1 Organischen Chemie In diesem Kapitel Die Organische Chemie wird gemeinhin als die Chemie der Kohlenstoffverbindungen
O:/Wiley/Organische_Chemie_Aufl_1/3d/c01.3d from 19.07.2012 09:18:28 1 Bindungskonzepte in der 1 Organischen Chemie In diesem Kapitel Die Organische Chemie wird gemeinhin als die Chemie der Kohlenstoffverbindungen
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II
 Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II Elektronenpaarbindung, Elektronegativität, polare Atombindung, Dipolmoment, Hybridisierung von Atomorbitalen, sp 3 -, sp 2 -, sp-hybridorbitale,
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II Elektronenpaarbindung, Elektronegativität, polare Atombindung, Dipolmoment, Hybridisierung von Atomorbitalen, sp 3 -, sp 2 -, sp-hybridorbitale,
Chemie II. Vorlesung: Mo Uhr, HPT C103 Übungen: Mo Uhr, HCI H2.1, HCI J4
 hemie II Vorlesung: Mo 11-13 Uhr, PT 103 Übungen: Mo 14-16 Uhr, I 2.1, I J4 Literatur:.E. Mortimer, U. Müller: hemie, 11. Auflage Thieme-Verlag Stuttgart 2014 Dr. Wolfram Uhlig Laboratorium für Anorganische
hemie II Vorlesung: Mo 11-13 Uhr, PT 103 Übungen: Mo 14-16 Uhr, I 2.1, I J4 Literatur:.E. Mortimer, U. Müller: hemie, 11. Auflage Thieme-Verlag Stuttgart 2014 Dr. Wolfram Uhlig Laboratorium für Anorganische
Oktett-Theorie von Lewis
 Oktett-Theorie von Lewis Oktettregel Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst ein Elektronenoktett zu erlangen. allgemeiner: Edelgasregel Atome streben durch Vereinigung
Oktett-Theorie von Lewis Oktettregel Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst ein Elektronenoktett zu erlangen. allgemeiner: Edelgasregel Atome streben durch Vereinigung
Grundlagen der Chemie Die Atombindung Kovalente Bindungen
 Die Atombindung Kovalente Bindungen Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu Kovalente Bindungen In einem
Die Atombindung Kovalente Bindungen Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu Kovalente Bindungen In einem
Grundlagen der Chemie
 Grundlagen der Chemie Angelika Brückner, Thomas Werner Leibniz-Institut für Katalyse e. V. an der Universität Rostock Bitte! 1 Informationen Vorlesung Dienstag, 11:00-12:30, LHSL Mittwoch, 11:30-13:00,
Grundlagen der Chemie Angelika Brückner, Thomas Werner Leibniz-Institut für Katalyse e. V. an der Universität Rostock Bitte! 1 Informationen Vorlesung Dienstag, 11:00-12:30, LHSL Mittwoch, 11:30-13:00,
Auf der rechten Seite sind Beispiele für kovalente Bindungen.
 Bei einem Gemisch aus Natrium und Chlorid wird einen Ionenverbindung entstehen und sich ein Ionengitter ausbilden. Wenn Natrium nicht vorhanden ist, hat Chlorid aber natürlich noch immer das Bedürfnis,
Bei einem Gemisch aus Natrium und Chlorid wird einen Ionenverbindung entstehen und sich ein Ionengitter ausbilden. Wenn Natrium nicht vorhanden ist, hat Chlorid aber natürlich noch immer das Bedürfnis,
Organische Chemie I. OC I Lehramt F. H. Schacher 1
 Organische Chemie I OC I Lehramt F. H. Schacher 1 Organisatorisches Kontakt: Felix H. Schacher IOMC, Lessingstr. 8, Raum 122 Email: felix.schacher@uni jena.de Termine: Vorlesung: Freitag 12 14 Uhr Hörsaal,
Organische Chemie I OC I Lehramt F. H. Schacher 1 Organisatorisches Kontakt: Felix H. Schacher IOMC, Lessingstr. 8, Raum 122 Email: felix.schacher@uni jena.de Termine: Vorlesung: Freitag 12 14 Uhr Hörsaal,
Zustände der Elektronen sind Orbitale, die durch 4 Quantenzahlen
 Wiederholung der letzten Vorlesungsstunde: Thema: Das wellenmechanische h Atommodell (Orbitalmodell) ll) Zustände der Elektronen sind Orbitale, die durch 4 Quantenzahlen beschrieben werden, Hauptquantenzahl
Wiederholung der letzten Vorlesungsstunde: Thema: Das wellenmechanische h Atommodell (Orbitalmodell) ll) Zustände der Elektronen sind Orbitale, die durch 4 Quantenzahlen beschrieben werden, Hauptquantenzahl
30. Lektion. Moleküle. Molekülbindung
 30. Lektion Moleküle Molekülbindung Lernziel: Moleküle entstehen aus Atomen falls ihre Wellenfunktionen sich derart überlappen, daß die Gesamtenergie abgesenkt wird. Begriffe Begriffe: Kovalente Bindung
30. Lektion Moleküle Molekülbindung Lernziel: Moleküle entstehen aus Atomen falls ihre Wellenfunktionen sich derart überlappen, daß die Gesamtenergie abgesenkt wird. Begriffe Begriffe: Kovalente Bindung
Prof. Christoffers, Vorlesung Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler
 Prof. hristoffers, Vorlesung Organische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. inführung 1.1 Atomorbitale Die Atome im Molekülverband werden durch lektronen
Prof. hristoffers, Vorlesung Organische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. inführung 1.1 Atomorbitale Die Atome im Molekülverband werden durch lektronen
1/5. Symbol des Elements
 1/5 Wasser aus der Sicht der Chemie Das Wassermolekül Factsheet 1 Einführung Die Summenformel von Wasser 2 wurde vom italienischen Wissenschaftler Cannizzarro 1860 bestimmt. Sie bedeutet, dass ein Wasserteilchen
1/5 Wasser aus der Sicht der Chemie Das Wassermolekül Factsheet 1 Einführung Die Summenformel von Wasser 2 wurde vom italienischen Wissenschaftler Cannizzarro 1860 bestimmt. Sie bedeutet, dass ein Wasserteilchen
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Organisatorisches Kurs-Skript http://www.uni-due.de/ adb297b
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Organisatorisches Kurs-Skript http://www.uni-due.de/ adb297b
Reaktionstypen der Aliphate
 Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
2 Die Atombindung im Wasserstoff-Molekül
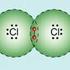 2.1 Lernziele 1. Sie wissen, wie eine chemische Bindung zwischen zwei Wasserstoff-Atomen zustande kommt. 2. Sie können den bindenden vom antibindenden Zustand unterscheiden. 3. Sie wissen, weshalb das
2.1 Lernziele 1. Sie wissen, wie eine chemische Bindung zwischen zwei Wasserstoff-Atomen zustande kommt. 2. Sie können den bindenden vom antibindenden Zustand unterscheiden. 3. Sie wissen, weshalb das
Das Lewis-Modell zur Erklärung kovalenter Bindungen
 Das Lewis-Modell zur Erklärung kovalenter Bindungen Erarbeiten Sie sich, innerhalb der Expertengruppe, einen Überblick über das Lewis-Modell zur Erklärung kovalenter Bindungen! Gehen Sie zusätzlich auf
Das Lewis-Modell zur Erklärung kovalenter Bindungen Erarbeiten Sie sich, innerhalb der Expertengruppe, einen Überblick über das Lewis-Modell zur Erklärung kovalenter Bindungen! Gehen Sie zusätzlich auf
CHEMIE KAPITEL 1 AUFBAU DER MATERIE. Timm Wilke. Georg-August-Universität Göttingen. Wintersemester 2014 / 2015
 CHEMIE KAPITEL 1 AUFBAU DER MATERIE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2014 / 2015 Folie 2 Valenzelektronen und Atomeigenschaften Valenzelektronen (Außenelektronen) bestimmen
CHEMIE KAPITEL 1 AUFBAU DER MATERIE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2014 / 2015 Folie 2 Valenzelektronen und Atomeigenschaften Valenzelektronen (Außenelektronen) bestimmen
1.3. Periodensystem der Elemente
 1.3. Periodensystem der Elemente Anordnung der Elemente Periodizität von Eigenschaften Folie Nr. 1 Anordnung der Elemente Historie: Johann Wolfgang Döbereiner (dt. Pharmazeut, 1780-1849) Döberreiners Triadenregel
1.3. Periodensystem der Elemente Anordnung der Elemente Periodizität von Eigenschaften Folie Nr. 1 Anordnung der Elemente Historie: Johann Wolfgang Döbereiner (dt. Pharmazeut, 1780-1849) Döberreiners Triadenregel
Orbitalmodell SPF BCH am
 Orbitalmodell Inhaltsverzeichnis Sie können sich unter einer elektromagnetischen Welle etwas vorstellen. Sie kennen typische Eigenschaften von Wellen im Vergleich zu Teilchen-Strahlen...2 Sie können die
Orbitalmodell Inhaltsverzeichnis Sie können sich unter einer elektromagnetischen Welle etwas vorstellen. Sie kennen typische Eigenschaften von Wellen im Vergleich zu Teilchen-Strahlen...2 Sie können die
Das Tetraeder-Bällchen/Oktaeder-Bällchen
 H-Atome: klein, weiß Edelgas-Atome: He, Ne, Ar, Kr, Xe, Rn: verschiedene Lila-Töne Metalle: Natrium, Calcium: eher Dunkelblau-Töne Nichtmetalle: C N O F P S Cl grau (kopiert) hellblau rot hellgelb orange
H-Atome: klein, weiß Edelgas-Atome: He, Ne, Ar, Kr, Xe, Rn: verschiedene Lila-Töne Metalle: Natrium, Calcium: eher Dunkelblau-Töne Nichtmetalle: C N O F P S Cl grau (kopiert) hellblau rot hellgelb orange
6. Carbonyl-Verbindungen
 6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
Valence Shell Electron Pair Repulsion
 Das VSEPR-Modell der Molekularen Struktur Valence Shell Electron Pair Repulsion Vorhersage der Molekülstruktur basierend auf der Anordnung von Elektronen-Paaren in der Valenz-Schale R. J. Gillespie, 1963
Das VSEPR-Modell der Molekularen Struktur Valence Shell Electron Pair Repulsion Vorhersage der Molekülstruktur basierend auf der Anordnung von Elektronen-Paaren in der Valenz-Schale R. J. Gillespie, 1963
08.12.2013. Wichtige Stoffgruppen. Stoffgruppe. Atomverband. Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Metall Metall:
 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter) - Salze Nichtmetall Nichtmetall:
1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter) - Salze Nichtmetall Nichtmetall:
Übungen zur VL Chemie für Biologen und Humanbiologen 18.11.2011 Lösung Übung 3
 Übungen zur VL Chemie für Biologen und Humanbiologen 18.11.2011 Lösung Übung 3 Teil 1: Die Geometrie organischer Verbindungen 1. Welche Form hat ein s-orbital? Welche Form haben p-orbitale? Skizzieren
Übungen zur VL Chemie für Biologen und Humanbiologen 18.11.2011 Lösung Übung 3 Teil 1: Die Geometrie organischer Verbindungen 1. Welche Form hat ein s-orbital? Welche Form haben p-orbitale? Skizzieren
Einführung in die Organische Chemie. Benjamin Grimm
 Einführung in die Organische Chemie Benjamin Grimm Gliederung Einführung: Begriff der organischen Chemie Synthese organischer Stoffe: Cracken von Erdöl Organische Stoffklassen Isomerie Orbitalmodell: Hybridisierung
Einführung in die Organische Chemie Benjamin Grimm Gliederung Einführung: Begriff der organischen Chemie Synthese organischer Stoffe: Cracken von Erdöl Organische Stoffklassen Isomerie Orbitalmodell: Hybridisierung
2. Elementare Stöchiometrie I Definition und Gesetze, Molbegriff, Konzentrationseinheiten
 Inhalt: 1. Regeln und Normen Modul: Allgemeine Chemie 2. Elementare Stöchiometrie I Definition und Gesetze, Molbegriff, Konzentrationseinheiten 3.Bausteine der Materie Atomkern: Elementarteilchen, Kernkräfte,
Inhalt: 1. Regeln und Normen Modul: Allgemeine Chemie 2. Elementare Stöchiometrie I Definition und Gesetze, Molbegriff, Konzentrationseinheiten 3.Bausteine der Materie Atomkern: Elementarteilchen, Kernkräfte,
Inhaltsverzeichnis. 3 Gesättigte Kohlenwasserstoffe (Alkane) 3.1 Offenkettige Alkane 3.2 Cyclische Alkane
 Inhaltsverzeichnis 1 Chemische Bindung in organischen Verbindungen 1.1 Einleitung 1.2 Grundlagen der chemischen Bindung 1.3 Die Atombindung (kovalente oder homöopolare Bindung) 1.4 Bindungslängen und Bindungsenergien
Inhaltsverzeichnis 1 Chemische Bindung in organischen Verbindungen 1.1 Einleitung 1.2 Grundlagen der chemischen Bindung 1.3 Die Atombindung (kovalente oder homöopolare Bindung) 1.4 Bindungslängen und Bindungsenergien
Ionisierungsenergie und Elektronenaffinität. Bindigkeit Valenzstrichformel Molekülgeometrie
 Tendenzen im Periodensystem Ionisierungsenergie und Elektronenaffinität Atombindung (Elektronenpaarbindung) Bindigkeit Valenzstrichformel Molekülgeometrie Räumlicher Bau einfacher Moleküle Polare Atombindung
Tendenzen im Periodensystem Ionisierungsenergie und Elektronenaffinität Atombindung (Elektronenpaarbindung) Bindigkeit Valenzstrichformel Molekülgeometrie Räumlicher Bau einfacher Moleküle Polare Atombindung
1.4. Die Darstellung von Strukturen
 1 Elektronenstruktur und Bindung Säuren und Basen 3D-Moleküle: Li, 2, F zieht positive Ladungen an rot orange gelb grün blau zieht negative Ladungen an stärkstes negatives elektrostatisches Potenzial stärkstes
1 Elektronenstruktur und Bindung Säuren und Basen 3D-Moleküle: Li, 2, F zieht positive Ladungen an rot orange gelb grün blau zieht negative Ladungen an stärkstes negatives elektrostatisches Potenzial stärkstes
Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006
 Übungsaufgaben zur Vorlesung hemie für Biologen, WS 2005/2006 Themenbereiche Atombau, chemische Bindung, Stöchiometrie, Aggregatzustände 1. Ergänzen Sie folgende Tabelle: Symbol Z M Protonen eutronen Elektronen
Übungsaufgaben zur Vorlesung hemie für Biologen, WS 2005/2006 Themenbereiche Atombau, chemische Bindung, Stöchiometrie, Aggregatzustände 1. Ergänzen Sie folgende Tabelle: Symbol Z M Protonen eutronen Elektronen
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Lernwerkstatt: Atombindung. Das komplette Material finden Sie hier:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Atombindung Das komplette Material finden Sie hier: School-Scout.de Titel: Atombindungen Reihe: Lernwerkstatt Bestellnummer:
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Atombindung Das komplette Material finden Sie hier: School-Scout.de Titel: Atombindungen Reihe: Lernwerkstatt Bestellnummer:
(2.65 ev), da sich die beiden Elektronen gegenseitig abstossen.
 phys4.026 Page 1 13.8 Das Wasserstoff-Molekül Wie im Fall des H2 + Moleküls führen im H2 Molekül symmetrische Wellenfunktionen zu bindenden Zuständen, wohingegen anti-symmetrische Wellenfunktionen zu anti-bindenden
phys4.026 Page 1 13.8 Das Wasserstoff-Molekül Wie im Fall des H2 + Moleküls führen im H2 Molekül symmetrische Wellenfunktionen zu bindenden Zuständen, wohingegen anti-symmetrische Wellenfunktionen zu anti-bindenden
Kohlenwasserstoffe. Alkane. Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind.
 2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
Grundwissen Chemie 9. Jahrgangsstufe
 Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
n Pentan 2- Methylbutan 2,2, dimethylpropan ( Wasserstoffatome sind nicht berücksichtigt )
 Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Übersicht. Wasserstoff-Verbindungen
 Allgemeine Chemie - Teil Anorganische Chemie II: 5. Hauptgruppe Übersicht A. Die Stellung der Elemente der 5. Hauptgruppe im Periodensystem. Stickstoff 2.1. Stickstoff-Wasserstoff Wasserstoff-Verbindungen.1.1.
Allgemeine Chemie - Teil Anorganische Chemie II: 5. Hauptgruppe Übersicht A. Die Stellung der Elemente der 5. Hauptgruppe im Periodensystem. Stickstoff 2.1. Stickstoff-Wasserstoff Wasserstoff-Verbindungen.1.1.
Chemie-Tutorien zur Vorbereitung auf das Praktikum
 Seite 1 von 7 LMU Co.Med (Curriculumsoptimierung Medizin) Chemie-Tutorien zur Vorbereitung auf das Praktikum 07.03.-18.03.2017 Dienstag, 07.03.2017 18.00-20.00 Uhr Grundlagen der Chemie I Donnerstag, 09.03.2017
Seite 1 von 7 LMU Co.Med (Curriculumsoptimierung Medizin) Chemie-Tutorien zur Vorbereitung auf das Praktikum 07.03.-18.03.2017 Dienstag, 07.03.2017 18.00-20.00 Uhr Grundlagen der Chemie I Donnerstag, 09.03.2017
Chemische Bindung. Kovalente Bindung (Atombindung) Ionenbindung Metallischer Zustand. Zwischenmolekulare Kräfte:
 Chemische Bindung Chemische Bindung Kovalente Bindung (Atomindung) Ionenindung Metallischer Zustand Zwischenmolekulare Kräfte: o H-Brücken o Van-der-Waals-Kräfte/Londonkräfte LEWIS-Darstellung Oktettregel
Chemische Bindung Chemische Bindung Kovalente Bindung (Atomindung) Ionenindung Metallischer Zustand Zwischenmolekulare Kräfte: o H-Brücken o Van-der-Waals-Kräfte/Londonkräfte LEWIS-Darstellung Oktettregel
Supramolekulare Chemie: zwischenmolekulare Wechselwirkungen molekulare Erkennung. Pflanzenschutz. Organische Synthese.
 OCI_folie1 Proteine DNA, RNA Enzyme polymere Werkstoffe und Materialien Makromoleküle Peptide Nucleotide Supramolekulare Chemie: zwischenmolekulare Wechselwirkungen molekulare Erkennung Synthetische Oligo-
OCI_folie1 Proteine DNA, RNA Enzyme polymere Werkstoffe und Materialien Makromoleküle Peptide Nucleotide Supramolekulare Chemie: zwischenmolekulare Wechselwirkungen molekulare Erkennung Synthetische Oligo-
CHEMIE KAPITEL 1 AUFBAU DER MATERIE. Timm Wilke. Georg-August-Universität Göttingen. Wintersemester 2014 / 2015
 CHEMIE KAPITEL 1 AUFBAU DER MATERIE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2014 / 2015 Folie 2 Atombau und Elementarteilchen Folie 3 Atommasse und Stoffmenge Stoffmenge [mol]: 12,000
CHEMIE KAPITEL 1 AUFBAU DER MATERIE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2014 / 2015 Folie 2 Atombau und Elementarteilchen Folie 3 Atommasse und Stoffmenge Stoffmenge [mol]: 12,000
Orbital. Atombindung, Bindung. Elektronegativität. Dipol
 GW Chemie 10. SG GA rbital aum, in dem sich Elektronen mit 99%iger Wahrscheinlichkeit aufhalten; in einem rbital halten sich maximal 2 Elektronen auf; man unterscheidet Atom- und Molekülorbitale Atombindung,
GW Chemie 10. SG GA rbital aum, in dem sich Elektronen mit 99%iger Wahrscheinlichkeit aufhalten; in einem rbital halten sich maximal 2 Elektronen auf; man unterscheidet Atom- und Molekülorbitale Atombindung,
1 Struktur und Bindung organischer Moleküle
 1 Struktur und Bindung organischer Moleküle 20. (sowie 21 und 25, s. unten) (a) (b) Die Dreifachbindung ist fur die Ausbildung der Oktette an C und N erforderlich. (c) d + d H:O :Cl: (d) Man beachte, dass
1 Struktur und Bindung organischer Moleküle 20. (sowie 21 und 25, s. unten) (a) (b) Die Dreifachbindung ist fur die Ausbildung der Oktette an C und N erforderlich. (c) d + d H:O :Cl: (d) Man beachte, dass
Organische Chemie I Molekül der Woche - Azulen
 I Molekül der Woche - Azulen 1 I Alkine C n H 2n-2 Bindungslängen Der C-H-Abstand verringert sich in dem Maße, wie der s-anteil an der Hybridisierung des C-Atoms wächst Schwermetallacetylide Ag 2 C 2 und
I Molekül der Woche - Azulen 1 I Alkine C n H 2n-2 Bindungslängen Der C-H-Abstand verringert sich in dem Maße, wie der s-anteil an der Hybridisierung des C-Atoms wächst Schwermetallacetylide Ag 2 C 2 und
Grundtypen der Bindung. Grundtypen chemischer Bindung. Oktettregel. A.8.1. Atombindung
 Grundtypen der Bindung Grundtypen chemischer Bindung Oktettregel A.8.1. Atombindung 1 A.8.1 Atombindung Valenz (Zahl der Bindungen) Atombindung auch: kovalente Bindung, ElektronenpaarBindung Zwei Atome
Grundtypen der Bindung Grundtypen chemischer Bindung Oktettregel A.8.1. Atombindung 1 A.8.1 Atombindung Valenz (Zahl der Bindungen) Atombindung auch: kovalente Bindung, ElektronenpaarBindung Zwei Atome
Chemische Bindung zweiatomiger Moleküle
 Die Born Oppenheimer Näherung vernachlässigt Elektronenimpulse gegenüber Kernimpulsen und erlaubt die Gesamtwellenfunktion als ein Produkt aus einer Kernwellenfunktion F q ( R) und der einer Elektronenwellenfunktion
Die Born Oppenheimer Näherung vernachlässigt Elektronenimpulse gegenüber Kernimpulsen und erlaubt die Gesamtwellenfunktion als ein Produkt aus einer Kernwellenfunktion F q ( R) und der einer Elektronenwellenfunktion
Musterprüfung Welche der Elemente Lithium, Kohlenstoff, Wasserstoff, Sauerstoff, Magnesium, Aluminium und Calcium sind Nichtmetalle?
 Module: Atombau und Periodensystem Chemische Bindungen Chemische Reaktionen 1 Musterprüfung 1. Teil: Atombau und Periodensystem 1.1. Welche Art von Teilchen befinden sich a) im Atomkern b) in der Elektronenhülle
Module: Atombau und Periodensystem Chemische Bindungen Chemische Reaktionen 1 Musterprüfung 1. Teil: Atombau und Periodensystem 1.1. Welche Art von Teilchen befinden sich a) im Atomkern b) in der Elektronenhülle
mentor Abiturhilfe: Chemie Oberstufe
 mentor Abiturhilfen mentor Abiturhilfe: Chemie Oberstufe Organische Chemie. Aufbauwissen von eribert Rampf, Sandra Schaumann-Eckel 1. Auflage mentor Abiturhilfe: Chemie Oberstufe Rampf / Schaumann-Eckel
mentor Abiturhilfen mentor Abiturhilfe: Chemie Oberstufe Organische Chemie. Aufbauwissen von eribert Rampf, Sandra Schaumann-Eckel 1. Auflage mentor Abiturhilfe: Chemie Oberstufe Rampf / Schaumann-Eckel
Chemische Bindung. Ionenbindung (heteropolare Bindung) kovalente Bindung van-der-waals-bindung Metallbindung
 Chemische Bindung Ionenbindung (heteropolare Bindung) kovalente Bindung van-der-waals-bindung Metallbindung 1 Was sind Ionen? Ein Ion besteht aus einem oder mehreren Atomen und hat elektrische Ladung Kationen
Chemische Bindung Ionenbindung (heteropolare Bindung) kovalente Bindung van-der-waals-bindung Metallbindung 1 Was sind Ionen? Ein Ion besteht aus einem oder mehreren Atomen und hat elektrische Ladung Kationen
5 Mehrelektronensysteme
 5.1 Übersicht und Lernziele Thema Im ersten Teil dieses Kapitels behandeln wir Atome, die mehr als ein Elektron besitzen. Anschliessend betrachten wir im zweiten Teil die Bildung von Bindungen zwischen
5.1 Übersicht und Lernziele Thema Im ersten Teil dieses Kapitels behandeln wir Atome, die mehr als ein Elektron besitzen. Anschliessend betrachten wir im zweiten Teil die Bildung von Bindungen zwischen
Bauchemie 1. 1. Welche elementaren Teilchen enthält a) der Atomkern und b) die Atomhülle?
 Bauchemie 1 1. Welche elementaren Teilchen enthält a) der Atomkern und b) die Atomhülle? a) Der Atomkern besteht aus Neutronen und Protonen, die zusammen auch Nukleonen genannt werden. Er befindet sich
Bauchemie 1 1. Welche elementaren Teilchen enthält a) der Atomkern und b) die Atomhülle? a) Der Atomkern besteht aus Neutronen und Protonen, die zusammen auch Nukleonen genannt werden. Er befindet sich
Vom Atombau zum Königreich der Elemente
 Vom Atombau zum Königreich der Elemente Wiederholung: Elektronenwellenfunktionen (Orbitale) Jedes Orbital kann durch einen Satz von Quantenzahlen n, l, m charakterisiert werden Jedes Orbital kann maximal
Vom Atombau zum Königreich der Elemente Wiederholung: Elektronenwellenfunktionen (Orbitale) Jedes Orbital kann durch einen Satz von Quantenzahlen n, l, m charakterisiert werden Jedes Orbital kann maximal
Erläutere den CO 2 -Nachweis. Definiere den Begriff exotherme Reaktion und zeichne ein passendes Energiediagramm. Grundwissenskatalog Chemie 8 NTG
 Erläutere den CO 2 -Nachweis. Wird das Gas in Kalkwasser (Ca(OH) 2 ) eingeleitet bildet sich ein schwerlöslicher Niederschlag von Calciumcarbonat (CaCO 3 ). Abgabe von innerer Energie (Wärme, Knall,...)
Erläutere den CO 2 -Nachweis. Wird das Gas in Kalkwasser (Ca(OH) 2 ) eingeleitet bildet sich ein schwerlöslicher Niederschlag von Calciumcarbonat (CaCO 3 ). Abgabe von innerer Energie (Wärme, Knall,...)
Zeichnen von Valenzstrichformeln
 Zeichnen von Valenzstrichformeln ür anorganische Salze werden keine Valenzstrichformeln gezeichnet, da hier eine ionische Bindung vorliegt. Die Elektronen werden vollständig übertragen und die Ionen bilden
Zeichnen von Valenzstrichformeln ür anorganische Salze werden keine Valenzstrichformeln gezeichnet, da hier eine ionische Bindung vorliegt. Die Elektronen werden vollständig übertragen und die Ionen bilden
Grundlagen der Chemie Allgemeine Chemie Teil 2
 Allgemeine Chemie Teil 2 Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu AO-Theorie Wellenmechanik So wie Licht
Allgemeine Chemie Teil 2 Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu AO-Theorie Wellenmechanik So wie Licht
Atommodell. Atommodell nach Bohr und Sommerfeld Für sein neues Atommodell stellte Bohr folgende Postulate auf:
 Für sein neues Atommodell stellte Bohr folgende Postulate auf: Elektronen umkreisen den Kern auf bestimmten Bahnen, wobei keine Energieabgabe erfolgt. Jede Elektronenbahn entspricht einem bestimmten Energieniveau
Für sein neues Atommodell stellte Bohr folgende Postulate auf: Elektronen umkreisen den Kern auf bestimmten Bahnen, wobei keine Energieabgabe erfolgt. Jede Elektronenbahn entspricht einem bestimmten Energieniveau
Das quantenmechanische Atommodell
 Ende 93 konzipierte de Broglie seine grundlegenden Ideen über die Dualität von Welle und Korpuskel. Albert Einstein hatte schon 905 von den korpuskularen Eigenschaften des Lichtes gesprochen; de Broglie
Ende 93 konzipierte de Broglie seine grundlegenden Ideen über die Dualität von Welle und Korpuskel. Albert Einstein hatte schon 905 von den korpuskularen Eigenschaften des Lichtes gesprochen; de Broglie
Bindungstheorie Elektronenoktett durch Übertragung von Elektronen: Ionenbindung
 Bindungstheorie Elektronenoktett durch Übertragung von Elektronen: Ionenbindung al: (Elektronegativität: a 0.9 l 3.1) a (1s 2, 2s 2, 2p 6, 3s 1 ) a + (1s 2, 2s 2, 2p 6 ) + e eon-konfiguration l (1s 2,
Bindungstheorie Elektronenoktett durch Übertragung von Elektronen: Ionenbindung al: (Elektronegativität: a 0.9 l 3.1) a (1s 2, 2s 2, 2p 6, 3s 1 ) a + (1s 2, 2s 2, 2p 6 ) + e eon-konfiguration l (1s 2,
Wiederholung der letzten Vorlesungsstunde:
 Wiederholung der letzten Vorlesungsstunde: Chemische Bindungen, starke, schwache Bindungen, Elektronenpaarbindung, bindende und freie Elektronenpaare, Oktettregel, Edelgaskonfiguration, Lewis-Formeln,
Wiederholung der letzten Vorlesungsstunde: Chemische Bindungen, starke, schwache Bindungen, Elektronenpaarbindung, bindende und freie Elektronenpaare, Oktettregel, Edelgaskonfiguration, Lewis-Formeln,
Chemie für Bauingenieure Uebung 2
 Chemie für Bauingenieure Uebung 2 Aufgabe 1 i. Bestimmen Sie mithilfe des Periodensystems für folgende Elemente die Anzahl Elektronen, Protonen und Neutronen. ii. Bestimmen Sie dann für die jeweiligen
Chemie für Bauingenieure Uebung 2 Aufgabe 1 i. Bestimmen Sie mithilfe des Periodensystems für folgende Elemente die Anzahl Elektronen, Protonen und Neutronen. ii. Bestimmen Sie dann für die jeweiligen
41. Welches der folgenden Elemente zeigt die geringste Tendenz, Ionen zu bilden?
 41. Welches der folgenden Elemente zeigt die geringste Tendenz, Ionen zu bilden? A) Ca B) C C) F D) Na 42. Steinsalz löst sich in Wasser, A) weil beide Ionen Hydrathüllen bilden können B) es eine Säure
41. Welches der folgenden Elemente zeigt die geringste Tendenz, Ionen zu bilden? A) Ca B) C C) F D) Na 42. Steinsalz löst sich in Wasser, A) weil beide Ionen Hydrathüllen bilden können B) es eine Säure
Beschreiben Sie den Aufbau und die Eigenschaften der Kohlenwasserstoffe. Beschreiben Sie die Alkane allgemein.
 den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
Grundwissenkarten Hans-Carossa-Gymnasium. 9. Klasse. Chemie SG
 Grundwissenkarten Hans-Carossa-Gymnasium 9. Klasse Chemie SG Es sind insgesamt 18 Karten für die 9. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Grundwissenkarten Hans-Carossa-Gymnasium 9. Klasse Chemie SG Es sind insgesamt 18 Karten für die 9. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Basiskenntnistest - Chemie
 Basiskenntnistest - Chemie 1.) Welche Aussage trifft auf Alkohole zu? a. ) Die funktionelle Gruppe der Alkohole ist die Hydroxygruppe. b. ) Alle Alkohole sind ungiftig. c. ) Mehrwertige Alkohole werden
Basiskenntnistest - Chemie 1.) Welche Aussage trifft auf Alkohole zu? a. ) Die funktionelle Gruppe der Alkohole ist die Hydroxygruppe. b. ) Alle Alkohole sind ungiftig. c. ) Mehrwertige Alkohole werden
Radikalische Substitution von Alkanen
 adikalische Substitution von Alkanen KW mit sp³-hybridisierten C-Atomen (z.b. in Alkanen) und alogene Gemisch aus alogenalkanen und alogenwasserstoff Licht C n n à C n n1 eaktionsmechanismus z.b. Chlorierung
adikalische Substitution von Alkanen KW mit sp³-hybridisierten C-Atomen (z.b. in Alkanen) und alogene Gemisch aus alogenalkanen und alogenwasserstoff Licht C n n à C n n1 eaktionsmechanismus z.b. Chlorierung
1. Stoffe und Eigenschaften
 1. Stoffe und Eigenschaften Chemischer Vorgang Stoffänderung, keine Zustandsänderung Physikalischer Vorgang Lösung Zustandsänderung, keine Stoffänderung (z.b. Lösen, Aggregatzustände,...) Homogenes Gemisch
1. Stoffe und Eigenschaften Chemischer Vorgang Stoffänderung, keine Zustandsänderung Physikalischer Vorgang Lösung Zustandsänderung, keine Stoffänderung (z.b. Lösen, Aggregatzustände,...) Homogenes Gemisch
Chemie für Biologen. Vorlesung im. WS 2004/05 V2, Mi 10-12, S04 T01 A02. Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen
 Chemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen (Teil 2: 20.10.2004) MILESS: Chemie für Biologen 24 Aufbau
Chemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen (Teil 2: 20.10.2004) MILESS: Chemie für Biologen 24 Aufbau
3. Bausteine der Materie: Atomhülle. Form der Atomorbitale. s-orbitale kugelsymmetrische Elektronendichteverteilung
 3. Bausteine der Materie: Atomhülle Form der Atomorbitale s-orbitale kugelsymmetrische Elektronendichteverteilung 1s 2s 3d - Orbitale 3. Bausteine der Materie: Atomhülle 3. Bausteine der Materie: Atomhülle
3. Bausteine der Materie: Atomhülle Form der Atomorbitale s-orbitale kugelsymmetrische Elektronendichteverteilung 1s 2s 3d - Orbitale 3. Bausteine der Materie: Atomhülle 3. Bausteine der Materie: Atomhülle
Pentan enthält 12 Atome Wasserstoff, ein Wassermolekül 2 Atome. Es entstehen also 6 Moleküle Wasser:
 VERTIEFUNG Aufstellen und Einrichten von Gleichungen Reaktionsgleichungen fassen eine chemische Reaktion knapp zusammen. Es werden die Edukte (Ausgangsstoffe) angegeben, die in der chemischen Reaktion
VERTIEFUNG Aufstellen und Einrichten von Gleichungen Reaktionsgleichungen fassen eine chemische Reaktion knapp zusammen. Es werden die Edukte (Ausgangsstoffe) angegeben, die in der chemischen Reaktion
Vorkurs Allgemeine Chemie für Ingenieure und Biologen 20. Oktober 2015 Dr. Helmut Sitzmann, Apl.-Professor für Anorganische Chemie
 Vorkurs Allgemeine Chemie für Ingenieure und Biologen 20. Oktober 2015 Dr. Helmut Sitzmann, Apl.-Professor für Anorganische Chemie DIE CHEMISCHE BINDUNG Ionische Bindung, Beispiel Natriumchlorid Trifft
Vorkurs Allgemeine Chemie für Ingenieure und Biologen 20. Oktober 2015 Dr. Helmut Sitzmann, Apl.-Professor für Anorganische Chemie DIE CHEMISCHE BINDUNG Ionische Bindung, Beispiel Natriumchlorid Trifft
Elektronenkonfiguration
 Um die chemischen Eigenschaften von Elementen zu verstehen, muss man deren Elektronenkonfiguration kennen. Als Elektronenkonfiguration bezeichnet man die Verteilung der Elektronen auf Schalen um den Kern
Um die chemischen Eigenschaften von Elementen zu verstehen, muss man deren Elektronenkonfiguration kennen. Als Elektronenkonfiguration bezeichnet man die Verteilung der Elektronen auf Schalen um den Kern
3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen.
 Inhalt Index 3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1 Die Nomenklatur der Alkene Eine C=C Doppelbindung ist die funktionelle Gruppe, die
Inhalt Index 3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1 Die Nomenklatur der Alkene Eine C=C Doppelbindung ist die funktionelle Gruppe, die
Wiederholung der letzten Vorlesungsstunde:
 Wiederholung der letzten Vorlesungsstunde: Hybridisierung und Molekülstruktur, sp 3 -Hybridorbitale (Tetraeder), sp 2 - Hybridorbitale (trigonal planare Anordnung), sp-hybridorbitale (lineare Anordnung),
Wiederholung der letzten Vorlesungsstunde: Hybridisierung und Molekülstruktur, sp 3 -Hybridorbitale (Tetraeder), sp 2 - Hybridorbitale (trigonal planare Anordnung), sp-hybridorbitale (lineare Anordnung),
Chemische Bindung. Ue Mol 1. fh-pw
 Ue Mol 1 Chemische Bindung Periodensystem - Atome - Moleküle Periodensystem(e) 3 Nichtmetalle - Metalloide 5 Eigenschaften der Elemente 6 Bindungstypen 7 Ionenbindung 8 Kovalente, homöopolare Bindung 10
Ue Mol 1 Chemische Bindung Periodensystem - Atome - Moleküle Periodensystem(e) 3 Nichtmetalle - Metalloide 5 Eigenschaften der Elemente 6 Bindungstypen 7 Ionenbindung 8 Kovalente, homöopolare Bindung 10
Grundwissen 9. Klasse Chemie
 Grundwissen 9. Klasse Chemie 1. Formelzeichen und Einheiten 2. Was versteht man unter der Stoffmenge und der Avogadro- Konstante N A? Eine Stoffportion hat die Stoffmenge n = 1 mol, wenn sie 6 * 10 23
Grundwissen 9. Klasse Chemie 1. Formelzeichen und Einheiten 2. Was versteht man unter der Stoffmenge und der Avogadro- Konstante N A? Eine Stoffportion hat die Stoffmenge n = 1 mol, wenn sie 6 * 10 23
Die Einheit der Atommasse m ist u. Das ist der 12. Teil der Masse eines Kohlenstoffatoms. 1 u = 1,6608 * 10-27 kg m(h) = 1 u
 Analytische Chemie Stöchiometrie Absolute Atommasse Die Einheit der Atommasse m ist u. Das ist der 12. Teil der Masse eines Kohlenstoffatoms. 1 u = 1,6608 * 10-27 kg m() = 1 u Stoffmenge n Die Stoffmenge
Analytische Chemie Stöchiometrie Absolute Atommasse Die Einheit der Atommasse m ist u. Das ist der 12. Teil der Masse eines Kohlenstoffatoms. 1 u = 1,6608 * 10-27 kg m() = 1 u Stoffmenge n Die Stoffmenge
Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag)
 Pharmazeutische Chemie Seite 1 Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag) Fragen zu der sp³ Hybridisierung (S. 124-128): 1.) Notieren Sie die Elektronenverteilung
Pharmazeutische Chemie Seite 1 Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag) Fragen zu der sp³ Hybridisierung (S. 124-128): 1.) Notieren Sie die Elektronenverteilung
Grundlagen. Maximilian Ernestus Waldorfschule Saarbrücken
 Grundlagen Maximilian Ernestus Waldorfschule Saarbrücken 2008/2009 Inhaltsverzeichnis 1 Chemische Elemente 2 2 Das Teilchenmodell 3 3 Mischungen und Trennverfahren 4 4 Grundgesetze chemischer Reaktionen
Grundlagen Maximilian Ernestus Waldorfschule Saarbrücken 2008/2009 Inhaltsverzeichnis 1 Chemische Elemente 2 2 Das Teilchenmodell 3 3 Mischungen und Trennverfahren 4 4 Grundgesetze chemischer Reaktionen
Organische Chemie. Kohlenwasserstoffe. Alkane. Alkane
 1 1 Organische Chemie beschäftigt sich mit Verbindungen, die C- Atome enthalten 2 2 Kohlenwasserstoffe bestehen ausschließlich aus C- und H- Atomen 3 3 es existieren nur C-H Einfachbindungen C-C Einfachbindung
1 1 Organische Chemie beschäftigt sich mit Verbindungen, die C- Atome enthalten 2 2 Kohlenwasserstoffe bestehen ausschließlich aus C- und H- Atomen 3 3 es existieren nur C-H Einfachbindungen C-C Einfachbindung
Hybridorbitale und ihre Bedeutung
 Hybridorbitale und ihre Bedeutung Roland Heynkes 27.4.2005, Aachen Die Chemie wird kaum von den Atomkernen und den inneren Elektronenschalen, sondern hauptsächlich von der jeweils äußersten Elektronenschale
Hybridorbitale und ihre Bedeutung Roland Heynkes 27.4.2005, Aachen Die Chemie wird kaum von den Atomkernen und den inneren Elektronenschalen, sondern hauptsächlich von der jeweils äußersten Elektronenschale
VERTIEFUNG. Die Funktionsweise einer Brennstoffzelle
 Die Funktionsweise einer Brennstoffzelle VERTIEFUNG Die folgenden Abbildungen sollen dir helfen, die Vorgänge zu verstehen, die in der Brennstoffzelle ablaufen. Arbeitsauftrag: Beschreibe jeweils die dargestellten
Die Funktionsweise einer Brennstoffzelle VERTIEFUNG Die folgenden Abbildungen sollen dir helfen, die Vorgänge zu verstehen, die in der Brennstoffzelle ablaufen. Arbeitsauftrag: Beschreibe jeweils die dargestellten
10. Chemische Bindung
 10. Chemische Bindung 10.1 Hybridisierung 10.2 Massenwirkungsgesetz 10.1 van de Waals Bindung van de Waals-Wechselwirkung wirkt zwischen neutralen inerten Atomen/Molekülen (z.b. Edelgas- Atome) ohne permanentes
10. Chemische Bindung 10.1 Hybridisierung 10.2 Massenwirkungsgesetz 10.1 van de Waals Bindung van de Waals-Wechselwirkung wirkt zwischen neutralen inerten Atomen/Molekülen (z.b. Edelgas- Atome) ohne permanentes
Atombau, Periodensystem der Elemente
 Seminar zum Brückenkurs Chemie 2015 Atombau, Periodensystem der Elemente Dr. Jürgen Getzschmann Dresden, 21.09.2015 1. Aufbau des Atomkerns und radioaktiver Zerfall - Erläutern Sie den Aufbau der Atomkerne
Seminar zum Brückenkurs Chemie 2015 Atombau, Periodensystem der Elemente Dr. Jürgen Getzschmann Dresden, 21.09.2015 1. Aufbau des Atomkerns und radioaktiver Zerfall - Erläutern Sie den Aufbau der Atomkerne
Ausarbeitung zum Theoretischen Seminar
 Ausarbeitung zum Theoretischen Seminar Kovalente Molekübindungen 28.01.2015 Robin.Stegmueller@googlemail.com Inhaltsverzeichnis 1 Einführung 1 1.1 Molekulare Bindungen......................... 1 1.2 Beispiel:
Ausarbeitung zum Theoretischen Seminar Kovalente Molekübindungen 28.01.2015 Robin.Stegmueller@googlemail.com Inhaltsverzeichnis 1 Einführung 1 1.1 Molekulare Bindungen......................... 1 1.2 Beispiel:
22. Chemische Bindungen
 .05.03. Chemische Bindungen Molekül: System aus zwei oder mehr Atomen Kleinste Einheit einer Substanz, die deren chemische Eigenschaften ausweist Quantenmechanisches Vielteilchensystem: Exakte explizite
.05.03. Chemische Bindungen Molekül: System aus zwei oder mehr Atomen Kleinste Einheit einer Substanz, die deren chemische Eigenschaften ausweist Quantenmechanisches Vielteilchensystem: Exakte explizite
 INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
3 Mehrelektronensysteme
 3.1 Lernziele 1. Sie sind in der Lage, den Aufbau des Periodensystems nachzuvollziehen. 2. Sie können die Elektronenverteilung eines Atoms angeben, wenn Sie seine Elektronenanzahl kennen. 3. Sie können
3.1 Lernziele 1. Sie sind in der Lage, den Aufbau des Periodensystems nachzuvollziehen. 2. Sie können die Elektronenverteilung eines Atoms angeben, wenn Sie seine Elektronenanzahl kennen. 3. Sie können
Daltonsche Atomhypothese (1808)
 Daltonsche Atomhypothese (1808) Chemische Elemente bestehen aus kleinsten, chemisch nicht weiter zerlegbaren Teilchen, den Atomen. Alle Atome eines Elementes haben untereinander gleiche Masse, während
Daltonsche Atomhypothese (1808) Chemische Elemente bestehen aus kleinsten, chemisch nicht weiter zerlegbaren Teilchen, den Atomen. Alle Atome eines Elementes haben untereinander gleiche Masse, während
Chemische Bindung. Wie halten Atome zusammen? Welche Atome können sich verbinden? Febr 02
 Chemische Bindung locker bleiben Wie halten Atome zusammen? positiv Welche Atome können sich verbinden? power keep smiling Chemische Bindung Die chemischen Reaktionen spielen sich zwischen den Hüllen der
Chemische Bindung locker bleiben Wie halten Atome zusammen? positiv Welche Atome können sich verbinden? power keep smiling Chemische Bindung Die chemischen Reaktionen spielen sich zwischen den Hüllen der
Grundlagen der organischen Chemie
 Heinz Kaufmann Grundlagen der organischen Chemie Fünfte Auflage FACHBEREICH I.;-BIOLOGI - BibHolhek - SchnjttspahhstraSe 10 v D-64287 Darmstadt Birkhäuser Verlag, Basel und Stuttgart Inhaltsverzeichnis
Heinz Kaufmann Grundlagen der organischen Chemie Fünfte Auflage FACHBEREICH I.;-BIOLOGI - BibHolhek - SchnjttspahhstraSe 10 v D-64287 Darmstadt Birkhäuser Verlag, Basel und Stuttgart Inhaltsverzeichnis
Stoff, Reinstoff, Gemisch, homogenes Gemisch, heterogenes Gemisch. Reinstoff, Element, Verbindung. Zweiatomige Elemente.
 1 1 Einteilung der Stoffe: Stoff, Reinstoff, Gemisch, homogenes Gemisch, heterogenes Gemisch Stoff Reinstoff Mischen Gemisch Bei gleichen Bedingungen (Temperatur, Druck) immer gleiche Eigenschaften (z.b.
1 1 Einteilung der Stoffe: Stoff, Reinstoff, Gemisch, homogenes Gemisch, heterogenes Gemisch Stoff Reinstoff Mischen Gemisch Bei gleichen Bedingungen (Temperatur, Druck) immer gleiche Eigenschaften (z.b.
Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler
 Prof. Dr. J. Christoffers Institut für Organische Chemie Universität Stuttgart 29.04.2003 Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. Einführung 2.
Prof. Dr. J. Christoffers Institut für Organische Chemie Universität Stuttgart 29.04.2003 Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. Einführung 2.
Element. Verbindung. Reinstoff. homogenes Gemisch
 Element Reinstoff, der chemisch nicht mehr zersetzt werden kann und dessen Teilchen(Atome oder Moleküle) aus einer einzigen Atomart (d.h. Teilchen mit gleicher Ordnungszahl) besteht. Verbindung Reinstoff,
Element Reinstoff, der chemisch nicht mehr zersetzt werden kann und dessen Teilchen(Atome oder Moleküle) aus einer einzigen Atomart (d.h. Teilchen mit gleicher Ordnungszahl) besteht. Verbindung Reinstoff,
