225. Stellungnahme der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe (DGGG)
|
|
|
- Ingelore Gärtner
- vor 6 Jahren
- Abrufe
Transkript
1 DGGG e.v. Hausvogteiplatz Berlin Präsident Prof. Dr. Diethelm Wallwiener Ärztlicher Direktor Universitäts-Frauenklinik Tübingen Repräsentanz der DGGG und Fachgesellschaften Hausvogteiplatz 12 D Berlin Telefon: +49 (0) Telefax: +49 (0) info@dggg.de DGGG-Stellungnahmensekretariat Frauenklinik Universitätsklinikum Erlangen Universitätsstraße Erlangen Telefon: +49 (0) (0) Telefax: +49 (0) fk-dggg-stellungnahmen@ukerlangen.de Stellungnahme der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe (DGGG) für die zur Erprobung Magnetresonanztomographie-gesteuerte hochfokussierte Ultraschalltherapie zur Behandlung des Uterusmyoms (MRgFUS-TUF) Überlegungen des G-BA zu den Eckpunkten Zielsetzung Um den Gemeinsamen Bundesausschuss (G-BA) in die Lage zu versetzen, eine abschließende Bewertung des Nutzens der MRgFUS-TUF durchzuführen, sollen im Wege der Erprobung die hierfür nach den 135 Absatz 1, 137c SGB V i.v.m. den Vorgaben der Verfahrensordnung des G-BA (VerfO) notwendigen Erkenntnisse für die Bewertung des Nutzens der Methode gewonnen werden. Die hierfür notwendige Studie soll durch eine unabhängige wissenschaftliche Institution nach Maßgabe dieser Richtlinie entworfen, durchgeführt und ausgewertet werden. Die Ausgestaltung des Studiendesigns ist soweit nicht im Folgenden näher bestimmt von der unabhängigen wissenschaftlichen Institution auf der Basis des Die DGGG hat als wissenschaftliche Gesellschaft großes Interesse an der Erprobung dieser potenziell nutzenbringenden, nicht-invasiven Intervention mit engem Indikationsspektrum. Grundsätzlich soll die Indikation zur Behandlung wegen symptomatischem Uterus myomatosus durch einen Facharzt für Gynäkologie und Geburtshilfe gestellt werden. Dies ist in zahlreichen interdisziplinär mit Vertretern der radiologischen Fachgesellschaft verfassten Stellungnahmen zur Uterusarterienembolisation (UAE) festgehalten worden. Das Studiendesign zur Erprobung der MRgFUS-TUF sollte unter Beteiligung von wissenschaftlichen Vertretern der Frauenheilkunde ausgestaltet werden. Die DGGG benennt auf Anfrage solche Exper- Repräsentanz der DGGG und Fachgesellschaften Hausvogteiplatz 12 D Berlin Telefon: +49 (0) Telefax +49 (0) info@dggg.de \\ \Frauen-Data$\DGGG-Leitlinien\Neue Archivierung\Stellungsnahmen Und Handlungsempfehlungen\MRT US-Therapie Zur Beh. Des Uterusmyoms\224 Stellungnahme Zur MRT US-Therapie Zur Behandl Des Uterusmyoms.Docx
2 Überlegungen des G-BA zu den Eckpunkten Standes der wissenschaftlichen Erkenntnisse vorzunehmen und zu begründen. Bei der Erstellung des Studienprotokolls sind die Vorschläge der an den Kosten beteiligten Unternehmer zu berücksichtigen; das Wirtschaftlichkeitsprinzip ist zu beachten. Fragestellung Die Erprobung soll der Beantwortung der Frage dienen, ob bei Patientinnen mit symptomatischen und medikamentös nicht ausreichend therapiebaren Uterusmyomen (Population) die MRgFUS-TUF (Intervention) im Vergleich zur Myomektomie (Vergleich) patientenrelevante Vorteile als weniger belastendes Therapieverfahren bei gleichzeitig ebenso guter Symptomlinderung bietet, so dass der Schluss auf einen therapeutischen Nutzen dieser Methode zulässig ist. Population (1) In die Erprobungsstudie sollen nur Frauen mit symptomatischen und medikamentös nicht ausreichend therapierbaren Uterusmyomen, die auf dem Symptom Severity Score (SSS) des Uterine Fibroid Symptom and Quality of Life Questionnaire (UFS-QoL) mindestens einen Punktwert von 40 erzielen, eingeschlossen werden. Die Zahl der therapiebedürftigen Myome darf fünf und das Gesamt- Myom-Volumen 500 ml nicht überschreiten. Die Frauen müssen sowohl für eine Behandlung mit MRgFUS-TUF als auch für eine Myomektomie geeignet sein. ten. Die Zielsetzung der Richtlinie ist wichtig und wird von der DGGG befürwortet. Die notwendigen Erkenntnisse für die Bewertung des Nutzens der MRgFUS-TUF im wissenschaftlich sinnvollen Vergleich zum Goldstandard der Myomektomie sollten gewonnen werden. Der patientenrelevante Nutzen bei der erfolgreichen Linderung der Symptome (irreguläre Blutungen, unerfüllter Kinderwunsch, Schmerzen, Lebensqualität), müssen im Vordergrund stehen und sind als primäres Studienziel zu formulieren. In der Nutzen-Risiko-Abwägung ist für die Patientinnen der Schweregrad und die Häufigkeit höhergradiger postinterventioneller Komplikationen von besonderem Interesse. Diese Komplikationen sollten in einem standardisierten Verfahren (z.b. Clavien Dindo, Geburtshilfe Frauenheilkd Aug;74(8): ) für beide Verfahren erfasst werden. Spätkomplikationen wie venöse Thrombembolien (z. B. VTE im Zusammenhang mit fortbestehendem Myom ohne signifikante Volumenreduktion nach MRgFUS-TUF) sollten über den gesamten Beobachtungszeitraum erfasst werden. Die Population ist sinnvoll definiert. Die Indikation zur MRgFUS-TUF wird sehr eng gestellt, wegen zahlreicher absoluter und relativer Kontraindikationen der MRg- FUS-TUF. Aspekte der präoperativen Unsicherheit hinsichtlich der Dignität des uterinen Tumors sollten Berücksichtigung finden (Positionspapier der DGGG Geburtshilfe Frauenheilkd Feb;75(2): ). 2
3 Überlegungen des G-BA zu den Eckpunkten (2) Die Ein- und Ausschlusskriterien (z. B. Alter, Komorbiditäten, Vorerkrankungen) sind so festzulegen, dass eine Übertragbarkeit der Ergebnisse auf die Zielpopulation gemäß Absatz 1 ermöglicht wird. Intervention und Vergleichsintervention (Kontrolle) (1) Die Studienbehandlung (Intervention) ist die MRgFUS-TUF. Die Behandlung kann auf zwei Therapiesitzungen verteilt werden. (2) Die angemessene Vergleichsintervention ist die offen chirurgische, laparoskopische oder hysteroskopische Myomektomie. Endpunkte (1) Primärer Endpunkt ist die Zeit bis zur Rückkehr zu normalen Aktivitäten. Für die Erhebung dieses Endpunkts sind möglichst eindeutige Kriterien festzulegen. (2) Als sekundäre Endpunkte sind jedenfalls die Rate an Patientinnen, die eine a priori als klinisch relevant zu definierende Verringerung im SSS des UFS- QoL erreichen, die Krankenhausverweildauer, Schmerz, unerwünschte Ereignisse, Anzahl an Reinterventionen, gesundheitsbezogene Lebensqualität und die Anzahl von Schwangerschaften und Lebendgeburten zu erfassen. (3) Die Erhebung weiterer Endpunkte ist jeweils zu begründen. Studientyp und Beobachtungszeitraum (1) Bei der Erprobungsstudie muss es sich um eine randomisierte, kontrollierte Studie handeln. Die Studie soll multizentrisch durchgeführt werden. (2) Die Personen, die die Endpunkte erheben, müssen vollständig gegen die Intervention verblindet sein. (3) Bei Studieneinschluss sind insbe- Für die Vergleichintervention gemäß Absatz 2 kann die Kombination aus 2 Verfahren, evt. auch zweizeitig, erforderlich sein, z. B. die Kombination aus Hysteroresektoskopie und Laparoskopie. Dies sollte für die Vergleichintervention ebenso möglich sein wie für die Studienintervention. Da der Nutzen für die Betroffenen in der nachhaltigen Symptomenkontrolle liegt, ist der hier als primärer Endpunkt formulierte als ein sekundärer Endpunkt einzustufen. Primärer Endpunkt soll die Rate an Patientinnen, die nach 12 Monaten eine a priori als klinisch relevant zu definierende Verringerung im SSS des UFS-QoL erreicht haben, sein. Die Krankenhausverweildauer ist durch die Verknüpfung mit den in den DRGhinterlegten Verweildauern schwer interpretierbar, es sei denn, im Rahmen der Studie erfahren die Leistungserbringer keine wirtschaftlichen Nachteile durch eine Entlassung beispielsweise vor Erreichen der unteren Grenzverweildauer. Das Studiendesign erscheint sinnvoll. Die Verblindung von Personen unter Absatz 2 ist nicht unproblematisch, da die Patientin ihre Behandlungsmethode kennt. Die Nachbeobachtungszeit hinsichtlich des Therapieerfolgs ist besonders wichtig. Da je nach Patientenalter das Rezidivrisi- 3
4 Überlegungen des G-BA zu den Eckpunkten sondere die Ausgangswerte der Endpunktparameter und die Charakteristika der Patientenpopulation zu erfassen. Weitere Messzeitpunkte sind a priori festzulegen; dabei ist eine ausreichend lange Nachbeobachtungszeit zu gewährleisten, um so eine Aussage über eine hinreichende Langzeitwirkung der Intervention zu ermöglichen. Sächliche, personelle und sonstige Anforderungen an die Qualität der Studiendurchführung Es ist sicherzustellen, dass in jedem Studienzentrum die Behandlung gemäß dem Studienprotokoll unter Berücksichtigung aller erforderlichen anerkannten, nach ethischen und wissenschaftlichen Gesichtspunkten aufgestellten Regeln für die Durchführung von klinischen Studien erfolgt. ko ab 3 Jahren nach der Intervention deutlich steigt, sollten die Kontrollen nach 1, 3 und 5 Jahren erfolgen. (Eur J Obstet Gynecol Reprod Biol Sep;180:35-9) Für die Qualität der Studiendurchführung ist die Qualität der durchgeführten Methoden von besonderer Bedeutung. Vorgesehen sind für die MRgFUS-TUF 7 Krankenhäuser mit der entsprechenden gerätetechnischen Ausstattung ihrer jeweiligen radiologischen Abteilung mit offenbar fallzahlenmäßig großer Expertise. Auf gynäkologisch-operativer Seite sollten entsprechend Kliniken mit wissenschaftlichem Schwerpunkt auf dem Gebiet der Myombehandlung mit hoher Fallzahl und Erfahrung in umfassender gynäkologischer Aufklärung der Patientinnen im Rahmen einer präinterventionellen Sprechstunde als Studienzentren gewonnen werden. Da die MRgFUS-TUF nur an wenigen Krankenhäusern etabliert ist, sollte erwogen werden, Gynäkologische Kliniken an Krankenhäusern ohne Möglichkeit einer MRgFUS-TUF als Studienzentren aufzunehmen. Anforderungen an die Durchführung, wissenschaftliche Begleitung und Auswertung der Erprobung (1) Die Methoden und Ergebnisse der Erprobungsstudie sind umfassend nach Abschluss der Studie öffentlich zugänglich zu machen. Hierzu sind die Ergebnisse der Erprobung spätestens 3 Monate nach Abnahme des Studienberichtes durch den G-BA von der unabhängigen wissenschaftlichen Institution zur Veröffentlichung in einer internationalen Fachzeitschrift, deren Beiträge einem wissenschaftlichen Begutachtungsprozess (sog. Peer-Review) unterzogen werden, einzu- Die DGGG hält diese Anforderungen für sinnvoll. 4
5 Überlegungen des G-BA zu den Eckpunkten reichen. (2) Nähere Bestimmungen zu Durchführung, wissenschaftlicher Begleitung und Auswertung können im Rahmen der Beauftragung einer unabhängigen wissenschaftlichen Institution entsprechend 2. Kapitel 25 VerfO vertraglich festgelegt werden. Studienkosten und Kostenbeteiligung Beruht die technische Anwendung der Methode maßgeblich auf dem Einsatz eines Medizinprodukts, darf der G-BA einen Beschluss zur Erprobung nur dann fassen, wenn sich die Hersteller dieses Medizinprodukts oder Unternehmen, die in sonstiger Weise als Anbieter der Methode ein wirtschaftliches Interesse an einer Erbringung zulasten der Krankenkassen haben, zuvor gegenüber dem G-BA bereit erklären, die Kosten der wissenschaftlichen Begleitung und Auswertung einschließlich derjenigen zur Erstellung des Studienprotokolls (sog. Studienoverhead; im Folgenden: Overheadkosten) in angemessenem Umfang zu übernehmen ( 137e Absatz 6 SGB V). Im Falle der hier zu planenden Studie trifft es zu, dass die technische Anwendung der gegenständlichen Behandlungsmethode maßgeblich auf dem Einsatz eines Medizinprodukts beruht. Der Kostenanteil ist als angemessen anzusehen, wenn die beteiligten Unternehmen jeweils den Anteil der Overheadkosten tragen, welcher auf die Untersuchung der Methode unter Verwendung der von ihnen hergestellten oder angebotenen Medizinprodukte entfällt. Zu diesem Anteil zählen bei Vergleichsstudien auch die (bei mehreren zu vergleichenden Methoden: anteiligen) Overheadkosten bezüglich der Untersuchung der Vergleichsintervention. Beteiligen sich mehrere Unternehmen an der Finanzierung einer Methode, deren technische Anwendung auf dem Einsatz desselben Medizinprodukts beruht, so werden die Overheadkosten nach gleichen Anteilen auf diese Beteiligten verteilt. Die nach dieser Aufteilung grundsätzlich zu tragenden Kosten können, soweit sie nicht die Kosten zur Erstellung des Studienprotokolls betreffen, auf Antrag ermäßigt werden. Eine solche Ermäßigung ist vorgesehen zum einen für kleine und mittelständische Unternehmen und zum anderen für die Erprobung von Methoden, deren Anwendung auf seltene Erkrankungen beschränkt ist. Die Kostenanteile der übrigen beteiligten Unternehmen bleiben von einer danach verminderten Kostentragung unberührt. 5
6 Erste Schätzung der Overheadkosten der Erprobungsstudie Für klinische Studien mittlerer Größe (100 bis 500 Teilnehmer) und hohen Aufwands lässt sich nach Angaben der Koordinierungszentren für Klinische Studien (KKS-Netzwerk) der studienspezifische Mehraufwand in Höhe von etwa 5000 je Teilnehmer schätzen. Bei großen Studien (> 500 Teilnehmer) liegt er geschätzt bei etwa 3000 je Teilnehmer. Nach des G-BA bedingt die hier zu planende Studie einen hohen Aufwand je Probandin. Es kann grob angenommen werden, dass etwa 30 % bis 40 % der Patientinnen 12 Monate nach MRgFUS-TUF eine Verbesserung von etwa 25 Punkten im SSS erreichen, während dies im Vergleichsarm möglicherweise in 60 % bis 70 % der Fall ist. Unter den üblichen Annahmen (Signifikanzniveau 5 %, Power 90 %) ergibt sich, dass zwischen 80 und 676 Patientinnen benötigt werden, um bei den in der nachstehenden Tabelle dargestellten Erfolgsraten nachweisen zu können, dass der Unterschied in den Erfolgsraten kleiner als 50 Prozentpunkte beträgt. Die große Spanne an möglichen Fallzahlen ergibt sich maßgeblich wegen der großen benötigten Fallzahl für Szenario 2a. Dort wird eine Unterlegenheit der Interventionsgruppe gegenüber der Vergleichsgruppe von 40 Prozentpunkten (70 % 30 %) angenommen. Diese Unterlegenheit ist sehr nahe an der Nichtunterlegenheitsgrenze von 50 Prozentpunkten angelegt. Daher ist eine große Fallzahl (und damit hohe Präzision) notwendig, um die Nichtunterlegenheit nachzuweisen. Tabelle: Fallzahlplanung für eine Nichtunterlegenheitsschwelle von 50 Prozentpunkten zu einem Signifikanzniveau von α = 5 % und einer Power von 1 β = 90 % Parameter Erfolgsrate in Interventionsgruppe Erfolgsrate in Vergleichsgruppe Erforderliche Fallzahl n (nach Farrington 1990) Szenario 1a Szenario 1b Szenario 2a Szenario 2b 30 % 40 % 30 % 40 % 60 % 60 % 70 % 70 % Auf der Basis dieser Annahmen werden die Overheadkosten auf etwa 0,4 Millionen (Szenario 1b), 0,9 Millionen (Szenarien 1a und 2b) beziehungsweise 2,0 Millionen (Szenario 2a) geschätzt. Wie lautet Ihre? Die DGGG teilt diese hinsichtlich der Kosten. Als Studienzentren sollten in erster Linie universitäre Non-profit- Einrichtungen mit entsprechender, vorgehaltener Infrastruktur für klinischen Studie avisiert werden. Hinsichtlich der benötigten Studienteilnehmerinnen ist das Szenario 2a realistisch. Aufgrund der hohen Therapieerfolgsrate und der hohen Zufriedenheit der Patientinnen mit dem Standardverfahren der Myomektomie auch bei peri- und postmenopausalen Patientinnen (Eur J Obstet Gynecol Reprod Biol Jun;162(2):192-6) ist von einer Erfolgsrate von mindestens 70% auszugehen. Da die Wahrscheinlichkeit für eine Erfolgsrate von 30% in der Interventionsgruppe hoch ist, sollte von dem Szenario 2a ausgegangen werden. 6
7 Literaturverzeichnis Nr. Feldbezeichnung Text Radosa MP, Meyberg-Solomayer G, Radosa J, Vorwergk J, Oettler K, Mothes A, Baum S, Juhasz-Boess I, Petri E, Solomayer EF, Runnebaum IB Standardised Registration of Surgical Complications in Laparoscopic-Gynaecological Therapeutic Procedures Using the Clavien-Dindo Classification. Geburtshilfe Frauenheilkd Aug;74(8): Beckmann MW, Juhasz-Böss I, Denschlag D, Gaß P, Dimpfl T, Harter P, Mallmann P, Renner SP, Rimbach S, Runnebaum I, Untch M, Brucker SY, Wallwiener D. Surgical Methods for the Treatment of Uterine Fibroids - Risk of Uterine Sarcoma and Problems of Morcellation: Position Paper of the DGGG. Geburtshilfe Frauenheilkd Feb;75(2): Radosa MP, Owsianowski Z, Mothes A, Weisheit A, Vorwergk J, Asskaryar FA, Camara O, Bernardi TS, Runnebaum IB. Long-term risk of fibroid recurrence after laparoscopic myomectomy. Eur J Obstet Gynecol Reprod Biol Sep;180:35-9. Radosa MP, Winzer H, Mothes AR, Camara O, Diebolder H, Weisheit A, Runnebaum IB. Laparoscopic myomectomy in peri- and post-menopausal women is safe, efficacious and associated with long-term patient satisfaction. Eur J Obstet Gynecol Reprod Biol Jun;162(2):
8 Die Stellungnahme wurde von Herrn Prof. Dr. Ingo Runnebaum, Klinik für Frauenheilkunde und Geburtshilfe, Universitätsklinikum Jena erstellt. Herzliche kollegiale Grüße Prof. Dr. Diethelm Wallwiener Präsident der DGGG e.v. Prof. Dr. Matthias W. Beckmann Leitlinienbeauftragter DGGG 8
BAnz AT B4. Bekanntmachung
 Bekanntmachung des Gemeinsamen Bundesausschusses (G-BA) 1. über die Aufnahme von Beratungen über eine Richtlinie zur Erprobung der transkutanen Vagusnervstimulation bei pharmakoresistenter Epilepsie sowie
Bekanntmachung des Gemeinsamen Bundesausschusses (G-BA) 1. über die Aufnahme von Beratungen über eine Richtlinie zur Erprobung der transkutanen Vagusnervstimulation bei pharmakoresistenter Epilepsie sowie
des Gemeinsamen Bundesausschusses zur Erprobung der allogenen Stammzelltransplantation bei Multiplem Myelom jenseits der Erstlinientherapie
 Richtlinie des Gemeinsamen Bundesausschusses zur Erprobung der allogenen Stammzelltransplantation bei Multiplem Myelom jenseits der Erstlinientherapie (Erprobungs-Richtlinie Stammzelltransplantation bei
Richtlinie des Gemeinsamen Bundesausschusses zur Erprobung der allogenen Stammzelltransplantation bei Multiplem Myelom jenseits der Erstlinientherapie (Erprobungs-Richtlinie Stammzelltransplantation bei
*Abzugrenzen davon sind nicht MR-gesteuerte Verfahren zur Verwendung des fokussierten Ultraschalls
 DGGG e.v. Hausvogteiplatz 12 10117 Berlin Präsident Prof. Dr. Diethelm Wallwiener Ärztlicher Direktor Universitäts-Frauenklinik Tübingen Repräsentanz der DGGG und Fachgesellschaften Hausvogteiplatz 12
DGGG e.v. Hausvogteiplatz 12 10117 Berlin Präsident Prof. Dr. Diethelm Wallwiener Ärztlicher Direktor Universitäts-Frauenklinik Tübingen Repräsentanz der DGGG und Fachgesellschaften Hausvogteiplatz 12
Die künftige Finanzierung von Medizintechnik und Innovationen im Gesundheitswesen: Was geht?
 Die künftige Finanzierung von Medizintechnik und Innovationen im Gesundheitswesen: Was geht? Isabel Henkel Director Access & Reimbursement Johnson & Johnson Medical GmbH, Germany Marktzugang Erstattung
Die künftige Finanzierung von Medizintechnik und Innovationen im Gesundheitswesen: Was geht? Isabel Henkel Director Access & Reimbursement Johnson & Johnson Medical GmbH, Germany Marktzugang Erstattung
Das Bewertungsverfahren des G-BA nach 137h SGB V für neue Methoden mit Medizinprodukten hoher Risikoklasse. Einbettung in die Methodenbewertung
 Das Bewertungsverfahren des G-BA nach 137h SGB V für neue Methoden mit Medizinprodukten hoher Risikoklasse Informationsveranstaltung am 20. Mai 2016 Einbettung in die Methodenbewertung Dr. Dietrich Sonntag
Das Bewertungsverfahren des G-BA nach 137h SGB V für neue Methoden mit Medizinprodukten hoher Risikoklasse Informationsveranstaltung am 20. Mai 2016 Einbettung in die Methodenbewertung Dr. Dietrich Sonntag
Präambel. Präsident Prof. Dr. Diethelm Wallwiener Ärztlicher Direktor Universitäts-Frauenklinik Tübingen
 DGGG e.v. Hausvogteiplatz 12 10117 Berlin Präsident Prof. Dr. Diethelm Wallwiener Ärztlicher Direktor Universitäts-Frauenklinik Tübingen Repräsentanz der DGGG und Fachgesellschaften Hausvogteiplatz 12
DGGG e.v. Hausvogteiplatz 12 10117 Berlin Präsident Prof. Dr. Diethelm Wallwiener Ärztlicher Direktor Universitäts-Frauenklinik Tübingen Repräsentanz der DGGG und Fachgesellschaften Hausvogteiplatz 12
236. Stellungnahme der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe (DGGG)
 DGGG e.v. Hausvogteiplatz 12 10117 Berlin Institut für Qualität und Transparenz im Gesundheitswesen (IQTiG) Präsident Prof. Dr. Diethelm Wallwiener Ärztlicher Direktor Universitäts-Frauenklinik Tübingen
DGGG e.v. Hausvogteiplatz 12 10117 Berlin Institut für Qualität und Transparenz im Gesundheitswesen (IQTiG) Präsident Prof. Dr. Diethelm Wallwiener Ärztlicher Direktor Universitäts-Frauenklinik Tübingen
Statistische Überlegungen: Eine kleine Einführung in das 1 x 1
 Statistische Überlegungen: Eine kleine Einführung in das 1 x 1 PD Dr. Thomas Friedl Klinik für Frauenheilkunde und Geburtshilfe, Universitätsklinikum Ulm München, 23.11.2012 Inhaltsübersicht Allgemeine
Statistische Überlegungen: Eine kleine Einführung in das 1 x 1 PD Dr. Thomas Friedl Klinik für Frauenheilkunde und Geburtshilfe, Universitätsklinikum Ulm München, 23.11.2012 Inhaltsübersicht Allgemeine
Dossierbewertung A11-30 Version 1.0 Apixaban Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat mit Schreiben vom 14.12.2011 das IQWiG mit der Nutzenbewertung des Wirkstoffs Apixaban gemäß 35a SGB V beauftragt. Die Bewertung
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat mit Schreiben vom 14.12.2011 das IQWiG mit der Nutzenbewertung des Wirkstoffs Apixaban gemäß 35a SGB V beauftragt. Die Bewertung
BAnz AT 10.07.2013 B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über Maßnahmen zur Qualitätssicherung bei der Enukleation der Prostata mittels Thulium-Laser (TmLEP) zur Behandlung des benignen Prostatasyndroms (BPS) 21. März
Beschluss des Gemeinsamen Bundesausschusses über Maßnahmen zur Qualitätssicherung bei der Enukleation der Prostata mittels Thulium-Laser (TmLEP) zur Behandlung des benignen Prostatasyndroms (BPS) 21. März
Delegiertenkonferenz der AWMF. Frankfurt/Main,
 Delegiertenkonferenz der AWMF Frankfurt/Main, 05.11.2016 Die Medizinproduktemethoden-Bewertung nach 137h SGB V - Wie kommt das Wissen in den Prozess? RA Andreas Propp Justiziar Gliederung I. Rechtsgrundlage
Delegiertenkonferenz der AWMF Frankfurt/Main, 05.11.2016 Die Medizinproduktemethoden-Bewertung nach 137h SGB V - Wie kommt das Wissen in den Prozess? RA Andreas Propp Justiziar Gliederung I. Rechtsgrundlage
Genereller Verfahrensablauf
 Genereller Verfahrensablauf - Antrag auf Erprobung gem. 137e Abs. 7 SGB V - Antrag auf Beratung gem. 137e Abs. 8 SGB V Informationsveranstaltung G-BA 15. April 2013 Dr. Edith Pfenning Abteilungsleiterin
Genereller Verfahrensablauf - Antrag auf Erprobung gem. 137e Abs. 7 SGB V - Antrag auf Beratung gem. 137e Abs. 8 SGB V Informationsveranstaltung G-BA 15. April 2013 Dr. Edith Pfenning Abteilungsleiterin
Die Verfahrensordnung zur Erprobungsregelung Neue Wege in die Versorgung: Richtlinien zur Erprobung
 Die Verfahrensordnung zur Erprobungsregelung Neue Wege in die Versorgung: Richtlinien zur Erprobung Informationsveranstaltung zu 137e SGB V am 15. April 2013 in Berlin Von Dr. Dominik Roters Stellvertretender
Die Verfahrensordnung zur Erprobungsregelung Neue Wege in die Versorgung: Richtlinien zur Erprobung Informationsveranstaltung zu 137e SGB V am 15. April 2013 in Berlin Von Dr. Dominik Roters Stellvertretender
Zulassungsüberschreitende Anwendung von Arzneimitteln im Rahmen klinischer Studien ( 35c SGB V)
 Zulassungsüberschreitende Anwendung von Arzneimitteln im Rahmen klinischer Studien ( 35c SGB V) Berlin, 22. September 2009 Dr. Regina Skavron Abteilung Arzneimittel, Gemeinsamer Bundesausschuss Zulassungsüberschreitende
Zulassungsüberschreitende Anwendung von Arzneimitteln im Rahmen klinischer Studien ( 35c SGB V) Berlin, 22. September 2009 Dr. Regina Skavron Abteilung Arzneimittel, Gemeinsamer Bundesausschuss Zulassungsüberschreitende
Die frühe Nutzenbewertung und ihre rechtlichen Herausforderungen
 und ihre rechtlichen Herausforderungen Rechtssymposium Die frühe Nutzenbewertung von Arzneimitteln nach AMNOG G-BA, Berlin Referent: Dr. jur. Rainer Hess, G-BA Seite 1 16. November 2010 Rechtssymposium
und ihre rechtlichen Herausforderungen Rechtssymposium Die frühe Nutzenbewertung von Arzneimitteln nach AMNOG G-BA, Berlin Referent: Dr. jur. Rainer Hess, G-BA Seite 1 16. November 2010 Rechtssymposium
Bekanntmachung der Verfahrensregeln zur Bewertung von Untersuchungs- und Behandlungsmethoden im Krankenhaus gemäß 137 c SGB V
 Bekanntmachung der Verfahrensregeln zur Bewertung von Untersuchungs- und Behandlungsmethoden im Krankenhaus gemäß 137 c SGB V Der Ausschuss Krankenhaus nach 137c SGB V hat in seiner Sitzung vom 28.01.2002
Bekanntmachung der Verfahrensregeln zur Bewertung von Untersuchungs- und Behandlungsmethoden im Krankenhaus gemäß 137 c SGB V Der Ausschuss Krankenhaus nach 137c SGB V hat in seiner Sitzung vom 28.01.2002
Dossierbewertung A14-01 Version 1.0 Trastuzumab Emtansin Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Trastuzumab Emtansin gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Trastuzumab Emtansin gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf
Richtlinien des Bundesausschusses der Zahnärzte und Krankenkassen
 Richtlinien des Bundesausschusses der Zahnärzte und Krankenkassen über die Einführung neuer Untersuchungs- und Behandlungsmethoden und die Überprüfung erbrachter vertragszahnärztlicher Leistungen (NUB-Richtlinien)
Richtlinien des Bundesausschusses der Zahnärzte und Krankenkassen über die Einführung neuer Untersuchungs- und Behandlungsmethoden und die Überprüfung erbrachter vertragszahnärztlicher Leistungen (NUB-Richtlinien)
Formular zur Anforderung einer Beratung gemäß 137e Absatz 8 SGB V
 Formular zur Anforderung einer Beratung gemäß 137e Absatz 8 SGB V Stand: 1. Beratungsinteressent a) Name b) Anschrift 2. Zuständige Kontaktperson a) Name der Kontaktperson,
Formular zur Anforderung einer Beratung gemäß 137e Absatz 8 SGB V Stand: 1. Beratungsinteressent a) Name b) Anschrift 2. Zuständige Kontaktperson a) Name der Kontaktperson,
Tragende Gründe zum Beschluss. des Gemeinsamen Bundesausschusses über die Änderung der Arzneimittel-Richtlinie (AM-RL):
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage 1 (OTC-Übersicht) Nr. 20 Ginkgo-biloba-Blätter-Extrakt Vom 14. April 2011 Inhaltsverzeichnis
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage 1 (OTC-Übersicht) Nr. 20 Ginkgo-biloba-Blätter-Extrakt Vom 14. April 2011 Inhaltsverzeichnis
Dossierbewertung A16-60 Version 1.0 Ibrutinib (chronische lymphatische Leukämie)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ibrutinib in Kombination mit Bendamustin und Rituximab (Ibrutinib + BR) gemäß
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ibrutinib in Kombination mit Bendamustin und Rituximab (Ibrutinib + BR) gemäß
BAnz AT B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Diagnostik und Versorgung von Patienten im Rahmen der pädiatrischen Kardiologie Anlage 3, Nr. 8
 Antrag nach 116 b SGB V Krankenhaus Diagnostik und Versorgung von Patienten im Rahmen der pädiatrischen Kardiologie Anlage 3, Nr. 8 1. Konkretisierung der Erkrankung und des Behandlungsauftrages mittels
Antrag nach 116 b SGB V Krankenhaus Diagnostik und Versorgung von Patienten im Rahmen der pädiatrischen Kardiologie Anlage 3, Nr. 8 1. Konkretisierung der Erkrankung und des Behandlungsauftrages mittels
IQWiG Herbstsymposium / Unterschied zwischen Risiko-Nutzenabwägung (nach AMG) und Nutzen-Schadenabwägung (nach SGB V)
 IQWiG Herbstsymposium 19.11./20.11.2010 Unterschied zwischen Risiko-Nutzenabwägung (nach AMG) und Nutzen-Schadenabwägung (nach SGB V) Referent: Maximilian Grüne, Justiziar Gemeinsamer Bundesausschuss Seite
IQWiG Herbstsymposium 19.11./20.11.2010 Unterschied zwischen Risiko-Nutzenabwägung (nach AMG) und Nutzen-Schadenabwägung (nach SGB V) Referent: Maximilian Grüne, Justiziar Gemeinsamer Bundesausschuss Seite
Individuelle Patientenpräferenzen könnten über die Art der Operation entscheiden
 IQWIG zum Benignen Prostatasyndrom: Stellenwert von weniger eingreifenden Operationsverfahren bleibt unklar Individuelle Patientenpräferenzen könnten über die Art der Operation entscheiden Berlin (30.
IQWIG zum Benignen Prostatasyndrom: Stellenwert von weniger eingreifenden Operationsverfahren bleibt unklar Individuelle Patientenpräferenzen könnten über die Art der Operation entscheiden Berlin (30.
Operative Therapiemöglichkeiten des Uterus myomatosus: und die Qualität?
 Abteilung für Gynäkologie und Geburtshilfe Zentrum für minimal-invasive Chirurgie in der Gynäkologie Krankenhaus Sachsenhausen Frankfurt am Main Akademisches Lehrkrankenhaus der Johann Wolfgang Goethe-Universität
Abteilung für Gynäkologie und Geburtshilfe Zentrum für minimal-invasive Chirurgie in der Gynäkologie Krankenhaus Sachsenhausen Frankfurt am Main Akademisches Lehrkrankenhaus der Johann Wolfgang Goethe-Universität
Nutzenbewertungen des IQWiG im Bereich Medizinprodukte
 Verfahren zur Aufnahme einer Leistung in den Leistungskatalog Themenreihe Telemedizin und Medizintechnik in der Zukunft MFC - Multifunktionscenter, Lübeck, 28.10.2014 Nutzenbewertungen des IQWiG im Bereich
Verfahren zur Aufnahme einer Leistung in den Leistungskatalog Themenreihe Telemedizin und Medizintechnik in der Zukunft MFC - Multifunktionscenter, Lübeck, 28.10.2014 Nutzenbewertungen des IQWiG im Bereich
Anlage V zum 2. Kapitel VerfO
 Formular zur Übermittlung von Informationen über den Stand der wissenschaftlichen Erkenntnisse für die Bewertung einer neuen Untersuchungs- oder Behandlungsmethode mit Medizinprodukten hoher Risikoklasse
Formular zur Übermittlung von Informationen über den Stand der wissenschaftlichen Erkenntnisse für die Bewertung einer neuen Untersuchungs- oder Behandlungsmethode mit Medizinprodukten hoher Risikoklasse
4. Abschnitt Zusammenarbeit mit fachlich unabhängigen wissenschaftlichen Instituten
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Geschäfts- und Verfahrensordnung: Zusammenarbeit mit fachlich unabhängigen wissenschaftlichen Instituten und redaktionelle Anpassungen
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Geschäfts- und Verfahrensordnung: Zusammenarbeit mit fachlich unabhängigen wissenschaftlichen Instituten und redaktionelle Anpassungen
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dossier zur Nutzenbewertung gemäß 35a SGB V Nivolumab (Nivolumab BMS) Bristol-Myers Squibb GmbH & Co. KGaA Modul 4 B Lokal fortgeschrittenes oder metastasiertes nichtkleinzelliges Lungenkarzinom mit plattenepithelialer
Dossier zur Nutzenbewertung gemäß 35a SGB V Nivolumab (Nivolumab BMS) Bristol-Myers Squibb GmbH & Co. KGaA Modul 4 B Lokal fortgeschrittenes oder metastasiertes nichtkleinzelliges Lungenkarzinom mit plattenepithelialer
Dossierbewertung A16-64 Version 1.1 Idelalisib (chronische lymphatische Leukämie)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Idelalisib für das im September 2016 neu zugelassene Anwendungsgebiet gemäß
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Idelalisib für das im September 2016 neu zugelassene Anwendungsgebiet gemäß
Dossierbewertung A15-45 Version 1.0 Aclidiniumbromid Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der Gemeinsame Bundesausschuss (G-BA) hat das IQWiG mit der erneuten Nutzenbewertung des Wirkstoffs Aclidiniumbromid gemäß 35a Absatz 5
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der Gemeinsame Bundesausschuss (G-BA) hat das IQWiG mit der erneuten Nutzenbewertung des Wirkstoffs Aclidiniumbromid gemäß 35a Absatz 5
Dossierbewertung A15-60 Version 1.0 Sacubitril/Valsartan Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Sacubitril/Valsartan gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Sacubitril/Valsartan gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf
Dossierbewertung A15-20 Version 1.0 Secukinumab Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Secukinumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Secukinumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
Dossierbewertung A16-10 Version 1.0 Ramucirumab (Kolorektalkarzinom)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ramucirumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ramucirumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
Dossierbewertung A15-31 Version 1.0 Tiotropium/Olodaterol Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung der Wirkstoffkombination Tiotropium/ Olodaterol gemäß 35a SGB V beauftragt. Die Bewertung
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung der Wirkstoffkombination Tiotropium/ Olodaterol gemäß 35a SGB V beauftragt. Die Bewertung
Dossierbewertung A15-28 Version 1.0 Netupitant/Palonosetron Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Netupitant/Palonosetron gemäß 35a SGB V beauftragt. Die Bewertung erfolgte
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Netupitant/Palonosetron gemäß 35a SGB V beauftragt. Die Bewertung erfolgte
Anästhesiologie und Intensivmedizin (DGAI) zur Frage der postoperativen Überwachung von Kaiserschnittpatientinnen
 DGGG e.v. Hausvogteiplatz 12 10117 Berlin Präsident Prof. Dr. Diethelm Wallwiener Ärztlicher Direktor Universitäts-Frauenklinik Tübingen Repräsentanz der DGGG und Fachgesellschaften Hausvogteiplatz 12
DGGG e.v. Hausvogteiplatz 12 10117 Berlin Präsident Prof. Dr. Diethelm Wallwiener Ärztlicher Direktor Universitäts-Frauenklinik Tübingen Repräsentanz der DGGG und Fachgesellschaften Hausvogteiplatz 12
Kostenerstattung der Protonentherapie in Deutschland
 Kostenerstattung der Protonentherapie in Deutschland Gregor Däubler Kompetenzzentrum Medizin Verband der Ersatzkassen e.v. (vdek) Berlin PROTONENTHERAPIE: ENTWICKLUNG EINES TRINATIONALEN WISSENSCHAFTSNETZWERKS
Kostenerstattung der Protonentherapie in Deutschland Gregor Däubler Kompetenzzentrum Medizin Verband der Ersatzkassen e.v. (vdek) Berlin PROTONENTHERAPIE: ENTWICKLUNG EINES TRINATIONALEN WISSENSCHAFTSNETZWERKS
Beschluss. vom 21. Oktober 2010 veröffentlicht im Bundesanzeiger (BAnz. S. 4506) in Kraft getreten am 22. Dezember 2011
 Beschluss über Maßnahmen zur Qualitätssicherung der Positronenemissionstomographie bei Patientinnen und Patienten mit Hodgkin- Lymphomen und aggressiven Non-Hodgkin- Lymphomen zum Interim-Staging nach
Beschluss über Maßnahmen zur Qualitätssicherung der Positronenemissionstomographie bei Patientinnen und Patienten mit Hodgkin- Lymphomen und aggressiven Non-Hodgkin- Lymphomen zum Interim-Staging nach
Gynäkologisches Universitäts- Krebszentrum Franken
 Gynäkologisches Universitäts- Krebszentrum Franken Kompetenz durch Teamwork und Erfahrung Bösartige Erkrankungen und ihre Vorstufen an den weiblichen Geschlechtsorganen wie Gebärmutterschleimhautkrebs
Gynäkologisches Universitäts- Krebszentrum Franken Kompetenz durch Teamwork und Erfahrung Bösartige Erkrankungen und ihre Vorstufen an den weiblichen Geschlechtsorganen wie Gebärmutterschleimhautkrebs
Bewertungskriterien und methoden nach dem SGB V. Kommentar aus der Sicht der forschenden Arzneimittelindustrie
 Bewertungskriterien und methoden nach dem SGB V Kommentar aus der Sicht der forschenden Arzneimittelindustrie Die Rechtsverfassung der Bewertung von Leistungen durch den G-BA und das IQWiG, Tagung am 26.
Bewertungskriterien und methoden nach dem SGB V Kommentar aus der Sicht der forschenden Arzneimittelindustrie Die Rechtsverfassung der Bewertung von Leistungen durch den G-BA und das IQWiG, Tagung am 26.
Dossierbewertung A14-28 Version 1.0 Apixaban (neues Anwendungsgebiet) Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Apixaban (neues Anwendungsgebiet) gemäß 35a SGB V beauftragt. Die Bewertung
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Apixaban (neues Anwendungsgebiet) gemäß 35a SGB V beauftragt. Die Bewertung
Frühe Nutzenbewertung aus Sicht des IQWiG. Jürgen Windeler
 Frühe Nutzenbewertung aus Sicht des IQWiG Jürgen Windeler AMNOG, aus der Begründung Die Datenlage für neue Wirkstoffe (insbesondere in der Onkologie) wird von Experten als unbefriedigend bezeichnet. Die
Frühe Nutzenbewertung aus Sicht des IQWiG Jürgen Windeler AMNOG, aus der Begründung Die Datenlage für neue Wirkstoffe (insbesondere in der Onkologie) wird von Experten als unbefriedigend bezeichnet. Die
Version: V1.0 basierend auf Amendment 1 vom 15. Juli 2016
 Pertuzumab in First Line Treatment of HER2-positive metastatic breast Cancer patients: A cohort study of patients treated either with docetaxel and Trastuzumab or docetaxel, trastuzumab and, NCT02642458
Pertuzumab in First Line Treatment of HER2-positive metastatic breast Cancer patients: A cohort study of patients treated either with docetaxel and Trastuzumab or docetaxel, trastuzumab and, NCT02642458
Vom 15. Dezember Rechtsgrundlagen Eckpunkte der Entscheidung Verfahrensablauf Fazit Anhang...
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einstellung der Beratungen gemäß 137c SGB V zur allogenen Stammzelltransplantation mit nicht verwandtem Spender bei akuter lymphatischer
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einstellung der Beratungen gemäß 137c SGB V zur allogenen Stammzelltransplantation mit nicht verwandtem Spender bei akuter lymphatischer
Tragende Gründe. Vom 20. November 2014
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der -Richtlinie: Anlage III Nummer 19 traditionell angewendete Vom 20. November 2014 Inhalt 1. Rechtsgrundlage... 2 2.
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der -Richtlinie: Anlage III Nummer 19 traditionell angewendete Vom 20. November 2014 Inhalt 1. Rechtsgrundlage... 2 2.
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Teduglutid wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Verfahrenstechnische und methodische Anforderungen an die Bewertung einer Untersuchungs- u. Behandlungsmethode
 Informationsblatt Verfahrenstechnische und methodische Anforderungen an die Bewertung einer Untersuchungs- u. Behandlungsmethode (Bezug zu 2. Kapitel der Verfahrensordnung des G-BA (VerfO), Anlage II,
Informationsblatt Verfahrenstechnische und methodische Anforderungen an die Bewertung einer Untersuchungs- u. Behandlungsmethode (Bezug zu 2. Kapitel der Verfahrensordnung des G-BA (VerfO), Anlage II,
Arthroskopie des Kniegelenks bei Arthrose: kein Nutzen erkennbar
 Einbezug neuer Studiendaten ändert nichts am Ergebnis des IQWiG-Vorberichts Arthroskopie des Kniegelenks bei Arthrose: kein Nutzen erkennbar Köln (12. Mai 2014) - Der Nutzen der therapeutischen Arthroskopie
Einbezug neuer Studiendaten ändert nichts am Ergebnis des IQWiG-Vorberichts Arthroskopie des Kniegelenks bei Arthrose: kein Nutzen erkennbar Köln (12. Mai 2014) - Der Nutzen der therapeutischen Arthroskopie
Diskrepanzen zwischen Zulassung und früher Nutzenbewertung Prof. Dr. Karl Broich
 Diskrepanzen zwischen Zulassung und früher Nutzenbewertung Prof. Dr. Karl Broich Gliederung Aufgaben der Zulassung Aktuelle und neue Zulassungswege Rolle des BfArM national/europäisch bei der Zusatznutzenbewertung
Diskrepanzen zwischen Zulassung und früher Nutzenbewertung Prof. Dr. Karl Broich Gliederung Aufgaben der Zulassung Aktuelle und neue Zulassungswege Rolle des BfArM national/europäisch bei der Zusatznutzenbewertung
Fragen der Antragstellung nach 137e Absatz 7 des Fünften Buches Sozialgesetzbuch (SGB V)
 Informationsblatt Fragen der Antragstellung nach 137e Absatz 7 des Fünften Buches Sozialgesetzbuch (SGB V) 1. Wer ist antragsberechtigt? 1 Antragsberechtigt sind einerseits Hersteller eines Medizinprodukts,
Informationsblatt Fragen der Antragstellung nach 137e Absatz 7 des Fünften Buches Sozialgesetzbuch (SGB V) 1. Wer ist antragsberechtigt? 1 Antragsberechtigt sind einerseits Hersteller eines Medizinprodukts,
WAS BRINGEN KLINISCHE STUDIEN FÜR PATIENTEN
 CAMPUS INNENSTADT KOMM. DIREKTOR: PROF. DR: C. DANNEKER STELLV. DIREKTOR: PD DR. T. WEISSENBACHER WAS BRINGEN KLINISCHE STUDIEN FÜR PATIENTEN Informationsnachmittag- Leben mit Brustkrebs Was gibt es Neues?
CAMPUS INNENSTADT KOMM. DIREKTOR: PROF. DR: C. DANNEKER STELLV. DIREKTOR: PD DR. T. WEISSENBACHER WAS BRINGEN KLINISCHE STUDIEN FÜR PATIENTEN Informationsnachmittag- Leben mit Brustkrebs Was gibt es Neues?
Die Brachytherapie-Studie als Modell
 Können GKV-SV-initiierte Studien die Antwort sein? Die Brachytherapie-Studie als Modell Dr. Sandra Janatzek Fachbereich Evidenzbasierte Medizin Medizinischer Dienst des Spitzenverbandes Bund der Krankenkassen
Können GKV-SV-initiierte Studien die Antwort sein? Die Brachytherapie-Studie als Modell Dr. Sandra Janatzek Fachbereich Evidenzbasierte Medizin Medizinischer Dienst des Spitzenverbandes Bund der Krankenkassen
Tabelle 2: Fragestellung der Nutzenbewertung von Ticagrelor
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der Gemeinsame Bundesausschuss (G-BA) hat das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) mit der Nutzenbewertung
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der Gemeinsame Bundesausschuss (G-BA) hat das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) mit der Nutzenbewertung
Evaluationskonzepte bei neuen Methoden. Analyse und Konsequenz des GKV.SV
 Evaluationskonzepte bei neuen Methoden Analyse und Konsequenz des GKV.SV Dr. Diedrich Bühler Dr. Diedrich Bühler Überblick I) Situation und Position des GKV SV II) Methodenbewertung, Selbstverwaltung /
Evaluationskonzepte bei neuen Methoden Analyse und Konsequenz des GKV.SV Dr. Diedrich Bühler Dr. Diedrich Bühler Überblick I) Situation und Position des GKV SV II) Methodenbewertung, Selbstverwaltung /
Dossierbewertung A15-13 Version 1.0 Ruxolitinib Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ruxolitinib gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ruxolitinib gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
Die aktuelle S3-Leitlinie zur Diagnsotik, Therapie und Nachsorge des Ovarialkarzinoms. Diagnostik
 Die aktuelle S3-Leitlinie zur Diagnsotik, Therapie und Nachsorge des Ovarialkarzinoms Diagnostik Diagnostik: Zielsetzung und Fragestellungen Diagnostik (siehe Kapitel 3.3) Welche Symptome weisen auf ein
Die aktuelle S3-Leitlinie zur Diagnsotik, Therapie und Nachsorge des Ovarialkarzinoms Diagnostik Diagnostik: Zielsetzung und Fragestellungen Diagnostik (siehe Kapitel 3.3) Welche Symptome weisen auf ein
BAnz AT 19.08.2015 B3. Bekanntmachung
 Bekanntmachung des Gemeinsamen Bundesausschusses (G-BA) 1. über die Aufnahme von Beratungen zu Richtlinien auf Erprobung der Methoden transkorneale Elektrostimulation bei Retinopathia pigmentosa, Elektrostimulation
Bekanntmachung des Gemeinsamen Bundesausschusses (G-BA) 1. über die Aufnahme von Beratungen zu Richtlinien auf Erprobung der Methoden transkorneale Elektrostimulation bei Retinopathia pigmentosa, Elektrostimulation
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Pitolisant wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der -Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von n mit neuen Wirkstoffen nach 35a SGB V Vom 19. Januar 2017 Der
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der -Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von n mit neuen Wirkstoffen nach 35a SGB V Vom 19. Januar 2017 Der
EVIDENZ KOMPAKT. Screening auf das Vorliegen einer Carotisstenose bei asymptomatischen Erwachsenen
 EVIDENZ KOMPAKT Screening auf das Vorliegen einer Carotisstenose bei asymptomatischen Erwachsenen Stand: 15.11.2016 Autoren Stefanie Butz (M. Sc. Public Health) Dr. med. Dagmar Lühmann (Oberärztliche Koordinatorin
EVIDENZ KOMPAKT Screening auf das Vorliegen einer Carotisstenose bei asymptomatischen Erwachsenen Stand: 15.11.2016 Autoren Stefanie Butz (M. Sc. Public Health) Dr. med. Dagmar Lühmann (Oberärztliche Koordinatorin
Zusammenfassung. 5 Zusammenfassung
 5 Zusammenfassung Die Diskussion über den optimalen Operationszeitpunkt der frakturierten Hüfte wird seit langem kontrovers geführt. Ziel dieser Arbeit war zu überprüfen, ob die in Deutschland derzeit
5 Zusammenfassung Die Diskussion über den optimalen Operationszeitpunkt der frakturierten Hüfte wird seit langem kontrovers geführt. Ziel dieser Arbeit war zu überprüfen, ob die in Deutschland derzeit
Der allgemein anerkannte Stand der medizinischen Erkenntnisse
 Der allgemein anerkannte Stand der medizinischen Erkenntnisse Ein Maßstab zwischen faktischer Anerkennung und eidenzbasierter Methodenbewertung Von Kilian Ertl 14.07.2016, KILIAN ERTL Einleitung 2 Abs.
Der allgemein anerkannte Stand der medizinischen Erkenntnisse Ein Maßstab zwischen faktischer Anerkennung und eidenzbasierter Methodenbewertung Von Kilian Ertl 14.07.2016, KILIAN ERTL Einleitung 2 Abs.
Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten
 Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten Arzneimittelmarktneuordnungsgesetz (AMNOG) 35a Bewertung des Nutzens von Arzneimitteln
Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten Arzneimittelmarktneuordnungsgesetz (AMNOG) 35a Bewertung des Nutzens von Arzneimitteln
Die Embolisation der Arteria uterina zur Therapie des symptomatischen Uterus myomatosus
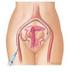 Aus der Klinik für Frauenheilkunde und Geburtsmedizin der Medizinischen Fakultät der Charité Universitätsmedizin Berlin DISSERTATION Die Embolisation der Arteria uterina zur Therapie des symptomatischen
Aus der Klinik für Frauenheilkunde und Geburtsmedizin der Medizinischen Fakultät der Charité Universitätsmedizin Berlin DISSERTATION Die Embolisation der Arteria uterina zur Therapie des symptomatischen
ENTWURF. MIC-Endoskopie Grund- und Fortgeschrittenenkurse. Januar Wissen schafft Gesundheit
 Klinik für Frauenheilkunde, Geburtshilfe und Reproduktionsmedizin Prof. Dr. med. Erich F. Solomayer ETC Saarbrücken European Training Center for Gynecologic Endoscopy and Surgery Prof. Dr. med. Klaus J.
Klinik für Frauenheilkunde, Geburtshilfe und Reproduktionsmedizin Prof. Dr. med. Erich F. Solomayer ETC Saarbrücken European Training Center for Gynecologic Endoscopy and Surgery Prof. Dr. med. Klaus J.
MIC-Endoskopie Grund- und Fortgeschrittenenkurse. Januar Wissen schafft Gesundheit
 Klinik für Frauenheilkunde, Geburtshilfe und Reproduktionsmedizin Prof. Dr. med. Erich F. Solomayer ETC Saarbrücken European Training Center for Gynecologic Endoscopy and Surgery Prof. Dr. med. Klaus J.
Klinik für Frauenheilkunde, Geburtshilfe und Reproduktionsmedizin Prof. Dr. med. Erich F. Solomayer ETC Saarbrücken European Training Center for Gynecologic Endoscopy and Surgery Prof. Dr. med. Klaus J.
Enzalutamid bei Prostatakrebs: Anhaltpunkte für Zusatznutzen
 Enzalutamid bei Prostatakrebs: Anhaltpunkte für Zusatznutzen - Längeres Gesamtüberleben bei Patienten ohne viszerale Metastasen - Komplikationen an Knochen sowie Schmerzprogression verzögert Köln (2. Dezember
Enzalutamid bei Prostatakrebs: Anhaltpunkte für Zusatznutzen - Längeres Gesamtüberleben bei Patienten ohne viszerale Metastasen - Komplikationen an Knochen sowie Schmerzprogression verzögert Köln (2. Dezember
Dossierbewertung A14-13 Nutzenbewertung gemäß 35a SGB V Version 1.0 Insulin degludec Diabetes mellitus Typ
 Insulin degludec Diabetes mellitus Typ 1 30.07.2014 I 2 Nutzenbewertung I 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Insulin degludec
Insulin degludec Diabetes mellitus Typ 1 30.07.2014 I 2 Nutzenbewertung I 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Insulin degludec
Abschlussbericht V06-02B Interventionen bei Kleinkindern mit obstruktiven Atemwegserkrankungen
 Zu allen Dokumenten, auf die via Internet zugegriffen wurde und die entsprechend zitiert sind, ist das jeweilige Zugriffsdatum angegeben. Sofern diese Dokumente zukünftig nicht mehr über die genannte Zugriffsadresse
Zu allen Dokumenten, auf die via Internet zugegriffen wurde und die entsprechend zitiert sind, ist das jeweilige Zugriffsdatum angegeben. Sofern diese Dokumente zukünftig nicht mehr über die genannte Zugriffsadresse
GBG 80 - SenSzi. Sherko Kümmel Interdisziplinäres Brustzentrum Kliniken Essen-Mitte
 GBG 80 - SenSzi Randomisierte, kontrollierte, multizentrische, operative Studie zur Evaluation der Rolle einer präoperativen Lymphszintigraphie vor axillärer Sentinel-Lymphonodektomie beim primären Mammakarzinom
GBG 80 - SenSzi Randomisierte, kontrollierte, multizentrische, operative Studie zur Evaluation der Rolle einer präoperativen Lymphszintigraphie vor axillärer Sentinel-Lymphonodektomie beim primären Mammakarzinom
Endometriose-Intensiv Workshop Februar 2014
 Endometriose-Intensiv Workshop 13.- 15. Februar 2014 P R O G R A M M Donnerstag, 13.Februar 2014 08:00 Uhr Begrüßung E. F. Solomayer K. J. Neis Einführungsvortrag: 08:15 Uhr Endometriose - eine Erkrankung
Endometriose-Intensiv Workshop 13.- 15. Februar 2014 P R O G R A M M Donnerstag, 13.Februar 2014 08:00 Uhr Begrüßung E. F. Solomayer K. J. Neis Einführungsvortrag: 08:15 Uhr Endometriose - eine Erkrankung
Tragende Gründe. Vom 19. März 2015
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Einstellung der Methodenbewertung gemäß 137c des Fünften Buches Sozialgesetzbuch zu acht Methoden der Stammzelltransplantation
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Einstellung der Methodenbewertung gemäß 137c des Fünften Buches Sozialgesetzbuch zu acht Methoden der Stammzelltransplantation
Methoden der evidenzbasierten Medizin und des Qualitätsmanagements im Kontext der Aufgaben des Gemeinsamen Bundesausschusses
 Methoden der evidenzbasierten Medizin und des Qualitätsmanagements im Kontext der Aufgaben des Gemeinsamen Bundesausschusses Dr. Barbara Pietsch Gemeinsamer Bundesausschuss, Fachberatung Medizin 8. Jahrestagung
Methoden der evidenzbasierten Medizin und des Qualitätsmanagements im Kontext der Aufgaben des Gemeinsamen Bundesausschusses Dr. Barbara Pietsch Gemeinsamer Bundesausschuss, Fachberatung Medizin 8. Jahrestagung
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Daratumumab wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Dossierbewertung A17-61 Version 1.0 Perampanel (Epilepsie)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Perampanel gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis eines
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Perampanel gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis eines
BAnz AT B5. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Bewertungskriterien und -methoden nach dem SGB V
 Prof. Dr. Robert Francke Prof. Dr. Dieter Hart Bewertungskriterien und -methoden nach dem SGB V Vortrag auf der gemeinsamen Tagung von G-BA, IQWiG und IGMR am 26.4.2007 in Berlin Übersicht A. Vorwort B.
Prof. Dr. Robert Francke Prof. Dr. Dieter Hart Bewertungskriterien und -methoden nach dem SGB V Vortrag auf der gemeinsamen Tagung von G-BA, IQWiG und IGMR am 26.4.2007 in Berlin Übersicht A. Vorwort B.
BAnz AT B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG)
 Kurzfassung Der Gemeinsame Bundesausschuss (G-BA) hat mit Schreiben vom 22.02.2005 das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen mit der Nutzenbewertung verschiedener in Deutschland
Kurzfassung Der Gemeinsame Bundesausschuss (G-BA) hat mit Schreiben vom 22.02.2005 das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen mit der Nutzenbewertung verschiedener in Deutschland
Verbesserte Lebensqualität für Brustkrebspatientinnen unter Chemotherapie
 Neue Studie zu Iscador Verbesserte Lebensqualität für Brustkrebspatientinnen unter Chemotherapie Schwäbisch-Gmünd (2. Dezember 2009) - Eine prospektive randomisierte offene Pilotstudie ergab eine Verbesserung
Neue Studie zu Iscador Verbesserte Lebensqualität für Brustkrebspatientinnen unter Chemotherapie Schwäbisch-Gmünd (2. Dezember 2009) - Eine prospektive randomisierte offene Pilotstudie ergab eine Verbesserung
STUDIEN PRO UND CONTRA
 V) WEITERE THEMEN STUDIEN PRO UND CONTRA Die Erfahrung hat gezeigt, dass Behandlungsergebnisse an mehr oder weniger kleinen Patientenzahlen von Autor zu Autor auch bei Einsatz gleicher Zytostatika zu unterschiedlichen,
V) WEITERE THEMEN STUDIEN PRO UND CONTRA Die Erfahrung hat gezeigt, dass Behandlungsergebnisse an mehr oder weniger kleinen Patientenzahlen von Autor zu Autor auch bei Einsatz gleicher Zytostatika zu unterschiedlichen,
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um die Wirkstoffkombination Tiotropium/Olodaterol wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
SAPV Die Spezialisierte Ambulante Palliativversorgung
 SAPV Die Spezialisierte Ambulante Palliativversorgung von Gliederung Grundlagen Vorraussetzungen Ziele Anspruchs SAPV Spezialisierte Ambulante Palliativversorgung Neue Richtlinie Beschluss des gemeinsamen
SAPV Die Spezialisierte Ambulante Palliativversorgung von Gliederung Grundlagen Vorraussetzungen Ziele Anspruchs SAPV Spezialisierte Ambulante Palliativversorgung Neue Richtlinie Beschluss des gemeinsamen
MIC-Endoskopie Grund- und Fortgeschrittenenkurs. November Wissen schafft Gesundheit
 Klinik für Frauenheilkunde, Geburtshilfe und Reproduktionsmedizin Prof. Dr. med. Erich F. Solomayer ETC Saarbrücken European Training Center for Gynecologic Endoscopy and Surgery Prof. Dr. med. Klaus J.
Klinik für Frauenheilkunde, Geburtshilfe und Reproduktionsmedizin Prof. Dr. med. Erich F. Solomayer ETC Saarbrücken European Training Center for Gynecologic Endoscopy and Surgery Prof. Dr. med. Klaus J.
Diagnostik und Versorgung von Patienten vor oder nach Lebertransplantation Anlage 2, Nr. 16
 Antrag nach 116 b SGB V Krankenhaus Diagnostik und Versorgung von Patienten vor oder nach Lebertransplantation Anlage 2, Nr. 16 1. Konkretisierung der Erkrankung und des Behandlungsauftrages mittels Angabe
Antrag nach 116 b SGB V Krankenhaus Diagnostik und Versorgung von Patienten vor oder nach Lebertransplantation Anlage 2, Nr. 16 1. Konkretisierung der Erkrankung und des Behandlungsauftrages mittels Angabe
Erprobung und Bewertung von Medizinprodukten mit hoher Risikoklasse
 Hamburg, 2017 Erprobung und Bewertung von Medizinprodukten mit hoher Risikoklasse Eckpunkte der Methodenbewertung nach Impressum Diese Präsentation wurde durch die GmbH erstellt. Weitergabe, Zitierung
Hamburg, 2017 Erprobung und Bewertung von Medizinprodukten mit hoher Risikoklasse Eckpunkte der Methodenbewertung nach Impressum Diese Präsentation wurde durch die GmbH erstellt. Weitergabe, Zitierung
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneitel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneiteln neuen Wirkstoffen nach 35a SGB V Alirocumab
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneitel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneiteln neuen Wirkstoffen nach 35a SGB V Alirocumab
Dossierbewertung A17-25 Version 1.0 Etelcalcetid (sekundärer Hyperparathyreoidismus)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Etelcalcetid gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Etelcalcetid gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis
Beschluss des G-BA (nach 91 Abs. 4 SGB V) vom : Fragenkatalog
 Fragenkatalog für Empfehlungen geeigneter chronischer Krankheiten für neue strukturierte Behandlungsprogramme (DMP) Erläuterungen und Ausfüllhinweise Das Ziel der vom Gesetzgeber initiierten strukturierten
Fragenkatalog für Empfehlungen geeigneter chronischer Krankheiten für neue strukturierte Behandlungsprogramme (DMP) Erläuterungen und Ausfüllhinweise Das Ziel der vom Gesetzgeber initiierten strukturierten
zum Beschluss des Gemeinsamen Bundesausschusses
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung: Elektrostimulation des peripheren Nervensystems durch
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung: Elektrostimulation des peripheren Nervensystems durch
Abschlussbericht A05-19A: Cholinesterasehemmer bei Alzheimer Demenz KURZFASSUNG
 KURZFASSUNG Hintergrund Im Auftrag des Gemeinsamen Bundesausschusses (G-BA) wurde vom Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) eine Nutzenbewertung der Behandlung mit Cholinesterasehemmern
KURZFASSUNG Hintergrund Im Auftrag des Gemeinsamen Bundesausschusses (G-BA) wurde vom Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) eine Nutzenbewertung der Behandlung mit Cholinesterasehemmern
Bewertung von Arzneimitteln. Überblick über den AMNOG Prozess
 Bewertung von Arzneimitteln Überblick über den AMNOG Prozess Was erwartet Sie? Ablauf und Prinzip der frühen Nutzenbewertung nach 35a SGB V (Bewertung des Nutzens von Arzneimitteln mit neuen Wirkstoffen)
Bewertung von Arzneimitteln Überblick über den AMNOG Prozess Was erwartet Sie? Ablauf und Prinzip der frühen Nutzenbewertung nach 35a SGB V (Bewertung des Nutzens von Arzneimitteln mit neuen Wirkstoffen)
Medizintechnologie.de. G-BA Antrag. Antrag auf Erprobung von Untersuchungs- und Behandlungsmethoden nach 13 V
 Medizintechnologie.de G-BA Antrag Antrag auf Erprobung von Untersuchungs- und Behandlungsmethoden nach 13 V Der Gemeinsame Bundesausschuss (G-BA) regelt die Verordnungsfähigkeit von medizinischen Leistungen
Medizintechnologie.de G-BA Antrag Antrag auf Erprobung von Untersuchungs- und Behandlungsmethoden nach 13 V Der Gemeinsame Bundesausschuss (G-BA) regelt die Verordnungsfähigkeit von medizinischen Leistungen
1. Zusatznutzen des Arzneimittels im Verhältnis zur zweckmäßigen Vergleichstherapie
 Alirocumab Beschluss vom: 4. Mai 2016 gültig bis: unbefristet In Kraft getreten am: 4. Mai 2016 BAnz AT 16.06.2016 B3 Zugelassenes Anwendungsgebiet vom 23. September 2015: Praluent ist, begleitend zu einer
Alirocumab Beschluss vom: 4. Mai 2016 gültig bis: unbefristet In Kraft getreten am: 4. Mai 2016 BAnz AT 16.06.2016 B3 Zugelassenes Anwendungsgebiet vom 23. September 2015: Praluent ist, begleitend zu einer
