ENTWURF EINES BERICHTS
|
|
|
- Dagmar Wetzel
- vor 5 Jahren
- Abrufe
Transkript
1 EUROPÄISCHES PARLAMENT Ausschuss für Umweltfragen, öffentliche Gesundheit und Lebensmittelsicherheit /2041(INI) ENTWURF EINES BERICHTS zu dem Thema Das Problem der Mikroben die steigende Gefahr der Resistenz gegen antimikrobielle Wirkstoffe (2012/2041(INI)) Ausschuss für Umweltfragen, öffentliche Gesundheit und Lebensmittelsicherheit Berichterstatterin: Anna Rosbach PR\ doc PE v01-00 In Vielfalt geeint
2 PR_INI INHALT Seite ENTWURF EINER ENTSCHLIESSUNG S EUROPÄISCHEN PARLAMENTS...3 BEGRÜNDUNG...10 PE v /13 PR\ doc
3 ENTWURF EINER ENTSCHLIESSUNG S EUROPÄISCHEN PARLAMENTS zu dem Thema Das Problem der Mikroben die steigende Gefahr der Resistenz gegen antimikrobielle Wirkstoffe (2012/2041(INI)) Das Europäische Parlament, in Kenntnis der Schlussfolgerungen des Rates vom 22. Juni 2012 zu den Auswirkungen der Antibiotikaresistenz in der Human- und Tiermedizin Die Initiative Eine Gesundheit, in Kenntnis der Mitteilung der Kommission vom 15. November 2011 über einen Aktionsplan zur Abwehr der steigenden Gefahr der Antibiotikaresistenz (COM(2011)0748), in Kenntnis der Empfehlung der Kommission vom 27. Oktober 2011 für eine Initiative zur gemeinsamen Planung der Forschungsprogramme im Bereich Die mikrobielle Herausforderung eine neue Gefahr für die menschliche Gesundheit (C(2011)7660), unter Hinweis auf seine Entschließung vom 27. Oktober 2011 zu dem Thema Antimikrobielle Resistenz als Gefahr für die öffentliche Gesundheit 1, unter Hinweis auf seine Entschließung vom 12. Mai 2011 zu Antibiotikaresistenz 2, in Kenntnis des Arbeitsdokuments der Kommissionsdienststellen vom 18. November 2009 über Antibiotikaresistenzen (SANCO/6876/2009r6), in Kenntnis des gemeinsamen technischen Berichts des Europäischen Zentrums für die Prävention und die Kontrolle von Krankheiten (ECDC) und der Europäischen Arzneimittel-Agentur (EMA) vom 17. September 2009 mit dem Titel The bacterial challenge: time to react A call to narrow the gap between multidrug-resistant bacteria in the EU and the development of new antibacterial agents, in dem gefordert wird, im Interesse einer Verringerung der Diskrepanz zwischen multiresistenten Bakterien in der EU und der Entwicklung neuer antibakterieller Wirkstoffe tätig zu werden 3, in Kenntnis des zweiten gemeinsamen Berichts der Europäischen Behörde für Lebensmittelsicherheit (EFSA) und des Europäischen Zentrums für die Prävention und die Kontrolle von Krankheiten (ECDC) vom 14. März 2012 über antimikrobielle Resistenzen bei zoonotischen Bakterien, die sich auf Menschen, Tiere und Lebensmittel auswirken 4, in Kenntnis der Schlussfolgerungen der Tagung des Rates vom 10. Juni 2008 zu Antibiotikaresistenzen, in Kenntnis der Schlussfolgerungen der Tagung des Rates vom 1. Dezember Angenommene Texte, P7_TA(2011) Angenommene Texte, P7_TA(2011) EFSA Journal 2012;10(3):2598 [233 Seiten]. PR\ doc 3/13 PE v01-00
4 zu innovativen Anreizen für wirksame Antibiotika, in Kenntnis der Empfehlung des Rates vom 9. Juni 2009 zur Sicherheit der Patienten unter Einschluss der Prävention und Eindämmung von therapieassoziierten Infektionen 1, unter Hinweis auf die zweite Überarbeitung der WHO-Liste antimikrobieller Mittel, die für die Humanmedizin von besonderer Bedeutung sind (Bericht über die erste Sitzung der WHO-Beratungsgruppe für integrierte Überwachung der Antibiotikaresistenz [AGISAR], Kopenhagen, 2009), unter Hinweis auf den zweiten Bericht der Kommission an den Rat vom 9. April 2010 auf der Grundlage der Berichte der Mitgliedstaaten über die Umsetzung der Empfehlung (2002/77/EG) des Rates zur umsichtigen Verwendung antimikrobieller Mittel in der Humanmedizin 2 und auf das diesem Bericht beigefügte Arbeitsdokument der Kommissionsdienststellen 3, unter Hinweis auf die Verordnung (EG) Nr. 1831/2003 des Europäischen Parlaments und des Rates vom 22. September 2003 über Zusatzstoffe zur Verwendung in der Tierernährung, gemäß deren die Verwendung von Antibiotika als Wachstumsförderer verboten ist 4, unter Hinweis auf die Empfehlung des Rates vom 15. November 2001 zur umsichtigen Verwendung antimikrobieller Mittel in der Humanmedizin 5 (2002/77/EG) und auf die Entschließung des Europäischen Parlaments vom 23. Oktober 2001 zu dem Vorschlag für diese Empfehlung (COM(2001)0333), in Kenntnis der Mitteilung der Kommission vom 20. Juni 2001 über eine Strategie der Gemeinschaft zur Bekämpfung der Resistenz gegen antimikrobielle Mittel (COM(2001)0333), unter Hinweis auf seine Entschließung vom 5. Mai 2010 zur Bewertung und Beurteilung des Aktionsplans für Tierschutz , in Kenntnis der Empfehlungen der Transatlantischen Taskforce zur Antibiotikaresistenz (TATFAR) für die künftige Zusammenarbeit zwischen den USA und der EU 7, in Kenntnis der im Rahmen des Codex Alimentarius geltenden Leitlinien für die Risikoanalyse von lebensmittelbedingten Antibiotikaresistenzen 8, gestützt auf Artikel 48 seiner Geschäftsordnung, in Kenntnis des Berichts des Ausschusses für Umweltfragen, öffentliche Gesundheit und 1 ABl. C 151 vom , S ABl. L 268 vom , S ABl. L 34 vom , S Angenommene Texte, P7_TA(2010) CAC/GL PE v /13 PR\ doc
5 Lebensmittelsicherheit sowie der Stellungnahme des Ausschusses für Landwirtschaft und ländliche Entwicklung (A7 0000/2012), A. in der Erwägung, dass die Ausbildung von Arzneimittelresistenzen eine natürliche und unvermeidbare Folge der Behandlung mit antimikrobiellen Wirkstoffen darstellt; in der Erwägung, dass sich dieser Vorgang durch eine übermäßige und unüberlegte Anwendung in der Human- und Tiermedizin beschleunigen kann, was in Kombination mit unzureichender Hygiene und Infektionsbekämpfung wiederum die wirksame Nutzung einer bereits im Vorfeld begrenzten Bandbreite an antimikrobiellen Mitteln beeinträchtigen kann; B. in der Erwägung, dass die Antibiotikaresistenzrate bestimmter Bakterien in einigen Mitgliedstaaten bei 25 % oder höher liegt; C. in der Erwägung, dass Bakterien mit einer Resistenz gegen antimikrobielle Wirkstoffe allein in der EU, in Island und in Norwegen zu etwa Infektionen und Todesfälle pro Jahr führen und mindestens 1,5 Milliarden Euro an zusätzlichen Gesundheitskosten und Produktivitätseinbußen verursachen; D. in der Erwägung, dass die zunehmende Resistenz gegen antimikrobielle Wirkstoffe (antimicrobial resistance AMR) einen komplexen Sachverhalt darstellt, der sich aus einer Reihe zusammenhängender Faktoren ergibt; in der Erwägung, dass einzelne Interventionsmaßnahmen nur in geringem Maße wirksam sein werden; E. in der Erwägung, dass zwischen der steigenden AMR und der Entwicklung neuer antimikrobieller Wirkstoffe eine starke Diskrepanz besteht; in der Erwägung, dass seit den 1970er Jahren lediglich drei systemisch zu verabreichende Antibiotika gegen multiresistente grampositive Bakterien 1 entwickelt worden sind; in der Erwägung, dass zwei Drittel der Todesfälle in der EU, die mit antimikrobiellen Resistenzen in Zusammenhang stehen, auf gramnegative Bakterien zurückzuführen sind, und nicht zu erwarten ist, dass in absehbarer Zukunft neue Mittel auf den Markt gebracht werden; F. in der Erwägung, dass es mangels der Entwicklung neuer antibakterieller Arzneimittel von entscheidender Bedeutung ist, dass die antimikrobiellen Wirkstoffe, die im Moment verfügbar sind, so lange wie möglich wirksam genutzt werden können, indem der Verbreitung von Infektionen entgegengewirkt wird, alternative Behandlungsmethoden angewendet werden, antimikrobielle Mittel umsichtig genutzt werden und ihre Dosierung kontrolliert wird; G. in der Erwägung, dass zwischen dem Einsatz antmikrobieller Mittel bei Tieren und der Resistenzausbreitung beim Menschen ein Zusammenhang besteht und dieser Zusammenhang weiter erforscht werden muss; in der Erwägung, dass es in Bezug auf AMR eines koordinierten, multisektoriellen Politikansatzes bedarf, mit dem gezielt Ärzte und Anwender angesprochen werden; 1 Bezieht sich darauf, ob die Mikroorganismen die bei der Anwendung der Methode der Gram-Färbung genutzte violette Färbung annehmen oder nicht. Die Beurteilung der Färbungseigenschaften gilt als bewährte Methode zur Klassifizierung von Bakterien. PR\ doc 5/13 PE v01-00
6 H. in der Erwägung, dass auf europäischer Ebene immer noch ein Mangel an ausreichend detaillierten und vergleichbaren Daten zum Zwecke der umfassenden länderübergreifenden Überwachung und Analyse besteht, in deren Rahmen ein Zusammenhang zwischen der Verwendung antimikrobieller Mittel und der Resistenz hergestellt werden kann; 1. vertritt die Auffassung, dass zwar nahezu alle Mitgliedstaaten nationale AMR-Strategien ausgearbeitet haben, jedoch bis jetzt nur langsam Fortschritte erreicht werden konnten, die sich darüber hinaus uneinheitlich gestalten; fordert, dass die Regierungen alles daran setzen, die Ziele auf nationaler Ebene vollständig und rechtzeitig umzusetzen; Umsichtige Verwendung antimikrobieller Stoffe in der Human- und Tiermedizin 2. betont, dass das Hauptziel jeglicher AMR-Strategie darin bestehen muss, die Wirksamkeit bereits vorhandener antimikrobieller Wirkstoffe zu erhalten, indem sie verantwortungsvoll in der korrekten therapeutischen Breite und ausschließlich im Rahmen einer Verschreibung über einen beschränkten Zeitraum in einer angemessenen Dosierung eingesetzt werden und die Verabreichung antimikrobieller Wirkstoffe im Allgemeinen und insbesondere antimikrobieller Wirkstoffe von besonderer Bedeutung (Critically-Important Antimicrobials CIA) 1 in der Human- und Tiermedizin reduziert wird; 3. betont, dass weitere Anstrengungen vonnöten sind, um die Verwendung antimikrobieller Wirkstoffe im Veterinärbereich zu überwachen; lehnt einen unkontrollierten, vorbeugenden Einsatz antimikrobieller Wirkstoffe in der Tierhaltung entschieden ab; 4. fordert die Kommission auf, einen Legislativvorschlag für die Beschränkung des Einsatzes von CIA der dritten und vierten Generation beim Menschen vorzulegen; betont, dass ein derartiger Vorschlag auf faktengestützten europäischen Leitlinien für die umsichtige Nutzung antimikrobieller Mittel in der Tiermedizin beruhen muss; 5. fordert die Kommission auf, mit neuem Elan ihren Fortschrittsbericht über die Umsetzung des AMR-Aktionsplans bis Ende 2013 vorzulegen; 6. fordert die Kommission auf, die Umsetzung der einschlägigen europäischen Gesetzgebung über antimikrobielle Wirkstoffe in Bezug auf deren ausschließlich im Rahmen einer ärztlichen Verschreibung möglichen Anwendung und das Verbot der Verwendung antimikrobieller Wirkstoffe als Wachstumsförderer in der Tierernährung zu bewerten und zu überwachen; Vorbeugung 7. begrüßt im Hinblick darauf, den Einsatz und die Zugänglichkeit antimikrobieller Wirkstoffe einzuschränken, die Initiativen der Mitgliedstaaten zur Überprüfung des Rechtsstatus aller oralen, zu inhalierenden und parenteralen Antibiotika (d. h. Arzneimittel zur Behandlung von Malaria, Viren und Pilzen), die Patienten rezeptfrei zugänglich sind; 1 Bericht über die erste Sitzung der WHO-Beratungsgruppe für integrierte Überwachung der Antibiotikaresistenz [AGISAR], Kopenhagen, 2009). PE v /13 PR\ doc
7 8. betont, dass die Impfstoffe in Bezug auf die Beschränkung der Ausbildung von AMR eine wichtige Rolle spielen, da durch sie die Menge der antimikrobiellen Wirkstoffe gesenkt wird, die zur Behandlung von Infektionen eingesetzt werden müssen; 9. fordert die Kommission auf, Leitlinien zur umsichtigen Verwendung und zur Senkung der unnötigen und unangemessenen Verwendung antimikrobieller Wirkstoffe in der Humanund der Tiermedizin sowie in Tierhaltung, Landwirtschaft, Aquakultur und im Pflanzenanbau auszuarbeiten und zu fördern; Entwicklung neuer antimikrobieller Mittel oder alternativer Behandlungsmethoden 10. fordert die Kommission und die Mitgliedstaaten auf, Bemühungen zur Entwicklung neuer und innovativer Geschäftsmodelle im Rahmen öffentlich-privater Partnerschaften (ÖPP) zu fördern, bei denen Investitionen in Forschung und Entwicklung in Bezug auf neue Antibiotika und Diagnosemöglichkeiten von Verkaufstransaktionen abgekoppelt werden, um eine breitere Zugänglichkeit und Erschwinglichkeit zu fördern und die unnötige Verwendung antimikrobieller Stoffe zu senken; 11. hält es für dringend geboten, dass CIA und neu entwickelte antimikrobielle Mittel und Technologien für die Verwendung in der Human- und Tiermedizin in nur begrenztem Maße eingesetzt werden; betont, dass CIA angemessen zielgerichtet und nur in spezifischen Fällen eingesetzt werden dürfen; 12. fordert die Kommission und die Mitgliedstaaten auf, neue ordnungspolitische Ansätze, u. a. die Übertragbarkeit von Rechten des geistigen Eigentums und die Verlängerung des Patentschutzes, mit dem Ziel zu prüfen, Investitionen des Privatsektors in die Entwicklung antimikrobieller Wirkstoffe zu fördern; Überwachung und Berichterstattung 13. fordert die Kommission und die Mitgliedstaaten auf, in Bezug auf die Früherkennung pathogener Bakterien mit antimikrobieller Resistenz bei Menschen, Tieren, Fischen und Lebensmitteln eine engere Zusammenarbeit und Koordinierung anzustreben, damit das Ausmaß und die Zunahme von AMR stetig überwacht werden; 14. hält es für überaus wichtig, dass ein europäisches Netzwerk nationaler Überwachungssysteme für die menschliche Gesundheit und den Veterinärbereich eingerichtet wird, damit eindeutige, vergleichbare, transparente und aktuelle Referenzdaten über die Verwendung antimikrobieller Arzneimittel erhoben werden können; vertritt die Auffassung, dass sich dieses Netzwerk auf bestehende Überwachungssysteme im Rahmen der EFSA, d. h. auf das Europäische Netz zur Überwachung des Verbrauchs antimikrobieller Substanzen (ESAC-Netz) beim ECDC, das Europäische Netz zur Überwachung von Resistenzen gegen antimikrobielle Wirkstoffe (EARS-Netz) beim ECDC und die Europäische Überwachung des Verbrauchs antimikrobieller Substanzen in der Veterinärmedizin (ESVAC) bei der EMA stützen sollte; Kommunikation, Aus- und Weiterbildung PR\ doc 7/13 PE v01-00
8 15. weist darauf hin, dass es von einem Sinneswandel der Patienten, Landwirte und praktizierenden Human- und Tiermediziner sowie einer Änderung ihrer Gewohnheiten abhängt, ob antimikrobielle Mittel vernünftig eingesetzt werden; vertritt die Auffassung, dass auf nationaler und europäischer Ebene mehr wirksame und regelmäßig stattfindende Aus- und Weiterbildungsmaßnahmen angeboten werden sollten; 16. begrüßt den jährlichen Europäischen Antibiotikatag (18. November), der eingeführt wurde, um auf einen verantwortungsvollen Einsatz antimikrobieller Wirkstoffe hinzuwirken; vertritt jedoch die Auffassung, dass die Öffentlichwirksamkeit und das Potenzial dieses Tages im Rahmen koordinierter, innovativer und effektiver Kampagnen noch mehr gesteigert werden könnten, wenn darin die Erfahrungen einfließen, die bei erfolgreichen europäischen und internationalen Initiativen gesammelt worden sind; 17. fordert die Kommission auf, eine Liste bewährter Verfahren für die Umsetzung wirksamer Kommunikationskampagnen und von Maßnahmen zur beruflichen Fortbildung mit dem Ziel der Sensibilisierung für AMR zu erstellen; Internationale Zusammenarbeit 18. weist darauf hin, dass der zunehmende internationale Reiseverkehr und vor allem der weltweite Lebens- und Futtermittelhandel dazu beitragen dürften, dass sich AMR grenzüberschreitend verbreiten; vertritt die Auffassung, dass nur mit abgestimmten und rechtzeitigen Maßnahmen auf internationaler Ebene, mit denen Überschneidungen verhindert werden und eine kritische Masse gebildet wird, Fortschritte in Bezug darauf erreicht werden können, die von AMR weltweit für die öffentliche Gesundheit ausgehenden Gefahren zu verringern; 19. hält die durch die Weltgesundheitsorganisation (WHO), die Weltorganisation für Tiergesundheit (OIE), die Ernährungs- und Landwirtschaftsorganisation der Vereinten Nationen (FAO) und durch andere einschlägige, auf globaler Ebene agierende Organisationen eingeleiteten Initiativen für äußerst wichtig; weist jedoch darauf hin, dass die beschlossenen internationalen Standards und Leitlinien weltweit unbedingt eingehalten werden müssen; fordert die Kommission auf, im Rahmen ihrer Bewertung der Umsetzung des derzeitigen AMR-Aktionsplans über den Fortschritt der Mitgliedstaaten in Bezug auf die wesentlichen international bestehenden Verpflichtungen zu AMR Bericht zu erstatten; 20. begrüßt die Einrichtung der TATFAR und die Empfehlungen, die im September 2011 in Bezug auf die künftige Zusammenarbeit zwischen der EU und den USA angenommen wurden; betont dass insbesondere in den folgenden Bereichen konkrete Maßnahmen ergriffen werden müssen: bei der Erhebung vergleichbarer Daten und beim Austausch von Daten über antimikrobielle Wirkstoffe im Veterinärbereich, bei der Entwicklung gemeinsamer Vorlagen für den Umgang mit therapieassoziierten Infektionen auf der Grundlage bewährter Verfahren; für eine erweiterte Zusammenarbeit zwischen der US-amerikanischen Lebens- und PE v /13 PR\ doc
9 Arzneimittelbehörde und der EMA in Bezug auf koordinierte Ansätze zur Förderung der Entwicklung antibakterieller Arzneimittel und deren Regulierung, insbesondere bei der klinischen Prüfung; o o o 21. beauftragt seinen Präsidenten, diese Entschließung dem Rat, der Kommission und den Mitgliedstaaten zu übermitteln. PR\ doc 9/13 PE v01-00
10 BEGRÜNDUNG Seit der Entwicklung des Penizillins in den 1930er Jahren haben antimikrobielle Mittel die human- und tiermedizinische Praxis revolutioniert, in Bezug auf viele gefährliche und oftmals tödlich verlaufenden Bakterieninfektionen zu einer erheblichen Senkung der Sterblichkeit beigetragen und dazu geführt, dass die invasive Chirurgie breite Anwendung finden konnte. Der überragende medizinische Fortschritt des Antibiotikazeitalters läuft jedoch Gefahr, von der zunehmenden Bedrohung durch Resistenzen gegen antimikrobielle Wirkstoffe (AMR) unterlaufen zu werden. Antimikrobielle Resistenz bedeutet, dass mikrobielle Organismen sich trotz der Verabreichung eines antimikrobiellen Mittels in einer Dosis, die unter normalen Umständen ausreicht, um Mikroorganismen derselben Art zu hemmen oder abzutöten, vermehren und überleben. In der Folge können antimikrobielle Organismen eine überaus starke Resistenz gegen bestimmte antimikrobielle Mittel entwickeln, auf die sie normalerweise reagieren 1. Nachdem antimikrobielle Mittel seit nunmehr achtzig Jahren eingesetzt werden, hat die Tatsache, dass sich infektiöse Mikroben weiterentwickeln und anpassen, dazu geführt, dass viele antimikrobielle Wirkstoffe nicht mehr wirksam sind. Diese sich abzeichnende Krise ist das Ergebnis zweier grundlegender zusammenhängender Probleme: des unangemessenen Einsatzes antmikrobieller Wirkstoffe in der Human- und Tiermedizin und einer Innovationslücke von 40 Jahren bei der Entwicklung neuer antimikrobieller Wirkstoffe, die auf die niedrige Rendite von Investitionen in Forschung und Entwicklung zurückzuführen ist. Das Problem der AMR hat sich durch die Herausbildung multipler Arzneimittelresistenzen einiger bakterieller Organismen weiter verstärkt, da diese Resistenzen die Wirksamkeit einer Reihe antimikrobieller Wirkstoffe beeinträchtigen können, die miteinander nicht in Zusammenhang stehen, sowie eine Gefahr für die Behandlungsmethoden für Mensch und Tier darstellen, die Genesung verzögern oder dazu führen können, dass die Behandlung erfolglos bleibt. Neben dem durchaus bekannten, äußerst schwer zu behandelnden MRSA-Bakterium (methicillin-resistenter Staphylococcus aureus), das üblicherweise von Patienten weitergetragen wird, die in verschiedenen Krankenhäusern behandelt werden, haben wir es mit einer langen Liste multiresistenter Infektionen zu tun, zu denen u. a. Infektionen der ableitenden Harnwege, Lungenentzündung und Tuberkulose zählen. Laut der Weltgesundheitsorganisation (WHO) gibt es weltweit mindestens Einzelfälle multiresistenter Tuberkulose mit Todesfällen pro Jahr 2. Es überrascht daher kaum, dass die Gesundheitssysteme in Europa sich aufgrund dieser multiresistenten Infektionen bereits mit zunehmenden Ausgaben konfrontiert sehen. Einerseits sind die Arzneimittel, die zur Behandlung dieser Fälle benötigt werden, oft sehr teuer, andererseits dauert die Behandlung inzwischen länger und ist komplexer. Laut der WHO und des Europäischen Zentrums für die Prävention und die Kontrolle von Krankheiten (ECDC) PE v /13 PR\ doc
11 haben multiresistente Infektionen in der EU, in Norwegen und in Island 1 im Jahr 2007 zu über 2,5 Millionen zusätzlichen Krankenhaustagen und in derselben Region zu zusätzlichen Todesfällen 2 geführt. Wenn keine konzertierten Maßnahmen zur Lösung des zunehmenden Problems der antimikrobiellen Resistenz ergriffen werden, ist zu erwarten, dass diese Zahlen in den kommenden Jahren signifikant steigen werden. Darüber hinaus wird die Herausbildung arzneimittelresistenter Organismen durch die heutzutage üblichen Behandlungsmethoden sogar noch begünstigt d. h. durch den unangemessenen Einsatz antimikrobieller Mittel, nicht zuletzt die verantwortungslose Überdosierung, die Einnahme minderwertiger Antibiotika und das Versäumnis, den Behandlungszyklus zu beenden, wie er durch einen qualifizierten Arzt verschrieben wird. Neben dieser verschwenderischen Einnahme antimikrobieller Wirkstoffe spielt darüber hinaus der Zusammenhang zwischen ihrer Anwendung in der Tierhaltung und der Verbreitung der Resistenz beim Menschen eine Rolle. Alle Bakterien bilden aufgrund ihrer natürlichen Flexibilität Gene aus, die sie dazu befähigen, eine Resistenz gegen jedweden antimikrobiellen Wirkstoff zu entwickeln, und durch die Vernichtung von Bakterien mit einer Empfindlichkeit gegenüber antimikrobiellen Wirkstoffen können antimikrobielle Wirkstoffe wiederum zu einem Selektionsdruck führen, der zur Überpopulation der Bakterien führt, die eine Resistenz aufweisen. Mit der zeitlich ausgedehnten Verabreichung antimikrobieller Mittel wird daher die weite Verbreitung resistenter Stämme begünstigt. Das Problem verstärkt sich weiter durch einen merklichen Rückgang der Entwicklung neuer antimikrobieller Wirkstoffe. Während die Liste der arzneimittelrestistenten Mikroben immer länger wird, werden nur relativ wenige neue antimikrobielle Wirkstoffe entwickelt und für die Behandlung einiger arzneimittelresistenter Organismen, die sich derzeit vermehren, sogar überhaupt keine. Daher ist zu erwarten, dass die Tendenz von immer schwieriger zu behandelnden Infektionen weiter zunehmen wird, wenn keine koordinierten Präventions- und Kontrollmaßnahmen verfolgt werden, um der Resistenz gegen antimikrobielle Wirkstoffe entgegenzuwirken. Dies wird alarmierende Folgen nach sich ziehen: Antimikrobielle Mittel, für die sich Forschung und Entwicklung auf mehrere zehn Millionen Euro beläuft und deren Markteinführung nahezu ein Jahrzehnt in Anspruch nimmt, haben eine immer kürzere Wirkungsspanne. Einerseits verbreiten sich Resistenzen, andererseits verkürzt sich die Wirkungsspanne antimikrobieller Mittel, und während immer weniger neue antimikrobielle Wirkstoffe zugänglich gemacht werden, wird die Diskrepanz zwischen den Infektionen und ihrer Eindämmung immer größer. Laut der WHO bringen AMR die Gefahr der Rückkehr in das Post-Antibiotika-Zeitalter mit sich. 3 Aufgrund der Tatsache, dass infektiöse Erkrankungen keine Grenzen kennen, stellt die Zunahme an arzneimittelresistenten Mikroben ein weltweites Problem dar, dem auch auf nhagen_eupresidency.pdf 3 PR\ doc 11/13 PE v01-00
12 weltweiter Ebene begegnet werden muss. Jedoch ist weiterhin von entscheidender Bedeutung, dass die EU konzertierte Maßnahmen zur Lösung dieses Problems ergreift. Während der vergangenen zehn Jahre haben der Europäische Rat in seinen Schlussfolgerungen und das Europäische Parlament in seinen Entschließungen wiederholt eine umsichtige Nutzung der verfügbaren antimikrobiellen Mittel und die Förderung von Initiativen gefordert, die der Entwicklung neuer Mittel dienen. Diesen Schlussfolgerungen und Entschließungen muss nun seitens der Mitgliedstaaten und der EU dringend entsprochen werden. Es sei an dieser Stelle daran erinnert, dass das Problem der AMR nicht durch eine einfache Lösung bewältigt werden kann. Vielmehr ist ein vielschichtiger Ansatz vonnöten: Umsichtige Verwendung antimikrobieller Stoffe in der Human- und Tiermedizin Vor allem muss unbedingt dafür gesorgt werden, dass antimikrobielle Mittel umsichtig eingesetzt werden. Dies bedeutet, dass Antibiotika der Verschreibungspflicht durch einen Arzt unterliegen müssen und nicht grundlos eingesetzt werden dürfen wie z. B. für die Behandlung weit verbreiteter Virusinfektionen des Menschen; auch muss im gesamten Veterinärbereich auf eine umsichtige Verwendung geachtet werden. Um diese Ziele zu erreichen, müssen die Kommission und die Mitgliedstaaten bei der Entwicklung kompatibler strategischer Aktionspläne mit dem Ziel der umsichtigen Verwendung zusammenarbeiten. Vorbeugung Es müssen unbedingt bessere Maßnahmen zur Vorbeugung der Ausbildung und Verbreitung der Arzneimittelresistenz ergriffen werden. Dies umfasst auch eine verbesserte Überwachung und ein besseres Meldesystem für arzneimittelresistente Organismen sowie eine wirksamere Infektionskontrolle, die auch Impfungen umfasst. Entwicklung neuer antimikrobieller Mittel oder alternativer Behandlungsmethoden Einerseits muss dafür gesorgt werden, dass sich weniger Resistenzen gegen Arzneimittel ausbilden, andererseits muss jedoch auch die Entwicklung neuer antimikrobieller Mittel gefördert werden. Ein Mittel zum Fortschritt könnten öffentlich-private Partnerschaften sein jedoch müssen auch neue ordnungspolitische Ansätze geprüft werden, mit denen die Forschung in der Industrie und die Entwicklung neuer antimikrobieller Mittel gefördert werden können, und in deren Rahmen auch für die Sicherheit der Patienten gesorgt ist. Überwachung und Berichterstattung Um wirksame Maßnahmen ergreifen zu können, bedarf es korrekter und aktueller Daten aus allen Mitgliedstaaten. Daher ist es wichtig, dass eine europaweite Überwachung im Bereich der Human- sowie der Veterinärmedizin erfolgt. Darüber hinaus müssen unbedingt vergleichbare, transparente und aktuelle Referenzdaten über die Verwendung antimikrobieller Arzneimittel in allen Mitgliedstaaten erhoben werden. Kommunikation, Aus- und Weiterbildung Zur Bekämpfung der zunehmenden Resistenz gegen mikrobielle Wirkstoffe ist ein Austausch bewährter Verfahren und eine bessere Kommunikation sowie Aus- und Weiterbildung praktizierender Human- und Tiermediziner notwendig. Darüber hinaus ist eine bessere Vermittlung von Informationen über dieses Thema an die Öffentlichkeit entscheidend, um zu erreichen, dass die Patienten die fraglichen Mittel umsichtig nutzen. PE v /13 PR\ doc
13 Internationale Zusammenarbeit Aufgrund der Tatsache, dass infektiöse Erkrankungen keine Grenzen kennen, muss dem Problem auch auf weltweiter Ebene begegnet werden. Die Arbeit der Transatlantischen Taskforce zur Antibiotikaresistenz (TATFAR) ist ein hervorragendes Beispiel für die internationale Zusammenarbeit im Bereich AMR, und ein vergleichbares multilaterales und bilaterales Engagement sollte gefördert werden. PR\ doc 13/13 PE v01-00
ENTSCHLIESSUNGSANTRAG
 EUROPÄISCHES PARLAMENT 2009-2014 Plenarsitzung 1.3.2011 B7-000/2011 ENTSCHLIESSUNGSANTRAG eingereicht im Anschluss an die Anfrage zur mündlichen Beantwortung B7-000/2011 gemäß Artikel 115 Absatz 5 der
EUROPÄISCHES PARLAMENT 2009-2014 Plenarsitzung 1.3.2011 B7-000/2011 ENTSCHLIESSUNGSANTRAG eingereicht im Anschluss an die Anfrage zur mündlichen Beantwortung B7-000/2011 gemäß Artikel 115 Absatz 5 der
Antimikrobielle Resistenz als Gefahr für die öffentliche Gesundheit
 P7_TA(2011)0473 Antimikrobielle Resistenz als Gefahr für die öffentliche Gesundheit Entschließung des Europäischen Parlaments vom 27. Oktober 2011 zu dem Thema Antimikrobielle Resistenz als Gefahr für
P7_TA(2011)0473 Antimikrobielle Resistenz als Gefahr für die öffentliche Gesundheit Entschließung des Europäischen Parlaments vom 27. Oktober 2011 zu dem Thema Antimikrobielle Resistenz als Gefahr für
ENTWURF EINER STELLUNGNAHME
 EUROPÄISCHES PARLAMENT 2014-2019 Ausschuss für Umweltfragen, öffentliche Gesundheit und Lebensmittelsicherheit 5.1.2015 2014/2204(INI) ENTWURF EINER STELLUNGNAHME des Ausschusses für Umweltfragen, öffentliche
EUROPÄISCHES PARLAMENT 2014-2019 Ausschuss für Umweltfragen, öffentliche Gesundheit und Lebensmittelsicherheit 5.1.2015 2014/2204(INI) ENTWURF EINER STELLUNGNAHME des Ausschusses für Umweltfragen, öffentliche
ENTWURF EINES BERICHTS
 EUROPÄISCHES PARLAMENT 2009 2014 Rechtsausschuss 21.6.2012 2012/2038INI ENTWURF EINES BERICHTS über den Bericht über die Umsetzung und die Auswirkungen der Folgerecht- Richtlinie (2001/84/EG) (2012/2038(INI))
EUROPÄISCHES PARLAMENT 2009 2014 Rechtsausschuss 21.6.2012 2012/2038INI ENTWURF EINES BERICHTS über den Bericht über die Umsetzung und die Auswirkungen der Folgerecht- Richtlinie (2001/84/EG) (2012/2038(INI))
ENTWURF EINES BERICHTS
 EUROPÄISCHES PARLAMENT 2014-2019 Rechtsausschuss 2014/2151(INI) 5.2.2015 ENTWURF EINES BERICHTS zum EU-Aktionsplan für einen neuen Konsens über die Durchsetzung von Immaterialgüterrechten (2014/2151(INI))
EUROPÄISCHES PARLAMENT 2014-2019 Rechtsausschuss 2014/2151(INI) 5.2.2015 ENTWURF EINES BERICHTS zum EU-Aktionsplan für einen neuen Konsens über die Durchsetzung von Immaterialgüterrechten (2014/2151(INI))
EMPFEHLUNG DER KOMMISSION. vom
 EUROPÄISCHE KOMMISSION Brüssel, den 3.10.2017 C(2017) 6560 final EMPFEHLUNG DER KOMMISSION vom 3.10.2017 zur Durchführung der Bestimmungen des Schengener Grenzkodexes über die vorübergehende Wiedereinführung
EUROPÄISCHE KOMMISSION Brüssel, den 3.10.2017 C(2017) 6560 final EMPFEHLUNG DER KOMMISSION vom 3.10.2017 zur Durchführung der Bestimmungen des Schengener Grenzkodexes über die vorübergehende Wiedereinführung
ENTWURF EINES BERICHTS
 EUROPÄISCHES PARLAMENT 2009 2014 Haushaltskontrollausschuss 23.1.2014 2013/2235(C) ENTWURF EINES BERICHTS betreffend die Entlastung für die Ausführung des Haushaltsplans des Europäischen Polizeiamts für
EUROPÄISCHES PARLAMENT 2009 2014 Haushaltskontrollausschuss 23.1.2014 2013/2235(C) ENTWURF EINES BERICHTS betreffend die Entlastung für die Ausführung des Haushaltsplans des Europäischen Polizeiamts für
10. BfR-Forum Verbraucherschutz: Antibiotika-Resistenzen Standortbestimmung und Perspektiven 23. und 24. November 2011
 10. BfR-Forum Verbraucherschutz: Antibiotika-Resistenzen Standortbestimmung und Perspektiven 23. und 24. November 2011 Susanne Mauersberg Referentin Gesundheitspolitik Verbraucherzentrale Bundesverband
10. BfR-Forum Verbraucherschutz: Antibiotika-Resistenzen Standortbestimmung und Perspektiven 23. und 24. November 2011 Susanne Mauersberg Referentin Gesundheitspolitik Verbraucherzentrale Bundesverband
EUROPÄISCHES PARLAMENT
 EUROPÄISCHES PARLAMENT 2004 2009 Ausschuss für Landwirtschaft und ländliche Entwicklung 2007/0244(CNS) 29.11.2007 * ENTWURF EINES BERICHTS über den Vorschlag für eine Verordnung des Rates zur Änderung
EUROPÄISCHES PARLAMENT 2004 2009 Ausschuss für Landwirtschaft und ländliche Entwicklung 2007/0244(CNS) 29.11.2007 * ENTWURF EINES BERICHTS über den Vorschlag für eine Verordnung des Rates zur Änderung
ENTWURF EINES BERICHTS
 Europäisches Parlament 2014-2019 Ausschuss für internationalen Handel 2015/2067(INI) 29.5.2015 ENTWURF EINES BERICHTS mit einem nichtlegislativen Entschließungsantrag zu dem Entwurf eines Beschlusses des
Europäisches Parlament 2014-2019 Ausschuss für internationalen Handel 2015/2067(INI) 29.5.2015 ENTWURF EINES BERICHTS mit einem nichtlegislativen Entschließungsantrag zu dem Entwurf eines Beschlusses des
Mitteilung. Aufruf der PEG zum umsichtigen Einsatz von Antibiotika aus Anlass der Veröffentlichung der Pariser WAAAR Deklaration
 Ihr Kontakt: Prof. Dr. Michael Kresken Geschäftsstelle der PEG Tel.: 02226/908 916 Fax: 02226/908 918 Email: geschaeftsstelle@p-e-g.org Rheinbach, 23. Juni 2014 Aufruf der PEG zum umsichtigen Einsatz von
Ihr Kontakt: Prof. Dr. Michael Kresken Geschäftsstelle der PEG Tel.: 02226/908 916 Fax: 02226/908 918 Email: geschaeftsstelle@p-e-g.org Rheinbach, 23. Juni 2014 Aufruf der PEG zum umsichtigen Einsatz von
Einsatz / Problematik Antibiotika in der Veterinärmedizin
 Einsatz / Problematik Antibiotika in der Veterinärmedizin 1 Inhalt 1. Ausgangslage 2. Aktuelle Situation und ergriffene Massnahmen in der Veterinärmedizin 3. Massnahmen für die unmittelbare Zukunft 4.
Einsatz / Problematik Antibiotika in der Veterinärmedizin 1 Inhalt 1. Ausgangslage 2. Aktuelle Situation und ergriffene Massnahmen in der Veterinärmedizin 3. Massnahmen für die unmittelbare Zukunft 4.
Antibiotika-Resistenzen
 Antibiotika-Resistenzen Position der Tiergesundheitsindustrie Dr. Dieter Schillinger Bundesverband für Tiergesundheit e.v., Bonn BfR-Forum Verbraucherschutz: Antibiotika-Resistenzen - Standortbestimmung
Antibiotika-Resistenzen Position der Tiergesundheitsindustrie Dr. Dieter Schillinger Bundesverband für Tiergesundheit e.v., Bonn BfR-Forum Verbraucherschutz: Antibiotika-Resistenzen - Standortbestimmung
INTERNATIONALE PHARMEZEUTISCHE FÖDERATION (FIP) FIP-GRUNDSATZERKLÄRUNG KONTROLLE DER RESISTENZ GEGEN ANTIMIKROBIELLE ARZNEIMITTEL (AMR)
 International Pharmaceutical Federation Fédération Internationale Pharmaceutique Postbus 84200, 2508 AE Den Haag, Niederlande INTERNATIONALE PHARMEZEUTISCHE FÖDERATION (FIP) FIP-GRUNDSATZERKLÄRUNG KONTROLLE
International Pharmaceutical Federation Fédération Internationale Pharmaceutique Postbus 84200, 2508 AE Den Haag, Niederlande INTERNATIONALE PHARMEZEUTISCHE FÖDERATION (FIP) FIP-GRUNDSATZERKLÄRUNG KONTROLLE
Rat der Europäischen Union Brüssel, den 14. November 2014 (OR. en)
 047053/EU XXV. GP Eingelangt am 21/11/14 Rat der Europäischen Union Brüssel, den 14. November 2014 (OR. en) 15441/14 SAN 429 VERMERK Absender: Empfänger: Betr.: Generalsekretariat des Rates Ausschuss der
047053/EU XXV. GP Eingelangt am 21/11/14 Rat der Europäischen Union Brüssel, den 14. November 2014 (OR. en) 15441/14 SAN 429 VERMERK Absender: Empfänger: Betr.: Generalsekretariat des Rates Ausschuss der
Labortests für Ihre Gesundheit. Warum und wann Antibiotika? 07
 Labortests für Ihre Gesundheit Warum und wann Antibiotika? 07 01IPF Labortests für Ihre Gesundheit Warum und wann Antibiotika? Infektionskrankheiten und ihre Behandlung heute und morgen Heutzutage ist
Labortests für Ihre Gesundheit Warum und wann Antibiotika? 07 01IPF Labortests für Ihre Gesundheit Warum und wann Antibiotika? Infektionskrankheiten und ihre Behandlung heute und morgen Heutzutage ist
Vorschlag für eine VERORDNUNG DES RATES
 EUROPÄISCHE KOMMISSION Brüssel, den 3.10.2012 COM(2012) 578 final 2012/0280 (NLE) Vorschlag für eine VERORDNUNG DES RATES über die Verwendung von Milchsäure zur Verringerung mikrobiologischer Oberflächenverunreinigungen
EUROPÄISCHE KOMMISSION Brüssel, den 3.10.2012 COM(2012) 578 final 2012/0280 (NLE) Vorschlag für eine VERORDNUNG DES RATES über die Verwendung von Milchsäure zur Verringerung mikrobiologischer Oberflächenverunreinigungen
50. Fortbildungsveranstaltung für Hals-Nasen- Ohrenärzte
 Expertenrunde: Informationen zu aktuellen medizinischen Themen: Evidente Therapie bei Infektionen Antibiotikaeinsatz, Indikationen für antivirale Therapie in der HNO Autor: Prof. Dr. med. Wolfgang Pfister,
Expertenrunde: Informationen zu aktuellen medizinischen Themen: Evidente Therapie bei Infektionen Antibiotikaeinsatz, Indikationen für antivirale Therapie in der HNO Autor: Prof. Dr. med. Wolfgang Pfister,
Federführende Ausschüsse: Ausschuss für Umweltfragen, öffentliche Gesundheit und Lebensmittelsicherheit (ENVI)
 ***I BERICHT über den Vorschlag für eine Verordnung des Jungen Europäischen Parlaments und des Rates zur Festsetzung von Emissionsnormen für neue Personenkraftwagen im Rahmen des Gesamtkonzepts der Europäischen
***I BERICHT über den Vorschlag für eine Verordnung des Jungen Europäischen Parlaments und des Rates zur Festsetzung von Emissionsnormen für neue Personenkraftwagen im Rahmen des Gesamtkonzepts der Europäischen
BactiGuard Infektionsschutz Katheter. ein gewaltiger Schritt in Richtung Infektionskontrolle
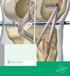
 BactiGuard Infektionsschutz Katheter ein gewaltiger Schritt in Richtung Infektionskontrolle Innovationen Exklusivvertrieb bei Menke-Med DIE HERAUSFORDERUNG Infektionen im Krankenhausbereich die vierthäufigste
BactiGuard Infektionsschutz Katheter ein gewaltiger Schritt in Richtung Infektionskontrolle Innovationen Exklusivvertrieb bei Menke-Med DIE HERAUSFORDERUNG Infektionen im Krankenhausbereich die vierthäufigste
Antibiotikaresistenzen Ein Ziel, eine Strategie. Damit Antibiotika auch morgen noch wirken
 Antibiotikaresistenzen Ein Ziel, eine Strategie Damit Antibiotika auch morgen noch wirken «Sensibilität und Wissen über Antibiotika und resistente Keime sind in der Tierärzteschaft stark gewachsen. Tierärztinnen
Antibiotikaresistenzen Ein Ziel, eine Strategie Damit Antibiotika auch morgen noch wirken «Sensibilität und Wissen über Antibiotika und resistente Keime sind in der Tierärzteschaft stark gewachsen. Tierärztinnen
Antibiotikaresistenzen ein Ziel, eine Strategie. Damit Antibiotika auch morgen noch wirken
 Antibiotikaresistenzen ein Ziel, eine Strategie Damit Antibiotika auch morgen noch wirken «Sensibilität und Wissen über Antibiotika und resistente Keime sind in der Tierärzteschaft stark gewachsen. Tierärztinnen
Antibiotikaresistenzen ein Ziel, eine Strategie Damit Antibiotika auch morgen noch wirken «Sensibilität und Wissen über Antibiotika und resistente Keime sind in der Tierärzteschaft stark gewachsen. Tierärztinnen
*** ENTWURF EINER EMPFEHLUNG
 EUROPÄISCHES PARLAMENT 2009-2014 Ausschuss für Umweltfragen, Volksgesundheit und Lebensmittelsicherheit 13.4.2010 2010/0016(NLE) *** ENTWURF EINER EMPFEHLUNG zu dem Vorschlag für einen Beschluss des Rates
EUROPÄISCHES PARLAMENT 2009-2014 Ausschuss für Umweltfragen, Volksgesundheit und Lebensmittelsicherheit 13.4.2010 2010/0016(NLE) *** ENTWURF EINER EMPFEHLUNG zu dem Vorschlag für einen Beschluss des Rates
Themenbox Antibiotikaresistenzen
 Berlin, 08.02.2012 Themenbox Antibiotikaresistenzen AZ Wen Antibiotika und Antibiotikaresistenzen Der Einsatz von Antibiotika in der landwirtschaftlichen Tierhaltung steht derzeit stark in der Kritik.
Berlin, 08.02.2012 Themenbox Antibiotikaresistenzen AZ Wen Antibiotika und Antibiotikaresistenzen Der Einsatz von Antibiotika in der landwirtschaftlichen Tierhaltung steht derzeit stark in der Kritik.
MITTEILUNG DER KOMMISSION AN DAS EUROPÄISCHE PARLAMENT UND DEN RAT. Aktionsplan zur Abwehr der steigenden Gefahr der Antibiotikaresistenz
 EUROPÄISCHE KOMMISSION Brüssel, den 15.11.2011 KOM(2011) 748 endgültig MITTEILUNG DER KOMMISSION AN DAS EUROPÄISCHE PARLAMENT UND DEN RAT Aktionsplan zur Abwehr der steigenden Gefahr der Antibiotikaresistenz
EUROPÄISCHE KOMMISSION Brüssel, den 15.11.2011 KOM(2011) 748 endgültig MITTEILUNG DER KOMMISSION AN DAS EUROPÄISCHE PARLAMENT UND DEN RAT Aktionsplan zur Abwehr der steigenden Gefahr der Antibiotikaresistenz
DELEGIERTE VERORDNUNG (EU).../... DER KOMMISSION. vom
 EUROPÄISCHE KOMMISSION Brüssel, den 24.3.2017 C(2017) 1951 final DELEGIERTE VERORDNUNG (EU).../... DER KOMMISSION vom 24.3.2017 zur Änderung der Delegierten Verordnung (EU) 2016/1675 zur Ergänzung der
EUROPÄISCHE KOMMISSION Brüssel, den 24.3.2017 C(2017) 1951 final DELEGIERTE VERORDNUNG (EU).../... DER KOMMISSION vom 24.3.2017 zur Änderung der Delegierten Verordnung (EU) 2016/1675 zur Ergänzung der
DELEGIERTE VERORDNUNG (EU).../... DER KOMMISSION. vom
 EUROPÄISCHE KOMMISSION Brüssel, den 24.11.2016 C(2016) 7495 final DELEGIERTE VERORDNUNG (EU).../... DER KOMMISSION vom 24.11.2016 zur Änderung der Delegierten Verordnung (EU) 2016/1675 der Kommission zur
EUROPÄISCHE KOMMISSION Brüssel, den 24.11.2016 C(2016) 7495 final DELEGIERTE VERORDNUNG (EU).../... DER KOMMISSION vom 24.11.2016 zur Änderung der Delegierten Verordnung (EU) 2016/1675 der Kommission zur
Vermerk: Keimgefahr aus der Massentierhaltung Victoria Döringer, Praktikantin im Abgeordnetenbüro Dr.Werner Langen
 Vermerk: Keimgefahr aus der Massentierhaltung 19.02.2016 Victoria Döringer, Praktikantin im Abgeordnetenbüro Dr.Werner Langen Hintergrundinformation: Multiresistente Keime - bezeichnen in der Medizin eine
Vermerk: Keimgefahr aus der Massentierhaltung 19.02.2016 Victoria Döringer, Praktikantin im Abgeordnetenbüro Dr.Werner Langen Hintergrundinformation: Multiresistente Keime - bezeichnen in der Medizin eine
Annahme Schlussfolgerungen des Rates zur Mitteilung der Kommission an das Europäische Parlament und den Rat. Zweiter Fahrplan für die TSE-Bekämpfung
 RAT R EUROPÄISCHEN UNION Brüssel, den 22. Oktober 2010 (26.10) (OR. en) 13889/10 ADD 1 REV 1 AGRILEG 119 VETER 31 I/A-PUNKT-VERMERK des Generalsekretariats für den AStV/Rat Betr.: Schlussfolgerungen des
RAT R EUROPÄISCHEN UNION Brüssel, den 22. Oktober 2010 (26.10) (OR. en) 13889/10 ADD 1 REV 1 AGRILEG 119 VETER 31 I/A-PUNKT-VERMERK des Generalsekretariats für den AStV/Rat Betr.: Schlussfolgerungen des
ENTWURF EINES BERICHTS
 EUROPÄISCHES PARLAMENT 2009-2014 Ausschuss für Wirtschaft und Währung 18.7.2012 2012/2150(INI) ENTWURF EINES BERICHTS über das Europäische Semester für die Koordinierung der Wirtschaftspolitik: Umsetzung
EUROPÄISCHES PARLAMENT 2009-2014 Ausschuss für Wirtschaft und Währung 18.7.2012 2012/2150(INI) ENTWURF EINES BERICHTS über das Europäische Semester für die Koordinierung der Wirtschaftspolitik: Umsetzung
Antibiotika- Ratgeber. Information für Patienten, Angehörige und Besucher
 Antibiotika- Ratgeber Information für Patienten, Angehörige und Besucher Wie wirkt ein Antibiotikum? Wenn Bakterien in unseren Körper eindringen, sich vermehren, damit das Abwehrsystem unseres Körpers
Antibiotika- Ratgeber Information für Patienten, Angehörige und Besucher Wie wirkt ein Antibiotikum? Wenn Bakterien in unseren Körper eindringen, sich vermehren, damit das Abwehrsystem unseres Körpers
ENTWURF EINES BERICHTS
 EUROPÄISCHES PARLAMENT 2009-2014 Ausschuss für Umweltfragen, öffentliche Gesundheit und Lebensmittelsicherheit 7.5.2013 2013/2022(INI) ENTWURF EINES BERICHTS über den Bericht der Kommission an den Rat
EUROPÄISCHES PARLAMENT 2009-2014 Ausschuss für Umweltfragen, öffentliche Gesundheit und Lebensmittelsicherheit 7.5.2013 2013/2022(INI) ENTWURF EINES BERICHTS über den Bericht der Kommission an den Rat
ENTWURF EINES BERICHTS
 EUROPÄISCHES PARLAMENT 2009-2014 Ausschuss für bürgerliche Freiheiten, Justiz und Inneres 14.10.2013 2013/2183(INI) ENTWURF EINES BERICHTS über den EU-Fahrplan zur Bekämpfung von Homophobie und Diskriminierung
EUROPÄISCHES PARLAMENT 2009-2014 Ausschuss für bürgerliche Freiheiten, Justiz und Inneres 14.10.2013 2013/2183(INI) ENTWURF EINES BERICHTS über den EU-Fahrplan zur Bekämpfung von Homophobie und Diskriminierung
BERICHT. DE In Vielfalt geeint DE. Europäisches Parlament A8-0257/
 Europäisches Parlament 2014-2019 Plenarsitzungsdokument A8-0257/2018 10.7.2018 BERICHT über den Europäischen Aktionsplan zur Bekämpfung antimikrobieller Resistenzen im Rahmen des Konzepts Eine Gesundheit
Europäisches Parlament 2014-2019 Plenarsitzungsdokument A8-0257/2018 10.7.2018 BERICHT über den Europäischen Aktionsplan zur Bekämpfung antimikrobieller Resistenzen im Rahmen des Konzepts Eine Gesundheit
Rat der Europäischen Union Brüssel, den 4. September 2016 (OR. en)
 Rat der Europäischen Union Brüssel, den 4. September 2016 (OR. en) 11638/16 UD 174 ENT 148 CORDROGUE 44 ÜBERMITTLUNGSVERMERK Absender: Eingangsdatum: 29. Juni 2016 Empfänger: Nr. Komm.dok.: Betr.: Herr
Rat der Europäischen Union Brüssel, den 4. September 2016 (OR. en) 11638/16 UD 174 ENT 148 CORDROGUE 44 ÜBERMITTLUNGSVERMERK Absender: Eingangsdatum: 29. Juni 2016 Empfänger: Nr. Komm.dok.: Betr.: Herr
ENTWURF EINER STELLUNGNAHME
 Europäisches Parlament 2014-2019 Ausschuss für Umweltfragen, öffentliche Gesundheit und Lebensmittelsicherheit 22.3.2017 2016/2327(INI) ENTWURF EINER STELLUNGNAHME des Ausschusses für Umweltfragen, öffentliche
Europäisches Parlament 2014-2019 Ausschuss für Umweltfragen, öffentliche Gesundheit und Lebensmittelsicherheit 22.3.2017 2016/2327(INI) ENTWURF EINER STELLUNGNAHME des Ausschusses für Umweltfragen, öffentliche
ÄNDERUNGSANTRÄGE 1-13
 Europäisches Parlament 2014-2019 Entwicklungsausschuss 2016/2220(INI) 7.12.2016 ÄNRUNGSANTRÄGE 1-13 Maria Heubuch (PE593.897v01-00) Staatenlosigkeit in Süd- und Südostasien (2016/2220(INI)) AM\1110548.docx
Europäisches Parlament 2014-2019 Entwicklungsausschuss 2016/2220(INI) 7.12.2016 ÄNRUNGSANTRÄGE 1-13 Maria Heubuch (PE593.897v01-00) Staatenlosigkeit in Süd- und Südostasien (2016/2220(INI)) AM\1110548.docx
Europäischer Wirtschafts- und Sozialausschuss STELLUNGNAHME. des Europäischen Wirtschafts- und Sozialausschusses. zu dem
 Europäischer Wirtschafts- und Sozialausschuss NAT/152 "Süßungsmittel" Brüssel, den 11. Dezember 2002 STELLUNGNAHME des Europäischen Wirtschafts- und Sozialausschusses zu dem "Vorschlag für eine Richtlinie
Europäischer Wirtschafts- und Sozialausschuss NAT/152 "Süßungsmittel" Brüssel, den 11. Dezember 2002 STELLUNGNAHME des Europäischen Wirtschafts- und Sozialausschusses zu dem "Vorschlag für eine Richtlinie
IDF Faktencheck 3/2017 Leitfaden zu Antibiotikaresistenzen im Milchsektor
 Deutsches Nationalkomitee im Internationalen Milchwirtschaftsverband IDF IDF Faktencheck 3/2017 Leitfaden zu Antibiotikaresistenzen im Milchsektor Einleitung Der vorliegende Faktencheck befasst sich mit
Deutsches Nationalkomitee im Internationalen Milchwirtschaftsverband IDF IDF Faktencheck 3/2017 Leitfaden zu Antibiotikaresistenzen im Milchsektor Einleitung Der vorliegende Faktencheck befasst sich mit
Der Bundesrat hat in seiner 930. Sitzung am 6. Februar 2015 gemäß 3 und 5 EUZBLG die folgende Stellungnahme beschlossen:
 Bundesrat Drucksache 417/14 (Beschluss) 06.02.15 Beschluss des Bundesrates Vorschlag für eine Verordnung des Europäischen Parlaments und des Rates über die Herstellung, das Inverkehrbringen und die Verwendung
Bundesrat Drucksache 417/14 (Beschluss) 06.02.15 Beschluss des Bundesrates Vorschlag für eine Verordnung des Europäischen Parlaments und des Rates über die Herstellung, das Inverkehrbringen und die Verwendung
Verordnung über das Inverkehrbringen von Pflanzenschutzmitteln
 Verordnung über das Inverkehrbringen von Pflanzenschutzmitteln (Pflanzenschutzmittelverordnung, PSMV) Änderung vom 31. Oktober 2018 Der Schweizerische Bundesrat verordnet: I Die Pflanzenschutzmittelverordnung
Verordnung über das Inverkehrbringen von Pflanzenschutzmitteln (Pflanzenschutzmittelverordnung, PSMV) Änderung vom 31. Oktober 2018 Der Schweizerische Bundesrat verordnet: I Die Pflanzenschutzmittelverordnung
BfR stuft den massiven Einsatz von Antibiotika in der Tierproduktion als bedenklich ein
 Antibiotikaresistente Keime auf Hähnchenfleisch-Proben sind nichts Neues BfR stuft den massiven Einsatz von Antibiotika in der Tierproduktion als bedenklich ein Berlin (10. Januar 2012) - Eine Stichprobe
Antibiotikaresistente Keime auf Hähnchenfleisch-Proben sind nichts Neues BfR stuft den massiven Einsatz von Antibiotika in der Tierproduktion als bedenklich ein Berlin (10. Januar 2012) - Eine Stichprobe
KOMMISSION DER EUROPÄISCHEN GEMEINSCHAFTEN. Vorschlag für eine ENTSCHEIDUNG DES RATES
 KOMMISSION R EUROPÄISCHEN GEMEINSCHAFTEN Brüssel, den 23.9.2009 KOM(2009) 500 endgültig 2009/0141 (AVC) Vorschlag für eine ENTSCHEIDUNG S RATES zur Übertragung besonderer Aufgaben im Zusammenhang mit der
KOMMISSION R EUROPÄISCHEN GEMEINSCHAFTEN Brüssel, den 23.9.2009 KOM(2009) 500 endgültig 2009/0141 (AVC) Vorschlag für eine ENTSCHEIDUNG S RATES zur Übertragung besonderer Aufgaben im Zusammenhang mit der
EMPFEHLUNG DER KOMMISSION. vom
 EUROPÄISCHE KOMMISSION Brüssel, den 29.6.2017 C(2017) 4393 final EMPFEHLUNG DER KOMMISSION vom 29.6.2017 zur steuerlichen Behandlung privater Altersvorsorgeprodukte und insbesondere des europaweiten privaten
EUROPÄISCHE KOMMISSION Brüssel, den 29.6.2017 C(2017) 4393 final EMPFEHLUNG DER KOMMISSION vom 29.6.2017 zur steuerlichen Behandlung privater Altersvorsorgeprodukte und insbesondere des europaweiten privaten
ENTWURF EINES ENTSCHLIESSUNGSANTRAGS
 Europäisches Parlament 2014-2019 Ausschuss für Umweltfragen, öffentliche Gesundheit und Lebensmittelsicherheit 24.3.2017 2017/2576(RSP) ENTWURF EINES ENTSCHLIESSUNGSANTRAGS eingereicht im Anschluss an
Europäisches Parlament 2014-2019 Ausschuss für Umweltfragen, öffentliche Gesundheit und Lebensmittelsicherheit 24.3.2017 2017/2576(RSP) ENTWURF EINES ENTSCHLIESSUNGSANTRAGS eingereicht im Anschluss an
15349/16 gha/jc 1 DG D 2A
 Rat der Europäischen Union Brüssel, den 8. Dezember 2016 (OR. en) 15349/16 JUSTCIV 318 EJUSTICE 213 BERATUNGSERGEBNISSE Absender: Generalsekretariat des Rates vom 8. Dezember 2016 Empfänger: Delegationen
Rat der Europäischen Union Brüssel, den 8. Dezember 2016 (OR. en) 15349/16 JUSTCIV 318 EJUSTICE 213 BERATUNGSERGEBNISSE Absender: Generalsekretariat des Rates vom 8. Dezember 2016 Empfänger: Delegationen
ENTWURF EINES BERICHTS
 Europäisches Parlament 2014-2019 Rechtsausschuss 2016/2011(INI) 6.6.2016 ENTWURF EINES BERICHTS über die Anwendung des Europäischen Mahnverfahrens (2016/2011(INI)) Rechtsausschuss Berichterstatter: Kostas
Europäisches Parlament 2014-2019 Rechtsausschuss 2016/2011(INI) 6.6.2016 ENTWURF EINES BERICHTS über die Anwendung des Europäischen Mahnverfahrens (2016/2011(INI)) Rechtsausschuss Berichterstatter: Kostas
Triclosan und Antibiotikaresistenz
 Seite 1/6 Triclosan und Antibiotikaresistenz Quelle: SCCS (2010) Übersicht & Details: GreenFacts Kontext - Triclosan wird vielen Konsumgütern wie Kosmetika und Reinigungsmitteln hinzugefügt, um Mikroorganismen
Seite 1/6 Triclosan und Antibiotikaresistenz Quelle: SCCS (2010) Übersicht & Details: GreenFacts Kontext - Triclosan wird vielen Konsumgütern wie Kosmetika und Reinigungsmitteln hinzugefügt, um Mikroorganismen
Europäisches Parlament
 Europäisches Parlament 204-209 ANGENOMMENE TEXTE P8_TA(206)0260 Ratifizierung des Protokolls von 200 zu dem Übereinkommen über schädliche und gefährliche Stoffe und Beitritt zu diesem Protokoll im Hinblick
Europäisches Parlament 204-209 ANGENOMMENE TEXTE P8_TA(206)0260 Ratifizierung des Protokolls von 200 zu dem Übereinkommen über schädliche und gefährliche Stoffe und Beitritt zu diesem Protokoll im Hinblick
mit dem Titel "Zahlreiche Verzögerungen bei den IT-Systemen für den Zoll: Was ist falsch gelaufen?" veröffentlicht.
 Rat der Europäischen Union Brüssel, den 22. Februar 2019 (OR. en) 6752/19 I/A-PUNKT-VERMERK Absender: Empfänger: Betr.: Generalsekretariat des Rates Ausschuss der Ständigen Vertreter/Rat UD 69 FIN 164
Rat der Europäischen Union Brüssel, den 22. Februar 2019 (OR. en) 6752/19 I/A-PUNKT-VERMERK Absender: Empfänger: Betr.: Generalsekretariat des Rates Ausschuss der Ständigen Vertreter/Rat UD 69 FIN 164
STANDPUNKT IN FORM VON ÄNDERUNGSANTRÄGEN
 Europäisches Parlament 2014-2019 Ausschuss für die Rechte der Frau und die Gleichstellung der Geschlechter 4.5.2017 2017/2025(INI) STANDPUNKT IN FORM VON ÄNRUNGSANTRÄGEN des Ausschusses für die Rechte
Europäisches Parlament 2014-2019 Ausschuss für die Rechte der Frau und die Gleichstellung der Geschlechter 4.5.2017 2017/2025(INI) STANDPUNKT IN FORM VON ÄNRUNGSANTRÄGEN des Ausschusses für die Rechte
Rat der Europäischen Union Brüssel, den 6. November 2015 (OR. en)
 Rat der Europäischen Union Brüssel, den 6. November 2015 (OR. en) 13762/15 NLEG 142 AGRI 575 SAN 367 ÜBERMITTLUNGSVERMERK Absender: Europäische Kommission Eingangsdatum: 4. November 2015 Empfänger: Nr.
Rat der Europäischen Union Brüssel, den 6. November 2015 (OR. en) 13762/15 NLEG 142 AGRI 575 SAN 367 ÜBERMITTLUNGSVERMERK Absender: Europäische Kommission Eingangsdatum: 4. November 2015 Empfänger: Nr.
Erklärung von Hermann Gröhe, Gesundheitsminister Mitglied des Deutschen Bundestags
 Erklärung von Hermann Gröhe, Gesundheitsminister Mitglied des Deutschen Bundestags anlässlich des Hochrangigen Ministertreffens auf VN-Ebene zu HIV/AIDS vom 8. 10. Juni 2016 in New York - 2 - - 2 - Sehr
Erklärung von Hermann Gröhe, Gesundheitsminister Mitglied des Deutschen Bundestags anlässlich des Hochrangigen Ministertreffens auf VN-Ebene zu HIV/AIDS vom 8. 10. Juni 2016 in New York - 2 - - 2 - Sehr
VERORDNUNGEN. (Text von Bedeutung für den EWR)
 30.4.2016 DE L 116/3 VERORDNUNGEN DURCHFÜHRUNGSVERORDNUNG (EU) 2016/672 DER KOMMISSION vom 29. April 2016 zur von Peressigsäure als alten Wirkstoff zur Verwendung in Biozidprodukten der en 1, 2, 3, 4,
30.4.2016 DE L 116/3 VERORDNUNGEN DURCHFÜHRUNGSVERORDNUNG (EU) 2016/672 DER KOMMISSION vom 29. April 2016 zur von Peressigsäure als alten Wirkstoff zur Verwendung in Biozidprodukten der en 1, 2, 3, 4,
Rat der Europäischen Union Brüssel, den 23. Juli 2014 (OR. en) Herr Uwe CORSEPIUS, Generalsekretär des Rates der Europäischen Union
 Rat der Europäischen Union Brüssel, den 23. Juli 2014 (OR. en) 12140/14 DENLEG 135 AGRI 512 SAN 296 ÜBERMITTLUNGSVERMERK Absender: Europäische Kommission Eingangsdatum: 22. Juli 2014 Empfänger: Nr. Komm.dok.:
Rat der Europäischen Union Brüssel, den 23. Juli 2014 (OR. en) 12140/14 DENLEG 135 AGRI 512 SAN 296 ÜBERMITTLUNGSVERMERK Absender: Europäische Kommission Eingangsdatum: 22. Juli 2014 Empfänger: Nr. Komm.dok.:
Europäisches Parlament
 Europäisches Parlament 2014-2019 ANGENOMMENE TEXTE Vorläufige Ausgabe P8_TA-PROV(2018)0465 Borreliose (Lyme-Krankheit) Entschließung des Europäischen Parlaments vom 15. November 2018 zu Lyme- Borreliose
Europäisches Parlament 2014-2019 ANGENOMMENE TEXTE Vorläufige Ausgabe P8_TA-PROV(2018)0465 Borreliose (Lyme-Krankheit) Entschließung des Europäischen Parlaments vom 15. November 2018 zu Lyme- Borreliose
5750/17 gt/bb/ab 1 DG D 1 A
 Rat der Europäischen Union Brüssel, den 3. Februar 2017 (OR. en) Interinstitutionelles Dossier: 2017/0014 (NLE) 5750/17 SCH-EVAL 35 FRONT 37 COMIX 70 A-PUNKT-VERMERK Absender: Empfänger: Generalsekretariat
Rat der Europäischen Union Brüssel, den 3. Februar 2017 (OR. en) Interinstitutionelles Dossier: 2017/0014 (NLE) 5750/17 SCH-EVAL 35 FRONT 37 COMIX 70 A-PUNKT-VERMERK Absender: Empfänger: Generalsekretariat
TOP 24 - Antrag der Fraktionen CDU/CSU und SPD
 DEUTSCHER BUNDESTAG Platz der Republik 1 11011 Berlin Tel. 030 227 77916 Fax 030 227 76916 Email: patricia.lips@bundestag.de Homepage: www.patricia-lips.de WAHLKREIS-GESCHÄFTSSTELLE: Hauptstr. 59 64711
DEUTSCHER BUNDESTAG Platz der Republik 1 11011 Berlin Tel. 030 227 77916 Fax 030 227 76916 Email: patricia.lips@bundestag.de Homepage: www.patricia-lips.de WAHLKREIS-GESCHÄFTSSTELLE: Hauptstr. 59 64711
Kurze Einführung Überblick über aktuelle Situation Aktionsplan gegen resistente Keime Dr. Steingruber 1
 Kurze Einführung Überblick über aktuelle Situation Aktionsplan gegen resistente Keime 10.11.2015 Dr. Steingruber 1 80 Wirkstoffe gegen Bakterien und doch zu wenige Zu teure Entwicklung für den seltenen
Kurze Einführung Überblick über aktuelle Situation Aktionsplan gegen resistente Keime 10.11.2015 Dr. Steingruber 1 80 Wirkstoffe gegen Bakterien und doch zu wenige Zu teure Entwicklung für den seltenen
Bundesrat Drucksache 740/ Unterrichtung durch die Europäische Kommission EU - AV - G - K - U
 Bundesrat 17.11.11 EU - AV - G - K - U Unterrichtung durch die Europäische Kommission Mitteilung Kommission an das Europäische Parlament und den Rat: Aktionsplan zur Abwehr steigenden Gefahr Antibiotikaresistenz
Bundesrat 17.11.11 EU - AV - G - K - U Unterrichtung durch die Europäische Kommission Mitteilung Kommission an das Europäische Parlament und den Rat: Aktionsplan zur Abwehr steigenden Gefahr Antibiotikaresistenz
10. BfR-Forum Antibiotikaresistenzen 24.November Position der Tierhalter
 10. BfR-Forum Antibiotikaresistenzen 24.November 2011 Position der Tierhalter Brigitte Wenzel Referentin für Tiergesundheit, Eier & Geflügel beim Deutschen Bauernverband b.wenzel@bauernverband.net 1 Über
10. BfR-Forum Antibiotikaresistenzen 24.November 2011 Position der Tierhalter Brigitte Wenzel Referentin für Tiergesundheit, Eier & Geflügel beim Deutschen Bauernverband b.wenzel@bauernverband.net 1 Über
London-Málaga-Deklaration zu. Investitionen in die Asthmaforschung
 London-Málaga-Deklaration zu Investitionen in die Asthmaforschung Einleitung Asthma ist eine Erkrankung, die das Leben von 30 Millionen Europäern und 300 Millionen Menschen in aller Welt jeden Tag aufs
London-Málaga-Deklaration zu Investitionen in die Asthmaforschung Einleitung Asthma ist eine Erkrankung, die das Leben von 30 Millionen Europäern und 300 Millionen Menschen in aller Welt jeden Tag aufs
Europäischer Wirtschafts- und Sozialausschuss STELLUNGNAHME
 Europäischer Wirtschafts- und Sozialausschuss TEN/392 "Verwaltungsorgane der europäischen Satellitennavigationsprogramme" Brüssel, den 15. Juli 2009 STELLUNGNAHME des Europäischen Wirtschafts- und Sozialausschusses
Europäischer Wirtschafts- und Sozialausschuss TEN/392 "Verwaltungsorgane der europäischen Satellitennavigationsprogramme" Brüssel, den 15. Juli 2009 STELLUNGNAHME des Europäischen Wirtschafts- und Sozialausschusses
***I ENTWURF EINES BERICHTS
 EUROPÄISCHES PARLAMENT 2009-2014 Rechtsausschuss 14.9.2012 2012/0224(COD) ***I ENTWURF EINES BERICHTS über den Vorschlag für eine Verordnung des Europäischen Parlaments und des Rates zur Einführung befristeter
EUROPÄISCHES PARLAMENT 2009-2014 Rechtsausschuss 14.9.2012 2012/0224(COD) ***I ENTWURF EINES BERICHTS über den Vorschlag für eine Verordnung des Europäischen Parlaments und des Rates zur Einführung befristeter
KOMMISSION DER EUROPÄISCHEN GEMEINSCHAFTEN. Empfehlung für eine ENTSCHEIDUNG DES RATES
 KOMMISSION DER EUROPÄISCHEN GEMEINSCHAFTEN Brüssel, den 8.1.2003 SEK (2003) 9 endgültig EU EINGESCHRÄNKTE VERTEILUNG Empfehlung für eine ENTSCHEIDUNG DES RATES über das Bestehen eines übermäßigen Defizits
KOMMISSION DER EUROPÄISCHEN GEMEINSCHAFTEN Brüssel, den 8.1.2003 SEK (2003) 9 endgültig EU EINGESCHRÄNKTE VERTEILUNG Empfehlung für eine ENTSCHEIDUNG DES RATES über das Bestehen eines übermäßigen Defizits
Bundesrat Drucksache 509/08. Unterrichtung durch das Europäische Parlament
 Bundesrat Drucksache 509/08 11.07.08 Unterrichtung durch das Europäische Parlament Legislative Entschließung des Europäischen Parlaments vom 17. Juni 2008 zu dem Vorschlag für eine Entscheidung des Rates
Bundesrat Drucksache 509/08 11.07.08 Unterrichtung durch das Europäische Parlament Legislative Entschließung des Europäischen Parlaments vom 17. Juni 2008 zu dem Vorschlag für eine Entscheidung des Rates
(Text von Bedeutung für den EWR)
 L 21/74 DE DURCHFÜHRUNGSVERORDNUNG (EU) 2016/105 DER KOMMISSION vom 27. Januar 2016 zur von Biphenyl-2-ol als alten Wirkstoff zur Verwendung in Biozidprodukten der en 1, 2, 4, 6 und 13 (Text von Bedeutung
L 21/74 DE DURCHFÜHRUNGSVERORDNUNG (EU) 2016/105 DER KOMMISSION vom 27. Januar 2016 zur von Biphenyl-2-ol als alten Wirkstoff zur Verwendung in Biozidprodukten der en 1, 2, 4, 6 und 13 (Text von Bedeutung
Zweite Verordnung zur Änderung der Verordnung über tierärztliche Hausapotheken
 Bun d esrat Drucksache 759/17 (Beschluss) 02.02.18 Beschluss des Bundesrates Zweite Verordnung zur Änderung der Verordnung über tierärztliche Hausapotheken Der Bundesrat hat in seiner 964. Sitzung am 2.
Bun d esrat Drucksache 759/17 (Beschluss) 02.02.18 Beschluss des Bundesrates Zweite Verordnung zur Änderung der Verordnung über tierärztliche Hausapotheken Der Bundesrat hat in seiner 964. Sitzung am 2.
Die Delegationen erhalten in der Anlage das Dokument COM(2016) 437 final.
 Rat der Europäischen Union Brüssel, den 1. Juli 2016 (OR. en) Interinstitutionelles Dossier: 2016/0200 (NLE) 10864/16 ENV 473 WTO 186 VORSCHLAG Absender: Eingangsdatum: 1. Juli 2016 Empfänger: Nr. Komm.dok.:
Rat der Europäischen Union Brüssel, den 1. Juli 2016 (OR. en) Interinstitutionelles Dossier: 2016/0200 (NLE) 10864/16 ENV 473 WTO 186 VORSCHLAG Absender: Eingangsdatum: 1. Juli 2016 Empfänger: Nr. Komm.dok.:
EU-Initiativen zur Verbesserung der Patientensicherheit unter Einschluss der Prävention und Eindämmung therapieassoziierter Infektionen
 EU-Initiativen zur Verbesserung der Patientensicherheit unter Einschluss der Prävention und Eindämmung therapieassoziierter Infektionen Brüssel, Juni 2014 I. Umsetzungsbericht zur Patientensicherheit vom
EU-Initiativen zur Verbesserung der Patientensicherheit unter Einschluss der Prävention und Eindämmung therapieassoziierter Infektionen Brüssel, Juni 2014 I. Umsetzungsbericht zur Patientensicherheit vom
ENTWURF EINES BERICHTS
 Europäisches Parlament 2014-2019 Ausschuss für Beschäftigung und soziale Angelegenheiten 2015/2107(INI) 29.5.2015 ENTWURF EINES BERICHTS über den strategischen Rahmen der EU für Gesundheit und Sicherheit
Europäisches Parlament 2014-2019 Ausschuss für Beschäftigung und soziale Angelegenheiten 2015/2107(INI) 29.5.2015 ENTWURF EINES BERICHTS über den strategischen Rahmen der EU für Gesundheit und Sicherheit
PUBLIC RAT DER EUROPÄISCHEN UNION. Brüssel, den 20. Oktober 2009 (06.11) (OR. en) 13644/09 LIMITE PV/CONS 48 COMPET 397 RECH 289
 Conseil UE RAT DER EUROPÄISCHEN UNION Brüssel, den 20. Oktober 2009 (06.11) (OR. en) PUBLIC 13644/09 LIMITE PV/CONS 48 COMPET 397 RECH 289 ENTWURF EINES PROTOKOLLS 1 Betr.: 2963. Tagung des Rates der Europäischen
Conseil UE RAT DER EUROPÄISCHEN UNION Brüssel, den 20. Oktober 2009 (06.11) (OR. en) PUBLIC 13644/09 LIMITE PV/CONS 48 COMPET 397 RECH 289 ENTWURF EINES PROTOKOLLS 1 Betr.: 2963. Tagung des Rates der Europäischen
Stand arzneimittelrechtlicher Regelungen zur Minimierung des Antibiotikaeinsatzes
 Stand arzneimittelrechtlicher Regelungen zur Minimierung des Antibiotikaeinsatzes Bernhard Kühnle Leiter der Abteilung Ernährung, Lebensmittelsicherheit, Tiergesundheit Berlin, 11. November 2013 Ziele
Stand arzneimittelrechtlicher Regelungen zur Minimierung des Antibiotikaeinsatzes Bernhard Kühnle Leiter der Abteilung Ernährung, Lebensmittelsicherheit, Tiergesundheit Berlin, 11. November 2013 Ziele
ENTSCHLIESSUNGSANTRAG
 EUROPÄISCHES PARLAMENT 2009 2014 Plenarsitzungsdokument 22.4.2013 B7-0000/2013 ENTSCHLIESSUNGSANTRAG eingereicht im Anschluss an die Anfrage zur mündlichen Beantwortung B7-0000/2013 gemäß Artikel 115 Absatz
EUROPÄISCHES PARLAMENT 2009 2014 Plenarsitzungsdokument 22.4.2013 B7-0000/2013 ENTSCHLIESSUNGSANTRAG eingereicht im Anschluss an die Anfrage zur mündlichen Beantwortung B7-0000/2013 gemäß Artikel 115 Absatz
KOMMISSION (2003/701/EG)
 8.10.2003 L 254/21 KOMMISSION ENTSCHEIDUNG R KOMMISSION vom 29. September 2003 zur Festlegung gemäß Richtlinie 2001/18/EG des Europäischen Parlaments und des Rates des Formulars für die Darstellung der
8.10.2003 L 254/21 KOMMISSION ENTSCHEIDUNG R KOMMISSION vom 29. September 2003 zur Festlegung gemäß Richtlinie 2001/18/EG des Europäischen Parlaments und des Rates des Formulars für die Darstellung der
* ENTWURF EINES BERICHTS
 Europäisches Parlament 2014-2019 Ausschuss für Verkehr und Fremdenverkehr 2017/0115(CNS) 20.12.2017 * ENTWURF EINES BERICHTS über den des Rates zur Änderung der Richtlinie 1999/62/EG über die Erhebung
Europäisches Parlament 2014-2019 Ausschuss für Verkehr und Fremdenverkehr 2017/0115(CNS) 20.12.2017 * ENTWURF EINES BERICHTS über den des Rates zur Änderung der Richtlinie 1999/62/EG über die Erhebung
Amtsblatt der Europäischen Union
 L 55/4 VERORDNUNG (EU) 2016/293 R KOMMISSION vom 1. März 2016 zur Änderung der Verordnung (EG) Nr. 850/2004 des Europäischen Parlaments und des Rates über persistente organische Schadstoffe hinsichtlich
L 55/4 VERORDNUNG (EU) 2016/293 R KOMMISSION vom 1. März 2016 zur Änderung der Verordnung (EG) Nr. 850/2004 des Europäischen Parlaments und des Rates über persistente organische Schadstoffe hinsichtlich
Verordnung über Massnahmen zur Bekämpfung einer Influenza-Pandemie
 Verordnung über Massnahmen zur Bekämpfung einer Influenza-Pandemie (Influenza-Pandemieverordnung, IPV) 818.101.23 vom 27. April 2005 (Stand am 1. Januar 2012) Der Schweizerische Bundesrat, gestützt auf
Verordnung über Massnahmen zur Bekämpfung einer Influenza-Pandemie (Influenza-Pandemieverordnung, IPV) 818.101.23 vom 27. April 2005 (Stand am 1. Januar 2012) Der Schweizerische Bundesrat, gestützt auf
* ENTWURF EINES BERICHTS
 EUROPÄISCHES PARLAMENT 2014-2019 Rechtsausschuss 4.11.2014 2011/0450(NLE) * ENTWURF EINES BERICHTS über den Vorschlag für einen Beschluss des Rates zur Einverständniserklärung der Mitgliedstaaten im Interesse
EUROPÄISCHES PARLAMENT 2014-2019 Rechtsausschuss 4.11.2014 2011/0450(NLE) * ENTWURF EINES BERICHTS über den Vorschlag für einen Beschluss des Rates zur Einverständniserklärung der Mitgliedstaaten im Interesse
(Text von Bedeutung für den EWR)
 L 24/6 DE 30.1.2016 DURCHFÜHRUNGSVERORDNUNG (EU) 2016/125 DER KOMMISSION vom 29. Januar 2016 über die von PHMB (1600; 1.8) als alten Wirkstoff zur Verwendung in Biozidprodukten der en 2, 3 und 11 (Text
L 24/6 DE 30.1.2016 DURCHFÜHRUNGSVERORDNUNG (EU) 2016/125 DER KOMMISSION vom 29. Januar 2016 über die von PHMB (1600; 1.8) als alten Wirkstoff zur Verwendung in Biozidprodukten der en 2, 3 und 11 (Text
Rat der Europäischen Union Brüssel, den 3. Mai 2016 (OR. en)
 Rat der Europäischen Union Brüssel, den 3. Mai 2016 (OR. en) 8540/16 DENLEG 34 AGRI 222 SAN 162 ÜBERMITTLUNGSVERMERK Absender: Europäische Kommission Eingangsdatum: 29. April 2016 Empfänger: Nr. Komm.dok.:
Rat der Europäischen Union Brüssel, den 3. Mai 2016 (OR. en) 8540/16 DENLEG 34 AGRI 222 SAN 162 ÜBERMITTLUNGSVERMERK Absender: Europäische Kommission Eingangsdatum: 29. April 2016 Empfänger: Nr. Komm.dok.:
Vorschlag für eine VERORDNUNG DES EUROPÄISCHEN PARLAMENTS UND DES RATES
 EUROPÄISCHE KOMMISSION Brüssel, den 29.11.2017 COM(2017) 735 final 2017/0328 (COD) Vorschlag für eine VERORDNUNG DES EUROPÄISCHEN PARLAMENTS UND DES RATES zur Änderung der Verordnung (EG) Nr. 726/2004
EUROPÄISCHE KOMMISSION Brüssel, den 29.11.2017 COM(2017) 735 final 2017/0328 (COD) Vorschlag für eine VERORDNUNG DES EUROPÄISCHEN PARLAMENTS UND DES RATES zur Änderung der Verordnung (EG) Nr. 726/2004
(Rechtsakte ohne Gesetzescharakter) VERORDNUNGEN
 30.1.2016 DE L 24/1 II (Rechtsakte ohne Gesetzescharakter) VERORDNUNGEN DURCHFÜHRUNGSVERORDNUNG (EU) 2016/124 DER KOMMISSION vom 29. Januar 2016 zur von PHMB (1600; 1.8) als alten Wirkstoff zur Verwendung
30.1.2016 DE L 24/1 II (Rechtsakte ohne Gesetzescharakter) VERORDNUNGEN DURCHFÜHRUNGSVERORDNUNG (EU) 2016/124 DER KOMMISSION vom 29. Januar 2016 zur von PHMB (1600; 1.8) als alten Wirkstoff zur Verwendung
ZEIT, ALARM ZU SCHLAGEN. Die unangemessene Verwendung von Antibiotika bei Mensch und Tier führt zur. Bildung von multiresistenten Bakterien.
 ANTIBIOTIKA ZEIT, ALARM ZU SCHLAGEN Die unangemessene Verwendung von Antibiotika bei Mensch und Tier führt zur Bildung von multiresistenten Bakterien. In der EU sterben jedes Jahr mehr als 25 000 Menschen
ANTIBIOTIKA ZEIT, ALARM ZU SCHLAGEN Die unangemessene Verwendung von Antibiotika bei Mensch und Tier führt zur Bildung von multiresistenten Bakterien. In der EU sterben jedes Jahr mehr als 25 000 Menschen
6020/17 gha/ab 1 DG D 1 A
 Rat der Europäischen Union Brüssel, den 7. Februar 2017 (OR. en) Interinstitutionelles Dossier: 2017/0014 (NLE) 6020/17 SCH-EVAL 52 FRONT 48 COMIX 95 BERATUNGSERGEBNISSE Absender: Generalsekretariat des
Rat der Europäischen Union Brüssel, den 7. Februar 2017 (OR. en) Interinstitutionelles Dossier: 2017/0014 (NLE) 6020/17 SCH-EVAL 52 FRONT 48 COMIX 95 BERATUNGSERGEBNISSE Absender: Generalsekretariat des
MRSA. (Methicillin-resistenter Staphylococcus aureus)
 MRSA (Methicillin-resistenter Staphylococcus aureus) Gemeinsam auf Nummer sicher Liebe Patientin, lieber Patient, herzlich willkommen in der Fachklinik 360 Die Klinik für Orthopädie und Rheumatologie der
MRSA (Methicillin-resistenter Staphylococcus aureus) Gemeinsam auf Nummer sicher Liebe Patientin, lieber Patient, herzlich willkommen in der Fachklinik 360 Die Klinik für Orthopädie und Rheumatologie der
***I ENTWURF EINES BERICHTS
 Europäisches Parlament 2014-2019 Ausschuss für Wirtschaft und Währung 2016/0182(COD) 21.11.2016 ***I ENTWURF EINES BERICHTS über den des Europäischen Parlaments und des Rates zur Auflegung eines Unionsprogramms
Europäisches Parlament 2014-2019 Ausschuss für Wirtschaft und Währung 2016/0182(COD) 21.11.2016 ***I ENTWURF EINES BERICHTS über den des Europäischen Parlaments und des Rates zur Auflegung eines Unionsprogramms
Amtsblatt der Europäischen Union
 4.1.2019 DE L 2/21 DURCHFÜHRUNGSVERORDNUNG (EU) 2019/12 DER KOMMISSION vom 3. Januar 2019 zur von L-Arginin als in Futtermitteln für alle Tierarten (Text von Bedeutung für den EWR) DIE EUROPÄISCHE KOMMISSION
4.1.2019 DE L 2/21 DURCHFÜHRUNGSVERORDNUNG (EU) 2019/12 DER KOMMISSION vom 3. Januar 2019 zur von L-Arginin als in Futtermitteln für alle Tierarten (Text von Bedeutung für den EWR) DIE EUROPÄISCHE KOMMISSION
Gesundheitspolitische Aspekte der Infektionsprävention
 Gesundheitspolitische Aspekte der Infektionsprävention Rückblick der letzten zehn Jahre Dr. Antina Ziegelmann Bundesministerium für Gesundheit Referat 322 Infektionskrankheiten, Antimikrobielle Resistenzen,
Gesundheitspolitische Aspekte der Infektionsprävention Rückblick der letzten zehn Jahre Dr. Antina Ziegelmann Bundesministerium für Gesundheit Referat 322 Infektionskrankheiten, Antimikrobielle Resistenzen,
Stellungnahmen des Bundesrates: Drucksachen 62/04 (Beschluss), 361/05 (Beschluss) und 361/05 (Beschluss) (2)
 Bundesrat Drucksache 556/09 04.06.09 Unterrichtung durch das Europäische Parlament Entschließung des Europäischen Parlaments vom 7. Mai 2009 zu dem Entwurf einer Verordnung (EG) Nr.... der Kommission vom...
Bundesrat Drucksache 556/09 04.06.09 Unterrichtung durch das Europäische Parlament Entschließung des Europäischen Parlaments vom 7. Mai 2009 zu dem Entwurf einer Verordnung (EG) Nr.... der Kommission vom...
MRE AK Krankenhäuser Punktprävalenz-Untersuchung MRE Netzwerk Metropolregion Rhein-Neckar
 MRE AK Krankenhäuser Punktprävalenz-Untersuchung MRE Netzwerk Metropolregion Rhein-Neckar Warum sind wir hier? Wir möchten Ihnen eine Untersuchung vorstellen, die zeigt dass die Zahl der von multiresistenten
MRE AK Krankenhäuser Punktprävalenz-Untersuchung MRE Netzwerk Metropolregion Rhein-Neckar Warum sind wir hier? Wir möchten Ihnen eine Untersuchung vorstellen, die zeigt dass die Zahl der von multiresistenten
Erfassung des Antibiotikaverbrauchs: Beantwortet die Datenbank alle Fragen?
 Eidgenössisches Departement des Innern EDI Bundesamt für Lebensmittelsicherheit und Veterinärwesen BLV Erfassung des Antibiotikaverbrauchs: Beantwortet die Datenbank alle Fragen? FitPig-Tagung, 27. Oktober
Eidgenössisches Departement des Innern EDI Bundesamt für Lebensmittelsicherheit und Veterinärwesen BLV Erfassung des Antibiotikaverbrauchs: Beantwortet die Datenbank alle Fragen? FitPig-Tagung, 27. Oktober
Bundesrat Drucksache 737/09. Unterrichtung durch die Bundesregierung EU - Fz - Wi
 Bundesrat Drucksache 737/09 29.09.09 EU - Fz - Wi Unterrichtung durch die Bundesregierung Vorschlag für eine Entscheidung des Rates zur Übertragung besonderer Aufgaben im Zusammenhang mit der Funktionsweise
Bundesrat Drucksache 737/09 29.09.09 EU - Fz - Wi Unterrichtung durch die Bundesregierung Vorschlag für eine Entscheidung des Rates zur Übertragung besonderer Aufgaben im Zusammenhang mit der Funktionsweise
Europäisches Parlament
 Europäisches Parlament 2014-2019 ANGENOMMENE TEXTE P8_TA(2017)0233 Mehrwertsteuersätze für Bücher, Zeitungen und Zeitschriften * Legislative Entschließung des Europäischen Parlaments vom 1. Juni 2017 zu
Europäisches Parlament 2014-2019 ANGENOMMENE TEXTE P8_TA(2017)0233 Mehrwertsteuersätze für Bücher, Zeitungen und Zeitschriften * Legislative Entschließung des Europäischen Parlaments vom 1. Juni 2017 zu
Baku (Aserbaidschan), September September ORIGINAL: ENGLISCH. Resolution. Europäischer Aktionsplan HIV/Aids ( )
 Regionalkomitee für Europa 61. Tagung EUR/RC61/R8 Baku (Aserbaidschan), 12. 15. September 2011 15. September 2011 112573 ORIGINAL: ENGLISCH Resolution Europäischer Aktionsplan HIV/Aids (2012 2015) Das
Regionalkomitee für Europa 61. Tagung EUR/RC61/R8 Baku (Aserbaidschan), 12. 15. September 2011 15. September 2011 112573 ORIGINAL: ENGLISCH Resolution Europäischer Aktionsplan HIV/Aids (2012 2015) Das
14257/16 bz/bl 1 DG G 2B
 Rat der Europäischen Union Brüssel, den 9. November 2016 (OR. en) 14257/16 FISC 190 ECOFIN 1023 BERATUNGSERGEBNISSE Absender: Generalsekretariat des Rates vom 9. November 2016 Empfänger: Delegationen Nr.
Rat der Europäischen Union Brüssel, den 9. November 2016 (OR. en) 14257/16 FISC 190 ECOFIN 1023 BERATUNGSERGEBNISSE Absender: Generalsekretariat des Rates vom 9. November 2016 Empfänger: Delegationen Nr.
9452/16 KAR/sm 1 DG G 2B
 Rat der Europäischen Union Brüssel, den 25. Mai 2016 (OR. en) 9452/16 FISC 85 ECOFIN 502 BERATUNGSERGEBNISSE Absender: vom 25. Mai 2016 Empfänger: Generalsekretariat des Rates Delegationen Nr. Vordok.:
Rat der Europäischen Union Brüssel, den 25. Mai 2016 (OR. en) 9452/16 FISC 85 ECOFIN 502 BERATUNGSERGEBNISSE Absender: vom 25. Mai 2016 Empfänger: Generalsekretariat des Rates Delegationen Nr. Vordok.:
