Chemiepraktikum I, HS 2011, ETH Zürich. Bericht von: Nicole Schai Thomas Rölli Assistiert von:
|
|
|
- Inken Ursler
- vor 5 Jahren
- Abrufe
Transkript
1 Chemiepraktikum I, HS 2011, ETH Zürich Versuch 4 Gravimetrie und Redoxtitration Bericht von: Nicole Schai (schain@student.ethz.ch) Thomas Rölli (roellit@student.ethz.ch) Assistiert von: Niklaus Kränzlin Florian Heiligtag Philippe Knüsel
2 1. Zusammenfassung Dieser Versuch besteht aus zwei Teilen. Der erste Teil beschäftigt sich mit der Methode der Gravimetrie. Bei der Gravimetrie wird eine selektive Fällung vorgenommen und so ein filtrierbarer Niederschlag gebildet. Wenn die Stöchiometrie bekannt ist, kann so eine quantitative Analyse vorgenommen werden. In diesem Versuch wurde spezifisch der Nickelgehalt einer Münze analysiert. Leider sind die erhaltenen Resultate (Mittelwert: 31.2 %) weit vom theoretischen Wert (25%) entfernt. Dies ist auf ungenaues Arbeiten während des Versuches zurückzuführen. Die Ausbeute entspricht demnach % (Probe 1) und % (Probe 2). Im Zweiten Teil des Versuches wurde mit der Methode der Iodometrie gearbeitet. Bei der Iodometrie wird eine Redoxtitration mit Thiosulfat durchgeführt. Speziell daran ist, dass man ohne technische Hilfsmittel den ziemlich exakten Titrationsendpunkt bestimmen kann. In diesem Versuch wurde der Kupfergehalt einer 10 Cent Euromünze ermittelt. Die Resultate (Mittelwert: 98.1%) liegen sehr nahe am theoretischen Wert (100%). Die Resultate kamen mit jeder neuen Probe näher an den theoretischen Wert ran, was ein Indiz dafür ist, dass der Versuch immer genauer durchgeführt werden konnte. 2. Einleitung 2.1. Versuch Gravimetrie Ziel Es soll der Nickelgehalt (Massenprozent) einer Nickelsalzlösung einer bereits aufgelösten Münze bestimmen werden. Dabei soll das Analyseverfahren der Gravimetrie verwendet werden Theorie [1] Bei der Gravimetrie wird eine unbekannte Konzentration einer Substanz durch eine selektive Fällung in einen schwerlöslichen Niederschlag gebracht. Danach wird der Niederschlag (mit bekannter Stöchiometrie) filtriert und gewägt. Anhand der gewonnen Daten kann danach der Massenanteil des Stoffes errechnet werden. Auflösung durch Salpetersäure: In diesem Versuch musste dieser Schritt nicht gemacht werden, da bereits eine fertige Nickelsalzlösung vorhanden war. Zur Vervollständigung wird dieser Schritt aber trotzdem kurz erwähnt. Damit man die Gravimetrie anwenden kann, muss sich die zu analysierende Substanz (in diesem Versuch Nickel) in einer Lösung befinden. Um dies zu erreichen, wird z.b. eine Münze (Cu/Ni) in konzentrierte Salpetersäure getaucht und die Münze löst sich auf. Bei diesem Vorgang wird HNO 3 reduziert und die beiden Metalle Cu und Ni oxidiert: Cu! Cu!!!" + 2e! (1) 1
3 Ni (!) Ni!! (!") + 2e! (2)! NO! (!")! NO! (!") + 2H! (!") + 1e! NO! (!) + H! O (!) (3) + 4H! + 3e! NO (!) + 2H! O (!) (4) Maskierung von Cu 2+, Selektive Fällung von Ni 2+ In der Lösung sind noch andere Metalle als Nickel- und Kupferkationen vorhanden. Um diese unerwünschten Kationen zu entfernen, wird die Lösung basisch gemacht. Die Metallkationen fallen als Hydroxide aus, da diese nur ein geringes Löslichkeitsprodukt K L besitzen. Weil aber auch das Ni(II) ausfallen würde muss das Ni(II) mit Weinsäure maskiert werden. Nickel (auch Kupfer) komplexisiert mit der Weinsäure. Die erhöhte Löslichkeit des Komplexgebildes führt dazu, dass Nickel und Kupfer nicht ausfallen. Abb. 1: Komplexbildung von Cu 2+ mit Weinsäure Nun liegen nur noch Cu 2+ und Ni 2+ - Ionen in der Lösung vor. Um Ni 2+ ausfallen zu lassen wird Dimethylglyoxim (H! DMG) beigegeben. Damit Cu 2+ nicht mit ausfällt wird Thiosulfat, welches Cu 2+ maskiert, beigegeben. Abb. 2: Maskierung von Nickel mit Dimethylglyoxim Berechnungen 1. Masse des Nickels: 2 m(ni(hdmg) 2 ) = siehe Tabelle 2!(!"(!"#$)! )!(!"(!"#$)! M Ni = m(ni) (4) M(Ni(HDMG) 2 ) = g/mol M(Ni) = g/mol
4 2. Prozentualer Massenanteil von Nickel in der Münze:!(!")!(!ü!"#) 100% = Massenanteil von Nickel in % (5) m(münze) = siehe Tabelle Versuch Iodometrie Ziel Der Kupfergehalt einer Lösung, in der eine 10 Eurocent Münze aufgelöst wurde, soll bestimmt werden. Bei diesem Versuch soll die Methode der Iodometrie angewendet werden Theorie [1] Bei der Iodometrie handelt es sich um ein Redoxtitrationsverfahren. Mit diesem Instrument kann man ein analytisches Bestimmungsverfahren durchführen. Dies geschieht mit Hilfe von Iod. Dabei kann das Iodidanion als Reduktionsmittel benutzt werden, welches dabei zu Iod oxidiert. Bei bekannter Stöchiometrie aller beteiligten Redoxprozesse kann die Iodometrie zur Hand gezogen werden, um eine quantitative Aussage über eine bestimmte Substanz zu machen. Interessant ist dieses Verfahren, weil der ganze Vorgang von blossem Auge beobachtet werden kann. Es werden keine besonderen Hilfsmittel benötigt. Iodometrische Bestimmung von Kupfer: Werden in eine Lösung, in der Cu 2+ vorhanden ist, Iodid- Anionen beigefügt, fällt schwerlösliches Kupfer(I)- iodid als gelbliche Substanz aus. Liegt Iodid im Überschuss vor, fallen beinahe alle Kupferkationen aus. Der ganze Vorgang geschieht mit folgender Reaktion: 2Cu!! (!") + 4I! (!") 2CuI (!) + I! (6) Um die Masse des Kupfers in der Lösung zu berechnen, macht man sich zu Nutzen, dass n(s! O!! ) = n(cu!! ) = n(i! ) ist. Somit muss n(i! ) bestimmt werden. Iodbestimmung Für die Iodbestimmung wird die Lösung mit einer Thiosulfatlösung titriert (Reaktion findet nur im leicht sauren Bereich statt. Deshalb wird Essigsäure dazugegeben.). Dabei läuft folgende Reaktion ab: I! + S! O!!! (!") S!O!!! (!") + 2I! (!") (7) Bei der Titration verschiebt sich das Gleichgewicht der Gleichung 7 nach rechts, bis kein neues Iod mehr entsteht. Hier spielt eine weitere Reaktion eine wichtige Rolle: 3
5 I! + I! (!") I!!(!") (8) Wenn noch Iod vorhanden ist, reagiert es mit Iodid. Die Triiodidanionen lassen die Lösung braun erscheinen. Mit dem Verbrauch von Iod nimmt die Konzentration an Triiodidanionen ab und die Lösung wird gelblich. Wenn die Titration fertig ist, erscheint die Lösung weiss. Um sicher zu stellen, dass alles Iod ausgefallen ist ohne sich rein auf optische Unterschiede zwischen gelblich und weiss verlassen zu müssen kann Stärke zur Titrierlösung zugegeben werden. Sollte noch Iod in der Lösung sein, wird dieser komplexiert (Iodstärkekomplexe). Solche Komplexe scheinen blau. Grundsätzlich bestehen keine grösseren Gefahren bei diesem Versuch. Allerdings muss man besonders auf das austreten nitroser Gase achten. Um diese schon am Anfang des Experimentes zu entfernen, wird Harnstoff verwendet. Dieser wird im Überschuss zur Stammlösung zugegeben. Der austretende braune Rauch sollte strikt gemieden werden. Ansonsten hat Harnstoff keinen weiteren Einfluss auf das Experiment. Gleichung 9 beschreibt den chemischen Ablauf der Reaktion. 2NO!! + CO(NH! )! + 2H! CO! + 2N! + 3H! O (9) Berechnungen Bei der Betrachtung von Reaktionen (6) und (7) kann man schliessen dass n(cu!! ) = n(s! O!!! ) (10) ist. Aufgrund dieser Tatsache lassen sich folgende Formeln aufstellen: 1. m Cu = n S! O!!! M Cu 10 (10) M(Cu) = g/mol 2.!(!")!(!ü!"#) = Prozentualer Massenanteil von Kupfer in der Münze (11) 3. Materialien und Methoden 3.1. Versuch Gravimetrie Chemikalien Ausgangsstoff war eine Nickelsalzlösung mit unbekannter Nickelkonzentration. Damit beim Umgiessen von einem Becherglas ins andere möglichst wenig Nickel verloren ging, wurden Reste an den Bechergläsern mit entionisiertem Wasser gespült. Ebenfalls wurde entionsiertes Wasser für die Herstellung der Stammlösung benötigt. Für das komplette gravimetrische Verfahren wurden folgende Lösungen benutzt: Dimethylglyoximlösung (10 g/l Ethanol), Weinsäurelösung (200 g/l), Natriumthiosulfatlösung (200 g/l), Ammoniumacetatlösung (200 g/l). Um den ph- Wert dem jeweiligen Versuchsschritt anzupassen, wurde eine Ammoniaklösung (w=25%ig) und Salzsäure (ca. 2 M) benutzt. 4
6 Methoden Da bereits eine Lösung mit der aufgelösten Münze vorhanden war, konnte der erste Schritt übersprungen werden. Die blaugrüne Lösung, die sich in einem 250 ml Messkolben befand, wurde mit entionisiertem Wasser bis zur Strichmarkierung aufgefüllt. Das war dann die Stammlösung. Da der Versuch zweimal durchgeführt wurde, wurden zwei Bechergläser (400 ml) mit je 50 ml der Stammlösung und 5 ml Weinsäurelösung aufgefüllt. Im Folgenden wurden alle Schritte parallel mit beiden Stammlösungen durchgeführt. Danach wurde jede Lösung mit einer Ammoniaklösung neutralisiert, bis sie leicht alkalisch wurde (ph = 7-7,5). Als nächstes wurde Salzsäure hinzugegeben, bis die Lösung einen ph- Wert von 3-5 erreichte. Daraufhin wurde die Lösung auf ca. 200 ml verdünnt. Dann wurde die Lösung auf T = 55 C erwärmt und unter Rühren wurden 15 ml Natriumthiosulfatlösung langsam hinzugegeben. Da der ph- Wert dabei nicht über 4 steigen durfte, wurde bei Bedarf Salzsäure beigegeben. Nach min bei 55 C wurde 40 ml Dimethylglyoximlösung und unmittelbar danach 40 ml Ammoniumacetat hinzugegeben. Die Lösung wurde danach für 30 min bei Raumtemperatur abgekühlt. In der Zwischenzeit wurde eine Glasfilterfritte gewogen und das Gewicht notiert. Nach dem Abkühlen der Lösung wurde die Lösung abgenutscht. Reste die im Becherglas hängengeblieben sind, mit entionisiertem Wasser in die Glasfilterfritte übergeführt worden. Die Glasfilterfritte wurde danach mit einem Papier verschlossen und über Nacht bei 60 C unter Vakuum getrocknet. Zum Schluss musste noch die Glasfilterfritte gewogen werden. Abb. 3: Versuchsaufbau zum Abnutschen der Lösung 3.2. Versuch Iodometrie Chemikalien Ausgangsmaterial war eine Kupfersalzlösung mit unbekannter Konzentration. Zur Herstellung der Stammlösung wurde entionisiertes Wasser benutzt. Im weiteren Versuchsverlauf wurde 5
7 Harnstofflösung (25 g Harnstoff in 250 ml Wasser), HCl- Lösung (2 M). Zum Titrieren wurde Natriumthiosulfatlösung (0.2 M) verwendet. Zudem wurde noch Eisessig und Kaliumiodid benutzt Methoden Wiederum war bereits eine vorbereitete Kupfersalzlösung vorhanden und es musste keine Münze aufgelöst werden. Als erstes wurde die Lösung, die sich in einem 250 ml Messkolben befand, mit entionisiertem Wasser aufgefüllt. Die entstandene Lösung diente in diesem Versuch als Stammlösung. Es wurden 25 ml der Stammlösung in einen 250 ml Erlenmeyerkolben mit einer Vollpipette pipettiert. Die noch vorhandenen nitrosen Gase bzw. Nitrite wurden mit 10 ml Harnstofflösung unter Rühren entfernt. Daraufhin wurde die Lösung für 5 min stehengelassen. In der Zwischenzeit wurde eine 50 ml Bürette mit 0.2 M Natriumthiosulfatlösung gefüllt. Zum Verdünnen der Lösung wurden 100 ml entionsiertes Wasser beigemischt. Danach wurde (unter vorsichtigem Schwenken) 5 ml Eisessig und gleich danach ca. 3 g feste Kaliumiodid zugegeben. Der entstandene braungrüne Niederschlag liess man sedimentieren. Der nächste Schritt war die Titration mit 0.2 M Natriumthiosulfatlösung. Nach der Zugabe von einigen Millilitern Natriumthiosulfatlösung wurde das Becherglas mit der Titrierlösung geschwenkt. Das Mischen durch das Schwenken wurde im Verlauf des Versuches mehrmals wiederholt. Gegen Ende der Titration wurde das Schwenken nach jedem Tropfen wiederholt und jeweils ca. 30 Sekunden gewartet. Als die Lösung nur noch schwach gelblich war, wurden 2 ml Stärkelösung beigegeben. Daraufhin wurde die Lösung ein weiteres Mal geschwenkt. Somit war die Titration beendet. Abb. 4: Versuchsaufbau zur Titration mit Natriumthiosulfatlösung 4. Resultate 4.1. Versuch Gravimetrie Tabelle 1: Theoretischer Nickelgehalt und Masse der Münze Theoretischer Nickelgehalt der Münze w- % [%] Masse der Münze [g] In Tabelle 1 ist die Masse der aufgelösten Münze und der theoretische Nickelgehalt dieser Münze aufgeführt. 6
8 Tabelle 2: Gemessene und errechnete Werte aus dem Versuch Gravimetrie Probe 1 Probe 2 Mittelwert Standardabweichung Masse Glasfilterfritte leer [g] Masse Glasfilterfritte voll [g] m(ni(hdmg)! ) [g] m(ni) in Münze [g] w- % Ni [%] Ausbeute (exp/theor) [%] In Tabelle 2 sind die Resultate der beiden Proben aufgeführt. Ebenfalls vorhanden sind, die mit den Formeln (4) und (5) errechneten Werte für die Masse von Nickel und die Werte für die Gewichtsprozente von Nickel in der Münze Versuch Iodometrie Tabelle 3: Theoretischer Kupfergehalt und Masse der Münze Theoretischer Kupfergehalt der Münze w- % [%] Masse der Münze [g] In Tabelle 3 ist die Masse der aufgelösten Münze und der theoretische Kupfergehalt dieser Münze aufgeführt. Tabelle 4: Gemessene und errechnete Werte aus dem Versuch Iodometrie + Probe 1 Probe 2 Probe 3 Probe 4 Mittelwert 95% Vertrau V(S! O!!! ) [ml] c(s! O!!! ) mol/l m(cu) [g] w % Cu [%] In Tabelle 4 sind alle Resultate vom Versuch Iodometrie zusammengefasst. Die Resultate für die Masse von Kupfer und der prozentuale Anteil in der Münze wurden mit den Formeln (10) und (11) berechnet. 5. Diskussion 5.1. Versuch Gravimetrie Diskussion Resultate Aus Tabelle 1 und 2 ist sofort zu erkennen, dass die errechneten Werte für w- % Ni zu hoch sind. Nach Tabelle 1 ist der theoretische Wert bei 25%. Die berechnete Ausbeute fällt dementsprechend mit 123.6% und 125.6% zu hoch aus. Die Standardabweichung ist immer relativ tief. Die 7
9 Standardabweichung in der letzten Zeile von Tabelle 2 darf nicht falsch interpretiert werden. Da die Standardabweichung relativ tief ist, kann ein Ausreisser einer Probe ausgeschlossen werden. Dies kann auch intuitiv erkannt werden, indem man die Zahlen von Probe 1 und 2 für m(ni(hdmg)! ) vergleicht. Sie liegen nur g auseinander. Wahrscheinlich wurde am Anfang zu viel Stammlösung genommen. Also mehr als 50 ml. Würde man die Formel (4) nicht mit 5 sondern mit 4 multiplizieren, bekäme man Werte, die ziemlich genau 25% entsprechen würden. Dass aber 62.5 ml, also 12.5 ml zu viel, genommen wurde, ist sehr unwahrscheinlich, da dies hätte bemerkt werden müssen. Es müssen also noch andere Fehler aufgetreten sein. Vielleicht wurde die leere Glasfilterfritte falsch gewogen. Es könnte gut sein, dass beim Wägen ein Fehler passiert ist, da die Wagen sehr empfindlich sind Verbesserungsmöglichkeiten In diesem Versuch wurde deutlich, wie wichtig genaues Arbeiten im Labor ist. Bei einer erneuten Versuchsdurchführung müsste unbedingt darauf geachtet werden, dass von Anfang an genauer gearbeitet würde. Denn bereits kleine Fehler können die Resultate stark verfälschen Versuch Iodometrie Diskussion Resultate Die Resultate liegen nahe beim theoretischen Wert. Dies kann aus der Tabelle 3 und 4 entnommen werden. Auch der Mittelwert liegt nur wenig darunter. Gut zu erkennen ist, dass die Werte von Probe 1 und 2 weiter weg vom theoretischen Wert sind, als dies Probe 3 und 4 sind. Vor allem Probe 1 weicht deutlicher ab, als dies die anderen Proben tun. Die Werte von Probe 1 sind eher zu tief. Ein Grund dafür ist, dass die Lösung bereits mit der Luft reagiert hat, da lange gewartet wurde, um den Ausfall des Komplexes zu sehen. Es könnte auch sein, dass sich in der Lösung von Probe 1 noch Iod befand, welches nicht ausgefällt wurde. Denn durch das Schütteln beim Entsorgen der Lösung wurde diese nochmals leicht gelb. Mit grosser Wahrscheinlichkeit lag das Problem daran, dass bei Probe 1 von Hand gerührt wurde und nicht mit dem Magnetrührer. Beim Betrachten der Resultate wird allerdings auch deutlich, dass die Ausbeute bei den Wiederholungen verbessert werden konnte. Es wurde besser abgeschätzt, wie lange man titrieren soll. Oder anders gesagt, der Umschlagspunkt von Probe zu Probe besser erkannt. Mit den gewonnen Daten kann man also sehr zufrieden sein Verbesserungsmöglichkeiten In Anbetracht der Resultate, die nahe beim theoretischen Wert liegen, gibt es keine konkreten Verbesserungsmöglichkeiten. Verbesserungen wurden bereits bei der Versuchsdurchführung gemacht. Um eine noch genauere Ausbeute zu bekommen, müssten technische Hilfsmittel vorhanden sein. 8
10 6. Referenzen 6.1. Text: [1]: Anleitungsskript Versuch 4: Quantitative Bestimmung des Nickel- und Kupfergehaltes in Münzen durch Gravimetrie und Redoxtitration 6.2. Abbildungen Abb.1: Anleitungsskript Versuch 4: Quantitative Bestimmung des Nickel- und Kupfergehaltes in Münzen durch Gravimetrie und Redoxtitration Abb.2: Anleitungsskript Versuch 4: Quantitative Bestimmung des Nickel- und Kupfergehaltes in Münzen durch Gravimetrie und Redoxtitration 7. Anhang 7.1. Fragen im Skript: Frage 4.1: Allgemeine Struktur von Oximen: R 1 R 2 CNOH (Quelle: Dezember 2011) Frage 4.2 P. Krumholz und F. Hönel, Fresenius' Journal of Analytical Chemistry, 2001, 207 Frage 4.3 Frage 4.5 NO 3 - +V, NO 2 +IV, NH III, HNO 2 +III, NO +II, N 2 O +I, N 2 O = M(Nickelkomplex); = M(Nickel); = M(Kupfer); = M(Kupferkomplex) m(ni)/m(ni)=n(ni)=n(ni- Komplex) n(ni- Komplex)*M(Ni- Komplex)=m(Ni- Komplex)=0.05 g (theor. Wert) m(cu)/m(cu)=n(cu)=n(cu- Komplex) n(cu- Komplex)*M(Cu- Komplex)= m(cu- Komplex)=0.009 g m(cu- Komplex)+m(Ni- Komplex)= g (exp. Wert) 0.059/0.05= 118% Frage 4.7 9
11 Frage 4.8!(!")!(!")!!ü!"#!!(!")!!(!")!(!")!(!") 100 % = mol % Nickel Frage 4.9 Der ph- Wert wird auf gehalten, da die Metallionen sonst nicht als Metallhydroxide (Salz) ausfallen würden. Der ph- Wert wird auf 3.5 gehalten damit sich möglichst viel Weinsäure und Kupferionen bilden. Nur so können die Kupferionen vom Thiosulfat maskiert werden. Der ph- Wert wird auf gehalten damit sich Nickel mit dem Dimethylglyoxim komplexisieren kann. DMG liegt im sauren Bereich vollständig protoniert, im basischen vollständig deprotoniert vor. Um eine Komplexierung zu ermöglichen wird eine genau eine einfache Deprotonierung benötigt. 10
Gravimetrie und Redoxtitration
 Praktikum 1 Chemie Gravimetrie und Redoxtitration WS 006 /07 Verfasser: David Weibel, Carlo Weingart E-mail: weibeld@student.ethz.ch carlow@student.ethz.ch Datum: 7.1.007 Assistentin: Maha Maglinao Zusammenfassung:
Praktikum 1 Chemie Gravimetrie und Redoxtitration WS 006 /07 Verfasser: David Weibel, Carlo Weingart E-mail: weibeld@student.ethz.ch carlow@student.ethz.ch Datum: 7.1.007 Assistentin: Maha Maglinao Zusammenfassung:
Quantitative Bestimmung des Nickel- und Kupfergehalts in Münzen durch Gravimetrie und Redoxtitration
 Praktikum I, WS 05/06 Versuch 4-02.02.2006 Quantitative Bestimmung des Nickel- und Kupfergehalts in Münzen durch Gravimetrie und Redoxtitration Zahner Michele (zahnerm@student.ethz.ch) Büchi Luca (lbuechi@student.ethz.ch)
Praktikum I, WS 05/06 Versuch 4-02.02.2006 Quantitative Bestimmung des Nickel- und Kupfergehalts in Münzen durch Gravimetrie und Redoxtitration Zahner Michele (zahnerm@student.ethz.ch) Büchi Luca (lbuechi@student.ethz.ch)
Gravimetrie und Redoxtitration
 Praktikum I, Teil Chemie HS 2008/09 Versuch 4; 5.11.2008 Quantitative Bestimmung des Nickel- und Kupfergehaltes in Münzen durch Gravimetrie und Redoxtitration Verfasser: Philippe Knüsel (pknuesel@student.ethz.ch)
Praktikum I, Teil Chemie HS 2008/09 Versuch 4; 5.11.2008 Quantitative Bestimmung des Nickel- und Kupfergehaltes in Münzen durch Gravimetrie und Redoxtitration Verfasser: Philippe Knüsel (pknuesel@student.ethz.ch)
Säure-Base Titrationen
 Chemie Praktikum Säure-Base Titrationen WS 2006/2007 Verfasser: Lorenz Germann, Lukas Bischoff Versuchsteilnehmer: Lorenz Germann, Lukas Bischoff Datum: 29.11.2006 Assistent: Lera Tomasic E-mail: lukas-bischoff@student.ethz.ch
Chemie Praktikum Säure-Base Titrationen WS 2006/2007 Verfasser: Lorenz Germann, Lukas Bischoff Versuchsteilnehmer: Lorenz Germann, Lukas Bischoff Datum: 29.11.2006 Assistent: Lera Tomasic E-mail: lukas-bischoff@student.ethz.ch
Chemisches Grundpraktikum Nickelbestimmung im Stahl
 im Stahl Analytischer Versuch von: Alexander Treter und Romina Dörig Abstract: Es wurde Stahl aufgeschlossen und der Nickelanteil bestimmt. Wir erhielten einen Anteil von 11.3 % ±0.9 (n=4; 95%). Inhaltsverzeichnis
im Stahl Analytischer Versuch von: Alexander Treter und Romina Dörig Abstract: Es wurde Stahl aufgeschlossen und der Nickelanteil bestimmt. Wir erhielten einen Anteil von 11.3 % ±0.9 (n=4; 95%). Inhaltsverzeichnis
Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10. V1/3: Iodometrie Iodometrische Bestimmung von Iodat und Kupfer
 Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10 V1/: Iodometrie Iodometrische Bestimmung von Iodat und Kupfer Versuchsdurchführung: 26.02.2010 Protokollabgabe: 01.0.2010 durchgeführt von:
Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10 V1/: Iodometrie Iodometrische Bestimmung von Iodat und Kupfer Versuchsdurchführung: 26.02.2010 Protokollabgabe: 01.0.2010 durchgeführt von:
Analytische Chemie. B. Sc. Chemieingenieurwesen. 22. September 2017, 13 bis 16 Uhr. Dr. Stephanie Möller & Prof. Dr. Thomas Jüstel.
 Analytische Chemie B. Sc. Chemieingenieurwesen 22. September 2017, 13 bis 16 Uhr Dr. Stephanie Möller & Prof. Dr. Thomas Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des
Analytische Chemie B. Sc. Chemieingenieurwesen 22. September 2017, 13 bis 16 Uhr Dr. Stephanie Möller & Prof. Dr. Thomas Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des
Analytische Chemie. B. Sc. Chemieingenieurwesen. 6. Juli 2016, Uhr. Prof. Dr. T. Jüstel & Stephanie Möller M.Sc.
 Analytische Chemie B. Sc. Chemieingenieurwesen 6. Juli 2016, 10.30 13.30 Uhr Prof. Dr. T. Jüstel & Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Analytische Chemie B. Sc. Chemieingenieurwesen 6. Juli 2016, 10.30 13.30 Uhr Prof. Dr. T. Jüstel & Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Anorganisches Praktikum 1. Semester. FB Chemieingenieurwesen. Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften
 Anorganisches Praktikum 1. Semester FB Chemieingenieurwesen Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften 1 Gravimetrie Bestimmung von Nickel Sie erhalten eine Lösung, die 0.1-0.2g
Anorganisches Praktikum 1. Semester FB Chemieingenieurwesen Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften 1 Gravimetrie Bestimmung von Nickel Sie erhalten eine Lösung, die 0.1-0.2g
Analytische Chemie. B. Sc. Chemieingenieurwesen. 7. März 2016, Uhr. Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer:
 Analytische Chemie B. Sc. Chemieingenieurwesen 7. März 2016, 8.00 11.00 Uhr Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Analytische Chemie B. Sc. Chemieingenieurwesen 7. März 2016, 8.00 11.00 Uhr Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Analytische Chemie. B. Sc. Chemieingenieurwesen. 5. Februar Dr. Stephanie Möller, Prof. Dr. Thomas Jüstel. Matrikelnummer:
 Analytische Chemie B. Sc. Chemieingenieurwesen 5. Februar 2019 Dr. Stephanie Möller, Prof. Dr. Thomas Jüstel Name: Matrikelnummer: Geburtsdatum: Sowohl der Lösungsweg als auch die Endergebnisse sind korrekt
Analytische Chemie B. Sc. Chemieingenieurwesen 5. Februar 2019 Dr. Stephanie Möller, Prof. Dr. Thomas Jüstel Name: Matrikelnummer: Geburtsdatum: Sowohl der Lösungsweg als auch die Endergebnisse sind korrekt
AnC I Protokoll: 3.4 Iodometrische Bestimmung von Ascorbinsäure (Vitamin C)" SS Analytische Chemie I. Versuchsprotokoll
 Analytische Chemie I Versuchsprotokoll 3.4 Iodometrische Bestimmung von Ascorbinsäure (Vitamin C) 1.! Theoretischer Hintergrund Bei dieser Redoxtitration wird Ascorbinsäure mit Hilfe von Triiodid oxidiert.
Analytische Chemie I Versuchsprotokoll 3.4 Iodometrische Bestimmung von Ascorbinsäure (Vitamin C) 1.! Theoretischer Hintergrund Bei dieser Redoxtitration wird Ascorbinsäure mit Hilfe von Triiodid oxidiert.
How To Determine The
 ZÜRCHER HCHSCHULE FÜR ANGEWANDTE WISSENSCHAFTEN DEPARTEMENT LIFE SCIENCES UND FACILITY MANAGEMENT INSTITUT FÜR CHEMIE UND BILGISCHE CHEMIE (ICBC) WÄDENSWIL Aufschluss von Legierungen Messing von Remo Badertscher
ZÜRCHER HCHSCHULE FÜR ANGEWANDTE WISSENSCHAFTEN DEPARTEMENT LIFE SCIENCES UND FACILITY MANAGEMENT INSTITUT FÜR CHEMIE UND BILGISCHE CHEMIE (ICBC) WÄDENSWIL Aufschluss von Legierungen Messing von Remo Badertscher
Analytische Chemie. B. Sc. Chemieingenieurwesen. 10. Juli Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 10. Juli 2009 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 10. Juli 2009 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie. B. Sc. Chemieingenieurwesen. 13. Juli 2017, Uhr. Prof. Dr. T. Jüstel, Dr. Stephanie Möller.
 Analytische Chemie B. Sc. Chemieingenieurwesen 13. Juli 2017, 8.30 11.30 Uhr Prof. Dr. T. Jüstel, Dr. Stephanie Möller Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Analytische Chemie B. Sc. Chemieingenieurwesen 13. Juli 2017, 8.30 11.30 Uhr Prof. Dr. T. Jüstel, Dr. Stephanie Möller Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Analytische Chemie. B. Sc. Chemieingenieurwesen. 19. März Prof. Dr. T. Jüstel, Stephanie Möller M.Sc. Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 19. März 2014 Prof. Dr. T. Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der
Analytische Chemie B. Sc. Chemieingenieurwesen 19. März 2014 Prof. Dr. T. Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der
Analytische Chemie. B. Sc. Chemieingenieurwesen. 13. September 2016, Uhr. Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc.
 Analytische Chemie B. Sc. Chemieingenieurwesen 13. September 2016, 8.00 11.00 Uhr Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe
Analytische Chemie B. Sc. Chemieingenieurwesen 13. September 2016, 8.00 11.00 Uhr Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe
H1 Bestimmung des Löslichkeitsprodukts von Magnesiumhydroxid
 H Löslichkeitsprodukt und Komplexgleichgewichte Auch bei den Komplex-Reaktionen beschäftigen wir uns im Wesentlichen mit Gleichgewichtsreaktionen, in denen Liganden ausgetauscht werden. Dabei sollen Kriterien
H Löslichkeitsprodukt und Komplexgleichgewichte Auch bei den Komplex-Reaktionen beschäftigen wir uns im Wesentlichen mit Gleichgewichtsreaktionen, in denen Liganden ausgetauscht werden. Dabei sollen Kriterien
Analytische Chemie. B. Sc. Chemieingenieurwesen. 11. September Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 11. September 2013 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 11. September 2013 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie. B. Sc. Chemieingenieurwesen. 11. Februar Prof. Dr. T. Jüstel, Stephanie Möller M.Sc. Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 11. Februar 2014 Prof. Dr. T. Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der
Analytische Chemie B. Sc. Chemieingenieurwesen 11. Februar 2014 Prof. Dr. T. Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der
Protokoll 2. Labor für Physikalische Chemie. Modul IV. Versuch 6
 Protokoll 2 Labor für Physikalische Chemie Modul IV Versuch 6 Herstellung einer Titerbestimmung von 500mL einer Salzsäure Maßlösung mit der Äquivalentkonzentration c(hcl) = 0,1 mol/l Fachbereich MT 1 Wintersemester
Protokoll 2 Labor für Physikalische Chemie Modul IV Versuch 6 Herstellung einer Titerbestimmung von 500mL einer Salzsäure Maßlösung mit der Äquivalentkonzentration c(hcl) = 0,1 mol/l Fachbereich MT 1 Wintersemester
Handbuch zum Chemischen Praktikum für Studierende der Human- und Zahnmedizin. Steffen Blaurock Thomas Zimmermann
 Handbuch zum Chemischen Praktikum für Studierende der Human- und Zahnmedizin Steffen Blaurock Thomas Zimmermann 1.1 Einleitung Titrationen werden in der chemischen Analytik durchgeführt, um die Stoffmenge
Handbuch zum Chemischen Praktikum für Studierende der Human- und Zahnmedizin Steffen Blaurock Thomas Zimmermann 1.1 Einleitung Titrationen werden in der chemischen Analytik durchgeführt, um die Stoffmenge
Analytische Chemie. B. Sc. Chemieingenieurwesen. 01. Februar Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 01. Februar 2012 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 01. Februar 2012 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Protokoll Tag 4, Teil 1
 Protokoll Tag 4, Teil 1 D. Titrationsverfahren D.1. Einführung in die quantitative Analyse; D.2. Acidimetrie (Bestimmung der Konzentration einer Säure) Am heutigen letzten Tag des Praktikums geht es um
Protokoll Tag 4, Teil 1 D. Titrationsverfahren D.1. Einführung in die quantitative Analyse; D.2. Acidimetrie (Bestimmung der Konzentration einer Säure) Am heutigen letzten Tag des Praktikums geht es um
Aufgabe Punkte (je 10) Anorganisches Grund-Praktikum (Poly-BSc/Lehramt) Abschlußklausur (Nachklausur) Name: Vorname: Matrikel-Nr.
 Aufgabe 1 2 3 4 5 6 7 8 9 10 Punkte (je 10) Ich bin damit einverstanden, dass mein Klausurergebnis unter Angabe der Matrikelnummer im Web bekanntgegeben wird: Anorganisches Grund-Praktikum (Poly-BSc/Lehramt)
Aufgabe 1 2 3 4 5 6 7 8 9 10 Punkte (je 10) Ich bin damit einverstanden, dass mein Klausurergebnis unter Angabe der Matrikelnummer im Web bekanntgegeben wird: Anorganisches Grund-Praktikum (Poly-BSc/Lehramt)
Analytische Chemie. B. Sc. Chemieingenieurwesen. 15. März 2017, Uhr. Prof. Dr. Thomas Jüstel, Dr. Stephanie Möller.
 Analytische Chemie B. Sc. Chemieingenieurwesen 15. März 2017, 12.30 15.30 Uhr Prof. Dr. Thomas Jüstel, Dr. Stephanie Möller Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Analytische Chemie B. Sc. Chemieingenieurwesen 15. März 2017, 12.30 15.30 Uhr Prof. Dr. Thomas Jüstel, Dr. Stephanie Möller Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10. V1/4: Komplexometrische Bestimmung von Cobalt durch Rücktitration
 Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10 V1/4: Komplexometrische Bestimmung von Cobalt durch Rücktitration Versuchsdurchführung: 18.01.2010 Protokollabgabe: 22.02.2010 durchgeführt
Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10 V1/4: Komplexometrische Bestimmung von Cobalt durch Rücktitration Versuchsdurchführung: 18.01.2010 Protokollabgabe: 22.02.2010 durchgeführt
Analytische Chemie. B. Sc. Chemieingenieurwesen. 8. Juli 2015, Uhr. Prof. Dr. T. Jüstel, Stephanie Möller M. Sc.
 Analytische Chemie B. Sc. Chemieingenieurwesen 8. Juli 2015, 12.30 15.30 Uhr Prof. Dr. T. Jüstel, Stephanie Möller M. Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Analytische Chemie B. Sc. Chemieingenieurwesen 8. Juli 2015, 12.30 15.30 Uhr Prof. Dr. T. Jüstel, Stephanie Möller M. Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Analytische Chemie. B. Sc. Chemieingenieurwesen. 2. Februar 2016, Uhr. Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc.
 Analytische Chemie B. Sc. Chemieingenieurwesen 2. Februar 2016, 14.00 17.00 Uhr Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des
Analytische Chemie B. Sc. Chemieingenieurwesen 2. Februar 2016, 14.00 17.00 Uhr Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des
Analytische Chemie. B. Sc. Chemieingenieurwesen. 02. Februar Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 02. Februar 2011 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 02. Februar 2011 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Übungsaufgaben zu Ionenreaktionen in wässriger Lösung
 Übungsaufgaben zu Ionenreaktionen in wässriger Lösung 1) Berechnen Sie den phwert von folgenden Lösungen: a) 0.01 M HCl b) 3 10 4 M KOH c) 0.1 M NaOH d) 0.1 M CH 3 COOH (*) e) 0.3 M NH 3 f) 10 8 M HCl
Übungsaufgaben zu Ionenreaktionen in wässriger Lösung 1) Berechnen Sie den phwert von folgenden Lösungen: a) 0.01 M HCl b) 3 10 4 M KOH c) 0.1 M NaOH d) 0.1 M CH 3 COOH (*) e) 0.3 M NH 3 f) 10 8 M HCl
Prüfung zur Analytischen Chemie
 Prüfung zur Analytischen Chemie Datum: 10. Juli 2006 Punktzahl: Name: Matrikel-Nummer: Bitte verwenden Sie für die Lösung nur diese Aufgabenblätter (notfalls auch die Rückseite)! Aufgabe 1) Löslichkeit
Prüfung zur Analytischen Chemie Datum: 10. Juli 2006 Punktzahl: Name: Matrikel-Nummer: Bitte verwenden Sie für die Lösung nur diese Aufgabenblätter (notfalls auch die Rückseite)! Aufgabe 1) Löslichkeit
Quantitativer, selektiver, eindeutiger, stöchiometrisch einheitlicher und rascher Reaktionsverlauf.
 Grundlage der Maßanalyse Quantitativer, selektiver, eindeutiger, stöchiometrisch einheitlicher und rascher Reaktionsverlauf. Was ist eine Maßlösung? Eine Lösung mit genau bekannter Konzentration mithilfe
Grundlage der Maßanalyse Quantitativer, selektiver, eindeutiger, stöchiometrisch einheitlicher und rascher Reaktionsverlauf. Was ist eine Maßlösung? Eine Lösung mit genau bekannter Konzentration mithilfe
Seminar zum Quantitativen Anorganischen Praktikum WS 2011/12
 Seminar zum Quantitativen Anorganischen Praktikum WS 2011/12 Teil des Moduls MN-C-AlC Dr. Matthias Brühmann Dr. Christian Rustige Inhalt Montag, 09.01.2012, 8-10 Uhr, HS III Allgemeine Einführung in die
Seminar zum Quantitativen Anorganischen Praktikum WS 2011/12 Teil des Moduls MN-C-AlC Dr. Matthias Brühmann Dr. Christian Rustige Inhalt Montag, 09.01.2012, 8-10 Uhr, HS III Allgemeine Einführung in die
Versuch Synthese von Kupfer(I)-oxid. Einleitung. Material und Methoden. Versuchsdurchführung
 Synthese von Kupfer(I)-oxid Versuch 3.16 Ausgehend von Kupfersulfat soll Kupfer(I)oxid gebildet werden. Kupfer(I) neigt in wässriger Lösung zur Disproportionierung und ist daher instabil. Die Gleichung
Synthese von Kupfer(I)-oxid Versuch 3.16 Ausgehend von Kupfersulfat soll Kupfer(I)oxid gebildet werden. Kupfer(I) neigt in wässriger Lösung zur Disproportionierung und ist daher instabil. Die Gleichung
3. Praktikumstag. Elektro- und Redoxchemie. Versuch 1.1: Qualitative Versuche zur Redoxchemie. Geräte: 2 Reagenzgläser
 Elektro- und Redoxchemie Versuch 1.1: Qualitative Versuche zur Redoxchemie Geräte: 2 Reagenzgläser Chemikalien: Fe-Nagel, Zn-Granalie, CuSO 4 -Lösung, SnCl 2 -Lösung Versuchsdurchführung: 3. Praktikumstag
Elektro- und Redoxchemie Versuch 1.1: Qualitative Versuche zur Redoxchemie Geräte: 2 Reagenzgläser Chemikalien: Fe-Nagel, Zn-Granalie, CuSO 4 -Lösung, SnCl 2 -Lösung Versuchsdurchführung: 3. Praktikumstag
AnC I Protokoll: 7.1 Synthese und Charakterisierung von Tetraamminkupfer(II)-sulfat! SS Analytische Chemie I.
 Analytische Chemie I Versuchsprotokoll 7.1 Synthese und Charakterisierung der Komplexverbindung Tetraamminkupfer(II)-sulfat 1.! Theoretischer Hintergrund Aus Kupfer(II)-sulfat und Ammoniak wird zunächst
Analytische Chemie I Versuchsprotokoll 7.1 Synthese und Charakterisierung der Komplexverbindung Tetraamminkupfer(II)-sulfat 1.! Theoretischer Hintergrund Aus Kupfer(II)-sulfat und Ammoniak wird zunächst
Analytische Chemie. B. Sc. Chemieingenieurwesen. 23. März Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 23. März 2009 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 23. März 2009 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie. B. Sc. Chemieingenieurwesen. 17. März Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 17. März 2010 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 17. März 2010 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10. V2/3: Coulometrie. Coulometrische Titration von Ascorbinsäure
 Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10 V2/3: Coulometrie Coulometrische Titration von Ascorbinsäure Versuchsdurchführung: 01.03.2010 Protokollabgabe: 03.03.2010 durchgeführt von:
Versuchsprotokoll Grundpraktikum Analytische Chemie WS 09/10 V2/3: Coulometrie Coulometrische Titration von Ascorbinsäure Versuchsdurchführung: 01.03.2010 Protokollabgabe: 03.03.2010 durchgeführt von:
Quantitative Bestimmungen des Nickelund Kupfergehalte in Münzen durch Gravimetrie und Redoxtitration
 Chemie Praktikum Quantitative Bestimmungen des Nickelund Kupfergehalte in Münzen durch Gravimetrie und Redoxtitration WS 2006/2007 Verfasser: Lorenz Germann, Lukas Bischoff Versuchsteilnehmer: Lorenz Germann,
Chemie Praktikum Quantitative Bestimmungen des Nickelund Kupfergehalte in Münzen durch Gravimetrie und Redoxtitration WS 2006/2007 Verfasser: Lorenz Germann, Lukas Bischoff Versuchsteilnehmer: Lorenz Germann,
3. Praktikumstag. Elektro- und Redoxchemie. Versuch 1.1: Qualitative Versuche zur Redoxchemie. Geräte: 2 Reagenzgläser
 Elektro- und Redoxchemie Versuch 1.1: Qualitative Versuche zur Redoxchemie Geräte: 2 Reagenzgläser Chemikalien: Fe-Nagel, Zn-Granalie, CuSO 4 -Lösung, SnCl 2 -Lösung Versuchsdurchführung: 3. Praktikumstag
Elektro- und Redoxchemie Versuch 1.1: Qualitative Versuche zur Redoxchemie Geräte: 2 Reagenzgläser Chemikalien: Fe-Nagel, Zn-Granalie, CuSO 4 -Lösung, SnCl 2 -Lösung Versuchsdurchführung: 3. Praktikumstag
Chemisches Praktikum für Biologen
 Chemisches Praktikum für Biologen Klausur am 03.02.2016 Name: Vorname: Matrikelnummer: Aufgabe Maximale Punktzahl Erreichte Punktzahl 1 3 2 3 3 3 4 3 5 3 6 3 7 3 8 3 Gesamt 24 Bestanden: Die Klausur besteht
Chemisches Praktikum für Biologen Klausur am 03.02.2016 Name: Vorname: Matrikelnummer: Aufgabe Maximale Punktzahl Erreichte Punktzahl 1 3 2 3 3 3 4 3 5 3 6 3 7 3 8 3 Gesamt 24 Bestanden: Die Klausur besteht
Studienbegleitende Prüfung Modul 12 Anorganisch-Chemisches Grundpraktikum SS
 Studienbegleitende Prüfung Modul 12 Anorganisch-Chemisches Grundpraktikum SS 2003 20.10.2003 Name: Vorname: Matrikelnummer: Fachsemester: Punkte: Note: Frage 1 Bei 25 C lösen sich 0,02869 g CuBr in einem
Studienbegleitende Prüfung Modul 12 Anorganisch-Chemisches Grundpraktikum SS 2003 20.10.2003 Name: Vorname: Matrikelnummer: Fachsemester: Punkte: Note: Frage 1 Bei 25 C lösen sich 0,02869 g CuBr in einem
Schulversuchspraktikum. Jans Manjali. Sommersemester Klassenstufen 9 & 10. Titration. Kurzprotokoll
 Schulversuchspraktikum Jans Manjali Sommersemester 2015 Klassenstufen 9 & 10 Titration Kurzprotokoll Auf einen Blick: Die hier vorgestellte Argentometrie ist eine Fällungstitration, bei der Silberionen
Schulversuchspraktikum Jans Manjali Sommersemester 2015 Klassenstufen 9 & 10 Titration Kurzprotokoll Auf einen Blick: Die hier vorgestellte Argentometrie ist eine Fällungstitration, bei der Silberionen
Anorganisches Praktikum 1. Semester. FB Chemieingenieurwesen. Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften
 Anorganisches Praktikum 1. Semester FB Chemieingenieurwesen Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften 1 Gravimetrie Bestimmung von Nickel Sie erhalten eine Lösung, die 0.1-0.2g
Anorganisches Praktikum 1. Semester FB Chemieingenieurwesen Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften 1 Gravimetrie Bestimmung von Nickel Sie erhalten eine Lösung, die 0.1-0.2g
Das Iod-Verteilungsgleichgewicht. Online-Ergänzung
 Das Iod-Verteilungsgleichgewicht Ein problemorientierter Zugang zum chemischen Gleichgewicht zur Schulung der naturwissenschaftlichen Arbeitsweise im Chemieunterricht S. I S. I + II S. II HOLGER FLEISCHER
Das Iod-Verteilungsgleichgewicht Ein problemorientierter Zugang zum chemischen Gleichgewicht zur Schulung der naturwissenschaftlichen Arbeitsweise im Chemieunterricht S. I S. I + II S. II HOLGER FLEISCHER
Qualitative anorganische Analyse
 Qualitative anorganische Analyse Grundprinzip: nicht Stoffe (chemische Verbindungen) werden nachgewiesen, sondern die Ionen, aus denen sie aufgebaut sind Ergebnisform: (auf einem A4 oder A5 Blatt mit Namen,
Qualitative anorganische Analyse Grundprinzip: nicht Stoffe (chemische Verbindungen) werden nachgewiesen, sondern die Ionen, aus denen sie aufgebaut sind Ergebnisform: (auf einem A4 oder A5 Blatt mit Namen,
Stöchiometrie-Seminar April 2019 Moritz Helmstädter 1
 Stöchiometrie-Seminar 4 1 Themen des heutigen Seminars 1) Zusammenfassung des letzten Seminars 2) Besprechung der Hausaufgaben 3) Theorie 4) Übungsaufgaben 2 Themen des heutigen Seminars 1) Zusammenfassung
Stöchiometrie-Seminar 4 1 Themen des heutigen Seminars 1) Zusammenfassung des letzten Seminars 2) Besprechung der Hausaufgaben 3) Theorie 4) Übungsaufgaben 2 Themen des heutigen Seminars 1) Zusammenfassung
Titration kleiner Chloridmengen mit Quecksilber(II)-nitrat
 Illumina-Chemie.de - Artikel Analytik Mit der hier dargestellten maßanalytischen Bestimmung von Chlorid über eine eingestellte Quecksilber(II)-nitrat-Lösung können noch sehr geringe Mengen, bis etwa 0,5
Illumina-Chemie.de - Artikel Analytik Mit der hier dargestellten maßanalytischen Bestimmung von Chlorid über eine eingestellte Quecksilber(II)-nitrat-Lösung können noch sehr geringe Mengen, bis etwa 0,5
Kalium 13-vanadonickelat(IV) K 7 [NiV 13 O 38 ]*16 H 2 0
![Kalium 13-vanadonickelat(IV) K 7 [NiV 13 O 38 ]*16 H 2 0 Kalium 13-vanadonickelat(IV) K 7 [NiV 13 O 38 ]*16 H 2 0](/thumbs/79/80348146.jpg) K 7 [NiV 13 O 38 ]*16 H 0 Zürich, 03.0.004 1 SYNTHESE 1.1 Methode Kaliumcarbonat und Vanadiumpentoxid reagieren in Wasser zu Kaliummetavanadat. Kaliummetavanadat und Nickelsulfat in Wasser reagieren in
K 7 [NiV 13 O 38 ]*16 H 0 Zürich, 03.0.004 1 SYNTHESE 1.1 Methode Kaliumcarbonat und Vanadiumpentoxid reagieren in Wasser zu Kaliummetavanadat. Kaliummetavanadat und Nickelsulfat in Wasser reagieren in
Nährstoffe und Nahrungsmittel
 1 Weitere Lehrerversuche Schulversuchspraktikum Annika Nüsse Sommersemester 2016 Klassenstufen 5 & 6 Nährstoffe und Nahrungsmittel Kurzprotokoll 1 Weitere Lehrerversuche Auf einen Blick: Der Lehrerversuch
1 Weitere Lehrerversuche Schulversuchspraktikum Annika Nüsse Sommersemester 2016 Klassenstufen 5 & 6 Nährstoffe und Nahrungsmittel Kurzprotokoll 1 Weitere Lehrerversuche Auf einen Blick: Der Lehrerversuch
1. Qualitativer Nachweis von Anionen und Sodaauszug
 Anionennachweis 1 1. Qualitativer Nachweis von Anionen und Sodaauszug Die moderne Analytische Chemie unterscheidet zwischen den Bereichen der qualitativen und quantitativen Analyse sowie der Strukturanalyse.
Anionennachweis 1 1. Qualitativer Nachweis von Anionen und Sodaauszug Die moderne Analytische Chemie unterscheidet zwischen den Bereichen der qualitativen und quantitativen Analyse sowie der Strukturanalyse.
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2012/13 vom
 Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2012/13 vom 21.09.2012 A1 A2 A3 A4 A5 Σ Note 14 10 9 8 9 50 NAME/VORNAME:... Lösungsstichpunkte Pseudonym für Ergebnisveröffentlichung:... Schreiben
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2012/13 vom 21.09.2012 A1 A2 A3 A4 A5 Σ Note 14 10 9 8 9 50 NAME/VORNAME:... Lösungsstichpunkte Pseudonym für Ergebnisveröffentlichung:... Schreiben
Säure-Base-Titrationen
 Martin Raiber Chemie Protokoll Nr.3 19.2.2006 Säure-Base-Titrationen 1. Titration von Salzsäure mit Natronlauge Chemikalien: Salzsäure (100ml; c(hcl)=0,1 mol/l) Natronlauge (c(naoh)=1 mol/l) Bromthymolblau
Martin Raiber Chemie Protokoll Nr.3 19.2.2006 Säure-Base-Titrationen 1. Titration von Salzsäure mit Natronlauge Chemikalien: Salzsäure (100ml; c(hcl)=0,1 mol/l) Natronlauge (c(naoh)=1 mol/l) Bromthymolblau
Es soll eine schriftliche Ausarbeitung abgegeben werden (1 Exemplar pro Gruppe).
 Gruppe 1 Thema: Wissenswertes über Essig 1. Bestimme den ph-wert von Haushaltsessig. 2. Wie viel Essigsäure (in mol/l und in g/l) ist in Haushaltsessig enthalten? 3. Wie wird Essigsäure hergestellt (Ausgangsstoffe,
Gruppe 1 Thema: Wissenswertes über Essig 1. Bestimme den ph-wert von Haushaltsessig. 2. Wie viel Essigsäure (in mol/l und in g/l) ist in Haushaltsessig enthalten? 3. Wie wird Essigsäure hergestellt (Ausgangsstoffe,
Studienbegleitende Prüfung Modul 12 Anorganisch-Chemisches Grundpraktikum WS 2002/
 Studienbegleitende Prüfung Modul 12 Anorganisch-Chemisches Grundpraktikum WS 2002/2003 22.04.2003 Name: Vorname: Matrikelnummer: Fachsemester: Punkte: Note: Frage 1 Welche Flammenfärbung zeigen folgende
Studienbegleitende Prüfung Modul 12 Anorganisch-Chemisches Grundpraktikum WS 2002/2003 22.04.2003 Name: Vorname: Matrikelnummer: Fachsemester: Punkte: Note: Frage 1 Welche Flammenfärbung zeigen folgende
Technische Universität Chemnitz Chemisches Grundpraktikum
 Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP5 - Massanalytische Bestimmungsverfahren (Volumetrie)» Martin Wolf Betreuerin: Frau Sachse Datum:
Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP5 - Massanalytische Bestimmungsverfahren (Volumetrie)» Martin Wolf Betreuerin: Frau Sachse Datum:
Messung des Vitamin C Gehaltes in Orangen mit und ohne Schalen written by Cyril Hertz, 3dMN, 25.11.2004
 1. Fragestellung: Das Ziel des Versuches war, herauszufinden, ob sich die Ascorbinsäure 1 eher im Fruchtfleisch oder in der Schale von Orangen befindet. Zu diesem Zweck wurden Orangen mit und ohne Schale
1. Fragestellung: Das Ziel des Versuches war, herauszufinden, ob sich die Ascorbinsäure 1 eher im Fruchtfleisch oder in der Schale von Orangen befindet. Zu diesem Zweck wurden Orangen mit und ohne Schale
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 2,
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr., 6.04.11 1. Sie legen 100 ml einer 0, mol/l Natronlauge vor. Als Titrant verwenden Sie eine 0,8 mol/l Salzsäure. Berechnen
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr., 6.04.11 1. Sie legen 100 ml einer 0, mol/l Natronlauge vor. Als Titrant verwenden Sie eine 0,8 mol/l Salzsäure. Berechnen
Gefahrenstoffe. 2 Bechergläser (230 ml), Bürette, Magnetrührer, Trichter, Rührschwein, Pipette, Stativ, Muffe, ph-meter
 1.1 V1 Titration von Cola In diesem Versuch wird die in Cola enthaltene Phosphorsäure mittels Säure-Base-Titration titriert und bestimmt. Ebenfalls wird mit den erhaltenen Werten gerechnet um das chemische
1.1 V1 Titration von Cola In diesem Versuch wird die in Cola enthaltene Phosphorsäure mittels Säure-Base-Titration titriert und bestimmt. Ebenfalls wird mit den erhaltenen Werten gerechnet um das chemische
Abschlußklausur (Nachklausur)
 Aufgabe 1 2 3 4 5 6 7 8 9 10 Punkte (je 10) Ich bin damit einverstanden, dass mein Klausurergebnis unter Angabe der Matrikelnummer im Web bekanntgegeben wird: Anorganisches Grund-Praktikum (Lehramt) Abschlußklausur
Aufgabe 1 2 3 4 5 6 7 8 9 10 Punkte (je 10) Ich bin damit einverstanden, dass mein Klausurergebnis unter Angabe der Matrikelnummer im Web bekanntgegeben wird: Anorganisches Grund-Praktikum (Lehramt) Abschlußklausur
Dichlorobis(triphenylphosphin)nickel(II)
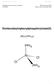 Praktikum Org. und Anorg. Chemie II D-CHAB Wintersemester 04/05 Zürich, den 8. November 2004 Dichlorobis(triphenylphosphin)nickel(II) [Ni 2 ( ) 2 ] Ni 1 1. SYNTHESE 1.1 Methode [1] Nickel(II)chlorid reagiert
Praktikum Org. und Anorg. Chemie II D-CHAB Wintersemester 04/05 Zürich, den 8. November 2004 Dichlorobis(triphenylphosphin)nickel(II) [Ni 2 ( ) 2 ] Ni 1 1. SYNTHESE 1.1 Methode [1] Nickel(II)chlorid reagiert
Das abgetrennte Eisen als Fe 2 O 3 gravimetrisch bestimmen;nickel mit Dimethylglyoxim gravimetrisch bestimmen oder komplexometrisch titrieren.
 Trennungen, Mehrkomponenten-Bestimmungen 81 Versuch 313: Hydrolysentrennung von Eisen und Nickel Arbeitsanleitung Geräte: Bunsenbrenner, Dreifuß, Ceranplatte, 0-mL-Vollpipette, Messzylinder, 600-mL-Bechergläser,
Trennungen, Mehrkomponenten-Bestimmungen 81 Versuch 313: Hydrolysentrennung von Eisen und Nickel Arbeitsanleitung Geräte: Bunsenbrenner, Dreifuß, Ceranplatte, 0-mL-Vollpipette, Messzylinder, 600-mL-Bechergläser,
Bestimmung von Chlorid nach MOHR
 Illumina-Chemie.de - Artikel Analytik Bestimmung von Chlorid nach MOHR Die maßanalytische Bestimmung von Chlorid nach Friedrich Mohr (1806-1879) ist eines der ältesten titrimetrischen Verfahren. Es ist
Illumina-Chemie.de - Artikel Analytik Bestimmung von Chlorid nach MOHR Die maßanalytische Bestimmung von Chlorid nach Friedrich Mohr (1806-1879) ist eines der ältesten titrimetrischen Verfahren. Es ist
Analytische Chemie. B. Sc. Chemieingenieurwesen. 05. Februar Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 05. Februar 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 05. Februar 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie. B. Sc. Chemieingenieurwesen. 14. März Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 14. März 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 14. März 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
2. Teilklausur zum Chemischen Grundpraktikum im WS 2014/15 vom
 2. Teilklausur zum Chemischen Grundpraktikum im WS 2014/15 vom 21.01.2015 A1 A2 A3 F4 R5 E6 Note 8 12 5 9 8 8 50 NAME/VORNAME:... Matrikelnummer:... Pseudonym für Ergebnisveröffentlichung Schreiben Sie
2. Teilklausur zum Chemischen Grundpraktikum im WS 2014/15 vom 21.01.2015 A1 A2 A3 F4 R5 E6 Note 8 12 5 9 8 8 50 NAME/VORNAME:... Matrikelnummer:... Pseudonym für Ergebnisveröffentlichung Schreiben Sie
Versuch 3: Säure-Base Titrationen Chemieteil, Herbstsemester 2008
 Versuch 3: Säure-Base Titrationen Chemieteil, Herbstsemester 2008 Verfasser: Zihlmann Claudio Teammitglied: Knüsel Philippe Datum: 29.10.08 Assistent: David Weibel E-Mail: zclaudio@student.ethz.ch 1. Abstract
Versuch 3: Säure-Base Titrationen Chemieteil, Herbstsemester 2008 Verfasser: Zihlmann Claudio Teammitglied: Knüsel Philippe Datum: 29.10.08 Assistent: David Weibel E-Mail: zclaudio@student.ethz.ch 1. Abstract
Arbeitsblatt. Puffer
 Arbeitsblatt Ziele: Vertiefen des konzeptes Anwenden der Henderson-Hasselbalch Gleichung: i) Berechnen der ph-änderung bei Zugabe von Säure (mit konkreten Konzentrationen durchgeführte Repetition des Wandtafelbeispiels)
Arbeitsblatt Ziele: Vertiefen des konzeptes Anwenden der Henderson-Hasselbalch Gleichung: i) Berechnen der ph-änderung bei Zugabe von Säure (mit konkreten Konzentrationen durchgeführte Repetition des Wandtafelbeispiels)
CHEMIE-PRAKTIKUM FÜR MEDIZINER WS 2010/2011
 Universität Duisburg-Essen - Institut für Organische Chemie 1 CHEMIE-PRAKTIKUM FÜR MEDIZINER WS 2010/2011 1. Tag: Maßanalyse I Datum: Name: Kurs: Saal: Platz Nr. Theoret. Grundlagen: 1. Aufgabe: Titerstellung
Universität Duisburg-Essen - Institut für Organische Chemie 1 CHEMIE-PRAKTIKUM FÜR MEDIZINER WS 2010/2011 1. Tag: Maßanalyse I Datum: Name: Kurs: Saal: Platz Nr. Theoret. Grundlagen: 1. Aufgabe: Titerstellung
Titrationen (Alltagschemikalien)
 Schulversuchspraktikum Kristina Breithaupt Sommersemester 2016 Klassenstufen: 9/10 Titrationen (Alltagschemikalien) Kurzprotokoll Auf einen Blick: In diesem Protokoll werden zwei weitere Schülerversuche
Schulversuchspraktikum Kristina Breithaupt Sommersemester 2016 Klassenstufen: 9/10 Titrationen (Alltagschemikalien) Kurzprotokoll Auf einen Blick: In diesem Protokoll werden zwei weitere Schülerversuche
PARACETAMOL ein Medikamentenwirkstoff
 Julia Seidel, 8B PARACETAMOL ein Medikamentenwirkstoff EINLEITUNG Ich hatte mich für das Arbeiten mit Arzneimitteln entschieden und durchsuchte darum den familiären Medikamentenschrank. Dabei kamen mir
Julia Seidel, 8B PARACETAMOL ein Medikamentenwirkstoff EINLEITUNG Ich hatte mich für das Arbeiten mit Arzneimitteln entschieden und durchsuchte darum den familiären Medikamentenschrank. Dabei kamen mir
Stöchiometrie-Seminar November 2017 Pascal Heitel 1
 Stöchiometrie-Seminar 4 Pascal Heitel 1 Themen des heutigen Seminars 1) Zusammenfassung des letzten Seminars 2) Besprechung der Hausaufgaben 3) Theorie 4) Übungsaufgaben Pascal Heitel 2 1) Zusammenfassung
Stöchiometrie-Seminar 4 Pascal Heitel 1 Themen des heutigen Seminars 1) Zusammenfassung des letzten Seminars 2) Besprechung der Hausaufgaben 3) Theorie 4) Übungsaufgaben Pascal Heitel 2 1) Zusammenfassung
Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2004/
 Klausur zum Anorganisch-Chemischen Grundpraktikum vom 08.04.05 Seite 1 von 10 Punkte: von 84 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2004/2005 08.04.2005 Matrikelnummer: Name:
Klausur zum Anorganisch-Chemischen Grundpraktikum vom 08.04.05 Seite 1 von 10 Punkte: von 84 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2004/2005 08.04.2005 Matrikelnummer: Name:
Fette, Öle und Tenside
 Schulversuchspraktikum Thomas Polle Sommersemester 2015 Klassenstufen 11 & 12 Fette, Öle und Tenside Kurzprotokoll Inhalt Inhaltsverzeichnis 1Weitere Lehrerversuche... 3 V1 Verseifungszahl... 3 2Weitere
Schulversuchspraktikum Thomas Polle Sommersemester 2015 Klassenstufen 11 & 12 Fette, Öle und Tenside Kurzprotokoll Inhalt Inhaltsverzeichnis 1Weitere Lehrerversuche... 3 V1 Verseifungszahl... 3 2Weitere
Trisacetylacetonatoferrat(III) Fe(acac) 3
 Trisacetylacetonatoferrat(III) Fe(acac) 3 Mols, 21. 11. 2004 Marco Lendi, AC II 1. Synthese 1.1 Methode Wasserfreies Eisen(III)chlorid wird in wässriger, basischer Lösung durch Erhitzen in Eisen(III)hydroxid
Trisacetylacetonatoferrat(III) Fe(acac) 3 Mols, 21. 11. 2004 Marco Lendi, AC II 1. Synthese 1.1 Methode Wasserfreies Eisen(III)chlorid wird in wässriger, basischer Lösung durch Erhitzen in Eisen(III)hydroxid
Kapitel 17: Weitere Aspekt. wässriger Gleichgew. Einfluss gleicher Ionen: Gleichioniger Zusatz, Verschiebung des Gleichgewichtes nach Le-Châtelier.
 Ache2 Kapitel 17: Weitere Aspekt. wässriger Gleichgew. Einfluss gleicher Ionen: Gleichioniger Zusatz, Verschiebung des Gleichgewichtes nach Le-Châtelier. Bsp. ph berechnen einer 0.085 mol/l salpetriger
Ache2 Kapitel 17: Weitere Aspekt. wässriger Gleichgew. Einfluss gleicher Ionen: Gleichioniger Zusatz, Verschiebung des Gleichgewichtes nach Le-Châtelier. Bsp. ph berechnen einer 0.085 mol/l salpetriger
Anorganisch-Chemisches Praktikum für Physiker:
 Anorganisch-Chemisches Praktikum für Physiker: Quantitative Analyse (Teil 1) Dr. Christopher Anson INSTITUT FÜR ANORGANISCHE CHEMIE KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum
Anorganisch-Chemisches Praktikum für Physiker: Quantitative Analyse (Teil 1) Dr. Christopher Anson INSTITUT FÜR ANORGANISCHE CHEMIE KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum
2.Klausur Chemisches Rechnen 21. Januar 2013
 2.Klausur Chemisches Rechnen 21. Januar 2013 Name: Matrikelnr.: Dauer: 90 min. Maximal erreichbare Punkte: 40 Punkte 1 Sehr gut: 40 35.5 Punkte 2 Gut: 35 30.5 Punkte 3 Befriedigend: 30 25.5 Punkte 4 Genügend:
2.Klausur Chemisches Rechnen 21. Januar 2013 Name: Matrikelnr.: Dauer: 90 min. Maximal erreichbare Punkte: 40 Punkte 1 Sehr gut: 40 35.5 Punkte 2 Gut: 35 30.5 Punkte 3 Befriedigend: 30 25.5 Punkte 4 Genügend:
Tris(acetylacetonato)eisen(III)
 Praktikum rg. und Anorg. Chemie II DCHAB Wintersemester 04/05 Zürich, den 15. November 2004 Tris(acetylacetonato)eisen(III) [Fe(acac) 3 ] Fe 1 1. SYNTHESE 1.1 Methode [1] Eisen(III)chlorid wird mit Ammoniak
Praktikum rg. und Anorg. Chemie II DCHAB Wintersemester 04/05 Zürich, den 15. November 2004 Tris(acetylacetonato)eisen(III) [Fe(acac) 3 ] Fe 1 1. SYNTHESE 1.1 Methode [1] Eisen(III)chlorid wird mit Ammoniak
Konzentrationsbestimmung mit Lösungen
 Kapitel 5 Konzentrationsbestimmung mit Lösungen Abb. 5.1: Die Farben von Universalindikatoren sind nützlich für Konzentrationsbestimmungen. Sie lernen auf den folgenden Seiten eine sehr nützliche Methode
Kapitel 5 Konzentrationsbestimmung mit Lösungen Abb. 5.1: Die Farben von Universalindikatoren sind nützlich für Konzentrationsbestimmungen. Sie lernen auf den folgenden Seiten eine sehr nützliche Methode
Anorganische-Chemie. Michael Beetz Arbeitskreis Prof. Bein. Grundpraktikum für Biologen 2017
 Michael Beetz Arbeitskreis Prof. Bein Butenandstr. 11, Haus E, E 3.027 michael.beetz@cup.uni-muenchen.de Anorganische-Chemie Grundpraktikum für Biologen 2017 Trennungsgänge und Nachweise # 2 Trennungsgänge
Michael Beetz Arbeitskreis Prof. Bein Butenandstr. 11, Haus E, E 3.027 michael.beetz@cup.uni-muenchen.de Anorganische-Chemie Grundpraktikum für Biologen 2017 Trennungsgänge und Nachweise # 2 Trennungsgänge
Welcher Indikator ist für die Titration von Essigsäure (pks =4.76) mit Natronlauge am besten geeignet?
 1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen ist falsch? A) Säuren erhöhen durch Abgabe eines Protons an Wasser die H3O + -Konzentration einer Lösung. B)
1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen ist falsch? A) Säuren erhöhen durch Abgabe eines Protons an Wasser die H3O + -Konzentration einer Lösung. B)
Analytische Chemie. B. Sc. Chemieingenieurwesen. 9. September 2015, Uhr. Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc.
 Analytische Chemie B. Sc. Chemieingenieurwesen 9. September 2015, 13.30 16.30 Uhr Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe
Analytische Chemie B. Sc. Chemieingenieurwesen 9. September 2015, 13.30 16.30 Uhr Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe
Maßanalyse. Bestimmung einer Schwefelsäure mit einer NaOH Maßlösung: bzw. n(naoh * 1 = n(h 2 SO 4 ) * 2 V [ml] * * t * 1 = n(h 2 SO 4 ) * 2
![Maßanalyse. Bestimmung einer Schwefelsäure mit einer NaOH Maßlösung: bzw. n(naoh * 1 = n(h 2 SO 4 ) * 2 V [ml] * * t * 1 = n(h 2 SO 4 ) * 2 Maßanalyse. Bestimmung einer Schwefelsäure mit einer NaOH Maßlösung: bzw. n(naoh * 1 = n(h 2 SO 4 ) * 2 V [ml] * * t * 1 = n(h 2 SO 4 ) * 2](/thumbs/79/78929570.jpg) Maßanalyse Bei der Maßanalyse (Volumetrie) wird zu der zu analysierenden Lösung unbekannten Gehaltes soviel einer Lösung bekannter Konzentration der Maßlösung zugegeben, bis ein Indikationssystem den Endpunkt
Maßanalyse Bei der Maßanalyse (Volumetrie) wird zu der zu analysierenden Lösung unbekannten Gehaltes soviel einer Lösung bekannter Konzentration der Maßlösung zugegeben, bis ein Indikationssystem den Endpunkt
Anorganisch-Chemisches Praktikum für Physiker und Geoökologen: Quantitative Analyse (Teil 1)
 Anorganisch-Chemisches Praktikum für Physiker und Geoökologen: Quantitative Analyse (Teil 1) Dr. Christopher Anson ISTITUT FÜR AORGAISCHE CHEMIE KIT Universität des Landes Baden-Württemberg und nationales
Anorganisch-Chemisches Praktikum für Physiker und Geoökologen: Quantitative Analyse (Teil 1) Dr. Christopher Anson ISTITUT FÜR AORGAISCHE CHEMIE KIT Universität des Landes Baden-Württemberg und nationales
Anorganische Chemie. Versuch 16 Titration einer schwachen Säure gegen eine starke Base. Versuchsteil 16.1 Potentiometrische Titration
 Georg-August-Universität Göttingen Fakultät für Biologie und Psychologie Anorganische Chemie Versuch 16 Titration einer schwachen Säure gegen eine starke Base Versuchsteil 16.1 Potentiometrische Titration
Georg-August-Universität Göttingen Fakultät für Biologie und Psychologie Anorganische Chemie Versuch 16 Titration einer schwachen Säure gegen eine starke Base Versuchsteil 16.1 Potentiometrische Titration
Grundlagen der Iodometrie
 Illumina-Chemie.de - Artikel Analytik Die Iodometrie ist ein vielseitig anwendbares Verfahren der Maßanalyse. Die zugrundeliegende Reaktion ist die Oxydation von Iodid zu Iod, beziehungsweise die Reduktion
Illumina-Chemie.de - Artikel Analytik Die Iodometrie ist ein vielseitig anwendbares Verfahren der Maßanalyse. Die zugrundeliegende Reaktion ist die Oxydation von Iodid zu Iod, beziehungsweise die Reduktion
DURNI-COAT DNC 25. Autokatalytischer Nickel/Phosphor-Prozess zur Kunststoff-Beschichtung
 Postfach 169 CH-9545 Wängi TG 08.12.2009 DURNI-COAT DNC 25 Autokatalytischer Nickel/Phosphor-Prozess zur Kunststoff-Beschichtung DNC 25 ist ein leicht alkalisches bei Raumtemperatur arbeitendes Verfahren,
Postfach 169 CH-9545 Wängi TG 08.12.2009 DURNI-COAT DNC 25 Autokatalytischer Nickel/Phosphor-Prozess zur Kunststoff-Beschichtung DNC 25 ist ein leicht alkalisches bei Raumtemperatur arbeitendes Verfahren,
Argentometrische Titration nach Volhard
 Illumina-Chemie.de - Artikel Analytik Die massanalytische Methode nach Volhard, wobei die zu bestimmende Substanz mit Silbernitratlösung im Überschuss versetzt und dann das überschüssige Silber mit Ammoniumthiocyanatlösung
Illumina-Chemie.de - Artikel Analytik Die massanalytische Methode nach Volhard, wobei die zu bestimmende Substanz mit Silbernitratlösung im Überschuss versetzt und dann das überschüssige Silber mit Ammoniumthiocyanatlösung
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2016/17 vom
 Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2016/17 vom 23.09.2016 A1 A2 A3 A4 A5 Note 12 12 8 10 8 NAME:... VORNAME:... Stichpunkte zu den Lösungen Pseudonym für Ergebnisveröffentlichung:...
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2016/17 vom 23.09.2016 A1 A2 A3 A4 A5 Note 12 12 8 10 8 NAME:... VORNAME:... Stichpunkte zu den Lösungen Pseudonym für Ergebnisveröffentlichung:...
Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13
 Kantonsschule Kreuzlingen, Klaus Hensler Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13 Grundregeln für stöchiometrische Berechnungen Wenn es um Reaktionen geht zuerst die chem. Gleichung aufstellen
Kantonsschule Kreuzlingen, Klaus Hensler Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13 Grundregeln für stöchiometrische Berechnungen Wenn es um Reaktionen geht zuerst die chem. Gleichung aufstellen
Komplexe SPF BCH am Inhaltsverzeichnis Ihr könnt die Formeln von Komplexsalzen korrekt aufschreiben... 2
 Komplexe Inhaltsverzeichnis Ihr könnt die Formeln von Komplexsalzen korrekt aufschreiben... 2 Ihr könnt die Namen von Komplexsalzen aus den Formeln herleiten... 2 Ihr könnt aus der Beschreibung einer Komplexreaktion
Komplexe Inhaltsverzeichnis Ihr könnt die Formeln von Komplexsalzen korrekt aufschreiben... 2 Ihr könnt die Namen von Komplexsalzen aus den Formeln herleiten... 2 Ihr könnt aus der Beschreibung einer Komplexreaktion
2. Teilklausur zum Chemischen Grundpraktikum im WS 2010/11 vom
 2. Teilklausur zum Chemischen Grundpraktikum im WS 2010/11 vom 02.02.2011 A1 A2 A3 F1 F2 R1 R2 E1 Σ Note 8 7 10 4 5 3 6 7 NAME/VORNAME:... Matrikelnummer:... Schreiben Sie bitte gut leserlich: Name und
2. Teilklausur zum Chemischen Grundpraktikum im WS 2010/11 vom 02.02.2011 A1 A2 A3 F1 F2 R1 R2 E1 Σ Note 8 7 10 4 5 3 6 7 NAME/VORNAME:... Matrikelnummer:... Schreiben Sie bitte gut leserlich: Name und
