Stoffwechsel von Aminosäuren (AS)
|
|
|
- Dominic Reuter
- vor 8 Jahren
- Abrufe
Transkript
1 Kapitel: Aminosäuren 1 Stoffwechsel von Aminosäuren (AS) Repetition Die Aminosäuren besitzen im Stoffwechsel der Zellen vier Funktionen: Aminosäuren sind die 20 Bausteine für die Biosynthese der Proteine. Wie bei allen Körperbausteinen mit Ausnahme der Desoxyribonucleinsäuren besteht auch bei den Proteinen ein dynamisches Gleichgewicht zwischen Auf- und Abbau. Die Halbwertszeit der einzelnen Proteine schwankt zwischen Minuten und Stunden bei einigen Enzymen, Tagen bis Wochen bei Plasmaproteinen und Monaten bei Strukturproteinen wie dem Kollagen. Die Halbwertszeit wird auch durch das rgan in dem das betreffende Protein zu finden ist, bestimmt. Aus den Aminosäuren entstehen in einem Mehrschrittprozess die Proteine, die charakteristisch für eine Zelle sind und das Proteom darstellen. Der Abbau von Proteinen zu Aminosäuren erfolgt unter dem Einfluss von Proteinasen, die Aminosäureseitenketten erkennen, die sich in achbarschaft der gespaltenen Peptidbindung befinden. Im Cytosol sind diese Proteinasen oft Bestandteil von Proteasomen. Aminosäuren wirken als Stickstoff- bzw. Aminogruppendonatoren bei der Biosynthese anderer stickstoffhaltiger Verbindungen wie Purinen, Pyrimidinen, Kreatinphosphat oder Stickstoffmonoxid (). Aminosäuren spielen eine grosse Rolle bei der Glucosehomöostase, da neben Metaboliten der Glycolyse und dem aus der Lipolyse stammenden Glycerin nur die glucogenen Aminosäuren als Substrat für die Gluconeogenese zur Verfugung stehen. Aminosäuren wirken im Gehirn als exzitatorische und inhibitorische eurotransmitter (Glutamat, GABA und Glycin). Abbau der Proteine und Aminosäuren Alle Aminosäuren, die in Proteinen vorkommen, befinden sich auch in freier Form im Blut, in der extrazellularen Flüssigkeit und in den Zellen. Dieser Pool von freien Aminosäuren hat seinen Zufluss aus ahrungsproteinen, welche im Darm in Aminosäuren zerlegt werden, und aus dem intrazellularen Abbau von körpereigenen Proteinen. Die Aminosäuren des Pools werden einerseits verwendet für den Aufbau körpereigener Proteine und für die Synthese von anderen -haltigen Verbindungen, andrerseits werden sie bei einem Überangebot zu C 2 oxidiert und - bei Glucose-Mangel - teilweise zu Glucose verwandelt.
2 Kapitel: Aminosäuren 2 Schema des Aminosäurenstoffwechsels Umwelt rganismus Proteine Proteine H 2 C H 2 Aminosäurenpool Aminosäurenderivate: ucleotide Porphyrine Kreatin -haltige Lipide H 4 Acetoacetat C-Gerüst Glucose C 2 H 2 Acetyl-CoA Pyruvat und Dicarbonsäuren des Citratzyklus Unter AS-Pool (70g) versteht man die Gesamtheit aller im rganismus vorhandenen Aminosäuren. Aus dem AS-Pool gelangen die AS in die Stoffwechselwege des Anabolismus (Protein-Synthese, etc.) oder des Katabolismus. Täglich werden im rganismus eines erwachsenen Mannes bei einem Gesamtbestand von etwa 10 kg Protein - ca. 300 g Protein synthetisiert. Ein Minimum an Aminosäuren (~30g/Tag) (obligatorischer AS-Verlust) wird auch bei ausreichender Zufuhr von Kohlehydraten und Fett abgebaut unter ATP-Gewinn. Der AS-Abbau wird gesteigert bei - proteinreicher Kost und - wenn Kohlehydrat- und Fettreserven aufgebraucht sind, d.h. im Endstadium des Verhungerns. Der gesunde Erwachsene befindet sich bei einer täglichen Zufuhr von 32 g hochwertigem Protein im Stickstoffgleichgewicht, d. h. bei dieser Zufuhr halten sich Stickstoffaufnahme mit der ahrung und Stickstoffabgabe mit den Faeces, dem Urin und über die Haut (durch Schweissabgabe, Epidermisabschilferung und Haarausfall) die Waage.
3 Kapitel: Aminosäuren 3 Grundsätzlich bestehen 2 Möglichkeiten des Abbaus von AS 1. Zur ATP-Gewinnung (Hauptweg) a) Entfernung von b) xydation des C-Skeletts 2. Zur Synthese von biologisch aktiven Verbindungen c) Decarboxylierung Biogene Amine d) xydation der Amine durch Amin-xidasen Der Abbau der AS läuft über mehrere Reaktionen: 1. Desaminierung/Transaminierung H 2 -Gruppe H 3 oder Aspartat 2. Harnstoffbildung -Atom aus H 3 und Aspartat Harnstoff 3. Abbau des Kohlenstoffgerüstes AS und der α-ketocarbonsäure Zwischenprodukte Der grösste Teil des Stickstoffs der Aminosäuren wird im Urin als Harnstoff ausgeschieden. Das eine -Atom des Harnstoffs stammt aus H4, das andere aus Aspartat. In der Leber wird der Stickstoff der meisten Aminosäuren durch Transaminierung so verschoben, dass er schliesslich im Glutamat vorliegt. Dieses kann entweder mit xalacetat transaminieren zu Aspartat oder seinen Stickstoff als Ammonium-Ion abgeben. H4 und die Aminogruppe von Aspartat werden anschliessend mit HC - 3 im Harnstoffzyklus zu Harnstoff kondensiert. Die Entfernung des Stickstoffs aus den Aminosäuren hinterlässt Kohlenstoff-Skelette, welche nun - ebenfalls in der Leber - zu Glucose und Ketonkörpern umgebaut werden können. AS-Stickstoff wird über 3 aufeinander folgende Vorgänge eliminiert (Desaminierung): Intermolekulare Verschiebung der Aminogruppe (Transanimierung) Abspaltung von H 3 vom C-Gerüst (oxidative Desanimierung) Erzeugung einer ungiftigen Transportform (Glutamin) bzw. eines ausscheidbaren - haltigen Derivates (Harnstoff)
4 Kapitel: Aminosäuren 4 Weg des Aminosäuren- zum Harnstoff oxidative Desaminierung C - CH H 3 C - C H 4 Transaminierung von anderen Aminosäuren C - Glutamat C - a-ketoglutarat C - CH H 3 C - Aspartat H 2 C H 2 Harnstoff HC 3 - Harnstoff Bildung Aminosäuren-Desaminierung A. Transaminierung (Transaminasen) B. xidative Desaminierung (Glutamat-Dehydrogenase, GLDH) Die erste Reaktion beim Abbau einer Aminosäure ist fast immer die Entfernung ihrer α- Aminogruppe mit dem Ziel, überschüssigen Stickstoff auszuscheiden und das zurückbleibende Kohlenstoffgerüst abzubauen. Die Desaminierung der meisten Aminosäuren erfolgt durch Transaminierung, der Übertragung ihrer Aminogruppe auf eine α-ketocarbonsäure; dabei entsteht die α-ketocarbonsäure der ursprünglichen Aminosäure und eine neue Aminosäure. Diese Reaktionen werden von Aminotransferasen (Transaminasen) katalysiert. Die Transaminierung führt natürlich nicht zu einer etto-desaminierung. Die eigentliche Desaminierung erfolgt vor allem über die oxidative Desaminierung von Glutamat durch Glutamat-Dehydrogenase, wobei Ammoniak entsteht.
5 Kapitel: Aminosäuren 5 Transaminierung Die α-h 2 -Gruppe der AS wird auf eine α-ketocarbonsäure übertragen, wobei als H 2 - Gruppe-Akzeptoren vor allem α-ketoglutarat aber auch xalacetat zur Verfügung stehen. H 2 -Akzeptoren α-ketoglutarat xalacetat C C Pyridoxal-5 -Phosphat (PLP) PLP ist ein Derivat von Pyridoxin (Vit. B6) H C H -2 3 P H 2 C H -2 3 P H 2 C H CH 3 CH 3 Der Aminogruppen-Akzeptor der Aminotransferasen ist das Coenzym Pyridoxal-5' phosphat (PLP), ein Derivat von Pyridoxin (Vitamin B 6 ). Durch Aminierung entsteht daraus Pyridoxamin-5'-phosphat (PMP). PLP ist kovalent an das Enzym über eine Imin-Bindung (Schiff-Base) verknüpft, die durch die Kondensation seiner Aldehydgruppe mit der ε Aminogruppe eines Lys-Restes des Enzyms entsteht. Die Aminotransferase-Reaktion läuft über einen Ping-Pong-Mechanismus ab, dessen zwei Stufen jeweils drei Einzelschritte umfassen: Stufe 1: Umwandlung einer Aminosäure in eine Ketocarbonsäure Schrittt 1: Transaminierung Schritt 2 : Tautomerisierung Schritt 3: Hydrolyse Stufe 2: Umwandlung einer Ketocarbonsäure in eine Aminosäure Schritte 1-3: umgekehrte Reihenfolge
6 Kapitel: Aminosäuren 6 CH H 2 CH 3 Alanin CH CH 3 C CH 3 CH Transaminierung H H 3 C Lys CH Pyridoxalphosphat (PLP) P CH CH C CH H 2 Glutamat Stufe 1 Stufe 2 C CH 3 Pyruvat H 2 H 2 Pyridoxaminphosphat (PMP) - H 2 C α-ketoglutarat Bilanz: Aminosäure1 α-ketosäure > Aminosäure2 α-ketosäure1 Durch Aminotransferasen, die für die jeweiligen Aminosäuren spezifisch sind, werden die Aminogruppen auf die α-ketosäuren α-ketoglutarat bzw. Pyruvat unter Bildung von Glutamat bzw. Alanin übertragen. Durch zwei Aminotransferasen, die in hohen Konzentrationen in Leber, Myocard und Gehirn vorkommen, kann die Aminogruppe von Alanin auf α-ketoglutarat unter Bildung von Glutamat und Pyruvat übertragen werden. Es handelt sich um die Aspartat-Aminotransferase oder Glutamat-xalacetat Transaminase (ASAT oder GT) bzw. die Alanin-Aminotransferase oder Glutamat-Pyruvat-Transaminase (ALAT oder GPT). Aspartataminotransferase (AST) GT Asp α-ketoglutarat <-----> Glu xalacetat Alaninaminotransferase (ALT) GPT Ala α-ketoglutarat <-----> Glu Pyruvat
7 Kapitel: Aminosäuren 7 xidative Desaminierung Glutamat wird im Mitochondrium oxidativ durch Glutamat-Dehydrogenase desaminiert; es ist das einzige Enzym, das - zumindest in einigen rganismen - sowohl AD als auch ADP als Redox-Coenzym akzeptiert. xidative Desaminierung H C - C C - H 3 C - GLDH C AD H 2 H 4 ADH H C - Glutamat α-ketoglutarat GLDH-Reaktion wird durch Koppelung mit der Transaminasereaktion zum Hauptweg für Bildung von Ammoniak. Citratzyklus α-as a-ks α-ketoglutarat ASAT/ALAT GLDH Glutamat ADH H H4 H 2 AD 3 Produkte: α-ketoglutarat Citratzyklus, Transaminasen (Rezykl.) ADH H4 Harnstoff Gleichgewicht der GLDH-Reaktion liegt stark auf der Seite von Glutamat. Reaktion läuft nur dann in nennenswertem Umfang nach rechts ab, wenn H 4 sofort abgefangen wird (In der Leber geschieht das durch Synthese von Glutamin und Harnstoff).
8 Kapitel: Aminosäuren 8 Speicherung und Transport von Ammoniak als Glutamin Da Ammoniak schon in verhältnismässig niedrigen Konzentrationen als Zellgift (ervensystem!) wirkt, ist eine Umwandlung in andere Verbindungen nötig. Eine wichtige Reaktion, die in vielen rganen ablaufen kann, ist die energetisch günstige Bildung von Glutamin aus Glutaminsäure und Ammoniak. Sie wird durch das Enzym Glutamin- Synthetase katalysiert und erfolgt nach der Gleichung: C - CH H 3 ATP ADP Pi C - CH H 3 H 4 H 2 C - C H 2 Glutamat Glutamin Glutamin dient im Stoffwechsel als H 2 -Donator für die meisten Aminogruppen, ausgenommen die α-aminogruppen der Aminosäuren; ausserdem für die Purin-Synthese und für die Pyrimidin-Synthese; ferner ist es eine Transportform des Ammoniaks im rganismus. Glutamin kann nämlich leicht hydrolytisch gespalten werden zu Glutamat und Ammoniak; das entsprechende Enzym, die Glutaminase, findet sich vor allem in der iere, und das Ammoniak des Harns entsteht zum erheblichen Teil durch diese Reaktion. Transport von Aminogruppen durch den Aspartatzyklus
9 Kapitel: Aminosäuren 9 Aspartatzyklusreaktionen. Auf eine Reihe von Ketoverbindungen kann eine Aminogruppe dadurch übertragen werden, dass die Aminogruppe der Aminosäure Aspartat mit der Ketoverbindung unter Energieverbrauch (ATP oder GTP) zu einem Kondensationsprodukt zusammentritt und das Kondensationsprodukt durch eine Lyasereaktion in die aminierte Verbindung und Fumarat gespalten wird. Aspartat wird aus Fumarat durch die Fumarase-, Malatdehydrogenase- und Glutamat-xalacetat-Transaminase-Reaktion unter gleichzeitigem Gewinn eines Reduktionsäquivalentes ( 1 mol ADH = 3 mol ATP) regeneriert und steht für den erneuten Umlauf zur Verfügung. Alle genannten Reaktionen, auch die Teilreaktionen des Citratzyklus (!), laufen im Cytosol ab. Ausscheidung von Stickstoff bei Vertebraten Lebende rganismen können überschüssigen Stickstoff, der aus dem Aminosäureabbau stammt, auf drei Wegen ausscheiden. Viele im Wasser lebende Tiere geben einfach Ammoniak an das umgebende Milieu ab. Wo Wasser nicht so reichlich vorhanden ist, wurden Mechanismen entwickelt, die Ammoniak in weniger toxische Abfallprodukte umwandeln, für deren Ausscheidung dann weniger Wasser erforderlich ist. Eines dieser Produkte ist Harnstoff der von den meisten landlebenden Vertebraten ausgeschieden wird; ein weiteres ist Harnsäure, die von Vögeln und landlebenden Reptilien abgesondert wird. AS-Stickstoff Ammoniakausscheider ammnotelisch Harnstoffausscheider ureotelisch Harnsäureausscheider uricotelisch Harnstoff-Synthese (Harnstoff-Zyklus) Harnstoff wird in der Leber durch die Enzyme des Harnstoff-Zyklus synthetisiert. Er wird dann in den Blutstrom abgegeben und von den ieren mit dem Urin ausgeschieden. Die Grundzüge des Harnstoff-Zyklus wurden 1932 von Hans Krebs und Kurt Henseleit aufgeklärt (es war der erste bekannte Stoffwechsel-Zyklus überhaupt). Eine 7o kg schwere ormalperson bildet in 24 h etwa 0,5 mol (30 g) Harnstoff. Bei proteinreicher Ernährung kann die Harnstoffbildung bis auf das Dreifache ansteigen. Diese
10 Kapitel: Aminosäuren 10 Steigerung ist deshalb möglich, weil die Enzyme im Überschuss vorhanden sind und weil sich außerdem die Enzymaktivitäten bei proteinreicher ahrung um das Zwei- bis Dreifache erhöhen können. HC 3-2ATP 2ADP Pi CPS H 2 C P Carbamoyl-P H 4 H 2 C Harnstoff H 2 H 3 ARG CH H 3 C - rnithin TC H 2 Arginin H 2 C H 2 H CH H 3 C - ASL C - CH CH C - Fumarat Malat (Citrat-Zyklus) Pi H 2 C H 2 C H C - CH Mitochondrium H CH H 3 C - Citrullin H CH ASS 2 ATP CH H 3 C - C - AMP PPi H 2 CH H 3 C - Aspartat Cytosol C - Argininosuccinat Harnstoffzyklus Enzyme im Harnstoffzyklus: Carbamoylphosphat-Synthetase (CPS), rnithin-transcabamoylase (TC), Argininsuccinat-Synthase (ASS), Argininsuccinat-Lyase (Argininosuccinase) (ASL), Arginase (ARG). Die Bildung des Harnstoffs verläuft in 5 Schritte. Die ersten zwei Schritte finden im Mitochondrium statt, die übrigen im Cytosol: 1. Schritt: Durch das Enzym Carbamylphosphat-Synthetase I (CPS) wird unter Verbrauch von zwei Molekülen ATP aus Bicarbonat und Ammoniak das Phosphorsäureanhydrid der Carbaminsäure, das Carbamoylphosphat, gebildet. Carbamoylphosphat ist auch der Ausgangspunkt der Pyrimidinbiosynthese. Für diese Reaktion wird es jedoch durch eine cytosolische CPS II gebildet, die Glutamin, Bicarbonat und zwei Moleküle ATP benötigt.
11 Kapitel: Aminosäuren Schritt: Zunächst wird der Carbamylrest von Carbamylphosphat auf die nicht proteinogene Aminosäure rnithin übertragen (rnithin-transcarbamylase). Dabei entstehen Citrullin, eine ebenfalls nicht proteinogene Aminosäure, und anorganisches Phosphat. Das Reaktionsgleichgewicht liegt stark auf der Seite der Citrullinbildung. 3. Schritt: Citrullin tritt durch die Mitochondrienmembran in das Cytosol über, wo alle weiteren Reaktionen des Kreisprozesses ablaufen. Auf den an rnithin gebundenen Carbamylrest (Citrullin) soll im nächsten Schritt eine weitere Aminogruppe übertragen werden. Dabei kondensiert die Carbonylgruppe von Citrullin mit der Aminogruppe von Aspartat unter Bildung von Argininosuccinat (Argininosuccinat-Synthetase). Auch diese Reaktion ist ATP-abhängig, das entstehende Pyrophosphat wird durch eine Pyrophosphatase gespalten, wobei das Reaktionsgleichgewicht in Richtung Argininosuccinatbildung verschoben wird. 4. Schritt: Die anschließende Spaltung der C--Bindung (Argininosuccinat-Lyase) in die Produkte Fumarat und die proteinogene Aminosäure Arginin ist im Gegensatz zu den vorhergehenden Reaktionen reversibel. Durch diese beiden Reaktionen ist die Aminogruppe von Aspartat auf Citrullin übertragen worden. 5. Schritt: Der Kreisprozess der Harnstoffbiosynthese wird durch die hydrolytische Abspaltung der Guanidinogruppe von Arginin geschlossen. Dabei entstehen Harnstoff und rnithin. Bilanz Energieverbrauch: 3ATP 2ADP, 2Pi, AMP, PPi(2Pi) Bedarf für die Regeneration: 4 ATP Energiekompensierung (durch Fumarat): 1 ADH = 3 ATP Bemerkenswert an den beschriebenen Reaktionen ist, dass durch den Kreisprozess das Trägermolekül rnithin ständig regeneriert wird und auch der Aminogruppendonator Aspartat durch wenige enzymatische Schritte erneuert werden kann, wobei ein Reduktionsäquivalent gewonnen wird. Somit werden dem Hepatocyten bei der Biosynthese von Harnstoff lediglich zwei Ammoniakmoleküle, Bicarbonat und Energie entzogen. Hyperammoniämien Homozygote bzw. gemischt heterozygote Defekte der Harnstoffzyklus-Enzyme führen zu einem Zusammenbruch des Harnstoffzyklus mit einem Anstieg der Ammoniakkonzentration (Hyperammoniämien). hne entsprechende Therapie, d.h. Hämodialyse in der Akutphase, treten Gehirnschaden (Hirnödem mit verkleinertem Ventrikelsystem, Abflachung der Gyri) und der Tod der Patienten ein. Ammoniak ist extrem
12 Kapitel: Aminosäuren 12 neurotoxisch in höheren Konzentrationen und eine Belastung für die GLDH (α-ketoglutarat ), Glu-Synthase (GABA ) und eurotransmittersynthese (Dopamin ). Die Harnstoffsynthese produziert ein Proton, welches zur eutralisierung eines Teils des beim AS-Abbau freigesetzten HC - 3 dient. Blockierung der Harnstoffsynthese (Enzymdefekte) führt zu Alkalose. 1. HC - 3 2H 4 H Stoff 2H 2 H 2. H HC - 3 C 2 H 2 Σ 2 HC 3-2H 4 H Stoff 3 H 2 C 2 Enzymdefekte des Harnstoffzyklus 1. Cabamoylphosphat-Synthase (CPS)-Mangel 2. rnithin-transcabamoylase (TC)-Mangel 3. Argininsuccinat-Synthase (ASS)-Mangel 4. Argininsuccinat-Lyase (Argininosuccinase) (ASL)-Mangel 5. Arginase (ARG)-Mangel 6. -Acetyglutamat-Synthase (AGS)-Mangel Differentialdiagnose (Beispiel ASL-Magel) PLASMA Gln Ala Asn Cit Arg-suc rn Lys Arg ASL /n /n n n /n
13 Kapitel: Aminosäuren 13 Abbau des Kohlenstoffgerüstes der Aminosäuren Die Abbauprodukte von Aminosäuren sind im allgemeinen Intermediate des Citronensäurezyklus oder deren Vorstufen, so dass sie zu C, und H 2 verarbeitet oder in der Gluconeogenese eingesetzt werden können. Tatsachlich liefert der oxidative Aminosäureabbau typischerweise 10 bis 15% der im Stoffwechsel erzeugten Energie eines Tieres. Die Standard-Aminosäuren können zu sieben verschiedenen Intermediaten des Stoffwechsels abgebaut werden, nämlich Pyruvat, α-ketoglutarat, Succinyl-CoA, Fumarat, xalacetat, Acetyl-CoA oder Acetoacetat. Die Aminosäuren lassen sich je nach katabolischem Weg in zwei Gruppen einteilen: 1. Glucogene (glucoplastische) AS Synthese v. Kohlehydraten 2. Ketogene (ketoplastische) AS Fettsäuren und Ketokörper Glucose C 2 PEP Pyruvat Ala, Gly Cys, Ser Thr, Trp Leu Ile Trp, Thr Leu Lys Phe Tyr C 2 C 2 Acetyl-CoA Acetoacetat Asp Asn xalacetat Citrat Lipide Tyr Phe Asp Fumarat Citronensäure- Zyklus C 2 a-katoglutarat Glu Gln His Pro Arg C 2 Succinly-CoA Ile Met Thr Val ketogene AS glucogene AS So ist z. B. Alanin glucogen, weil sein Transaminierungsprodukt Pyruvat über die Gluconeogenese in Glucose umgewandelt werden kann. Leucin dagegen ist ketogen, da sein Kohlenstoffgerüst zu Acetyl-CoA und Acetoacetat abgebaut wird.
14 Kapitel: Aminosäuren 14 Ala Ser Gly Thr Cys Trp Pyruvat Das Abbauprodukt von fünf Aminosäuren (Alanin, Cystein, Glycin, Serin und Threonin) ist Pyruvat. Tryptophan gehört eigentlich auch zu dieser Gruppe, da eines seiner Abbauprodukte - Alanin - durch Transaminierung zu Pyruvat konvertiert wird. Abbau des Glycins Glycin wird durch Serin-Hydroxymethyltransferase - ein PLP-haltiges Enzym - in Serin umgewandelt. Dieses Enzym verwendet 5, 10 -Methylen-Tetrahydrofolat (5,10-MTHF) als Coenzym, das die für diese Umwandlung benötigte C 1 -Einheit liefert. Die bei der Umwandlung von Glycin in Serin eingesetzte Methylen-Gruppe aus 5, 10 -Methylen-THF stammt aus einem zweiten Abbauweg fur Glycin; dieser wird vom glycinabbauenden Enzymkomplex (bei der Rückreaktion als Glycin-Spaltsystem bezeichnet) katalysiert. Es handelt sich dabei um einen Multienzymkomplex. Die Synthese des Glycins erfolgt über eine Serin-Aldolase. Abbau des Glycins C 2 H 4 ADH 2 5,10-MTHF H 2 C H 3 C - Gly 1 Ser-Aldolase Gly AD THF H 2 C H H C H 3 C - Ser Pyruvat H 4 Ser-Dehydratase (PLP) 1. Gly Ser ( Pyruvat) ] Ser-Hydroxymethyltransferase (PLP-Enzym) 2. Gly C 2 H 4 ] Gly-Spaltsystem (THF-abhängig) Die menschliche Erbkrankheit nichtketotische Hyperglycinamie (KH), die sich durch geistige Retardierung und Akkumulation grösser Mengen von Glycin in den Körperflüssigkeiten auszeichnet, beruht auf einem Fehlen des glycinabbauenden Enzymkomplexes.
15 Kapitel: Aminosäuren 15 Ile Leu Acetoacetat Val Pyruvat Beim Abbau von Isoleucin, Leucin und Valin, die verzweigte Ketten haben, sind die Enzyme bei den ersten drei Reaktionen: (1) Transaminierung zur entsprechenden α- Ketocarbonsdure, (2) oxidative Decarboxylierung zum entsprechenden Acyl-CoA und (3) Dehydrierung durch FAD unter Bildung einer Doppelbindung. Danach verläuft der Isoleucinabbau wie bei der Fettsäureoxidation: (4) Hydratisierung der Doppelbindung, (5) Dehydrierung durch AD und (6) thiolytische Spaltung zu Acetyl- CoA und Propionyl-CoA, das anschliessend zu Succinyl-CoA,verarbeitet" wird. Valin wird analog abgebaut: ach der Hydratisierung der Doppelbindung (7), wird (8) die CoA- Thioester-Bindung hydrolysiert, dann erst folgt (9) die zweite Dehydrierungsreaktion. Die Thioesterbindung wird in der letzten Reaktion (10) - einer oxidativen Decarboxylierung anstelle einer thiolytischen Spaltung - als Propionyl-CoA regeneriert. Abbau der Verzweigkettigten Aminosäuren und bekannte Enzymdefekte
16 Kapitel: Aminosäuren Schritt: Transaminierung (PLP); Cytosol H 2 CH 3 CH CH Isoleucin CH 3 α-kg Glu Transaminierung (PLP) CH 3 CH C CH 3 α-keto-β-metyl-valeriansäure β α 2. Schritt: oxidative Decarboxylierung (CoSH, AD, FAD); innere Mitochondienmembran CH 3 CH C α-keto-β-metyl-valeriansäure CH 3 α-methylbutyryl-coa xosäurendehydrogenase (Enzymkoplex) C 2 CoSH AD FAD CH 3 CH C SCoA CH 3
17 Kapitel: Aminosäuren Schritt: Dehydrierung (FAD); Mitochondrien CH 3 CH C CH 3 α-methylbutyryl-coa SCoA Acyl-CoA-Dehydrogenase FAD Tiglyl-CoA CH 3 CH C C CH 3 SCoA Ahornsirup-Krankheit ist die Folge eines Defektes beim Abbau verzweigtkettiger Aminosäuren α-ketoisovalerat-dehydrogenase, die beim Abbau von Aminosäuren mit verzweigten Ketten Reaktion 2 katalysiert, ist ein Multienzymkomplex, der neben seinem terminal oxidierenden Agens AD die Coenzyme TPP, Lipoamid und FAD einsetzt. Ein genetischer Defekt in diesem Enzymkomplex ist die Ursache der Ahornsirup-Krankheit (Meaplesyrup urine disease, MSUD); die daraus folgende Akkumulation von α-ketocarbonsäuren (α- Keto-β-Methylvaleriansäure) mit verzweigten Ketten verleiht dem Urin den charakteristischen Geruch von Ahornsirup (würzig-süsslich). Wird der Anteil verzweigtkettiger Aminosäuren in der ahrung nicht reduziert, führt die Krankheit schnell zum Tod. α-ketosäuren-dehydogenase Komplex 6 Genloci: 2 Proteine und 4 regulatorische Enzyme MSUD Häufigkeit: 1:200'000 eugeborene (Mennoiten 1:176) Phenotyp: Apathie, Trinkschwäche, Krämpfe, Coma
18 Kapitel: Aminosäuren 18 Phe Tyr Fumarat Acetoacetat Die erste Reaktion des Abbaus von Phenylalanin ist die Hydroxylierung zu Tyrosin, so dass der weitere Abbau der beiden Aminosäuren auf einem einzigen Weg erfolgt. Die Endprodukte des sechsstufigen Abbaus sind Fumarat, Bestandteil des Citronensäure- Zyklus, und Acetoacetat. Abbau der aromatischen Aminosäuren Phenylalanin und Tyrosin Phenylalaninhydroxylase H Transaminase H Dioxygenase H Tetrahydrobiopterin α-ketoglutarat (PLP) 2 CHH 2 -H 2 CHH 2 C Phenylalanin Tyrosin p-hydroxyphenylpyruvat Ascorbat 2 -C 2 2 H Homogentisinsäure Dioxygenase Fumarat Acetoacetat H 2 HC Isomerase Fumarylacetoacetat (trans) Maleylacetoacetat (cis) Phenylketonurie (PKU) und Hyperphenylalaninämien PKU und Hyperphenylalaninämien sind eine Gruppe von angeborenen Stoffwechsel- Erkrankungen, die auf eine ungenügende xidation des Phenylalanins zurückzuführen sind. Die gemeinsame biochemische Abnormität ist eine Anhäufung von Phenylalanin im Gewebe und Blut. Je nach Schweregrad der Hyperphenylalaninämie werden drei Formen unterschieden (klassische PKU, milde PKU und benigne Hyperphenylalaninämie). Asbjörn Fölling (orwegen) fand 1934 im Urin eines Patienten grosse Mengen Phenylbrenztraubensäure. Drei Jahre später wurde diese Krankheit als Phenylketonurie beschrieben und erst 1947 konnte mittels eines Phenylalaninbelastungstestes der metabolische Defekt bei diesen Patienten identifiziert werden. Es wurde festgestellt, dass es sich dabei um einen Phenylalaninhydroxylase-Mangel handelt. Bickel und Mitarbeiter (Heidelberg) führten eine wirksame Therapie mit einer phenylalaninarmen Diät ein und
19 Kapitel: Aminosäuren 19 Guthrie und Susi propagieren seit 1961 das Screening auf Hyperphenylalaninämie bei eugeborenen mit dem von ihnen entwickelten bakteriellen Hemmtest (Guthrietest). Phenylketonurie (PKU): Entstehung von Metaboliten PAH a-ketoglutarat CH C - H 3 Phenylalanine H CH C - Tyrosin H 3 Transaminasen (PLP) ADH H Glutalat AD CoA C C - ADH H Dehydrogenase AD Phenylpyruvat H 2 C 2 C - C SCoA CH C - H Phenylacetat CoA Phenylacetyl-CoA Phenyllactat Das überschüssige Phenylalanin wird auf einem sonst unbedeutenden Weg zu Phenylpyruvat transaminiert. Phenylalanin-Hydroxylase-Mangel erklärt auch ein anderes allgemeines PKU-Symptom: Die Betroffenen haben hellere Haar- und Hautfarbe als ihre gesunden Geschwister. Die Tyrosin-Hydroxylierung, die erste Reaktion bei der Bildung des schwarzen Hautpigments Melanin, wird durch erhöhte Phenylalaninspiegel gehemmt. Phenylalanin hemmt zudem zwei geschwindigkeitsbestimmende Enzyme in der Biosynthese von Dopamin und Serotonin (Tyrosin- und Tryptophanhydroxylase). Phenylketonurie Häufigkeit: 1: eugeborene Erbgang: Autosomal-rezessiv Phenotyp (unbehandelt): Hypotonie der Rumpfmuskulatur, Hypertonie der Extremitäten, Epilepsie, Ptose Therapie: Phenylalaninarme Diät (neu: BH 4 -Cofaktor Therapie)
20 Kapitel: Aminosäuren 20 eugeborenen Screeing Ein Enzymdefekt führt zu einem Block in einer Reaktionskette des Intermediärstoffwechsels. Die dem Block folgenden Metaboliten werden nicht oder nur in erheblich verminderter Menge gebildet und die Vorstufen akkumulieren (Phenylalanin). Jedem eugeborenen werden in der ersten Lebenswoche aus der Ferse einige Tropfen Blut für den so genannten Guthrie- Test entnommen. Die eugeborenen werden, neben der PKU, auch auf einige andere behandelbare Stoffwechselstörungen getestet. Bei dem Guthrie-Test auf PKU werden die Bakteriensporen (B. subtilis) zusammen mit dem Inhibitor (β-thienylalanin; Antimetabolit) in einem phenylalanin-freien Agar auf Platten gegossen. Auf diese Agarplatte werden Trockenblutproben (Filterpapier) aufgelegt. Durch die Gegenwart von Phenylalanin in diesen Proben wird die Wirkung des kompetitiven Inhibitors (β-thienylalanin) aufgehoben und die Bakterien bilden einen Wachstumshof. Die Größe dieses Wachstumhofes ist dem Gehalt der Blutprobe an Phenylalanin proportional. Phenylalanin im Blut (normal) < 0.12 mmol/l Tetrahydrobiopterin (BH 4 ): Cofaktor der Hydroxylierung von aromatischen Aminosäuren Die Hydroxylierung von Phenylalanin durch das Fe(III)-haltige Enzym Phenylalanin- Hydroxylase benötigt einen Cofaktor: Tetrahydrobiopterin, ein Pterin-Derivat. Pterine enthalten ein Pteridinring, welcher auch in der Folsäure enthalten ist (siehe Kapitel: C1- Stoffwechsel). Pterine sind wie Flavine an biologischen xidationen beteiligt. Die aktive Form von Biopterin ist die vollreduzierte Form 5,6,7,8-Tetrahydrobiopterin. Sie wird durch drei Enzyme (GTP-Cyclohydrolase, PTP-Synthase und Sepiapterin-Reduktase) aus GTP gebildet. In der Phenylalanin-Hydroxylase-Reaktion wird 5,6,7,8- Tetrahydrobiopterin über eine Zwischenstufe (Carbinolamin) zur chinoiden Form von 7,8- Dihydrobiopterin oxidiert. Dieses Chinoid wird anschliessend durch das ADH-abhängige Enzym Dihydropteridin-Reduktase reduziert und der aktive Cofaktor regeneriert.
21 Kapitel: Aminosäuren 21 Funktion des Tetrahydrobiopterins als Redox-Cofaktor GTP H 2 H H H H H 5,6,7,8-Tetrahydrobiopterin 2 PAH H 2 H H H H H Phe CHH 2 ADH -AD DHPR PAH H H 2 H H H q-dihydrobiopterin -H 2 PCD H 2 HH H H H Tetrahydrobiopterin- 4a-carbinolamine Tyr CHH 2 PCD = Pterin-4a-Carbinolamindehydratase DHPR = Dihydropteridin-Reduktase Enzyme, die auf diese Weise zwei miteinander gekoppelte xidationen katalysieren (xidation von Phenylalanin zu Tyrosin und 5,6,7,8-Tetrahydrobiopterin zu q-7,8-dihydrobiopterin), werden als gemischt funktionelle xidasen (Hydroxylasen, Monooxygenasen) bezeichnet. Allgemeine Reaktion: XH CoeH 2 2 X-H H 2 Coe Tetrahydrobiopterin-Mangel Seit 1974 wurde über einige Patienten mit atypischer Hyperphenylalaninämie berichtet, die trotz Früherkennung und Behandlung mit phenylalaninarmer Diät progressive neurologische Störungen und einen zunehmenden Entwicklungsrückstand zeigten und zum Teil daran starben. Man fand bei diesen Patienten ein Defekt in der Biosynthese des BH 4, das im Gegensatz zur Folsäure, kein Vitamin darstellt, sondern im gesunden Menschen nach Bedarf in katalytisch kleinen Mengen synthetisiert wird. Die Bedeutung dieser Stoffwechselkrankheiten, die alle als BH 4 -Mangel bezeichnet werden können, ist trotz ihrer Seltenheit (2-3 : ) gross. Das Risiko eines Hirnschadens bei konventioneller Behandlung eines neuentdeckten Patienten mit Hyperphenylalaninämie muss vermieden werden.
22 Kapitel: Aminosäuren 22 BH4-Mangel (Info: Häufigkeit: 1: eugeborene Erbgang: Autosomal-rezessiv Phenotyp (unbehandelt): Hypotonie der Rumpfmuskulatur, Hypertonie der Extremitäten, Epilepsie, Ptose, Therapie: BH 4 -Cofaktor Therapie, eurotransmitter-vorstufen (L-Dopa/Carbidopa/5-hydroxytryptophan) Abbau des Tyrosins (Abb. S. 18) Tyrosin verliert seine Aminogruppe über die Transaminierung auf a-ketoglutarat oder Pyruvat. Das verantwortliche Enzym, die Tyrosinaminotransferase, ist sowohl im Cytosol als auch in den Mitochondrien nachweisbar. Das entstandene p-hydroxyphenylpyruvat wird durch die cytosolische p-hydroxyphenylpyruvat-dioxygenase, eine kupferhaltige mischfunktionelle xygenase in Leber und ieren, in Homogentisat umgewandelt. Bei dieser Reaktion, die die Anwesenheit von Ascorbinsäure (Vitamin C) oder einem anderen Reduktionsmittel erfordert, erfolgt gleichzeitig die Hydroxylierung des Benzolrings in Parastellung sowie eine Wanderung der Pyruvatseitenkette, aus der durch Dehydrierung und Decarboylierung eine Acetatseitenkette entsteht. Im nächsten Schritt wird der Benzolring durch die Einführung von molekularem Sauerstoff gespalten. Katalysator ist die Homogentisatdioxygenase, ein eisenabhängiges Protein. Das Reaktionsprodukt Maleylacetoacetat wird durch eine Glutathion-abhängige cistrans-isomerisierung in Fumarylacetoacetat umgewandelt und anschliessend hydrolytisch in Fumarat und Acetacetat gespalten. Fumarat ist ein direkter Bestandteil des Citratcyclus, Acetoacetat, ein Ketonkörper, wird nach Aktivierung zu Acetoacetyl-CoA in 2 Moleküle Acetyl-CoA gespalten. Tyrosinämien Drei angeborene Stoffwechseldefekte im Tyrosinabbau sind bekannt: Tyrosinämie Typ 1 (Fumaryl-Acetoacetase-Mangel) Tyrosinämie Typ 2 (Tyrosinaminotransferase-Mangel) Alkaptonurie (Homogentisinsäure-Dioxigenase-Mangel) Bei der Tyrosinämie Typ 1 (Inzidenz 1:100 00) handelt sich um eine autosomal-rezessiv vererbte Abbaustörung von Tyrosin, die zur Bildung des toxischen Metabolites Succinylaceton (aus Fumarylacetoacetat und Maleylacetoazetat) führt. Die toxischen
23 Kapitel: Aminosäuren 23 Metabolite greifen in die Hämsynthese ein und verursachen eine progrediente Hepatopathie mit schlechter Prognose, die entweder im ersten Lebensjahr zum Leberversagen und Tode oder - bei langsamerem, chronischen Verlauf - zur Leberzirrhose, häufig hepatozellulärem Karzinom und Tod in der späten Kindheit führt. Während früher allein die Lebertransplantation die einzige Möglichkeit war, das Leben zu retten, steht heute mit dem TBC [2-(2-itro-4-trifluoromethylbenzoyl)-1,3-zyklohexandion] ein potenter Inhibitor des Abbaus des Tyrosins auf einer Stufe vor der Furmaylacetoacetase (p-hydroxyphenylpyruvat-dioxygenase) zur Verfügung, der verhindert, dass die toxischen Metaboliten anfallen. Alkaptonurie ist die erste, zu Beginn dieses Jahrhunderts von Archibald Garrod erkannte, angeborene Stoffwechselkrankheit, die zur Ausscheidung grosser Mengen von Homogentisinsäure führte. Die Symptome der Alkaptonurie sind relativ milde und treten erst im Erwachsenenalter auf. Typischerweise entwickeln Alkaptonuriker im Laufe des Lebens eine Arthritis; ihr Urin färbt sich infolge Luftoxidation des ausgeschiedenen Homogentisats dunkel. Aminosäuren als Vorstufer wichtiger Biomoleküle Bestimmte Aminosäuren sind Vorstufen wichtiger Biomoleküle, einschliesslich der ucleotide und ucleotid-coenzyme, Häm, verschiedener Hormone, eurotransmitter und Glutathion. Tyr Katecholamine Melanin Thyroxin Biosynthese der Katecholamine aus Tyrosin Dopamin, oradrenalin und Adrenalin werden zusammen als Katecholamine bezeichnet, da sie die Amin-Derivate von Katechol sind. Die Umwandlung von Tyrosin in die verschiedenen Katecholamine läuft über eine Tyrosin-Hydroxylase (BH 4 -Abhängig), AA- Decarboxylase (B6-Abhängig), Dopamin-β-Hydroxylase (Vit.C-Abhängig; Cu-Enzym) und Phenylethanolamin--Methyltransferease (SAM-Abhängig; siehe Kapitel C1-Stoffwechsel).
24 Kapitel: Aminosäuren 24 Biosynthese der Katecholamine Biosynthese von Melanin aus Tyrosin Melanin ist einer der wichtigsten Pigmenstoffe der atur (Schutz vor ionisierter UV- Strahlung). Es wird aus Tyrosin in mehreren Stufen gebildet und hat quantitativ für den Tyr- Abbau keine Bedeutung. Die ganze Reaktionsfolge wird von einem einzigen Enzym, der Monophenol-Monooxygenase (früher Tyrosinase genannt), katalysiert. Der Bildungsort sind die Melanozyten in Basalschicht von Haut und Auge.
25 Kapitel: Aminosäuren 25 Melaninbiosynthese H CHH 2 Monophenol- Monooxygenase H H CHH 2 Ringschluss Tyrosin L-Dopa Dopachrom H H H H Decarboxylase -C 2 H Indol-5,6-chinon Polymerisation Polymertypen: Eumelanine (schwarz-braun) Phäomelanine (gelb-rotbraun) Triochrome (rot); (rot); Cys Cys H Melanin H Melaninmangel Monophenol-Monooxygenase-Mangel (Albinismus) o Rote Augenfarbe o Weisse Haut o Flaches blondes Haar o Sehr Lichtempfindlich o Gefahr von Melanomen Vitiligio o weisse Flecken o Ursache unklar PKU (reduzierte Zufuhr von Tyrosin) Kupfermangel (Monooxygenase = Cu-Enzym)
26 Kapitel: Aminosäuren 26 Biosynthese von Aminosäuren Viele Aminosäuren können nur von Pflanzen und Mikroorganismen synthetisiert werden. Da Säuger diese Aminosäuren mit der ahrung aufnehmen müssen, bezeichnet man sie als essentielle Aminosäuren. Aminosäuren, die von Säugern selbst gebildet werden können, nennt man nichtessentiell. Die für Menschen essentiellen und nichtessentiellen Aminosäuren sind unten aufgeführt. Arginin wird zwar im Harnstoff-Cyclus synthetisiert, da aber Kinder (nicht Erwachsene) während ihrer normalen Entwicklung mehr davon benötigen, als dieser Stoffwechselweg liefern kann, rechnet man es zu den halbessentiellen Aminosäuren. Essentielle Arginin* Histidin Isoleucin Leucin Lysin Methionin Phenylalanin Threonin Tryptophan Valin ichtessentielle Alanin Asparagin Aspartat Cystein Glutamat Glutamin Glycin Prolin Serin Tyrosin Biosynthese nichtessentieller Aminosäuren Alle nichtessentiellen Aminosäuren, ausser Tyrosin, werden auf einfachen Wegen synthetisiert, die von vier Grundbausteinen des Stoffwechsels ausgehen: Pyruvat, xalacetat, α-ketoglutarat und 3-Phosphoglycerat. Tyrosin entsteht in einem Schritt durch Hydroxylierung der essentiellen Aminosäuren Phenylalanin, ist also strenggenommen ebenfalls als essentiell anzusehen. Biosynthese aus Pyruvat, xalacetat und α-ketoglutarat durch Transaminierung Ala: Pyruvat Ala Asp, Asn: calacetat Asp (Asn) Glu, Gln: α-ketoglutarat Glu (Gln)
27 Kapitel: Aminosäuren 27 Biosynthese von Alanin, Aspartat, Glutamat, Asparagin und Glutamin Pyruvat xalacetat α-ketoglutarat AS AS AS Transaminasen Transaminasen Transaminasen α-ks α-ks α-ks Alanin Aspartat ATP Asn-Synthase AMPPPi Asparagin Glutamat ATP H 3 Gln-Synthase ADPPi Glutamin Synthese von Prolin, rnithin und Arginin aus Glutamat Bei der Umwandlung von Glutamat in Prolin sind 4 Enzyme beteiligt. Glu Glu-5-P Glu-5-semialdehyd Prolin Bei der Umwandlung von Glutamat in rnithin sind 5 Enzyme beteiligt. Glu -Acetyl-Glu -Acetyl-Glu-P -Acetyl-Glu-semialdehyd -Acetyl-rn rn Arginin wird im Harnstoffzyklus aus rnithin synthetisiert. Synthese von Serin, Cystein und Glycin aus 3-Phosphoglycerat 3-Phosphoglycerat 3-Phosphohydroxypyruvat 3-Phosphoserin Serin Serin Homocystein Cystathionin Cystein (siehe Seite 31) Serin Glycin (siehe Seite 14)
Proteinstoffwechsel. Bildung der Aminosäuren. Protein-Abbau der Körperproteine. Protein-Abbau der Nahrungsproteine. Verwertung der Aminosäuren
 Bildung der Aminosäuren Körperproteine 10000 g Nahrungsproteine Proteinstoffwechsel Proteolyse (300 400 g/d) AminosäurePool Verdauung (50 100 g/d) 100 g Vortragender: Dr. W. Helliger Neusynthese aus z.b.
Bildung der Aminosäuren Körperproteine 10000 g Nahrungsproteine Proteinstoffwechsel Proteolyse (300 400 g/d) AminosäurePool Verdauung (50 100 g/d) 100 g Vortragender: Dr. W. Helliger Neusynthese aus z.b.
Metabolisierung des Aminosäure-Kohlestoffgerüstes
 Metabolisierung des Aminosäure-Kohlestoffgerüstes Abbau zu 7 wichtigen Molekülen: Pyruvat, Acetyl-CoA, Acetoacetyl-CoA, -Ketoglutarat, Succinyl-CoA, Fumarat, Oxalacetat >> also zu 4 Intermediaten des Citratzyklus,
Metabolisierung des Aminosäure-Kohlestoffgerüstes Abbau zu 7 wichtigen Molekülen: Pyruvat, Acetyl-CoA, Acetoacetyl-CoA, -Ketoglutarat, Succinyl-CoA, Fumarat, Oxalacetat >> also zu 4 Intermediaten des Citratzyklus,
Stoffwechsel der essentiellen Aminosäuren
 Stoffwechsel der essentiellen Aminosäuren Andrea Schulte aus: Löffler/Petrides, Biochemie und Pathobiochemie, 7. Aufl., Kap. 15.3 Gliederung Einleitung: essentielle Aminosäuren, Biosynthese Abbau, Stoffwechselbedeutung
Stoffwechsel der essentiellen Aminosäuren Andrea Schulte aus: Löffler/Petrides, Biochemie und Pathobiochemie, 7. Aufl., Kap. 15.3 Gliederung Einleitung: essentielle Aminosäuren, Biosynthese Abbau, Stoffwechselbedeutung
Nichtessentielle Aminosäuren. Stoffwechsel Nahrungskarenz
 Nichtessentielle Aminosäuren Stoffwechsel Nahrungskarenz Einleitung 11 nichtessentielle AS Können von Säugetierzellen selbstsynthetisiert werden. Im Vergleich zu essentiellen AS einfache Synthesewege Nichtessentiell
Nichtessentielle Aminosäuren Stoffwechsel Nahrungskarenz Einleitung 11 nichtessentielle AS Können von Säugetierzellen selbstsynthetisiert werden. Im Vergleich zu essentiellen AS einfache Synthesewege Nichtessentiell
Aminosäuren & Ketosäuren BIOGENE AMINE
 BIOGENE AMINE Von Mohammed Jaber BIOGENE AMINE: Biogene Amine sind AS ohne COOH-Gruppe! Und warum sind sie so wichtig? Von Mohammed Jaber und Proteine BIOGENE AMINE: Durch die Abspaltung der COOH- Gruppe
BIOGENE AMINE Von Mohammed Jaber BIOGENE AMINE: Biogene Amine sind AS ohne COOH-Gruppe! Und warum sind sie so wichtig? Von Mohammed Jaber und Proteine BIOGENE AMINE: Durch die Abspaltung der COOH- Gruppe
Energie aus Aminosäuren - Wundermittel Protein?
 Jeder von uns kennt die Versprechen der Eiweißshakes: Mehr Proteine machen dich schlank, jung und wunderschön. Aber was haben Proteine an sich, das diese Versprechen rechtfertigt? Dies ist der vierte Teil
Jeder von uns kennt die Versprechen der Eiweißshakes: Mehr Proteine machen dich schlank, jung und wunderschön. Aber was haben Proteine an sich, das diese Versprechen rechtfertigt? Dies ist der vierte Teil
pk S der α-carbonsäure = 1,88; pk S der β-carbonsäure = 3,65 Die beiden Carbonsäuregruppen unterscheiden sich auch in ihrer chemischen Reaktivität
 Aminosäuren mit sauren Seitengruppen Asparaginsäure (Asp,D) pk S der α-carbonsäure = 1,88; pk S der β-carbonsäure = 3,65 Die beiden Carbonsäuregruppen unterscheiden sich auch in ihrer chemischen Reaktivität
Aminosäuren mit sauren Seitengruppen Asparaginsäure (Asp,D) pk S der α-carbonsäure = 1,88; pk S der β-carbonsäure = 3,65 Die beiden Carbonsäuregruppen unterscheiden sich auch in ihrer chemischen Reaktivität
Aufgabe 2: (Aminosäuren)
 Aufgabe 2: (Aminosäuren) Aufgabenstellung Die 20 Aminosäuren (voller Name, 1- und 3-Buchstaben-Code) sollen identifiziert und mit RasMol grafisch dargestellt werden. Dann sollen die AS sinnvoll nach ihren
Aufgabe 2: (Aminosäuren) Aufgabenstellung Die 20 Aminosäuren (voller Name, 1- und 3-Buchstaben-Code) sollen identifiziert und mit RasMol grafisch dargestellt werden. Dann sollen die AS sinnvoll nach ihren
Pharmazeutische Biologie Grundlagen der Biochemie
 Pharmazeutische Biologie Grundlagen der Biochemie Prof. Dr. Theo Dingermann Institut für Pharmazeutische Biologie Goethe-Universität Frankfurt Dingermann@em.uni-frankfurt.de Aminosäure... chirale Moleküle
Pharmazeutische Biologie Grundlagen der Biochemie Prof. Dr. Theo Dingermann Institut für Pharmazeutische Biologie Goethe-Universität Frankfurt Dingermann@em.uni-frankfurt.de Aminosäure... chirale Moleküle
Peptide Proteine. 1. Aminosäuren. Alle optisch aktiven proteinogenen Aminosäuren gehören der L-Reihe an: 1.1 Struktur der Aminosäuren
 1. Aminosäuren Aminosäuren Peptide Proteine Vortragender: Dr. W. Helliger 1.1 Struktur 1.2 Säure-Basen-Eigenschaften 1.2.1 Neutral- und Zwitterion-Form 1.2.2 Molekülform in Abhängigkeit vom ph-wert 1.3
1. Aminosäuren Aminosäuren Peptide Proteine Vortragender: Dr. W. Helliger 1.1 Struktur 1.2 Säure-Basen-Eigenschaften 1.2.1 Neutral- und Zwitterion-Form 1.2.2 Molekülform in Abhängigkeit vom ph-wert 1.3
Gluconeognese Neusynthese von Glucose aus Pyruvat
 Gluconeognese Neusynthese von Glucose aus Pyruvat Warum notwendig? Das Gehirn ist auf eine konstante Versorgung mit Glucose angewiesen. Eine Unterzuckerung (< 3 4 mmol/l) führt unweigerlich zur Bewußtlosigkeit
Gluconeognese Neusynthese von Glucose aus Pyruvat Warum notwendig? Das Gehirn ist auf eine konstante Versorgung mit Glucose angewiesen. Eine Unterzuckerung (< 3 4 mmol/l) führt unweigerlich zur Bewußtlosigkeit
Mathematik und Naturwissenschaften, Biologie, Biochemie. Biochemie II - Tutorium
 Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 20.10.2016 Alexander Götze 3.Semester Molekulare Biotechnologie a.goetze2207@googlemail.com Mi. 2DS DRU. 68 H Michel
Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 20.10.2016 Alexander Götze 3.Semester Molekulare Biotechnologie a.goetze2207@googlemail.com Mi. 2DS DRU. 68 H Michel
Proteinogene Aminosäuren. Unpolare, aliphatische Seitenketten Monoaminomonocarbonsäuren
 Proteinogene Aminosäuren Unpolare, aliphatische Seitenketten Monoaminomonocarbonsäuren Proteinogene Aminosäuren Unpolare, heterozyklische Seitenkette Monoaminomonocarbonsäuren Proteinogene Aminosäuren
Proteinogene Aminosäuren Unpolare, aliphatische Seitenketten Monoaminomonocarbonsäuren Proteinogene Aminosäuren Unpolare, heterozyklische Seitenkette Monoaminomonocarbonsäuren Proteinogene Aminosäuren
Aliphatische Aminosäuren. Aromatische Aminosäuren
 Prof. Dr..-U. eißig rganische Chemie I 17.1 Aliphatische Aminosäuren systematischer ame (Trivialname) truktur Vorkommen, Bedeutung 2-Aminoethansäure (α-aminoessigsäure, Glycin) 3 C 2 C 2 α Proteine, Peptide
Prof. Dr..-U. eißig rganische Chemie I 17.1 Aliphatische Aminosäuren systematischer ame (Trivialname) truktur Vorkommen, Bedeutung 2-Aminoethansäure (α-aminoessigsäure, Glycin) 3 C 2 C 2 α Proteine, Peptide
1. Fragentyp A Welche der folgenden Aminosäuren ergibt beim Abbau Propionyl-CoA? A) Isoleucin B) Tyrosin C) Glutaminsäure D) Glycin E) Asparaginsäure
 1. Fragentyp A Welche der folgenden Aminosäuren ergibt beim Abbau Propionyl-CoA? A) Isoleucin B) Tyrosin C) Glutaminsäure D) Glycin E) Asparaginsäure 2. Fragentyp D Welche der folgenden Aussagen ist (sind)
1. Fragentyp A Welche der folgenden Aminosäuren ergibt beim Abbau Propionyl-CoA? A) Isoleucin B) Tyrosin C) Glutaminsäure D) Glycin E) Asparaginsäure 2. Fragentyp D Welche der folgenden Aussagen ist (sind)
- der oxidative Abbau von Acetyl-CoA (und die somit gebildeten Reduktionsäquivalente) - Lieferung von Substraten für verschiedene Synthesen
 Die Aufgabe des Citratcyklus ist: - der oxidative Abbau von Acetyl-CoA (und die somit gebildeten Reduktionsäquivalente) - Lieferung von Substraten für verschiedene Synthesen Die Aufgabe des Citratcyklus
Die Aufgabe des Citratcyklus ist: - der oxidative Abbau von Acetyl-CoA (und die somit gebildeten Reduktionsäquivalente) - Lieferung von Substraten für verschiedene Synthesen Die Aufgabe des Citratcyklus
Primärstoffwechsel. Prof. Dr. Albert Duschl
 Primärstoffwechsel Prof. Dr. Albert Duschl Aufgaben Der Primärstoffwechsel sorgt für Aufbau (Anabolismus) und Abbau (Katabolismus) biologischer Moleküle, wie Aminosäuren, Lipide, Kohlenhydrate und Nukleinsäuren.
Primärstoffwechsel Prof. Dr. Albert Duschl Aufgaben Der Primärstoffwechsel sorgt für Aufbau (Anabolismus) und Abbau (Katabolismus) biologischer Moleküle, wie Aminosäuren, Lipide, Kohlenhydrate und Nukleinsäuren.
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die gentechnische Produktion von Insulin - Selbstlerneinheit zur kontextorientierten Wiederholung der molekularen Genetik Das komplette
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die gentechnische Produktion von Insulin - Selbstlerneinheit zur kontextorientierten Wiederholung der molekularen Genetik Das komplette
Wirkungsmechanismen regulatorischer Enzyme
 Wirkungsmechanismen regulatorischer Enzyme Ein Multienzymsystem ist eine Aufeinanderfolge von Enzymen, bei der das Produkt eines vorstehenden Enzyms das Substrat des nächsten Enzyms wird. Ein regulatorisches
Wirkungsmechanismen regulatorischer Enzyme Ein Multienzymsystem ist eine Aufeinanderfolge von Enzymen, bei der das Produkt eines vorstehenden Enzyms das Substrat des nächsten Enzyms wird. Ein regulatorisches
8. Aminosäuren - (Proteine) Eiweiß
 8. Aminosäuren - (Proteine) Eiweiß Proteine sind aus Aminosäuren aufgebaut. Aminosäuren bilden die Grundlage der belebten Welt. 8.1 Struktur der Aminosäuren Aminosäuren sind organische Moleküle, die mindestens
8. Aminosäuren - (Proteine) Eiweiß Proteine sind aus Aminosäuren aufgebaut. Aminosäuren bilden die Grundlage der belebten Welt. 8.1 Struktur der Aminosäuren Aminosäuren sind organische Moleküle, die mindestens
Was ist denn NAD / NADP??
 Exkurs Oxidative Desaminierung: Was ist denn NAD / NADP?? Exkurs Oxidative Desaminierung: NAD / NADP gehört zum Vitamin B2- Komplex Nikotinsäureamid = Nikotinamid= Vit B3 Exkurs Oxidative Desaminierung:
Exkurs Oxidative Desaminierung: Was ist denn NAD / NADP?? Exkurs Oxidative Desaminierung: NAD / NADP gehört zum Vitamin B2- Komplex Nikotinsäureamid = Nikotinamid= Vit B3 Exkurs Oxidative Desaminierung:
Bachelor Studiengang Ernährungswissenschaften Seminar Biochemie der Ernährung (Modul BE2.3) Übersicht Seminarthemen
 Biochemie der Ernährung (Modul BE2.3) Prof. Dr. Stefan Lorkowski 1 Bachelor Studiengang Ernährungswissenschaften Seminar Biochemie der Ernährung (Modul BE2.3) Übersicht Seminarthemen Biosynthese von Aminosäuren
Biochemie der Ernährung (Modul BE2.3) Prof. Dr. Stefan Lorkowski 1 Bachelor Studiengang Ernährungswissenschaften Seminar Biochemie der Ernährung (Modul BE2.3) Übersicht Seminarthemen Biosynthese von Aminosäuren
15. Aminosäuren, Peptide und Proteine
 15. Aminosäuren, Peptide und Proteine 1 Proteine (Polypeptide) erfüllen in biologischen ystemen die unterschiedlichsten Funktionen. o wirken sie z.b. bei vielen chemischen eaktionen in der atur als Katalysatoren
15. Aminosäuren, Peptide und Proteine 1 Proteine (Polypeptide) erfüllen in biologischen ystemen die unterschiedlichsten Funktionen. o wirken sie z.b. bei vielen chemischen eaktionen in der atur als Katalysatoren
Biochemie (für Bioinformatiker) WS 2010/2011, 2. Klausur (50 Punkte)
 Datum: 07.02.2011 Name: Matrikel-Nr.: Vorname: Studiengang: Bioinformatik Biochemie (für Bioinformatiker) WS 2010/2011, 2. Klausur (50 Punkte) Modulnr.: FMI-BI0027 Hiermit bestätige ich meine Prüfungstauglichkeit.
Datum: 07.02.2011 Name: Matrikel-Nr.: Vorname: Studiengang: Bioinformatik Biochemie (für Bioinformatiker) WS 2010/2011, 2. Klausur (50 Punkte) Modulnr.: FMI-BI0027 Hiermit bestätige ich meine Prüfungstauglichkeit.
Die Pyrimidinsynthese
 Die Pyrimidinsynthese Bei der Pyrimidinsynthese wird zunächst der 6-Ring, also die Base zusammengefügt. Erst anschließend kommt es zum Anknüpfen der Ribose. Lokalisation: Zytoplasma Der Ausgang, der
Die Pyrimidinsynthese Bei der Pyrimidinsynthese wird zunächst der 6-Ring, also die Base zusammengefügt. Erst anschließend kommt es zum Anknüpfen der Ribose. Lokalisation: Zytoplasma Der Ausgang, der
Citratzyklus. Biochemie Maria Otto,Bo Mi Ok Kwon Park
 Citratzyklus Biochemie 13.12.2004 Maria Otto,Bo Mi Ok Kwon Park O CH 3 C Acetyl-CoA + H 2 O HO C COO C NADH O C H Citrat Cis-Aconitat H C Malat Citratzyklus HO C H Isocitrat CH H 2 O Fumarat C = O FADH
Citratzyklus Biochemie 13.12.2004 Maria Otto,Bo Mi Ok Kwon Park O CH 3 C Acetyl-CoA + H 2 O HO C COO C NADH O C H Citrat Cis-Aconitat H C Malat Citratzyklus HO C H Isocitrat CH H 2 O Fumarat C = O FADH
Aminosäurestoffwechsel I. Grundlagen und Ammoniak-Stoffwechsel COO- +H 3 C R. Johannes Schmidt; Matthias Schnepper
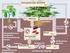 Aminosäurestoffwechsel I Grundlagen und Ammoniak-Stoffwechsel OO- 3 N R Johannes Schmidt; Matthias Schnepper Einführung Gliederung: Struktur und Einteilung der Aminosäuren Grundzüge des Aminosäurestoffwechsels
Aminosäurestoffwechsel I Grundlagen und Ammoniak-Stoffwechsel OO- 3 N R Johannes Schmidt; Matthias Schnepper Einführung Gliederung: Struktur und Einteilung der Aminosäuren Grundzüge des Aminosäurestoffwechsels
Aminosäuren. Die Mischung macht's. Die Proteinfabrik. ANKUBERO GmbH. Verschiedene Aminosäuren und Proteine
 Aminosäuren ANKUBERO GmbH Lieber Kunde, lieber Interessent, Die Mischung macht's Verschiedene Aminosäuren und Proteine Aufgeteilt in drei Hauptgruppen unterscheidet man essenzielle, semi-essenzielle oder
Aminosäuren ANKUBERO GmbH Lieber Kunde, lieber Interessent, Die Mischung macht's Verschiedene Aminosäuren und Proteine Aufgeteilt in drei Hauptgruppen unterscheidet man essenzielle, semi-essenzielle oder
10 BIOGENE-AMINE 4 NICHT-PROTEINOGENE- AS. 20 PROTEINOGENE AS glucoplastisch/ketoplastisch 8 ESSENTIELLE AS
 Für uns! - es gibt 20 AS Diese sind wiederum aufgeteilt in: Neutrale AS Saure AS Basische AS Schwefelhaltige AS Aromatische AS Heterocyklische AS - es gibt 20 AS - davon sind 8 essentiell d.h.: der Körper
Für uns! - es gibt 20 AS Diese sind wiederum aufgeteilt in: Neutrale AS Saure AS Basische AS Schwefelhaltige AS Aromatische AS Heterocyklische AS - es gibt 20 AS - davon sind 8 essentiell d.h.: der Körper
Rolle der Aminosäuren im Stoffwechsel
 Rolle der Aminosäuren im Stoffwechsel freie AS aus zugeführtem Protein und hydrolysiertem Körperprotein = 0.05 % 70 g Im Gegensatz zu Fettsäuren und Glucose sind freie AS NICHT speicherbar 70-80 % davon
Rolle der Aminosäuren im Stoffwechsel freie AS aus zugeführtem Protein und hydrolysiertem Körperprotein = 0.05 % 70 g Im Gegensatz zu Fettsäuren und Glucose sind freie AS NICHT speicherbar 70-80 % davon
Organische Chemie der biologischen Stoffwechselwege
 Organische Chemie der biologischen Stoffwechselwege John McMurry / Tadhg Begley aus dem Amerikanischen übersetzt von Karin Beifuss ELSEVIER SPEKTRUM AKADEMISCHER VERLAG Spektrum k_/l AKADEMISCHER VERLAG
Organische Chemie der biologischen Stoffwechselwege John McMurry / Tadhg Begley aus dem Amerikanischen übersetzt von Karin Beifuss ELSEVIER SPEKTRUM AKADEMISCHER VERLAG Spektrum k_/l AKADEMISCHER VERLAG
Biochemie Übungsblatt Nr Fettsäuresynthese:
 Fettsäuresynthese: 1) Mit Hilfe des mitochondriale ACP? AcetylCoA Carrboxylase (Biothin als prosth. Gruppe) AcetylCoA + Kohlendioxid + ATP MalonylCoA + ADP + P 2)? Reguliert durch Insulin (Insulin hemmt
Fettsäuresynthese: 1) Mit Hilfe des mitochondriale ACP? AcetylCoA Carrboxylase (Biothin als prosth. Gruppe) AcetylCoA + Kohlendioxid + ATP MalonylCoA + ADP + P 2)? Reguliert durch Insulin (Insulin hemmt
Aminosäuren - Proteine
 Aminosäuren - Proteine ÜBERBLICK D.Pflumm KSR / MSE Aminosäuren Überblick Allgemeine Formel für das Grundgerüst einer Aminosäure Carboxylgruppe: R-COOH O Aminogruppe: R-NH 2 einzelnes C-Atom (α-c-atom)
Aminosäuren - Proteine ÜBERBLICK D.Pflumm KSR / MSE Aminosäuren Überblick Allgemeine Formel für das Grundgerüst einer Aminosäure Carboxylgruppe: R-COOH O Aminogruppe: R-NH 2 einzelnes C-Atom (α-c-atom)
Energiestoffwechsel --- Aminosäuren. Prof. Dr. Martin van der Laan
 Energiestoffwechsel --- Aminosäuren Prof. Dr. Martin van der Laan Stoffwechsel von Aminosäuren (Überblick) Aminosäure N 3 + R C α Desaminierung Transaminierung Decarboxylierung CO 2 N 3 + R C (Biogenes)
Energiestoffwechsel --- Aminosäuren Prof. Dr. Martin van der Laan Stoffwechsel von Aminosäuren (Überblick) Aminosäure N 3 + R C α Desaminierung Transaminierung Decarboxylierung CO 2 N 3 + R C (Biogenes)
Was bisher geschah 1
 Was bisher geschah 1 Zellatmung (Übersicht) Der Citratcyclus ist die erste Stufe der Zellatmung 2 Citratzyklus Synonyme: Tricarbonsäurezyklus (TCA-Zyklus) Krebszyklus, Zitronensäurezyklus Der Zyklus ist
Was bisher geschah 1 Zellatmung (Übersicht) Der Citratcyclus ist die erste Stufe der Zellatmung 2 Citratzyklus Synonyme: Tricarbonsäurezyklus (TCA-Zyklus) Krebszyklus, Zitronensäurezyklus Der Zyklus ist
Biochemie und Stoffwechsel Biochemie Aufklärung der Stoffwechselwege und -teilschritte
 Biochemie und Stoffwechsel Biochemie Aufklärung der Stoffwechselwege und -teilschritte Identifikation der Ausgangs-, Zwischen- und Endprodukte (Stoffwechselprodukte) Enzyme sind Proteine mit Katalysatorwirkung.
Biochemie und Stoffwechsel Biochemie Aufklärung der Stoffwechselwege und -teilschritte Identifikation der Ausgangs-, Zwischen- und Endprodukte (Stoffwechselprodukte) Enzyme sind Proteine mit Katalysatorwirkung.
Zellulärer Abbau von Proteinen in Aminosäuren:! Proteine werden in Zellen durch Proteasom-Komplexe in! einzelne Aminosäuren abgebaut.!
 Zellulärer Abbau von Proteinen in Aminosäuren: Proteine werden in Zellen durch Proteasom-Komplexe in einzelne Aminosäuren abgebaut. Abbau von Aminosäuren: Uebersicht über den Aminosäureabbau Als erster
Zellulärer Abbau von Proteinen in Aminosäuren: Proteine werden in Zellen durch Proteasom-Komplexe in einzelne Aminosäuren abgebaut. Abbau von Aminosäuren: Uebersicht über den Aminosäureabbau Als erster
52: Welche der Coenzyme sind an der oxidativen Decarboxylierung von Pyruvat beteiligt? 1) Thiaminpyrophosphat
 2. Testat Biochemie 93/94 - Teil B (Leider ist dies nur ein Teil der Fragen!) 52: Welche der Coenzyme sind an der oxidativen Decarboxylierung von Pyruvat beteiligt? 1) Thiaminpyrophosphat 3) Biotin 2)
2. Testat Biochemie 93/94 - Teil B (Leider ist dies nur ein Teil der Fragen!) 52: Welche der Coenzyme sind an der oxidativen Decarboxylierung von Pyruvat beteiligt? 1) Thiaminpyrophosphat 3) Biotin 2)
Z 11 GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: 2) ÜBERSICHT ÜBER DEN ENERGIESTOFFWECHSEL
 GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE Zusammenfassung Zusammenfassung Kapitel 11 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: Fette und Kohlenhydrate aus der Nahrung nutzt der Körper hauptsächlich zur Energiegewinnung.
GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE Zusammenfassung Zusammenfassung Kapitel 11 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: Fette und Kohlenhydrate aus der Nahrung nutzt der Körper hauptsächlich zur Energiegewinnung.
Stoffwechsel - Energiebereitstellung - Biomoleküle
 Biochemie und Stoffwechsel Biochemie Aufklärung der Stoffwechselwege und -teilschritte Identifikation der Ausgangs-, Zwischen- und Endprodukte (Stoffwechselprodukte) Enzyme sind Proteine mit Katalysatorwirkung.
Biochemie und Stoffwechsel Biochemie Aufklärung der Stoffwechselwege und -teilschritte Identifikation der Ausgangs-, Zwischen- und Endprodukte (Stoffwechselprodukte) Enzyme sind Proteine mit Katalysatorwirkung.
Vorlesung Biophysik I - Molekulare Biophysik Kalbitzer/Kremer/Ziegler
 Vorlesung Biophysik I - Molekulare Biophysik Kalbitzer/Kremer/Ziegler 23.10. Zelle 30.10. Biologische Makromoleküle I 06.11. Biologische Makromoleküle II 13.11. Nukleinsäuren-Origami (DNA, RNA) 20.11.
Vorlesung Biophysik I - Molekulare Biophysik Kalbitzer/Kremer/Ziegler 23.10. Zelle 30.10. Biologische Makromoleküle I 06.11. Biologische Makromoleküle II 13.11. Nukleinsäuren-Origami (DNA, RNA) 20.11.
-Klausur Biochemie Name: Matrikelnr.:
 25.07.207 Name: Matrikelnr.: Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
25.07.207 Name: Matrikelnr.: Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
ORGANISCHE CHEMIE. Aminosäuren und Proteine
 RGAISE EMIE Aminosäuren und Proteine Aminosäuren (AS) R 2 arbonsäuren mit einer Aminogruppe Die (etwa) 20 proteinogenen Aminosäuren sind alle α-aminosäuren (Aminogruppe an -2), unterscheiden sich durch
RGAISE EMIE Aminosäuren und Proteine Aminosäuren (AS) R 2 arbonsäuren mit einer Aminogruppe Die (etwa) 20 proteinogenen Aminosäuren sind alle α-aminosäuren (Aminogruppe an -2), unterscheiden sich durch
Z11 GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: 2) ÜBERSICHT ÜBER DEN ENERGIESTOFFWECHSEL
 GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: Fette und Kohlenhydrate aus der Nahrung nutzt der Körper hauptsächlich zur Energiegewinnung. Proteine aus der Nahrung werden
GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: Fette und Kohlenhydrate aus der Nahrung nutzt der Körper hauptsächlich zur Energiegewinnung. Proteine aus der Nahrung werden
Klausurbogen im Studiengang B.Sc. Biologie Modul BSc-Bio-7, Teilklausur Biochemie vom
 Johann Wolfgang Goethe-Universität Frankfurt am Main Deckblatt Fachbereich Biowissenschaften Klausurbogen im Studiengang B.Sc. Biologie Modul BSc-Bio-7, Teilklausur Biochemie vom 08.12.2008 Name: Vorname:
Johann Wolfgang Goethe-Universität Frankfurt am Main Deckblatt Fachbereich Biowissenschaften Klausurbogen im Studiengang B.Sc. Biologie Modul BSc-Bio-7, Teilklausur Biochemie vom 08.12.2008 Name: Vorname:
Aminosäuren und Proteine
 Aminosäuren und Proteine Von Mohammed Jaber Aminosäuren und Proteine Kleinigkeit: 23 proteinogene AS 250 nicht-proteinogene AS (Anzahl synthetisch erzeugten erheblich größer) Aminosäuren und Proteine Kleinigkeit:
Aminosäuren und Proteine Von Mohammed Jaber Aminosäuren und Proteine Kleinigkeit: 23 proteinogene AS 250 nicht-proteinogene AS (Anzahl synthetisch erzeugten erheblich größer) Aminosäuren und Proteine Kleinigkeit:
Folsäure. Struktur = Pteroylglutamat; PteGLU n
 Folsäure Struktur = Pteroylglutamat; PteGLU n Biochemische Wirkungsweise Übertragung von C1-Einheiten; Wirksame Form ist das Tetrahydrofolat (H 4 -Folat), das durch Serin in das N 5,N 10 -Methylentetrahydrofolat
Folsäure Struktur = Pteroylglutamat; PteGLU n Biochemische Wirkungsweise Übertragung von C1-Einheiten; Wirksame Form ist das Tetrahydrofolat (H 4 -Folat), das durch Serin in das N 5,N 10 -Methylentetrahydrofolat
Regulation der Glykolyse: Phosphofructokinase
 Regulation der Glykolyse: Phosphofructokinase Abbauwege des Pyruvats Weitere Oxidation (zu CO 2 ) Alkoholische Gärung Pyruvat- Decarboxylase Alkohol- Dehydrogenase NAD + wird bei der Gärung regneriert,
Regulation der Glykolyse: Phosphofructokinase Abbauwege des Pyruvats Weitere Oxidation (zu CO 2 ) Alkoholische Gärung Pyruvat- Decarboxylase Alkohol- Dehydrogenase NAD + wird bei der Gärung regneriert,
- Biochemieklausur Name: Matrikelnr.:
 07.02.207 Name: Matrikelnr.: Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
07.02.207 Name: Matrikelnr.: Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
Der Energiestoffwechsel eukaryotischer Zellen
 Der Energiestoffwechsel eukaryotischer Zellen Der Abbau (Katabolismus/Veratmung/Verbrennung) reduzierter Kohlenstoffverbindungen (Glukose, Fettsäuren, Aminosäuren) bzw. deren makromolekularer Speicher
Der Energiestoffwechsel eukaryotischer Zellen Der Abbau (Katabolismus/Veratmung/Verbrennung) reduzierter Kohlenstoffverbindungen (Glukose, Fettsäuren, Aminosäuren) bzw. deren makromolekularer Speicher
Kapitel: Häm 35. Hämsynthese COOH. Porphobilinogen- Synthase NH 2 H. 5-Aminolävulinsäure (ALA) HOOC CH 2. Uroporphyrinogen- HN Decarboxylase CH 3
 Kapitel: Häm 35 Häm Biosynthese Häm ist, wie wir bereits gesehen haben, eine Fe-haltige prosthetische Gruppe, die ein essentieller Bestandteil vieler Proteine ist, wie z. B. Hämoglobin, Myoglobin und der
Kapitel: Häm 35 Häm Biosynthese Häm ist, wie wir bereits gesehen haben, eine Fe-haltige prosthetische Gruppe, die ein essentieller Bestandteil vieler Proteine ist, wie z. B. Hämoglobin, Myoglobin und der
Atmung Übersicht. Atmung der Mitochondrien
 Atmung der Mitochondrien Atmung Übersicht e - Transportkette REAKTION: C 6 H 12 O 6 + 6O 2 6CO 2 + 6H 2 O + Energie (Glucose) (Sauerstoff) (Kohlendioxid) (Wasser) Nur ca. 40% der Energie wird zu ATP Der
Atmung der Mitochondrien Atmung Übersicht e - Transportkette REAKTION: C 6 H 12 O 6 + 6O 2 6CO 2 + 6H 2 O + Energie (Glucose) (Sauerstoff) (Kohlendioxid) (Wasser) Nur ca. 40% der Energie wird zu ATP Der
Kataboler und Anaboler Stoffwechsel
 Vorlesung Vom Molekül zur Zelle Ao.Univ.Prof. Dr. Georg Weitzer Fortsetzung von Block 3 nach Prof. Müllner, ab 8.1. Kataboler und Anaboler Stoffwechsel Aktuelle Folien unter http://homepage.univie.ac.at/georg.weitzer/lectures.html
Vorlesung Vom Molekül zur Zelle Ao.Univ.Prof. Dr. Georg Weitzer Fortsetzung von Block 3 nach Prof. Müllner, ab 8.1. Kataboler und Anaboler Stoffwechsel Aktuelle Folien unter http://homepage.univie.ac.at/georg.weitzer/lectures.html
Biosynthese und Metabolismus von Nukleotiden
 Biosynthese und Metabolismus von ukleotiden Biochemie Die beiden Möglichkeiten... Zwei Möglichkeiten zur Bereitstellung von ukleotiden: 1) De-novo Synthese: Purine: ausgehend von Glycin (ca. 10 20 %) Pyrimidine:
Biosynthese und Metabolismus von ukleotiden Biochemie Die beiden Möglichkeiten... Zwei Möglichkeiten zur Bereitstellung von ukleotiden: 1) De-novo Synthese: Purine: ausgehend von Glycin (ca. 10 20 %) Pyrimidine:
Der Fettsäurestoffwechsel. Basierend auf Stryer Kapitel 22
 Der Fettsäurestoffwechsel Basierend auf Stryer Kapitel 22 1 CoA 2 3 Überblick 4 Ein paar Grundlagen... Carbonsäure Alkohol Carbonsäureester Eine Acyl-Gruppe 5 Eine Acyl-Gruppe H O Formyl H 3 C O Acetyl
Der Fettsäurestoffwechsel Basierend auf Stryer Kapitel 22 1 CoA 2 3 Überblick 4 Ein paar Grundlagen... Carbonsäure Alkohol Carbonsäureester Eine Acyl-Gruppe 5 Eine Acyl-Gruppe H O Formyl H 3 C O Acetyl
COOH. Die Aminosäuren tragen laborübliche Abkürzungen, so stehen z. B. Gly für Glycin oder Phe für Phenylalanin.
 Aminosäuren 1. Textentwurf Allgemeine Formel der Aminosäuren Aminosäuren sind die Grundbestandteile der Proteine. Neben der -Gruppe 1 enthalten sie als charakteristisches Merkmal die Aminogruppe N. Zwei
Aminosäuren 1. Textentwurf Allgemeine Formel der Aminosäuren Aminosäuren sind die Grundbestandteile der Proteine. Neben der -Gruppe 1 enthalten sie als charakteristisches Merkmal die Aminogruppe N. Zwei
Aminosäuren 1. Aufbau der Aminosäuren
 Aminosäuren 1 Aufbau der Aminosäuren Aminosäuren bestehen aus einer Carbonsäuregruppe und einer Aminogruppe. Die einfachste Aminosäure ist das Glycin mit 2 Kohlenstoffatomen. Das Kohlenstoffatom nach der
Aminosäuren 1 Aufbau der Aminosäuren Aminosäuren bestehen aus einer Carbonsäuregruppe und einer Aminogruppe. Die einfachste Aminosäure ist das Glycin mit 2 Kohlenstoffatomen. Das Kohlenstoffatom nach der
Campherchinon (teuer)
 chiral pool alle chiralen, nicht racemischen Verbindungen aturstoffe - müssen enantiomerenrein verfügbar sein - müssen leicht und rein isolierbar sein dann sind diese billig im andel verfügbar alle Verbindungen,
chiral pool alle chiralen, nicht racemischen Verbindungen aturstoffe - müssen enantiomerenrein verfügbar sein - müssen leicht und rein isolierbar sein dann sind diese billig im andel verfügbar alle Verbindungen,
Beispiele für Prüfungsfragen zu den Einheiten. 2, 3, 5, 9-12, 15, 16, und 21 (Hartig)
 Beispiele für Prüfungsfragen zu den Einheiten 2, 3, 5, 9-12, 15, 16, und 21 (Hartig) Untenstehendes Molekül ist ein Peptidhormon. Wieviele Peptidbindungen besitzt dieses Molekül (zeichnen Sie diese ein)?
Beispiele für Prüfungsfragen zu den Einheiten 2, 3, 5, 9-12, 15, 16, und 21 (Hartig) Untenstehendes Molekül ist ein Peptidhormon. Wieviele Peptidbindungen besitzt dieses Molekül (zeichnen Sie diese ein)?
Biochemie II - Tutorium
 Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 04.01.2016 Zellkern Lipidtröpfchen Nucleotidmetabolismus Glykogen- Stoffwechsel Pentosephosephatweg Glucose Glucose
Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 04.01.2016 Zellkern Lipidtröpfchen Nucleotidmetabolismus Glykogen- Stoffwechsel Pentosephosephatweg Glucose Glucose
BIOCHEMIE. Prof. Manfred SUSSITZ. über(be)arbeitet und zusammengestellt nach Internetvorlagen:
 BIOCHEMIE Prof. Manfred SUSSITZ über(be)arbeitet und zusammengestellt nach Internetvorlagen: Medizinische Fakultät, Universität Erlangen http://www2.chemie.uni-erlangen.de/projects/vsc/chemie-mediziner-neu/start.html
BIOCHEMIE Prof. Manfred SUSSITZ über(be)arbeitet und zusammengestellt nach Internetvorlagen: Medizinische Fakultät, Universität Erlangen http://www2.chemie.uni-erlangen.de/projects/vsc/chemie-mediziner-neu/start.html
Biochemie II - Tutorium
 Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 16.11.2016 Ablauf des Tutoriums Einführung und Wiederholung Vorlesungszusammenfassung Übungsaufgaben Selbststudium
Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 16.11.2016 Ablauf des Tutoriums Einführung und Wiederholung Vorlesungszusammenfassung Übungsaufgaben Selbststudium
Einführung in die Biochemie
 Stoffwechselvorgänge, bei denen Kohlenhydrate abgebaut werden um dem rganismus Energie zur Verfügung zu stellen, können auf verschieden Wegen ablaufen: 1. Die Atmung ist der aerobe Abbau, bei dem zur Energiegewinnung
Stoffwechselvorgänge, bei denen Kohlenhydrate abgebaut werden um dem rganismus Energie zur Verfügung zu stellen, können auf verschieden Wegen ablaufen: 1. Die Atmung ist der aerobe Abbau, bei dem zur Energiegewinnung
Klausur zur Vorlesung Biochemie I im WS 2001/02
 (insgesamt 100 Punkte, mindestens 40 erforderlich) Klausur zur Vorlesung Biochemie I im WS 2001/02 am 18.02.2002 von 08.15 09.45 Uhr Gebäude 52, Raum 207 Bitte Namen, Matrikelnummer und Studienfach unbedingt
(insgesamt 100 Punkte, mindestens 40 erforderlich) Klausur zur Vorlesung Biochemie I im WS 2001/02 am 18.02.2002 von 08.15 09.45 Uhr Gebäude 52, Raum 207 Bitte Namen, Matrikelnummer und Studienfach unbedingt
Citratzyklus. Citratzyklus
 Der hat in der Zelle verschiedene Aufgaben. Teilschritte werden z.b. bei manchen Gärungen eingesetzt (Methyl-Malonyl-CoA-Weg). Er ist wichtig zur Bereitstellung verschiedener Vorstufen für Biosynthesen,
Der hat in der Zelle verschiedene Aufgaben. Teilschritte werden z.b. bei manchen Gärungen eingesetzt (Methyl-Malonyl-CoA-Weg). Er ist wichtig zur Bereitstellung verschiedener Vorstufen für Biosynthesen,
BIOINF1110 Einführung in die Bioinforma7k. 5. Molekulare Maschinen Proteinstrukturen und ihre Funk/on
 BIOINF1110 Einführung in die Bioinforma7k 5. Molekulare Maschinen Proteinstrukturen und ihre Funk/on Oliver Kohlbacher Zentrum für Bioinforma7k Tübingen Proteine Zentrales Dogma DNA Transkription mrna
BIOINF1110 Einführung in die Bioinforma7k 5. Molekulare Maschinen Proteinstrukturen und ihre Funk/on Oliver Kohlbacher Zentrum für Bioinforma7k Tübingen Proteine Zentrales Dogma DNA Transkription mrna
-Klausur Biochemie Name:
 -Klausur Biochemie -03.02.5 Name: Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
-Klausur Biochemie -03.02.5 Name: Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
BIOINF1110 Einführung in die Bioinforma7k. Molekulare Maschinen Proteinstrukturen und ihre Funk/on
 BIOINF1110 Einführung in die Bioinforma7k Molekulare Maschinen Proteinstrukturen und ihre Funk/on Oliver Kohlbacher Angewandte Bioinforma0k Zentrum für Bioinforma0k Tübingen Proteine 2 Zentrales Dogma
BIOINF1110 Einführung in die Bioinforma7k Molekulare Maschinen Proteinstrukturen und ihre Funk/on Oliver Kohlbacher Angewandte Bioinforma0k Zentrum für Bioinforma0k Tübingen Proteine 2 Zentrales Dogma
Nach Terpenen und Kohlenhydraten nun eine weitere große Klasse an Naturstoffen
 260 17. Aminosäuren, Peptide ach Terpenen und Kohlenhydraten nun eine weitere große Klasse an aturstoffen 17.1 Übersicht Analog zu ydroxycarbonsäuren α-, β-, γ- Aminocarbonsäuren möglich: 2 3 2 2 α-amino-essigsäure
260 17. Aminosäuren, Peptide ach Terpenen und Kohlenhydraten nun eine weitere große Klasse an aturstoffen 17.1 Übersicht Analog zu ydroxycarbonsäuren α-, β-, γ- Aminocarbonsäuren möglich: 2 3 2 2 α-amino-essigsäure
Aminosäurenanalytik. Probenvorbereitung Eiweißfällung, Oxidation und Hydrolyse Karl-Heinz Jansen SYKAM CHROMATOGRAPHIE
 Aminosäurenanalytik Probenvorbereitung Eiweißfällung, Oxidation und Hydrolyse Karl-Heinz Jansen SYKAM CHROMATOGRAPHIE Proteinfällung 2 Proteinfällung 3 Proteinfällung 4 Proteinfällung 5 Proteinfällung
Aminosäurenanalytik Probenvorbereitung Eiweißfällung, Oxidation und Hydrolyse Karl-Heinz Jansen SYKAM CHROMATOGRAPHIE Proteinfällung 2 Proteinfällung 3 Proteinfällung 4 Proteinfällung 5 Proteinfällung
Application Notes. Aracus
 Application Notes Aracus membrapure GmbH Wolfgang Küntscher Str. 14 16761 Hennigsdorf / Berlin Mail: info@membrapure.de Tel.: 03302 / 201 20 0 Fax: 03302 / 201 20 21 Index Physiological Extended 54 amino
Application Notes Aracus membrapure GmbH Wolfgang Küntscher Str. 14 16761 Hennigsdorf / Berlin Mail: info@membrapure.de Tel.: 03302 / 201 20 0 Fax: 03302 / 201 20 21 Index Physiological Extended 54 amino
BIOCHEMIE des Stoffwechsels ( )
 BIOCHEMIE des Stoffwechsels (772.114) 11. Einheit Protein und Aminosäure Stoffwechsel Abbau von Proteinen aus der Nahrung Abbau von zellulären Proteinen Transaminasen und Glutamat-Dehydrogenase Harnstoff-Cyclus
BIOCHEMIE des Stoffwechsels (772.114) 11. Einheit Protein und Aminosäure Stoffwechsel Abbau von Proteinen aus der Nahrung Abbau von zellulären Proteinen Transaminasen und Glutamat-Dehydrogenase Harnstoff-Cyclus
- Biochemieklausur Name: Matrikelnr.:
 08.07.20 Name: Matrikelnr.: Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
08.07.20 Name: Matrikelnr.: Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
Biologische Oxidation: Atmung (Dissimilation) C 6 H 12 O O 2 6 CO H 2 O G kj
 Biologische Oxidation: Atmung (Dissimilation) C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 O G 0-2872 kj Hydrolyse der Stärke Ausgangssubstrate: Glucose, Fructose Stärkehydrolyse: Amylasen Endo- ( -Amylase) und
Biologische Oxidation: Atmung (Dissimilation) C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 O G 0-2872 kj Hydrolyse der Stärke Ausgangssubstrate: Glucose, Fructose Stärkehydrolyse: Amylasen Endo- ( -Amylase) und
Musterlösung. Frage Summe Note Punkte 1, ,5 1,0
 Biochemische Teilklausur zum Grundmodul 0 im Bachelor-Studiengang Biowissenschaften (neue Prüfungsordnung Dauer Std.), 2. 2. 203, 8:00-9:00 Uhr, Sporthalle, sowie Biochemische Teilklausur zum Grundmodul
Biochemische Teilklausur zum Grundmodul 0 im Bachelor-Studiengang Biowissenschaften (neue Prüfungsordnung Dauer Std.), 2. 2. 203, 8:00-9:00 Uhr, Sporthalle, sowie Biochemische Teilklausur zum Grundmodul
Stoffwechsel. Metabolismus (3)
 Vorlesung Zell- und Molekularbiologie Stoffwechsel Metabolismus (3) Überblick Stoffwechsel Glykolyse Citratcyklus Chemiosmotische Prinzipien 1 Glykolyse 1 Glucose und in der Glykolyse daraus gebildete
Vorlesung Zell- und Molekularbiologie Stoffwechsel Metabolismus (3) Überblick Stoffwechsel Glykolyse Citratcyklus Chemiosmotische Prinzipien 1 Glykolyse 1 Glucose und in der Glykolyse daraus gebildete
2. Prinzipien der Pflanzenstärkung durch Blattanwendung von L Aminosäuren
 Aminosäuren und Peptide für die Pflanzenstärkung von Dr. Helmut Wolf, Protan AG 1. Einführung 2. Prinzipien der Pflanzenstärkung durch Blattanwendung von L Aminosäuren 3. Wirtschaftlichkeit der Blattanwendung
Aminosäuren und Peptide für die Pflanzenstärkung von Dr. Helmut Wolf, Protan AG 1. Einführung 2. Prinzipien der Pflanzenstärkung durch Blattanwendung von L Aminosäuren 3. Wirtschaftlichkeit der Blattanwendung
Grundlagen der Physiologie
 Grundlagen der Physiologie Abbau eines Zuckermoleküls www.icbm.de/pmbio Lebensweise eines heterotrophen Aerobiers 1 Überblick Stoffwechsel Glykolyse Citratcyklus Chemiosmotische Prinzipien Anabolismus
Grundlagen der Physiologie Abbau eines Zuckermoleküls www.icbm.de/pmbio Lebensweise eines heterotrophen Aerobiers 1 Überblick Stoffwechsel Glykolyse Citratcyklus Chemiosmotische Prinzipien Anabolismus
Kapitel: C 1 -Stoffwechsel 28
 Kapitel: 1 -Stoffwechsel 28 Bedeutung des 1 -Stoffwechsels Viele biosynthetische Vorgänge erfordern die Addition einer 1 -Einheit an eine metabolische Vorstufe. Bei den meisten arboxylierungsreaktionen
Kapitel: 1 -Stoffwechsel 28 Bedeutung des 1 -Stoffwechsels Viele biosynthetische Vorgänge erfordern die Addition einer 1 -Einheit an eine metabolische Vorstufe. Bei den meisten arboxylierungsreaktionen
schnell und portofrei erhältlich bei
 Kurzlehrbuch Biochemie Kurzlehrbuch Biochemie Bearbeitet von Melanie Königshoff, Timo Brandenburger 2. überarb. Aufl. 2007. Taschenbuch. 46 S. Paperback ISBN 978 3 13 136412 8 Format (B x L): 24 x 17 cm
Kurzlehrbuch Biochemie Kurzlehrbuch Biochemie Bearbeitet von Melanie Königshoff, Timo Brandenburger 2. überarb. Aufl. 2007. Taschenbuch. 46 S. Paperback ISBN 978 3 13 136412 8 Format (B x L): 24 x 17 cm
Häm. Biosynthese Pathophysiologie der Biosynthese
 Häm Biosynthese Pathophysiologie der Biosynthese Häm = Porphyrin farbige Verbindung, konjugiertes Ringsystem 4 Pyrrolringe ubiquitär in Tier- und Pflanzenreich prosthetische Gruppe von Hämoproteinen Mensch
Häm Biosynthese Pathophysiologie der Biosynthese Häm = Porphyrin farbige Verbindung, konjugiertes Ringsystem 4 Pyrrolringe ubiquitär in Tier- und Pflanzenreich prosthetische Gruppe von Hämoproteinen Mensch
-Klausur Biochemie Name: Matrikelnr.: 1. a) Erklären Sie, warum ist Wasser gutes Lösungsmittel von Salzen und polaren Biomolekülen ist.
 4.07.205 Name: Matrikelnr.:. a) Erklären Sie, warum ist Wasser gutes Lösungsmittel von Salzen und polaren Biomolekülen ist. 2. Was bedeutet es, wenn eine schwache Säure einen pks von 5 hat? 3. Nennen Sie
4.07.205 Name: Matrikelnr.:. a) Erklären Sie, warum ist Wasser gutes Lösungsmittel von Salzen und polaren Biomolekülen ist. 2. Was bedeutet es, wenn eine schwache Säure einen pks von 5 hat? 3. Nennen Sie
Der Stoffwechsel. Wir zeigen dir wie er funktioniert.
 Der Stoffwechsel. Wir zeigen dir wie er funktioniert. Der Stoffwechsel. Wir zeigen dir wie er funktioniert. Guter Stoffwechsel, schlechter Stoffwechsel, der Stoffwechsel schläft, den Stoffwechsel ankurbeln,
Der Stoffwechsel. Wir zeigen dir wie er funktioniert. Der Stoffwechsel. Wir zeigen dir wie er funktioniert. Guter Stoffwechsel, schlechter Stoffwechsel, der Stoffwechsel schläft, den Stoffwechsel ankurbeln,
KOHLENHYDRATE PYRUVAT-DEHYDROGENASE
 PYRUVAT-DEHYDROGENASE PYRUVAT-DEHYDROGENASE: Um ein Optimum Beute garantieren zu können, Wird das entstandene Pyruvat (bei der aeroben) Glykolyse, durch die PDH in Acetyl-CoA umgewandelt, um dann, Teil
PYRUVAT-DEHYDROGENASE PYRUVAT-DEHYDROGENASE: Um ein Optimum Beute garantieren zu können, Wird das entstandene Pyruvat (bei der aeroben) Glykolyse, durch die PDH in Acetyl-CoA umgewandelt, um dann, Teil
Lipidstoffwechsel. 5. Regulation des Fettsäurestoffwechsels. 1. Verdauung, Aufnahme und Transport von Fetten. 6. Cholesterinstoffwechsel
 Lipidstoffwechsel 1. Verdauung, Aufnahme und Transport von Fetten 2. Fettsäureoxidation 3. Ketonkörper 4. Biosynthese von Fettsäuren 5. Regulation des Fettsäurestoffwechsels 6. Cholesterinstoffwechsel
Lipidstoffwechsel 1. Verdauung, Aufnahme und Transport von Fetten 2. Fettsäureoxidation 3. Ketonkörper 4. Biosynthese von Fettsäuren 5. Regulation des Fettsäurestoffwechsels 6. Cholesterinstoffwechsel
Grundzüge des Energiestoffwechsels I
 Grundzüge des Energiestoffwechsels I 4.5 Grundzüge des Energiestoffwechsels 4.5.2 Glykolyse 4.5.3 Pyruvatdecarboxylierung 4.5.4 Citratzyklus 4.5.5 Glyoxylatzyklus und Gluconeogenese 4.5.6 Atmung, Endoxidation
Grundzüge des Energiestoffwechsels I 4.5 Grundzüge des Energiestoffwechsels 4.5.2 Glykolyse 4.5.3 Pyruvatdecarboxylierung 4.5.4 Citratzyklus 4.5.5 Glyoxylatzyklus und Gluconeogenese 4.5.6 Atmung, Endoxidation
1. Biochemie-Klausur Zahnmediziner, WS 03/04
 1. Biochemie-Klausur Zahnmediziner, WS 03/04 1. Welche Aussage zur ß-Oxidation von Fettsäuren in Peroxisomen ist falsch? A) Die Aufnahme langkettiger Fettsäuren in die Peroxisomen erfolgt Carnitin-unabhängig!
1. Biochemie-Klausur Zahnmediziner, WS 03/04 1. Welche Aussage zur ß-Oxidation von Fettsäuren in Peroxisomen ist falsch? A) Die Aufnahme langkettiger Fettsäuren in die Peroxisomen erfolgt Carnitin-unabhängig!
Unter der Kollagensynthese versteht man die intrazellulär und extrazellulär. stattfindende Synthese von Kollagen.
 KOLLAGENSYNTHESE!! Unter der Kollagensynthese versteht man die intrazellulär und extrazellulär stattfindende Synthese von Kollagen. Das Kollagen ist im menschlichen Körper Bestandteil aller Binde. - und
KOLLAGENSYNTHESE!! Unter der Kollagensynthese versteht man die intrazellulär und extrazellulär stattfindende Synthese von Kollagen. Das Kollagen ist im menschlichen Körper Bestandteil aller Binde. - und
7 Stoffwechsel von Proteinen und Aminosäuren
 135 7 7 Stoffwechsel von Proteinen und Aminosäuren GK 12.5.1 12.5.4; 13.3; 14.4.1 14.4.3 > > Einleitung Der tägliche Proteinumsatz des Menschen liegt etwa zehnmal höher als die Proteinzufuhr und ausscheidung.
135 7 7 Stoffwechsel von Proteinen und Aminosäuren GK 12.5.1 12.5.4; 13.3; 14.4.1 14.4.3 > > Einleitung Der tägliche Proteinumsatz des Menschen liegt etwa zehnmal höher als die Proteinzufuhr und ausscheidung.
Pentosephosphat-Weg: alternativer Abbau von Glucose. Wird auch als Hexosemonophosphatweg (HMW) oder Phosphogluconat-Cyclus bezeichnet.
 Pentosephosphat-Weg: alternativer Abbau von Glucose Wird auch als Hexosemonophosphatweg (HMW) oder Phosphogluconat-Cyclus bezeichnet. Er liefert NADPH und Ribose-5-phosphat. NADPH ist die 2. Währung der
Pentosephosphat-Weg: alternativer Abbau von Glucose Wird auch als Hexosemonophosphatweg (HMW) oder Phosphogluconat-Cyclus bezeichnet. Er liefert NADPH und Ribose-5-phosphat. NADPH ist die 2. Währung der
Funktionelle Gruppen Amine
 sind Stickstoff-Derivate, die als schwache organische Basen gelten. Funktionelle Gruppen Einfachstes Amin, Methanamin. Ammoniak besitzt drei -Atome, die formal durch organische este ersetzt werden können.
sind Stickstoff-Derivate, die als schwache organische Basen gelten. Funktionelle Gruppen Einfachstes Amin, Methanamin. Ammoniak besitzt drei -Atome, die formal durch organische este ersetzt werden können.
Der Citratzyklus (= Trikarbonsäurezyklus, Krebszyklus)
 Der Citratzyklus (= Trikarbonsäurezyklus, Krebszyklus) Biochemischer Kreisprozeß Ablauf in der mitochondrialen Matrix Glykolyse β-oxidation Atmungskette AS-Abbau Der Citratzyklus Der Citratzyklus: Übersicht
Der Citratzyklus (= Trikarbonsäurezyklus, Krebszyklus) Biochemischer Kreisprozeß Ablauf in der mitochondrialen Matrix Glykolyse β-oxidation Atmungskette AS-Abbau Der Citratzyklus Der Citratzyklus: Übersicht
Oxidativer Stress Vitamine
 1 Oxidativer Stress Vitamine 2 Reaktive Sauerstoffspezies (ROS) Reaktive Sauerstoffspezies (ROS) Ein-Elektronenreduktion von Sauerstoff durch Strahlung oder Autooxidation von reduzierten Stoffwechselzwischenprodukten
1 Oxidativer Stress Vitamine 2 Reaktive Sauerstoffspezies (ROS) Reaktive Sauerstoffspezies (ROS) Ein-Elektronenreduktion von Sauerstoff durch Strahlung oder Autooxidation von reduzierten Stoffwechselzwischenprodukten
Punkte 1. a) Erklären Sie wieso das Wassermolekül ein Dipol ist (gerne mit Zeichnung).
 -Klausur Biochemie - 20.07.6 Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
-Klausur Biochemie - 20.07.6 Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
Asmaa Mebrad Caroline Mühlmann Gluconeogenese
 Gluconeogenese Asmaa Mebrad Caroline Mühlmann 06.12.2004 Definition: wichtiger Stoffwechselweg, bei dem Glucose aus Nicht-Kohlenhydrat-Vorstufen synthetisiert wird Ablauf bei längeren Hungerperioden dient
Gluconeogenese Asmaa Mebrad Caroline Mühlmann 06.12.2004 Definition: wichtiger Stoffwechselweg, bei dem Glucose aus Nicht-Kohlenhydrat-Vorstufen synthetisiert wird Ablauf bei längeren Hungerperioden dient
Modul 8: Bioinformatik A. Von der DNA zum Protein Proteinsynthese in silicio
 Modul 8: Bioinformatik A. Von der DNA zum Protein Proteinsynthese in silicio Ein Wissenschaftler erhält nach einer Sequenzierung folgenden Ausschnitt aus einer DNA-Sequenz: 5 ctaccatcaa tccggtaggt tttccggctg
Modul 8: Bioinformatik A. Von der DNA zum Protein Proteinsynthese in silicio Ein Wissenschaftler erhält nach einer Sequenzierung folgenden Ausschnitt aus einer DNA-Sequenz: 5 ctaccatcaa tccggtaggt tttccggctg
Klausur zur Vorlesung Biochemie I im WS 2004/05
 Klausur zur Vorlesung Biochemie I im W 2004/05 am 9.03.2005 von 0.00 -.30 Uhr Gebäude 42, örsaal 5 Lösungen in rot Punkte in grün Aufgabe : Formulieren ie die repetitiven chritte in der -xidation von Fettsäuren
Klausur zur Vorlesung Biochemie I im W 2004/05 am 9.03.2005 von 0.00 -.30 Uhr Gebäude 42, örsaal 5 Lösungen in rot Punkte in grün Aufgabe : Formulieren ie die repetitiven chritte in der -xidation von Fettsäuren
Oxidative Phosphorylierung
 BICEMIE DER ERÄRUG II Grundzüge des Metabolismus xidative Phosphorylierung 24.04.2012 xidative Phosphorylierung xidative Phosphorylierung -Die Elektronen in AD und in FAD 2 (hohes Übertragungspotential)
BICEMIE DER ERÄRUG II Grundzüge des Metabolismus xidative Phosphorylierung 24.04.2012 xidative Phosphorylierung xidative Phosphorylierung -Die Elektronen in AD und in FAD 2 (hohes Übertragungspotential)
