Fraktionierte Destillation eines Gemisches
|
|
|
- Karsten Kaufman
- vor 9 Jahren
- Abrufe
Transkript
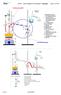
1 Fraktionierte Destillation eines Gemisches Die Destillation ist eine physikalische Trennmethode, bei welcher die unterschiedlichen Siedepunkte der Bestandteile (Komponenten) eines Gemisches zur Trennung ausgenutzt werden. Fraktionierung [lat.fractio = Bruch] Zerlegung eines chemischen Arbeitsprozesses in mehrere Teilprozesse, z.b. Destillation bei verschiedenen en Die einfachste Variante der fraktionierten Destillation wird folgendermassen durchgeführt: Die aus dem Kühler herabtropfende Flüssigkeit wird in kleinen Anteilen nacheinander und getrennt aufgefangen. Dieser Vorgang wird solange fortgesetzt, bis der grösste Teil des ursprünglichen Volumens destilliert ist. Danach untersucht man mit einer geeigneten Methode die Zusammensetzung der einzelnen Anteile (Fraktionen). Idealerweise sollten nun die ersten Anteile nur die tiefsiedende Komponente und die späteren Anteile nur die höhersiedende Komponente enthalten (bei einem Zweikomponentengemisch). Durchführung 1. Apparatur aufstellen. Achtung: Kühlwasser Eintritt unten! 2 50 ml eines Gemisches aus gleichen Volumenteilen von n-hexan oder n- Heptan und reiner Essigsäure in den Destillierkolben einfüllen. Zur Vermeidung von Siedeverzug 2 Siedesteinchen beifügen. 3. Kühlwasser langsam anstellen und mit Aufheizen anfangen. 4. Mit Protokollführung anfangen: (in Minuten) und jede Minute notieren (Stoppuhr). 1 FRAKT. DESTILLATION
2 5. Sobald Kondensat erscheint, die Destillationsgeschwindigkeit durch Regulierung der Flamme derartig regeln, dass etwa 1 Tropfen pro Sekunde in die Vorlage fällt. Abb. 1: Apparatur für fraktionierte Destillation 6. Die Vorlagen (= kleine RG) wechseln, wenn sie etwa 2 cm Flüssigkeit enthalten. Jedes Wechseln der Vorlage im Protokoll markieren. 7. Identifikation: In jedes RG ca. 2 cm hoch Wasser zufügen. Beobachtung: Nun in jedes RG einige Tropfen Jodlösung beifügen. Beobachtung: 2 FRAKT. DESTILLATION
3 Protokoll FRAKT. DESTILLATION
4 Auswertung 1. Graphische Auftragung der Siedetemperatur in Abhängigkeit der : Temp ( C) 140 = f () (Min) 2. Zeichnen Sie die Flüssigkeitsspiegel und Farben Ihrer Reagenzgläser in das folgende Schema ein: 4 FRAKT. DESTILLATION
5 Bestimmen Sie die Siedepunkte der beiden Bestandteile des Gemisches und vergleichen Sie Ihre Werte mit den Werten aus der Literatur: n-heptan Sdp. = 98,3 C Essigsäure Sdp. = 118,5 C Fragen 1. Warum ist der Siedepunkt von Essigsäure höher als derjenige von n-heptan? 2. Warum mischt sich Wasser mit Essigsäure, mit n-heptan hingegen nicht? 3. Durch welche Trennmethode könnte man dieses Gemisch auch noch trennen? Welche Vorteile, bzw. Nachteile haben die beiden Trennmethoden? 5 FRAKT. DESTILLATION
6 6 FRAKT. DESTILLATION
7 Materialliste Allgemein n-heptan Essigsäure 100% Jodlösung 1 Messzylinder 50 ml (breit) Pro Arbeitsplatz 1 Destillationsbrücke 1 Destillationskolben 500 ml NS 29 1 Vorlagenaufsatz NS 29 1 Schliffstopfen NS Schliffklammern für NS 29 1 Schliffthermometer 1 Vierfuss mit Ceramplatte 2 Gummischläuche ca. 1 m 1 Stativ 1 Klammer mit Muffe (für Kühler) 1 Korkring gross 1 RG-Gestell für kleine RG 1 Stoppuhr 1 Trichter (Durchmesser 5 cm) 1 Destillier-Vorstoss 7 FRAKT. DESTILLATION
Trennung eines Flüssigkeitsgemisches durch Destillation (Artikelnr.: P )
 Trennung eines Flüssigkeitsgemisches durch Destillation (Artikelnr.: P1132500) Lehrerinformation Einleitung Viele Stoffe liegen in der Natur als Stoffgemisch und nicht als Reinstoff vor. Da viele Stoffe
Trennung eines Flüssigkeitsgemisches durch Destillation (Artikelnr.: P1132500) Lehrerinformation Einleitung Viele Stoffe liegen in der Natur als Stoffgemisch und nicht als Reinstoff vor. Da viele Stoffe
ENGLER-BUNTE-INSTITUT Bereich I: Chemische Energieträger - Brennstofftechnologie. Verfahrenstechnisches Praktikum (22999) am Engler-Bunte-Institut
 ENGLER-BUNTE-INSTITUT Bereich I: Chemische Energieträger - Brennstofftechnologie INHALT Verfahrenstechnisches Praktikum (22999) am Engler-Bunte-Institut - Versuch C3-1 STOFFDATEN VON BENZIN UND DIESEL
ENGLER-BUNTE-INSTITUT Bereich I: Chemische Energieträger - Brennstofftechnologie INHALT Verfahrenstechnisches Praktikum (22999) am Engler-Bunte-Institut - Versuch C3-1 STOFFDATEN VON BENZIN UND DIESEL
LMPG1 ÜB3-Lösungen Grundlagen der Destillation Seite 1 von 12
 LMPG1 ÜB3-Lösungen Grundlagen der Destillation Seite 1 von 12 LMPG1 ÜB3-Lösungen Grundlagen der Destillation Seite 2 von 12 a. Nennen Sie eine Bedingung, damit eine Gleichstromdestillation zum Einsatz
LMPG1 ÜB3-Lösungen Grundlagen der Destillation Seite 1 von 12 LMPG1 ÜB3-Lösungen Grundlagen der Destillation Seite 2 von 12 a. Nennen Sie eine Bedingung, damit eine Gleichstromdestillation zum Einsatz
LMPG1 ÜB Grundlagen der Destillation Lösungen Seite 1 von 12
 LMPG1 ÜB Grundlagen der Destillation Lösungen Seite 1 von 12 LMPG1 ÜB Grundlagen der Destillation Lösungen Seite 2 von 12 a. Nennen Sie eine Bedingung, damit eine Gleichstromdestillation zum Einsatz kommt.
LMPG1 ÜB Grundlagen der Destillation Lösungen Seite 1 von 12 LMPG1 ÜB Grundlagen der Destillation Lösungen Seite 2 von 12 a. Nennen Sie eine Bedingung, damit eine Gleichstromdestillation zum Einsatz kommt.
Destillation von Rotwein
 Destillation von Rotwein Weiterbildung für fachfremd unterrichtende Lehrkräfte Chromatografi e von Blattfarbstoffen Zerlegung der Verbindung Wasser Titration Herstellung von Natronlauge Öltröpfchen versuch
Destillation von Rotwein Weiterbildung für fachfremd unterrichtende Lehrkräfte Chromatografi e von Blattfarbstoffen Zerlegung der Verbindung Wasser Titration Herstellung von Natronlauge Öltröpfchen versuch
Versuch 10: Siedediagramm
 Versuch 10: Siedediagramm 1 Messung von Siedekurven binärer Stoffgemische 1. Theorie und Methode 1.1 Theorie Die Siedetemperatur eines Stoffes ist eine stoffspezifische Eigenschaft und hängt von der Größe
Versuch 10: Siedediagramm 1 Messung von Siedekurven binärer Stoffgemische 1. Theorie und Methode 1.1 Theorie Die Siedetemperatur eines Stoffes ist eine stoffspezifische Eigenschaft und hängt von der Größe
Schwierigkeitsgrad Vorbereitungszeit Durchführungszeit Empfohlene Gruppengröße. {time:2} 20 Minuten. Versuchsvarianten:
 Lehrer-/Dozentenblatt Gedruckt: 2.8.27 6::24 P753 Siedetemperatur Lehrerinformationen Einführung Schwierigkeitsgrad Vorbereitungszeit Durchführungszeit Empfohlene Gruppengröße {complexity:3} mittel {time:}
Lehrer-/Dozentenblatt Gedruckt: 2.8.27 6::24 P753 Siedetemperatur Lehrerinformationen Einführung Schwierigkeitsgrad Vorbereitungszeit Durchführungszeit Empfohlene Gruppengröße {complexity:3} mittel {time:}
Wie verändern sich die Eigenschaften der Alkohole bei Zunahme der Kohlenstoffzahl?
 Naturwissenschaften - Chemie - Organische Chemie - 4 Alkohole (P77200) 4.6 Eigenschaften der homologen Reihe Experiment von: Phywe Gedruckt: 20.07.206 3:58:38 intertess (Version 3.2 B24, Export 2000) Aufgabe
Naturwissenschaften - Chemie - Organische Chemie - 4 Alkohole (P77200) 4.6 Eigenschaften der homologen Reihe Experiment von: Phywe Gedruckt: 20.07.206 3:58:38 intertess (Version 3.2 B24, Export 2000) Aufgabe
Endersch, Jonas 09./
 Endersch, Jonas 09./10.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Gruppe 3, Platz 53 Versuchsprotokoll Versuch 1.2: Destillation 1 Versuch 1.3: Destillation 2 Einleitung und Theorie: In diesen Versuchen
Endersch, Jonas 09./10.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Gruppe 3, Platz 53 Versuchsprotokoll Versuch 1.2: Destillation 1 Versuch 1.3: Destillation 2 Einleitung und Theorie: In diesen Versuchen
Thermoplast oder Duroplast?
 Name: Datum: Thermoplast oder Duroplast? Geräte Heißluftgebläse oder Brenner, Tiegelzange, Keramiknetz Materialien verschiedene Kunststoffproben (Joghurtbecher, Einwegflasche, Wasserschlauch, Partybesteck,
Name: Datum: Thermoplast oder Duroplast? Geräte Heißluftgebläse oder Brenner, Tiegelzange, Keramiknetz Materialien verschiedene Kunststoffproben (Joghurtbecher, Einwegflasche, Wasserschlauch, Partybesteck,
Liebigkühler. Rundkolben Vorstoß. Becherglas
 Die Destillation 1 1 Allgemeines Bei der Destillation werden Stoffe mit unterschiedlichen Siedetemperaturen durch Erhitzen voneinander getrennt. Aus Rotwein kann auf diese Weise der Alkohol (Ethanol, Sdp.
Die Destillation 1 1 Allgemeines Bei der Destillation werden Stoffe mit unterschiedlichen Siedetemperaturen durch Erhitzen voneinander getrennt. Aus Rotwein kann auf diese Weise der Alkohol (Ethanol, Sdp.
3.3 Entparaffinierung durch Extraktion. Aufbau. Gefahren. Aufbau. Naturwissenschaften - Chemie - Organische Chemie - 3 Erdöl
 Naturwissenschaften - Chemie - Organische Chemie - 3 Erdöl (P77400) 3.3 Entparaffinierung durch Extraktion Experiment von: seb Gedruckt: 7.03.204 4:55:40 intertess (Version 3.2 B24, Export 2000) Aufbau
Naturwissenschaften - Chemie - Organische Chemie - 3 Erdöl (P77400) 3.3 Entparaffinierung durch Extraktion Experiment von: seb Gedruckt: 7.03.204 4:55:40 intertess (Version 3.2 B24, Export 2000) Aufbau
Besitzen andere Kohlenwasserstoffe ähnliche Eigenschaften wie Methan?
 Naturwissenschaften - Chemie - Organische Chemie - 2 Kohlenwasserstoffe (P770800) 2.2 Homologe Reihe der Alkane Experiment von: Anouch Gedruckt: 20.02.204 08:58:7 intertess (Version 3.2 B24, Export 2000)
Naturwissenschaften - Chemie - Organische Chemie - 2 Kohlenwasserstoffe (P770800) 2.2 Homologe Reihe der Alkane Experiment von: Anouch Gedruckt: 20.02.204 08:58:7 intertess (Version 3.2 B24, Export 2000)
Veranstaltung 5: Chemie macht hungrig!
 Veranstaltung 5: Chemie macht hungrig! Station 1: Kohlenhydrate E1 Gummibärchen gehen baden! E2 Ist Zucker gleich Zucker? E3 Was macht eine Kartoffel stark? Station 2: Fette E4 Können Fette verschwinden?
Veranstaltung 5: Chemie macht hungrig! Station 1: Kohlenhydrate E1 Gummibärchen gehen baden! E2 Ist Zucker gleich Zucker? E3 Was macht eine Kartoffel stark? Station 2: Fette E4 Können Fette verschwinden?
Ethanol, der bekannteste Alkohol
 Klasse:. Gruppe: 3.Praktikum Fam.Name:.. Vorname:... im 2er Team mit: Fam.Name:.. Vorname:... Ethanol, der bekannteste Alkohol 1. Herstellung von Ethanol durch Gärung (Demo-Exp) 5 g Glucose (Traubenzucker)
Klasse:. Gruppe: 3.Praktikum Fam.Name:.. Vorname:... im 2er Team mit: Fam.Name:.. Vorname:... Ethanol, der bekannteste Alkohol 1. Herstellung von Ethanol durch Gärung (Demo-Exp) 5 g Glucose (Traubenzucker)
Destillation und Alkohol
 Destillation und Alkohol Destillation Veronikas Vater hat die Genehmigung Schnaps zu brennen. Dazu braucht er eine Destillationsanlage: Abb. 1: Destillationsanlage Bei der Destillation wird eine Flüssigkeit
Destillation und Alkohol Destillation Veronikas Vater hat die Genehmigung Schnaps zu brennen. Dazu braucht er eine Destillationsanlage: Abb. 1: Destillationsanlage Bei der Destillation wird eine Flüssigkeit
 Lösungen flüchtiger Stoffe - Stofftrennung http://ac16.uni-paderborn.de/lehrveranstaltungen/_aac/vorles/skript/kap_7/kap7_5/ Für Lösungen flüchtiger Stoffe ist der Dampfdruck des Gemischs ebenfalls von
Lösungen flüchtiger Stoffe - Stofftrennung http://ac16.uni-paderborn.de/lehrveranstaltungen/_aac/vorles/skript/kap_7/kap7_5/ Für Lösungen flüchtiger Stoffe ist der Dampfdruck des Gemischs ebenfalls von
Destillation und Alkohol
 Destillation und Alkohol Destillation Veronikas Vater hat die Genehmigung Schnaps zu brennen. Dazu braucht er eine Destillationsanlage: Abb. 1: Destillationsanlage Bei der Destillation wird eine Flüssigkeit
Destillation und Alkohol Destillation Veronikas Vater hat die Genehmigung Schnaps zu brennen. Dazu braucht er eine Destillationsanlage: Abb. 1: Destillationsanlage Bei der Destillation wird eine Flüssigkeit
HTBL-PINKAFELD Arbeitsblatt A4/1 Wasser
 HTBL-PINKAFELD Arbeitsblatt A4/1 Wasser DIE ZERDRÜCKTE ALUDOSE LEERE Alu-Getränkedose (1/2 Liter!) Tiegelzange Schüssel mit kaltem Wasser 1. Fülle die leere Getränkedose mit wenig Wasser 2. Stelle die
HTBL-PINKAFELD Arbeitsblatt A4/1 Wasser DIE ZERDRÜCKTE ALUDOSE LEERE Alu-Getränkedose (1/2 Liter!) Tiegelzange Schüssel mit kaltem Wasser 1. Fülle die leere Getränkedose mit wenig Wasser 2. Stelle die
Destillation (Artikelnr.: P )
 Lehrer-/Dozentenblatt Destillation (Artikelnr.: P1045000) Curriculare Themenzuordnung Fachgebiet: Physik Bildungsstufe: Klasse 7-10 Lehrplanthema: Wärmelehre Unterthema: Schmelzen, Sieden, Verdampfen (Aggregatzustände)
Lehrer-/Dozentenblatt Destillation (Artikelnr.: P1045000) Curriculare Themenzuordnung Fachgebiet: Physik Bildungsstufe: Klasse 7-10 Lehrplanthema: Wärmelehre Unterthema: Schmelzen, Sieden, Verdampfen (Aggregatzustände)
Protokoll zur Herstellung von Essigsäureethylester
 Protokoll zur Herstellung von Essigsäureethylester 1) Ziel des Versuches: Herstellung von Essigsäureethylester unter säurekatalytischen Bedingungen. 2) Theoretischer Hintergrund: Ester sind eine Klasse
Protokoll zur Herstellung von Essigsäureethylester 1) Ziel des Versuches: Herstellung von Essigsäureethylester unter säurekatalytischen Bedingungen. 2) Theoretischer Hintergrund: Ester sind eine Klasse
Aufgabe: Unterscheidung von Stoffen anhand von Eigenschaften
 Aufgabe: Unterscheidung von Stoffen anhand von Eigenschaften Vorbereitungen: Benötigte Materialien sind entsprechend der Anzahl an Gruppen für die Teams bereitzustellen. -Aufgabenstellung und Hinweise
Aufgabe: Unterscheidung von Stoffen anhand von Eigenschaften Vorbereitungen: Benötigte Materialien sind entsprechend der Anzahl an Gruppen für die Teams bereitzustellen. -Aufgabenstellung und Hinweise
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg Lösungen zum Übungsblatt 4 zur Vorlesung Physikalische Chemie II WS 2008/09 Prof. E. Bartsch 4.1 Der Siedepunkt einer flüssigen Mischung
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg Lösungen zum Übungsblatt 4 zur Vorlesung Physikalische Chemie II WS 2008/09 Prof. E. Bartsch 4.1 Der Siedepunkt einer flüssigen Mischung
Extraktion. Aufgabe und Material. Lehrer-/Dozentenblatt. Lehrerinformationen. Lernziele. Hinweise zu Aufbau und Durchführung. H- und P-Sätze.
 Lehrer-/Dozentenblatt Extraktion Aufgabe und Material Lehrerinformationen Lernziele Farbstoffe lassen sich durch Extraktion aus den gefärbten Substanzen herauswaschen. Extraktion ist ein sowohl im Alltag
Lehrer-/Dozentenblatt Extraktion Aufgabe und Material Lehrerinformationen Lernziele Farbstoffe lassen sich durch Extraktion aus den gefärbten Substanzen herauswaschen. Extraktion ist ein sowohl im Alltag
Endersch, Jonas Praktikum Allgemeine Chemie 2, Saal G1, Platz 53
 Endersch, Jonas 03.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 1.1: Einführung in die Laboratoriumstechnik Einleitung Um die in diesem Praktikum verwendeten Glasgeräte
Endersch, Jonas 03.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 1.1: Einführung in die Laboratoriumstechnik Einleitung Um die in diesem Praktikum verwendeten Glasgeräte
Wie lässt sich Stickstoff gewinnen, welche Eigenschaften hat er?
 Naturwissenschaften - Chemie - Anorganische Chemie - 2 Luft und andere Gase (P753800) 2.6 Stickstoff - Darstellung und Eigenschaften Experiment von: P753900D Gedruckt: 24.03.204 0:54:2 intertess (Version
Naturwissenschaften - Chemie - Anorganische Chemie - 2 Luft und andere Gase (P753800) 2.6 Stickstoff - Darstellung und Eigenschaften Experiment von: P753900D Gedruckt: 24.03.204 0:54:2 intertess (Version
Versuchsbeschreibung zum Chemisch-Technischen Grundpraktikum
 Universität Karlsruhe Institut für Chemische Technik Prof. Dr. H. Bockhorn Versuchsbeschreibung zum Chemisch-Technischen Grundpraktikum Glockenbodenkolonne 1 Literatur Bockhard/Güntzschel/Poetschukat Grundlagen
Universität Karlsruhe Institut für Chemische Technik Prof. Dr. H. Bockhorn Versuchsbeschreibung zum Chemisch-Technischen Grundpraktikum Glockenbodenkolonne 1 Literatur Bockhard/Güntzschel/Poetschukat Grundlagen
Bestimmung des Stickstoffgehalts von Erde
 Bestimmung des Stickstoffgehalts von Erde Schülerversuch, ca. 25 Minuten Experiment Teil 1 Material und Chemikalien: Ofentrockene Erde Kaliumchloridlösung (c = 2 mol/l) Flasche (250 ml) Trichter Filterpapier
Bestimmung des Stickstoffgehalts von Erde Schülerversuch, ca. 25 Minuten Experiment Teil 1 Material und Chemikalien: Ofentrockene Erde Kaliumchloridlösung (c = 2 mol/l) Flasche (250 ml) Trichter Filterpapier
Chemie ist eine naturwissenschaftliche Disziplin, welche sich mit den Stoffen, den Stoffeigenschaften und den Stoffumwandlungen beschäftigt.
 1 Definition: Chemie ist eine naturwissenschaftliche Disziplin, welche sich mit den Stoffen, den Stoffeigenschaften und den Stoffumwandlungen beschäftigt. 2 Erscheinungsformen der Materie Homogen oder
1 Definition: Chemie ist eine naturwissenschaftliche Disziplin, welche sich mit den Stoffen, den Stoffeigenschaften und den Stoffumwandlungen beschäftigt. 2 Erscheinungsformen der Materie Homogen oder
Titration. Weiterbildung für fachfremd unterrichtende Lehrkräfte
 Titration Weiterbildung für fachfremd unterrichtende Lehrkräfte Chromatografi e von Blattfarbstoffen Destillation von Rotwein Zerlegung der Verbindung Wasser Herstellung von Natronlauge Öltröpfchen versuch
Titration Weiterbildung für fachfremd unterrichtende Lehrkräfte Chromatografi e von Blattfarbstoffen Destillation von Rotwein Zerlegung der Verbindung Wasser Herstellung von Natronlauge Öltröpfchen versuch
mischbar Lösung Feststoffen
 Kristalle züchten Mischen und Lösen - Nicht alle Stoffe sind miteinander mischbar. --> Hexan (Bestandteil von Benzin) und Wasser --> Hast du Beispiele aus dem Alltag? - Kann man die Stoffe nach dem Mischen
Kristalle züchten Mischen und Lösen - Nicht alle Stoffe sind miteinander mischbar. --> Hexan (Bestandteil von Benzin) und Wasser --> Hast du Beispiele aus dem Alltag? - Kann man die Stoffe nach dem Mischen
Trenne ein Gemisch aus Sand und Kochsalz sowie ein Gemisch aus Sand und Eisen.
 Naturwissenschaften - Chemie - Allgemeine Chemie - 3 Trennverfahren (P750900) 3.2 Gemischtrennungen - Filtrieren, Magnetscheidung Experiment von: Phywe Gedruckt:.0.203 2:53:30 intertess (Version 3.06 B200,
Naturwissenschaften - Chemie - Allgemeine Chemie - 3 Trennverfahren (P750900) 3.2 Gemischtrennungen - Filtrieren, Magnetscheidung Experiment von: Phywe Gedruckt:.0.203 2:53:30 intertess (Version 3.06 B200,
Abhängigkeit der Reaktionsgeschwindigkeit (RG) von der Konzentration: Kalk (CaCO 3 ) + Salzsäure (HCl)
 Abhängigkeit der Reaktionsgeschwindigkeit Abhängigkeit der Reaktionsgeschwindigkeit (RG) von der Konzentration: Kalk (CaCO 3 ) + Salzsäure (HCl) Beim Lösen von Kalk in Salzsäure bildet sich ein gut wasserlösliches
Abhängigkeit der Reaktionsgeschwindigkeit Abhängigkeit der Reaktionsgeschwindigkeit (RG) von der Konzentration: Kalk (CaCO 3 ) + Salzsäure (HCl) Beim Lösen von Kalk in Salzsäure bildet sich ein gut wasserlösliches
Während den Arbeiten dieses Abschnitts muss unbedingt die Schutzbrille getragen werden. In einem Erlenmeyer werden
 Synthese von Aspirin Reaktion Während den Arbeiten dieses Abschnitts muss unbedingt die Schutzbrille getragen werden. In einem Erlenmeyer werden 6 g Salicylsäure OH COOH 8 ml (8,6 g) Essigsäureanhydrid
Synthese von Aspirin Reaktion Während den Arbeiten dieses Abschnitts muss unbedingt die Schutzbrille getragen werden. In einem Erlenmeyer werden 6 g Salicylsäure OH COOH 8 ml (8,6 g) Essigsäureanhydrid
Laborprotokoll. Trennung von Chlorophyll a und Chlorophyll b mittels Säulenchromatographie
 Laborprotokoll Trennung von Chlorophyll a und Chlorophyll b mittels Säulenchromatographie Cédric Birrer (E46) Michel Rickhaus (E45) Anna-Caterina Senn (E44) Juni 2007 Inhaltsverzeichnis 1 Versuchsziel...
Laborprotokoll Trennung von Chlorophyll a und Chlorophyll b mittels Säulenchromatographie Cédric Birrer (E46) Michel Rickhaus (E45) Anna-Caterina Senn (E44) Juni 2007 Inhaltsverzeichnis 1 Versuchsziel...
Wir untersuchen das Grün der Blätter
 Naturwissenschaften Kantonsschule Freudenberg Wir untersuchen das Grün der Blätter Messzylinder: Mörser: 1. Schritt: Farbe aus grünen Blättern extrahieren Jede Gruppe wählt im Park eine andere Pflanze
Naturwissenschaften Kantonsschule Freudenberg Wir untersuchen das Grün der Blätter Messzylinder: Mörser: 1. Schritt: Farbe aus grünen Blättern extrahieren Jede Gruppe wählt im Park eine andere Pflanze
2. SIEDEDIAGRAMM FÜR EINE BINÄRE MISCHUNG. Zum Bestehen müssen vier von sechs gestellten Fragen richtig beantwortet werden.
 1 2. SIEDEDIAGRAMM FÜR EINE BINÄRE MISCHUNG Fragen zum Eingangskolloquium: Zum Bestehen müssen vier von sechs gestellten Fragen richtig beantwortet werden. 1. Definieren Sie den Begriff Phase? 2. Wann
1 2. SIEDEDIAGRAMM FÜR EINE BINÄRE MISCHUNG Fragen zum Eingangskolloquium: Zum Bestehen müssen vier von sechs gestellten Fragen richtig beantwortet werden. 1. Definieren Sie den Begriff Phase? 2. Wann
7.2.1 Nitrierung von Toluol zu 2-Nitrotoluol (1a), 4-Nitrotoluol (1b) und 2,4-Dinitrotoluol
 7.2.1 Nitrierung von Toluol zu 2-Nitrotoluol (1a), 4-Nitrotoluol (1b) und 2,4-Dinitrotoluol (1c) HNO 3, H 2 SO 4 + + C 7 H 8 (92.1) HNO 3 (63.0) H 2 SO 4 (98.1) 1a 1b 1c C 7 H 7 (137.1) C 7 H 6 N 2 O 4
7.2.1 Nitrierung von Toluol zu 2-Nitrotoluol (1a), 4-Nitrotoluol (1b) und 2,4-Dinitrotoluol (1c) HNO 3, H 2 SO 4 + + C 7 H 8 (92.1) HNO 3 (63.0) H 2 SO 4 (98.1) 1a 1b 1c C 7 H 7 (137.1) C 7 H 6 N 2 O 4
Azeotrope, Nichtideale Mischungen
 Azeotrope, Nichtideale Mischungen http://ac16.uni-paderborn.de/lehrveranstaltungen/_aac/vorles/skript/kap_7/kap7_5/kap7_55.html Nicht alle Lösungen verhalten sich ideal, folgen also dem RAOULTschen Gesetz
Azeotrope, Nichtideale Mischungen http://ac16.uni-paderborn.de/lehrveranstaltungen/_aac/vorles/skript/kap_7/kap7_5/kap7_55.html Nicht alle Lösungen verhalten sich ideal, folgen also dem RAOULTschen Gesetz
Was ist drin in der Cola?
 Was ist drin in der Cola? - Nachweisreaktionen für Anionen, Kationen und Zucker - Ein Nachweis ist eine Methode der Analytischen Chemie, die dazu dient, eine Stoffprobe zu untersuchen. Nachweisreaktionen
Was ist drin in der Cola? - Nachweisreaktionen für Anionen, Kationen und Zucker - Ein Nachweis ist eine Methode der Analytischen Chemie, die dazu dient, eine Stoffprobe zu untersuchen. Nachweisreaktionen
OSZ Körperpflege Chemie Fachhochschulreife FOS 2009/10
 Name: Klasse: GASCHROMATOGRAFIE Experiment 08 1. Aufgabe: a) Nehmen Sie ein Gaschromatogramm ihres Feuerzeuggases auf. (Füllen Sie dazu 2 ml des Feuerzeuggases in die Spritze!) Siehe Anlage Durchführung!!!
Name: Klasse: GASCHROMATOGRAFIE Experiment 08 1. Aufgabe: a) Nehmen Sie ein Gaschromatogramm ihres Feuerzeuggases auf. (Füllen Sie dazu 2 ml des Feuerzeuggases in die Spritze!) Siehe Anlage Durchführung!!!
Destillation Destillation
 Destillation Die Destillation ist ein in der organischen Chemie häufig eingesetztes Verfahren, um flüssige Substanzen (Stoffgemische und Lösungen) aufgrund der verschiedenen Flüchtigkeiten der Komponente
Destillation Die Destillation ist ein in der organischen Chemie häufig eingesetztes Verfahren, um flüssige Substanzen (Stoffgemische und Lösungen) aufgrund der verschiedenen Flüchtigkeiten der Komponente
Titration von Speise-Essig
 Titration von Speise-Essig Wir werden in diesem Versuch die Titration [frz.titer = Feingehalt] Konzentration der Essigsäure in Analytisches Verfahren, bei dem die Reagenzlösung tropfenweise zugesetzt wird,
Titration von Speise-Essig Wir werden in diesem Versuch die Titration [frz.titer = Feingehalt] Konzentration der Essigsäure in Analytisches Verfahren, bei dem die Reagenzlösung tropfenweise zugesetzt wird,
Versuch RE Bestimmung von Flüssigkeits-Dampf-Gleichgewichten Ermittlung der Trennleistung verschiedener Rektifikationskolonnen
 Versuch RE Bestimmung von Flüssigkeits-Dampf-Gleichgewichten Ermittlung der Trennleistung verschiedener Rektifikationskolonnen 1.) Bestimmung von Flüssigkeits-Dampf-Gleichgewichten Aufgabenstellung: -
Versuch RE Bestimmung von Flüssigkeits-Dampf-Gleichgewichten Ermittlung der Trennleistung verschiedener Rektifikationskolonnen 1.) Bestimmung von Flüssigkeits-Dampf-Gleichgewichten Aufgabenstellung: -
3. Stoffgemische und Ihre Zerlegung
 3. Stoffgemische und Ihre Zerlegung Aus Stoffgemischen lassen sich die einzelnen Bestandteile durch physikalische Trennverfahren isolieren. Wenn ein Stoff mittels physikalischen Methoden nicht weiter zerlegen
3. Stoffgemische und Ihre Zerlegung Aus Stoffgemischen lassen sich die einzelnen Bestandteile durch physikalische Trennverfahren isolieren. Wenn ein Stoff mittels physikalischen Methoden nicht weiter zerlegen
Einführungspraktikum zu den Arbeitsmethoden in der Organischen Chemie
 Einführungspraktikum zu den Arbeitsmethoden in der Organischen Chemie Versuche und Übungen Kapitel 3: Klassische Methoden zur Charakterisierung organischer Verbindungen Übungen 3.1-3.3 Untersuchungen zum
Einführungspraktikum zu den Arbeitsmethoden in der Organischen Chemie Versuche und Übungen Kapitel 3: Klassische Methoden zur Charakterisierung organischer Verbindungen Übungen 3.1-3.3 Untersuchungen zum
In der Natur verschwindet nichts - Lösen und Auskristallisieren von Kochsalz
 Name: Datum: In der Natur verschwindet nichts - Lösen und Auskristallisieren von Kochsalz Geräte Becherglas, Spatel, Alu-Teelichtschale, Heizplatte, Pipette, Tiegelzange, Glasstab, Lupe Materialien Kochsalz
Name: Datum: In der Natur verschwindet nichts - Lösen und Auskristallisieren von Kochsalz Geräte Becherglas, Spatel, Alu-Teelichtschale, Heizplatte, Pipette, Tiegelzange, Glasstab, Lupe Materialien Kochsalz
Versuch 6: Rektifikation
 Physikalisch-Chemisches Grundpraktikum Sommersemester 2004 Gruppe B9 Andreas Frintrup / Sven Wolff Versuch 6: Rektifikation Ziel: Die Effizienz zweier verschiedener Trennsäulen, einer fünfbödigen Glockenbodenkolonne
Physikalisch-Chemisches Grundpraktikum Sommersemester 2004 Gruppe B9 Andreas Frintrup / Sven Wolff Versuch 6: Rektifikation Ziel: Die Effizienz zweier verschiedener Trennsäulen, einer fünfbödigen Glockenbodenkolonne
Chemisches Praktikum für TUM-BWL Praxisseminar I Grundoperationen und Reinigungstechniken
 Chemisches Praktikum für TUM-BWL Praxisseminar I Grundoperationen und Reinigungstechniken Inhalt: Aufbauten Umkristallisation Destillation Dr. Andreas Bauer, Dr. Stefan Breitenlechner Lehrstuhl für Organische
Chemisches Praktikum für TUM-BWL Praxisseminar I Grundoperationen und Reinigungstechniken Inhalt: Aufbauten Umkristallisation Destillation Dr. Andreas Bauer, Dr. Stefan Breitenlechner Lehrstuhl für Organische
Berichte OCP1. Manuela Bieri 17. Januar 2007
 Berichte CP1 SYNTESE VN ISAMYLACETAT Manuela Bieri 17. Januar 2007 1 Berichte CP1 1. Methode Isoamylacetat wurde durch eine säurekatalysierte Veresterung von Isoamylalkohol (3-Methyl-1-butanol) mit Essigsäure
Berichte CP1 SYNTESE VN ISAMYLACETAT Manuela Bieri 17. Januar 2007 1 Berichte CP1 1. Methode Isoamylacetat wurde durch eine säurekatalysierte Veresterung von Isoamylalkohol (3-Methyl-1-butanol) mit Essigsäure
Alles was uns umgibt!
 Was ist Chemie? Womit befasst sich die Chemie? Die Chemie ist eine Naturwissenschaft, die sich mit der Materie (den Stoffen), ihren Eigenschaften und deren Umwandlung befasst Was ist Chemie? Was ist Materie?
Was ist Chemie? Womit befasst sich die Chemie? Die Chemie ist eine Naturwissenschaft, die sich mit der Materie (den Stoffen), ihren Eigenschaften und deren Umwandlung befasst Was ist Chemie? Was ist Materie?
Fettgehalt einer Tafel Schokolade
 Fettgehalt einer Tafel Schokolade Betriebsanweisung nach 20 Gefahrstoffverordnung Verwendete Chemikalien Bezeichnung RSätze SSätze Gefährlichkeitsmerkmale 100 ml R 1138 50/536567 S 9162933 606162 leicht
Fettgehalt einer Tafel Schokolade Betriebsanweisung nach 20 Gefahrstoffverordnung Verwendete Chemikalien Bezeichnung RSätze SSätze Gefährlichkeitsmerkmale 100 ml R 1138 50/536567 S 9162933 606162 leicht
Arbeitskreis Bestimmung der Dissoziationskonstanten von D 05 Kappenberg Essigsäure (Variante nach R. Nagel) Konduktometrie. Prinzip: Versuchsaufbau:
 Kappenerg Essigsäure (Variante nach R. Nagel) Konduktometrie Prinzip: Essigsäure ist ein schwacher Elektrolyt. Die Leitfähigkeit ei sehr kleinen unterschiedlichen Verdünnungen wird gemessen und graphisch
Kappenerg Essigsäure (Variante nach R. Nagel) Konduktometrie Prinzip: Essigsäure ist ein schwacher Elektrolyt. Die Leitfähigkeit ei sehr kleinen unterschiedlichen Verdünnungen wird gemessen und graphisch
Darstellung von 4-Acetylcumol (1-Acetyl-4-isopropylbenzol) [1] Präparat 2
![Darstellung von 4-Acetylcumol (1-Acetyl-4-isopropylbenzol) [1] Präparat 2 Darstellung von 4-Acetylcumol (1-Acetyl-4-isopropylbenzol) [1] Präparat 2](/thumbs/95/126253543.jpg) Janine Schneider 05.05.00 Darstellung von 4-Acetylcumol (1-Acetyl-4-isopropylbenzol) [1] Präparat 2 1. Reaktionstyp: Friedel-rafts-Acylierung 2. Reaktionsgleichung: + Al 3 9 12 2 3 Al 3 11 14 M=120.2 g/mol
Janine Schneider 05.05.00 Darstellung von 4-Acetylcumol (1-Acetyl-4-isopropylbenzol) [1] Präparat 2 1. Reaktionstyp: Friedel-rafts-Acylierung 2. Reaktionsgleichung: + Al 3 9 12 2 3 Al 3 11 14 M=120.2 g/mol
V 2 Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration und der Temperatur bei der Reaktion von Kaliumpermanganat mit Oxalsäure in Lösung
 V 2 Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration und der Temperatur bei der Reaktion von Kaliumpermanganat mit Oxalsäure in Lösung Bei diesem Versuch geht es darum, die Geschwindigkeit
V 2 Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration und der Temperatur bei der Reaktion von Kaliumpermanganat mit Oxalsäure in Lösung Bei diesem Versuch geht es darum, die Geschwindigkeit
Gefahrenstoffe. 2 Bechergläser (230 ml), Bürette, Magnetrührer, Trichter, Rührschwein, Pipette, Stativ, Muffe, ph-meter
 1.1 V1 Titration von Cola In diesem Versuch wird die in Cola enthaltene Phosphorsäure mittels Säure-Base-Titration titriert und bestimmt. Ebenfalls wird mit den erhaltenen Werten gerechnet um das chemische
1.1 V1 Titration von Cola In diesem Versuch wird die in Cola enthaltene Phosphorsäure mittels Säure-Base-Titration titriert und bestimmt. Ebenfalls wird mit den erhaltenen Werten gerechnet um das chemische
Zerlegung von Wasser durch Reduktionsmittel
 Lehrer-/Dozentenblatt Zerlegung von Wasser durch Reduktionsmittel (Artikelnr.: P7155500) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Anorganische Chemie Unterthema:
Lehrer-/Dozentenblatt Zerlegung von Wasser durch Reduktionsmittel (Artikelnr.: P7155500) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Anorganische Chemie Unterthema:
Saure, neutrale und alkalische Lösungen
 Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 5 und 6 einen Lehrerversuch
Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 5 und 6 einen Lehrerversuch
Laborführerschein. Dieses Skript gehört:
 Laborführerschein Dieses Skript gehört: Laborführerschein Seite 2 Station 1: Laborgeräte, ein Muss für jeden Chemiker Welche Laborgeräte des Titelbildes findest Du in der Liste wieder? Suche an deinem
Laborführerschein Dieses Skript gehört: Laborführerschein Seite 2 Station 1: Laborgeräte, ein Muss für jeden Chemiker Welche Laborgeräte des Titelbildes findest Du in der Liste wieder? Suche an deinem
Manfred Nitsche. Kolonnen-Fibel. Für die Praxis im chemischen Anlagenbau. Springer Vi eweg
 Manfred Nitsche KolonnenFibel Für die Praxis im chemischen Anlagenbau Springer Vi eweg 1 Planung von Destillations und Absorptionskolonnen 1 1.1 Planungshinweise 1 1.2 Mengenbilanz für die gegebene Aufgabenstellung
Manfred Nitsche KolonnenFibel Für die Praxis im chemischen Anlagenbau Springer Vi eweg 1 Planung von Destillations und Absorptionskolonnen 1 1.1 Planungshinweise 1 1.2 Mengenbilanz für die gegebene Aufgabenstellung
Multiple-Choice Test. Alle Fragen können mit Hilfe der Versuchsanleitung richtig gelöst werden.
 PCG-Grundpraktikum Versuch 2- Siedediagramm Multiple-Choice Test Zu jedem Versuch im PCG wird ein Vorgespräch durchgeführt. Für den Versuch Siedediagramm wird dieses Vorgespräch durch einen Multiple-Choice
PCG-Grundpraktikum Versuch 2- Siedediagramm Multiple-Choice Test Zu jedem Versuch im PCG wird ein Vorgespräch durchgeführt. Für den Versuch Siedediagramm wird dieses Vorgespräch durch einen Multiple-Choice
Wie wirkt sich die Zugabe von Salz auf den Schmelz- und Siedepunkt von Wasser aus?
 Naturwissenschaften - Chemie - Allgemeine Chemie - 7 Chemische Bindung (P752400) 7.4 Schmelzpunktserniedrigung und Siedepunktserhöhung Experiment von: Phywe Gedruckt:.0.203 3:5:43 intertess (Version 3.06
Naturwissenschaften - Chemie - Allgemeine Chemie - 7 Chemische Bindung (P752400) 7.4 Schmelzpunktserniedrigung und Siedepunktserhöhung Experiment von: Phywe Gedruckt:.0.203 3:5:43 intertess (Version 3.06
Praktikum Physikalische Chemie I 30. Januar Aktivierungsenergie. Guido Petri Anastasiya Knoch PC111/112, Gruppe 11
 Praktikum Physikalische Chemie I 30. Januar 2016 Aktivierungsenergie Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1 Aufgabenstellung Für die Reaktion von Saccharose mit Wasser zu Glucose und Fructose
Praktikum Physikalische Chemie I 30. Januar 2016 Aktivierungsenergie Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1 Aufgabenstellung Für die Reaktion von Saccharose mit Wasser zu Glucose und Fructose
Identifizierung des Farbstoffes in blauen M&Ms durch Dünnschichtchromatographie
 Name Datum Identifizierung des Farbstoffes in blauen M&Ms durch Dünnschichtchromatographie Material: DC-Karten (Kieselgel), Glas mit Deckel(DC-Kammer), Kapillare, Messzylinder Chemikalien: Blaue M&Ms,
Name Datum Identifizierung des Farbstoffes in blauen M&Ms durch Dünnschichtchromatographie Material: DC-Karten (Kieselgel), Glas mit Deckel(DC-Kammer), Kapillare, Messzylinder Chemikalien: Blaue M&Ms,
Klassenarbeit - Mechanik
 5. Klasse / Physik Klassenarbeit - Mechanik Aggregatszustände; Geschwindigkeit; Geradlinige Bewegung; Volumen; Physikalische Größen; Masse; Dichte Aufgabe 1 Welche 3 Arten von Stoffen kennst Du? Nenne
5. Klasse / Physik Klassenarbeit - Mechanik Aggregatszustände; Geschwindigkeit; Geradlinige Bewegung; Volumen; Physikalische Größen; Masse; Dichte Aufgabe 1 Welche 3 Arten von Stoffen kennst Du? Nenne
4. Methoden zur Reinigung der organischen Verbindungen Elementaranalyse. Empirische und Summenformel.
 4. Methoden zur Reinigung der organischen Verbindungen Elementaranalyse. Empirische und Summenformel. Prof. Ivo C. Ivanov 1 Allgemeines Ablauf eines Experiments in der Organischen Chemie: Literaturrecherche
4. Methoden zur Reinigung der organischen Verbindungen Elementaranalyse. Empirische und Summenformel. Prof. Ivo C. Ivanov 1 Allgemeines Ablauf eines Experiments in der Organischen Chemie: Literaturrecherche
Schmelz- und Erstarrungskurve von watriumthiosulfat
 Lehrer-/Dozentenblatt Schmelz- und Erstarrungskurve von watriumthiosulfat (Artikelnr.: P044600) Curriculare Themenzuordnung Fachgebiet: Physik Bildungsstufe: Klasse 7-0 Lehrplanthema: Wärmelehre Unterthema:
Lehrer-/Dozentenblatt Schmelz- und Erstarrungskurve von watriumthiosulfat (Artikelnr.: P044600) Curriculare Themenzuordnung Fachgebiet: Physik Bildungsstufe: Klasse 7-0 Lehrplanthema: Wärmelehre Unterthema:
spaltet. Der Sauerstoff entflammt den Glimmspan. Bei der katalytischen Substanz handelt es sich um das Enzym Katalase.
 ENZYMATIK 1. Vorversuch Versuch Spaltung von Wasserstoffperoxid (H 2 O 2 ) Material: Bäckerhefe, Braunstein (MnO 2 ), Wasserstoffperoxid, Rundkolben, Stativ, Brenner, Glimmspan Durchführung 1: 5ml Wasserstoffperoxid
ENZYMATIK 1. Vorversuch Versuch Spaltung von Wasserstoffperoxid (H 2 O 2 ) Material: Bäckerhefe, Braunstein (MnO 2 ), Wasserstoffperoxid, Rundkolben, Stativ, Brenner, Glimmspan Durchführung 1: 5ml Wasserstoffperoxid
DESTILLATION. Aufgabenstellung THEORIE
 DESTILLATION Aufgabenstellung Eine wässrig-alkoholische Lösung (Rotwein) wird durch Destillation in Fraktionen zerlegt. Da Wasser mit Ethanol ein Azeotrop bildet, wird keine der Komponenten rein gewonnen,
DESTILLATION Aufgabenstellung Eine wässrig-alkoholische Lösung (Rotwein) wird durch Destillation in Fraktionen zerlegt. Da Wasser mit Ethanol ein Azeotrop bildet, wird keine der Komponenten rein gewonnen,
Alltagschemie im Mittelalter - Farbe
 Alltagschemie im Mittelalter - Farbe E1 Färben mit Indigo E2 Färben mit Krapp E3 Tusche der Römer (Rußtinte) E4 Eisengallus-Tinte E5 Malfarben aus Quark E1 Färben mit Indigo Heiße Flüssigkeiten! Ätzende
Alltagschemie im Mittelalter - Farbe E1 Färben mit Indigo E2 Färben mit Krapp E3 Tusche der Römer (Rußtinte) E4 Eisengallus-Tinte E5 Malfarben aus Quark E1 Färben mit Indigo Heiße Flüssigkeiten! Ätzende
Dünnschichtchromatographie (DC) und Säulenchromatographie Kurzanleitung
 Dünnschichtchromatographie (DC) und Säulenchromatographie Kurzanleitung Sebastian Meiss 24. Oktober 2008 1 1 Dünnschichtchromatographie Vorbereitung Gemisch fest Gemisch in möglichst wenig Lösungsmittel
Dünnschichtchromatographie (DC) und Säulenchromatographie Kurzanleitung Sebastian Meiss 24. Oktober 2008 1 1 Dünnschichtchromatographie Vorbereitung Gemisch fest Gemisch in möglichst wenig Lösungsmittel
Chlorwasserstoff und Salzsäure
 Chlorwasserstoff und Salzsäure 1. Reaktionsgleichung Chlorwasserstoff entsteht, wenn Natriumchlorid mit Schwefelsäure H 2 SO 4 in Kontakt kommt. Die Reaktionsgleichung lässt sich folgendermassen formulieren:...
Chlorwasserstoff und Salzsäure 1. Reaktionsgleichung Chlorwasserstoff entsteht, wenn Natriumchlorid mit Schwefelsäure H 2 SO 4 in Kontakt kommt. Die Reaktionsgleichung lässt sich folgendermassen formulieren:...
Baustein Aufgabe Material Niveau Bestimmung des Atemzugvolumens in Ruhe und bei Belastung Ermittlung von Einzelwerten, Mittelwertbildung
 Baustein 7: Mit jedem Atemzug... BP2016BW-ALLG-GYM-BIO/InhaltlicherStand:23.März2016/PDFgeneriertam07.04.201600:24 Baustein Aufgabe Material Niveau A Ermittlung von Einzelwerten, Mittelwertbildung AB,
Baustein 7: Mit jedem Atemzug... BP2016BW-ALLG-GYM-BIO/InhaltlicherStand:23.März2016/PDFgeneriertam07.04.201600:24 Baustein Aufgabe Material Niveau A Ermittlung von Einzelwerten, Mittelwertbildung AB,
Versuch: In der Natur verschwindet nichts - Lösen und Auskristallisieren von Salz
 Name: Datum: Versuch: In der Natur verschwindet nichts - Lösen und Auskristallisieren von Salz Material: Kochsalz (NaCl), Leitungswasser, Mineralwasser, Becherglas, Spatel, destilliertes Wasser, Alu-Teelichtschalen,
Name: Datum: Versuch: In der Natur verschwindet nichts - Lösen und Auskristallisieren von Salz Material: Kochsalz (NaCl), Leitungswasser, Mineralwasser, Becherglas, Spatel, destilliertes Wasser, Alu-Teelichtschalen,
Auf welche Eigenschaften lassen sich Kunststoffe untersuchen? (2)
 Naturwissenschaften - Chemie - Polymerchemie - 3 Erste Identifizierung von Kunststoffen (P780500) 3.2 Kunststoffeigenschaften (2) - Ermittlung der Dichte von Kunststoffen Experiment von: Seb Gedruckt:
Naturwissenschaften - Chemie - Polymerchemie - 3 Erste Identifizierung von Kunststoffen (P780500) 3.2 Kunststoffeigenschaften (2) - Ermittlung der Dichte von Kunststoffen Experiment von: Seb Gedruckt:
Bundesrealgymnasium Imst. Chemie 2010-11. Klasse 4. Einführung Stoffe
 Bundesrealgymnasium Imst Chemie 2010-11 Einführung Stoffe Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
Bundesrealgymnasium Imst Chemie 2010-11 Einführung Stoffe Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
Kalibrieren eines Thermometers (Thermometermodell) (Artikelnr.: P )
 Lehrer-/Dozentenblatt Kalibrieren eines Thermometers (Thermometermodell) (Artikelnr.: P1042300) Curriculare Themenzuordnung Fachgebiet: Physik Bildungsstufe: Klasse 7-10 Lehrplanthema: Wärmelehre Unterthema:
Lehrer-/Dozentenblatt Kalibrieren eines Thermometers (Thermometermodell) (Artikelnr.: P1042300) Curriculare Themenzuordnung Fachgebiet: Physik Bildungsstufe: Klasse 7-10 Lehrplanthema: Wärmelehre Unterthema:
Bruchrechnung Aufgaben zum Geobrett 1
 Bruchrechnung Aufgaben zum Geobrett 8 6 Bruchrechnung Aufgaben zum Geobrett 8 Bruchrechnung Aufgaben zum Geobrett 8 6 Bruchrechnung Aufgaben zum Geobrett 5 8 5 6 Bruchrechnung Aufgaben zum Geobrett 5 5
Bruchrechnung Aufgaben zum Geobrett 8 6 Bruchrechnung Aufgaben zum Geobrett 8 Bruchrechnung Aufgaben zum Geobrett 8 6 Bruchrechnung Aufgaben zum Geobrett 5 8 5 6 Bruchrechnung Aufgaben zum Geobrett 5 5
Verbrennung einiger Stoffe
 Verbrennung einiger Stoffe beobachte wie ein Stoff verbrennt! beschreibe den Rückstand der Verbrennung Verbrennung von Flüssigkeiten: 3 Abdampfschalen, 3 Flüssigkeiten (je 10 Tropfen) Flüssigkeit 1 Flüssigkeit
Verbrennung einiger Stoffe beobachte wie ein Stoff verbrennt! beschreibe den Rückstand der Verbrennung Verbrennung von Flüssigkeiten: 3 Abdampfschalen, 3 Flüssigkeiten (je 10 Tropfen) Flüssigkeit 1 Flüssigkeit
Wasserdurchlässigkeit und Kapillaraufstieg
 Wasserdurchlässigkeit und Kapillaraufstieg Kurzinformation Um was geht es? Regenwasser versickert in verschiedenen Böden unterschiedlich. Ihr untersucht in diesem Versuch den Einfluss auf die Versickerung
Wasserdurchlässigkeit und Kapillaraufstieg Kurzinformation Um was geht es? Regenwasser versickert in verschiedenen Böden unterschiedlich. Ihr untersucht in diesem Versuch den Einfluss auf die Versickerung
Die folgende Abbildung zeigt dir, wie man mit Hilfe des Brennstrahls und des Parallelstrahls das Bild bestimmen kann.
 Begleitmaterial zum Modul Bruchgleichungen Die folgende Abbildung zeigt dir, wie man mit Hilfe des Brennstrahls und des Parallelstrahls das Bild bestimmen kann.. Führe eine entsprechende Konstruktion selbst
Begleitmaterial zum Modul Bruchgleichungen Die folgende Abbildung zeigt dir, wie man mit Hilfe des Brennstrahls und des Parallelstrahls das Bild bestimmen kann.. Führe eine entsprechende Konstruktion selbst
Salzbildung durch Reaktion von Säuren mit Laugen
 Lehrer-/Dozentenblatt Salzbildung durch Reaktion von Säuren mit Laugen (Artikelnr.: P7159400) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Anorganische Chemie
Lehrer-/Dozentenblatt Salzbildung durch Reaktion von Säuren mit Laugen (Artikelnr.: P7159400) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Anorganische Chemie
Kupfersteckbrief 06 AB1 MS
 Um einen Stoff und seine Eigenschaften genauer beschreiben zu können, ist es wichtig verschiedene Versuche durchzuführen und genau zu beobachten. Aufgabe: Erstelle einen Steckbrief für, indem du verschiedene
Um einen Stoff und seine Eigenschaften genauer beschreiben zu können, ist es wichtig verschiedene Versuche durchzuführen und genau zu beobachten. Aufgabe: Erstelle einen Steckbrief für, indem du verschiedene
V 1 Ableiten des Zeitgesetzes für die Reduktion von Iodat-Ionen durch Iodid-Ionen (Landolt-Reaktion)
 V 1 Ableiten des Zeitgesetzes für die Reduktion von IodatIonen durch IodidIonen (LandoltReaktion) Bei diesem Versuch soll es darum gehen, das Geschwindigkeitsgesetz für die Landoltreaktion herzuleiten.
V 1 Ableiten des Zeitgesetzes für die Reduktion von IodatIonen durch IodidIonen (LandoltReaktion) Bei diesem Versuch soll es darum gehen, das Geschwindigkeitsgesetz für die Landoltreaktion herzuleiten.
Chemisches Praktikum für TUM-BWL Praxisseminar II Grundoperationen und Reinigungstechniken
 Chemisches Praktikum für TUM-BWL Praxisseminar II Grundoperationen und Reinigungstechniken Inhalt: Wiederholung Azeotrop-Destillation Extraktion Kontinuierliche Feststoffextraktion Dr. Andreas Bauer, Dr.
Chemisches Praktikum für TUM-BWL Praxisseminar II Grundoperationen und Reinigungstechniken Inhalt: Wiederholung Azeotrop-Destillation Extraktion Kontinuierliche Feststoffextraktion Dr. Andreas Bauer, Dr.
Die Verdauung im Magen (Artikelnr.: P )
 Lehrer-/Dozentenblatt Die Verdauung im Magen (Artikelnr.: P8012800) Curriculare Themenzuordnung Fachgebiet: Biologie Bildungsstufe: Klasse 7-10 Lehrplanthema: Ernährung und Verdauung Unterthema: Verdauung
Lehrer-/Dozentenblatt Die Verdauung im Magen (Artikelnr.: P8012800) Curriculare Themenzuordnung Fachgebiet: Biologie Bildungsstufe: Klasse 7-10 Lehrplanthema: Ernährung und Verdauung Unterthema: Verdauung
Synthese eines Fruchtesters
 Synthese eines Fruchtesters 1/5 Synthese eines Fruchtesters Theorie arbonsäuren können mit Alkoholen unter Abspaltung eines Wasser-Moleküls zu arbonsäure-estern reagieren: ' ' Die Einstellung der Gleichgewichts-Lage
Synthese eines Fruchtesters 1/5 Synthese eines Fruchtesters Theorie arbonsäuren können mit Alkoholen unter Abspaltung eines Wasser-Moleküls zu arbonsäure-estern reagieren: ' ' Die Einstellung der Gleichgewichts-Lage
Eigenschaften der homologen Reihe (Artikelnr.: P )
 Lehrer-/Dozentenblatt Eigenschaften der homologen Reihe (Artikelnr.: P7172100) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Organische Chemie Unterthema: Sauerstoffhaltige
Lehrer-/Dozentenblatt Eigenschaften der homologen Reihe (Artikelnr.: P7172100) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Organische Chemie Unterthema: Sauerstoffhaltige
Versuch: Reaktion von Magnesium ( ) und Iod ( )
 Name: Datum: Station 1 Versuch: Reaktion von Magnesium ( ) und Iod ( ) Gib zunächst den Bildern mit Nummern eine sinnvolle Reihenfolge und formuliere anschließend eine Durchführung. 1 Führe den Versuch
Name: Datum: Station 1 Versuch: Reaktion von Magnesium ( ) und Iod ( ) Gib zunächst den Bildern mit Nummern eine sinnvolle Reihenfolge und formuliere anschließend eine Durchführung. 1 Führe den Versuch
7.1 Ester der Essigsäure. Aufgabe. Wie reagieren Alkansäuren mit Alkoholen? Naturwissenschaften - Chemie - Organische Chemie - 7 Ester
 Naturwissenschaften - Chemie - Organische Chemie - 7 Ester (P773000) 7. Ester der Essigsäure Experiment von: Anouch Gedruckt: 25.02.204 4:20:33 intertess (Version 3.2 B24, Export 2000) Aufgabe Aufgabe
Naturwissenschaften - Chemie - Organische Chemie - 7 Ester (P773000) 7. Ester der Essigsäure Experiment von: Anouch Gedruckt: 25.02.204 4:20:33 intertess (Version 3.2 B24, Export 2000) Aufgabe Aufgabe
Erst lesen, dann schneiden!!!
 Bauanleitung für "Dosimeter" 1 Material: 1 Digital-Thermometer, Schere, Lineal, Zirkel, schwarze Pappe, selbstklebende Alufolie, Konservendose (425 ml) ohne Boden und Deckel Erst lesen, dann schneiden!!!
Bauanleitung für "Dosimeter" 1 Material: 1 Digital-Thermometer, Schere, Lineal, Zirkel, schwarze Pappe, selbstklebende Alufolie, Konservendose (425 ml) ohne Boden und Deckel Erst lesen, dann schneiden!!!
1.14 Darstellung und Eigenschaften von Kohlensäure. Aufgabe. Welche Eigenschaften besitzt Kohlensäure?
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P758300).4 Darstellung und Eigenschaften von Kohlensäure Experiment von: Phywe Gedruckt: 5.0.203 :5:22 intertess (Version 3.06 B200, Export
Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P758300).4 Darstellung und Eigenschaften von Kohlensäure Experiment von: Phywe Gedruckt: 5.0.203 :5:22 intertess (Version 3.06 B200, Export
Trennverfahren (c) by Gerald Trutschl
 Trennverfahren (c) by Gerald Trutschl Inhalt Einteilung der Materie Homogene vs. Heterogene Gemische Trennverfahren Materie Materie by GT Gemische Reinstoffe heterogene Elemente homogene Verbindungen Gemische
Trennverfahren (c) by Gerald Trutschl Inhalt Einteilung der Materie Homogene vs. Heterogene Gemische Trennverfahren Materie Materie by GT Gemische Reinstoffe heterogene Elemente homogene Verbindungen Gemische
Abflussreiniger. Eine chemische Untersuchung. 1. Die Bestandteile des Abflussreinigers. Material: Chemikalien: Durchführung:
 Abflussreiniger Eine chemische Untersuchung 1. Die Bestandteile des Abflussreinigers 8 Uhrgläser (mind. 5 cm) Abflussreiniger 3 Spatel Indikatorpapier 3 Pinzetten Haare, Wollreste, etc. 2 Reagenzgläser,
Abflussreiniger Eine chemische Untersuchung 1. Die Bestandteile des Abflussreinigers 8 Uhrgläser (mind. 5 cm) Abflussreiniger 3 Spatel Indikatorpapier 3 Pinzetten Haare, Wollreste, etc. 2 Reagenzgläser,
Schmelzpunktserniedrigung und Siedepunktserhöhung
 Lehrer-/Dozentenblatt Schmelzpunktserniedrigung und Siedepunktserhöhung Aufgabe und Material Lehrerinformationen Lernziele Lösungen haben einen höheren Siedepunkt und einen niedrigeren Schmelzpunkt als
Lehrer-/Dozentenblatt Schmelzpunktserniedrigung und Siedepunktserhöhung Aufgabe und Material Lehrerinformationen Lernziele Lösungen haben einen höheren Siedepunkt und einen niedrigeren Schmelzpunkt als
Umschmelzen und Tiefziehen von Polystyrol
 Umschmelzen und Tiefziehen von Heißluftgebläse, Keramiknetz, Tiegelzange, Saugflasche mit Gummiring, Glasfritte, Wasserstrahlpumpe, Stativ mit Muffe und Klammer Joghurtbecher aus (PS) Schutzbrille! Das
Umschmelzen und Tiefziehen von Heißluftgebläse, Keramiknetz, Tiegelzange, Saugflasche mit Gummiring, Glasfritte, Wasserstrahlpumpe, Stativ mit Muffe und Klammer Joghurtbecher aus (PS) Schutzbrille! Das
SV: Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration
 SV: Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration Der Versuch sollte mindestens zu zweit oder in einer Gruppe durchgeführt werden, damit die Messung so genau wie möglich erfolgt. Als
SV: Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration Der Versuch sollte mindestens zu zweit oder in einer Gruppe durchgeführt werden, damit die Messung so genau wie möglich erfolgt. Als
