Michael Maiworm Themenheft. Chemie. Einfache chemische Reaktionen. Arbeitsblätter für den deutschsprachigen Fachunterricht an Auslandsschulen
|
|
|
- Marcus Kopp
- vor 7 Jahren
- Abrufe
Transkript
1 Michael Maiworm Themenheft Chemie Einfache chemische Reaktionen Arbeitsblätter für den deutschsprachigen Fachunterricht an Auslandsschulen
2 Inhaltsverzeichnis Blatt 1: Wir erhitzen ein Gemisch aus Eisen und Schwefel Blatt 2: Was passiert bei einer chemischen Reaktion? Blatt 3: Wann beginnt eine chemische Reaktion? Blatt 4: Analyse und Synthese Blatt 5: Sprachübung: Analyse und Synthese Blatt 6: Die Einteilung der Stoffe Blatt 7: Ein Element zwei Stoffe Blatt 8: Die Verbrennung von Eisen beobachten und vermuten Blatt 9: Luft und Verbrennung Blatt 10: Luft und Oxidation Blatt 11: Metalle reagieren verschieden mit Sauerstoff Blatt 12: Schutz vor Oxidationen Blatt 13: Oxidation und Reduktion (Teil 1) Blatt 14: Oxidation und Reduktion (Teil 2) Blatt 15: Die Reduktionsstärke der Metalle Blatt 16: Das Thermit - Verfahren Blatt 17: Sprachübung: Oxidation und Reduktion Blatt 18-21: Nun rate mal Blatt 22/ 23: Wortliste einfache chemische Reaktionen Grundkonzeption, Layout und Herausgeber Michael Maiworm Deutsche Schule Mexiko-Stadt (Xochimilco) Autor Michael Maiworm Zeichnungen und Fotos José Antonio Arean Álvarez Michael Maiworm Das Werk und seine Teile sind urheberrechtlich geschützt. Die öffentliche Zugänglichmachung eines für den Unterrichtsgebrauch an Schulen bestimmten Werkes ist stets nur mit Einwilligung des Berechtigten zulässig ( 52a, Abs. 2 UrhG). Diese Regelung betrifft auch das Kopieren von Einzelseiten.
3 Chemie einfache chemische Reaktionen, Blatt 1 Wir erhitzen ein Gemisch aus Eisen und Schwefel 1. Bringe in die Satzteile in die richtige Reihenfolge. Durchführung: (mit einem Stück Glaswolle., in die nichtleuchtende Flamme des Gasbrenners., Zuerst geben wir das Gemisch aus Eisen und Schwefel, das Reagenzglas, Anschließend halten wir das Reagenzglas, Dann verschließen wir, in ein Reagenzglas.) 2. Beschreibe deine Beobachtungen. Vor dem Erhitzen Beim Erhitzen Nach dem Erhitzen 3. Fülle die Tabelle aus. Eigenschaften Eisen Schwefel Stoff nach dem Erhitzen Farbe Verformbarkeit Magnetismus Elektrische Leitfähigkeit 4. Setze die Wörter in die Lücken ein. Ergebnis: Wenn wir erhitzen, dann entsteht ein. Der neue Stoff hat als das Eisen und der Schwefel. Wenn sich die Stoffe, dann findet eine statt. Wir nennen Eisensulfid. (Setze ein: neuer Stoff, umwandeln, den neuen Stoff, ein Gemisch aus Eisen und Schwefel, chemische Reaktion, andere Eigenschaften)
4 Chemie einfache chemische Reaktionen, Blatt 2 Was passiert bei einer chemischen Reaktion? Findest du auch, dass rechts sehr viele Sätze zu einer einzigen chemischen Reaktion stehen? Du kannst die Vorgänge bei einer chemischen Reaktion viel kürzer aufschreiben. Diese Schreibweise heißt Reaktionsschema (-s Reaktionsschema, -s). Im Reaktionsschema stehen links die Stoffe, die miteinander reagieren. Wir nennen sie Edukte (-s Edukt, -e). Wenn du ein Gemisch aus Kupfer und Schwefel erhitzt, dann glühen die Stoffe auf. Es gibt eine chemische Reaktion. Dabei entsteht ein neuer Stoff. Wir nennen diesen Stoff Kupfersulfid. Rechts stehen die neuen Stoffe. Wir nennen sie Produkte (-s Produkt, -e). Dazwischen zeichnest du den Reaktionspfeil (-r Reaktionspfeil, -e). Du sprichst den Pfeil aus als reagieren zu. Du darfst kein Gleichheitszeichen (wie in der Mathematik) schreiben, weil die Edukte und die Produkte verschieden sind. Edukte chemische Reaktion Produkt(e) Kupfer und Schwefel reagieren zu Kupfersulfid Reaktionsschema: Kupfer + Schwefel Kupfersulfid Teilchenmodell: + Ergänze den Text. In unserem Teilchenmodell besteht Kupfer aus und Schwefel aus. Bei einer chemischen Reaktion werden keine Teilchen und keine Teilchen. Die Kupferteilchen und die Schwefelteilchen und neu an. Der neue Stoff besteht also aus den gleichen Kupferteilchen und Schwefelteilchen, die sich neu geordnet haben. (Setze ein: produziert, trennen sich, kugelförmigen Schwefelteilchen, zerstört, kugelförmigen Kupferteilchen, ordnen sich)
5 Chemie einfache chemische Reaktionen, Blatt 3 Wann beginnt eine chemische Reaktion? 1. Ergänze den Text. Bilde dabei den richtigen Fall aus den vorgegebenen Wörtern. Ein Gemisch aus Eisen und Schwefel reagiert nicht von alleine. Erst wenn du (-s Stoffgemisch, -e) mit (-r Gasbrenner, -) erhitzt, dann beginnt (-e chemische Reaktion, -en). Die Energie (-r Gasbrenner, -) löst die Reaktion aus. Die Chemiker sagen: man muss (-s Stoffgemisch, -e) Energie zufügen, damit die Reaktion beginnt. Diese Energie nennen wir Aktivierungsenergie (-e Aktivierungsenergie, -n). Wenn du genügend Aktivierungsenergie zugefügt hast, dann läuft (-e chemische Reaktion, en) von alleine ab. Das Gemisch aus Eisen und Schwefel glüht weiter, auch wenn du (-r Gasbrenner, -) entfernst. Bei dieser chemischen Reaktion entstehen Licht und Wärme. Eine Reaktion, bei der Wärme abgegeben wird, nennen die Chemiker exotherme Reaktion. Der neue Stoff (Eisensulfid) hat weniger Energie als (-s Stoffgemisch, -e) aus Eisen und Schwefel. 2. Beschreibe, was an den Punkten 1 5 passiert. Ordne dazu die Satzteile richtig an. Du kannst Satzteile mehrfach verwenden
6 Chemie einfache chemische Reaktionen, Blatt 4 Analyse und Synthese Die Reaktion von Eisen mit Schwefel Die Zerlegung von Wasser Wasserstoff Wasser Sauerstoff Reaktionsschema: Reaktionsschema: Edukte Produkt Edukt Produkte Eisen + Schwefel Wasser + Bei dieser Reaktion werden zu einem neuen Stoff. Diese Reaktion nennen wir Bei dieser Reaktion wird in seine Bestandteile. Diese Reaktion nennen wir Analyse (-e Analyse, -n). Synthese (-e Synthese, -n). Bei dieser Reaktion wird Energie. Das Produkt (Eisensulfid) hat Energie als die Edukte (Eisen und Schwefel). Eine Reaktion, bei der (Wärme)energie entsteht, nennen wir exotherme Reaktion (-e exotherme Reaktion, -en). Bei dieser Reaktion wird Energie. Die Produkte (Wasserstoff und Sauerstoff) haben Energie als das Edukt (Wasser). Eine Reaktion, bei der Energie benötigt wird, nennen wir endotherme Reaktion (-e endotherme Reaktion, -en). (setze ein: abgegeben, zwei Stoffe, weniger, zusammen gefügt) (Setze die fehlenden Wörter ein. Dazu musst du die Antonyme zu den Wörtern links finden)
7 Chemie einfache chemische Reaktionen, Blatt 5 Sprachübung: Analyse und Synthese 1. Bringe die folgenden Satzteile von Synthese und Analyse in die richtige Reihenfolge. Synthese: zu einer Verbindung. / Dabei werden die Teilchen / Die Synthese ist / aus den Teilchen der Elemente / aus denen die Elemente bestehen / die Bildung eines neuen Stoffes aus zwei anderen Stoffen. / neu miteinander verbunden. / Bei diesem Vorgang reagieren zwei Elemente / die miteinander reagiert haben. / Die neue Verbindung besteht Synthese: Analyse: aus denen die Verbindung besteht / Dabei reagiert eine Verbindung / in zwei andere Stoffe getrennt. / Die gleichen Teilchen verbinden sich wieder miteinander / Bei einer Analyse wird ein Stoff / trennen sich. / so dass Elemente entstehen. / zu zwei Elementen. / Die verschiedenen Teilchen Analyse: 2. Setze das Verb im Perfekt richtig ein: reagieren: Die beiden Stoffe. abgeben: Das Wasser den Sauerstoff. aufnehmen: Das Eisen den Sauerstoff. glühen: Das Stoffgemisch im Reagenzglas. sich verändern: Die Eigenschaften des Stoffes. sich bilden: Bei der Reaktion zwei Produkte.
8 A l le S t o f f e Setze folgende Wörter in die Tabelle ein. Bilde dabei immer den Plural. -r Rauch, -s Stoffgemisch, -e Lösung, -s Element, -e Suspension, -r Reinstoff, -s homogene Gemisch, -e Emulsion, -s Metall, -s Gasgemisch, -r Nebel, -s heterogene Gemisch, -e Verbindung, -s Feststoffgemisch, -s Nichtmetall Chemie einfache chemische Reaktionen, Blatt 6 Die Einteilung der Stoffe
9 Chemie einfache chemische Reaktionen, Blatt 7 Ein Element - zwei Stoffe Anschließend schütten wir die Eigenschaften in ein Reagenzglas. Zuerst untersuchen wir das Reagenzglas in kaltes Wasser. Zuletzt erhitzen wir den flüssigen Schwefel des kalten Schwefels. Dann geben wir etwas festen Schwefel mit dem Gasbrenner. 1. Beschreibe den Versuch. Bringe dazu die Satzteile in die richtige Reihenfolge Ergänze den Text. Der Schwefel, den du kennst, ist ein fester, Stoff. Wenn wir aber heißen, flüssigen Schwefel schnell (z. B. in kaltem Wasser), dann bildet sich des Schwefels. Dieser Schwefel ist. Wir können ihn verformen. Wir haben plastischen Schwefel. Beide Formen des Schwefels sind aus Schwefelteilchen aufgebaut. Aber die Schwefelteilchen sind in beiden Formen angeordnet. Es gibt mehrere Elemente, in denen die kleinsten Teilchen unterschiedlich angeordnet sein können. Es bleibt das gleiche Element, nur die Eigenschaften der Stoffe sind verschieden. Die Eigenschaften eines Feststoffs sind nicht nur von der Art der kleinsten Teilchen abhängig. Die Eigenschaften eines Stoffes sind auch von der Anordnung der kleinsten Teilchen abhängig. Verschiedene Formen eines Elements oder einer Verbindung nennt man Modifikationen (-e Modifikation, -en). (Setze ein: den gleichen, eine andere Form, gelber, plastisch, dunkelgelb, verschieden, abkühlen)
10 Chemie einfache chemische Reaktionen, Blatt 8 Die Verbrennung von Eisen beobachten und vermuten 1. Beschreibe den Versuch. Benutze die Wörter in der angegebenen Reihenfolge. (geben, -e Eisenwolle, -e Waage) (bringen, -e Waage, -s Gleichgewicht) (erhitzen, -e Eisenwolle, eine Seite) 2. Was beobachtest du bei diesem Versuch? Formuliere deine Beobachtungen ohne Hilfen. 3. Stelle verschiedene Vermutungen auf, die deine Beobachtungen erklären könnten. Formuliere ohne Hilfen. Ich vermute, dass bei diesem Versuch _ Ich vermute, dass bei diesem Versuch Ich vermute, dass bei diesem Versuch
11 Chemie einfache chemische Reaktionen, Blatt 9 Luft und Verbrennung Erstelle das Versuchsprotokoll. Geräte und Chemikalien: 1: 2.: 3: 4.: 5: 6.: Durchführung: (Benutze die Wörter in der angegebenen Reihenfolge). (Zuerst geben -e Eisenwolle -s Glasrohr. Dann geben 100 ml Luft -r Kolbenprober. Anschließend erhitzen -e Eisenwolle. Dabei leiten -e Luft -e Eisenwolle.) Beobachtung: (Formuliere ohne Hilfen). Ergebnis: Vergleiche das Diagramm rechts mit deinen Beobachtungen. Mit welchem Bestandteil der Luft hat das Eisen reagiert? Begründe deine Antwort! Die Zusammensetzung der Luft 80% 70% 60% 50% 40% 30% 20% 10% 0% Stickstoff Sauerstoff Edelgase
12 Chemie einfache chemische Reaktionen, Blatt Ergänze den Text. Luft und Oxidation Wenn ein (z. B. Eisen) verbrennt, dann reagiert es nur der Luft. Dieser Teil der Luft ist das Gas. Verbrennt Eisen, dann entsteht aus Eisen und Sauerstoff. Wir nennen diese Verbindung Eisenoxid. Auch andere Stoffe reagieren mit Sauerstoff: Verbrennt Zink, dann bildet sich, verbrennt, dann bildet sich Schwefeldioxid. Die Silbe oxid kannst du vom lateinischen Wort für Sauerstoff (= oxigenium) herleiten. Eine Reaktion mit Sauerstoff nennen wir Oxidation (-e Oxidation, -en). Bei einer Oxidation bildet sich ein Oxid (-s Oxid, -e). (Setze ein: eine Verbindung, Schwefel, mit einem Teil, Sauerstoff, Zinkoxid, Metall) 2. Ergänze das Reaktionsschema: Kupfer + Sauerstoff + + Schwefeldioxid Die Eigenschaften der Luftbestandteile Stickstoff ist geruchlos-, geschmacklos und farblos. Dieses Gas brennt nicht und es unterhält die Verbrennung auch nicht. Stickstoff hat eine Dichte von 1,25 g/l. Alle Lebewesen brauchen Verbindungen mit Stickstoff. Nur wenige Lebewesen können den Stickstoff direkt aus der Luft nutzen. Die Pflanzen nehmen Stickstoffverbindungen mit den Wurzeln aus dem Boden auf, die Menschen und die Tiere nehmen die Stickstoffverbindungen mit der Nahrung auf. Flüssiger Stickstoff ist sehr kalt. Lebensmittel werden damit in kürzester Zeit tief gefroren und haltbar gemacht. In der Medizin werden sogar Organe darin aufbewahrt. Sauerstoff ist ein farbloses, geruchloses und geschmackloses Gas. Wir können den Sauerstoff mit den Sinnesorganen nicht wahrnehmen. Sauerstoff hat eine Dichte von 1,33 g/l, sie ist etwas größer als die von Luft (1,19 g/l). Sauerstoff ist selbst nicht brennbar, unterhält jedoch die Verbrennung. Man nutzt diese Eigenschaft aus, um den Sauerstoff nachzuweisen: Wenn du einen glühenden Holzspan in Sauerstoff hältst, dann brennt mit heller Flamme. Wir nenne diese Methode Glimmspanprobe (-e Glimmspanprobe, -n). Die Menschen und die Tiere brauchen den Sauerstoff zum Atmen. In den Krankenhäusern wird Sauerstoff in Reinform oder mit Luft vermischt zum Beatmen verwendet. Die grünen Pflanzen hingegen produzieren Sauerstoff. Die Edelgase sind geruchlose und geschmacklose Gase. Sie sind reaktionsträge und daher nicht brennbar. Das besonders leichte Edelgas Helium (Dichte 0,18 g/l) wird zum Beispiel als Füllgas für Fesselballons oder Zeppeline verwendet. Die Edelgase Neon und Argon leuchten mithilfe des elektrischen Stromes. Deshalb benutzt man diese Gase zum Füllen von Leuchtstoffröhren. Wir können in der Schule die Edelgase nicht nachweisen. 3. Trage die Eigenschaften der Luftbestandteile in die Tabelle ein. Stickstoff Sauerstoff Edelgase (z. B. Helium) Farbe Geruch Dichte Brennbarkeit Nachweis durch
13 Chemie einfache chemische Reaktionen, Blatt 11 Metalle reagieren verschieden mit Sauerstoff Wenn du nacheinander verschiedene Metallpulver in die Flamme des Gasbrenners gibst, dann beobachtest du unterschiedlich heftig Reaktionen. Einige Metalle reagieren heftig mit Sauerstoff, andere Metalle reagieren schwach mit Sauerstoff (siehe Bild rechts). Wir sagen: Die Metalle haben ein unterschiedliches Bindungsbestreben zu Sauerstoff (-s Bindungsbestreben, -). Wenn ein Metall ein großes Bindungsbestreben zu Sauerstoff hat, dann reagiert es heftig mit Sauerstoff. Die Beobachtungen bei diesem Versuch siehst du in der Tabelle rechts unten. Je heller das Metall bei der Reaktion mit Sauerstoff in der Flamme leuchtet, desto größer ist sein Bindungsbestreben zu Sauerstoff. Wir sagen auch: Unedle Metalle reagieren heftig mit Sauerstoff. Edle Metalle reagieren schwach (oder nicht) mit Sauerstoff. ein Metallpulver -e Brennerflamme -r Gasbrenner 1. Aufgabe: Mache den Versuch und trage die fehlenden Beobachtungen in die Tabelle ein. Metalle in der Brennerflamme Metall Wie verhält sich das Metall in der Brennerflamme? 2. Aufgabe: Erstelle die zwei Merksätze aus den Satzteilen: Aluminium Eisen Magnesium Kupfer Silber Zink Gold Platin leuchtet hell weiß leuchtet nicht, das Metall schmilzt nur leuchtet nicht, schmilzt nicht leuchtet nicht, schmilzt nicht 3. Aufgabe: Trage die Metalle in der richtigen Reihenfolge die Kästchen ein. großes Bindungsbestreben kleines Bindungsbestreben Das Bindungsbestreben zu Sauerstoff nimmt ab. unedle Metalle edle Metalle
14 Chemie einfache chemische Reaktionen, Blatt 12 Schutz vor Oxidationen 1. Lies den Text sorgfältig durch. 2. Markiere im Text die Sinnabschnitte (durch horizontale Linien). 3. Schreibe die wichtigen Wörter aus jedem Sinnabschnitt in die mittlere Spalte. 4. Entwickle eigene Merksätze zu jedem Sinnabschnitt. Schreibe diese Sätze in die rechte Spalte. Text Wichtige Wörter Merksätze Wenn ein Metall längere Zeit an der Luft liegt oder unter Wasser ist, dann kann sich das Metall verändern. An der Oberfläche des Metalls bildet sich ein Oxid. Häufig sagt man dann: Das Metall rostet. Meistens ist das ein Nachteil für das Metall. Bei einigen Metallen ist das Rosten aber auch ein Vorteil. Aluminium: Beim Aluminium schützt die Schicht aus Aluminiumoxid das Metall. Das Aluminiumoxid auf dem Aluminium ist so fest, dass keine Luft mehr eindringen kann. Dadurch wird das darunter liegende Metall vor weiterem Oxidieren geschützt. Die Oxidschicht des Kupfers ist eigentlich schwarz. Wenn aber Kupfer längere Zeit an der feuchten Luft liegt, und dabei andere Stoffe aus der Luft (z. B. Kohlenstoffdioxid oder Schadstoffe aus Industriebetrieben) dazu kommen, dann entsteht an der Oberfläche des Kupfers die grüne Patina. Viele Menschen lieben diese Farbe bei antiken Gegenständen, weil sie ein Zeichen für das Alter des Gegenstands ist. Wenn das Eisen an der Luft oxidiert, dann können große Schäden entstehen. Ungefähr ein Drittel des Eisens, das im Jahr gewonnen wird, wird durch das Rosten zerstört. Das sind etwa 300 Millionen Tonnen Eisen - so viel, wie in 333 Millionen Autos enthalten sind - eine unvorstellbar große Menge! Rost (Eisenoxid) ist durchlässig für Gase und Flüssigkeiten. Luft und Feuchtigkeit können durch die Rostschicht des Eisens dringen und auch das darunter liegende Eisen zerstören. Das geht so lange, bis das gesamte Eisen verrostet ist. Um das Rosten zu verhindern, muss man die Oberfläche von Gegenständen aus Eisen schützen. Man kann den Gegenstand mit einem Lack anstreichen, mit einer Schicht aus Plastik überziehen, oder den Gegenstand mit einem anderen Metall (z. B. Chrom) überziehen. Wörterbuch rosten: oxidarse -r Nachteil, -e: la desventaja -r Vorteil, -e: la ventaja -e Schicht, -en: la capa, la película eindringen: penetrar schützen: proteger -r Schadstoff:,e: la sustancia nociva -r (Industrie)betrieb, -e: la empresa (industial) Überziehen mit: cubrir con una capa de
15 Chemie einfache chemische Reaktionen, Blatt 13 Oxidation und Reduktion (Teil 1) Bei den Experimenten versuchst du, die Verbindung Eisenoxid in die Elemente Eisen und Sauerstoff zu zerlegen. 1. Versuch: Wir erhitzen das Eisenoxid. (Beschreibe den Versuch und die Beobachtungen. Verwende die Worthilfen). Durchführung: (erhitzen, -s Eisenoxid, -s Reagenzglas, -r Gasbrenner) Beobachtung: Durchführung: (nach dem Erhitzen, halten, -r Magnet, -s Produkt) Beobachtung: 2. Versuch: Wir geben ein Metall mit einem großen Bindungsbestreben zu Sauerstoff zum Eisenoxid und erhitzen das Gemisch. (Beschreibe den Versuch und die Beobachtungen. Verwende die Worthilfen). Durchführung: (mischen, -s Eisenoxid, -s Zinkpulver. Erhitzen, -s Gemisch, -r Gasbrenner) Beobachtung: Durchführung: (Nach dem Erhitzen, halten, -r Magnet, -s Produkt) Beobachtung:
16 Chemie einfache chemische Reaktionen, Blatt Ergänze den Text: Dekliniere dazu die Substantive. Oxidation und Reduktion (Teil 2) Wenn wir (-s Gemisch, -e) aus Eisenoxid und Zink erhitzen, dann können wir nach (-e Reaktion, -en) das Element Eisen mit (-r Magnet, -e) nachweisen. Das Eisenoxid hat also (-r Sauerstoff) abgegeben. Wenn bei einer chemischen Reaktion Sauerstoff abgegeben wird, dann sprechen wir von einer Reduktion (-e Reduktion, -en). Gleichzeitig hat (-s Zink) den Sauerstoff aufgenommen. Wenn bei einer chemischen Reaktion Sauerstoff aufgenommen wird, sprechen wir von einer Oxidation (-e Oxidation, -en). Bei dieser Reaktion gibt es gleichzeitig eine Reduktion und eine Oxidation. Wir könnten diese Reaktion Reduktions- Oxidations-Reaktion nennen. Weil dieses Wort zu lang ist, sprechen die Chemiker von einer Redox-Reaktion. Das Zink hat (-s Eisenoxid) (-r Sauerstoff) entzogen. Das Zink hat das Eisenoxid reduziert. Zink ist ein Reduktionsmittel. Stoffe, die einen anderen Stoff reduzieren, heißen Reduktionsmittel (-s Reduktionsmittel, -). Das Eisenoxid hat (-r Sauerstoff) an (-s Zink) abgegeben. Das Eisenoxid hat das Zink oxidiert. Eisenoxid ist ein Oxidationsmittel. Stoffe, die einen anderen Stoff oxidieren, heißen Oxidationsmittel (-s Oxidationsmittel, -). 4. Schreibe die Begriffe Oxidation, Reduktion, Oxidationsmittel und Reduktionsmittel an das Reaktionsschema. Eisenoxid + Zink Eisen + Zinkoxid - mittel - mittel
17 Chemie einfache chemische Reaktionen, Blatt 15 Die Reduktionsstärke der Metalle Das Eisenoxid ist eine Verbindung aus den Elementen Eisen und Sauerstoff. Du hast in den Versuchen im Unterricht gesehen, dass einige Metalle das Eisenoxid reduzieren können. Nur die Metalle, die ein größeres Bindungsbestreben zu Sauerstoff als das Eisen haben, reduzieren das Eisenoxid. 1. Entwickle einen allgemein gültigen Merksatz. Benutze dabei das Wortpuzzle. durch die Elemente haben reduziert, als das Metall die ein Ein Metalloxid zu Sauerstoff größeres Bindungsbestreben wird 2. Schreibe dazu das allgemeine Reaktionsschema auf. Metall(1)oxid + Metall(2) + 3. Ergänze die Texte. + keine Reaktion Eisenoxid Kupfer Das Kupfer hat ein Bindungsbestreben zu _ als das. Es gibt Reaktion zwischen Kupfer und Eisenoxid. + + Eisenoxid Magnesium Magnesiumoxid Eisen Das Magnesium hat ein Bindungsbestreben zu _ als das. Es gibt Reaktion zwischen Magnesium und Eisenoxid.
18 Chemie einfache chemische Reaktionen, Blatt Beschrifte die Teile: Das Thermit - Verfahren Ergänze das Reaktionsschema. Eisenoxid + Aluminium Eisen + Aluminiumoxid - mittel - mittel 3. Ergänze den Text. Aluminium hat ein Bindungsbestreben zu Sauerstoff als Eisen. Deshalb kann das Aluminium dem Eisenoxid den entziehen. Es findet eine _ Reaktion statt. Bei dieser Reaktion entsteht _ Eisen, das eine Temperatur von mehr als 2000 C hat. Dieses Eisen benutzt man, um Schienen miteinander zu. Das flüssige Eisen fließt in eine zwischen den Schienen. Dort wird das flüssige Eisen wieder, und die Schienen sind miteinander verbunden. Dieses Verfahren nennt man Thermit-Verfahren (-s Thermit- Verfahren). (Setze ein: flüssiges, exotherme, fest, verbinden, Lücke, größeres, Sauerstoff)
19 Chemie einfache chemische Reaktionen, Blatt 17 Sprachübung: Oxidation und Reduktion 1. Setze das Verb im Perfekt richtig ein: reagieren: Die beiden Stoffe. sich verändern: Die Eigenschaften des Stoffes. sich bilden: Bei der Reaktion zwei Produkte. abgeben: Das Oxidationsmittel den Sauerstoff. glühen: Das Stoffgemisch im Reagenzglas. aufnehmen: Das Reduktionsmittel den Sauerstoff. 2. Ergänze den Text. Verwende die Wörter aus der Wortliste im Anhang. Bei einer Oxidation ein Stoff den Sauerstoff. Bei einer Reduktion ein Stoff den Sauerstoff. Die Kombination dieser beiden Reaktionen nennt man. Der Stoff, der den anderen Stoff ist das. Er wird dabei selbst. Der Stoff, der den anderen Stoff, ist das. Er wird dabei selbst. Häufig Redoxreaktionen Energie an die Umgebung. Es sind also Reaktionen. 3. Beschreibe die folgende Reaktion mit einem kurzen Text. Verwende dazu die angegebenen Wörter. Du musst einige Wörter mehrfach verwenden. Kupferoxid + Magnesium Kupfer + Magnesiumoxid Setze ein:: reagieren zu, oxidiert werden, reduziert werden, Sauerstoff abgeben, Sauerstoff aufnehmen -s Kupferoxid, -s Magnesium, -s Kupfer, -s Magnesiumoxid, -s Oxidationsmittel, -s Reduktionsmittel
20 Chemie einfache chemische Reaktionen, Blatt 18 Nun rate mal 1. Löse das Rätsel und finde das Lösungswort Wasser ist ein Beispiel für eine Reaktionen, bei denen man immer Energie zugeben muss, nennt man Redoxreaktionen sind Reaktionen mit... (Element) 4. Stoffe, die auf der linken Seite des Reaktionspfeils stehen, nennt man Bei einer... bildet sich eine Verbindung. 6. Bei einer... nimmt ein Stoff Sauerstoff auf. 7. Reaktionen, die Energie an die Umgebung abgeben, nennt man Bei einer... trennt man eine Verbindung ist ein Beispiel für ein Metall. 10. Stoffe, die auf der rechten Seite des Reaktionspfeils stehen, nennt man Die Verbrennung ist eine Reaktion, bei der man... sieht. 12. Bei einer... gibt ein Stoff Sauerstoff ab. 13. Magnesium reagiert mit Sauerstoff zu Magnesium Schwefel ist ein Beispiel für ein...
21 Chemie einfache chemische Reaktionen, Blatt Finde die Wörter aus der Vokabelliste, die in den Buchstaben versteckt sind (z. B. das Wort Dichte ). Tipp: Es haben sich 8 Substantive versteckt. A Ü N L W W M B E G A E H U B Ö Ä M Y C V B E I L G A S B R E N N E R G P E W L H Z F D C B S E O G Z I S O E B F S T N N E H C L I E T A N A S C S N K K T P K Z G D R C E S M E T A L L E C R H J T L I M N Q A E N E A Q A S T O F F X O I N F Y N A E L T B M M D E T N D V Z E T H C I D L H 3. Die Buchstaben in den folgenden Wörtern sind durcheinander geraten. Ordne du die Buchstaben so, dass sich sinnvolle Wörter ergeben. (Beispiel: Nitrokea = Reaktion). a. Dutek: b. Sylanea: c. Remthit: d. merthoxe: e. Tupdor: f. Kfostistf: g. Binlommsprepag: h. Mecehi:
22 Chemie einfache chemische Reaktionen, Blatt Schneide die Kärtchen aus und spiele mit einem Mitschüler damit Domino. Dabei müssen der Name und das Bild immer zusammenpassen. das Reagenzglas das Becherglas der Kolben die Reagenzglasklammer die Abdampfschale das Uhrglas die Tiegelzange der Dreifuß
23 Chemie einfache chemische Reaktionen, Blatt 21 das Drahtnetz die Doppelmuffe der Gasbrenner der Spatel der Trichter das Glasrohr der Stopfen das Stativ die Schutzbrille der Schutzkittel
24 Chemie einfache chemische Reaktionen, Blatt 22 Wortliste einfache chemische Reaktionen (Secundaria) Die Substantive los sustantivos -e Aktivierungsenergie, -n: la energía de activación Die Aktivierungsenergie müssen wir bei jeder Reak tion am Anfang zugeben. -e Analyse, -n: el análisis Bei einer Analyse trennen wir eine Verbindung. -s Edukt, -e: el educto Die Edukte stehen auf der linken Seite des Reaktionspfeiles. -s Element, -e: el elemento Der Sauerstoff ist ein Element. -e endotherme Reaktion, -n: la reacción endotérmica Bei einer endothermen Reaktion müssen wir Energie zugeben. -e exotherme Reaktion, -n: la reacción exotérmica Eine exotherme Reaktion gibt Energie ab. -e Oxidation, -en: la oxidación Bei einer Oxidation nimmt ein Stoff Sauerstoff auf. -s Oxidationsmittel, -: el agente oxidante Ein Oxidationsmittel oxidiert einen anderen Stoff. -s Produkt, -e: el producto Die Produkte stehen auf der rechten Seite des Reaktionspfeiles -r Reaktionspfeil, -e: la flecha de reacción Die Produkte stehen auf der rechten Seite des Reaktionspfeiles. -s Reaktionsschema, -s: la ecuación chímica Im Reaktionsschema schreiben wir erst die Edukte, den Reaktionspfeil und dann die Produkte. -e Redoxreaktion, -en: la reacción redox Eine Reaktion mit einer Oxidation und einer Reduktion nennen wir Redoxreaktion. -e Reduktion, -en: la reducción Bei einer Reduktion gibt ein Stoff Sauerstoff ab. -s Reduktionsmittel, -: el agente reductor Ein Reduktionsmittel reduziert einen anderen Stoff. -e Synthese, -n: la síntesis Bei einer Synthese bildet sich eine Verbindung. -e Verbindung, -en: el compuesto Wasser ist eine Verbindung. -e Verbrennung, -en: la combustión Bei einer Verbrennung reagiert ein Stoff mit Sauerstoff. Die Verben los verbos ab/geben (+Akk.) dar, perder Die Verbindung gibt den Sauerstoff ab. gab ab Die Verbindung gab den Sauerstoff ab. hat abgegeben Die Verbindung hat den Sauerstoff abgegeben. auf/nehmen (+Akk.) recibir Das Element nimmt den Sauerstoff auf. nahm auf Das Element nahm den Sauerstoff auf. hat aufgenommen Das Element hat den Sauerstoff aufgenommen. befestigen (+ Akk.,+ Dat.) fijar, sujetar Wir befestigen das Glasrohr am Stativ. befestigte Ich befestigte das Glasrohr am Stativ. hat befestigt Sie hat das Glasrohr am Stativ befestigt. sich bilden formarse, obtenerse Bei der Reaktion bildet sich ein neuer Stoff. bildete sich Bei der Reaktion bildete sich ein neuer Stoff. hat sich gebildet Bei der Reaktion hat sich ein neuer Stoff gebildet.
25 Chemie einfache chemische Reaktionen, Blatt 23 geben (+ Akk.) añadir, agregar Wir geben den Stoff in das Reagenzglas. gab Ich gab den Stoff in das Reagenzglas. hat gegeben Sie hat den Stoff in das Reagenzglas gegeben. (zu)geben (+Dat.) añadir Wir geben zu dem Gemisch etwas Eisen. gab (zu) Ich gab zu dem Gemisch etwas Eisen. hat (zu)gegeben Sie hat zu dem Gemisch etwas Eisen gegeben. gießen (+ Akk.) echar (líquidos) Wir gießen das Wasser in den Kolben. goss Ich goss das Wasser in den Kolben. hat gegossen Sie hat das Wasser in den Kolben gegossen. glühen arder sin llama Der Holzstab glüht. glühte Der Holzstab glühte. hat geglüht Der Holzstab hat geglüht. legen (+ Akk.) colocar, poner Wir legen das Drahtnetz auf den Dreifuß. legte Ich legte das Drahtnetz auf den Dreifuß. hat gelegt Sie hat das Drahtnetz auf den Dreifuß gelegt. oxidieren (+Akk.) oxidar Das Oxidationsmittel oxidiert einen anderen Stoff. oxidierte Das Oxidationsmittel oxidierte einen anderen Stoff. hat oxidiert Das Oxidationsmittel hat einen anderen Stoff oxidiert. oxidiert werden (Passiv) Der Stoff wird oxidiert. wurde oxidiert Der Stoff wurde oxidiert. ist oxidiert worden Der Stoff ist oxidiert worden. reagieren reaccionar Ein Stoff reagiert mit einem anderen Stoff. reagierte Ein Stoff reagierte mit einem anderen Stoff. hat reagiert Ein Stoff hat mit einem anderen Stoff reagiert. reduzieren (+ Akk.) reducir Das Reduktionsmittel reduziert einen anderen Stoff. reduzierte Das Reduktionsmittel reduzierte einen anderen Stoff. hat reduziert Das Reduktionsmittel hat einen anderen Stoff reduziert. reduziert werden (Passiv) Der Stoff wird reduziert. wurde oxidiert Der Stoff wurde reduziert. ist oxidiert worden Der Stoff ist reduziert worden. stellen (+ Akk.) colocar, poner Wir stellen das Becherglas auf den Tisch. stellte Ich stellte das Becherglas auf den Tisch. hat gestellt Sie hat das Becherglas auf den Tisch gestellt. sich verändern cambiarse Der Stoff verändert sich bei der Reaktion. veränderte sich Der Stoff veränderte sich bei der Reaktion. hat sich verändert Der Stoff hat sich bei der Reaktion verändert. verbrennen quemar(se) Das Holz verbrennt. verbrannte Das Holz verbrannte. ist verbrannt Das Holz ist verbrannt. Die Adjektive los adjetivos fest: sólido Das Eis ist fest. flüssig: líquido Das Wasser ist flüssig. gasförmig gas Der Wasserdampf ist gasförmig.
Chemie Fragenkatalog Jahrgang 8
 Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Themenheft. Chemie. chemische Gesetze, Atombau und Formeln. Arbeitsblätter für den deutschsprachigen Fachunterricht an Auslandsschulen
 Themenheft Chemie chemische Gesetze, Atombau und Formeln Arbeitsblätter für den deutschsprachigen Fachunterricht an Auslandsschulen Inhaltsverzeichnis: Blatt 1: Die Masse bei chemischen Reaktionen Blatt
Themenheft Chemie chemische Gesetze, Atombau und Formeln Arbeitsblätter für den deutschsprachigen Fachunterricht an Auslandsschulen Inhaltsverzeichnis: Blatt 1: Die Masse bei chemischen Reaktionen Blatt
Curriculum Chemie Klasse 8 Albert-Einstein-Gymnasium Ulm
 Curriculum Chemie Klasse 8 Albert-Einstein-Gymnasium Ulm Klasse 8 Themen Experimentieren im Chemieunterricht Grundregeln des Experimentierens 5. - mit Laborgeräten sachgerecht umgehen und die Sicherheitsmaßnahmen
Curriculum Chemie Klasse 8 Albert-Einstein-Gymnasium Ulm Klasse 8 Themen Experimentieren im Chemieunterricht Grundregeln des Experimentierens 5. - mit Laborgeräten sachgerecht umgehen und die Sicherheitsmaßnahmen
1. Chemie ist da wo es stinkt und kracht Die chemische Reaktion zwischen Zucker und Kaliumnitrat
 1. Chemie ist da wo es stinkt und kracht Die chemische Reaktion zwischen Zucker und Kaliumnitrat Geräte/Chemikalien: Mörser mit Pistill, feuerfeste Unterlage, Zucker, Kaliumnitrat, Zünder: Kaliumpermanganat
1. Chemie ist da wo es stinkt und kracht Die chemische Reaktion zwischen Zucker und Kaliumnitrat Geräte/Chemikalien: Mörser mit Pistill, feuerfeste Unterlage, Zucker, Kaliumnitrat, Zünder: Kaliumpermanganat
KSO METALLE (SEKP) Skript Metalle (SekP) V1.0 04/15 Bor
 1 KSO METALLE (SEKP) Skript Metalle (SekP) V1.0 04/15 Bor 2 INHALTSVERZEICHNIS "METALLE" 1. Einleitung...03 2. Reaktionen von Metallen... 05 3. Gewinnung von Metallen... 07 4. Domino: Eigenschaften der
1 KSO METALLE (SEKP) Skript Metalle (SekP) V1.0 04/15 Bor 2 INHALTSVERZEICHNIS "METALLE" 1. Einleitung...03 2. Reaktionen von Metallen... 05 3. Gewinnung von Metallen... 07 4. Domino: Eigenschaften der
Wer spannt wem den Sauerstoff aus? Metalloxide
 1 von 24 Wer spannt wem den Sauerstoff aus? Metalloxide Ein Beitrag von Petra Frank, Tobias Frank und Dr. Hans-Peter Haseloff, Esslingen Mit Illustrationen von Julia Lenzmann, Stuttgart Foto: Colourbox
1 von 24 Wer spannt wem den Sauerstoff aus? Metalloxide Ein Beitrag von Petra Frank, Tobias Frank und Dr. Hans-Peter Haseloff, Esslingen Mit Illustrationen von Julia Lenzmann, Stuttgart Foto: Colourbox
Chemie, Kapitel 4 : Chemische Reaktionen und Luft
 Lesen Sie aufmerksam das Kapitel 4.4 und lösen Sie die folgenden Aufgaben: a) Definieren Sie die drei Begriffe in jeweils einem Satz b) Geben Sie ein Beispiel aus dem Alltag Exotherme Reaktion: Endotherme
Lesen Sie aufmerksam das Kapitel 4.4 und lösen Sie die folgenden Aufgaben: a) Definieren Sie die drei Begriffe in jeweils einem Satz b) Geben Sie ein Beispiel aus dem Alltag Exotherme Reaktion: Endotherme
Was passiert, wenn Schwefeldampf über einen heissen Kupferblechstreifen streicht?
 Posten 1a Was passiert, wenn Schwefeldampf über einen heissen Kupferblechstreifen streicht? a) es entsteht Wasserdampf (Wassertropfen kondensieren am Streifen) (=> Posten 5l) b) der Schwefeldampf wird
Posten 1a Was passiert, wenn Schwefeldampf über einen heissen Kupferblechstreifen streicht? a) es entsteht Wasserdampf (Wassertropfen kondensieren am Streifen) (=> Posten 5l) b) der Schwefeldampf wird
Modelle helfen Erscheinungen und Vorgänge zu beschreiben und Wesentliches zu erkennen, geben jedoch die Wirklichkeit nie vollständig wieder.
 I. Stoffen auf der Spur 1. Eigenschaften von Stoffen erkennen Farbe Geruch Geschmack Kristallform Klang Zustandsform 2. Eigenschaften von Stoffen ermitteln/ messen Wärmeleitfähigkeit Elektrische Leitfähigkeit
I. Stoffen auf der Spur 1. Eigenschaften von Stoffen erkennen Farbe Geruch Geschmack Kristallform Klang Zustandsform 2. Eigenschaften von Stoffen ermitteln/ messen Wärmeleitfähigkeit Elektrische Leitfähigkeit
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Wer spannt wem den Sauerstoff aus? Das komplette Material finden Sie hier:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Wer spannt wem den Sauerstoff aus? Das komplette Material finden Sie hier: School-Scout.de 2 von 24 17. Metalloxide (Kl. 8/9) Stoffe
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Wer spannt wem den Sauerstoff aus? Das komplette Material finden Sie hier: School-Scout.de 2 von 24 17. Metalloxide (Kl. 8/9) Stoffe
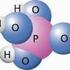
Chemische Reaktionen. Wir erzeugen Wasser
 hemische Reaktionen + Natrium + -> hlor -> Natriumchlorid = Kochsalz Wir erzeugen Wasser Die kleinsten Teilchen des Sauerstoffes und des Wasserstoffes waren im roten Ballon bereits gut durchmischt. Daher
hemische Reaktionen + Natrium + -> hlor -> Natriumchlorid = Kochsalz Wir erzeugen Wasser Die kleinsten Teilchen des Sauerstoffes und des Wasserstoffes waren im roten Ballon bereits gut durchmischt. Daher
Wovon hängt das Reaktionsverhalten der Metalle beim Erhitzen an Luft ab?
 Naturwissenschaften - Chemie - Anorganische Chemie - Metalle (P75300).2 Abhängigkeit des Reaktionsverhaltens von Metallen Experiment von: Phywe Gedruckt:.0.203 5:7:52 intertess (Version 3.06 B200, Export
Naturwissenschaften - Chemie - Anorganische Chemie - Metalle (P75300).2 Abhängigkeit des Reaktionsverhaltens von Metallen Experiment von: Phywe Gedruckt:.0.203 5:7:52 intertess (Version 3.06 B200, Export
Was kannst Du (schon)? Stoffe und Eigenschaften D
 Falte zunächst das Blatt entlang des Pfeils nach hinten. Mache Dir zunächst alleine Gedanken über Deine Fähigkeiten und kreuze an. Tausche Dich im Folgenden mit Deinem Nachbar aus bzw. falte das Blatt
Falte zunächst das Blatt entlang des Pfeils nach hinten. Mache Dir zunächst alleine Gedanken über Deine Fähigkeiten und kreuze an. Tausche Dich im Folgenden mit Deinem Nachbar aus bzw. falte das Blatt
Stoffe und ihre Eigenschaften
 Stoffe und ihre Eigenschaften 1.) Welche Stoffeigenschaften kennen Sie? Zählen Sie auf. Aussehen, Geruch, Geschmack, Verformbarkeit, elektr. LF, Magnetismus, Härte, Verhalten beim Erhitzen, Brennbarkeit;
Stoffe und ihre Eigenschaften 1.) Welche Stoffeigenschaften kennen Sie? Zählen Sie auf. Aussehen, Geruch, Geschmack, Verformbarkeit, elektr. LF, Magnetismus, Härte, Verhalten beim Erhitzen, Brennbarkeit;
Echt ätzend! - Was ist und wie wirkt Abflussreiniger?
 Echt ätzend! - Was ist und wie wirkt Abflussreiniger? Versuch 1: Zusammensetzung von festem Abflussreiniger (Analyse nach Prof. Pick ): fester Abflussreiniger (z.b. Drano Rohrfrei) Petrischale, Holzstab
Echt ätzend! - Was ist und wie wirkt Abflussreiniger? Versuch 1: Zusammensetzung von festem Abflussreiniger (Analyse nach Prof. Pick ): fester Abflussreiniger (z.b. Drano Rohrfrei) Petrischale, Holzstab
Grundwissen Chemie 8. Klasse NTG
 Grundwissen Chemie 8. Klasse NTG Reinstoff hat gleich bleibende Eigenschaften (Stoffebene) besteht aus einer Sorte gleichartiger Teilchen z.b.: dest. Wasser, Kupfer, Gold, Salz 8.1 C NTG Element sind nicht
Grundwissen Chemie 8. Klasse NTG Reinstoff hat gleich bleibende Eigenschaften (Stoffebene) besteht aus einer Sorte gleichartiger Teilchen z.b.: dest. Wasser, Kupfer, Gold, Salz 8.1 C NTG Element sind nicht
Michael Maiworm Themenheft. Chemie. Stoff und Stofftrennung. Arbeitsblätter für den deutschsprachigen Fachunterricht an Auslandsschulen
 Michael Maiworm Themenheft Chemie Stoff und Stofftrennung Arbeitsblätter für den deutschsprachigen Fachunterricht an Auslandsschulen Inhaltsverzeichnis Blatt 1: Experimente aber sicher! (Teil 1) Blatt
Michael Maiworm Themenheft Chemie Stoff und Stofftrennung Arbeitsblätter für den deutschsprachigen Fachunterricht an Auslandsschulen Inhaltsverzeichnis Blatt 1: Experimente aber sicher! (Teil 1) Blatt
Chemische Reaktionen 4. Redoxreaktionen Schritt für Schritt (Kl. 8/9) Ein Geben und Nehmen Redoxreaktionen Schritt für Schritt VORANSICHT
 V Chemische Reaktionen 4. Redoxreaktionen Schritt für Schritt (Kl. 8/9) 1 von 30 Ein Geben und Nehmen Redoxreaktionen Schritt für Schritt Tobias Dunst, Kißlegg Welche Verbindung besteht zwischen dem mysteriösen
V Chemische Reaktionen 4. Redoxreaktionen Schritt für Schritt (Kl. 8/9) 1 von 30 Ein Geben und Nehmen Redoxreaktionen Schritt für Schritt Tobias Dunst, Kißlegg Welche Verbindung besteht zwischen dem mysteriösen
4. Chemische Reaktion
 Chemie GU 9 4. Chemische Reaktion 4.1 Stoffe wandeln sich um Aus Kupfer und Schwefel entsteht ein neuer Stoff Metalle reagieren mit Schwefel zu Metallsulfiden o Edukte und Produkte Das Reaktionsschema
Chemie GU 9 4. Chemische Reaktion 4.1 Stoffe wandeln sich um Aus Kupfer und Schwefel entsteht ein neuer Stoff Metalle reagieren mit Schwefel zu Metallsulfiden o Edukte und Produkte Das Reaktionsschema
Die chemische Reaktion
 Die chemische Reaktion 1. Versuch In eine mit Sauerstoff gefüllte Flasche halten wir ein Stück brennenden Schwefel. Aus den beiden Ausgangsstoffen (Edukten) entsteht ein neuer Stoff (Produkt) mit eigenen,
Die chemische Reaktion 1. Versuch In eine mit Sauerstoff gefüllte Flasche halten wir ein Stück brennenden Schwefel. Aus den beiden Ausgangsstoffen (Edukten) entsteht ein neuer Stoff (Produkt) mit eigenen,
3.11 Zerlegung von Wasser durch Reduktionsmittel. Aufgabe. Aus welchen Elementen besteht Wasser?
 Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P755500) 3. Zerlegung von Wasser durch Reduktionsmittel Experiment von: Seb Gedruckt: 24.03.204 :42:33
Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P755500) 3. Zerlegung von Wasser durch Reduktionsmittel Experiment von: Seb Gedruckt: 24.03.204 :42:33
Untersuche die ausgegebenen Stoffe auf Brennbarkeit und Schmelztemperatur.
 Naturwissenschaften - Chemie - Allgemeine Chemie - Stoffeigenschaften (P750200).2 Stoffeigenschaften - Brennbarkeit, Schmelztemperatur Experiment von: Phywe Gedruckt: 07.2.205 :7:33 intertess (Version
Naturwissenschaften - Chemie - Allgemeine Chemie - Stoffeigenschaften (P750200).2 Stoffeigenschaften - Brennbarkeit, Schmelztemperatur Experiment von: Phywe Gedruckt: 07.2.205 :7:33 intertess (Version
1.1 Oxidation von Metallen. Aufgabe. Wie verändern sich Metalle beim Erhitzen? Naturwissenschaften - Chemie - Anorganische Chemie - 1 Metalle
 Naturwissenschaften - Chemie - Anorganische Chemie - Metalle (P753000). Oxidation von Metallen Experiment von: Phywe Gedruckt:.0.203 5:6:40 intertess (Version 3.06 B200, Export 2000) Aufgabe Aufgabe Wie
Naturwissenschaften - Chemie - Anorganische Chemie - Metalle (P753000). Oxidation von Metallen Experiment von: Phywe Gedruckt:.0.203 5:6:40 intertess (Version 3.06 B200, Export 2000) Aufgabe Aufgabe Wie
Aufgabe: Unterscheidung von Stoffen anhand von Eigenschaften
 Aufgabe: Unterscheidung von Stoffen anhand von Eigenschaften Vorbereitungen: Benötigte Materialien sind entsprechend der Anzahl an Gruppen für die Teams bereitzustellen. -Aufgabenstellung und Hinweise
Aufgabe: Unterscheidung von Stoffen anhand von Eigenschaften Vorbereitungen: Benötigte Materialien sind entsprechend der Anzahl an Gruppen für die Teams bereitzustellen. -Aufgabenstellung und Hinweise
Verbrennung einer Kerze
 Verbrennung einer Kerze Schauen wir uns zunächst die Kerze genauer an. Aus welchen Bestandteilen besteht sie? Und wozu dienen diese? Bestandteil Stoff Funktion Der Stoff ist das Material, woraus ein Körper
Verbrennung einer Kerze Schauen wir uns zunächst die Kerze genauer an. Aus welchen Bestandteilen besteht sie? Und wozu dienen diese? Bestandteil Stoff Funktion Der Stoff ist das Material, woraus ein Körper
Löschversuche mit Wasser sowie Feuchtigkeit führen zur Spaltung von Wasser und erzeugen Knallgas
 Thermit / Blatt 1 Einleitung Gegen Ende des 19. Jahrhunderts entdeckte Hans Goldschmidt in Essen die technische Gewinnung von Schwermetallen aus ihren Oxiden durch die Oxidation von Aluminium. Thermit
Thermit / Blatt 1 Einleitung Gegen Ende des 19. Jahrhunderts entdeckte Hans Goldschmidt in Essen die technische Gewinnung von Schwermetallen aus ihren Oxiden durch die Oxidation von Aluminium. Thermit
Lösungen Thema: Stoffe und ihre Eigenschaften
 Lösungen Thema: Stoffe und ihre Eigenschaften zu 1: Siedetemperatur, Schmelztemperatur, Dichte (Löslichkeit) zu 2: Brennbarkeit, Härte, Löslichkeit, Farbe, Geruch zu 3: zu 4: Bei der Flüssigkeit handelt
Lösungen Thema: Stoffe und ihre Eigenschaften zu 1: Siedetemperatur, Schmelztemperatur, Dichte (Löslichkeit) zu 2: Brennbarkeit, Härte, Löslichkeit, Farbe, Geruch zu 3: zu 4: Bei der Flüssigkeit handelt
Verbrennung einer Kerze
 Verbrennung einer Kerze Zünde eine Kerze an und notiere deine Beobachtungen: Was passiert eigentlich genau bei der Verbrennung einer Kerze? Diese Frage versuchen wir in diesem Kapitel zu beantworten. Schauen
Verbrennung einer Kerze Zünde eine Kerze an und notiere deine Beobachtungen: Was passiert eigentlich genau bei der Verbrennung einer Kerze? Diese Frage versuchen wir in diesem Kapitel zu beantworten. Schauen
Kapitel 2 Repetitionen Chemie und Werkstoffkunde. Thema 6 Oxidation und Reduktion
 BEARBEITUNGSTECHNIK REPETITONEN LÖSUNGSSATZ Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 6 Oxidation und Reduktion Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1, 8772
BEARBEITUNGSTECHNIK REPETITONEN LÖSUNGSSATZ Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 6 Oxidation und Reduktion Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1, 8772
Verbrennung von Eisenwolle und Holz
 Name: Datum: Versuch: Verbrennung von Eisenwolle und Holz Geräte: 1 Stativ 2 Muffen 2 Klemmen 1 Laborboy (hier Holzklotz) 1 Porzellanschale 1 Analysetrichter 1 Gaswaschflasche 1 Wasserstrahlpumpe 1 Gummischlauch
Name: Datum: Versuch: Verbrennung von Eisenwolle und Holz Geräte: 1 Stativ 2 Muffen 2 Klemmen 1 Laborboy (hier Holzklotz) 1 Porzellanschale 1 Analysetrichter 1 Gaswaschflasche 1 Wasserstrahlpumpe 1 Gummischlauch
Lösungen Kap. 4 Die chemische Reaktion
 Elemente Grundlagen der Chemie für Schweizer Maturitätsschulen Klett und Balmer Verlag Zug 2007 Verwendung für den Gebrauch in der eigenen Klasse gestattet Lösungen Kap. 4 Die chemische Reaktion Lösungen
Elemente Grundlagen der Chemie für Schweizer Maturitätsschulen Klett und Balmer Verlag Zug 2007 Verwendung für den Gebrauch in der eigenen Klasse gestattet Lösungen Kap. 4 Die chemische Reaktion Lösungen
TH emeneft. Klima und Klimawandel. Kohlendioxid das besondere Gas. Aufgaben:
 Kohlendioxid das besondere Gas Das Klima auf der Erde wird durch viele verschiedene Dinge bestimmt. Eine wichtige Rolle spielt dabei die Luft. Sie besteht aus einem Gemisch von unsichtbaren Gasen. Dazu
Kohlendioxid das besondere Gas Das Klima auf der Erde wird durch viele verschiedene Dinge bestimmt. Eine wichtige Rolle spielt dabei die Luft. Sie besteht aus einem Gemisch von unsichtbaren Gasen. Dazu
Chemie ist eine naturwissenschaftliche Disziplin, welche sich mit den Stoffen, den Stoffeigenschaften und den Stoffumwandlungen beschäftigt.
 1 Definition: Chemie ist eine naturwissenschaftliche Disziplin, welche sich mit den Stoffen, den Stoffeigenschaften und den Stoffumwandlungen beschäftigt. 2 Erscheinungsformen der Materie Homogen oder
1 Definition: Chemie ist eine naturwissenschaftliche Disziplin, welche sich mit den Stoffen, den Stoffeigenschaften und den Stoffumwandlungen beschäftigt. 2 Erscheinungsformen der Materie Homogen oder
Untersuche die ausgegebenen Stoffe auf Brennbarkeit und Schmelztemperatur.
 Naturwissenschaften - Chemie - Allgemeine Chemie - Stoffeigenschaften (P750200).2 Stoffeigenschaften - Brennbarkeit, Schmelztemperatur Experiment von: Phywe Gedruckt:.0.203 2:44:57 intertess (Version 3.06
Naturwissenschaften - Chemie - Allgemeine Chemie - Stoffeigenschaften (P750200).2 Stoffeigenschaften - Brennbarkeit, Schmelztemperatur Experiment von: Phywe Gedruckt:.0.203 2:44:57 intertess (Version 3.06
Klassischer Redoxbegriff
 Schulversuchspraktikum Elena von Hoff Sommersemester 2014 Klassenstufen 7&8 Klassischer Redoxbegriff (Affinitätsreihe) 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Diese Unterrichtseinheit
Schulversuchspraktikum Elena von Hoff Sommersemester 2014 Klassenstufen 7&8 Klassischer Redoxbegriff (Affinitätsreihe) 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Diese Unterrichtseinheit
Suche aus dem Schulbuch folgende Eigenschaften der beiden Metalle heraus:
 Kopiervorlage 1: Eisen und Aluminium 1. Suche aus dem Schulbuch folgende Eigenschaften der beiden Metalle heraus: Eisen Aluminium Dichte Härte Schmelzpunkt Magnetisierbarkeit 2. a) Berechne die Eisenmasse
Kopiervorlage 1: Eisen und Aluminium 1. Suche aus dem Schulbuch folgende Eigenschaften der beiden Metalle heraus: Eisen Aluminium Dichte Härte Schmelzpunkt Magnetisierbarkeit 2. a) Berechne die Eisenmasse
Die Sch. kennen die Zusammensetzung von Luft und können die verschiedenen Gase per Formel benennen.
 Anleitung LP Ziel: Die Sch. kennen die Zusammensetzung von Luft und können die verschiedenen Gase per Formel benennen. Arbeitsauftrag: Textblatt lesen lassen und Lücken ausfüllen mit Hilfe der zur Verfügung
Anleitung LP Ziel: Die Sch. kennen die Zusammensetzung von Luft und können die verschiedenen Gase per Formel benennen. Arbeitsauftrag: Textblatt lesen lassen und Lücken ausfüllen mit Hilfe der zur Verfügung
Kopiervorlage 1: Eisen und Aluminium
 Kopiervorlage 1: Eisen und Aluminium 1. Suche aus dem Schulbuch folgende Eigenschaften der beiden Metalle heraus: Eisen Aluminium Dichte Härte Schmelzpunkt Magnetisierbarkeit 2. a) Berechne die Eisenmenge
Kopiervorlage 1: Eisen und Aluminium 1. Suche aus dem Schulbuch folgende Eigenschaften der beiden Metalle heraus: Eisen Aluminium Dichte Härte Schmelzpunkt Magnetisierbarkeit 2. a) Berechne die Eisenmenge
Eine Reaktion mit Kupfer und Schwefel
 Eine Reaktion mit Kupfer und Schwefel Materialien: Chemikalien: Duranglas, Stativstange mit Stativklemme, Gasbrenner Schwefelpulver, Kupferblech Durchführung: Fülle vorsichtig ca. 1cm breit Schwefelpulver
Eine Reaktion mit Kupfer und Schwefel Materialien: Chemikalien: Duranglas, Stativstange mit Stativklemme, Gasbrenner Schwefelpulver, Kupferblech Durchführung: Fülle vorsichtig ca. 1cm breit Schwefelpulver
LB1 Stoffe. LB1 Stoffe. LB1 Stoffe. Womit beschäftigt sich die Chemie?
 Lernkartei Klasse 7 LB1: Stoffe Womit beschäftigt sich die Chemie? LB1 Stoffe mit den Stoffen, ihren Eigenschaften und ihren Veränderungen (Stoffumwandlungen) Was sind Stoffe? LB1 Stoffe Stoffe sind die
Lernkartei Klasse 7 LB1: Stoffe Womit beschäftigt sich die Chemie? LB1 Stoffe mit den Stoffen, ihren Eigenschaften und ihren Veränderungen (Stoffumwandlungen) Was sind Stoffe? LB1 Stoffe Stoffe sind die
Anorganische Chemie! der unbelebten Natur keine Kohlenstoffverbindung (Kohlenstoffatome C) Metall Nichtmetallverbindungen Ionenbindung
 3 Chemie / Physik 3.1 Eigenheiten der Chemie und Physik Chemie ist die Lehre von den Stoffen, ihrer Zusammensetzung, dem Aufbau, der Struktur und ihrer Umwandlung Die Chemie untersucht und beschreibt die
3 Chemie / Physik 3.1 Eigenheiten der Chemie und Physik Chemie ist die Lehre von den Stoffen, ihrer Zusammensetzung, dem Aufbau, der Struktur und ihrer Umwandlung Die Chemie untersucht und beschreibt die
CHEMIE WIEDERHOLUNG: KAPITEL 5 REAKTIONEN DER ANORGANISCHEN CHEMIE. Timm Wilke. Georg-August-Universität Göttingen. Wintersemester 2013 / 2014
 CHEMIE WIEDERHOLUNG: KAPITEL 5 REAKTIONEN DER ANORGANISCHEN CHEMIE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Einführung Brennendes Magnesiumband reagiert mit Sauerstoff
CHEMIE WIEDERHOLUNG: KAPITEL 5 REAKTIONEN DER ANORGANISCHEN CHEMIE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Einführung Brennendes Magnesiumband reagiert mit Sauerstoff
Wer spannt wem den Sauerstoff aus? Metalloxide
 II Stoffe und ihre Eigenschaften 17. Metalloxide (Kl. 8/9) 1 von 24 Wer spannt wem den Sauerstoff aus? Metalloxide Ein Beitrag von Petra Frank, Tobias Frank und Dr. Hans-Peter Haseloff, Esslingen Mit Illustrationen
II Stoffe und ihre Eigenschaften 17. Metalloxide (Kl. 8/9) 1 von 24 Wer spannt wem den Sauerstoff aus? Metalloxide Ein Beitrag von Petra Frank, Tobias Frank und Dr. Hans-Peter Haseloff, Esslingen Mit Illustrationen
Zerlegung von Wasser durch Reduktionsmittel
 Lehrer-/Dozentenblatt Zerlegung von Wasser durch Reduktionsmittel (Artikelnr.: P7155500) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Anorganische Chemie Unterthema:
Lehrer-/Dozentenblatt Zerlegung von Wasser durch Reduktionsmittel (Artikelnr.: P7155500) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Anorganische Chemie Unterthema:
Löslichkeit gesättigte Lösung kaltgesättigte heissgesättigte
 Löslichkeit - In welcher Einheit wird die Löslichkeit eines Stoffes angegeben? - In welchem Grössenordnungsbereich schwankt die Löslichkeit von Feststoffen? - Wie sieht es mit der Löslichkeit von Gasen
Löslichkeit - In welcher Einheit wird die Löslichkeit eines Stoffes angegeben? - In welchem Grössenordnungsbereich schwankt die Löslichkeit von Feststoffen? - Wie sieht es mit der Löslichkeit von Gasen
Definiere den Begriff Chemischer Vorgang! Definiere den Begriff Physikalischer Vorgang!
 Chemischer Vorgang! Stoffänderung, keine Zustandsänderung, mit Energiebeteiligung Physikalischer Vorgang! Zustandsänderung, keine Stoffänderung (z.b. Lösen, Aggregatzustände,...) Erkläre die Begriffe heterogenes
Chemischer Vorgang! Stoffänderung, keine Zustandsänderung, mit Energiebeteiligung Physikalischer Vorgang! Zustandsänderung, keine Stoffänderung (z.b. Lösen, Aggregatzustände,...) Erkläre die Begriffe heterogenes
Was passiert, wenn Schwefeldampf über einen heissen Kupferblechstreifen streicht? Antworten: a) es entsteht Wasserdampf (Wasser-
 Posten 1a Was passiert, wenn Schwefeldampf über einen heissen Kupferblechstreifen streicht? a) es entsteht Wasserdampf (Wasser- (=> Posten 5l) tropfen kondensieren am Streifen) b) der Schwefeldampf wird
Posten 1a Was passiert, wenn Schwefeldampf über einen heissen Kupferblechstreifen streicht? a) es entsteht Wasserdampf (Wasser- (=> Posten 5l) tropfen kondensieren am Streifen) b) der Schwefeldampf wird
Schulinterne Lehrpläne Naturwissenschaften 7.1 Veränderungen von Stoffen/Chem. Reaktionen (Lehrwerk Prisma Naturwissenschaften 7/8)
 Schulinterne Lehrpläne Naturwissenschaften 7.1 Veränderungen von Stoffen/Chem. Reaktionen (Lehrwerk Prisma Naturwissenschaften 7/8) Unterrichtsvorhaben Kompetenz 1 Kompetenz 2 Methodische VERHALTEN IM
Schulinterne Lehrpläne Naturwissenschaften 7.1 Veränderungen von Stoffen/Chem. Reaktionen (Lehrwerk Prisma Naturwissenschaften 7/8) Unterrichtsvorhaben Kompetenz 1 Kompetenz 2 Methodische VERHALTEN IM
Identifizierung der Produkte der Reaktion "Alkalimetalle + Wasser"
 Identifizierung der Produkte der Reaktion "Alkalimetalle + Wasser" a) Identifizierung des entstehenden Gases: Chemikalien: Geräte: Lithium [C] [F], Natrium [C] [F] (jeweils in Benzin mit Siedebereich 90-110
Identifizierung der Produkte der Reaktion "Alkalimetalle + Wasser" a) Identifizierung des entstehenden Gases: Chemikalien: Geräte: Lithium [C] [F], Natrium [C] [F] (jeweils in Benzin mit Siedebereich 90-110
Was passiert denn genau?
 Was passiert denn genau? - Bei chemischen Reaktionen entstehen neue Stoffe, mit neuen Eigenschaften. - Im Teilchenmodell stellen wir uns vor, dass Kugelteilchen (Edukte) neu kombiniert werden. - Wenn wir
Was passiert denn genau? - Bei chemischen Reaktionen entstehen neue Stoffe, mit neuen Eigenschaften. - Im Teilchenmodell stellen wir uns vor, dass Kugelteilchen (Edukte) neu kombiniert werden. - Wenn wir
Was haben wir gelernt?
 Was haben wir gelernt? - Gesetze chemischer Reaktionen - Atommodell von Dalton - Elementsymbole - Die atomare Masseneinheit u - Die Avogadro-Zahl und deren Umkehrung - Von Massenverhältnissen zu Teilchenverhältnissen
Was haben wir gelernt? - Gesetze chemischer Reaktionen - Atommodell von Dalton - Elementsymbole - Die atomare Masseneinheit u - Die Avogadro-Zahl und deren Umkehrung - Von Massenverhältnissen zu Teilchenverhältnissen
1-2 Unterrichtsstunden
 Lernziele Scaffolding und Differenzierung im Biologieunterricht (Praktikum) - Die Schüler sollen Material/Stoff, respektiv Form eines Körpers unterscheiden können, und mithilfe von Fachbegriffen verschiedene
Lernziele Scaffolding und Differenzierung im Biologieunterricht (Praktikum) - Die Schüler sollen Material/Stoff, respektiv Form eines Körpers unterscheiden können, und mithilfe von Fachbegriffen verschiedene
Rezepte: 1. Brause herstellen
 1D Rezepte: 1. Brause herstellen zutaten ½ TL Natron 2 TL Zucker 1 TL Zitronensäure 200 ml Wasser zubereitung Natron, Zucker und Zitronensäure in das Glas geben. Das Wasser hinzufügen. aufgaben Vergleiche
1D Rezepte: 1. Brause herstellen zutaten ½ TL Natron 2 TL Zucker 1 TL Zitronensäure 200 ml Wasser zubereitung Natron, Zucker und Zitronensäure in das Glas geben. Das Wasser hinzufügen. aufgaben Vergleiche
Merkmale chemischer Reaktionen
 Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 7 & 8 Merkmale chemischer Reaktionen Kurzprotokoll Auf einen Blick: Im Folgenden werden weitere Versuche zum Thema Merkmale einer
Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 7 & 8 Merkmale chemischer Reaktionen Kurzprotokoll Auf einen Blick: Im Folgenden werden weitere Versuche zum Thema Merkmale einer
Kupfersteckbrief 06 AB1 MS
 Um einen Stoff und seine Eigenschaften genauer beschreiben zu können, ist es wichtig verschiedene Versuche durchzuführen und genau zu beobachten. Aufgabe: Erstelle einen Steckbrief für, indem du verschiedene
Um einen Stoff und seine Eigenschaften genauer beschreiben zu können, ist es wichtig verschiedene Versuche durchzuführen und genau zu beobachten. Aufgabe: Erstelle einen Steckbrief für, indem du verschiedene
Naturwissenschaft Vermutungswissen Alles ist Chemie!!! Analyse Synthese
 SPF 2 Chemie Was ist Chemie? - Chemie ist eine Naturwissenschaft Wie schafft eine Naturwissenschaft wissen? - Vermutungswissen; naturwissenschaftlicher Erkenntnisgang Womit beschäftigt sich die Chemie?
SPF 2 Chemie Was ist Chemie? - Chemie ist eine Naturwissenschaft Wie schafft eine Naturwissenschaft wissen? - Vermutungswissen; naturwissenschaftlicher Erkenntnisgang Womit beschäftigt sich die Chemie?
!!! Du darfst eine Teilaufgabe von Nr. 2 und zwei der Teilaufgaben von Nr 4 streichen!!!
 1 Klassenarbeit Chemie 1/5 A TIPP alle Rechenaufgaben mit Einheit, Ergebnis und Antwortsatz! In der Tabelle links stehende Elemente haben eher die maximale Wertigkeit! In der Tabelle rechts stehende Elemente
1 Klassenarbeit Chemie 1/5 A TIPP alle Rechenaufgaben mit Einheit, Ergebnis und Antwortsatz! In der Tabelle links stehende Elemente haben eher die maximale Wertigkeit! In der Tabelle rechts stehende Elemente
Posten 1a. Was gilt immer. bei einer Oxidation?
 Posten 1a Was gilt immer bei einer Oxidation? a) Es werden Elektronen aufgenommen. (=> Posten 3c) b) Es wird mit Sauerstoff reagiert. (=> Posten 6b) c) Sie kann alleine in einer Reaktions- 9k) gleichungg
Posten 1a Was gilt immer bei einer Oxidation? a) Es werden Elektronen aufgenommen. (=> Posten 3c) b) Es wird mit Sauerstoff reagiert. (=> Posten 6b) c) Sie kann alleine in einer Reaktions- 9k) gleichungg
Überlege dir welche drei Voraussetzungen gegeben sein müssen, damit Verbrennung stattfinden kann.
 Verbrennungsvorgang Überlege dir welche drei Voraussetzungen gegeben sein müssen, damit Verbrennung stattfinden kann. Trage die Begriffe in die leeren Felder des Verbrennungsdreiecks ein. Die drei Voraussetzungen
Verbrennungsvorgang Überlege dir welche drei Voraussetzungen gegeben sein müssen, damit Verbrennung stattfinden kann. Trage die Begriffe in die leeren Felder des Verbrennungsdreiecks ein. Die drei Voraussetzungen
CHEMISCHE REAKTIONEN (SEKP)
 KSO CHEMISCHE REAKTIONEN (SEKP) Skript Chemische Reaktionen (SekP) V1.0 01/15 Bor 2 INHALTSVERZEICHNIS "CHEMISCHE REAKTIONEN" 1. Einleitung...03 2. Stoffe wandeln sich um... 04 2.1 Kupfer reagiert mit
KSO CHEMISCHE REAKTIONEN (SEKP) Skript Chemische Reaktionen (SekP) V1.0 01/15 Bor 2 INHALTSVERZEICHNIS "CHEMISCHE REAKTIONEN" 1. Einleitung...03 2. Stoffe wandeln sich um... 04 2.1 Kupfer reagiert mit
man sagt : Phosphor + Sauerstoff reagieren Tetraphosphorzu dekaoxid
 Die Luft 1.Versuch Wir entzünden eine Kerze und stülpen ein Becherglas darüber. Beobachtung : Nach kurzer Zeit erlischt die Flamme. Feststellung : Für die Verbrennung in unserer Umwelt ist Luft notwendig.
Die Luft 1.Versuch Wir entzünden eine Kerze und stülpen ein Becherglas darüber. Beobachtung : Nach kurzer Zeit erlischt die Flamme. Feststellung : Für die Verbrennung in unserer Umwelt ist Luft notwendig.
Anhand welcher Eigenschaften lässt sich Sauerstoff identifizieren?
 Naturwissenschaften - Chemie - Allgemeine Chemie - 5 Nachweisreaktionen (P75400) 5. Nachweis von Sauerstoff Experiment von: Phywe Gedruckt:.0.203 3:00:4 intertess (Version 3.06 B200, Export 2000) Aufgabe
Naturwissenschaften - Chemie - Allgemeine Chemie - 5 Nachweisreaktionen (P75400) 5. Nachweis von Sauerstoff Experiment von: Phywe Gedruckt:.0.203 3:00:4 intertess (Version 3.06 B200, Export 2000) Aufgabe
B E I S P I E L A R B E I T / Aufgaben. Kultusministerium. Name, Vorname: Klasse: Schule: Seite 1 von 6
 B E I S P I E L A R B E I T / Aufgaben Kultusministerium Name, Vorname: Klasse: Schule: Seite 1 von 6 B E I S P I E L A R B E I T / Aufgaben Aufgabe 1: Stoffe und ihre Eigenschaften a) Die Naturwissenschaft
B E I S P I E L A R B E I T / Aufgaben Kultusministerium Name, Vorname: Klasse: Schule: Seite 1 von 6 B E I S P I E L A R B E I T / Aufgaben Aufgabe 1: Stoffe und ihre Eigenschaften a) Die Naturwissenschaft
Die Brandbekämpfung (Gruppenversuche)
 Die Brandbekämpfung (Gruppenversuche) Führt die folgenden Versuche nacheinander durch. Lest die Versuchsbeschreibungen (Kopie) genau durch und klebt sie sofort in eure Haushefte ein. Notiert mit Bleistift
Die Brandbekämpfung (Gruppenversuche) Führt die folgenden Versuche nacheinander durch. Lest die Versuchsbeschreibungen (Kopie) genau durch und klebt sie sofort in eure Haushefte ein. Notiert mit Bleistift
2.8 Laugenbildung durch Reaktion von Metalloxiden mit Wasser. Aufgabe. Woraus lassen sich Laugen herstellen? (2)
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P759200) 2.8 Laugenbildung durch Reaktion von Metalloxiden mit Wasser Experiment von: Phywe Gedruckt: 5.0.203 2:6:25 intertess (Version 3.06
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P759200) 2.8 Laugenbildung durch Reaktion von Metalloxiden mit Wasser Experiment von: Phywe Gedruckt: 5.0.203 2:6:25 intertess (Version 3.06
Ch 9.2 Stoffe, Experimente: ein erster Blick in die Chemie
 Katalog Apps für 9 II/III (und auch 8I) Ch 9.2 Stoffe, Experimente: ein erster Blick in die Chemie Allgemeines: Laborgeräte 1. Chemische Laborgeräte: Paare zuordnen 2. Memory Laborgeräte 3. Laborgeräte
Katalog Apps für 9 II/III (und auch 8I) Ch 9.2 Stoffe, Experimente: ein erster Blick in die Chemie Allgemeines: Laborgeräte 1. Chemische Laborgeräte: Paare zuordnen 2. Memory Laborgeräte 3. Laborgeräte
Metall versus Metalloxid: Wer spannt wem den Sauerstoff aus?
 1 von 16 Metall versus Metalloxid: Wer spannt wem den Sauerstoff aus? Petra Frank, Tobias Frank und Dr. Hans-Peter Haseloff Niveau: Dauer: Sek. I 4 Unterrichtsstunden Bezug zu den KMK-Bildungsstandards
1 von 16 Metall versus Metalloxid: Wer spannt wem den Sauerstoff aus? Petra Frank, Tobias Frank und Dr. Hans-Peter Haseloff Niveau: Dauer: Sek. I 4 Unterrichtsstunden Bezug zu den KMK-Bildungsstandards
Testfragen für Jahrgang 7
 Testfragen für Jahrgang 7 Nenne 5 Stoffe, die sich beim Erhitzen verändern! Nenne 3 Stoffe, die sich beim Erhitzen nicht verändern! An welchen 3 Kennzeichen erkennt man eine chemische Reaktion? Nenne 5
Testfragen für Jahrgang 7 Nenne 5 Stoffe, die sich beim Erhitzen verändern! Nenne 3 Stoffe, die sich beim Erhitzen nicht verändern! An welchen 3 Kennzeichen erkennt man eine chemische Reaktion? Nenne 5
Erwartete Kompetenzen. Kompetenzbereich Erkenntnisgewinnung Die Schülerinnen und Schüler E1 E2 E3 E4 E5 E6 E7 E8 E9 E10 E11 E12 E13 E14 E15 E16 E17
 Stoffverteilungsplan Kerncurriculum für die Oberschule in Niedersachsen (Schuljahrgänge 7/8) PRISMA Chemie Niedersachsen Differenzierende Ausgabe Band 7/8 Schule: Klettbuch ISBN 978-3-12-068537-1 Lehrer:
Stoffverteilungsplan Kerncurriculum für die Oberschule in Niedersachsen (Schuljahrgänge 7/8) PRISMA Chemie Niedersachsen Differenzierende Ausgabe Band 7/8 Schule: Klettbuch ISBN 978-3-12-068537-1 Lehrer:
Vergleich von Chemie heute Teilband 1 zu den Basiskonzepten des Kerncurriculums in Niedersachsen
 934.280 Vergleich von Chemie heute zu den Basiskonzepten des Kerncurriculums in Niedersachsen Kennzeichen chem. 61 Chemie eine Naturwissenschaft 7 Was ist Chemie? 10 Methode: Sicher experimentieren 11
934.280 Vergleich von Chemie heute zu den Basiskonzepten des Kerncurriculums in Niedersachsen Kennzeichen chem. 61 Chemie eine Naturwissenschaft 7 Was ist Chemie? 10 Methode: Sicher experimentieren 11
Chemische Reaktionen von Metallen mit Brom
 Chemische Reaktionen von Metallen mit Brom a) Umsetzung von Natrium und Kalium mit Brom: Chemikalien: Geräte: Natrium [C,F], Kalium [C,F], Brom [T +,C,N] ca. 5%ige Lösung von Fixiersalz (=Natriumthiosulfat)
Chemische Reaktionen von Metallen mit Brom a) Umsetzung von Natrium und Kalium mit Brom: Chemikalien: Geräte: Natrium [C,F], Kalium [C,F], Brom [T +,C,N] ca. 5%ige Lösung von Fixiersalz (=Natriumthiosulfat)
Reaktion von Metallen und Nichtmetallen mit Sauerstoff
 Schulversuchspraktikum Sommersemester 2016 Klassenstufen 7 & 8 Reaktion von Metallen und Nichtmetallen mit Sauerstoff Auf einen Blick: Das Protokoll,,Reaktion von Metall und Nichtmetall mit Sauerstoff
Schulversuchspraktikum Sommersemester 2016 Klassenstufen 7 & 8 Reaktion von Metallen und Nichtmetallen mit Sauerstoff Auf einen Blick: Das Protokoll,,Reaktion von Metall und Nichtmetall mit Sauerstoff
Eigenschaften Reinstoffe Elemente Kugelteilchen Elementes Atom
 Einstieg: Atom Der Chemiker will alles genau untersuchen, um die Eigenschaften von Stoffen heraus zu finden. Er trennt Gemische in Reinstoffe. Er analysiert Reinstoffe, so dass sie in ihre Elemente zerfallen.
Einstieg: Atom Der Chemiker will alles genau untersuchen, um die Eigenschaften von Stoffen heraus zu finden. Er trennt Gemische in Reinstoffe. Er analysiert Reinstoffe, so dass sie in ihre Elemente zerfallen.
Trenne ein Gemisch aus Sand und Kochsalz sowie ein Gemisch aus Sand und Eisen.
 Naturwissenschaften - Chemie - Allgemeine Chemie - 3 Trennverfahren (P750900) 3.2 Gemischtrennungen - Filtrieren, Magnetscheidung Experiment von: Phywe Gedruckt:.0.203 2:53:30 intertess (Version 3.06 B200,
Naturwissenschaften - Chemie - Allgemeine Chemie - 3 Trennverfahren (P750900) 3.2 Gemischtrennungen - Filtrieren, Magnetscheidung Experiment von: Phywe Gedruckt:.0.203 2:53:30 intertess (Version 3.06 B200,
Brenner Streichhölzer Eis
 Versuch 1: Wir erhitzen Eis! Reagenzglas Reagenzglasklammer Reagenzglasständer Brenner Streichhölzer Eis Fülle soviel Eis in das Reagenzglas, dass es zu einem Drittel gefüllt ist. Damit Du Dir beim Erhitzen
Versuch 1: Wir erhitzen Eis! Reagenzglas Reagenzglasklammer Reagenzglasständer Brenner Streichhölzer Eis Fülle soviel Eis in das Reagenzglas, dass es zu einem Drittel gefüllt ist. Damit Du Dir beim Erhitzen
Kohlenstoffdioxid (Teil2)
 Kohlenstoffdioxid (Teil2) Wo Schornsteine qualmen, ist meist auch Kohlenstoffdioxid im Spiel. Jedes Jahr werden unglaubliche Mengen des farblosen Gases ausgestoßen mit Konsequenzen für uns alle! Wie entsteht
Kohlenstoffdioxid (Teil2) Wo Schornsteine qualmen, ist meist auch Kohlenstoffdioxid im Spiel. Jedes Jahr werden unglaubliche Mengen des farblosen Gases ausgestoßen mit Konsequenzen für uns alle! Wie entsteht
5. Lernstraße Chemische Reaktionen (Kl. 8/9) Vom Edukt zum Produkt eine Lernstraße zu chemischen Reaktionen
 V Chemische Reaktionen 5. Lernstraße Chemische Reaktionen (Kl. 8/9) 1 von 28 Vom Edukt zum Produkt eine Lernstraße zu chemischen Reaktionen Ein Beitrag von Edith Mallek, Buseck Mit Illustrationen von Wolfgang
V Chemische Reaktionen 5. Lernstraße Chemische Reaktionen (Kl. 8/9) 1 von 28 Vom Edukt zum Produkt eine Lernstraße zu chemischen Reaktionen Ein Beitrag von Edith Mallek, Buseck Mit Illustrationen von Wolfgang
Grundwissen 8. Klasse 1 Grundwissen 8. Klasse 1. Grundwissen 8. Klasse 2 Grundwissen 8. Klasse 2. Stoffebene
 Grundwissen 8. Klasse 1 Grundwissen 8. Klasse 1 Stoff Einteilung der Stoffe Reinstoff mischen Gemisch Stelle in einem Fließdiagramm folgende Begriffe zueinander in Beziehung: Stoff, Reinstoff, Gemisch,
Grundwissen 8. Klasse 1 Grundwissen 8. Klasse 1 Stoff Einteilung der Stoffe Reinstoff mischen Gemisch Stelle in einem Fließdiagramm folgende Begriffe zueinander in Beziehung: Stoff, Reinstoff, Gemisch,
Fachkompetenzen Prozessbezogene Kompetenzen
 Blatt 1 Blatt 2 1. Chemie eine Naturwissenschaft Merkmale chemischer Reaktionen Sicherheitsunterweisung Gefahrstoffe und Gefahrenpiktogramme Arbeitsgeräte 2. Stoffteilchenmodell und Aggregatzustände Stoffteilchenmodell
Blatt 1 Blatt 2 1. Chemie eine Naturwissenschaft Merkmale chemischer Reaktionen Sicherheitsunterweisung Gefahrstoffe und Gefahrenpiktogramme Arbeitsgeräte 2. Stoffteilchenmodell und Aggregatzustände Stoffteilchenmodell
Chemie Chemie - Klasse 8 - Version 1 (Juli 2004)
 Fehler! Kein Text mit angegebener Formatvorlage im Dokument. - Chemie Chemie Chemie - Klasse 8 - Version 1 (Juli 2004) Themenfeld Kerncurriculum
Fehler! Kein Text mit angegebener Formatvorlage im Dokument. - Chemie Chemie Chemie - Klasse 8 - Version 1 (Juli 2004) Themenfeld Kerncurriculum
Erwartete Kompetenzen
 Stoffverteilungsplan Kerncurriculum für die Oberschule/Realschule in Niedersachsen (Schuljahrgänge 7/8) PRISMA Chemie Niedersachsen Differenzierende Ausgabe Band 7/8 Schule: Klettbuch ISBN 978-3-12-068537-1
Stoffverteilungsplan Kerncurriculum für die Oberschule/Realschule in Niedersachsen (Schuljahrgänge 7/8) PRISMA Chemie Niedersachsen Differenzierende Ausgabe Band 7/8 Schule: Klettbuch ISBN 978-3-12-068537-1
Jeder Gegenstand Stoff Jeder Stoff Eigenschaften
 Stoffe Jeder Gegenstand der Welt, die euch umgibt, besteht aus einem chemischen Stoff. Jeder Stoff hat ganz spezielle Eigenschaften, die bestimmen, wie er verwendet wird. Die Chemie hat die Aufgabe die
Stoffe Jeder Gegenstand der Welt, die euch umgibt, besteht aus einem chemischen Stoff. Jeder Stoff hat ganz spezielle Eigenschaften, die bestimmen, wie er verwendet wird. Die Chemie hat die Aufgabe die
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Übungstests Chemie im praktischen Paket
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Übungstests Chemie im praktischen Paket Das komplette Material finden Sie hier: School-Scout.de Titel: Übungstest: Atombindungen Bestellnummer:
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Übungstests Chemie im praktischen Paket Das komplette Material finden Sie hier: School-Scout.de Titel: Übungstest: Atombindungen Bestellnummer:
Reaktionsgleichungen verstehen anhand der Verbrennung von Magnesium
 Reaktionsgleichungen verstehen anhand der Verbrennung von Magnesium Unterrichtsfach Themenbereich/e Schulstufe (Klasse) Fachliche Vorkenntnisse Sprachliche Kompetenzen Zeitbedarf Material- & Medienbedarf
Reaktionsgleichungen verstehen anhand der Verbrennung von Magnesium Unterrichtsfach Themenbereich/e Schulstufe (Klasse) Fachliche Vorkenntnisse Sprachliche Kompetenzen Zeitbedarf Material- & Medienbedarf
Curriculum Fach: Chemie Klasse: 8 Hölderlin-Gymnasium Nürtingen. Chemie
 Klassenstufe 8 BS (nach S. 196/197) Curriculum Fach: Chemie Klasse: 8 Chemie Kerncurriculum Inhalte Zeit Kompetenzen: die Schülerinnen und Schüler können Stoffe und ihre Eigenschaften Bemerkungen Wichtige
Klassenstufe 8 BS (nach S. 196/197) Curriculum Fach: Chemie Klasse: 8 Chemie Kerncurriculum Inhalte Zeit Kompetenzen: die Schülerinnen und Schüler können Stoffe und ihre Eigenschaften Bemerkungen Wichtige
Kerncurriculum Chemie Eichsfeld-Gymnasium Duderstadt Juni 2012
 Kerncurriculum Chemie Eichsfeld-Gymnasium Duderstadt Juni 2012 Jahrgänge 7 und 8 Jeweils 1 Jahreswochenstunde pro Schuljahr (epochal, entspricht 40 Stunden pro Schuljahr). Basiskonzepte: BK1: Stoff-Teilchen;
Kerncurriculum Chemie Eichsfeld-Gymnasium Duderstadt Juni 2012 Jahrgänge 7 und 8 Jeweils 1 Jahreswochenstunde pro Schuljahr (epochal, entspricht 40 Stunden pro Schuljahr). Basiskonzepte: BK1: Stoff-Teilchen;
Stoffeigenschaften auf der Spur
 Stoffeigenschaften auf der Spur Station 1 Welche Stoffe sind magnetisch? Sicherheit Entsorgung:/ Prüfe, welche Stoffe vom Magneten angezogen werden! Trage deine Beobachtungen in die Tabelle in deinem Forscherbuch
Stoffeigenschaften auf der Spur Station 1 Welche Stoffe sind magnetisch? Sicherheit Entsorgung:/ Prüfe, welche Stoffe vom Magneten angezogen werden! Trage deine Beobachtungen in die Tabelle in deinem Forscherbuch
Inhaltsverzeichnis VORSCHAU
 Inhaltsverzeichnis 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 Vorwort 5 Naturwissenschaften 6 Chemie (Einführung) 7 Vorsicht (in der) Chemie 8 Exemplarische Demonstration der
Inhaltsverzeichnis 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 Vorwort 5 Naturwissenschaften 6 Chemie (Einführung) 7 Vorsicht (in der) Chemie 8 Exemplarische Demonstration der
Stoffverteilungsplan. 0 1 Sicherheit im Chemieunterricht (S )
 Stoffverteilungsplan Bildungsplan 2016 für die Sekundarstufe I in Baden-Württemberg PRISMA Chemie 7/8, Baden-Württemberg Band Chemie für die Klasse 7/8 Klettbuch ISBN 978-3-12-068871-6 Schule: Lehrer:
Stoffverteilungsplan Bildungsplan 2016 für die Sekundarstufe I in Baden-Württemberg PRISMA Chemie 7/8, Baden-Württemberg Band Chemie für die Klasse 7/8 Klettbuch ISBN 978-3-12-068871-6 Schule: Lehrer:
B E I S P I E L A R B E I T / Aufgaben. Kultusministerium
 B E I S P I E L A R B E I T / Aufgaben Kultusministerium Name, Vorname: Klasse: Schule: Seite 1 von 6 B E I S P I E L A R B E I T / Aufgaben Aufgabe 1: Stoffe und ihre Eigenschaften a) Die Naturwissenschaft
B E I S P I E L A R B E I T / Aufgaben Kultusministerium Name, Vorname: Klasse: Schule: Seite 1 von 6 B E I S P I E L A R B E I T / Aufgaben Aufgabe 1: Stoffe und ihre Eigenschaften a) Die Naturwissenschaft
Elektronenpaarbindung (oder Atombindung) Nichtmetallatom + Nichtmetallatom Metallatom + Nichtmetallatom 7. Welche Bindungsart besteht jeweils?
 LÖSUNGEN Probetest 1 Kap. 03 Theorie Name: 1. C = Kohlenstoff Ag = Silber Br = Brom Schwefel = S Lithium = Li Uran = U 2. Aluminium - Finde die richtigen Zahlen mit Hilfe deines PSE: Massenzahl: 27 Ordnungszahl:
LÖSUNGEN Probetest 1 Kap. 03 Theorie Name: 1. C = Kohlenstoff Ag = Silber Br = Brom Schwefel = S Lithium = Li Uran = U 2. Aluminium - Finde die richtigen Zahlen mit Hilfe deines PSE: Massenzahl: 27 Ordnungszahl:
Untersuche, ob Wasser gelöste Gase enthält und wovon die Löslichkeit der Gase abhängt.
 Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P754700) 3.3 Löslichkeit von Gasen in Wasser Experiment von: Seb Gedruckt: 24.03.204 :24:34 intertess
Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P754700) 3.3 Löslichkeit von Gasen in Wasser Experiment von: Seb Gedruckt: 24.03.204 :24:34 intertess
prozessbezogene Kompetenzen E = Erkenntnisgewinnung K = Kommunikation B = Bewertung beachten Sicherheitsaspekte (E)
 Helene-Lange-Schule Hannover Fachcurriculum Chemie Jahrgang 5+6 Unterrichtsinhalte und inhaltsbezogene Kompetenzen (Die Schülerinnen und Schüler...) Klasse 5 prozessbezogene Kompetenzen E = Erkenntnisgewinnung
Helene-Lange-Schule Hannover Fachcurriculum Chemie Jahrgang 5+6 Unterrichtsinhalte und inhaltsbezogene Kompetenzen (Die Schülerinnen und Schüler...) Klasse 5 prozessbezogene Kompetenzen E = Erkenntnisgewinnung
Steckbrief-Test. 1 Überprüfe, ob die Stoff-Steckbriefe richtig sind. Wenn nicht, fertige einen überarbeiteten Steckbrief im Heft an.
 Steckbrief-Test Emma soll für die Schule Stoff-Steckbriefe zu vier verschiedenen Stoffen erstellen. Im Internet hat sie folgende Stoff-Steckbriefe gefunden. Bei manchen Angaben hat sie aber Zweifel, ob
Steckbrief-Test Emma soll für die Schule Stoff-Steckbriefe zu vier verschiedenen Stoffen erstellen. Im Internet hat sie folgende Stoff-Steckbriefe gefunden. Bei manchen Angaben hat sie aber Zweifel, ob
Online Ergänzung zu der RAABits Unterrichtseinheit. Wie Metalle reagieren - ein Mystery. Vanessa Engelhard Silvija Markic
 Online Ergänzung zu der RAABits Unterrichtseinheit Wie Metalle reagieren - ein Mystery Vanessa Engelhard Silvija Markic Einleitung: An den folgenden Seiten finden Sie Detektiv-Lupenkarten, die eine Ergänzung
Online Ergänzung zu der RAABits Unterrichtseinheit Wie Metalle reagieren - ein Mystery Vanessa Engelhard Silvija Markic Einleitung: An den folgenden Seiten finden Sie Detektiv-Lupenkarten, die eine Ergänzung
TIPP alle Rechenaufgaben mit Einheit, Ergebnis und Antwortsatz!
 1 Klassenarbeit Chemie 1/5 TIPP alle Rechenaufgaben mit Einheit, Ergebnis und Antwortsatz! 1 Stoffe und Stoffgemische 1.1 Ordne die Begriffe Verbindung, Element, Stoff, Mischung, Reinstoff, Metall, Nichtmetall,
1 Klassenarbeit Chemie 1/5 TIPP alle Rechenaufgaben mit Einheit, Ergebnis und Antwortsatz! 1 Stoffe und Stoffgemische 1.1 Ordne die Begriffe Verbindung, Element, Stoff, Mischung, Reinstoff, Metall, Nichtmetall,
Element. Verbindung. Reinstoff. homogenes Gemisch
 Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
