Anhang II. Wissenschaftliche Schlussfolgerungen und Begründung für die Aussetzung der Genehmigungen für das Inverkehrbringen
|
|
|
- Alma Wagner
- vor 7 Jahren
- Abrufe
Transkript
1 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Aussetzung der Genehmigungen für das Inverkehrbringen 12
2 Wissenschaftliche Schlussfolgerungen und Begründung für die Aussetzung der Genehmigungen für das Inverkehrbringen (siehe Anhang I) Die Koordinierungsgruppe für das Verfahren der gegenseitigen Anerkennung und das dezentralisierte Verfahren Humanarzneimittel [CMD(h)] stimmt unter Berücksichtigung der Empfehlung des PRAC vom 11. April 2013 in Bezug auf Tetrazepam-haltige Arzneimittel mit der darin enthaltenen Empfehlung, wie unten ausgeführt, überein: Komplette Zusammenfassung der wissenschaftlichen Beurteilung Tetrazepam-haltiger Arzneimittel durch den PRAC Tetrazepam ist ein Benzodiazepin, das bei schmerzhaften Kontrakturen im Bereich der Rheumatologie oder bei Spastiken angezeigt ist. Benzodiazepine (BZP) fördern die hemmende Wirkung von Gamma-Aminobuttersäure (GABA), wodurch eine beruhigende, hypnotische, krampflösende und muskelentspannende Wirkung entsteht. Tetrazepam-haltige Arzneimittel sind in Belgien, Bulgarien, Deutschland, Frankreich, Lettland, Litauen, Luxemburg, Österreich, Polen, Rumänien, der Slowakei, Spanien und der Tschechischen Republik zugelassen (siehe Anhang I für die Liste der Tetrazepam-haltigen Arzneimittel, die in der EU zugelassen sind). Am 20. Dezember 2012 informierte Frankreich die Europäische Arzneimittel-Agentur gemäß Artikel 107 Buchstabe i der Richtlinie 2001/83/EG über seine Überlegung, gemäß der Bewertung der Daten aus Pharmakovigilanz-Aktivitäten die Genehmigungen für das Inverkehrbringen Tetrazepam-haltiger Arzneimittel zu widerrufen. Nach Berichten über neue schwere Hautreaktionen in Verbindung mit der Anwendung von Tetrazepam überprüfte die zuständige französische nationale Behörde im November 2012 das Hautrisiko im Zusammenhang mit Tetrazepam auf Grundlage von Ergebnissen aus einer nationalen Pharmakovigilanz-Studie. Diese Überprüfung der Pharmakovigilanz bezog sich auf unerwünschte Arzneimittelwirkungen auf die Haut, die in der französischen nationalen Pharmakovigilanz- Datenbank seit Erteilung der ersten Genehmigungen für das Inverkehrbringen von Tetrazepam im Jahre 1967 in diesem Mitgliedstaat erfasst wurden. Diese Bewertung zeigte ein erhöhtes Hautrisiko in Zusammenhang mit Tetrazepam zusätzlich zu den pharmakologisch erwarteten unerwünschten Arzneimittelwirkungen von Benzodiazepinen auf die Hälfte der unerwünschten Arzneimittelwirkungen in Zusammenhang mit Tetrazepam bezogen sich auf die Haut und von den 648 gemeldeten schweren Fällen wurden 305 Fälle gemäß Systemorganklasse als Erkrankungen der Haut und des Unterhautzellgewebes gemeldet: Es wurden 33 Fälle von Stevens-Johnson- Syndrom (SJS), 33 Fälle von toxischer epidermaler Nekrolyse (TEN), 59 Fälle von Erythema multiforme (EM) und 15 Fälle von Medikamentenausschlag mit Eosinophilie und systemischen Symptomen (DRESS-Syndrom) festgestellt, von denen 11 Fälle tödlich verliefen. Der PRAC berücksichtigte die verfügbaren Daten, einschließlich der Daten aus der französischen Pharmakovigilanz-Studie, Daten, die von anderen Mitgliedstaaten zur Verfügung gestellt wurden, Daten aus Einreichungen der Interessenvertreter, Daten, die von den Inhabern der Genehmigung für das Inverkehrbringen eingereicht wurden, sowie veröffentlichter Daten. Sicherheit Bei der französischen nationalen Pharmakovigilanz-Studie wurde eine Analyse der seit der ersten Erteilung der Genehmigung für das Inverkehrbringen bis zum 30. Juni 2012 gemeldeten Fälle von Hautwirkungen in der nationalen Pharmakovigilanz-Datenbank durchgeführt. Bis zum 30. Juni 2012 wurden in der französischen nationalen Datenbank Fälle in Zusammenhang mit Tetrazepam erfasst. Von diesen wiesen die WHO-Schlüssel Verdacht auf oder Wechselwirkung auf. Nach Ausschluss eines doppelten Eintrags wurden Fälle in die Analyse aufgenommen. Von diesen Fällen galten 805 (49,80 %) unerwünschte Arzneimittelwirkungen gemäß Systemorganklasse als Erkrankungen der Haut und des Unterhautzellgewebes, von denen 305 (37,9 %) als schwerwiegend, einschließlich lebensbedrohlich und tödlich verlaufen, eingestuft wurden. Diese umfassten 33 Fälle von SJS (einschließlich 1 tödlich verlaufenen Falls), 33 Fälle von Lyell-Syndrom (TEN) (einschließlich 9 13
3 tödlich verlaufener Fälle), 59 Fälle von EM (einschließlich 1 tödlich verlaufenen Falls), 15 Fälle von DRESS-Syndrom, 3 mögliche Fälle von DRESS-Syndrom und 5 Fälle von akutem generalisiertem pustulösem Exanthem. Tetrazepam war bei 18 von 81 Fällen von SJS, TEN oder DRESS das einzige unter Verdacht stehende Arzneimittel oder hatte einen Score zur Bewertung des Kausalzusammenhanges, der höher als bei den gleichzeitig verabreichten Behandlungen war. Fälle von Anaphylaxie wurden ebenfalls berichtet. Darüber hinaus wurden 10 Fälle von Angioödem, das eine allergische Reaktion vom Soforttyp hervorrief, sowie 67 Fälle von Medikamentenausschlag, zusätzlich zu den vorherigen Fällen, mit oder ohne Beteiligung von mindestens einem Organ, beschrieben. Viele der Hautreaktionen waren makulo-papulös, aber gelegentlich auch vesikulär, pustulär, purpurisch oder bullös. Dies weist darauf hin, dass schwere Hautreaktionen unter Tetrazepam wahrscheinlich mit einer Allergie vom verzögerten Typ (Typ-IV-Allergie) in Zusammenhang stehen, was durch positive Pflasterproben bei 79 von 115 Fällen, in denen ein Allergietest durchgeführt wurde, unterstützt wird. Wie vom Inhaber der Genehmigung für das Inverkehrbringen des Originalpräparats in seiner schriftlichen Antwort auf die Liste von Fragen des PRAC mitgeteilt, wurden gemäß der Pharmakovigilanz-Datenbank des Inhabers der Genehmigung für das Inverkehrbringen seit der Markteinführung des Arzneimittels im Jahre 1969 bis zum 31. Mai 2012 (Datenstichtag) 513 eindeutige Fälle von Hautreaktion oder Allergie in Bezug auf 748 Reaktionen unter Tetrazepam gemeldet. Achtunddreißig (38) Fälle waren nicht medizinisch bestätigt, 475 Fälle waren medizinisch bestätigt. Darunter wurden 180 Fälle direkt an das Unternehmen gemeldet, 245 Fälle wurden von den Gesundheitsbehörden gemeldet und 50 Fälle wurden in der weltweiten wissenschaftlichen Literatur gefunden. Insgesamt sind die am häufigsten berichteten Hautreaktionen in absteigender Reihenfolge verschiedene Typen von Hautausschlag ohne genaue Angabe (162 Fälle), Pruritus (94 Fälle), Erythema multiforme (48 Fälle), Urtikaria (47 Fälle), toxische epidermale Nekrolyse (35 Fälle), Angioödem (34 Fälle), Stevens-Johnson-Syndrom (31 Fälle), Erythem (28 Fälle), toxischer Hautausschlag (19 Fälle), Exfoliation der Haut (16 Fälle), Dermatitis bullös, nicht näher bezeichnet (NNB) (16 Fälle) und DRESS-Syndrom (7 Fälle). Eine spezifische Analyse der vom Inhaber der Genehmigung für das Inverkehrbringen berichteten relevantesten schweren unerwünschten Hautreaktionen bezüglich ihrer Beschaffenheit und Schwere erfolgte in der Antwort des Inhabers der Genehmigung für das Inverkehrbringen auf die Liste von Fragen des PRAC. Insgesamt gelten mehr als 40 % der berichteten Fälle gemäß Systemorganklasse als Erkrankungen der Haut und des Unterhautzellgewebes ; es wurden schwere unerwünschte arzneimittelinduzierte Hautreaktionen (severe Cutaneous Adverse Reactions to Drugs; SCARs), wie etwa SJS, TEN, DRESS-Syndrom und EM, nach Tetrazepam-Behandlung diagnostiziert und 11 tödlich verlaufene Fälle gemeldet; in 8 Fällen wurde der tödliche Verlauf infolge der Hautreaktion gemeldet und 3 Fälle wurden auf eine assoziierte Reaktion zurückgeführt. Allergietests wurden in mehreren Fällen durchgeführt. Insgesamt waren geschätzte 70 bis 80 % der durchgeführten Allergietests positiv. In den meisten Fällen wurde der Kausalzusammenhang mit Tetrazepam als möglich (86 % der Fälle) und in einigen Fällen als wahrscheinlich (11 % der Fälle) angegeben. Der PRAC erkannte an, dass bei den meisten gemeldeten Berichten eine Anwendung mehrerer Arzneimittel stattgefunden hatte. Allerdings ist die Zurechenbarkeit von Tetrazepam bei einer großen Zahl von Fällen sehr wahrscheinlich. Dies wird durch die Ergebnisse der Allergietests bestätigt, bei denen bei einer Reihe von Fällen nur Tetrazepam positive Ergebnisse aufwies. Darüber hinaus wurden nach Wiederaufnahme der Behandlung Fälle mit neuen Episoden von Hauterkrankungen berichtet. In Bezug auf die Fälle von SJS/TEN, die vom Inhaber der Genehmigung für das Inverkehrbringen beschrieben wurden, wurden 65 medizinisch bestätigte schwere Fälle von SJS/TEN berichtet. Hierbei handelte es sich um 31 Fälle von SJS und 35 Fälle von TEN, einschließlich eines Falles mit beiden Reaktionen. In 10 Fällen wurde die Diagnose mittels Hautbiopsie bestätigt. Die Zeit bis zum Auftreten der Reaktion lag bei 14 Patienten zwischen 1 und 3 Wochen, während in 9 Fällen eine kürzere Zeit bis zum Auftreten berichtet wurde (<7 Tage), einschließlich 6 Fälle mit einer sehr kurzen Zeit bis zum Auftreten von 1 bis 3 Tagen. In fast allen Fällen mit Informationen über die Dauer der Behandlung mit Tetrazepam wurde eine Behandlungsdauer von bis zu einem Monat beobachtet; in 9 Fällen war die Dauer sehr kurz (weniger als 4 Tage). Über schwere unerwünschte Hautreaktionen unter Tetrazepam wurde auch in der veröffentlichten Literatur berichtet 1,2,3,4,5,6,7,8,9,10,11. Hautreaktionen wurden auch in den Antworten anderer 1 Sanchez I et al. Stevens-Johnson syndrome from tetrazepam [Stevens-Johnson-Syndrom durch Tetrazepam]. Allergol Immunopathol 1998;26:
4 Inhaber der Genehmigung für das Inverkehrbringen und den Einreichungen der Interessenvertreter aufgeführt. Der Inhaber der Genehmigung für das Inverkehrbringen legte seine Sichtweise der möglichen Mechanismen Tetrazepam-induzierter Hautreaktionen vor: ein struktureller Unterschied zwischen Tetrazepam und anderen Benzodiazepinen (d. h. der substituierte Cyclohexenylring von Tetrazepam) steht eventuell in Zusammenhang mit den verschiedenen allergischen Reaktionen der Haut, die unter Tetrazepam beobachtet wurden. Das Potential eines nukleophilen Angriffs, der in der Literatur (von Barbaud et al, 2009) vorgeschlagen wird, steht in Einklang mit dem Mechanismus, der von der In-silico-Analyse vorgeschlagen wird, und könnte das berichtete Fehlen einer Kreuzreaktivität zwischen Tetrazepam und anderen Benzodiazepinen bei Patienten mit allergischen Reaktionen der Haut erklären. Die Affinität von Tetrazepam zu Haut könnte den Ort der allergischen Reaktion erklären. Der PRAC zog Maßnahmen zur Risikominimierung in Erwägung, einschließlich einer Reduzierung der Behandlungsdauer auf 6 Tage und einer Beschränkung der Anwendungsgebiete, um das Risiko schwerer Hautreaktionen zu senken. Weitere Maßnahmen zur Risikominimierung, wie etwa zusätzliche Änderungen an den Produktinformationen (Gegenanzeigen, Warnhinweise), Kommunikationsmaterial (Therapiepass, Schreiben an Angehörige der Gesundheitsberufe) und eine Reduzierung der Packungsgröße, wurden während der Erörterung ebenfalls in Erwägung gezogen. Unter Berücksichtigung der Anwendungsgebiete von Tetrazepam stellte der PRAC die Effektivität einer Reduzierung der Behandlungsdauer angesichts des Potentials einer wiederholten Anwendung infrage. Darüber hinaus war der PRAC der Ansicht, dass die klinischen Daten, welche den Nutzen einer 6-tägigen Behandlungsdauer unterstützen, nicht ausreichend robust sind. Angesichts der Unvorhersagbarkeit dieser Art von Nebenwirkungen würde eine Beschränkung der Anwendungsgebiete keine effektive Maßnahme zur Risikominimierung darstellen. Die Option eines Therapiepasses wurde ebenfalls erörtert, aber auch dies wurde zur Vorbeugung dieser Art von SCARs nicht als effektiv erachtet. Nach Beurteilung der Gesamtheit der vorgeschlagenen Maßnahmen zur Risikominimierung schlussfolgerte der PRAC, dass die vorgeschlagenen Maßnahmen angesichts des Risikos und der Unvorhersagbarkeit schwerer unerwünschter Hautreaktionen unter Tetrazepam nicht ausreichen, um das Risiko auf ein klinisch akzeptables Niveau zu senken. Angesichts der oben genannten Argumente gelangte der PRAC zu der Ansicht, dass Tetrazepam im Vergleich zu Arzneimitteln der gleichen pharmakotherapeutischen Gruppe mit einem erhöhten Risiko schwerer unerwünschter Hautreaktionen verbunden ist, einschließlich Stevens-Johnson- Syndrom, toxischer epidermaler Nekrolyse, Erythema multiforme und DRESS-Syndrom, die lebensbedrohlich sein und tödlich verlaufen können. 2 Camarasa JG et al. Tetrazepam allergy detected by patch test [Durch Pflasterprobe nachgewiesene Tetrazepamallergie]. Contact Dermatitis 1990;22: Quinones D et al. Photodermatitis from tetrazepam [Photodermatitis durch Tetrazepam]. Contact Dermatitis 1998 ;39(2):84. 4 Bachmeyter C. Probable drug rash with eosinophilia and systemic symptoms syndrome related to tetrazepam [Mutmaßliches Arzneimittelexanthem mit Eosinophilie und systemischen Symptomen in Zusammenhang mit Tetrazepam]. J Eur Acad Dermatol Venereol 2008;22(7): Cabreizo Ballesteros et al. Erythema multiforme to tetrazepam [Erythema multiforme nach Tetrazepam]. J Investig Allergol Clin Immunol 2007;17(3): Delesalle F et la. Toxic epidermal necrolysis caused by tetrazepam [Toxische epidermale Nekrolyse verursacht durch Tetrazepam]. International Journal of Dermatology 2006;45(4): Del Pozo MD et al. Tetrazepam Allergy [Tetrazepamallergie]. Allergy 1999;54(11): Sanchez-Morillas L et al. Systemic dermatitis due to tetrazepam [Systemische Dermatitis aufgrund von Tetrazepam]. J Investig Allergol Clin Immunol 2008;18(5): Blanco R et la. Delayed hypersensitivity to tetrazepam [Überempfindlichkeit vom Spättyp gegen Tetrazepam]. Allergy 1997;52(11): LagnouiR et al. Fatal toxic epidemal necrolysis associated with tetrazepam [Tödliche toxische epidermale Nekrolyse im Zusammenhang mit Tetrazepam]. Therapie 2001;56(2): Thomas E et al. Acute generalised exanthematous pustulosis due to tetrazepam [Akut generalisierendes pustulöses Exanthem aufgrund von Tetrazepam]. J Investig Allergol Clin Immunol 2008;18(2):
5 Wirksamkeit Tetrazepam ist ein Benzodiazepin, das in den Mitgliedstaaten bei schmerzhaften Kontrakturen im Bereich der Rheumatologie und von spastischen Syndromen angezeigt ist. Einige Mitgliedstaaten verfügen über beide Anwendungsgebiete. Die Ergebnisse klinischer Studien zur Anwendung von Tetrazepam bei beiden Anwendungsgebieten wurden seit der Erteilung der Genehmigung für das Inverkehrbringen von Tetrazepam veröffentlicht. Insgesamt wird die Wirksamkeit von Tetrazepam beim Anwendungsgebiet schmerzhafter Kontrakturen hauptsächlich von zwei kleinen doppelblinden, placebokontrollierten klinischen Studien (Arbus 1987 und Salzmann 1993), an denen insgesamt 70 Patienten (50 Patienten bzw. 20 Patienten) teilnahmen, unterstützt. In diesen Studien wurde lediglich eine begrenzte Wirksamkeit gezeigt. Der PRAC stellte auch fest, dass die derzeitigen Leitlinien die Anwendung von Tetrazepam beim Anwendungsgebiet der Spastik nicht nennen. Die Wirksamkeit von Tetrazepam wurde auch mit anderen Wirkstoffen in kontrollierten, doppelblinden Studien verglichen: diese Studien zeigten bei beiden Anwendungsgebieten keinen statistisch signifikanten Unterschied zwischen den Gruppen. Der PRAC war der Ansicht, dass die verfügbaren Wirksamkeitsdaten, einschließlich Daten, die seit der ersten Erteilung der Genehmigung für das Inverkehrbringen verfügbar wurden, nur eine sehr begrenzte klinische Wirksamkeit von Tetrazepam in den zugelassenen Anwendungsgebieten zeigten. Schlussfolgerung Auf Grundlage der vorstehenden Ausführungen schlussfolgerte der PRAC, dass Tetrazepam Sicherheitsbedenken bezüglich schwerer, potenziell tödlicher Hautreaktionen aufweist und begrenzte klinische Wirksamkeit zeigt. Der PRAC war der Ansicht, dass die während der Beurteilung erörterten Maßnahmen zur Risikominimierung, einschließlich Reduzierung der Behandlungsdauer und Beschränkung der Anwendungsgebiete, nicht ausreichen, um das Risiko zu senken. Der PRAC schlussfolgerte daher, dass das Nutzen-Risiko-Verhältnis Tetrazepam-haltiger Arzneimittel nicht positiv ist. Gründe für die Empfehlung des PRAC In Erwägung nachstehender Gründe: Der PRAC berücksichtigte das Verfahren gemäß Artikel 107 Buchstabe i der Richtlinie 2001/83/EG für Tetrazepam-haltige Arzneimittel. Der PRAC berücksichtigte die Gesamtheit der für Tetrazepam-haltige Arzneimittel verfügbaren Daten in Bezug auf das Risiko von unerwünschten Hautreaktionen. Dies beinhaltete Daten der Mitgliedstaaten und Daten aus der veröffentlichten Literatur, die seit der Erteilung der ersten Genehmigungen für das Inverkehrbringen verfügbar geworden sind, sowie die Antworten des Inhabers der Genehmigung für das Inverkehrbringen und die Einreichungen der Interessenvertreter. Der PRAC stellte fest, dass unter Tetrazepam schwere unerwünschte Hautreaktionen, einschließlich tödlich verlaufener Fälle, berichtet wurden. Der PRAC gelangte nach Überprüfung der verfügbaren Daten zu der Ansicht, dass Tetrazepam im Vergleich zu Arzneimitteln der gleichen pharmakotherapeutischen Gruppe mit einem erhöhten Risiko schwerer unerwünschter Hautreaktionen verbunden ist, einschließlich Stevens-Johnson-Syndrom, toxischer epidermaler Nekrolyse, Erythema multiforme und Medikamentenausschlag mit Eosinophilie und systemischen Symptomen (Drug Reaction of Eosinophilia Systemic Symptoms; DRESS), die lebensbedrohlich sein und tödlich verlaufen können. 16
6 Der PRAC war der Ansicht, dass die verfügbaren Wirksamkeitsdaten, einschließlich Daten, die seit der ersten Erteilung der Genehmigung für das Inverkehrbringen verfügbar wurden, nur eine sehr begrenzte klinische Wirksamkeit von Tetrazepam in den zugelassenen Anwendungsgebieten zeigten. Der PRAC war der Ansicht, dass die während der Beurteilung erörterten Maßnahmen zur Risikominimierung, einschließlich Reduzierung der Behandlungsdauer und Beschränkung der Anwendungsgebiete, nicht ausreichen, um das Risiko schwerer Hautreaktionen zu senken Angesichts der Sicherheitsbedenken in Bezug auf schwere, potenziell tödlich verlaufende Hautreaktionen und der begrenzten Wirksamkeit von Tetrazepam schlussfolgerte der PRAC, dass das Nutzen-Risiko-Verhältnis Tetrazepam-haltiger Arzneimittel gemäß Artikel 116 der Richtlinie 2001/83/EG nicht länger als positiv erachtet wird. Daher empfiehlt der PRAC gemäß Artikel 107 Buchstabe i der Richtlinie 2001/83/EG die Aussetzung der Genehmigungen für das Inverkehrbringen aller in Anhang I aufgeführten Arzneimittel. Die Bedingungen für die Aufhebung der Aussetzung der Genehmigungen für das Inverkehrbringen sind in Anhang III dargelegt. Position der CMD(h) Die CMD(h) nahm unter Berücksichtigung der Empfehlung des PRAC vom 11. April 2013 gemäß Artikel 107 Buchstabe k Absatz 1 und Absatz 2 der Richtlinie 2001/83/EG sowie der Anhörung eines Inhabers der Genehmigung für das Inverkehrbringen am 22. April 2013, eine Position zur Aussetzung der Genehmigungen für das Inverkehrbringen Tetrazepam-haltiger Arzneimittel ein. Die Bedingungen für die Aufhebung der Aussetzung der Genehmigungen für das Inverkehrbringen sind in Anhang III dargelegt. 17
Anhang I. Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen
 Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für den Widerruf oder die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen und die detaillierte Erklärung der Abweichungen
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für den Widerruf oder die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen und die detaillierte Erklärung der Abweichungen
ENDGÜLTIGES GUTACHTEN DES AUSSCHUSSES FÜR ARZNEISPEZIALITÄTEN GEMÄSS ARTIKEL 12 DER RICHTLINIE 75/319/EWG DES RATES, EINSCHLIESSLICH ÄNDERUNGEN, FÜR
 The European Agency for the Evaluation of Medicinal Products Human Medicines Evaluation Unit CPMP/375/97-DE ENDGÜLTIGES GUTACHTEN DES AUSSCHUSSES FÜR ARZNEISPEZIALITÄTEN GEMÄSS ARTIKEL 12 DER RICHTLINIE
The European Agency for the Evaluation of Medicinal Products Human Medicines Evaluation Unit CPMP/375/97-DE ENDGÜLTIGES GUTACHTEN DES AUSSCHUSSES FÜR ARZNEISPEZIALITÄTEN GEMÄSS ARTIKEL 12 DER RICHTLINIE
Anhang II. Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen 10 Wissenschaftliche Schlussfolgerungen Solu-Medrol 40 mg Pulver und Lösungsmittel zur Herstellung einer Injektionslösung (im Folgenden Solu-Medrol genannt)
Anhang II Wissenschaftliche Schlussfolgerungen 10 Wissenschaftliche Schlussfolgerungen Solu-Medrol 40 mg Pulver und Lösungsmittel zur Herstellung einer Injektionslösung (im Folgenden Solu-Medrol genannt)
Anhang II. Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen 203 Wissenschaftliche Schlussfolgerungen Die Koordinierungsgruppe
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen 203 Wissenschaftliche Schlussfolgerungen Die Koordinierungsgruppe
Akute venösen Thromboembolien (VTE) oder VTE in der Vorgeschichte, einschließlich tiefer Venenthrombose und Lungenembolie.
 Aktualisierte Indikation Behandlung der schweren Osteoporose: bei postmenopausalen Frauen, bei erwachsenen Männern, mit hohem Frakturrisiko, für die eine Behandlung mit anderen für die Osteoporosetherapie
Aktualisierte Indikation Behandlung der schweren Osteoporose: bei postmenopausalen Frauen, bei erwachsenen Männern, mit hohem Frakturrisiko, für die eine Behandlung mit anderen für die Osteoporosetherapie
Anhang I. Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen
 Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
ANHANG I VERZEICHNIS DER BEZEICHNUNGEN UND DER STÄRKEN DES ARZNEIMITTELS UND DER INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN IN DEN
 ANHANG I VERZEICHNIS DER BEZEICHNUNGEN UND DER STÄRKEN DES ARZNEIMITTELS UND DER INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN IN DEN MITGLIEDSTAATEN Anhang A - Chlormezanon Mitgliedstaat Inhaber der
ANHANG I VERZEICHNIS DER BEZEICHNUNGEN UND DER STÄRKEN DES ARZNEIMITTELS UND DER INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN IN DEN MITGLIEDSTAATEN Anhang A - Chlormezanon Mitgliedstaat Inhaber der
Anhang III. Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage
 Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang I. Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen
 Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Ambroxol/Bromhexin, Hypersensitivitätsreaktionen Verfahren nach Art. 31 der RL 2001/83/EG 76. Routinesitzung,
 Ambroxol/Bromhexin, Hypersensitivitätsreaktionen Verfahren nach Art. 31 der RL 2001/83/EG 76. Routinesitzung, 21.04.2015 Betroffene Arzneimittel und Indikationen Ambroxol ist aktiver Metabolit von Bromhexin
Ambroxol/Bromhexin, Hypersensitivitätsreaktionen Verfahren nach Art. 31 der RL 2001/83/EG 76. Routinesitzung, 21.04.2015 Betroffene Arzneimittel und Indikationen Ambroxol ist aktiver Metabolit von Bromhexin
Anhang I. Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen
 Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der Europäischen Arzneimittel-Agentur für das befürwortende Gutachten für die Genehmigung für das Inverkehrbringen mit einer Auflage und die
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der Europäischen Arzneimittel-Agentur für das befürwortende Gutachten für die Genehmigung für das Inverkehrbringen mit einer Auflage und die
Komplette Zusammenfassung der wissenschaftlichen Beurteilung von Nimesulid enthaltenden Arzneimitteln zur systemischen Anwendung (siehe Anhang I)
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der EMA für die Änderungen der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage 41 Wissenschaftliche Schlussfolgerungen
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der EMA für die Änderungen der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage 41 Wissenschaftliche Schlussfolgerungen
Fachinformation. Sehr geehrte Damen und Herren,
 Datum: 09.05.2014 Kontakt: Veronika Iro Abteilung: REGA Tel. / Fax: +43 (0) 505 55 36247 E-Mail: pv-implementation@ages.at Unser Zeichen: 16c-140509-00024-A-PHV Ihr Zeichen: PHV-issue: Clindamycin hältige
Datum: 09.05.2014 Kontakt: Veronika Iro Abteilung: REGA Tel. / Fax: +43 (0) 505 55 36247 E-Mail: pv-implementation@ages.at Unser Zeichen: 16c-140509-00024-A-PHV Ihr Zeichen: PHV-issue: Clindamycin hältige
Anhang II. Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen 11 Wissenschaftliche Schlussfolgerungen Die CMDh stimmt unter Berücksichtigung der überarbeiteten endgültigen Empfehlung des PRAC vom 10. Juli 2014 in Bezug
Anhang II Wissenschaftliche Schlussfolgerungen 11 Wissenschaftliche Schlussfolgerungen Die CMDh stimmt unter Berücksichtigung der überarbeiteten endgültigen Empfehlung des PRAC vom 10. Juli 2014 in Bezug
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen
 Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen Wissenschaftliche Schlussfolgerungen Der CHMP ist unter Berücksichtigung
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen Wissenschaftliche Schlussfolgerungen Der CHMP ist unter Berücksichtigung
Anhang IV. Wissenschaftliche Schlussfolgerungen
 Anhang IV Wissenschaftliche Schlussfolgerungen 1 Wissenschaftliche Schlussfolgerungen Vier Fälle von schwerwiegenden Leberschäden, die eine Lebertransplantation erforderlich machten, wurden seit dem Inverkehrbringen
Anhang IV Wissenschaftliche Schlussfolgerungen 1 Wissenschaftliche Schlussfolgerungen Vier Fälle von schwerwiegenden Leberschäden, die eine Lebertransplantation erforderlich machten, wurden seit dem Inverkehrbringen
Neufassung des Wortlauts der Produktinformationen Auszüge aus den Empfehlungen des PRAC zu Signalen
 12 October 2017 EMA/PRAC/662561/2017 Pharmacovigilance Risk Assessment Committee (PRAC) Neufassung des Wortlauts der Produktinformationen Auszüge aus den Empfehlungen des PRAC zu Verabschiedet im Rahmen
12 October 2017 EMA/PRAC/662561/2017 Pharmacovigilance Risk Assessment Committee (PRAC) Neufassung des Wortlauts der Produktinformationen Auszüge aus den Empfehlungen des PRAC zu Verabschiedet im Rahmen
Komplette Zusammenfassung der wissenschaftlichen Beurteilung von Kytril und zugehörige Bezeichnungen (siehe Anhang I)
 ANHANG II WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG DER EUROPÄISCHEN ARZNEIMITTEL-AGENTUR FÜR DIE ÄNDERUNG DER ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS, DER ETIKETTIERUNG UND DER PACKUNGSBEILAGE
ANHANG II WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG DER EUROPÄISCHEN ARZNEIMITTEL-AGENTUR FÜR DIE ÄNDERUNG DER ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS, DER ETIKETTIERUNG UND DER PACKUNGSBEILAGE
ANHANG III RELEVANTE ABSCHNITTE DER FACH- UND GEBRAUCHSINFORMATION. Hinweis: Diese Änderungen der Zusammenfassung der Merkmale des
 ANHANG III RELEVANTE ABSCHNITTE DER FACH- UND GEBRAUCHSINFORMATION Hinweis: Diese Änderungen der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage sind zum Zeitpunkt der Entscheidung
ANHANG III RELEVANTE ABSCHNITTE DER FACH- UND GEBRAUCHSINFORMATION Hinweis: Diese Änderungen der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage sind zum Zeitpunkt der Entscheidung
ANHANG I BEZEICHNUNG, DARREICHUNGSFORM, STÄRKE DER ARZNEIMITTEL, TIERARTEN, ARTEN DER ANWENDUNG UND INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN
 ANHANG I BEZEICHNUNG, DARREICHUNGSFORM, STÄRKE DER ARZNEIMITTEL, TIERARTEN, ARTEN DER ANWENDUNG UND INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN EMEA/CVMP/166766/2006-DE Mai 2006 1/7 Inhaber der Genehmigung
ANHANG I BEZEICHNUNG, DARREICHUNGSFORM, STÄRKE DER ARZNEIMITTEL, TIERARTEN, ARTEN DER ANWENDUNG UND INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN EMEA/CVMP/166766/2006-DE Mai 2006 1/7 Inhaber der Genehmigung
Position of the Co-ordination Group for Mutual Recognition and Decentralised Procedures for human use on Periodic Safety Update Reports for
 London, 21 February 2018 EMA/CMDh/93680/2018 Co-ordination group for Human Use PSUSA/00001711/201707 Position of the Co-ordination Group for Mutual Recognition and Decentralised Procedures for human use
London, 21 February 2018 EMA/CMDh/93680/2018 Co-ordination group for Human Use PSUSA/00001711/201707 Position of the Co-ordination Group for Mutual Recognition and Decentralised Procedures for human use
L 59/20 Amtsblatt der Europäischen Union
 L 59/20 Amtsblatt der Europäischen Union 28.2.2014 DURCHFÜHRUNGSVERORDNUNG (EU) Nr. 192/2014 R KOMMISSION vom 27. Februar 2014 zur des Wirkstoffs 1,4-Dimethylnaphthalin gemäß der Verordnung (EG) Nr. 1107/2009
L 59/20 Amtsblatt der Europäischen Union 28.2.2014 DURCHFÜHRUNGSVERORDNUNG (EU) Nr. 192/2014 R KOMMISSION vom 27. Februar 2014 zur des Wirkstoffs 1,4-Dimethylnaphthalin gemäß der Verordnung (EG) Nr. 1107/2009
Anhang IV. Wissenschaftliche Schlussfolgerungen
 Anhang IV Wissenschaftliche Schlussfolgerungen 1 Wissenschaftliche Schlussfolgerungen Inhibitoren des Natrium-Glukose-Cotransporters 2 (SGLT2-Inhibitoren) werden zusammen mit Diät und Sport bei Patienten
Anhang IV Wissenschaftliche Schlussfolgerungen 1 Wissenschaftliche Schlussfolgerungen Inhibitoren des Natrium-Glukose-Cotransporters 2 (SGLT2-Inhibitoren) werden zusammen mit Diät und Sport bei Patienten
Anhang II. Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen 7 Wissenschaftliche Schlussfolgerungen Zusammenfassung der wissenschaftlichen Beurteilung methadonhaltiger Arzneimittel zum Einnehmen, in denen Povidon enthalten
Anhang II Wissenschaftliche Schlussfolgerungen 7 Wissenschaftliche Schlussfolgerungen Zusammenfassung der wissenschaftlichen Beurteilung methadonhaltiger Arzneimittel zum Einnehmen, in denen Povidon enthalten
Anhang IV. Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen
 Anhang IV Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen Wissenschaftliche Schlussfolgerungen Der CHMP berücksichtigte
Anhang IV Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen Wissenschaftliche Schlussfolgerungen Der CHMP berücksichtigte
Systemisch verabreichte Wirkstoffe, die ein hohes Risiko für das Auftreten schwerer Hautreaktionen wie SJS/TEN haben
 Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Pharmazeutische Unternehmer (s. Verteiler) Postanschrift: Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn http://www.bfarm.de
Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Pharmazeutische Unternehmer (s. Verteiler) Postanschrift: Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn http://www.bfarm.de
Neue Einschränkungen zur Minimierung der Risiken für Auswirkungen auf den Herzrhythmus bei Hydroxyzin enthaltenden Arzneimitteln
 Freitag, 27. März 2015 EMA/149624/2015 Neue Einschränkungen zur Minimierung der Risiken für Auswirkungen auf den Herzrhythmus bei Hydroxyzin enthaltenden Arzneimitteln Die Anwendung ist bei Patienten mit
Freitag, 27. März 2015 EMA/149624/2015 Neue Einschränkungen zur Minimierung der Risiken für Auswirkungen auf den Herzrhythmus bei Hydroxyzin enthaltenden Arzneimitteln Die Anwendung ist bei Patienten mit
Name. Actonel Combi D. Norsedcombi 35 mg mg/880 IU. Norsed plus Calcium D. Optinate Plus Ca &D. Opticalcio D3 35 mg mg/880 IU
 ANHANG I VERZEICHNIS DER BEZEICHNUNGEN, DARREICHUNGSFORMEN, STÄRKEN DES ARZNEIMITTELS, ART DER ANWENDUNG, ANTRAGSTELLER UND INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN IN DEN MITGLIEDSTAATEN 1 Mitgliedstaat
ANHANG I VERZEICHNIS DER BEZEICHNUNGEN, DARREICHUNGSFORMEN, STÄRKEN DES ARZNEIMITTELS, ART DER ANWENDUNG, ANTRAGSTELLER UND INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN IN DEN MITGLIEDSTAATEN 1 Mitgliedstaat
Anhang I. Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen
 Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Mitgliedstaat Inhaber der Marketing-genehmigung (Name und Adresse) Erfundener Name Stärke Darreichungsform Verabreichungsform SIMVASTATIN BMM PHARMA
 ANHANG I LISTE DER NAMEN, DARREICHUNGSFORM, STÄRKEN DER MEDIZINISCHEN PRODUKTE, VERABREICHUNGSFORM UND INHABER DER MARKETINGGENEHMIGUNG (MA) IN DEN MITGLIEDSTAATEN 1 Mitgliedstaat Inhaber der Marketing-genehmigung
ANHANG I LISTE DER NAMEN, DARREICHUNGSFORM, STÄRKEN DER MEDIZINISCHEN PRODUKTE, VERABREICHUNGSFORM UND INHABER DER MARKETINGGENEHMIGUNG (MA) IN DEN MITGLIEDSTAATEN 1 Mitgliedstaat Inhaber der Marketing-genehmigung
Pathophysiologie und therapeutisches Management von Arzneimittelreaktionen
 Pathophysiologie und therapeutisches Management von Arzneimittelreaktionen Wolfgang Pfützner Vortrag vom 18.06.2016 Arzneimittel-Nebenwirkungen Eine nicht beabsichtigte Wirkung, ausgelöst durch eine normalerweise
Pathophysiologie und therapeutisches Management von Arzneimittelreaktionen Wolfgang Pfützner Vortrag vom 18.06.2016 Arzneimittel-Nebenwirkungen Eine nicht beabsichtigte Wirkung, ausgelöst durch eine normalerweise
Die häufigsten Auslöser allergischer Arzneimittel- Wirkungen in der Schweiz Dr. Raymond Schlienger, MPH
 Die häufigsten Auslöser allergischer Arzneimittel- Wirkungen in der Schweiz Dr. Raymond Schlienger, MPH Basel Pharmacoepidemiology Unit (BPU) Abt. für Klinische Pharmakologie & Toxikologie Kantonsspital
Die häufigsten Auslöser allergischer Arzneimittel- Wirkungen in der Schweiz Dr. Raymond Schlienger, MPH Basel Pharmacoepidemiology Unit (BPU) Abt. für Klinische Pharmakologie & Toxikologie Kantonsspital
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union,
 L 367/16 23.12.2014 LEGIERTE VERORDNUNG (EU) Nr. 1378/2014 R KOMMISSION vom 17. Oktober 2014 zur Änderung des Anhangs I der Verordnung (EU) Nr. 1305/2013 des Europäischen Parlaments und des Rates und der
L 367/16 23.12.2014 LEGIERTE VERORDNUNG (EU) Nr. 1378/2014 R KOMMISSION vom 17. Oktober 2014 zur Änderung des Anhangs I der Verordnung (EU) Nr. 1305/2013 des Europäischen Parlaments und des Rates und der
Amtsblatt der Europäischen Union L 309/17
 19.11.2013 Amtsblatt der Europäischen Union L 309/17 DURCHFÜHRUNGSVERORDNUNG (EU) Nr. 1165/2013 R KOMMISSION vom 18. November 2013 zur des Wirkstoffs Orangenöl gemäß der Verordnung (EG) Nr. 1107/2009 des
19.11.2013 Amtsblatt der Europäischen Union L 309/17 DURCHFÜHRUNGSVERORDNUNG (EU) Nr. 1165/2013 R KOMMISSION vom 18. November 2013 zur des Wirkstoffs Orangenöl gemäß der Verordnung (EG) Nr. 1107/2009 des
Anhang II. Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen 13 Wissenschaftliche Schlussfolgerungen Haldol, das den Wirkstoff Haloperidol enthält, ist ein Antipsychotikum aus der Gruppe der Butyrophenone. Es handelt
Anhang II Wissenschaftliche Schlussfolgerungen 13 Wissenschaftliche Schlussfolgerungen Haldol, das den Wirkstoff Haloperidol enthält, ist ein Antipsychotikum aus der Gruppe der Butyrophenone. Es handelt
ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION
 ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION Diese Änderungen von SPC und Packungsbeilage treten zum Zeitpunkt der Kommissionsentscheidung in Kraft.
ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION Diese Änderungen von SPC und Packungsbeilage treten zum Zeitpunkt der Kommissionsentscheidung in Kraft.
Position of the Co-ordination Group for Mutual Recognition and Decentralised Procedures for human use on Periodic Safety Update Reports for
 London, 30 January 2019 EMA/28476/2019 Co-ordination group for Human Use PSUSA/00010665/201805 Position of the Co-ordination Group for Mutual Recognition and Decentralised Procedures for human use on Periodic
London, 30 January 2019 EMA/28476/2019 Co-ordination group for Human Use PSUSA/00010665/201805 Position of the Co-ordination Group for Mutual Recognition and Decentralised Procedures for human use on Periodic
Anhang I. Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen
 Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anleitung zur Interpretation von spontanen Fallberichten über Verdachtsfälle von Arzneimittelnebenwirkungen
 30. Januar 2017 Inspektionen, Pharmakovigilanz von Humanarzneimitteln und Ausschüsse EMA/749446/2016 Revision 1* Anleitung zur Interpretation von spontanen Fallberichten über Verdachtsfälle von Vereinbarung
30. Januar 2017 Inspektionen, Pharmakovigilanz von Humanarzneimitteln und Ausschüsse EMA/749446/2016 Revision 1* Anleitung zur Interpretation von spontanen Fallberichten über Verdachtsfälle von Vereinbarung
Anhang IV. Bedingungen der Genehmigungen für das Inverkehrbringen
 Anhang IV Bedingungen der Genehmigungen für das Inverkehrbringen 66 Bedingungen der Genehmigung(en) für das Inverkehrbringen Die Inhaber der Genehmigungen für das Inverkehrbringen müssen innerhalb der
Anhang IV Bedingungen der Genehmigungen für das Inverkehrbringen 66 Bedingungen der Genehmigung(en) für das Inverkehrbringen Die Inhaber der Genehmigungen für das Inverkehrbringen müssen innerhalb der
Datum: Kontakt: Abteilung: Tel. / Fax: Unser Zeichen: Ihr Zeichen:
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 28.11.2016 Ing. Veronika Iro, B.Sc. REGA +43 (0) 505 55 36247 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 28.11.2016 Ing. Veronika Iro, B.Sc. REGA +43 (0) 505 55 36247 pv-implementation@ages.at
Art. 107i-Verfahren nach RL 2001/83/EG zu Cyproteronazetat/Ethinylestradiol (2mg/0,035mg): Diane 35 und Generika. 72. Routinesitzung 29.
 Art. 107i-Verfahren nach RL 2001/83/EG zu Cyproteronazetat/Ethinylestradiol (2mg/0,035mg): Diane 35 und Generika 72. Routinesitzung 29. Mai 2013 Hintergrund des Verfahrens Neubewertung des Nutzen-Risiko-Verhältnisses
Art. 107i-Verfahren nach RL 2001/83/EG zu Cyproteronazetat/Ethinylestradiol (2mg/0,035mg): Diane 35 und Generika 72. Routinesitzung 29. Mai 2013 Hintergrund des Verfahrens Neubewertung des Nutzen-Risiko-Verhältnisses
(Rechtsakte ohne Gesetzescharakter) VERORDNUNGEN
 14.5.2014 L 139/1 II (Rechtsakte ohne Gesetzescharakter) VERORDNUNGEN LEGIERTE VERORDNUNG (EU) Nr. 492/2014 R KOMMISSION vom 7. März 2014 zur Ergänzung der Verordnung (EU) Nr. 528/2012 des Europäischen
14.5.2014 L 139/1 II (Rechtsakte ohne Gesetzescharakter) VERORDNUNGEN LEGIERTE VERORDNUNG (EU) Nr. 492/2014 R KOMMISSION vom 7. März 2014 zur Ergänzung der Verordnung (EU) Nr. 528/2012 des Europäischen
Gebrauchsinformation: Information für Anwender. Azyter 15 mg/g Augentropfen im Einzeldosisbehältnis Azithromycin 2 H 2O
 PACKUNGSBEILAGE Gebrauchsinformation: Information für Anwender Azyter 15 mg/g Augentropfen im Einzeldosisbehältnis Azithromycin 2 H 2O Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
PACKUNGSBEILAGE Gebrauchsinformation: Information für Anwender Azyter 15 mg/g Augentropfen im Einzeldosisbehältnis Azithromycin 2 H 2O Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
BAnz AT B7. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
DURCHFÜHRUNGSBESCHLUSS DER KOMMISSION
 13.12.2013 Amtsblatt der Europäischen Union L 334/37 DURCHFÜHRUNGSBESCHLUSS DER KOMMISSION vom 11. Dezember 2013 zur Änderung des Beschlusses 2012/226/EU über die zweite Reihe gemeinsamer Sicherheitsziele
13.12.2013 Amtsblatt der Europäischen Union L 334/37 DURCHFÜHRUNGSBESCHLUSS DER KOMMISSION vom 11. Dezember 2013 zur Änderung des Beschlusses 2012/226/EU über die zweite Reihe gemeinsamer Sicherheitsziele
Allergologische Tests: T-Zell-Assays
 Allergologische Tests: T-Zell-Assays Proliferations-Assay LTT CD69 CD25 mam AM HLA-DR APZ Nachweis spezifischer Zytokine IL-4, IL-5 IFN-γ ELISA / ELISPOT Granzym B Perforin nach: Pfützner W, Möbs C (2014)
Allergologische Tests: T-Zell-Assays Proliferations-Assay LTT CD69 CD25 mam AM HLA-DR APZ Nachweis spezifischer Zytokine IL-4, IL-5 IFN-γ ELISA / ELISPOT Granzym B Perforin nach: Pfützner W, Möbs C (2014)
Bewilligungsantrag Nucala (Mepolizumab) - Erstdokumentation
 Bewilligungsantrag - Erstdokumentation Sozialversicherungsnummer: Anwendungsgebiet: ist angezeigt als Zusatzbehandlung bei schwerem refraktärem eosinophilem Asthma bei erwachsenen Patienten (siehe Fachinformation
Bewilligungsantrag - Erstdokumentation Sozialversicherungsnummer: Anwendungsgebiet: ist angezeigt als Zusatzbehandlung bei schwerem refraktärem eosinophilem Asthma bei erwachsenen Patienten (siehe Fachinformation
DURCHFÜHRUNGSVERORDNUNG (EU) 2018/891 DER KOMMISSION
 22.6.2018 L 159/21 VERORDNUNGEN DURCHFÜHRUNGSVERORDNUNG (EU) 2018/891 R KOMMISSION vom 21. Juni 2018 zur Festsetzung der Höchstbeträge für 2018 für bestimmte Direktzahlungsregelungen gemäß der Verordnung
22.6.2018 L 159/21 VERORDNUNGEN DURCHFÜHRUNGSVERORDNUNG (EU) 2018/891 R KOMMISSION vom 21. Juni 2018 zur Festsetzung der Höchstbeträge für 2018 für bestimmte Direktzahlungsregelungen gemäß der Verordnung
Datum: Kontakt: Abteilung: Tel. / Fax: Unser Zeichen: Ihr Zeichen:
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 25.10.2017 Ing. Veronika Iro, B.Sc. REGA +43 (0) 505 55 36247 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 25.10.2017 Ing. Veronika Iro, B.Sc. REGA +43 (0) 505 55 36247 pv-implementation@ages.at
DURCHFÜHRUNGSVERORDNUNG (EU) 2016/699 DER KOMMISSION
 11.5.2016 L 121/11 DURCHFÜHRUNGSVERORDNUNG (EU) 2016/699 R KOMMISSION vom 10. Mai 2016 zur Festsetzung der Höchstbeträge für 2016 für bestimmte Direktzahlungsregelungen gemäß der Verordnung (EU) Nr. 1307/2013
11.5.2016 L 121/11 DURCHFÜHRUNGSVERORDNUNG (EU) 2016/699 R KOMMISSION vom 10. Mai 2016 zur Festsetzung der Höchstbeträge für 2016 für bestimmte Direktzahlungsregelungen gemäß der Verordnung (EU) Nr. 1307/2013
Wissenschaftliche Schlussfolgerungen und detaillierte Erklärung der wissenschaftlichen Gründe für die Abweichungen von der Empfehlung des PRAC
 Anhang II Wissenschaftliche Schlussfolgerungen und detaillierte Erklärung der wissenschaftlichen Gründe für die Abweichungen von der Empfehlung des PRAC 33 Wissenschaftliche Schlussfolgerungen und detaillierte
Anhang II Wissenschaftliche Schlussfolgerungen und detaillierte Erklärung der wissenschaftlichen Gründe für die Abweichungen von der Empfehlung des PRAC 33 Wissenschaftliche Schlussfolgerungen und detaillierte
1. Zusatznutzen des Arzneimittels im Verhältnis zur zweckmäßigen Vergleichstherapie
 Fidaxomicin Beschluss vom: 4. Juli 2013 gültig bis: unbefristet In Kraft getreten am: 4. Juli 2013 BAnz AT 02.08.2013 B7 Zugelassenes Anwendungsgebiet1 (Stand Januar 2013): DIFICLIR ist indiziert bei Erwachsenen
Fidaxomicin Beschluss vom: 4. Juli 2013 gültig bis: unbefristet In Kraft getreten am: 4. Juli 2013 BAnz AT 02.08.2013 B7 Zugelassenes Anwendungsgebiet1 (Stand Januar 2013): DIFICLIR ist indiziert bei Erwachsenen
Anhang III. Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des
Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des
Aus: Terbinafin Schäfer-Korting/Schmid-Wendtner Copyright 2006 ABW Wissenschaftsverlag GmbH, Kurfürstendamm 57, Berlin
 10 Verträglichkeit Bis heute haben weltweit mehr als 18 Millionen Patienten Terbinafin systemisch eingenommen. Das Auftreten unerwünschter Wirkungen sowie Interaktionen mit anderen Arzneimitteln wurden
10 Verträglichkeit Bis heute haben weltweit mehr als 18 Millionen Patienten Terbinafin systemisch eingenommen. Das Auftreten unerwünschter Wirkungen sowie Interaktionen mit anderen Arzneimitteln wurden
Dermatologie in der Hausarzt und Notfallpraxis Tips und Tricks für den Praktiker Paul Scheidegger, Brugg
 Dermatologie in der Hausarzt und Notfallpraxis Tips und Tricks für den Praktiker Paul Scheidegger, Brugg www.allergieundhaut.ch!' !!!! Der Ausschlag Juckreiz Gesicht einer Frau / Genitale beim Mann Der
Dermatologie in der Hausarzt und Notfallpraxis Tips und Tricks für den Praktiker Paul Scheidegger, Brugg www.allergieundhaut.ch!' !!!! Der Ausschlag Juckreiz Gesicht einer Frau / Genitale beim Mann Der
Bezeichnung INN Stärke Darreichungsform Art der Anwendung. Fipronil 412,5 mg
 Anhang I Liste der Bezeichnungen, Darreichungsform, Stärken des Tierarzneimittels, Zieltierarten, Art der Anwendung und Inhaber der Genehmigung für das in den Mitgliedstaaten 1/15 Mitgliedstaat EU/EWR
Anhang I Liste der Bezeichnungen, Darreichungsform, Stärken des Tierarzneimittels, Zieltierarten, Art der Anwendung und Inhaber der Genehmigung für das in den Mitgliedstaaten 1/15 Mitgliedstaat EU/EWR
Empfehlungen des PRAC zu Signalen für die Aktualisierung der Produktinformationen
 23 April 2015 EMA/PRAC/273924/2015 Pharmacovigilance Risk Assessment Committee Empfehlungen des PRAC zu Signalen für die Aktualisierung der Produktinformationen Verabschiedet im Rahmen der PRAC-Sitzung
23 April 2015 EMA/PRAC/273924/2015 Pharmacovigilance Risk Assessment Committee Empfehlungen des PRAC zu Signalen für die Aktualisierung der Produktinformationen Verabschiedet im Rahmen der PRAC-Sitzung
Rat der Europäischen Union Brüssel, den 11. April 2017 (OR. en)
 Rat der Europäischen Union Brüssel, den. April 207 (OR. en) Interinstitutionelles Dossier: 207/00 (NLE) 5649/7 SCH-EVAL 28 SIRIS 4 COMIX 59 GESETZGEBUNGSAKTE UND ANRE RECHTSINSTRUMENTE Betr.: BESCHLUSS
Rat der Europäischen Union Brüssel, den. April 207 (OR. en) Interinstitutionelles Dossier: 207/00 (NLE) 5649/7 SCH-EVAL 28 SIRIS 4 COMIX 59 GESETZGEBUNGSAKTE UND ANRE RECHTSINSTRUMENTE Betr.: BESCHLUSS
(Text von Bedeutung für den EWR)
 L 118/18 DURCHFÜHRUNGSBESCHLUSS (EU) 2018/704 R KOMMISSION vom 8. Mai 2018 bezüglich der Konformität der Gebührensätze für die einzelnen n mit den Durchführungsverordnungen (EU) Nr. 390/2013 und (EU) Nr.
L 118/18 DURCHFÜHRUNGSBESCHLUSS (EU) 2018/704 R KOMMISSION vom 8. Mai 2018 bezüglich der Konformität der Gebührensätze für die einzelnen n mit den Durchführungsverordnungen (EU) Nr. 390/2013 und (EU) Nr.
Anhang III. Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen
 Anhang III Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen Anmerkung: Diese Änderungen der entsprechenden Abschnitte der Zusammenfassung
Anhang III Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen Anmerkung: Diese Änderungen der entsprechenden Abschnitte der Zusammenfassung
RoACTEMRA (Tocilizumab) Patientenpass
 RoACTEMRA (Tocilizumab) Patientenpass Dieser Patientenpass ist eine Auflage im Rahmen der Zulassung von RoACTEMRA und enthält wichtige Sicherheitsinformationen, über die Patienten bzw. deren Eltern/gesetzliche
RoACTEMRA (Tocilizumab) Patientenpass Dieser Patientenpass ist eine Auflage im Rahmen der Zulassung von RoACTEMRA und enthält wichtige Sicherheitsinformationen, über die Patienten bzw. deren Eltern/gesetzliche
Anhang II. Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen 74 Wissenschaftliche Schlussfolgerungen Am 7. Juli 2016 veranlasste das Vereinigte Königreich ein Verfahren nach Artikel 31 der Richtlinie 2001/83/EG aufgrund
Anhang II Wissenschaftliche Schlussfolgerungen 74 Wissenschaftliche Schlussfolgerungen Am 7. Juli 2016 veranlasste das Vereinigte Königreich ein Verfahren nach Artikel 31 der Richtlinie 2001/83/EG aufgrund
Methotrexat - Risiko der Überdosierung durch Anwendungsfehler. Verfahren nach Art. 31 der Richtlinie 2001/83/EG
 Methotrexat - Risiko der Überdosierung durch Anwendungsfehler Verfahren nach Art. 31 der Richtlinie 2001/83/EG 82. Routinesitzung, 19. April 2018 82. Routinesitzung 19. April 2018 Seite 1 Einleitung eines
Methotrexat - Risiko der Überdosierung durch Anwendungsfehler Verfahren nach Art. 31 der Richtlinie 2001/83/EG 82. Routinesitzung, 19. April 2018 82. Routinesitzung 19. April 2018 Seite 1 Einleitung eines
Anhang II. Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen 7 Wissenschaftliche Schlussfolgerungen Amitriptylin ist ein gut bekanntes trizyklisches Antidepressivum mit bekanntem Wirkmechanismus und bewährter Anwendung
Anhang II Wissenschaftliche Schlussfolgerungen 7 Wissenschaftliche Schlussfolgerungen Amitriptylin ist ein gut bekanntes trizyklisches Antidepressivum mit bekanntem Wirkmechanismus und bewährter Anwendung
Neufassung des Wortlauts der Produktinformationen Auszüge aus den Empfehlungen des PRAC zu Signalen
 20 July 2017 EMA/PRAC/467483/2017 Pharmacovigilance Risk Assessment Committee (PRAC) Neufassung des Wortlauts der Produktinformationen Auszüge aus den Empfehlungen des PRAC zu Verabschiedet im Rahmen der
20 July 2017 EMA/PRAC/467483/2017 Pharmacovigilance Risk Assessment Committee (PRAC) Neufassung des Wortlauts der Produktinformationen Auszüge aus den Empfehlungen des PRAC zu Verabschiedet im Rahmen der
Anhang III. Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage
 Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
β-lactam-antibiotika: Was tun, wenn der Patient angibt, auf Penizillin allergisch zu sein? Medikamentenallergien 26. Februar 2004 Michael Fricker
 β-lactam-antibiotika: Was tun, wenn der Patient angibt, auf Penizillin allergisch zu sein? Medikamentenallergien 26. Februar 2004 Michael Fricker Fallbeispiel (frei erfunden oder nicht?) erstmalige Konsultation
β-lactam-antibiotika: Was tun, wenn der Patient angibt, auf Penizillin allergisch zu sein? Medikamentenallergien 26. Februar 2004 Michael Fricker Fallbeispiel (frei erfunden oder nicht?) erstmalige Konsultation
ANHANG II WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG FÜR DAS POSITIVE GUTACHTEN
 ANHANG II WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG FÜR DAS POSITIVE GUTACHTEN 3 Wissenschaftliche Schlussfolgerungen Komplette Zusammenfassung der wissenschaftlichen Beurteilung von Okrido und
ANHANG II WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG FÜR DAS POSITIVE GUTACHTEN 3 Wissenschaftliche Schlussfolgerungen Komplette Zusammenfassung der wissenschaftlichen Beurteilung von Okrido und
Definition der Urtikaria
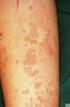 Haut und Allergie Urtikaria und Angioödem Definition der Urtikaria Exanthem, bestehend aus (flüchtigen) Quaddeln Angioödem Pruritus + bis +++ Abheilung ohne Narben ohne Pigmentverschiebung ohne Kratzspuren
Haut und Allergie Urtikaria und Angioödem Definition der Urtikaria Exanthem, bestehend aus (flüchtigen) Quaddeln Angioödem Pruritus + bis +++ Abheilung ohne Narben ohne Pigmentverschiebung ohne Kratzspuren
ANHANG. des. Berichts der Kommission an das Europäische Parlament und den Rat
 EUROPÄISCHE KOMMISSION Brüssel, den 17.5.2017 COM(2017) 242 final ANNEX 1 ANHANG des Berichts der Kommission an das Europäische Parlament und den Rat über die Überprüfung der praktischen Anwendung der
EUROPÄISCHE KOMMISSION Brüssel, den 17.5.2017 COM(2017) 242 final ANNEX 1 ANHANG des Berichts der Kommission an das Europäische Parlament und den Rat über die Überprüfung der praktischen Anwendung der
ANHANG III. Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 ANHANG III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Die zuständigen Behörden der Mitgliedstaaten müssen die Zusammenfassung der
ANHANG III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Die zuständigen Behörden der Mitgliedstaaten müssen die Zusammenfassung der
Datum: Kontakt: Abteilung: Tel. / Fax: Unser Zeichen: Ihr Zeichen:
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 14.03.2016 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 14.03.2016 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
(Rechtsakte ohne Gesetzescharakter) VERORDNUNGEN
 19.2.2014 Amtsblatt der Europäischen Union L 48/1 II (Rechtsakte ohne Gesetzescharakter) VERORDNUNGEN DURCHFÜHRUNGSVERORDNUNG (EU) Nr. 151/2014 R KOMMISSION vom 18. Februar 2014 zur Genehmigung des Wirkstoffs
19.2.2014 Amtsblatt der Europäischen Union L 48/1 II (Rechtsakte ohne Gesetzescharakter) VERORDNUNGEN DURCHFÜHRUNGSVERORDNUNG (EU) Nr. 151/2014 R KOMMISSION vom 18. Februar 2014 zur Genehmigung des Wirkstoffs
Verordnung über das Inverkehrbringen von Pflanzenschutzmitteln
 Verordnung über das Inverkehrbringen von Pflanzenschutzmitteln (Pflanzenschutzmittelverordnung, PSMV) Änderung vom 31. Oktober 2018 Der Schweizerische Bundesrat verordnet: I Die Pflanzenschutzmittelverordnung
Verordnung über das Inverkehrbringen von Pflanzenschutzmitteln (Pflanzenschutzmittelverordnung, PSMV) Änderung vom 31. Oktober 2018 Der Schweizerische Bundesrat verordnet: I Die Pflanzenschutzmittelverordnung
11130/15 hm/ab 1 DG D 1B
 Rat der Europäischen Union Brüssel, den 22. Juli 2015 (OR. en) 11130/15 ASIM 62 RELEX 633 VERMERK Absender: Empfänger: Generalsekretariat des Rates Delegationen Nr. Vordok.: 10830/2/15 REV 2 ASIM 52 RELEX
Rat der Europäischen Union Brüssel, den 22. Juli 2015 (OR. en) 11130/15 ASIM 62 RELEX 633 VERMERK Absender: Empfänger: Generalsekretariat des Rates Delegationen Nr. Vordok.: 10830/2/15 REV 2 ASIM 52 RELEX
Die Aufgaben des Pharmacovigilance Risk Assessment Committee (PRAC)
 Die Aufgaben des Pharmacovigilance Risk Assessment Committee (PRAC) November 2012 Hintergrund Verordnung (EU) Nr. 1235/2010 des Europäischen Parlaments und des Rates vom 15. Dezember 2010 (8) Um sicherzustellen,
Die Aufgaben des Pharmacovigilance Risk Assessment Committee (PRAC) November 2012 Hintergrund Verordnung (EU) Nr. 1235/2010 des Europäischen Parlaments und des Rates vom 15. Dezember 2010 (8) Um sicherzustellen,
MITTEILUNG DER KOMMISSION
 MITTEILUNG DER KOMMISSION Mitteilung der Kommission über die Anwendung neuer Verfahren für die Zulassung von Human- und Tierarzneimitteln gemäß der Verordnung (EWG) Nr. 2309/93 des Rates vom 22. Juli 1993
MITTEILUNG DER KOMMISSION Mitteilung der Kommission über die Anwendung neuer Verfahren für die Zulassung von Human- und Tierarzneimitteln gemäß der Verordnung (EWG) Nr. 2309/93 des Rates vom 22. Juli 1993
(Text von Bedeutung für den EWR)
 L 24/6 DE 30.1.2016 DURCHFÜHRUNGSVERORDNUNG (EU) 2016/125 DER KOMMISSION vom 29. Januar 2016 über die von PHMB (1600; 1.8) als alten Wirkstoff zur Verwendung in Biozidprodukten der en 2, 3 und 11 (Text
L 24/6 DE 30.1.2016 DURCHFÜHRUNGSVERORDNUNG (EU) 2016/125 DER KOMMISSION vom 29. Januar 2016 über die von PHMB (1600; 1.8) als alten Wirkstoff zur Verwendung in Biozidprodukten der en 2, 3 und 11 (Text
Datum: Kontakt: Abteilung: Tel. / Fax: Unser Zeichen: Ihr Zeichen:
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 25.06.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 25.06.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
Hedera Effervescent Tablets MODULE Product Information SPC, Labelling and Package Leaflet 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 1.3.1 SPC, LABELLING AND PACKAGE LEAFLET Beschriftungsentwurf der Fachinformation Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Bronchoverde Hustenlöser 50 mg Brausetabletten
1.3.1 SPC, LABELLING AND PACKAGE LEAFLET Beschriftungsentwurf der Fachinformation Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Bronchoverde Hustenlöser 50 mg Brausetabletten
Anhang II. Wissenschaftliche Schlussfolgerungen und Begründung der Europäischen Arzneimittel-Agentur für die Versagung
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der Europäischen Arzneimittel-Agentur für die Versagung 4 Wissenschaftliche Schlussfolgerungen Komplette Zusammenfassung der wissenschaftlichen
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der Europäischen Arzneimittel-Agentur für die Versagung 4 Wissenschaftliche Schlussfolgerungen Komplette Zusammenfassung der wissenschaftlichen
Risikoüberwachung von Arzneimitteln - Aktuelle Situation
 Risikoüberwachung von Arzneimitteln - Aktuelle Situation U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte Abteilung Pharmakovigilanz Fortbildung für den Öffentlichen Dienst Berlin, 2. April
Risikoüberwachung von Arzneimitteln - Aktuelle Situation U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte Abteilung Pharmakovigilanz Fortbildung für den Öffentlichen Dienst Berlin, 2. April
Gebrauchsinformation: Information für Patienten. Osanit Hustenkügelchen Wirkstoff: Drosera D6
 Osanit Hustenkügelchen Seite 1 von 5 Gebrauchsinformation: Information für Patienten Osanit Hustenkügelchen Wirkstoff: Drosera D6 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Osanit Hustenkügelchen Seite 1 von 5 Gebrauchsinformation: Information für Patienten Osanit Hustenkügelchen Wirkstoff: Drosera D6 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Fachinformation. Sonstige Bestandteile mit bekannter Wirkung:Enthält u.a. Macrogolglycerolhydroxystearat und Ethanol.
 Fachinformation 1. Bezeichnung des Arzneimittels Thymian Hustenlösung Flüssigkeit zum Einnehmen 2. Qualitative und quantitative Zusammensetzung 100 ml (entsprechend 97 g) Flüssigkeit enthalten: Wirkstoff:
Fachinformation 1. Bezeichnung des Arzneimittels Thymian Hustenlösung Flüssigkeit zum Einnehmen 2. Qualitative und quantitative Zusammensetzung 100 ml (entsprechend 97 g) Flüssigkeit enthalten: Wirkstoff:
Seminar. Management von unerwünschten Arzneimittelwirkungen an der Haut. Gesellschaft für Dermopharmazie
 Abstracts Seminar Management von unerwünschten Arzneimittelwirkungen an der Haut Gesellschaft für Dermopharmazie Vorsitzende: Dr. Joachim Kresken, Viersen Prof. Dr. med. Axel Schnuch, Göttingen 16. GD
Abstracts Seminar Management von unerwünschten Arzneimittelwirkungen an der Haut Gesellschaft für Dermopharmazie Vorsitzende: Dr. Joachim Kresken, Viersen Prof. Dr. med. Axel Schnuch, Göttingen 16. GD
Wichtige Information zur Risikominimierung bei der Anwendung von Hydroxyethylstärke-haltigen Infusionslösungen. Schulung
 Pflicht-Schulung Wichtige Information zur Risikominimierung bei der Anwendung von Hydroxyethylstärke-haltigen Infusionslösungen Schulung Anwendung von Hydroxyethylstärke-Lösungen in Übereinstimmung mit
Pflicht-Schulung Wichtige Information zur Risikominimierung bei der Anwendung von Hydroxyethylstärke-haltigen Infusionslösungen Schulung Anwendung von Hydroxyethylstärke-Lösungen in Übereinstimmung mit
(Rechtsakte ohne Gesetzescharakter) VERORDNUNGEN
 27.8.2016 DE L 232/1 II (Rechtsakte ohne Gesetzescharakter) VERORDNUNGEN DURCHFÜHRUNGSVERORDNUNG (EU) 2016/1429 DER KOMMISSION vom 26. August 2016 zur Genehmigung des Wirkstoffs Bacillus amyloliquefaciens
27.8.2016 DE L 232/1 II (Rechtsakte ohne Gesetzescharakter) VERORDNUNGEN DURCHFÜHRUNGSVERORDNUNG (EU) 2016/1429 DER KOMMISSION vom 26. August 2016 zur Genehmigung des Wirkstoffs Bacillus amyloliquefaciens
(Rechtsakte ohne Gesetzescharakter) VERORDNUNGEN
 18.4.2013 Amtsblatt der Europäischen Union L 108/1 II (Rechtsakte ohne Gesetzescharakter) VERORDNUNGEN VERORDNUNG (EU) Nr. 348/2013 DER KOMMISSION vom 17. April 2013 zur Änderung von Anhang XIV der Verordnung
18.4.2013 Amtsblatt der Europäischen Union L 108/1 II (Rechtsakte ohne Gesetzescharakter) VERORDNUNGEN VERORDNUNG (EU) Nr. 348/2013 DER KOMMISSION vom 17. April 2013 zur Änderung von Anhang XIV der Verordnung
ÄNDERUNGSANTRÄGE 15-28
 EUROPÄISCHES PARLAMENT 2009-2014 Ausschuss für Industrie, Forschung und Energie 23.2.2010 2008/0257(COD) ÄNRUNGSANTRÄGE 15-28 Entwurf einer Stellungnahme Michèle Rivasi (PE430.771v01-00) zu dem Vorschlag
EUROPÄISCHES PARLAMENT 2009-2014 Ausschuss für Industrie, Forschung und Energie 23.2.2010 2008/0257(COD) ÄNRUNGSANTRÄGE 15-28 Entwurf einer Stellungnahme Michèle Rivasi (PE430.771v01-00) zu dem Vorschlag
(Rechtsakte ohne Gesetzescharakter) VERORDNUNGEN
 30.1.2016 DE L 24/1 II (Rechtsakte ohne Gesetzescharakter) VERORDNUNGEN DURCHFÜHRUNGSVERORDNUNG (EU) 2016/124 DER KOMMISSION vom 29. Januar 2016 zur von PHMB (1600; 1.8) als alten Wirkstoff zur Verwendung
30.1.2016 DE L 24/1 II (Rechtsakte ohne Gesetzescharakter) VERORDNUNGEN DURCHFÜHRUNGSVERORDNUNG (EU) 2016/124 DER KOMMISSION vom 29. Januar 2016 zur von PHMB (1600; 1.8) als alten Wirkstoff zur Verwendung
Anhang II. Wissenschaftliche Schlussfolgerungen und Begründung der EMA für die Aussetzung des Inverkehrbringens und der Anwendung der Arzneimittel
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der EMA für die Aussetzung des Inverkehrbringens und der Anwendung der Arzneimittel 14 Wissenschaftliche Schlussfolgerungen Komplette Zusammenfassung
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der EMA für die Aussetzung des Inverkehrbringens und der Anwendung der Arzneimittel 14 Wissenschaftliche Schlussfolgerungen Komplette Zusammenfassung
Datum: Kontakt: Abteilung: Tel. / Fax: Unser Zeichen: Ihr Zeichen:
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 12.09.2014 Veronika Iro REGA +43 (0) 505 55 36247 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 12.09.2014 Veronika Iro REGA +43 (0) 505 55 36247 pv-implementation@ages.at
RoACTEMRA (Tocilizumab) i.v. und s.c. Patientenpass
 RoACTEMRA (Tocilizumab) i.v. und s.c. Patientenpass Dieser Patientenpass enthält wichtige Sicherheitsinformationen, über die Patienten bzw. deren Eltern/ Erziehungsberechtigte Bescheid wissen müssen, bevor,
RoACTEMRA (Tocilizumab) i.v. und s.c. Patientenpass Dieser Patientenpass enthält wichtige Sicherheitsinformationen, über die Patienten bzw. deren Eltern/ Erziehungsberechtigte Bescheid wissen müssen, bevor,
Pharmakovigilanz update Umsetzung in nationale Gesetzgebung
 Pharmakovigilanz update Umsetzung in nationale Gesetzgebung 13. DGRA Jahreskongress Jan Farzan Brigitte Keller-Stanislawski Überblick UAW Definition und Meldungen Koordinierungsgruppe Risikomanagement
Pharmakovigilanz update Umsetzung in nationale Gesetzgebung 13. DGRA Jahreskongress Jan Farzan Brigitte Keller-Stanislawski Überblick UAW Definition und Meldungen Koordinierungsgruppe Risikomanagement
