Minilabor. Versuchsanleitungen. Naturwissenschaftliches Arbeiten
|
|
|
- Kerstin Hase
- vor 6 Jahren
- Abrufe
Transkript
1 Minilabor Versuchsanleitungen Naturwissenschaftliches Arbeiten Professor Michael Schallies Zinsser Analytic D Frankfurt, Eschborner Landstraße 135 Tel.: , Fax: GB-Maidenhead, Berks. SL6 1AP, Howarth Road Tel.: , Fax: USA-Northridge, CA 91324, Parthenia Street, Ste.C Tel.: , fax: Internet:
2 Inhaltsverzeichnis V : Extraktion und Chromatographie von Blattfarbstoffen... 3 V : Isolierung von Zimtaldehyd aus Zimtstangen durch Wasserdampf-Destillation. 4 V: Umkristallisation von Benzoesäure... 5 V: Destillation von Rotwein... 6 V : Herstellung und Nachweis von Wasserstoff... 7 V : Herstellung und Nachweis von Sauerstoff... 8 V: Herstellung und Nachweis von Kohlenstoffdioxid... 9 V : Entwicklung und Nachweis von Sauerstoff und Kohlenstoffdioxid aus Fleckensalz V: Nachweis von Methanol bzw. Ethanol als Borsäureester V: Wasserreinigung V: Isolierung von Lebensmittelfarbstoffen V: Fettgehalt von Wurst V: Kalk im Boden (qualitativer Nachweis)... 16
3 V : Extraktion und Chromatographie von Blattfarbstoffen Ethanol 10 ml Petrolether (40-60 ) 5 ml 11-51/ Aceton 1 ml DC Kieselgel- Fertigfolie 1 1. Thermoblock auf den Magnetheizrührer stellen und auf 100 C einregulieren. (Temperaturkontrolle mit Digital- Thermometer Digitemp) ml Ethanol in das Reaktionsgefäß 24mL füllen und einen Miniatur- Rührmagneten hinzugeben. 3. Schraubkupplung 20/20 auf das Reaktionsgefäß aufschrauben. PTFE- Filterträger und Filterpapier in die Schraubkupplung 20/20 einlegen und Gewinderohr aufschrauben. 4. Ein bis zwei Brennnesselblätter in das Gewinderohr stecken. 5. Fertige Apparatur in den Thermoblock stellen und bei einer Blocktemperatur von 100 C erhitzen. Beobachtung: Nach kurzer Zeit kondensiert im Gewinderohr das grün gefärbte Lösemittel. Durch Herausnehmen der Apparatur aus dem Thermoblock und Abkühlen des Reaktionsgefäßes fließt das Lösemittel in das Reaktionsgefäß zurück. Der Extraktionsvorgang kann nun mehrfach wiederholt werden. Die Blätter im Gewinderohr werden deutlich heller bis farblos und sind bei Versuchsende spröde geworden. Chromatographie des Extraktes: Blattfarbstoffextrakt etwa 1cm vom unteren Rand der DC-Folie entfernt mit einer Kapillare auftragen (bei schwach gefärbten Extrakten zwei bis dreimal). Das Laufmittelgemisch (Petrolether/Aceton im Verhältnis 5 / 1) in ein Schraubdeckelglas, das als Chromatographiegefäß dient, geben. Die DC-Folie einstellen und das Gefäß mit dem Schraubverschluss 20 mm verschließen. Nach einer Entwicklungszeit von ca Minuten DC-Folie zur Auswertung entnehmen. Ergebnis: Chlorophyll b (gelbgrün), Chlorophyll a (blaugrün), Xanthophyll (gelb) und Carotin (orange) können anhand ihrer Farbe und des chromatographischen Verhaltens nachgewiesen werden.
4 V : Isolierung von Zimtaldehyd aus Zimtstangen durch Wasserdampf-Destillation O Zimtaldehyd Zimtstangen 1,5 g - - H 2 O dest. 10 ml ml Wasser mit einer Pipette in das Reaktionsgefäß 24mL geben und Miniatur-Rührmagneten hinzufügen. 2. Y-Stück mit Hilfe der Schraubkupplung 13/20 aufschrauben und Apparatur im Thermoblock auf den Magnetheizrührer stellen. 3. Kleines Refluxrohr am Seitenarm des Y-Stückes mittels der Schraubkupplung 13/13 befestigen. 4. Schraubdeckel auf die obere Öffnung des Y-Stückes schrauben. 5. Ansatz unter Rühren zum Sieden erhitzen. Blocktemperatur max. 150 C mit Digital-Thermometer (Digitemp) ü- berwachen. 6. Reaktionsgefäß mit Seitenarm 45 als Vorlage offen unter den Kühlerauslauf stellen. Anmerkung: Falls der Ansatz beim Erwärmen zu stark schäumen sollte, wird die Temperaturregelung am Magnetheizrührer zurückgestellt und notfalls die gesamte Destillationsapparatur aus dem Thermoblock herausgenommen, um ein Überschäumen zu vermeiden. Beobachtung: Die ersten Tropfen des Destillats sind milchig weiß gefärbt und riechen intensiv nach Zimtaldehyd. Nach ca. zehnminütigem Destillieren wird das Destillat zunehmend farblos und die Destillation kann beendet werden.
5 V: Umkristallisation von Benzoesäure Benzoesäure 0,25 g H 2 O 5 ml 1. Benzoesäure in das Reaktionsgefäß 24mL geben ml Wasser dest. zugeben und Miniatur- Rührmagneten hinzufügen. 3. Refluxrohr mit Hilfe der Schraubkupplung 20/20 aufschrauben. 4. Fertige Apparatur im Thermoblock auf den Magnetheizrührer stellen. Ansatz unter Rühren zum Sieden erhitzen. Blocktemperatur ca. 110 C mit Digital-Thermometer (Digitemp) überwachen. 5. Sobald die Benzoesäure gelöst ist, die Apparatur aus dem Thermoblock nehmen und an der Luft abkühlen lassen. (Benzoesäure kristallisiert nach kurzer Zeit aus). 6. Refluxrohr und Schraubkupplung 20/20 abschrauben. Aufbau der Filtrationseinheit: PTFE-Filterträger und Filterpapier in die Schraubkupplung 20/20 einlegen und so auf das Reaktionsgefäß 24 ml aufschrauben, daß das Filterpapier in Richtung des Flüssigkeit-Feststoff- Gemisches zeigt. Reaktionsgefäß mit Seitenarm 45 anschrauben und Schlaucholive am Seitenarm befestigen. Apparatur um 180 drehen, kurz umschütteln und Lösemittel mit der Wasserstrahlpumpe absaugen. Falls die Filtration stockt, Schlaucholive am Seitenarm aufdrehen, um Apparatur zu belüften. Nach beendeter Filtration Benzoesäure mit Spatel aus dem Reaktionsgefäß entfernen und trocknen.
6 V: Destillation von Rotwein Rotwein 10 ml ml Rotwein mit einer Pipette in das Reaktionsgefäß 24mL geben und Miniatur- Rührmagneten hinzufügen. 2. Y-Stück mit Hilfe der Schraubkupplung 13/20 aufschrauben und Apparatur im Thermoblock auf den Magnetheizrührer stellen. 3. Kleines Refluxrohr am Seitenarm des Y- Stückes mittels der Schraubkupplung 13/13 befestigen. 4. Thermometer in die Adapterkupplung 13mm einführen und auf die obere Öffnung des Y-Stückes aufschrauben. 5. Ansatz unter Rühren zum Sieden erhitzen. Blocktemperatur ca. 100 C mit Digital- Thermometer (Digitemp) überwachen. 6. Reaktionsgefäß 4mL als Vorlage offen unter den Kühlerauslauf stellen. Anmerkung: Falls der Rotwein beim Erwärmen stark schäumen sollte, wird die Temperaturregelung am Magnetheizrührer zurückgestellt und notfalls die gesamte Destillationsapparatur aus dem Thermoblock herausgenommen, um ein Überschäumen zu vermeiden. Beobachtung: Die ersten klaren Tropfen des Destillats werden auf ihre Brennbarkeit getestet. (Die Flamme des brennenden Destillats ist sehr klein und fast farblos, sie kann daher leicht übersehen werden).
7 V : Herstellung und Nachweis von Wasserstoff Reaktion: Mg + 2HCl MgCl 2 + H 2 Magnesiumspäne 0,4 g (2) 7/8-43 Salzsäure (w=18%) 2 ml /37/ Magnesiumspäne in das Reaktionsgefäß mit Seitenarm geben. 2. Schraubkupplung 20/20 auf die große Gefäßöffnung, Adapterkupplung 13mm auf den Seitenarm aufschrauben und Apparatur in den Thermoblock stellen. 3. Spritze mit ca. 2 ml Salzsäure füllen und durch die Adapterkupplung 13mm in den Seitenarm des Reaktionsgefäßes einführen. 4. Reaktionsgefäß 24mL nur locker auf die Schraubkupplung 20/20 aufschrauben, damit die Luft aus der Apparatur verdrängt werden kann. 5. Wasserstoffentwicklung durch vorsichtiges Zutropfen der Säure starten. Mehrere Reaktionsgefäße füllen, mit Schraubverschlüssen 20mm verschließen und für die Nachweisreaktionen (Knallgasprobe, Brennbarkeit) aufbewahren.
8 V : Herstellung und Nachweis von Sauerstoff Reaktion: MnO 2 2 H 2 O 2 O H 2 O Mangandioxid 0,1 g 20/22 (2) - 25 Wasserstoffperoxid- Lösung (w=10%) 4 ml /37/ Mangandioxid in das Reaktionsgefäß mit Seitenarm 45 geben. 2. Schraubkupplung 20/20 und Gewinderohr auf die große Gefäßöffnung, Adapterkupplung 13mm auf den Seitenarm aufschrauben. Apparatur in den Thermoblock stellen. 3. Spritze mit 4 ml Wasserstoffperoxid-Lösung füllen und durch die Adapterkupplung 13mm in den Seitenarm des Reaktionsgefäßes einführen. 4. Alle Kupplungen auf festen Sitz überprüfen! 5. Wasserstoffperoxid-Lösung auf das Mangandioxid tropfen. Beobachtung: Unter Aufschäumen zersetzt sich die Wasserstoffperoxid-Lösung. Nach ca. 1 Minute entflammt ein glimmender Span, der in das Gewinderohr eingeführt wird. Die Glimmspanprobe kann mehrmals wiederholt werden.
9 V: Herstellung und Nachweis von Kohlenstoffdioxid Reaktion: H + Na 2 CO 3 + H 2 O 2 NaOH + CO 2 Wasser dest. Brausetablette Multibionta 1/4 Calciumhydroxid- Lösung ges. 1 ml 10 ml Brausetablette in das Reaktionsgefäß mit Seitenarm 45 geben. 2. Schraubkupplung 20/20 auf die große Gefäßöffnung und Adapterkupplung 13mm auf den Seitenarm aufschrauben. PTFE-Filterträger und PTFE-Membran in die Schraubkupplung 20/20 einlegen, Gewinderohr aufschrauben und Apparatur in den Thermoblock stellen ml Calciumhydroxid-Lösung in das Gewinderohr einfüllen. 4. Spritze mit ca. 1 ml destilliertem Wasser füllen und durch die Adapterkupplung 13mm in den Seitenarm des Reaktionsgefäßes einführen. 5. Alle Kupplungen auf festen Sitz überprüfen! 6. Wasser auf die Brausetablette tropfen. Beobachtung: Unter Aufschäumen löst sich die Brausetablette auf. Nach ca. 30 Sekunden ist das Kalkwasser im Gewinderohr getrübt. Alternativen für die Durchführung: Statt einer Brausetablette kann auch ein Schneckengehäuse, eine Muschelschale oder Kalkstein zur Kohlendioxidherstellung verwendet werden. In diesen Fällen wird die Gasentwicklung mit verdünnter Salzsäure (w = 7 %) ausgelöst. (Stockmann & Schallies 1991)
10 V : Entwicklung und Nachweis von Sauerstoff und Kohlenstoffdioxid aus Fleckensalz Reaktion O Na + O O Na + ca. 70 C CO 2 + Na 2 O 2 O Natriumpercarbonat Natriumperoxid 2 Na 2 O H 2 O ca. 70 C O NaOH Fleckensalz (K2R oder Skip). Inhaltsstoffe: Natriumpercarbonat Natriumhydrogencarbonat 1 g Calciumhydroxid-Lösung 3 ml H 2 O dest. 5 ml 1. Thermoblock auf den Magnetheizrührer stellen und auf ca. 90 C vorheizen (Temperaturkontrolle mit Digital- Thermometer Digitemp) g Fleckensalz, 5 ml destilliertes Wasser und Rührmagneten in das Reaktionsgefäß 24mL geben. 3. Schraubkupplung 20/20 aufschrauben, PTFE-Filterträger und PTFE-Membran einlegen und Gewinderohr befestigen. 4. Apparatur in den Thermoblock stellen ml Kalkwasser in das Gewinderohr einfüllen. Beobachtung: Nach kurzer Zeit trübt sich die Calciumhydroxid-Lösung im Gewinderohr durch aufsteigendes Kohlendioxid. Nach beendeter Reaktion entflammt ein glimmender Span, der in das Gewinderohr eingeführt wird. Auf diese Weise lassen sich die Gase Kohlenstoffdioxid und Sauerstoff nebeneinander (bzw. übereinander) nachweisen. (Schallies, Schnelle, & Kunze 1996)
11 V: Nachweis von Methanol bzw. Ethanol als Borsäureester Reaktion: HO O CH 3 B OH + 3 HO CH 3 O B + 3 H 2 O HO H 3 C O CH 3 Methanol 2 ml 11-23/24/ / /23/24/25 Ethanol 2 ml Borsäure. 0,2 g H 2 SO 4 konz. 2 Tropfen Geräte, Apparatur und Versuchsaufbau: 1. Thermoblock auf den Magnetheizrührer stellen und auf ca. 100 C vorheizen (Temperaturkontrolle mit Digital- Thermometer Digitemp) ml Methanol bzw. 2 ml Ethanol in je ein Reaktionsgefäß 24mL geben und in jedes Gefäß 0,1 g Borsäure, 1 Tropfen Schwefelsäure konz. und einen Miniatur- Rührmagneten hinzufügen. 3. Schraubkupplung 20/20 und Refluxrohr aufschrauben. 4. Apparatur in den vorgeheizten Thermoblock (ca. 100 C) stellen und unter Rühren erhitzen. Beobachtung: Nach kurzer Zeit sieden die beiden gebildeten Borsäureester. Sobald diese dampfförmig das Refluxrohr verlassen, können sie entzündet werden. Der Borsäuremethylester brennt mit grüner Flamme (nach ca. 1 Minute), der Borsäureethylester brennt gelb mit grünem Saum (nach ca. 2-3 Minuten). Entsorgung: Der Rückstand wird im Abfallbehälter für brennbare organische Lösemittel gesammelt.
12 V: Wasserreinigung Torf Blumenerde Sand Kies Methylenblau- Lösung (w= %) 10 ml Torf Blumenerde Sand Kies 1. Schraubkupplung 20/20 auf die große Gefäßöffnung eines Reaktionsgefäßes mit Seitenarm 45 aufschrauben. Einen PTFE-Filterträger in die Schraubkupplung einlegen und ein Gewinderohr aufschrauben. Apparatur in den Thermoblock stellen. 2. Ein wenig Glaswolle auf den PTFE-Filterträger geben und mittels eines Glasstabes etwas festdrücken. Anschließend Kies, Sand, Blumenerde und Torf schichtweise in das Gewinderohr hinein geben (siehe Abbildung). 3. Den Aufbau mit destilliertem Wasser spülen, bis eine klare Lösung abfließt. 4. Anschließend ca. 10 ml Schmutzwasser bzw. Methylenblaulösung auftragen und in die Schichten einsickern lassen. Mit destilliertem Wasser nachspülen und das ablaufende Wasser im Reaktionsgefäß mit Seitenarm in Augenschein nehmen. Beobachtung Beim erstmaligen Spülen des Versuchsaufbaus mit destilliertem Wasser wird eine klare Lösung erhalten, die möglicherweise hellgelb gefärbt ist von Huminbestandteilen aus der Torf- bzw. Blumenerdeschicht. Mit der Anschließend aufgetragenen Schmutzwasser bzw. Methylenblaulösung werden klare Lösungen erhalten.
13 V: Isolierung von Lebensmittelfarbstoffen Fruchtgummi Weinsäure Ammoniak-Lösung (w= 3,8 %) Phenolphthalein- Lösung H 2 O dest. 1 g 0,5 g 2 ml 2 Tropfen 10 ml 1. Schritt: Adsorption der Lebensmittelfarbstoffe an einen Wollefaden: 1. In ein Reaktionsgefäß werden ca. 1g Fruchtgummi, 5 ml destilliertes Wasser und eine Spatelspitze Weinsäure gegeben. 2. Eine Rührnadel wird hinzu gegeben und der Ansatz unter Rühren und leichtem Erwärmen im Thermoblock so lange gerührt, bis alles gelöst ist. 3. Ein entfetteter Wollfaden von etwa 5cm Länge wird hinzu gegeben, eine Kupplung 20/20 wird aufgeschraubt und ein Refluxrohr damit befestigt. 4. Bei einer Blocktemperatur von 90 Celsius wird 10 Minuten lang unter Rühren weiter erwärmt. 5. Der Ansatz wird nun aus dem Thermoblock herausgenommen (durch Anfassen am oberen Ende des Refluxrohres) und unter dem Kaltwasserhahn abgekühlt. Der Wollefaden kann nun mit einer Pinzette herausgenommen werden. Er wird mit destilliertem Wasser gründlich abgespült.
14 2. Schritt: Desorption der Lebensmittelfarbstoffe als Voraussetzung für die dünnschichtchromatographische Trennung und Analyse: 6. Der Wollefaden wird nun in ein weiteres Reaktionsgefäß gegeben und mit 2 ml verdünnter Ammoniaklösung versetzt. Eine Kupplung 20/13 wird aufgeschraubt und mit einem Y-Stück verbunden (siehe Abbildung). 7. Der absteigende Arm des Y-Stückes wird mit einer Kupplung 13/13 verbunden, an die ein Refluxrohr angeschraubt wird. 8. Mittels einer Adapterkupplung 20 mm wird ein weiteres Reaktionsgefäß mit Seitenarm, das 2 ml destilliertes Wasser, versetzt mit Phenolphthalein als Indikator, enthält. Die Spitze des Refluxrohres muss in die Flüssigkeit eintauchen. Der Ansatz wird anschließend im Thermoblock bei einer Blocktemperatur von etwa 100 Celsius erwärmt. Beobachtung: Der gefärbte Wollefaden entfärbt sich und es entsteht wiederum eine Lösung, welches die Lebensmittelfarbstoffe enthält. Gleichzeitig schlägt der Indikator in der Vorlage nach rot um. Wenn der Wollefaden nahezu entfärbt ist, wird der Versuch abgebrochen. Darauf achten, dass nunmehr die Adapterkupplung am Refluxrohr gelockert wird oder dass das Ende des Refluxrohres nicht mehr in die Flüssigkeit der Vorlage eintaucht. Vorbereitung zur Analyse: Nach Abkühlen den Wollefaden mit einer Pinzette entnehmen. Die Farbstofflösung im Reaktionsgefäß kann danach unter Rühren eingedampft werden, um eine konzentriertere Lösung der Lebensmittelfarbstoffe zu erhalten. Zur weiteren Analyse wird eine Dünnschichtchromatographische Trennung dieser Lösung durchgeführt. Dazu werden benötigt: DC-Folie (z.b. Polygramm Zell 300), Laufmittelgemisch, bestehend aus 10 ml Natriumcitratlösung (W = 25%) und 4 ml einer Mischung aus 2,5 ml Ammoniaklösung (W = 25%) und 1,5 ml Methanol. Für die Analyse können Referenzfarbstoffe oder Testfarbstoffgemische, z.b. erhältlich von der Firma Macharey & Nagel, verwendet werden.
15 V: Fettgehalt von Wurst Chemikalien Wurst Petroleumbenzin (40-60 ) 5 g 15 ml g 11-51/ In ein Reaktionsgefäß werden 15 ml Petroleumbenzin und eine Rührnadel gegeben. 2. Eine Kupplung 20/20 wird aufgeschraubt. In den oberen Teil der Kupplung wird eine PTFE-Filterscheibe und ein Filterpapier eingelegt. 3. Ein Gewinderohr wird aufgeschraubt. Mit Hilfe des Pulvertrichters wird eine abgewogene Menge (ca. 5 bis 6 g) in das Gewinderohr gegeben. 4. Mit Hilfe einer zweiten Kupplung 20/20 wird ein Refluxrohr aufgeschraubt. 5. Die fertige Apparatur wird in einen Thermoblock eingestellt und auf dem Magnetheizrührer unter Rühren zum Sieden erwärmt. Beobachtung: Die aufsteigenden Lösungsmitteldämpfe kondensieren im oberen Teil des Gewinderohres und tropfen in die Wurstprobe. Die sich ansammelnde Flüssigkeit ist in der Regel leicht gelblich gefärbt. Weiter Versuchsdurchführung: Damit das kondensierte Lösungsmittel mit den gelösten Fettbestandteilen in das Reaktionsgefäß zurückfließt, wird die gesamte Apparatur kurz aus dem Thermoblock herausgehoben. Beim Abkühlen des Reaktionsgefäßes entsteht ein leichter Unterdruck, der dafür sorgt, dass die Flüssigkeit aus dem Gewinderohr vollständig abläuft. Durch erneutes Einstellen in den Thermoblock und Weiterhitzen wird der Extraktionsvorgang wiederholt. Nach ca. 15 Minuten wird die Versuchsdurchführung abgebrochen und der Versuch ausgewertet. Mit den im Petroleumbenzin gelösten Fettanteilen kann eine Fettfleckprobe durchgeführt werden. Die im Gewinderohr zurückgebliebene Wurstmasse wird vollständig getrocknet und erneut gewogen. Aus der Gewichtsdifferenz zwischen Wursteinwaage und dem nunmehr gemessenen Wert wird der Rohfettgehalt in Prozent bestimmt.
16 V: Kalk im Boden (qualitativer Nachweis) Bodenprobe Salzsäure (w=18%) 5 g 5 ml /37/ In ein Reaktionsgefäß mit Seitenarm 45 wird eine Bodenprobe mit Hilfe des Pulvertrichters eingefüllt. 2. Auf die große Gefäßöffnung wird eine Kupplung 20/20 aufgeschraubt. In die obere Öffnung wird eine PTFE-Filterscheibe und eine PTFE-Filtrationsmembran eingelegt. Ein Gewinderohr wird aufgeschraubt und mit ca. 5 ml Kaltwasser gefüllt. 3. Auf den Seitenarm des Reaktionsgefäßes wird eine Adapterkupplung 13 aufgeschraubt. Eine Spritze wird mit ca. 5 ml verdünnter Salzsäure gefüllt und über die Adapterkupplung mit dem Reaktionsgefäß verbunden. 4. Auf festen Sitz aller Kupplungen achten. Der Versuch wird durch Auftropfen der verdünnten Salzsäure auf die Bodenprobe gestartet.
17 Literatur Schallies, M., Schnelle, H.-O., & Kunze, K. (1996). Welche Gase lassen sich aus Haushaltsreinigern und Fleckensalzen entwickeln? - Einfachste Nachweis- und Trennmethoden mit Hilfe eines miniaturisierten Gasgenerators und einer PTFE- Membran. In: K.H.Wiebel (Hrsg.), Zur Didaktik der Physik und Chemie L16, Stockmann, S., & Schallies, M. (1991). Umwelterziehung experimentell: Exemplarische Versuche zur Bodenuntersuchung mit einem Minilabor. In: K.H.Wiebel (Hrsg.), Zur Didaktik der Physik und Chemie, Zur Didaktik der Physik und Chemie L11,
Durchführungsanleitung für die Versuche:
 Durchführungsanleitung für die Versuche: 1. Gewinnung des extraktes mit Minilaborteilen und Ethanol; Thermoblock auf den Magntheizrührer / Kocher stellen und auf 100 C einregulieren. (Bei ca. 70 C eizung
Durchführungsanleitung für die Versuche: 1. Gewinnung des extraktes mit Minilaborteilen und Ethanol; Thermoblock auf den Magntheizrührer / Kocher stellen und auf 100 C einregulieren. (Bei ca. 70 C eizung
UNTERSUCHUNG VON KNALLERBSEN
 VERSUCHSANLEITUNGEN UNTERSUCHUNG VON KNALLERBSEN Knallerbsen 1 Reagenzglas 10/80 mm 1 Wäscheklammer 600 ml Der Inhalt einer noch nicht zur Reaktion gebrachten Knallerbse wird vorsichtig vom umhüllenden
VERSUCHSANLEITUNGEN UNTERSUCHUNG VON KNALLERBSEN Knallerbsen 1 Reagenzglas 10/80 mm 1 Wäscheklammer 600 ml Der Inhalt einer noch nicht zur Reaktion gebrachten Knallerbse wird vorsichtig vom umhüllenden
Chromatographie von Acetylsalicylsäure. Gefährdungsbeurteilung. Schülerexperiment. Lehrerexperiment
 Chromatographie von Acetylsalicylsäure Brandgefahr! Cyclohexan R-Sätze: 11-38-65-67-50/53 S-Sätze: 9-16-25-33-60-61-62 Acetylsalicylsäure R-Sätze: 22 S-Sätze: 26-37/39-45 Aceton R-Sätze: 11-36-66-67 S-Sätze:
Chromatographie von Acetylsalicylsäure Brandgefahr! Cyclohexan R-Sätze: 11-38-65-67-50/53 S-Sätze: 9-16-25-33-60-61-62 Acetylsalicylsäure R-Sätze: 22 S-Sätze: 26-37/39-45 Aceton R-Sätze: 11-36-66-67 S-Sätze:
Nährstoffe und Nahrungsmittel
 1 Weitere Lehrerversuche Schulversuchspraktikum Annika Nüsse Sommersemester 2016 Klassenstufen 5 & 6 Nährstoffe und Nahrungsmittel Kurzprotokoll 1 Weitere Lehrerversuche Auf einen Blick: Der Lehrerversuch
1 Weitere Lehrerversuche Schulversuchspraktikum Annika Nüsse Sommersemester 2016 Klassenstufen 5 & 6 Nährstoffe und Nahrungsmittel Kurzprotokoll 1 Weitere Lehrerversuche Auf einen Blick: Der Lehrerversuch
Welche Eigenschaften besitzen Calcium- und Magnesiumlaugen?
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P758900) 2.5 Herstellung und Eigenschaften von Kalkwasser (Magnesiumhydroxidlösung) Experiment von: Phywe Gedruckt: 5.0.203 2:3:05 intertess
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P758900) 2.5 Herstellung und Eigenschaften von Kalkwasser (Magnesiumhydroxidlösung) Experiment von: Phywe Gedruckt: 5.0.203 2:3:05 intertess
3 Kjeldahl-Kolben, 500 ml Weithals-Erlenmeyerkolben, 10 ml Vollpipette,
 Instrumentelle Bestimmungsverfahren 227 Versuch 451: Bestimmung von Stickstoff Arbeitsanleitung Geräteliste: KJELDAHL-Apparatur, 3 Kjeldahl-Kolben, 500 ml Weithals-Erlenmeyerkolben, 20 ml Vollpipette,
Instrumentelle Bestimmungsverfahren 227 Versuch 451: Bestimmung von Stickstoff Arbeitsanleitung Geräteliste: KJELDAHL-Apparatur, 3 Kjeldahl-Kolben, 500 ml Weithals-Erlenmeyerkolben, 20 ml Vollpipette,
ZINSSER-MINILABOR Das komplette Chemielabor im Koffer
 ZINSSER-MINILABOR Das komplette Chemielabor im Koffer Seit den 80er Jahren kommt das ZINSSER-MINILABOR nicht nur in vielen europäischen Schulen zum Einsatz. Es ist auch sehr nützlich für das Entwickeln
ZINSSER-MINILABOR Das komplette Chemielabor im Koffer Seit den 80er Jahren kommt das ZINSSER-MINILABOR nicht nur in vielen europäischen Schulen zum Einsatz. Es ist auch sehr nützlich für das Entwickeln
Anhand welcher Eigenschaften lässt sich Wasserstoff identifizieren?
 Naturwissenschaften - Chemie - Allgemeine Chemie - 5 Nachweisreaktionen (P75500) 5.2 Nachweis von Wasserstoff Experiment von: Phywe Gedruckt:.0.203 3:02:34 intertess (Version 3.06 B200, Export 2000) Aufgabe
Naturwissenschaften - Chemie - Allgemeine Chemie - 5 Nachweisreaktionen (P75500) 5.2 Nachweis von Wasserstoff Experiment von: Phywe Gedruckt:.0.203 3:02:34 intertess (Version 3.06 B200, Export 2000) Aufgabe
Aufstellung einiger Versuche zur Farbenchemie (Kurzfassung)
 Aufstellung einiger Versuche zur Farbenchemie (Kurzfassung) Zusammenstellung der Versuche, die für Schulversuche als geeignet eingestuft wurden (zusammengestellt von Herrn Buchholz, TU Dresden) 1. Darstellung
Aufstellung einiger Versuche zur Farbenchemie (Kurzfassung) Zusammenstellung der Versuche, die für Schulversuche als geeignet eingestuft wurden (zusammengestellt von Herrn Buchholz, TU Dresden) 1. Darstellung
Echt ätzend! - Was ist und wie wirkt Abflussreiniger?
 Echt ätzend! - Was ist und wie wirkt Abflussreiniger? Versuch 1: Zusammensetzung von festem Abflussreiniger (Analyse nach Prof. Pick ): fester Abflussreiniger (z.b. Drano Rohrfrei) Petrischale, Holzstab
Echt ätzend! - Was ist und wie wirkt Abflussreiniger? Versuch 1: Zusammensetzung von festem Abflussreiniger (Analyse nach Prof. Pick ): fester Abflussreiniger (z.b. Drano Rohrfrei) Petrischale, Holzstab
Darstellung von Aconitsäure
 Illumina-Chemie.de - Artikel Synthesen Darstellung von ist eine ungesättigte Tricarbonsäure, die in lebenden Organismen als Zwischenglied des Citronensäurezyklus eine wichtige Rolle spielt. Sie lässt sich
Illumina-Chemie.de - Artikel Synthesen Darstellung von ist eine ungesättigte Tricarbonsäure, die in lebenden Organismen als Zwischenglied des Citronensäurezyklus eine wichtige Rolle spielt. Sie lässt sich
Wie verändern sich die Eigenschaften der Alkohole bei Zunahme der Kohlenstoffzahl?
 Naturwissenschaften - Chemie - Organische Chemie - 4 Alkohole (P77200) 4.6 Eigenschaften der homologen Reihe Experiment von: Phywe Gedruckt: 20.07.206 3:58:38 intertess (Version 3.2 B24, Export 2000) Aufgabe
Naturwissenschaften - Chemie - Organische Chemie - 4 Alkohole (P77200) 4.6 Eigenschaften der homologen Reihe Experiment von: Phywe Gedruckt: 20.07.206 3:58:38 intertess (Version 3.2 B24, Export 2000) Aufgabe
Synthese von 3-Aminophthalsäurehydrazid
 Illumina-Chemie.de - Artikel Synthesen Synthese von 3-Aminophthalsäurehydrazid Hier wird eine zweistufige Synthese von Luminol beschrieben. Luminol findet insbesondere für Chemilumineszenz Verwendung,
Illumina-Chemie.de - Artikel Synthesen Synthese von 3-Aminophthalsäurehydrazid Hier wird eine zweistufige Synthese von Luminol beschrieben. Luminol findet insbesondere für Chemilumineszenz Verwendung,
von Miriam Richter, Marc Sören Homeyer, Brigitte Duvinage
 Experimentiervorschriften zum Beitrag Wärmepflaster, im Chemieunterricht nachgebaut von Miriam Richter, Marc Sören Homeyer, Brigitte Duvinage 1 Experimente zur Identifizierung der Inhaltsstoffe Aus didaktisch-methodischen
Experimentiervorschriften zum Beitrag Wärmepflaster, im Chemieunterricht nachgebaut von Miriam Richter, Marc Sören Homeyer, Brigitte Duvinage 1 Experimente zur Identifizierung der Inhaltsstoffe Aus didaktisch-methodischen
Anhand welcher Eigenschaften lässt sich Sauerstoff identifizieren?
 Naturwissenschaften - Chemie - Allgemeine Chemie - 5 Nachweisreaktionen (P75400) 5. Nachweis von Sauerstoff Experiment von: Phywe Gedruckt:.0.203 3:00:4 intertess (Version 3.06 B200, Export 2000) Aufgabe
Naturwissenschaften - Chemie - Allgemeine Chemie - 5 Nachweisreaktionen (P75400) 5. Nachweis von Sauerstoff Experiment von: Phywe Gedruckt:.0.203 3:00:4 intertess (Version 3.06 B200, Export 2000) Aufgabe
Von Arrhenius zu Brönsted
 Schulversuchspraktikum Name Annika Münch Sommersemester 2015 Klassenstufen 9/10 Von Arrhenius zu Brönsted Kurzprotokoll Auf einen Blick: Für die Unterrichtseinheit zum Themas Säure-Base-Konzepte und im
Schulversuchspraktikum Name Annika Münch Sommersemester 2015 Klassenstufen 9/10 Von Arrhenius zu Brönsted Kurzprotokoll Auf einen Blick: Für die Unterrichtseinheit zum Themas Säure-Base-Konzepte und im
4028 Synthese von 1-Bromdodecan aus 1-Dodecanol
 4028 Synthese von 1-Bromdodecan aus 1-Dodecanol C 12 H 26 O (186.3) OH H 2 SO 4 konz. (98.1) + HBr (80.9) C 12 H 25 Br (249.2) Br + H 2 O (18.0) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
4028 Synthese von 1-Bromdodecan aus 1-Dodecanol C 12 H 26 O (186.3) OH H 2 SO 4 konz. (98.1) + HBr (80.9) C 12 H 25 Br (249.2) Br + H 2 O (18.0) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
Gasentwickler Best.- Nr. MT00476
 Gasentwickler Best.- Nr. MT00476 I. Beschreibung Dieser Aufbau kann im Schullabor als Gasentwickler für die Erzeugung von geringen Gasmengen eingesetzt werden - Herstellung von Gasen aus Feststoffen (Granulat)
Gasentwickler Best.- Nr. MT00476 I. Beschreibung Dieser Aufbau kann im Schullabor als Gasentwickler für die Erzeugung von geringen Gasmengen eingesetzt werden - Herstellung von Gasen aus Feststoffen (Granulat)
Vorpraktikum Grundoperationen im chemischen Laboratorium
 Vorpraktikum Grundoperationen im chemischen Laboratorium Stand: 23. April 2019 Inhalt: Volumetrische Messgeräte Säure-Base-Titration Analysenwaagen Fest-Flüssig-Trennverfahren Wasserlöslichkeit Verdünnung
Vorpraktikum Grundoperationen im chemischen Laboratorium Stand: 23. April 2019 Inhalt: Volumetrische Messgeräte Säure-Base-Titration Analysenwaagen Fest-Flüssig-Trennverfahren Wasserlöslichkeit Verdünnung
Nachweis von Eisen-Ionen mit Kaliumthiocyanat
 Name: Datum: Nachweis von Eisen- mit Kaliumthiocyanat Geräte 3 Bechergläser (100 ml), 4 Reagenzgläser, Reagenzglasständer, kleiner Trichter, Faltenfilter, Spatel Materialien Eisennagel, Muscheln (braun
Name: Datum: Nachweis von Eisen- mit Kaliumthiocyanat Geräte 3 Bechergläser (100 ml), 4 Reagenzgläser, Reagenzglasständer, kleiner Trichter, Faltenfilter, Spatel Materialien Eisennagel, Muscheln (braun
V 1 Herstellung von Natriumchlorid
 1 V 1 Herstellung von Natriumchlorid In diesem Versuch wird Natriumchlorid, im Alltag als Kochsalz bekannt, aus den Edukten Natrium und Chlorgas hergestellt. Dieser Versuch ist eine Reaktion zwischen einem
1 V 1 Herstellung von Natriumchlorid In diesem Versuch wird Natriumchlorid, im Alltag als Kochsalz bekannt, aus den Edukten Natrium und Chlorgas hergestellt. Dieser Versuch ist eine Reaktion zwischen einem
,Prinzip: Versuchsaufbau - Variante I: Materialliste:
 Computer im Chemieunterricht Gaschromatographische Identifizierung Chromatogr.,Prinzip: Einige Kohlenwasserstoffe werden aus Carbiden im Minigasentwickler hergestellt. Weitere Kohlenwasserstoffe lassen
Computer im Chemieunterricht Gaschromatographische Identifizierung Chromatogr.,Prinzip: Einige Kohlenwasserstoffe werden aus Carbiden im Minigasentwickler hergestellt. Weitere Kohlenwasserstoffe lassen
Rein oder nicht rein?
 Station 1: Rein oder nicht rein? Versuche: 1 Bestimmen Sie experimentell die Löslichkeit von Kochsalz. [Hinweis: Unter der Löslichkeit versteht man die Masse eines Stoffes in Gramm, die sich gerade noch
Station 1: Rein oder nicht rein? Versuche: 1 Bestimmen Sie experimentell die Löslichkeit von Kochsalz. [Hinweis: Unter der Löslichkeit versteht man die Masse eines Stoffes in Gramm, die sich gerade noch
Herstellung und Eigenschaften von Kalkwasser (Magnesiumhydroxidlösung) (Artikelnr.: P )
 Lehrer-/Dozentenblatt Herstellung und Eigenschaften von Kalkwasser (Magnesiumhydroxidlösung) (Artikelnr.: P7158900) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema:
Lehrer-/Dozentenblatt Herstellung und Eigenschaften von Kalkwasser (Magnesiumhydroxidlösung) (Artikelnr.: P7158900) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema:
HTBL-PINKAFELD Arbeitsblatt A3/1 1.Station: KOHLENMONOXID. VORSICHT: Ameisensäure und konz. Schwefelsäure sind gefährliche Chemikalien!!
 HTBL-PINKAFELD Arbeitsblatt A3/1 1.Station: KOHLENMONOXID ÜBUNG: KOHLENMONOXID Für diese Versuche brauchst du: Proberöhren Proberöhrenständer Proberöhrenhalter Laborbrenner Ameisensäure konz. Schwefelsäure
HTBL-PINKAFELD Arbeitsblatt A3/1 1.Station: KOHLENMONOXID ÜBUNG: KOHLENMONOXID Für diese Versuche brauchst du: Proberöhren Proberöhrenständer Proberöhrenhalter Laborbrenner Ameisensäure konz. Schwefelsäure
4.4 Borax-Probe. Aufgabe. Wie lässt sich Methanol von Ethanol unterscheiden? (1) Naturwissenschaften - Chemie - Organische Chemie - 4 Alkohole
 Naturwissenschaften - Chemie - Organische Chemie - 4 Alkohole (P77900) 4.4 Borax-Probe Experiment von: Anouch Gedruckt: 25.02.204 3:45:2 intertess (Version 3.2 B24, Export 2000) Aufgabe Aufgabe Wie lässt
Naturwissenschaften - Chemie - Organische Chemie - 4 Alkohole (P77900) 4.4 Borax-Probe Experiment von: Anouch Gedruckt: 25.02.204 3:45:2 intertess (Version 3.2 B24, Export 2000) Aufgabe Aufgabe Wie lässt
4023 Synthese von Cyclopentanon-2-carbonsäureethylester aus
 NP 4023 Synthese von Cyclopentanon-2-carbonsäureethylester aus Adipinsäurediethylester NaEt C 10 H 18 4 Na C 2 H 6 C 8 H 12 3 (202.2) (23.0) (46.1) (156.2) Klassifizierung Reaktionstypen und Stoffklassen
NP 4023 Synthese von Cyclopentanon-2-carbonsäureethylester aus Adipinsäurediethylester NaEt C 10 H 18 4 Na C 2 H 6 C 8 H 12 3 (202.2) (23.0) (46.1) (156.2) Klassifizierung Reaktionstypen und Stoffklassen
Ammoniumhexacyanoferrat(III) / Hexacyanoeisen(III)-säure
 Illumina-Chemie.de - Artikel Synthesen Ammoniumhexacyanoferrat(III) / Hexacyanoeisen(III)-säure Geräte: Erlenmeyerkolben, Becherglas, Scheidetrichter, Pipetten, Trichter und Faltenfilter Chemikalien: Kaliumhexacyanoferrat(III)
Illumina-Chemie.de - Artikel Synthesen Ammoniumhexacyanoferrat(III) / Hexacyanoeisen(III)-säure Geräte: Erlenmeyerkolben, Becherglas, Scheidetrichter, Pipetten, Trichter und Faltenfilter Chemikalien: Kaliumhexacyanoferrat(III)
Gruppe I : Darstellung und Nachweis von Säuren
 Gruppe I : Darstellung und Nachweis von Säuren Behauptung: Säuren lassen sich durch die Reaktion von Nichtmetalloxiden mit Wasser darstellen. 1. Überprüfen Sie experimentell die aufgeführte Behauptung
Gruppe I : Darstellung und Nachweis von Säuren Behauptung: Säuren lassen sich durch die Reaktion von Nichtmetalloxiden mit Wasser darstellen. 1. Überprüfen Sie experimentell die aufgeführte Behauptung
Carbonat, Hydrogencarbonat
 Chlorid a) Die Lösung die einer Menge Substanz, die etwa 2 mg Chlorid entspricht, in 2 ml Wasser R oder 2 ml der vorgeschrieben Lösung werden verwendet. Diese Lösung wird mit verdünnter Salpetersäure R
Chlorid a) Die Lösung die einer Menge Substanz, die etwa 2 mg Chlorid entspricht, in 2 ml Wasser R oder 2 ml der vorgeschrieben Lösung werden verwendet. Diese Lösung wird mit verdünnter Salpetersäure R
Identifizierung der Produkte der Reaktion "Alkalimetalle + Wasser"
 Identifizierung der Produkte der Reaktion "Alkalimetalle + Wasser" a) Identifizierung des entstehenden Gases: Chemikalien: Geräte: Lithium [C] [F], Natrium [C] [F] (jeweils in Benzin mit Siedebereich 90-110
Identifizierung der Produkte der Reaktion "Alkalimetalle + Wasser" a) Identifizierung des entstehenden Gases: Chemikalien: Geräte: Lithium [C] [F], Natrium [C] [F] (jeweils in Benzin mit Siedebereich 90-110
8 Stevia qualitativ aus der Pflanze extrahieren
 8 Stevia qualitativ aus der Pflanze extrahieren 8.1 Vorwort Stevia ist der mit Abstand am teuersten Zuckerersatzstoff den wir untersucht haben, deshalb beschäftigte uns die Frage, wie der hohe Preis zu
8 Stevia qualitativ aus der Pflanze extrahieren 8.1 Vorwort Stevia ist der mit Abstand am teuersten Zuckerersatzstoff den wir untersucht haben, deshalb beschäftigte uns die Frage, wie der hohe Preis zu
Herstellen gasförmiger Kohlenwasserstoffe Gaschromatografische Identifizierung. Präparategläschen mit Kappe und Septum Kanüle 0,6 mm
 Prinzip Einige Kohlenwasserstoffe werden aus Carbiden im Minigasentwickler hergestellt. Weitere Kohlenwasserstoffe lassen sich mit Hilfe des Perlkatalysators, der normalerweise bei Crackversuchen eingesetzt
Prinzip Einige Kohlenwasserstoffe werden aus Carbiden im Minigasentwickler hergestellt. Weitere Kohlenwasserstoffe lassen sich mit Hilfe des Perlkatalysators, der normalerweise bei Crackversuchen eingesetzt
Versuch: Qualitativer Nachweis von Kohlenstoff und Wasserstoff
 Philipps-Universität Marburg 20.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 1, Einführung in die OC Versuch: Qualitativer Nachweis
Philipps-Universität Marburg 20.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 1, Einführung in die OC Versuch: Qualitativer Nachweis
Chemie zur Weihnacht. Farbreihe
 Farbreihe Reagenzien: 2 ml Phenolphthalein in 200 ml Wasser verdünnte Natronlauge in Tropfflasche Kaliumpermanganat 2,5 g Eisen(II)-sulfat in 50 ml Wasser 2,5 g Kaliumthiocyanat in 50 ml Wasser 2,5 g Kaliumhexacyanoferrat(II)
Farbreihe Reagenzien: 2 ml Phenolphthalein in 200 ml Wasser verdünnte Natronlauge in Tropfflasche Kaliumpermanganat 2,5 g Eisen(II)-sulfat in 50 ml Wasser 2,5 g Kaliumthiocyanat in 50 ml Wasser 2,5 g Kaliumhexacyanoferrat(II)
TROPANALKALOIDE. QUALITATIVE UNTERSUCHUNGEN Allgemeine Nachweisreaktionen (Alkaloide) Belladonnae folium. Belladonnae radix.
 QUALITATIVE UNTERSUCHUNGEN Allgemeine Nachweisreaktionen (Alkaloide) Belladonnae folium Belladonnae radix Stramonii folium 2.0 g pulverisierte Droge werden mit 40 ml 0.2 M H 2 SO 4 zwei Minuten lang in
QUALITATIVE UNTERSUCHUNGEN Allgemeine Nachweisreaktionen (Alkaloide) Belladonnae folium Belladonnae radix Stramonii folium 2.0 g pulverisierte Droge werden mit 40 ml 0.2 M H 2 SO 4 zwei Minuten lang in
Zerlegung von Wasser durch Reduktionsmittel
 Lehrer-/Dozentenblatt Zerlegung von Wasser durch Reduktionsmittel (Artikelnr.: P7155500) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Anorganische Chemie Unterthema:
Lehrer-/Dozentenblatt Zerlegung von Wasser durch Reduktionsmittel (Artikelnr.: P7155500) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Anorganische Chemie Unterthema:
Wir untersuchen das Grün der Blätter
 Naturwissenschaften Kantonsschule Freudenberg Wir untersuchen das Grün der Blätter Messzylinder: Mörser: 1. Schritt: Farbe aus grünen Blättern extrahieren Jede Gruppe wählt im Park eine andere Pflanze
Naturwissenschaften Kantonsschule Freudenberg Wir untersuchen das Grün der Blätter Messzylinder: Mörser: 1. Schritt: Farbe aus grünen Blättern extrahieren Jede Gruppe wählt im Park eine andere Pflanze
JUSTUS-LIEBIG- UNIVERSITÄT GIESSEN. Institut für Didaktik der Chemie. Experimente im Halbmikromaßstab mit dem Minilabor
 JUSTUS-LIEBIG- UNIVERSITÄT GIESSEN Experimente im Halbmikromaßstab mit dem Minilabor Zusammengestellt und bearbeitet von Heiko Barth, Januar 2002 Das Minilabor 2 Das Minilabor ist ein Gerätesystem, dass
JUSTUS-LIEBIG- UNIVERSITÄT GIESSEN Experimente im Halbmikromaßstab mit dem Minilabor Zusammengestellt und bearbeitet von Heiko Barth, Januar 2002 Das Minilabor 2 Das Minilabor ist ein Gerätesystem, dass
Endotherm und Exotherm
 Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 7 & 8 Endotherm und Exotherm Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 7 und 8 einen Lehrerversuch und einen
Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 7 & 8 Endotherm und Exotherm Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 7 und 8 einen Lehrerversuch und einen
Veranstaltung 5: Zaubereien gibt es nicht!
 Veranstaltung 5: Zaubereien gibt es nicht! Station 1: Kerzenversuche E1 Steigendes Wasser E2 Löschen von Kerzenflammen durch Geisterhand Station 2: Farbenzauber E3 Zauberschriften E4 Zauberhafte Umwandlung
Veranstaltung 5: Zaubereien gibt es nicht! Station 1: Kerzenversuche E1 Steigendes Wasser E2 Löschen von Kerzenflammen durch Geisterhand Station 2: Farbenzauber E3 Zauberschriften E4 Zauberhafte Umwandlung
2013 Umsetzung von Zimtsäure mit Thionylchlorid zu Zimtsäurechlorid
 2013 Umsetzung von Zimtsäure mit Thionylchlorid zu Zimtsäurechlorid H + SCl 2 Cl + HCl + S 2 C 9 H 8 2 (148.2) (119.0) C 9 H 7 Cl (166.6) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der Carbonylgruppe
2013 Umsetzung von Zimtsäure mit Thionylchlorid zu Zimtsäurechlorid H + SCl 2 Cl + HCl + S 2 C 9 H 8 2 (148.2) (119.0) C 9 H 7 Cl (166.6) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der Carbonylgruppe
4002 Synthese von Benzil aus Benzoin
 4002 Synthese von Benzil aus Benzoin H VCl 3 + 1 / 2 2 + 1 / 2 H 2 C 14 H 12 2 C 14 H 10 2 (212.3) 173.3 (210.2) Klassifizierung Reaktionstypen und Stoffklassen xidation Alkohol, Keton, Schwermetallkatalysator
4002 Synthese von Benzil aus Benzoin H VCl 3 + 1 / 2 2 + 1 / 2 H 2 C 14 H 12 2 C 14 H 10 2 (212.3) 173.3 (210.2) Klassifizierung Reaktionstypen und Stoffklassen xidation Alkohol, Keton, Schwermetallkatalysator
Merkmale Chemischer Reaktionen (qualitativ)
 Schulversuchspraktikum Carolin Schilling Sommersemester 2016 Klassenstufen 7&8 Merkmale Chemischer Reaktionen (qualitativ) Kurzprotokoll Auf einen Blick: Die beiden Schülerexperimente dieses Kurzprotokolls
Schulversuchspraktikum Carolin Schilling Sommersemester 2016 Klassenstufen 7&8 Merkmale Chemischer Reaktionen (qualitativ) Kurzprotokoll Auf einen Blick: Die beiden Schülerexperimente dieses Kurzprotokolls
Vorpraktikum Grundoperationen im chemischen Laboratorium
 Vorpraktikum Grundoperationen im chemischen Laboratorium Stand: 09. April 2018 Inhalt: Volumetrische Messgeräte Analysenwaagen Fest-Flüssig-Trennverfahren Flüssig-Flüssig-Trennverfahren Wasserlöslichkeit
Vorpraktikum Grundoperationen im chemischen Laboratorium Stand: 09. April 2018 Inhalt: Volumetrische Messgeräte Analysenwaagen Fest-Flüssig-Trennverfahren Flüssig-Flüssig-Trennverfahren Wasserlöslichkeit
1 Lehrerversuch Alkalimetalle in Wasser
 1 Lehrerversuch Alkalimetalle in Wasser Diese Versuchsreihe kann zum Einstieg in das Thema Alkalimetalle verwendet werden, da kein Vorwissen benötigt wird. Die Versuche sind nur gering aufwändig und können
1 Lehrerversuch Alkalimetalle in Wasser Diese Versuchsreihe kann zum Einstieg in das Thema Alkalimetalle verwendet werden, da kein Vorwissen benötigt wird. Die Versuche sind nur gering aufwändig und können
Herstellung und Eigenschaften von Natronlauge
 Lehrer-/Dozentenblatt Herstellung und Eigenschaften von Natronlauge (Artikelnr.: P759000) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-0 Lehrplanthema: Anorganische Chemie Unterthema:
Lehrer-/Dozentenblatt Herstellung und Eigenschaften von Natronlauge (Artikelnr.: P759000) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-0 Lehrplanthema: Anorganische Chemie Unterthema:
Extraktion. Aufgabe und Material. Lehrer-/Dozentenblatt. Lehrerinformationen. Lernziele. Hinweise zu Aufbau und Durchführung. H- und P-Sätze.
 Lehrer-/Dozentenblatt Extraktion Aufgabe und Material Lehrerinformationen Lernziele Farbstoffe lassen sich durch Extraktion aus den gefärbten Substanzen herauswaschen. Extraktion ist ein sowohl im Alltag
Lehrer-/Dozentenblatt Extraktion Aufgabe und Material Lehrerinformationen Lernziele Farbstoffe lassen sich durch Extraktion aus den gefärbten Substanzen herauswaschen. Extraktion ist ein sowohl im Alltag
4027 Synthese von 11-Chlorundec-1-en aus 10-Undecen-1-ol
 4027 Synthese von 11-Chlorundec-1-en aus 10-Undecen-1-ol OH SOCl 2 Cl + HCl + SO 2 C 11 H 22 O C 11 H 21 Cl (170.3) (119.0) (188.7) (36.5) (64.1) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
4027 Synthese von 11-Chlorundec-1-en aus 10-Undecen-1-ol OH SOCl 2 Cl + HCl + SO 2 C 11 H 22 O C 11 H 21 Cl (170.3) (119.0) (188.7) (36.5) (64.1) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
Fette, Öle und Tenside
 Schulversuchspraktikum Thomas Polle Sommersemester 2015 Klassenstufen 11 & 12 Fette, Öle und Tenside Kurzprotokoll Inhalt Inhaltsverzeichnis 1Weitere Lehrerversuche... 3 V1 Verseifungszahl... 3 2Weitere
Schulversuchspraktikum Thomas Polle Sommersemester 2015 Klassenstufen 11 & 12 Fette, Öle und Tenside Kurzprotokoll Inhalt Inhaltsverzeichnis 1Weitere Lehrerversuche... 3 V1 Verseifungszahl... 3 2Weitere
Was kannst Du (schon)? Stoffe und Eigenschaften D
 Falte zunächst das Blatt entlang des Pfeils nach hinten. Mache Dir zunächst alleine Gedanken über Deine Fähigkeiten und kreuze an. Tausche Dich im Folgenden mit Deinem Nachbar aus bzw. falte das Blatt
Falte zunächst das Blatt entlang des Pfeils nach hinten. Mache Dir zunächst alleine Gedanken über Deine Fähigkeiten und kreuze an. Tausche Dich im Folgenden mit Deinem Nachbar aus bzw. falte das Blatt
Schulversuchspraktikum. Johanna Osterloh. Sommersemester Klassenstufen 9 & 10. Stoffkreisläufe. Kurzprotokoll
 Schulversuchspraktikum Johanna Osterloh Sommersemester 2015 Klassenstufen 9 & 10 Stoffkreisläufe Kurzprotokoll Auf einen Blick: Dieses Protokoll enthält vier Schülerversuche, die zum Thema Kohlenstoffdioxidkreislauf
Schulversuchspraktikum Johanna Osterloh Sommersemester 2015 Klassenstufen 9 & 10 Stoffkreisläufe Kurzprotokoll Auf einen Blick: Dieses Protokoll enthält vier Schülerversuche, die zum Thema Kohlenstoffdioxidkreislauf
Herstellung von Natriumethanolat
 Illumina-Chemie.de - Artikel Synthesen Herstellung von Natriumethanolat Die folgende Anleitung kann zur Orientierung zur Herstellung anderer Natriumalkoholate verwendet werden. Allerdings muss bei der
Illumina-Chemie.de - Artikel Synthesen Herstellung von Natriumethanolat Die folgende Anleitung kann zur Orientierung zur Herstellung anderer Natriumalkoholate verwendet werden. Allerdings muss bei der
Gemische. Zeitangabe: 8 min SCHUTZBRILLE NICHT VERGESSEN! VERSUCH 1 VERSUCH 2
 Gemische Zeitangabe: 8 min SCHUTZBRILLE NICHT VERGESSEN! Materialien: Becherglas, Spatel Chemikalien: Wasser, Tinte VERSUCH 1 Gebt in das Becherglas ca. 2 cm hoch Wasser und gebt dann fünf Tropfen Tinte
Gemische Zeitangabe: 8 min SCHUTZBRILLE NICHT VERGESSEN! Materialien: Becherglas, Spatel Chemikalien: Wasser, Tinte VERSUCH 1 Gebt in das Becherglas ca. 2 cm hoch Wasser und gebt dann fünf Tropfen Tinte
Schulversuchspraktikum. Ansgar Misch. Sommersemester Klassenstufen 7 & 8. Stickstoff. Kurzprotokoll
 Schulversuchspraktikum Ansgar Misch Sommersemester 2016 Klassenstufen 7 & 8 Stickstoff Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll zum Thema Stickstoff enthält weitere Versuche, die die Eigenschaften
Schulversuchspraktikum Ansgar Misch Sommersemester 2016 Klassenstufen 7 & 8 Stickstoff Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll zum Thema Stickstoff enthält weitere Versuche, die die Eigenschaften
Katalysator vor und nach der Reaktion
 Katalysator vor und nach der Reaktion Braunstein als Katalysator bei der Zersetzung von Wasserstoffperoxid Wasserstoffperoxid ist wenig stabil und zerfällt leicht. Dabei entsteht Sauerstoff, der mit Hilfe
Katalysator vor und nach der Reaktion Braunstein als Katalysator bei der Zersetzung von Wasserstoffperoxid Wasserstoffperoxid ist wenig stabil und zerfällt leicht. Dabei entsteht Sauerstoff, der mit Hilfe
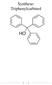
Synthese: Triphenylcarbinol
 Synthese: Triphenylcarbinol 1 Inhaltsverzeichnis Synthese von Triphenylcarbinol 1.1 Allgemeine Angaben..... 3 1.2 Strukturformel...3 1.3 Reaktionsgleichung.......3 1.4 Ansatz........4 1.5 Ausbeuteberechnung.4
Synthese: Triphenylcarbinol 1 Inhaltsverzeichnis Synthese von Triphenylcarbinol 1.1 Allgemeine Angaben..... 3 1.2 Strukturformel...3 1.3 Reaktionsgleichung.......3 1.4 Ansatz........4 1.5 Ausbeuteberechnung.4
Thema: Sauerstoff Klasse 7 / 8. Schulversuchspraktikum. Bastian Hollemann. Sommersemester Klassenstufen 7 & 8. Sauerstoff
 Thema: Sauerstoff Klasse 7 / 8 Schulversuchspraktikum Bastian Hollemann Sommersemester 2015 Klassenstufen 7 & 8 Sauerstoff Thema: Sauerstoff Klasse 7 / 8 Auf einen Blick: Diese Unterrichtseinheit für die
Thema: Sauerstoff Klasse 7 / 8 Schulversuchspraktikum Bastian Hollemann Sommersemester 2015 Klassenstufen 7 & 8 Sauerstoff Thema: Sauerstoff Klasse 7 / 8 Auf einen Blick: Diese Unterrichtseinheit für die
Welcher Unterschied besteht zwischen schwefliger Säure und Schwefelsäure?
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P75800).2 Oxidation von schwefliger Säure Experiment von: PHYWE Gedruckt: 0.0.205 3:05:3 intertess (Version 3.2 B24, Export 2000) Aufgabe Aufgabe
Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P75800).2 Oxidation von schwefliger Säure Experiment von: PHYWE Gedruckt: 0.0.205 3:05:3 intertess (Version 3.2 B24, Export 2000) Aufgabe Aufgabe
7.2.1 Nitrierung von Toluol zu 2-Nitrotoluol (1a), 4-Nitrotoluol (1b) und 2,4-Dinitrotoluol
 7.2.1 Nitrierung von Toluol zu 2-Nitrotoluol (1a), 4-Nitrotoluol (1b) und 2,4-Dinitrotoluol (1c) HNO 3, H 2 SO 4 + + C 7 H 8 (92.1) HNO 3 (63.0) H 2 SO 4 (98.1) 1a 1b 1c C 7 H 7 (137.1) C 7 H 6 N 2 O 4
7.2.1 Nitrierung von Toluol zu 2-Nitrotoluol (1a), 4-Nitrotoluol (1b) und 2,4-Dinitrotoluol (1c) HNO 3, H 2 SO 4 + + C 7 H 8 (92.1) HNO 3 (63.0) H 2 SO 4 (98.1) 1a 1b 1c C 7 H 7 (137.1) C 7 H 6 N 2 O 4
4026 Synthese von 2-Chlor-2-methylpropan (tert-butylchlorid) aus tert-butanol
 4026 Synthese von 2-Chlor-2-methylpropan (tert-butylchlorid) aus tert-butanol OH + HCl Cl + H 2 O C 4 H 10 O C 4 H 9 Cl (74.1) (36.5) (92.6) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
4026 Synthese von 2-Chlor-2-methylpropan (tert-butylchlorid) aus tert-butanol OH + HCl Cl + H 2 O C 4 H 10 O C 4 H 9 Cl (74.1) (36.5) (92.6) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
Versuch: Welche Farben sind im Blattgrün?
 Name: Datum: Versuch: Welche Farben sind im Blattgrün? Materialien: Mörser, Pistill, 100-mL-Becherglas, Schere, 10-mL-Pipette oder Tropfpipette, Trichter, Faltenfilter, Erlenmeyerkolben (50 oder 100 ml),
Name: Datum: Versuch: Welche Farben sind im Blattgrün? Materialien: Mörser, Pistill, 100-mL-Becherglas, Schere, 10-mL-Pipette oder Tropfpipette, Trichter, Faltenfilter, Erlenmeyerkolben (50 oder 100 ml),
Bildung und Eigenschaften von Nichtmetalloxiden
 Problem: Bildung und Eigenschaften von Nichtmetalloxiden a) Umsetzung von Phosphor mit Sauerstoff: Phosphor (rot) [F], Sauerstoff [O] 250ml-Schraubdeckelglas, Verbrennungslöffel, Bierdeckel, Spatel, Gasbrenner,
Problem: Bildung und Eigenschaften von Nichtmetalloxiden a) Umsetzung von Phosphor mit Sauerstoff: Phosphor (rot) [F], Sauerstoff [O] 250ml-Schraubdeckelglas, Verbrennungslöffel, Bierdeckel, Spatel, Gasbrenner,
Lerne Nachweismöglichkeiten für Fett kennen und untersuche verschiedene Lebensmittel auf Fett.
 Naturwissenschaften - Biologie - Allgemeine Biologie - 4 Unsere Nahrungsmittel und ihre Verdauung (P8012500) 4.4 Fetthaltige Nahrungsmittel Experiment von: Phywe Gedruckt: 07.10.2013 15:40:07 intertess
Naturwissenschaften - Biologie - Allgemeine Biologie - 4 Unsere Nahrungsmittel und ihre Verdauung (P8012500) 4.4 Fetthaltige Nahrungsmittel Experiment von: Phywe Gedruckt: 07.10.2013 15:40:07 intertess
4006 Synthese von 2-(3-Oxobutyl)cyclopentanon-2- carbonsäureethylester
 4006 Synthese von 2-(3-xobutyl)cyclopentanon-2- carbonsäureethylester CEt + FeCl 3 x 6 H 2 CEt C 8 H 12 3 C 4 H 6 C 12 H 18 4 (156.2) (70.2) (270.3) (226.3) Klassifizierung Reaktionstypen und Stoffklassen
4006 Synthese von 2-(3-xobutyl)cyclopentanon-2- carbonsäureethylester CEt + FeCl 3 x 6 H 2 CEt C 8 H 12 3 C 4 H 6 C 12 H 18 4 (156.2) (70.2) (270.3) (226.3) Klassifizierung Reaktionstypen und Stoffklassen
Untersuche die Wirkung verschiedener Säuren und Laugen auf natürliche und industriell hergestellte Indikatoren.
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 1 Säuren (P7157400) 1.5 Wirkung von Säuren und Laugen auf natürliche und technische Indikatoren Experiment von: Phywe Gedruckt: 15.10.2013 11:37:56
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 1 Säuren (P7157400) 1.5 Wirkung von Säuren und Laugen auf natürliche und technische Indikatoren Experiment von: Phywe Gedruckt: 15.10.2013 11:37:56
2.6 Herstellung und Eigenschaften von Natronlauge. Aufgabe. Welche Eigenschaften besitzt Natronlauge?
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P759000) 2.6 Herstellung und Eigenschaften von Natronlauge Experiment von: Phywe Gedruckt: 5.0.203 2:4:04 intertess (Version 3.06 B200, Export
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P759000) 2.6 Herstellung und Eigenschaften von Natronlauge Experiment von: Phywe Gedruckt: 5.0.203 2:4:04 intertess (Version 3.06 B200, Export
4.1 Vergleich von physikalischem Vorgang und chemischer Reaktion. Aufgabe. Woran lassen sich chemische Reaktionen erkennen? (1)
 Naturwissenschaften - Chemie - Allgemeine Chemie - 4 Chemische Reaktionen (P75200) 4. Vergleich von physikalischem Vorgang und chemischer Reaktion Experiment von: Phywe Gedruckt:.0.203 2:58:37 intertess
Naturwissenschaften - Chemie - Allgemeine Chemie - 4 Chemische Reaktionen (P75200) 4. Vergleich von physikalischem Vorgang und chemischer Reaktion Experiment von: Phywe Gedruckt:.0.203 2:58:37 intertess
2017 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid
 217 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid O O Cl NH 3 NH 2 C 9 H 7 ClO (166.6) (17.) C 9 H 9 NO (147.2) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der Carbonylgruppe
217 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid O O Cl NH 3 NH 2 C 9 H 7 ClO (166.6) (17.) C 9 H 9 NO (147.2) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der Carbonylgruppe
1.7 Säurestärke. Aufgabe. Gibt es verschieden starke Säuren? Naturwissenschaften - Chemie - Säuren, Basen, Salze - 1 Säuren
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 1 Säuren (P7157600) 1.7 Säurestärke Experiment von: Phywe Gedruckt: 15.10.2013 11:41:12 intertess (Version 13.06 B200, Export 2000) Aufgabe Aufgabe
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 1 Säuren (P7157600) 1.7 Säurestärke Experiment von: Phywe Gedruckt: 15.10.2013 11:41:12 intertess (Version 13.06 B200, Export 2000) Aufgabe Aufgabe
4. Anorganisch-chemische Versuche
 4. Anorganisch-chemische Versuche o 4.4 Redoxreaktionen 4.4.1 Reduktion von Mangan(VII) in schwefelsaurer Lsg. 4.4.2 Oxidation von Mangan(II) in salpetersaurer Lsg. 4.4.3 Oxidation von Chrom(III) in alkalischer
4. Anorganisch-chemische Versuche o 4.4 Redoxreaktionen 4.4.1 Reduktion von Mangan(VII) in schwefelsaurer Lsg. 4.4.2 Oxidation von Mangan(II) in salpetersaurer Lsg. 4.4.3 Oxidation von Chrom(III) in alkalischer
Gruppe 1 Pflichtversuch. Qualitative Analyse: Nachweis von Kohlenstoff als Kohlendioxid
 Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 19.05.09 SS 09 Gruppe 1 Pflichtversuch Qualitative Analyse: Nachweis
Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 19.05.09 SS 09 Gruppe 1 Pflichtversuch Qualitative Analyse: Nachweis
Ch A 13/03 Me_Online-Ergänzung
 Ch A 13/03 Me_Online-Ergänzung Versuch: Kohlenstoffdioxid und (Schülerexperiment) MATTHIAS KREMER Online-Ergänzung MNU 66/4 (1.6.2013) Seiten 1 7, ISSN 0025-5866, Verlag Klaus Seeberger, Neuss 1 VERSUCH:
Ch A 13/03 Me_Online-Ergänzung Versuch: Kohlenstoffdioxid und (Schülerexperiment) MATTHIAS KREMER Online-Ergänzung MNU 66/4 (1.6.2013) Seiten 1 7, ISSN 0025-5866, Verlag Klaus Seeberger, Neuss 1 VERSUCH:
Chemie: Nachweisreaktionen
 Chemie: Nachweisreaktionen 1. Nachweis von Elementen und Verbindungen a) Nachweis von Wasserstoff Wasserstoff H2 Nachweis: Knallgasprobe Durchführung: verschlossenes Reagenzglas wird waagerecht mit der
Chemie: Nachweisreaktionen 1. Nachweis von Elementen und Verbindungen a) Nachweis von Wasserstoff Wasserstoff H2 Nachweis: Knallgasprobe Durchführung: verschlossenes Reagenzglas wird waagerecht mit der
IMST-Wiki Unterrichtsmaterialien. Chemie VIELE WEGE FÜHREN ZU GUTEM UNTERRICHT.
 IMST-Wiki Unterrichtsmaterialien Fach Schulstufe HS Chemie www.imst.ac.at/wiki VIELE WEGE FÜHREN ZU GUTEM UNTERRICHT www.imst.ac.at/wiki Innovationen Machen Schulen Top! Mit über 1000 Beiträgen bietet
IMST-Wiki Unterrichtsmaterialien Fach Schulstufe HS Chemie www.imst.ac.at/wiki VIELE WEGE FÜHREN ZU GUTEM UNTERRICHT www.imst.ac.at/wiki Innovationen Machen Schulen Top! Mit über 1000 Beiträgen bietet
Praktikum Anorganische Chemie für Lehramt Bachelor (Modul 2) Quantitative Analyse
 Kaiserslautern, den 21. Juni 2017 2. Redoxtitration Praktikum Anorganische Chemie für Lehramt Bachelor (Modul 2) Quantitative Analyse C 2 O 4 2- mit MnO 4 - Reaktion: 5 C 2 O 4 2- + 2 MnO 4 - + 16 H +
Kaiserslautern, den 21. Juni 2017 2. Redoxtitration Praktikum Anorganische Chemie für Lehramt Bachelor (Modul 2) Quantitative Analyse C 2 O 4 2- mit MnO 4 - Reaktion: 5 C 2 O 4 2- + 2 MnO 4 - + 16 H +
4029 Synthese von Dodecylphenylether aus Bromdodecan und Phenol OH
 4029 Synthese von Dodecylphenylether aus Bromdodecan und Phenol H C 12 H 25 Br (249.2) Br + + NaH (40.0) + Adogen 464 C 25 H 54 ClN (404.2) C 6 H 6 (94.1) C 18 H 30 (262.4) + NaBr (102.9) Klassifizierung
4029 Synthese von Dodecylphenylether aus Bromdodecan und Phenol H C 12 H 25 Br (249.2) Br + + NaH (40.0) + Adogen 464 C 25 H 54 ClN (404.2) C 6 H 6 (94.1) C 18 H 30 (262.4) + NaBr (102.9) Klassifizierung
Grundkenntnisse von Versuchsanordnungen. Laborgeräte zu einem Versuch auf Folie, Overheadprojektor
 4.1 Folienpuzzle ca. 5 10 Min. ab Kl. 7 Grundkenntnisse von Versuchsanordnungen Laborgeräte zu einem Versuch auf Folie, Overheadprojektor Wie ordnen wir sinnvoll Laborgeräte zu einem Versuch an? Es werden
4.1 Folienpuzzle ca. 5 10 Min. ab Kl. 7 Grundkenntnisse von Versuchsanordnungen Laborgeräte zu einem Versuch auf Folie, Overheadprojektor Wie ordnen wir sinnvoll Laborgeräte zu einem Versuch an? Es werden
Wirkung von Säuren auf Metalle (Artikelnr.: P )
 Lehrer-/Dozentenblatt Wirkung von Säuren auf Metalle (Artikelnr.: P7157500) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Anorganische Chemie Unterthema: Säuren
Lehrer-/Dozentenblatt Wirkung von Säuren auf Metalle (Artikelnr.: P7157500) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Anorganische Chemie Unterthema: Säuren
Versuchsprotokoll: Ampel-Bottle - Experiment
 Versuchsprotokoll: Ampel-Bottle - Experiment Zeitaufwand: Aufbau: 5 Minuten Durchführung: 1 Minuten Entsorgung/Abbau: 5 Minuten Chemikalien: Chemikalien Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz
Versuchsprotokoll: Ampel-Bottle - Experiment Zeitaufwand: Aufbau: 5 Minuten Durchführung: 1 Minuten Entsorgung/Abbau: 5 Minuten Chemikalien: Chemikalien Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz
Endersch, Jonas Praktikum Allgemeine Chemie 2, Saal G1, Platz 53
 Endersch, Jonas 30.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.5a: Herstellung von Cholesterylbenzoat Reaktionsgleichung: Einleitung und Theorie: In diesem Versuch
Endersch, Jonas 30.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.5a: Herstellung von Cholesterylbenzoat Reaktionsgleichung: Einleitung und Theorie: In diesem Versuch
1017 Azokupplung von Benzoldiazoniumchlorid mit 2-Naphthol zu 1-Phenylazo-2-naphthol
 OP 1017 Azokupplung von Benzoldiazoniumchlorid mit 2-aphthol zu 1-Phenylazo-2-naphthol H 3 Cl Cl ao 2 C 6 H 8 Cl (129.6) (69.0) C 6 H 5 Cl 2 (140.6) OH + Cl OH C 10 H 8 O (144.2) C 6 H 5 Cl 2 (140.6) C
OP 1017 Azokupplung von Benzoldiazoniumchlorid mit 2-aphthol zu 1-Phenylazo-2-naphthol H 3 Cl Cl ao 2 C 6 H 8 Cl (129.6) (69.0) C 6 H 5 Cl 2 (140.6) OH + Cl OH C 10 H 8 O (144.2) C 6 H 5 Cl 2 (140.6) C
3016 Oxidation von Ricinolsäure (aus Rizinusöl) mit KMnO 4 zu Azelainsäure
 6 Oxidation von Ricinolsäure (aus Rizinusöl) mit KMnO 4 zu Azelainsäure CH -(CH ) OH (CH ) -COOH KMnO 4 /KOH HOOC-(CH ) -COOH C H 4 O (.) KMnO 4 KOH (.) (6.) C H 6 O 4 (.) Klassifizierung Reaktionstypen
6 Oxidation von Ricinolsäure (aus Rizinusöl) mit KMnO 4 zu Azelainsäure CH -(CH ) OH (CH ) -COOH KMnO 4 /KOH HOOC-(CH ) -COOH C H 4 O (.) KMnO 4 KOH (.) (6.) C H 6 O 4 (.) Klassifizierung Reaktionstypen
1009 Intramolekulare Acylierung von 4-Phenylbuttersäure zu 1,2,3,4-Tetrahydronaphthalin-1-on (α-tetralon)
 1009 Intramolekulare Acylierung von 4-Phenylbuttersäure zu 1,2,3,4-Tetrahydronaphthalin-1-on (α-tetralon) H Polyphosphorsäure C 10 H 12 2 (164.2) C 10 H 10 (146.2) Klassifizierung Reaktionstypen und Stoffklassen
1009 Intramolekulare Acylierung von 4-Phenylbuttersäure zu 1,2,3,4-Tetrahydronaphthalin-1-on (α-tetralon) H Polyphosphorsäure C 10 H 12 2 (164.2) C 10 H 10 (146.2) Klassifizierung Reaktionstypen und Stoffklassen
Schulversuchspraktikum
 Schulversuchspraktikum Jans Manjali Sommersemester 2015 Klassenstufen 7 & 8 1 Beschreibung des Themas und zugehörige Lernziele Kohlenstoffdioxid (Nachweis, Dichte) Auf einen Blick: Kohlenstoffdioxid ist
Schulversuchspraktikum Jans Manjali Sommersemester 2015 Klassenstufen 7 & 8 1 Beschreibung des Themas und zugehörige Lernziele Kohlenstoffdioxid (Nachweis, Dichte) Auf einen Blick: Kohlenstoffdioxid ist
Säurestärke (Artikelnr.: P )
 Lehrer-/Dozentenblatt Säurestärke (Artikelnr.: P7157600) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Anorganische Chemie Unterthema: Säuren und Basen, Protonenübergänge
Lehrer-/Dozentenblatt Säurestärke (Artikelnr.: P7157600) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Anorganische Chemie Unterthema: Säuren und Basen, Protonenübergänge
Untersuche die ausgegebenen Stoffe auf Brennbarkeit und Schmelztemperatur.
 Naturwissenschaften - Chemie - Allgemeine Chemie - Stoffeigenschaften (P750200).2 Stoffeigenschaften - Brennbarkeit, Schmelztemperatur Experiment von: Phywe Gedruckt: 07.2.205 :7:33 intertess (Version
Naturwissenschaften - Chemie - Allgemeine Chemie - Stoffeigenschaften (P750200).2 Stoffeigenschaften - Brennbarkeit, Schmelztemperatur Experiment von: Phywe Gedruckt: 07.2.205 :7:33 intertess (Version
Schulversuchspraktikum. Constanze Koch. Sommersemester Klassenstufen 5 & 6. Wasser als Lösungsmittel. Kurzprotokoll
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 5 & 6 Wasser als Lösungsmittel Kurzprotokoll Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch und vier Schülerversuche
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 5 & 6 Wasser als Lösungsmittel Kurzprotokoll Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch und vier Schülerversuche
Kohlenhydrate in Lebensmitteln Schokolade ist nicht gleich Schokolade!
 Kohlenhydrate in Lebensmitteln ist nicht gleich! Einführung Sicher hast du schon davon gehört, dass es verschiedene Zuckerarten gibt. So gibt es Traubenzucker (Glucose), Fruchtzucker (Fructose) und natürlich
Kohlenhydrate in Lebensmitteln ist nicht gleich! Einführung Sicher hast du schon davon gehört, dass es verschiedene Zuckerarten gibt. So gibt es Traubenzucker (Glucose), Fruchtzucker (Fructose) und natürlich
170 C C 2 H C C 11 H 10 (174.2) Darstellung von Cyclopentadien durch thermische Spaltung von Dicyclopentadien
 3.4.2 Darstellung von Cyclopentadien durch thermische Spaltung von Dicyclopentadien. [4+2]-Cycloaddition von Cyclopentadien mit p-benzochinon zum 1:1- Addukt (2a) und zum 2:1-Addukt (2b) 170 C 2 C 10 12
3.4.2 Darstellung von Cyclopentadien durch thermische Spaltung von Dicyclopentadien. [4+2]-Cycloaddition von Cyclopentadien mit p-benzochinon zum 1:1- Addukt (2a) und zum 2:1-Addukt (2b) 170 C 2 C 10 12
Wie lassen sich die Eigenschaften des Kohlenstoffdioxids nutzen?
 Naturwissenschaften - Chemie - Anorganische Chemie - 2 Luft und andere Gase (P754000) 2.8 Modell eines Feuerlöschers Experiment von: Seb Gedruckt: 24.03.204 :0:45 intertess (Version 3.2 B24, Export 2000)
Naturwissenschaften - Chemie - Anorganische Chemie - 2 Luft und andere Gase (P754000) 2.8 Modell eines Feuerlöschers Experiment von: Seb Gedruckt: 24.03.204 :0:45 intertess (Version 3.2 B24, Export 2000)
Anionen-Nachweis durch Fällungsreaktionen
 Lehrer-/Dozentenblatt Anionen-Nachweis durch Fällungsreaktionen (Artikelnr.: P7511300) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Allgemeine Chemie- Einführung
Lehrer-/Dozentenblatt Anionen-Nachweis durch Fällungsreaktionen (Artikelnr.: P7511300) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Allgemeine Chemie- Einführung
Säulenchromatogaphie Trennung von Pflanzenfarbstoffen
 Säulenchromatogaphie Trennung von Pflanzenfarbstoffen Allgemeine Hinweise Es ist grundsätzlich immer eine Schutzbrille und ein Labormantel zu tragen. Alle Tätigkeiten, Aufbauten, verwendeten Chemikalien
Säulenchromatogaphie Trennung von Pflanzenfarbstoffen Allgemeine Hinweise Es ist grundsätzlich immer eine Schutzbrille und ein Labormantel zu tragen. Alle Tätigkeiten, Aufbauten, verwendeten Chemikalien
1. Qualitativer Nachweis von Anionen und Sodaauszug
 Anionennachweis 1 1. Qualitativer Nachweis von Anionen und Sodaauszug Die moderne Analytische Chemie unterscheidet zwischen den Bereichen der qualitativen und quantitativen Analyse sowie der Strukturanalyse.
Anionennachweis 1 1. Qualitativer Nachweis von Anionen und Sodaauszug Die moderne Analytische Chemie unterscheidet zwischen den Bereichen der qualitativen und quantitativen Analyse sowie der Strukturanalyse.
Dihydridotetrakis(triphenylphosphino)ruthenium(II)
 Illumina-Chemie.de - Artikel Synthesen (RuH2(PPh3)4) Die Synthese des RuH2(PPh3)4 ist weitaus günstiger, als den Komplex zu kaufen, da bei der rechnerisch selben Masse an Ruthenium der Komplex beinahe
Illumina-Chemie.de - Artikel Synthesen (RuH2(PPh3)4) Die Synthese des RuH2(PPh3)4 ist weitaus günstiger, als den Komplex zu kaufen, da bei der rechnerisch selben Masse an Ruthenium der Komplex beinahe
Saure, neutrale und alkalische Lösungen
 Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 5 und 6 einen Lehrerversuch
Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 5 und 6 einen Lehrerversuch
Ein Gemisch aus 13,2 g (0,1mol) 2,5-Dimethoxyterahydrofuran und 80ml 0,6 N Salzsäure werden erhitzt bis vollständige Lösung eintritt.
 1.Acetondicarbonsäureanhydrid 40g (0,27mol)Acetondicarbonsäure werden in einer Lösung aus 100ml Eisessig und 43ml (0,45mol) Essigsäureanhydrid gelöst. Die Temperatur sollte 20 C nicht überschreiten und
1.Acetondicarbonsäureanhydrid 40g (0,27mol)Acetondicarbonsäure werden in einer Lösung aus 100ml Eisessig und 43ml (0,45mol) Essigsäureanhydrid gelöst. Die Temperatur sollte 20 C nicht überschreiten und
