Anhang I. Verzeichnis der Bezeichnungen, Darreichungsform, Stärken des Arzneimittels, Art der Anwendung, des Antragstellers in den Mitgliedsstaaten
|
|
|
- Felix Winkler
- vor 6 Jahren
- Abrufe
Transkript
1 Anhang I Verzeichnis der Bezeichnungen, Darreichungsform, Stärken des Arzneimittels, Art der Anwendung, des Antragstellers in den Mitgliedsstaaten 1
2 Mitgliedsstaat EU/EWR Antragsteller Phantasiebezeichnung Stärke Darreichungsform Art der Anwendung Österreich Belgien Frankreich Deutschland Italien Polen Seasonique Filmtabletten 0,15/0,03 mg und 0,01 mg Filmtablette zum Einnehmen Seasonique ,15/0,03 mg und 0,01 mg Filmtablette zum Einnehmen mg/0.03 mg filmomhulde tabletten en 0.01 mg filmomhulde tabletten Seasonique 0,15/0,03 mg und 0,01 mg Filmtablette zum Einnehmen Seasonique 0,15/0,03 mg und 0,01 mg Filmtablette zum Einnehmen Seasonique 0,15/0,03 mg und 0,01 mg Filmtablette zum Einnehmen Seasonique 0,15/0,03 mg und 0,01 mg Filmtablette zum Einnehmen 2
3 Rumänien Slowakische Republik Slowenien SEASONIQUE 150 micrograme/30 micrograme şi 10 micrograme comprimate filmate 0,15/0,03 mg und 0,01 mg Filmtablette zum Einnehmen Seasonique 0,15/0,03 mg und 0,01 mg Filmtablette zum Einnehmen Seasonique 0,15 0,15/0,03 mg und 0,01 mg Filmtablette zum Einnehmen mg/0,03 mg in 0,01 mg filmsko obložene tablete 3
4 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für das positive Gutachten der Europäischen Arzneimittel-Agentur 4
5 Wissenschaftliche Schlussfolgerungen Komplette Zusammenfassung der wissenschaftlichen Beurteilung von Seasonique und zugehörigen Bezeichnungen (siehe Anhang I) Seasonique ist ein auf die verlängerte Anwendungsdauer von insgesamt 91 Tagen ausgelegtes orales Kontrazeptivum, das aus einer festgelegten Hormondosis-Kombination besteht, bei der zunächst über 84 Tage 150 µg Levonorgestrel plus 30 µg Ethinylestradiol gegeben werden und danach über 7 Tage 10 µg Ethinylestradiol-Filmtabletten. Levonorgestrel (LNG) ist ein Progestogen, das bekanntermaßen die Ovulation hemmt, während das gering dosierte Östrogen Ethinylestradiol (EE) eine Kontrolle der Unterdrückung der Follikelreifung gewährleistet und das Endometrium stabil hält, um Durchbruchblutungen zu minimieren. Aufgrund des geringen Östrogengehalts gehört das Präparat zu den sogenannten niedrig-dosierten kombinierten oralen Kontrazeptiva (KOK). Beide Wirkstoffe sind in dieser Kombination in dieser Dosierung sowie in einer niedrigeren Dosierung (LNG 100 µg/ EE 20 µg) bereits zugelassen. Seasonique ist in einigen Ländern außerhalb der Europäischen Union (EU) zugelassen. Der Antrag auf dezentralisierte Zulassung wurde gemäß Artikel 28 Absatz 3 der Richtlinie 2001/83/EG in Übereinstimmung mit Artikel 10b der Richtlinie 2001/83/EG gestellt. Als Anwendungsgebiet für Seasonique wurde orale Kontrazeption vorgeschlagen. Im Rahmen des dezentralisierten Verfahrens war der Einspruch erhebende Mitgliedstaat der Ansicht, dass die kontrazeptive Wirksamkeit von Seasonique nicht ausreichend nachgewiesen sei. Da in der Zulassungsstudie PSE-301 mit der klassischen Poisson-Methode tatsächlich keine adäquate Präzision für das 95 %-Konfidenzintervall (95 %-KI) der Punktschätzung des Gesamt-Pearl-Index (PI) für Seasonique bei Frauen im Alter von 18 bis 35 Jahren erreicht wurde (Punktschätzung 0,76; 95 %-KI: 0,16-2,22), präsentierte der Antragsteller weitere Analysen, bei der das 95 %-KI nach einer Bootstrap- Methode berechnet worden war. Mit dieser nachträglich (post-hoc) gewählten Methode würde eine adäquate Präzision hinsichtlich der Anforderungen für hormonelle Kontrazeptiva der CHMP-Leitlinie zur klinischen Untersuchung steroidaler Kontrazeptiva bei Frauen (EMEA/CPMP/EWP/519/98 Rev. 1) (abhängig von der spezifischen Bootstrap-Simulation) mit einer Punktschätzung von 0,76 und einem 95 %-KI von (0,0-1,76) knapp erreicht. Außerdem vertrat der Einspruch erhebende Mitgliedstaat die Ansicht, dass das Muster der Menstruationsblutung nicht günstig sei und eine potenzielle Beeinträchtigung der Compliance und Wirksamkeit des Kontrazeptivums nicht ausgeschlossen werden könne. Das dezentralisierte Verfahren wurde an Tag 210 abgeschlossen. Die meisten betroffenen Mitgliedstaaten stimmten den Schlussfolgerungen des Referenzmitgliedstaats zu; eine Ausnahme bildete Deutschland, das eine potenziell schwerwiegende Gefahr für die öffentliche Gesundheit befürchtete. Aus diesem Grund wurde eine Befassung durch den CMD(h) eingeleitet. Weitere Analysen beider Studienarme (DP3-84/30 [höhere EE-Dosis als in Seasonique in den letzten 7 Tagen des Zyklus] und DP3-84/10 [Seasonique]) der Zulassungsstudie PSE-301 und der unterstützenden Studie PSE-302 lieferten trotz des größeren Stichprobenumfangs keine zuverlässigere Schätzung der kontrazeptiven Wirksamkeit von Seasonique und führten zu einem höheren PI von 1,67 (95 %-KI: 0,91-2,80). Die von Deutschland geäußerten gravierenden Bedenken konnten demnach im Rahmen des CMD(h)-
6 Befassungsverfahrens nicht ausgeräumt werden und das Problem wurde an den Ausschuss für Humanarzneimittel (CHMP) verwiesen. Kritische Beurteilung Das klinische Entwicklungsprogramm für Seasonique beinhaltete zwei randomisierte klinische Studien der Phase III, die Zulassungsstudie PSE-301 und die unterstützende Studie PSE-302, die speziell zur Bewertung der Ergebnisse der in den USA durchgeführten endometrialen Biopsien diente. Wirksamkeit des Kontrazeptivums In der Zulassungsstudie PSE-301 wurden unter Einnahme von Seasonique in Tage-Zyklen bei 621 Frauen im Alter von 18 bis 35 Jahren 3 Schwangerschaften beobachtet, was nach dem Poisson- Modell zu einem Gesamt-PI von 0,76 mit einem 95 %-KI von 0,16 bis 2,22 führt. Wie bereits erwähnt, legte der Antragsteller die zusätzliche im Rahmen des dezentralisierten Verfahrens durchgeführte Analyse vor, bei der anhand der Bootstrap-Methode eine adäquate Präzision für kontrazeptive Methoden erreicht wurde, wie durch den 95 %-KI von 0,0 1,76 gezeigt. Es wurden jedoch Bedenken hinsichtlich der Eigenschaften der Überdeckungswahrscheinlichkeit dieser Post-hoc-Analyse geäußert. Zur Beurteilung der Gültigkeit dieser Methode im vorliegenden Fall ersuchte der CHMP um Rat von der Arbeitsgruppe Biostatistik (Biostatistics Working Party, BSWP). Der CHMP unterstützte die Position der BSWP, die zu dem Schluss kam, dass die Bootstrap-Methode generell ungeeignet ist, um ein Konfidenzintervall für einen PI zu berechnen; erst recht in diesem Beispiel, in dem sie nicht zuvor spezifiziert worden war und erst durchgeführt wurde, nachdem sich die Ergebnisse der konventionelleren Analyse als negativ erwiesen hatten. Der mit der Poisson-Methode errechnete PI wurde daher angesichts der Tatsache, dass die verlängerte Anwendungsdauer bei Seasonique nur eine geringfügige Änderung eines existierenden Produkts darstellt, als akzeptabel betrachtet. Die Hormonkombination LNG 150 µg/ee 30 µg ist schließlich seit über 35 Jahren in der EU als Kontrazeptivum zugelassen und ihre Wirksamkeit ist gut dokumentiert. Darüber hinaus führte der Antragsteller über einen verlängerten Zyklus von 91 Tagen (84 Tage LNG/EE, gefolgt von ausschließlich EE über 7 Tage) eine nicht-vergleichende Pharmakodynamikstudie (PD-Studie) mit der Bezeichnung DR durch. Für die Analyse wurde dieser Zeitraum in zwei 28-Tage- und einen 35-Tage-Zeitraum aufgeteilt. Bei zwei Probandinnen (5,71 % der Frauen) fand während des zweiten 28-Tage-Zeitraums der Eisprung statt, von denen eine auch im dritten Zeitraum ihren Eisprung hatte; somit ergibt sich eine Gesamt-Eierstockaktivität von 2,86 (95 %-KI: 0,78-7,22) über einen Zeitraum von 91 Tagen. Das Fehlen eines Vergleichs-Studienarms wurde als gerechtfertigt betrachtet, da der Wirkmechanismus dieser Hormonkombination in dieser Dosierung hinlänglich bekannt ist und da die einzigen Unterschiede zwischen Seasonique und anderen erhältlichen LNG/EE- Kombinationsprodukten in der Behandlungsdauer (84 Tage bei Seasonique gegenüber 21 Tagen) und der Verabreichung von 10 µg EE während der letzten 7 Tage des Zyklus bei Seasonique anstelle eines hormonfreien Intervalls (HFI) liegen. Außerdem haben mehrere veröffentlichte pharmakodynamische Studien gezeigt, dass mit einem kürzen HFI eine stärkere Hemmung des Eisprungs stattfindet. Die Spiegel von follikelstimulierendem Hormon (FSH), luteinisierendem Hormon (LH), Estradiol und Inhibin B wurden effektiver unterdrückt, wenn die Dauer des HFI von 7 auf 3 bzw. 4 Tage pro 28-Tage- Behandlungszyklus reduziert wurde (Willis, 2006). Diese ausgeprägtere Unterdrückung wurde auch bei
7 folgenden Anwendungsschemata gezeigt: Drospirenon 3 mg/ee 2 µg 24/4 im Vergleich zu 21/7-Standardbehandlung (Klipping, 2008), bei Nomegestrolacetat/17b-Estradiol 24/4 zum Einnehmen im Vergleich zu 21/7 (Christin-Maitre, 2011) und bei 0,075 mg Gestoden/20 µg EE 23-Tage-Schema im Vergleich zum 21-Tage-Schema (Spona, 1996). Außerdem wurde in der Fachliteratur gezeigt, dass die Eliminierung des HFI mit einer besseren Hemmung der Eisprungaktivität einhergeht. Eine veröffentlichte Studie mit 3 verschiedenen Studienarmen mit kombinierten oralen Kontrazeptiva (KOK) zeigte, dass Frauen, die mit einem durchgängigen 28-Tage-Schema behandelt wurden, eine ausgeprägtere Follikelsuppression aufwiesen als Frauen, die entweder eine ergänzende Behandlung mit 10 µg EE über 5 Tage erhielten oder ein 7-tägiges HFI hatten (Schlaff, 2004). Eine weitere veröffentlichte pharmakodynamische Studie zeigte, dass ein durchgängiges KOK-Schema mit Levonorgestrel/EE und Norgestimat/EE in einer effektiveren Follikelsuppression resultierte als dasselbe KOK-Anwendungsschema mit einem monatlichen 7-tägigen HFI (Birtch, 2006). Basierend auf den Ergebnissen dieser veröffentlichten klinischen Studien ist davon auszugehen, dass Seasonique den Eisprung besser kontrolliert, was wiederum im Vergleich zu Standard-KOK mit 21/7 Tagen LNG/EE zu einer höheren kontrazeptiven Wirksamkeit führt; deshalb wird eine Pharmakodynamikstudie zum Vergleich mit Standard-KOK mit 21/7 Tagen LNG/EE nicht als obligatorisch betrachtet. Außerdem ist die Anwendung von Standard-KOK mit 21/7 Tagen LNG 150 µg/ee 30 µg weit verbreitet, und laut den jeweiligen Produktinformationen in einigen Mitgliedstaaten kann der Zyklus auf 2 Monate ohne HFI verlängert werden. Das Fehlen eines hormonfreien Intervalls wird also nicht als die kontrazeptive Wirksamkeit verringernd betrachtet und der CHMP kam zu dem Schluss, dass die gut dokumentierte kontrazeptive Wirksamkeit der 28-Tage-Kombination aus 150 µg LNG/30 µg EE auf die Seasonique-Anwendung extrapoliert werden kann. Die in den klinischen Studien mit Seasonique erzielten Ergebnisse werden außerdem durch die Daten nach Markteinführung gestützt. Laut außerhalb der EU gewonnen Daten wurden im Zeitraum von der ersten Zulassung im Jahr 2006 bis Dezember 2013 bei einer geschätzten Anwendung von Frauenjahren nur 10 Schwangerschaften gemeldet, was einer Schwangerschafts-Melderate von 0,0026 % entspricht. Weiterhin zeigte eine 1-Jahres-Retrospektivstudie, an der Frauen im Alter zwischen 15 und 40 Jahren teilgenommen hatten, dass die gemeldeten Schwangerschaftsraten bei der Anwendung oraler Kontrazeptiva (OK) mit verlängertem Zyklus (84/7) niedriger waren als bei Standard - Anwendungsschemata (21/7 und 24/4). In die Studie wurden zum Vergleich des 84/7-Schemas mit dem 21/7-Schema Frauen (mittleres Alter 27,3 Jahre) (n= in beiden Gruppen) aufgenommen, während zum Vergleich des 84/7-Schemas mit dem 24/4-Schema Frauen (mittleres Alter 27,8 Jahre) (n= in beiden Gruppen) aufgenommen wurden. Die Schwangerschaftsraten nach einem Jahr waren bei dem Anwendungsschema 84/7 statistisch signifikant niedriger als bei dem Anwendungsschema 21/7 (4,4 % vs. 7,3 %; p<0,0001) und dem Anwendungsschema 24/4 (4,4 % vs. 6,9 %, p<0,0001). Statistisch signifikant höhere Schwangerschaftsraten bei den Anwendungsschemata 21/7 und 24/4 im Vergleich zur Anwendung 84/7 (p<0,0001) wurden auch in den 2- und 3-Jahres-Kohorten beobachtet (Howard, 2014). Einige CHMP-Mitglieder waren der Ansicht, dass diese Veröffentlichung als Beweis für die kontrazeptive Wirksamkeit von Anwendungsschemata mit verlängerter Zyklusdauer nicht akzeptabel sei, da die verwendete Studienform für verschiedene Störfaktoren anfällig ist (Dauer der Anwendung verschiedener KOK, Schwangerschaftsabsicht, Anwendung aus anderen Gründen als einer Schwangerschaftsvermeidung). Trotz dieser Einschränkungen spricht diese Veröffentlichung wenigstens nicht für eine verminderte kontrazeptive Wirksamkeit des 84/7-Anwendungsschemas.
8 Zu beachten ist, dass die kombinierten Analysen mit beiden Studienarmen (DP3-84/30 [höhere Dosis EE als in Seasonique in den letzten 7 Tagen des Zyklus] und DP3-84/10 [Seasonique-Schema]) der Zulassungsstudie PSE-301 und der unterstützenden Studie PSE-302 in einem höheren PI von 1,67 (95 %-KI 0,91-2,80) resultierte. Allerdings ist im DP3-84/30-Arm der Studie PSE-301 bei 3 der 9 Schwangerschaften, die mit der Einstufung während der Behandlung auftretend in die Analyse aufgenommen wurden, keine Dokumentation und Kontrolle der Studienmedikation erfolgt; basierend auf den verfügbaren Daten ist es in der Tat so, dass diese Schwangerschaften möglicherweise als nicht während der Behandlung auftretend eingestuft werden müssen. Die Studie PSE-302 beinhaltete eine begrenzte Anzahl von Zyklen mit Exposition gegenüber dem Arzneimittel und wurde nicht für die PI-Auswertung konzipiert. Aus diesen Gründen erachtete der CHMP diesen höheren PI nicht als für die Beurteilung der Wirksamkeit von Seasonique relevant. Obwohl die PD-Studie keinen Vergleichsarm enthielt, lässt sich basierend auf den umfangreichen Ergebnissen aus veröffentlichten klinischen Studien und angesichts der Tatsache, dass das verlängerte Anwendungsschema bei Seasonique gegenüber existierenden Produkten nur eine geringfügige Änderung darstellt, schlussfolgern, dass Seasonique im Vergleich zu den LNG/EE- Kombinationsprodukten, deren Wirksamkeit gut dokumentiert ist, eine bessere Kontrolle des Eisprungs ermöglicht. Die PD-Daten zeigten, dass die Wirksamkeit zur Hemmung des Eisprungs von Seasonique in dem Bereich liegt, der bei anderen zugelassenen kombinierten hormonellen Kontrazeptiva beobachtet wird. Darüber hinaus war die Schwangerschaftsrate in der klinischen Studie der Phase III relativ niedrig (PI<1), und in den umfangreichen Anwendungserfahrungen nach Markteinführung wurden keine Anzeichen für eine reduzierte Wirksamkeit beobachtet. Daher erachtete der CHMP die Wirksamkeit von Seasonique als ausreichend belegt. Muster der Menstruationsblutung In der Studie PSE 302 wurde das Muster der Menstruationsblutung bei Seasonique mit dem Standardschema 21/7-Tage-Zyklus verglichen (Nordette, LNG 150 µg/ee 30 µg und HFI von 7 Tagen). Obwohl bei Frauen, die ein volles Behandlungsjahr abgeschlossen hatten, ein Absetzen der Behandlung aufgrund von unerwünschten Ereignissen in Zusammenhang mit Blutungen/Schmierblutungen in der Seasonique-Gruppe mit 7,4 % häufiger zu verzeichnen war als in der Vergleichsgruppe (1,1 %), war die mittlere Gesamtanzahl an Tagen mit Blutungen/Schmierblutungen (planmäßig und unplanmäßig) pro Patientenmonat ähnlich, und zwar 4,4 Tage sowohl bei Seasonique als auch bei dem Vergleichspräparat. Daher wurde der Antragsteller aufgefordert, zusätzliche Analysen zum Muster der Menstruationsblutung auf Basis von drei Extrapolationsregeln durchzuführen, um Frauen, die die Einnahme vorzeitig abbrachen, miteinzubeziehen und diese Daten auf die gesamte geplante Dauer der Studie PSE-302 von 1 Jahr zu extrapolieren. Die Gesamtzahl an Tagen mit Blutung/Schmierblutung war innerhalb der geplanten Studiendauer von 1 Jahr bei der Seasonique-Gruppe höher als bei der Vergleichsgruppe (Mittelwert 61-62, vs , abhängig von der Extrapolationsregel). Erwartungsgemäß war aufgrund des verlängerten Anwendungsschemas die Gesamtzahl der planmäßigen Blutungen/Schmierblutungen innerhalb der geplanten Studiendauer bei Seasonique um den Faktor 3 niedriger als bei dem Vergleichspräparat (Mittelwert 11 vs. 33). Im Gegensatz dazu war die Gesamtzahl an Tagen mit unplanmäßigen Blutungen/Schmierblutungen mit Seasonique doppelt so hoch wie bei dem Vergleichspräparat (Mittelwert 53 vs. 24).
9 Ähnliche Zahlen an Patientinnen meldeten unplanmäßige Blutungen von jedem Schweregrad: 64 (80,0 %) bzw. 69 (78,4 %) leichte Blutung, 42 (52,5 %) bzw. 42 (47,7 %) mäßige Blutung und 14 (17,5 %) bzw. 13 (14,8 %) starke Blutung in der Seasonique- bzw. der Vergleichsgruppe. In Übereinstimmung mit diesen Befunden zeigten die Laborergebnisse, dass das unplanmäßige Blutungs-/Schmierblutungsprofil bei Seasonique nicht zu klinisch signifikanten Änderungen führte. Die Gesamt-Compliance für alle behandelten Patientinnen lag bei 97 % in der Zulassungsstudie und bei 98 % in der unterstützenden Studie. In der Studie PSE-302 wurden bei der Seasonique-Gruppe und der Vergleichsgruppe vergleichbare Abbruchraten (51,6 % vs. 49,5 %) beobachtet. Auch in einer unverblindeten, randomisierten Studie der Phase II, an der 265 Frauen über 8 Monate teilnahmen, wurden vergleichbare Abbruchraten, u. a. Abbrüche aufgrund von unerwünschten Ereignissen, bei Seasonique (34,5 %) und zwei 28-Tage-OK (35,2 % bzw. 39,1 %) beobachtet. Abschließend kann laut Studie PSE-302 festgehalten werden, dass die Gesamtzahl an Tagen mit Blutung/Schmierblutung bei Seasonique höher war als beim Vergleichspräparat Nordette. Die bei Seasonique erhöhte Anzahl an Tagen mit unplanmäßiger Blutung/Schmierblutung schien im Vergleich zu anderen 21/7-Tagezyklus-OK keinen Einfluss auf die Compliance zu haben. Dies wurde ferner untermauert durch das Fehlen einer Anämie oder klinisch relevanter Veränderungen der Laborergebnisse im Vergleich zu den 21/7-Tagezyklus-KOK. Der CHMP vertrat daher die Auffassung, dass das Muster der Menstruationsblutung bei Seasonique weder ein Sicherheitsproblem für Frauen darstellt, noch die kontrazeptive Wirksamkeit beeinträchtigt. Adäquate Angaben hierzu wurden bereits in die vorgeschlagene Produktinformation aufgenommen. Risikomanagement-Plan (RMP) Ein Risikomanagementplan wurde im Rahmen des vorangegangenen dezentralisierten Verfahrens zu Seasonique vorgelegt und vereinbart. Es wurden keine zusätzlichen Änderungen durch den CHMP vorgenommen. Allgemeines Nutzen-Risiko-Verhältnis Unter Berücksichtigung aller vom Antragsteller eingereichten Daten und der Ansicht der BSWP gelangte der CHMP zu der Auffassung, dass die kontrazeptive Wirksamkeit von Seasonique angemessen nachgewiesen wurde. Der CHMP berücksichtigte auch, dass das mit der Anwendung von Seasonique verbundene Blutungsmuster weder ein Sicherheitsproblem darstellte noch die Wirksamkeit beeinträchtigte. Der CHMP war der Ansicht, dass das Nutzen-Risiko-Verhältnis von Seasonique und zugehörigen Bezeichnungen als günstig erachtet wird. Begründung für das befürwortende Gutachten In Erwägung nachstehender Gründe: Der Ausschuss prüfte die Mitteilung über das von Frankreich gemäß Artikel 29 Absatz 4 der Richtlinie 2001/83/EG eingeleitete Befassungsverfahren. Deutschland war der Ansicht, dass die
10 Erteilung der Genehmigung für das Inverkehrbringen ein potenziell schwerwiegendes Risiko für die öffentliche Gesundheit darstellt. Der Ausschuss prüfte alle vom Antragsteller zum Nachweis der Wirksamkeit von Seasonique und zugehörigen Bezeichnungen zur oralen Kontrazeption mit verlängerter Anwendung eingereichten Daten. Der Ausschuss ist der Ansicht, dass die verfügbaren Daten die Wirksamkeit von Seasonique und zugehörigen Bezeichnungen als verlängertes Anwendungsschema eines existierenden kombinierten oralen Kontrazeptivums stützen. Der Ausschuss vertritt außerdem die Ansicht, dass das mit der Anwendung von Seasonique und zugehörigen Bezeichnungen verbundene Blutungsmuster weder ein Sicherheitsproblem darstellt noch die kontrazeptive Wirksamkeit beeinträchtigt und zu diesem Punkt ausreichende Informationen in die vorgeschlagene Produktinformation aufgenommen wurden hat der CHMP die Erteilung der Genehmigung(en) für das Inverkehrbringen empfohlen, deren Zusammenfassung der Merkmale des Arzneimittels, Etikettierung und Packungsbeilage gemäß den im Rahmen des Verfahrens der Koordinierungsgruppe erzielten Endfassungen, wie in Anhang III zu Seasonique und zugehörigen Bezeichnungen (siehe Anhang I) dargelegt, beibehalten werden.
11 Anhang III Zusammenfassung der Merkmale des Arzneimittels, Etikettierung und Packungsbeilage
12 Die gültige Zusammenfassung der Merkmale des Arzneimittels, Etikettierung und Packungsbeilage sind die Endversionen, die aus dem Koordinierungsgruppen-Verfahren hervorgegangen sind.
Bezeichnung Darreichungsform Stärken Zieltierarten Häufigkeit und Art der Anwendung. Clavulanic acid 10 mg. Clavulanic acid 10 mg
 Anhang I Liste der Bezeichnungen, der Darreichungsform, der Stärke des Tierarzneimittels, der Zieltierarten, der Art der Anwendung sowie des Antragsstellers/Inhabers der Genehmigung für das Inverkehrbringen
Anhang I Liste der Bezeichnungen, der Darreichungsform, der Stärke des Tierarzneimittels, der Zieltierarten, der Art der Anwendung sowie des Antragsstellers/Inhabers der Genehmigung für das Inverkehrbringen
Anhang IV. Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen
 Anhang IV Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen 28 Wissenschaftliche Schlussfolgerungen Komplette Zusammenfassung
Anhang IV Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen 28 Wissenschaftliche Schlussfolgerungen Komplette Zusammenfassung
Arzneimittel nicht länger zugelassen. Anhang IV
 Anhang IV Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen und detaillierte Erklärung der Abweichungen von der Empfehlung
Anhang IV Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen und detaillierte Erklärung der Abweichungen von der Empfehlung
KOMPLETTE ZUSAMMENFASSUNG DER WISSENSCHAFTLICHEN BEURTEILUNG VON ARZNEIMITTELN, DIE VALPROINSÄURE/VALPROAT ENTHALTEN (siehe Anhang I)
 ANHANG II WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG DER EUROPÄISCHEN ARZNEIMITTEL-AGENTUR FÜR DIE ÄNDERUNG DER ZUSAMMENFASSUNGEN DER MERKMALE DER ARZNEIMITTEL UND DER PACKUNGSBEILAGEN 127 WISSENSCHAFTLICHE
ANHANG II WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG DER EUROPÄISCHEN ARZNEIMITTEL-AGENTUR FÜR DIE ÄNDERUNG DER ZUSAMMENFASSUNGEN DER MERKMALE DER ARZNEIMITTEL UND DER PACKUNGSBEILAGEN 127 WISSENSCHAFTLICHE
Rat der Europäischen Union Brüssel, den 11. Dezember 2015 (OR. en)
 Rat der Europäischen Union Brüssel, den 11. Dezember 2015 (OR. en) 15273/15 NLEG 164 AGRI 670 SAN 437 ÜBERMITTLUNGSVERMERK Absender: Europäische Kommission Eingangsdatum: 11. Dezember 2015 Empfänger: Nr.
Rat der Europäischen Union Brüssel, den 11. Dezember 2015 (OR. en) 15273/15 NLEG 164 AGRI 670 SAN 437 ÜBERMITTLUNGSVERMERK Absender: Europäische Kommission Eingangsdatum: 11. Dezember 2015 Empfänger: Nr.
Anhang II. Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen
 Anhang II Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen 12 Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung
Anhang II Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen 12 Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung
ANHANG I VERZEICHNIS DER BEZEICHNUNGEN, DARREICHUNGSFORM, STÄRKE DES ARZNEIMITTELS, ART DER ANWENDUNG, DER ANTRAGSTELLER IN DEN MITGLIEDSTAATEN
 ANHANG I VERZEICHNIS DER BEZEICHNUNGEN, DARREICHUNGSFORM, STÄRKE DES ARZNEIMITTELS, ART DER ANWENDUNG, DER ANTRAGSTELLER IN DEN MITGLIEDSTAATEN 1 AT - Österreich Flutiform 50 Mikrogramm/5 Mikrogramm pro
ANHANG I VERZEICHNIS DER BEZEICHNUNGEN, DARREICHUNGSFORM, STÄRKE DES ARZNEIMITTELS, ART DER ANWENDUNG, DER ANTRAGSTELLER IN DEN MITGLIEDSTAATEN 1 AT - Österreich Flutiform 50 Mikrogramm/5 Mikrogramm pro
Die Delegationen erhalten in der Anlage das Kommissionsdokument - D007617/03.
 RAT R EUROPÄISCHEN UNION Brüssel, den 14. Januar 2010 (15.01) (OR. en) 5349/10 NLEG 5 ÜBERMITTLUNGSVERMERK Absender: Europäische Kommission Eingangsdatum: 8. Januar 2010 Empfänger: Generalsekretariat des
RAT R EUROPÄISCHEN UNION Brüssel, den 14. Januar 2010 (15.01) (OR. en) 5349/10 NLEG 5 ÜBERMITTLUNGSVERMERK Absender: Europäische Kommission Eingangsdatum: 8. Januar 2010 Empfänger: Generalsekretariat des
Antragsteller Phantasie-bezeichnung Name
 ANHANG I VERZEICHNIS DER BEZEICHNUNGEN, DARREICHUNGSFORM, STÄRKE, ART DER ANWENDUNG DES ARZNEIMITTELS UND DER INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN IN DEN MITGLIEDSTAATEN 1 Mitgliedstaat EU/EEA
ANHANG I VERZEICHNIS DER BEZEICHNUNGEN, DARREICHUNGSFORM, STÄRKE, ART DER ANWENDUNG DES ARZNEIMITTELS UND DER INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN IN DEN MITGLIEDSTAATEN 1 Mitgliedstaat EU/EEA
Die östrogenfreie Pille
 Alle wichtigen Infos über Sexualität und Verhütung unter: www.frau-und-pille.de Mit bester Empfehlung Die östrogenfreie Pille Verhütung für Frauen mit besonderem Anspruch. Einscannen und mehr erfahren...
Alle wichtigen Infos über Sexualität und Verhütung unter: www.frau-und-pille.de Mit bester Empfehlung Die östrogenfreie Pille Verhütung für Frauen mit besonderem Anspruch. Einscannen und mehr erfahren...
Das Östrogen wird mit einem Gestagen kombiniert, welches in erster Linie für die Verhütung zuständig ist.
 Pille Die Pille - das beliebteste Verhütungsmittel Die Pille ist das am häufigsten verwendete Verhütungsmittel in Deutschland. Rund sieben Millionen Frauen schlucken sie täglich. Die Pille gilt zudem als
Pille Die Pille - das beliebteste Verhütungsmittel Die Pille ist das am häufigsten verwendete Verhütungsmittel in Deutschland. Rund sieben Millionen Frauen schlucken sie täglich. Die Pille gilt zudem als
Hormone replacement therapy and risk of venous thromboembolism in postmenopausal women: systematic review and meta-analysis
 Hormone replacement therapy and risk of venous thromboembolism in postmenopausal women: systematic review and meta-analysis Canonico M, Plu-Bureau G, Lowe G and Scarabin PY. BMJ May 2008;336:1227-1231
Hormone replacement therapy and risk of venous thromboembolism in postmenopausal women: systematic review and meta-analysis Canonico M, Plu-Bureau G, Lowe G and Scarabin PY. BMJ May 2008;336:1227-1231
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Tolperison, Nichtigkeitsklage vor dem Gericht der EU gegen den Durchführungsbeschluss der Kommission aus dem Art. 31-Verfahren nach RL 2001/83/EG
 Tolperison, Nichtigkeitsklage vor dem Gericht der EU gegen den Durchführungsbeschluss der Kommission aus dem Art. 31-Verfahren nach RL 2001/83/EG 72. Routinesitzung 29. Mai 2012 Tolperison, Verfahren nach
Tolperison, Nichtigkeitsklage vor dem Gericht der EU gegen den Durchführungsbeschluss der Kommission aus dem Art. 31-Verfahren nach RL 2001/83/EG 72. Routinesitzung 29. Mai 2012 Tolperison, Verfahren nach
3 Die Notfallkontrazeption
 . Die Wirksamkeit durch das Prinzip der Eisprungverschiebung In Studien konnte gezeigt werden, dass signifikant überlegen ist. Besonders deutlich wird die Überlegenheit von gegenüber bei rascher Einnahme,
. Die Wirksamkeit durch das Prinzip der Eisprungverschiebung In Studien konnte gezeigt werden, dass signifikant überlegen ist. Besonders deutlich wird die Überlegenheit von gegenüber bei rascher Einnahme,
Emergency contraception. Dr. Friederike Thieringer
 Emergency contraception Dr. Friederike Thieringer Einführung Wahrscheinlichkeit einer Schwangerschaft nach ungeschütztem Geschlechtsverkehr: Über den gesamten Zyklus: ca. 5 8% In der periovulatorischen
Emergency contraception Dr. Friederike Thieringer Einführung Wahrscheinlichkeit einer Schwangerschaft nach ungeschütztem Geschlechtsverkehr: Über den gesamten Zyklus: ca. 5 8% In der periovulatorischen
Sandoz Pharmaceuticals AG
 Die Pille danach. Was ist eine Notfallverhütung oder die sogenannte «Pille danach»? 1 Wann wird NorLevo Uno eingenommen? 2 Bei der «Pille danach» handelt es sich um eine Notfallverhütung, die eine unerwünschte
Die Pille danach. Was ist eine Notfallverhütung oder die sogenannte «Pille danach»? 1 Wann wird NorLevo Uno eingenommen? 2 Bei der «Pille danach» handelt es sich um eine Notfallverhütung, die eine unerwünschte
BAnz AT 25.04.2014 B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Überprüfung von Umwelttechnologien (ETV)
 Überprüfung von Umwelttechnologien (ETV) 20/02/2008-21/03/2008 371 Antworten 0. TEILNAHME Land DE Deutschland 63 (17%) NL Niederlande 44 (11.9%) CZ Tschechische Republik 30 (8.1%) PL Polen 22 (5.9%) UK
Überprüfung von Umwelttechnologien (ETV) 20/02/2008-21/03/2008 371 Antworten 0. TEILNAHME Land DE Deutschland 63 (17%) NL Niederlande 44 (11.9%) CZ Tschechische Republik 30 (8.1%) PL Polen 22 (5.9%) UK
Keine CE-Kennzeichnung ohne klinische Bewertung
 Seite 1 von 5 Keine CE-Kennzeichnung ohne klinische Bewertung Medizinprodukte können in der Regel nicht ohne klinische Daten und deren Bewertung auf den Markt gelangen. Zudem besteht für Medizinprodukte
Seite 1 von 5 Keine CE-Kennzeichnung ohne klinische Bewertung Medizinprodukte können in der Regel nicht ohne klinische Daten und deren Bewertung auf den Markt gelangen. Zudem besteht für Medizinprodukte
Sachverständigenausschuss für Verschreibungspflicht (SVA) 72. Sitzung, TOP 7 Famciclovir
 Sachverständigenausschuss für Verschreibungspflicht (SVA) 72. Sitzung, TOP 7 Famciclovir Antrag auf Entlassung aus der Verschreibungspflicht Famciclovir zur oralen Behandlung von rezidivierenden Episoden
Sachverständigenausschuss für Verschreibungspflicht (SVA) 72. Sitzung, TOP 7 Famciclovir Antrag auf Entlassung aus der Verschreibungspflicht Famciclovir zur oralen Behandlung von rezidivierenden Episoden
RAT DER (26.01) EUROPÄISCHEN UNION (OR.
 RAT R EUROPÄISCHEN UNION Brüssel, den 25. Januar 2012 (26.01) (OR. en) 5726/12 NLEG 5 AGRI 43 ÜBERMITTLUNGSVERMERK Absender: Europäische Kommission Eingangsdatum: 20. Januar 2012 Empfänger: Generalsekretariat
RAT R EUROPÄISCHEN UNION Brüssel, den 25. Januar 2012 (26.01) (OR. en) 5726/12 NLEG 5 AGRI 43 ÜBERMITTLUNGSVERMERK Absender: Europäische Kommission Eingangsdatum: 20. Januar 2012 Empfänger: Generalsekretariat
gestützt auf den Vertrag zur Gründung der Europäischen Wirtschaftsgemeinschaft,
 Avis juridique important 31993L0008 Richtlinie 93/8/EWG der Kommission vom 15. März 1993 zur Änderung der Richtlinie 82/711/EWG des Rates über die Grundregeln für die Ermittlung der Migration von Materialien
Avis juridique important 31993L0008 Richtlinie 93/8/EWG der Kommission vom 15. März 1993 zur Änderung der Richtlinie 82/711/EWG des Rates über die Grundregeln für die Ermittlung der Migration von Materialien
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. PROGESTOGEL 1 % Gel. Progesteron
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER PROGESTOGEL 1 % Gel Progesteron Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER PROGESTOGEL 1 % Gel Progesteron Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
L 209/4 Amtsblatt der Europäischen Union 4.8.2012
 L 209/4 Amtsblatt der Europäischen Union 4.8.2012 VERORDNUNG (EU) Nr. 712/2012 DER KOMMISSION vom 3. August 2012 zur Änderung der Verordnung (EG) Nr. 1234/2008 über die Prüfung von Änderungen der Zulassungen
L 209/4 Amtsblatt der Europäischen Union 4.8.2012 VERORDNUNG (EU) Nr. 712/2012 DER KOMMISSION vom 3. August 2012 zur Änderung der Verordnung (EG) Nr. 1234/2008 über die Prüfung von Änderungen der Zulassungen
14949/14 hm/ab 1 DG G 2B
 Rat der Europäischen Union Brüssel, den 31. Oktober 2014 (OR. en) Interinstitutionelles Dossier: 2013/0045 (CNS) 14949/14 FISC 181 ECOFIN 1001 BERICHT Absender: Empfänger: Vorsitz Rat Nr. Vordok.: 14576/14
Rat der Europäischen Union Brüssel, den 31. Oktober 2014 (OR. en) Interinstitutionelles Dossier: 2013/0045 (CNS) 14949/14 FISC 181 ECOFIN 1001 BERICHT Absender: Empfänger: Vorsitz Rat Nr. Vordok.: 14576/14
Calcineurininhibitoren zur topischen Anwendung: Pimecrolimus und Tacrolimus (Elidel, Douglan und Protopic )
 Calcineurininhibitoren zur topischen Anwendung: Pimecrolimus und Tacrolimus (Elidel, Douglan und Protopic ) Ergebnisse der europäischen Risiko- Bewertungs-Verfahren Anlass für die Risikobewertungsverfahren
Calcineurininhibitoren zur topischen Anwendung: Pimecrolimus und Tacrolimus (Elidel, Douglan und Protopic ) Ergebnisse der europäischen Risiko- Bewertungs-Verfahren Anlass für die Risikobewertungsverfahren
Geschätzte Kosten von Maßnahmen der EU zur Terrorismusbekämpfung
 xxx GENERALDIREKTION INTERNE POLITIKBEREICHE FACHABTEILUNG C: BÜRGERRECHTE UND VERFASSUNGSFRAGEN BÜRGERLICHE FREIHEITEN, JUSTIZ UND INNERES Geschätzte Kosten von Maßnahmen der EU zur Terrorismusbekämpfung
xxx GENERALDIREKTION INTERNE POLITIKBEREICHE FACHABTEILUNG C: BÜRGERRECHTE UND VERFASSUNGSFRAGEN BÜRGERLICHE FREIHEITEN, JUSTIZ UND INNERES Geschätzte Kosten von Maßnahmen der EU zur Terrorismusbekämpfung
Anhaltspunkt für erheblichen Zusatznutzen
 Pertuzumab Anhaltspunkt für erheblichen Zusatznutzen - Überlebensvorteil bei bestimmten Patientinnen - Keine Aussagen zum Schaden möglich Köln (1. Juli 2013) - Pertuzumab (Perjeta ) ist seit März 2013
Pertuzumab Anhaltspunkt für erheblichen Zusatznutzen - Überlebensvorteil bei bestimmten Patientinnen - Keine Aussagen zum Schaden möglich Köln (1. Juli 2013) - Pertuzumab (Perjeta ) ist seit März 2013
Endfassung vom. 13. März 2006
 DFG - Senatskommission zur Beurteilung der gesundheitlichen Unbedenklichkeit von Lebensmitteln Prof. Dr. G. Eisenbrand - Vorsitzender SKLM Natürliche Lebensmittel-Inhaltsstoffe: Beurteilung der Toxizität
DFG - Senatskommission zur Beurteilung der gesundheitlichen Unbedenklichkeit von Lebensmitteln Prof. Dr. G. Eisenbrand - Vorsitzender SKLM Natürliche Lebensmittel-Inhaltsstoffe: Beurteilung der Toxizität
Therapie des Uterus myomatosus im Wandel. Dr. Lilli Kock Evangelisches Diakoniekrankenhaus
 Therapie des Uterus myomatosus im Wandel Dr. Lilli Kock Evangelisches Diakoniekrankenhaus Gliederung! Übersicht Therapiestrategien! Ulipristalacetat (UPA) = Esmya! Übersicht Zulassungsstudien! PEARL IV
Therapie des Uterus myomatosus im Wandel Dr. Lilli Kock Evangelisches Diakoniekrankenhaus Gliederung! Übersicht Therapiestrategien! Ulipristalacetat (UPA) = Esmya! Übersicht Zulassungsstudien! PEARL IV
Arbeitslosigkeit nach der Finanz- und Wirtschaftskrise (Teil 1)
 (Teil 1) Ausgewählte europäische Staaten, im Jahr 2010 und Veränderung der Spanien 2010 20,1 77,9 Estland 16,9 207,3 Slowakei Irland 13,7 14,4 117,5 51,6 Griechenland Portugal 12,0 12,6 41,2 63,6 Türkei
(Teil 1) Ausgewählte europäische Staaten, im Jahr 2010 und Veränderung der Spanien 2010 20,1 77,9 Estland 16,9 207,3 Slowakei Irland 13,7 14,4 117,5 51,6 Griechenland Portugal 12,0 12,6 41,2 63,6 Türkei
PRESSEMITTEILUNG GESUNKEN
 16. Januar 2012 PRESSEMITTEILUNG ANZAHL DER MONETÄREN FINANZINSTITUTE IM EURO- WÄHRUNGSGEBIET UND IN DER EU IM JAHR 2011 WEITER GESUNKEN Am 1. Januar 2012 belief sich die Anzahl der im Euro-Währungsgebiet
16. Januar 2012 PRESSEMITTEILUNG ANZAHL DER MONETÄREN FINANZINSTITUTE IM EURO- WÄHRUNGSGEBIET UND IN DER EU IM JAHR 2011 WEITER GESUNKEN Am 1. Januar 2012 belief sich die Anzahl der im Euro-Währungsgebiet
Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva
 Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva Darmstadt (19. Februar 2009) Die Merck KGaA hat heute bekannt gegeben, dass die europäische Arzneimittelbehörde EMEA
Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva Darmstadt (19. Februar 2009) Die Merck KGaA hat heute bekannt gegeben, dass die europäische Arzneimittelbehörde EMEA
VASOCEDINE PSEUDOEPHEDRINE 60 mg, Filmtabletten Pseudoephedrinhydrochlorid
 VASOCEDINE PSEUDOEPHEDRINE 60 mg, Filmtabletten Pseudoephedrinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen. - Heben Sie
VASOCEDINE PSEUDOEPHEDRINE 60 mg, Filmtabletten Pseudoephedrinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen. - Heben Sie
des beeinträchtigten Sehvermögens aufgrund eines durch Diabetes verursachten Makulaödems;
 EMA/677928/2015 EMEA/H/C/002392 Zusammenfassung des EPAR für die Öffentlichkeit Aflibercept Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
EMA/677928/2015 EMEA/H/C/002392 Zusammenfassung des EPAR für die Öffentlichkeit Aflibercept Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
Notfallkontrazeption Die Pille danach für jeden Haushalt!
 Gesellschaft für Geburtshilfe und Gynäkologie Berlin 20.02.2013 Notfallkontrazeption Die Pille danach für jeden Haushalt! Julia Bartley Abteilung für gynäkologische Endokrinologie Charité Universitätsmedizin
Gesellschaft für Geburtshilfe und Gynäkologie Berlin 20.02.2013 Notfallkontrazeption Die Pille danach für jeden Haushalt! Julia Bartley Abteilung für gynäkologische Endokrinologie Charité Universitätsmedizin
Dreizehnte Verordnung zur Änderung der Arzneimittelverschreibungsverordnung
 Bundesrat Drucksache 768/12 (Beschluss) 01.02.13 Beschluss des Bundesrates Dreizehnte Verordnung zur Änderung der Arzneimittelverschreibungsverordnung Der Bundesrat hat in seiner 906. Sitzung am 1. Februar
Bundesrat Drucksache 768/12 (Beschluss) 01.02.13 Beschluss des Bundesrates Dreizehnte Verordnung zur Änderung der Arzneimittelverschreibungsverordnung Der Bundesrat hat in seiner 906. Sitzung am 1. Februar
Vorschlag für einen DURCHFÜHRUNGSBESCHLUSS DES RATES
 EUROPÄISCHE KOMMISSION Brüssel, den 13.7.2016 COM(2016) 459 final 2016/0219 (NLE) Vorschlag für einen DURCHFÜHRUNGSBESCHLUSS DES RATES zur Änderung des Durchführungsbeschlusses 2014/170/EU zwecks Streichung
EUROPÄISCHE KOMMISSION Brüssel, den 13.7.2016 COM(2016) 459 final 2016/0219 (NLE) Vorschlag für einen DURCHFÜHRUNGSBESCHLUSS DES RATES zur Änderung des Durchführungsbeschlusses 2014/170/EU zwecks Streichung
(Text von Bedeutung für den EWR)
 25.11.2015 L 307/11 VERORDNUNG (EU) 2015/2173 R KOMMISSION vom 24. November 2015 zur Änderung der Verordnung (EG) Nr. 1126/2008 zur Übernahme bestimmter internationaler Rechnungslegungsstandards gemäß
25.11.2015 L 307/11 VERORDNUNG (EU) 2015/2173 R KOMMISSION vom 24. November 2015 zur Änderung der Verordnung (EG) Nr. 1126/2008 zur Übernahme bestimmter internationaler Rechnungslegungsstandards gemäß
Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen:
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 06.11.2014 Veronika Iro REGA +43 (0) 505 55 36247 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 06.11.2014 Veronika Iro REGA +43 (0) 505 55 36247 pv-implementation@ages.at
Unterrichtung. Deutscher Bundestag 13. Wahlperiode. Drucksache 13/44. durch das Europäische Parlament
 Deutscher Bundestag 13. Wahlperiode Drucksache 13/44 24.11.94 Unterrichtung durch das Europäische Parlament Entschließung zur Finanzierung der Gemeinsamen Außenund Sicherheitspolitik (GASP) DAS EUROPÄISCHE
Deutscher Bundestag 13. Wahlperiode Drucksache 13/44 24.11.94 Unterrichtung durch das Europäische Parlament Entschließung zur Finanzierung der Gemeinsamen Außenund Sicherheitspolitik (GASP) DAS EUROPÄISCHE
Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen bzw. die Aussetzung der Genehmigungen für das Inverkehrbringen
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen bzw. die Aussetzung der Genehmigungen für das Inverkehrbringen
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Apixaban wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Bericht der Zentralen Verbindungsstelle gem. 3 Abs. 2 EG-Verbraucherschutzdurchsetzungsgesetz
 Bericht der Zentralen Verbindungsstelle gem. 3 Abs. 2 EG-Verbraucherschutzdurchsetzungsgesetz (VSchDG) Bericht für das Jahr 2007 Dienstsitz Berlin Mauerstr. 39 42 07 Berlin Tel.: 030 / 8444-00-0 Fax: 030
Bericht der Zentralen Verbindungsstelle gem. 3 Abs. 2 EG-Verbraucherschutzdurchsetzungsgesetz (VSchDG) Bericht für das Jahr 2007 Dienstsitz Berlin Mauerstr. 39 42 07 Berlin Tel.: 030 / 8444-00-0 Fax: 030
Anhang IV. Wissenschaftliche Schlussfolgerungen
 Anhang IV Wissenschaftliche Schlussfolgerungen 54 Wissenschaftliche Schlussfolgerungen 1. - Empfehlung des PRAC Hintergrundinformationen Ivabradin ist ein herzfrequenzsenkender Wirkstoff mit spezieller
Anhang IV Wissenschaftliche Schlussfolgerungen 54 Wissenschaftliche Schlussfolgerungen 1. - Empfehlung des PRAC Hintergrundinformationen Ivabradin ist ein herzfrequenzsenkender Wirkstoff mit spezieller
Innovativ. Natürlich. Weiblich.
 Innovativ. Natürlich. Weiblich. Moderne Verhütungsoptionen im Überblick Presseinformation 10. Mai 2012 Mit freundlicher Unterstützung von Die in diesem Text verwendeten Personen- und Berufsbezeichnungen
Innovativ. Natürlich. Weiblich. Moderne Verhütungsoptionen im Überblick Presseinformation 10. Mai 2012 Mit freundlicher Unterstützung von Die in diesem Text verwendeten Personen- und Berufsbezeichnungen
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Injektionslösung Wirkstoff: Gonadorelin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen.
Gebrauchsinformation: Information für Anwender Injektionslösung Wirkstoff: Gonadorelin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen.
Pflanzenschutzmittel Fakten statt Hysterie Gefahr, Risiko oder Sicherheit
 Pflanzenschutzmittel Fakten statt Hysterie Gefahr, Risiko oder Sicherheit Dr. Albert Bergmann Institut für Pflanzenschutzmittel Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH Zusammenfassung
Pflanzenschutzmittel Fakten statt Hysterie Gefahr, Risiko oder Sicherheit Dr. Albert Bergmann Institut für Pflanzenschutzmittel Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH Zusammenfassung
Tierseuchenrechtliche Bedingungen für den Handel mit Hunden, Katzen und Frettchen ***I
 P7_TA-PROV(2013)0221 Tierseuchenrechtliche Bedingungen für den Handel mit Hunden, Katzen und Frettchen ***I Legislative Entschließung des Europäischen Parlaments vom 23. Mai 2013 zu dem Vorschlag für eine
P7_TA-PROV(2013)0221 Tierseuchenrechtliche Bedingungen für den Handel mit Hunden, Katzen und Frettchen ***I Legislative Entschließung des Europäischen Parlaments vom 23. Mai 2013 zu dem Vorschlag für eine
Epilepsie erfolgreich kontrollieren
 Epilepsie pass Epilepsie erfolgreich kontrollieren Mit Epilepsie-Tagebuch Das Epilepsie-Tagebuch von Hund Name Geburtsdatum Rasse Gewicht Erster epileptischer Anfall am (Tag/Monat/Jahr) im Alter von Besitzer
Epilepsie pass Epilepsie erfolgreich kontrollieren Mit Epilepsie-Tagebuch Das Epilepsie-Tagebuch von Hund Name Geburtsdatum Rasse Gewicht Erster epileptischer Anfall am (Tag/Monat/Jahr) im Alter von Besitzer
Anhang III. Ergänzungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Ergänzungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage 20 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS [Der unten genannte Wortlaut
Anhang III Ergänzungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage 20 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS [Der unten genannte Wortlaut
Bericht zum Dienstleistungs- und Zweigniederlassungsverkehr 2011
 Bericht zum Dienstleistungs- und Zweigniederlassungsverkehr 2011 1/18 I. Dienstleistungs- und Zweigniederlassungsverkehr Der seit Anfang Juli 1994 bestehende europäische Versicherungsbinnenmarkt, welcher
Bericht zum Dienstleistungs- und Zweigniederlassungsverkehr 2011 1/18 I. Dienstleistungs- und Zweigniederlassungsverkehr Der seit Anfang Juli 1994 bestehende europäische Versicherungsbinnenmarkt, welcher
VALDOXAN (Agomelatin)
 Die EU-Gesundheidsbehörden verknüpfen die Zulassung von Valdoxan 25 mg mit bestimmten Bedingungen. Der verbindliche Risikominimierungsplan in Belgien, von dem diese Informationen ein Teil ist, ist eine
Die EU-Gesundheidsbehörden verknüpfen die Zulassung von Valdoxan 25 mg mit bestimmten Bedingungen. Der verbindliche Risikominimierungsplan in Belgien, von dem diese Informationen ein Teil ist, ist eine
Dieses Dokument ist lediglich eine Dokumentationsquelle, für deren Richtigkeit die Organe der Gemeinschaften keine Gewähr übernehmen
 2009R0041 DE 10.02.2009 000.001 1 Dieses Dokument ist lediglich eine Dokumentationsquelle, für deren Richtigkeit die Organe der Gemeinschaften keine Gewähr übernehmen B VERORDNUNG (EG) Nr. 41/2009 DER
2009R0041 DE 10.02.2009 000.001 1 Dieses Dokument ist lediglich eine Dokumentationsquelle, für deren Richtigkeit die Organe der Gemeinschaften keine Gewähr übernehmen B VERORDNUNG (EG) Nr. 41/2009 DER
Name. 0,5 mg - Tabletten. 1mg - Tabletten. 2 mg - Tabletten. 3 mg - Tabletten. 4 mg - Tabletten. Risperidon Risperdal 0,5 mg - Filmtablettenn
 ANHANG I VERZEICHNIS DER BEZEICHNUNGEN, DARREICHUNGSFORMEN, STÄRKEN, ARTEN DER ANWENDUNG DER ARZNEIMITTEL, DER ANTRAGSTELLER, DER INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN IN DEN MITGLIEDSTAATEN
ANHANG I VERZEICHNIS DER BEZEICHNUNGEN, DARREICHUNGSFORMEN, STÄRKEN, ARTEN DER ANWENDUNG DER ARZNEIMITTEL, DER ANTRAGSTELLER, DER INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN IN DEN MITGLIEDSTAATEN
WIRT/238 STRUKTURELLE UNTERNEHMENS- STATISTIK. Brüssel, den 28. Januar 1998
 WIRT/238 STRUKTURELLE UNTERNEHMENS- STATISTIK Brüssel, den 28. Januar 1998 STELLUNGNAHME des Wirtschafts- und Sozialausschusses zu dem "Vorschlag für eine Verordnung (EG, Euratom) des Rates zur Änderung
WIRT/238 STRUKTURELLE UNTERNEHMENS- STATISTIK Brüssel, den 28. Januar 1998 STELLUNGNAHME des Wirtschafts- und Sozialausschusses zu dem "Vorschlag für eine Verordnung (EG, Euratom) des Rates zur Änderung
Ödeme, Hypertonie und Herzinsuffizienz wurden im Zusammenhang mit NSAID - Behandlung berichtet.
 Alle rezeptpflichtigen nicht-selektiven NSAIDs zur systemischen Anwendung Für alle Präparate ohne fixes Dosierungsschema: 4.2. Dosierung, Art und Dauer der Anwendung 4.3. Gegenanzeigen Schwere Herzinsuffizienz
Alle rezeptpflichtigen nicht-selektiven NSAIDs zur systemischen Anwendung Für alle Präparate ohne fixes Dosierungsschema: 4.2. Dosierung, Art und Dauer der Anwendung 4.3. Gegenanzeigen Schwere Herzinsuffizienz
Antrag auf Entlassung aus der Verschreibungspflicht. -Doramectin-
 Antrag auf Entlassung aus der Verschreibungspflicht Antrag auf Entlassung von Doramectin aus der Verschreibungspflicht für die topische Anwendung bei Königspython, Abgottschlange und Bartagame bei einem
Antrag auf Entlassung aus der Verschreibungspflicht Antrag auf Entlassung von Doramectin aus der Verschreibungspflicht für die topische Anwendung bei Königspython, Abgottschlange und Bartagame bei einem
Gebrauchsinformation: Information für Anwender Desloratadin Sandoz 5 mg Filmtabletten Desloratadin
 Gebrauchsinformation: Information für Anwender Desloratadin Sandoz 5 mg Filmtabletten Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
Gebrauchsinformation: Information für Anwender Desloratadin Sandoz 5 mg Filmtabletten Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
Mitteilung des Bundesamts für Sicherheit im Gesundheitswesen über Maßnahmen zur Gewährleistung der Arzneimittelsicherheit:
 Landeshauptleute Landessanitätsdirektionen Österreichische Apothekerkammer Österreichische Ärztekammer Landesärztekammern Anstaltsapotheken d. Universitätskliniken Datum: 16.11.2015 Kontakt: Mag. Rudolf
Landeshauptleute Landessanitätsdirektionen Österreichische Apothekerkammer Österreichische Ärztekammer Landesärztekammern Anstaltsapotheken d. Universitätskliniken Datum: 16.11.2015 Kontakt: Mag. Rudolf
Anhang III. Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage
 Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
002067/EU XXV. GP. Eingelangt am 15/11/13 RAT DER EUROPÄISCHEN UNION. Brüssel, den 14. November 2013 (OR. en) 16180/13 DENLEG 128 SAN 447 AGRI 742
 002067/EU XXV. GP Eingelangt am 15/11/13 RAT DER EUROPÄISCHEN UNION Brüssel, den 14. November 2013 (OR. en) 16180/13 DENLEG 128 SAN 447 AGRI 742 ÜBERMITTLUNGSVERMERK Absender: Europäische Kommission Eingangsdatum:
002067/EU XXV. GP Eingelangt am 15/11/13 RAT DER EUROPÄISCHEN UNION Brüssel, den 14. November 2013 (OR. en) 16180/13 DENLEG 128 SAN 447 AGRI 742 ÜBERMITTLUNGSVERMERK Absender: Europäische Kommission Eingangsdatum:
ANHANG III FINANZ- UND VERTRAGSBEDINGUNGEN. Leitaktion 1 Schulbildung
 ANHANG III FINANZ- UND VERTRAGSBEDINGUNGEN Leitaktion 1 Schulbildung I. EINLEITUNG Dieser Anhang ergänzt die Regeln für die Verwendung des Zuschusses unter den verschiedenen Budgetkategorien für das im
ANHANG III FINANZ- UND VERTRAGSBEDINGUNGEN Leitaktion 1 Schulbildung I. EINLEITUNG Dieser Anhang ergänzt die Regeln für die Verwendung des Zuschusses unter den verschiedenen Budgetkategorien für das im
(Text von Bedeutung für den EWR)
 29.9.2015 DE L 252/27 DURCHFÜHRUNGSVERORDNUNG (EU) 2015/1730 DER KOMMISSION vom 28. September 2015 zur von Wasserstoffperoxid als alter Wirkstoff zur Verwendung in Biozidprodukten der en 1, 2, 3, 4, 5
29.9.2015 DE L 252/27 DURCHFÜHRUNGSVERORDNUNG (EU) 2015/1730 DER KOMMISSION vom 28. September 2015 zur von Wasserstoffperoxid als alter Wirkstoff zur Verwendung in Biozidprodukten der en 1, 2, 3, 4, 5
Diagnostik und Therapie von Blutungsstörungen
 Diagnostik und Therapie von Blutungsstörungen S. Buchholz Klinik für Frauenheilkunde und Geburtshilfe der Universität Regensburg am Caritas-Krankenhaus St. Josef Direktor: Prof. Dr. Ortmann Gynäkologisches
Diagnostik und Therapie von Blutungsstörungen S. Buchholz Klinik für Frauenheilkunde und Geburtshilfe der Universität Regensburg am Caritas-Krankenhaus St. Josef Direktor: Prof. Dr. Ortmann Gynäkologisches
5 Selbstkonstruktion und interpersonale Distanz empirische Prüfung
 Selbstkonstruktion und interpersonale Distanz U.R. Roeder - 66-5 Selbstkonstruktion und interpersonale Distanz empirische Prüfung 5.1 Die Hypothesen Im Rahmen dieser Arbeit können nur wenige der im theoretischen
Selbstkonstruktion und interpersonale Distanz U.R. Roeder - 66-5 Selbstkonstruktion und interpersonale Distanz empirische Prüfung 5.1 Die Hypothesen Im Rahmen dieser Arbeit können nur wenige der im theoretischen
2. Anzahl der Patienten bzw. Abgrenzung der für die Behandlung infrage kommenden Patientengruppen
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Mesalazin bei Colitis ulcerosa Sind alle therapeutischen Möglichkeiten ausgereizt?
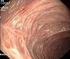 Mesalazin bei Colitis ulcerosa Sind alle therapeutischen Möglichkeiten ausgereizt? Von Prof. Dr. med. Stefan Schreiber Berlin (3. Oktober 2008) - Seit 1940 erstmals Sulfasalazine zur Therapie der entzündlichen
Mesalazin bei Colitis ulcerosa Sind alle therapeutischen Möglichkeiten ausgereizt? Von Prof. Dr. med. Stefan Schreiber Berlin (3. Oktober 2008) - Seit 1940 erstmals Sulfasalazine zur Therapie der entzündlichen
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Norlevo 1,5 mg Tabletten Levonorgestrel
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Norlevo 1,5 mg Tabletten Levonorgestrel Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Norlevo 1,5 mg Tabletten Levonorgestrel Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses
Der Bundesrat hat ferner die aus der Anlage ersichtliche Entschließung gefasst.
 Bundesrat Drucksache 169/14 (Beschluss) 23.05.14 Beschluss des Bundesrates Verordnung zur Umsetzung der Regelungen der Europäischen Union über die Anerkennung von in anderen Mitgliedstaaten ausgestellten
Bundesrat Drucksache 169/14 (Beschluss) 23.05.14 Beschluss des Bundesrates Verordnung zur Umsetzung der Regelungen der Europäischen Union über die Anerkennung von in anderen Mitgliedstaaten ausgestellten
Formulierung des Bestätigungsvermerks gemäß 274 UGB des Abschluss/Bankprüfers zum Rechenschaftsbericht
 Richtlinie des Instituts Österreichischer Wirtschaftsprüfer zur Formulierung des Bestätigungsvermerks gemäß 274 UGB des Abschluss/Bankprüfers zum Rechenschaftsbericht einer Verwaltungsgesellschaft (Kapitalanlagegesellschaft
Richtlinie des Instituts Österreichischer Wirtschaftsprüfer zur Formulierung des Bestätigungsvermerks gemäß 274 UGB des Abschluss/Bankprüfers zum Rechenschaftsbericht einer Verwaltungsgesellschaft (Kapitalanlagegesellschaft
IMPLANON NXT Erläuternde Broschüre für Patientinnen
 Die Markteinführung von IMPLANON NXT wurde von den belgischen Gesundheitsbehörden an bestimmte Bedingungen geknüpft. Der vorgeschriebene Plan zur Risikominimierung in Belgien, der auch das vorliegende
Die Markteinführung von IMPLANON NXT wurde von den belgischen Gesundheitsbehörden an bestimmte Bedingungen geknüpft. Der vorgeschriebene Plan zur Risikominimierung in Belgien, der auch das vorliegende
Tapentadol weiterhin keine nachhaltige therapeutische Verbesserung belegt
 AG AMV Arbeitsgruppe Arzneimittelvereinbarung Gemeinsame Information der KVWL und der Verbände der Krankenkassen in Westfalen-Lippe Datum: Oktober 2014 Tapentadol weiterhin keine nachhaltige therapeutische
AG AMV Arbeitsgruppe Arzneimittelvereinbarung Gemeinsame Information der KVWL und der Verbände der Krankenkassen in Westfalen-Lippe Datum: Oktober 2014 Tapentadol weiterhin keine nachhaltige therapeutische
4.3 Zusatzstoffe und Gentechnik
 4.3 Zusatzstoffe und Gentechnik 4.3.1 Einleitung In der Öffentlichkeit wird immer wieder behauptet, dass Gentechnik bei Zusatzstoffen eine Rolle spielt. Tatsächlich können verschiedene der in der EU und
4.3 Zusatzstoffe und Gentechnik 4.3.1 Einleitung In der Öffentlichkeit wird immer wieder behauptet, dass Gentechnik bei Zusatzstoffen eine Rolle spielt. Tatsächlich können verschiedene der in der EU und
WICHTIG - MITTEILUNG AN DEN KUNDEN FLOWONIX MEDICAL, PROMETRA PROGRAMMIERBARE PUMPE AUFHEBUNG DER CE-KENNZEICHNUNG
 WICHTIG - MITTEILUNG AN DEN KUNDEN FLOWONIX MEDICAL, PROMETRA PROGRAMMIERBARE PUMPE AUFHEBUNG DER CE-KENNZEICHNUNG 558455 Art der Maßnahme: Kundenmitteilung bezüglich der Aufhebung der CE-Kennzeichnung
WICHTIG - MITTEILUNG AN DEN KUNDEN FLOWONIX MEDICAL, PROMETRA PROGRAMMIERBARE PUMPE AUFHEBUNG DER CE-KENNZEICHNUNG 558455 Art der Maßnahme: Kundenmitteilung bezüglich der Aufhebung der CE-Kennzeichnung
Frauen in klinischen Prüfungen Arbeitsgemeinschaft für angewandte Humanpharmakologie (AGAH) e.v
 Arbeitsgemeinschaft für angewandte Humanpharmakologie (AGAH) e.v Historie Regelungen FDA Internationale und deutsche Regelungen Umsetzung der Regeln Frauen im gebärfähigen Alter als Studienteilnehmerinnen
Arbeitsgemeinschaft für angewandte Humanpharmakologie (AGAH) e.v Historie Regelungen FDA Internationale und deutsche Regelungen Umsetzung der Regeln Frauen im gebärfähigen Alter als Studienteilnehmerinnen
Zur Statistik im neuen Genehmigungsantrag
 Zur Statistik im neuen Genehmigungsantrag 21. Essener Informationstreffen, 12. März 2014 PD Dr. Nicole Heussen nheussen@ukaachen.de Institut für Medizinische Statistik RWTH Aachen Zur Statistik im neuen
Zur Statistik im neuen Genehmigungsantrag 21. Essener Informationstreffen, 12. März 2014 PD Dr. Nicole Heussen nheussen@ukaachen.de Institut für Medizinische Statistik RWTH Aachen Zur Statistik im neuen
Methodenbeschreibung zur Auswahl der Gefragten Berufe Inhalt
 Methodenbeschreibung zur Auswahl der Gefragten Berufe Inhalt 1. Ausgangslage... 2 2. Statistiken und Kennzahlen... 2 3. Identifikation der Gefragten Berufe... 3 4. Interpretation der Gefragten Berufe...
Methodenbeschreibung zur Auswahl der Gefragten Berufe Inhalt 1. Ausgangslage... 2 2. Statistiken und Kennzahlen... 2 3. Identifikation der Gefragten Berufe... 3 4. Interpretation der Gefragten Berufe...
Cefavora - Tropfen. Gebrauchsinformation: Information für Anwender
 1 von 5 Cefavora - Tropfen Gebrauchsinformation: Information für Anwender Wirkstoffe: Ginkgo biloba Ø / Viscum album Ø / Crataegus Ø Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor sie mit
1 von 5 Cefavora - Tropfen Gebrauchsinformation: Information für Anwender Wirkstoffe: Ginkgo biloba Ø / Viscum album Ø / Crataegus Ø Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor sie mit
Zusatznutzen oraler Kontrazeptiva neben der reinen Verhütung
 Zusatznutzen oraler Kontrazeptiva neben der reinen Verhütung Thomas Hess Departement für Geburtshilfe & Gynäkologie Kantonsspital Winterthur Freitag, 11. 11. 2011 Nutzen der COC % Risikoreduktion: kontrazeptiv
Zusatznutzen oraler Kontrazeptiva neben der reinen Verhütung Thomas Hess Departement für Geburtshilfe & Gynäkologie Kantonsspital Winterthur Freitag, 11. 11. 2011 Nutzen der COC % Risikoreduktion: kontrazeptiv
Vom 19. Februar 2009. I. Die Anlage 4 wird um den folgenden Therapiehinweis ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über die Einleitung eines Stellungnahmeverfahrens zur Änderung der Arzneimittel-Richtlinie in Anlage 4: Therapiehinweis zu Ezetimib Vom 19. Februar 2009 Der
Beschluss des Gemeinsamen Bundesausschusses über die Einleitung eines Stellungnahmeverfahrens zur Änderung der Arzneimittel-Richtlinie in Anlage 4: Therapiehinweis zu Ezetimib Vom 19. Februar 2009 Der
Dopaminerge Substanzen und Impulskontrollstörungen
 - 2 - Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Pharmazeutische Unternehmer (s. Anlage) Nachrichtlich: Stufenplanbeteiligte Postanschrift: Kurt-Georg-Kiesinger-Allee
- 2 - Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Pharmazeutische Unternehmer (s. Anlage) Nachrichtlich: Stufenplanbeteiligte Postanschrift: Kurt-Georg-Kiesinger-Allee
ÄNDERUNGSANTRÄGE 28-38
 EUROPÄISCHES PARLAMENT 2009-2014 Ausschuss für Wirtschaft und Währung 12.1.2012 2011/0204(COD) ÄNRUNGSANTRÄGE 28-38 Entwurf einer Stellungnahme Elena Băsescu (PE475.906v01-00) Europäischer Beschluss zur
EUROPÄISCHES PARLAMENT 2009-2014 Ausschuss für Wirtschaft und Währung 12.1.2012 2011/0204(COD) ÄNRUNGSANTRÄGE 28-38 Entwurf einer Stellungnahme Elena Băsescu (PE475.906v01-00) Europäischer Beschluss zur
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. ALLEGRATAB 120 mg Filmtabletten Fexofenadinhydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER ALLEGRATAB 120 mg Filmtabletten Fexofenadinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER ALLEGRATAB 120 mg Filmtabletten Fexofenadinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen
Erwerbstätigenquoten nach Anzahl der Kinder*
 Erwerbstätigenquoten nach Anzahl der Kinder* In Prozent, nach Frauen und Männern zwischen 25 bis 54 Jahren, Europäische Union **, 2009 Frauen 75,8 71,3 69,2 3 oder mehr 54,7 * Kinder sind all diejenigen
Erwerbstätigenquoten nach Anzahl der Kinder* In Prozent, nach Frauen und Männern zwischen 25 bis 54 Jahren, Europäische Union **, 2009 Frauen 75,8 71,3 69,2 3 oder mehr 54,7 * Kinder sind all diejenigen
PRESSEMITTEILUNG ERNEUTER RÜCKGANG DER ANZAHL MONETÄRER FINANZINSTITUTE IM EURO-WÄHRUNGSGEBIET UND IN DER EU IM JAHR
 2. Januar 203 PRESSEMITTEILUNG ERNEUTER RÜCKGANG DER ANZAHL MONETÄRER FINANZINSTITUTE IM EURO-WÄHRUNGSGEBIET UND IN DER EU IM JAHR 202 Am. Januar 203 belief sich die Anzahl der im Euro-Währungsgebiet ansässigen
2. Januar 203 PRESSEMITTEILUNG ERNEUTER RÜCKGANG DER ANZAHL MONETÄRER FINANZINSTITUTE IM EURO-WÄHRUNGSGEBIET UND IN DER EU IM JAHR 202 Am. Januar 203 belief sich die Anzahl der im Euro-Währungsgebiet ansässigen
Frauen in politischen Spitzenpositionen der EU-Staaten sowie im EU-Bereich
 Prof. Dr. Werner Zögernitz Wien, am 03.03.2014 Frauen in politischen Spitzenpositionen der EU-Staaten sowie im EU-Bereich Im Jahr 2013 hat sich die Europäische Union durch den Beitritt Kroatiens zahlenmäßig
Prof. Dr. Werner Zögernitz Wien, am 03.03.2014 Frauen in politischen Spitzenpositionen der EU-Staaten sowie im EU-Bereich Im Jahr 2013 hat sich die Europäische Union durch den Beitritt Kroatiens zahlenmäßig
Dieses Dokument ist lediglich eine Dokumentationshilfe, für deren Richtigkeit die Organe der Union keine Gewähr übernehmen
 1993R3199 DE 01.07.2013 009.001 1 Dieses Dokument ist lediglich eine Dokumentationshilfe, für deren Richtigkeit die Organe der Union keine Gewähr übernehmen B VERORDNUNG (EG) Nr. 3199/93 DER KOMMISSION
1993R3199 DE 01.07.2013 009.001 1 Dieses Dokument ist lediglich eine Dokumentationshilfe, für deren Richtigkeit die Organe der Union keine Gewähr übernehmen B VERORDNUNG (EG) Nr. 3199/93 DER KOMMISSION
1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE VERANTWORTLICH IST
 GEBRAUCHSINFORMATION Zylexis Lyophilisat und Lösungsmittel zur Herstellung einer Suspension zur Injektion für Hunde, Katzen, Pferde, Rinder und Schweine 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND,
GEBRAUCHSINFORMATION Zylexis Lyophilisat und Lösungsmittel zur Herstellung einer Suspension zur Injektion für Hunde, Katzen, Pferde, Rinder und Schweine 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND,
Vorschlag für einen BESCHLUSS DES EUROPÄISCHEN PARLAMENTS UND DES RATES
 EUROPÄISCHE KOMMISSION Straßburg, den 20.11.2012 COM(2012) 697 final 2012/0328 (COD) Vorschlag für einen BESCHLUSS DES EUROPÄISCHEN PARLAMENTS UND DES RATES über die vorübergehende Abweichung von der Richtlinie
EUROPÄISCHE KOMMISSION Straßburg, den 20.11.2012 COM(2012) 697 final 2012/0328 (COD) Vorschlag für einen BESCHLUSS DES EUROPÄISCHEN PARLAMENTS UND DES RATES über die vorübergehende Abweichung von der Richtlinie
Informationen zur Ausnahmebewilligung für verbotene Betäubungsmittel des Bundesamtes für Gesundheit (BAG)
 Informationen zur Ausnahmebewilligung für verbotene Betäubungsmittel des Bundesamtes für Gesundheit (BAG) 1. Zweck dieses Merkblatts Dieses Merkblatt gibt eine Übersicht darüber, welche Tätigkeiten im
Informationen zur Ausnahmebewilligung für verbotene Betäubungsmittel des Bundesamtes für Gesundheit (BAG) 1. Zweck dieses Merkblatts Dieses Merkblatt gibt eine Übersicht darüber, welche Tätigkeiten im
Erläuterungen zu Leitlinien für die Bewertung der Gleichwertigkeit durch nationale Aufsichtsbehörden gemäß Solvabilität II
 Erläuterungen zu Leitlinien für die Bewertung der Gleichwertigkeit durch nationale Aufsichtsbehörden gemäß Solvabilität II Die nachfolgenden Ausführungen in deutscher Sprache sollen die EIOPA- Leitlinien
Erläuterungen zu Leitlinien für die Bewertung der Gleichwertigkeit durch nationale Aufsichtsbehörden gemäß Solvabilität II Die nachfolgenden Ausführungen in deutscher Sprache sollen die EIOPA- Leitlinien
FEDERATION EUROPEENNE DE LA MANUTENTION Produktgruppe. Flurförderzeuge. Kurze Anleitung zum Erkennen nicht konformer Flurförderzeuge
 FEDERATION EUROPEENNE DE LA MANUTENTION Produktgruppe Flurförderzeuge FEM Kurze Anleitung zum Erkennen nicht konformer Flurförderzeuge 05.2012 (DE) - Abgasemission - I n d e x 1 Einleitung... 2 2 Umfang...
FEDERATION EUROPEENNE DE LA MANUTENTION Produktgruppe Flurförderzeuge FEM Kurze Anleitung zum Erkennen nicht konformer Flurförderzeuge 05.2012 (DE) - Abgasemission - I n d e x 1 Einleitung... 2 2 Umfang...
