2.7 Gibt es Behandlungsfortschritte bei häufigen metastasierten Krebserkrankungen
|
|
|
- Vincent Weiß
- vor 5 Jahren
- Abrufe
Transkript
1 Gibt es Behandlungsfortschritte bei häufigen metastasierten Krebserkrankungen in den letzten n? Regelmäßig wird über erfolgreiche Studien mit innovativen Chemo- oder Hormontherapien, mit neuen operativen oder strahlentherapeutischen Behandlungen von metastasierten Patienten berichtet. Dies sind Positivmeldungen, die Hoffnungen bei Bürgern, Patienten, Angehörigen und überweisenden Ärzten wecken. Ein aktuelles, als Kongreß-Abstract gern zitiertes Negativbeispiel bietet Cancer 4; :44. Auch die Einschränkung, daß die Onkologie mit jeder Studie leider nur kleine Fortschritte macht, impliziert Additivität, die dann über größere Zeiträume zu bemerkenswerten Verbesserungen führen sollte. Solche Aussagen sind eine Herausforderung für Krebsregister, diese positiven Entwicklungen aufzudecken und zu belegen. Das TRM erfaßt von Anfang an auch Progressionen und zwar differenziert nach lokalen bzw. regionären Rezidiven, nach Metastasierungen sowie Progressionen bei Systemerkrankungen. Die Erfassung der Metastasierungen und Progressionen ist nicht vollständig. Defizite sind auf die internistische Onkologie und den ambulanten Sektor zurückzuführen, die beiden bisher schwächsten Kooperationspartner im TRM. Die Defizite variieren tumorspezifisch. Bei soliden Tumoren sind z.t. über 65 der Progressionen nach einem tumorfreien Intervall verfügbar. Zudem werden bei operativen Eingriffen im Krankheitsverlauf Daten auch aus der Pathologie übermittelt. Es gibt natürlich Optimierungschancen. Deshalb ist auch hier an die Meldebereitschaft zu appellieren. Die Meldung einer Progression an das TRM ist einfach und schnell machbar! Das Ende des tumorfreien Intervalls kann formlos oder auf dem Folgeerhebungsbogen des TRM mit Minimalangaben dokumentiert werden. Die Identifikation des Patienten, Primärtumor und Jahr der Erstdiagnose sowie Monat, Jahr und Art der Progression reichen aus, zusammen ein Aufwand von weniger als Sekunden! Zum einen werden damit die wichtigen Qualitätsindikatoren erfaßt, die die Primärtherapeuten für die Bewertung ihrer Maßnahmen brauchen. Zum anderen ist so eine Klassifikation progredienter Verläufe möglich, die nicht systematisch den Todesbescheinigungen zu entnehmen ist. Wie sind diese Progressionsdaten im Hinblick auf eine Verbesserung in der Palliativsituation auszuwerten? Das TRM ist eine Sammlung von Beobachtungsstudien. Alle mitwirkenden Ärzte und Kliniken bringen durch ihre Dokumentation ihre eigene Behandlungskohorte ein, auf die nur zugreifen kann, wer zur Dokumentation beigetragen hat. Aus all diesen "Klinikregistern" lassen sich zahlreiche, auf der Hand liegende Kohorten definieren, z.b. nach dem Jahrgang der Behandlung, nach Behandlungsmodalitäten oder nach den Behandelnden. Krebstodesursache Männer Frauen in n n Lunge Darm Brust Prostata Summe alle Krebserkrankungen Tab. 19: Anteil der vier häufigsten krebsbedingten Todesursachen an allen krebsbedingten Todesursachen, getrennt nach Geschlecht für Deutschland im Jahr
2 56 Für die Frage nach dem Outcome bei progredienten Patienten wurden die Tumoren der Lunge, des Darms, der Brust und der Prostata ausgewertet, die bei beiden Geschlechtern jeweils die drei häufigsten krebsbedingten Todesursachen darstellen (Tab. 19). Zusammen sind in Deutschland auf diese Erkrankungen,9 der krebsbedingten Sterbefälle bei den Männern und 42,7 bei den Frauen im Jahr zurückzuführen. Für das Überleben nach Metastasierung aufgrund dieser vier Erkrankungen wird anhand der Daten des TRM die von 1978 bis 1989 mit der von 19 bis 1999 verglichen. Damit ist im Minimum ein Follow-up von 4 n nach Diagnose des Primärtumors gegeben. Es ist natürlich problematisch, Kohorten aus so verschiedenen n zu vergleichen, weil sich u.a. das Erkrankungsbild wie beim Prostatakarzinom verändert haben kann. Trotz der Untererfassung der Progressionen kann aber davon ausgegangen werden, daß die aus vielen Kliniken bereitgestellten Meldungen über die Zeit vergleichbare Kohorten progredienter Patienten ergeben haben. Zuerst wird das Überleben ab Metastasierung betrachtet, und zwar in Abhängigkeit vom wichtigen Prognosefaktor tumorfreie Zeit. Die tumorfreie Zeit wurde gruppiert nach einem metastasierten Primärbefund, also einer tumorfreien Zeit von und tumorspezifisch drei unterschiedlich langen tumorfreien Intervallen für Prostata und Mamma bzw. Darm und Lunge. Diese unterschiedlichen Einteilungen sind erforderlich, weil die Verteilungen der tumorfreien Zeit bei den betrachteten Tumoren stark variieren. Nach Tab. (S32) betragen die medianen Überlebenszeiten für progrediente Patienten bei kolorektalen Karzinomen 11/14 Monate, beim Prostatakarzinom 21, beim Mammakarzinom 22 und beim Lungenkarzinom 5 Monate. Die Ergebnisse für die vier Diagnosen zeigen (Abb. ), daß das tumorfreie Intervall ein wichtiger Prognosefaktor ist. Es ist eine Proxy-Variable für das Tumorwachstum. Andererseits hat das Tumorwachstum keinen so dramatischen Einfluß. Denn eine Brustkrebspatientin mit M1-Befund (23,6) hat eine vergleichbare Prognose wie die 26,8 Patientinnen mit einem tumorfreien Intervall von vier und mehr n. Der Lead-time-Effekt, die Vorverlegung des Zeitpunktes des Metastasennachweises durch die in Deutschland übliche systematische Metastasendiagnostik im Rahmen der Primärtherapie, ist offensichtlich größer als der Einfluß des Tumorwachstums. Aus Abb. ist zum Mammakarzinom abzulesen, daß das Survival nach einem M1-Befund oder einem tumorfreien Intervall von mehr als 48 Monaten vergleichbar ist und im Median 25 bzw. 28 Monate beträgt. Ein tumorfreies Intervall von weniger als 2 n ist dagegen mit einem medianen Überleben von 16 Monaten verbunden. Bei allen vier Diagnosen sind zusätzlich die 5-s-Überlebensraten für M1-Patienten aus den zum Vergleich eingetragen. Das Überleben nach Metastasierung wurde für alle seit 1978 diagnostizierten Patienten zusammengefaßt, weil bei keiner Diagnose ein Trend zu Verbesserung erkennbar war. Multivariat kommt man zur Absicherung dieser Aussage, wenn im Modellansatz (Cox- Modell) die als eigene Variable berücksichtigt wird. Im TRM wird nicht detailliert die Art der Palliativtherapie erfaßt. Unterschiedlichste Ansätze und Protokolle dürften entsprechend dem wissenschaftlichen Fortschritt zur Anwendung gekommen sein. In den regelmäßig erscheinenden Manualen des Tumorzentrums München werden gesichert wirksam erscheinende Innovationen empfohlen. Wenn in einem multivariaten Modell zusätzlich der Zeitraum der Diagnose berücksichtigt wird, würden Verbesserungen des Überlebens progredienter Patienten, die nach Adjustierung für bekannte Prognosefaktoren nicht erklärt werden können, als Effekt des Zeitraumes erkennbar. Der Zeitraum kann dann als Proxy-Variable für die Verbesserung der Palliativtherapien über die Zeit gewertet werden. Beim Mamma- und Prostatakarzinom ergab sich nach Adjustierung bezüglich Alter und metastasenfreier Zeit für die diagnostizierten Patienten eine geringe, z.t. durch die begrenzte Beobachtungszeit bedingte Verschlechterung im Vergleich zu bis
3 57 Lunge Kolon/Rektum n= n= < - < 12 Mon. n= < - < 12 Mon. n= < 24 Mon. n= < 24 Mon. n= >= 24 Mon. n= >= 24 Mon. n= Mamma Prostata n= n= < - < 24 Mon. n= < - < 24 Mon. n= < 48 Mon. n= < 48 Mon. n= >= 48 Mon. n= >= 48 Mon. n= Abb. : Überleben ab Metastasierung für die vier häufigsten Krebserkrankungen in Abhängigkeit von der tumorfreien Zeit mit Vergleichen zum Überleben von M1- Patienten aus den der letzten 25 (Cancer 1; 92:2211: Lunge n= , Kolon/Rektum n=51.485, Mamma n=18.365, Prostata n=31.727) 19 diagnostizierten Metastasierungen, bei Darmtumoren eine Verbesserung von 11 und beim Lungenkarzinom unter zusätzlicher Berücksichtigung der Histologie keine Veränderung des Überlebens. In Abb. 21 sind die Vergleiche der n für die vier Diagnosen grafisch aufbereitet. Die bisherigen Analysen bezogen sich auf das Überleben ab Metastasierung. Sie sind nicht ausreichend. Es ist zusätzlich auch die gesamte Überlebenszeit metastasierter Patienten ab Diagnose zu betrachten. Sie setzt sich aus der tumorfreien Zeit und der Überlebenszeit ab Progression zusammen. Ein Fortschritt, den man mit dem Qualitätsindikator Überleben messen kann, könnte sich entweder in einer Verlängerung des Überlebens ab Metastasierung und/oder einer Verlängerung des tumorfreien Intervalls niederschlagen. Neue adjuvante Therapien könnten zu einer stärkeren Reduktion der bereits bei Primärtherapie erfolgten Metastasierungen führen, so daß der Nachweis der Metastasen erst
4 58 Lunge Kolon/Rektum bis 19 n= bis 19 n= n= n= Mamma Prostata bis 19 n=94.8 bis 19 n= n= n= Abb. 21: Überleben ab Metastasierung für die vier häufigsten Krebserkrankungen im Vergleich der n bis 19 und später möglich würde. Daraus müßte eine längere tumorfreie Zeit resultieren. Abb. 22 zeigt für die vier Tumordiagnosen die Überlebenszeit ab Diagnose für metastasierte Patienten und stratifiziert nach der tumorfreien Zeit im Vergleich der beiden n vor und ab 19. Auch für die gesamte Überlebenszeit zeigt sich keine Verbesserung über die letzten. Bei Lungen- und Darmtumoren werden der nicht nachweisbare Effekt bzw. eine geringfügige Verbesserung beschrieben. Beim Prostata- und Mammakarzinom wird ein Artefakt insbesondere für die Untergruppe mit dem längsten tumorfreien Intervall erkennbar. Für diese jeweils diagnostizierten Gruppen kann wegen der kürzeren Beobachtungszeit bei einem metastasenfreien Intervall von 4 n noch keine Metastasierung nach n beobachtet worden sein. Daraus resultiert hinsichtlich des Überlebens ein großer Unterschied zwischen den Gruppen mit kurzer und langer Beobachtungszeit. Dieser Effekt wird auch aus der Verteilung der progredienten Krankheitsverläufe über die 4 Gruppen erkennbar.
5 59 Lunge Kolon/Rektum bis 19 n= bis 19 n= < - <12 Mon. bis 19 n= < - <12 Mon. bis 19 n= <24 Mon. bis 19 n= >=24 Mon. bis 19 n= n= < - <12 Mon. n= <24 Mon. n= >=24 Mon. n= <24 Mon. bis 19 n= >=24 Mon. bis 19 n= n= < - <12 Mon. n= <24 Mon. n= >=24 Mon. n= Mamma Prostata bis 19 n= bis 19 n= < - <24 Mon. bis 19 n= < - <24 Mon. bis 19 n= <48 Mon. bis 19 n= >=48 Mon. bis 19 n= n= < - <24 Mon. n= <48 Mon. n= >=48 Mon. n= <48 Mon. bis 19 n= >=48 Mon. bis 19 n= n=6.1 < - <24 Mon. n= <48 Mon. n= >=48 Mon. n= Abb. 22: Überleben ab Diagnose des Primärtumors für die vier häufigsten Krebserkrankungen in Abhängigkeit von der tumorfreien Zeit im Vergleich der n bis 19 und Fortschritte der Onkologie für progrediente Patienten sind also bevölkerungsbezogen mit dem Qualitätsindikator Überleben nicht nachweisbar. Dies ist keine isolierte Aussage aus den Daten des TRM, die ja selektiert sein könnten. Vergleichbares wurde zu den gleichen vier Tumorerkrankungen aus den der USA abgeleitet, allerdings nur bezogen auf M1-Befunde (Cancer 1; 92:2211) und in Abb. zusätzlich aufbereitet. Die aus den abgeleiteten Aussagen basierten auf M1-Befunden beim Mammakarzinom und M1-Befunden beim Lungenkarzinom. Diese Daten reichen bis 1973 zurück. Diese Stagnation über die letzten wird mittlerweile auch von Klinikern eingeräumt, die im Sinne der evidenzbasierten Medizin ebenfalls die Aussagekraft der vielen kleinen Fortschritte hinterfragen. Ein Blick in die Reviews der Cochrane Library ( zu den vielen randomisierten Studien ist mittlerweile für viele Diagnostik- und Therapiemaßnahmen eine erfolgversprechende Bewertungshilfe.
6 Wie sind solche eigentlich dramatischen Ergebnisse für die systemische Therapie zu interpretieren? Fünf Hypothesen können diskutiert werden. Erstens wäre zu prüfen, bei welchen Studien signifikante Ergebnisse lediglich auf einen publication bias zurückzuführen sein könnten oder nur für Surrogatparameter belegt sind. Wenn bei einem innovativen Therapieansatz weltweit vielleicht und mehr Studien begonnen wurden, so ist davon auszugehen, daß zumindest in einer Studie zufällig ein Effekt belegt wird, obwohl die Nullhypothese einer nicht wirksameren Therapie zutrifft. Wenn nur diese Studie publiziert wird, werden viele fälschlicherweise zu der neuen Chance greifen und die neue Strategie verfolgen bis der nächste Fortschritt publiziert wird. Kritische Studienbewertungen im Sinne der evidenzbasierten Medizin sollten dieses Risiko der Fehlinterpretation verkleinern. Zweitens ist bei einer weniger pessimistischen Annahme die Größe des kleinen Fortschrittes zu diskutieren, der durch eine valide Studie belegt wurde. Wenn mit einer innovativen Therapie wie z.b. dem Herceptin eine Lebensverlängerung von 2 Monaten erreichbar ist (N Engl J Med 1; 344:783), so müßte ein solcher Effekt mit den im TRM verfügbaren Daten nachzuweisen sein. Wenn ein solcher Fortschritt allerdings nur bei etwa aller Patienten zu erreichen ist, die zudem alle diese Therapie erhalten müssen, stößt man populationsbezogen sicherlich an die Grenzen der Nachweisbarkeit. Wenn nur bei der Patientinnen eine solche Therapie angewendet wird, resultiert für die ganze Gruppe der metastasierten Patientinnen ein nicht mehr meßbarer Überlebenszeitgewinn von etwa 6 Tagen. Drittens ist zu diskutieren, warum nicht ein höherer Prozentsatz der Patienten von den Fortschritten profitiert. Wenn immer wieder neue Wirkprinzipien erfolgreich geprüft und propagiert werden, so müßte sich zumindest für die meisten Patienten ein Effekt zeigen, für die sequentiell von der First-line- bis zur Fifth-line-Therapie die verschiedenen Modalitäten eingesetzt werden. Für solche Sequenzen werden ja mittlerweile Rationale angeboten. Da sich kein Fortschritt zeigt, ist auch die Evidenz dieser Empfehlungen zu hinterfragen. Viertens könnte es auch sein, daß die Ein- und Ausschlußkriterien in den erfolgreichen Studien auf ganz wenige Patienten zutrafen, so daß trotz fulminanter Erfolge in Einzelfällen bevölkerungsbezogen kein auffälliger Fortschritt auszumachen ist. Die Metastasenchirurgie ist ein Beispiel, das selbst bei Darmtumoren keine überzeugenden konsistenten Verbesserungen (Abb. 22, Untergruppe M1) über die Zeit erkennen läßt. Als fünfte Hypothese sollte auch Folgendes bedacht werden: Da davon auszugehen ist, daß im Versorgungsalltag die Indikation für eine Progressionstherapie im Vergleich zu den kontrollierten Studien eher großzügiger gestellt wird, könnte es sein, daß die Patienten, die den Studienbedingungen genügen, tatsächlich profitieren, Patienten, die sie aber nicht erfüllen, sogar mit einer kürzeren Überlebenszeit rechnen müssen. Damit wäre in der Gesamtgruppe ebenfalls kein positiver Effekt nachweisbar, weil sich Nutzen und Schaden bestenfalls kompensieren bzw. sogar zu einer negativen Bilanz führen könnten. Fortschritte bei der Behandlung metastasierter Erkrankungen, die mit dem Qualitätsindikator Überlebenszeit gemessen werden, sind in der Region München nicht nachweisbar. Sind es vielleicht einzelne, nicht auf Evidenz geprüfte Studien, das Ansprechen von Surrogatparametern, die Beobachtung von einzelnen Langzeitüberlebenden mit Metastasen unter neuen Therapiestrategien und vielleicht auch die kontinuierlich steigenden Therapiekosten, die den Ärzten den Eindruck zunehmend wirksamerer Therapieansätze vermitteln? Es ist bemerkenswert, daß gerade das Fachgebiet, das die Fortschritte propa-
7 61 giert, am schlechtesten mit dem TRM kooperiert. Die internistische Onkologie hat offensichtlich noch nicht erkannt, welche Chancen sich eröffnen, wenn man sich mit den eigenen Therapiestrategien und den Ergebnissen im historischen Vergleich auseinandersetzt. Es reicht nicht aus, nur an die in Studien eingesetzten Therapien zu glauben und sie gebetsmühlenartig zu propagieren. Eine kritische Überprüfung der historischen Entwicklung der Therapiestrategien im Sinne der evidenzbasierten Medizin ist bei solchen Ergebnissen überfällig. Dabei ist nicht nur die Signifikanz der Ergebnisse, sondern auch die erreichte Überlebenszeit in den überlegenen Therapiearmen zu beachten. Des weiteren ist in Bezug auf die Additivität der kleinen Fortschritte die jeweilige Standardtherapie zu registrieren. Diese Aussage zu kaum meßbaren Fortschritten ist durch eine aktuelle Arbeit (Lancet 4; 363:263) indirekt abgesichert worden. Die Schlußfolgerung lautet, daß die Aussage, Krebspatienten würden von der Teilnahme an klinischen Studien profitieren, bisher nicht überzeugend bestätigt worden ist. Wenn dies zutreffen sollte, wäre das für Patienten und ihre Ärzte sehr erfreulich. Denn damit wäre der Vorwurf an die Ärzte aus der Welt geschafft, daß sie Patienten im Kontrollarm von Studien mit der Standardtherapie besser versorgen als außerhalb von Studien. Damit würde eigentlich gleichzeitig die oft geäußerte Aussage in Frage gestellt, daß eine Zentralisierung der Versorgung das Outcome verbessert, wofür es ebenfalls keine überzeugende Evidenz gibt. Für ein Tumorregister ist das nicht überraschend. Das TRM schätzt, daß z.b. beim Mammakarzinom für Studien aufgrund der üblichen Ein- und Ausschlußkriterien (u.a. <, M, keine gravierende Komorbidität, soziale Kompetenz) höchstens einer Bevölkerungskohorte rekrutierbar sind. Daß bei einer solchen Selektion die Ergebnisse überdurchschnittlich sein können, ist zu erwarten. Daß es nicht so sein muß, wurde mit Abb. 16 gezeigt. Die Überlebensraten in Abhängigkeit von der Anzahl der positiven Lymphknoten sind beim Mammakarzinom im TRM mit anerkannten Studien vergleichbar. Für die Argumentation dieses Abschnittes folgt aus der vergleichbaren Qualität außerhalb von Studien, daß die TRM-Ergebnisse der letzten aussagekräftig sind. Es gibt zusätzlich auch keine relevante Outcome-Variation zwischen Kliniken und die aktuellen "state of the art Therapien" werden in den Neuauflagen der Manuale des TZM empfohlen. Wenn auch diese empfohlenen Innovationen zu Studien vergleichbare Ergebnisse bringen, ist die Aussage noch wahrscheinlicher, daß sich in Bezug auf Überlebensraten und Überlebenszeit in den letzten n nichts wesentlich verbessert hat. Da auch aus den USA vergleichbar ernüchternde Daten aus den letzten n vorliegen, sollte die Onkologie für sich selbst und die Öffentlichkeit die Vervielfachung der Therapiekosten und den damit erreichten Nutzen überzeugend darlegen. In Anbetracht dieser Realität erscheint die Intensivierung der Diskussion erforderlich, welche Evidenz die Empfehlungen zur First-line- bis zur Fifth-line-Therapie haben. Solche Empfehlungen können dazu führen, daß die tumorgerichtete Therapie den kritischen Punkt überschreitet, von dem ab Patienten und Angehörige mit einer symptomorientierten Therapie zur Ruhe kommen könnten, anstatt mit immer neuen Therapiestrategien, mit Interventionsaktionismus und einer aufwendigen Diagnostik bis wenige Tage vor dem Tod der erhofften kurativen Restchance nachzujagen.
2. Ergebnisse. Ersterhebungen Folgeerhebungen Pathologiebefunde Bestrahlungsberichte 3800 Arztbriefe 2500
 18 2. Ergebnisse 2.1 Bearbeitete Dokumente 1998 Das derzeitige Arbeitsvolumen des TRM kann am einfachsten durch die Anzahl der 1998 verarbeiteten Dokumente beschrieben werden. Neben der reinen Erfassung
18 2. Ergebnisse 2.1 Bearbeitete Dokumente 1998 Das derzeitige Arbeitsvolumen des TRM kann am einfachsten durch die Anzahl der 1998 verarbeiteten Dokumente beschrieben werden. Neben der reinen Erfassung
Nutzung der Daten eines TR für das kritische Lesen von Publikationen
 Spezielle Auswertungen C: Mammakarzinom (Frauen) Literaturvergleich Cancer 4;;44-52 1/ Nutzung der Daten eines TR für das kritische Lesen von Publikationen Vergleichbar zur kritischen Diskussion einer
Spezielle Auswertungen C: Mammakarzinom (Frauen) Literaturvergleich Cancer 4;;44-52 1/ Nutzung der Daten eines TR für das kritische Lesen von Publikationen Vergleichbar zur kritischen Diskussion einer
Tumorregister München
 Tumorregister München Basisstatistiken Auswahlmatrix Homepage English Tumorregister München am Tumorzentrum München Marchioninistr. 15 81377 München Deutschland http://www.tumorregister-muenchen.de Tumorstatistik:
Tumorregister München Basisstatistiken Auswahlmatrix Homepage English Tumorregister München am Tumorzentrum München Marchioninistr. 15 81377 München Deutschland http://www.tumorregister-muenchen.de Tumorstatistik:
Tumorregister München
 Tumorregister München Basisstatistiken Auswahlmatrix Homepage English Tumorregister München am Tumorzentrum München Marchioninistr. 15 81377 München Deutschland http://www.tumorregister-muenchen.de Tumorstatistik:
Tumorregister München Basisstatistiken Auswahlmatrix Homepage English Tumorregister München am Tumorzentrum München Marchioninistr. 15 81377 München Deutschland http://www.tumorregister-muenchen.de Tumorstatistik:
Tumorregister München
 Tumorregister München Basisstatistiken Auswahlmatrix Homepage English Tumorregister München am Tumorzentrum München Marchioninistr. 15 81377 München Deutschland http://www.tumorregister-muenchen.de Tumorstatistik:
Tumorregister München Basisstatistiken Auswahlmatrix Homepage English Tumorregister München am Tumorzentrum München Marchioninistr. 15 81377 München Deutschland http://www.tumorregister-muenchen.de Tumorstatistik:
Tumorregister München
 Tumorregister München Basisstatistiken Auswahlmatrix Homepage English Tumorregister München am Tumorzentrum München Marchioninistr. 15 81377 München Deutschland http://www.tumorregister-muenchen.de Tumorstatistik:
Tumorregister München Basisstatistiken Auswahlmatrix Homepage English Tumorregister München am Tumorzentrum München Marchioninistr. 15 81377 München Deutschland http://www.tumorregister-muenchen.de Tumorstatistik:
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C92: Myeloische Leukämie Survival Diagnosejahr 1988-1997 1998-14 Patienten 436 3 653 Erkrankungen 436 3 667 Fälle in Auswertung
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C92: Myeloische Leukämie Survival Diagnosejahr 1988-1997 1998-14 Patienten 436 3 653 Erkrankungen 436 3 667 Fälle in Auswertung
ALLGEMEIN ICD-1 C71: Glioblastom 2/11 ICD-1 C71: Gliom (Glioblastom) Diagnosezeitraum % Relatives Überleben N=
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C71: Glioblastom Survival Diagnosejahr 1988-1997 1998-215 Patienten 234 2 921 Erkrankungen 234 2 921 Fälle in Auswertung
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C71: Glioblastom Survival Diagnosejahr 1988-1997 1998-215 Patienten 234 2 921 Erkrankungen 234 2 921 Fälle in Auswertung
ALLGEMEIN 2/ Diagnosezeitraum % Relatives Überleben N= Abb. 1a. Relatives Überleben für Patienten mit myeloische Leu
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English Survival Diagnosejahr 1988-1997 1998-15 Patienten 4 4 14 Erkrankungen 4 4 Fälle in Auswertung 375 2 1 Erstellungsdatum 4.1.18
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English Survival Diagnosejahr 1988-1997 1998-15 Patienten 4 4 14 Erkrankungen 4 4 Fälle in Auswertung 375 2 1 Erstellungsdatum 4.1.18
Tumorregister München
 Tumorregister München Basisstatistiken Auswahlmatrix Homepage English Tumorregister München am Tumorzentrum München Marchioninistr. 15 81377 München Deutschland http://www.tumorregister-muenchen.de Tumorstatistik:
Tumorregister München Basisstatistiken Auswahlmatrix Homepage English Tumorregister München am Tumorzentrum München Marchioninistr. 15 81377 München Deutschland http://www.tumorregister-muenchen.de Tumorstatistik:
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C91.1: Chron. lymphat. Leukämie Survival Diagnosejahr 1988-1997 1998-14 Patienten 488 3 136 Erkrankungen 488 3 14 Fälle
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C91.1: Chron. lymphat. Leukämie Survival Diagnosejahr 1988-1997 1998-14 Patienten 488 3 136 Erkrankungen 488 3 14 Fälle
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C91.: Akute lymphat. Leukämie Survival Diagnosejahr 1988-1997 1998-14 Patienten 179 751 Erkrankungen 179 751 Fälle in Auswertung
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C91.: Akute lymphat. Leukämie Survival Diagnosejahr 1988-1997 1998-14 Patienten 179 751 Erkrankungen 179 751 Fälle in Auswertung
Tumorregister München
 Tumorregister München Basisstatistiken Auswahlmatrix Homepage English Tumorregister München am Tumorzentrum München Marchioninistr. 15 81377 München Deutschland http://www.tumorregister-muenchen.de Tumorstatistik:
Tumorregister München Basisstatistiken Auswahlmatrix Homepage English Tumorregister München am Tumorzentrum München Marchioninistr. 15 81377 München Deutschland http://www.tumorregister-muenchen.de Tumorstatistik:
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C91.: Akute lymphat. Leukämie Survival Diagnosejahr 1988-1997 1998-14 Patienten 179 752 Erkrankungen 179 752 Fälle in
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C91.: Akute lymphat. Leukämie Survival Diagnosejahr 1988-1997 1998-14 Patienten 179 752 Erkrankungen 179 752 Fälle in
Tumorregister München
 Tumorregister München Basisstatistiken Auswahlmatrix Homepage English Tumorregister München am Tumorzentrum München Marchioninistr. 15 81377 München Deutschland http://www.tumorregister-muenchen.de Tumorstatistik:
Tumorregister München Basisstatistiken Auswahlmatrix Homepage English Tumorregister München am Tumorzentrum München Marchioninistr. 15 81377 München Deutschland http://www.tumorregister-muenchen.de Tumorstatistik:
ALLGEMEIN ICD-1 C91.1: Chron. lymphat. Leukämie 2/1 Diagnosezeitraum % Relatives Überleben N= Diagnosezeitraum n=434 18
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C91.1: Chron. lymphat. Leukämie Survival Diagnosejahr 1988-1997 1998-15 Patienten 493 3 379 Erkrankungen 493 3 384 Fälle
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C91.1: Chron. lymphat. Leukämie Survival Diagnosejahr 1988-1997 1998-15 Patienten 493 3 379 Erkrankungen 493 3 384 Fälle
Tumorregister München
 Tumorregister München Basisstatistiken Auswahlmatrix Homepage English Tumorregister München am Tumorzentrum München Marchioninistr. 15 81377 München Deutschland http://www.tumorregister-muenchen.de Tumorstatistik:
Tumorregister München Basisstatistiken Auswahlmatrix Homepage English Tumorregister München am Tumorzentrum München Marchioninistr. 15 81377 München Deutschland http://www.tumorregister-muenchen.de Tumorstatistik:
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C9: Plasmozytom Survival Diagnosejahr 1988-1997 1998-14 Patienten 445 3 754 Erkrankungen 445 3 757 Fälle in Auswertung
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C9: Plasmozytom Survival Diagnosejahr 1988-1997 1998-14 Patienten 445 3 754 Erkrankungen 445 3 757 Fälle in Auswertung
ALLGEMEIN ICD-1 C9: Plasmozytom 2/1 ICD-1 C9: Plasmozytom und bösartige Plasmazellen-Neubildungen Diagnosezeitraum % Relatives Überleben N=294
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C9: Plasmozytom Survival Diagnosejahr 1988-1997 1998-15 Patienten 446 4 64 Erkrankungen 446 4 66 Fälle in Auswertung 39
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C9: Plasmozytom Survival Diagnosejahr 1988-1997 1998-15 Patienten 446 4 64 Erkrankungen 446 4 66 Fälle in Auswertung 39
Tumorregister München
 Tumorregister München Basisstatistiken Auswahlmatrix Homepage English Tumorregister München am Tumorzentrum München Marchioninistr. 15 81377 München Deutschland http://www.tumorregister-muenchen.de Tumorstatistik:
Tumorregister München Basisstatistiken Auswahlmatrix Homepage English Tumorregister München am Tumorzentrum München Marchioninistr. 15 81377 München Deutschland http://www.tumorregister-muenchen.de Tumorstatistik:
Tumorregister München
 Tumorregister München Basisstatistiken Auswahlmatrix Homepage English Tumorregister München am Tumorzentrum München Marchioninistr. 15 81377 München Deutschland http://www.tumorregister-muenchen.de Tumorstatistik:
Tumorregister München Basisstatistiken Auswahlmatrix Homepage English Tumorregister München am Tumorzentrum München Marchioninistr. 15 81377 München Deutschland http://www.tumorregister-muenchen.de Tumorstatistik:
ALLGEMEIN ICD-1 D5: Mammakarzinom i.s. (Frauen) 2/8 Diagnosezeitraum % Relatives Überleben N=46 11 Diagnosezeitraum n= % 199
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 D5: Mammakarzinom i.s. (Frauen) Survival Diagnosejahr 1988-1997 1998-215 Patienten 671 5 264 Erkrankungen 681 5 348 Fälle
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 D5: Mammakarzinom i.s. (Frauen) Survival Diagnosejahr 1988-1997 1998-215 Patienten 671 5 264 Erkrankungen 681 5 348 Fälle
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C91.1: Chron. lymphat. Leukämie Survival Diagnosejahr 1988-1997 1998-14 Patienten 489 3 1 Erkrankungen 489 3 164 Fälle
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C91.1: Chron. lymphat. Leukämie Survival Diagnosejahr 1988-1997 1998-14 Patienten 489 3 1 Erkrankungen 489 3 164 Fälle
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C61: Prostatakarzinom Survival Diagnosejahr 1988-1997 1998-214 Patienten 7 399 46 513 Erkrankungen 7 399 46 514 Fälle in
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C61: Prostatakarzinom Survival Diagnosejahr 1988-1997 1998-214 Patienten 7 399 46 513 Erkrankungen 7 399 46 514 Fälle in
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C61: Prostatakarzinom Survival Diagnosejahr 1988-1997 1998-14 Patienten 7 41 46 855 Erkrankungen 7 41 46 856 Fälle in Auswertung
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C61: Prostatakarzinom Survival Diagnosejahr 1988-1997 1998-14 Patienten 7 41 46 855 Erkrankungen 7 41 46 856 Fälle in Auswertung
ALLGEMEIN P-NET: Neuroendokr. Pankreastu. 2/9 Diagnosezeitraum % Relatives Überleben N= Abb. 1a. Relatives Überleben
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English P-NET: Neuroendokr. Pankreastu. Survival Diagnosejahr 1998-15 Patienten 424 Erkrankungen 424 Fälle in Auswertung 338 Erstellungsdatum
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English P-NET: Neuroendokr. Pankreastu. Survival Diagnosejahr 1998-15 Patienten 424 Erkrankungen 424 Fälle in Auswertung 338 Erstellungsdatum
Tumorregister München
 Tumorregister München Basisstatistiken Auswahlmatrix Homepage English Tumorregister München am Tumorzentrum München Marchioninistr. 15 81377 München Deutschland http://www.tumorregister-muenchen.de Tumorstatistik:
Tumorregister München Basisstatistiken Auswahlmatrix Homepage English Tumorregister München am Tumorzentrum München Marchioninistr. 15 81377 München Deutschland http://www.tumorregister-muenchen.de Tumorstatistik:
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English P-NET: Neuroendokr. Pankreastu. Survival Diagnosejahr 1998-14 Patienten 368 Erkrankungen 368 Fälle in Auswertung 292 Erstellungsdatum
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English P-NET: Neuroendokr. Pankreastu. Survival Diagnosejahr 1998-14 Patienten 368 Erkrankungen 368 Fälle in Auswertung 292 Erstellungsdatum
Ösophagus. 3.2 Ösophaguskarzinom
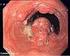 55 3.2 karzinom Das karzinom ist mit einer Inzidenzrate von ca. 8 je 100.000 bzw. 2% aller Krebsneuerkrankungen bei Männern und 2,1 bzw. 0,4% bei Frauen eine seltene Erkrankungsform. 82% der Erkrankten
55 3.2 karzinom Das karzinom ist mit einer Inzidenzrate von ca. 8 je 100.000 bzw. 2% aller Krebsneuerkrankungen bei Männern und 2,1 bzw. 0,4% bei Frauen eine seltene Erkrankungsform. 82% der Erkrankten
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C5: Mammakarzinom (Männer) Survival Diagnosejahr 1988-1997 1998-14 Patienten 59 425 Erkrankungen 59 429 Fälle in Auswertung
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C5: Mammakarzinom (Männer) Survival Diagnosejahr 1988-1997 1998-14 Patienten 59 425 Erkrankungen 59 429 Fälle in Auswertung
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English Survival Diagnosejahr 1988-1997 1998-16 Patienten 33 2 24 Erkrankungen 33 2 24 Fälle in Auswertung 28 1 567 Erstellungsdatum
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English Survival Diagnosejahr 1988-1997 1998-16 Patienten 33 2 24 Erkrankungen 33 2 24 Fälle in Auswertung 28 1 567 Erstellungsdatum
Tumorregister München
 Tumorregister München Basisstatistiken Auswahlmatrix Homepage English Tumorregister München am Tumorzentrum München Marchioninistr. 15 81377 München Deutschland http://www.tumorregister-muenchen.de Tumorstatistik:
Tumorregister München Basisstatistiken Auswahlmatrix Homepage English Tumorregister München am Tumorzentrum München Marchioninistr. 15 81377 München Deutschland http://www.tumorregister-muenchen.de Tumorstatistik:
Cervix uteri. 3.5 Cervix uteri
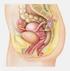 87 3.5 Das Zervixkarzinom ist der zweithäufigste bösartige Tumor der Frau in der Welt [Par97]. In Deutschland steht es an sechster Stelle (nach Brust- und Darmkrebs, Tumoren der Atmungsorgane und der Gebärmutter,
87 3.5 Das Zervixkarzinom ist der zweithäufigste bösartige Tumor der Frau in der Welt [Par97]. In Deutschland steht es an sechster Stelle (nach Brust- und Darmkrebs, Tumoren der Atmungsorgane und der Gebärmutter,
ALLGEMEIN ICD- C3: Zahnfleischtumor 2/ Diagnosezeitraum % Relatives Überleben N= Abb. 1a. Relatives Überleben für Pat
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C3: Zahnfleischtumor Survival Diagnosejahr 1988-1997 1998-15 Patienten 95 3 Erkrankungen 95 4 Fälle in Auswertung 84 321
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C3: Zahnfleischtumor Survival Diagnosejahr 1988-1997 1998-15 Patienten 95 3 Erkrankungen 95 4 Fälle in Auswertung 84 321
ALLGEMEIN ICD- C92.1: Chron. myel. Leukämie 2/ ICD- C92.1: Chronische myeloische Leukämie (CML), BCR/ABL-positiv Diagnosezeitraum % Relatives Überlebe
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C92.1: Chron. myel. Leukämie Survival Diagnosejahr 1988-1997 1998-215 Patienten 133 966 Erkrankungen 133 966 Fälle in Auswertung
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C92.1: Chron. myel. Leukämie Survival Diagnosejahr 1988-1997 1998-215 Patienten 133 966 Erkrankungen 133 966 Fälle in Auswertung
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English iep-net: iastr.ent.pankr. neuroend. Tumor Survival Diagnosejahr 1988-1997 1998-14 Patienten 163 2 512 Erkrankungen 163 2 538
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English iep-net: iastr.ent.pankr. neuroend. Tumor Survival Diagnosejahr 1988-1997 1998-14 Patienten 163 2 512 Erkrankungen 163 2 538
2.7 15-Jahre Überleben zu häufigen Krebserkrankungen
 45 2.7 15-Jahre Überleben zu häufigen Krebserkrankungen Die krankheitsspezifische Mortalität - präziser Letalität - ist eine wichtige Kenngröße jeder Krebserkrankung. Auch wenn Aussagen wie "92% aller
45 2.7 15-Jahre Überleben zu häufigen Krebserkrankungen Die krankheitsspezifische Mortalität - präziser Letalität - ist eine wichtige Kenngröße jeder Krebserkrankung. Auch wenn Aussagen wie "92% aller
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English icd- C5: Mammakarzinom (Frauen) Survival Diagnosejahr 1988-1997 1998-14 Patienten 11 854 53 681 Erkrankungen 12 334 56 79 Fälle
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English icd- C5: Mammakarzinom (Frauen) Survival Diagnosejahr 1988-1997 1998-14 Patienten 11 854 53 681 Erkrankungen 12 334 56 79 Fälle
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C61: Prostatakarzinom Survival Diagnosejahr 1988-1997 1998-216 Patienten 7 418 51 786 Erkrankungen 7 418 51 786 Fälle
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C61: Prostatakarzinom Survival Diagnosejahr 1988-1997 1998-216 Patienten 7 418 51 786 Erkrankungen 7 418 51 786 Fälle
Klaus Kraywinkel. Überlebenszeitanalysen in Epidemiologischen Krebsregistern
 Klaus Kraywinkel Überlebenszeitanalysen in Epidemiologischen Krebsregistern DGEpi - GEKID Hintergrund These: Überlebenszeiten von Krebspatienten sagen etwas über die Qualität von Therapie und Versorgung
Klaus Kraywinkel Überlebenszeitanalysen in Epidemiologischen Krebsregistern DGEpi - GEKID Hintergrund These: Überlebenszeiten von Krebspatienten sagen etwas über die Qualität von Therapie und Versorgung
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English icd-1 C91.1: Chron. lymphat. Leukämie Survival Diagnosejahr 1988-1997 1998-14 Patienten 489 3 196 Erkrankungen 489 3 Fälle in
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English icd-1 C91.1: Chron. lymphat. Leukämie Survival Diagnosejahr 1988-1997 1998-14 Patienten 489 3 196 Erkrankungen 489 3 Fälle in
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English icd- C33, C34: Nicht-kleinzell. BC Survival Diagnosejahr 1988-1997 1998-214 Patienten 3 539 2 69 Erkrankungen 3 557 2 887 Fälle
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English icd- C33, C34: Nicht-kleinzell. BC Survival Diagnosejahr 1988-1997 1998-214 Patienten 3 539 2 69 Erkrankungen 3 557 2 887 Fälle
ALLGEMEIN ICD-1 C33, C34: Nicht-kleinzell. BC 2/18 ICD-1 C33, C34: Nicht-kleinzelliges Lungenkarzinom Diagnosezeitraum % Relatives Überleben N
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C33, C34: Nicht-kleinzell. BC Survival Diagnosejahr 1988-1997 1998-15 Patienten 3 54 22 125 Erkrankungen 3 558 22 343
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C33, C34: Nicht-kleinzell. BC Survival Diagnosejahr 1988-1997 1998-15 Patienten 3 54 22 125 Erkrankungen 3 558 22 343
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English GIST: Gastroint. Stromatumor Survival Diagnosejahr 1994-1997 1998-216 Patienten 6 1 8 Erkrankungen 6 1 81 Fälle in Auswertung
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English GIST: Gastroint. Stromatumor Survival Diagnosejahr 1994-1997 1998-216 Patienten 6 1 8 Erkrankungen 6 1 81 Fälle in Auswertung
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C12, C13: Hypopharynxtumor Survival Diagnosejahr 1988-1997 1998-14 Patienten 4 1 5 Erkrankungen 451 1 5 Fälle in Auswertung
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C12, C13: Hypopharynxtumor Survival Diagnosejahr 1988-1997 1998-14 Patienten 4 1 5 Erkrankungen 451 1 5 Fälle in Auswertung
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C5: Mammakarzinom (Frauen) Survival Diagnosejahr 1988-1997 1998-16 Patienten 11 895 59 157 Erkrankungen 12 378 61 951 Fälle
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C5: Mammakarzinom (Frauen) Survival Diagnosejahr 1988-1997 1998-16 Patienten 11 895 59 157 Erkrankungen 12 378 61 951 Fälle
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C22.1: Cholangiokarzinom Survival Diagnosejahr 1992-1997 1998-16 Patienten 9 859 Erkrankungen 9 859 Fälle in Auswertung
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C22.1: Cholangiokarzinom Survival Diagnosejahr 1992-1997 1998-16 Patienten 9 859 Erkrankungen 9 859 Fälle in Auswertung
Tumorregister München April 2012
 Zur Nutzung der Daten und Statistiken des Tumorregisters München Die vom Tumorregister München (TRM) im Internet zusammengestellten Fakten zu den verschiedenen Krebserkrankungen basieren auf der Leistung
Zur Nutzung der Daten und Statistiken des Tumorregisters München Die vom Tumorregister München (TRM) im Internet zusammengestellten Fakten zu den verschiedenen Krebserkrankungen basieren auf der Leistung
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C2: Zungentumor (ohne Zungengrund) Survival Diagnosejahr 1988-1997 1998-14 Patienten 325 1 112 Erkrankungen 326 1 115 Fälle
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C2: Zungentumor (ohne Zungengrund) Survival Diagnosejahr 1988-1997 1998-14 Patienten 325 1 112 Erkrankungen 326 1 115 Fälle
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English icd- C43: Malignes Melanom Survival Diagnosejahr 1988-1997 1998-14 Patienten 3 153 15 857 Erkrankungen 3 218 16 618 Fälle in
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English icd- C43: Malignes Melanom Survival Diagnosejahr 1988-1997 1998-14 Patienten 3 153 15 857 Erkrankungen 3 218 16 618 Fälle in
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C-C72: Gehirn- u. Nervensystem-Tumor Survival Diagnosejahr 1988-1997 1998-216 Patienten 748 5 4 Erkrankungen 751 5 912
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C-C72: Gehirn- u. Nervensystem-Tumor Survival Diagnosejahr 1988-1997 1998-216 Patienten 748 5 4 Erkrankungen 751 5 912
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C67: Blasenkarzinom Survival Diagnosejahr 1988-1997 1998-14 Patienten 2 17 9 73 Erkrankungen 2 17 9 76 Fälle in Auswertung
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C67: Blasenkarzinom Survival Diagnosejahr 1988-1997 1998-14 Patienten 2 17 9 73 Erkrankungen 2 17 9 76 Fälle in Auswertung
ALLGEMEIN ICD- C81: Hodgkin-Lymphom 2/12 ICD- C81: Hodgkin-Krankheit (Lymphogranulomatose) Diagnosezeitraum % Relatives Überleben N=
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C81: Hodgkin-Lymphom Survival Diagnosejahr 1988-1997 1998-15 Patienten 459 1 814 Erkrankungen 459 1 814 Fälle in Auswertung
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C81: Hodgkin-Lymphom Survival Diagnosejahr 1988-1997 1998-15 Patienten 459 1 814 Erkrankungen 459 1 814 Fälle in Auswertung
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C5: Mammakarzinom (Männer) Survival Diagnosejahr 1988-1997 1998-16 Patienten 6 491 Erkrankungen 6 495 Fälle in Auswertung
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C5: Mammakarzinom (Männer) Survival Diagnosejahr 1988-1997 1998-16 Patienten 6 491 Erkrankungen 6 495 Fälle in Auswertung
ALLGEMEIN ICD- C67: Blasenkarzinom 2/18 ICD- C67: Neubildung der Harnblase (nur invasiv) Diagnosezeitraum % Relatives Überleben N=
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C67: Blasenkarzinom Survival Diagnosejahr 1988-1997 1998-15 Patienten 2 123 9 878 Erkrankungen 2 123 9 884 Fälle in Auswertung
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C67: Blasenkarzinom Survival Diagnosejahr 1988-1997 1998-15 Patienten 2 123 9 878 Erkrankungen 2 123 9 884 Fälle in Auswertung
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C82-C85: NHL Survival Diagnosejahr 1988-1997 1998-216 Patienten 1 9 952 Erkrankungen 1 7 1 39 Fälle in Auswertung 1 418
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C82-C85: NHL Survival Diagnosejahr 1988-1997 1998-216 Patienten 1 9 952 Erkrankungen 1 7 1 39 Fälle in Auswertung 1 418
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C33, C34: Kleinzell. BC Survival Diagnosejahr 1988-1997 1998-216 Patienten 893 5 54 Erkrankungen 893 5 55 Fälle in Auswertung
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C33, C34: Kleinzell. BC Survival Diagnosejahr 1988-1997 1998-216 Patienten 893 5 54 Erkrankungen 893 5 55 Fälle in Auswertung
ALLGEMEIN ICD- C38, C47-C49: Weichteiltumor 2/15 ICD- C38, C47-C49: Bösartige Neubildung des Binde- und Weichteilgewebes Diagnosezeitraum % Relatives
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C38, C47-C49: Weichteiltumor Survival Diagnosejahr 1988-1997 1998-15 Patienten 612 3 565 Erkrankungen 612 3 581 Fälle in
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C38, C47-C49: Weichteiltumor Survival Diagnosejahr 1988-1997 1998-15 Patienten 612 3 565 Erkrankungen 612 3 581 Fälle in
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C38, C47-C49: Weichteiltumor Survival Diagnosejahr 1988-1997 1998-16 Patienten 615 3 777 Erkrankungen 615 3 794 Fälle in
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C38, C47-C49: Weichteiltumor Survival Diagnosejahr 1988-1997 1998-16 Patienten 615 3 777 Erkrankungen 615 3 794 Fälle in
ALLGEMEIN ICD- C22: Leberkarzinom 2/13 ICD- C22: Bösartige Neubildung der Leber Diagnosezeitraum % Relatives Überleben N=
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C22: Leberkarzinom Survival Diagnosejahr 1988-1997 1998-15 Patienten 391 6 783 Erkrankungen 391 6 791 Fälle in Auswertung
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C22: Leberkarzinom Survival Diagnosejahr 1988-1997 1998-15 Patienten 391 6 783 Erkrankungen 391 6 791 Fälle in Auswertung
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English icd- C16: Magenkarzinom Survival Diagnosejahr 1988-1997 1998-214 Patienten 2 561 12 568 Erkrankungen 2 563 12 591 Fälle in Auswertung
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English icd- C16: Magenkarzinom Survival Diagnosejahr 1988-1997 1998-214 Patienten 2 561 12 568 Erkrankungen 2 563 12 591 Fälle in Auswertung
Analyse der klinischen und epidemiologischen Daten des Tumorregister München. Bronchialkarzinom. Datenquellen, Befundverteilung und Prognose
 Analyse der klinischen und epidemiologischen Daten des Tumorregister München Bronchialkarzinom Datenquellen, Befundverteilung und Prognose M.Schmidt, D.Hölzel Abb. 1: Titel und Autoren des Vortrags Neuerkrankungen
Analyse der klinischen und epidemiologischen Daten des Tumorregister München Bronchialkarzinom Datenquellen, Befundverteilung und Prognose M.Schmidt, D.Hölzel Abb. 1: Titel und Autoren des Vortrags Neuerkrankungen
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C, C31: Nasenhöhle, Nasennebenhöhlen, Mittelohr Survival Diagnosejahr 1988-1997 1998-16 Patienten 139 664 Erkrankungen
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C, C31: Nasenhöhle, Nasennebenhöhlen, Mittelohr Survival Diagnosejahr 1988-1997 1998-16 Patienten 139 664 Erkrankungen
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English Survival Diagnosejahr 1991-1997 1998-216 Patienten 44 1 41 Erkrankungen 44 1 46 Fälle in Auswertung 41 839 Erstellungsdatum
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English Survival Diagnosejahr 1991-1997 1998-216 Patienten 44 1 41 Erkrankungen 44 1 46 Fälle in Auswertung 41 839 Erstellungsdatum
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English Survival Diagnosejahr 1988-1997 1998-216 Patienten 64 4 Erkrankungen 64 4 Fälle in Auswertung 489 Erstellungsdatum 22.8.218
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English Survival Diagnosejahr 1988-1997 1998-216 Patienten 64 4 Erkrankungen 64 4 Fälle in Auswertung 489 Erstellungsdatum 22.8.218
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English M. Paget der Brust Survival Diagnosejahr 1988-1997 1998-16 Patienten 31 236 Erkrankungen 31 236 Fälle in Auswertung 28 3 Erstellungsdatum
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English M. Paget der Brust Survival Diagnosejahr 1988-1997 1998-16 Patienten 31 236 Erkrankungen 31 236 Fälle in Auswertung 28 3 Erstellungsdatum
ALLGEMEIN ICD- C64: Nierenkarzinom 2/14 ICD- C64: Bösartige Neubildung der Niere Diagnosezeitraum % Relatives Überleben N=
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C64: Nierenkarzinom Survival Diagnosejahr 1988-1997 1998-15 Patienten 2 781 737 Erkrankungen 2 812 963 Fälle in Auswertung
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C64: Nierenkarzinom Survival Diagnosejahr 1988-1997 1998-15 Patienten 2 781 737 Erkrankungen 2 812 963 Fälle in Auswertung
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English Survival Diagnosejahr 1988-1997 1998-216 Patienten 161 Erkrankungen 161 Fälle in Auswertung 39 148 Erstellungsdatum 22.8.218
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English Survival Diagnosejahr 1988-1997 1998-216 Patienten 161 Erkrankungen 161 Fälle in Auswertung 39 148 Erstellungsdatum 22.8.218
ALLGEMEIN ICD- C21: Analkarzinom 2/16 ICD- C21: Bösartige Neubildung des Anus und des Analkanals Diagnosezeitraum % Relatives Überleben N=1334
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C21: Analkarzinom Survival Diagnosejahr 1988-1997 1998-15 Patienten 241 1 422 Erkrankungen 241 1 422 Fälle in Auswertung
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C21: Analkarzinom Survival Diagnosejahr 1988-1997 1998-15 Patienten 241 1 422 Erkrankungen 241 1 422 Fälle in Auswertung
Jahresbericht 2001/2002
 Tumorregister München Jahresbericht 2001/2002 des klinisch-epidemiologischen Krebsregisters am Tumorzentrum München Schwerpunkt: Larynx, Lunge, Niere 112 Abbildungen und Tabellen W. Zuckschwerdt Verlag
Tumorregister München Jahresbericht 2001/2002 des klinisch-epidemiologischen Krebsregisters am Tumorzentrum München Schwerpunkt: Larynx, Lunge, Niere 112 Abbildungen und Tabellen W. Zuckschwerdt Verlag
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C33, C34: Nicht-kleinzell. BC Survival Diagnosejahr 1988-1997 1998-14 Patienten 3 539 331 Erkrankungen 3 557 525 Fälle
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C33, C34: Nicht-kleinzell. BC Survival Diagnosejahr 1988-1997 1998-14 Patienten 3 539 331 Erkrankungen 3 557 525 Fälle
Leistungen klinischer Krebsregister - morgen
 Arbeitsgemeinschaft Deutscher Tumorzentren e.v. www.tumorzentren.de Leistungen klinischer Krebsregister - morgen D.Hölzel* Heute - bestehende Chancen und Kommunikationsbedarf Morgen die greifbare Vision
Arbeitsgemeinschaft Deutscher Tumorzentren e.v. www.tumorzentren.de Leistungen klinischer Krebsregister - morgen D.Hölzel* Heute - bestehende Chancen und Kommunikationsbedarf Morgen die greifbare Vision
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C21: Analkarzinom Survival Diagnosejahr 1988-1997 1998-216 Patienten 24 1 514 Erkrankungen 24 1 514 Fälle in Auswertung
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C21: Analkarzinom Survival Diagnosejahr 1988-1997 1998-216 Patienten 24 1 514 Erkrankungen 24 1 514 Fälle in Auswertung
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C8: CUP-Syndrom Survival Diagnosejahr 1988-1997 1998-16 Patienten 363 2 733 Erkrankungen 363 2 733 Fälle in Auswertung
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C8: CUP-Syndrom Survival Diagnosejahr 1988-1997 1998-16 Patienten 363 2 733 Erkrankungen 363 2 733 Fälle in Auswertung
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C17: Dünndarmkarzinom Survival Diagnosejahr 1988-1997 1998-14 Patienten 141 1 653 Erkrankungen 141 1 657 Fälle in Auswertung
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C17: Dünndarmkarzinom Survival Diagnosejahr 1988-1997 1998-14 Patienten 141 1 653 Erkrankungen 141 1 657 Fälle in Auswertung
Informationsblatt für Überweiser Qualitätssicherungsbericht FDG-PET/CT bei CUP-Syndrom September 2016
 Informationsblatt für Überweiser Qualitätssicherungsbericht FDG-PET/CT bei CUP-Syndrom September 2016 Beim CUP-Syndrom handelt es sich um ein relativ häufiges Krankheitsbild, das 3 bis 5 % aller Tumorerkrankungen
Informationsblatt für Überweiser Qualitätssicherungsbericht FDG-PET/CT bei CUP-Syndrom September 2016 Beim CUP-Syndrom handelt es sich um ein relativ häufiges Krankheitsbild, das 3 bis 5 % aller Tumorerkrankungen
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C-C14: HNO-Tumoren Survival Diagnosejahr 1988-1997 1998-16 Patienten 2 514 9 8 Erkrankungen 2 571 156 Fälle in Auswertung
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C-C14: HNO-Tumoren Survival Diagnosejahr 1988-1997 1998-16 Patienten 2 514 9 8 Erkrankungen 2 571 156 Fälle in Auswertung
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ieichteiltumor (klassif. nach Histologie) Survival Diagnosejahr 1988-1997 1998-14 Patienten 685 3 162 Erkrankungen 685 3 179
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ieichteiltumor (klassif. nach Histologie) Survival Diagnosejahr 1988-1997 1998-14 Patienten 685 3 162 Erkrankungen 685 3 179
 65 Ovar 3.2 Ovar Das mittlere Erkrankungsalter der Patientinnen im TRM (ab 1988 mit Wohnsitz in der Region) mit einem Ovarialtumor beträgt 61,9 Jahre. 80% erkranken im Alter zwischen 43 und 81 Jahren.
65 Ovar 3.2 Ovar Das mittlere Erkrankungsalter der Patientinnen im TRM (ab 1988 mit Wohnsitz in der Region) mit einem Ovarialtumor beträgt 61,9 Jahre. 80% erkranken im Alter zwischen 43 und 81 Jahren.
3. Schwerpunkt: Maligne gynäkologische Tumoren aus klinisch-epidemiologischer
 Gynäkologische Tumoren 58 3. Schwerpunkt: Maligne gynäkologische Tumoren aus klinisch-epidemiologischer Sicht 3.1. Epidemiologische Kenngrößen Zur klinisch-epidemiologischen Beschreibung der gynäkologischen
Gynäkologische Tumoren 58 3. Schwerpunkt: Maligne gynäkologische Tumoren aus klinisch-epidemiologischer Sicht 3.1. Epidemiologische Kenngrößen Zur klinisch-epidemiologischen Beschreibung der gynäkologischen
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C21: Analkarzinom Survival Diagnosejahr 1988-1997 1998-14 Patienten 242 1 5 Erkrankungen 242 1 5 Fälle in Auswertung 226
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C21: Analkarzinom Survival Diagnosejahr 1988-1997 1998-14 Patienten 242 1 5 Erkrankungen 242 1 5 Fälle in Auswertung 226
Wie man herausfindet, wie viele Menschen in München sterben
 27 Gesamt Lunge Mamma Prostata Kolorektal amtl. Abw. amtl. Abw. amtl. Abw. amtl. Abw. amtl. Abw. Tumorlokalisation n % n % n % n % n % Stadt München 3042 6.1 471-1.3 305 5.9 180 39.4 364 10.7 Dachau 312
27 Gesamt Lunge Mamma Prostata Kolorektal amtl. Abw. amtl. Abw. amtl. Abw. amtl. Abw. amtl. Abw. Tumorlokalisation n % n % n % n % n % Stadt München 3042 6.1 471-1.3 305 5.9 180 39.4 364 10.7 Dachau 312
Meldungsübersicht für Gesamt-Rheinland-Pfalz. Zeitraum: bis I. Meldungen: Anzahl und Qualität
 Meldungsübersicht für Gesamt-Rheinland-Pfalz Zeitraum: 01.01.2016 bis 30.09.2017 I. Meldungen: Anzahl und Qualität Tabelle 1: Anzahl aller Meldungen in Rheinland-Pfalz Zeitraum: Meldungseingang 01.01.2016
Meldungsübersicht für Gesamt-Rheinland-Pfalz Zeitraum: 01.01.2016 bis 30.09.2017 I. Meldungen: Anzahl und Qualität Tabelle 1: Anzahl aller Meldungen in Rheinland-Pfalz Zeitraum: Meldungseingang 01.01.2016
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English Weichteiltumor (klassif. nach Histologie) Survival Diagnosejahr 1988-1997 1998-16 Patienten 69 3 536 Erkrankungen 69 3 556 Fälle
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English Weichteiltumor (klassif. nach Histologie) Survival Diagnosejahr 1988-1997 1998-16 Patienten 69 3 536 Erkrankungen 69 3 556 Fälle
ALLGEMEIN ICD- C-C14,C-C32: HNO-Tumoren 2/16 ICD- C-C14,C-C32: Kopf-Halstumoren Diagnosezeitraum % Relatives Überleben N=
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C-C14,C-C32: HNO-Tumoren Survival Diagnosejahr 1988-1997 1998-215 Patienten 3 437 12 327 Erkrankungen 3 528 12 8 Fälle
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD- C-C14,C-C32: HNO-Tumoren Survival Diagnosejahr 1988-1997 1998-215 Patienten 3 437 12 327 Erkrankungen 3 528 12 8 Fälle
Gute Überlebensqualität Trastuzumab beim metastasierten Magenkarzinom
 Gute Überlebensqualität Trastuzumab beim metastasierten Magenkarzinom München (24. April 2012) - Mit dem monoklonalen Antikörper Trastuzumab (Herceptin ) steht bislang die einzige zielgerichtete Substanz
Gute Überlebensqualität Trastuzumab beim metastasierten Magenkarzinom München (24. April 2012) - Mit dem monoklonalen Antikörper Trastuzumab (Herceptin ) steht bislang die einzige zielgerichtete Substanz
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C-C14,C-C32: HNO-Tumoren Survival Diagnosejahr 1988-1997 1998-216 Patienten 3 447 12 889 Erkrankungen 3 541 13 445 Fälle
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 C-C14,C-C32: HNO-Tumoren Survival Diagnosejahr 1988-1997 1998-216 Patienten 3 447 12 889 Erkrankungen 3 541 13 445 Fälle
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English Survival Diagnosejahr 1988-1997 1998-2014 Patienten 51 75 Erkrankungen 51 75 Fälle in Auswertung 50 54 Erstellungsdatum 12.04.2016
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English Survival Diagnosejahr 1988-1997 1998-2014 Patienten 51 75 Erkrankungen 51 75 Fälle in Auswertung 50 54 Erstellungsdatum 12.04.2016
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 D39.1: Ovar Borderline Survival Diagnosejahr 1988-1997 1998-216 Patienten 42 1 342 Erkrankungen 42 1 343 Fälle in Auswertung
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-1 D39.1: Ovar Borderline Survival Diagnosejahr 1988-1997 1998-216 Patienten 42 1 342 Erkrankungen 42 1 343 Fälle in Auswertung
Tumorregister München
 Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-10 D33: Gutart. Neub. d. ZNS Survival Diagnosejahr 1988-1997 1998-2016 Patienten 53 1 393 Erkrankungen 53 1 397 Fälle in
Tumorregister München Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-10 D33: Gutart. Neub. d. ZNS Survival Diagnosejahr 1988-1997 1998-2016 Patienten 53 1 393 Erkrankungen 53 1 397 Fälle in
Tumorregister München
 Tumorregister München Basisstatistiken Auswahlmatrix Homepage English Tumorregister München am Tumorzentrum München Marchioninistr. 15 81377 München Deutschland http://www.tumorregister-muenchen.de Tumorstatistik:
Tumorregister München Basisstatistiken Auswahlmatrix Homepage English Tumorregister München am Tumorzentrum München Marchioninistr. 15 81377 München Deutschland http://www.tumorregister-muenchen.de Tumorstatistik:
Informationsblatt für Überweiser Qualitätssicherungsbericht FDG-PET/CT bei CUP-Syndrom Januar 2015
 Informationsblatt für Überweiser Qualitätssicherungsbericht FDG-PET/CT bei CUP-Syndrom Januar 2015 Beim CUP-Syndrom handelt es sich um ein relativ häufiges Krankheitsbild, das 3 bis 5 % aller Tumorerkrankungen
Informationsblatt für Überweiser Qualitätssicherungsbericht FDG-PET/CT bei CUP-Syndrom Januar 2015 Beim CUP-Syndrom handelt es sich um ein relativ häufiges Krankheitsbild, das 3 bis 5 % aller Tumorerkrankungen
Tumorregister München
 Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-10 C75: Tumor sonstiger endokriner Drüsen Survival Diagnosejahr 1991-1997 1998-2016 Patienten 9 144 Erkrankungen 9 144 Fälle in Auswertung 8 88
Inzidenz und Mortalität Auswahlmatrix Homepage English ICD-10 C75: Tumor sonstiger endokriner Drüsen Survival Diagnosejahr 1991-1997 1998-2016 Patienten 9 144 Erkrankungen 9 144 Fälle in Auswertung 8 88
Tab. 14: Krebssterbefälle auf Gemeindeebene für die Jahre 1998 und 1999
 37 Tab. 14 beobachtet Mortalität 1998/99 erwartet beobachtet erwartet Einw. GKZ Wohnort gesamt männl. weibl. gesamt gesamt 188132 Seefeld 6723 16 12 28 35 0.80 188137 Pöcking 5499 10 10 20 28 0.70 188139
37 Tab. 14 beobachtet Mortalität 1998/99 erwartet beobachtet erwartet Einw. GKZ Wohnort gesamt männl. weibl. gesamt gesamt 188132 Seefeld 6723 16 12 28 35 0.80 188137 Pöcking 5499 10 10 20 28 0.70 188139
Tab. 18 beobachtet. 2. Die Lebenserwartung eines Patienten in der Normalbevölkerung ist bekannt. In Tab. 19 sind Basisdaten zusammengestellt.
 38 Tab. 18 beobachtet Mortalität 1998 erwartet beobachtet erwartet Einw. GKZ Wohnort gesamt männl. weibl. gesamt gesamt 188132 Seefeld 6470 7 4 11 17 0.66 188137 Pöcking 5543 2 4 6 14 0.42 188139 Starnberg,
38 Tab. 18 beobachtet Mortalität 1998 erwartet beobachtet erwartet Einw. GKZ Wohnort gesamt männl. weibl. gesamt gesamt 188132 Seefeld 6470 7 4 11 17 0.66 188137 Pöcking 5543 2 4 6 14 0.42 188139 Starnberg,
H. Wilsdorf-Köhler, R. Stabenow. der Länder Berlin, Brandenburg, Mecklenburg-Vorpommern, Sachsen-Anhalt und der Freistaaten Sachsen und Thüringen
 Wie haben sich die Überlebenszeiten bei älteren (über 75 Jahre) im Vergleich zu jüngeren Krebspatienten (unter 65 Jahre) in den letzten 20 Jahren entwickelt? H. Wilsdorf-Köhler, R. Stabenow der Länder
Wie haben sich die Überlebenszeiten bei älteren (über 75 Jahre) im Vergleich zu jüngeren Krebspatienten (unter 65 Jahre) in den letzten 20 Jahren entwickelt? H. Wilsdorf-Köhler, R. Stabenow der Länder
Überleben nach Krebs Methodische Überlegungen und Ergebnisse aus Deutschen Epidemiologischen Krebsregistern
 Klaus Kraywinkel, Alice Nennecke, Bernd Holleczek, Hans-Werner Hense Überleben nach Krebs Methodische Überlegungen und Ergebnisse aus Deutschen Epidemiologischen Krebsregistern DGEpi - GEKID Hintergrund
Klaus Kraywinkel, Alice Nennecke, Bernd Holleczek, Hans-Werner Hense Überleben nach Krebs Methodische Überlegungen und Ergebnisse aus Deutschen Epidemiologischen Krebsregistern DGEpi - GEKID Hintergrund
2.8 Patienten wollen mitwirken die Medizin braucht diese Bewertung
 53 2.8 Patienten wollen mitwirken die Medizin braucht diese Bewertung Die stets geforderte Mitwirkung der Patienten bei den Therapieentscheidungen braucht als Entscheidungsbasis das Wissen um den Nutzen
53 2.8 Patienten wollen mitwirken die Medizin braucht diese Bewertung Die stets geforderte Mitwirkung der Patienten bei den Therapieentscheidungen braucht als Entscheidungsbasis das Wissen um den Nutzen
Aktuelle Studie zeigt positive Effekte präoperativer Maßnahmen bei zuvor nicht operablen Tumoren
 Neoadjuvante Therapie bei Pankreaskrebs Aktuelle Studie zeigt positive Effekte präoperativer Maßnahmen bei zuvor nicht operablen Tumoren Patienten mit nicht operablen Pankreastumoren profitieren von einer
Neoadjuvante Therapie bei Pankreaskrebs Aktuelle Studie zeigt positive Effekte präoperativer Maßnahmen bei zuvor nicht operablen Tumoren Patienten mit nicht operablen Pankreastumoren profitieren von einer
Lokale Therapie des Prostatatumors (durch OP oder RT) bei Patienten mit metastasiertem Prostata-Ca
 seit 350 Jahren ganz weit oben Lokale Therapie des Prostatatumors (durch OP oder RT) bei Patienten mit metastasiertem Prostata-Ca Prof. Dr. Jürgen Dunst & Dr. René Baumann Klinik für Strahlentherapie,
seit 350 Jahren ganz weit oben Lokale Therapie des Prostatatumors (durch OP oder RT) bei Patienten mit metastasiertem Prostata-Ca Prof. Dr. Jürgen Dunst & Dr. René Baumann Klinik für Strahlentherapie,
