ENDLICH. OPDIVO Dosierung, Anwendung und Nebenwirkungsmanagement
|
|
|
- Hertha Margarete Schuler
- vor 7 Jahren
- Abrufe
Transkript
1 OPDIVO Dosierung, Anwendung und Nebenwirkungsmanagement Konzentrat zur Herstellung einer Infusionslösung 10 mg/ml Jetzt zugelassen zur Behandlung von lokal fortgeschrittenem oder metastasiertem nicht-kleinzelligem Lungenkarzinom (NSCLC) nach vorangegangener Chemotherapie 1 ENDLICH
2
3 Konzentrat zur Herstellung einer Infusionslösung 10 mg/ml Dosierung OPDIVO Management Guide Dosierung 3
4
5 Dosierschema OPDIVO 3 mg/kg alle 2 Wochen als 60-minütige Infusion zur fortlaufenden Stärkung der Immunantwort Dosis Woche Die Behandlung sollte so lange fortgesetzt werden, wie ein klinischer Nutzen beobachtet wird oder bis die Behandlung vom Patienten nicht mehr toleriert wird. Eine Erhöhung oder Reduktion der Dosis wird nicht empfohlen. Eine Verzögerung der Dosierung oder ein Absetzen kann basierend auf der individuellen Sicherheit und Verträglichkeit erforderlich sein. 5
6 Dosierung 1 Die verordnete Dosis für den Patienten wird in mg/kg angegeben. Berechnen Sie basierend auf dieser verordneten Dosis die gesamte zu verabreichende Dosis. Es kann mehr als eine Durchstechflasche OPDIVO -Konzentrat erforderlich sein, um die Gesamtdosis für den Patienten zu erhalten. 1 ml OPDIVO -Konzentrat enthält 10 mg Nivolumab 40 mg Nivolumab in 4 ml OPDIVO -Konzentrat zur Herstellung einer Infusionslösung 100 mg Nivolumab in 10 ml OPDIVO -Konzentrat zur Herstellung einer Infusionslösung 10 mg/ml mg 3mg/kg ml Gesamtdosis Nivolumab (mg) = Körpergewicht des Patienten (kg) 3 mg/kg (zugelassene Dosis) Volumen (ml) OPDIVO -Konzentrat zur Herstellung der Dosis = Gesamtdosis Nivolumab (mg) dividiert durch 10 mg/ml (Konzentration des OPDIVO -Konzentrats) Beispielrechnung: Eine Person mit 71 kg Körpergewicht benötigt 213 mg = Gesamtdosis 1 vial à 100 mg + 3 vials à 40 mg 71 kg 213 mg 100 mg 40 mg g 10 ml 4 ml 40 mg 33 mg 4 ml 3,3 ml 6
7 Infusionszubereitung 1 Achten Sie bei der Vorbereitung der Infusion auf aseptische Bedingungen. Die Infusionslösung sollte in einer Werkbank mit Laminarströmungsabzug oder einer Sicherheitswerkbank unter Anwendung der Standardvorsichtsmassnahmen für den sicheren Umgang mit Parenteralia vorbereitet werden. OPDIVO wird intravenös infundiert und kann entweder unverdünnt nach Überführung in ein Infusionsbehältnis mittels einer geeigneten sterilen Spritze oder nach Verdünnung auf Konzentrationen von bis zu 1 mg/ml verwendet werden. Die endgültige Konzentration der Infusion sollte zwischen 1 und 10 mg/ml liegen. Zur Verdünnung des OPDIVO -Konzentrats können entweder 9 mg/ml (0,9 %ige) Natriumchlorid- Injektionslösung oder 50 mg/ml (5 %ige) Glucose-Injektionslösung verwendet werden. Das OPDIVO -Konzentrat hat einen ph-wert von etwa 6,0 und eine Osmolalität von ungefähr 340 mosm/kg. 7
8 Infusionszubereitung 1 Fortsetzung Schritt 1 Untersuchen Sie das OPDIVO -Konzentrat auf Schwebestoffteilchen oder Verfärbung. Die Durchstechflasche nicht schütteln. Das OPDIVO -Konzentrat ist eine klare bis opaleszierende, farblose bis blassgelbe Flüssigkeit, die helle (wenige) Schwebestoffteilchen enthalten kann. Entnehmen Sie die benötigte Menge OPDIVO -Konzentrat mit einer geeigneten sterilen Spritze. Schritt 2 Füllen Sie das Konzentrat in eine sterile, entlüftete Glasflasche oder einen sterilen i.v.-beutel (PVC oder Polyolefin). Verdünnen Sie das Konzentrat gegebenenfalls mit der erforderlichen Menge Natriumchloridlösung 9 mg/ml (0,9 %) für Injektionszwecke oder Glucoselösung 50 mg/ml (5 %) für Injektionszwecke. Mischen Sie die Infusionslösung vorsichtig durch manuelles Schwenken. Nicht schütteln. 8
9 Verabreichung 1 Die OPDIVO -Infusionslösung darf nicht als intravenöse Druck- oder Bolusinjektion verabreicht werden. Die OPDIVO -Infusionslösung darf nicht gleichzeitig mit anderen Präparaten verabreicht werden. Verwenden Sie für die Infusion einen separaten intravenösen Zugang. Verabreichen Sie die OPDIVO -Infusionslösung intravenös über einen Zeitraum von 60 Minuten. Verwenden Sie ein Infusionsset und einen sterilen, nichtpyrogenen In Line-Filter mit geringer Proteinbindung (Porengrösse 0,2 μm bis 1,2 μm). Die OPDIVO -Lösung ist kompatibel mit: - PVC-Beuteln, - Polyolefin-Beuteln, - Glasflaschen, - PVC-Infusionssets, - In-Line-Filtern mit Polyethersulfonmembranen mit Porengrössen von 0,2 µm bis 1,2 µm. Die Infusionsleitung ist am Ende der Infusion mit Natriumchlorid-Injektionslösung 9 mg/ml (0,9 %) oder Glucose- Injektionslösung 50 mg/ml (5 %) zu spülen. Verbliebene Restmengen der Infusionslösung dürfen nicht zur weiteren Verwendung gelagert werden. Nicht verwendetes Arzneimittel oder Abfallmaterialien sind gemäss den lokalen Bestimmungen zu entsorgen. 9
10 Mögliche Ansprechmuster mit OPDIVO 2 Mehrheit der Responder Konventionelles Ansprechen Langsame, stetige Abnahme der Tumorlast Minderheit der Responder Spätes Ansprechen nach anfänglicher Progression, Pseudoprogression Neue Läsionen treten auf und nehmen im weiteren Verlauf mit der Zielläsion ab, Pseudoprogression Therapiebeginn Erste Beurteilung Spätere Beurteilungen Unter Umständen dauert es Monate, bis sich ein klinisch signifikantes Ansprechen auf die immunonkologische Therapie entwickelt. Die Bestätigung der Krankheitsprogression ist wichtig, um die Patienten mit,echtem Progress von den Patienten mit,pseudoprogression zu unterscheiden. 2 10
11 Produktinformation 1 4 ml steriles Konzentrat zur Herstellung einer Infusionslösung in einer Glas-Durchstechflasche 10 ml steriles Konzentrat zur Herstellung einer Infusionslösung in einer Glas-Durchstechflasche Besondere Vorsichtsmassnahmen für die Aufbewahrung Für Kinder unerreichbar aufbewahren Im Kühlschrank (2 C 8 C) lagern Nicht einfrieren In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen Dauer der Haltbarkeit Sie dürfen OPDIVO nach dem auf dem Etikett der Durchstechflasche angegebenen Verfallsdatum nicht mehr verwenden. Das Verfallsdatum bezieht sich auf den letzten Tag des Monats. Infusion: Aus mikrobiologischer Perspektive muss das Arzneimittel nach dem Öffnen sofort infundiert oder verdünnt und infundiert werden. Nach der Zubereitung der Infusion: Die Verabreichung der OPDIVO -Infusion muss innerhalb von 24 Stunden nach der Vorbereitung abgeschlossen werden. Wenn die Infusionslösung nicht sofort verwendet wird, kann sie im Kühlschrank (2 C 8 C) und vor Licht geschützt für maximal 24 Stunden gelagert werden (maximal 4 Stunden der gesamten 24 Stunden Lagerung können bei Raumtemperatur [15 C 25 C] und Raumlicht erfolgen der maximale Zeitraum von 4 Stunden bei Raumtemperatur und Raumlicht muss den Zeitraum für die Verabreichung des Produkts umfassen). 11
12 Notizen 12
13 Konzentrat zur Herstellung einer Infusionslösung 10 mg/ml Anwendungshinweise OPDIVO Management Guide Anwendungshinweise 13
14
15 Interaktionen 1 OPDIVO ist ein humaner monoklonaler Antikörper. Darum wurden keine pharmakokinetischen Interaktionsstudien durchgeführt. Da monoklonale Antikörper nicht durch Cytochrom-P450-(CYP)-Enzyme oder andere Arzneimittel metabolisierende Enzyme metabolisiert werden, wird nicht erwartet, dass die Hemmung oder Induktion dieser Enzyme durch gleichzeitig verabreichte Arzneimittel die Pharmakokinetik von OPDIVO beeinträchtigt. Kortikosteroide Die Verwendung von systemischen Kortikosteroiden und anderen Immunsuppressiva vor Beginn (Baseline) der Behandlung mit OPDIVO sollte wegen ihrer möglichen Interferenz mit der pharmakodynamischen Aktivität vermieden werden. Systemische Kortikosteroide und andere Immunsuppressiva können jedoch nach Beginn der Therapie mit OPDIVO zur Behandlung von immunvermittelten unerwünschten Wirkungen verwendet werden. Die vorläufigen Ergebnisse zeigen, dass die systemische Immunsuppression nach dem Beginn der Behandlung mit OPDIVO das Ansprechen auf OPDIVO nicht zu beeinträchtigen scheint. 15
16 Spezielle Patientenpopulationen und Anwendungshinweise Ältere Patienten Für ältere Patienten ( 65 Jahre) ist keine Dosisanpassung erforderlich. Patienten mit Nierenfunktionsstörung Basierend auf Ergebnissen der Populationspharmakokinetik (Populations-PK) ist bei Patienten mit leichter oder moderater Nierenfunktionsstörung keine Dosisanpassung erforderlich. Die Datenlage bei Patienten mit schwerer Nierenfunktionsstörung ist zu begrenzt, um Schlussfolgerungen bei dieser Population ziehen zu können. Patienten mit Leberfunktionsstörung Basierend auf Ergebnissen der Populations- PK ist bei Patienten mit leichter Leberfunktionsstörung keine Dosisanpassung erforderlich. OPDIVO muss bei Patienten mit moderater Leberfunktionsstörung (Gesamtbilirubin > 1,5 bis 3 die Obergrenze des Normalwerts [ULN] und jegliche AST) oder schwerer Leberfunktionsstörung (Gesamtbilirubin > 3 ULN und jegliche AST) mit Vorsicht verabreicht werden. 16
17 Schwangerschaft Zur Anwendung von Nivolumab bei schwangeren Frauen liegen keine Daten vor. Während der Schwangerschaft und bei gebärfähigen Frauen, die keine wirksame Empfängnisverhütung verwenden, darf OPDIVO nicht verabreicht werden, es sei denn, dies ist eindeutig erforderlich. Patientinnen sollen angewiesen werden, für mindestens 5 Monate nach der letzten Gabe von OPDIVO wirksame Verhütungsmethoden anzuwenden. Stillzeit Es ist nicht bekannt, ob OPDIVO in die menschliche Muttermilch übergeht. Da viele Medikamente, darunter Antikörper, in die Muttermilch ausgeschieden werden, kann ein Risiko für das Neugeborene/ Kleinkind nicht ausgeschlossen werden. Der Nutzen des Stillens für das Kind und der Nutzen der Behandlung für die Mutter sind gegeneinander abzuwägen und es muss entschieden werden, ob das Stillen oder die Behandlung mit OPDIVO beendet wird. Wirkung auf Fahrtüchtigkeit und das Bedienen von Maschinen Basierend auf seinen pharmakodynamischen Eigenschaften ist es unwahrscheinlich, dass OPDIVO die Fahrtüchtigkeit und die Fähigkeit zum Bedienen von Maschinen beeinträchtigt. Aufgrund möglicher unerwünschter Wirkungen wie Müdigkeit sollten die Patienten angewiesen werden, beim Fahren oder Bedienen von Maschinen vorsichtig zu sein, bis sie sicher sind, dass Nivolumab ihre Fähigkeiten nicht beeinträchtigt. 17
18 Infusionsverabreichung und Prämedikation Aus klinischer Perspektive ist es sinnvoll, die Vitalzeichen des Patienten zu überprüfen, dies ist aber nach Empfehlungen laut Fachinformation offiziell nicht notwendig. Eine Prämedikation ist generell nicht nötig (ausser bei Überempfindlichkeitsreaktionen, siehe unten). Nivolumab wird am häufigsten mit immunvermittelten unerwünschten Wirkungen (iraes) assoziiert. Die meisten davon, einschliesslich schwerer unerwünschter Wirkungen, verschwanden nach Einleitung einer entsprechenden Therapie oder Absetzen von Nivolumab. Das mediane Auftreten der iraes lag zwischen 1,4 und 3,0 Monaten. 1 Überempfindlichkeitsreaktionen/Infusionsreaktionen einschliesslich anaphylaktischer Reaktion traten bei 3,8 % aller Patienten auf (1,5 % Grad 2, 0,2 % Grad 3 und < 0,1 % Grad 4). Im Fall einer schweren Infusionsreaktion muss die Nivolumab-Infusion abgebrochen werden und eine geeignete medizinische Behandlung erfolgen. Patienten mit einer leichten oder mittelschweren Infusionsreaktion können Nivolumab erhalten, vorausgesetzt sie werden engmaschig überwacht und erhalten eine Prämedikation gemäss lokalen Richtlinien zur Vorbeugung von Infusionsreaktionen. Daher sollte der Patient während der Infusion unter Beobachtung stehen, eine Beobachtungsdauer nach der Infusion ist jedoch nicht vorgeschrieben. Patienten sollten die Patientenkarte erhalten, um über mögliche iraes aufgeklärt zu sein. 18
19 Konzentrat zur Herstellung einer Infusionslösung 10 mg/ml OPDIVO Management Guide Immunvermittelte Nebenwirkungen (iraes) 19 Immunvermittelte Nebenwirkungen
20
21 Empfehlungen für das Management immunvermittelter Nebenwirkungen 1 Die Therapie mit OPDIVO kann mit entzündlichen Nebenwirkungen einhergehen, die durch eine erhöhte bzw. übermässige Aktivität des Immunsystems bedingt sind (immunvermittelte Nebenwirkungen) und wahrscheinlich mit seinem Wirkmechanismus in Verbindung stehen. Von immunvermittelten Nebenwirkungen, die u. U. schwer ausgeprägt oder lebensbedrohlich sind, können Lunge, Magen-Darm-Trakt, Leber, Nieren, endokrine Systeme, Haut und andere Organsysteme betroffen sein. Die Patienten sollten kontinuierlich überwacht werden, da eine unerwünschte Wirkung von Nivolumab jederzeit während oder nach dem Absetzen einer Nivolumab-Therapie auftreten kann. Solange keine anderen Ursachen festzustellen sind, haben Anzeichen und Symptome, die auf immunvermittelte Nebenwirkungen hindeuten (Atemnot, Husten, Durchfall, häufigerer Stuhlgang, Blut im Stuhl, erhöhte Leberfunktionswerte, Endokrinopathie und Hautausschlag), als entzündlich und durch OPDIVO bedingt zu gelten. Eine frühzeitige Diagnose und eine geeignete Behandlung sind wesentlich, um lebensbedrohliche Komplikationen zu vermeiden. Für die Behandlung schwerer immunvermittelter Nebenwirkungen kann systemisches, hochdosiertes Kortikosteroid mit oder ohne zusätzliche immunsuppressive Therapie erforderlich sein. Wenn eine Immunsuppression mit Kortikosteroiden zur Behandlung von Nebenwirkungen eingesetzt wird, sollte nach der Besserung das Ausschleichen über mindestens einen Monat eingeleitet werden. Die vorliegenden Empfehlungen für das Management OPDIVO -spezifischer immunvermittelter Nebenwirkungen sollen zu einer frühzeitigen Diagnose und zum geeigneten Management beitragen und sind von entscheidender Bedeutung, um lebensbedrohliche Komplikationen möglichst zu vermeiden. Angehörige von Gesundheitsberufen sind aufgefordert, Nebenwirkungen zu melden. 21
22 Verwendung dieses Leitfadens Immunvermittelte Nebenwirkungen können jedes Organsystem betreffen. Auf Seite 24 befindet sich eine schematische Darstellung des Körpers und der am häufigsten betroffenen Organsysteme (z. B. Lunge, Magen-Darm-Trakt, Haut). Die Seiten sind nach Organsystemen geordnet und enthalten Hinweise für ein geeignetes Management der jeweiligen Nebenwirkungen. In der Fachinformation zu OPDIVO finden Sie eine umfassende Beschreibung dieser und anderer Risiken. 22
23 Management immunvermittelter Nebenwirkungen Richtig und zeitnah behandelt sind die durch OPDIVO bedingten Nebenwirkungen in der Regel gut beherrschbar. Folgende Empfehlungen zum Nebenwirkungsmanagement sind allgemeiner Natur. Zur Behandlung organspezifischer immunvermittelter Nebenwirkungen wird auf die Fachinformation verwiesen. Grad 1 Grad 2 Grad 3 und 4 In der Regel symptomatisch behandeln In der Regel ist eine Behandlung mit oralen Kortikosteroiden angezeigt OPDIVO aufschieben, bis sich die Symptome zurückgebildet haben und die Behandlung mit Kortikosteroiden beendet ist In der Regel intravenös mit Kortikosteroiden behandeln; nach Besserung der Symptome sollte das Ausschleichen der Kortikosteroide über mindestens einen Monat eingeleitet werden Wenn es trotz Kortikosteroidtherapie zu einer Verschlechterung oder keiner Besserung kommt, sollten zusätzlich nicht-steroidale Immunsuppressiva gegeben werden Grad 3: OPDIVO aufschieben oder dauerhaft absetzen Grad 4: OPDIVO dauerhaft absetzen Geben Sie die Patientenkarte an Ihre Patienten weiter, damit diese über die folgenden Punkte informiert sind: Auf welche Symptome sie achten sollten Warum es wichtig ist, auftretende Symptome sofort Ihnen als behandelndem Arzt zu melden Warum es wichtig ist, dass Patienten nicht versuchen, Symptome ohne vorherige Rücksprache mit Ihnen als Arzt selbst zu behandeln Im Falle einer immunvermittelten Nebenwirkung: Beachten Sie die Empfehlungen für das Management immunvermittelter Nebenwirkungen bei OPDIVO und die Fachinformation zu OPDIVO Weisen Sie die Patienten darauf hin, Sie als behandelnden Arzt bei neuen, persistierenden oder sich verschlechternden Symptomen sofort zu informieren Richtlinien zum dauerhaften Absetzen oder Aufschieben von Dosen finden sich in der Fachinformation. OPDIVO sollte auch dauerhaft abgesetzt werden bei immunvermittelten Nebenwirkungen vom Grad 2 oder 3, die trotz Behandlungsmodifikation persistieren, oder wenn die Kortikosteroiddosis nicht auf 10 mg Prednison oder Äquivalent reduziert werden kann. OPDIVO muss bei jeder schweren wiederauftretenden immunvermittelten Nebenwirkung und bei jeder lebensbedrohlichen immunvermittelten Nebenwirkung dauerhaft abgesetzt werden. Durch ein schnelles und konsequentes Eingreifen sind die Nebenwirkungen in der Regel gut beherrschbar. 23
24 Immunvermittelte Nebenwirkungen 1 Mit Hilfe des Registers finden Sie den entsprechenden Abschnitt der Management-Empfehlungen. Atemwege SIEHE SEITE 27 Anzeichen und Symptome wie z. B.: Atemnot Husten Leber SIEHE SEITE 33 Anzeichen wie z. B.: Erhöhung der Leberwerte (z. B. AST, ALT oder Gesamtbilirubin) Magen-Darm-Trakt SIEHE SEITE 39 Anzeichen und Symptome wie z. B.: Durchfall Bauchschmerzen Blut im Stuhl Endokrines System SIEHE SEITE 45 Anzeichen und Symptome wie z. B.: Müdigkeit Kopfschmerzen Veränderungen der psychischen Verfassung Auffällige Ergebnisse bei Schilddrüsen-Funktionstests und/oder Serumchemie Nieren SIEHE SEITE 51 Symptome wie z. B.: Blut im Urin Erhöhtes Serumkreatinin Verminderte Urinmenge Haut SIEHE SEITE 57 Symptome wie z. B.: Juckreiz Hautausschlag Sonstige Nebenwirkungen 1 Weitere, vermutlich immunvermittelte Neben wirkungen bei Patienten, die mit OPDIVO behandelt wurden, entnehmen Sie bitte der Fachinformation. 24 Weitere Informationen finden Sie in der Fachinformation zu OPDIVO.
25 Zeitliches Auftreten von immunvermittelten Nebenwirkungen Diese Darstellung zeigt eine gepoolte Analyse aus zwei klinischen Studien mit Nivolumab (CheckMate-063 und CheckMate-017). 3 Immunvermittelte Nebenwirkungen können jederzeit während der Behandlung auftreten. ANZAHL PATIENTEN MIT ERSTEM NEBENWIRKUNGSEREIGNIS JE KATEGORIE a Patienten in Studie Patienten in Behandlung Patienten mit erstem Nebenwirkungsereignis 0 3 > 3 6 > 6 12 > MONATE Haut Magen-Darm-Trakt Atemwege b Endokrines System Niere Infusionsreaktionen Leber Bei der Mehrheit der Patienten traten die immunvermittelten Nebenwirkungen unter OPDIVO innerhalb der ersten drei Behandlungsmonate auf. a Je angegebenem Zeitraum wurden Patienten mit 1 Nebenwirkungsereignis nur einmal je Kategorie gezählt, konnten aber zugleich mehreren Kategorien zugeordnet werden. b Schliesst eine Pneumonitis vom Grad 3 aus (CheckMate-017), die nach Abschluss der Datenerfassung als therapiebedingt eingestuft wurde. 25
26 Notizen 26
27 Atemwege Konzentrat zur Herstellung einer Infusionslösung 10 mg/ml OPDIVO Management Guide Immunvermittelte Nebenwirkungen (iraes) Atemwege 27
28
29 Lunge Immunvermittelte Pneumonitis 1 Unter der Behandlung mit OPDIVO wurden Fälle schwerer Pneumonitis oder interstitieller Lungenerkrankung auch mit tödlichem Verlauf beobachtet. Fordern Sie Ihre Patienten auf, sich bei Anzeichen und Symptomen wie Brustschmerzen, Husten oder Atemnot sofort zu melden. Patienten sollten auf Anzeichen und Symptome einer Pneumonitis wie beispielsweise radiologische Veränderungen, Dyspnoe und Hypoxie überwacht werden. Eine mögliche Infektion und krankheitsbedingte Ursachen sollten ausgeschlossen werden. OPDIVO ist dauerhaft abzusetzen bei einer Pneumonitis Grad 3 oder 4. Eine Behandlung mit Kortikosteroiden in einer Dosis von 2 bis 4 mg/kg/tag Methylprednisolon- Äquivalent sollte eingeleitet werden. OPDIVO ist aufzuschieben bei einer Pneumonitis Grad 2. Eine Behandlung mit Kortikosteroiden in einer Dosis von 1 mg/kg/tag Methylprednisolon-Äquivalent sollte eingeleitet werden. Weitere Informationen finden Sie in der Fachinformation zu OPDIVO. 29
30 Lunge Pneumonitis Zeichen und Symptome Atembeschwerden oder Husten Radiologische Veränderungen (z. B. fokale milchglasartige Verschattungen, fleckförmige Infiltrate) Dyspnoe Hypoxie Infektiöse und krankheitsbedingte Ätiologien sind auszuschliessen. 30 Weitere Informationen finden Sie in der Fachinformation zu OPDIVO.
31 Grad* der Pneumonitis Handhabung 1, 4, 5 1, 4, 5 Follow-up Grad 1 Nur radiologische Veränderungen OPDIVO eventuell aufschieben Alle 2 3 Tage auf Symptome hin kontrollieren Ggf. Pneumologen oder Infektiologen konsultieren Erneute Bildgebung mindestens alle 3 Wochen Bei Verbesserung: OPDIVO bei Aufschub wiederaufnehmen Bei Verschlechterung: Wie Grad 2 oder 3 4 behandeln Grad 2 Leichte bis mittelschwere neue Symptome wie Dyspnoe, Hypoxie, Husten, Brustschmerz OPDIVO aufschieben Pneumologen und Infektiologen konsultieren Symptome täglich kontrollieren 1,0 mg/kg/tag Methylprednisolon oder Äquivalent Ggf. prophylaktisch Antibiotika verabreichen Eventuell Bronchoskopie/Lungenbiopsie Alle 1 3 Tage erneute Bildgebung Bei Symptomrückbildung und radiologischer Befundverbesserung: Steroide über mindestens einen Monat lang ausschleichen; anschliessend OPDIVO wiederaufnehmen Bei keiner Verbesserung nach 2 Wochen oder Verschlechterung: Wie Grad 3 4 behandeln Grad 3 4 Schwere neue Symptome; neue/sich verschlechternde Hypoxie; lebensbedrohlich OPDIVO dauerhaft absetzen Stationär behandeln Pneumologen und Infektiologen konsultieren 2 4 mg/kg/tag Methylprednisolon oder Äquivalent Ggf. prophylaktisch Antibiotika verabreichen Eventuell Bronchoskopie/Lungenbiopsie Bei Verbesserung auf Ausgangsniveau: Steroide über mindestens einen Monat lang ausschleichen Bei keiner Verbesserung oder Verschlechterung nach 48 Stunden: Ggf. zusätzliche Immunsuppression Bildgebende Verfahren sind einzusetzen und ein Pneumologe ist zu konsultieren. OPDIVO fortführen OPDIVO aufschieben OPDIVO dauerhaft absetzen * Die Toxizitätsgrade entsprechen den Kriterien des nationalen Krebsinstituts der USA (National Cancer Institute Common Terminology Criteria for Adverse Effects), Version
32 Notizen 32
33 Konzentrat zur Herstellung einer Infusionslösung 10 mg/ml Leber OPDIVO Management Guide Immunvermittelte Nebenwirkungen (iraes) Leber 33
34
35 Leber Immunvermittelte Hepatitis 1 Unter Behandlung mit OPDIVO wurden Fälle schwerer Hepatitis beobachtet. Patienten müssen auf Zeichen und Symptome von Hepatitis wie Erhöhungen der Transaminase- und Gesamtbilirubinwerte überwacht werden. OPDIVO ist bei Leberwerterhöhung von Grad 3 4 dauerhaft abzusetzen. Eine Behandlung mit Kortikosteroiden in einer Dosis von 1 bis 2 mg/kg/tag Methylprednisolon-Äquivalent sollte eingeleitet werden. OPDIVO ist bei Leberwerterhöhungen von Grad 2 aufzuschieben. Anhaltende Erhöhungen dieser Laborwerte sollten mit Kortikosteroiden in einer Dosis von 0,5 bis 1 mg/kg/tag Methylprednisolon-Äquivalent behandelt werden. Weitere Informationen finden Sie in der Fachinformation zu OPDIVO. 35
36 Leber Hepatotoxizität Zeichen und Symptome Veränderungen der Laborwerte wie z. B.: 1 Erhöhung der Transaminasewerte Erhöhung der Gesamtbilirubinwerte Gelbfärbung von Augen oder Haut (Gelbsucht) Schmerzen rechts von der Magengegend Müdigkeit Infektiöse und krankheitsbedingte Ätiologien sind auszuschliessen. 36 Weitere Informationen finden Sie in der Fachinformation zu OPDIVO.
37 Grad* der Leberwerterhöhung Handhabung 1, 4, 5 1, 4, 5 Follow-up Grad 1 AST oder ALT > ULN 3 ULN und/oder Gesamtbilirubin > 1,5 ULN OPDIVO fortsetzen Auf Zeichen von Hepatitis kontrollieren: Transaminasen, Bilirubin, Gelbfärbung von Skleren oder Haut, dunkler Urin, Schmerz im Magenbereich rechts, Übelkeit, Erbrechen, Müdigkeit, Blutung Regelmässige Kontrolle der Leberwerte Bei Verschlechterung: Wie Grad 2 oder 3 4 behandeln Grad 2 AST oder ALT > 3 bis 5 ULN und/oder Gesamtbilirubin > 1,5 bis 3 ULN OPDIVO aufschieben Häufigkeit der Kontrolle auf alle 3 Tage erhöhen Bei Persistenz: 0,5 1,0 mg/kg/tag Methylprednisolon oder Äquivalent Ggf. prophylaktisch Antibiotika verabreichen Bei Verbesserung der Leberwerte auf Grad 1 oder Rückkehr zum Ausgangswert: Bei Steroidgabe Steroide über mindestens einen Monat lang ausschleichen; OPDIVO wiederaufnehmen; Laborwerte kontrollieren Bei Persistenz oder Verschlechterung: 1,0 2,0 mg/kg/tag Methylprednisolon oder Äquivalent; OPDIVO abbrechen Bei weiterer Verschlechterung: Wie Grad 3 4 behandeln Grad 3 4 AST oder ALT > 5 ULN und/oder Gesamtbilirubin > 3 ULN OPDIVO dauerhaft absetzen Häufigkeit der Kontrolle auf alle 1 2 Tage erhöhen 1,0 2,0 mg/kg/tag Methylprednisolon oder Äquivalent Ggf. prophylaktisch Antibiotika verabreichen Gastroenterologen konsultieren Bei Rückkehr zu Grad 2: Steroide über mindestens einen Monat lang allmählich reduzieren Bei fehlender Verbesserung in > 3 5 Tagen, Verschlechterung oder Rebound-Effekten: Ggf. zusätzliche Immunsuppression (z. B. Mycophenolat-Mofetil) Eine mögliche Obstruktion/Tumorprogression ist ggf. mit bildgebenden Verfahren auszuschliessen. OPDIVO fortführen OPDIVO aufschieben OPDIVO dauerhaft absetzen * Die Toxizitätsgrade entsprechen den Kriterien des nationalen Krebsinstituts der USA (National Cancer Institute Common Terminology Criteria for Adverse Effects), Version
38 Notizen 38
39 Konzentrat zur Herstellung einer Infusionslösung 10 mg/ml Magen-Darm-Trakt OPDIVO Management Guide Immunvermittelte Nebenwirkungen (iraes) Magen-Darm-Trakt 39
40
41 Magen-Darm-Trakt Immunvermittelte Kolitis 1 Unter der Behandlung mit OPDIVO wurden Fälle von schwerer Diarrhö oder Kolitis beobachtet. Weisen Sie Ihre Patienten darauf hin, dass sie Veränderungen beim Stuhlgang sofort melden müssen. Überwachen Sie die Patienten im Hinblick auf gastrointestinale Symptome wie Bauchschmerzen und Schleim oder Blut im Stuhl, die auf immunvermittelte Kolitis hindeuten können. Die klinische Symptomatik kann Durchfall, erhöhte Häufigkeit des Stuhlgangs, Bauchschmerzen oder Hämatochezie, mit oder ohne Fieber, umfassen. Schieben Sie OPDIVO auf bei Patienten mit mittelschwerem Durchfall oder Kolitis, die persistieren (> 5 Tage) oder wiederkehren. Eine Behandlung mit Kortikosteroiden in einer Dosis von 1 bis 2 mg/kg/tag Methylprednisolon-Äquivalent sollte eingeleitet werden. Setzen Sie OPDIVO dauerhaft ab bei Patienten mit schweren Symptomen (Bauchschmerzen, schwerer Durchfall, signifikante Veränderung in der Anzahl der Stuhlgänge, Blut im Stuhl, gastrointestinale Blutungen, gastrointestinale Perforation). Eine Behandlung mit Kortikosteroiden in einer Dosis von 1 bis 2 mg/kg/tag Methylprednisolon- Äquivalent sollte eingeleitet werden. Weitere Informationen finden Sie in der Fachinformation zu OPDIVO. 41
42 Magen-Darm-Trakt Durchfall und Kolitis Zeichen und Symptome Wässriger, dünner oder weicher Stuhl Bauchschmerzen Schleim oder Blut im Stuhl Infektiöse und krankheitsbedingte Ätiologien sind auszuschliessen. 42 Weitere Informationen finden Sie in der Fachinformation zu OPDIVO.
43 Grad* der Diarrhö/Kolitis Handhabung 1, 4, 5 1, 4, 5 Follow-up Grad 1 Diarrhö: < 4 zusätzliche Stuhlgänge pro Tag im Vergleich zum Ausgangswert Kolitis: asymptomatisch OPDIVO fortsetzen Symptomatische Behandlung Engmaschige Überwachung bei Symptomverschlechterung Die Patienten sind anzuweisen, sich bei Symptomverschlechterung sofort zu melden Bei Verschlechterung: Wie Grad 2 oder 3 4 behandeln Grad 2 Diarrhö: 4 6 zusätzliche Stuhlgänge pro Tag im Vergleich zum Ausgangswert; i.v. Flüssigkeit indiziert < 24 Std.; keine Beeinträchtigung von Aktivitäten des täglichen Lebens Kolitis: Bauchschmerz; Blut im Stuhl OPDIVO aufschieben Symptomatische Behandlung Bei Persistenz: 0,5 1,0 mg/kg/tag Methylprednisolon oder Äquivalent Ggf. prophylaktisch Antibiotika verabreichen (G2 und G3) Bei Verbesserung: Bei Steroidgabe Steroide über mindestens einen Monat lang ausschleichen; OPDIVO wiederaufnehmen Bei Persistenz oder Verschlechterung unter Steroidgabe: Methylprednisolon auf 1,0 2,0 mg/kg/tag oder Äquivalent erhöhen; OPDIVO abbrechen Grad 3 Diarrhö: 7 zusätzliche Stuhlgänge pro Tag im Vergleich zum Ausgangswert; Inkontinenz; i.v. Flüssigkeit indiziert 24 Std.; Beeinträchtigung von Aktivitäten des täglichen Lebens Kolitis: starker Bauchschmerz; medizinischer Eingriff indiziert, peritoneale Zeichen OPDIVO aufschieben 1,0 2,0 mg/kg/tag Methylprednisolon oder Äquivalent Ggf. prophylaktisch Antibiotika verabreichen Bei Verbesserung: Steroide über mindestens einen Monat lang ausschleichen OPDIVO wiederaufnehmen Bei Persistenz oder Verschlechterung unter Steroidgabe: OPDIVO dauerhaft absetzen Grad 4 Kolitis: lebensbedrohlich; Perforation OPDIVO dauerhaft absetzen 1,0 2,0 mg/kg/tag Methylprednisolon oder Äquivalent Ggf. prophylaktisch Antibiotika verabreichen Eventuell untere Endoskopie durchführen Bei Verbesserung: Steroide bis Grad 1, anschliessend über mindestens einen Monat ausschleichen Bei Persistenz > 3 5 Tage oder Rekurrenz nach Verbesserung: Zusätzliche Immunsuppression OPDIVO fortführen OPDIVO aufschieben OPDIVO dauerhaft absetzen * Die Toxizitätsgrade entsprechen den Kriterien des nationalen Krebsinstituts der USA (National Cancer Institute Common Terminology Criteria for Adverse Effects), Version
44 Notizen 44
45 Konzentrat zur Herstellung einer Infusionslösung 10 mg/ml Endokrines System OPDIVO Management Guide Immunvermittelte Nebenwirkungen (iraes) Endokrines System 45
46
47 Endokrines System Immunvermittelte Endokrinopathien 1 Unter der Behandlung mit OPDIVO wurden schwere Endokrinopathien, einschliesslich Hypothyreose, Hyperthyreose, Nebenniereninsuffizienz, Hypophysitis, Diabetes mellitus und diabetische Ketoazidose beobachtet. Patienten sind auf Zeichen und Symptome von Endokrinopathien (siehe nächste Seite) zu überwachen. Fordern Sie Ihre Patienten auf, Ihnen Symptome wie Müdigkeit, Kopfschmerzen, Veränderungen des psychischen Zustandes, Bauchschmerzen, veränderte Stuhlgewohnheiten und Hypotonie sofort mitzuteilen. OPDIVO muss aufgeschoben werden, wenn die Bildgebung der Hypophyse oder Labor untersuchungen der endokrinen Funktion keine normalen Ergebnisse liefern. Eventuell ist eine Kortikosteroid-Therapie und/oder langfristige Hormonersatztherapie erforderlich. Weitere Informationen finden Sie in der Fachinformation zu OPDIVO. 47
48 Endokrines System Endokrinopathien Zeichen und Symptome Müdigkeit Gewichtsveränderung Kopfschmerzen Psychische Veränderungen Bauchschmerzen Veränderter oder ungewöhnlicher Stuhlgang Hypotonie Sehstörungen Übermässiger Durst Deutlich erhöhte Urinmenge Gesteigerter Appetit gepaart mit Gewichtsverlust Gefühl von Benommenheit, Schwäche, depressiver Verstimmung, Reizbarkeit, generelles Unwohlsein und andere unspezifische Symptome 48 Weitere Informationen finden Sie in der Fachinformation zu OPDIVO.
49 Asymptomatische TSH-Erhöhung OPDIVO fortsetzen Wenn TSH < 0,5 LLN oder TSH > 2 ULN oder bei 2 aufeinander folgenden Messungen durchgängig ausserhalb des Bereichs: in aufeinander folgenden Zyklen je nach klinischer Indikation ft4-bestimmung ergänzen; ggf. Endokrinologen konsultieren Symptomatische Endokrinopathie (Hypo-/Hyperthyreose, akute Thyreoiditis, Nebenniereninsuffizenz, Hypophysitis, Diabetes) Bei Symptomen wie Müdigkeit, Gewichtsveränderungen, Kopfschmerzen: endokrine Funktion untersuchen Bei symptomatischer Hyperthyreose Thyreostatika erwägen Bei symptomatischem Diabetes ggf. Insulintherapie beginnen; bei symptomat. Hypophysitis Hormonersatztherapie starten Ggf. Darstellung der Hypophyse durchführen Bei Symptomen und auffälligen Laborwerten / auffälliger Hypophysendarstellung, bei akuter Thyreoiditis, Hypophysitis (Grad 2 3): OPDIVO aufschieben 1,0 2,0 mg/kg/tag Methylprednisolon oder Äquivalent Geeignete Hormontherapie einleiten Laborwerte oder Hypophysen-MRT unauffällig, jedoch persistierende Symptome: Laborwerte in 1 3 Wochen / MRT in einem Monat wiederholen Bei Verbesserung (mit oder ohne Hormonersatz): Steroide über mindestens einen Monat lang allmählich ausschleichen OPDIVO wiederaufnehmen begleitend zur Hormonersatztherapie, sofern keine Symptome auftreten Patienten mit Nebenniereninsuffizienz: ggf. weiterhin Steroide mit mineralokortikoider Komponente mit Kontrolle der Nebennierenfunktion und Hormonspiegel Blutzuckerspiegel weiterhin überwachen Schilddrüsenfunktion weiter kontrollieren Bei einer lebensbedrohlichen (Grad 4) Nebenniereninsuffizienz oder Hypophysitis: OPDIVO dauerhaft absetzen Bei Verdacht auf adrenale Krise (z. B. schwere Dehydrierung; Hypotonie; Schock, der nicht dem aktuellen Krankheitszustand entspricht) OPDIVO aufschieben Sepsis ausschliessen Stresstest mit i.v. Steroiden mit mineralokortikoider Aktivität I.v. Flüssigkeitsgabe Endokrinologen konsultieren Nach Ausschluss einer adrenalen Krise wie symptomatische Endokrinopathie behandeln (siehe oben) Eine Gesichtsfeldtestung, ein endokrinologisches Konsil und bildgebende Verfahren sind zu erwägen. OPDIVO fortführen OPDIVO aufschieben OPDIVO dauerhaft absetzen 49
50 Notizen 50
51 Konzentrat zur Herstellung einer Infusionslösung 10 mg/ml OPDIVO Management Guide Nieren Immunvermittelte Nebenwirkungen (iraes) Nieren 51
52
53 Nieren Immunvermittelte Nephritis und Nierenfunktionsstörung 1 Unter der Behandlung mit OPDIVO wurden Fälle von schwerer Nephritis oder Nierenfunktionsstörung beobachtet. Fordern Sie Ihre Patienten auf, Anzeichen von Nierenproblemen sofort zu melden. Die Patienten sind auf Anzeichen und Symptome einer Nephritis und Nierenfunktionsstörung zu überwachen. OPDIVO ist dauerhaft abzusetzen bei Patienten mit einer Kreatininerhöhung im Serum von Grad 4. Eine Behandlung mit Kortikosteroiden in einer Dosis von 1 bis 2 mg/kg/tag Methylprednisolon-Äquivalent sollte eingeleitet werden. OPDIVO ist aufzuschieben bei Patienten mit einer Kreatininerhöhung im Serum von Grad 2 3. Eine Behandlung mit Kortikosteroiden in einer Dosis von 0,5 bis 1 mg/kg/tag Methylprednisolon-Äquivalent sollte eingeleitet werden. Weitere Informationen finden Sie in der Fachinformation zu OPDIVO. 53
54 Nieren Nephrotoxizität Zeichen und Symptome Asymptomatischer Anstieg von Serumkreatinin Andere anomale Nierenfunktionstests Verminderte Urinmenge Krankheitsbedingte Ätiologien sind auszuschliessen. 54 Weitere Informationen finden Sie in der Fachinformation zu OPDIVO.
55 Grad* der Kreatininerhöhung Handhabung 1, 4, 5 1, 4, 5 Follow-up Grad 1 Kreatinin > ULN und > als Ausgangswert, jedoch 1,5 Ausgangswert OPDIVO fortsetzen Kreatinin wöchentlich kontrollieren Zeichen renaler Dysfunktion kontrollieren: Kreatininanstieg, Urinabnahme, Blut im Urin, Knöchelschwellung, Appetitlosigkeit Bei Rückkehr zum Ausgangswert: Routinemässige Kreatininkontrolle wiederaufnehmen Grad 2 3 Kreatinin > 1,5 als Ausgangswert bis 6 ULN OPDIVO aufschieben Kreatinin alle 2 3 Tage kontrollieren 0,5 1,0 mg/kg/tag Methylprednisolon oder Äquivalent Ggf. prophylaktisch Antibiotika geben Eventuell Nierenbiopsie durchführen Bei Rückkehr zu Grad 1: Steroide über mindestens einen Monat lang ausschleichen; OPDIVO sowie routinemässige Kreatininkontrolle wiederaufnehmen Wenn erhöhte Werte > 7 Tage persistieren oder sich verschlechtern: 1,0 2,0 mg/kg/tag Methylprednisolon oder Äquivalent OPDIVO dauerhaft absetzen Grad 4 Kreatinin > 6 ULN OPDIVO dauerhaft absetzen Kreatinin täglich kontrollieren 1,0 2,0 mg/kg/tag Methylprednisolon oder Äquivalent Ggf. prophylaktisch Antibiotika geben Nephrologen konsultieren Eventuell Nierenbiopsie durchführen Bei Rückkehr zu Grad 1: Steroide über mindestens einen Monat lang ausschleichen Bei Persistenz oder Verschlechterung unter Steroiden: Ggf. zusätzliche Immunsuppression OPDIVO fortführen OPDIVO aufschieben OPDIVO dauerhaft absetzen * Die Toxizitätsgrade entsprechen den Kriterien des nationalen Krebsinstituts der USA (National Cancer Institute Common Terminology Criteria for Adverse Effects), Version
56 Notizen 56
57 Konzentrat zur Herstellung einer Infusionslösung 10 mg/ml OPDIVO Management Guide Immunvermittelte Nebenwirkungen (iraes) Haut 57 Haut
58
59 Haut Immunvermittelter Hautausschlag 1 OPDIVO kann schwerwiegende Nebenwirkungen im Bereich der Haut auslösen, die immunvermittelt sein können. Fordern Sie Ihre Patienten auf, Ihnen Hautveränderungen mitzuteilen. Von OPDIVO induzierter Rash und Juckreiz sind je nach Schweregrad zu behandeln. Patienten sind auf die häufigsten Erscheinungsformen einer immunvermittelten Dermatitis hin zu überwachen, wie z. B. Rash und Juckreiz. Schwerer Hautausschlag sollte mit hochdosierten Kortikosteroiden in einer Dosis von 1 bis 2 mg/kg/tag Prednison-Äquivalenten behandelt werden. OPDIVO ist unabhängig von der Ursache aufzuschieben bei Patienten mit mittel schwerem bis schwerem Rash (Grad 3) oder ausgedehntem bzw. starkem Juckreiz. OPDIVO ist dauerhaft abzusetzen bei Patienten mit lebensbedrohlichem Rash oder schwerem ausgedehntem Juckreiz, der die Aktivitäten des täglichen Lebens stört oder eine medizinische Intervention erfordert (Grad 4). Schwerer Hautausschlag sollte mit hochdosierten Kortikosteroiden in einer Dosis von 1 bis 2 mg/kg/tag Prednison- Äquivalenten behandelt werden. Weitere Informationen finden Sie in der Fachinformation zu OPDIVO. 59
60 Haut Hautausschlag ist ein übergeordneter Begriff und kann sich beziehen auf: makulopapulösen Ausschlag vesikulären Ausschlag erythematösen Ausschlag Dermatitis juckenden Ausschlag akneiforme Dermatitis follikulären Ausschlag allergische Dermatitis makulären Ausschlag exfoliative Dermatitis papulösen Ausschlag pustulösen Ausschlag Hautentzündung, die zu Hautausschlag und Juckreiz führen kann 60 Weitere Informationen finden Sie in der Fachinformation zu OPDIVO.
61 1, 4, 5 Grad* der Hautveränderungen Handhabung 1, 4, 5 Follow-up Grad % der Körperoberfläche betroffen OPDIVO fortsetzen Bei Verschlechterung: Wie Grad 3 behandeln Grad 3 4 > 30 % der Körperoberfläche betroffen; lebensbedrohliche Folgen OPDIVO aufschieben (Grad 3) bzw. dauerhaft absetzen (Grad 4) Bei schwerem Hautausschlag: 1,0 2,0 mg/kg/tag Methylprednisolon oder Äquivalent Bei Verbesserung (Grad 3): Bei Steroidgabe Steroide über mindestens einen Monat ausschleichen; OPDIVO wiederaufnehmen Bei Persistenz oder Verschlechterung (Grad 3): 1,0 2,0 mg/kg/tag Methylprednisolon oder Äquivalent OPDIVO dauerhaft absetzen Vorsicht ist geboten, wenn für einen Patienten, der zuvor bei Behandlung mit anderen immunstimulierenden Krebsmedikamenten eine schwere oder lebensbedrohliche Hautreaktion erlitten hat, die Anwendung mit Nivolumab erwogen wird. OPDIVO fortführen OPDIVO aufschieben OPDIVO dauerhaft absetzen * Die Toxizitätsgrade entsprechen den Kriterien des nationalen Krebsinstituts der USA (National Cancer Institute Common Terminology Criteria for Adverse Effects), Version
62 OPDIVO (Nivolumab). I: Behandlung von lokal fortgeschrittenem oder metastasiertem nicht-kleinzelligem Lungenkarzinom (NSCLC) nach vorangegangener Chemotherapie. D: Die empfohlene Dosierung von OPDIVO ist 3 mg/kg intravenös verabreicht über 60 Minuten alle 2 Wochen. Die Behandlung sollte so lange fortgesetzt werden, wie ein klinischer Nutzen beobachtet wird oder bis die Behandlung vom Patienten nicht mehr toleriert wird. Eine Dosisreduktion wird nicht empfohlen. Für weitere Informationen zur Dosierung siehe Fachinformation. KI: Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe. W&V: OPDIVO wird mit immunvermittelten unerwünschten Wirkungen in Verbindung gebracht, die wahrscheinlich auf den Wirkungsmechanismus des Präparats zurückzuführen sind. Immunvermittelte Nebenwirkungen, die schwerwiegend bis lebensbedrohlich sein können, können Lunge, Verdauungstrakt, Leber, Haut, Niere, endokrines System oder andere Organsysteme betreffen. Eine systemische hochdosierte Therapie mit Kortikosteroiden zusammen mit oder ohne andere Immunsuppressiva kann für die Behandlung schwerer immunvermittelter Nebenwirkungen erforderlich sein. Spezifische Richtlinien für OPDIVO zur Behandlung von immunvermittelten Nebenwirkungen sind in der Fachinformation beschrieben. Weitere Warnhinweise siehe Fachinformation. UAW: Anaphylaktische Reaktion, infusionsbedingte Reaktion, Hypersensitivität, Hypothyreose, Hyperthyreose, verminderter Appetit, periphere Neuropathie, Kopfschmerzen, Schwindel, verschwommenes Sehen, Hypertonie, Pneumonitis, Atemnot, Husten, Diarrhö, Übelkeit, Stomatitis, Erbrechen, Bauchschmerzen, Verstopfung, Mundtrockenheit, Kolitis, Pankreatitis, Gastritis, Hepatitis, Rash, Pruritus, Vitiligo, trockene Haut, Erythem, Alopezie, toxische epidermale Nekrolyse, Schmerzen im Bewegungsapparat, Arthralgie, tubuläre interstitielle Nephritis, Nierenversagen, Müdigkeit, Pyrexie, Ödeme, erhöhte AST, erhöhte ALT, erhöhte alkalische Phosphatase, erhöhte Lipasewerte, erhöhte Amylase, erhöhtes Kreatinin, Lymphozytopenie, Leukopenie, Thrombozytopenie, Anämie, Hyperkalzämie, Hypokalzämie, Hyperkaliämie, Hypokaliämie, Hypomagnesiämie, Hypo na triämie, erhöhtes Gesamtbilirubin, Neutropenie, Hypermagnesiämie, Hypernatriämie, Gewichtsverlust. DF: 10 mg/ml Konzentrat zur Herstellung einer Infusionslösung, Durchstechflaschen zu 100 mg/10 ml und 40 mg/4 ml. Z: Siehe Fachinformation. ZI: Bristol-Myers Squibb SA, CH-Steinhausen. Stand der Information: November
63 Referenzen 1. OPDIVO -Fachinformation, 2. Wolchok et al., Guidelines for the evaluation of immune therapy activity in solid tumors: immune-related response criteria. Clin Cancer Res 2009; 15: Gettinger et al., Nivolumab Safety Profile: Summary of Findings From Trials in Patients With Advanced Squamous Non-Small Cell Lung Cancer (NSCLC), Poster P346 presented at the 18th ECCO 40th ESMO European Cancer Congress; September 25 29, 2015; Vienna, Austria. 4. Borghaei et al., Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer, N Engl J Med Oct 22; 373(17): and Suppl. 5. Brahmer et al., Nivolumab versus Docetaxel in Advanced Squamous-Cell Non-Small-Cell Lung Cancer, N Engl J Med Jul 9; 373(2): and Suppl. 63
64 Weitere Informationen über OPDIVO erhalten Sie unter für medizinische Informationen unter oder telefonisch unter Bristol-Myers Squibb, 12/ CH15PR Konzentrat zur Herstellung einer Infusionslösung 10 mg/ml
Empfehlungen zur Behandlung von immunvermittelten Nebenwirkungen unter Nivolumab / Nivolumab + Ipilimumab:
 Empfehlungen zur Behandlung von immunvermittelten Nebenwirkungen unter Nivolumab / Nivolumab + Ipilimumab: Allgemeine Vorgehensweise bei immunvermittelten Nebenwirkungen unter Nivolumab / Nivolumab + Ipilimumab
Empfehlungen zur Behandlung von immunvermittelten Nebenwirkungen unter Nivolumab / Nivolumab + Ipilimumab: Allgemeine Vorgehensweise bei immunvermittelten Nebenwirkungen unter Nivolumab / Nivolumab + Ipilimumab
Wichtige Sicherheitsinformationen zur Minimierung des Risikos von immunbedingten Nebenwirkungen
 BAVENCIO (Avelumab) Version 1.6, Juli 2017 Wichtige Sicherheitsinformationen zur Minimierung des Risikos von immunbedingten Nebenwirkungen Patientenpass Dieses Arzneimittel unterliegt einer zusätzlichen
BAVENCIO (Avelumab) Version 1.6, Juli 2017 Wichtige Sicherheitsinformationen zur Minimierung des Risikos von immunbedingten Nebenwirkungen Patientenpass Dieses Arzneimittel unterliegt einer zusätzlichen
YERVOY (Ipilimumab) Informationen zur Risikominimierung für medizinische Fachkräfte Leitfaden für die Anwendung
 Behördlich genehmigtes Schulungsmaterial YERVOY (Ipilimumab) Konzentrat zur Herstellung einer Infusionslösung Informationen zur Risikominimierung für medizinische Fachkräfte Leitfaden für die Anwendung
Behördlich genehmigtes Schulungsmaterial YERVOY (Ipilimumab) Konzentrat zur Herstellung einer Infusionslösung Informationen zur Risikominimierung für medizinische Fachkräfte Leitfaden für die Anwendung
YERVOY (Ipilimumab) Informationen zur Risikominimierung für medizinische Fachkräfte Leitfaden für die Anwendung
 Behördlich genehmigtes Schulungsmaterial YERVOY (Ipilimumab) Konzentrat zur Herstellung einer Infusionslösung Informationen zur Risikominimierung für medizinische Fachkräfte Leitfaden für die Anwendung
Behördlich genehmigtes Schulungsmaterial YERVOY (Ipilimumab) Konzentrat zur Herstellung einer Infusionslösung Informationen zur Risikominimierung für medizinische Fachkräfte Leitfaden für die Anwendung
Ihr Wegweiser zur Therapie mit YERVOY (Ipilimumab)
 Behördlich genehmigtes Schulungsmaterial Ihr Wegweiser zur Therapie mit YERVOY (Ipilimumab) Informationsbroschüre für Patienten Diese Patientenbroschüre zur Anwendung von Ipilimumab wurde als Teil der
Behördlich genehmigtes Schulungsmaterial Ihr Wegweiser zur Therapie mit YERVOY (Ipilimumab) Informationsbroschüre für Patienten Diese Patientenbroschüre zur Anwendung von Ipilimumab wurde als Teil der
Anhang III. Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage
 Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit.
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit.
Ihr Wegweiser zu. Information für Patienten
 Ihr Wegweiser zu Information für Patienten Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Sie können
Ihr Wegweiser zu Information für Patienten Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Sie können
Ihr Wegweiser zu. Information für Patienten
 Ihr Wegweiser zu Information für Patienten Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Sie können
Ihr Wegweiser zu Information für Patienten Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Sie können
Valdoxan (Agomelatin)
 Valdoxan (Agomelatin) Zur Behandlung von Episoden einer Major Depression bei Erwachsenen Informationen für Ärzte Empfehlungen zu: Überprüfung der Leberfunktion (Transaminasenkontrollen) Interaktion mit
Valdoxan (Agomelatin) Zur Behandlung von Episoden einer Major Depression bei Erwachsenen Informationen für Ärzte Empfehlungen zu: Überprüfung der Leberfunktion (Transaminasenkontrollen) Interaktion mit
OPDIVO 10 mg/ml Konzentrat zur Herstellung einer Infusionslösung
 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
OPDIVO 10 mg/ml Konzentrat zur Herstellung einer Infusionslösung.
 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
OPDIVO 10 mg/ml Konzentrat zur Herstellung einer Infusionslösung.
 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
Ihr Wegweiser zur. Therapie mit YERVOY (Ipilimumab)
 Ihr Wegweiser zur Therapie mit YERVOY (Ipilimumab) Informationsbroschüre für Patienten Yervoy unterliegt einer zusätzlichen Überwachung. Dies ermögicht eine schnelle Identifizierung neuer Erkenntnisse
Ihr Wegweiser zur Therapie mit YERVOY (Ipilimumab) Informationsbroschüre für Patienten Yervoy unterliegt einer zusätzlichen Überwachung. Dies ermögicht eine schnelle Identifizierung neuer Erkenntnisse
Ihr Wegweiser zu. Information für Patienten
 behördlich genehmigtes Schulungsmaterial Ihr Wegweiser zu Information für Patienten Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse
behördlich genehmigtes Schulungsmaterial Ihr Wegweiser zu Information für Patienten Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Penstapho 1 g, Pulver und Lösungsmittel zur Herstellung einer Injektionslösung.
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Penstapho 1 g, Pulver und Lösungsmittel zur Herstellung einer Injektionslösung. Natriumoxazillin Monohydrat Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Penstapho 1 g, Pulver und Lösungsmittel zur Herstellung einer Injektionslösung. Natriumoxazillin Monohydrat Lesen Sie die gesamte Packungsbeilage sorgfältig
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS. Arzneimittel nicht länger zugelassen
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit.
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit.
OPDIVO 10 mg/ml Konzentrat zur Herstellung einer Infusionslösung
 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
Leitfaden zur Anwendung und Überwachung
 Leitfaden zur Anwendung und Überwachung Informationen für verordnende Ärzte und das Pflegepersonal August 2016 Dieser Leitfaden zur Anwendung von Micafungin wurde als Teil der Zulassungsauflagen erstellt.
Leitfaden zur Anwendung und Überwachung Informationen für verordnende Ärzte und das Pflegepersonal August 2016 Dieser Leitfaden zur Anwendung von Micafungin wurde als Teil der Zulassungsauflagen erstellt.
Patienteninformation Lamotrigin Desitin 04/2007
 Information für Patientinnen und Patienten Lesen Sie diese Packungsbeilage sorgfältig, bevor Sie das Arzneimittel einnehmen bzw. anwenden. Dieses Arzneimittel ist Ihnen persönlich verschrieben worden und
Information für Patientinnen und Patienten Lesen Sie diese Packungsbeilage sorgfältig, bevor Sie das Arzneimittel einnehmen bzw. anwenden. Dieses Arzneimittel ist Ihnen persönlich verschrieben worden und
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Neurobion 100 mg 100 mg 1 mg / 3 ml Injektionslösung Vitamine B 1 + B 6 + B 12
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Neurobion 100 mg 100 mg 1 mg / 3 ml Injektionslösung Vitamine B 1 + B 6 + B 12 Lesen Sie die gesamte Packungsbeilage sorgfältig durch bevor Sie mit der Anwendung
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Neurobion 100 mg 100 mg 1 mg / 3 ml Injektionslösung Vitamine B 1 + B 6 + B 12 Lesen Sie die gesamte Packungsbeilage sorgfältig durch bevor Sie mit der Anwendung
PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Basistherapie mit Abatacept
 PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Basistherapie mit Abatacept Sehr geehrte Patientin! Sehr geehrter Patient! Sie leiden an einer chronischen Polyarthritis (Rheumatoiden Arthritis). Ihr
PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Basistherapie mit Abatacept Sehr geehrte Patientin! Sehr geehrter Patient! Sie leiden an einer chronischen Polyarthritis (Rheumatoiden Arthritis). Ihr
Gebrauchsinformation: Information für Patienten. Trobicin 2 g Pulver und Lösungsmittel zur Herstellung einer Injektionssuspension Spectinomycin
 Gebrauchsinformation: Information für Patienten Trobicin 2 g Pulver und Lösungsmittel zur Herstellung einer Injektionssuspension Spectinomycin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor
Gebrauchsinformation: Information für Patienten Trobicin 2 g Pulver und Lösungsmittel zur Herstellung einer Injektionssuspension Spectinomycin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor
Tecentriq (Atezolizumab):
 (Atezolizumab): Wichtige Sicherheitsinformationen zur Minimierung des Risikos immunvermittelter Nebenwirkungen Schulungsmaterial für Angehörige von Gesundheitsberufen Anwendungsgebiete: Urothelkarzinom.
(Atezolizumab): Wichtige Sicherheitsinformationen zur Minimierung des Risikos immunvermittelter Nebenwirkungen Schulungsmaterial für Angehörige von Gesundheitsberufen Anwendungsgebiete: Urothelkarzinom.
Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem
Diagnose und Behandlung von Cushing- und Addison- Verdachtsfällen bei Hunden
 Snap Cortisol Testleitfaden Diagnose und Behandlung von Cushing- und Addison- Verdachtsfällen bei Hunden ACTH-Stimulationstest Diagnose-Protokoll für Fälle mit Verdacht auf Hypoadrenokortizismus (Addison)
Snap Cortisol Testleitfaden Diagnose und Behandlung von Cushing- und Addison- Verdachtsfällen bei Hunden ACTH-Stimulationstest Diagnose-Protokoll für Fälle mit Verdacht auf Hypoadrenokortizismus (Addison)
Orale Target-Therapie mit dem Tyrosinkinaseinhibitor Sunitinib (Sutent )
 202 Kapitel 18 Nierentumor 18.1.2 Orale Target-Therapie mit dem Tyrosinkinaseinhibitor Sunitinib (Sutent ) Orale Target-Therapie mit dem Tyrosinkinaseinhibitor Sunitinib (Sutent ) Fortgeschrittenes Nierenzellkarzinom
202 Kapitel 18 Nierentumor 18.1.2 Orale Target-Therapie mit dem Tyrosinkinaseinhibitor Sunitinib (Sutent ) Orale Target-Therapie mit dem Tyrosinkinaseinhibitor Sunitinib (Sutent ) Fortgeschrittenes Nierenzellkarzinom
Broschüre zur Aufklärung von Patienten
 Broschüre zur Aufklärung von Patienten Ihnen wurde Jinarc verordnet, weil Sie eine autosomal-dominante polyzystische Nierenerkrankung bzw. ADPKD haben, die ein Wachstum von Zysten in den Nieren verursacht.
Broschüre zur Aufklärung von Patienten Ihnen wurde Jinarc verordnet, weil Sie eine autosomal-dominante polyzystische Nierenerkrankung bzw. ADPKD haben, die ein Wachstum von Zysten in den Nieren verursacht.
Anhang III. Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage
 Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Mycostatin - orale Suspension
 Dermapharm GmbH Gebrauchsinformation: Information für den Anwender Mycostatin - orale Suspension Wirkstoff: Nystatin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Dermapharm GmbH Gebrauchsinformation: Information für den Anwender Mycostatin - orale Suspension Wirkstoff: Nystatin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Akute venösen Thromboembolien (VTE) oder VTE in der Vorgeschichte, einschließlich tiefer Venenthrombose und Lungenembolie.
 Aktualisierte Indikation Behandlung der schweren Osteoporose: bei postmenopausalen Frauen, bei erwachsenen Männern, mit hohem Frakturrisiko, für die eine Behandlung mit anderen für die Osteoporosetherapie
Aktualisierte Indikation Behandlung der schweren Osteoporose: bei postmenopausalen Frauen, bei erwachsenen Männern, mit hohem Frakturrisiko, für die eine Behandlung mit anderen für die Osteoporosetherapie
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Ecalta 100 mg Pulver zur Herstellung eines Konzentrats zur Herstellung einer Infusionslösung Anidulafungin Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Ecalta 100 mg Pulver zur Herstellung eines Konzentrats zur Herstellung einer Infusionslösung Anidulafungin Lesen Sie die gesamte Packungsbeilage sorgfältig
PACKUNGSBEILAGE Carprogesic 50mg/ml Injektionslösung für Hunde und Katzen
 B. PACKUNGSBEILAGE PACKUNGSBEILAGE Carprogesic 50mg/ml Injektionslösung für Hunde und Katzen 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE
B. PACKUNGSBEILAGE PACKUNGSBEILAGE Carprogesic 50mg/ml Injektionslösung für Hunde und Katzen 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE
Sanvita Meno Tabletten
 Gebrauchsinformation: Information für Anwender Sanvita Meno Tabletten Wirkstoff: Trockenextrakt aus Traubensilberkerzenwurzelstock (Cimicifuga rhizoma) Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Anwender Sanvita Meno Tabletten Wirkstoff: Trockenextrakt aus Traubensilberkerzenwurzelstock (Cimicifuga rhizoma) Lesen Sie die gesamte Packungsbeilage sorgfältig
PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Therapie mit Cyclophosphamid
 PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Therapie mit Cyclophosphamid Sehr geehrte Patientin! Sehr geehrter Patient! Sie leiden unter einer schwerwiegenden entzündlichen Erkrankung des rheumatischen
PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Therapie mit Cyclophosphamid Sehr geehrte Patientin! Sehr geehrter Patient! Sie leiden unter einer schwerwiegenden entzündlichen Erkrankung des rheumatischen
Gebrauchsinformation: Information für Patienten. Bromhexin Krewel Meuselbach Tropfen 12 mg/ml. Wirkstoff: Bromhexinhydrochlorid
 Gebrauchsinformation: Information für Patienten Bromhexin Krewel Meuselbach Tropfen 12 mg/ml Wirkstoff: Bromhexinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
Gebrauchsinformation: Information für Patienten Bromhexin Krewel Meuselbach Tropfen 12 mg/ml Wirkstoff: Bromhexinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Medivitan iv Fertigspritze 5mg, 1mg, 1,05mg Injektionslösung Wirkstoffe: Pyridoxinhydrochlorid / Cyanocobalamin / Folsäure Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Anwender Medivitan iv Fertigspritze 5mg, 1mg, 1,05mg Injektionslösung Wirkstoffe: Pyridoxinhydrochlorid / Cyanocobalamin / Folsäure Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Patienten. Allernon 10 mg-tabletten Wirkstoff: Loratadin
 Gebrauchsinformation: Information für Patienten Allernon 10 mg-tabletten Wirkstoff: Loratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Patienten Allernon 10 mg-tabletten Wirkstoff: Loratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
DOKUMENTATIONSBLOCK LABOR DOKUMENTATION VON LABORKONTROLLEN ZUR FUMADERM -THERAPIE
 DOKUMENTATIONSBLOCK LABOR DOKUMENTATION VON LABORKONTROLLEN ZUR FUMADERM -THERAPIE HANDHABUNG VON LABORWERTVERÄNDERUNGEN Bitte beachten Sie ergänzend auch die Angaben in der Fachinformation.4 MONITORING
DOKUMENTATIONSBLOCK LABOR DOKUMENTATION VON LABORKONTROLLEN ZUR FUMADERM -THERAPIE HANDHABUNG VON LABORWERTVERÄNDERUNGEN Bitte beachten Sie ergänzend auch die Angaben in der Fachinformation.4 MONITORING
Wirkstoff: Mariendistelfrüchte-Trockenextrakt, entsprechend 167 mg Silymarin.
 Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation: Information für den Anwender Silymarin forte-ct Hartkapseln Wirkstoff: Mariendistelfrüchte-Trockenextrakt, entsprechend 167
Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation: Information für den Anwender Silymarin forte-ct Hartkapseln Wirkstoff: Mariendistelfrüchte-Trockenextrakt, entsprechend 167
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
 Gebrauchsinformation: Information für den Anwender Bromhexin Krewel Meuselbach Tabletten 12 mg Wirkstoff: Bromhexinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält
Gebrauchsinformation: Information für den Anwender Bromhexin Krewel Meuselbach Tabletten 12 mg Wirkstoff: Bromhexinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält
Gebrauchsinformation: Information für Anwender. Replagal 1 mg/ml Konzentrat zur Herstellung einer Infusionslösung Agalsidase alfa
 Gebrauchsinformation: Information für Anwender Replagal 1 mg/ml Konzentrat zur Herstellung einer Infusionslösung Agalsidase alfa Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Gebrauchsinformation: Information für Anwender Replagal 1 mg/ml Konzentrat zur Herstellung einer Infusionslösung Agalsidase alfa Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Gebrauchsinformation: Information für Anwender. Choleodoron Tropfen Wirkstoffe: Chelidonium majus (Schöllkraut) Ø, Curcuma xanthorrhiza (Gelbwurz) Ø
 1 Gebrauchsinformation: Information für Anwender Choleodoron Tropfen Wirkstoffe: Chelidonium majus (Schöllkraut) Ø, Curcuma xanthorrhiza (Gelbwurz) Ø Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
1 Gebrauchsinformation: Information für Anwender Choleodoron Tropfen Wirkstoffe: Chelidonium majus (Schöllkraut) Ø, Curcuma xanthorrhiza (Gelbwurz) Ø Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Gebrauchsinformation
 : Information für Anwender Raffiniertes Sojaöl (Ph.Eur.) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen.
: Information für Anwender Raffiniertes Sojaöl (Ph.Eur.) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen.
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Medivitan iv Ampullen 5mg, 1mg, 1,05mg Injektionslösung Wirkstoffe: Pyridoxinhydrochlorid / Cyanocobalamin / Folsäure Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Anwender Medivitan iv Ampullen 5mg, 1mg, 1,05mg Injektionslösung Wirkstoffe: Pyridoxinhydrochlorid / Cyanocobalamin / Folsäure Lesen Sie die gesamte Packungsbeilage
Natriumchlorid 10 % und 20 %, Konzentrat zur Herstellung einer Infusionslösung Natriumchlorid
 Seite 1/5 Gebrauchsinformation für den Benutzer Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel ist auch ohne Verschreibung
Seite 1/5 Gebrauchsinformation für den Benutzer Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel ist auch ohne Verschreibung
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben?
 Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Orgaran enthält Danaparoid-Natrium und gehört zu einer Gruppe von Arzneimitteln, die als Antithrombotika bezeichnet werden.
 Gebrauchsinformation: Information für Anwender Orgaran 750 Anti-Xa-Einheiten Injektionslösung Wirkstoff: Danaparoid-Natrium Lesen Sie die gesamte Gebrauchsinformation sorgfältig durch, bevor Ihnen dieses
Gebrauchsinformation: Information für Anwender Orgaran 750 Anti-Xa-Einheiten Injektionslösung Wirkstoff: Danaparoid-Natrium Lesen Sie die gesamte Gebrauchsinformation sorgfältig durch, bevor Ihnen dieses
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
 Gebrauchsinformation: Information für den Anwender Bromhexin Krewel Meuselbach Hustensaft 8 mg/10 ml Wirkstoff: Bromhexinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält
Gebrauchsinformation: Information für den Anwender Bromhexin Krewel Meuselbach Hustensaft 8 mg/10 ml Wirkstoff: Bromhexinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält
Gebrauchsinformation: Information für Anwender Urfadyn PL 100 mg Hartkapseln Nifurtoinol
 Gebrauchsinformation: Information für Anwender Urfadyn PL 100 mg Hartkapseln Nifurtoinol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Anwender Urfadyn PL 100 mg Hartkapseln Nifurtoinol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Prospan Hustenliquid Flüssigkeit zum Einnehmen Wirkstoff: Efeublättertrockenextrakt
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Prospan Hustenliquid Flüssigkeit zum Einnehmen Wirkstoff: Efeublättertrockenextrakt Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Prospan Hustenliquid Flüssigkeit zum Einnehmen Wirkstoff: Efeublättertrockenextrakt Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
Gebrauchsinformation: Information für Patienten. Removab 10 Mikrogramm Konzentrat zur Herstellung einer Infusionslösung Catumaxomab
 Gebrauchsinformation: Information für Patienten Removab 10 Mikrogramm Konzentrat zur Herstellung einer Infusionslösung Catumaxomab Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Gebrauchsinformation: Information für Patienten Removab 10 Mikrogramm Konzentrat zur Herstellung einer Infusionslösung Catumaxomab Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Gebrauchsinformation: Information für Anwender. Monuril 3 g Granulat zum Herstellung einer Lösung zum Einnehmen Fosfomycin-Trometamol
 Gebrauchsinformation: Information für Anwender Monuril 3 g Granulat zum Herstellung einer Lösung zum Einnehmen Fosfomycin-Trometamol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Gebrauchsinformation: Information für Anwender Monuril 3 g Granulat zum Herstellung einer Lösung zum Einnehmen Fosfomycin-Trometamol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
GEBRAUCHSINFORMATION : INFORMATION FÜR DEN ANWENDER. NORADRENALINE (norepinephrine) AGUETTANT 1 MG/ML KONZENTRAT ZUR HERSTELLUNG EINER INFUSIONSLÖSUNG
 GEBRAUCHSINFORMATION : INFORMATION FÜR DEN ANWENDER NORADRENALINE (norepinephrine) AGUETTANT 1 MG/ML KONZENTRAT ZUR HERSTELLUNG EINER INFUSIONSLÖSUNG Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
GEBRAUCHSINFORMATION : INFORMATION FÜR DEN ANWENDER NORADRENALINE (norepinephrine) AGUETTANT 1 MG/ML KONZENTRAT ZUR HERSTELLUNG EINER INFUSIONSLÖSUNG Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
NeuroBloc. Botulinumtoxin Typ B Injektionslösung 5000 E/ml. Wichtige Informationen zur Sicherheit für Ärzte
 NeuroBloc Botulinumtoxin Typ B Injektionslösung 5000 E/ml Wichtige Informationen zur Sicherheit für Ärzte Dieses Handbuch dient dazu, Ärzte, die für die Verschreibung und die Verabreichung von NeuroBloc
NeuroBloc Botulinumtoxin Typ B Injektionslösung 5000 E/ml Wichtige Informationen zur Sicherheit für Ärzte Dieses Handbuch dient dazu, Ärzte, die für die Verschreibung und die Verabreichung von NeuroBloc
Behandlung mit. was Sie darüber wissen müssen
 Information für Patienten, denen Volibris verschrieben wurde Behandlung mit was Sie darüber wissen müssen Diese Informationsbroschüre ist verpflichtender Teil der Zulassung um sicherzustellen, dass Angehörige
Information für Patienten, denen Volibris verschrieben wurde Behandlung mit was Sie darüber wissen müssen Diese Informationsbroschüre ist verpflichtender Teil der Zulassung um sicherzustellen, dass Angehörige
Zur Anwendung bei Erwachsenen und Jugendlichen ab 12 Jahre
 Gebrauchsinformation: Information für den Anwender Aspecton Eukaps 200 mg Weichkapseln Zur Anwendung bei Erwachsenen und Jugendlichen ab 12 Jahre Wirkstoff: Eucalyptusöl Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für den Anwender Aspecton Eukaps 200 mg Weichkapseln Zur Anwendung bei Erwachsenen und Jugendlichen ab 12 Jahre Wirkstoff: Eucalyptusöl Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender 200 mg/ml Konzentrat zur Herstellung einer Infusionslösung Wirkstoff: N(2)-L-Alanyl-L-Glutamin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor
Gebrauchsinformation: Information für Anwender 200 mg/ml Konzentrat zur Herstellung einer Infusionslösung Wirkstoff: N(2)-L-Alanyl-L-Glutamin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Selenase 100 Mikrogramm/2 ml Lösung zum Einnehmen 100 Mikrogramm Selen in 2 ml Lösung zum Einnehmen
 biosyn Arzneimittel GmbH Schorndorfer Straße 32, 70734 Fellbach, Deutschland GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Selenase 100 Mikrogramm/2 ml Lösung zum Einnehmen 100 Mikrogramm Selen in 2
biosyn Arzneimittel GmbH Schorndorfer Straße 32, 70734 Fellbach, Deutschland GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Selenase 100 Mikrogramm/2 ml Lösung zum Einnehmen 100 Mikrogramm Selen in 2
Dr. Böhm Traubensilberkerze 6,5 mg Filmtabletten
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Dr. Böhm Traubensilberkerze 6,5 mg Filmtabletten Wirkstoff: Trockenextrakt aus Traubensilberkerzenwurzelstock (Cimicifugae rhizoma) Lesen Sie die gesamte
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Dr. Böhm Traubensilberkerze 6,5 mg Filmtabletten Wirkstoff: Trockenextrakt aus Traubensilberkerzenwurzelstock (Cimicifugae rhizoma) Lesen Sie die gesamte
Nehmen Sie dieses Arzneimittel immer genau wie in dieser Packungsbeilage beschrieben bzw. genau nach Anweisung Ihres Arztes oder Apothekers ein.
 Gebrauchsinformation: Information für Patienten Bromhexin Krewel Meuselbach Tabletten 12 mg Wirkstoff: Bromhexinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
Gebrauchsinformation: Information für Patienten Bromhexin Krewel Meuselbach Tabletten 12 mg Wirkstoff: Bromhexinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
Mitteilung des Bundesamts für Sicherheit im Gesundheitswesen über Maßnahmen zur Gewährleistung der Arzneimittelsicherheit:
 Landeshauptleute Landessanitätsdirektionen Österreichische Apothekerkammer Österreichische Ärztekammer Landesärztekammern Anstaltsapotheken d. Universitätskliniken Datum: 16.03.2016 Kontakt: Mag. Rudolf
Landeshauptleute Landessanitätsdirektionen Österreichische Apothekerkammer Österreichische Ärztekammer Landesärztekammern Anstaltsapotheken d. Universitätskliniken Datum: 16.03.2016 Kontakt: Mag. Rudolf
HINWEISE FÜR MEDIZINISCHES FACHPERSONAL ZUR ANWENDUNG VON TENOFOVIRDISOPROXIL BEI HIV-INFIZIERTEN JUGENDLICHEN
 HINWEISE FÜR MEDIZINISCHES FACHPERSONAL ZUR ANWENDUNG VON TENOFOVIRDISOPROXIL BEI HIV-INFIZIERTEN JUGENDLICHEN Dieses Informationsmaterial zur Anwendung von Tenofovirdisoproxil wurde als Teil der Zulassungsauflagen
HINWEISE FÜR MEDIZINISCHES FACHPERSONAL ZUR ANWENDUNG VON TENOFOVIRDISOPROXIL BEI HIV-INFIZIERTEN JUGENDLICHEN Dieses Informationsmaterial zur Anwendung von Tenofovirdisoproxil wurde als Teil der Zulassungsauflagen
Rivoltan Teufelskralle 480 mg wird angewendet zur unterstützenden Behandlung bei Verschleißerscheinungen des Bewegungsapparates.
 Gebrauchsinformation: Information für Patienten Rivoltan Teufelskralle 480 mg, Filmtabletten Für Erwachsene Wirkstoff: Teufelskrallenwurzel-Trockenextrakt Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Patienten Rivoltan Teufelskralle 480 mg, Filmtabletten Für Erwachsene Wirkstoff: Teufelskrallenwurzel-Trockenextrakt Lesen Sie die gesamte Packungsbeilage sorgfältig
1. Zusatznutzen des Arzneimittels im Verhältnis zur zweckmäßigen Vergleichstherapie
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Aciclostad 200 mg Tabletten Wirkstoff: Aciclovir
 GEBRAUCHSINFORMATION: Information für den Anwender Aciclostad 200 mg Tabletten Wirkstoff: Aciclovir Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
GEBRAUCHSINFORMATION: Information für den Anwender Aciclostad 200 mg Tabletten Wirkstoff: Aciclovir Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
Gebrauchsinformation: Information für Patienten. Aspecton Hustentropfen Flüssigkeit zum Einnehmen Thymiankraut-Dickextrakt
 Gebrauchsinformation: Information für Patienten Aspecton Hustentropfen Flüssigkeit zum Einnehmen Thymiankraut-Dickextrakt Für Erwachsene und Kinder ab 2 Jahren Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Patienten Aspecton Hustentropfen Flüssigkeit zum Einnehmen Thymiankraut-Dickextrakt Für Erwachsene und Kinder ab 2 Jahren Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Ambroxol Fair-Med 30 mg Tabletten Wirkstoff: Ambroxolhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
Gebrauchsinformation: Information für Anwender Ambroxol Fair-Med 30 mg Tabletten Wirkstoff: Ambroxolhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
PHV-issue: Hydroxyethylstärke (HES) hältige Arzneispezialitäten (Infusionen) Änderungen der Fach- und Gebrauchsinformationen
 Datum: 03.01.2014 Kontakt: Mag. pharm. Dr. Ulrike Rehberger Abteilung: Tel. / Fax: +43 (0) 505 55 36258 E-Mail: ulrike.rehberger@ages.at Unser Zeichen: 16c-140103-00002-A-PHV Ihr Zeichen: PHV-issue: Hydroxyethylstärke
Datum: 03.01.2014 Kontakt: Mag. pharm. Dr. Ulrike Rehberger Abteilung: Tel. / Fax: +43 (0) 505 55 36258 E-Mail: ulrike.rehberger@ages.at Unser Zeichen: 16c-140103-00002-A-PHV Ihr Zeichen: PHV-issue: Hydroxyethylstärke
Gebrauchsinformation: Information für Patienten. Bavencio 20 mg/ml Konzentrat zur Herstellung einer Infusionslösung Avelumab
 Gebrauchsinformation: Information für Patienten Bavencio 20 mg/ml Konzentrat zur Herstellung einer Infusionslösung Avelumab Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht
Gebrauchsinformation: Information für Patienten Bavencio 20 mg/ml Konzentrat zur Herstellung einer Infusionslösung Avelumab Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht
PACKUNGSBEILAGE. Bronchostop Guaifenesin 10% akut Hustentropfen 1/6
 PACKUNGSBEILAGE Bronchostop Guaifenesin 10% akut Hustentropfen 1/6 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER BRONCHOSTOP Guaifenesin 10% akut Hustentropfen Wirkstoff: Guaifenesin Lesen Sie die gesamte
PACKUNGSBEILAGE Bronchostop Guaifenesin 10% akut Hustentropfen 1/6 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER BRONCHOSTOP Guaifenesin 10% akut Hustentropfen Wirkstoff: Guaifenesin Lesen Sie die gesamte
Gebrauchsinformation: Information für Patienten. Hedelix s. a. 0,04 g/ml Tropfen zum Einnehmen. Wirkstoff: Efeublätter-Auszug
 Gebrauchsinformation: Information für Patienten Hedelix s. a. 0,04 g/ml Tropfen zum Einnehmen Wirkstoff: Efeublätter-Auszug Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
Gebrauchsinformation: Information für Patienten Hedelix s. a. 0,04 g/ml Tropfen zum Einnehmen Wirkstoff: Efeublätter-Auszug Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
Aciclovir A Pharma ist ein Arzneimittel zur Behandlung von Virusinfektionen
 Gebrauchsinformation: Information für den Anwender Aciclovir 200-1 A Pharma Wirkstoff: Aciclovir 200 mg pro Tablette Liebe Patientin, lieber Patient! Bitte lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für den Anwender Aciclovir 200-1 A Pharma Wirkstoff: Aciclovir 200 mg pro Tablette Liebe Patientin, lieber Patient! Bitte lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Patienten. Essentiale forte-kapseln Wirkstoff: Phospholipide aus Sojabohnen
 Gebrauchsinformation: Information für Patienten Essentiale forte-kapseln Wirkstoff: Phospholipide aus Sojabohnen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Gebrauchsinformation: Information für Patienten Essentiale forte-kapseln Wirkstoff: Phospholipide aus Sojabohnen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Leflunomid - 1 A Pharma 10 mg / 20 mg Filmtabletten
 Spezielle Informationen zur Sicherheit Leflunomid - 1 A Pharma 10 mg / 20 mg Filmtabletten Wirkstoff: Leflunomid Leflunomid - 1 A Pharma 10 mg / 20 mg Filmtabletten (Leflunomid) ist als antirheumatisches
Spezielle Informationen zur Sicherheit Leflunomid - 1 A Pharma 10 mg / 20 mg Filmtabletten Wirkstoff: Leflunomid Leflunomid - 1 A Pharma 10 mg / 20 mg Filmtabletten (Leflunomid) ist als antirheumatisches
Anwendung von Bortezomib 3,5 mg nach Zubereitung: Subkutane oder intravenöse Injektion
 Wichtige sicherheitsrelevante Informationen zur Rekonstitution, Dosierung und Applikation/Anwendung für medizinische Fachkreise Anwendung von Bortezomib 3,5 mg nach Zubereitung: Subkutane oder intravenöse
Wichtige sicherheitsrelevante Informationen zur Rekonstitution, Dosierung und Applikation/Anwendung für medizinische Fachkreise Anwendung von Bortezomib 3,5 mg nach Zubereitung: Subkutane oder intravenöse
Folsäure-CT 5 mg wird angewendet zur - Behandlung von Folsäuremangelzuständen, die diätetisch nicht behoben werden können.
 Gebrauchsinformation: Information für den Anwender Folsäure-CT 5 mg Tabletten Wirkstoff: Folsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
Gebrauchsinformation: Information für den Anwender Folsäure-CT 5 mg Tabletten Wirkstoff: Folsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
Natriumhydrogencarbonat-Lösung 4,2 %/8.4 % AlleMan Pharma. Fachinformation FACHINFORMATION
 Natriumhydrogencarbonat-Lösung 4,2 %/8.4 % AlleMan Pharma Fachinformation FACHINFORMATION 1. Bezeichnung der Arzneimittel Wirkstoff: Natriumhydrogencarbonat 2. Qualitative und quantitative Zusammensetzung
Natriumhydrogencarbonat-Lösung 4,2 %/8.4 % AlleMan Pharma Fachinformation FACHINFORMATION 1. Bezeichnung der Arzneimittel Wirkstoff: Natriumhydrogencarbonat 2. Qualitative und quantitative Zusammensetzung
Patienteninformation zur Behandlung der Psoriasis mit Methotrexat
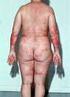 Praxis Dr. Ralph von Kiedrowski Patienteninformation zur Behandlung der Psoriasis mit Methotrexat Liebe Patientin, lieber Patient, dieses Informationsblatt soll Ihnen die vorgesehene Behandlung mit Methotrexat
Praxis Dr. Ralph von Kiedrowski Patienteninformation zur Behandlung der Psoriasis mit Methotrexat Liebe Patientin, lieber Patient, dieses Informationsblatt soll Ihnen die vorgesehene Behandlung mit Methotrexat
VITAMIN C-ROTEXMEDICA
 Gebrauchsinformation: Information für den Anwender 100 mg/ml, Injektionslösung Wirkstoff: Ascorbinsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für den Anwender 100 mg/ml, Injektionslösung Wirkstoff: Ascorbinsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für den Anwender. Tilavist Augentropfen Wirkstoff: Nedocromil-Natrium
 Gebrauchsinformation: Information für den Anwender Tilavist Augentropfen Wirkstoff: Nedocromil-Natrium Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für den Anwender Tilavist Augentropfen Wirkstoff: Nedocromil-Natrium Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Wenn Sie sich nach 7 Tagen nicht besser oder gar schlechter fühlen, wenden Sie sich an Ihren
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Bronchoverde Hustenlöser 25 mg Granulat Granulat zur Herstellung einer Lösung zum Einnehmen Wirkstoff: Efeublätter-Trockenextrakt Pflanzliches Arzneimittel
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Bronchoverde Hustenlöser 25 mg Granulat Granulat zur Herstellung einer Lösung zum Einnehmen Wirkstoff: Efeublätter-Trockenextrakt Pflanzliches Arzneimittel
Gebrauchsinformation: Information für den Anwender
 Gebrauchsinformation: Information für den Anwender ANGOCIN Anti-Infekt N Filmtabletten Wirkstoffe: Kapuzinerkressenkrautpulver und Meerrettichwurzelpulver Bitte lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für den Anwender ANGOCIN Anti-Infekt N Filmtabletten Wirkstoffe: Kapuzinerkressenkrautpulver und Meerrettichwurzelpulver Bitte lesen Sie die gesamte Packungsbeilage sorgfältig
OPDIVO 10 mg/ml Konzentrat zur Herstellung einer Infusionslösung 2. Qualitative und quantitative Zusammensetzung
 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
Gebrauchsinformation: Information für Patienten. Vancomycin Pfizer 1000 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
 1 Gebrauchsinformation: Information für Patienten Vancomycin Pfizer 1000 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung Wirkstoff: Vancomycin Lesen Sie die gesamte Packungsbeilage sorgfältig
1 Gebrauchsinformation: Information für Patienten Vancomycin Pfizer 1000 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung Wirkstoff: Vancomycin Lesen Sie die gesamte Packungsbeilage sorgfältig
Vi-Polysaccharid von Salmonella typhi (Ty2 Stamm)
 Zusammenfassung der Merkmale des Arzneimittels 1. Bezeichnung des Arzneimittels Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff 2. Qualitative und quantitative Zusammensetzung
Zusammenfassung der Merkmale des Arzneimittels 1. Bezeichnung des Arzneimittels Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff 2. Qualitative und quantitative Zusammensetzung
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. AQUA STEROP AQUA STEROP FLEXO Lösungsmittel zur Herstellung von Parenteralia. Wasser zur Injektion
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER AQUA STEROP AQUA STEROP FLEXO Lösungsmittel zur Herstellung von Parenteralia Wasser zur Injektion Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER AQUA STEROP AQUA STEROP FLEXO Lösungsmittel zur Herstellung von Parenteralia Wasser zur Injektion Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Geänderter Text ist i.a. durch graue Hinterlegung markiert. Gebrauchsinformation: Information für den Anwender. Aciclovir Aristo 200 mg Tabletten
 Änderungen gegenüber Vorversion: Neue Packungsgröße 100 ( N3) Geänderter Text ist i.a. durch graue Hinterlegung markiert. Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation:
Änderungen gegenüber Vorversion: Neue Packungsgröße 100 ( N3) Geänderter Text ist i.a. durch graue Hinterlegung markiert. Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation:
Prospan - Hustensaft
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Prospan - Hustensaft Wirkstoff: Efeublättertrockenextrakt Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Prospan - Hustensaft Wirkstoff: Efeublättertrockenextrakt Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
ELOSULFASE ALFA (VIMIZIM ) LEITFADEN FÜR ÄRZTE
 SCHULUNGSMATERIAL ELOSULFASE ALFA (VIMIZIM ) LEITFADEN FÜR ÄRZTE Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung und einer besonderen Meldepflicht bei unerwünschten Ereignissen. Kurzfassung
SCHULUNGSMATERIAL ELOSULFASE ALFA (VIMIZIM ) LEITFADEN FÜR ÄRZTE Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung und einer besonderen Meldepflicht bei unerwünschten Ereignissen. Kurzfassung
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER BENERVA 300 mg magensaftresistente Tabletten Thiaminhydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER BENERVA 300 mg magensaftresistente Tabletten Thiaminhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER BENERVA 300 mg magensaftresistente Tabletten Thiaminhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Gebrauchsinformation: Information für Anwender. Mannit 15 % Fresenius Infusionsflasche Wirkstoff: Mannit
 Gebrauchsinformation: Information für Anwender Mannit 15 % Fresenius Infusionsflasche Wirkstoff: Mannit Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Anwender Mannit 15 % Fresenius Infusionsflasche Wirkstoff: Mannit Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Wichtige sicherheitsrelevante Informationen für. Patienten. zur Behandlung mit Soliris bei refraktärer gmg. Patienten.
 Patienten refraktäre gmg Wichtige sicherheitsrelevante Informationen für Patienten zur Behandlung mit Soliris bei refraktärer gmg behördlich genehmigtes Schulungsmaterial Diese Informationsbroschüre zur
Patienten refraktäre gmg Wichtige sicherheitsrelevante Informationen für Patienten zur Behandlung mit Soliris bei refraktärer gmg behördlich genehmigtes Schulungsmaterial Diese Informationsbroschüre zur
Gebrauchsinformation: Information für den Anwender
 Bronchipret Saft 1/5 Gebrauchsinformation: Information für den Anwender Bronchipret Saft Wirkstoffe: Thymiankraut-Flüssigextrakt Efeublätter-Flüssigextrakt Lesen Sie die gesamte Packungsbeilage sorgfältig
Bronchipret Saft 1/5 Gebrauchsinformation: Information für den Anwender Bronchipret Saft Wirkstoffe: Thymiankraut-Flüssigextrakt Efeublätter-Flüssigextrakt Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Anwender. BALSOCLASE ANTITUSSIVUM 2,13 mg/ml Lösung zum Einnehmen (Pentoxyverincitrat)
 Gebrauchsinformation: Information für Anwender BALSOCLASE ANTITUSSIVUM 2,13 mg/ml Lösung zum Einnehmen (Pentoxyverincitrat) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
Gebrauchsinformation: Information für Anwender BALSOCLASE ANTITUSSIVUM 2,13 mg/ml Lösung zum Einnehmen (Pentoxyverincitrat) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. FLUORESCEINE 10 % Faure Injektionslösung Fluoresceinnatrium
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN FLUORESCEINE 10 % Faure Injektionslösung Fluoresceinnatrium Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN FLUORESCEINE 10 % Faure Injektionslösung Fluoresceinnatrium Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
PATIENTENINFORMATION
 Die belgischen Gesundheitsbehörden haben bestimmte Voraussetzungen für das Inverkehrbringen des Arzneimittels Azzalure erlassen. Der in Belgien vorgeschriebene Plan zur Risikominimierung, zu dem diese
Die belgischen Gesundheitsbehörden haben bestimmte Voraussetzungen für das Inverkehrbringen des Arzneimittels Azzalure erlassen. Der in Belgien vorgeschriebene Plan zur Risikominimierung, zu dem diese
Gebrauchsinformation: Information für Anwender. Tomudex 2 mg Pulver zur Herstellung einer Infusionslösung Wirkstoff: Raltitrexed
 1 Gebrauchsinformation: Information für Anwender Tomudex 2 mg Pulver zur Herstellung einer Infusionslösung Wirkstoff: Raltitrexed Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor mit der Anwendung
1 Gebrauchsinformation: Information für Anwender Tomudex 2 mg Pulver zur Herstellung einer Infusionslösung Wirkstoff: Raltitrexed Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor mit der Anwendung
