2.2 Polysomnographie. Fakultativ: Schulung und Training des Patienten im Gebrauch einer ncpap- / oder BiPAP-Beatmungsmaske, analog Nr. 518.
|
|
|
- Leon Sternberg
- vor 7 Jahren
- Abrufe
Transkript
1 Biochemisch-mechanische Gewebspräparation zur Spermiengewinnung, einschließlich Untersuchung der Hodengewebsproben nach dem Auftauen, analog Nr Die Analogposition ist im Behandlungsfall nur einmal berechnungsfähig. 2. Diagnostische Leistungen in der Schlafmedizin nach GOÄ Der Ausschuss Gebührenordnung der Bundesärztekammer gibt folgende, mit dem Verband der privaten Krankenversicherung e.v., dem Bundesministerium für Gesundheit und Soziale Sicherung sowie dem Bundesministerium des Innern abgestimmte Empfehlungen zur Abrechnung diagnostischer Leistungen in der Schlafmedizin nach GOÄ bekannt: 2.1 Kardiorespiratorische Polygraphie Der Leistungskomplex der kardiorespiratorischen Polygraphie (so genanntes Kleines Schlaflabor ) setzt sich aus folgenden Leistungen zusammen: EKG über mindestens sechs Stunden Dauer, analog Nr. 653 GOÄ. Messung der Sauerstoffsättigung über mindestens sechs Stunden Dauer, Zuordnung zu Nr. 602 GOÄ. Kontinuierliche Atemflussmessung an Mund und Nase über mindestens sechs Stunden, Zuordnung zu Nr. 605 GOÄ. Kontinuierliche Registrierung der Körperlage mittels Lagesensoren über mindestens sechs Stunden, analog Nr. 714 GOÄ. Fakultativ: Kontinuierliche Videokontrolle der Korrelation von elektrophysiologischer Aufzeichnung und Verhaltensbefund über mindestens sechs Stunden, analog Nr GOÄ. Fakultativ: Kontrolle der Beatmung unter ncpap- oder BiPAP-Bedingungen, analog Nr Die Voraussetzungen zur Anerkennung der einzelnen Leistungen im Rahmen der kardiorespiratorischen Polygraphie sind dann erfüllt, wenn jeweils eine kontinuierliche Registrierung beziehungsweise Überwachung über eine mindestens sechsstündige Schlafphase erfolgt. Die jeweilige Dokumentation der einzelnen elektrophysiologischen Messdaten sowie der einfache Befundbericht sind mit den in Ansatz gebrachten Gebührenpositionen abgegolten. 2.2 Polysomnographie Der Leistungskomplex der Polysomnographie (so genanntes Großes Schlaflabor ) setzt sich aus folgenden Leistungen zusammen: EEG-Aufzeichnung über mindestens sechs Stunden, Zuordnung zu Nr EOG-Registrierung über mindestens sechs Stunden, Zuordnung zu Nr EKG-Registrierung über mindestens sechs Stunden, analog Nr Kontinuierliche Messung der Sauerstoffsättigung über mindestens sechs Stunden, Zuordnung zu Nr Kontinuierliche Atemflussmessung an Mund und Nase über mindestens sechs Stunden, Zuordnung zu Nr Kontinuierliche EMG-Registrierung an wenigstens zwei Muskelgruppen über mindestens sechs Stunden, analog Nr Kontinuierliche Körperlagebestimmung mittels Lagesensoren über mindestens sechs Stunden, analog Nr Kontinuierliche Videokontrolle der Korrelation von elektrophysiologischen Messdaten und Verhaltensbefund über mindestens sechs Stunden, analog Nr Fakultativ: Kontrolle der Beatmung unter ncpap-/bipap-bedingungen, analog Nr Fakultativ: Schulung und Training des Patienten im Gebrauch einer ncpap- / oder BiPAP-Beatmungsmaske, analog Nr Die Vorstände von Bundesärztekammer und Kassenärztlicher Bundesvereinigung beauftragten mit Beschluss vom ihre gemeinsame HTA-Arbeitsgruppe, ein evidenzbasiertes Assessment zum gegenwärtigen Stand der wissenschaftlichen Erkenntnisse über die Radiumchloridtherapie bei Morbus Bechterew zu erstellen. Dieser HTA-Bericht wurde inzwischen abgeschlossen, einem Peer Review BUNDESÄRZTEKAMMER 2.3 Polygraphische Vigilanzmessung am Tag Der Leistungskomplex der polygraphischen Vigilanzmessung am Tag setzt sich aus folgenden Leistungen zusammen: EEG nach Nr. 827, einmal pro Untersuchungstag. EOG nach Nr. 1237, einmal pro Untersuchungstag. EMG nach Nr. 838, einmal pro Untersuchungstag. Die Messung der Hirn- und Muskelaktivitäten durch EEG, EOG und EMG über jeweils mindestens 20 Minuten müssen an einem Untersuchungstag mindestens viermal in jeweils zweistündigem Abstand gemessen werden. 2.4 Anpassung von ncpap- oder BiPAP- Beatmungsmasken, analog Nr Anpassung von Beatmungsmasken und Schulung des Patienten im Gebrauch der ncpap- oder BiPAP-Beatmungsmaske, analog Nr. 518 je Sitzung. 2.6 Einsatz neuropsychologischer Testverfahren zur schlafmedizinischen Diagnostik, analog Nr Die Anerkennung der Leistung setzt voraus, dass mindestens zwei neuropsychologische Testverfahren, gegebenenfalls einschließlich psychometrischer und projektiver Verfahren, eingesetzt werden. KASSENÄRZTLICHE BUNDESVEREINIGUNG Bekanntmachungen Gemeinsamer HTA der Bundesärztekammer und der Kassenärztlichen Bundesvereinigung zur Radiumchloridtherapie bei Morbus Bechterew durch vom wissenschaftlichen Beirat der Bundesärztekammer benannte Sachverständige unterzogen und von beiden o. g. Vorständen am 30. Januar 2004 zur Veröffentlichung freigegeben. Die Veröffentlichung einer Zusammenfassung erfolgt in diesem Heft unter Medizinreport. Der vollständige Bericht steht im Internet unter kammer.de/30/hta/index.html sowie unter Deutsches Ärzteblatt Jg. 101 Heft Februar 2004 A 527
2 KASSENÄRZTLICHE BUNDESVEREINIGUNG Der Bundesausschuss der Ärzte und Krankenkassen hat in seiner Sitzung am beschlossen, die Richtlinien über die Verordnung von Hilfsmitteln in der vertragsärztlichen Versorgung ( Hilfsmittel-Richtlinien ), in der Fassung vom 17. Juni 1992 (BAnz Nr. 183 b vom 29. September 1992), zuletzt geändert am 6. Februar 2001 (BAnz S ), wie folgt zu ändern: E. Sehhilfen Die Nr. 53. Eine Sehhilfe soll nur dann verordnet werden, wenn sie der Verbesserung der Sehschärfe oder der Behebung bzw. Linderung eines anderen Krankheitszustandes dient. wird wie folgt neu gefasst: 53. Verordnungsfähigkeit von Sehhilfen Die Nummern 53.1 bis 53.3 werden wie folgt neu gefasst: 53.1 Eine Sehhilfe zur Verbesserung der Sehschärfe ist verordnungsfähig bei Versicherten bis zur Vollendung des 18. Lebensjahres bei Versicherten, die das 18. Lebensjahr vollendet haben, wenn sie aufgrund ihrer Sehschwäche oder Blindheit, entsprechend der von der Weltgesundheitsorganisation empfohlenen Klassifikation des Schweregrades der Sehbeeinträchtigung, auf beiden Augen eine schwere Sehbeeinträchtigung mindestens der Stufe 1 aufweisen. Diese liegt vor, wenn die Sehschärfe (Visus) bei bestmöglicher Korrektur mit einer Brillen- oder möglichen Kontaktlinsenversorgung auf dem besseren Auge maximal 0,3 beträgt Eine therapeutische Sehhilfe ist verordnungsfähig, wenn diese der Behandlung von Augenverletzungen oder Augenerkrankungen dient Die Verordnung von Sehhilfen zur Verbesserung der Sehschärfe und therapeutischer Sehhilfen zulasten der Gesetzlichen Krankenversicherung kann nur aufgrund einer augenärztlichen Untersuchung erfolgen. Bekanntmachungen Beschluss einer Änderung der Richtlinien des Bundesausschusses der Ärzte und Krankenkassen über die Verordnung von Hilfsmitteln in der vertragsärztlichen Versorgung ( Hilfsmittel-Richtlinien ) vom 1. Dezember 2003 Dies gilt nicht für Sehhilfen zur Verbesserung der Sehschärfe bei Folgeverordnungen nach Vollendung des 14. Lebensjahres, sofern nicht aufgrund einer auffälligen Veränderung der Sehschärfe seit der letzten Verordnung die Gefahr einer Erkrankung des Auges besteht und keine schwere Sehbeeinträchtigung im Sinne der Nummer 53.1 zweiter Spiegelstrich vorliegt. Ersatzbeschaffungen innerhalb von drei Monaten bei Kindern bis zur Vollendung des 14. Lebensjahres ohne Änderung der Refraktionswerte: In Nr. 54. werden nach Als Sehhilfen die Worte zur Verbesserung der Sehschärfe ergänzt. In Nr wird vor dem Wort Sehhilfen das Wort vergrößernde eingefügt. In Nr. 55. werden nach dem Wort Brillengläser die Worte zur Verbesserung der Sehschärfe eingefügt. In Nr werden im letzen Satz die Nummern 59 und 60 durch die Nummern 58 und 59 ersetzt. Die Nr Die Erstversorgung mit Brillengläsern soll nur aufgrund einer augenärztlichen Untersuchung erfolgen. Der Folgeversorgung mit Brillengläsern soll eine augenärztliche Untersuchung vorausgehen, wenn aufgrund einer auffälligen Veränderung der Sehschärfe seit der letzten Verordnung oder aufgrund des Alters des Brillenträgers im Zusammenhang mit dem Zeitablauf seit der letzten Verordnung die Gefahr einer Erkrankung des Auges besteht. entfällt. Die nachfolgende Nummerierung wird angepasst. Die bisherige Nr wird zu Die Nr. 56. Anstelle von Fernund/oder Nahgläser können Bifokalgläser ggf. mit Planglasanteil verordnet werden, sofern die Notwendigkeit zum ständigen Tragen der Brille eine solche Ausstattung erforderlich macht. entfällt. Nr. 57. wird zu Nr. 56 und lautet dann wie folgt: 56. Sind aufgrund medizinischer Indikation besondere Gläser erforderlich, kann die Verordnung nur unter Anlegung eines strengen Maßstabes erfolgen. Die Nr wird wie folgt neugefasst: 56.1 Bifokalgläser a) ggf. mit Planglasanteil anstelle von Fern- oder Nahgläsern, sofern die Notwendigkeit zum ständigen Tragen der Brille eine solche Ausstattung erforderlich macht b) mit extra großem Nahteil bei Kindern und Jugendlichen zur Behandlung des akkommodativen Strabismus Die Nr wird zu Nr In Nr (neue Nummerierung) b) werden die Worte sowie den Blendschutz herabsetzenden Substanzverlusten der Iris (z. B. Iriskolobom, Aniridie, traumatische Mydriasis, Iridodialyse) gestrichen. Unter Nr (neue Nummerierung) wird der Abschnitt i) Albinismus gestrichen. Die nachfolgende Aufzählung mit Buchstaben wird entsprechend angepasst. Unter Nr (neue Nummerierung) werden die Abschnitte m) als Sonderform Kantenfiltergläser (400 nm) im Rahmen einer Photochemotherapie, als UV-Schutz nach Staroperationen, wenn keine Intraokularlinse mit UV-Schutz implantiert wurde, bei Iriskolobmen oder Albinismus, und n) als Sonderform Kantenfiltergläser (540 bis 660 nm) bei dystrophischen Netzhauterkrankungen gestrichen. Die Nummern 57.2, 57.2 a) bis h) werden zu 56.3 a) bis h) Die Nr.58. wird zu Nr.57. und die Nummern 58.1 bis 58.9 werden zu 57.1 bis 57.9 Die Nr Gläser und Folien mit prismatischer Wirkung sind nur verordnungsfähig, wenn sie zur Behandlung oder Behebung von Beschwerden erforderlich sind, die durch krankhafte Störungen in der sensorischen und motorischen Zusammenarbeit der Augen ausgelöst werden. Dies setzt in jedem Fall eine umfassende augenärztliche, orthoptisch-pleoptische Diagnostik voraus. Isolierte Ergebnisse einer subjektiven Heterophorie- Testmethode begründen keine Verordnungsfähigkeit von Folien und Gläsern mit prismatischer Wirkung. Ausgleichs- Prismen bei übergroßen Brillenglasdurchmessern sind nicht verordnungsfähig. wird gestrichen. Die Nummern bis werden zu Nr bis und die Nr. 59. wird zu 58. Die Abschnitte a) bis i) unter 59.1 werden entsprechend zu Abschnitt a) bis i) unter Die Abschnitte j) als Verbandlinse/Verbandschale bei schwerer Erkrankung der Hornhaut, bei durchbohrender Hornhautverletzung oder bei Einsatz als Medikamententräger, A 528 Deutsches Ärzteblatt Jg. 101 Heft Februar 2004
3 k) als Occlusionslinse/Occlusionsschale in der Schielbehandlung, sofern andere Maßnahmen nicht durchführbar sind, l) als Irislinse bei Substanzverlust der Regenbogenhaut. werden gestrichen. Die Nummern 59.2 bis werden zu Nummern 58.2 bis Nr. 60. wird zu 59. und durch die Worte zur Verbesserung der Sehschärfe ergänzt. Die Nummern 60.1 und 60.2 werden entsprechend zu und Die Nummern 60. bis j) werden wie folgt neu gefasst: 60. Therapeutische Sehhilfen zur Behandlung einer Augenverletzung oder Augenerkrankung sind in folgenden Fällen bei bestehender medizinischer Notwendigkeit verordnungsfähig: 60.1 Lichtschutz mit einer 75%igen Transmission oder weniger bei a) den Blendschutz herabsetzenden Substanzverlusten der Iris (z. B. Iriskolobom, Aniridie, traumatische Mydriasis, Iridodialyse), b) Albinismus UV-Kantenfilter (400 nm) bei a) Aphakie (Linsenlosigkeit), b) Photochemotherapie (zur Absorption des langwelligen UV-Lichts), c) als UV-Schutz nach Staroperation, wenn keine Intraokularlinse mit UV- Schutz implantiert wurde, d) Iriskolobomen, e) Albinismus. Helligkeit und Farbe des Kantenfilters sind individuell zu erproben, die subjektive Akzeptanz ist zu überprüfen Kantenfilter (540 bis 660 nm) bei a) dystrophischen Netzhauterkrankungen, z. B. Zapfenanomalien der Netzhaut bedingte Sehstörung (Achromatopsie), Retinopathia pigmentosa, b) Iriskolobomen, c) Albinismus. Kantenfilter sind nicht verordnungsfähig bei altersbedingter Makuladegeneration, diabetischer Retinopathie und Fundus myopicus. Helligkeit und Farbe des Kantenfilters sind individuell zu erproben, die subjektive Akzeptanz ist zu überprüfen Horizontale Prismen in Gläser ab 3 Prismendioptrien und Folien mit prismatischer Wirkung ab 3 Prismendioptrien (Gesamtkorrektur auf beiden Augen), bei krankhaften Störungen in der sensorischen und motorischen Zusammenarbeit der Augen, mit dem Ziel Binokularsehen zu ermöglichen und die sensorische Zusammenarbeit der Augen zu verbessern, sowie bei Augenmuskelparesen Muskelkontrakturen zu beseitigen oder zu verringern. Bei vertikalen Prismen gelten die Voraussetzungen des Satzes 1 mit Ausnahme, Indikation Tacrolimus ist zugelassen zur Behandlung des mittelschweren bis schweren atopischen Ekzems bei Erwachsenen, die dass der Grenzwert jeweils 1 Prismendioptrie beträgt. Die Verordnung setzt in jedem Falle eine umfassende augenärztliche orthoptisch-pleoptische Diagnostik voraus. Isolierte Ergebnisse einer subjektiven Heterophorie-Testmethode begründen keine Verordnungsfähigkeit von Folien und Gläsern mit prismatischer Wirkung. Ausgleichsprismen bei übergroßen Brillendurchmessern sind nicht verordnungsfähig. Höhenausgleichsprismen bei Bifokalgläsern mit Fernkorrektur > 2dpt Unterschied sind nicht verordnungsfähig. Bei wechselnder Prismenstärke oder temporärem Einsatz, z. B. prä- oder postoperativ, ist der Einsatz von Prismenfolien angezeigt Organisches Glas mit sphärischen Flächen bei akkommodativem Schielen von Kindern und Jugendlichen bis zur Vollendung des 18. Lebensjahres Organisches Glas mit sphäro-torischen Flächen bei akkommodativem Schielen von Kindern und Jugendlichen bis zur Vollendung des 18. Lebensjahres Okklusionskapseln bei Amblyopie, mit Herabsetzung der zentralen Sehschärfe ohne erkennbaren pathologischen Okklusionsfolien bei Amblyopie, mit Herabsetzung der zentralen Sehschärfe ohne erkennbaren pathologischen 60.9 Okklusionspflaster bei Amblyopie, mit Herabsetzung der zentralen Sehschärfe ohne erkennbaren pathologischen Uhrglasverbände bei unvollständigem Lidschluss, z. B. infolge einer Gesichtslähmung, um das Austrocknen der Hornhaut zu vermeiden Irislinsen bei den Blendschutz herabsetzenden Substanzverlusten der Iris Regenbogenhaut (z. B. Iriskolobom, Aniridie, traumatische Mydriasis, Iridodialyse) Okklusionsschalen/Okklusionslinsen bei Amblyopie, sofern eine andere Behandlungsform nicht möglich ist Verbandlinsen/Verbandschalen bei/nach a) Erosionen, Epitheldefekten, Ulzeration der Hornhaut (nicht nach refraktiv-chirurgischen Eingriffen), b) Abrasio nach Operation (nicht nach refraktiv-chirurgischen Eingriffen), c) Verletzung, d) Verätzung, e) Verbrennung, f) Hornhautperforation oder lamellierende Hornhautverletzung, g) Keratoplastik, h) Hornhautentzündungen und -ulzerationen, z. B. Keratitis bullosa, Keratitis neuroparalytica, Keratitis e lagophthalmo, Keratitis filiformis, Keratitis herpetica, i) kontinuierlicher Medikamentenzufuhr als Medikamententräger Kontaktlinsen bei Keratokonus mit Verdünnung der Hornhaut um mind. 50 %, kegelförmiger Vorwölbung und Vogt-Linien sowie Keratitis punctata superficialis Die Änderung der Richtlinien tritt am in Kraft. Köln, 1. Dezember 2003 Bundesausschuss der Ärzte und Krankenkassen Der Vorsitzende Jung Der Bundesausschuss der Ärzte und Krankenkassen hat in seiner Sitzung am 4. September 2003 beschlossen, die Anlage 4 der Richtlinien des Bundesausschusses der Ärzte und Krankenkassen über die Verordnung von Arzneimitteln in der vertragsärztlichen Versorgung (Arzneimittel-Richtlinien/AMR) in der Fassung vom 31. August 1993 (BAnz. S ), zuletzt geändert am 11. August 2003 (BAnz. S ), Anlage 4 zuletzt geändert am 24. März 2003 (BAnz. S ), wie folgt zu ändern bzw. zu ergänzen: Therapiehinweis nach Nr. 14 der Arzneimittelrichtlinien Tacrolimus zur topischen Behandlung (z. B. Protopic ) auf herkömmliche Therapie nicht ausreichend ansprechen oder diese nicht vertragen, sowie bei Kindern ab zwei Jahren, die nicht ausreichend auf die herkömmliche Therapie angesprochen haben. Deutsches Ärzteblatt Jg. 101 Heft Februar 2004 A 529
4 Es kann zur Kurzzeitbehandlung und intermittierenden Langzeitbehandlung angewendet werden. Die Behandlung erfolgt zweimal täglich bis zu drei Wochen und wird dann auf einmal täglich reduziert und bis zur Abheilung fortgeführt, danach abgesetzt. Bei Kindern ist nur die Wirkstärke 0,03 % indiziert. Bei Erwachsenen (ab 16 Jahren) sollte mit der 0,1 %-Salbe begonnen werden bei zweimal täglicher Anwendung für eine Dauer von bis zu drei Wochen. Danach sollte die Stärke auf 0,03 % bei zweimal täglicher Anwendung reduziert werden. Wenn der klinische Zustand es erlaubt, sollte versucht werden, die Anwendungshäufigkeit zu verringern. Ist nach zweiwöchiger Behandlung keine Besserung zu erkennen, sind andere Therapiemöglichkeiten in Betracht zu ziehen. Neben dem Wirkstoff sind folgende Hilfsstoffe enthalten: weißes Vaselin, dickflüssiges Paraffin, Propylencarbonat, gebleichtes Wachs und Hartparaffin. Tacrolimus darf nur von Dermatologen beziehungsweise Ärzten mit umfangreicher Erfahrung in der Behandlung des atopischen Ekzems mit immunmodulierenden Therapien verschrieben werden. Empfehlungen zur wirtschaftlichen Verordnungsweise Tacrolimus ist nur zugelassen zur Behandlung des mittelschweren bis schweren atopischen Ekzems bei Erwachsenen, die auf herkömmliche Therapie nicht ausreichend ansprechen oder diese nicht vertragen, sowie bei Kindern ab zwei Jahren, die nicht ausreichend auf die herkömmliche Therapie angesprochen haben. Die zur Zulassung führenden vergleichenden Studien haben solche Patienten nicht explizit eingeschlossen. Insgesamt dürfte dies nur auf wenige Patienten zutreffen. Der Einsatz als First-Line-Therapie ist unwirtschaftlich. In den direkt vergleichenden Untersuchungen traten mehr lokale Nebenwirkungen unter Tacrolimus-Salbe und auch unter der Salbengrundlage allein als unter Corticosteroidbehandlung auf. Die bisherigen vergleichenden Studien gingen nicht über drei Wochen hinaus, sodass eine abschließende Beurteilung insbesondere zu Langzeitnebenwirkungen der unterschiedlichen Behandlungsoptionen zurzeit nicht möglich ist. Der Stellenwert der Behandlung mit Tacrolimus, insbesondere im direktem Vergleich zum optimierten Einsatz von topischen Glucocorticoiden, auch im Wechsel mit wirkstofffreien Mitteln in der erscheinungsarmen Zeit, ist unklar. Tacrolimus scheint eine vergleichbare Wirksamkeit wie mittelstark bis stark wirksame Glucocorticoide zu haben. Es fehlen zurzeit direkt vergleichende Studien zu anderen topischen Makrolidimmunsuppressiva. Aufgrund der jetzigen Datenlage wird angenommen, dass Pimecrolimus eher weniger wirksam als Tacrolimus ist. Da keine Erfahrungen bei Kindern unter zwei Jahren vorliegen, ist hier eine Behandlung nicht indiziert. Kombinationsbehandlungen von Tacrolimus mit systemischen oder topischen wirkstoffhaltigen Arzneimitteln sind nicht untersucht und von daher unwirtschaftlich mit gleichzeitigem Einsatz von Lichttherapien sind wegen eines nicht auszuschließenden photokanzerogenen Risikos nicht angezeigt. Kosten Es werden die Preise der Festbeträge von topischen Glucocorticosteroiden angegeben. Innerhalb der einzelnen Festbetragsgruppen variieren die Preise jedoch um bis zu 50 Prozent. Tabelle C Preisvergleich (Preise in Euro) Wirkungen Tacrolimus wird aus Streptomyces tsukubaensis gewonnen. Es bindet an ein spezifisches Zellplasma-Immunophilin (FKBP12) und hemmt dadurch in den T-Zellen calciumabhängige Wege der Signaltransduktion, wodurch die Synthese von IL-2, IL-3, IL-4, IL-5 und anderen Zytokinen wie GM-CSF, TNF- und IFN- verhindert wird. Es wurde eine Hemmung der Freisetzung von Entzündungsmediatoren aus Mastzellen der Haut sowie aus basophilen und eosinophilen Granulozyten nachgewiesen. Bei Patienten mit atopischem Ekzem ging die Besserung der Hautschäden während der Behandlung mit einer Beeinträchtigung der Fc-Rezeptor-Expression auf den Langerhans-Zellen und einer Reduzierung ihrer übermäßig stimulierenden Wirkung auf T-Zellen einher. Der Wirkmechanismus von Tacrolimus ist nicht vollständig geklärt. Die klinische Bedeutung der beschriebenen Mechanismen für die Behandlung des atopischen Ekzems ist nicht bekannt. Wirksamkeit Menge Tacrolimus topische Glucocorticosteroide Pimecrolimus in Gramm Salbe Creme 0,03 % 0,1 % mittel stark 1 % 15 6,94 7,69 26, ,32 53,93 11,72 13,44 49, ,49 102,90 19,88 23, ,32 35,48 155,02 Die Wirksamkeit wurde in fünf maßgeblichen Phase-III-Studien geprüft, die in Europa und Amerika durchgeführt wurden. Bei den eingeschlossenen Patienten war im Durchschnitt ein Drittel der Körperoberfläche erkrankt, und ungefähr die Hälfte der Patienten litt unter einer schweren Erkrankung. Die Behandlung mit Tacrolimus-Salbe zeigte im Vergleich zur Salbengrundlage in direkt vergleichenden Studien über eine Behandlungsdauer von drei bis zwölf Wochen signifikant bessere Ergebnisse. Ungefähr drei- bis viermal mehr Patienten sprachen auf Tacrolimus versus Salbengrundlage an (Salbengrundlage 7 8 %, 0,03 %-Tacrolimus circa 35 %, 0,1 %- Tacrolimus circa 40 %). Vergleichende Untersuchungen zu topischen Glucocorticoiden wurden durchgeführt. Bei Kindern war Tacrolimus dem schwach wirksamen 1 %-Hydrocortisonacetat in zwei Studien überlegen. Allerdings wird die Wahl des schwach wirksamen Referenzsteroids wegen dessen begrenzter Wirksamkeit als nicht optimal angesehen. Im Vergleich zu einem mittelstarken Corticosteroid (0,1 %-Hydrocortisonbutyrat) ergab sich bei Erwachsenen kein signifikanter Unterschied der Wirksamkeit. In zwei vergleichenden japanischen Studien der Phase III mit insgesamt 329 Patienten war die Wirksamkeit von 0,1 %-Tacrolimus dem stark wirksamen topischen Corticosteroid (0,12 %-Betamethasonvalerat) vergleichbar und dem mittelstark wirksamen 0,1 %-Alcometasondipropionat überlegen. Unter Tacrolimus und auch unter der Salbengrundlage allein traten mehr lokale Nebenwirkungen auf als unter Corticosteroiden. Das Wiederauftreten der Erkrankung war bisher nicht Ziel von Untersuchun- A 530 Deutsches Ärzteblatt Jg. 101 Heft Februar 2004
5 gen. In den US-amerikanischen Studien kam es bei ungefähr der Hälfte der Patienten zwei Wochen nach Absetzen der Therapie zu einem erneuten Schub. In den europäischen Untersuchungen hielt eine moderate Verbesserung bei etwa der Hälfte der Patienten zwei Wochen nach Absetzen an. Risiken ggf. Vorsichtsmaßnahmen Bei 50 % aller Patienten traten Nebenwirkungen in Form von Hautreizungen verschiedener Art im behandelten Bereich auf. Brennen, Jucken und Hautrötung traten sehr häufig auf und verschwanden in der Regel innerhalb einer Woche. Erhöhte Empfindlichkeit in der Haut und Prickeln sowie Hyperästhesie wurden ebenso wie lokale Unverträglichkeit gegenüber Alkohol häufig beobachtet. Unter den häufigen Nebenwirkungen finden sich auch Follikulitis, Akne und Herpes simplex (Herpes, Fieberbläschen, Eczema herpeticatum [Kaposi varicelliforme Eruption]). In klinischen Untersuchungen kam es in 0,8 % zu Lymphadenopathien. In der Mehrzahl handelte es sich um Infektionen, die unter einer angemessenen Antibiotikabehandlung abklangen. Bei transplantierten, mit Immunsuppressiva behandelten Patienten ist das Risiko der Entstehung eines Lymphoms erhöht; daher sind mit Tacrolimus behandelte Patienten, die eine Lymphadenopathie entwickeln, zu überwachen, um sicherzustellen, dass die Lymphadenopathie abklingt. Die Ätiologie ist zu klären. Kann die Krankheitsursache nicht eindeutig ermittelt werden oder liegt eine infektiöse Mononukleose vor, so ist die Unterbrechung der Behandlung mit Tacrolimus in Erwägung zu ziehen. Die Auswirkungen der Behandlung auf das sich entwickelnde Immunsystem bei Kindern ist nicht bekannt. Impfungen sollten nicht während der Behandlung mit Tacrolimus verabreicht werden. Bei abgeschwächten Lebendimpfstoffen (z. B. gegen Masern, Mumps, Röteln, oder Kinderlähmung) beträgt die Karenzzeit 28 Tage, bei inaktivierten Impfstoffen (z. B. gegen Tetanus, Diphtherie, Keuchhusten oder Grippe) 14 Tage. In einer Photokanzerogenitätsstudie wurden haarlose Albinomäuse chronisch mit Tacrolimussalbe und UV-Bestrahlung behandelt. Die mit Tacrolimussalbe behandelten Tiere zeigten eine statistisch signifikante Verkürzung der Zeitspanne bis zum Auftreten von Hauttumoren (Plattenepithelkarzinome) und eine erhöhte Anzahl von Tumoren. Inwieweit diese Befunde auf den Menschen übertragbar sind, ist unbekannt. Nach der Fachinformation des Herstellers sollte während der Behandlung mit Tacrolimus- Salbe die Haut möglichst nicht dem Sonnenlicht ausgesetzt werden. Die Anwendung von ultraviolettem (UV) Licht in Solarien sowie die Therapie mit UVB oder UVA in Kombination mit Psoralenen (PUVA) sollte vermieden werden. Der Arzt muss die Patienten über geeignete Lichtschutzmaßnahmen beraten (z. B. Vermeidung von Aufenthalt in der Sonne, Anwendung von Lichtschutzmitteln und Abdeckung der Haut mit entsprechender Kleidung). Ob eine Behandlungsdauer von mehr als zwei Jahren mit dem Risiko einer lokalen, eventuell zu Infektionen oder kutanen Malignomen führenden Immunsuppression verbunden ist, ist nicht bekannt. Hautpflegemittel dürfen innerhalb von zwei Stunden vor beziehungsweise nach Applikation von Tacrolimus nicht im gleichen Hautbereich angewendet werden. Über die gleichzeitige Verwendung anderer topischer Präparate und systemischer Steroide oder Immunsuppressiva liegen keine Erfahrungen vor. Die gleichzeitige systemische Verabreichung von CYP3A4-Hemmern (z. B. Erythromycin, Itraconazol, Ketoconazol und Diltiazem) bei Patienten mit ausgedehnter und/oder erythrodermischer Erkrankung sollte mit Vorsicht erfolgen. Die Anwendung in der Schwangerschaft und Stillzeit sowie bei Patienten mit genetisch bedingten Schädigungen der Epidermisschranke (z. B. Netherton- Syndrom) und generalisierter Erythrodermie wird nicht empfohlen. Das Gleiche gilt für Okklusivverbände. Der Kontakt mit Augen und Schleimhaut ist zu vermeiden. Die Salbe darf auf infizierten Hautstellen nicht angewendet werden. 4. Davoser Tage: Fortbildungskongress für Ärzte 18. bis 20. März 2004 Veranstalter: Ärzteverein Davos in Zusammenarbeit mit dem Medizinischen Zentrum Bad Ragaz, der Deutschen Klinik für Dermatologie und Allergie Davos Alexanderhausklinik, der Ultraschallschule und Davos Tourismus Wissenschaftliche Organisation und Eröffnung: Prof. Dr. med. Dr. phil. Siegfried Borelli, em. Direktor der Klinik und Poliklinik für Dermatologie und Allergologie am Biederstein der Technischen Universität München, ehemaliger Ärztlicher Direktor der Alexanderhausklinik, Davos. Wissenschaftliche Leitung: Dr. med. Peter Risi, Davos; Prof. Dr. med. Dr. phil. Siegfried Borelli, München/Davos; Dr. med. Josias Mattli, Davos; Dr. med. Beat Villiger, Bad Ragaz; Dr. med. Rainer Disch, Davos. Programm: Generalthema: Von der Grundlagenforschung zur Therapie. Einzelvorträge, Kurse, Seminare und praktische Übungen sowie Workshops: Anti-Aging-Tag; Ultraschallkurs: Grundkurs Mammasonographie; Ultraschallkurs: Refresherkurs zu Abdomen in Form eines interaktiven Quiz mit Selbstkontrolle; Osteoporose-Vorträge; Aknetherapie im Jugendund Erwachsenenalter; Sportmedizin in der Praxis; Symposium über Phytotherapie; Prophylaxe und Therapie atopischer Erkrankungen; Asthmamanagement im Kindes- und Jugendalter; Somatoforme Schmerzstörung: Pathogenese, interdisziplinäre Diagnostik und Therapie unter biopsychosozialen Aspekten; Workshop: Notfalltherapie bei Anaphylaxie. Ferner: Mittagsseminar in der Alexanderhausklinik, Tobelmühlstraße, Davos Platz. Referenten, Übungsleiter, Kursleiter und Workshop-Seminarleiter aus der Schweiz und aus Deutschland. Organisation: Annamarie Piacente, Bahnhofstraße 169 A, CH-7247 Saas i. Prättigau, Telefon: 00 41/81/ ; Fax: 00 41/81/ , piacente@bluewin.ch Teilnahmegebühren: 300 sfr; Tageskarte: 150 sfr; Halbtageskarte: 100 sfr, Grundkurs Mammasonographie: 200 sfr; Refresherkurs Abdomen: 350 sfr; Anti-Aging-Tag: 150 sfr; Phytotherapieseminar: 150 sfr Kongressort: Kongresszentrum Davos, Promenade 92, CH 7270 Davos Platz Kongressbüro Davos: Tourismusbüro Davos, Corinne Vils, Promenade 67, CH 7270 Davos Platz; Telefon: 00 41/81/ ; Fax: 00 41/81/ Deutsches Ärzteblatt Jg. 101 Heft Februar 2004 A 531
Insgesamt dürfte dies nur auf wenige Patienten zutreffen, dies gilt auch für den Einsatz als Second-Line-Behandlung.
 Pimecrolimus (z. B. Elidel ) Beschluss vom: 04.09.2003 In Kraft getreten am: 07.01.2004 BAnz. Nr. 2 vom 06.01.2004, S. 68 Indikation Pimecrolimus ist zugelassen bei Patienten ab 2 Jahren mit leichtem bis
Pimecrolimus (z. B. Elidel ) Beschluss vom: 04.09.2003 In Kraft getreten am: 07.01.2004 BAnz. Nr. 2 vom 06.01.2004, S. 68 Indikation Pimecrolimus ist zugelassen bei Patienten ab 2 Jahren mit leichtem bis
Richtlinien des gemeinsamen Bundesausschusses über die Verordnung von Hilfsmitteln in der vertragsärztlichen Versorgung ( Hilfsmittel-Richtlinien )
 Richtlinien des gemeinsamen Bundesausschusses über die Verordnung von Hilfsmitteln in der vertragsärztlichen Versorgung ( Hilfsmittel-Richtlinien ) in der Fassung vom 17.06.1992, veröffentlicht im Bundesanzeiger
Richtlinien des gemeinsamen Bundesausschusses über die Verordnung von Hilfsmitteln in der vertragsärztlichen Versorgung ( Hilfsmittel-Richtlinien ) in der Fassung vom 17.06.1992, veröffentlicht im Bundesanzeiger
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Protopic 0,03% Salbe 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 g Protopic 0,03% Salbe enthält 0,3 mg Tacrolimus
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Protopic 0,03% Salbe 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 g Protopic 0,03% Salbe enthält 0,3 mg Tacrolimus
NIEDERSÄCHSISCHE VERSORGUNGSKASSE
 NIEDERSÄCHSISCHE VERSORGUNGSKASSE Stand: 01.09.2016 Informationsblatt zur Beihilfefähigkeit von Aufwendungen für Sehhilfen Die notwendigen und angemessenen Aufwendungen für die Anschaffung von Sehhilfen
NIEDERSÄCHSISCHE VERSORGUNGSKASSE Stand: 01.09.2016 Informationsblatt zur Beihilfefähigkeit von Aufwendungen für Sehhilfen Die notwendigen und angemessenen Aufwendungen für die Anschaffung von Sehhilfen
Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen
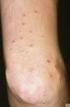 Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen München (1. Mai 2009) Die europäische Arzneimittelagentur EMEA hat mit Wirkung zum 1. Mai 2009 Protopic
Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen München (1. Mai 2009) Die europäische Arzneimittelagentur EMEA hat mit Wirkung zum 1. Mai 2009 Protopic
Calcineurininhibitoren zur topischen Anwendung: Pimecrolimus und Tacrolimus (Elidel, Douglan und Protopic )
 Calcineurininhibitoren zur topischen Anwendung: Pimecrolimus und Tacrolimus (Elidel, Douglan und Protopic ) Ergebnisse der europäischen Risiko- Bewertungs-Verfahren Anlass für die Risikobewertungsverfahren
Calcineurininhibitoren zur topischen Anwendung: Pimecrolimus und Tacrolimus (Elidel, Douglan und Protopic ) Ergebnisse der europäischen Risiko- Bewertungs-Verfahren Anlass für die Risikobewertungsverfahren
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Protopic 0,03% Salbe 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 g Protopic 0,03% Salbe enthält 0,3 mg Tacrolimus
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Protopic 0,03% Salbe 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 g Protopic 0,03% Salbe enthält 0,3 mg Tacrolimus
Richtlinien über künstliche Befruchtung
 Richtlinien über künstliche Befruchtung Der Bundesausschuss der Ärzte und Krankenkassen hat in seiner Sitzung am 26. Februar 2002 beschlossen, die Richtlinien über ärztliche Maßnahmen zur künstlichen Befruchtung
Richtlinien über künstliche Befruchtung Der Bundesausschuss der Ärzte und Krankenkassen hat in seiner Sitzung am 26. Februar 2002 beschlossen, die Richtlinien über ärztliche Maßnahmen zur künstlichen Befruchtung
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Protopic 0,1% Salbe Tacrolimus-Monohydrat
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Protopic 0,1% Salbe Tacrolimus-Monohydrat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Protopic 0,1% Salbe Tacrolimus-Monohydrat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
B E S C H L U S S. des Bewertungsausschusses nach 87 Abs. 1 Satz 1 SGB V in seiner 291. Sitzung (schriftliche Beschlussfassung)
 B E S C H L U S S des Bewertungsausschusses nach 87 Abs. 1 Satz 1 SGB V in seiner 291. Sitzung (schriftliche Beschlussfassung) zur Änderung des Einheitlichen Bewertungsmaßstabes (EBM) mit Wirkung zum 1.
B E S C H L U S S des Bewertungsausschusses nach 87 Abs. 1 Satz 1 SGB V in seiner 291. Sitzung (schriftliche Beschlussfassung) zur Änderung des Einheitlichen Bewertungsmaßstabes (EBM) mit Wirkung zum 1.
Richtlinien. des. Bundesausschusses der Ärzte und Krankenkassen
 Richtlinien des Bundesausschusses der Ärzte und Krankenkassen über die Verordnung von Hilfsmitteln in der vertragsärztlichen Versorgung ( Hilfsmittel-Richtlinien ) in der Fassung vom 17. Juni 1992 veröffentlicht
Richtlinien des Bundesausschusses der Ärzte und Krankenkassen über die Verordnung von Hilfsmitteln in der vertragsärztlichen Versorgung ( Hilfsmittel-Richtlinien ) in der Fassung vom 17. Juni 1992 veröffentlicht
des Gemeinsamen Bundesauschusses über die Verordnung von Hilfsmitteln in der vertragsärztlichen Versorgung
 Richtlinie des Gemeinsamen Bundesauschusses über die Verordnung von Hilfsmitteln in der vertragsärztlichen Versorgung (Hilfsmittel-Richtlinie / HilfsM-RL) In der Neufassung vom 21. Dezember 2011/15. März
Richtlinie des Gemeinsamen Bundesauschusses über die Verordnung von Hilfsmitteln in der vertragsärztlichen Versorgung (Hilfsmittel-Richtlinie / HilfsM-RL) In der Neufassung vom 21. Dezember 2011/15. März
Landesverwaltungsamt Berlin Zentrale Beihilfestelle
 Landesverwaltungsamt Berlin Zentrale Beihilfestelle Informationsblatt Beihilfe für Sehhilfen Übersicht 1. Sind Sehhilfen für Personen ab dem vollendeten 18. Lebensjahr beihilfefähig? 2. Welche Aufwendungen
Landesverwaltungsamt Berlin Zentrale Beihilfestelle Informationsblatt Beihilfe für Sehhilfen Übersicht 1. Sind Sehhilfen für Personen ab dem vollendeten 18. Lebensjahr beihilfefähig? 2. Welche Aufwendungen
Einleitung und Leseanweisung
 VII Einleitung und Leseanweisung Für wen ist dieses Buch? Der Pocket Guide ist für alle klinisch tätigen Psychiater geschrieben, denen das Kompendium der Psychiatrischen Pharmakotherapie für die Kitteltasche
VII Einleitung und Leseanweisung Für wen ist dieses Buch? Der Pocket Guide ist für alle klinisch tätigen Psychiater geschrieben, denen das Kompendium der Psychiatrischen Pharmakotherapie für die Kitteltasche
Beschluss. in der Fassung vom 26. April 1976
 1 Beschluss einer Änderung der Richtlinien des Bundesausschusses der Ärzte und Krankenkassen über die Früherkennung von Krebserkrankungen ( Krebsfrüherkennungs-Richtlinien ) in der Fassung vom 26. April
1 Beschluss einer Änderung der Richtlinien des Bundesausschusses der Ärzte und Krankenkassen über die Früherkennung von Krebserkrankungen ( Krebsfrüherkennungs-Richtlinien ) in der Fassung vom 26. April
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V
B E S C H L U S S. des Bewertungsausschusses nach 87 Abs. 1 Satz 1 SGB V in seiner 291. Sitzung (schriftliche Beschlussfassung)
 B E S C H L U S S des Bewertungsausschusses nach 87 Abs. 1 Satz 1 SGB V in seiner 291. Sitzung (schriftliche Beschlussfassung) zur Änderung des Einheitlichen Bewertungsmaßstabes (EBM) mit Wirkung zum 1.
B E S C H L U S S des Bewertungsausschusses nach 87 Abs. 1 Satz 1 SGB V in seiner 291. Sitzung (schriftliche Beschlussfassung) zur Änderung des Einheitlichen Bewertungsmaßstabes (EBM) mit Wirkung zum 1.
Erste Verordnung zur Änderung der Bundesbeihilfeverordnung. Vom 17. Dezember 2009
 Erste Verordnung zur Änderung der Bundesbeihilfeverordnung Vom 17. Dezember 2009 Auf Grund des 80 Absatz 4 des Bundesbeamtengesetzes vom 5. Februar 2009 (BGBl. I S. 160) verordnet das Bundesministerium
Erste Verordnung zur Änderung der Bundesbeihilfeverordnung Vom 17. Dezember 2009 Auf Grund des 80 Absatz 4 des Bundesbeamtengesetzes vom 5. Februar 2009 (BGBl. I S. 160) verordnet das Bundesministerium
Arzneimittel-Richtlinien
 Arzneimittel-Richtlinien Der Bundesausschuß der Ärzte und Krankenkassen hat in seine Sitzung am 16. Februar 2000 beschlossen, die Anlage 2 der Richtlinien des Bundesausschusses der Ärzte und Krankenkassen
Arzneimittel-Richtlinien Der Bundesausschuß der Ärzte und Krankenkassen hat in seine Sitzung am 16. Februar 2000 beschlossen, die Anlage 2 der Richtlinien des Bundesausschusses der Ärzte und Krankenkassen
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Lebende Larven von Lucilia sericata wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 3a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 3a SGB
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Vedolizumab wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B5. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Dreizehnte Verordnung zur Änderung der Arzneimittelverschreibungsverordnung
 Bundesrat Drucksache 768/12 (Beschluss) 01.02.13 Beschluss des Bundesrates Dreizehnte Verordnung zur Änderung der Arzneimittelverschreibungsverordnung Der Bundesrat hat in seiner 906. Sitzung am 1. Februar
Bundesrat Drucksache 768/12 (Beschluss) 01.02.13 Beschluss des Bundesrates Dreizehnte Verordnung zur Änderung der Arzneimittelverschreibungsverordnung Der Bundesrat hat in seiner 906. Sitzung am 1. Februar
Behandlungsoptionen ein einfacher Leitfaden
 Behandlungsoptionen ein einfacher Leitfaden Für die Entscheidung, welche Behandlung die richtige für Sie ist, ist es gut zu wissen, welche Optionen Sie haben und die jeweiligen Vor- und Nachteile zu verstehen.
Behandlungsoptionen ein einfacher Leitfaden Für die Entscheidung, welche Behandlung die richtige für Sie ist, ist es gut zu wissen, welche Optionen Sie haben und die jeweiligen Vor- und Nachteile zu verstehen.
28. Oktober 2015 I Seite 1. Der Vertragsarzt im Spannungsfeld zwischen Verordnungsfähigkeit und Regressgefahr
 28. Oktober 2015 I Seite 1 Der Vertragsarzt im Spannungsfeld zwischen Verordnungsfähigkeit und Regressgefahr Dipl.-Med. Jutta Eckert Forum Ambulant-stationärer Dialog, 21. Oktober 2015 DEGAM Leitlinie
28. Oktober 2015 I Seite 1 Der Vertragsarzt im Spannungsfeld zwischen Verordnungsfähigkeit und Regressgefahr Dipl.-Med. Jutta Eckert Forum Ambulant-stationärer Dialog, 21. Oktober 2015 DEGAM Leitlinie
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben?
 Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Gliederung. Änderung der Arzneimittelrichtlinie durch den G-BA Umsetzung in der Praxis
 Änderung der Arzneimittelrichtlinie durch den G-BA Umsetzung in der Praxis Prof. Dr. Roland Radziwill Apotheke, Ernährungszentrum und Patienten-Beratungs-Zentrum Dresden, 09.06.2016 Seite 1 Gliederung
Änderung der Arzneimittelrichtlinie durch den G-BA Umsetzung in der Praxis Prof. Dr. Roland Radziwill Apotheke, Ernährungszentrum und Patienten-Beratungs-Zentrum Dresden, 09.06.2016 Seite 1 Gliederung
1. Die Angaben zu Perampanel in der Fassung des Beschlusses vom 7. März 2013 (BAnz AT B4) werden aufgehoben.
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
In allen anderen Fällen sind Schutzimpfungen nach Satz 1 von der Leistungspflicht ausgeschlossen.
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Schutzimpfungs- Richtlinie (SI-RL): Umsetzung STIKO- Empfehlungen August 2016 und weitere Anpassungen Vom 1. Dezember 2016 Der Gemeinsame
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Schutzimpfungs- Richtlinie (SI-RL): Umsetzung STIKO- Empfehlungen August 2016 und weitere Anpassungen Vom 1. Dezember 2016 Der Gemeinsame
Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten
 Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten Arzneimittelmarktneuordnungsgesetz (AMNOG) 35a Bewertung des Nutzens von Arzneimitteln
Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten Arzneimittelmarktneuordnungsgesetz (AMNOG) 35a Bewertung des Nutzens von Arzneimitteln
des Gemeinsamen Bundesausschusses über die Änderung der Schutzimpfungs- Richtlinie (SI-RL): Umsetzung der STIKO-Empfehlungen August 2013
 Beschluss des Gemeinsamen Bundesausschusses über die Änderung der Schutzimpfungs- Richtlinie (SI-RL): Umsetzung der STIKO-Empfehlungen August 2013 Vom 5. Dezember 2013 Der Gemeinsame Bundesausschuss hat
Beschluss des Gemeinsamen Bundesausschusses über die Änderung der Schutzimpfungs- Richtlinie (SI-RL): Umsetzung der STIKO-Empfehlungen August 2013 Vom 5. Dezember 2013 Der Gemeinsame Bundesausschuss hat
B E S C H L U S S. des Bewertungsausschusses nach 87 Abs. 1 Satz 1 SGB V in seiner 316. Sitzung (schriftliche Beschlussfassung)
 B E S C H L U S S des Bewertungsausschusses nach 87 Abs. 1 Satz 1 SGB V in seiner 316. Sitzung (schriftliche Beschlussfassung) Teil A zur Änderung des Einheitlichen Bewertungsmaßstabes (EBM) mit Wirkung
B E S C H L U S S des Bewertungsausschusses nach 87 Abs. 1 Satz 1 SGB V in seiner 316. Sitzung (schriftliche Beschlussfassung) Teil A zur Änderung des Einheitlichen Bewertungsmaßstabes (EBM) mit Wirkung
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um die Wirkstoffkombination Dapagliflozin/Metformin wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um die Wirkstoffkombination Insulin degludec/liraglutid wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um die Wirkstoffkombination Empagliflozin/Metformin wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Diagnose MS. Leitfaden zur Therapieauswahl
 Diagnose MS Leitfaden zur Therapieauswahl Vorbereitung ist alles Vor einer Entscheidung für eine Behandlung stehen viele Fragen. Zum einzelnen Wirkstoff. Zum Behandlungsplan. Zur Krankheit generell. Alles
Diagnose MS Leitfaden zur Therapieauswahl Vorbereitung ist alles Vor einer Entscheidung für eine Behandlung stehen viele Fragen. Zum einzelnen Wirkstoff. Zum Behandlungsplan. Zur Krankheit generell. Alles
Erratum. zu CT/MRT-gestützten interventionellen schmerztherapeutischen Leistungen umfasst u. a. die CT-gesteuerte Intervention(en) nach der neuen
 Erratum zum Beschluss des Bewertungsausschusses nach 87 Abs. 1 Satz 1 SGB V in seiner 290. Sitzung (schriftliche Beschlussfassung) mit Wirkung zum 1. April 2013 Der Beschluss des Bewertungsausschusses
Erratum zum Beschluss des Bewertungsausschusses nach 87 Abs. 1 Satz 1 SGB V in seiner 290. Sitzung (schriftliche Beschlussfassung) mit Wirkung zum 1. April 2013 Der Beschluss des Bewertungsausschusses
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
HINWEISE FÜR MEDIZINISCHES FACHPERSONAL ZUR ANWENDUNG VON TENOFOVIRDISOPROXIL BEI HIV-INFIZIERTEN JUGENDLICHEN
 HINWEISE FÜR MEDIZINISCHES FACHPERSONAL ZUR ANWENDUNG VON TENOFOVIRDISOPROXIL BEI HIV-INFIZIERTEN JUGENDLICHEN Dieses Informationsmaterial zur Anwendung von Tenofovirdisoproxil wurde als Teil der Zulassungsauflagen
HINWEISE FÜR MEDIZINISCHES FACHPERSONAL ZUR ANWENDUNG VON TENOFOVIRDISOPROXIL BEI HIV-INFIZIERTEN JUGENDLICHEN Dieses Informationsmaterial zur Anwendung von Tenofovirdisoproxil wurde als Teil der Zulassungsauflagen
Analyse diagnostischer Maßnahmen mit GKV-Routinedaten: Zur Richtlinienkonformität der Stufendiagnostik bei vermuteter Schlafapnoe
 Analyse diagnostischer Maßnahmen mit GKV-Routinedaten: Zur Richtlinienkonformität der Stufendiagnostik bei vermuteter Schlafapnoe AGENS Methodenworkshop 13.-14. Februar 2014 Hannover Schneider U, Linder
Analyse diagnostischer Maßnahmen mit GKV-Routinedaten: Zur Richtlinienkonformität der Stufendiagnostik bei vermuteter Schlafapnoe AGENS Methodenworkshop 13.-14. Februar 2014 Hannover Schneider U, Linder
Anhang III. Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage
 Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anlage 5 (zu 25 Abs. 1 und 4)
 Anlage 5 (zu 25 Abs. 1 und 4) Beihilfefähigkeit der Aufwendungen für Hilfsmittel, Geräte zur Selbstbehandlung und Selbstkontrolle sowie für Körperersatzstücke einschließlich Zubehör 1. Die notwendigen
Anlage 5 (zu 25 Abs. 1 und 4) Beihilfefähigkeit der Aufwendungen für Hilfsmittel, Geräte zur Selbstbehandlung und Selbstkontrolle sowie für Körperersatzstücke einschließlich Zubehör 1. Die notwendigen
Die frühe Nutzenbewertung und ihre rechtlichen Herausforderungen
 und ihre rechtlichen Herausforderungen Rechtssymposium Die frühe Nutzenbewertung von Arzneimitteln nach AMNOG G-BA, Berlin Referent: Dr. jur. Rainer Hess, G-BA Seite 1 16. November 2010 Rechtssymposium
und ihre rechtlichen Herausforderungen Rechtssymposium Die frühe Nutzenbewertung von Arzneimitteln nach AMNOG G-BA, Berlin Referent: Dr. jur. Rainer Hess, G-BA Seite 1 16. November 2010 Rechtssymposium
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um die Wirkstoffkombination Tafluprost/Timolol wie folgt ergänzt:
 BAnz AT 1.07.201 B4 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
BAnz AT 1.07.201 B4 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
1. Zusatznutzen des Arzneimittels im Verhältnis zur zweckmäßigen Vergleichstherapie
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Parkinson kommt selten allein
 Herausforderung Komorbiditäten Parkinson kommt selten allein Prof. Dr. Jens Volkmann, Würzburg Würzburg (14. März 2013) - Morbus Parkinson ist eine chronisch progrediente Erkrankung, für die noch keine
Herausforderung Komorbiditäten Parkinson kommt selten allein Prof. Dr. Jens Volkmann, Würzburg Würzburg (14. März 2013) - Morbus Parkinson ist eine chronisch progrediente Erkrankung, für die noch keine
BAnz AT B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
B E S C H L U S S. des Bewertungsausschusses nach 87 Abs. 1 Satz 1 SGB V in seiner 404. Sitzung (schriftliche Beschlussfassung) Teil A
 B E S C H L U S S des Bewertungsausschusses nach 87 Abs. 1 Satz 1 SGB V in seiner 404. Sitzung (schriftliche Beschlussfassung) Teil A zur Änderung des Einheitlichen Bewertungsmaßstabes (EBM) mit Wirkung
B E S C H L U S S des Bewertungsausschusses nach 87 Abs. 1 Satz 1 SGB V in seiner 404. Sitzung (schriftliche Beschlussfassung) Teil A zur Änderung des Einheitlichen Bewertungsmaßstabes (EBM) mit Wirkung
des Gemeinsamen Bundesausschusses über die Änderung der Schutzimpfungs- Richtlinie (SI-RL): Umsetzung der STIKO-Empfehlungen Juli 2012
 Beschluss des Gemeinsamen Bundesausschusses über die Änderung der Schutzimpfungs- Richtlinie (SI-RL): Umsetzung der STIKO-Empfehlungen Juli 2012 Vom 18. Oktober 2012 Der Gemeinsame Bundesausschuss hat
Beschluss des Gemeinsamen Bundesausschusses über die Änderung der Schutzimpfungs- Richtlinie (SI-RL): Umsetzung der STIKO-Empfehlungen Juli 2012 Vom 18. Oktober 2012 Der Gemeinsame Bundesausschuss hat
Gebrauchsinformation: Information für den Anwender
 Gebrauchsinformation: Information für den Anwender Metrocreme 0,75 % Wirkstoff: Metronidazol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen.
Gebrauchsinformation: Information für den Anwender Metrocreme 0,75 % Wirkstoff: Metronidazol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen.
Tragende Gründe. Vom 22. November Inhalt 1. Rechtsgrundlage Eckpunkte der Entscheidung Verfahrensablauf... 4
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses zur ambulanten Sanierungsbehandlung von Trägern des Methicillin-resistenten Staphylococcus aureus (MRSA) zu Lasten der gesetzlichen Krankenversicherung
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses zur ambulanten Sanierungsbehandlung von Trägern des Methicillin-resistenten Staphylococcus aureus (MRSA) zu Lasten der gesetzlichen Krankenversicherung
BAnz AT B7. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Zovirax 5%-Creme Wirkstoff: Aciclovir
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Zovirax 5%-Creme Wirkstoff: Aciclovir Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Zovirax 5%-Creme Wirkstoff: Aciclovir Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Zovirax 5%-Creme Wirkstoff: Aciclovir
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Zovirax 5%-Creme Wirkstoff: Aciclovir Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Zovirax 5%-Creme Wirkstoff: Aciclovir Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn
Zugelassenes Anwendungsgebiet (laut Zulassung vom 11. Mai 2016):
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Richtlinie des Gemeinsamen Bundesausschusses über die Verordnung von Hilfsmitteln in der vertragsärztlichen Versorgung
 Richtlinie des Gemeinsamen Bundesausschusses über die Verordnung von Hilfsmitteln in der vertragsärztlichen Versorgung (Hilfsmittel-Richtlinie/HilfsM-RL) in der Neufassung vom 16. Oktober 2008, veröffentlicht
Richtlinie des Gemeinsamen Bundesausschusses über die Verordnung von Hilfsmitteln in der vertragsärztlichen Versorgung (Hilfsmittel-Richtlinie/HilfsM-RL) in der Neufassung vom 16. Oktober 2008, veröffentlicht
25. Produktgruppe "Sehhilfen"
 25. Produktgruppe "Sehhilfen" HMV.Nr Pos.Nr Leistungsbeschreibung Kennz. Preis Kennzeichen Gen.- ab 01.03.2008 25.21. Anwendungsbereich Auge / Sehorgan 25.21.01 Systemträger 2521010 Systemträger sind in
25. Produktgruppe "Sehhilfen" HMV.Nr Pos.Nr Leistungsbeschreibung Kennz. Preis Kennzeichen Gen.- ab 01.03.2008 25.21. Anwendungsbereich Auge / Sehorgan 25.21.01 Systemträger 2521010 Systemträger sind in
Bundesministerium für Gesundheit
 BAnz. Nr. (S. 54) vom 9.0.0 Bundesministerium für Gesundheit Bekanntmachung [40 A] eines Beschlusses des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII
BAnz. Nr. (S. 54) vom 9.0.0 Bundesministerium für Gesundheit Bekanntmachung [40 A] eines Beschlusses des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII
Anlage 1 (Lesetextfassung, enthält den 1., 2. und 3. Nachtrag) mit Wirkung ab dem ( Impfvereinbarung Sachsen Pflichtleistungen )
 Anlage 1 (Lesetextfassung, enthält den 1., 2. und 3. Nachtrag) mit Wirkung ab dem 01.07.2014 zu der mir Wirkung ab dem 1. Januar 2013 abgeschlossenen Vereinbarung gemäß 132e SGB V über die Durchführung
Anlage 1 (Lesetextfassung, enthält den 1., 2. und 3. Nachtrag) mit Wirkung ab dem 01.07.2014 zu der mir Wirkung ab dem 1. Januar 2013 abgeschlossenen Vereinbarung gemäß 132e SGB V über die Durchführung
Zulassungsüberschreitende Anwendung von Arzneimitteln im Rahmen klinischer Studien ( 35c SGB V)
 Zulassungsüberschreitende Anwendung von Arzneimitteln im Rahmen klinischer Studien ( 35c SGB V) Berlin, 22. September 2009 Dr. Regina Skavron Abteilung Arzneimittel, Gemeinsamer Bundesausschuss Zulassungsüberschreitende
Zulassungsüberschreitende Anwendung von Arzneimitteln im Rahmen klinischer Studien ( 35c SGB V) Berlin, 22. September 2009 Dr. Regina Skavron Abteilung Arzneimittel, Gemeinsamer Bundesausschuss Zulassungsüberschreitende
BAnz Nr. 96 (S. 2326) vom 01. Juli 2008
 Bekanntmachung [1604 A] eines Beschlusses des Gemeinsamen Bundesausschusses über eine Änderung der Kinder-Richtlinien: Einrichtung einer Kinderuntersuchung U7a Vom 15. Mai 2008 Der Gemeinsame Bundesausschuss
Bekanntmachung [1604 A] eines Beschlusses des Gemeinsamen Bundesausschusses über eine Änderung der Kinder-Richtlinien: Einrichtung einer Kinderuntersuchung U7a Vom 15. Mai 2008 Der Gemeinsame Bundesausschuss
Akute venösen Thromboembolien (VTE) oder VTE in der Vorgeschichte, einschließlich tiefer Venenthrombose und Lungenembolie.
 Aktualisierte Indikation Behandlung der schweren Osteoporose: bei postmenopausalen Frauen, bei erwachsenen Männern, mit hohem Frakturrisiko, für die eine Behandlung mit anderen für die Osteoporosetherapie
Aktualisierte Indikation Behandlung der schweren Osteoporose: bei postmenopausalen Frauen, bei erwachsenen Männern, mit hohem Frakturrisiko, für die eine Behandlung mit anderen für die Osteoporosetherapie
Richtlinien des Bundesausschusses der Zahnärzte und Krankenkassen
 Richtlinien des Bundesausschusses der Zahnärzte und Krankenkassen über die Einführung neuer Untersuchungs- und Behandlungsmethoden und die Überprüfung erbrachter vertragszahnärztlicher Leistungen (NUB-Richtlinien)
Richtlinien des Bundesausschusses der Zahnärzte und Krankenkassen über die Einführung neuer Untersuchungs- und Behandlungsmethoden und die Überprüfung erbrachter vertragszahnärztlicher Leistungen (NUB-Richtlinien)
Richtlinien. des Bundesausschusses der Ärzte und Krankenkassen
 Richtlinien des Bundesausschusses der Ärzte und Krankenkassen über die Gesundheitsuntersuchung zur Früherkennung von Krankheiten ( Gesundheitsuntersuchungs-Richtlinien ) in der Fassung vom 24. August 1989
Richtlinien des Bundesausschusses der Ärzte und Krankenkassen über die Gesundheitsuntersuchung zur Früherkennung von Krankheiten ( Gesundheitsuntersuchungs-Richtlinien ) in der Fassung vom 24. August 1989
Beihilfevorschriften - 27-22 BayBhV. Aufwendungen für Sehhilfen
 Beihilfevorschriften - 27-22 BayBhV 22 Aufwendungen für Sehhilfen (1) 1 Aufwendungen für Sehhilfen sind nach den Abs. 2 bis 6 beihilfefähig 1. bis zur Vollendung des 18. Lebensjahres, 2. nach Vollendung
Beihilfevorschriften - 27-22 BayBhV 22 Aufwendungen für Sehhilfen (1) 1 Aufwendungen für Sehhilfen sind nach den Abs. 2 bis 6 beihilfefähig 1. bis zur Vollendung des 18. Lebensjahres, 2. nach Vollendung
Gesetz zur Änderung betäubungsmittelrechtlicher und anderer Vorschriften
 Bundesrat Drucksache 21/17 20.01.17 Gesetzesbeschluss des Deutschen Bundestages G Gesetz zur Änderung betäubungsmittelrechtlicher und anderer Vorschriften Der Deutsche Bundestag hat in seiner 212. Sitzung
Bundesrat Drucksache 21/17 20.01.17 Gesetzesbeschluss des Deutschen Bundestages G Gesetz zur Änderung betäubungsmittelrechtlicher und anderer Vorschriften Der Deutsche Bundestag hat in seiner 212. Sitzung
Verwaltungsvorschrift
 Verwaltungsvorschrift des Sächsischen Staatsministeriums für Soziales und Verbraucherschutz über öffentlich empfohlene und zur unentgeltlichen Durchführung bestimmte Schutzimpfungen und andere Maßnahmen
Verwaltungsvorschrift des Sächsischen Staatsministeriums für Soziales und Verbraucherschutz über öffentlich empfohlene und zur unentgeltlichen Durchführung bestimmte Schutzimpfungen und andere Maßnahmen
Beclometason, Fluticason, Mometason und ihre Ester
 Beclometason, Fluticason, Mometason und ihre Ester Sachverständigen-Ausschuss für Verschreibungspflicht 19.01.2016 Sachverständigen-Ausschuss für Verschreibungspflicht 19.01.2016 Seite 1 Hintergrund (I)
Beclometason, Fluticason, Mometason und ihre Ester Sachverständigen-Ausschuss für Verschreibungspflicht 19.01.2016 Sachverständigen-Ausschuss für Verschreibungspflicht 19.01.2016 Seite 1 Hintergrund (I)
Tragende Gründe. Vom 19. Juni 2014
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage VI Off-Label-Use Venlafaxin bei neuropathischen Schmerzen Vom 19. Juni 2014
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage VI Off-Label-Use Venlafaxin bei neuropathischen Schmerzen Vom 19. Juni 2014
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Ponatinib wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Vortragszusammenfassungen
 13. Jahrestagung der Gesellschaft für Dermopharmazie Heidelberg, 1. April 2009 en Symposium der GD-Fachgruppe Magistralrezepturen Klinische Erfahrungen und therapeutischer Nutzen von dermatologischen Rezepturen
13. Jahrestagung der Gesellschaft für Dermopharmazie Heidelberg, 1. April 2009 en Symposium der GD-Fachgruppe Magistralrezepturen Klinische Erfahrungen und therapeutischer Nutzen von dermatologischen Rezepturen
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Zovirax 3%-Augensalbe Wirkstoff: Aciclovir
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Zovirax 3%-Augensalbe Wirkstoff: Aciclovir Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Zovirax 3%-Augensalbe Wirkstoff: Aciclovir Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
Bekanntmachungen Bundesministerium für Gesundheit und Soziale Sicherung Bekanntmachung des Gemeinsamen Bundesausschusses über eine Änderung der
 Exkurs Festbeträge Beispiel Bekanntmachungen Bundesministerium für Gesundheit und Soziale Sicherung Bekanntmachung des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinien über die Verordnung
Exkurs Festbeträge Beispiel Bekanntmachungen Bundesministerium für Gesundheit und Soziale Sicherung Bekanntmachung des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinien über die Verordnung
Aureocort 1 mg/g + 30 mg/g Salbe
 Dermapharm GmbH Gebrauchsinformation: Information für Anwender Aureocort 1 mg/g + 30 mg/g Salbe Wirkstoff: Triamcinolonacetonid und Chlortetracyclinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig
Dermapharm GmbH Gebrauchsinformation: Information für Anwender Aureocort 1 mg/g + 30 mg/g Salbe Wirkstoff: Triamcinolonacetonid und Chlortetracyclinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig
Diese Impfungen bezahlt die AOK Bremen/Bremerhaven
 Die AOK übernimmt die Kosten für alle hier aufgeführten Impfungen. Diese rechnet der Arzt oder Kinderarzt direkt mit der AOK ab. Bei der Übernahme der Impfkosten richten wir uns nach der Schutzimpfungsrichtlinie
Die AOK übernimmt die Kosten für alle hier aufgeführten Impfungen. Diese rechnet der Arzt oder Kinderarzt direkt mit der AOK ab. Bei der Übernahme der Impfkosten richten wir uns nach der Schutzimpfungsrichtlinie
Anlage 1 zum RS 098/2010 vom
 Anlage 1 zum RS 098/2010 vom 24.03.2010 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinie Methoden vertragsärztliche Versorgung: Diamorphingestützte Substitutionsbehandlung
Anlage 1 zum RS 098/2010 vom 24.03.2010 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinie Methoden vertragsärztliche Versorgung: Diamorphingestützte Substitutionsbehandlung
BAnz AT B5. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Richtlinie. in der Fassung vom 24. August 1989 veröffentlicht im Bundesarbeitsblatt Nr. 10 vom 29. September 1989 in Kraft getreten am 1.
 Richtlinie des Gemeinsamen Bundesausschusses über die Gesundheitsuntersuchungen zur Früherkennung von Krankheiten (Gesundheitsuntersuchungs-Richtlinie) in der Fassung vom 24. August 1989 veröffentlicht
Richtlinie des Gemeinsamen Bundesausschusses über die Gesundheitsuntersuchungen zur Früherkennung von Krankheiten (Gesundheitsuntersuchungs-Richtlinie) in der Fassung vom 24. August 1989 veröffentlicht
BAnz AT B1. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Inhaltsverzeichnis. 1 Grundlagen der Augenheilkunde Einführung Anatomie, Physiologie und Pathophysiologie... des Auges...
 Inhaltsverzeichnis 1 Grundlagen der Augenheilkunde.................. 1 1.1 Einführung..................... 2 1.2 Anatomie, Physiologie und Pathophysiologie... des Auges...................... 3 2 Augenuntersuchung
Inhaltsverzeichnis 1 Grundlagen der Augenheilkunde.................. 1 1.1 Einführung..................... 2 1.2 Anatomie, Physiologie und Pathophysiologie... des Auges...................... 3 2 Augenuntersuchung
Tragende Gründe. zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Schutzimpfungs-Richtlinie:
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Schutzimpfungs-Richtlinie: Umsetzung der STIKO-Empfehlungen / Stand: Juli 2007 vom 18. Oktober 2007 Inhaltsverzeichnis
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Schutzimpfungs-Richtlinie: Umsetzung der STIKO-Empfehlungen / Stand: Juli 2007 vom 18. Oktober 2007 Inhaltsverzeichnis
Entyvio (Vedolizumab) Der darmselektiv wirkende Integrin-Hemmer bei Colitis ulcerosa und Morbus Crohn 1 4
 Entyvio (Vedolizumab) Der darmselektiv wirkende Integrin-Hemmer bei Colitis ulcerosa und Morbus Crohn 1 4 INTERAKTIVES PDF Gelangen Sie per Klick auf die gewünschte Seite. NUR FÜR ACROBAT Chronisch-entzündliche
Entyvio (Vedolizumab) Der darmselektiv wirkende Integrin-Hemmer bei Colitis ulcerosa und Morbus Crohn 1 4 INTERAKTIVES PDF Gelangen Sie per Klick auf die gewünschte Seite. NUR FÜR ACROBAT Chronisch-entzündliche
Gebrauchsinformation: Information für den Anwender
 Gebrauchsinformation: Information für den Anwender Delphicort Creme; 0,1 % Wirkstoff: Triamcinolonacetonid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für den Anwender Delphicort Creme; 0,1 % Wirkstoff: Triamcinolonacetonid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Proaktive Therapie mit Tacrolimus-Salbe Fortschritt in der Behandlung der atopischen Dermatitis
 22. Fortbildungswoche für praktische Dermatologie und Venerologie Proaktive Therapie mit Tacrolimus-Salbe Fortschritt in der Behandlung der atopischen Dermatitis München (28. Juli 2010) Neben einer genetisch
22. Fortbildungswoche für praktische Dermatologie und Venerologie Proaktive Therapie mit Tacrolimus-Salbe Fortschritt in der Behandlung der atopischen Dermatitis München (28. Juli 2010) Neben einer genetisch
des Bewertungsausschusses nach 87 Abs. 1 Satz 1 SGB V in seiner 328. Sitzung am 25. Juni 2014 zur Änderung des Einheitlichen Bewertungsmaßstabes (EBM)
 BESCHLUSS des Bewertungsausschusses nach 87 Abs. 1 Satz 1 SGB V in seiner 328. Sitzung am 25. Juni 2014 zur Änderung des Einheitlichen Bewertungsmaßstabes (EBM) mit Wirkung zum 1. Oktober 2014 1. Änderung
BESCHLUSS des Bewertungsausschusses nach 87 Abs. 1 Satz 1 SGB V in seiner 328. Sitzung am 25. Juni 2014 zur Änderung des Einheitlichen Bewertungsmaßstabes (EBM) mit Wirkung zum 1. Oktober 2014 1. Änderung
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Sehr geehrte Patientin! Sehr geehrter Patient!
 Univ. Klinik f. Innere Medizin LKH Graz Klinische Abteilung für Rheumatologie und Immunologie Univ. Prof. Dr. W. Graninger Auenbruggerplatz 15, A-8036 Graz Tel 0 316-385-12645 PATIENTENAUFKLÄRUNG ZUR THERAPIE
Univ. Klinik f. Innere Medizin LKH Graz Klinische Abteilung für Rheumatologie und Immunologie Univ. Prof. Dr. W. Graninger Auenbruggerplatz 15, A-8036 Graz Tel 0 316-385-12645 PATIENTENAUFKLÄRUNG ZUR THERAPIE
Bewertungskriterien im KBV-Innovationsservice
 Bewertungskriterien im KBV-Innovationsservice Welche Kriterien verwendet der KBV-Innovationsservice, um zu entscheiden, ob eine medizinische Innovation für einen Antrag an den Gemeinsamen Bundesausschuss
Bewertungskriterien im KBV-Innovationsservice Welche Kriterien verwendet der KBV-Innovationsservice, um zu entscheiden, ob eine medizinische Innovation für einen Antrag an den Gemeinsamen Bundesausschuss
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 1. BEZEICHNUNG DES ARZNEIMITTELS Protopic 0,1 % Salbe 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 g Protopic 0,1 % Salbe enthält 1,0 mg als -Monohydrat (0,1 %). Die vollständige Auflistung der sonstigen
1. BEZEICHNUNG DES ARZNEIMITTELS Protopic 0,1 % Salbe 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 g Protopic 0,1 % Salbe enthält 1,0 mg als -Monohydrat (0,1 %). Die vollständige Auflistung der sonstigen
Sehr geehrte Patientin! Sehr geehrter Patient!
 Univ. Klinik f. Innere Medizin LKH Graz Klinische Abteilung für Rheumatologie und Immunologie Univ. Prof. Dr. W. Graninger Auenbruggerplatz 15, A-8036 Graz Tel 0 316-385-12645 PATIENTENAUFKLÄRUNG ZUR THERAPIE
Univ. Klinik f. Innere Medizin LKH Graz Klinische Abteilung für Rheumatologie und Immunologie Univ. Prof. Dr. W. Graninger Auenbruggerplatz 15, A-8036 Graz Tel 0 316-385-12645 PATIENTENAUFKLÄRUNG ZUR THERAPIE
Der GKV-Spitzenverband. (Spitzenverband Bund der Krankenkassen) K. d. ö. R., Berlin. und. die Deutsche Krankenhausgesellschaft e. V., Berlin.
 Der GKV-Spitzenverband (Spitzenverband Bund der Krankenkassen) K. d. ö. R., Berlin und die Deutsche Krankenhausgesellschaft e. V., Berlin sowie die Kassenärztliche Bundesvereinigung K. d. ö. R., Berlin
Der GKV-Spitzenverband (Spitzenverband Bund der Krankenkassen) K. d. ö. R., Berlin und die Deutsche Krankenhausgesellschaft e. V., Berlin sowie die Kassenärztliche Bundesvereinigung K. d. ö. R., Berlin
Tragende Gründe. zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Schutzimpfungs-Richtlinie:
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Schutzimpfungs-Richtlinie: Überarbeitung der Spaltenzuordnung in Anlage 1 Vom 17. Juni 2010 Inhaltsverzeichnis 1 Rechtsgrundlagen
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Schutzimpfungs-Richtlinie: Überarbeitung der Spaltenzuordnung in Anlage 1 Vom 17. Juni 2010 Inhaltsverzeichnis 1 Rechtsgrundlagen
Anlage 11 BBhV Verordnung über Beihilfe in Krankheits-, Pflege- und Geburtsfällen (Bundesbeihilfeverordnung - BBhV)
 Anlage 11 BBhV Verordnung über Beihilfe in Krankheits-, Pflege- und Geburtsfällen (Bundesbeihilfeverordnung - BBhV) Bundesrecht Anhangteil Titel: Verordnung über Beihilfe in Krankheits-, Pflege- und Geburtsfällen
Anlage 11 BBhV Verordnung über Beihilfe in Krankheits-, Pflege- und Geburtsfällen (Bundesbeihilfeverordnung - BBhV) Bundesrecht Anhangteil Titel: Verordnung über Beihilfe in Krankheits-, Pflege- und Geburtsfällen
Tragende Gründe. Vom 21. August 2014
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Clopidogrel, Gruppe 1, in Stufe 1 nach 35 Absatz
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Clopidogrel, Gruppe 1, in Stufe 1 nach 35 Absatz
