Schulversuchspraktikum. Jans Manjali. Sommersemester. Klassenstufen 11 & 12. Löslichkeitsprodukt
|
|
|
- Ingeborg Krüger
- vor 6 Jahren
- Abrufe
Transkript
1 Schulversuchspraktikum Jans Manjali Sommersemester Klassenstufen 11 & 12 Löslichkeitsprodukt
2 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll wird das Thema Löslichkeit bzw. das Löslichkeitsprodukt von Salzen näher beleuchtet. Dabei liegt der Fokus der Versuche vor allem auf der Bestimmung des Löslichkeitsprodukts. Es werden zwei Methoden vorgestellt, wie in guter Näherung das Löslichkeitsprodukt ermittelt werden kann. Inhalt 1 Beschreibung des Themas und zugehörige Lernziele Relevanz des Themas für SuS der Klasse 11 & 12 und didaktische Reduktion Lehrer -/Schülerversuch Bestimmung des Löslichkeitsprodukts von Silberchlorid Schülerversuch Schätzung des Löslichkeitsprodukts Didaktischer Kommentar zum Schülerarbeitsblatt Erwartungshorizont (Kerncurriculum) Erwartungshorizont (Inhaltlich)... 7
3 1 Beschreibung des Themas und zugehörige Lernziele 1 Beschreibung des Themas und zugehörige Lernziele Viele Stoffe, insbesondere Salze, lassen sich in Wasser leicht oder schwer lösen. Silbernitrat beispielsweise löst sich sehr gut in Wasser, während Silberchlorid schwerlöslich ist. Aber auch hier gehen Silber- und Chloridionen in geringen Mengen in Lösung. Gleichzeitig kristallisiert Silberchlorid und fällt aus. Es entsteht ein heterogenes Gleichgewicht zwischen den zwei Phasen (Bodenkörper und Lösung), d.h. es gehen genauso viele Ionen in Lösung wie Festkörper ausfällt. Das Löslichkeitsprodukt lässt sich aus dem Massenwirkungsgesetz herleiten und ist das Produkt der Ionenkonzentrationen einer gesättigten Lösung: Im Kerncurriculum der gymnasialen Oberstufe ist das Löslichkeitsprodukt zunächst dadurch beschrieben, dass die Schüler_innen die Löslichkeitseigenschaften eines Stoffes erklären können sollen (Basiskonzept Struktur-Eigenschaft). Des Weiteren kann erst ein Löslichkeitsprodukt aufgestellt werden, wenn die Schüler_innen das chemische Gleichgewicht der Reaktion auf Stoff- und Teilchenebene erkennen und beschreiben sowie das Massenwirkungsgesetz aufstellen können. Im Zusammenhang mit einer übersättigten Lösung beschreiben die Schüler_innen das Verschieben der Gleichgewichtsreaktion und wenden hierbei das Prinzip nach Le Chatelier an, damit sich das Löslichkeitsprodukt wieder einstellt (Basiskonzept Kinetik und chemisches Gleichgewicht). Der Lehrer-/Schülerversuch beschäftigt sich mit der Ermittlung des Löslichkeitsprodukts von Silberchlorid. Dabei beschreiben die Schüler_innen die galvanische Zelle als Kopplung zweier Redoxgleichgewichte und berechnen mithilfe der Messung der Spannung und der Umformung der Nernst schen Gleichung das Löslichkeitsprodukt. Dadurch verknüpfen die Schüler_innen chemische Überlegungen mit mathematischen Fähigkeiten und Fertigkeiten. Im weiteren Schülerversuch wird eine weitere Methode vorgestellt, wie das Löslichkeitsprodukt in guter Näherung geschätzt werden kann. Dadurch erlernen die Schüler_innen verschiedene Herangehensweisen zu Bestimmung des Löslichkeitsprodukts.
4 2 Relevanz des Themas für SuS der Klasse 11 & 12 und didaktische Reduktion 2 Relevanz des Themas für SuS der Klasse 11 & 12 und didaktische Reduktion Bei dem Versuch verschiedene Stoffe in einem Lösungsmittel (meistens Wasser) zu lösen haben Schüler_innen schon oft erlebt, dass ein Stoff, wie beispielsweise Zucker, Salz oder andere Lebensmittel, sich nur zu einem bestimmten Grad lösen lässt und danach einen Bodensatz bildet oder allgemein schwerlöslich ist. An diesen Alltagsbeobachtungen kann das Thema Löslichkeitsprodukt im Chemieunterricht veranschaulicht werden. Auch das Phänomen des Verkalkens auf verschiedenen Materialien, wie beispielsweise im Bad oder im Wasserkocher, beruht auf dem Löslichkeitsprodukt von Calciumcarbonat. Auf die gleiche Weise bilden sich die Tropfsteine in Höhlen. Eine große gesundheitliche Relevanz besitzt das Löslichkeitsprodukt im Zusammenhang mit der Ausbildung von Nierensteinen. In den Nieren kann es häufig zu übersättigten Lösungen von Salzen kommen. Bei Fehlen bestimmter Schutzstoffe kristallisieren diese aus und es bildet sich ein Nierenstein. Da das Thema Löslichkeit und das Herleiten des Löslichkeitsprodukts nachvollziehbar und verständlich dargestellt werden kann, wird auf eine didaktische Reduktion des Themas verzichtet. 3 Lehrer-/Schülerversuch Bestimmung des Löslichkeitsprodukts von Silberchlorid Zur Ermittlung des Löslichkeitsprodukts von Silberchlorid wird die Spannung eines galvanischen Elements gemessen und über die Nernst sche Gleichung das Löslichkeitsprodukt errechnet. Gefahrenstoffe Silbernitrat H: P: Natriumchlorid Kaliumnitrat H: 272 P: Silberchlorid -- --
5 3 Lehrer-/Schülerversuch Bestimmung des Löslichkeitsprodukts von Silberchlorid Materialien: Chemikalien: Durchführung: Beobachtung: Silberelektroden, 2x 50 ml Bechergläser, Filterpapierstreifen, Glasstab, Kabel, Multimeter Silbernitratlösung (c = 0,1 mol/l), Natriumchloridlösung (c = 1 mol/l), Kaliumnitratlösung (c = 3 mol/l) In ein Becherglas werden 50 ml Silbernitrat- in das andere 50 ml Natriumchloridlösung gefüllt. Anschließend wird ein Streifen Filterpapier mit Kaliumnitratlösung getränkt und die Enden jeweils in die beiden Bechergläser getaucht. Zu der Natriumchloridlösung werden 3 Tropfen der Silbernitratlösung gegeben. Die Silberelektroden werden über die Kabel mit dem Multimeter verbunden und in die Bechergläser getaucht. Nun wird direkt nach dem Eintauchen der Elektroden die Spannung am Multimeter (Gleichspannung DC einstellen) abgelesen (s. Abb. 1). Nach Zugabe der 3 Tropfen Silbernitratlösung in die Natriumchloridlösung kann ein weißer Niederschlag beobachtet werden. Die gemessene Spannung beträgt 0,486 V. Abb. 1: Versuchsaufbau der galvanischen Zelle. Links die Anode mit der Natriumchloridlösung und rechts die Kathode mit der Silbernitratlösung. Deutung: In der Natriumchloridlösung (Anode) fällt nach Zugabe von Silbernitratlösung festes Silberchlorid aus. Nach der Nernst schen Gleichung gilt für das System Ag/NaCl (c = 1 mol/l)+3 Tr. AgNO 3//AgNO 3 (c = 1 mol/l)/ag:
6 4 Schülerversuch Schätzung des Löslichkeitsprodukts NERNST sche Gleichung: ( ) ( ) ( ) Einsetzen der gemessenen Spannung 0,486 V: Der Literaturwert beträgt etwa bei 25 C. Der absolute Fehler liegt bei und der relative Fehler beträgt 240 %. Mögliche Temperaturunterschiede könnten der Grund dafür sein, dass sich die Werte unterscheiden. Entsorgung: Literatur: Die Entsorgung der Lösungen erfolgt in den anorganischen Abfall mit Schwermetallen. Göbel, K. (26. Oktober 1994). Das chemische Gleichgewicht. (C. i. Schule, Hrsg.) Marburg. Anmerkungen: Die Schüler_innen sollten hierbei über Kenntnisse der Funktionsweise einer galvanischen Zelle verfügen und die Nernst sche Gleichung anwenden können. 4 Schülerversuch Schätzung des Löslichkeitsprodukts
7 4 Schülerversuch Schätzung des Löslichkeitsprodukts In diesem Versuch soll durch Mischen der verschiedenen Probelösungen von Kaliumchlorid und Perchlorsäure jeweils gleicher Konzentrationen das Löslichkeitsprodukt des entstehenden Kaliumperchlorats grob innerhalb bestimmter Grenzen geschätzt werden. Gefahrenstoffe Kaliumchlorid Perchlorsäure H: P: Kaliumperchlorat H: P: 220 Materialien: Chemikalien: Durchführung: 12 Reagenzgläser, Reagenzglasständer, 10 ml Pipette mit Peleusball, 2x 100 ml Bechergläser Kaliumchlorid, Perchlorsäure, dest. Wasser Es werden 100 ml 1 molarer Lösungen an Kaliumchlorid (Lösung X) bzw. Perchlorsäure (Lösung Y) als Ausgangslösungen hergestellt. Daraus werden jeweils 10 ml der Probelösungen X 1, X 2, X 3, X 4 und Y 1, Y 2, Y 3, Y 4 in Reagenzgläser mit folgenden Konzentrationen hergestellt: - Für 0,6 molare Lösungen X 1 und Y 1: je 6 ml der Lösungen in 4 ml Wasser. - Für 0,45 molare Lösungen X 2 und Y 2: je 4,5 ml der Lösungen in 5,5 ml Wasser. - Für 0,2 molare Lösungen X 3 und Y 3: je 2 ml der Lösungen in 8 ml Wasser. - Für 0,1 molare Lösungen X 4 und Y 4: je 1 ml der Lösungen in 9 ml Wasser. Anschließend werden je 5 ml der Lösungen X 1 und Y 1, X 2 und Y 2, X 3 und Y 3, X 4 und Y 4 in einen Reagenzglas gegeben und vermischt und die Veränderungen beobachtet. Beobachtung: In dem Reagenzglas X 1Y 1 und X 2Y 2 ist ein Niederschlag zu erkennen, wobei in X 2Y 2 viel weniger Feststoff ausfällt. In den Probelösungen X 3Y 3 und X 4Y 4 ist kein Niederschlag zu erkennen (s. Abb. 2).
8 4 Schülerversuch Schätzung des Löslichkeitsprodukts Abb. 2: Reagenzgläser X1Y1, X2Y2, X3Y3 und X4Y4 (von links nach rechts). In dem Gemisch X1Y1 ist ein deutlicher Niederschlag während in X2Y2 nur ein ganz geringer Niederschlag zu erkennen ist. In den anderen Reagenzgläsern fällt kein Feststoff aus. Deutung: Reaktionsgleichung: In den ersten beiden Mischungen ist Kaliumperchlorat ausgefallen, in X 1Y 1 mehr als in X 2Y 2. Da die Konzentrationen von Kalium- und Perchlorat-Ionen in der Mischung gleich groß sind gilt: Gemisch X 1Y 1: Gemisch X 2Y 2: Gemisch X 3Y 3: Gemisch X 4Y 4: Berechnung der Ionenprodukte: Gemisch X 1Y 1:
9 4 Schülerversuch Schätzung des Löslichkeitsprodukts Gemisch X 2Y 2: Gemisch X 3Y 3: Gemisch X 4Y 4: Das Löslichkeitsprodukt liegt demnach im Bereich zwischen und, da sich in dem Gemisch X 1Y 1 und X 2Y 2 ein Niederschlag gebildet hat und in den Mischungen X 3Y 3 und X 4Y 4 nicht. Der Literaturwert liegt bei und demnach im Bereich der jeweiligen geschätzten Werte. Entsorgung: Literatur: Die Lösungen werden vermischt und mit Kaliumchloridlösung gefällt. Der Rückstand wird im Feststoff-Abfall entsorgt. Das Filtrat mit viel Wasser in den Ausguss gegeben. Endersch, J. Abgerufen am 12. August 2015 von e.de/wp-content/uploads/2010/10/a1-schaetzung-eines- Loeslichkeitsprodukts.pdf Mortimer, C., & Müller, U. (2007). Chemie. Stuttgart : Thieme Verlag. Anmerkungen: Dieser Versuch eignet sich, um erst das Löslichkeitsprodukt zunächst grob abzuschätzen und anschließend, wie im ersten Versuch, genau zu berechnen.
10 Arbeitsblatt Bestimmung des Löslichkeitsprodukts Aufgabe 1: Definiere den Begriff Löslichkeitsprodukt mithilfe des Massenwirkungsgesetzes. Skizziere hierzu das chemische Gleichgewicht von Silberchlorid in wässriger Lösung auf der Teilchenebene. Aufgabe 2: Die Spannung einer galvanischen Zelle für das System Ag/NaCl (c = 1 mol/l)+3 Tr. AgNO 3//AgNO 3 (c = 1 mol/l)/ag beträgt 0,485 V. Berechne daraus das Löslichkeitsprodukt von Silberchlorid mit Hilfe der Nernst schen Gleichung. Aufgabe 3: Diskutiere die eventuelle Abweichung zwischen deinem errechneten Wert für das Löslichkeitsprodukt und dem Literaturwert.
11 5 Didaktischer Kommentar zum Schülerarbeitsblatt 5 Didaktischer Kommentar zum Schülerarbeitsblatt Das Arbeitsblatt beschäftigt sich mit der theoretischen Herleitung und Ermittlung des Löslichkeitsprodukts. Hierzu kann in den vorherigen Unterrichtsstunden die Schätzung des Löslichkeitsprodukts mithilfe des oben aufgeführten Schülerversuch durchgeführt worden sein. Des Weiteren sollte die Voraussetzung gegeben sein, dass sich die Schüler_innen schon intensiv mit der Nernst schen Gleichung beschäftigt und diese angewendet haben sowie den Aufbau und Funktion einer galvanische Zelle kennen. Ziel ist es hier vor allen Dingen, dass die Schüler_innen lernen fachliche Verknüpfungen herzustellen (Massenwirkungsgesetz und Nernst sche Gleichung mit dem Löslichkeitsprodukt) und sich diese Zusammenhänge selbst zu erarbeiten. 5.1 Erwartungshorizont (Kerncurriculum) Die im Kerncurriculum (Basiskonzepte Donator-Akzeptor und Kinetik und chemisches Gleichgewicht) zusammengefassten Kompetenzbereiche werden nachfolgend mit den Aufgaben des Arbeitsblatts verknüpft: Fachwissen: Erkenntnisgewinnung: Kommunikation: Bewerten: Die Schüler_innen erklären das Löslichkeitsprodukt, indem sie dieses aus dem Massenwirkungsgesetz herleiten und das chemische Gleichgewicht auf Teilchenebene anhand einer Skizze veranschaulichen (Aufgabe 1). Des Weiteren wenden sie ihr Wissen um die Funktionsweise einer galvanischen Zelle an (Aufgabe 2). Die Schüler_innen leiten den Versuchsdaten der galvanischen Zelle Kennzeichen des chemischen Gleichgewichts ab und übertragen chemische Sachverhalte in mathematische Darstellungen (Aufgabe 2). Die Schüler_innen argumentieren mithilfe des Massenwirkungsgesetzes und der Nernst schen Gleichung den Zusammenhang mit dem Löslichkeitsprodukt (Aufgabe 1 und 2). Die Schüler_innen vergleichen die errechneten Werte mit den Literaturwerten und erläutern die Unterschiede mithilfe der Löslichkeitsprodukt-abhängigen Faktoren (Aufgabe 3). In Aufgabe 1 definieren die Schüler_innen das Löslichkeitsprodukt mithilfe des Massenwirkungsgesetzes (Anforderungsbereich I). Anschließend berechnen die Schüler_innen das Löslich-
12 5 Didaktischer Kommentar zum Schülerarbeitsblatt keitsprodukt anhand eines Beispiels (Anforderungsbereich II), diskutieren mögliche Abweichungen mit dem Literaturwert und begründen die Unterschiede (Anforderungsbereich III). 5.2 Erwartungshorizont (Inhaltlich) Aufgabe 1: Das Produkt der Ionenkonzentrationen einer gesättigten Lösung wird als Löslichkeitsprodukt bezeichnet. Es gibt an, wie viel Salz bei einer bestimmten Temperatur maximal gelöst sein kann. Ag + + Cl - Ag + + Cl - (gelöst) AgCl (fest) Ag + + Cl - Aufgabe 2: NERNST sche Gleichung: ( ) ( ) ( ) Wegen und gilt: mol 2 /L 2
13 5 Didaktischer Kommentar zum Schülerarbeitsblatt Einsetzen der gemessenen Spannung 0,485 V: Aufgabe 3: Der Literaturwert beträgt etwa bei 25 C. Mögliche Temperaturunterschiede könnten der Grund dafür sein, dass sich die Werte unterscheiden.
Löslichkeits- und Ionenprodukt
 Schulversuchspraktikum Anonym_16 Sommersemester 2016 Klassenstufen 11 & 12 Löslichkeits- und Ionenprodukt 0 Auf einen Blick: In diesem Protokoll werden vier Versuche zum Thema Löslichkeits- und Ionenprodukt
Schulversuchspraktikum Anonym_16 Sommersemester 2016 Klassenstufen 11 & 12 Löslichkeits- und Ionenprodukt 0 Auf einen Blick: In diesem Protokoll werden vier Versuche zum Thema Löslichkeits- und Ionenprodukt
Arbeitsblatt Ist groß besser als klein?
 Arbeitsblatt Ist groß besser als klein? Aufgabe 1: Führe folgendes Experiment durch und notiere deine Beobachtungen. Materialien: 4 Reagenzgläser, Reagenzglasständer, Spatel Chemikalien: Gefahrenstoffe
Arbeitsblatt Ist groß besser als klein? Aufgabe 1: Führe folgendes Experiment durch und notiere deine Beobachtungen. Materialien: 4 Reagenzgläser, Reagenzglasständer, Spatel Chemikalien: Gefahrenstoffe
Schulversuchspraktikum. Jans Manjali. Sommersemester Klassenstufen 9 & 10. Titration. Kurzprotokoll
 Schulversuchspraktikum Jans Manjali Sommersemester 2015 Klassenstufen 9 & 10 Titration Kurzprotokoll Auf einen Blick: Die hier vorgestellte Argentometrie ist eine Fällungstitration, bei der Silberionen
Schulversuchspraktikum Jans Manjali Sommersemester 2015 Klassenstufen 9 & 10 Titration Kurzprotokoll Auf einen Blick: Die hier vorgestellte Argentometrie ist eine Fällungstitration, bei der Silberionen
Fluoreszierende Verbindungen
 Thema: Fluoreszierende Verbindungen Klasse 11 / 12 Schulversuchspraktikum Bastian Hollemann Sommersemester 2015 Klassenstufen 11 & 12 Fluoreszierende Verbindungen Thema: Fluoreszierende Verbindungen Klasse
Thema: Fluoreszierende Verbindungen Klasse 11 / 12 Schulversuchspraktikum Bastian Hollemann Sommersemester 2015 Klassenstufen 11 & 12 Fluoreszierende Verbindungen Thema: Fluoreszierende Verbindungen Klasse
Thema: Sauerstoff Klasse 7 / 8. Schulversuchspraktikum. Bastian Hollemann. Sommersemester Klassenstufen 7 & 8. Sauerstoff
 Thema: Sauerstoff Klasse 7 / 8 Schulversuchspraktikum Bastian Hollemann Sommersemester 2015 Klassenstufen 7 & 8 Sauerstoff Thema: Sauerstoff Klasse 7 / 8 Auf einen Blick: Diese Unterrichtseinheit für die
Thema: Sauerstoff Klasse 7 / 8 Schulversuchspraktikum Bastian Hollemann Sommersemester 2015 Klassenstufen 7 & 8 Sauerstoff Thema: Sauerstoff Klasse 7 / 8 Auf einen Blick: Diese Unterrichtseinheit für die
Schulversuchspraktikum. Name: Jennifer Kölling. Sommersemester: Klassenstufen: 9/10. Salze
 Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 9/10 Salze 1 Schulversuchspraktikum 1 Auf einen Blick:. Die Thematik der Salze ist sehr umfangreich. Die hier dargestellten
Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 9/10 Salze 1 Schulversuchspraktikum 1 Auf einen Blick:. Die Thematik der Salze ist sehr umfangreich. Die hier dargestellten
Schulversuchspraktikum. Moritz Pemberneck. Sommersemester Klassenstufen 7 & 8. Fällungsreaktionen. Kurzprotokoll
 Schulversuchspraktikum Moritz Pemberneck Sommersemester 2016 Klassenstufen 7 & 8 Fällungsreaktionen Kurzprotokoll Auf einen Blick: In diesem Protokoll werden weitere Schülerversuche zum Thema Fällungsreaktionen
Schulversuchspraktikum Moritz Pemberneck Sommersemester 2016 Klassenstufen 7 & 8 Fällungsreaktionen Kurzprotokoll Auf einen Blick: In diesem Protokoll werden weitere Schülerversuche zum Thema Fällungsreaktionen
Thema: Die Luftbatterie
 Klasse: 9/10 Name: Datum: Thema: Die Luftbatterie Gefahrenstoffe Natriumchlorid - - Materialien: Graphit-Elektrode, Aluminium-Folie, Küchenpapier oder Handpapier, Pipette Chemikalien: Durchführung: Natriumchlorid-Lösung
Klasse: 9/10 Name: Datum: Thema: Die Luftbatterie Gefahrenstoffe Natriumchlorid - - Materialien: Graphit-Elektrode, Aluminium-Folie, Küchenpapier oder Handpapier, Pipette Chemikalien: Durchführung: Natriumchlorid-Lösung
Konsequenzen der Ozeanversauerung
 Thema: Stoffkreisläufe Jahrgang 9 & 10 Konsequenzen der Ozeanversauerung Lies den Ausschnitt aus dem nachfolgenden Zeitungsartikel eines Wissenschaftsmagazins aufmerksam durch und betrachte im Diagramm
Thema: Stoffkreisläufe Jahrgang 9 & 10 Konsequenzen der Ozeanversauerung Lies den Ausschnitt aus dem nachfolgenden Zeitungsartikel eines Wissenschaftsmagazins aufmerksam durch und betrachte im Diagramm
Löslichkeitsprodukt und Ionenprodukt
 Schulversuchspraktikum Sommersemester 2014 Klassenstufe 11 und 12 öslichkeitsprodukt und Ionenprodukt 1 Beschreibung des Themas und zugehörige ernziele 1 Auf einen Blick: Diese Unterrichtseinheit für die
Schulversuchspraktikum Sommersemester 2014 Klassenstufe 11 und 12 öslichkeitsprodukt und Ionenprodukt 1 Beschreibung des Themas und zugehörige ernziele 1 Auf einen Blick: Diese Unterrichtseinheit für die
Warum korrodiert Eisen?
 Warum korrodiert Eisen? Korrodiertes Eisen bzw. Rost findet sich überall. An Brücken, Autos, an unseren Fahrrädern und an altem Werkzeug. Es richtet in Deutschland jährlich Schäden im Wert von 100 Millionen
Warum korrodiert Eisen? Korrodiertes Eisen bzw. Rost findet sich überall. An Brücken, Autos, an unseren Fahrrädern und an altem Werkzeug. Es richtet in Deutschland jährlich Schäden im Wert von 100 Millionen
Fällungsreaktionen und Fotografie
 Schulversuchspraktikum Dennis Roggenkämper Sommersemester 2015 Klassenstufen 7 & 8 Fällungsreaktionen und Fotografie 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Das Protokoll umfasst
Schulversuchspraktikum Dennis Roggenkämper Sommersemester 2015 Klassenstufen 7 & 8 Fällungsreaktionen und Fotografie 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Das Protokoll umfasst
Schulversuchspraktikum. Isabelle Faltiska. Sommersemester Klassenstufen 11 & 12. Quantitative Analyse von. Kohlenwasserstoffen
 Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 11 & 12 Quantitative Analyse von Kohlenwasserstoffen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Im Folgenden
Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 11 & 12 Quantitative Analyse von Kohlenwasserstoffen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Im Folgenden
Löslichkeitsprodukt und Ionenprodukt
 Schulversuchspraktikum Name: Christoph Biesemann Semester: Sommersemester 2012 Klassenstufe 11/12 Löslichkeitsprodukt und Ionenprodukt 1 Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick:
Schulversuchspraktikum Name: Christoph Biesemann Semester: Sommersemester 2012 Klassenstufe 11/12 Löslichkeitsprodukt und Ionenprodukt 1 Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick:
Gruppe 05: Alkylchloride gegenüber AgNO 3
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 05: Alkylchloride gegenüber AgNO 3 Reaktion: am Beispiel des sekundären
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 05: Alkylchloride gegenüber AgNO 3 Reaktion: am Beispiel des sekundären
11/2 Alles im Gleichgewicht Zuordnung der Kompetenzen aus dem KC Sek II
 Fachgruppe Chemie Kurshalbjahr 11/2 Alles im Gleichgewicht Stand SJ 2010/2011 11/2 Alles im Gleichgewicht Zuordnung der Kompetenzen aus dem KC Sek II Basiskonzept Stoff-Teilchen / unterscheiden anorganische
Fachgruppe Chemie Kurshalbjahr 11/2 Alles im Gleichgewicht Stand SJ 2010/2011 11/2 Alles im Gleichgewicht Zuordnung der Kompetenzen aus dem KC Sek II Basiskonzept Stoff-Teilchen / unterscheiden anorganische
Reaktionen von Metallen mit Sauerstoff und mit Luft
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die
Arbeitsblatt Pip und Lucky: Was atmen Tiere im Wasser?
 http://www.kostenloseausmalbilder.de/media/.gallery/main606.jpg (02.08.2015) Arbeitsblatt Pip und Lucky: Was atmen Tiere im Wasser? Pip, die kleine Maus, benötigt zum Atmen Luft, vor allem den Sauerstoff,
http://www.kostenloseausmalbilder.de/media/.gallery/main606.jpg (02.08.2015) Arbeitsblatt Pip und Lucky: Was atmen Tiere im Wasser? Pip, die kleine Maus, benötigt zum Atmen Luft, vor allem den Sauerstoff,
Endotherm und Exotherm
 Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 7 & 8 Endotherm und Exotherm Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 7 und 8 einen Lehrerversuch und einen
Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 7 & 8 Endotherm und Exotherm Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 7 und 8 einen Lehrerversuch und einen
Die SuS erklären die Entstehung saurer Lösungen mit dem Konzept von Arrhenius als Dissoziation von Chlorwasserstoff zu Hydoniumionen und
 1 Arbeitsblatt Das Arbeitsblatt dient der Protokollierung und der Auswertung des Lehrerversuches V1. Während die Versuchsdurchführung und Versuchbeobachtung wenig strukturiert sind, da die SuS über diese
1 Arbeitsblatt Das Arbeitsblatt dient der Protokollierung und der Auswertung des Lehrerversuches V1. Während die Versuchsdurchführung und Versuchbeobachtung wenig strukturiert sind, da die SuS über diese
Merkmale einer chemischen Reaktion
 Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 7 & 8 Merkmale einer chemischen Reaktion 1 Auf Beschreibung einen Blick: des Themas und zugehörige Lernziele Im Folgenden werden
Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 7 & 8 Merkmale einer chemischen Reaktion 1 Auf Beschreibung einen Blick: des Themas und zugehörige Lernziele Im Folgenden werden
Hausarbeit. Das Fällungs- und Löslichkeitsgleichgewicht. über. von Marie Sander
 Hausarbeit über Das Fällungs- und Löslichkeitsgleichgewicht von Marie Sander Inhaltsverzeichnis 1. Einstieg in das Thema 2. Einflüsse auf das Löslichkeitsgleichgewicht - Das Prinzip von Le Chatelier 3.
Hausarbeit über Das Fällungs- und Löslichkeitsgleichgewicht von Marie Sander Inhaltsverzeichnis 1. Einstieg in das Thema 2. Einflüsse auf das Löslichkeitsgleichgewicht - Das Prinzip von Le Chatelier 3.
Wasser als Lösungsmittel
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 5 & 6 Wasser als Lösungsmittel 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die Versuche zum Thema Wasser
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 5 & 6 Wasser als Lösungsmittel 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die Versuche zum Thema Wasser
Merkmale chemischer Reaktionen
 Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 7 & 8 Merkmale chemischer Reaktionen Kurzprotokoll Auf einen Blick: Im Folgenden werden weitere Versuche zum Thema Merkmale einer
Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 7 & 8 Merkmale chemischer Reaktionen Kurzprotokoll Auf einen Blick: Im Folgenden werden weitere Versuche zum Thema Merkmale einer
Dichte und Nachweis von Kohlenstoffdioxid
 Schulversuchspraktikum Name: Lydia Reinhardt Semester: Sommersemester 2014 Klassenstufen 7 & 8 Dichte und Nachweis von Kohlenstoffdioxid 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum Name: Lydia Reinhardt Semester: Sommersemester 2014 Klassenstufen 7 & 8 Dichte und Nachweis von Kohlenstoffdioxid 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum. Friederike Kellner. Sommersemester Klassenstufen 11 & 12. Alkanone
 Schulversuchspraktikum Friederike Kellner Sommersemester 2014 Klassenstufen 11 & 12 Alkanone 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Die im Folgenden vorgestellte Unterrichtseinheit
Schulversuchspraktikum Friederike Kellner Sommersemester 2014 Klassenstufen 11 & 12 Alkanone 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Die im Folgenden vorgestellte Unterrichtseinheit
Messung der Reaktionsgeschwindigkeit
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 11 & 12 Messung der Reaktionsgeschwindigkeit 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 11 & 12 Messung der Reaktionsgeschwindigkeit 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll
Wir untersuchen Mineralwasser
 Wir untersuchen Mineralwasser Jeder von uns kennt es: Mineralwasser. Im Geschäft wird es mit viel, wenig oder gar keiner Kohlensäure angeboten. Kohlensäure beschreibt die Form, in der das Gas Kohlenstoffdioxid
Wir untersuchen Mineralwasser Jeder von uns kennt es: Mineralwasser. Im Geschäft wird es mit viel, wenig oder gar keiner Kohlensäure angeboten. Kohlensäure beschreibt die Form, in der das Gas Kohlenstoffdioxid
Stöchiometrie-Seminar November 2016 Pascal Heitel 1
 Stöchiometrie-Seminar 4 Pascal Heitel 1 Themen des heutigen Seminars 1) Zusammenfassung des letzten Seminars 2) Besprechung der Hausaufgaben 3) Theorie 4) Übungsaufgaben Pascal Heitel 2 Themen des heutigen
Stöchiometrie-Seminar 4 Pascal Heitel 1 Themen des heutigen Seminars 1) Zusammenfassung des letzten Seminars 2) Besprechung der Hausaufgaben 3) Theorie 4) Übungsaufgaben Pascal Heitel 2 Themen des heutigen
Schulversuchspraktikum. Alexander König. Sommersemester Klassenstufen 11 & 12. Katalysatoren
 Schulversuchspraktikum Alexander König Sommersemester 2015 Klassenstufen 11 & 12 Katalysatoren Auf einen Blick: Diese Unterrichtseinheit für die Klassen 11 und 12 enthält einen Schülerversuch und einen
Schulversuchspraktikum Alexander König Sommersemester 2015 Klassenstufen 11 & 12 Katalysatoren Auf einen Blick: Diese Unterrichtseinheit für die Klassen 11 und 12 enthält einen Schülerversuch und einen
Schulversuchspraktikum. Name Thomas Polle. Sommersemester Klassenstufen 5 & 6. Feuer und Kerzen
 Schulversuchspraktikum Name Thomas Polle Sommersemester 2015 Klassenstufen 5 & 6 Feuer und Kerzen 2 Auf einen Blick: Es werden je ein Schüler- und Lehrerversuch zum Thema Kerzen und Feuer für den 5. und
Schulversuchspraktikum Name Thomas Polle Sommersemester 2015 Klassenstufen 5 & 6 Feuer und Kerzen 2 Auf einen Blick: Es werden je ein Schüler- und Lehrerversuch zum Thema Kerzen und Feuer für den 5. und
Schulversuchspraktikum. Constanze Koch. Sommersemester Klassenstufen 5 & 6. Wasser als Lösungsmittel. Kurzprotokoll
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 5 & 6 Wasser als Lösungsmittel Kurzprotokoll Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch und vier Schülerversuche
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 5 & 6 Wasser als Lösungsmittel Kurzprotokoll Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch und vier Schülerversuche
Schulversuchspraktikum. Sommersemester 2014. Klassenstufen 11 & 12. Batterien und Akkus
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 11 & 12 Batterien und Akkus Auf einen Blick: In der folgenden Unterrichtseinheit Batterien und Akkus werden Schüler- und Lehrerversuche für die
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 11 & 12 Batterien und Akkus Auf einen Blick: In der folgenden Unterrichtseinheit Batterien und Akkus werden Schüler- und Lehrerversuche für die
Arbeitsblatt Verändert sich die Masse von Edukten und Produkten während einer
 Arbeitsblatt Verändert sich die Masse von Edukten und Produkten während einer chemischen Reaktion? In der letzten Chemiestunde hast du eine Hypothese zu der Frage formuliert: Verändert sich die Masse von
Arbeitsblatt Verändert sich die Masse von Edukten und Produkten während einer chemischen Reaktion? In der letzten Chemiestunde hast du eine Hypothese zu der Frage formuliert: Verändert sich die Masse von
Synthese, Analyse, Umsetzung
 Schulversuchspraktikum Carl Föst Sommersemester 2015 Klassenstufen 7&8 Synthese, Analyse, Umsetzung Auf einen Blick Die Thematik Synthese, Analyse und Umsetzung umfasst die Grundtypen chemischer Reaktionen.
Schulversuchspraktikum Carl Föst Sommersemester 2015 Klassenstufen 7&8 Synthese, Analyse, Umsetzung Auf einen Blick Die Thematik Synthese, Analyse und Umsetzung umfasst die Grundtypen chemischer Reaktionen.
Eine Reaktion mit Kupfer und Schwefel
 Eine Reaktion mit Kupfer und Schwefel Materialien: Chemikalien: Duranglas, Stativstange mit Stativklemme, Gasbrenner Schwefelpulver, Kupferblech Durchführung: Fülle vorsichtig ca. 1cm breit Schwefelpulver
Eine Reaktion mit Kupfer und Schwefel Materialien: Chemikalien: Duranglas, Stativstange mit Stativklemme, Gasbrenner Schwefelpulver, Kupferblech Durchführung: Fülle vorsichtig ca. 1cm breit Schwefelpulver
Erweiterung des Redoxbegriffs
 Schulversuchspraktikum Sissy Freund Sommersemester 2013 Klassenstufen 11 & 12 Erweiterung des Redoxbegriffs 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Dieses Protokoll beinhaltet
Schulversuchspraktikum Sissy Freund Sommersemester 2013 Klassenstufen 11 & 12 Erweiterung des Redoxbegriffs 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Dieses Protokoll beinhaltet
Saure, neutrale und alkalische Lösungen
 Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 5 und 6 einen Lehrerversuch
Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 5 und 6 einen Lehrerversuch
Korrosion und Korrosionsschutz
 Schulversuchspraktikum Alexander König Sommersemester 2015 Klassenstufen 7 & 8 Korrosion und Korrosionsschutz Auf einen Blick: Diese Unterrichtseinheit für die Klassen 7 & 8 enthält 1 Schülerversuch und
Schulversuchspraktikum Alexander König Sommersemester 2015 Klassenstufen 7 & 8 Korrosion und Korrosionsschutz Auf einen Blick: Diese Unterrichtseinheit für die Klassen 7 & 8 enthält 1 Schülerversuch und
Schulversuchspraktikum. Jannik Nöhles. Sommersemester Klassenstufen 9 & 10. Erdalkalimetalle
 Schulversuchspraktikum Jannik Nöhles Sommersemester 2016 Klassenstufen 9 & 10 Erdalkalimetalle Auf einen Blick: Dieses Protokoll beinhaltet vier Versuche zum Thema Erdalkalimetalle für die 9. & 10. Klassenstufe.
Schulversuchspraktikum Jannik Nöhles Sommersemester 2016 Klassenstufen 9 & 10 Erdalkalimetalle Auf einen Blick: Dieses Protokoll beinhaltet vier Versuche zum Thema Erdalkalimetalle für die 9. & 10. Klassenstufe.
Qualitativer Nachweis von Säuren und Basen
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll
Planung, Bau und Betrieb von Chemieanlagen - Übung Allgemeine Chemie. Allgemeine Chemie. Rückblick auf vorherige Übung
 Planung, Bau und Betrieb von Chemieanlagen - Übung Allgemeine Chemie 1 Allgemeine Chemie Rückblick auf vorherige Übung 2 Löslichkeit Was ist eine Lösung? - Eine Lösung ist ein einphasiges (homogenes) Gemisch
Planung, Bau und Betrieb von Chemieanlagen - Übung Allgemeine Chemie 1 Allgemeine Chemie Rückblick auf vorherige Übung 2 Löslichkeit Was ist eine Lösung? - Eine Lösung ist ein einphasiges (homogenes) Gemisch
Mehrprotonige Säuren; als Beispiel Cola
 Mehrprotonige Säuren; als Beispiel Cola Arbeitsauftrag: Führe den nachstehenden Versuch Titration von Cola gemäß der Durchführung durch und notiere deine Messwerte: Materialien: 2 Bechergläser (230 ml),
Mehrprotonige Säuren; als Beispiel Cola Arbeitsauftrag: Führe den nachstehenden Versuch Titration von Cola gemäß der Durchführung durch und notiere deine Messwerte: Materialien: 2 Bechergläser (230 ml),
Arbeitsblatt Sollte eine Wasserflasche aus Glas im Gefrierfach gekühlt werden?
 Arbeitsblatt Sollte eine Wasserflasche aus Glas im Gefrierfach gekühlt werden? Beschrifte die Kästchen mit je einem Aggregatzustand. Benenne die Nummern, es handelt sich dabei um Fachbegriffe für die Übergänge
Arbeitsblatt Sollte eine Wasserflasche aus Glas im Gefrierfach gekühlt werden? Beschrifte die Kästchen mit je einem Aggregatzustand. Benenne die Nummern, es handelt sich dabei um Fachbegriffe für die Übergänge
Stöchiometrie-Seminar November 2017 Pascal Heitel 1
 Stöchiometrie-Seminar 4 Pascal Heitel 1 Themen des heutigen Seminars 1) Zusammenfassung des letzten Seminars 2) Besprechung der Hausaufgaben 3) Theorie 4) Übungsaufgaben Pascal Heitel 2 1) Zusammenfassung
Stöchiometrie-Seminar 4 Pascal Heitel 1 Themen des heutigen Seminars 1) Zusammenfassung des letzten Seminars 2) Besprechung der Hausaufgaben 3) Theorie 4) Übungsaufgaben Pascal Heitel 2 1) Zusammenfassung
Schulversuchspraktikum Sebastian Gerke Sommersemester 2012 Klassenstufen 9 & 10. Die Brennstoffzelle
 Schulversuchspraktikum Sebastian Gerke Sommersemester 2012 Klassenstufen 9 & 10 Die Brennstoffzelle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll sind drei Lehrerversuche
Schulversuchspraktikum Sebastian Gerke Sommersemester 2012 Klassenstufen 9 & 10 Die Brennstoffzelle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll sind drei Lehrerversuche
Schulversuchspraktikum. Jans Manjali. Sommersemester Klassenstufen 9 & 10. Titration
 Schulversuchspraktikum Jans Manjali Sommersemester 2015 Klassenstufen 9 & 10 Titration Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Das Thema Titration wird im Folgenden anhand der
Schulversuchspraktikum Jans Manjali Sommersemester 2015 Klassenstufen 9 & 10 Titration Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Das Thema Titration wird im Folgenden anhand der
6. Tag: Chemisches Gleichgewicht und Reaktionskinetik
 6. Tag: Chemisches Gleichgewicht und Reaktionskinetik 1 6. Tag: Chemisches Gleichgewicht und Reaktionskinetik 1. Das chemische Gleichgewicht Eine chemische Reaktion läuft in beiden Richtungen ab. Wenn
6. Tag: Chemisches Gleichgewicht und Reaktionskinetik 1 6. Tag: Chemisches Gleichgewicht und Reaktionskinetik 1. Das chemische Gleichgewicht Eine chemische Reaktion läuft in beiden Richtungen ab. Wenn
Leitfähigkeit und einfache Elektrolysen
 Schulversuchspraktikum Name Stefan Krüger Semester SoSe 2014 Klassenstufen 9/10 Leitfähigkeit und einfache Elektrolysen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll
Schulversuchspraktikum Name Stefan Krüger Semester SoSe 2014 Klassenstufen 9/10 Leitfähigkeit und einfache Elektrolysen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll
Nährstoffe und Nahrungsmittel
 1 Weitere Lehrerversuche Schulversuchspraktikum Annika Nüsse Sommersemester 2016 Klassenstufen 5 & 6 Nährstoffe und Nahrungsmittel Kurzprotokoll 1 Weitere Lehrerversuche Auf einen Blick: Der Lehrerversuch
1 Weitere Lehrerversuche Schulversuchspraktikum Annika Nüsse Sommersemester 2016 Klassenstufen 5 & 6 Nährstoffe und Nahrungsmittel Kurzprotokoll 1 Weitere Lehrerversuche Auf einen Blick: Der Lehrerversuch
V 1 Herstellung von Natriumchlorid
 1 V 1 Herstellung von Natriumchlorid In diesem Versuch wird Natriumchlorid, im Alltag als Kochsalz bekannt, aus den Edukten Natrium und Chlorgas hergestellt. Dieser Versuch ist eine Reaktion zwischen einem
1 V 1 Herstellung von Natriumchlorid In diesem Versuch wird Natriumchlorid, im Alltag als Kochsalz bekannt, aus den Edukten Natrium und Chlorgas hergestellt. Dieser Versuch ist eine Reaktion zwischen einem
Erweiterter Redoxbegriff (Einführung)
 Schulversuchspraktikum Annika Nüsse Sommersemester 2016 Klassenstufen 7 & 8 Erweiterter Redoxbegriff (Einführung) 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Dieses Protokoll zeigt
Schulversuchspraktikum Annika Nüsse Sommersemester 2016 Klassenstufen 7 & 8 Erweiterter Redoxbegriff (Einführung) 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Dieses Protokoll zeigt
E5: Faraday-Konstante
 E5: Faraday-Konstante Theoretische Grundlagen: Elektrischer Strom ist ein Fluss von elektrischer Ladung; in Metallen sind Elektronen die Ladungsträger, in Elektrolyten übernehmen Ionen diese Aufgabe. Befinden
E5: Faraday-Konstante Theoretische Grundlagen: Elektrischer Strom ist ein Fluss von elektrischer Ladung; in Metallen sind Elektronen die Ladungsträger, in Elektrolyten übernehmen Ionen diese Aufgabe. Befinden
Versuch 1. 1/48 Konzentrationsabhängigkeit des Elektrodenpotenzials
 1/48 Konzentrationsabhängigkeit des Elektrodenpotenzials Versuch 1 Wir stellen je 100 ml der folgenden Lösungen her: a) Silbernitrat AgNO3 (c = 0,1 mol/l) b) Kaliumnitrat KNO3 (c = 0,1 mol/l) 2/48 Konzentrationsabhängigkeit
1/48 Konzentrationsabhängigkeit des Elektrodenpotenzials Versuch 1 Wir stellen je 100 ml der folgenden Lösungen her: a) Silbernitrat AgNO3 (c = 0,1 mol/l) b) Kaliumnitrat KNO3 (c = 0,1 mol/l) 2/48 Konzentrationsabhängigkeit
Schulversuchspraktikum. Name: Jennifer Ahrens. Semester: Sommersemester Klassenstufen 11 & 12. Elektrolyse
 Schulversuchspraktikum Name: Jennifer Ahrens Semester: Sommersemester 2012 Klassenstufen 11 & 12 Elektrolyse Auf einen Blick: In dieser Unterrichtseinheit werden Versuche zur Elektrolyse vorgestellt, die
Schulversuchspraktikum Name: Jennifer Ahrens Semester: Sommersemester 2012 Klassenstufen 11 & 12 Elektrolyse Auf einen Blick: In dieser Unterrichtseinheit werden Versuche zur Elektrolyse vorgestellt, die
Wasserhärtebestimmung
 Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 9 & 10 Wasserhärtebestimmung Auf einen Blick: Im Folgenden wird ein Schüler- und ein Lehrerversuch zum Thema Wasserhärtebestimmung
Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 9 & 10 Wasserhärtebestimmung Auf einen Blick: Im Folgenden wird ein Schüler- und ein Lehrerversuch zum Thema Wasserhärtebestimmung
Von Arrhenius zu Brönsted
 Schulversuchspraktikum Name Annika Münch Sommersemester 2015 Klassenstufen 9/10 Von Arrhenius zu Brönsted Kurzprotokoll Auf einen Blick: Für die Unterrichtseinheit zum Themas Säure-Base-Konzepte und im
Schulversuchspraktikum Name Annika Münch Sommersemester 2015 Klassenstufen 9/10 Von Arrhenius zu Brönsted Kurzprotokoll Auf einen Blick: Für die Unterrichtseinheit zum Themas Säure-Base-Konzepte und im
Saure, neutrale und alkalische Lösungen
 Schulversuchspraktikum Sina Bachsmann Sommersemester 2014 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Im Folgenden
Schulversuchspraktikum Sina Bachsmann Sommersemester 2014 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Im Folgenden
Qualitativer Nachweis von Säuren und Basen
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen Kurzprotokoll Auf einen Blick: In diesem Protokoll wird ein Lehrerversuch, der
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen Kurzprotokoll Auf einen Blick: In diesem Protokoll wird ein Lehrerversuch, der
Schulversuchspraktikum. Till Beuermann. Sommersemester Klassenstufen 11 & 12. Batterien und Akkus
 Schulversuchspraktikum Till Beuermann Sommersemester 2013 Klassenstufen 11 & 12 Batterien und Akkus 1 Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Dieses Protokoll beschäftigt sich
Schulversuchspraktikum Till Beuermann Sommersemester 2013 Klassenstufen 11 & 12 Batterien und Akkus 1 Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Dieses Protokoll beschäftigt sich
Erweiterter Redoxbegriff
 Schulversuchspraktikum Friederike Kellner Sommersemester 2014 Klassenstufen 7 & 8 Erweiterter Redoxbegriff 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Die im Folgenden vorgestellte
Schulversuchspraktikum Friederike Kellner Sommersemester 2014 Klassenstufen 7 & 8 Erweiterter Redoxbegriff 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Die im Folgenden vorgestellte
Erscheinungsformen und Eigenschaften des Wassers
 Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 5 & 6 Erscheinungsformen und Eigenschaften des Wassers 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In
Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 5 & 6 Erscheinungsformen und Eigenschaften des Wassers 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In
Halogene, Nachweise in Alltagsprodukten
 Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 9 & 10 Halogene, Nachweise in Alltagsprodukten Auf einen Blick: Das Protokoll enthält für die Klassen 9 und 10 einen Lehrerversuch
Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 9 & 10 Halogene, Nachweise in Alltagsprodukten Auf einen Blick: Das Protokoll enthält für die Klassen 9 und 10 einen Lehrerversuch
Effizienz einer Solarzelle in Abhängigkeit vom Winkel der Einstrahlung
 Effizienz einer Solarzelle in Abhängigkeit vom Winkel der Einstrahlung Material: Solarzelle, Lichtquelle, Multimeter, Windrad, Kabel, Drehwinkelschablone Aufbau: 1. Stelle durch Anfertigung einer Schaltskizze
Effizienz einer Solarzelle in Abhängigkeit vom Winkel der Einstrahlung Material: Solarzelle, Lichtquelle, Multimeter, Windrad, Kabel, Drehwinkelschablone Aufbau: 1. Stelle durch Anfertigung einer Schaltskizze
Gefahrenstoffe H:
 V1 Verseifungsgeschwindigkeit eines Esters In diesem Versuch wird die Reaktionsgeschwindigkeit quantitativ ermittelt. Da dies anhand einer Verseifung eines Esters geschieht, sollten die Schülerinnen und
V1 Verseifungsgeschwindigkeit eines Esters In diesem Versuch wird die Reaktionsgeschwindigkeit quantitativ ermittelt. Da dies anhand einer Verseifung eines Esters geschieht, sollten die Schülerinnen und
Lösungswärme von Salzen
 Lösungswärme von Salzen In diesem Versuch wird die Lösungswärme von zwei Salzen, Calciumchlorid und Calciumchlorid-Hexahydrat ermittelt. Dabei wird die Temperaturänderung beim Lösen des Salzes kalorimetrisch
Lösungswärme von Salzen In diesem Versuch wird die Lösungswärme von zwei Salzen, Calciumchlorid und Calciumchlorid-Hexahydrat ermittelt. Dabei wird die Temperaturänderung beim Lösen des Salzes kalorimetrisch
erweiterter Redoxbegriff
 Schulversuchspraktikum Thomas Polle Sommersemester 2015 Klassenstufen 7 & 8 erweiterter Redoxbegriff 2 Auf einen Blick: Der erweiterte Redoxbegriff beschreibt die Redoxreaktion als Elektronenübertragungsreaktion,
Schulversuchspraktikum Thomas Polle Sommersemester 2015 Klassenstufen 7 & 8 erweiterter Redoxbegriff 2 Auf einen Blick: Der erweiterte Redoxbegriff beschreibt die Redoxreaktion als Elektronenübertragungsreaktion,
Endotherm und Exotherm
 Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 7 & 8 Endotherm und Exotherm Auf einen Blick: Das Protokoll enthält für die Klassen 7 und 8 einen Lehrerversuch und einen Schülerversuch
Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 7 & 8 Endotherm und Exotherm Auf einen Blick: Das Protokoll enthält für die Klassen 7 und 8 einen Lehrerversuch und einen Schülerversuch
Schwimmen, Schweben, Sinken
 Schulversuchspraktikum Patricia Hiller Sommersemester 2015 Klassenstufen 5 & 6 Schwimmen, Schweben, Sinken 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll werden
Schulversuchspraktikum Patricia Hiller Sommersemester 2015 Klassenstufen 5 & 6 Schwimmen, Schweben, Sinken 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll werden
Metalle und Nichtmetalle
 Schulversuchspraktium Bastian Hollemann Sommersemester 2015 Klassenstufen 9 & 10 Metalle und Nichtmetalle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Diese Unterrichtseinheit für
Schulversuchspraktium Bastian Hollemann Sommersemester 2015 Klassenstufen 9 & 10 Metalle und Nichtmetalle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Diese Unterrichtseinheit für
Schulversuchspraktikum. Isabel Böselt. Sommersemester Klassenstufen 5 & 6. Aggregatzustände. und deren Temperaturabhängigkeit
 Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit 1 Konzept und Lernziele 1 Auf einen Blick: In diesem Protokoll werden einfache
Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit 1 Konzept und Lernziele 1 Auf einen Blick: In diesem Protokoll werden einfache
Chemie-Lehrerin muss Knallgas-Explosion mit 1800 Euro büßen
 Überschrift 1 dem Text zuzuweisen, der hier angezeigt werden soll. 1 Name: Elektrolyse von Wasser Datum: Chemie-Lehrerin muss Knallgas-Explosion mit 1800 Euro büßen Göttingen. Eine Chemie-Lehrerin (48)
Überschrift 1 dem Text zuzuweisen, der hier angezeigt werden soll. 1 Name: Elektrolyse von Wasser Datum: Chemie-Lehrerin muss Knallgas-Explosion mit 1800 Euro büßen Göttingen. Eine Chemie-Lehrerin (48)
Galvanische Konzentrations- und Reaktions-Zellen
 12 - Konzentrationszellen.4.216 Übungen in physikalischer Chemie für Studierende der Pharmazie Versuch Nr.: 12 Version 216 Kurzbezeichnung: Konzentrationszellen Galvanische Konzentrations- und Reaktions-Zellen
12 - Konzentrationszellen.4.216 Übungen in physikalischer Chemie für Studierende der Pharmazie Versuch Nr.: 12 Version 216 Kurzbezeichnung: Konzentrationszellen Galvanische Konzentrations- und Reaktions-Zellen
Versuch: In der Natur verschwindet nichts - Lösen und Auskristallisieren von Salz
 Name: Datum: Versuch: In der Natur verschwindet nichts - Lösen und Auskristallisieren von Salz Material: Kochsalz (NaCl), Leitungswasser, Mineralwasser, Becherglas, Spatel, destilliertes Wasser, Alu-Teelichtschalen,
Name: Datum: Versuch: In der Natur verschwindet nichts - Lösen und Auskristallisieren von Salz Material: Kochsalz (NaCl), Leitungswasser, Mineralwasser, Becherglas, Spatel, destilliertes Wasser, Alu-Teelichtschalen,
Arbeitsblatt Wasserkreislauf der Erde
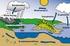 Arbeitsblatt Wasserkreislauf der Erde Aufgabe 1) Du hast im Unterricht bereits den Begriff des Aggregatzustands kennengelernt. Benenne die Übergänge zwischen den Aggregatzuständen, indem du die Pfeile
Arbeitsblatt Wasserkreislauf der Erde Aufgabe 1) Du hast im Unterricht bereits den Begriff des Aggregatzustands kennengelernt. Benenne die Übergänge zwischen den Aggregatzuständen, indem du die Pfeile
SV: Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration
 SV: Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration Der Versuch sollte mindestens zu zweit oder in einer Gruppe durchgeführt werden, damit die Messung so genau wie möglich erfolgt. Als
SV: Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration Der Versuch sollte mindestens zu zweit oder in einer Gruppe durchgeführt werden, damit die Messung so genau wie möglich erfolgt. Als
Schulversuchspraktikum. Annika Nüsse. Sommersemester Klassenstufen 9 & 10. Halogene
 Schulversuchspraktikum Annika Nüsse Sommersemester 2016 Klassenstufen 9 & 10 Halogene 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Das Protokoll beinhaltet je zwei Lehrer- und Schülerversuche
Schulversuchspraktikum Annika Nüsse Sommersemester 2016 Klassenstufen 9 & 10 Halogene 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Das Protokoll beinhaltet je zwei Lehrer- und Schülerversuche
Schulversuchspraktikum. Isabel Böselt. Sommersemester Klassenstufen 9 & 10. Alkalimetalle
 Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 9 & 10 Alkalimetalle 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll sollen Versuche zum
Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 9 & 10 Alkalimetalle 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll sollen Versuche zum
8. Löslichkeit verschiedener Salze bestimmen
 Praktikum Chemie N 8 Classe : Date de la remise : Note sur 10 : Nom(s) : 8. Löslichkeit verschiedener Salze bestimmen Video Löslichkeit Die Löslichkeit eines Stoffes gibt an, in welchem Umfang ein Reinstoff
Praktikum Chemie N 8 Classe : Date de la remise : Note sur 10 : Nom(s) : 8. Löslichkeit verschiedener Salze bestimmen Video Löslichkeit Die Löslichkeit eines Stoffes gibt an, in welchem Umfang ein Reinstoff
Umwelt und Recycling
 Schulversuchspraktikum Anonym_16 Sommersemester 2016 Klassenstufen 5 & 6 Umwelt und Recycling Kurzprotokoll Auf einen Blick: Versuch 1 und 2 behandeln die Problematik der Meeresverschmutzung mit Ölen.
Schulversuchspraktikum Anonym_16 Sommersemester 2016 Klassenstufen 5 & 6 Umwelt und Recycling Kurzprotokoll Auf einen Blick: Versuch 1 und 2 behandeln die Problematik der Meeresverschmutzung mit Ölen.
Seminar: Löse- und Fällungsgleichgewichte
 1 Seminar: Löse- und Fällungsgleichgewichte Ziel des Seminars: Lösungs- und Fällungsgleichgewichte sollen verstanden werden. Weiters soll durch praxisrelevante Beispiele die medizinische und klinische
1 Seminar: Löse- und Fällungsgleichgewichte Ziel des Seminars: Lösungs- und Fällungsgleichgewichte sollen verstanden werden. Weiters soll durch praxisrelevante Beispiele die medizinische und klinische
Schwimmen, Schweben, Sinken
 Schulversuchspraktikum Daniel Lüert Sommersemester 2016 Klassenstufen 5 & 6 Schwimmen, Schweben, Sinken 1 Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Auf den folgenden Seiten dieses
Schulversuchspraktikum Daniel Lüert Sommersemester 2016 Klassenstufen 5 & 6 Schwimmen, Schweben, Sinken 1 Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Auf den folgenden Seiten dieses
Schulversuchspraktikum. Olga Streck. Sommersemester Klassenstufen 5 & 6. Papier
 Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufen 5 & 6 Papier 2 Auf einen Blick: Diese Unterrichtseinheit für die Klassen 5 & 6 enthält 2 Lehrerversuche und 2 Schülerversuche zum Thema
Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufen 5 & 6 Papier 2 Auf einen Blick: Diese Unterrichtseinheit für die Klassen 5 & 6 enthält 2 Lehrerversuche und 2 Schülerversuche zum Thema
Grundlagen: Galvanische Zellen:
 E1 : Ionenprodukt des Wassers Grundlagen: Galvanische Zellen: Die Galvanische Zelle ist eine elektrochemische Zelle. In ihr laufen spontan elektrochemische Reaktionen unter Erzeugung von elektrischer Energie
E1 : Ionenprodukt des Wassers Grundlagen: Galvanische Zellen: Die Galvanische Zelle ist eine elektrochemische Zelle. In ihr laufen spontan elektrochemische Reaktionen unter Erzeugung von elektrischer Energie
Saure, neutrale und alkalische Lösungen
 Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen Auf einen Blick: Das Protokoll enthält für die Klassen 5 und 6 einen Lehrerversuch und
Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen Auf einen Blick: Das Protokoll enthält für die Klassen 5 und 6 einen Lehrerversuch und
Schulversuchspraktikum. Name: Tobias Piotrowski. Semester: Sommersemester 2013. Klassenstufen 9 & 10. ph-wert
 Schulversuchspraktikum Name: Tobias Piotrowski Semester: Sommersemester 2013 Klassenstufen 9 & 10 ph-wert 1 Beschreibung des Themas und zugehörige Lernziele (Max. 1 Seite) 2 Auf einen Blick: Dieses Protokoll
Schulversuchspraktikum Name: Tobias Piotrowski Semester: Sommersemester 2013 Klassenstufen 9 & 10 ph-wert 1 Beschreibung des Themas und zugehörige Lernziele (Max. 1 Seite) 2 Auf einen Blick: Dieses Protokoll
H1 Bestimmung des Löslichkeitsprodukts von Magnesiumhydroxid
 H Löslichkeitsprodukt und Komplexgleichgewichte Auch bei den Komplex-Reaktionen beschäftigen wir uns im Wesentlichen mit Gleichgewichtsreaktionen, in denen Liganden ausgetauscht werden. Dabei sollen Kriterien
H Löslichkeitsprodukt und Komplexgleichgewichte Auch bei den Komplex-Reaktionen beschäftigen wir uns im Wesentlichen mit Gleichgewichtsreaktionen, in denen Liganden ausgetauscht werden. Dabei sollen Kriterien
Universität Regensburg
 Universität Regensburg Fakultät für Chemie und Pharmazie 93040 Regensburg 14. März 2006 Institut für Anorganische Chemie Prof. Dr. R. Winter 1. Was besagt das Moseleysche Gesetz? Welche Größe kann man
Universität Regensburg Fakultät für Chemie und Pharmazie 93040 Regensburg 14. März 2006 Institut für Anorganische Chemie Prof. Dr. R. Winter 1. Was besagt das Moseleysche Gesetz? Welche Größe kann man
1.1 V 1 Überprüfung des Satzes von Hess mit der Reaktion von Calcium und Salzsäure
 1.1 V 1 Überprüfung des Satzes von Hess mit der Reaktion von Calcium und Salzsäure In diesem Versuch soll der Satz von Hess (die umgesetzte Wärmemenge ist bei einer chemischen Reaktion unabhängig vom Weg)
1.1 V 1 Überprüfung des Satzes von Hess mit der Reaktion von Calcium und Salzsäure In diesem Versuch soll der Satz von Hess (die umgesetzte Wärmemenge ist bei einer chemischen Reaktion unabhängig vom Weg)
Enthalpie und Entropie
 Schulversuchspraktikum Patricia Hiller Sommersemester 2015 Klassenstufen 11 & 12 Enthalpie und Entropie 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll zum Themenbereich
Schulversuchspraktikum Patricia Hiller Sommersemester 2015 Klassenstufen 11 & 12 Enthalpie und Entropie 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll zum Themenbereich
Analytische Chemie. B. Sc. Chemieingenieurwesen. 14. März Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 14. März 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 14. März 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Schulversuchspraktikum. Sommersemester 2014 Klassenstufen 11 & 12. Nährstoffe
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 11 & 12 Nährstoffe 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll befinden sich verschiedene Experimente
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 11 & 12 Nährstoffe 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll befinden sich verschiedene Experimente
Anorganische-Chemie. Michael Beetz Arbeitskreis Prof. Bein. Grundpraktikum für Biologen 2017
 Michael Beetz Arbeitskreis Prof. Bein Butenandstr. 11, Haus E, E 3.027 michael.beetz@cup.uni-muenchen.de Anorganische-Chemie Grundpraktikum für Biologen 2017 Trennungsgänge und Nachweise # 2 Trennungsgänge
Michael Beetz Arbeitskreis Prof. Bein Butenandstr. 11, Haus E, E 3.027 michael.beetz@cup.uni-muenchen.de Anorganische-Chemie Grundpraktikum für Biologen 2017 Trennungsgänge und Nachweise # 2 Trennungsgänge
Schulversuchspraktikum. Dennis Roggenkämper. Sommersemester Klassenstufen 11 & 12. Kohlenhydrate
 Schulversuchspraktikum Dennis Roggenkämper Sommersemester 2015 Klassenstufen 11 & 12 Kohlenhydrate 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Das Protokoll umfasst ein Lehrer-
Schulversuchspraktikum Dennis Roggenkämper Sommersemester 2015 Klassenstufen 11 & 12 Kohlenhydrate 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Das Protokoll umfasst ein Lehrer-
Arbeitsblatt Wie entstehen Farben?
 Arbeitsblatt Wie entstehen Farben? Der für das menschliche Auge sichtbare Wellenlängenbereich liegt bei 380-750 nm. Farbstoffe sind in der Lage bestimmte Wellenlängen des Lichts zu absorbieren und eine
Arbeitsblatt Wie entstehen Farben? Der für das menschliche Auge sichtbare Wellenlängenbereich liegt bei 380-750 nm. Farbstoffe sind in der Lage bestimmte Wellenlängen des Lichts zu absorbieren und eine
Chemie Protokoll. Versuch 2 3 (RKV) Reaktionskinetik Esterverseifung. Stuttgart, Sommersemester 2012
 Chemie Protokoll Versuch 2 3 (RKV) Reaktionskinetik Esterverseifung Stuttgart, Sommersemester 202 Gruppe 0 Jan Schnabel Maximilian Möckel Henri Menke Assistent: Durmus 20. Mai 202 Inhaltsverzeichnis Theorie
Chemie Protokoll Versuch 2 3 (RKV) Reaktionskinetik Esterverseifung Stuttgart, Sommersemester 202 Gruppe 0 Jan Schnabel Maximilian Möckel Henri Menke Assistent: Durmus 20. Mai 202 Inhaltsverzeichnis Theorie
Schulversuchspraktikum. Dennis Roggenkämper. Sommersemester Klassenstufen 5 & 6. Brandbekämpfung
 Schulversuchspraktikum Dennis Roggenkämper Sommersemester 2015 Klassenstufen 5 & 6 Brandbekämpfung 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Das Protokoll umfasst ein Lehrer-
Schulversuchspraktikum Dennis Roggenkämper Sommersemester 2015 Klassenstufen 5 & 6 Brandbekämpfung 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Das Protokoll umfasst ein Lehrer-
Arbeitskreis Kappenberg Bestimmung des Iodgehaltes mit Natriumthiosulfat- E 05
 Arbeitskreis Kappenberg Bestimmung des Iodgehaltes mit Natriumthiosulfat- E 05 Computer im Chemieunterricht lösung und Bestimmung der MWG-Konstanten Potenziometrie Prinzip: Die Probe der Iodlösung wird
Arbeitskreis Kappenberg Bestimmung des Iodgehaltes mit Natriumthiosulfat- E 05 Computer im Chemieunterricht lösung und Bestimmung der MWG-Konstanten Potenziometrie Prinzip: Die Probe der Iodlösung wird
Fette, Öle und Tenside
 Schulversuchspraktikum Thomas Polle Sommersemester 2015 Klassenstufen 11 & 12 Fette, Öle und Tenside Kurzprotokoll Inhalt Inhaltsverzeichnis 1Weitere Lehrerversuche... 3 V1 Verseifungszahl... 3 2Weitere
Schulversuchspraktikum Thomas Polle Sommersemester 2015 Klassenstufen 11 & 12 Fette, Öle und Tenside Kurzprotokoll Inhalt Inhaltsverzeichnis 1Weitere Lehrerversuche... 3 V1 Verseifungszahl... 3 2Weitere
Gefahrenstoffe. P: Zinknitrat-Hexahydrat-Lösung H: P:
 Redoxreihe Der Versuch führt den SuS vor Augen, dass sich nicht jedes Metall von jeder Metallsalz-Lösung oxidieren lässt, sondern dass es viel mehr eine experimentell zu ermittelnde Gesetzmäßigkeit dahintersteckt.
Redoxreihe Der Versuch führt den SuS vor Augen, dass sich nicht jedes Metall von jeder Metallsalz-Lösung oxidieren lässt, sondern dass es viel mehr eine experimentell zu ermittelnde Gesetzmäßigkeit dahintersteckt.
