9 Experimenteller Teil. 9.1 Allgemeine Bemerkungen
|
|
|
- Hermann Becke
- vor 5 Jahren
- Abrufe
Transkript
1 Experimenteller Teil 78 9 Experimenteller Teil 9.1 Allgemeine Bemerkungen, -Dihydroxybiphenyl (Merck),,-Dibromtoluol (Aldrich), -(Brommethyl)brombenzol (Aldrich), -Bromphenol (Aldrich), 1,-Phenyldiboronsäure (Lancaster), -Hydroxypyrimidin Hydrochlorid (Aldrich), Tetrabutylammoniumfluorid (1M Lösung in THF) (Aldrich), tert.-butyldiphenylsilylchlorid (Aldrich), Tetrakis-triphenylphosphinpalladium [11] wurden ohne weitere Reinigung verwendet. Die entsprechenden ligoethylenglykole wurden im Vakuum destilliert und über Molekularsieb aufbewahrt. Toluol-p-sulfonylchlorid wurde mehrfach aus n-heptan umkristallisiert und unter Argon gelagert. atriumhydrid (80 % in Mineralöl) wurde durch wiederholtes Waschen mit wasserfreiem n-hexan vom Mineralöl befreit und unter Argon gelagert. Verwendete Lösungsmittel wurden nach Standardmethoden gereinigt und getrocknet [11] und vor Verwendung mit Hilfe der Karl-Fischer-Methode [117] auf den Wassergehalt geprüft. Für die hydrogenolytische Abspaltung der Benzylschutzgruppe unter erhöhter Temperatur und Drücken wurde eine Hydrierapparatur der Firma Parr Instrument (Deutschland, Frankfurt a.m.) verwendet. Kieselgel 0 (d = µm, µm) (Merck) wurde für die Säulenchromatographie und Kieselgel 0 PF (gipshaltig ) (Merck) für die fliehkraftvermittelte präparative Dünnschichtchromatographie mit einem Chromatotron der Firma Harrison Research Europe (Muttenz) verwendet. Die Identität und Reinheit der synthetisierten Verbindungen wurde mit 1 H- und 1 C-MR Spektroskopie (Varian Unity 00 oder Bruker WP 00 Spektrometer) mit Tetramethylsilan als innerem Standard und EI-Massenspektrometrie (AMD 0) und Elektrospraymassenspektrometrie (eine Lösung der Verbindungen in CHCl /MeH/H mit einer Konzentration von ca. 10 µg/ml wurden in einem Finnigan MAT LCQ Spektrometer vermessen) überprüft. Für die Dünnschichtchromatographie wurden mit Kieselgel beschichtete Aluminiumfolien (Merck) verwendet. Die Detektion erfolgte mit UV-Licht ( und nm), mittels Einwirken von Ioddämpfen, Besprühen der Dünnschichtfolie mit alkalischer Bromthymolblau-Lösung und anschließender Einwirkung von Ammoniak oder mit Dragendorfs Reagenz [118]. Phasenumwandlungstemperaturen werden in Grad Celsius angegeben und sind nicht korrigiert. Die Umwandlungstemperaturen wurden mit einem Boetius-Heiztischmikroskop nach KFLER oder mit einem Mettler FP HAT Heiztisch in Verbindung mit einem ikon ptiphot Polarisationsmikroskop bestimmt und mit den Ergebnissen der DSC Messungen mit einem Perkin-Elmer DSC-7 abgestimmt. Für die Röntgenkristallstrukturanalysen wurden automatische Vierkreisdiffraktometer STADI oder IPDS der Firma Stoe & Cie verwendet. Die Charge-Transfer Komplexe wurden entweder durch Lösen der entsprechenden Mengen der Verbindungen und,,7-trinitrofluorenon in Chloroform und anschließendem Entfernen des Lösungsmittels unter vermindertem Druck oder direkt durch Vermischen der isotropen Phasen erhalten.
2 Experimenteller Teil 79 Monoschichten an der Wasser/Luft-Grenzfläche wurden mit einer Filmwaage der Firma R&K durchgeführt. Dabei wurden ca. 1mM Lösungen der Verbindungen in frisch destilliertem Chloroform auf die Wasseroberfläche gespreitet und die Barrieren mit ca. 0.1 nm Molekül -1 min -1 bewegt. Das verwendete Wasser wurde mit einer Millipor-Anlage gereinigt. Die Ausbeuten beziehen sich auf die reinen, nach den chromatographischen Trennungen und Umkristallisation erhaltenen Produkte und sind nicht optimiert. Die meisten Cyclischen Verbindungen, die Heterocyclen und zwei ligoethylenglykolbrücken enthalten, nahmen an der Luft sehr schnell Feuchtigkeit auf. Deshalb wurden die Verbindungen durch Erhitzen auf ca. 0 C über den Klärpunkt (~1 min) getrocknet, sofort verschlossen und untersucht. Die umerierung der Kohlenstoffatome im experimentellen Teil folgt nicht der IUPAC- omenklatur, sondern soll der Vereinfachung und Übersichtlichkeit dienen.
3 Experimenteller Teil Allgemeine Arbeitsvorschriften-Synthese der Intermediate Die Charakterisierung eines Teiles der Zwischenverbindungen ist in Anhang II beschrieben WILLIAMS-Veretherung Methode A: 1 mmol Phenol und 1.1 Äquivalente des entsprechenden Tosylates oder Halogenides werden in einer Argonatmosphäre zu einer Suspension von 10 Äquivalenten Kaliumcarbonat und einer Spatelspitze Tetrabutylammoniumiodid in 0 ml Acetonitril gegeben und unter Rühren am Rückfluß erwärmt. Die Reaktion wird dünnschichtchromatographisch verfolgt (Elutionsmittel: CHCl /MeH 10:0... oder Benzin (Kp.: C)/EtAc 10:...). Sobald kein Phenol mehr nachweisbar ist, wird die Reaktionsmischung auf Raumtemperatur abgekühlt und das Lösungsmittel unter vermindertem Druck abdestilliert. Der Rückstand wird mit Methylenchlorid oder Diethylether (0 ml) und destilliertem Wasser (0 ml) versetzt und die Phasen getrennt. Die wäßrige Phase wird noch einmal mit dem entsprechenden organischen Lösungsmittel extrahiert und die organischen Phasen vereinigt. Die organische Phase wird mit jeweils 0 ml M HCl, gesättigter atriumhydrogencarbonatlösung, destilliertem Wasser und gesättigter Kochsalzlösung gewaschen und über atriumsulfat getrocknet. Das Lösungsmittel wird unter vermindertem Druck abdestilliert und das Rohprodukt durch verschiedene chromatographische Methoden gereinigt oder aus geeigneten Lösungsmittelgemischen umkristallisiert. Methode B: Unter einer Argonatmosphäre wird langsam unter starkem Rühren zu 0 Äquivalenten ligoethylenglykol portionsweise Äquivalente atrium so zugegeben, daß die Reaktion unter Kontrolle gehalten werden kann. Sobald alles atrium zugegeben ist, erwärmt man die Reaktionsmischung langsam auf 70 C bis alles atrium gelöst ist. ach einer Stunde Rühren bei dieser Temperatur wird 1 mmol Benzylbromid portionsweise zugeben und anschließend für 18 Stunden bei 0 C gerührt. ach Abkühlen auf Raumtemperatur versetzt man die Reaktionsmischung mit dest. H (100 ml) und extrahiert die Lösung dreimal mit Chloroform oder Methylenchlorid (je 80 ml). Die vereinigte organische Phase wird mit destilliertem Wasser und gesättigter Kochsalzlösung (je 0 ml) gewaschen und über atriumsulfat getrocknet. Das Rohprodukt, das durch Abdestillieren des Lösungsmittels unter vermindertem Druck erhalten wird, kann chromatographisch gereinigt werden. Methode C: Kommerziell erhältliches ah (0 % in Mineralöl) wird in einer Argonatmosphäre mehrfach (...mal) mit wasserfreiem Hexan gewaschen und im Vakuum getrocknet. Zu 1.1 Äquivalenten so behandeltem ah werden 10 ml DMF gegeben und die Suspension auf
4 Experimenteller Teil C gekühlt. Bei dieser Temperatur werden unter Rühren 1 mmol Alkohol in 10 ml DMF langsam zugegeben und nach Beendigung der Wasserstoffentwicklung h gerührt. Das entsprechende Halogenid (1 Äquivalent) wird portionsweise hinzu gegeben und die Reaktionsmischung 1 h bei Raumtemperatur und anschließend h bei 0 C gerührt. Zu der auf Raumtemperatur abgekühlten meist tiefschwarzen Reaktionsmischung wird vorsichtig 1 ml Methanol und Wasser (1 ml) zugegeben, das Lösungsmittel unter vermindertem Druck abdestilliert und der Rückstand in 0 ml Dichlormethan oder 0 ml Essigester und 1 ml HCl aufgenommen und die Phasen getrennt. Die organische Phase wird mit wäßriger atriumhydrogencarbonatlösung, Wasser und gesättigter Kochsalzlösung (jeweils 1 ml) gewaschen und über atriumsulfat getrocknet. Das Rohprodukt, welches durch Abdestillieren des Lösungsmittels erhalten wird, kann in siedendem Methanol aufgenommen werden und wird heiß filtriert, um es von den schwarzen ebenprodukten abzutrennen. Das Filtrat wird unter vermindertem Druck eingeengt und kann durch Umkristallisation aus geeigneten Lösungsmittelgemischen oder chromatographisch gereinigt werden. 9.. Tosylierung Methode A: 1 mmol des entsprechenden Alkohols werden in 10 ml eines Gemisches von gleichen Teilen THF und 0%iger wäßriger ah gelöst und auf 0... C abgekühlt. Bei dieser Temperatur werden unter starkem Rühren über einen Zeitraum von Stunden 1. Äquivalente Toluol-psulfonylchlorid in ml THF mit Hilfe einer Dosierpumpe zugegeben. Man rührt weitere h bei dieser Temperatur und versetzt die Reaktionsmischung mit 0 ml destilliertem Wasser. Das Gemisch wird dreimal mit Methylenchlorid (je ml) extrahiert und die vereinigte organische Phase mit destilliertem Wasser und anschließend mit gesättigter Kochsalzlösung gewaschen und über atriumsulfat getrocknet. Das nach dem Abdestillieren des Lösungsmittels unter vermindertem Druck erhaltene Rohprodukt wird chromatographisch gereinigt. Methode B: Die Reaktion wird wie in Methode A beschrieben durchgeführt. Zur Aufarbeitung wird die Reaktionsmischung in 0 ml Eis/H gegeben und die wäßrige Phase mit Toluol (mal 10 ml) extrahiert. Die vereinigte organische Phase wird mit gesättigter Kochsalzlösung gewaschen und über Calciumchlorid getrocknet. Dabei bilden die monotosylierten ligoethylenglykole schwerlösliche Komplexe, die durch Filtration abgetrennt werden können. Durch Abdestillieren des Lösungsmittels werden die ligoethylenglykolbistosylate im allgemeinen rein erhalten, so daß keine weitere Reinigung erforderlich ist.
5 Experimenteller Teil Photobromierung mit BS Zu einer gut gerührten, siedenden Suspension von 1 mmol der Benzylverbindung und 1.1 Äquivalenten -Bromsuccinimid in 80 ml wasserfreiem CCl werden ca. 00 mg Dibenzoylperoxid zugegben und die Reaktionsmischung Stunden am Rückfluß erhitzt. ach Abkühlen auf Raumtemperatur wird vom Succinimid abfiltriert und der iederschlag mal mit Tetrachlorkohlenstoff gewaschen und das Lösungsmittel der vereinigten organischen Phasen unter vermindertem Druck abdestilliert. Das so erhaltene Rohprodukt kann aus geeigneten Lösungsmittelgemischen umkristallisiert werden. 9.. Herstellung von Boronsäuren aus Bromarenen Methode A: Eine auf C gekühlte aus 1 mmol Bromaren und 1. Äquivalenten Mg in 100 ml wasserfreiem THF hergestellte Grignard-Lösung wird unter Rühren in einer Argonatmosphäre zu einer auf -0 C gekühlten Lösung von Äquivalenten Borsäuretrimethylester in 0 ml wassserfreiem THF über einen Zeitraum von einer Stunde getropft. Man läßt die Reaktionsmischung langsam auf Raumtemperatur erwärmen und rührt 1 Stunden bei dieser Temperatur. ach der Hydrolyse mit 10%iger Salzsäure ( Äquivalente), wird die entstehende Suspension mit Diethylether oder Essigsäureethylester zweimal (ca. 0 ml) extrahiert und die vereinigte organische Phase mit gesättigter Kochsalzlösung (0 ml) gewaschen. ach Trocknen über atriumsulfat wird das Lösungsmittel unter verminderten Druck abdestilliert und das Rohprodukt aus Benzin (Kp.: C) oder Pentan umkristallisiert. Methode B: Zu einer auf -70 C gekühlten Lösung von 1 mmol Bromaren in 0 ml wasserfreiem THF werden unter Rühren 1. Äquivalente n-butyllithium (1.M-Lösung in Hexan) langsam zugegeben und nach beendigter Zugabe die Reaktionsmischung h bei dieser Temperatur gerührt. Zu dieser Lösung wird bei -70 C eine auf -0 C gekühlte Lösung von Äquivalenten Borsäuretrimethylester in 0 ml wassserfreiem THF über einen Zeitraum von einer Stunde getropft. Man läßt die Reaktionsmischung in einem Zeitraum von...8 Stunden auf Raumtemperatur erwärmen und rührt 1 Stunden bei dieser Temperatur. ach der Hydrolyse mit 10%iger Salzsäure ( Äquivalente) wird die entstehende Suspension mit Diethylether oder Essigsäureethylester zweimal (ca. 0 ml) extrahiert und die vereinigte organische Phase mit gesättigter Kochsalzlösung (0 ml) gewaschen. ach Trocknen über atriumsulfat wird das Lösungsmittel unter verminderten Druck abdestilliert und das Rohprodukt aus Benzin (Kp.: C) oder Pentan umkristallisiert.
6 Experimenteller Teil SUZUKI-Kupplung Methode A: 1 mmol Boronsäure und 1.1 Äquivalente der entsprechenden Halogenarenverbindung werden in 0 ml eines Gemisches aus Benzol (0 ml) und M a C - Lösung suspendiert und die Reaktionsapparatur sorgfältig sekuriert. Im Argongegenstrom werden 0.1 Äquivalente Pd(PPh ) zugegeben und die Reaktionsmischung bei Raumtemperatur gerührt. Die Reaktion wird dünnschichtchromatographisch verfolgt (Elutionsmittel: CHCl /MeH 10:0... oder Benzin (Kp.: C)/EtAc 10:...). Sobald keine Halogenarenverbindung mehr nachweisbar ist, wird der sich bildende iederschlag abgesaugt, in Methylenchlorid (0 ml) aufgenommen und mit H und gesättigter Kochsalzlösung gewaschen. ach Trocknen der organischen Phase über atriumsulfat und Abdestillieren des Lösungsmittels unter vermindertem Druck kann das erhaltene Rohprodukt durch Umkristallisieren aus geeigneten Lösungsmittelgemischen gereinigt werden. Methode B: 1 mmol Boronsäure und 1.1 Äquivalente der entsprechenden Halogenarenverbindung werden in 0 ml eines Gemisches aus Glyme (0 ml) und 1M ahc - Lösung suspendiert und die Reaktionsapparatur sorgfältig sekuriert. Im Argongegenstrom werden 0.1 Äquivalente Pd(PPh ) zugegeben und die Reaktionsmischung unter Rühren am Rückfluß erwärmt. Die Reaktion wird dünnschichtchromatographisch verfolgt (Elutionsmittel: CHCl /MeH 10:0... oder Benzin (Kp.: C)/EtAc 10:...). Sobald keine Halogenarenverbindung mehr nachweisbar ist, wird die Reaktionsmischung auf Raumtemperatur abgekühlt und das Lösungsmittel unter vermindertem Druck auf die Hälfte eingeengt. Die so erhaltene Suspension wird dreimal mit Methylenchlorid (jeweils 0 ml) extrahiert, die vereinigte organische Phase mit 0 ml gesättigter Kochsalzlösung gewaschen und über atriumsulfat getrocknet. Das erhaltene Rohprodukt kann durch Umkristallisieren aus geeigneten Lösungsmittelgemischen gereinigt werden. 9.. Hydrogenolytische Abspaltung der Benzylschutzgruppe Methode A: 1 mmol der entsprechenden benzylgeschützten Verbindung wird in einem Hydriergefäß in 0 ml Essigsäureethylester oder bei Verbindungen, die in diesem Lösungsmittel nicht oder schwer löslich sind, in 0 ml eines Gemisches von THF/CH Cl /Eisessig im Verhältnis 8./1/0. gelöst und 10 mol% Palladium (10 % auf Aktivkohle) zugegeben. Die Apparatur wird 10 Minuten mit Wasserstoff gespült und anschließend in einer Wasserstoffatmosphäre geschüttelt. Die Reaktion wird dünnschichtchromatographisch verfolgt (Elutionsmittel: CHCl /MeH 10:0... oder Benzin (Kp.: C)/EtAc 10:...) und sobald kein Ausgangsstoff mehr nachweisbar ist, der Katalysator durch Filtration abgetrennt. Das Lösungs-
7 Experimenteller Teil 8 mittel wird unter vermindertem Druck abdestilliert und das Rohprodukt aus geeigneten Lösungsmittelgemischen umkristallisiert. Methode B: 1 mmol der entsprechenden benzylgeschützten Verbindung und 10 mol% Palladium (10 % auf Aktivkohle) werden in 0 ml Essigsäureethylester heiß gelöst und in ein Druckgefäß gegeben, dreimal mit Wasserstoff gespült und anschließend auf 70 C erwärmt. Die Reaktionsmischung wird in einer Wasserstoffatmosphäre bei atm solange geschüttelt bis dünnschichtchromatographisch (Elutionsmittel: CHCl /MeH 10:0... oder Benzin (Kp.: C)/EtAc 10:...) kein Ausgangsstoff mehr nachweisbar ist. Die Reaktionsmischung wird, zum Abtrennen des Katalysators, heiß filtriert und das Lösungsmittel unter vermindertem Druck abdestilliert. Das Rohprodukt kann durch Umkristallisation aus geeigneten Lösungsmittelgemischen gereinigt werden. 9. Allgemeine Arbeitsvorschrift-rthopalladierung Äquimolare Mengen (1 mmol) des Liganden und Pd(PhC) Cl werden bei Raumtemperatur in 10 ml Ethanol suspendiert und 1 min gerührt. Anschließend wird soviel Chloroform (ca. 0. ml) zugegeben bis eine klare Lösung entsteht. Es bildet sich ein iederschlag der nach 8 h rühren bei Raumtemperatur abgesaugt und nacheinander mit Ethanol und Aceton (je ml) gewaschen wird. Das Produkt wird in frisch destilliertem Chloroform gelöst, filtriert und das Lösungsmittel unter vermindertem Druck abdestilliert. Die Komplexe können aus Chloroform/ Ethanol umkristallisiert werden. 9. Allgemeine Arbeitsvorschriften-Synthese der Cyclophane 9..1 WILLIAMS-Veretherung (Cyclisierung) Die Reaktionen wurden in einer Argonatmosphäre mit sorgfältig getrockneten und sekurierten Geräten durchgeführt. 0.1 mmol Tosylat- oder Halogenverbindung und 1 Äquivalent des entsprechenden Phenols werden in 100 ml DMF (abs.) gelöst und über einen Zeitraum von 1... h mit Hilfe einer Dosierpumpe zu einer auf 80 C erwärmten Suspension von 10 Äquivalenten Kaliumcarbonat und 10 Äquivalenten Kaliumtosylat in 0 ml DMF getropft. Das Reaktionsgemisch wird 1 bis 7 Stunden bei dieser Temperatur gerührt und anschließend auf Raumtemperatur abgekühlt. Unter vermindertem Druck wird das Lösungsmittel abdestilliert und der Rückstand in 70 ml Methylenchlorid und 0 ml destilliertem Wasser aufgenommen und die Phasen getrennt. Die organische Phase wird mit jeweils 0 ml M HCl, gesättigter
8 Experimenteller Teil 8 atriumhydrogencarbonatlösung, destilliertem Wasser und gesättigter Kochsalzlösung (jeweils ca. 1 ml) gewaschen und über atriumsulfat getrocknet. Das Lösungsmittel wird unter vermindertem Druck abdestilliert und das Rohprodukt durch verschiedene chromatographische Methoden gereinigt und anschließend bis zur Konstanz der Phasenumwandlungstemperaturen aus geeigneten Lösungsmittelgemischen umkristallisiert. 9.. YAMAGUCHI-Lactonisierung 0. mmol Dicarbonsäure werden in 8 ml getrocknetem THF gelöst und auf 0 C abgekühlt. Zu der gerührten Lösung werden bei dieser Temperatur mit einer Spritze 0. mmol,,- Trichlorbenzoesäurechlorid und anschließend 0.8 mmol absolutes Pyridin langsam zugegeben. Die Reaktionsmischung wird 0 Minuten bei dieser Temperatur und anschließend bei Raumtemperatur weitere 90 Minuten gerührt. Die Reaktionsmischung wird unter Argon filtriert und das Filtrat mit wasserfreiem Methylenchlorid auf 70 ml verdünnt. 0. mmol des entsprechenden Alkohols werden in 70 ml wasserfreiem Methylenchlorid gelöst und beide Lösungen simultan mit zwei Dosierpumpen oder zwei Tropftrichtern über einen Zeitraum von 1 bis 0 Stunden zu einer auf 0 C gekühlten Suspension von mmol DMAP in 0 ml wasserfreiem Methylenchlorid gegeben. Die Reaktionsmischung wird 8 Stunden bei 0 C und weitere 18 Stunden bei Raumtemperatur gerührt und danach mit jeweils 0 ml HCl (mal), gesättigter atriumhydrogencarbonatlösung und gesättigter Kochsalzlösung gewaschen. Die organische Phase wird über atriumsulfat getrocknet und das Lösungsmittel unter vermindertem Druck abdestilliert. Das Rohprodukt wird chromatographisch gereinigt und anschließend bis zur Konstanz der Phasenumwandlungstemperaturen aus geeigneten Lösungsmittelgemischen umkristallisiert.
9 Experimenteller Teil 8 9. Synthese der Cyclophane mit zwei gleichen starren Struktureinheiten 9..1 TBETBE 1a 7,10,1,1,19,9,,,8,1-Decaoxapentacyclo[0...,.. 1,.,7 ]dopentaconta-,,1,,,7,,(1),,7,9,1-dodecaen Ansatz: 0. mmol (0. g) 1,11-Bis[-( -hydroxyphenyl)benzyloxy]-,7,10- trioxaundecan 0. mmol (0.7 g) Tetraethylenglykolbistosylat. mmol (0.7 g) K C. mmol (1.1 g) KTos 100 ml wasserfreies DMF Reaktionszeit: 19 h Elutionsmittel: Chloroform/Methanol (10:1) Umkristallisiert aus: Heptan ' TB 1' 1 ' ' α Ausbeute: 0 mg (8 %) cr 10 S E 10 S A 11 is C H 10 berechnet C 70. H g/mol gefunden C 70. H H-MR (CDCl, 00 MHz): δ.0-.7 (m, H, CH ),.8 (t, H, J.9 Hz, C- - CH CH ),.0 (t, J. Hz, H, C- -CH ),. (s, H, H α,α ),.8 (d, J 8.8 Hz, H, H, ), 7.9 (d, J 8. Hz, H, H, ), 7.7 (d, J 8.8 Hz, H, H, ), 7.0 (d, J 8.1 Hz, H, H, ). EIMS m/z (relative Intensität, %): 71 (90, M + ), 8 (9), 0 (), 0 (1), (), 97 (8), 9 (10), (11), (10), 09 (0), 197 (8), 18 (100), 1 (9), 1 (), 1 (8), 119 (10), 10 (0), 89 (80), 7 (17), 9 (18). 9.. BPEBTE 1b,9,1,1,18,9,,,8,1-Decaoxapentacyclo[0...,.. 0,.,8 ]dopentaconta-,,0,,,,,(1),,7,9,1-dodecaen Ansatz: 1 mmol (0.87 g), -Bis-[1-(toluol-p-sulfonyloxy)-,,8,11-tetraoxa tridecyl]biphenyl 8 1 mmol (0.18 g), -Dihydroxybiphenyl 10 mmol (1. g) K C 10 mmol (.11 g) KTos 10 ml wasserfreies DMF
10 Experimenteller Teil 87 Reaktionszeit: 17 h Elutionsmittel: Chloroform/Methanol (10:1) Umkristallisiert aus: Essigsäureethylester Geeignete Kristalle für die Röntgenkristallstrukturanalyse konnten aus Essigsäureethylester erhalten werden. ' 1' ' ' BP 1' ' ' ' 1 BT 1 α Ausbeute: 80 mg (11 %) cr 8 S E 9 S A 118 is C H 10 berechnet C 70. H g/mol gefunden C H 7. 1 H-MR (CDCl, 00 MHz): δ (H, m, CH ),.8 (t, J.8 Hz, H, C-, BP - CH CH ),.09 (t, J.8 Hz, H, C-, BP -CH ),. (s, H, H-α,α ),.8 (d, J 8.7 Hz, H, H,,, BP), 7.9 (d, J 8.1 Hz, H, H,,, BT), 7.1 (d, J 8.7 Hz, H, H,,, BP), 7. (d, J 8.1 Hz, H, H,,, BT). EIMS m/z (relative Intensität, %): 71 (100. M + ), 7 (10), 8 (), 0 (), (7), 19 (1), 180 (1), 89 (). 9.. DPTEDPTE a 10,1,1,19,,,8,1,,7,0,,1,,,,1,-Dodecaoxadithiatetraazaheptacyclo[...,9.,9.,7.1,.1 0, ]hexahexaconta-,,,8,,8,0,,,,, (1),7,9,,-hexadecaen Ansatz: mmol (0. g),-bis(-hydroxyphenyl)-1,,-thiadiazol mmol (1.09 g) Pentaethylenglykolbistosylat 97c 0 mmol (.7 g) K C 0 mmol (.0 g)ktos ' ' 1'' 0 ml wasserfreies DMF S 1' '' ' '' ' '' Reaktionszeit: 17 h ' Elutionsmittel: Methylenchlorid/Ethanol (10:0...) S Umkristallisiert aus: Toluol /Ethanol ε Ausbeute: 1 mg (0. %) cr 11 S C is C 8 H 1 S berechnet 9.1 (M+1) g/mol gefunden H-MR (CDCl, 00 MHz) δ.7 (s, 8H, H ε,ε ),.8-.7 (m, 1H, CH ),.8 (t, J.8 Hz, 8H, Ar-CH -CH ),.0 (t, J.8 Hz, 8H, Ar-CH ),.8 (d, J 8. Hz, 8H, H,,, ),.70 (d, J 8. Hz, 8H, H,,, ). EIMS m/z (relative Intensität, %): 9 (8, M + ), 91 (10), 900 (1), 88 (19), 89 (0), 8 (18), 81 (17), 781 (0), 78 (), 7 (1), 7 (1), 0 (1), 1 (0), 7 (), 9 (), 8 (8), 97 (), 70 (8), 1 (89), 1 (100). ESI-MS m/z (relative Intensität): 9 [M+H] + (100), 901 (1), 87 ().
11 Experimenteller Teil DPTEDPTE b 10,1,1,19,,,8,1,,7,0,,,9,,70,,,,-tetradecaoxadithiatetraazaheptacyclo[8...,9. 9,. 7,0.1,.1, ]doheptaconta-,,,8,9,1,,,7,9,0, (1),,,8, 71-hexadecaen Ansatz:.0 mmol (1.08 g),-bis(-hydroxyphenyl)-1,,-thiadiazol.0 mmol (. g) Hexaethylenglykolbistosylat 97d 0 mmol (. g) K C ' 0 mmol (8. g ) KTos ' β α 1'' S 1' 890 ml wasserfreies DMF '' ' '' ' '' ' Reaktionszeit: 10 h S Elutionsmittel: Methylenchlorid/Ethanol (10:0...) Umkristallisiert aus: Essigsäureethylester/Acetonitril, Ethanol Ausbeute: mg (0.9 % bezogen auf 0 mg getrenntes Rohprodukt) cr 118 S C 18 is C H 1 S berechnet (M+1) g/mol gefunden H-MR (CDCl, 00 MHz) δ.-.7 (m, 1H, CH ), (m, 1H, CH ),.8 (t, J. Hz, 8H, H β,β ),.09 (t, J. Hz, 8H, H α,α ),.90 (d, J 8.0 Hz, 8H, H,,, ), 7.79 (d, J 8.0 Hz, 8H, H,,, ). EIMS m/z (relative Intensität, %): 10 (1), 100 (), 987 (1), 9 (8), 8 (88), 9 (18), 1 (), 70 (70), 1 (100). 9.. DPTE 10,1,1,19,,,9,,,-Heptaoxathiadiazatetracyclo[7...,9.1, ]hexatriaconta-,,,8,0,1(1),,-octaen Elutionsmittel: Methylenchlorid/Ethanol (10:0...1) Umkristallisiert aus: Essigsäureethylester/Acetonitril, Ethanol: Heptan/Toluol, Ethanol ' ' 1'' '' '' '' S 1' ' ' ' α Ausbeute: mg (0.9 % bezogen auf 0 mg getrenntes Rohprodukt) Fp.:18 C C H 7 S berechnet (M+1) + 1. g/mol gefunden H-MR (CDCl, 00 MHz) δ.1-. (m, 8H, H ζ,ζ,ε,ε ),.8-.0 (m, H, H δ,δ ),.8-.1 (m, H, H γ,γ ),.7 (t, J.8 Hz, H β,β ),. (t, J.9 Hz, H α,α ), 7.18 (d, J 8.8 Hz, H, H,,, ), 7.88 (d, J 8.8 Hz, H, H,,, ). EIMS m/z (relative Intensität, %): 1 (100, M + ), 7 (), 7 (9), 7 (7), 8 (8), 00 (7), 8 (1), 9 (10), 8 (10), (1). ζ ε δ γ β
12 Experimenteller Teil 89 ESI-MS m/z (relative Intensität): [M+K] + (1 %), 9 [M+a] + (19 %), 17 [M+H] + (100 %). 9.. DPTMEDPTEM (R,R)-11,-Dimethyl-1,1-dioxo-10,1,1,19,,,8,1,,7,0,,1,,,,1,- Dodecaoxadithiatetraazaheptacyclo[...,9.,9.,7.1,.1 0, ]hexahexaconta-,,,8,,8,0,,,,,(1),7,9,,-hexadecaen Synthetisiert nach allgemeiner Arbeitsvorschrift 9.. YAMAGUCHI-LACTISIERUG Ansatz: 0. mmol (0.097 g) (R,R)-,-Bis{-[1-(ethoxycarbonyl)ethoxy)phenyl]}- 1,,-thiadiazol 0. mmol (0.1 g),,-trichlorbenzoylchlorid 0.8 mmol (0.0 ml) Pyridin 0. mmol (0.1 g),-bis[-(1-hydroxy-1,,7,10-tetraoxadodecyl)phenyl]- 1,,-thiadiazol 1. mmol (0.190 g) DMAP 0 ml Methylenchlorid ' ' 1'' Reaktionszeit: 0 h S 1' '' ' '' ' Elutionsmittel: Methylenchlorid/Ethanol '' ' (10:0...) S Umkristallisiert aus: Ethanol Ausbeute: 80.7 mg (1 %) cr 17 (S C * 1) Ch 1 BP 1 is C 0 H 1 S berechnet (M+1) g/mol gefunden H-MR (CDCl, 00 MHz) δ 1.1 (d, J.7 Hz, H, CH -CH),.9-. (m, 8H, CH ),. (m, 8H, CH ),.70 (m, H, CH ),.8 (t, J. Hz, H, C-, -CH ),.1 (B des A,A,B-Spinnsystems, J. Hz, H, C()CH -CH ),.1 (A,A des A,A,B-Spinnsystems, J. Hz, J. Hz, H, C()CH -CH ),.7 (q, J.7 Hz, H, CH -CH),.8,.88 (d, J 8.7 Hz, 8H, H,,, ), 7.7, 7.7 (d, ü, J 8.7 Hz, 8H, H,,, ). 1 C-MR (100 MHz, CDCl ): δ 19. (CH ),.0, 8.81, 9.90, 70., 71.7, 71.79, 71.89, 7.0, 7. (CH ), 11., 11. (C-,,, DPT ), 1.10, 1.7 (C- 1,1 DPT ), 10.7, 10. (C-,,, DPT ), 10.78, 1.1 (C-, DPT ), 18.0, (C-, DPT ), 17. (C=). EIMS m/z (relative Intensität, %): 1000 (, M + ), 98 (), 971 (), 9 (10), 91 (1), 97 (9), 91 (1), 897 (11), 88 (8), 89 (10), 8 (11), 8 (18), 809 (8), 79 (0), 78 (19), 7 (), 9 (), (10), 01 (17), 7 (8), 9 (1), 8 (1), 1 (90), 100 (100). ESI-MS m/z (relative Intensität): 109 [M+K] + (), 10 [M+a] + (), 1001 [M+H] + (100).
13 Experimenteller Teil DPEDPE 10,1,1,19,,,8,1,,0,,,,8,9-onaoxadithiatetraazaheptacyclo[...,9.,. 1,.1,.1 7,0 ]pentapentaconta-,,,8,,,7,9,1,,,7(1),8,1,,-hexadecaen Ansatz: 0.17 mmol (0.110 g) 1,10-Bis{-[-(-hydroxyphenyl)-1,,-oxadiazol- -yl]phenyl}-1,,7,10-tetraoxadecan 0.17 mmol (0.088 g) Tetraethylenglykolbistosylat 97b mmol (0.1 g) K C mmol (0.0 g) KTos 100 ml wasserfreies DMF Reaktionszeit: 17 h ' ' Elutionsmittel: Methylenchlorid/Ethanol (10:0...) 1'' 1' '' ' '' ' Umkristallisiert aus: Heptan/Essigsäureethylester '' DP ' Ausbeute: 1.8 mg ( %) Fp.: 19 C C H 11 berechnet C.1 H g/mol gefunden C. H H-MR (CDCl, 00 MHz) δ.8-.9 (m, 8H, CH ),.7 (s, H, CH ), (m, 8H, Ar-CH -CH ).0-.0 (m, 8H, Ar-CH ),.88 (d, J 8. Hz, H, H ),.89 (d, J 8. Hz, H, H, ), 7.8 (d, J 8., 8H, H,,, ) ()PPE()PPE a,9,1,1,,7,0,,,18,9,1-ctaoxatetraazapentacyclo[...,. 1,19. 0, ]tetratetraconta-,,1,18,0,,,(1),7,9,1,-dodecaen Ansatz: 0.0 mmol (0.09 g) 1,10-Bis[-(-hydroxypyrimidin--yl)phenyloxy]-,7- dioxaoctan 1a 0.0 mmol (0.09 g) Triethylenglykolbistosylat 97a mmol (0.1 g) K C mmol (0.0 g) KTos PP 100 ml wasserfreies DMF ' 1' Reaktionszeit: 17 h Elutionsmittel: Methylenchlorid/Ethanol (10:0...) ' ' Umkristallisiert aus: Heptan, Heptan/Toluol Ausbeute: mg ( %) cr 178 ( 1) is C H 8. 0.H berechnet C. H g/mol gefunden C. H H-MR (CDCl, 00 MHz) δ.71 (s, H, CH ),.7 (s, H, CH ),.80 (t, J.8 Hz, H, C- -CH -CH ),.8 (t, J.7 Hz, H, C--CH -CH ),.00 (t, J.8 Hz,
14 Experimenteller Teil 91 H, C- -CH ),.0 (t, J.7 Hz, H, C--CH ),.79 (d, J 8.8 Hz, H, H, ), 8.0 (d, J 8.8 Hz, H, H, ), 8.7 (s, H, H, ). 1 C-MR (100 MHz, CDCl ): δ 7., 8.80, 9.8, 9.8, 71.00, (CH ), 11. (C-, ), (C-, ), 10. (C-1 ), 1. (C-,), 11.8 (C-), (C- ), 10.0 (C-) ()PPE()PPE b,9,1,1,18,7,0,,,9,,1,,7-decaoxatetraazapentacyclo[8...,. 19,., ]pentaconta-,,19,1,,,0,(1),,,7,9-dodecaen Ansatz: 0.0 mmol (0.1 g) 1,1-Bis[-(-hydroxypyrimidin--yl)phenyloxy]-,7,10- trioxatridecan 1b 0.0 mmol (0.11 g) Tetraethylenglykolbistosylat mmol (0.1 g) K C mmol (0.0 g) KTos PP 100 ml wasserfreies DMF ' 1' ' ' Reaktionszeit: 19 h Elutionsmittel: Methylenchlorid/Ethanol (10:0...) Umkristallisiert aus: Ethanol/Toluol, Heptan Ausbeute: mg ( %) cr 17 ( 1) is C H 10 berechnet 9.1 (M+1) g/mol gefunden H-MR (CDCl, 00 MHz) δ.-.9 (m, H, CH ), (m, H, CH ),.8 (t, J.8 Hz, H, C- -CH -CH),.8 (t, J. Hz, H, C--CH -CH),.0 (t, J.8 Hz, H, C- -CH ),.1 (t, J. Hz, H, C--CH ),.8 (d, J 8.8 Hz, H, H, ), 8.1 (d, J 8.8 Hz, H, H, ), 8. (s, H, H, ). 1 C-MR (100 MHz, CDCl ): δ 7.0, 8., 9., 9.8, 70.78, 70.8, 70.9, 70.9 (CH ), 11.9 (C-, ), 19.1 (C-, ), 10.7 (C-1 ), 1.11 (C-,), (C-), (C- ), 10. (C-). EIMS m/z (relative Intensität, %): 9 (1), (), 9 (), 0 (1), 1 (0), 7 (10), (), 7 (18), (0), 90 (1), 81 (1), 7 (1), 9 (), 1 (), 7 (1), 1 (100), 188 (), 11 (), 108 (). ESI-MS m/z (relative Intensität): 71 [M+K] + (), 71 [M+a] + (81), 9 [M+H] + (100) ()PPE()PPE c,9,1,1,18,1,0,,,9,,,,,1,-dodecaoxatetraazapentacyclo[...,.,.,9 ]hexapentaconta-,,,,,8,,8(1),9,1,,-dodecaen Ansatz: 0.0 mmol (0.17 g) 1,1-Bis[-(-hydroxypyrimidin--yl)phenyloxy]-
15 Experimenteller Teil 9,7,10,1-tetraoxatetradecan 1c 0.0 mmol (0.1 g) Pentaethylenglykolbistosylat 97c mmol (0.7 g) K C mmol (0.0 g) KTos 110 ml wasserfreies DMF ' Reaktionszeit: 17 h Elutionsmittel: Methylenchlorid/Ethanol (10:0...) Umkristallisiert aus: Heptan 1' ' ' PP Ausbeute: mg (18 %) cr 1 ( 111) is C 0 H 1 berechnet (M+1) g/mol gefunden H-MR (CDCl, 00 MHz) δ.-.7 (m, 8H, CH ),.81 (t, J.7 Hz, H, C- -CH - CH),.8 (t, J. Hz, H, C--CH -CH),.07 (t, J.7 Hz, H, C- -CH ),.17 (t, J. Hz, H, C--CH ),.87 (d, J 8.8 Hz, H, H, ), 8.17 (d, J 8.8 Hz, H, H, ), 8.8 (s, H, H, ). 1 C-MR (100 MHz, CDCl ): δ 7., 8.7, 9., 9., 70.8, 70.7, 70.9, (CH ), 11. (C-, ), 19.1 (C-, ), (C-1 ), 1.11 (C-,), 11.0 (C-), (C- ), 10. (C-). EIMS m/z (relative Intensität, %): 780 (100, M + ), 70 (9), 7 (0), 70 (), 9 (11), 7 (7), 9 (9), 1 (1), 17 (1), 00 (1), (11), 79 (1), 17 (18), 91 (1), 7 (0), 0 (1), 1 (), 11 (0). ESI-MS m/z (relative Intensität): 819 [M+K] + (1), 80 [M+a] + (8), 781 [M+H] + (100) ()PPE()PPE d,9,1,1,18,1,0,,,9,,,,7-decaoxatetraazapentacyclo[8...,.,.,9 ]pentaconta-,,,,,8,0,(1),,,7,9-dodecaen Ansatz: 0.0 mmol (0.19 g) 1,1-Bis[-(-hydroxypyrimidin--yl)phenyloxy]-,7,10,1-tetraoxatetradecan 1c 0.0 mmol (0.1 g) Pentaethylenglykolbistosylat 97c mmol (0.1 g) K C PP mmol (0.0 g) KTos ' 1' 10 ml wasserfreies DMF Reaktionszeit: 17 h ' ' Elutionsmittel: Methylenchlorid/Ethanol (10:0...) Umkristallisiert aus: Heptan Ausbeute: 8 mg (1 %) C H H berechnet C 1.1 H gefunden C 1. H cr 1 ( 1) is 9.77 g/mol
16 Experimenteller Teil 9 1 H-MR (CDCl, 00 MHz) δ.-.7 (m, 8H, CH ),.8-.7 (m, 8H, CH ),.1-.8 (m, H, C- -CH -CH ),.89 (t, J. Hz, H, C--CH -CH ),.0 (t, J.7 Hz, H, C- -CH ),.0 (t, J. Hz, H, C--CH ),.8 (d, J 8.9 Hz, H, H, ), 8.10 (d, J 8.9 Hz, H, H, ), 8.7 (s, H, H, ). ESI-MS m/z (relative Intensität): 71 [M+K] + (9), 71 [M+a] + (1), 9 [M+H] + (100) ()PPE()PPE e,9,1,1,1,7,0,,,9,,18,1,-decaoxatetraazapentacyclo[8...,. 1,19. 0, ]pentaconta-,,1,18,0,,0,(1),,,7,9-dodecaen Ansatz: 0.0 mmol (0.17 g) 1,10-Bis[-(-hydroxypyrimidin--yl)phenyloxy]-,7- dioxaoctan 1a 0.0 mmol (0.17 g) Triethylenglykolbistosylat 97a mmol (0.7 g) K C mmol (0.0 g) KTos ' 1' 110 ml wasserfreies DMF ' ' Reaktionszeit: 18 h Elutionsmittel: Methylenchlorid/Ethanol (10:0...) Umkristallisiert aus: Heptan Ausbeute: 7 mg ( %) cr 19 ( 11) is C H H berechnet C 1.1 H g/mol gefunden C 1.9 H H-MR (CDCl, 00 MHz) δ.7 (s, ü, H, CH ), (m, 1H, CH ),.71 (s, ü, H, CH ), (m, 8H, CH ),.0 (d, J.8 Hz, H, C- -CH ),.0 (d, J. Hz, H, C--CH ),.8 (d, J 8.8 Hz, H, H, ), 8.1 (d, J 8.8 Hz, H, H, ), 8.0 (s, H, H, ). 1 C-MR (100 MHz, CDCl ): δ 7., 8.7, 9., 9.8, 70.78, 70.9, (CH ), 11. (C-, ), (C-, ), 10. (C-1 ), 1. (C-,), 11.1 (C-), (C- ), 10. (C-). ESI-MS m/z (relative Intensität): 71 [M+K] + (), 71 [M+a] + (100), 9 [M+H] + (99) ()PPE()PPE f,9,1,1,18,7,0,,,,1,,-onaoxatetraazapentacyclo[...,. 19,., ]heptatetraconta-,,19,1,,,7,9(1),0,,,-dodecaen Ansatz: 0.0 mmol (0.19 g) 1,10-Bis[-(-benzyloxypyrimidin--yl)phenyloxy]-,7- dioxaoctan 0a 0.0 mmol (0.11 g) Tetraethylenglykolbistosylat 97b
17 Experimenteller Teil 9 mmol (0.1 g) K C mmol (0.0 g) KTos 100 ml wasserfreies DMF Reaktionszeit: 17 h Elutionsmittel: Methylenchlorid/Ethanol (10:0...) Umkristallisiert aus: Heptan PP ' 1' ' ' Ausbeute: 9 mg ( %) cr 18 ( 19) is C H 0 9 berechnet 9.87 (M+1) g/mol gefunden H-MR (CDCl, 00 MHz) δ (m, H, CH ),.71 (s, ü, H, CH ),.7-.7 (m, H, CH ),.81 (t, J.8 Hz, H, C- -CH -CH),.89 (t, J.7 Hz, H, C--CH -CH),.0 (t, J.8 Hz, H, C- -CH ),.18 (t, J.7, H, C--CH ),.80 (d, J 8.9 Hz, H, H, ), 8.0 (d, J 8.9 Hz, H, H, ), 8. (s, H, H, ). 1 C-MR (100 MHz, CDCl ): δ 7., 8.8, 9.9, 9.8, 70.8, 70.97, (CH ), 11.0 (C-, ), (C-, ), (C-1 ), 1.0 (C-,), (C-), (C- ), 10. (C-). EIMS m/z (relative Intensität, %): 8 (100, M + ), 18 (7), 7 (11), 0 (1), 7 (7), 7 (8), 0 (7), 9 (11), 7 (8), 1 (8), 188 (18), 171 (1), 11 (1). ESI-MS m/z (relative Intensität): 87 [M+K] + (9), 71 [M+a] + (), 9 [M+H] + (100) ()PPE()PPE g,9,1,1,,7,0,,,,1,,-onaoxatetraazapentacyclo[...,. 1,19. 0, ]heptatetraconta-,,1,18,0,,7,9(1),0,,,-dodecaen Ansatz: 0.0 mmol (0.0 g) 1,1-Bis[-(-hydroxypyrimidin--yl)phenyloxy]-,7,10- trioxatridecan 1b 0.0 mmol (0.7 g) Triethylenglykolbistosylat 97a mmol (0.88 g) K C PP mmol (1.0 g) KTos ' 1' ' ' 10 ml wasserfreies DMF Reaktionszeit: 17 h Elutionsmittel: Methylenchlorid/Ethanol (10:0...) Umkristallisiert aus: Heptan Ausbeute: 89 mg ( %) cr 1 ( 1) is C H 0 9 berechnet 9.87 (M+1) g/mol gefunden H-MR (CDCl, 00 MHz) δ.-.80 (m, 1H, CH ),.8-.8 (m, 8H, CH ),.99 (t, J.8 Hz, H, C- -CH ),.0 (t, J.7 Hz, H, C--CH ),.81 (d, J 8.8 Hz, H, H, ), 8.1 (d, J 8.8 Hz, H, H, ), 8.7 (s, H, H, ).
18 Experimenteller Teil 9 1 C-MR (100 MHz, CDCl ): δ 7., 8.0, 9., 9.8, 70.78, 71.0, (CH ), 11. (C-, ), 19.0 (C-, ), (C-1 ), 1.01 (C-,), 10.9 (C-), (C- ), 10. (C-). EIMS m/z (relative Intensität, %): 8 (100, M + ), 18 (), 17 (), 91 (), 9 (8), 0 (8), 9 (11), 1 (), 1 (), 188 (11), 19 (), 11 (1). ESI-MS m/z (relative Intensität): 87 [M+K] + (8), 71 [M+a] + (7), 9 [M+H] + (100) ()PPE()PPE 7a,9,1,1,18,7,0,,,9,,0,,8-Decaoxatetraazapentacyclo[8...,. 19,., ]pentaconta-,,19,1,,,0,(1),,,7,9-dodecaen Ansatz: 0.08 mmol (0.0 g) 1,1-Bis[-(-hydroxyphenyl)pyrimidin--yl]- 1,,7,10,1-tetraoxatridecan 7b 0.08 mmol (0.01 g) Tetraethylenglykolbistosylat 97b 1 mmol (0.18 g) K C 1 mmol (0.10 g) KTos 70 ml wasserfreies DMF PP Reaktionszeit: 17 h ' 1' ' ' Elutionsmittel: Methylenchlorid/Ethanol (10:0...) Umkristallisiert aus: Toluol/Heptan Ausbeute: 9 mg (1 %) cr 11 S A 17 is C H 10 berechnet 9.1 (M+1) g/mol gefunden H-MR (CDCl, 00 MHz) δ.-.7 (m, H, CH ),.8-.7 (m, 1H, CH ),.87 (t, J.7 Hz, H, C- -CH -CH),.91 (t, J.9 Hz, H, C--CH -CH),.0 (t, J.7 Hz, H, C- -CH ),.1 (t, J.9 Hz, H, C--CH ),.89 (d, J 8. Hz, H, H, ), 7. (d, J 8. Hz, H, H, ), 8.0 (s, H, H, ). 1 C-MR (100 MHz, CDCl ): δ 7.0, 7.9, 9., 9., 70.7, 70.8, 70.89, 70.9 (CH ), 11. (C-, ), (C-1 ), 17. (C-, ), (C-), 1.79 (C-,), 19.1 (C- ), 1.7 (C-). EIMS m/z (relative Intensität, %): 9 (0, M + ), 9 (8), 1 (7), 1 (100), 188 (), 11 () 9..1 ()PPE()PPE 7b,9,1,1,18,7,0,,,,0,,-onaoxatetraazapentacyclo[...,. 19,., ]heptatetraconta-,,19,1,,,7,9(1),0,,,-dodecaen Ansatz: 0.0 mmol (0.1 g) 1,1-Bis[-(-hydroxyphenyl)pyrimidin--yl]-1,,7,10,1-
19 Experimenteller Teil 9 tetraoxatridecan 7b 0.0 mmol (0.17 g) Triethylenglykolbistosylat 97a mmol (0.1 g) K C mmol (0. g)ktos 10 ml wasserfreies DMF Reaktionszeit: 17 h Elutionsmittel: Methylenchlorid/Ethanol (10:0...) Umkristallisiert aus: Heptan, Toluol/Ethanol ' ' ' PP 1' Ausbeute: 71 mg (7 %) cr 17 S A 1 is C H 0 9. H berechnet C.09 H g/mol gefunden C1. H H-MR (CDCl, 00 MHz) δ.-.8 (m, H, CH ), (m, H, CH ),.7 (s, H, CH ),.8 (t, J.8 Hz, H, C- -CH -CH),.9 (t, J.8 Hz, H, C-- CH -CH),.0 (t, J.8 Hz, H, C- -CH ),.0 (t, J.8 Hz, H, C-- CH ),.89 (d, J 8. Hz, H, H, ), 7.19 (d, J 8. Hz, H, H, ), 8.8 (s, H, H, ). 1 C-MR (100 MHz, CDCl ): δ 7.08, 7.7, 9., 9.8, 70.71, 70.9, 71.0 (CH ), 11.7 (C-, ), 1.97 (C-1 ), 17. (C-, ), (C-), 1.7 (C-,), (C- ), 1. (C-). ESI-MS m/z (relative Intensität): 87 [M+K] + (1), 71 [M+a] + (100), 9 [M+H] + (97) ()PPE()PPE 7c,9,1,1,18,1,0,,,9,,,,8-Decaoxatetraazapentacyclo[8...,.,.,9 ]pentaconta-,,,,,8,0,(1),,,7,9-dodecaen Ansatz: 0. mmol (0.11 g) 1,1-Bis[-( -hydroxyphenyl)pyrimidin--yl]- 1,,7,10,1,1-hexaoxahexadecan 7c 0. mmol (0.09 g) Triethylenglykolbistosylat 97a mmol (0.7 g) K C mmol (0. g) KTos PP 10 ml wasserfreies DMF ' 1' ' ' Reaktionszeit: 17 h Elutionsmittel: Methylenchlorid/Ethanol (10:0...) Umkristallisiert aus: Heptan Ausbeute: mg ( %) cr 118 S A 1 is C H H berechnet C 1.1 H g/mol gefunden C 1. H
20 Experimenteller Teil 97 1 H-MR (CDCl, 00 MHz) δ. (s, H, CH ),,7-.9 (m, H, CH ),.7-.7 (m, H, CH ),,7 (s, ü, H, CH ),.8 (t, J.8 Hz, H, C- -CH -CH ),.91 (t, J.9 Hz, H, C--CH -CH ),.07 (t, J.8 Hz, H, C- -CH ),. (t, J.9 Hz, H, C--CH ),.90 (d, J 8. Hz, H, H, ), 7. (d, J 8. Hz, H, H, ), 8. (s, H, H, ). 1 C-MR (100 MHz, CDCl ): δ 8.0, 8.79, 70.9, 70.7, 71.81, 71.87, 71.90, 7.08 (CH ), 11.7 (C-, ), 17.91(C-1 ), 18. (C-, ), (C-), 17.8 (C-,), 10.0 (C- ), 1.19 (C-) (ap)-()ppe()ppe 8,9,1,1,18,7,0,,,9,,,,0-Decaoxatetraazapentacyclo[8...,. 19,., ]pentaconta-,,19,1,,,0,(1),,,7,9-dodecaen Ansatz: 0.0 mmol (0. g) -(-Hydroxyphenyl)--[1-(toluol-p-sulfonyloxy)- 1,,7,10-tetraoxadodecyl]pyrimidin 0 mmol (0.1 g) K C mmol (0.0 g) KTos 100 ml wasserfreies DMF Reaktionszeit: 18 h Elutionsmittel: Methylenchlorid/Ethanol (10:0...) PP Umkristallisiert aus: Methylenchlorid/Methanol, ' 1' ' ' Methylenchlorid/Ethanol Geeignete Kristalle für die Röntgenkristallstrukturanalyse konnten aus Chloroform/CH C erhalten werden. Ausbeute: 10. mg ( %) cr 10 S A 19 is C H 10 berechnet 9.1 (M+1) g/mol gefunden H-MR (CDCl, 00 MHz) δ (m, 8H, CH ), (m, 8H, CH ),.10 (t, J. Hz, H, C--CH -CH),.7 (m, H, C--CH ),.88 (d, J 8. Hz, H, H, ), 7. (ü, H, H, ), 8.9 (s, H, H, ). 1 C-MR (100 MHz, CDCl ): δ 7.1, 7.8, 9., 9.8, 70.8, 70.89, (CH ), 11. (C-, ), 1. (C-1 ), 17. (C-, ), 18.0 (C-), 1.88 (C-,), 19.8 (C- ), 1. (C-). EIMS m/z (relative Intensität, %): 9 (100, M + ), ESI-MS m/z (relative Intensität): 71 [M+K] + (), 71 [M+a] + (), 9 [M+H] + (100) ()PPC11()PPE 9,18,7,0,,,9,,1,,7-Heptaoxatetraazapentacyclo[8...,. 19,., ] pentaconta-,,19,1,,,0,(1),,,7,9-dodecaen
21 Experimenteller Teil 98 Ansatz: 0. mmol (0.1 g) 1,1-Bis[-(-hydroxypyrimidin--yl)phenyloxy]-,7,10- trioxatridecan 1b 0. mmol (0.09 g, 0.07 ml) 1,11-Dibromundecan mmol (0.1 g)k C mmol (0.0 g) KTos 10 ml wasserfreies DMF PP Reaktionszeit: 17 h ' 1' ' ' Elutionsmittel: Methylenchlorid/Ethanol (10:0...) Umkristallisiert aus: Heptan Ausbeute: mg ( %) cr is C 9 H 0 7 berechnet C 8.0 H g/mol gefunden C 7.8 H H-MR (CDCl, 00 MHz) δ (m, 10H, CH ), (m, H, CH ), 1.77 (t, J.7 Hz, H, C--CH -CH),.-.7 (m, H, CH ),.8 (m, H, CH ),.8 (t, J.7 Hz, H, C- -CH -CH),.0 (t, ü, J.7 Hz, H, C--CH ),.07 (t, ü, J.7 Hz, H, C- -CH ),.88 (d, J 8.8 Hz, H, H, ), 8. (d, J 8.8 Hz, H, H, ), 8. (s, H, H, ) 9..0 ()PPE()PPC11 10,9,1,1,18,9,,1,,7-Heptaoxatetraazapentacyclo[8...,. 19,., ]pentaconta-,,19,1,,,0,(1),,,7,9-dodecaen Ansatz: 0. mmol (0.18 g) 1,1-Bis[-(-benzyloxypyrimidin--yl)phenyloxy]tri decan 0. mmol (0.10 g) Tetraethylenglykolbistosylat 97b mmol (0.1 g) K C mmol (0.0 g) KTos 10 ml wasserfreies DMF PP Reaktionszeit: 17 h ' 1' ' ' Elutionsmittel: Methylenchlorid/Ethanol (10:0...) Umkristallisiert aus: Heptan Ausbeute: mg ( %) cr 1 ( 1) is C 9 H 0 7 berechnet (M+1) g/mol gefunden H-MR (CDCl, 00 MHz) δ (m, 10H, CH ), (m, H, CH ), 1.7 (t, J.7 Hz, H, C- -CH -CH),.-. (m, H, CH ), (m, H, CH ),.8 (t, J. Hz, H, C--CH -CH),.9 (t, J.7 Hz, H, C- -
22 Experimenteller Teil 99 CH ),.17 (t, J. Hz, H, C--CH ),.88 (d, J 8.8 Hz, H, H, ), 8.1 (d, J 8.8 Hz, H, H, ), 8.9 (s, H, H, ). 1 C-MR (100 MHz, CDCl ): δ.1, 7.7, 7.99, 8.1, 8.8 (CH ), 7.77, 8., 9., 70.77, 70.9 (CH ), 11.1 (C-, ), 19.1 (C-, ), (C-1 ), 1. (C-,), (C-), (C- ), (C-). EIMS m/z (relative Intensität, %): 8 (100), 7 (), (11), 1 (), 9 (19), 7 (7), 1 (1), 188 (), 171 (11). ESI-MS m/z (relative Intensität): 71 [M+K] + (8), 709 [M+a] + (9), 9 [M+Li] + (), 87 [M+H] + (100), 9 (9) ()PPC11()PPC11 11,18,7,9,,1,,7-Tetraoxatetraazapentacyclo[8...,. 19,., ]pentaconta-,,19,1,,,0,(1),,,7,9-dodecaen Ansatz: 0. mmol (0.10 g) 1,1-Bis[-(-benzyloxypyrimidin--yl)phenyloxy]tri decan 0. mmol (0.08 g, 0.01 ml) 1,11-Dibromundecan mmol (0.1 g) K C mmol (0. g) KTos 10 ml wasserfreies DMF PP Reaktionszeit: 17 h ' 1' ' ' Elutionsmittel: Methylenchlorid/Ethanol (10: ) Umkristallisiert aus: Heptan Ausbeute: 18 mg (10 %) cr 17 ( 171) is C H berechnet C 7.08 H g/mol gefunden C7. H H-MR (CDCl, 00 MHz) δ (m, 0H, CH ), (m, 8H, CH ), (m, 8H, C-,-CH -CH),.98 (t, J. Hz, H, C- -CH ),.0 (t, J. Hz, H, C--CH ),.91 (d, J 8.9 Hz, H, H, ), 8. (d, J 8.9 Hz, H, H, ), 8.7 (s, H, H, ). 1 C-MR (100 MHz, CDCl ): δ.,.0, 8., 8.0, 8., 8.8, 8.70, 8.7 (CH ), 7.79 (C- -CH ), 8.7 (C--CH ), 11.0 (C-, ), (C-, ), 19.8 (C-1 ), 1.01 (C-,), 11.1 (C-), 17. (C- ), (C-). 9.. ()PPE()PPC11 1a,9,1,1,18,7,9,,0,,8-Heptaoxatetraazapentacyclo[8...,. 19,., ]pentaconta-,,19,1,,,0,(1),,,7,9-dodecaen
23 Experimenteller Teil 100 Ansatz: 0.0 mmol (0.1 g) 1,1-Bis[-(-hydroxyphenyl)pyrimidin--yl]-1,,7,10,1- tetraoxatridecan 7b 0.0 mmol (0.09 g, 0.07 ml) 1,11-Dibromundecan mmol (0.1 g) K C mmol (0.0 g) KTos 110 ml wasserfreies DMF PP Reaktionszeit: 17 h ' 1' ' ' Elutionsmittel: Methylenchlorid/Ethanol (10:0...1.) Umkristallisiert aus: Heptan Ausbeute: 7 mg ( %) cr cr 18 S A 0 is C 9 H H berechnet C 7.1 H g/mol gefunden C 7.18 H H-MR (CDCl, 00 MHz) δ (m, 1H, CH ), (m, H, CH ), (m, H, CH ),.-. (m, H, CH ), (m, H, CH ),.88 (t, J.0 Hz, H, C--CH -CH),.9 (t, J. Hz, H, C- -CH ),.1 (t, J.0 Hz, H, C--CH ),.9 (d, J 8.7 Hz, H, H, ), 7. (d, J 8.7 Hz, H, H, ), 8. (s, H, H, ). 1 C-MR (100 MHz, CDCl ): δ.0, 7.91, 8.1, (CH ),.9, 7.9, 9., (CH ), 11.7 (C-, ), 1.70 (C-1 ), 17. (C, ), 18.0 (C-), 1.8 (C-,), 19.7 (C- ), 1. (C-). 9.. ()PPE()PPC8 1b,9,1,1,18,1,0,9,,0,,8-ctaoxatetraazapentacyclo[8...,.,.,9 ]pentaconta-,,,,,0,(1),,,7,9-dodecaen Ansatz: 0. mmol (0.17 g) 1,1-Bis[-( -hydroxyphenyl)pyrimidin--yl]- 1,,7,10,1,1-hexaoxahexadecan 7c 0. mmol (0.081 g, 0.0 ml) 1,8-Dibromoctan mmol (0.7 g) K C mmol (0. g) KTos 10 ml wasserfreies DMF PP Reaktionszeit: 17 h ' 1' ' ' Elutionsmittel: Methylenchlorid/Ethanol (10:0...) Umkristallisiert aus: Heptan Ausbeute: 78 mg (8 %) cr 11 S A 1 is
24 Experimenteller Teil 101 C 8 H H berechnet C.1 H g/mol gefunden C. H H-MR (CDCl, 00 MHz) δ (m, H, CH ), (m, H, CH ), (m, H, CH ),.8-.7 (m, 1H, CH ),.91 (t, J.0 Hz, H, C--CH -CH),.97 (t, J. Hz, H, C- -CH ),. (t, J.0 Hz, H, C--CH ),.90 (d, J 8.7 Hz, H, H, ), 7.9 (d, J 8.7 Hz, H, H, ), 8. (s, H, H, ). ESI-MS m/z (relative Intensität): 77 [M+K] + (8), 711 [M+a] + (81), 89 [M+H] + (100),, ()PPE()PPC1 1c,9,1,1,18,1,0,,,,,-ctaoxatetraazapentacyclo[...,.,.,9 ]hexapentaconta-,,,,,8,,8(1),9,1,,-dodecaen Ansatz: 0. mmol (0.11 g) 1,1-Bis[-( -hydroxyphenyl)pyrimidin--yl]- 1,,7,10,1,1-hexaoxahexadecan 7c 0. mmol (0.08 g) 1,1-Dibromteradecan mmol (0.1 g) K C mmol (0. g) KTos 10 ml wasserfreies DMF PP Reaktionszeit: 17 h ' 1' ' ' Elutionsmittel: Methylenchlorid/Ethanol (10:0...) Umkristallisiert aus: Heptan Ausbeute: 1 mg ( %) cr 8 S A 11 is C H H berechnet C 7.8 H g/mol gefunden C 7.88 H H-MR (CDCl, 00 MHz) δ (m, 1H, CH ), (m, H, CH ), (m, H, CH ),. (s, H, CH ),.-.71 (m, 8H, CH ),.91 (t, J.0 Hz, H, C--CH -CH),.97 (t, J. Hz, H, C- -CH ),.0 (t, J.0 Hz, H, C- -CH ),.9 (d, J 7.8 Hz, H, H, ), 7.9 (d, J 7.8Hz, H, H, ), 8.7 (s, H, H, ). 9. Synthese der Cyclophane mit zwei verschiedenen starren Struktureinheiten 9..1 BPE()PPE 1,9,1,1,18,7,0,,,9,,-Decaoxadiazapentacyclo[8...,. 19,., ]pentaconta-,,19,1,,,0,(1),,,7,9-dodecaen
25 Experimenteller Teil 10 Ansatz: 0.0 mmol (0.8 g), -Bis(1-(toluol-p-sulfonyloxy)-1,,7,10- tetraoxadodecyl)biphenyl 0.0 mmol (0.07 g) -(Hydroxyphenyl)--hydroxypyrimidin 79 mmol (0. g) K C mmol (0.8 g) KTos PP 170 ml wasserfreies DMF ' 1' Reaktionszeit: 18 h ' ' Elutionsmittel: Methylenchlorid/Ethanol (10:0...) ' 1' 1 Umkristallisiert aus: Toluol/Heptan, Toluol Ausbeute: 8 mg ( %) cr 17 ( 1) is C 8 H 10 berechnet C.07 H g/mol gefunden C.78 H H-MR (00 MHz, CDCl ): δ (m, 1H, CH ),.8-.9 (m, 8H, CH ),.01 (t, J.7 Hz, H, CH ), (m, H, CH ),.77 (d, J 8.8 Hz, H, H, BP),.8 (d, J 8. Hz, H, H, BP),.89 (d, J 9.0 Hz, H, H, PP), 7. (d, J 8.8 Hz, H, H, BP), 7.0 (d, J 8. Hz, H, H, BP), 8.17 (d, J 9.0 Hz, H, H, PP) 8. (s, H, H, PP). 1 C-MR (100 MHz, CDCl ): δ 7.1, 7.7, 8., 9., 9., 9.9, 9.7, 70.7, 70.79, 70.99, (CH ), 11.1 (C-, PP ), 11. (C-, BP ), 11.7 (C-, BP ), 17. (C-, BP ), 17. (C-, BP ), 19.1 (C-, PP ), (C-1 PP ), 10.0 (C-1 BP ), 1.09 (C-1 BP ), 1. (C-, PP ), (C- PP ), 17.0, 17.7, 17.9 (C-, BP, C- PP ), 10.8 (C- PP ). EIMS m/z (relative Intensität, %): 90 (100, M + ), 0 (), (10), 79 (8), 1 (1), 18 (11), 10 (11). ESI-MS m/z (relative Intensität): 79 [M+K] + (8), 71 [M+a] + (), 91 [M+H] + (100). ' ' BP 9.. BTE()PPE 1,9,1,1,18,9,,,8,1,,-Decaoxadiazapentacyclo[0...,. 0,.,7 ]dopentaconta-,,0,,,,,(1),,7,9,1-dodecaen Ansatz: 0.0 mmol (0.17 g), -Bis[1-(toluol-p-sulfonyloxy)-,,8,11- tetraoxatridecyl]biphenyl mmol (0.07 g) -(Hydroxyphenyl)--hydroxypyrimidin 79
26 Experimenteller Teil 10 mmol (0.7 g) K C mmol (0. g) KTos 10 ml wasserfreies DMF Reaktionszeit: 18 h Elutionsmittel: Methylenchlorid/Ethanol (10:0...) Umkristallisiert aus: Toluol/Ethanol ' 1' ' ' ' 1' ' ' PP Ausbeute: mg (1 %) Fp.: 87 C C 0 H 0 10 berechnet 719. (M+1) g/mol gefunden H-MR (00 MHz, CDCl ):.9-. (m, H, CH ),.-.7 (m, 0H, CH ),.8 (t, ü, J. Hz, H, C-, PP -CH ),.1,.1 (t, J. Hz, H, C-, PP -CH ),.,. (s, H, H α,α ),.90 (d, J 8.9 Hz, H, H, PP), 7.8, 7.0 (d, J 8.0 Hz, H, H,,, BT), 7., 7. (d, J 8.0 Hz, H, H,,, BT), 8.19 (d, J 8.9 Hz, H PP), 8. (s, H, H, PP). EIMS m/z (relative Intensität, %): 718 (8), 89 (), 7 (10), 8 (), 71 (9), (7), 79 (9), (17), 07 (7), 77 (8), 8 (9), 1 (9), 0 (9), 1 (9), 19 (100), 188 (1), 180 (), 17 (11), 90 (8). ESI-MS m/z (relative Intensität): 77 [M+K] + (19), 71 [M+a] + (7), 719 [M+H] + (100). 1 BT 9.. BPEBTBE 1 11,1,17,0,,,,8,1,-Decaoxahexacyclo[...,.,9.,7. 8,1 ]octapentaconta-,,,8,,,8,0,,8(1),9,1,,,7-pentadecaen Ansatz: 0. mmol (0.7 g), -Bis[1-(toluol-p-sulfonyloxy)-,,8,11-tetraoxatridecyl]-p-terphenyl mmol (0. 09 g), -Dihydroxybiphenyl mmol (0.7 g) K C BTB ' ' mmol (1.0 g) KTos α 100 ml wasserfreies DMF '' 1'' ' 1' 1 '' '' ' ' Reaktionszeit: 19 h Elutionsmittel: Chloroform/Methanol (10:1) Umkristallisiert aus: Essigsäureethylester/Ethanol ' 1' 1 Ausbeute: 0 mg (11 %) cr 18 S C 199 S A 1 is C 8 H 10 berechnet C 7.9 H g/mol gefunden C 7.9 H.98 1 H-MR (CDCl, 00 MHz) δ.7-.8 (m, H, CH ),.8 (t, J. Hz, H, C-, BP - CH CH),.01 (t, J.7 Hz, H, C-, BP -CH),. (s, H, H-α,α ),.78 (d, J ' ' BP
27 Experimenteller Teil Hz, H, H,,, BP), 7. (d, J 8. Hz, H, H,,, BTB), 7.8 (d, J 8. Hz, H, H,,, BP), 7. (s, H, H,,, BTP), 7. (d, ü, J 8. Hz, H, H,,, BTB). EIMS m/z (relative Intensität, %): 79 (100), 78 (), 70 (), 1 (1), 87 (), 99 (1), 8 (7), 71 (0), (0), (8), 18 (10), 18 (), 89 (9). 9.. BTEMeTPE 1 -Methyl-10,1,1,19,,,,9,,-Decaoxahexacyclo[...,.,9.,9. 8,1 ]octapentaconta-,,,8,,,8,0,,8(1),9,1,,,7-pentadecaen Ansatz: 0.80 mmol (0.700 g), -Bis[1-(toluol-p-sulfonyloxy)-,,8,11-tetraoxa tridecyl]biphenyl mmol (0. 1 g), -Dihydroxy- -methyl-p-terphenyl mmol (1. g) K C MeTP CH ' ' 0.80 mmol (1.9 g) KTos '' 1'' ' 1' 1 10 ml wasserfreies DMF '' '' ' ' Reaktionszeit: 178 h α Elutionsmittel: Chloroform/Methanol (10:1) 1' 1 Umkristallisiert aus: Heptan ' Ausbeute: mg (0. %) cr 0 10 is C 9 H g/mol 1 H-MR (CDCl, 00 MHz) δ. (s, H, C- - MeTP CH),.1-.7 (m, H, CH ),.88 (t, J. Hz, H, C-, MeTP -CH CH), (m, H, C-, BP -CH),.7 (s, H, H-α ),.0 (s, H, H-α),.9 (d, J 8. Hz, H, H, MeTP), (d, J 8. Hz, H, H, MeTP), 7.1 (d, J 8. Hz, 1H, H MeTP), 7.1 (d, J 8. Hz, H, H, MeTP), 7., 7. (d, ü, J 7.9 Hz, H, H,,, BT), 7.7 (d, ü, 1H, H MeTP), 7. (s, 1H, H MeTP), 7.8, 7.9 (d, ü, J 7.9 Hz, H, H,,, BT), 7. (d, J 8. Hz, H, H, MeTP. ' ' BT 9.. BPEMeTPE 17 -Methyl-10,1,1,19,,1,,7,0,-Decaoxahexacyclo[...,.,9.,. 7,0 ]hexapentaconta-,,,8,,,7,9,,(1),7,9,1,,-pentadecaen Ansatz: 0.0 mmol (0.80 g) -Methyl-, -bis[1-(toluol-p-sulfonyloxy)-1,,7,10- tetraoxadodecyl]-p-terphenyl mmol (0.0 g), -Dihydroxybiphenyl
28 Experimenteller Teil 10 mmol (0.7 g) K C mmol (0. g) KTos 10 ml wasserfreies DMF Reaktionszeit: 197 h Elutionsmittel: Chloroform/Methanol (10:0...) Umkristallisiert aus: Toluol/Ethanol ' '' '' MeTP ' 1'' ' BP CH 1' 1 '' ' ' ' 1' 1 ' ' Ausbeute: mg (11 %) cr is C 7 H 10 berechnet C 7.7 H g/mol gefunden C 71.1 H H-MR (CDCl, 00 MHz) δ.1 (s, H, C- MeTP -CH ) (m, H, CH ),.7-.7 (m, 1H, CH ), (m, 1H, CH ),.9 (t, J.7 Hz, H, Ar-CH ), (m, H, Ar-CH ),.8,.7 (d, J 8.7 Hz, H, H,,, BP),.9,.9 (d, J 8.7 Hz, H, H,,, MeTP), 7.09 (d, 7.8 Hz, 1H, H MeTP), 7.1 (d, J 8.7 Hz, H, H, MeTP), 7.0,7. (d, J 8.7 Hz, H, H,,, BP), 7. (d, ü, 1H, H MeTP), 7. (d, 1H, H MeTP), 7. (d, J 8.7 Hz, H, H, MeTP). 9.. BTBEMeTPE 18 -Methyl-10,1,1,19,,7,0,,,9-decaoxaheptacyclo[8...,.,9.,7. 8,1., ]tetrahexaconta-,,,8,,,8,0,,,0,(1),,,7,9,1,-octadecaen Ansatz: 0.8 mmol (0.g), -Bis[1-(toluol-p-sulfonyloxy)-,,8,11-tetraoxatridecyl]- p-terphenyl mmol (0.1 g), -Dihydroxy- -methyl-p-terphenyl 71 mmol (0.7 g) K C BTB ' ' ' ' α mmol (1.0 g) KTos '' 1'' ' 1' 1 '' 100 ml wasserfreies DMF '' Reaktionszeit: 19 h CH Elutionsmittel: Chloroform/Methanol (10:1) ' ' Umkristallisiert aus: Heptan/Essigsäureethylester '' 1'' ' 1' 1 Ausbeute: 1 mg (0. %) C H 10 '' '' ' ' MeTP cr 88 S A is g/mol 1 H-MR (CDCl, 00 MHz) δ. (s, H, Ar-CH),.1-.7 (m, H, CH ),.88 (t, J. Hz, H, C-, MeTP -CH CH), (m, H, C-, MeTP -CH),.7 (s, H, H-α ),.0 (s, H, H-α), (m, H, H), (m, H, Ar-H), (m, H, Ar-H), 7. (m, 1H, Ar-H), (m, H, Ar-H), 7. (m, H, H, MeTP).
29 Experimenteller Teil BTEDPTE 19 10,1,1,19,,,,9,,,1,,-Decaoxathiadiazahexacyclo[...,9.,7. 8,1.1, ]hexapentaconta-,,,8,,,8,0,,8(1),9,,,-tetradecaen Ansatz: 1 mmol (0.87 g), -Bis[1-(toluol-p-sulfonyloxy)-,,8,11-tetraoxa tridecyl]biphenyl 1 mmol (0.70 g),-bis-(-hydroxyphenyl)-1,,-thiadiazol 10 mmol (1. g) K C DPT ' ' 10 mmol (.11 g) KTos 1'' S 1' '' ' 10 ml wasserfreies DMF '' ' '' ' Reaktionszeit: 17 h Elutionsmittel: Chloroform/Methanol (10:1) α Methylenchlorid/Ethanol (10:0...) 1 1' ' ' Umkristallisiert aus: Ethanol BT ' Ausbeute: 0 mg ( %) cr S C 7 1 is C H 10 S. 0.H berechnet C. H g/mol gefunden C. H..1 1 H-MR (CDCl, 00 MHz) δ.8-.7 (m, H, CH ), (m, H, C-, DPT - CH CH ), (m, H, C-, DPT -CH ),.9 (s, H, H-α,α ),.9 (d, J 8.8 Hz, H, H,,, DPT), 7. (d, J 8. Hz, H, H,,, BT), 7.0 (d, J 8. Hz, H, H,,, BT), 7.78 (d, J 8.8 Hz, H, H,,, DPT). EIMS m/z (relative Intensität, %): 800 (0, M + ), 771 (11), 7 (0), 77 (8), 711 (), 7 (9), (0), 0 (), (19), 0 (70), 1 (1), 17 (7), 98 (), 7 (), 9 (9), 98 (10), 8 (10), 97 (8), 70 (9), (), (8), 19 (100), 180 (0), 17 (10), 1 (8), 90 (1) BPEDPTE 0 10,1,1,19,,1,,7,0,,9,,-Decaoxathiadiazahexacyclo[...,9,. 7,0.1, ]tetrapentaconta-,,,8,,,7,9,,(1),7,0,,-tetradecaen Ansatz: 0.1 mmol (0.08 g), -Bis(1-(toluol-p-sulfonyloxy)-1,,7,10- tetraoxadodecyl)biphenyl 0.1 mmol (0.07 g),-bis-(-hydroxyphenyl)-1,,-thiadiazol mmol (0.7 g) K C
2. Herstellung der α,β-ungesättigten Kupplungskomponenten C H 3 H 33. Br 22 25
 2. Herstellung der α,β-ungesättigten Kupplungskomponenten 2.1. E-3-(2-omphenyl)-propenal (25) C H 3 H 1 H H 33 1' 3 22 25 2' Eine Emulsion aus 1.85 g (10.0 mmol) 2-ombenzaldehyd (22), 616 mg (14.0 mmol)
2. Herstellung der α,β-ungesättigten Kupplungskomponenten 2.1. E-3-(2-omphenyl)-propenal (25) C H 3 H 1 H H 33 1' 3 22 25 2' Eine Emulsion aus 1.85 g (10.0 mmol) 2-ombenzaldehyd (22), 616 mg (14.0 mmol)
7 Experimenteller Teil
 7 Experimenteller Teil 7.1 Allgemeine Bemerkungen Zur Trocknung und Reinigung der Lösungsmittel wurden, sofern nicht anders vermerkt, die allgemein üblichen Standardverfahren angewendet [105]. Eine säulenchromatographische
7 Experimenteller Teil 7.1 Allgemeine Bemerkungen Zur Trocknung und Reinigung der Lösungsmittel wurden, sofern nicht anders vermerkt, die allgemein üblichen Standardverfahren angewendet [105]. Eine säulenchromatographische
Organisches Praktikum OCP II Wintersemester 2009/10. Versuch 30. 1,4-Diphenyl-6,7-dihydro-5H-cyclopenta[d]pyridazin. Betreuer:
![Organisches Praktikum OCP II Wintersemester 2009/10. Versuch 30. 1,4-Diphenyl-6,7-dihydro-5H-cyclopenta[d]pyridazin. Betreuer: Organisches Praktikum OCP II Wintersemester 2009/10. Versuch 30. 1,4-Diphenyl-6,7-dihydro-5H-cyclopenta[d]pyridazin. Betreuer:](/thumbs/55/37246535.jpg) Organisches Praktikum OCP II Wintersemester 2009/10 Versuch 30 1,4-Diphenyl-6,7-dihydro-5-cyclopenta[d]pyridazin Betreuer: Chemikalien: Benzonitril Tomahogh ydrazinhydrat achtraum (Kühlschrank) Schwefel
Organisches Praktikum OCP II Wintersemester 2009/10 Versuch 30 1,4-Diphenyl-6,7-dihydro-5-cyclopenta[d]pyridazin Betreuer: Chemikalien: Benzonitril Tomahogh ydrazinhydrat achtraum (Kühlschrank) Schwefel
Betreuer: Tobias Olbrich Literatur: Nach Organic Syntheses Coll. Vol. 10 (2004), 96.
 rganisches Praktikum CP II Wintersemester 2009/10 Versuch 28 Salen-Ligand Betreuer: Tobias lbrich Literatur: ach rganic Syntheses Coll. Vol. 10 (2004), 96. Chemikalien: L-()-Weinsäure 1,2-Diaminocyclohexan
rganisches Praktikum CP II Wintersemester 2009/10 Versuch 28 Salen-Ligand Betreuer: Tobias lbrich Literatur: ach rganic Syntheses Coll. Vol. 10 (2004), 96. Chemikalien: L-()-Weinsäure 1,2-Diaminocyclohexan
5 Chemisch-experimenteller Teil
 5 Chemisch-experimenteller Teil 113 5 Chemisch-experimenteller Teil 5.1 Allgemeine Angaben Schmelzpunkt-Bestimmung Lindström-Gerät (unkorrigiert) Elementaranalysen Elementar Vario EL IR-Spektren Perkin-Elmer
5 Chemisch-experimenteller Teil 113 5 Chemisch-experimenteller Teil 5.1 Allgemeine Angaben Schmelzpunkt-Bestimmung Lindström-Gerät (unkorrigiert) Elementaranalysen Elementar Vario EL IR-Spektren Perkin-Elmer
2017 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid
 217 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid O O Cl NH 3 NH 2 C 9 H 7 ClO (166.6) (17.) C 9 H 9 NO (147.2) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der Carbonylgruppe
217 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid O O Cl NH 3 NH 2 C 9 H 7 ClO (166.6) (17.) C 9 H 9 NO (147.2) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der Carbonylgruppe
4002 Synthese von Benzil aus Benzoin
 4002 Synthese von Benzil aus Benzoin H VCl 3 + 1 / 2 2 + 1 / 2 H 2 C 14 H 12 2 C 14 H 10 2 (212.3) 173.3 (210.2) Klassifizierung Reaktionstypen und Stoffklassen xidation Alkohol, Keton, Schwermetallkatalysator
4002 Synthese von Benzil aus Benzoin H VCl 3 + 1 / 2 2 + 1 / 2 H 2 C 14 H 12 2 C 14 H 10 2 (212.3) 173.3 (210.2) Klassifizierung Reaktionstypen und Stoffklassen xidation Alkohol, Keton, Schwermetallkatalysator
2-Methylcyclohexanon
 rganisches Praktikum I - SS 2006 Assistentin: Gabi Marti Synthese von 2-Methylcyclohexanon Zürich, Balzers & Eschen, Juni 2006 Daniel Frick frickd@student.ethz.ch 1. Einleitung 1 Das Ausgangsprodukt dieser
rganisches Praktikum I - SS 2006 Assistentin: Gabi Marti Synthese von 2-Methylcyclohexanon Zürich, Balzers & Eschen, Juni 2006 Daniel Frick frickd@student.ethz.ch 1. Einleitung 1 Das Ausgangsprodukt dieser
Ein Gemisch aus 13,2 g (0,1mol) 2,5-Dimethoxyterahydrofuran und 80ml 0,6 N Salzsäure werden erhitzt bis vollständige Lösung eintritt.
 1.Acetondicarbonsäureanhydrid 40g (0,27mol)Acetondicarbonsäure werden in einer Lösung aus 100ml Eisessig und 43ml (0,45mol) Essigsäureanhydrid gelöst. Die Temperatur sollte 20 C nicht überschreiten und
1.Acetondicarbonsäureanhydrid 40g (0,27mol)Acetondicarbonsäure werden in einer Lösung aus 100ml Eisessig und 43ml (0,45mol) Essigsäureanhydrid gelöst. Die Temperatur sollte 20 C nicht überschreiten und
Synthese von Acetophenon
 Illumina-Chemie.de - Artikel Synthesen Synthese von Geräte: 250 ml Zweihalskolben, Claisenaufsatz, 50 ml Tropftrichter mit Druckausgleich, Rückflusskühler, Eisbad, Trockenrohr, Thermometer, Magnetrührer,
Illumina-Chemie.de - Artikel Synthesen Synthese von Geräte: 250 ml Zweihalskolben, Claisenaufsatz, 50 ml Tropftrichter mit Druckausgleich, Rückflusskühler, Eisbad, Trockenrohr, Thermometer, Magnetrührer,
4028 Synthese von 1-Bromdodecan aus 1-Dodecanol
 4028 Synthese von 1-Bromdodecan aus 1-Dodecanol C 12 H 26 O (186.3) OH H 2 SO 4 konz. (98.1) + HBr (80.9) C 12 H 25 Br (249.2) Br + H 2 O (18.0) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
4028 Synthese von 1-Bromdodecan aus 1-Dodecanol C 12 H 26 O (186.3) OH H 2 SO 4 konz. (98.1) + HBr (80.9) C 12 H 25 Br (249.2) Br + H 2 O (18.0) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
SKRIPT ZUM INTEGRIERTEN SYNTHESEPRAKTIKUM
 Integriertes Synthesepraktikum 2016 rganische Chemie SKRIPT ZUM ITEGRIERTE SYTHESEPRAKTIKUM Woche 1 und 2 (rganische Chemie) 1. Herstellung eines Alkens über die lefinierung eines Aldehyds nach Wittig
Integriertes Synthesepraktikum 2016 rganische Chemie SKRIPT ZUM ITEGRIERTE SYTHESEPRAKTIKUM Woche 1 und 2 (rganische Chemie) 1. Herstellung eines Alkens über die lefinierung eines Aldehyds nach Wittig
Chloro(salen*)mangan(III)
 Chloro(salen*)mangan(III) [MnCl(salen*)] Asymmetrische Epoxidierung von Styrol Zürich, 31. Januar 2005 Raphael Aardoom, ACP 2 1 Synthese 1.1 Methode [1][2][3] Salen* reagiert mit Mangan(II)acetat und atriumchlorid
Chloro(salen*)mangan(III) [MnCl(salen*)] Asymmetrische Epoxidierung von Styrol Zürich, 31. Januar 2005 Raphael Aardoom, ACP 2 1 Synthese 1.1 Methode [1][2][3] Salen* reagiert mit Mangan(II)acetat und atriumchlorid
4023 Synthese von Cyclopentanon-2-carbonsäureethylester aus
 NP 4023 Synthese von Cyclopentanon-2-carbonsäureethylester aus Adipinsäurediethylester NaEt C 10 H 18 4 Na C 2 H 6 C 8 H 12 3 (202.2) (23.0) (46.1) (156.2) Klassifizierung Reaktionstypen und Stoffklassen
NP 4023 Synthese von Cyclopentanon-2-carbonsäureethylester aus Adipinsäurediethylester NaEt C 10 H 18 4 Na C 2 H 6 C 8 H 12 3 (202.2) (23.0) (46.1) (156.2) Klassifizierung Reaktionstypen und Stoffklassen
Protokoll zum Gruppenpra parat
 Protokoll zum Gruppenpra parat Versuche 5.4.1.2 und 4.4.4: Darstellung von 1 Naphthol 1. Darstellung von Anthranilsäure aus Phthalsäureimid 1.1. Literatur [1] www.merckmillipore.de/chemicals [2] sdbs.riodb.aist.go.jp/
Protokoll zum Gruppenpra parat Versuche 5.4.1.2 und 4.4.4: Darstellung von 1 Naphthol 1. Darstellung von Anthranilsäure aus Phthalsäureimid 1.1. Literatur [1] www.merckmillipore.de/chemicals [2] sdbs.riodb.aist.go.jp/
7.2.1 Nitrierung von Toluol zu 2-Nitrotoluol (1a), 4-Nitrotoluol (1b) und 2,4-Dinitrotoluol
 7.2.1 Nitrierung von Toluol zu 2-Nitrotoluol (1a), 4-Nitrotoluol (1b) und 2,4-Dinitrotoluol (1c) HNO 3, H 2 SO 4 + + C 7 H 8 (92.1) HNO 3 (63.0) H 2 SO 4 (98.1) 1a 1b 1c C 7 H 7 (137.1) C 7 H 6 N 2 O 4
7.2.1 Nitrierung von Toluol zu 2-Nitrotoluol (1a), 4-Nitrotoluol (1b) und 2,4-Dinitrotoluol (1c) HNO 3, H 2 SO 4 + + C 7 H 8 (92.1) HNO 3 (63.0) H 2 SO 4 (98.1) 1a 1b 1c C 7 H 7 (137.1) C 7 H 6 N 2 O 4
6011 Hippursäure aus Glycin und Benzoylchlorid
 P 6011 Hippursäure aus Glycin und Benzoylchlorid Cl + H 2 H H H C 7 H 5 Cl C 2 H 5 2 C 9 H 9 3 (140.6) (75.1) (179.2) Klassifizierung Reaktionstypen und Stoffklassen Benzoylierung, Reaktion der Carbonylgruppe
P 6011 Hippursäure aus Glycin und Benzoylchlorid Cl + H 2 H H H C 7 H 5 Cl C 2 H 5 2 C 9 H 9 3 (140.6) (75.1) (179.2) Klassifizierung Reaktionstypen und Stoffklassen Benzoylierung, Reaktion der Carbonylgruppe
Organisch chemisches Praktikum II
 18.04.2010 rganisch chemisches Praktikum II WS 2009 / 2010 Gruppenpräparat 7.3.4: 1,3-Dibenzoylbenzimidazolon Heuler Dominik Sedlag Florian Inhaltsverzeichnis: 1 Einleitung 2 Literaturrecherche 3 Reaktionsgleichung
18.04.2010 rganisch chemisches Praktikum II WS 2009 / 2010 Gruppenpräparat 7.3.4: 1,3-Dibenzoylbenzimidazolon Heuler Dominik Sedlag Florian Inhaltsverzeichnis: 1 Einleitung 2 Literaturrecherche 3 Reaktionsgleichung
Disproportionierung von Furan-2-carbaldehyd (Furfural) mit Natronlauge zu Furan-2-carbonsäure und 2-Furylmethanol (Cannizzaro-Reaktion)
 4.3.1.8 Disproportionierung von Furan-2-carbaldehyd (Furfural) mit Natronlauge zu Furan-2-carbonsäure und 2-Furylmethanol (Cannizzaro-Reaktion) H NaH konz. 8a H + 8b H H 4 2 (96.1) H 4 3 (112.1) H 6 2
4.3.1.8 Disproportionierung von Furan-2-carbaldehyd (Furfural) mit Natronlauge zu Furan-2-carbonsäure und 2-Furylmethanol (Cannizzaro-Reaktion) H NaH konz. 8a H + 8b H H 4 2 (96.1) H 4 3 (112.1) H 6 2
170 C C 2 H C C 11 H 10 (174.2) Darstellung von Cyclopentadien durch thermische Spaltung von Dicyclopentadien
 3.4.2 Darstellung von Cyclopentadien durch thermische Spaltung von Dicyclopentadien. [4+2]-Cycloaddition von Cyclopentadien mit p-benzochinon zum 1:1- Addukt (2a) und zum 2:1-Addukt (2b) 170 C 2 C 10 12
3.4.2 Darstellung von Cyclopentadien durch thermische Spaltung von Dicyclopentadien. [4+2]-Cycloaddition von Cyclopentadien mit p-benzochinon zum 1:1- Addukt (2a) und zum 2:1-Addukt (2b) 170 C 2 C 10 12
3001 Hydroborierung/Oxidation von 1-Octen zu 1-Octanol
 3001 Hydroborierung/Oxidation von 1-Octen zu 1-Octanol 1. NaBH, I CH H 3 C C. H O /NaOH H 3 OH C 8 H 16 NaBH H O I NaOH C 8 H 18 O (11.) (37.8) (3.0) (53.8) (0.0) (130.) Literatur A.S. Bhanu Prasad, J.V.
3001 Hydroborierung/Oxidation von 1-Octen zu 1-Octanol 1. NaBH, I CH H 3 C C. H O /NaOH H 3 OH C 8 H 16 NaBH H O I NaOH C 8 H 18 O (11.) (37.8) (3.0) (53.8) (0.0) (130.) Literatur A.S. Bhanu Prasad, J.V.
4019 Synthese von Acetamidostearinsäuremethylester aus Ölsäuremethylester
 NP 4019 Synthese von Acetamidostearinsäuremethylester aus Ölsäuremethylester C 19 H 36 2 (296.5) 10 9 SnCl 4 H 2 Me (260.5) + H 3 C C N C 2 H 3 N (41.1) NH + 10 10 9 9 Me Me C 21 H 41 N 3 (355.6) NH Klassifizierung
NP 4019 Synthese von Acetamidostearinsäuremethylester aus Ölsäuremethylester C 19 H 36 2 (296.5) 10 9 SnCl 4 H 2 Me (260.5) + H 3 C C N C 2 H 3 N (41.1) NH + 10 10 9 9 Me Me C 21 H 41 N 3 (355.6) NH Klassifizierung
Benzol-d. Illumina-Chemie.de - Artikel
 Illumina-Chemie.de - Artikel Synthesen Benzol-d 1 Dieser Versuch demonstriert eine häufig verwendete Möglichkeit zur gezielten Deuterierung von Molekülen, wie sie z.b. für die Mikrowellenspektroskopie
Illumina-Chemie.de - Artikel Synthesen Benzol-d 1 Dieser Versuch demonstriert eine häufig verwendete Möglichkeit zur gezielten Deuterierung von Molekülen, wie sie z.b. für die Mikrowellenspektroskopie
3 Experimenteller Teil
 77 3 Experimenteller Teil 3.1 Allgemeine Untersuchungsverfahren Chromatographie *Dünnschichtchromatographie Sorbentien: [a] DC-Alufolien, Kieselgel 60 F 254, Schichtdicke 0.2 mm (Merck) [b] Glasplatten,
77 3 Experimenteller Teil 3.1 Allgemeine Untersuchungsverfahren Chromatographie *Dünnschichtchromatographie Sorbentien: [a] DC-Alufolien, Kieselgel 60 F 254, Schichtdicke 0.2 mm (Merck) [b] Glasplatten,
3021 Oxidation von Anthracen zu Anthrachinon
 xidation von Anthracen zu Anthrachinon Ce(IV)(NH ) (N ) 6 C H CeH 8 N 8 8 C H 8 (78.) (58.) (8.) Literatur Tse-Lok Ho et al., Synthesis 97, 6. Klassifizierung Reaktionstypen und Stoffklassen xidation Aromat,
xidation von Anthracen zu Anthrachinon Ce(IV)(NH ) (N ) 6 C H CeH 8 N 8 8 C H 8 (78.) (58.) (8.) Literatur Tse-Lok Ho et al., Synthesis 97, 6. Klassifizierung Reaktionstypen und Stoffklassen xidation Aromat,
Organisch-chemisches Praktikum Wintersemester 2005/06. 1-Phenyl-propan-1-ol. Stephan Steinmann
 Organisch-chemisches Praktikum Wintersemester 005/06 -Phenyl-propan--ol 08.. 005 Stephan Steinmann . Methode [] Benzaldehyd () wird über eine Grignard-Reaktion mit Ethylmagnesiumbromid (5) zum -Phenylpropan--ol
Organisch-chemisches Praktikum Wintersemester 005/06 -Phenyl-propan--ol 08.. 005 Stephan Steinmann . Methode [] Benzaldehyd () wird über eine Grignard-Reaktion mit Ethylmagnesiumbromid (5) zum -Phenylpropan--ol
3003 Synthese von trans-2-chlorcyclohexanol aus Cyclohexen
 3003 Synthese von trans-2-chlorcyclohexanol aus Cyclohexen _ + SO 2 NCl Na OH H 2 SO 4 + x 3 H 2 O + Cl CH 3 SO 2 NH 2 CH 3 C 6 H 10 (82.2) C 7 H 13 ClNNaO 5 S (281.7) (98.1) C 6 H 11 ClO (134.6) C 7 H
3003 Synthese von trans-2-chlorcyclohexanol aus Cyclohexen _ + SO 2 NCl Na OH H 2 SO 4 + x 3 H 2 O + Cl CH 3 SO 2 NH 2 CH 3 C 6 H 10 (82.2) C 7 H 13 ClNNaO 5 S (281.7) (98.1) C 6 H 11 ClO (134.6) C 7 H
5007 Synthese von Fluorescein aus Phthalsäureanhydrid und Resorcin
 57 Synthese von Fluorescein aus Phthalsäureanhydrid und Resorcin CH H H + 2 + 2 H 2 H C 8 H 4 3 C 6 H 6 2 C 2 H 12 5 (148.1) (11.1) (332.3) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der
57 Synthese von Fluorescein aus Phthalsäureanhydrid und Resorcin CH H H + 2 + 2 H 2 H C 8 H 4 3 C 6 H 6 2 C 2 H 12 5 (148.1) (11.1) (332.3) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der
4 Experimenteller Teil
 4 EXPERIMENTELLER TEIL 62 4 Experimenteller Teil 4.1 Allgemeine Angaben Lösungsmittel und Reagenzien wurden vor Gebrauch gereinigt und falls angegeben entsprechend den Literaturangaben absolutiert 129.
4 EXPERIMENTELLER TEIL 62 4 Experimenteller Teil 4.1 Allgemeine Angaben Lösungsmittel und Reagenzien wurden vor Gebrauch gereinigt und falls angegeben entsprechend den Literaturangaben absolutiert 129.
Versuch 6.3.4: trans-1-benzoyl-2-phenylcyclopropan
 rganisch-chemisches Praktikum II WS 2008/2009 Gruppenpräparat Versuch 6.3.4: trans-1-benzoyl-2-phenylcyclopropan Felix Bergler Benjamin Fröhlich Franziska Witterauf Inhaltsverzeichnis 1. Aufgabenstellung.
rganisch-chemisches Praktikum II WS 2008/2009 Gruppenpräparat Versuch 6.3.4: trans-1-benzoyl-2-phenylcyclopropan Felix Bergler Benjamin Fröhlich Franziska Witterauf Inhaltsverzeichnis 1. Aufgabenstellung.
3 Experimenteller Teil
 Experimenteller Teil: Allgemeines 116 3 Experimenteller Teil 3.1 Allgemeines 3.1.1 Präparative Methoden 3.1.1.1 Arbeiten unter Schutzgas Alle metallorganischen Umsetzungen und sämtliche Reaktionen unter
Experimenteller Teil: Allgemeines 116 3 Experimenteller Teil 3.1 Allgemeines 3.1.1 Präparative Methoden 3.1.1.1 Arbeiten unter Schutzgas Alle metallorganischen Umsetzungen und sämtliche Reaktionen unter
4022 Synthese von (S)-(+)-3-Hydroxybuttersäureethylester
 NP 4022 Synthese von (S)-(+)-3-Hydroxybuttersäureethylester Fermentierende Hefe, Saccharose H C 6 H 10 3 C 12 H 22 11 C 6 H 12 3 (130.1) (342.3) (132.2) Klassifizierung Reaktionstypen und Stoffklassen
NP 4022 Synthese von (S)-(+)-3-Hydroxybuttersäureethylester Fermentierende Hefe, Saccharose H C 6 H 10 3 C 12 H 22 11 C 6 H 12 3 (130.1) (342.3) (132.2) Klassifizierung Reaktionstypen und Stoffklassen
Experimenteller Teil
 II 137 1. Allgemeine Anmerkungen Alle beschriebenen Versuche wurden, wenn nicht anders vermerkt, unter Stickstoff- Schutzgas-Atmosphäre durchgeführt. Zur Bestimmung der Schmelzpunkte wurde das Heiztischmikroskop
II 137 1. Allgemeine Anmerkungen Alle beschriebenen Versuche wurden, wenn nicht anders vermerkt, unter Stickstoff- Schutzgas-Atmosphäre durchgeführt. Zur Bestimmung der Schmelzpunkte wurde das Heiztischmikroskop
4027 Synthese von 11-Chlorundec-1-en aus 10-Undecen-1-ol
 4027 Synthese von 11-Chlorundec-1-en aus 10-Undecen-1-ol OH SOCl 2 Cl + HCl + SO 2 C 11 H 22 O C 11 H 21 Cl (170.3) (119.0) (188.7) (36.5) (64.1) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
4027 Synthese von 11-Chlorundec-1-en aus 10-Undecen-1-ol OH SOCl 2 Cl + HCl + SO 2 C 11 H 22 O C 11 H 21 Cl (170.3) (119.0) (188.7) (36.5) (64.1) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
Allgemeiner Teil (Synthese)
 Allgemeiner Teil (Synthese) 10 B Allgemeiner Teil (Synthese) Da ein großer Teil der Moleküle mittels der Synthesesequenz für die Tetrablockmoleküle dargestellt wurde soll exemplarisch für diese eine kurze
Allgemeiner Teil (Synthese) 10 B Allgemeiner Teil (Synthese) Da ein großer Teil der Moleküle mittels der Synthesesequenz für die Tetrablockmoleküle dargestellt wurde soll exemplarisch für diese eine kurze
3 Cyclophane mit zwei identischen starren Strukturelementen Synthese und flüssigkristalline Eigenschaften von Biphenylophanen
 Cyclophane mit zwei identischen starren trukturelementen 8 3 Cyclophane mit zwei identischen starren trukturelementen 3.1 Biphenylophane 3.1.1 ynthese und flüssigkristalline Eigenschaften von Biphenylophanen
Cyclophane mit zwei identischen starren trukturelementen 8 3 Cyclophane mit zwei identischen starren trukturelementen 3.1 Biphenylophane 3.1.1 ynthese und flüssigkristalline Eigenschaften von Biphenylophanen
6012 Aldol-Kondensation von Aceton und Benzaldehyd zu Dibenzalaceton (1,5-Diphenyl-1,4-pentadien-3-on)
 6012 Aldol-Kondensation von Aceton und Benzaldehyd zu Dibenzalaceton (1,5-Diphenyl-1,4-pentadien-3-on) H 2 + KH H 2 /EtH/THF C 7 H 6 C 3 H 6 KH (56.1) C 17 H 14 (106.1) (58.1) (234.3) Klassifizierung Reaktionstypen
6012 Aldol-Kondensation von Aceton und Benzaldehyd zu Dibenzalaceton (1,5-Diphenyl-1,4-pentadien-3-on) H 2 + KH H 2 /EtH/THF C 7 H 6 C 3 H 6 KH (56.1) C 17 H 14 (106.1) (58.1) (234.3) Klassifizierung Reaktionstypen
4006 Synthese von 2-(3-Oxobutyl)cyclopentanon-2- carbonsäureethylester
 4006 Synthese von 2-(3-xobutyl)cyclopentanon-2- carbonsäureethylester CEt + FeCl 3 x 6 H 2 CEt C 8 H 12 3 C 4 H 6 C 12 H 18 4 (156.2) (70.2) (270.3) (226.3) Klassifizierung Reaktionstypen und Stoffklassen
4006 Synthese von 2-(3-xobutyl)cyclopentanon-2- carbonsäureethylester CEt + FeCl 3 x 6 H 2 CEt C 8 H 12 3 C 4 H 6 C 12 H 18 4 (156.2) (70.2) (270.3) (226.3) Klassifizierung Reaktionstypen und Stoffklassen
8. Experimenteller Teil. 8.1 Darstellung und Charakterisierung von Bis(triphenylphosphoranyliden)ammonium-Salzen
 8. Experimenteller Teil 8.1 Darstellung und Charakterisierung von Bis(triphenylphosphoranyliden)ammonium-Salzen Das voluminöse [((C 6 H 5 ) 3 P) 2 N] + -Ion ist u.a. wegen der gleichmäßigen Ladungsverteilung
8. Experimenteller Teil 8.1 Darstellung und Charakterisierung von Bis(triphenylphosphoranyliden)ammonium-Salzen Das voluminöse [((C 6 H 5 ) 3 P) 2 N] + -Ion ist u.a. wegen der gleichmäßigen Ladungsverteilung
Synthese von Acetessigsäureethylester
 Illumina-Chemie.de - Artikel Synthesen Synthese von Acetessigsäureethylester Acetessigsäureethylester ist der wohl bekannteste β-ketoester und durch seine CH-acide Methylengruppe (pk a = 11) leicht elektrophil
Illumina-Chemie.de - Artikel Synthesen Synthese von Acetessigsäureethylester Acetessigsäureethylester ist der wohl bekannteste β-ketoester und durch seine CH-acide Methylengruppe (pk a = 11) leicht elektrophil
4009 Synthese von Adipinsäure aus Cyclohexen
 4009 Synthese von Adipinsäure aus Cyclohexen C 6 H 10 (82.2) + Natriumwolframat-Dihydrat + 4 H 2 H 2 H + 4 H 2 (34.0) + Aliquat 336. Na 2 W 4 2 H 2 (329.9) C 25 H 54 ClN (404.2) C 6 H 10 4 (146.1) Klassifizierung
4009 Synthese von Adipinsäure aus Cyclohexen C 6 H 10 (82.2) + Natriumwolframat-Dihydrat + 4 H 2 H 2 H + 4 H 2 (34.0) + Aliquat 336. Na 2 W 4 2 H 2 (329.9) C 25 H 54 ClN (404.2) C 6 H 10 4 (146.1) Klassifizierung
3016 Oxidation von Ricinolsäure (aus Rizinusöl) mit KMnO 4 zu Azelainsäure
 6 Oxidation von Ricinolsäure (aus Rizinusöl) mit KMnO 4 zu Azelainsäure CH -(CH ) OH (CH ) -COOH KMnO 4 /KOH HOOC-(CH ) -COOH C H 4 O (.) KMnO 4 KOH (.) (6.) C H 6 O 4 (.) Klassifizierung Reaktionstypen
6 Oxidation von Ricinolsäure (aus Rizinusöl) mit KMnO 4 zu Azelainsäure CH -(CH ) OH (CH ) -COOH KMnO 4 /KOH HOOC-(CH ) -COOH C H 4 O (.) KMnO 4 KOH (.) (6.) C H 6 O 4 (.) Klassifizierung Reaktionstypen
3012 Synthese von Adamantylidenadamantan aus Adamantanon
 Synthese von Adamantylidenadamantan aus Adamantanon O TiCl /Zn/THF C H O (.) TiCl Zn (9.) (.) C H (.) Literatur D. Lenoir, Synthesis, 99, -9 Klassifizierung Reaktionstypen und Stoffklassen McMurry-Reaktion,
Synthese von Adamantylidenadamantan aus Adamantanon O TiCl /Zn/THF C H O (.) TiCl Zn (9.) (.) C H (.) Literatur D. Lenoir, Synthesis, 99, -9 Klassifizierung Reaktionstypen und Stoffklassen McMurry-Reaktion,
2013 Umsetzung von Zimtsäure mit Thionylchlorid zu Zimtsäurechlorid
 2013 Umsetzung von Zimtsäure mit Thionylchlorid zu Zimtsäurechlorid H + SCl 2 Cl + HCl + S 2 C 9 H 8 2 (148.2) (119.0) C 9 H 7 Cl (166.6) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der Carbonylgruppe
2013 Umsetzung von Zimtsäure mit Thionylchlorid zu Zimtsäurechlorid H + SCl 2 Cl + HCl + S 2 C 9 H 8 2 (148.2) (119.0) C 9 H 7 Cl (166.6) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der Carbonylgruppe
1011 Synthese von 1,4-Di-tert-butylbenzol aus tert-butylbenzol und tert-butylchlorid
 1011 Synthese von 1,4-Di-tert-butylbenzol aus tert-butylbenzol und tert-butylchlorid + Cl AlCl 3 C 10 H 14 (134.) C 4 H 9 Cl C 14 H (9.6) (133.3) (190.3) Klassifizierung Reaktionstypen und Stoffklassen
1011 Synthese von 1,4-Di-tert-butylbenzol aus tert-butylbenzol und tert-butylchlorid + Cl AlCl 3 C 10 H 14 (134.) C 4 H 9 Cl C 14 H (9.6) (133.3) (190.3) Klassifizierung Reaktionstypen und Stoffklassen
5012 Synthese von Acetylsalicylsäure (Aspirin) aus Salicylsäure und Acetanhydrid
 NP 5012 Synthese von Acetylsalicylsäure (Aspirin) aus Salicylsäure und Acetanhydrid CH CH + H H 2 S 4 + CH 3 CH C 4 H 6 3 C 7 H 6 3 C 9 H 8 4 C 2 H 4 2 (120.1) (138.1) (98.1) (180.2) (60.1) Klassifizierung
NP 5012 Synthese von Acetylsalicylsäure (Aspirin) aus Salicylsäure und Acetanhydrid CH CH + H H 2 S 4 + CH 3 CH C 4 H 6 3 C 7 H 6 3 C 9 H 8 4 C 2 H 4 2 (120.1) (138.1) (98.1) (180.2) (60.1) Klassifizierung
4029 Synthese von Dodecylphenylether aus Bromdodecan und Phenol OH
 4029 Synthese von Dodecylphenylether aus Bromdodecan und Phenol H C 12 H 25 Br (249.2) Br + + NaH (40.0) + Adogen 464 C 25 H 54 ClN (404.2) C 6 H 6 (94.1) C 18 H 30 (262.4) + NaBr (102.9) Klassifizierung
4029 Synthese von Dodecylphenylether aus Bromdodecan und Phenol H C 12 H 25 Br (249.2) Br + + NaH (40.0) + Adogen 464 C 25 H 54 ClN (404.2) C 6 H 6 (94.1) C 18 H 30 (262.4) + NaBr (102.9) Klassifizierung
Tris(acetylacetonato)cobalt(III)
 Tris(acetylacetonato)cobalt(III) [Co(C5H7)3] Cobalt(III)acetylacetonat Zürich, 7. November 004 Raphael Aardoom, ACP 1 Synthese 1.1 Methode [1] Cobalt(II)carbonat reagiert mit Acetylaceton in Gegenwart
Tris(acetylacetonato)cobalt(III) [Co(C5H7)3] Cobalt(III)acetylacetonat Zürich, 7. November 004 Raphael Aardoom, ACP 1 Synthese 1.1 Methode [1] Cobalt(II)carbonat reagiert mit Acetylaceton in Gegenwart
1007 Synthese von 2,4,6-Tribromanilin aus 4-Bromacetanilid
 1007 Synthese von 2,4,6-Tribromanilin aus 4-omacetanilid O HN CH 3 NH 2 NH 2 KOH 2 C 8 H 8 NO C 6 H 6 N C 6 H 4 3 N (214.1) (56.1) (172.0) (159.8) (329.8) Klassifizierung Reaktionstypen und Stoffklassen
1007 Synthese von 2,4,6-Tribromanilin aus 4-omacetanilid O HN CH 3 NH 2 NH 2 KOH 2 C 8 H 8 NO C 6 H 6 N C 6 H 4 3 N (214.1) (56.1) (172.0) (159.8) (329.8) Klassifizierung Reaktionstypen und Stoffklassen
4 Experimenteller Teil
 73 4 Experimenteller Teil 4.1 Allgemeine Angaben Schmelzpunktbestimmung Die angegebenen Schmelztemperaturen wurden an einem Boetius-Heiztischmikroskop bestimmt und stellen unkorrigierte Werte dar. Elementaranalyse
73 4 Experimenteller Teil 4.1 Allgemeine Angaben Schmelzpunktbestimmung Die angegebenen Schmelztemperaturen wurden an einem Boetius-Heiztischmikroskop bestimmt und stellen unkorrigierte Werte dar. Elementaranalyse
5013 Synthese von 2,6-Dimethyl-4-phenyl-1,4-dihydropyridin- 3,5-dicarbonsäure-diethylester
 NP 5013 Synthese von 2,6-Dimethyl-4-phenyl-1,4-dihydropyridin- 3,5-dicarbonsäure-diethylester NH 4 HC 3 + + 2 C 2 C 2 C 2 H CH 3 H 3 C N CH 3 H + 4 H 2 + C N 3 C 7 H 6 C 6 H 10 3 C 19 H 23 4 N C 2 (79.1)
NP 5013 Synthese von 2,6-Dimethyl-4-phenyl-1,4-dihydropyridin- 3,5-dicarbonsäure-diethylester NH 4 HC 3 + + 2 C 2 C 2 C 2 H CH 3 H 3 C N CH 3 H + 4 H 2 + C N 3 C 7 H 6 C 6 H 10 3 C 19 H 23 4 N C 2 (79.1)
3.4.6 Cycloaddition von Anthracen und 1,4-Benzochinon unter Aluminiumchlorid- Katalyse zum 1:1-Addukt 6a und zum 2:1-Addukt 6b
 3.4.6 Cycloaddition von Anthracen und 1,4-Benzochinon unter Aluminiumchlorid- Katalyse zum 1:1-Addukt 6a und zum 2:1-Addukt 6b 1 : 1 6a + AlCl 3 C 2 Cl 2 2 : 1 6b C 14 10 (178.2) C 6 4 2 (108.1) AlCl 3
3.4.6 Cycloaddition von Anthracen und 1,4-Benzochinon unter Aluminiumchlorid- Katalyse zum 1:1-Addukt 6a und zum 2:1-Addukt 6b 1 : 1 6a + AlCl 3 C 2 Cl 2 2 : 1 6b C 14 10 (178.2) C 6 4 2 (108.1) AlCl 3
NO 2 Rühren mit Magnetrührer, Extrahieren, Ausschütteln, Abrotieren, Umkristallisieren, Abfiltrieren,
 1003 Nitrierung von Benzaldehyd zu 3-Nitrobenzaldehyd H O H O HNO 3 /H 2 SO 4 + Nebenprodukte NO 2 7 H 6 O HNO 3 (63.0) 7 H 5 NO 3 (106.1) H 2 SO 4 (98.1) (151.1) Klassifizierung Reaktionstypen und Stoffklassen
1003 Nitrierung von Benzaldehyd zu 3-Nitrobenzaldehyd H O H O HNO 3 /H 2 SO 4 + Nebenprodukte NO 2 7 H 6 O HNO 3 (63.0) 7 H 5 NO 3 (106.1) H 2 SO 4 (98.1) (151.1) Klassifizierung Reaktionstypen und Stoffklassen
Gruppenpräparat im Rahmen des organisch-chemischen Praktikums II im Wintersemester 2006/2007 an der Universität Würzburg
 Gruppenpräparat im Rahmen des organisch-chemischen raktikums II im Wintersemester 2006/2007 an der Universität Würzburg Versuch 10.1.1: Trennung eines racemischen Gemisches aus (M)- und ()-2,2 -Dihydroxy-1,1
Gruppenpräparat im Rahmen des organisch-chemischen raktikums II im Wintersemester 2006/2007 an der Universität Würzburg Versuch 10.1.1: Trennung eines racemischen Gemisches aus (M)- und ()-2,2 -Dihydroxy-1,1
4026 Synthese von 2-Chlor-2-methylpropan (tert-butylchlorid) aus tert-butanol
 4026 Synthese von 2-Chlor-2-methylpropan (tert-butylchlorid) aus tert-butanol OH + HCl Cl + H 2 O C 4 H 10 O C 4 H 9 Cl (74.1) (36.5) (92.6) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
4026 Synthese von 2-Chlor-2-methylpropan (tert-butylchlorid) aus tert-butanol OH + HCl Cl + H 2 O C 4 H 10 O C 4 H 9 Cl (74.1) (36.5) (92.6) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
1017 Azokupplung von Benzoldiazoniumchlorid mit 2-Naphthol zu 1-Phenylazo-2-naphthol
 OP 1017 Azokupplung von Benzoldiazoniumchlorid mit 2-aphthol zu 1-Phenylazo-2-naphthol H 3 Cl Cl ao 2 C 6 H 8 Cl (129.6) (69.0) C 6 H 5 Cl 2 (140.6) OH + Cl OH C 10 H 8 O (144.2) C 6 H 5 Cl 2 (140.6) C
OP 1017 Azokupplung von Benzoldiazoniumchlorid mit 2-aphthol zu 1-Phenylazo-2-naphthol H 3 Cl Cl ao 2 C 6 H 8 Cl (129.6) (69.0) C 6 H 5 Cl 2 (140.6) OH + Cl OH C 10 H 8 O (144.2) C 6 H 5 Cl 2 (140.6) C
1035 Synthese von p-methoxyacetophenon aus Anisol
 NP 05 Synthese von p-methoxyacetophenon aus Anisol CH + CH CH Sc(Tf) + CH CH CH CH C 7 H 8 (08.) C 4 H 6 (02.) (CF S ) Sc (492.2) C 9 H 0 2 (50.2) C 2 H 4 2 (60.) Klassifizierung Reaktionstypen und Stoffklassen
NP 05 Synthese von p-methoxyacetophenon aus Anisol CH + CH CH Sc(Tf) + CH CH CH CH C 7 H 8 (08.) C 4 H 6 (02.) (CF S ) Sc (492.2) C 9 H 0 2 (50.2) C 2 H 4 2 (60.) Klassifizierung Reaktionstypen und Stoffklassen
3011 Synthese von erythro-9,10-dihydroxystearinsäure aus Ölsäure
 311 Synthese von erythro-9,1-dihydroxystearinsäure aus Ölsäure COOH KMnO 4 /NaOH HO HO COOH C 18 H 34 O 2 (282.5) KMnO 4 (158.) NaOH (4.) C 18 H 36 O 4 (316.5) Literatur A. Lapworth und E. N. Mottram,
311 Synthese von erythro-9,1-dihydroxystearinsäure aus Ölsäure COOH KMnO 4 /NaOH HO HO COOH C 18 H 34 O 2 (282.5) KMnO 4 (158.) NaOH (4.) C 18 H 36 O 4 (316.5) Literatur A. Lapworth und E. N. Mottram,
Leitfaden: Protokoll Routinestufe
 Leitfaden: Protokoll Routinestufe Musterprotokoll: OC-Website, Informationen für Studierende, F-Praktikum, Vordrucke und Formulare, Musterprotokoll_Routinestufe - Kopf-/Fußzeile: Name, Präparate-Nummer,
Leitfaden: Protokoll Routinestufe Musterprotokoll: OC-Website, Informationen für Studierende, F-Praktikum, Vordrucke und Formulare, Musterprotokoll_Routinestufe - Kopf-/Fußzeile: Name, Präparate-Nummer,
1009 Intramolekulare Acylierung von 4-Phenylbuttersäure zu 1,2,3,4-Tetrahydronaphthalin-1-on (α-tetralon)
 1009 Intramolekulare Acylierung von 4-Phenylbuttersäure zu 1,2,3,4-Tetrahydronaphthalin-1-on (α-tetralon) H Polyphosphorsäure C 10 H 12 2 (164.2) C 10 H 10 (146.2) Klassifizierung Reaktionstypen und Stoffklassen
1009 Intramolekulare Acylierung von 4-Phenylbuttersäure zu 1,2,3,4-Tetrahydronaphthalin-1-on (α-tetralon) H Polyphosphorsäure C 10 H 12 2 (164.2) C 10 H 10 (146.2) Klassifizierung Reaktionstypen und Stoffklassen
3 Darstellung von n-butyllithium
 3 Darstellung von n-butyllithium 3.1 Haltbarkeit von Butyllithium in Heptan und in Diethylether 1 n-butyllithium kann man in verschiedenen Solventien darstellen, z.b. in Diethylether und in n-heptan. Dabei
3 Darstellung von n-butyllithium 3.1 Haltbarkeit von Butyllithium in Heptan und in Diethylether 1 n-butyllithium kann man in verschiedenen Solventien darstellen, z.b. in Diethylether und in n-heptan. Dabei
Organisches Praktikum I - SS 2006 Assistentin: Gabi Marti. Synthese von. Isobutylacetat. Zürich, Balzers & Eschen, Mai 2005
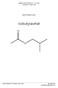 rganisches Praktikum I - SS 2006 Assistentin: Gabi Marti Synthese von Isobutylacetat Zürich, Balzers & Eschen, Mai 2005 Daniel Frick frickd@student.ethz.ch 1. Einleitung 1 Carbonsäure bilden mit Alkoholen
rganisches Praktikum I - SS 2006 Assistentin: Gabi Marti Synthese von Isobutylacetat Zürich, Balzers & Eschen, Mai 2005 Daniel Frick frickd@student.ethz.ch 1. Einleitung 1 Carbonsäure bilden mit Alkoholen
5009 Synthese von Kupferphthalocyanin
 P 59 Synthese von Kupferphthalocyanin (H H ) 6 Mo 7 2 2. H2 + 8 + CuCl H 2-8 H 3-8 C 2 - H 2 - HCl Cu C 8 H 3 CH 2 CuCl H 2 Mo 7 6 2. H 2 C 32 H 16 8 Cu (18.1) (6.1) (99.) (1235.9) (576.1) Literatur Klassiche
P 59 Synthese von Kupferphthalocyanin (H H ) 6 Mo 7 2 2. H2 + 8 + CuCl H 2-8 H 3-8 C 2 - H 2 - HCl Cu C 8 H 3 CH 2 CuCl H 2 Mo 7 6 2. H 2 C 32 H 16 8 Cu (18.1) (6.1) (99.) (1235.9) (576.1) Literatur Klassiche
5001 Nitrierung von Phenol zu 2-Nitrophenol und 4-Nitrophenol
 00 Nitrierung von Phenol zu -Nitrophenol und -Nitrophenol KNO, H SO NO + NO C H O (9.) KNO (0.) H SO (98.) C H NO (9.) Klassifizierung Reaktionstypen und Stoffklassen Elektrophile Substitution an Aromaten,
00 Nitrierung von Phenol zu -Nitrophenol und -Nitrophenol KNO, H SO NO + NO C H O (9.) KNO (0.) H SO (98.) C H NO (9.) Klassifizierung Reaktionstypen und Stoffklassen Elektrophile Substitution an Aromaten,
3009 Synthese von trans-5-norbornen-2,3-dicarbonsäure aus Fumarsäure und Cyclopentadien
 3009 Synthese von trans-5-norbornen-2,3-dicarbonsäure aus Fumarsäure und Cyclopentadien 170 C 2 C 10 H 12 C 5 H 6 (132.2) (66.1) + COOH COOH HOOC COOH C 5 H 6 (66.1) C 4 H 4 O 4 (116.1) C 9 H 10 O 4 (182.2)
3009 Synthese von trans-5-norbornen-2,3-dicarbonsäure aus Fumarsäure und Cyclopentadien 170 C 2 C 10 H 12 C 5 H 6 (132.2) (66.1) + COOH COOH HOOC COOH C 5 H 6 (66.1) C 4 H 4 O 4 (116.1) C 9 H 10 O 4 (182.2)
Indan-1,3-dion. Reaktionsgleichung. H- und P-Sätze. Für alle Reagenzien und Produkte. Ausformulierte H- und P-Sätze. Vor(Abschluss)protokoll
 Indan-1,3-dion Reaktionsgleichung H- und P-Sätze Substanz Gefahrensymbol Smp. ( C) Sdp. ( C) Phtalsäurediethylester Essigsäureethylester Flammpkt. ( C) H-Sätze P-Sätze - -40 302 150 - - Gefahr -83 77-4
Indan-1,3-dion Reaktionsgleichung H- und P-Sätze Substanz Gefahrensymbol Smp. ( C) Sdp. ( C) Phtalsäurediethylester Essigsäureethylester Flammpkt. ( C) H-Sätze P-Sätze - -40 302 150 - - Gefahr -83 77-4
Versuchsprotokoll. Versuch 2.5 B: Brom-Addition an Cholesterol und Brom-Eliminierung N - NaI
 Matrikelnr.: 242232 Organischchemisches Grundpraktikum Versuchsprotokoll Versuch 2.5 B: omaddition an Cholesterol und omeliminierung Reaktionsgleichung: 2 3 3 O ai O 386,7 g/mol 606,6 g/mol C 3 COO Literatur:
Matrikelnr.: 242232 Organischchemisches Grundpraktikum Versuchsprotokoll Versuch 2.5 B: omaddition an Cholesterol und omeliminierung Reaktionsgleichung: 2 3 3 O ai O 386,7 g/mol 606,6 g/mol C 3 COO Literatur:
1001 Nitrierung von Toluol zu 4-Nitrotoluol, 2-Nitrotoluol und 2,4-Dinitrotoluol
 1001 Nitrierung von Toluol zu 4-Nitrotoluol, 2-Nitrotoluol und 2,4-Dinitrotoluol CH 3 CH 3 CH 3 NO 2 CH 3 NO 2 HNO 3 /H 2 SO 4 + + + Nebenprodukte NO 2 NO 2 C 7 H 8 (92.1) HNO 3 (63.0) H 2 SO 4 (98.1)
1001 Nitrierung von Toluol zu 4-Nitrotoluol, 2-Nitrotoluol und 2,4-Dinitrotoluol CH 3 CH 3 CH 3 NO 2 CH 3 NO 2 HNO 3 /H 2 SO 4 + + + Nebenprodukte NO 2 NO 2 C 7 H 8 (92.1) HNO 3 (63.0) H 2 SO 4 (98.1)
2022 Reduktion von L-( )-Menthon mit Lithiumaluminiumhydrid zu einem Isomerengemisch ( )-Menthol (a) und (+)-Neomenthol (b).
 2022 Reduktion von L-( )-Menthon mit Lithiumaluminiumhydrid zu einem Isomerengemisch ( )-Menthol (a) und (+)-Neomenthol (b). 3 O LiAl 4 tert-butylmethylether 3 O + 3 O a b 10 18 O (154.3) LiAl 4 (38.0)
2022 Reduktion von L-( )-Menthon mit Lithiumaluminiumhydrid zu einem Isomerengemisch ( )-Menthol (a) und (+)-Neomenthol (b). 3 O LiAl 4 tert-butylmethylether 3 O + 3 O a b 10 18 O (154.3) LiAl 4 (38.0)
1004 Nitrierung von Pyridin-N-oxid zu 4-Nitropyridin-N-oxid
 1004 Nitrierung von Pyridin-N-oxid zu 4-Nitropyridin-N-oxid O N HNO 3 /H 2 SO 4 O N NO 2 C 5 H 5 NO (95.1) (63.0) (98.1) C 5 H 4 N 2 O 3 (140.1) Klassifizierung Reaktionstypen und Stoffklassen Elektrophile
1004 Nitrierung von Pyridin-N-oxid zu 4-Nitropyridin-N-oxid O N HNO 3 /H 2 SO 4 O N NO 2 C 5 H 5 NO (95.1) (63.0) (98.1) C 5 H 4 N 2 O 3 (140.1) Klassifizierung Reaktionstypen und Stoffklassen Elektrophile
Präparat 5: Darstellung von Triphenylmethanol -Reaktion der Carbonylfunktion mit Kohlenstoff-Nukleophilen (Grignard-Verbindungen)-
 Christina Sauermann 1 Präparat 5: Darstellung von Triphenylmethanol -Reaktion der Carbonylfunktion mit Kohlenstoff-Nukleophilen (Grignard-Verbindungen)- C + Et 2 C H C 13 H 10 (M=182,22 g/mol) C 6 H 5
Christina Sauermann 1 Präparat 5: Darstellung von Triphenylmethanol -Reaktion der Carbonylfunktion mit Kohlenstoff-Nukleophilen (Grignard-Verbindungen)- C + Et 2 C H C 13 H 10 (M=182,22 g/mol) C 6 H 5
4. Experimenteller Teil
 . Experimenteller Teil.. Material und Methoden... Analytik... H-MR-Spektroskopie Sämtliche Substanzen wurden mit Spektrometern des Typs AC 0 oder AC 0 und in besonderen Fällen mit einem AMX 00 der Firma
. Experimenteller Teil.. Material und Methoden... Analytik... H-MR-Spektroskopie Sämtliche Substanzen wurden mit Spektrometern des Typs AC 0 oder AC 0 und in besonderen Fällen mit einem AMX 00 der Firma
Titration von Metallorganylen und Darstellung der dazu benötigten
 Kapitel 1 Titration von tallorganylen und Darstellung der dazu benötigten Indikatoren -(2-Tolyl)pivalinsäureamid, ein Indikator zur Konzentrationsbestimmung von -rganylen [1] Reaktionstyp: Syntheseleistung:
Kapitel 1 Titration von tallorganylen und Darstellung der dazu benötigten Indikatoren -(2-Tolyl)pivalinsäureamid, ein Indikator zur Konzentrationsbestimmung von -rganylen [1] Reaktionstyp: Syntheseleistung:
Endersch, Jonas Praktikum Allgemeine Chemie 2, Saal G1, Platz 53
 Endersch, Jonas 30.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.5a: Herstellung von Cholesterylbenzoat Reaktionsgleichung: Einleitung und Theorie: In diesem Versuch
Endersch, Jonas 30.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.5a: Herstellung von Cholesterylbenzoat Reaktionsgleichung: Einleitung und Theorie: In diesem Versuch
Versuch 1.6/1: Benutzung des Wasserabscheiders zur Synthese von 2 (m Nitrophenyl) 1,3 dioxalan
 Endersch, Jonas 16.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Gruppe 3, Platz 53 Versuchsprotokoll Versuch 1.6/1: Benutzung des Wasserabscheiders zur Synthese von 2 (m Nitrophenyl) 1,3 dioxalan Reaktionsgleichung:
Endersch, Jonas 16.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Gruppe 3, Platz 53 Versuchsprotokoll Versuch 1.6/1: Benutzung des Wasserabscheiders zur Synthese von 2 (m Nitrophenyl) 1,3 dioxalan Reaktionsgleichung:
Praktikum Advanced Inorganic Chemistry. Praktikumsanleitung Version 10/2012. Graetzel Zelle
 Praktikum Advanced Inorganic Chemistry Praktikumsanleitung Version 10/2012 Graetzel Zelle Synthese von cis-ru II (dcbpy) 2 (CS) 2 Chemikalien: RuCl 3 x H 2 5,5 -Dicarboxyl-2,2`-bipyridin (Herstellung s.
Praktikum Advanced Inorganic Chemistry Praktikumsanleitung Version 10/2012 Graetzel Zelle Synthese von cis-ru II (dcbpy) 2 (CS) 2 Chemikalien: RuCl 3 x H 2 5,5 -Dicarboxyl-2,2`-bipyridin (Herstellung s.
Mustervorschrift zu Versuch 6.3.4: trans-1-benzoyl-2-phenylcyclopropan
 Mustervorschrift zu Versuch 6.3.4: trans-1-benzoyl-2-phenylcyclopropan Reaktion: Na N Cl + H 3 C CuCl 2 N H 3 C NaH DM N H 2 C CH 2 + H NaH EtH DM H Erstellt von: Felix Bergler Timo Duden Bettina Förster
Mustervorschrift zu Versuch 6.3.4: trans-1-benzoyl-2-phenylcyclopropan Reaktion: Na N Cl + H 3 C CuCl 2 N H 3 C NaH DM N H 2 C CH 2 + H NaH EtH DM H Erstellt von: Felix Bergler Timo Duden Bettina Förster
4010 Synthese von p-methoxyacetophenon aus Anisol
 4010 Synthese von p-methoxyacetophenon aus Anisol C 3 + 3 C C 3 Zeolith C 3 + C 3 C C 3 C 7 8 (108.1) C 4 6 3 (102.1) C 9 10 2 (150.2) C 2 4 2 (60.1) Klassifizierung Reaktionstypen und Stoffklassen Elektrophile
4010 Synthese von p-methoxyacetophenon aus Anisol C 3 + 3 C C 3 Zeolith C 3 + C 3 C C 3 C 7 8 (108.1) C 4 6 3 (102.1) C 9 10 2 (150.2) C 2 4 2 (60.1) Klassifizierung Reaktionstypen und Stoffklassen Elektrophile
OLED Herstellung: Elektrolumineszenz mit PVK / TPD als Lochleiter
 FB Chemieingenieurwesen Labor für Anorg. Chemie Angew. Materialwiss. OLED Herstellung: Elektrolumineszenz mit PVK / TPD als Lochleiter Versuchsdurchführung: Es sollen mehrere unterschiedliche OLED`s hergestellt
FB Chemieingenieurwesen Labor für Anorg. Chemie Angew. Materialwiss. OLED Herstellung: Elektrolumineszenz mit PVK / TPD als Lochleiter Versuchsdurchführung: Es sollen mehrere unterschiedliche OLED`s hergestellt
Präparat Nr. 2: Darstellung von Methyl-1-naphtylketon
 Präparat Nr. 2: Darstellung von Methyl-1-naphtylketon 3 3 l 1,2-Dichlorethan Naphthalin Acetylchlorid Methyl-1-naphtylketon ( 10 8 ) ( 2 3 l) ( 12 10 ) M=128.18 M=78.50 M=133.34 M=170.21 1. Ansatz: Es
Präparat Nr. 2: Darstellung von Methyl-1-naphtylketon 3 3 l 1,2-Dichlorethan Naphthalin Acetylchlorid Methyl-1-naphtylketon ( 10 8 ) ( 2 3 l) ( 12 10 ) M=128.18 M=78.50 M=133.34 M=170.21 1. Ansatz: Es
3002 Addition von Brom an Fumarsäure zu meso-dibrombernsteinsäure
 32 Addition von Brom an Fumarsäure zu meso-dibrombernsteinsäure OOC COO Br 2 OOC Br Br COO C 4 4 O 4 (6.) (59.8) C 4 4 Br 2 O 4 (275.9) Literatur A. M. McKenzie, J. Chem. Soc., 92,, 96 M. Eissen, D. Lenoir,
32 Addition von Brom an Fumarsäure zu meso-dibrombernsteinsäure OOC COO Br 2 OOC Br Br COO C 4 4 O 4 (6.) (59.8) C 4 4 Br 2 O 4 (275.9) Literatur A. M. McKenzie, J. Chem. Soc., 92,, 96 M. Eissen, D. Lenoir,
Fachbereich Chemie. der Philipps-Universität Marburg
 Fachbereich Chemie der Philipps-Universität Marburg Skriptum zu den Versuchen Moderne präparative Methoden der organischen Chemie (1. Auflage, April 2004) Versuch 1: (AK Schrader) Enantioselektive Michael-Addition
Fachbereich Chemie der Philipps-Universität Marburg Skriptum zu den Versuchen Moderne präparative Methoden der organischen Chemie (1. Auflage, April 2004) Versuch 1: (AK Schrader) Enantioselektive Michael-Addition
Dibenzoylmethan
 9.1.2. Dibenzoylmethan Dibenzoylmethan ist eine Stufe eines Zweistufenprärates: Benzoylchlorid (8.1.11) Benzoesäureethylester (8.1.3) Dibenzoylmethan Reaktion: Ansatz: 1,75 g Natrium, 16,0 g Acetophenon,
9.1.2. Dibenzoylmethan Dibenzoylmethan ist eine Stufe eines Zweistufenprärates: Benzoylchlorid (8.1.11) Benzoesäureethylester (8.1.3) Dibenzoylmethan Reaktion: Ansatz: 1,75 g Natrium, 16,0 g Acetophenon,
- 2 - Das folgende retrosynthetische Schema erwies sich als geeignet, die gewünschte Zielverbindung darzustellen. TEG. Abbildung 1
 - 1 - Protokoll ynthese von 4(3)-[4-(triethylenglykolmethylether)-3,5-dimetylphenyl]- cyclohepta-2,4,6-trienyl-[n-(triethylenglykolmethylether)-n- (methyl)-anilin] N rganisch-chemisches Fortgeschrittenenpraktikum
- 1 - Protokoll ynthese von 4(3)-[4-(triethylenglykolmethylether)-3,5-dimetylphenyl]- cyclohepta-2,4,6-trienyl-[n-(triethylenglykolmethylether)-n- (methyl)-anilin] N rganisch-chemisches Fortgeschrittenenpraktikum
4 Synthesen der Calix[n]aren-Stationärphasen
![4 Synthesen der Calix[n]aren-Stationärphasen 4 Synthesen der Calix[n]aren-Stationärphasen](/thumbs/98/136352900.jpg) 23 4.1 Überblick Dieses Kapitel enthält Methoden und Materialien sowie alle Synthesevorschriften zur Darstellung der Calixaren-Phasen. 4.2 Materialien und Methoden 4.2.1 Materialien p-tert-butylcalix[5]aren
23 4.1 Überblick Dieses Kapitel enthält Methoden und Materialien sowie alle Synthesevorschriften zur Darstellung der Calixaren-Phasen. 4.2 Materialien und Methoden 4.2.1 Materialien p-tert-butylcalix[5]aren
Versuch 2.1: Herstellung von Propoxybenzol (Phenylpropylether)
 Endersch, Jonas 17./19.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.1: Herstellung von Propoxybenzol (Phenylpropylether) Reaktionsgleichung: Einleitung und Theorie
Endersch, Jonas 17./19.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.1: Herstellung von Propoxybenzol (Phenylpropylether) Reaktionsgleichung: Einleitung und Theorie
Gruppenpräparat im Organisch-Chemischen Praktikum II
 Gruppenpräparat im rganisch-chemischen Praktikum II WS 2007/2008 Versuch 6.2.3 Philipp Bissinger Alexander Damme Yvonne Göbel Inhaltsverzeichnis 1. Einleitung 2. Darstellungsmethoden 2.1 Darstellung von
Gruppenpräparat im rganisch-chemischen Praktikum II WS 2007/2008 Versuch 6.2.3 Philipp Bissinger Alexander Damme Yvonne Göbel Inhaltsverzeichnis 1. Einleitung 2. Darstellungsmethoden 2.1 Darstellung von
5. Beschreibung der Versuche
 5. Beschreibung der Versuche Die analytischen Daten wurden mit folgenden Geräten bestimmt: 1 H-NMR: Varian Gemini (300/75 Mhz) IR: Philips PU 9624 FTIR-Spektrometer Elementaranalyse: Leco CHNS-923 UV/VIS:
5. Beschreibung der Versuche Die analytischen Daten wurden mit folgenden Geräten bestimmt: 1 H-NMR: Varian Gemini (300/75 Mhz) IR: Philips PU 9624 FTIR-Spektrometer Elementaranalyse: Leco CHNS-923 UV/VIS:
Protokoll Versuch 2. Synthese von Bis[8-(dimethylamino)naphthyl]ditellurid. Versuchsprotokoll. Fachbereich 2: Chemie
![Protokoll Versuch 2. Synthese von Bis[8-(dimethylamino)naphthyl]ditellurid. Versuchsprotokoll. Fachbereich 2: Chemie Protokoll Versuch 2. Synthese von Bis[8-(dimethylamino)naphthyl]ditellurid. Versuchsprotokoll. Fachbereich 2: Chemie](/thumbs/74/70509027.jpg) Protokoll Versuch 2 Versuchsprotokoll Fachbereich 2: Chemie Autor: Marcus Knappert Studienbereich: Fachbereich 2: Chemie Matrikelnummer: 24 24 74 3 E-Mail: marcus.knappert@gmx.de Semester: Wintersemester
Protokoll Versuch 2 Versuchsprotokoll Fachbereich 2: Chemie Autor: Marcus Knappert Studienbereich: Fachbereich 2: Chemie Matrikelnummer: 24 24 74 3 E-Mail: marcus.knappert@gmx.de Semester: Wintersemester
Gruppenpräparat 8.5. Darstellung von 2,4,6 Triphenyl N (3,5 di tert. butyl 4 hydroxyphenyl) pyridinium tetrafluoroborat und entsprechendes Betain
 Gruppenpräparat 8.5 Darstellung von 2,4,6 Triphenyl N (3,5 di tert. butyl 4 hydroxyphenyl) pyridinium tetrafluoroborat und entsprechendes Betain NaN 2,5nHCl H N Zn/HCl Cl NH 3 t-bu t-bu H C 14 H 22 206.33
Gruppenpräparat 8.5 Darstellung von 2,4,6 Triphenyl N (3,5 di tert. butyl 4 hydroxyphenyl) pyridinium tetrafluoroborat und entsprechendes Betain NaN 2,5nHCl H N Zn/HCl Cl NH 3 t-bu t-bu H C 14 H 22 206.33
QUALITATIVE UNTERSUCHUNGEN
 QUALITATIVE UNTERSUCHUNGEN Allgemeiner Alkaloid-Nachweis Cinchonae cortex 0.5 g gepulverte Droge werden mit 10 ml 0.2 M Schwefelsäure geschüttelt und abfiltriert. 2 ml aus den Extrakten werden in Reagenzgläser
QUALITATIVE UNTERSUCHUNGEN Allgemeiner Alkaloid-Nachweis Cinchonae cortex 0.5 g gepulverte Droge werden mit 10 ml 0.2 M Schwefelsäure geschüttelt und abfiltriert. 2 ml aus den Extrakten werden in Reagenzgläser
1005 Bromierung von 1,2-Dimethoxybenzol zu 4,5-Dibrom-1,2- dimethoxybenzol
 1005 omierung von 1,2-Dimethoxybenzol zu 4,5-Dibrom-1,2- dimethoxybenzol H 3 H 3 K 3, H Essigsäure H 3 H 3 + Nebenprodukt 8 H 10 2 K 3 (167.0) 8 H 8 2 2 (138.2) H (80.9) (296.0) Klassifizierung Reaktionstypen
1005 omierung von 1,2-Dimethoxybenzol zu 4,5-Dibrom-1,2- dimethoxybenzol H 3 H 3 K 3, H Essigsäure H 3 H 3 + Nebenprodukt 8 H 10 2 K 3 (167.0) 8 H 8 2 2 (138.2) H (80.9) (296.0) Klassifizierung Reaktionstypen
6.1 Allgemeine Bemerkungen
 EXPERIMETELLER TEIL 99 KAPITEL 6 EXPERIMETELLER TEIL 6.1 Allgemeine Bemerkungen Toluol und Ethanol wurden nach Standardmethoden [102] getrocknet. Die Synthese der Substanzen wurde mittels Dünnschichtchromatographie
EXPERIMETELLER TEIL 99 KAPITEL 6 EXPERIMETELLER TEIL 6.1 Allgemeine Bemerkungen Toluol und Ethanol wurden nach Standardmethoden [102] getrocknet. Die Synthese der Substanzen wurde mittels Dünnschichtchromatographie
Oxidation von p-xylol mit Kaliumpermanganat zu Terephthalsäure (2a) und Veresterung zu Terephthalsäurediethylester (2b) CO 2
 6. xidations-, Reduktions-Reaktionen www.ioc-praktikum.de 6.1.4.2 xidation von p-xylol mit Kaliumpermanganat zu Terephthalsäure (2a) und Veresterung zu Terephthalsäurediethylester (2b) C 3 C 2 C 2 C 2
6. xidations-, Reduktions-Reaktionen www.ioc-praktikum.de 6.1.4.2 xidation von p-xylol mit Kaliumpermanganat zu Terephthalsäure (2a) und Veresterung zu Terephthalsäurediethylester (2b) C 3 C 2 C 2 C 2
Mustervorschrift 2.3.1
 Christoph Böhm, Lisa Gutjahr, Philipp Hennig, Thorsten Scherpf, Junwen Shan, Verena Thyen Mustervorschrift 2.3.1 Darstellung von 1,2-Bis(trimethylsilyloxy)cyclohex-1-en: In einem trockenen und unter Schutzgas
Christoph Böhm, Lisa Gutjahr, Philipp Hennig, Thorsten Scherpf, Junwen Shan, Verena Thyen Mustervorschrift 2.3.1 Darstellung von 1,2-Bis(trimethylsilyloxy)cyclohex-1-en: In einem trockenen und unter Schutzgas
β-binaphthol (1,1 -Binaphthyl-2,2 -diol)
 rganisches Praktikum I - SS 2006 Assistentin: Gabi Marti Synthese von β-binaphthol (1,1 -Binaphthyl-2,2 -diol) Zürich, Balzers & Eschen, Juni 2006 Daniel Frick frickd@student.ethz.ch 1. Einleitung 1, 2
rganisches Praktikum I - SS 2006 Assistentin: Gabi Marti Synthese von β-binaphthol (1,1 -Binaphthyl-2,2 -diol) Zürich, Balzers & Eschen, Juni 2006 Daniel Frick frickd@student.ethz.ch 1. Einleitung 1, 2
6015 Bromaddition an Styrol zu 1,2-Dibrom-1-phenylethan
 6015 omaddition an Styrol zu 1,2-Dibrom-1-phenylethan 2 Dichlormethan C 8 H 8 2 (159.8) C 8 H 8 2 (104.2) (264.0) Klassifizierung Reaktionstypen und Stoffklassen Addition an Alkene, Stereoselektive Addition,
6015 omaddition an Styrol zu 1,2-Dibrom-1-phenylethan 2 Dichlormethan C 8 H 8 2 (159.8) C 8 H 8 2 (104.2) (264.0) Klassifizierung Reaktionstypen und Stoffklassen Addition an Alkene, Stereoselektive Addition,
Titanocendichlorid. AC-F Praktikum Wintersemester 2012/13. Iman Errouihi 12.12.2012. Inhaltsverzeichnis
 AC-F Praktikum Wintersemester 2012/13 Titanocendichlorid Iman Errouihi 12.12.2012 Inhaltsverzeichnis 1 Das Experiment Titanocendichlorid 2 1.1 Reaktionsgleichung............................... 2 1.2 Ansatz......................................
AC-F Praktikum Wintersemester 2012/13 Titanocendichlorid Iman Errouihi 12.12.2012 Inhaltsverzeichnis 1 Das Experiment Titanocendichlorid 2 1.1 Reaktionsgleichung............................... 2 1.2 Ansatz......................................
16. Arbeitsvorschriften
 Arbeitsvorschriften 68 16. Arbeitsvorschriften 16.1. Allgemeine Angaben Schmelzpunktbestimmung Die angegebenen Schmelzbereiche wurden mit einem eiztischmikroskop nach Boetius bestimmt und stellen unkorrigierte
Arbeitsvorschriften 68 16. Arbeitsvorschriften 16.1. Allgemeine Angaben Schmelzpunktbestimmung Die angegebenen Schmelzbereiche wurden mit einem eiztischmikroskop nach Boetius bestimmt und stellen unkorrigierte
(±)-4-Methyl-3- heptanon
 Synthese von (±)-4-Methyl-3- heptanon rganische Chemie Praktikum 1 Zürich, 14.12.2006 WS 2006 / 07 Maresa Afthinos Assistenz: Michael Schär Versuchsdurchführung: 12. Dezember 2006-1 - CP1 Synthese 5 Maresa
Synthese von (±)-4-Methyl-3- heptanon rganische Chemie Praktikum 1 Zürich, 14.12.2006 WS 2006 / 07 Maresa Afthinos Assistenz: Michael Schär Versuchsdurchführung: 12. Dezember 2006-1 - CP1 Synthese 5 Maresa
