4 l 5 Lehrerhinweise PRISMA. NWA l CHEMIE. Baden-Württemberg
|
|
|
- Angelika Klein
- vor 7 Jahren
- Abrufe
Transkript
1 PRISMA NWA l CHEMIE 4 l 5 Lehrerhinweise HEMIE, Naturwissenschaft, die sich m nd gebundenem Zustand beschäftigt nd Umwandlungen der Elemente un änge und wertet sie aus. Die Chemie nd Kräften der Natur hinsichtlich ih Baden-Württemberg
2 1. Auflage 2005 Von diesen Vorlagen ist die Vervielfältigung für den eigenen Unterrichtsgebrauch gestattet. Die Kopiergebühren sind abgegolten. Das Werk und seine Teile sind urheberrechtlich geschützt. Jede Nutzung in anderen als den gesetzlich zugelassenen Fällen bedarf der vorherigen schriftlichen Einwilligung des Verlags. Hinweis zu 52a UrhG: Weder das Werk noch seine Teile dürfen ohne eine solche Einwilligung eingescannt und in ein Netzwerk eingestellt werden. Dies gilt auch für Intranets von Schulen und sonstigen Bildungseinrichtungen. Fotomechanische oder andere Wiedergabeverfahren nur mit Genehmigung des Verlags. Ernst Klett Verlag GmbH, Stuttgart Alle Rechte vorbehalten. Internetadresse: Autoren: Wolfram Bäurle, Wolfgang Heitland, Barbara Hoppe, Otfried Müller, Reinhard Peppmeier, Eberhard Theophel, Michael Wächter, Burkhard Weizel, Ulrike Wolf Labelgestaltung und Innentitel: Koma Amok, Kunstbüro für Gestaltung, Stuttgart ISBN
3 Inhaltsverzeichnis Sicherheit beim Experimentieren 5 Der Umgang mit Chemikalien 5 Werkstatt: Der Kresse-Wachstumstest 5 Strategie: Experimente sicher planen 6 Strategie: Ein Experiment sicher durchführen 6 Werkstatt: Einfache Gasgeräte selbst hergestellt 7 Strategie: Wir erstellen eine Laborordnung 7 Schlusspunkt 8 Die chemische Reaktion 9 Werkstatt: Kartoffelpuffer und Apfelmus 9 Werkstatt: Kupfer-Rot und Schwefel-Gelb 9 Die chemische Reaktion 10 Werkstatt: Aktiv machen womit? 11 Zerlegung und Bildung von Wasser 12 Werkstatt: Der elektrische Strom zerlegt Wasser 13 Wasserstoff ein Stoff mit außergewöhnlichen Eigenschaften 14 Platin wirkt als Katalysator 15 Schlusspunkt 16 Reaktionen mit Sauerstoff 17 Die Rolle des Sauerstoffs bei der Verbrennung 17 Werkstatt: Luft reagiert mit Kupfer 17 Werkstatt: Sauerstoff, nicht aus der Luft 17 Metalle reagieren mit Sauerstoff 18 Das Bindungsbestreben von Metallen zu Sauerstoff 19 Werksatt: Metalle oxidieren verschieden stark 19 Oxide des Kohlenstoffs 20 Nichtmetalle reagieren mit Sauerstoff 21 Schwefeldioxid wird aus dem Rauchgas entfernt 21 Brennpunkt: Treibhauseffekt 22 Schlusspunkt 23 Reduktion und Redoxreaktionen 24 Die Reduktion 24 Die Redoxreaktion 25 Werkstatt: Wir stellen Kupfer her 25 Brennpunkt: Der Hochofenprozess 26 Zeitpunkt: Der Hochofenprozess verändert die Welt 27 Lexikon: Stahl 27 Das Thermitverfahren 28 Schlusspunkt 29 Die chemische Zeichensprache 30 Das Gesetz von der Erhaltung der Masse 30 Werkstatt: Werden Stoffe leichter oder schwerer? 30 Die chemische Reaktion als Umgruppierung von Teilchen 31 Brennpunkt: Bestimmung der Atommassen 31 Die Zeichensprache des Chemikers 32 Die Wertigkeit von Atomen 32 Die Reaktionsgleichung 33 Werkstatt: Reaktionsgleichungen spielerisch erstellen 33 Brennpunkt: Massenverhältnisse von Teilchen in Reaktionen 34 Werkstatt: Wie viel Schwefel reagiert mit Kupfer? 34 Schlusspunkt 34 Elementgruppen und Atombau 35 Alkalimetalle nicht aus dem Alltag 35 Werkstatt: Die Flammenfärbung bringt es an den Tag 36 Erdalkalimetalle gebunden im Gestein 37 Halogene Vorsicht! 38 Werkstatt: Belichten und Fixieren 39 Brennpunkt: Der MAK-Wert 39 Vom Bleistift zur Bleischürze die Kohlenstoff-Silicium- Gruppe 40 Werkstatt: Eine Ordnung finden 41 Werkstatt: Anziehen und Abstoßen 42 Das Schalenmodell 43 Schlusspunkt 44 Chemische Bindungen 45 Kochsalz aus Sicht der Chemie 45 Die Ionenbindung 46 Eigenschaften von Salzen 47 Brennpunkt: Kochsalz, ein Stoff aus dem Alltag 47 Die Atombindung 48 Wasser, ein Dipol 49 Werkstatt: Wasser entwickelt Kräfte 50 Wasser löst Salz 50 Die Ionenwanderung 51 Die Elektrolyse 52 Die Metallbindung 53 Werkstatt: Wir untersuchen Metalleigenschaften 54 Strategie: Moleküle und Modelle 54 Schlusspunkt 55 Säuren und Laugen 56 Werkstatt: Alles sauer, oder? 56 Strategie: Mit Indikatoren dem ph-wert auf der Spur 56 Was ist eine Säure? 57 Salzsäure eine bekannte Säure 58 Chloride Salze der Salzsäure 59 Schwefelsäure 60 Gips, ein Salz der Schwefelsäure 61 Strategie: Chemie und Internet 62 Kohlensäure 62 Salze der Kohlensäure 63 Werkstatt: Wir untersuchen Salze der Kohlensäure 63 Brennpunkt: Waldsterben 64 Die Bildung von Laugen 65 Werkstatt: Wir stellen Laugen her 66 Ammoniak 66 Die Neutralisation 67 Werkstatt: Säuren und Laugen? 67 Werkstatt: Neutralisation in der Spülmaschine 68 Der ph-wert 69 Schlusspunkt 70 Kohlenwasserstoffe und fossile Brennstoffe 71 Werkstatt: Wir untersuchen Erdölbestandteile 71 Fraktionierte Destillation des Erdöls 72 Methan der Hauptbestandteil des Erdgases 73 Werkstatt: Gewinnung von Biogas 73 Alkane bilden eine Reihe 74 Werkstatt: Wir untersuchen Feuerzeuggas 75 Alkene reaktionsfähige Crackprodukte 75 Rund um die Tankstelle 76 Benzinverbrennung und Drei-Wege-Kat 76 Brennpunkt: Wasserstoff oder Benzin? 77 Schlusspunkt 78 Alkohole und organische Säuren 79 Brennpunkt: Promille 79 Zeitpunkt: Bier im Wandel der Zeit 79 Brennpunkt: Bierherstellung 80 3
4 Inhaltsverzeichnis Werkstatt: Vergorenes 80 Ethanol 81 Werkstatt: Steckbrief von Ethanol 82 Werkstatt: Destillation von Rotwein 83 Die Reihe der Alkanole 84 Strategie: Debattieren, Pro und Contra 85 Süße Alkohole 86 Die Reihe der Alkanale 86 Aceton ein Keton 87 Brennpunkt: Essig unterschiedlich hergestellt 88 Ethansäure 89 Alkansäuren 90 Werkstatt: Organische Säuren in Lebensmitteln 91 Ester 92 Werkstatt: Ester selbst gemacht 93 Strategie: Dominospiel Chemie spielerisch lernen 93 Schlusspunkt 94 Große Moleküle 95 Werkstatt: Fette 95 Bedeutung und Eigenschaften von Fetten 95 Die Vielfalt der Fette 96 Eiweiße eine Elementaranalyse 97 Eiweiße bestehen aus Aminosäuren 97 Von den Aminosäuren zum Protein 98 Werkstatt: Eiweiße werden verdaut 98 Glucose und Maltose 99 Werkstatt: Wir untersuchen Zucker 100 Stärke eine Polysaccharid 100 Was ist Seife? 101 Werkstatt: Seife und Seifenblasen 102 Werkstatt: Experimentieren mit Waschmitteln 102 Waschmittel werden weiterentwickelt 103 Werkstatt: Wir untersuchen Kunststoffe 104 Eigenschaften von Kunststoffen 105 Kunststoffe Stoffe mit Strukturen 106 Schlusspunkt 107 4
5 Sicherheit beim Experimentieren Der Umgang mit Chemikalien Werkstatt: Der Kresse-Wachstumstest Zusatzinformationen Es bietet sich zur Einführung der Thematik an, verschiedene Haushaltschemikalien mit in den Unterricht zu bringen, die mit unterschiedlichen Gefahrensymbolen gekennzeichnet sind. Da viele Etiketten nicht alle relevanten Sicherheitsangaben enthalten, kann im weiteren Verlauf auf das Etikett des Grillanzünders in Bild 1 zurückgegriffen werden. Auf diesem Etikett sind alle notwendigen Angaben enthalten: Name: Zündix-Grillanzünder (Erdöldestillate) Gefahrensymbol: Symbol für Gesundheitsschädlich Kennbuchstabe: Xn Gefahrenbezeichnung: Gesundheitsschädlich R-Sätze: R 65 S-Sätze: S 2; S 23; S 24; S 62 Versuch Beim Einsatz der unterschiedlichen Haushaltschemikalien ist auch deren Einstufung nach der Gefahrstoffverordnung zu beachten. Die Schüler sollten sich aufgrund der Gefahrensymbole und der R- und S-Sätze auf den Etiketten über die Gefährlichkeit informieren und Schutzmaßnahmen vorschlagen (z.b. Schutzhandschuhe, Schutzbrille verwenden). Die meisten Haushaltschemikalien wirken sich negativ auf den Keimungsprozess und das Wachstum von Kresse aus. Sie gehören deshalb häufig in die Gruppe umweltgefährdender Stoffe. Um die mit dem Einsatz von Haushaltschemikalien verbundenen Umweltgefährdungen möglichst gering zu halten, bieten sich umweltverträgliche Alternativmittel an, z.b. bei Verunreinigungen Scheuerpulver auf Mineralstoffbasis anstelle chemisch wirkender Mittel oder bei Verstopfungen mechanische Hilfsmittel statt chemischer Abflussreiniger verwenden. Versuchsergebnis: Die mit Chemikalien versehenen Kressesamen wachsen nicht oder langsamer. 5
6 Sicherheit beim Experimentieren Strategie: Experimente sicher planen Strategie: Ein Experiment sicher durchführen Aufgaben Zu A. Es sollte über die häufig verwendeten Glasgefäße, wie z.b. Bechergläser, Erlenmeyerkolben, Reagenzgläser, Rundkolben, Standzylinder, Messzylinder u.ä. gesprochen werden. Um Gase unter Wasser aufzufangen, werden pneumatische Wannen eingesetzt. Für die meisten Glasgefäße ist die Glassorte, aus der sie bestehen, wichtig. Kalk-Natron-Glas kann thermisch nicht hoch belastet werden. Borosilikatglas ist ein technisches Universalglas mit hoher Hitzebeständigkeit. Sehr teure und sehr hochwertige Gläser bestehen aus Quarzglas. Zu B. Die Gefahrstoffe, die bei den gängigen Experimenten im Buch eingesetzt werden, sind im Anhang aufgeführt mit den besonderen Gefahrenhinweisen (R- Sätze) und den Sicherheitsratschlägen (S-Sätze). Besonders beim Erhitzen ist Vorsicht geboten, da es vor allem im Reagenzglas leicht zum Siedeverzug kommen kann. Zu C. Die richtige Befestigung von Universalmuffe und Universalklemme am Stativ muss geübt werden, um Fehler zu vermeiden (z.b. Kippgefahr) Zu D. Heizgeräte und Wärmequellen werden im Schulbuch auf Seite 18 präsentiert. Zu beachten ist vor allem die Feuergefährlichkeit der verwendeten Chemikalien. Zu E. Hinweise zur Entsorgung von Chemikalien sind im Anhang und am Schluss dieses Kapitels zu finden. Zusatzinformationen Eine Chemikalienliste, die einige wichtige Gefahrstoffe enthält sowie Hinweise auf besondere Gefahren (R-Sätze) und Sicherheitsratschlägen (S-Sätze), ist im Anhang des Schulbuchs zu finden. Literaturhinweise 1. Merkblätter für den naturwissenschaftlichen Unterricht ist eine Lose-Blatt-Sammlung, herausgegeben vom Landesinstitut für Erziehung und Unterricht (LEU) zum Thema Sicherheit, Umweltschutz und Naturschutz. 2. DGISS, Deutsches Gefahrstoff-Informations-System Schule ist ein Servicepaket auf CD-ROM und enthält Datensätze zu Gefahrstoffen, Gefahrgütern und vieles mehr. Beides ist zu beziehen über August Hedinger GmbH &Co. Chemikalien und Lehrmittel Postfach Stuttgart (Wangen) 6
7 Sicherheit beim Experimentieren Werkstatt: Einfache Glasgeräte selbst hergestellt Strategie: Wir erstellen eine Laborordnung 1 Beim Brechen des Biegerohrs besteht bei unsachgemäßer Ausübung die Gefahr, sich durch splitterndes Glas zu verletzten. Es muss deshalb unbedingt darauf geachtet werden, dass die Hände durch ein stärkeres Tuch geschützt werden und immer vom Körper weg gearbeitet wird. 2 Beim Rundschmelzen besteht die Gefahr des Verbrennes, wenn das Glasrohrstück zu lange in die Flamme gehalten wird. Die Schüler müssen deshalb darauf hingewiesen werden, das Glasrohr bei zu starker Erwärmung sofort aus der Hand zu nehmen und auf einer feuerfesten Unterlage abzulegen. Besteht der Schülerarbeitstisch aus Laborkeramik, kann der Tisch als Unterlage dienen. Die Gefahr des Verbrennens kann durch Verwendung hitzebeständiger Handschuhe verringert werden. Die Schülerinnen und Schüler sind darauf hinzuweisen, dass sie das Glasrohr beim Rundschmelzen ständig drehen müssen, um eine Tropfenbildung durch abschmelzendes Glas zu vermeiden. Zusatzinformationen Die von den Schülern erstellte Laborordnung kann im Laufe der Zeit weiter ergänzt werden. Werden z.b. in der Jahrgangsstufe 9 Säuren und Lauge besprochen, kann der Bereich Ätzende Stoffe weiter ergänzt werden. Bei der Behandlung der Kohlenwasserstoffe kann der Bereich Feuergefährliche Flüssigkeiten ergänzt werden, usw. Die Schülerinnen und Schüler können die Laborordnung auch durch Bilder ergänzen, die z.b. das richtige Verhalten beim Experimentieren darstellen. 3 Das Biegen eines Winkelrohres erfordert vom Schüler viel Geschick. Beim Biegen muss gleichzeitig eine Zugbewegung zu beiden Enden hin erfolgen, um eine Stauchung des Biegerohrs im Winkelbereich zu vermeiden. 4 Scharfkantige Stellen der Tropfpipette können mithilfe eines feinen Schleifpapiers oder durch kurzes Erhitzen in der Brennerflamme abgrundet werden. Beim Erhitzen in der Brennerflamme ist jedoch die Gefahr des Zuschmelzens der kleinen Öffnung recht groß. 7
8 Sicherheit beim Experimentieren Schlusspunkt Aufgaben 1 a) Das Gefahrensymbol für umweltgefährliche Stoffe weist auf die besondere Gefahr dieser Stoffe für die Natur hin. Stoffe, die mit diesem Symbol gekennzeichnet sind, sind schädlich für Gewässer, Boden, Luft und für Organismen. b) Das Gefahrensymbol ist nicht immer eindeutig, so wird z.b. das Totenkopf-Symbol sowohl für giftige als auch für sehr giftige Stoffe, das Flammensymbol sowohl für leicht entzündliche als auch für hochentzündliche Stoffe verwendet. Zur eindeutigen Kennzeichnung wird neben dem Gefahrensymbol deshalb noch die Gefahrenbezeichnung (z.b. giftig oder sehr giftig) angegeben. 2 a) An dem Gefahrensymbol ist zu erkennen, dass es sich um eine ätzende Flüssigkeit handelt. Beim Entsorgen dieser Flüssigkeit sollten Schutzhandschuhe und Schutzbrille getragen werden, da der Stoff zu Verätzungen führen kann. b) Nicht mehr identifizierbare Stoffe sollten vorsichtshalber als Problemabfall entsorgt werden. 8
9 Die chemische Reaktion Werkstatt: Kartoffelpuffer und Apfelmus Werkstatt: Kupfer-Rot und Schwefel-Gelb Zusatzinformationen Alltagsbeispiele aus der Lebenswelt der Schülerinnen und Schüler veranschaulichen sehr viel deutlicher eine Stoffumwandlung als Experimente mit Chemikalien. Mit der Herstellung von Kartoffelpuffern und Apfelmus können chemische Reaktionen propädeutisch, ohne als solche benannt zu werden, mit allen Sinnen erfahrbar gemacht werden. Aufgaben 1 Rohe Kartoffeln sind hart, an den Schnittflächen weiß bis gelb und schmecken nicht. Beim Reiben sammelt sich etwas Flüssigkeit auf dem Boden der Schüssel. Beim Frittieren oder Braten werden die Kartoffeln weich und mehlig. An der Oberfläche des geformten Kartoffelpuffers bildet sich eine knusprige, braune Schicht. Duft- und Aromastoffe regen den Appetit an, Geschmacksstoffe entfalten sich beim Essen. 2 Das Fruchtfleisch der Äpfel ist hart und bissfest. Beim Kochen werden die Apfelstücke weich und zerfallen mit der Zeit. Flüssigkeit mit Apfelaroma sammelt sich am Boden des Topfes. Die Farbe des Fruchtfleisches ändert sich, der Apfelmus wird an der Luft hellbraun, nach einiger Zeit dunkelbraun. 3 Kartoffeln und Äpfel verändern sich beim Erhitzen bleibend. Zusatzinformationen Werden Experimente mit Aktivkohlestopfen durchgeführt, müssen entsprechend lange Reagenzgläser verwendet werden, um die Kunststoffstopfen vor der Reaktionswärme zu schützen. Die Aktivkohle kann regeneriert werden. Aktivkohlestopfen können bezogen werden über August HEDINGER GmbH & Co. Chemikalien und Lehrmittel Postfach Stuttgart (Wangen) Aufgaben 1 Wird das Kupferblech mit stark rauschender Flamme erhitzt, beobachtet man eine Schwarzfärbung. Anschließend wird Schwefel am Boden des Reagenzglases erhitzt, bis heißer Schwefeldampf über das erhitzte Kupferblech strömt. Es bilden sich blau-schwarze glänzende Kristalle. An einigen Stellen des Streifens brechen kleine Stücke ab. Am Reagenzglasrand resublimiert Schwefel als gelbe, staubfeine Schicht. Im Aktivkohlestopfen beobachtet man ebenfalls einen gelben Belag von Schwefel. Beim Herausnehmen kann der blauschwarze Streifen zerbrechen. Aussehen, Farbe und Verformbarkeit des Streifens haben sich verändert. 2 Die geprüften Eigenschaften werden in einer Tabelle zusammengefasst. Eigenschaften Kupfer Schwefel Neuer Stoff (Kupfersulfid) Verformbarkeit verformbar spröde spröde elektrische Leitfähigkeit Aussehen unter der Lupe gut Nichtleiter gut sehr gut gering gering rötlich glänzendes Pulver gelbes Pulver Farbe rotbraun gelb blauschwarz Wärmeleitfähigkeit blauschwarzes einheitliches Pulver 3 Aus Kupfer und Schwefel entsteht ein neuer Stoff mit anderen Eigenschaften als die Ausgangsstoffe. 9
10 Die chemische Reaktion Die chemische Reaktion 1 Die untersuchten Eigenschaften lassen sich in einer Tabelle zusammenfassen. Eisen Schwefel Neuer Stoff (Eisensulfid) Farbe grau gelb grau-schwarz Eigenschaften Verformbarkeit Brennbarkeit elektrische Leitfähigkeit magnetische Wirkung verformbar spröde glüht, nicht brennbar verbrennt mit blauer Flamme spröde glüht, nicht brennbar gut Nichtleiter gering stark magnetisch nicht magnetisch schwach magnetisch Zusatzinformationen Entsprechend dem Versuch auf der Werkstattseite 29 (Kupfer-Rot und Schwefel-Gelb) kann auch Silbersulfid hergestellt werden, wenn anstelle des Kupferblechstreifens ein Silberblechstreifen verwendet wird. Auch für den Eigenschaftsvergleich von Silber, Schwefel und Silbersulfid lässt sich eine Tabelle erstellen. Eigenschaften Silber Schwefel Neuer Stoff (Silbersulfid) Farbe silber glänzend gelb schwarz Verformbarkeit verformbar spröde spröde elektrische Leitfähigkeit Wärmeleitfähigkeit gut Nichtleiter Nichtleiter gut gering gering 2 Die Reaktion von Zink und Schwefel ist als zentrales Bild auf der Startpunktseite zu sehen. Die wichtigsten Reaktionsschritte (Ausgangsstoffe im Gemisch mit glühendem Draht, chemische Reaktion, hellgelbes Reaktionsprodukt) sind rechts unten auf der Startpunktseite und auf Seite 27 abgebildet. Das Gemisch kann auch mit einer Wunderkerze gezündet werden (Abstand, Schutzhandschuhe, Schutzbrille!) Der Versuch sollte im Freien auf einem Ziegelstein durchgeführt werden, da erhebliche Mengen an Rauchgasen frei werden. Dabei ist darauf zu achten, dass die Schülerinnen und Schüler nicht in Windrichtung stehen und in genügendem Abstand die Reaktion beobachten. 10
11 Die chemische Reaktion Werkstatt: Aktiv machen womit? Die zum Start einer chemischen Reaktion notwendige Aktivierungsenergie kann dem Ausgansstoff bzw. den Ausgangsstoffen auf unterschiedliche Weise zugeführt werden z.b. durch: 1 Reibung 2 Wärme 3 Feuer Zusatzinformationen Mithilfe eines Brennglases lässt sich bei entsprechender Sonneneinstrahlung Papier entzünden. Mit diesem Versuch kann man die Aktivierung durch Licht- und Wärmeenergie veranschaulichen. 4 Beim Besprühen kommen die unterschiedlichen Lösungen miteinander in Kontakt, eine farbige Schrift wird sichtbar. Die Schrift hat eine andere Farbe als die Lösungen. Dies ist ein Hinweis darauf, dass eine chemische Reaktion stattgefunden hat. Wird Stahlwolle durch Berührung mit den Polen einer Flachbatterie entzündet, lässt sich die Aktivierung durch Zufuhr elektrischer Energie verdeutlichen. 11
12 Die chemische Reaktion Zerlegung und Bildung von Wasser 1 Die Zerlegung von Wasser wird unter Zusatz von verdünnter Schwefelsäure im dreischenkligen Hofmann`schen Apparat durchgeführt. Man öffnet die Hahnen und lässt durch die Kugel des mittleren Rohrs langsam so viel angesäuertes Wasser oben einfließen, bis die beiden äußeren Schenkel bis zu den Hahnen gefüllt sind. Dann schließt man die Hahnen, gießt noch so viel verdünnte Schwefelsäure (ca. 10 %ig) nach, bis die Flüssigkeit im mittleren Rohr ein bis zwei Zentimeter über den Hahnen steht und legt eine ausreichende Gleichspannung an. Die entstehenden Gase Wasserstoff und Sauerstoff sind etwas in Wasser löslich. Die sich bildenden Gasvolumina verhalten sich deshalb nicht genau im Verhältnis 2:1. Um diesen Fehler zu umgehen, lässt man die Reaktion zunächst bei noch geöffneten Hahnen eine kurze Zeit laufen, bis sich das Wasser in den beiden Röhren mit den Gasen gesättigt hat. Dann schließt man beide Hahnen. Ist der eine Schenkel etwa zur Hälfte mit Gas gefüllt, stoppt man die Stromzufuhr und liest die Volumina ab. Zum Nachweis der beiden Gase lässt man diese langsam in jeweils ein Reagenzglas strömen. Dabei ist darauf zu achten, dass die beiden Einleitungsröhrchen bis auf den Reagenzglasboden reichen. Das Reagenzglas am Minuspol wird mit der Öffnung nach unten gehalten, nach der Füllung mit dem Daumen verschlossen und anschließend mit der Öffnung an die Brennerflamme gehalten (Knallgasprobe als Nachweis für Wasserstoff). Das Reagenzglas am Pluspol wird mit der Öffnung nach oben gehalten und nach der Füllung mit dem Daumen verschlossen. Anschließend wird ein glimmender Holzspan in das Reagenzglas eingeführt (Glimmspanprobe als Nachweis für Sauerstoff). Zusatzinformationen Die Apparaturen mit ausführlicher Versuchsanleitung können bezogen werden über: August HEDINGER GmbH & Co. Chemikalien und Lehrmittel Postfach Stuttgart (Wangen) Zu Versuch 1: Die Nachweisreaktionen für Sauerstoff bzw. Wasserstoff müssen hier nicht explizit besprochen bzw. eingeübt werden. Diese werden im Buch in den Kapiteln Luft und Oxidation und Reduktion und Redoxreaktion noch genauer behandelt. 2 Mit dem Schager`schen Apparat lässt sich die kontinuierliche und drucklose Zersetzung und Bildung von Wasser ohne explosionsartige Reaktion zeigen. Man erhält innerhalb von 12 bis 15 Minuten etwa 2 ml Wasser. 12
13 Die chemische Reaktion Werkstatt: Der elektrische Strom zerlegt Wasser 1 Die kleinen Reagenzgläser brechen am unteren Rand leicht aus, wenn sie an den Halterungen verkanten oder schräg abgehoben werden. Die Schülerinnen und Schüler müssen darauf hingewiesen werden, dass die Reagenzgläser vorsichtig senkrecht von oben aufgesetzt und senkrecht nach oben abgehoben werden müssen. Die kleinen Reagenzgläser können bei Bedarf beim Hersteller nachbestellt werden, sodass sich der Versuch auch mehrmals wiederholen lässt. Aufgaben 1 Am Minuspol (blau) entsteht in der Reaktionsröhre Wasserstoff, der sich mit der Knallgasprobe nachweisen lässt. Am Pluspol (rot) entsteht in der zweiten Reaktionsröhre Sauerstoff, in dem ein glimmender Holzspan aufflammt. Da sich bei der Zerlegung von Wasser doppelt so viel Wasserstoff wie Sauerstoff bildet, kann man an der Höhe der Gasvolumina in den beiden Röhren die Art des Gases erkennen. 2 Das Reaktionsschema für die Zerlegung von Wasser (Wasserstoffoxid) lautet: Wasser Wasserstoff + Sauerstoff endotherm 3 Da für die Zerlegung von Wasser ständig Energie zugeführt werden muss (in Form von elektrischer Energie), handelt es sich um eine endotherme Reaktion. Zusatzinformationen Die Apparaturen mit ausführlicher Versuchsanleitung können bezogen werden über: Aug. HEDINGER GmbH & Co. Chemikalien und Lehrmittel Postfach Stuttgart (Wangen) 13
14 Die chemische Reaktion Wasserstoff ein Stoff mit außergewöhnlichen Eigenschaften 1 Die Geschwindigkeit der Diffusion des Wasserstoffs hängt stark von der Qualität des Luftballonmaterials ab. Je dünner (und billiger) die benutzten Ballone sind, desto besser kann man den Effekt innerhalb einer Unterrichtsstunde zeigen. Versuchsergebnis: Der mit Wasserstoff gefüllte Ballon trägt den mit Luft gefüllten Ballon. Mit der Zeit nimmt das Volumen des Wasserstoffballons schneller ab als das des Luftballons. Beide Ballone sinken zu Boden (Begründung vgl. Aufgabe 1). 2 Zur Überraschung der Schüler kann man diesen Versuch zunächst bei normalem Tageslicht durchführen. Die Wasserstoffflamme ist so kaum zu erkennen. Danach sollte man zur Aufklärung des Phänomens den Versuch im Dunkeln wiederholen. Die Kerze darf nicht zu weit in den Zylinder eingeführt werden und muss wieder zügig herausgeführt werden. Versuchsergebnis: Beim Einführen der Kerze entzündet sich der Wasserstoff am Zylinderrand. Im Zylinder erlischt die Kerze. Beim Herausziehen entzündet sich die Kerze wieder (Begründung vgl. Aufgabe 2). 3 Das entstehende Geräusch hängt von der zufälligen Zusammensetzung des Gemisches ab. Wiederholungen des Versuchs machen den Schüler sicherer in der Einschätzung des Geräusches. Versuchsergebnis: Ein pfeifendes Geräusch deutet auf ein Knallgasgemisch hin, ein mehr dumpfes Geräusch auf reinen Wasserstoff. Zusatzinformationen Das Zündrohr mit Piezo-Zünder kann man beziehen bei: August HEDINGER GmbH & Co. Chemikalien und Lehrmittel Postfach Stuttgart (Wangen) Für Schwerpunktkurse kann man die Synthese quantitativ in einem Reaktionsrohr von: LEYBOLD Didactic GmbH Leyboldstraße Hürth durchführen. Aufgaben 1 Der Auftrieb des Wasserstoffballons ist sehr groß, weil das Gewicht des Wasserstoffs nur ca. 1 / 14 der Luft beträgt. Der Wasserstoffballon trägt zunächst den Luftballon. Der Wasserstoffballon ist nach etwa ½ Stunde schon wesentlich kleiner, weil die Teilchen des Wasserstoffs viel kleiner als die der Luft sind. Sie wandern leichter und schneller durch die poröse Gummiwand des Ballons. Mit abnehmender Wasserstofffüllung verliert der Ballon seine Auftriebskraft und sinkt zu Boden. 2 Wasserstoff ist leicht entzündlich und bildet mit dem Luftsauerstoff explosive Gemische. 4 Der Versuch lässt sich eindrucksvoll und sicher im Zündrohr durchführen. Das Zündrohr muss mit der Öffnung nach unten an einem Stativ befestigt sein. Versuchsergebnis: Beim Entzünden ist wegen des entstandenen Knallgases im Zylinder eine Explosion festzustellen (Achtung vor wegfliegendem Deckel). Das Watesmopapier färbt sich blau (Nachweis von Wasser). 14
15 Die chemische Reaktion Platin wirkt als Katalysator Zusatzinformationen Die mit Platin beschichteten Katalysatorperlen für Versuch 1 können bezogen werden über: August HEDINGER GmbH & Co. Chemikalien und Lehrmittel Postfach Stuttgart (Wangen) Um die Katalysatorwirkung zu verdeutlichen, lässt sich auch ein Schülerversuch durchführen: Zunächst werden folgende Salzlösungen vorbereitet: 12,4 g Fixiersalz (Natriumthiosulfat) in 1 l Wasser lösen, 13,5 g Eisen(III)-chlorid in 1 l Wasser lösen und 8 g Kupfersulfat in 1 l Wasser lösen. Anschließend werden 10 ml Fixiersalzlösung und 10 ml Eisenchloridlösung gemischt und die Zeit gemessen, bis die auftretende Blaufärbung wieder verschwindet. Wird der Versuch unter Zugabe eines Tropfens Kupfersulfatlösung wiederholt, wird die Katalysatorwirkung deutlich. Kupfersulfatlösung setzt die Aktivierungsenergie herab und beschleunigt die Reaktion messbar. 15
16 Die chemische Reaktion Schlusspunkt Aufgaben 1 Rohe Kartoffeln sind hart und innen hellgelb. Beim Einfrieren von Pommes frites (klein geschnittene, stäbchenförmige Kartoffelstücke) ändern sich die Eigenschaften nicht. Beim Frittieren ändern sich die Eigenschaften. Die Kartoffelstücke werden innen weich und außen knusprig, die Farbe ändert sich in dunkelgelb bis braun. Beim Frittieren findet eine Stoffumwandlung oder chemische Reaktion statt, beim Einfrieren dagegen findet keine chemische Reaktion statt. 2 Eigenschaftsänderungen (das Fruchtfleisch wird braun und zersetzt sich, es entstehen Faulgase) deuten darauf hin, dass beim Faulen von Äpfeln chemische Reaktionen stattfinden. 3 Die Änderung der Eigenschaften (Farbe, Geruch, Geschmack), die Bildung neuer Stoffe (z.b. Kohlenstoff) und die Zufuhr von Energie (Aktivierungsenergie, Erhitzen im Toaster) sind Merkmale, an denen man eine chemische Reaktion erkennen kann. 4 Die Änderung der Aggregatzustände (Schmelzen, Erstarren, Verdampfen, Kondensieren, Sublimieren und Resublimieren) ist keine chemische Reaktion. Es findet keine Stoffumwandlung statt, die Stoffe bleiben dieselben. Im Beispiel wird durch Schmelzen aus Eis Wasser. Es ändert sich nur die Zustandsform, aus festem Eis wird flüssiges Wasser. Bei einer chemischen Reaktion findet eine Stoffumwandlung statt. Aus den Ausgangsstoffen (Edukten) entstehen Endstoffe (Reaktionsprodukte) mit anderen Eigenschaften. 5 a) Schwarzes Silbersulfid wird beim Erhitzen zerlegt, es findet eine chemische Reaktion statt. Aus einem Ausgangsstoff (Edukt) entstehen zwei Endstoffe (zwei Reaktionsprodukte). Bei der Zerlegung von Silbersulfid entstehen unter Wärmezufuhr die Reaktionsprodukte Silber (silbrig glänzende Kugel) und Schwefel (gelber Stoff). Das Reaktionsschema für die chemische Reaktion lautet: Silbersulfid Silber + Schwefel 6 a) Beim Erhitzen von Kupfer und Schwefel findet eine chemische Reaktion statt. Aus zwei Ausgangsstoffen (zwei Edukten) entsteht ein Endstoff (ein Reaktionsprodukt). Die Ausgangsstoffe (Edukte) sind Kupfer und Schwefel. Der Endstoff (Reaktionsprodukt) ist Kupfersulfid. Das Reaktionsschema für diese chemische Reaktion lautet: Kupfer + Schwefel Kupfersulfid exotherm b) Bei der Reaktion von Kupfer und Schwefel hat sich die Verbindung Kupfersulfid gebildet. Die Bildung einer Verbindung nennt man Synthese. c) Der Ablauf einer exothermen Reaktion kann mit folgender Modellvorstellung verglichen werden: Eine Kugel soll über einen Hügel nach unten gebracht werden. Sie kann den Hügel nicht von alleine überwinden. Dazu benötigt man Energie. Oben, von der Spitze des Hügels aus, kann die Kugel dann von selbst ins Tal rollen. Die chemische Reaktion kommt nicht von alleine in Gang. Die Ausgangsstoffe Kupfer und Schwefel müssen zuerst aktiv gemacht werden. Dazu benötigt man Aktivierungsenergie, man muss erwärmen. Hat die Reaktion eingesetzt, wird viel Energie (in Form von Wärme und Licht) frei. Sie reicht aus, um die chemische Reaktion in Gang zu halten. 7 Katalysatoren setzen die Aktivierungsenergie herab und liegen nach der Reaktion unverändert vor. Eine Modellvorstellung veranschaulicht, dass Katalysatoren einen anderen Reaktionsweg ermöglichen und chemische Reaktionen beschleunigen können. Mit einem Katalysator wird weniger Aktivierungsenergie benötigt, um die chemische Reaktion in Gang zu bringen. Im Modell wird die Kugel über einen anderen Weg, für den man weniger Energie benötigt, ins Tal gebracht (Vergleiche Aufgabe 6 c). b) Silber und Schwefel sind Elemente. Sie sind Grundstoffe, die sich nicht in weitere Stoffe zerlegen lassen. Silbersulfid ist eine Verbindung, sie lässt sich in Silber und Schwefel zerlegen. c) Es hat eine endotherme Reaktion stattgefunden, da bei der Zerlegung von Silbersulfid ständig Energie (in Form von Wärme) zugeführt wird. Im Reaktionsschema wird die endotherme Reaktion wie folgt angegeben: Silbersulfid Silber + Schwefel endotherm 16
17 Reaktionen mit Sauerstoff PDie Rolle des Sauerstoffs bei der Verbrennung Werkstatt: Sauerstoff, nicht aus der Luft Versuch 1 Das Volumen der eingesetzten Luft hat sich etwa um ein Fünftel verringert. Der Sauerstoff der Luft hat sich mit dem Kupfer an der Oberfläche der Kupferspäne zu Kupferoxid verbunden. Demnach besteht die Luft zu einem Fünftel (20,95 %) aus Sauerstoff. Der glimmende Holzspan flammt unter Sauerstoff hell auf (Glimmspanprobe zum Nachweis von Sauerstoff). Werkstatt: Luft reagiert mit Kupfer Versuch 1 Der Sauerstoff für den Versuch kann auch aus der Sauerstoffflasche bezogen werden. Die Bedienung des Ventils der Sauerstoffflasche muss aber durch die Lehrkraft erfolgen. Es genügt, wenn die Lehrerin / der Lehrer einen schwach durchs Wasser perlenden Sauerstoffstrom einstellt und die Schüler sich ihre Reagenzgläser daran selber füllen. Der glimmende Holzspan flammt in der Sauerstoffatmosphäre hell auf (Nachweis für Sauerstoff). Versuch Ein Fünftel (20,95 %) der im Versuch zur Verfügung gestellten Luft reagiert mit dem Kupfer, dieses Fünftel besteht aus Sauerstoff. Vier Fünftel der Luft reagieren nicht mit dem Kupfer, diese vier Fünftel bestehen im Wesentlichen aus Stickstoff. Zusatzinformationen Das Experimentieren mit der Medizintechnik gewährleistet einen geringen Stoffverbrauch und die Einsatzmöglichkeit komplexer Versuchsanordnungen für jeden Schüler. Alle Materialen kann man (auch als Set) erhalten über: August HEDINGER GmbH & Co. Chemikalien und Lehrmittel Postfach Stuttgart (Wangen) Aufgaben 1 Bei Nichtbeachtung dieser Maßnahme steigt über das Gasableitungsrohr beim Abkühlen Wasser in das noch heiße Reagenzglas, sodass dieses zerspringt. 2 Das Wasser hat nicht die Aufgabe, mit dem Sauerstoff eine chemische Reaktion einzugehen. Er verdrängt lediglich alle Luft aus dem Reagenzglas, wenn das Reagenzglas unter Wasser entsprechend gehalten wird. Wenn jetzt Sauerstoff unter Wasser in das Reagenzglas einströmt, dann verdrängt der Sauerstoff das Wasser. Es verbleibt im Reagenzglas reiner Sauerstoff. 17
18 Reaktionen mit Sauerstoff Metalle reagieren mit Sauerstoff Versuch 1 Das Licht, das bei der Verbrennung von Magnesium entsteht, schädigt die Augen. Es sollte daher nur wenig Magnesium eingesetzt werden. Etwa 5 cm Magnesiumband reichen völlig. Der Sand soll den gläsernen Standzylinder vor zu großer Hitzeeinwirkung durch herunterfallendes brennendes Magnesium schützen. Versuchsergebnis: Magnesium (graues, glänzendes Metall) verbrennt zu Magnesiumoxid (weißer, spröder Feststoff). 2 Auch beim Verbrennen von Eisen sollte der Standzylinder durch Sand vor zu großer Wärmeeinwirkung durch herabfallendes brennendes Eisen geschützt werden. Versuchsergebnis: Eisen (graues Metall) verbrennt zu Eisenoxid (grau-schwarzer Feststoff). Zusatzinformationen Der Versuch 4 wird in einem Porzellantiegel durchgeführt. Auf Bild 6 ist kein Porzellantiegel zu sehen, weil sonst die typische Flamme nicht gut zu erkennen wäre. Aufgaben 1. Wird Calcium mit einer stark rauschenden Brennerflamme erhitzt, entsteht als Reaktionsprodukt Calciumoxid. 2. Magnesia ist Magnesiumoxid, ein Reaktionsprodukt der Verbrennung von Magnesium in Sauerstoff. Magnesia ist nicht brennbar, sehr hitzebeständig und ein schlechter Wärmeleiter und ist daher für den Einsatz in der Hitze der Brennerflamme geeignet. 3 Vorsicht! Das Licht des brennenden Magnesiums ist schädlich für die Augen. Versuchsergebnis: Magnesiumoxid ist ein Metalloxid. Metalloxide bilden mit Wasser alkalische Lösungen. Der Universalindikator färbt sich blau. 4. Calcium reagiert stark exotherm mit Sauerstoff, es entsteht Calciumoxid. Das weiße Oxid bildet mit Wasser eine alkalische Lösung, der Universalindikator wird blau. 18
19 Reaktionen mit Sauerstoff Das Bindungsbestreben von Metallen zu Sauerstoff Werkstatt: Metalle oxidieren verschieden stark 1 Der Gasbrenner kann alternativ auch waagrecht eingespannt werden und das Pulver von oben in die nicht leuchtende Flamme gestreut werden. Keinen Kartuschenbrenner verwenden! Als Unterlage empfiehlt sich eine große Aluminiumfolie. Das Glasrohr soll wenigstens 20 cm lang sein. Taucht man das Glasrohr etwa 1 cm tief in das Magnesiumpulver ein, dann bleiben ausreichend viele Pulverkörner im Glasrohr haften. Erst einatmen, dann das Glasrohr an den Mund setzen, mit dem Glasrohrende auf die Gasbrennerflamme zielen und dann erst das Magnesiumpulver in die Gasbrennerflamme blasen. 2 Die Metalle reagieren unterschiedliche heftig mit Sauerstoff. Das Bindungsbestreben mit Sauerstoff ist unterschiedlich stark ausgeprägt. Die Reaktionsheftigkeit ist nur zu vergleichen, wenn man Pulver gleicher Menge und Korngröße einsetzt. Als Versuchsergebnis lässt sich folgende Reihenfolge mit zunehmender Reaktionsheftigkeit erstellen: Kupfer: brennt mit leicht grünlicher Flamme Eisen: leichter Funkenflug mit gelblichen Funken Magnesium: starker Funkenflug mit hell leuchtenden Funken Aluminium: heftiger Funkenflug mit leuchtenden Funken. 1 Eisenwolle verbrennt mit gelblich leuchtenden Funken zu schwarz-grauem Eisenoxid. 2 Es ist wichtig, dass das Kupferbriefchen sorgfältig gefaltet und zusammengepresst wird. Es muss sicher sein, dass keine Luft (kein Sauerstoff) von außen an die Innenfläche des Kupfers gelangt. Versuchsergebnis: Kupfer oxidiert an der der Luft zugewandten Seite zu Kupferoxid. An der Innenseite, die vor dem Zutritt des Sauerstoffs geschützt ist, findet keine Oxidation statt. 3 Es ist darauf zu achten, dass der Versuch über einer Aluminiumfolie ausgeführt wird, um den Arbeitsplatz sauber zu halten und ungewollte Verbrennungen auszuschließen. Es darf kein Kartuschenbrenner benutzt werden, und der Gasbrenner muss waagrecht eingespannt werden, damit die Metallspäne nicht in den Brenner fallen. Der Gasbrenner muss auf die nicht leuchtende Flamme eingestellt werden. Jedes Metall erzeugt unterschiedlich helle Funken und eine andere Funkenfärbung. Die Metalle lassen sich nach ihrer Reaktionsheftigkeit in eine Reihe anordnen: Kupfer: schwach grüne Flamme Zink: schwacher Funkenflug mit gelblichen Funken Eisen: etwas heftiger Funkenflug mit gelblich leuchtenden Funken 4 Die Eisenwolle muss fettfrei sein. Die Oxidation von Eisen verläuft langsam und benötigt mehrere Tage. Der für die Oxidation benötigte Sauerstoff stammt haupsächlich aus dem an der Wasseroberfläche des Reagenzglases gelösten Sauerstoff. Der Wasserspiegel im Reagenzglas steigt daher mit der Zeit an. Versuchsergebnis: Nach einigen Tagen bildet sich an der Eisenwolle im Reagenzglas Rost. 19
20 Reaktionen mit Sauerstoff Oxide des Kohlenstoffs Versuch 1 Das Stück Holzkohle sollte wenigstens die Größe einer Erbse haben. Versuchsergebnis: Holzkohle (schwarz-grau, spröde) verbrennt zu Kohlenstoffdioxid (farbloses Gas, trübt Kalkwasser). Aufgabe 1 Kohlenstoff + Sauerstoff Kohlenstoffdioxid 20
21 Reaktionen mit Sauerstoff Nichtmetalle reagieren mit Sauerstoff Schwefeldioxid wird aus dem Rauchgas entfernt Alle Verbrennungen werden unter Sauerstoff durchgeführt. Die Reaktionen laufen dabei deutlich sichtbarer und vollständiger ab. Bei den n sind die Eigenschaften des Eduktes mit denen des Reaktionsprodukts genau miteinander zu vergleichen. 1 Schwefeldioxid ist giftig, daher muss der Versuch unter dem Abzug ausgeführt werden. Versuchsergebnis: Schwefel (gelb, spröde) verbrennt zu Schwefeldioxid (farbloses Gas, bleichende Wirkung). 2 Schwefeldioxid ist giftig. Daher muss bei diesem Lehrerversuch im Abzug gearbeitet werden. Das Nichtmetall Schwefel verbrennt hauptsächlich zu Schwefeldioxid. Versuchsergebnis: In einer wässrigen Schwefeldioxidlösung färbt sich Universalindikator rot. Versuch 1 Ergebnis: In der 1. Waschflasche zeigt die Entfärbung das Vorhandensein von Schwefeldioxid an. Nachdem das Rauchgas die 2. Waschflasche mit Kalkwasser passiert hat, zeigt die Lugols-Lösung in der 3. Waschflasche keine Änderung mehr. Schwefeldioxid ist durch das Kalkwasser nach folgender Reaktionsgleichung absorbiert worden: SO 2 + Ca(OH) 2 + H 2O CaSO H 2O Um eine genaue Aussage über die Verminderung des Schwefeldioxid-Anteils zu erhalten wird das Rauchgas vor und nach dem Einleiten in Kalkwasser mit SO 2-Prüfröhrchen gemessen. 3 Das Holz verbrennt unter anderem zu Kohlenstoffdioxid. Kohlenstoffdioxid ist ein Nichtmetalloxid und bildet mit Wasser eine (schwach) saure Lösung. Versuchsergebnis: Der Universalindikator färbt sich in einer Kohlenstoffdioxidlösung schwach gelb-orange. 21
22 Reaktionen mit Sauerstoff Brennpunkt: Treibhauseffekt Aufgabe 1 Gefahren, die mit der Zunahme des Treibhauseffekts verbunden sind: Verringerung der polaren Eiskappen; Abschmelzen von Gletschern; dadurch und durch die Volumenausdehnung des erwärmten Meerwassers Anstieg des Meeresspiegels; Bedrohung von flachen Inseln und Küstenregionen; auch Veränderung des Klimas sowie Verschiebung der Klimazonen möglich, wodurch evt. Hauptanbaugebiete für Getreide bedroht sind. 2 Kohlenstoffdioxid entsteht vor allem bei der Verbrennung kohlenstoffhaltiger Brennstoffe (Kohle, Erdgas, Erdölprodukte) und bei der Vernichtung von Tropenwälder durch Brandrodung. 3 Neben Kohlenstoffdioxid wirken folgende Gase als Treibhausgase: Ozon (entstanden durch fotochemische Reaktionen über Stickstoffoxide, Hauptverursacher ist der Verkehr), CFKW (Chlor-Fluor-Kohlenwasserstoffe, früher verwendet als Treibgase in Spraydosen, Kühlmittel, Reinigungs- und Lösungsmittel, Kunststoffverschäumung), Methan (Nassreisanbau, Mägen der Wiederkäuer, Faulen von Biomasse, Sumpfgas, Deponiegas, Erdgaslecks, Biogas), Distickstoffoxid (Verbrennung fossiler Brennstoffe und Biomasse, Stickstoffdüngung). 22
23 Reaktionen mit Sauerstoff Schlusspunkt Aufgaben 1 Wird Terpentinöl in eine offene Flamme gesprüht, wird es fein zerstäubt bzw. zerteilt. Mit zunehmendem Zerteilungsgrad wird die Oberfläche des brennbaren Stoffes größer, die Verbrennung verläuft zunehmend heftiger und oft spontan oder explosionsartig. 2 Feuchtes Heu beginnt zu gären. Dabei entstehen brennbare Gase und Wärme. Wird die Zündtemperatur erreicht, kommt es zur Selbstentzündung. 3 Die Kerzenflamme ist nicht heiß genug, um die Oxidation von Kupfer ausreichend zu beschleunigen; es findet so gut wie keine Oxidation am Kupfer statt. Stattdessen schlägt sich der Ruß der Kerzenflamme am Kupfer nieder. Dagegen ist die Flamme des Gasbrenners heiß genug, um die Oxidation des Kupfers in die Wege zu leiten. Kupfer + Sauerstoff Kupferoxid 4 Das Gas aus der roten Gasflasche ist Wasserstoff. Es reagiert explosiv mit Luftsauerstoff zu Wasser, Watesmopapier wird blau. Die chemische Reaktion lässt sich mit folgendem Reaktionsschema beschreiben: Wasserstoff + Sauerstoff Wasser(stoffoxid) Die Reaktionsart ist eine Oxidation (Reaktion mit Sauerstoff). 5 Im Körper des Menschen werden Nährstoffe, meist Glucose (Traubenzucker) oxidiert. Die Oxidationen verlaufen im Vergleich zu Verbrennungen an der Luft sehr langsam ab und ohne Flammenerscheinung. Die frei werdende Energie dient zur Aufrechterhaltung der Körpertemperatur und zur Bewegung. 6 Edle Metalle reagieren nicht oder kaum mit Sauerstoff. Weil sie nicht oder nur schlecht Oxidschichten bilden, behalten sie ihren metallischen Glanz. Edelmetalle besitzen über lange Zeit einen metallischen Glanz. 7 Das Reaktionsprodukt von Blei und Sauerstoff ist Bleioxid. Das Rostschutzmittel gehört zu der Stoffklasse der Oxide. Mennige beispielsweise ist ein Rostschutzmittel, das aus Bleioxid besteht. 8 Der Luftbestandteil Kohlenstoffdioxid ist ein Nichtmetalloxid und reagiert mit den Wassertröpfchen in der Luft zu Kohlensäure. Der Anteil der Kohlensäure im Regenwasser ist allerdings recht gering. Zusatzinformation: Der Grund liegt im Aufbau der Kohlensäuremoleküle. Es sind überwiegend Wassermoleküle, welche jeweils ein Kohlenstoffdioxidmolekül verhältnismäßig locker gebunden haben. Die chemische Formel von Kohlensäure ist daher weniger H 2CO 3, sondern zutreffender eher H 2O CO 2. In dieser Form kann ein sauer wirkendes Wasserstoffion nur schwer abgespalten werden. 9 Menschen und Tiere atmen Kohlenstoffdioxid in die Luft aus, und die Pflanzen benötigen Kohlenstoffdioxid zur Fotosynthese. In diesem Rahmen ist Kohlenstoffdioxid ein natürlicher Luftbestandteil. Durch Verbrennung kohlenstoffhaltiger Brennstoffe entsteht weltweit mehr Kohlenstoffdioxid, als von den grünen Pflanzen gebunden werden kann. Dieses trägt zur Erwärmung der Erdatmosphäre bei und wird in diesem Sinne als Luftschadstoff angesehen. 23
24 Reduktion und Redoxreaktionen Die Reduktion 1 Silberoxid zerfällt schnell. Der feinpulvrige, weiße Rückstand (fein verteiltes Silber) ist leicht zu erhalten. Um ein metallisch glänzendes Silberkügelchen zu erhalten, muss der weiße Rückstand jedoch erst unter hoher Energiezufuhr zusammengeschmolzen werden. Das Silber(I)-oxid kann man selber herstellen, in dem man eine Silbersalzlösung mit Kalilauge versetzt und den braun-schwarzen Niederschlag abfiltriert. Den Niederschlag gut mit Wasser waschen und bei niedriger Temperatur trocknen. Versuchsergebnis: Aus grau-schwarzem Silberoxid entsteht ein feinpulvriger, weißer Stoff (fein verteiltes Silber). Die Glimmspanprobe verläuft positiv. Aufgabe 1 Das brennende Magnesium müsste in reinem Kohlenstoffdioxid erlöschen, da kein Sauerstoff zur Verfügung steht. Die weiterlaufende Reaktion und die Bildung von Kohlenstoff zeigen, dass das Magnesium dem Kohlenstoffdioxid den Sauerstoff entreißen kann. Magnesiumoxid bildet sich und Kohlenstoff bleibt zurück. Magnesium kann den Sauerstoff fester an sich binden als Kohlenstoff. Magnesium ist ein starkes Reduktionsmittel. Eine chemische Reaktion, bei der Sauerstoff abgegeben wird, ist eine Reduktion. Reduktion Kohlenstoffdioxid + Magnesium Kohlenstoff + Magnesiumoxid Zusatzinformationen Durch die Versuchsreihe (Versuch 2 bis Versuch 5), soll die Schülerin / der Schüler die Reduktionskraft der einzelne Metalle erkennen und diese selbstständig in eine Reihe einordnen können. 2 Das Reagenzglas kann durch die Hitzeentwicklung zerspringen, daher ist eine Unterlage unbedingt erforderlich. Versuchsergebnisse: Die Reaktion läuft nach kurzem Erhitzen von alleine ab. Eine Glühfront wandert durch das Gemisch. Nach dem Abkühlen kann man kupferfarbene Bestandteile im Reaktionsprodukt feststellen (vgl. Bild 4 und Bild 5 im Schülerbuch). Kupferoxid kann durch Eisen reduziert werden. Zusatzinformationen Oxidation Die Reduktionskraft der Metalle (Redoxreihe der Metalle) ist aus Gründen der Übersicht für den Schüler nur an vier Metallen aufgezeigt. Eine vollständigere Reihe lautet: Au, Pt, Hg, Ag, Cu, Pb, Fe, Zn, Al, Mg, Na, Ca, K Die Reduktionskraft nimmt zu 3 Dass hier keine Reaktion stattfindet, ist für den Schüler nur daran zu erkennen, dass kein Nachglühen also keine exotherme Reaktion stattfindet. Wichtig ist, dass im Versuch 2 vom Schüler die exotherme Reaktion erkannt wurde. Versuchsergebnis: Eisenoxid kann nicht durch Kupfer reduziert werden. Kupfer ist ein schwächeres Reduktionsmittel als Eisen. 4 Die schwarzen Kohlenstoffflocken im weißen Magnesiumoxid sind gut zu erkennen. Zur besseren Demonstration können die Kohlenstoffflocken mit Wasser ausgespült und abfiltriert werden. Damit der Glaszylinder bei der Reaktion nicht zerspringt, sollte etwas Sand auf den Boden des Gefäßes gegeben werden. Versuchsergebnis: Kohlenstoffdioxid kann durch Magnesium reduziert werden. 5 Bei genauer Beobachtung kann man leicht erkennen, dass das Glühen der Eisenwolle beim Eintauchen sofort aufhört. Versuchsergebnis: Kohlenstoffdioxid kann durch Eisen nicht reduziert werden. Eisen ist ein schwächeres Reduktionsmittel als Magnesium. 24
25 Reduktion und Redoxreaktionen Die Redoxreaktion Werkstatt: Wir stellen Kupfer her 1 Durch die Knallgasprobe wird sichergestellt, dass sich neben dem Kupferoxid nur noch reines Wasserstoffgas im Reaktionsrohr befindet. Mithilfe der Wasserstoffflamme lässt sich ein gleichmäßiges Durchströmen einstellen. Die eindrucksvolle Farbänderung wandert mit dem Wasserstoffstrom. Wenn etwa die Hälfte des Kupferoxides umgesetzt ist, sollte man mit dem Erhitzen aufhören, um nachher beide Stoffe (Cu und CuO) vorzeigen zu können. Dabei muss man darauf achten, dass der Wasserstoff nach dem Erhitzen noch weiter das Reaktionsrohr durchströmt und damit auskühlt. Sonst reagiert das heiße Kupfer mit dem Luftsauerstoff wieder zu schwarzem Kupferoxid. Sehr eindrucksvoll lässt sich der Versuch mit schwarzem Kupferoxid in Drahtform (evtl. auch einem Kupferdrahtnetz) darstellen. Man kann diese Drahtstückchen sehr gut in einem dünnen Reaktionsrohr aus Quarz aufbewahren. Reduktion und Oxidation lassen sich abwechselnd nach Bedarf durchführen. Zusatzinformationen Alle Materialien sind bei: August HEDINGER GmbH & Co. Chemikalien und Lehrmittel Postfach Stuttgart (Wangen) erhältlich. Versuch Der Versuch ist sicher und einfach durchzuführen. Die größte Gefahr ist, dass das Kalkwasser in das Reagenzglas zurücksteigt. Aus diesem Grunde ist es ratsam, kein großvolumiges Reagenzglas zu nehmen. Außerdem sollte genau darauf geachtet werden, dass das Winkelrohr nur wenig in das Kalkwasser eintaucht. Da beim Erhitzen Kohlenstoffdioxid entsteht, ist es ratsam, mit dem Erhitzen von rechts nach links zu beginnen. Sofort nach dem Durchglühen muss das Reagenzglas so weit angehoben werden, dass das Winkelrohr nicht mehr in das Kalkwasser eintaucht. Versuchsergebnisse: Im Kalkwasser perlen Gasblasen hoch, das Kalkwasser trübt sich. Nach dem Erkalten erkennt man im Reagenzglas einen rötlichen festen Stoff (Kupfer). Aufgaben 1 Neben überschüssigem Kohlenstoff hat sich ein rötlicher fester Stoff gebildet, der auf Kupfer hinweist. Als zweites Reaktionsprodukt wird Kohlenstoffdioxid mit Kalkwasser nachgewiesen. 2 Reduktion Kupferoxid + Kohlenstoff Kupfer + Kohlenstoffdioxid Oxidation 25
26 Reduktion und Redoxreaktionen Brennpunkt: Der Hochofenprozess Zusatzinformationen Modellversuch (Lehrerversuch): Material: Quarzglasrohr (ca. 20 cm lang, d = 1,5 cm), gewinkeltes Glasrohr mit durchbohrtem Stopfen, Glasrohr mit ausgezogener Spitze und durchbohrtem Stopfen, Glaswolle (bzw. Steinwolle), 2 Bunsenbrenner, Magnet, Stativmaterial Chemikalien: Aktivkohle (gekörnt), Eisen(III)-oxid, Sauerstoff (brandfördernd, O) Ergebnis: Es ist schwarzes Eisenpulver entstanden, das vom Magneten angezogen wird. Auswertung: An den chemischen Prozessen, die zur Reduktion von Eisen(III)-oxid führen, sind folgende zwei Schritte beteiligt: I. Entstehung des Reduktionsmittels Kohlenstoffmonooxid in den Aktivkohleschichten des Hochofenmodells (Oxidation): 2 C + O 2 2 CO II. Indirekte Reduktion des Eisenerzes: Das heiße Kohlenstoffmonooxid steigt in die darrüberliegende Schicht von Eisen(III)-oxid und reduziert dieses bei einer Temperatur von etwa 400 C, wobei es selbst oxidiert wird (Redoxreaktion): 3 Fe 2O 3 + CO 2 Fe 3O 4 + CO 2 Fe 3O 4 + CO 3 FeO + CO 2 FeO + CO Fe + CO 2 Hinweis: Es ist unbedingt erforderlich, die Sauerstoffzufuhr nach dem Aufglühen der Aktivkohle zu reduzieren, da anderenfalls die Aktivkohle durch den Sauerstoff vollständig zu Kohlenstoffdioxid oxidiert wird. Kohlenstoffmonooxid entsteht nur bei einer unvollständigen Verbrennung von Kohlenstoff. Literaturhinweise J. Reiss: Alltagschemie im Unterricht, Aulis Verlag Deubner & CO KG, Köln 1994, S.18ff. Medienhinweise Durchführung: Ein senkrecht im Stativ eingespanntes Quarzrohr wird am unteren Ende mit einem Stopfen verschlossen, in dem ein Glasrohr (gewinkelt) gasdicht eingeführt und mit einer Sauerstoffflasche verbunden ist. Das Reaktionsrohr wird gemäß der Abbildung folgendermaßen beschickt: Auf eine Schicht von Glaswolle folgt gekörnte Aktivkohle (etwa 7 cm hoch), dann Eisen(III)-oxid (etwa 2 cm hoch), dann wiederum eine Schicht Aktivkohle gefolgt von einer Schicht aus Eisen(III)-oxid. Die oberste Schicht wird dann mit Glaswolle abgedeckt und das Quarzglasrohr mit Stopfen und Glasrohr (mit Spitze) verschlossen. Mithilfe von zwei schräg gestellten Bunsenbrennern wird die unterste Kohleschicht zum Glühen gebracht und dann Sauerstoff durch das Reaktionsrohr geleitet. Dann erhitzt man das Eisen(III)-oxid und anschließend die obersten Schichten. Das am oberen Glasrohr entweichende Kohlenstoffmonooxid wird abgefackelt. Wenn beide Kohleschichten glühen, wird die Sauerstoffzufuhr vermindert und die Brenner werden entfernt. Beim Nachlassen des Glühens stellt man die Sauerstoffzufuhr ab und lässt das Reaktionsrohr abkühlen. Anschließend prüft man das Reaktionsprodukt mit einem Magneten. 26
Chemie Fragenkatalog Jahrgang 8
 Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Was passiert, wenn Schwefeldampf über einen heissen Kupferblechstreifen streicht?
 Posten 1a Was passiert, wenn Schwefeldampf über einen heissen Kupferblechstreifen streicht? a) es entsteht Wasserdampf (Wassertropfen kondensieren am Streifen) (=> Posten 5l) b) der Schwefeldampf wird
Posten 1a Was passiert, wenn Schwefeldampf über einen heissen Kupferblechstreifen streicht? a) es entsteht Wasserdampf (Wassertropfen kondensieren am Streifen) (=> Posten 5l) b) der Schwefeldampf wird
10 Das war das ist Chemie. 12 Sicherheit beim Experimentieren. 22 Stoffe, Teilchen, Eigenschaften
 10 Das war das ist Chemie 12 Sicherheit beim Experimentieren 14 Verhalten im Fachraum Chemie 15 Werkstatt: Umgang mit dem Gasbrenner 16 Der Gasbrenner ein wichtiges Laborgerät 17 Strategie: Ein Experiment
10 Das war das ist Chemie 12 Sicherheit beim Experimentieren 14 Verhalten im Fachraum Chemie 15 Werkstatt: Umgang mit dem Gasbrenner 16 Der Gasbrenner ein wichtiges Laborgerät 17 Strategie: Ein Experiment
1. Chemie ist da wo es stinkt und kracht Die chemische Reaktion zwischen Zucker und Kaliumnitrat
 1. Chemie ist da wo es stinkt und kracht Die chemische Reaktion zwischen Zucker und Kaliumnitrat Geräte/Chemikalien: Mörser mit Pistill, feuerfeste Unterlage, Zucker, Kaliumnitrat, Zünder: Kaliumpermanganat
1. Chemie ist da wo es stinkt und kracht Die chemische Reaktion zwischen Zucker und Kaliumnitrat Geräte/Chemikalien: Mörser mit Pistill, feuerfeste Unterlage, Zucker, Kaliumnitrat, Zünder: Kaliumpermanganat
1.1 Oxidation von Metallen. Aufgabe. Wie verändern sich Metalle beim Erhitzen? Naturwissenschaften - Chemie - Anorganische Chemie - 1 Metalle
 Naturwissenschaften - Chemie - Anorganische Chemie - Metalle (P753000). Oxidation von Metallen Experiment von: Phywe Gedruckt:.0.203 5:6:40 intertess (Version 3.06 B200, Export 2000) Aufgabe Aufgabe Wie
Naturwissenschaften - Chemie - Anorganische Chemie - Metalle (P753000). Oxidation von Metallen Experiment von: Phywe Gedruckt:.0.203 5:6:40 intertess (Version 3.06 B200, Export 2000) Aufgabe Aufgabe Wie
Verbrennung einer Kerze
 Verbrennung einer Kerze Schauen wir uns zunächst die Kerze genauer an. Aus welchen Bestandteilen besteht sie? Und wozu dienen diese? Bestandteil Stoff Funktion Der Stoff ist das Material, woraus ein Körper
Verbrennung einer Kerze Schauen wir uns zunächst die Kerze genauer an. Aus welchen Bestandteilen besteht sie? Und wozu dienen diese? Bestandteil Stoff Funktion Der Stoff ist das Material, woraus ein Körper
Chemische Reaktionen. Wir erzeugen Wasser
 hemische Reaktionen + Natrium + -> hlor -> Natriumchlorid = Kochsalz Wir erzeugen Wasser Die kleinsten Teilchen des Sauerstoffes und des Wasserstoffes waren im roten Ballon bereits gut durchmischt. Daher
hemische Reaktionen + Natrium + -> hlor -> Natriumchlorid = Kochsalz Wir erzeugen Wasser Die kleinsten Teilchen des Sauerstoffes und des Wasserstoffes waren im roten Ballon bereits gut durchmischt. Daher
Die chemische Reaktion
 Die chemische Reaktion 1. Versuch In eine mit Sauerstoff gefüllte Flasche halten wir ein Stück brennenden Schwefel. Aus den beiden Ausgangsstoffen (Edukten) entsteht ein neuer Stoff (Produkt) mit eigenen,
Die chemische Reaktion 1. Versuch In eine mit Sauerstoff gefüllte Flasche halten wir ein Stück brennenden Schwefel. Aus den beiden Ausgangsstoffen (Edukten) entsteht ein neuer Stoff (Produkt) mit eigenen,
Verbrennung einer Kerze
 Verbrennung einer Kerze Zünde eine Kerze an und notiere deine Beobachtungen: Was passiert eigentlich genau bei der Verbrennung einer Kerze? Diese Frage versuchen wir in diesem Kapitel zu beantworten. Schauen
Verbrennung einer Kerze Zünde eine Kerze an und notiere deine Beobachtungen: Was passiert eigentlich genau bei der Verbrennung einer Kerze? Diese Frage versuchen wir in diesem Kapitel zu beantworten. Schauen
Gruppe I : Darstellung und Nachweis von Säuren
 Gruppe I : Darstellung und Nachweis von Säuren Behauptung: Säuren lassen sich durch die Reaktion von Nichtmetalloxiden mit Wasser darstellen. 1. Überprüfen Sie experimentell die aufgeführte Behauptung
Gruppe I : Darstellung und Nachweis von Säuren Behauptung: Säuren lassen sich durch die Reaktion von Nichtmetalloxiden mit Wasser darstellen. 1. Überprüfen Sie experimentell die aufgeführte Behauptung
Stoffe im Alltag 8 Experimentieren in der Chemie 10
 2 Stoffe im Alltag 8 Experimentieren in der Chemie 10 Feuer und Brandbekämpfung 12 Feuer und Flamme 12 Voraussetzungen für die Verbrennung 14 Brände löschen 15 Stoffe und ihre Eigenschaften 16 Den Stoffen
2 Stoffe im Alltag 8 Experimentieren in der Chemie 10 Feuer und Brandbekämpfung 12 Feuer und Flamme 12 Voraussetzungen für die Verbrennung 14 Brände löschen 15 Stoffe und ihre Eigenschaften 16 Den Stoffen
Curriculum Chemie Klasse 8 Albert-Einstein-Gymnasium Ulm
 Curriculum Chemie Klasse 8 Albert-Einstein-Gymnasium Ulm Klasse 8 Themen Experimentieren im Chemieunterricht Grundregeln des Experimentierens 5. - mit Laborgeräten sachgerecht umgehen und die Sicherheitsmaßnahmen
Curriculum Chemie Klasse 8 Albert-Einstein-Gymnasium Ulm Klasse 8 Themen Experimentieren im Chemieunterricht Grundregeln des Experimentierens 5. - mit Laborgeräten sachgerecht umgehen und die Sicherheitsmaßnahmen
Echt ätzend! - Was ist und wie wirkt Abflussreiniger?
 Echt ätzend! - Was ist und wie wirkt Abflussreiniger? Versuch 1: Zusammensetzung von festem Abflussreiniger (Analyse nach Prof. Pick ): fester Abflussreiniger (z.b. Drano Rohrfrei) Petrischale, Holzstab
Echt ätzend! - Was ist und wie wirkt Abflussreiniger? Versuch 1: Zusammensetzung von festem Abflussreiniger (Analyse nach Prof. Pick ): fester Abflussreiniger (z.b. Drano Rohrfrei) Petrischale, Holzstab
Experimente mit Wasserstoff
 Experimente mit Wasserstoff Wasserstoff [F + ] aus Druck-Gasflasche entnehmen mit sachgerechter Betätigung der Ventile beim Öffnen und Wiederverschließen. Allen Experimenten ist gemeinsam, dass Wasserstoff
Experimente mit Wasserstoff Wasserstoff [F + ] aus Druck-Gasflasche entnehmen mit sachgerechter Betätigung der Ventile beim Öffnen und Wiederverschließen. Allen Experimenten ist gemeinsam, dass Wasserstoff
Welche Eigenschaften besitzen Calcium- und Magnesiumlaugen?
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P758900) 2.5 Herstellung und Eigenschaften von Kalkwasser (Magnesiumhydroxidlösung) Experiment von: Phywe Gedruckt: 5.0.203 2:3:05 intertess
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P758900) 2.5 Herstellung und Eigenschaften von Kalkwasser (Magnesiumhydroxidlösung) Experiment von: Phywe Gedruckt: 5.0.203 2:3:05 intertess
Zerlegung von Wasser durch Reduktionsmittel
 Lehrer-/Dozentenblatt Zerlegung von Wasser durch Reduktionsmittel (Artikelnr.: P7155500) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Anorganische Chemie Unterthema:
Lehrer-/Dozentenblatt Zerlegung von Wasser durch Reduktionsmittel (Artikelnr.: P7155500) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Anorganische Chemie Unterthema:
Modelle helfen Erscheinungen und Vorgänge zu beschreiben und Wesentliches zu erkennen, geben jedoch die Wirklichkeit nie vollständig wieder.
 I. Stoffen auf der Spur 1. Eigenschaften von Stoffen erkennen Farbe Geruch Geschmack Kristallform Klang Zustandsform 2. Eigenschaften von Stoffen ermitteln/ messen Wärmeleitfähigkeit Elektrische Leitfähigkeit
I. Stoffen auf der Spur 1. Eigenschaften von Stoffen erkennen Farbe Geruch Geschmack Kristallform Klang Zustandsform 2. Eigenschaften von Stoffen ermitteln/ messen Wärmeleitfähigkeit Elektrische Leitfähigkeit
Std Themenbereiche im Lehrplan Inhalte im Lehrplan Kapitel in PRISMA Chemie 7/8 Seiten im Buch
 Stoffverteilungsplan Lehrplan für den Erwerb des Hauptschul- und des Realschulabschlusses (Regelschule) in Thüringen 2011 PRISMA Chemie Thüringen Band 7/8 Schule: Klett 978-3-12-068562-3 Lehrer/Lehrerin:
Stoffverteilungsplan Lehrplan für den Erwerb des Hauptschul- und des Realschulabschlusses (Regelschule) in Thüringen 2011 PRISMA Chemie Thüringen Band 7/8 Schule: Klett 978-3-12-068562-3 Lehrer/Lehrerin:
Chemische Reaktionen von Metallen mit Brom
 Chemische Reaktionen von Metallen mit Brom a) Umsetzung von Natrium und Kalium mit Brom: Chemikalien: Geräte: Natrium [C,F], Kalium [C,F], Brom [T +,C,N] ca. 5%ige Lösung von Fixiersalz (=Natriumthiosulfat)
Chemische Reaktionen von Metallen mit Brom a) Umsetzung von Natrium und Kalium mit Brom: Chemikalien: Geräte: Natrium [C,F], Kalium [C,F], Brom [T +,C,N] ca. 5%ige Lösung von Fixiersalz (=Natriumthiosulfat)
Erwartete Kompetenzen. Kompetenzbereich Erkenntnisgewinnung Die Schülerinnen und Schüler E1 E2 E3 E4 E5 E6 E7 E8 E9 E10 E11 E12 E13 E14 E15 E16 E17
 Stoffverteilungsplan Kerncurriculum für die Oberschule in Niedersachsen (Schuljahrgänge 7/8) PRISMA Chemie Niedersachsen Differenzierende Ausgabe Band 7/8 Schule: Klettbuch ISBN 978-3-12-068537-1 Lehrer:
Stoffverteilungsplan Kerncurriculum für die Oberschule in Niedersachsen (Schuljahrgänge 7/8) PRISMA Chemie Niedersachsen Differenzierende Ausgabe Band 7/8 Schule: Klettbuch ISBN 978-3-12-068537-1 Lehrer:
Lösungen Thema: Stoffe und ihre Eigenschaften
 Lösungen Thema: Stoffe und ihre Eigenschaften zu 1: Siedetemperatur, Schmelztemperatur, Dichte (Löslichkeit) zu 2: Brennbarkeit, Härte, Löslichkeit, Farbe, Geruch zu 3: zu 4: Bei der Flüssigkeit handelt
Lösungen Thema: Stoffe und ihre Eigenschaften zu 1: Siedetemperatur, Schmelztemperatur, Dichte (Löslichkeit) zu 2: Brennbarkeit, Härte, Löslichkeit, Farbe, Geruch zu 3: zu 4: Bei der Flüssigkeit handelt
10 Neugierig auf Chemie? 12 Das war das ist Chemie. 14 Sicheres Experimentieren. 28 Stoffe, Teilchen, Eigenschaften
 10 Neugierig auf Chemie? 12 Das war das ist Chemie 14 Sicheres Experimentieren 16 Verhalten im Fachraum Chemie 17 Werkstatt: Umgang mit dem Gasbrenner 18 Der Gasbrenner ein wichtiges Laborgerät 19 Werkstatt:
10 Neugierig auf Chemie? 12 Das war das ist Chemie 14 Sicheres Experimentieren 16 Verhalten im Fachraum Chemie 17 Werkstatt: Umgang mit dem Gasbrenner 18 Der Gasbrenner ein wichtiges Laborgerät 19 Werkstatt:
Chemie, Kapitel 4 : Chemische Reaktionen und Luft
 Lesen Sie aufmerksam das Kapitel 4.4 und lösen Sie die folgenden Aufgaben: a) Definieren Sie die drei Begriffe in jeweils einem Satz b) Geben Sie ein Beispiel aus dem Alltag Exotherme Reaktion: Endotherme
Lesen Sie aufmerksam das Kapitel 4.4 und lösen Sie die folgenden Aufgaben: a) Definieren Sie die drei Begriffe in jeweils einem Satz b) Geben Sie ein Beispiel aus dem Alltag Exotherme Reaktion: Endotherme
Chemische Reaktionen 4. Redoxreaktionen Schritt für Schritt (Kl. 8/9) Ein Geben und Nehmen Redoxreaktionen Schritt für Schritt VORANSICHT
 V Chemische Reaktionen 4. Redoxreaktionen Schritt für Schritt (Kl. 8/9) 1 von 30 Ein Geben und Nehmen Redoxreaktionen Schritt für Schritt Tobias Dunst, Kißlegg Welche Verbindung besteht zwischen dem mysteriösen
V Chemische Reaktionen 4. Redoxreaktionen Schritt für Schritt (Kl. 8/9) 1 von 30 Ein Geben und Nehmen Redoxreaktionen Schritt für Schritt Tobias Dunst, Kißlegg Welche Verbindung besteht zwischen dem mysteriösen
Welt der Chemie Feuerwerk 178 Selbst untersucht Eigenschaften von Alkali- und Erdalkalimetallen 179 Natrium 180
 Inhalt Alkali- und Erdalkalimetalle 177 Welt der Chemie Feuerwerk 178 Selbst untersucht Eigenschaften von Alkali- und Erdalkalimetallen 179 Natrium 180 Die Elemente der I. Hauptgruppe 182 Magnesium und
Inhalt Alkali- und Erdalkalimetalle 177 Welt der Chemie Feuerwerk 178 Selbst untersucht Eigenschaften von Alkali- und Erdalkalimetallen 179 Natrium 180 Die Elemente der I. Hauptgruppe 182 Magnesium und
4. Chemische Reaktion
 Chemie GU 9 4. Chemische Reaktion 4.1 Stoffe wandeln sich um Aus Kupfer und Schwefel entsteht ein neuer Stoff Metalle reagieren mit Schwefel zu Metallsulfiden o Edukte und Produkte Das Reaktionsschema
Chemie GU 9 4. Chemische Reaktion 4.1 Stoffe wandeln sich um Aus Kupfer und Schwefel entsteht ein neuer Stoff Metalle reagieren mit Schwefel zu Metallsulfiden o Edukte und Produkte Das Reaktionsschema
Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen. Kurzprotokoll. Schulversuchspraktikum.
 Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 7 & 8 Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll
Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 7 & 8 Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll
Zugrunde gelegt wird ein Chemie-Unterricht mit zwei Wochenstunden. September. Oktober
 Vorschlag für einen Jahresplan Chemie-Unterricht im fünften Jahr mit dem Unterrichtswerk PRISMA Zugrunde gelegt wird ein Chemie-Unterricht mit zwei Wochenstunden Monat September Oktober Chemische Bindungen
Vorschlag für einen Jahresplan Chemie-Unterricht im fünften Jahr mit dem Unterrichtswerk PRISMA Zugrunde gelegt wird ein Chemie-Unterricht mit zwei Wochenstunden Monat September Oktober Chemische Bindungen
Inhalt. Was ist Chemie? 7
 Inhalt Was ist Chemie? 7 Überall Chemie 8 Chemie Chancen und Gefahren 10 Umgang mit Chemikalien 12 Typische Tätigkeiten in der Chemie 14 Methode Regeln beim Experimentieren 15 Methode Umgang mit dem Brenner
Inhalt Was ist Chemie? 7 Überall Chemie 8 Chemie Chancen und Gefahren 10 Umgang mit Chemikalien 12 Typische Tätigkeiten in der Chemie 14 Methode Regeln beim Experimentieren 15 Methode Umgang mit dem Brenner
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Wer spannt wem den Sauerstoff aus? Das komplette Material finden Sie hier:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Wer spannt wem den Sauerstoff aus? Das komplette Material finden Sie hier: School-Scout.de 2 von 24 17. Metalloxide (Kl. 8/9) Stoffe
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Wer spannt wem den Sauerstoff aus? Das komplette Material finden Sie hier: School-Scout.de 2 von 24 17. Metalloxide (Kl. 8/9) Stoffe
Inhalt. Methode Methode Aktion. Aktion Fakten Projekt Projekt Projekt Projekt. Ausblick Aktion Fakten Ausblick Methode Ausblick Wissen & Training
 Stoffe im Alltag 8 Experimentieren in der Chemie 10 Wärmequellen im Unterricht 12 Sicherheit in der Chemie Lernen an Stationen 14 Stoffe und ihren Eigenschaften 16 Den Stoffen auf der Spur 16 Körper und
Stoffe im Alltag 8 Experimentieren in der Chemie 10 Wärmequellen im Unterricht 12 Sicherheit in der Chemie Lernen an Stationen 14 Stoffe und ihren Eigenschaften 16 Den Stoffen auf der Spur 16 Körper und
Untersuche an einigen Beispielen, welche Grundstoffe am Aufbau unserer Nahrung beteiligt sind.
 Naturwissenschaften - Biologie - Allgemeine Biologie - 4 Unsere Nahrungsmittel und ihre Verdauung (P802200) 4. Nahrungsmittel und Nährstoffe Experiment von: Phywe Gedruckt: 07.0.203 5:36:8 intertess (Version
Naturwissenschaften - Biologie - Allgemeine Biologie - 4 Unsere Nahrungsmittel und ihre Verdauung (P802200) 4. Nahrungsmittel und Nährstoffe Experiment von: Phywe Gedruckt: 07.0.203 5:36:8 intertess (Version
WERKSTATT Weißen Stoffen auf der Spur 10. Ein Duft breitet sich aus STRATEGIE Darstellendes Spiel: Lebendige Teilchen 16
 STOFFE UND STOFFEIGENSCHAFTEN 41 WERKSTATT Da löst sich etwas 1 Sicheres Experimentieren 42 43 Die Dichte STRATEGIE Den Steckbrief eines Stoffes erstellen 44 WERKSTATT Weißen Stoffen auf der Spur 10 Verhalten
STOFFE UND STOFFEIGENSCHAFTEN 41 WERKSTATT Da löst sich etwas 1 Sicheres Experimentieren 42 43 Die Dichte STRATEGIE Den Steckbrief eines Stoffes erstellen 44 WERKSTATT Weißen Stoffen auf der Spur 10 Verhalten
Inhalt. Was ist Chemie? 7
 Inhalt Was ist Chemie? 7 Überall Chemie 8 Chemie Chancen und Gefahren 10 Umgang mit Chemikalien 12 Typische Tätigkeiten in der Chemie 14 Methode Regeln beim Experimentieren 15 Methode Umgang mit dem Brenner
Inhalt Was ist Chemie? 7 Überall Chemie 8 Chemie Chancen und Gefahren 10 Umgang mit Chemikalien 12 Typische Tätigkeiten in der Chemie 14 Methode Regeln beim Experimentieren 15 Methode Umgang mit dem Brenner
Anhand welcher Eigenschaften lässt sich Sauerstoff identifizieren?
 Naturwissenschaften - Chemie - Allgemeine Chemie - 5 Nachweisreaktionen (P75400) 5. Nachweis von Sauerstoff Experiment von: Phywe Gedruckt:.0.203 3:00:4 intertess (Version 3.06 B200, Export 2000) Aufgabe
Naturwissenschaften - Chemie - Allgemeine Chemie - 5 Nachweisreaktionen (P75400) 5. Nachweis von Sauerstoff Experiment von: Phywe Gedruckt:.0.203 3:00:4 intertess (Version 3.06 B200, Export 2000) Aufgabe
3.11 Zerlegung von Wasser durch Reduktionsmittel. Aufgabe. Aus welchen Elementen besteht Wasser?
 Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P755500) 3. Zerlegung von Wasser durch Reduktionsmittel Experiment von: Seb Gedruckt: 24.03.204 :42:33
Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P755500) 3. Zerlegung von Wasser durch Reduktionsmittel Experiment von: Seb Gedruckt: 24.03.204 :42:33
STOFFE U N D STOFFTRENNUNG
 Inhalt WAS IST CHEMIE? 10 STOFFE U N D STOFFTRENNUNG 22 Chemie erlebt Chem ie-chancen und Gefahren...12 Umgang mit Chemikalien... 14 Chemie erlebt Chemie is t... 16 Methode Regeln beim Experimentieren...17
Inhalt WAS IST CHEMIE? 10 STOFFE U N D STOFFTRENNUNG 22 Chemie erlebt Chem ie-chancen und Gefahren...12 Umgang mit Chemikalien... 14 Chemie erlebt Chemie is t... 16 Methode Regeln beim Experimentieren...17
Erwartete Kompetenzen
 Stoffverteilungsplan Kerncurriculum für die Oberschule/Realschule in Niedersachsen (Schuljahrgänge 7/8) PRISMA Chemie Niedersachsen Differenzierende Ausgabe Band 7/8 Schule: Klettbuch ISBN 978-3-12-068537-1
Stoffverteilungsplan Kerncurriculum für die Oberschule/Realschule in Niedersachsen (Schuljahrgänge 7/8) PRISMA Chemie Niedersachsen Differenzierende Ausgabe Band 7/8 Schule: Klettbuch ISBN 978-3-12-068537-1
Löschversuche mit Wasser sowie Feuchtigkeit führen zur Spaltung von Wasser und erzeugen Knallgas
 Thermit / Blatt 1 Einleitung Gegen Ende des 19. Jahrhunderts entdeckte Hans Goldschmidt in Essen die technische Gewinnung von Schwermetallen aus ihren Oxiden durch die Oxidation von Aluminium. Thermit
Thermit / Blatt 1 Einleitung Gegen Ende des 19. Jahrhunderts entdeckte Hans Goldschmidt in Essen die technische Gewinnung von Schwermetallen aus ihren Oxiden durch die Oxidation von Aluminium. Thermit
Baden-Württemberg Gefährdungsbeurteilungen. Gesamtband
 Baden-Württemberg en Gesamtband Luft und Oxidation Kupferbrief Falte ein Stück Kupferblech, indem du es in der Mitte umknickst. Biege die Ränder um und klopfe sie mit dem Hammer fest. Glühe den Kupferbrief
Baden-Württemberg en Gesamtband Luft und Oxidation Kupferbrief Falte ein Stück Kupferblech, indem du es in der Mitte umknickst. Biege die Ränder um und klopfe sie mit dem Hammer fest. Glühe den Kupferbrief
Europäischer Chemielehrerkongress Leoben Österreich im April 2007
 Einfache und erprobte Experimente für den Anfangsunterricht im Fach Chemie 1. Stoffumwandlung Stoffe reagieren Aggregatzustandsänderung Zusammensetzung der Luft Gesetz von der Erhaltung der Masse Reaktion
Einfache und erprobte Experimente für den Anfangsunterricht im Fach Chemie 1. Stoffumwandlung Stoffe reagieren Aggregatzustandsänderung Zusammensetzung der Luft Gesetz von der Erhaltung der Masse Reaktion
Kopiervorlage 1: Eisen und Aluminium
 Kopiervorlage 1: Eisen und Aluminium 1. Suche aus dem Schulbuch folgende Eigenschaften der beiden Metalle heraus: Eisen Aluminium Dichte Härte Schmelzpunkt Magnetisierbarkeit 2. a) Berechne die Eisenmenge
Kopiervorlage 1: Eisen und Aluminium 1. Suche aus dem Schulbuch folgende Eigenschaften der beiden Metalle heraus: Eisen Aluminium Dichte Härte Schmelzpunkt Magnetisierbarkeit 2. a) Berechne die Eisenmenge
Lösungen Kap. 4 Die chemische Reaktion
 Elemente Grundlagen der Chemie für Schweizer Maturitätsschulen Klett und Balmer Verlag Zug 2007 Verwendung für den Gebrauch in der eigenen Klasse gestattet Lösungen Kap. 4 Die chemische Reaktion Lösungen
Elemente Grundlagen der Chemie für Schweizer Maturitätsschulen Klett und Balmer Verlag Zug 2007 Verwendung für den Gebrauch in der eigenen Klasse gestattet Lösungen Kap. 4 Die chemische Reaktion Lösungen
Betriebsanweisung nach 20 Gefahrstoffverordnung. Verwendete Chemikalien /37/ Kupfer (Pulver) - -
 Versuche 85-91 3 Problemfeld Stoffkreisläufe Betriebsanweisung nach 20 Gefahrstoffverordnung Verwendete Chemikalien Bezeichnung R-Sätze S-Sätze Gefährlichkeits merkmale Ammoniumdiammintetrathiocyanatochromat(III)
Versuche 85-91 3 Problemfeld Stoffkreisläufe Betriebsanweisung nach 20 Gefahrstoffverordnung Verwendete Chemikalien Bezeichnung R-Sätze S-Sätze Gefährlichkeits merkmale Ammoniumdiammintetrathiocyanatochromat(III)
Verbrennung von Eisenwolle und Holz
 Name: Datum: Versuch: Verbrennung von Eisenwolle und Holz Geräte: 1 Stativ 2 Muffen 2 Klemmen 1 Laborboy (hier Holzklotz) 1 Porzellanschale 1 Analysetrichter 1 Gaswaschflasche 1 Wasserstrahlpumpe 1 Gummischlauch
Name: Datum: Versuch: Verbrennung von Eisenwolle und Holz Geräte: 1 Stativ 2 Muffen 2 Klemmen 1 Laborboy (hier Holzklotz) 1 Porzellanschale 1 Analysetrichter 1 Gaswaschflasche 1 Wasserstrahlpumpe 1 Gummischlauch
Gruppe 01: Elementarnachweis: Kohlenstoff- und Wasserstoffnachweis
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 01: Elementarnachweis: Kohlenstoff- und Wasserstoffnachweis Reaktion:
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 01: Elementarnachweis: Kohlenstoff- und Wasserstoffnachweis Reaktion:
Was kannst Du (schon)? Stoffe und Eigenschaften D
 Falte zunächst das Blatt entlang des Pfeils nach hinten. Mache Dir zunächst alleine Gedanken über Deine Fähigkeiten und kreuze an. Tausche Dich im Folgenden mit Deinem Nachbar aus bzw. falte das Blatt
Falte zunächst das Blatt entlang des Pfeils nach hinten. Mache Dir zunächst alleine Gedanken über Deine Fähigkeiten und kreuze an. Tausche Dich im Folgenden mit Deinem Nachbar aus bzw. falte das Blatt
Schulinterner Lehrplan im Fach Chemie Klassenstufe 7-8
 Schulinterner Lehrplan im Fach Chemie Klassenstufe 7-8 1. Sicherheit im Chemieunterricht Angemessenes Verhalten im Fachraum Chemie Schgemäßer Umgang mit dem Gasbrenner 2. Umgang und Entsorgung von Chemikalien
Schulinterner Lehrplan im Fach Chemie Klassenstufe 7-8 1. Sicherheit im Chemieunterricht Angemessenes Verhalten im Fachraum Chemie Schgemäßer Umgang mit dem Gasbrenner 2. Umgang und Entsorgung von Chemikalien
V 1 Herstellung von Natriumchlorid
 1 V 1 Herstellung von Natriumchlorid In diesem Versuch wird Natriumchlorid, im Alltag als Kochsalz bekannt, aus den Edukten Natrium und Chlorgas hergestellt. Dieser Versuch ist eine Reaktion zwischen einem
1 V 1 Herstellung von Natriumchlorid In diesem Versuch wird Natriumchlorid, im Alltag als Kochsalz bekannt, aus den Edukten Natrium und Chlorgas hergestellt. Dieser Versuch ist eine Reaktion zwischen einem
Identifizierung der Produkte der Reaktion "Alkalimetalle + Wasser"
 Identifizierung der Produkte der Reaktion "Alkalimetalle + Wasser" a) Identifizierung des entstehenden Gases: Chemikalien: Geräte: Lithium [C] [F], Natrium [C] [F] (jeweils in Benzin mit Siedebereich 90-110
Identifizierung der Produkte der Reaktion "Alkalimetalle + Wasser" a) Identifizierung des entstehenden Gases: Chemikalien: Geräte: Lithium [C] [F], Natrium [C] [F] (jeweils in Benzin mit Siedebereich 90-110
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Übungstests Chemie im praktischen Paket
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Übungstests Chemie im praktischen Paket Das komplette Material finden Sie hier: School-Scout.de Titel: Übungstest: Atombindungen Bestellnummer:
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Übungstests Chemie im praktischen Paket Das komplette Material finden Sie hier: School-Scout.de Titel: Übungstest: Atombindungen Bestellnummer:
5. Lernstraße Chemische Reaktionen (Kl. 8/9) Vom Edukt zum Produkt eine Lernstraße zu chemischen Reaktionen
 V Chemische Reaktionen 5. Lernstraße Chemische Reaktionen (Kl. 8/9) 1 von 28 Vom Edukt zum Produkt eine Lernstraße zu chemischen Reaktionen Ein Beitrag von Edith Mallek, Buseck Mit Illustrationen von Wolfgang
V Chemische Reaktionen 5. Lernstraße Chemische Reaktionen (Kl. 8/9) 1 von 28 Vom Edukt zum Produkt eine Lernstraße zu chemischen Reaktionen Ein Beitrag von Edith Mallek, Buseck Mit Illustrationen von Wolfgang
Untersuche die ausgegebenen Stoffe auf Brennbarkeit und Schmelztemperatur.
 Naturwissenschaften - Chemie - Allgemeine Chemie - Stoffeigenschaften (P750200).2 Stoffeigenschaften - Brennbarkeit, Schmelztemperatur Experiment von: Phywe Gedruckt: 07.2.205 :7:33 intertess (Version
Naturwissenschaften - Chemie - Allgemeine Chemie - Stoffeigenschaften (P750200).2 Stoffeigenschaften - Brennbarkeit, Schmelztemperatur Experiment von: Phywe Gedruckt: 07.2.205 :7:33 intertess (Version
KSO METALLE (SEKP) Skript Metalle (SekP) V1.0 04/15 Bor
 1 KSO METALLE (SEKP) Skript Metalle (SekP) V1.0 04/15 Bor 2 INHALTSVERZEICHNIS "METALLE" 1. Einleitung...03 2. Reaktionen von Metallen... 05 3. Gewinnung von Metallen... 07 4. Domino: Eigenschaften der
1 KSO METALLE (SEKP) Skript Metalle (SekP) V1.0 04/15 Bor 2 INHALTSVERZEICHNIS "METALLE" 1. Einleitung...03 2. Reaktionen von Metallen... 05 3. Gewinnung von Metallen... 07 4. Domino: Eigenschaften der
1 Lehrerversuch Alkalimetalle in Wasser
 1 Lehrerversuch Alkalimetalle in Wasser Diese Versuchsreihe kann zum Einstieg in das Thema Alkalimetalle verwendet werden, da kein Vorwissen benötigt wird. Die Versuche sind nur gering aufwändig und können
1 Lehrerversuch Alkalimetalle in Wasser Diese Versuchsreihe kann zum Einstieg in das Thema Alkalimetalle verwendet werden, da kein Vorwissen benötigt wird. Die Versuche sind nur gering aufwändig und können
Wer spannt wem den Sauerstoff aus? Metalloxide
 1 von 24 Wer spannt wem den Sauerstoff aus? Metalloxide Ein Beitrag von Petra Frank, Tobias Frank und Dr. Hans-Peter Haseloff, Esslingen Mit Illustrationen von Julia Lenzmann, Stuttgart Foto: Colourbox
1 von 24 Wer spannt wem den Sauerstoff aus? Metalloxide Ein Beitrag von Petra Frank, Tobias Frank und Dr. Hans-Peter Haseloff, Esslingen Mit Illustrationen von Julia Lenzmann, Stuttgart Foto: Colourbox
Inhalt. Was ist Chemie? 7
 Inhalt Was ist Chemie? 7 Überall Chemie 8 Chemie Chancen und Gefahren 10 Umgang mit Chemikalien 12 Typische Tätigkeiten in der Chemie 14 Methode Regeln beim Experimentieren 15 Methode Umgang mit dem Brenner
Inhalt Was ist Chemie? 7 Überall Chemie 8 Chemie Chancen und Gefahren 10 Umgang mit Chemikalien 12 Typische Tätigkeiten in der Chemie 14 Methode Regeln beim Experimentieren 15 Methode Umgang mit dem Brenner
Energie und Energieumwandlung
 Schulversuchspraktikum Maximilian Wolf Sommersemester Klassenstufen 7 & 8 Energie und Energieumwandlung Kurzprotokoll Auf einen Blick: In Versuch 1 werden Lycopodium-Sporen (Bärlapp) in der Gasbrennerflamme
Schulversuchspraktikum Maximilian Wolf Sommersemester Klassenstufen 7 & 8 Energie und Energieumwandlung Kurzprotokoll Auf einen Blick: In Versuch 1 werden Lycopodium-Sporen (Bärlapp) in der Gasbrennerflamme
Ergänzende Hinweise Feste Reaktionsprodukte nicht in den Ausguß schütten! Vorsicht; es entsteht Knallgas!
 Dehydrierung von ** Wassergefährdend! Kupferoxid R-Sätze: 22-50/53 S-Sätze: 22-61 Wasserstoff R-Sätze: 12 S-Sätze: 9-16-33 wird in einem Rundkolben erhitzt. Die Dämpfe werden über erhitzte Kupferspäne
Dehydrierung von ** Wassergefährdend! Kupferoxid R-Sätze: 22-50/53 S-Sätze: 22-61 Wasserstoff R-Sätze: 12 S-Sätze: 9-16-33 wird in einem Rundkolben erhitzt. Die Dämpfe werden über erhitzte Kupferspäne
Nachweisreaktionen Versuche. Flüssigkeiten beim Erhitzen, Siedeverzug 12-17 20-21 28-29 32-33 128 24-25 35-42
 Klasse 5 Sicherheitsbelehrung 6-9 Hinweise auf Fluchtwege, Feuerlösch- Einrichtungen, Verhalten im Chemieraum und beim Experiment, persönliche Sicherheitsvorkehrungen, Gefahrensymbole Umgang mit dem Gasbrenner
Klasse 5 Sicherheitsbelehrung 6-9 Hinweise auf Fluchtwege, Feuerlösch- Einrichtungen, Verhalten im Chemieraum und beim Experiment, persönliche Sicherheitsvorkehrungen, Gefahrensymbole Umgang mit dem Gasbrenner
1.9 Darstellung und Eigenschaften von schwefliger Säure. Aufgabe. Welche Eigenschaften besitzt schweflige Säure?
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P757800).9 Darstellung und Eigenschaften von schwefliger Säure Experiment von: Phywe Gedruckt: 5.0.203 :43:57 intertess (Version 3.06 B200,
Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P757800).9 Darstellung und Eigenschaften von schwefliger Säure Experiment von: Phywe Gedruckt: 5.0.203 :43:57 intertess (Version 3.06 B200,
Schulinterne Lehrpläne Naturwissenschaften 7.1 Veränderungen von Stoffen/Chem. Reaktionen (Lehrwerk Prisma Naturwissenschaften 7/8)
 Schulinterne Lehrpläne Naturwissenschaften 7.1 Veränderungen von Stoffen/Chem. Reaktionen (Lehrwerk Prisma Naturwissenschaften 7/8) Unterrichtsvorhaben Kompetenz 1 Kompetenz 2 Methodische VERHALTEN IM
Schulinterne Lehrpläne Naturwissenschaften 7.1 Veränderungen von Stoffen/Chem. Reaktionen (Lehrwerk Prisma Naturwissenschaften 7/8) Unterrichtsvorhaben Kompetenz 1 Kompetenz 2 Methodische VERHALTEN IM
Schriftliche Abschlussprüfung Chemie
 Sächsisches Staatsministerium für Kultus Schuljahr 2003/2004 Geltungsbereich: für Klassen 10 an Mittelschulen Förderschulen Abendmittelschulen Schriftliche Abschlussprüfung Chemie Realschulabschluss Allgemeine
Sächsisches Staatsministerium für Kultus Schuljahr 2003/2004 Geltungsbereich: für Klassen 10 an Mittelschulen Förderschulen Abendmittelschulen Schriftliche Abschlussprüfung Chemie Realschulabschluss Allgemeine
Gasentwickler Best.- Nr. MT00476
 Gasentwickler Best.- Nr. MT00476 I. Beschreibung Dieser Aufbau kann im Schullabor als Gasentwickler für die Erzeugung von geringen Gasmengen eingesetzt werden - Herstellung von Gasen aus Feststoffen (Granulat)
Gasentwickler Best.- Nr. MT00476 I. Beschreibung Dieser Aufbau kann im Schullabor als Gasentwickler für die Erzeugung von geringen Gasmengen eingesetzt werden - Herstellung von Gasen aus Feststoffen (Granulat)
Die chemische Reaktion
 Die chemische Reaktion 1. Versuch In eine mit Sauerstoff gefüllte Flasche halten wir ein Stück brennenden Schwefel. Beobachtung : Der gelbe Schwefel verbrennt mit blauer Flamme. Dabei wird Wärme frei und
Die chemische Reaktion 1. Versuch In eine mit Sauerstoff gefüllte Flasche halten wir ein Stück brennenden Schwefel. Beobachtung : Der gelbe Schwefel verbrennt mit blauer Flamme. Dabei wird Wärme frei und
Suche aus dem Schulbuch folgende Eigenschaften der beiden Metalle heraus:
 Kopiervorlage 1: Eisen und Aluminium 1. Suche aus dem Schulbuch folgende Eigenschaften der beiden Metalle heraus: Eisen Aluminium Dichte Härte Schmelzpunkt Magnetisierbarkeit 2. a) Berechne die Eisenmasse
Kopiervorlage 1: Eisen und Aluminium 1. Suche aus dem Schulbuch folgende Eigenschaften der beiden Metalle heraus: Eisen Aluminium Dichte Härte Schmelzpunkt Magnetisierbarkeit 2. a) Berechne die Eisenmasse
Jeder Gegenstand Stoff Jeder Stoff Eigenschaften
 Stoffe Jeder Gegenstand der Welt, die euch umgibt, besteht aus einem chemischen Stoff. Jeder Stoff hat ganz spezielle Eigenschaften, die bestimmen, wie er verwendet wird. Die Chemie hat die Aufgabe die
Stoffe Jeder Gegenstand der Welt, die euch umgibt, besteht aus einem chemischen Stoff. Jeder Stoff hat ganz spezielle Eigenschaften, die bestimmen, wie er verwendet wird. Die Chemie hat die Aufgabe die
Sauerstoff herstellen Versuchsvariante Thomas Seilnacht Geräte 2 Stative, Brenner, Spatel, Holzspan, Kolbenprober 100ml
 1 Sauerstoff herstellen Versuchsvariante Thomas Seilnacht Geräte 2 Stative, Brenner, Spatel, Holzspan, Kolbenprober 100ml RG klein d=20mm, RG groß d=30mm, Stopfen klein durchbohrt Stoffe Kaliumpermanganat
1 Sauerstoff herstellen Versuchsvariante Thomas Seilnacht Geräte 2 Stative, Brenner, Spatel, Holzspan, Kolbenprober 100ml RG klein d=20mm, RG groß d=30mm, Stopfen klein durchbohrt Stoffe Kaliumpermanganat
Inhalt. Was ist Chemie? 11
 Inhalt Was ist Chemie? 11 Überall Chemie 12 Chemie Chancen und Gefahren* 14 Umgang mit Chemikalien 16 Typische Tätigkeiten in der Chemie 18 Methode Regeln beim Experimentieren 19 Methode Umgang mit dem
Inhalt Was ist Chemie? 11 Überall Chemie 12 Chemie Chancen und Gefahren* 14 Umgang mit Chemikalien 16 Typische Tätigkeiten in der Chemie 18 Methode Regeln beim Experimentieren 19 Methode Umgang mit dem
Stoffverteilungsplan mit Kompetenzzuordnung Vorlage für die Erstellung eines Schulcurriculums für die Klasse 7/8 Elemente Chemie 7/8
 Stoffverteilungsplan mit Kompetenzzuordnung ISBN: 978-3-12-756332-0 Vorlage für die Erstellung eines Schulcurriculums für die Klasse 7/8 Version: 01.12.2017 Elemente Chemie 7/8 Niedersachsen G9 Schule:
Stoffverteilungsplan mit Kompetenzzuordnung ISBN: 978-3-12-756332-0 Vorlage für die Erstellung eines Schulcurriculums für die Klasse 7/8 Version: 01.12.2017 Elemente Chemie 7/8 Niedersachsen G9 Schule:
Entscheide bei jeder Aussage, ob es eine reine Beobachtung ist oder nicht, und kreuze an!
 Kerze Eine brennende Kerze wandelt Energie und Stoffe um. N_9d_44 Über eine brennende Rechaudkerze (Teelicht) wird ein «leeres» Glas gestülpt. Schülerinnen und Schüler notieren Aussagen zum Versuch. Entscheide
Kerze Eine brennende Kerze wandelt Energie und Stoffe um. N_9d_44 Über eine brennende Rechaudkerze (Teelicht) wird ein «leeres» Glas gestülpt. Schülerinnen und Schüler notieren Aussagen zum Versuch. Entscheide
Wovon hängt das Reaktionsverhalten der Metalle beim Erhitzen an Luft ab?
 Naturwissenschaften - Chemie - Anorganische Chemie - Metalle (P75300).2 Abhängigkeit des Reaktionsverhaltens von Metallen Experiment von: Phywe Gedruckt:.0.203 5:7:52 intertess (Version 3.06 B200, Export
Naturwissenschaften - Chemie - Anorganische Chemie - Metalle (P75300).2 Abhängigkeit des Reaktionsverhaltens von Metallen Experiment von: Phywe Gedruckt:.0.203 5:7:52 intertess (Version 3.06 B200, Export
man sagt : Phosphor + Sauerstoff reagieren Tetraphosphorzu dekaoxid
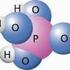 Die Luft 1.Versuch Wir entzünden eine Kerze und stülpen ein Becherglas darüber. Beobachtung : Nach kurzer Zeit erlischt die Flamme. Feststellung : Für die Verbrennung in unserer Umwelt ist Luft notwendig.
Die Luft 1.Versuch Wir entzünden eine Kerze und stülpen ein Becherglas darüber. Beobachtung : Nach kurzer Zeit erlischt die Flamme. Feststellung : Für die Verbrennung in unserer Umwelt ist Luft notwendig.
Jahrgangsstufe 7. Lehrplan. Inhaltsfelder. Bemerkungen Schwerpunkt/Kompetenzen. Zeit. Speisen u. Getränke. Stoffe und Stoffverändungen
 Jahrgangsstufe 7 Speisen u. Getränke Stoffe und Stoffverändungen Was ist Chemie? Wir untersuchen Lebensmittel auf Bestandteile. Wir gewinnen Stoffe aus Lebensmitteln. Wir verändern Nahrungsmittel durch
Jahrgangsstufe 7 Speisen u. Getränke Stoffe und Stoffverändungen Was ist Chemie? Wir untersuchen Lebensmittel auf Bestandteile. Wir gewinnen Stoffe aus Lebensmitteln. Wir verändern Nahrungsmittel durch
Fachkompetenzen Prozessbezogene Kompetenzen
 Blatt 1 Blatt 2 1. Chemie eine Naturwissenschaft Merkmale chemischer Reaktionen Sicherheitsunterweisung Gefahrstoffe und Gefahrenpiktogramme Arbeitsgeräte 2. Stoffteilchenmodell und Aggregatzustände Stoffteilchenmodell
Blatt 1 Blatt 2 1. Chemie eine Naturwissenschaft Merkmale chemischer Reaktionen Sicherheitsunterweisung Gefahrstoffe und Gefahrenpiktogramme Arbeitsgeräte 2. Stoffteilchenmodell und Aggregatzustände Stoffteilchenmodell
Stoffverteilungsplan. 0 1 Sicherheit im Chemieunterricht (S )
 Stoffverteilungsplan Bildungsplan 2016 für die Sekundarstufe I in Baden-Württemberg PRISMA Chemie 7/8, Baden-Württemberg Band Chemie für die Klasse 7/8 Klettbuch ISBN 978-3-12-068871-6 Schule: Lehrer:
Stoffverteilungsplan Bildungsplan 2016 für die Sekundarstufe I in Baden-Württemberg PRISMA Chemie 7/8, Baden-Württemberg Band Chemie für die Klasse 7/8 Klettbuch ISBN 978-3-12-068871-6 Schule: Lehrer:
Herstellung und Eigenschaften von Kalkwasser (Magnesiumhydroxidlösung) (Artikelnr.: P )
 Lehrer-/Dozentenblatt Herstellung und Eigenschaften von Kalkwasser (Magnesiumhydroxidlösung) (Artikelnr.: P7158900) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema:
Lehrer-/Dozentenblatt Herstellung und Eigenschaften von Kalkwasser (Magnesiumhydroxidlösung) (Artikelnr.: P7158900) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema:
Von Arrhenius zu Brönsted
 Schulversuchspraktikum Name Annika Münch Sommersemester 2015 Klassenstufen 9/10 Von Arrhenius zu Brönsted Kurzprotokoll Auf einen Blick: Für die Unterrichtseinheit zum Themas Säure-Base-Konzepte und im
Schulversuchspraktikum Name Annika Münch Sommersemester 2015 Klassenstufen 9/10 Von Arrhenius zu Brönsted Kurzprotokoll Auf einen Blick: Für die Unterrichtseinheit zum Themas Säure-Base-Konzepte und im
Sauerstoff herstellen Versuchsvariante Thomas Seilnacht Geräte 2 Stative, Brenner, Spatel, Holzspan, Kolbenprober 100ml
 1 Sauerstoff herstellen Versuchsvariante Thomas Seilnacht Geräte 2 Stative, Brenner, Spatel, Holzspan, Kolbenprober 100ml RG klein d=20mm, RG groß d=30mm, Stopfen klein durchbohrt Stoffe Kaliumpermanganat
1 Sauerstoff herstellen Versuchsvariante Thomas Seilnacht Geräte 2 Stative, Brenner, Spatel, Holzspan, Kolbenprober 100ml RG klein d=20mm, RG groß d=30mm, Stopfen klein durchbohrt Stoffe Kaliumpermanganat
Anhand welcher Eigenschaften lässt sich Wasserstoff identifizieren?
 Naturwissenschaften - Chemie - Allgemeine Chemie - 5 Nachweisreaktionen (P75500) 5.2 Nachweis von Wasserstoff Experiment von: Phywe Gedruckt:.0.203 3:02:34 intertess (Version 3.06 B200, Export 2000) Aufgabe
Naturwissenschaften - Chemie - Allgemeine Chemie - 5 Nachweisreaktionen (P75500) 5.2 Nachweis von Wasserstoff Experiment von: Phywe Gedruckt:.0.203 3:02:34 intertess (Version 3.06 B200, Export 2000) Aufgabe
1.3. Fragen zu chemischen Reaktionen
 1.3. Fragen zu chemischen Reaktionen Reaktionsgleichungen Ergänze die fehlenden Koeffizienten: a) PbI 4 PbI 2 + I 2 b) PbO 2 PbO + O 2 c) CO + O 2 CO 2 d) SO 2 + O 2 SO 3 e) N 2 + H 2 NH 3 f) N 2 + O 2
1.3. Fragen zu chemischen Reaktionen Reaktionsgleichungen Ergänze die fehlenden Koeffizienten: a) PbI 4 PbI 2 + I 2 b) PbO 2 PbO + O 2 c) CO + O 2 CO 2 d) SO 2 + O 2 SO 3 e) N 2 + H 2 NH 3 f) N 2 + O 2
Bildung und Eigenschaften von Nichtmetalloxiden
 Problem: Bildung und Eigenschaften von Nichtmetalloxiden a) Umsetzung von Phosphor mit Sauerstoff: Phosphor (rot) [F], Sauerstoff [O] 250ml-Schraubdeckelglas, Verbrennungslöffel, Bierdeckel, Spatel, Gasbrenner,
Problem: Bildung und Eigenschaften von Nichtmetalloxiden a) Umsetzung von Phosphor mit Sauerstoff: Phosphor (rot) [F], Sauerstoff [O] 250ml-Schraubdeckelglas, Verbrennungslöffel, Bierdeckel, Spatel, Gasbrenner,
1.1 Stoffeigenschaften - Härte, Farbe, Magnetisierbarkeit, Wasserlöslichkeit. Aufgabe. Wie lassen sich Stoffe unterscheiden? (1)
 Naturwissenschaften - Chemie - Allgemeine Chemie - 1 Stoffeigenschaften (P7150100) 1.1 Stoffeigenschaften - Härte, Farbe, Magnetisierbarkeit, Wasserlöslichkeit Experiment von: Phywe Gedruckt: 07.12.2015
Naturwissenschaften - Chemie - Allgemeine Chemie - 1 Stoffeigenschaften (P7150100) 1.1 Stoffeigenschaften - Härte, Farbe, Magnetisierbarkeit, Wasserlöslichkeit Experiment von: Phywe Gedruckt: 07.12.2015
Inhalt. Stoffe lassen sich ordnen - Elementfamilien. Der Bau der Atome. Kopiervorlagen. Kopiervorlagen. 0 Materialien zur Sprachbildung. aufgeführt.
 Inhalt 0 Materialien zur Sprachbildung Sofern sich die in eine besondere Rubrik einordnen lassen, ist dies jeweils aufgeführt. Stoffe lassen sich ordnen - Elementfamilien Diagnosebogen I - Selbsteinschätzung
Inhalt 0 Materialien zur Sprachbildung Sofern sich die in eine besondere Rubrik einordnen lassen, ist dies jeweils aufgeführt. Stoffe lassen sich ordnen - Elementfamilien Diagnosebogen I - Selbsteinschätzung
Reaktion von Metallen und Nichtmetallen mit Sauerstoff
 Schulversuchspraktikum Sommersemester 2016 Klassenstufen 7 & 8 Reaktion von Metallen und Nichtmetallen mit Sauerstoff Auf einen Blick: Das Protokoll,,Reaktion von Metall und Nichtmetall mit Sauerstoff
Schulversuchspraktikum Sommersemester 2016 Klassenstufen 7 & 8 Reaktion von Metallen und Nichtmetallen mit Sauerstoff Auf einen Blick: Das Protokoll,,Reaktion von Metall und Nichtmetall mit Sauerstoff
Versuch: Qualitativer Nachweis von Kohlenstoff und Wasserstoff
 Philipps-Universität Marburg 20.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 1, Einführung in die OC Versuch: Qualitativer Nachweis
Philipps-Universität Marburg 20.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 1, Einführung in die OC Versuch: Qualitativer Nachweis
Vorschlag für einen Jahresplan NWA/Chemie-Unterricht im 4. und 5. Jahr mit dem Unterrichtswerk PRISMA NWA/Chemie 4/5
 Vorschlag für einen Jahresplan Chemie-Unterricht im 4. und 5. Jahr mit dem Unterrichtswerk PRISMA Zu Grunde gelegt wird ein Chemie-Unterricht mit zwei Wochenstunden Monat 8-11 8 / 9 10 / 11 September Das
Vorschlag für einen Jahresplan Chemie-Unterricht im 4. und 5. Jahr mit dem Unterrichtswerk PRISMA Zu Grunde gelegt wird ein Chemie-Unterricht mit zwei Wochenstunden Monat 8-11 8 / 9 10 / 11 September Das
Untersuche die ausgegebenen Stoffe auf Brennbarkeit und Schmelztemperatur.
 Naturwissenschaften - Chemie - Allgemeine Chemie - Stoffeigenschaften (P750200).2 Stoffeigenschaften - Brennbarkeit, Schmelztemperatur Experiment von: Phywe Gedruckt:.0.203 2:44:57 intertess (Version 3.06
Naturwissenschaften - Chemie - Allgemeine Chemie - Stoffeigenschaften (P750200).2 Stoffeigenschaften - Brennbarkeit, Schmelztemperatur Experiment von: Phywe Gedruckt:.0.203 2:44:57 intertess (Version 3.06
Analyse und Synthese von Wasser
 Analyse und Synthese von Wasser Kurzbeschreibung: Wasser ist kein Element, sondern eine chemische Verbindung. Durch die Zerlegung von Wasser in die einzelnen Bestandteile und die Herstellung von Wasser
Analyse und Synthese von Wasser Kurzbeschreibung: Wasser ist kein Element, sondern eine chemische Verbindung. Durch die Zerlegung von Wasser in die einzelnen Bestandteile und die Herstellung von Wasser
RAHMENRICHTLINIEN SEKUNDARSCHULE CHEMIE KULTUSMINISTERIUM. Schuljahrgänge 7 10
 RAHMENRICHTLINIEN SEKUNDARSCHULE (Ergänzung der RRL Sekundarschule Schuljahrgänge 7 10 in Umsetzung der Bildungsstandards für das Fach Chemie für den Mittleren Schulabschluss) CHEMIE Schuljahrgänge 7 10
RAHMENRICHTLINIEN SEKUNDARSCHULE (Ergänzung der RRL Sekundarschule Schuljahrgänge 7 10 in Umsetzung der Bildungsstandards für das Fach Chemie für den Mittleren Schulabschluss) CHEMIE Schuljahrgänge 7 10
Schriftliche Abschlussprüfung Chemie
 Sächsisches Staatsministerium für Kultus Schuljahr 1999/ Geltungsbereich: für Klassen 10 an - Mittelschulen - Förderschulen - Abendmittelschulen Schriftliche Abschlussprüfung Chemie Realschulabschluss
Sächsisches Staatsministerium für Kultus Schuljahr 1999/ Geltungsbereich: für Klassen 10 an - Mittelschulen - Förderschulen - Abendmittelschulen Schriftliche Abschlussprüfung Chemie Realschulabschluss
Stoffverteilungsplan Lehrplan für den Erwerb des Hauptschul- und des Realschulabschlusses (Regelschule) in Thüringen 2012 PRISMA Chemie Thüringen
 Stoffverteilungsplan Lehrplan für den Erwerb des Hauptschul- und des Realschulabschlusses (Regelschule) in Thüringen 2012 PRISMA Chemie Thüringen Band 9/10 Schule: Klett 978-3-12-068567-8 Lehrer/Lehrerin:
Stoffverteilungsplan Lehrplan für den Erwerb des Hauptschul- und des Realschulabschlusses (Regelschule) in Thüringen 2012 PRISMA Chemie Thüringen Band 9/10 Schule: Klett 978-3-12-068567-8 Lehrer/Lehrerin:
STICKOXIDE. Braunes Giftgas
 STICKOXIDE Braunes Giftgas Stativmaterial Standzylinder, Deckglas Brenner Reagenzglas, gebohrter Stopfen Winkelrohr Spatel weißes Papier Aktivkohle, Blei(II)-nitrat, Glycerin Baue das Experiment nach Abbildung
STICKOXIDE Braunes Giftgas Stativmaterial Standzylinder, Deckglas Brenner Reagenzglas, gebohrter Stopfen Winkelrohr Spatel weißes Papier Aktivkohle, Blei(II)-nitrat, Glycerin Baue das Experiment nach Abbildung
Chemie Chemie - Klasse 8 - Version 1 (Juli 2004)
 Fehler! Kein Text mit angegebener Formatvorlage im Dokument. - Chemie Chemie Chemie - Klasse 8 - Version 1 (Juli 2004) Themenfeld Kerncurriculum
Fehler! Kein Text mit angegebener Formatvorlage im Dokument. - Chemie Chemie Chemie - Klasse 8 - Version 1 (Juli 2004) Themenfeld Kerncurriculum
Die Brandbekämpfung (Gruppenversuche)
 Die Brandbekämpfung (Gruppenversuche) Führt die folgenden Versuche nacheinander durch. Lest die Versuchsbeschreibungen (Kopie) genau durch und klebt sie sofort in eure Haushefte ein. Notiert mit Bleistift
Die Brandbekämpfung (Gruppenversuche) Führt die folgenden Versuche nacheinander durch. Lest die Versuchsbeschreibungen (Kopie) genau durch und klebt sie sofort in eure Haushefte ein. Notiert mit Bleistift
Saure, neutrale und alkalische Lösungen
 Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 5 und 6 einen Lehrerversuch
Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 5 und 6 einen Lehrerversuch
1 Verbrennung und Sauerstoff
 1 Verbrennung und Sauerstoff 1.1 Feuer und Flamme 1.2 Ein Feuer entsteht 1.3 Lagerfeuer Unterrichtsidee Unterrichtsphase Methoden und Materialien Leitfrage Erarbeitung Sicherung Hausaufgabe Unterrichtsziele
1 Verbrennung und Sauerstoff 1.1 Feuer und Flamme 1.2 Ein Feuer entsteht 1.3 Lagerfeuer Unterrichtsidee Unterrichtsphase Methoden und Materialien Leitfrage Erarbeitung Sicherung Hausaufgabe Unterrichtsziele
