- Grundlagen der Elektrotechnik I
|
|
|
- Helga Baumgartner
- vor 7 Jahren
- Abrufe
Transkript
1 - Grundlagen der Elektrotechnik I Physikalische Grundbegriffe 1.1 Aufbau der Materie, positive und negative Ladungen Aufbau der Materie: Alle Stoffe sind aus Atomen aufgebaut, die man zunächst als nicht weiter aufteilbare und nichtumwandelbare kleinste Einheiten der Materie betrachtet. Aufbau der Atome: Vereinfacht man das heute von der Physik (Atomphysik, Kernphysik) angebotene Atombild soweit, wie es im Rahmen dieser Vorlesung zulässig ist, kann man sich den Aufbau der Atome folgendermaßen vorstellen: Sie bestehen aus einem Kern, der aus Neutronen und Protonen aufgebaut ist, und aus einer Hülle, die aus um den Kern kreisenden Elektronen besteht. Diese Beschreibung ist der Grundgedanke des Bohrschen Atommodells. Beispiele: e e p n p p n e Wasserstoffatom ( H ) Heliumatom ( He ) Die verschiedenen chemischen Elemente unterscheiden sich durch die Anzahl der Protonen in ihrern Atomkernen. Isotope des gleichen Elements haben gleiche Protonenzahl, aber unterschiedliche Neutronenzahl. Die Anzahl der Elektronen in der Hülle ist stets gleich der Anzahl der Protonen im Kern, da Atome elektrisch neutral sind.
2 - Grundlagen der Elektrotechnik I Eigenschaften: 5/99 Neutron n : Masse m 1, n = kg elektrisch neutral Proton p : Masse m 1, p = kg elektrisch positiv geladen, Ladung Q 1, P = C ( C steht für Coulomb und ist die Einheit der elektrischen Ladung ) Elektron e : Masse m 9, e = kg elektrisch negativ geladen, Ladung Q 1, e = C. Weitere Teilchen des Kerns: Positron (Antielektron), Antiproton usw. Energieniveaus eines freien Einzelatoms: Die Elektronen können den Atomkern nur auf ganz bestimmten Bahnen umkreisen. Auf jeder Bahn haben die Elektronen eine bahntypische Gesamtenergie, die sich aus kinetischer und potentieller Energie zusammensetzt. In Kernnähe ist die Energie am kleinsten. Die Platzzahl (Hauptquantenzahl) für jede Bahn wächst mit der Wurzel der Energie des betreffenden Niveaus. W W 4 W 3 W W 1 diskrete Energieniveaus des Elektrons in der Atomhülle Durch äußere Energiezufuhr können Elektronen auf höhere Energieniveaus angehoben werden. allen Elektronen von höheren in tiefere Energieniveaus zurück, so wird ein Lichtquant mit der Energie h ν emittiert, die gleich der Differenz der beiden Energieniveaus ist, wobei h = 6, Js das Plancksche Wirkungsquantum und ν die requenz ist.
3 - Grundlagen der Elektrotechnik I Valenzelektronen: Elektronen auf der äußersten Bahn des Atoms. Sie bestimmen die Wertigkeit des Elements und viele chemische Eigenschaften. Elementarladung: Die kleinste in der Natur auftretende positive oder negative Ladung ist die Ladung des Protons bzw. des Elektrons. Kleinere Ladungsmengen gibt es in der Natur nicht. Die Elementarladung ist 19 ± e = ± 1, C. Elektrisch neutraler Körper: Ein elektrisch neutraler Körper hat gleich viele Elektronen und Protonen. Ein Wasserstoffatom oder ein wasserstofferfüllter Raum ist z.b. ein elektrisch neutraler Körper. Elektrisch geladener Körper: Ein elektrisch positiv geladener Körper hat mehr Protonen als Elektronen. Ein elektrisch negativ geladener Körper hat mehr Elektronen als Protonen. Der Kern eines Wasserstoffatoms ist z.b. ein elektrisch positiv geladener Körper. 1. Elektrostatische Kraft In 1.1 wurden elektrisch neutrale, elektrisch positiv sowie elektrisch negativ geladene Körper eingeführt. Es soll nun erklärt werden, wodurch sich elektrisch geladene von elektrisch neutralen Körpern im Verhalten unterscheiden. Aus Naturbeobachtungen weiß man, daß zwischen elektrisch geladenen Körpern Kraftwirkungen auftreten. Gleichnamig geladene Körper stoßen einander ab, ungleichnamig geladene Körper ziehen einander an. Diese Kraftwirkung bietet die Möglichkeit, elektrische Ladungen und deren Polarität festzustellen pos. geladener Körper neg. geladener Körper
4 - Grundlagen der Elektrotechnik I Coulombsches Gesetz: Die Kraft zwischen zwei geladenen Körpern ist proportional zu deren Ladungen Q 1 und Q und umgekehrt proportional zum Quadrat r ihrer Entfernung. Dieses Gesetz gilt nur dann exakt, wenn der Abstand der Körper groß gegenüber deren Abmessungen ist. Q1Q = k1 (Coulombsches Gesetz). (1..1) r Proportionalitätsfaktor k 1 1 = πεo εr Einheiten: [ ] = N (Newton), [Q 1/ ] = C (Coulomb), [ r ] = m (Meter). 9 Nm C 1 Vakuum mit ε r =1 Somit im Vakuum ( Q C) ( Q C) N ( r m). (1..) Anmerkung zur Analogie zur Gravitationskraft: Zwischen zwei Körpern mit den Massen M 1 und M im Abstand r wirkt die Gravitationskraft M M = γ 1 G r Proportionalitätsfaktor. 3 m γ = 6, kgs Einheiten: [ ] = N (Newton), [M 1/ ] = kg (Kilogramm), [ r ] = m (Meter). 1 ür die Konstanten in der Darstellung von k 1 gilt 1 As ε 0 = 8, ist die Dielektrizitätskonstante des Vakuums, Vm ε r die Dielekrizitätszahl.
5 - Grundlagen der Elektrotechnik I Beispiel: Vergleich von elektrostatischer Kraft und Gravitationskraft zwischen zwei Elektronen im Abstand r=1 mm. Berechnung der elektrostatischen Abstoßungskraft: C Q 1 = Q r = 10 3 = 1, m, 19 C, 19 9 (1, C C) N = (10 m m) = ,1 =, Bestimmung der Gravitationskraft, die die Elektronen aufeinander ausüben: G G G M1M = γ r N = 6,67 10 N = 6,67 10, γ = 6,67 10 (M 1 (9,1 10 (10 kg M (r 3 ) m) 31 ) 11 m kgs kg), 3, = 5,
6 - Grundlagen der Elektrotechnik I Leiter, Halbleiter und Nichtleiter Alle Stoffe enthalten als wesentliche Grundbestandteile ihrer Atome bzw. Moleküle u.a. Elektronen und Protonen und damit negative und positive Ladungsträger. Die verschiedenen Stoffe unterscheiden sich dadurch, daß die Ladungsträger mehr oder weniger beweglich sind. Stoffe, in denen Ladungsträger praktisch nicht frei beweglich sind, heißen Nichtleiter oder Isolatoren. Stoffe, in denen ein Teil der Ladungsträger sehr gut frei beweglich ist, heißen Leiter. este Stoffe: Zum Erklären des Leitungsmechanismus in estkörpern ist das Bändermodell geeignet. Anstelle der diskreten zulässigen Energieniveaus des Einzelatoms treten durch Überlagerung der Einzelpotentialtöpfe der Atome in einem estkörper (und damit durch gegenseitige Beeinflussung) zulässige Energiebänder auf (gekoppelte Schwingungen). ür T= 0 K (absoluter Nullpunkt) wird die Verteilung der Elektronen für verschiedene Stoffarten betrachtet. Dabei gelte zulässiges nächstes Band (ohne Elektronen). höchstes mit Elektronen besetztes Band (Valenzband), 1. Metalle: } Leitungsband Das Valenzband ist nicht voll besetzt, z.b. Cu, Ag, Au, Pt. oder } Leitungsband Das Valenzband ist voll besetzt, das nächste Band überlappt. Beispiele für diesen all sind e, Cr, Sn, Zn, Ni. Die Elektronen können Energie aufnehmen und in einem freien Teil des Bandes durch ihre Bewegung einen Strom darstellen.
7 - Grundlagen der Elektrotechnik I Halbleiter: Leitungsband } U < V verbotenes Band Je größer U, desto weniger Elektronen gelingt es bei äußerer Energiezufuhr, in das Leitungsband zu kommen (Eigenleitung). Jedem Elektron im Leitungsband ist ein Loch im Valenzband zugeordnet. Beispiele für Elemente mit diesen Eigenschaften sind Ge, Si, Se. Bei Silizium beträgt U 1,1 V. 3. Isolatoren: U > V } Leitungsband verbotenes Band U ist so groß, daß es den Elektronen trotz unbeschränkter äußerer Energiezufuhr fast unmöglich wird, in das Leitungsband zu gelangen. Daher leiten diese Stoffe (fast) keinen elektrischen Strom. Als Beispiele seien Quarz oder Diamant genannt. Bei Diamant gilt U 7 V.
8 - Grundlagen der Elektrotechnik I Dotierte Halbleiter: 5/99 1. Beispiel für n-halbleiter: Si-Atom (4-wertig) - As-Atom In das Kristallgitter des vierwertigen Siliziums (4 Elektronen auf der äußersten Elektronenhülle) werden fünfwertige Atome (5 Elektronen auf der äußersten Elektronenhülle) eingebaut, z.b. Arsen (As), Antimon (Sb) oder Phosphor (P). Sie wirken als Elektronendonatoren (spenden Elektronen). Dadurch entstehen praktisch ungebundene, bewegliche Elektronen. Die freien Ladungsträger sind Elektronen. Die Wirkung des Donators läßt sich am folgenden Energieschema erläutern: - überschüssiges As-Elektron - 0,01 V Donatorniveau Leitungsband Valenzband Das überschüssige Donatorelektron ist nicht sehr fest an sein Atom (hier As) gebunden und kann mit sehr geringer Energiezufuhr (z.b. thermische Energie bei Zimmertemperatur) in das Leitungsband gehoben werden.
9 - Grundlagen der Elektrotechnik I Beispiel für p-halbleiter: 5/99 Si-Atom (4-wertig) In-Atom In das Kristallgitter des vierwertigen Siliziums werden dreiwertige Atome eingebaut, z.b. Gallium (Ga), Indium (In), Aluminium (Al) oder Bor (B). Sie dienen als Elektronenakzeptoren (fangen Elektronen ein). Dadurch entsteht eine Elektronen-ehlstelle ( Loch, Defektelektron). Dieses wirkt wie ein positiver freier Ladungsträger. Die Wirkung von Akzeptoren läßt sich wiederum am Energieschema darstellen: durch Elektronenübergang entstandenes Defektelektron Leitungsband Akzeptorniveau Valenzband Geringe thermische Energie genügt, um ein Elektron aus dem Valenzband des Siliziums zu lösen und die Elektronenfehlstelle des In-Atoms, d.h. das Akzeptorniveau zu besetzen, wobei ein Loch (Defektelektron) im Valenzband des Siliziums entsteht. Dieses Loch wirkt wie ein positiver, beweglicher Ladungsträger.
10 - Grundlagen der Elektrotechnik I Dotierung: Die Dotierung erfolgt 1. beim Ziehen des Kristalls. Die Dotierstoffe werden der Kristallschmelze zugesetzt.. durch Legieren. Es werden z.b. Indium-Kügelchen auf n-ge-kristalle aufgeschmolzen. Es bildet sich p-ge (dotiert mit Indium). 3. durch diffundieren. Siliziumscheiben werden bei 1000 C einem dampfförmigen Dotierstoff, z.b. Bor, ausgesetzt. Boratome (3-wertig) diffundieren in den Si-Kristall (4-wertig) ein und erzeugen eine p-leitende Zone. 4. durch Implantieren. Ionen (aus Ionenquelle) eines gasförmigen Isolierstoffs werden im elektrischen eld beschleunigt und in den Halbleiterkristall hineingeschossen. lüssige Stoffe: In flüssigen Stoffen sind die Atome bzw. Moleküle nicht ortsgebunden. lüssige Stoffe sind Nichtleiter, wenn die Atome bzw. Moleküle nicht aufspaltbare Gebilde sind, die sich nicht in einen elektrisch positiv und einen elektrisch negativ geladenen Anteil zerlegen lassen. Beispiele für Nichtleiter: Destilliertes Wasser (die H 0-Moleküle sind elektrisch neutrale, festgefügte Einheiten, durch deren Bewegung keine Ladung transportiert werden kann), Mineralöle. lüssige Stoffe sind Leiter, wenn sich die Atome bzw. Moleküle in elektrisch entgegengesetzt geladene Teile aufspalten, die einander nicht mehr fest zugeordnet und deshalb frei beweglich sind. Dies ist vor allem bei wäßrigen Lösungen von Salzen, Säuren und Basen der all. Diese Lösungen heißen Elektrolyte. Eine andere Klasse leitender lüssigkeiten sind geschmolzene Metalle. Beispiel für Leiter: Lösung von Kochsalz (NaCl ) in Wasser. Die elektrisch neutralen Kochsalzmoleküle spalten sich in elektrisch positiv geladene und elektrisch negativ geladene Anteile auf, die unabhängig voneinander frei beweglich sind: Na Cl Na Cl.
11 - Grundlagen der Elektrotechnik I Die positiv und negativ geladenen Teile heißen Ionen. Na hat ein Elektron weniger, Cl - ein Elektron mehr, als zur elektrischen Neutralität erforderlich wäre. Aufspaltungen wie die obigen heißen Dissoziation. Gasförmige Stoffe: Gase sind im allgemeinen Nichtleiter. Unter gewissen Bedingungen ist jedoch auch bei Gasen eine Ionisierung möglich, so daß freie Elektronen und Ionen auftreten (Plasma). 1.4 Elektrische Strömung Bewegliche Ladungsträger in Leitern sind nach 1.3 Elektronen und Ionen. Die frei beweglichen Ladungsträger eines Leiters befinden sich bei Temperaturen oberhalb des absoluten Nullpunkts in dauernder ungeordneter Bewegung. Es ist deshalb zunächst kein gerichteter Ladungstransport festzustellen. Bei Leitern kann man erreichen, daß alle beweglichen Ladungsträger positiver Ladung in der einen, negativer Ladung in der entgegengesetzten Richtung wandern. Dieses gerichtete Wandern bezeichnet man als elektrische Strömung bzw. als elektrischen Strom. Ursache des elektrischen Stroms ist eine gerichtete Kraftwirkung auf die Ladungsträger. Elektronenströme: Bei Elektronenströmen hat man gerichteten Ladungstransport durch Elektronen. Elektronenströme existieren u.a. in Metallen. Sie fließen praktisch ohne Materietransport und ändern die chemischen Eigenschaften des durchströmten Körpers nicht. Ionenströme: Bei Ionenströmen hat man gerichteten Ladungstransport durch Ionen. Ionenströme existieren u.a. in Elektrolyten. Sie sind mit merklichem Materietransport verbunden und können die chemischen Eigenschaften des durchströmten Körpers verändern (Elektrolyse).
12 - Grundlagen der Elektrotechnik I Stromsymbol: ür den Strom verwendet man im allgemeinen das Symbol I, das an "Intensität" erinnert. Beispiel: Eine wässrige Lösung von CuSO 4 wird betrachtet. I I Elektronen Anode Kathode Elektronen Cu Cu SO Cu I Primärreaktion: CuS 0 Cu { SO 4 4 Kation 13 Anion Sekundärreaktion: SO 4 verbindet sich mit Anodenkupfer zu neuen CuSO 4, das in Lösung geht.
13 - Grundlagen der Elektrotechnik I Technische Stromrichtung: Ein Körper soll durch einen Strom über einen Leiter positiv oder negativ aufgeladen werden. Hierbei gibt es folgende Möglichkeiten: - Elektronen oder negative Ionen positive Ionen Körper POSITIVE AULADUNG Leiter NEGATIVE AULADUNG techn. Stromrichtung techn. Stromrichtung techn. Stromrichtung techn. Stromrichtung techn. Stromrichtung techn. Stromrichtung Die technische Stromrichtung ist definitionsgemäß gleich der Wanderungsrichtung der positiven Ladungsträger und entgegengesetzt gleich der Wanderungrichtung der negativen Ladungsträger. Einheit der Stromstärke: Die Einheit der elektrischen Stromstärke ist das Ampère (A), siehe.3.
14 - Grundlagen der Elektrotechnik I Elektromagnetische Kraft Zwischen stromdurchflossenen Leitern treten Kraftwirkungen auf. In entgegengesetzter Richtung von den Strömen I 1 bzw. I durchflossene parallele Leiter stoßen einander ab, in gleicher Richtung durchflossene parallele Leiter ziehen einander an. Hieraus ergibt sich eine Möglichkeit, elektrische Ströme und deren Richtung festzustellen. ANZIEHUNG l I 1 I ABSTOßUNG I 1 I I 1 I I 1 I
15 - Grundlagen der Elektrotechnik I Größe der Kraftwirkung: 5/99 Nimmt man zwei unendlich lange parallele Leiter an, so erhält man für die Kraft zwischen diesen einen einfachen Ausdruck. Die Kraft zwischen zwei parallelen, von den Strömen I 1 bzw. I durchflossenen Leiterabschnitten der Länge l ist proportional zum Produkt I 1 I der Ströme, zur Länge l und umgekehrt proportional zur Entfernung δ. I1 I l = k δ. (1.5.1) Proportionalitätsfaktor 7 k = 10 N A (im Vakuum; ergibt sich aus Naturbeobachtung) Einheiten: [ ] = N (Newton), [ I 1/ ] = A (Ampère), [ l,δ ] = m (Meter). Somit: N = 10 7 (I 1 A)(I A)( l δ m m). (1.5.)
16 - Grundlagen der Elektrotechnik I Beispiel: Elektromagnetische Anziehungskraft zweier Leiter für den all I 1 =I =50 A, δ=0,1 m, l=0,4 m N (50A) 0,4m = 10 N A 0,1m =.
Grundlagen der Rechnertechnologie Sommersemester Vorlesung Dr.-Ing. Wolfgang Heenes
 Grundlagen der Rechnertechnologie Sommersemester 2010 5. Vorlesung Dr.-Ing. Wolfgang Heenes 18. Mai 2010 TechnischeUniversitätDarmstadt Dr.-Ing. WolfgangHeenes 1 Inhalt 1. Aufbau der Materie 2. Energiebändermodell
Grundlagen der Rechnertechnologie Sommersemester 2010 5. Vorlesung Dr.-Ing. Wolfgang Heenes 18. Mai 2010 TechnischeUniversitätDarmstadt Dr.-Ing. WolfgangHeenes 1 Inhalt 1. Aufbau der Materie 2. Energiebändermodell
Elektrizitätslehre 3.
 Elektrizitätslehre 3. Elektrischer Strom Strom = geordnete Bewegung der Ladungsträgern Ladungsträgern: Elektronen Ionen Strom im Vakuum Strom im Gas Strom in Flüssigkeit (Lösung) Strom im Festkörper Leiter
Elektrizitätslehre 3. Elektrischer Strom Strom = geordnete Bewegung der Ladungsträgern Ladungsträgern: Elektronen Ionen Strom im Vakuum Strom im Gas Strom in Flüssigkeit (Lösung) Strom im Festkörper Leiter
Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde. Sommersemester 2007
 Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde Sommersemester 2007 VL #35 am 28.06.2007 Vladimir Dyakonov Leitungsmechanismen Ladungstransport in Festkörpern Ladungsträger
Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde Sommersemester 2007 VL #35 am 28.06.2007 Vladimir Dyakonov Leitungsmechanismen Ladungstransport in Festkörpern Ladungsträger
Gleichstromtechnik. Vorlesung 3: Ladung und elektrischer Strom. Fakultät für Elektro- und Informationstechnik, Manfred Strohrmann
 Gleichstromtechnik Vorlesung 3: Ladung und elektrischer Strom Fakultät für Elektro und Informationstechnik, Manfred Strohrmann Leiter, Halbleiter und Isolatoren Unterschiedliche Stoffe können elektrischen
Gleichstromtechnik Vorlesung 3: Ladung und elektrischer Strom Fakultät für Elektro und Informationstechnik, Manfred Strohrmann Leiter, Halbleiter und Isolatoren Unterschiedliche Stoffe können elektrischen
An welche Stichwörter von der letzten Vorlesung können Sie sich noch erinnern?
 An welche Stichwörter von der letzten Vorlesung können Sie sich noch erinnern? Entropieänderung f S = Sf Si = i dq T Der zweite Hauptsatz der Thermodynamik: Carnot (ideale) Wärmemaschine Carnot Kältemaschine
An welche Stichwörter von der letzten Vorlesung können Sie sich noch erinnern? Entropieänderung f S = Sf Si = i dq T Der zweite Hauptsatz der Thermodynamik: Carnot (ideale) Wärmemaschine Carnot Kältemaschine
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Atombau und PSE. Das komplette Material finden Sie hier: School-Scout.
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Atombau und PSE Das komplette Material finden Sie hier: School-Scout.de Chemiekonzept Pro Unterrichtsreihen Sekundarstufe I Band 11
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Atombau und PSE Das komplette Material finden Sie hier: School-Scout.de Chemiekonzept Pro Unterrichtsreihen Sekundarstufe I Band 11
Atombau. Chemie. Zusammenfassungen. Prüfung Mittwoch, 14. Dezember Elektrische Ladung. Elementarteilchen. Kern und Hülle
 Chemie Atombau Zusammenfassungen Prüfung Mittwoch, 14. Dezember 2016 Elektrische Ladung Elementarteilchen Kern und Hülle Atomsorten, Nuklide, Isotope Energieniveaus und Schalenmodell Steffi Alle saliorel
Chemie Atombau Zusammenfassungen Prüfung Mittwoch, 14. Dezember 2016 Elektrische Ladung Elementarteilchen Kern und Hülle Atomsorten, Nuklide, Isotope Energieniveaus und Schalenmodell Steffi Alle saliorel
Dielektrizitätskonstante
 Dielektrizitätskonstante Spannung am geladenen Plattenkondensator sinkt, wenn nichtleitendes Dielektrikum eingeschoben wird Ladung bleibt konstant : Q = C 0 U 0 = C D U D Q + + + + + + + + + + + - - -
Dielektrizitätskonstante Spannung am geladenen Plattenkondensator sinkt, wenn nichtleitendes Dielektrikum eingeschoben wird Ladung bleibt konstant : Q = C 0 U 0 = C D U D Q + + + + + + + + + + + - - -
18. Vorlesung III. Elektrizität und Magnetismus
 18. Vorlesung III. Elektrizität und Magnetismus 17. Elektrostatik Zusammenfassung Nachtrag zur Influenz: Faraday-Käfig 18. Elektrischer Strom (in Festkörpern, Flüssigkeiten und Gasen; elektrische Stromkreise)
18. Vorlesung III. Elektrizität und Magnetismus 17. Elektrostatik Zusammenfassung Nachtrag zur Influenz: Faraday-Käfig 18. Elektrischer Strom (in Festkörpern, Flüssigkeiten und Gasen; elektrische Stromkreise)
Physikalische. Grundlagen. L. Kölling, Fw Minden
 Physikalische Grundlagen L. Kölling, Fw Minden Radioaktivität kann man weder sehen, hören, fühlen, riechen oder schmecken. Daher muss sie der FA (SB) zumindest verstehen, um im Einsatzfall die erforderlichen
Physikalische Grundlagen L. Kölling, Fw Minden Radioaktivität kann man weder sehen, hören, fühlen, riechen oder schmecken. Daher muss sie der FA (SB) zumindest verstehen, um im Einsatzfall die erforderlichen
Freie Elektronen bilden ein Elektronengas. Feste positive Aluminiumionen. Abb. 1.1: Metallbindung: Feste Atomrümpfe und freie Valenzelektronen
 1 Grundlagen 1.1 Leiter Nichtleiter Halbleiter 1.1.1 Leiter Leiter sind generell Stoffe, die die Eigenschaft haben verschiedene arten weiterzuleiten. Im Folgenden steht dabei die Leitfähigkeit des elektrischen
1 Grundlagen 1.1 Leiter Nichtleiter Halbleiter 1.1.1 Leiter Leiter sind generell Stoffe, die die Eigenschaft haben verschiedene arten weiterzuleiten. Im Folgenden steht dabei die Leitfähigkeit des elektrischen
Grundwissen. Physik. Jahrgangsstufe 7
 Grundwissen Physik Jahrgangsstufe 7 Grundwissen Physik Jahrgangsstufe 7 Seite 1 1. Aufbau der Materie 1.1 Atome Ein Atom besteht aus dem positiv geladenen Atomkern und der negativ geladenen Atomhülle aus
Grundwissen Physik Jahrgangsstufe 7 Grundwissen Physik Jahrgangsstufe 7 Seite 1 1. Aufbau der Materie 1.1 Atome Ein Atom besteht aus dem positiv geladenen Atomkern und der negativ geladenen Atomhülle aus
Wie sind Atome aufgebaut Welche Informationen enthält das Periodensystem?
 2. DIE KLEINSTEN TEILCHEN ARBEITSBLATT 2.1 DER ATOMAUFBAU FRAGE Wie sind Atome aufgebaut Welche Informationen enthält das Periodensystem? Bausteine der Atome Ladung (+, -, 0) Masse (hoch, sehr gering)
2. DIE KLEINSTEN TEILCHEN ARBEITSBLATT 2.1 DER ATOMAUFBAU FRAGE Wie sind Atome aufgebaut Welche Informationen enthält das Periodensystem? Bausteine der Atome Ladung (+, -, 0) Masse (hoch, sehr gering)
1 Leitfähigkeit in Festkörpern
 1 Leitfähigkeit in Festkörpern Elektrische Leitfähigkeit ist eine physikalische Größe, die die Fähigkeit eines Stoffes angibt, elektrischen Strom zu leiten. Bändermodell Die Leitfähigkeit verschiedener
1 Leitfähigkeit in Festkörpern Elektrische Leitfähigkeit ist eine physikalische Größe, die die Fähigkeit eines Stoffes angibt, elektrischen Strom zu leiten. Bändermodell Die Leitfähigkeit verschiedener
15. Vom Atom zum Festkörper
 15. Vom Atom zum Festkörper 15.1 Das Bohr sche Atommodell 15.2 Quantenmechanische Atommodell 15.2.1 Die Hauptquantenzahl n 15.2.2 Die Nebenquantenzahl l 15.2.3 Die Magnetquantenzahl m l 15.2.4 Die Spinquantenzahl
15. Vom Atom zum Festkörper 15.1 Das Bohr sche Atommodell 15.2 Quantenmechanische Atommodell 15.2.1 Die Hauptquantenzahl n 15.2.2 Die Nebenquantenzahl l 15.2.3 Die Magnetquantenzahl m l 15.2.4 Die Spinquantenzahl
Physikalische Grundlagen Inhalt
 Physikalische Grundlagen Inhalt Das Atommodell nach Bohr Die Gleichspannung Der Gleichstrom Der Stromfluss in Metallen Der Stromfluss in Flüssigkeiten Die Elektrolyse Die Wechselspannung Der Wechselstrom
Physikalische Grundlagen Inhalt Das Atommodell nach Bohr Die Gleichspannung Der Gleichstrom Der Stromfluss in Metallen Der Stromfluss in Flüssigkeiten Die Elektrolyse Die Wechselspannung Der Wechselstrom
2 Elektrostatik. 2.1 Coulomb-Kraft und elektrische Ladung. 2.1 Coulomb-Kraft und elektrische Ladung
 2.1 Coulomb-Kraft und elektrische Ladung 2 Elektrostatik 2.1 Coulomb-Kraft und elektrische Ladung Abb. 2.1 Durch Reiben verschiedener Stoffe aneinander verbleiben Elektronen der Atomhüllen überwiegend
2.1 Coulomb-Kraft und elektrische Ladung 2 Elektrostatik 2.1 Coulomb-Kraft und elektrische Ladung Abb. 2.1 Durch Reiben verschiedener Stoffe aneinander verbleiben Elektronen der Atomhüllen überwiegend
Die kovalente Bindung
 Die kovalente Bindung Atome, die keine abgeschlossene Elektronenschale besitzen, können über eine kovalente Bindung dieses Ziel erreichen. Beispiel: 4 H H + C H H C H H Die Wasserstoffatome erreichen damit
Die kovalente Bindung Atome, die keine abgeschlossene Elektronenschale besitzen, können über eine kovalente Bindung dieses Ziel erreichen. Beispiel: 4 H H + C H H C H H Die Wasserstoffatome erreichen damit
Spezifischer Widerstand fester Körper. Leiter Halbleiter Isolatoren. Kupferoxid
 R. Brinkmann http://brinkmann-du.de Seite 1 26.11.2013 Halbleiter Widerstandsbestimmung durch Strom - Spannungsmessung Versuch: Widerstandsbestimmung durch Strom und Spannungsmessung. 1. Leiter : Wendel
R. Brinkmann http://brinkmann-du.de Seite 1 26.11.2013 Halbleiter Widerstandsbestimmung durch Strom - Spannungsmessung Versuch: Widerstandsbestimmung durch Strom und Spannungsmessung. 1. Leiter : Wendel
Einfaches Halbleitermodell
 Kapitel 9 Einfaches Halbleitermodell 9.1 Aufbau des liziumkristallgitters Der Inhalt dieses Kapitels ist aus Bauer/Wagener: Bauelemente und Grundschaltungen der Elektronik entnommen. Auf der äußeren Schale
Kapitel 9 Einfaches Halbleitermodell 9.1 Aufbau des liziumkristallgitters Der Inhalt dieses Kapitels ist aus Bauer/Wagener: Bauelemente und Grundschaltungen der Elektronik entnommen. Auf der äußeren Schale
Arbeit = Kraft Weg ; W = F s ; 1 Joule = 1 Newton Meter ; 1 J = 1 N m
 GRATIS-Übungsdokument Gymnasium Klasse 8 Physik Thema: Mechanik, Wärmelehre, Elektrizitätslehre CATLUX de Energie Arbeit = Kraft Weg ; W = F s ; 1 Joule = 1 Newton Meter ; 1 J = 1 N m Energie ist gespeicherte
GRATIS-Übungsdokument Gymnasium Klasse 8 Physik Thema: Mechanik, Wärmelehre, Elektrizitätslehre CATLUX de Energie Arbeit = Kraft Weg ; W = F s ; 1 Joule = 1 Newton Meter ; 1 J = 1 N m Energie ist gespeicherte
Chemie Zusammenfassung III
 Chemie Zusammenfassung III Inhaltsverzeichnis Atombau & Kernphysik... 2 Aufbau der Atome... 2 Atomkern... 2 Atomhülle... 2 Atomgrösse und Kernladung... 3 Reaktivität und Gruppen des Periodensystems...
Chemie Zusammenfassung III Inhaltsverzeichnis Atombau & Kernphysik... 2 Aufbau der Atome... 2 Atomkern... 2 Atomhülle... 2 Atomgrösse und Kernladung... 3 Reaktivität und Gruppen des Periodensystems...
Elektrische Leitung. Strom
 lektrische Leitung 1. Leitungsmechanismen Bändermodell 2. Ladungstransport in Festkörpern i) Temperaturabhängigkeit Leiter ii) igen- und Fremdleitung in Halbleitern iii) Stromtransport in Isolatoren iv)
lektrische Leitung 1. Leitungsmechanismen Bändermodell 2. Ladungstransport in Festkörpern i) Temperaturabhängigkeit Leiter ii) igen- und Fremdleitung in Halbleitern iii) Stromtransport in Isolatoren iv)
Elektrische Leitung. Leitung in Flüssigkeit
 Elektrische Leitung 1. Leitungsmechanismen Bändermodell 2. Ladungstransport in Festkörpern i) Temperaturabhängigkeit Leiter ii) Eigen- und Fremdleitung in Halbleitern iii) Stromtransport in Isolatoren
Elektrische Leitung 1. Leitungsmechanismen Bändermodell 2. Ladungstransport in Festkörpern i) Temperaturabhängigkeit Leiter ii) Eigen- und Fremdleitung in Halbleitern iii) Stromtransport in Isolatoren
Grundwissen Chemie 9. Jahrgangsstufe
 Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Halbleiter, Dioden. wyrs, Halbleiter, 1
 Halbleiter, Dioden Halbleiter, 1 Inhaltsverzeichnis Aufbau & physikalische Eigenschaften von Halbleitern Veränderung der Eigenschaften mittels Dotierung Vorgänge am Übergang von dotierten Materialen Verhalten
Halbleiter, Dioden Halbleiter, 1 Inhaltsverzeichnis Aufbau & physikalische Eigenschaften von Halbleitern Veränderung der Eigenschaften mittels Dotierung Vorgänge am Übergang von dotierten Materialen Verhalten
Konvektion. Prinzip: Bei Konvektion ist Wärmetransport an Materialtransport. Beispiel: See- und Landwind
 Konvektion Fluides Medium dehnt sich durch Erwärmung lokal aus erwärmte Stoffmenge hat kleinere Dichte steigt auf und wird durch kälteren Stoff ersetzt Konvektionskreislauf Prinzip: Warme Flüssigkeit steigt
Konvektion Fluides Medium dehnt sich durch Erwärmung lokal aus erwärmte Stoffmenge hat kleinere Dichte steigt auf und wird durch kälteren Stoff ersetzt Konvektionskreislauf Prinzip: Warme Flüssigkeit steigt
FOS: Radioaktivität und Strahlenschutz. Chemische Elemente und ihre kleinsten Teilchen
 R. Brinkmann http://brinkmann-du.de Seite 5..03 Chemische Elemente FOS: Radioaktivität und Strahlenschutz Chemische Elemente und ihre kleinsten Teilchen Der Planet Erde besteht aus 9 natürlich vorkommenden
R. Brinkmann http://brinkmann-du.de Seite 5..03 Chemische Elemente FOS: Radioaktivität und Strahlenschutz Chemische Elemente und ihre kleinsten Teilchen Der Planet Erde besteht aus 9 natürlich vorkommenden
2 Einfacher elektrischer Stromkreis, elektrisches Strömungsfeld, Strom und Spannung, Verbraucherzählpfeilsystem
 2 Einfacher elektrischer Stromkreis, elektrisches Strömungsfeld, Strom und Spannung, Verbraucherzählpfeilsystem Der elektrische Stromkreis a) Kreislauf des Wassers b) Kreislauf des elektrischen Stromes
2 Einfacher elektrischer Stromkreis, elektrisches Strömungsfeld, Strom und Spannung, Verbraucherzählpfeilsystem Der elektrische Stromkreis a) Kreislauf des Wassers b) Kreislauf des elektrischen Stromes
1 Physikalische Grundbegriffe
 1 Physikalische Grundbegriffe Um die Voraussetzungen der physikalischen Kenntnisse in den nächsten Kapiteln zu erfüllen, werden hier die dafür notwendigen Grundbegriffe 1 wie das Atom, das Proton, das
1 Physikalische Grundbegriffe Um die Voraussetzungen der physikalischen Kenntnisse in den nächsten Kapiteln zu erfüllen, werden hier die dafür notwendigen Grundbegriffe 1 wie das Atom, das Proton, das
Lösungen der Kontrollaufgaben
 Lösungen der Kontrollaufgaben Lösungen zu den Kontrollaufgaben 1.1 1.) 1000 2.) Glas und PVC ziehen einander an. - Begründung: Da offenbar Hartgummi und PVC gleichartig geladen sind (Abstossung), Glas
Lösungen der Kontrollaufgaben Lösungen zu den Kontrollaufgaben 1.1 1.) 1000 2.) Glas und PVC ziehen einander an. - Begründung: Da offenbar Hartgummi und PVC gleichartig geladen sind (Abstossung), Glas
Festkörper. Festkörper
 Festkörper Einteilung der Materie in drei Aggregatszustände: fest, flüssig, gasförmig Unterscheidung Festkörper behält seine Form Nachteil: Ungenaue Abgrenzung Beispiel: Ist Butter Festkörper oder Flüssigkeit
Festkörper Einteilung der Materie in drei Aggregatszustände: fest, flüssig, gasförmig Unterscheidung Festkörper behält seine Form Nachteil: Ungenaue Abgrenzung Beispiel: Ist Butter Festkörper oder Flüssigkeit
Elektrizität. Eledrisch is pradisch: wann'st 'as oreibst brennt's!
 Elektrizität Eledrisch is pradisch: wann'st 'as oreibst brennt's! Reibungselektrizität schon vor mehr als 2000 Jahren bei den Griechen bekannt: Reibt man Bernstein mit einem Tuch, zieht er danach Federn
Elektrizität Eledrisch is pradisch: wann'st 'as oreibst brennt's! Reibungselektrizität schon vor mehr als 2000 Jahren bei den Griechen bekannt: Reibt man Bernstein mit einem Tuch, zieht er danach Federn
Elektronische Bauelemente
 Elektronische Bauelemente Für Studenten des FB ET / IT Prof. M. Hoffmann Handout 2 Leitungsvorgänge Hinweis: Bei den Handouts handelt es sich um ausgewählte Schlüsselfolien und Zusammenfassungen. Die Handouts
Elektronische Bauelemente Für Studenten des FB ET / IT Prof. M. Hoffmann Handout 2 Leitungsvorgänge Hinweis: Bei den Handouts handelt es sich um ausgewählte Schlüsselfolien und Zusammenfassungen. Die Handouts
 2.2.2 Mechanismen der elektrischen Leitung Ohm sches Verhalten (U I bei T = const ) zeigen verschiedenste Materialien mit unterschiedlichen mikroskopischen Mechanismen der elektrischen Leitung: Metalle
2.2.2 Mechanismen der elektrischen Leitung Ohm sches Verhalten (U I bei T = const ) zeigen verschiedenste Materialien mit unterschiedlichen mikroskopischen Mechanismen der elektrischen Leitung: Metalle
Widerlegung des Modells von Thomson durch Rutherford
 Atomkerne Eine wichtige Frage stellt sich nach dem Aufbau eines Atoms aus diesen subatomaren Bausteinen. Gibt es eine Systematik des Aufbaus der Atome der verschiedenen chemischen Element im Hinblick auf
Atomkerne Eine wichtige Frage stellt sich nach dem Aufbau eines Atoms aus diesen subatomaren Bausteinen. Gibt es eine Systematik des Aufbaus der Atome der verschiedenen chemischen Element im Hinblick auf
1 Chemische Elemente und chemische Grundgesetze
 1 Chemische Elemente und chemische Grundgesetze Die Chemie ist eine naturwissenschaftliche Disziplin. Sie befasst sich mit der Zusammensetzung, Charakterisierung und Umwandlung von Materie. Unter Materie
1 Chemische Elemente und chemische Grundgesetze Die Chemie ist eine naturwissenschaftliche Disziplin. Sie befasst sich mit der Zusammensetzung, Charakterisierung und Umwandlung von Materie. Unter Materie
Bohrsches Atommodell
 Atome und ihre Bindungen Atomaufbau Im Atomkern befinden sich die Protonen (positiv geladen) und die Neutronen (neutral). P und N sind ungefähr gleich schwer und machen 99% der Atommasse aus. Um den Kern
Atome und ihre Bindungen Atomaufbau Im Atomkern befinden sich die Protonen (positiv geladen) und die Neutronen (neutral). P und N sind ungefähr gleich schwer und machen 99% der Atommasse aus. Um den Kern
3.4. Leitungsmechanismen
 a) Metalle 3.4. Leitungsmechanismen - Metall besteht aus positiv geladenen Metallionen und frei beweglichen Leitungselektronen (freie Elektronengas), Bsp.: Cu 2+ + 2e - - elektrische Leitung durch freie
a) Metalle 3.4. Leitungsmechanismen - Metall besteht aus positiv geladenen Metallionen und frei beweglichen Leitungselektronen (freie Elektronengas), Bsp.: Cu 2+ + 2e - - elektrische Leitung durch freie
2 Elektrische Ladung, Strom, Spannung
 2 Elektrische Ladung, Strom, Spannung In diesem Kapitel lernen Sie, ein Grundverständnis der Elektrizität zur Beschäftigung mit Elektronik, welche physikalischen Grundgrößen in der Elektronik verwendet
2 Elektrische Ladung, Strom, Spannung In diesem Kapitel lernen Sie, ein Grundverständnis der Elektrizität zur Beschäftigung mit Elektronik, welche physikalischen Grundgrößen in der Elektronik verwendet
Halbleiter. Das Herz unserer multimedialen Welt. Bastian Inselmann - LK Physik
 Halbleiter Das Herz unserer multimedialen Welt Inhalt Bisherig Bekanntes Das Bändermodell Halbleiter und ihre Eigenschaften Dotierung Anwendungsbeispiel: Funktion der Diode Bisher Bekanntes: Leiter Isolatoren
Halbleiter Das Herz unserer multimedialen Welt Inhalt Bisherig Bekanntes Das Bändermodell Halbleiter und ihre Eigenschaften Dotierung Anwendungsbeispiel: Funktion der Diode Bisher Bekanntes: Leiter Isolatoren
Spezifischer Widerstand fester Körper. Leiter Halbleiter Isolatoren. Kupferoxid
 R. Brinkmann http://brinkmann-du.de Seite 1 26.11.2013 Halbleiter Widerstandsbestimmung durch Strom - Spannungsmessung Versuch: Widerstandsbestimmung durch Strom und Spannungsmessung. 1. Leiter : Wendel
R. Brinkmann http://brinkmann-du.de Seite 1 26.11.2013 Halbleiter Widerstandsbestimmung durch Strom - Spannungsmessung Versuch: Widerstandsbestimmung durch Strom und Spannungsmessung. 1. Leiter : Wendel
Stoffe, durch die Strom fließen kann, heißen Leiter. Stoffe, durch die er nicht fließen kann, nennt man Nichtleiter oder Isolatoren.
 Elektrizitätslehre 1 Ein elektrischer Strom fließt nur dann, wenn ein geschlossener Stromkreis vorliegt. Batterie Grundlagen Schaltzeichen für Netzgerät, Steckdose: Glühlampe Schalter Stoffe, durch die
Elektrizitätslehre 1 Ein elektrischer Strom fließt nur dann, wenn ein geschlossener Stromkreis vorliegt. Batterie Grundlagen Schaltzeichen für Netzgerät, Steckdose: Glühlampe Schalter Stoffe, durch die
4. Fehleranordnung und Diffusion
 4. Fehleranordnung und Diffusion 33 4. Fehleranordnung und Diffusion Annahme: dichtes, porenfreies Oxid Materialtransport nur durch Festkörperdiffusion möglich Schematisch: Mögliche Teilreaktionen:. Übergang
4. Fehleranordnung und Diffusion 33 4. Fehleranordnung und Diffusion Annahme: dichtes, porenfreies Oxid Materialtransport nur durch Festkörperdiffusion möglich Schematisch: Mögliche Teilreaktionen:. Übergang
Atomphysik NWA Klasse 9
 Atomphysik NWA Klasse 9 Atome wurden lange Zeit als die kleinsten Teilchen angesehen, aus denen die Körper bestehen. Sie geben den Körpern ihre chemischen und physikalischen Eigenschaften. Heute wissen
Atomphysik NWA Klasse 9 Atome wurden lange Zeit als die kleinsten Teilchen angesehen, aus denen die Körper bestehen. Sie geben den Körpern ihre chemischen und physikalischen Eigenschaften. Heute wissen
Grundlagen der Elektrotechnik I Physikalische Größen, physikalische Größenarten, Einheiten und Werte physikalischer Größen
 Grundlagen der Elektrotechnik I 17 11.01.01 Einführung eines Einheitensystems.1 Physikalische Größen, physikalische Größenarten, Einheiten und Werte physikalischer Größen Physikalische Größen: Meßbare,
Grundlagen der Elektrotechnik I 17 11.01.01 Einführung eines Einheitensystems.1 Physikalische Größen, physikalische Größenarten, Einheiten und Werte physikalischer Größen Physikalische Größen: Meßbare,
1. Statisches elektrisches Feld
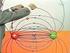 . Statisches elektrisches Feld. Grundlagen der Elektrizitätslehre.. Elektrizität in Natur, Technik und Alltag Altertum: Bernstein reiben Staubteilchen und Wollfasern werden angezogen 794 Coulomb: Gesetz
. Statisches elektrisches Feld. Grundlagen der Elektrizitätslehre.. Elektrizität in Natur, Technik und Alltag Altertum: Bernstein reiben Staubteilchen und Wollfasern werden angezogen 794 Coulomb: Gesetz
14. elektrischer Strom
 Ladungstransport, elektrischer Strom 14. elektrischer Strom In Festkörpern: Isolatoren: alle Elektronen fest am Atom gebunden, bei Zimmertemperatur keine freien Elektronen -> kein Stromfluß Metalle: Ladungsträger
Ladungstransport, elektrischer Strom 14. elektrischer Strom In Festkörpern: Isolatoren: alle Elektronen fest am Atom gebunden, bei Zimmertemperatur keine freien Elektronen -> kein Stromfluß Metalle: Ladungsträger
Grundlagen zum Versuch Aufbau einer Messkette für den Nachweis kleinster Ladungsmengen
 Grundlagen zum Versuch Aufbau einer Messkette für den Nachweis kleinster Ladungsmengen III.1 Halbleiter: Einzelne Atome eines chemischen Elements besitzen nach dem Bohrschen Atommodell einen positiv geladenen
Grundlagen zum Versuch Aufbau einer Messkette für den Nachweis kleinster Ladungsmengen III.1 Halbleiter: Einzelne Atome eines chemischen Elements besitzen nach dem Bohrschen Atommodell einen positiv geladenen
Grundlagen der Rechnerarchitektur
 Grundlagen der Rechnerarchitektur [CS3100.010] Wintersemester 2014/15 Tobias Scheinert / (Heiko Falk) Institut für Eingebettete Systeme/Echtzeitsysteme Ingenieurwissenschaften und Informatik Universität
Grundlagen der Rechnerarchitektur [CS3100.010] Wintersemester 2014/15 Tobias Scheinert / (Heiko Falk) Institut für Eingebettete Systeme/Echtzeitsysteme Ingenieurwissenschaften und Informatik Universität
Stoffgemisch. Reinstoff. Homogenes Gemisch. Heterogenes Gemisch. ( 8. Klasse NTG 1 / 48 ) ( 8. Klasse NTG 2 / 48 ) ( 8. Klasse NTG 3 / 48 )
 Stoffgemisch ( 8. Klasse NTG 1 / 48 ) besteht aus zwei oder mehr verschiedenen Reinstoffen Gemisch unterschiedlicher kleinster Teilchen Trennung durch physikalische Methoden möglich Reinstoff ( 8. Klasse
Stoffgemisch ( 8. Klasse NTG 1 / 48 ) besteht aus zwei oder mehr verschiedenen Reinstoffen Gemisch unterschiedlicher kleinster Teilchen Trennung durch physikalische Methoden möglich Reinstoff ( 8. Klasse
Teilchenmodell. Aggregatzustände. Diffusion. Spezifische Eigenschaften = Stoffeigenschaften
 Teilchenmodell (1) Alle Stoffe bestehen aus kleinsten Teilchen. (2) Zwischen den Teilchen wirken Anziehungskräfte. (3) Alle Teilchen befinden sich in ständiger, regelloser Bewegung (Brownsche Bewegung),
Teilchenmodell (1) Alle Stoffe bestehen aus kleinsten Teilchen. (2) Zwischen den Teilchen wirken Anziehungskräfte. (3) Alle Teilchen befinden sich in ständiger, regelloser Bewegung (Brownsche Bewegung),
Typische Eigenschaften von Metallen
 Typische Eigenschaften von Metallen hohe elektrische Leitfähigkeit (nimmt mit steigender Temperatur ab) hohe Wärmeleitfähigkeit leichte Verformbarkeit metallischer Glanz Elektronengas-Modell eines Metalls
Typische Eigenschaften von Metallen hohe elektrische Leitfähigkeit (nimmt mit steigender Temperatur ab) hohe Wärmeleitfähigkeit leichte Verformbarkeit metallischer Glanz Elektronengas-Modell eines Metalls
1.17eV exp eV exp Halbleiter
 7.6 Halbleiter Nichtleiter Die Bandstruktur eines Halbleiters ist gleich der Bandstruktur eines Nichtleiters. Der Hauptunterschied besteht in der Breite der Energielücke: Für einen Halbleiter ist die Energielücke
7.6 Halbleiter Nichtleiter Die Bandstruktur eines Halbleiters ist gleich der Bandstruktur eines Nichtleiters. Der Hauptunterschied besteht in der Breite der Energielücke: Für einen Halbleiter ist die Energielücke
7. Das Bohrsche Modell des Wasserstoff-Atoms. 7.1 Stabile Elektronbahnen im Atom
 phys4.08 Page 1 7. Das Bohrsche Modell des Wasserstoff-Atoms 7.1 Stabile Elektronbahnen im Atom Atommodell: positiv geladene Protonen (p + ) und Neutronen (n) im Kern negative geladene Elektronen (e -
phys4.08 Page 1 7. Das Bohrsche Modell des Wasserstoff-Atoms 7.1 Stabile Elektronbahnen im Atom Atommodell: positiv geladene Protonen (p + ) und Neutronen (n) im Kern negative geladene Elektronen (e -
2. Der Temperaturkoeffizient des spezifischen Widerstands α. Die SI-Einheit K -1 ρ = ρ
 7. Elektrische Leitfähigkeit von estkörpern 7.1 Die elektrischen Eigenschaften von Kristallen Die grundlegende Eigenschaften kennzeichnen das elektrische Verhalten von estkörpern: 1. Der spezifische Widerstand
7. Elektrische Leitfähigkeit von estkörpern 7.1 Die elektrischen Eigenschaften von Kristallen Die grundlegende Eigenschaften kennzeichnen das elektrische Verhalten von estkörpern: 1. Der spezifische Widerstand
11. Elektronen im Festkörper
 11. Elektronen im Festkörper 11.1 Elektrische Leitung in Festkörpern 11.2 Freies Elektronengas im Sommerfeld- Modell 11.3 Bändermodell des Festkörpers 11.4 Metalle, Isolatoren und Halbleiter WS 2013/14
11. Elektronen im Festkörper 11.1 Elektrische Leitung in Festkörpern 11.2 Freies Elektronengas im Sommerfeld- Modell 11.3 Bändermodell des Festkörpers 11.4 Metalle, Isolatoren und Halbleiter WS 2013/14
Die Anzahl der Protonen und Neutronen entspricht der Atommassenzahl.
 Atom Der Begriff Atom leitet sich von atomos her, was unteilbar heisst. Diese Definition ist alt, da man heutzutage fähig ist, Atome zu teilen. Atommassenzahl Die Anzahl der Protonen und Neutronen entspricht
Atom Der Begriff Atom leitet sich von atomos her, was unteilbar heisst. Diese Definition ist alt, da man heutzutage fähig ist, Atome zu teilen. Atommassenzahl Die Anzahl der Protonen und Neutronen entspricht
1. Teil: ANALOGELEKTRONIK
 1. Teil: ANALOGELEKTRONIK 1. ELEKTRISCHE EIGENSCHAFTEN DER FESTEN MATERIE 1.1. EINLEITUNG Um zu verstehen, wie Halbleiter als Bauteile der Elektronik funktionieren, ist es nützlich, sich mit dem Aufbau
1. Teil: ANALOGELEKTRONIK 1. ELEKTRISCHE EIGENSCHAFTEN DER FESTEN MATERIE 1.1. EINLEITUNG Um zu verstehen, wie Halbleiter als Bauteile der Elektronik funktionieren, ist es nützlich, sich mit dem Aufbau
Element. Verbindung. Reinstoff. homogenes Gemisch
 Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
Grundwissen C8 NTG. 1. Stoffe und Reaktionen. Reinstoff
 Grundwissen C8 NTG 1. Stoffe und Reaktionen Reinstoff Stoffgemisch - besitzt unter bestimmten Bedingungen (z.b. Temperatur, Druck ) kennzeichnende Eigenschaften, z.b. Farbe, Geruch, Geschmack, Dichte,
Grundwissen C8 NTG 1. Stoffe und Reaktionen Reinstoff Stoffgemisch - besitzt unter bestimmten Bedingungen (z.b. Temperatur, Druck ) kennzeichnende Eigenschaften, z.b. Farbe, Geruch, Geschmack, Dichte,
Die elektrische Ladung
 Die elektrische Ladung e - p + Die Grundbausteine der Atome (und damit aller Materie) sind Elektronen und Protonen Elektronen besitzen untrennbar eine negative elektrische Ladung von -1,602 10-19 C (Coulomb),d.h.
Die elektrische Ladung e - p + Die Grundbausteine der Atome (und damit aller Materie) sind Elektronen und Protonen Elektronen besitzen untrennbar eine negative elektrische Ladung von -1,602 10-19 C (Coulomb),d.h.
Elektrostatik. 4 Demonstrationsexperimente verwendete Materialien: Polyestertuch, Kunststoffstäbe (einer frei drehbar gelagert), Glasstab
 Elektrostatik 4 Demonstrationsexperimente verwendete Materialien: Polyestertuch, Kunststoffstäbe (einer frei drehbar gelagert), Glasstab Beschreibe und erkläre die Exp. stichpunkartig. Ergebnis: - Es gibt
Elektrostatik 4 Demonstrationsexperimente verwendete Materialien: Polyestertuch, Kunststoffstäbe (einer frei drehbar gelagert), Glasstab Beschreibe und erkläre die Exp. stichpunkartig. Ergebnis: - Es gibt
Chemieepoche Klasse 11. Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen
 Chemieepoche Klasse 11 Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen Eisengewinnung (Schülervortrag) Fortsetzung Chemische Bindungen Warum sind im Wassermolekül zwei Wasserstoffatome mit
Chemieepoche Klasse 11 Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen Eisengewinnung (Schülervortrag) Fortsetzung Chemische Bindungen Warum sind im Wassermolekül zwei Wasserstoffatome mit
Elektrizitätsleitung in Halbleitern
 Elektrizitätsleitung in Halbleitern Halbleiter sind chemische Elemente, die elektrischen Strom schlecht leiten. Germanium, Silicium und Selen sind die technisch wichtigsten Halbleiterelemente; aber auch
Elektrizitätsleitung in Halbleitern Halbleiter sind chemische Elemente, die elektrischen Strom schlecht leiten. Germanium, Silicium und Selen sind die technisch wichtigsten Halbleiterelemente; aber auch
1 Aufbau der Materie. 1.1 Anfänge und Kernhüllenmodell. Bauchemie / Bauphysik II Modul M-T 6
 1 Aufbau der Materie 1.1 Anfänge und Kernhüllenmodell 400 J. v. Chr. suchte Demokrit als erster die kleinsten Teile der Materie. Und weil auch er diese damals nicht sehen konnte, entwickelte er eine Modellvorstellung
1 Aufbau der Materie 1.1 Anfänge und Kernhüllenmodell 400 J. v. Chr. suchte Demokrit als erster die kleinsten Teile der Materie. Und weil auch er diese damals nicht sehen konnte, entwickelte er eine Modellvorstellung
2.4 Metallische Bindung und Metallkristalle. Unterteilung in Metalle, Halbmetalle, Nicht metalle. Li Be B C N O F. Na Mg Al Si P S Cl
 2.4 Metallische Bindung und Metallkristalle Li Be B C N O F Na Mg Al Si P S Cl K Ca Ga Ge As Se Br Rb Sr In Sn Sb Te I Cs Ba Tl Pb Bi Po At Unterteilung in Metalle, Halbmetalle, Nicht metalle Metalle etwa
2.4 Metallische Bindung und Metallkristalle Li Be B C N O F Na Mg Al Si P S Cl K Ca Ga Ge As Se Br Rb Sr In Sn Sb Te I Cs Ba Tl Pb Bi Po At Unterteilung in Metalle, Halbmetalle, Nicht metalle Metalle etwa
Ionenbindung Lehrerinformation
 Lehrerinformation 1/5 Arbeitsauftrag Ziel Material Sozialform Zeit Die SuS erarbeiten sich chemische Informationen zu Kochsalz. Sie kennen die Bestandteile und wissen, wie Salz chemisch aufgebaut ist.
Lehrerinformation 1/5 Arbeitsauftrag Ziel Material Sozialform Zeit Die SuS erarbeiten sich chemische Informationen zu Kochsalz. Sie kennen die Bestandteile und wissen, wie Salz chemisch aufgebaut ist.
Die Silizium - Solarzelle
 Die Silizium - Solarzelle 1. Prinzip einer Solarzelle Die einer Solarzelle besteht darin, Lichtenergie in elektrische Energie umzuwandeln. Die entscheidende Rolle bei diesem Vorgang spielen Elektronen
Die Silizium - Solarzelle 1. Prinzip einer Solarzelle Die einer Solarzelle besteht darin, Lichtenergie in elektrische Energie umzuwandeln. Die entscheidende Rolle bei diesem Vorgang spielen Elektronen
11. Elektronen im Festkörper
 11. Elektronen im Festkörper 11.1 Elektrische Leitung in Festkörpern 11.2 Freies Elektronengas im Sommerfeld- Modell 11.3 Bändermodell des Festkörpers 11.4 Metalle, Isolatoren und Halbleiter 1 11.4 Metalle,
11. Elektronen im Festkörper 11.1 Elektrische Leitung in Festkörpern 11.2 Freies Elektronengas im Sommerfeld- Modell 11.3 Bändermodell des Festkörpers 11.4 Metalle, Isolatoren und Halbleiter 1 11.4 Metalle,
Atomphysik Klasse 9. Aufgabe: Fülle die freien Felder aus!
 1. Was gibt die Massenzahl A eines Atoms an? Die Zahl der Neutronen im Kern. Die Zahl der Protonen im Kern. Die Summe aus Kernneutronen und Kernprotonen. Die Zahl der Elektronen. Die Summe von Elektronen
1. Was gibt die Massenzahl A eines Atoms an? Die Zahl der Neutronen im Kern. Die Zahl der Protonen im Kern. Die Summe aus Kernneutronen und Kernprotonen. Die Zahl der Elektronen. Die Summe von Elektronen
E 2 Temperaturabhängigkeit elektrischer Widerstände
 E 2 Temperaturabhängigkeit elektrischer Widerstände 1. Aufgaben 1. Für die Stoffe - Metall (Kupfer) - Legierung (Konstantan) - Halbleiter (Silizium, Galliumarsenid) ist die Temperaturabhängigkeit des elektr.
E 2 Temperaturabhängigkeit elektrischer Widerstände 1. Aufgaben 1. Für die Stoffe - Metall (Kupfer) - Legierung (Konstantan) - Halbleiter (Silizium, Galliumarsenid) ist die Temperaturabhängigkeit des elektr.
chemische Vorgänge spielen sich in erster Linie in der Atomhülle ab, sind also mit einer Änderung der Energiezustände der Elektronen verbunden.
 1 Atomhülle - Elektronen chemische Vorgänge spielen sich in erster Linie in der Atomhülle ab, sind also mit einer Änderung der Energiezustände der Elektronen verbunden. Energie der Elektronen Die Energie
1 Atomhülle - Elektronen chemische Vorgänge spielen sich in erster Linie in der Atomhülle ab, sind also mit einer Änderung der Energiezustände der Elektronen verbunden. Energie der Elektronen Die Energie
Christian-Ernst-Gymnasium
 Christian-Ernst-Gymnasium Am Langemarckplatz 2 91054 ERLANGEN GRUNDWISSEN CHEMIE 9 - MuG erstellt von der Fachschaft Chemie C 9.1 Stoffe und en Element kann chemisch nicht mehr zerlegt werden Teilchen
Christian-Ernst-Gymnasium Am Langemarckplatz 2 91054 ERLANGEN GRUNDWISSEN CHEMIE 9 - MuG erstellt von der Fachschaft Chemie C 9.1 Stoffe und en Element kann chemisch nicht mehr zerlegt werden Teilchen
Thema heute: Aufbau der Materie: Atommodelle 1
 Wiederholung der letzten Vorlesungsstunde: Naturwissenschaften, Unterteilung der Naturwissenschaften in einzelne Wissensgebiete, Modellvorstellungen, der "reine Stoff", thermische Eigenschaften, Siedepunkt,
Wiederholung der letzten Vorlesungsstunde: Naturwissenschaften, Unterteilung der Naturwissenschaften in einzelne Wissensgebiete, Modellvorstellungen, der "reine Stoff", thermische Eigenschaften, Siedepunkt,
Detektoren in der Kern- und Teilchenphysik Szintillationsdetektoren Ionisationsdetektoren Halbleiterdetektoren
 Wechselwirkung geladener Teilchen in Materie Physik VI Sommersemester 2008 Detektoren in der Kern- und Teilchenphysik Szintillationsdetektoren Ionisationsdetektoren Halbleiterdetektoren Szintillationsdetektoren
Wechselwirkung geladener Teilchen in Materie Physik VI Sommersemester 2008 Detektoren in der Kern- und Teilchenphysik Szintillationsdetektoren Ionisationsdetektoren Halbleiterdetektoren Szintillationsdetektoren
Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde VL # 14,
 Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde VL # 14, 20.05.2009 Vladimir Dyakonov Experimentelle Physik VI dyakonov@physik.uni-wuerzburg.de Professor Dr. Vladimir
Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde VL # 14, 20.05.2009 Vladimir Dyakonov Experimentelle Physik VI dyakonov@physik.uni-wuerzburg.de Professor Dr. Vladimir
Toll! Wir wissen nun eine Menge über den Bau von Atomen. Wir können Infos über Elemente aus dem PSE ablesen. Aber als Chemiker wollen wir auch
 Toll! Wir wissen nun eine Menge über den Bau von Atomen. Wir können Infos über Elemente aus dem PSE ablesen. Aber als Chemiker wollen wir auch Verbindungen untersuchen, ihre Zusammensetzung verstehen und
Toll! Wir wissen nun eine Menge über den Bau von Atomen. Wir können Infos über Elemente aus dem PSE ablesen. Aber als Chemiker wollen wir auch Verbindungen untersuchen, ihre Zusammensetzung verstehen und
Leiter, Halbleiter, Isolatoren
 eiter, Halbleiter, Isolatoren lektronen in Festkörpern: In einzelnem Atom: diskrete erlaubte nergieniveaus der lektronen. In Kristallgittern: Bänder erlaubter nergie: gap = Bandlücke, pot Positionen der
eiter, Halbleiter, Isolatoren lektronen in Festkörpern: In einzelnem Atom: diskrete erlaubte nergieniveaus der lektronen. In Kristallgittern: Bänder erlaubter nergie: gap = Bandlücke, pot Positionen der
Atombau und Periodensystem
 Atombau und Periodensystem Patrick Bucher 15. August 2011 Inhaltsverzeichnis 1 Die chemischen Grundlagen und Daltons Atomhypothese 1 2 Modelle zum Atombau 2 2.1 Die elektrische Ladung..............................
Atombau und Periodensystem Patrick Bucher 15. August 2011 Inhaltsverzeichnis 1 Die chemischen Grundlagen und Daltons Atomhypothese 1 2 Modelle zum Atombau 2 2.1 Die elektrische Ladung..............................
Radioaktivität. den 7 Oktober Dr. Emőke Bódis
 Radioaktivität den 7 Oktober 2016 Dr. Emőke Bódis Prüfungsfrage Die Eigenschaften und Entstehung der radioaktiver Strahlungen: Alpha- Beta- und Gamma- Strahlungen. Aktivität. Zerfallgesetz. Halbwertzeit.
Radioaktivität den 7 Oktober 2016 Dr. Emőke Bódis Prüfungsfrage Die Eigenschaften und Entstehung der radioaktiver Strahlungen: Alpha- Beta- und Gamma- Strahlungen. Aktivität. Zerfallgesetz. Halbwertzeit.
Anorganische Chemie III
 Seminar zu Vorlesung Anorganische Chemie III Wintersemester 01/13 Christoph Wölper Universität Duisburg-Essen Koordinationszahlen Ionenradien # dichteste Packung mit 1 Nachbarn -> in Ionengittern weniger
Seminar zu Vorlesung Anorganische Chemie III Wintersemester 01/13 Christoph Wölper Universität Duisburg-Essen Koordinationszahlen Ionenradien # dichteste Packung mit 1 Nachbarn -> in Ionengittern weniger
Elektrostatik. wie 1., ein Stab aus Glas (GS) Anziehung
 Elektrostatik (Die Lehre von quasi ruhenden elektrischen Ladungen) Erstelle ein Versuchsprotokoll! Verwendete Geräte: Kunststoffstäbe (KS), von denen einer frei drehbar gelagert ist Glasstab (GS) Polyestertuch
Elektrostatik (Die Lehre von quasi ruhenden elektrischen Ladungen) Erstelle ein Versuchsprotokoll! Verwendete Geräte: Kunststoffstäbe (KS), von denen einer frei drehbar gelagert ist Glasstab (GS) Polyestertuch
Bild 1.4 Wärmeschwingung des Kristallgitters bei T > 0K
 Bild 1.2 Das ideale Silizium-Gitter (Diamantgitterstruktur). Die großen Kugeln sind die Atomrümpfe; die kleinen Kugeln stellen die Valenzelektronen dar, von denen je zwei eine Elektronenpaarbrücke zwischen
Bild 1.2 Das ideale Silizium-Gitter (Diamantgitterstruktur). Die großen Kugeln sind die Atomrümpfe; die kleinen Kugeln stellen die Valenzelektronen dar, von denen je zwei eine Elektronenpaarbrücke zwischen
GRUNDWISSEN CHEMIE 9 - MuG erstellt von der Fachschaft Chemie
 Christian-Ernst-Gymnasium Am Langemarckplatz 2 91054 ERLANGEN GRUNDWISSEN CHEMIE 9 - MuG erstellt von der Fachschaft Chemie C 9.1 Stoffe und Reaktionen Reinstoff Element Kann chemisch nicht mehr zerlegt
Christian-Ernst-Gymnasium Am Langemarckplatz 2 91054 ERLANGEN GRUNDWISSEN CHEMIE 9 - MuG erstellt von der Fachschaft Chemie C 9.1 Stoffe und Reaktionen Reinstoff Element Kann chemisch nicht mehr zerlegt
FAKULTÄT FÜR ELEKTROTECHNIK UND INFORMATIONSTECHNIK
 Elektronik 1 - Bauelemente Vorlesung 5, 09.11.2017 Nils Pohl FAKULTÄT FÜR ELEKTROTECHNIK UND INFORMATIONSTECHNIK Lehrstuhl für Integrierte Systeme Organisatorisches Terminübersicht 02.11. 12:15 Vorlesung
Elektronik 1 - Bauelemente Vorlesung 5, 09.11.2017 Nils Pohl FAKULTÄT FÜR ELEKTROTECHNIK UND INFORMATIONSTECHNIK Lehrstuhl für Integrierte Systeme Organisatorisches Terminübersicht 02.11. 12:15 Vorlesung
2.5 Strom in Flüssigkeiten. 2.5 Strom in Flüssigkeiten. 2.5 Strom in Flüssigkeiten. 2.5 Strom in Flüssigkeiten. 2.5 Strom in Flüssigkeiten
 Leitungsversuche: Destilliertes Wasser Leitungswasser NaCl i Wasser Abhängigkeiten: Vorhandensein von Ladungsträgern Beweglichkeit der Ladungsträger ("Häufigkeit von Stößen", " Reibung") Anode + Kathode
Leitungsversuche: Destilliertes Wasser Leitungswasser NaCl i Wasser Abhängigkeiten: Vorhandensein von Ladungsträgern Beweglichkeit der Ladungsträger ("Häufigkeit von Stößen", " Reibung") Anode + Kathode
Lösungen, Salze, Ionen und Elektrolyte
 Lösungen, Salze, Ionen und Elektrolyte Lösungen Eine Lösung ist in der Chemie ein homogenes Gemisch, das aus zwei oder mehr chemisch reinen Stoffen besteht. Sie enthält einen oder mehrere gelöste Stoffe
Lösungen, Salze, Ionen und Elektrolyte Lösungen Eine Lösung ist in der Chemie ein homogenes Gemisch, das aus zwei oder mehr chemisch reinen Stoffen besteht. Sie enthält einen oder mehrere gelöste Stoffe
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Lernwerkstatt für die Klassen 7 bis 9: Strahlung
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt für die Klassen 7 bis 9: Strahlung Das komplette Material finden Sie hier: Download bei School-Scout.de SCHOOL-SCOUT
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt für die Klassen 7 bis 9: Strahlung Das komplette Material finden Sie hier: Download bei School-Scout.de SCHOOL-SCOUT
Bundesrealgymnasium Imst. Chemie Klasse 4. Aufbauprinzipien der Materie Periodensystem de Elemente
 Bundesrealgymnasium Imst Chemie 2010-11 Periodensystem de Elemente Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff
Bundesrealgymnasium Imst Chemie 2010-11 Periodensystem de Elemente Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff
Robert-Koch-Gymnasium Deggendorf. Grundwissen Chemie. 8. Jahrgangsstufe
 Robert-Koch-Gymnasium Deggendorf Grundwissen Chemie 8. Jahrgangsstufe Teilchenmodell und Stoffeigenschaften Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, vereinfacht dargestellt als Kugeln.
Robert-Koch-Gymnasium Deggendorf Grundwissen Chemie 8. Jahrgangsstufe Teilchenmodell und Stoffeigenschaften Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, vereinfacht dargestellt als Kugeln.
Dotierung. = gezieltes Verunreinigen des Si-Kristalls mit bestimmten Fremdatomen. n-dotierung Einbau. von Atomen mit 3 Valenzelektronen
 Halbleiter Dotierung = gezieltes Verunreinigen des Si-Kristalls mit bestimmten Fremdatomen. n-dotierung Einbau von Atomen mit 5 Valenzelektronen = Donatoren Elektronengeber (P, Sb, As) p-dotierung Einbau
Halbleiter Dotierung = gezieltes Verunreinigen des Si-Kristalls mit bestimmten Fremdatomen. n-dotierung Einbau von Atomen mit 5 Valenzelektronen = Donatoren Elektronengeber (P, Sb, As) p-dotierung Einbau
Elektrizitätslehre. Stromkreise. Stoffe. Elektrischer Strom
 Elektrizitätslehre 3 Elektrischer Strom Stromkreise Elektrischer Strom Stoffe Elektrischer Strom = kollektive geordnete Wanderung von Ladungsträgern (z.b. Elektronen, Ionen, ) Dieser elektrische Leitungsvorgang
Elektrizitätslehre 3 Elektrischer Strom Stromkreise Elektrischer Strom Stoffe Elektrischer Strom = kollektive geordnete Wanderung von Ladungsträgern (z.b. Elektronen, Ionen, ) Dieser elektrische Leitungsvorgang
Das elektrische Potential
 Das elektrische Potential Wir gehen nun genauso wie in der Mechanik vor: nachdem wir die elektrische Kraft diskutiert und durch eine Feldgröße beschrieben haben (das elektrische Feld E), betrachten wir
Das elektrische Potential Wir gehen nun genauso wie in der Mechanik vor: nachdem wir die elektrische Kraft diskutiert und durch eine Feldgröße beschrieben haben (das elektrische Feld E), betrachten wir
Element. Verbindung. Reinstoff. Gemisch
 Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
Begriffe zur Elektrik und Elektrochemie
 Staatsinstitut für Schulqualität und Bildungsforschung Begriffe zur Elektrik und Elektrochemie Akkumulator Atom Atomkern Batterie Ein Akkumulator ist eine Energiequelle, die wie eine Batterie Gleichstrom
Staatsinstitut für Schulqualität und Bildungsforschung Begriffe zur Elektrik und Elektrochemie Akkumulator Atom Atomkern Batterie Ein Akkumulator ist eine Energiequelle, die wie eine Batterie Gleichstrom
Grundbausteine des Mikrokosmos (3) Das Atom der Elektrizität...
 Grundbausteine des Mikrokosmos (3) Das Atom der Elektrizität... Für die Chemiker war es Ende des 19. und Anfang des 20. Jahrhunderts völlig klar, daß die Materie aus kleinen, wahrscheinlich unteilbaren
Grundbausteine des Mikrokosmos (3) Das Atom der Elektrizität... Für die Chemiker war es Ende des 19. und Anfang des 20. Jahrhunderts völlig klar, daß die Materie aus kleinen, wahrscheinlich unteilbaren
