Anwendung von Privigen : Eine nicht interventionelle Beobachtungsstudie
|
|
|
- Melanie Franke
- vor 7 Jahren
- Abrufe
Transkript
1 CSL Behring GmbH Beobachtungsplan Anwendung von Privigen : Eine nicht interventionelle Beobachtungsstudie Studien-Code: IgPro10_ EINLEITUNG Privigen ist ein polyvalentes Immunglobulin-Präparat zur intravenösen Anwendung, das sich durch eine spezielle Galenik mit der nicht-essentiellen Aminosäure L-Prolin als Stabilisator auszeichnet. Dadurch ist es gelungen, das Präparat hochkonzentriert (10%) und sehr stabil (36 Monate Lagerung bei Raumtemperatur) herzustellen. Seit der Markteinführung von Privigen in Deutschland führt CSL Behring unter der Studiennummer IgPro10_5001 eine Beobachtungsstudie durch, um Erkenntnisse zur Anwendung, zur Wirksamkeit und zur Verträglichkeit des Präparats zu gewinnen. Ergebnisse aus dieser Anwendungsbeobachtung zu unterschiedlichen Indikationen wurden regelmäßig bei internationalen Kongressen präsentiert: Pfründer et al., DÖSGHO 2009, Heidelberg/Mannheim; Hoffmann et al., AAAAI 2010, New Orleans; Tschechne et al., ESID 2010, Istanbul; Tschechne et al., DÖSGHO 2011, Basel; Otremba et al., ESID 2012, Florenz; Hoffmann et al., AAAAI 2014, San Diego; Slawik et al., ESID 2014, Prag; Plath et al., DÖSGHO 2015, Basel. Im Jahr 2015 hat CSL Behring unter der Bezeichnung "Ig-Isolo-Verfahren" in den Produktionsprozess von Privigen eine Immunaffinitätschromatographie-Säule integriert, die spezifisch den Gehalt an Anti-A- und Anti-B-Isoagglutininen reduziert. Diese Antikörper, die natürlicherweise im Plasma aller Spender mit einer anderen Blutgruppe als AB vorkommen, werden mit dem Auftreten von Hämolysen unter der Therapie mit polyvalenten Immunglobulinpräparaten in Verbindung gebracht (Bellac et al., Transfusion 2015;55;S13 S22). Zwar blieb Privigen schon mit dem bisherigen Produktionsprozess unter den behördlicherseits spezifizierten Grenzwerten für die Isoagglutinine, und in der Studie IgPro10_5001 wurden Seite 1 von 8
2 bisher auch keine unerwünschten Arzneimittelwirkungen mit Hämolysen gemeldet, aber CSL Behring betrachtet die Reduktion dieser unerwünschten Antikörper als einen weiteren sinnvollen Schritt zur Erhöhung der Sicherheit des Präparats. Ab Anfang 2016 stehen die ersten Chargen, die mit dem neuen Verfahren produziert wurden, zur Verfügung. Der Gehalt an Isoagglutininen in Privigen wird durch die spezifische Immunaffinitätschromatographie um 88-90% verringert, während sich die Konzentrationen von Antikörpern gegen eine Reihe von klinisch relevanten Viren und Bakterientoxine nicht nennenswert ändern (Hoefferer et al., Transfusion 2015;55;S117 S121). Da das Herstellungsverfahren von Privigen ansonsten gleich bleibt, geht CSL Behring davon aus, dass sich auch die übrigen Eigenschaften des Präparats nicht wesentlich verändern. Ein Beweis dafür kann jedoch nur durch eine geeignete Studie erbracht werden, in welcher eine adäquate Anzahl von Behandlungen mit alten und neuen Privigen -Chargen verglichen wird. Berücksichtigt man einerseits, dass Privigen bei Patienten unterschiedlicher Altersklassen in einer Vielzahl von Indikationen mit unterschiedlichen Einzel- und Gesamtdosen eingesetzt wird, und andererseits, dass die Studie auch eine Aussage über seltene potentielle Nebenwirkungen ermöglichen sollte, dann ergibt sich die Notwendigkeit für eine sehr große Patientenzahl. Die Anwendungsbeobachtung IgPro10_5001 stellt weltweit die einzige Studie dar, in der eine ausreichende Anzahl von Behandlungen mit alten Privigen -Chargen dokumentiert ist. Durch Verlängerung der Studie über das ursprünglich vorgesehene Abschlussdatum (Dezember 2015) und über die ursprünglich vorgesehene Patientenzahl (2000) hinaus wird es möglich sein, diese Behandlungen mit einer ähnlich großen Zahl von Behandlungen mit den ab 2016 verfügbaren neuen Chargen zu vergleichen. 2 ZIEL DER ANWENDUNGSBEOBACHTUNG Ziel der Anwendungsbeobachtung ist es, Erkenntnisse zur Anwendung, zur Wirksamkeit und zur Verträglichkeit von Privigen zu gewinnen, insbesondere im Hinblick auf einen Vergleich zwischen den bis 2015 produzierten "alten" Chargen und den ab 2016 zur Verfügung stehenden neuen Chargen, die durch Integration einer spezifischen Immunaffinitätschromatographie-Säule (Ig-Isolo-Verfahren) in den Produktionsprozess einen verminderten Gehalt an Anti-A- und Anti-B-Isoagglutininen aufweisen. 3 STUDIENDESIGN, AUSWAHL DER PATIENTEN Dies ist eine offene, multizentrische, nicht interventionelle Beobachtungsstudie im Sinne von 4 Abs. 23 Satz 3 des Arzneimittelgesetzes ohne Vorgaben zur Indikation oder Anwendung von Privigen. Die Fachinformation ist zu beachten. Es sollen 5000 Patienten eingeschlossen werden, die hinsichtlich der Anwendung, der Wirksamkeit und der Verträglichkeit von Privigen beobachtet werden. Es wird die Teilnahme von ca. 200 Zentren erwartet. Die Laufzeit der Studie ist von Juli 2008 bis Dezember 2019 mit jährlichen Zwischenauswertungen. Ein Patient kann in die Anwendungsbeobachtung eingeschlossen werden, wenn der Arzt bzw. die Ärztin Privigen als das zu verabreichende intravenöse Immunglobulin ausgewählt hat. Der Beobachtungsplan macht keine Vorgaben zur medikamentösen oder sonstigen Behandlung der Patienten. Es erfolgt lediglich eine Dokumentation der durchgeführten Diagnostik und Therapie. Seite 2 von 8
3 3.1 Identifizierung der eingeschlossenen Patienten Die Dokumentationsbögen werden durchgehend nummeriert. Die Patienten müssen während der ganzen Studiendauer im Studienzentrum, jedoch nicht beim Sponsor, identifizierbar sein (pseudonymisierte Daten). Zu diesem Zweck wird vom Zentrum eine patientenspezifische Identifikationsnummer vergeben und es wird eine Liste geführt, aus der die Zuordnung der Dokumentationsbögen und der Identifikationsnummern zu den Patienten hervorgeht. 3.2 Ausschlusskriterien Die Gegenanzeigen und Warnhinweise der Fachinformation sind zu beachten. Weitere Ausschlusskriterien gibt es nicht. 3.3 Begleitmedikation Um erwünschte und unerwünschte Wirkungen der Privigen -Gabe richtig beurteilen zu können, müssen alle begleitend gegebenen Medikamente ab dem ersten Tag der IVIG-Gabe mit Produktnamen, Stärke und Dosierung in den entsprechenden Feldern des Dokumentationsbogens (CRF) notiert werden. 4 METHODEN UND DURCHFÜHRUNG DER STUDIE Alle medizinischen Maßnahmen werden vom Arzt bzw. der Ärztin entsprechend seiner/ihrer klinischen Erfahrung in Übereinstimmung mit bestehenden Leitlinien und Richtlinien angeordnet. In einem CRF können bis zu 6 Therapiezyklen mit Privigen dokumentiert werden. Ergänzend ist die Dokumentation eines Besuches nach Abschluss der Behandlung wünschenswert, um die Dokumentation möglicher Nebenwirkungen zu gewährleisten, die erst nach Abschluss der Behandlung aufgetreten sind. Mit seiner Unterschrift unter den Studienvertrag bestätigt der Arzt bzw. die Ärztin, dass er/sie eine Liste führen wird, mit deren Hilfe die Patienten der Studie zurückverfolgbar sind (Patienten-Identifikations-Liste), falls dies später zur Auswertung der Studie notwendig sein sollte. 4.1 Labordiagnostik Alle während der Behandlung gemessenen Laborparameter sollten im entsprechenden Abschnitt des CRF dokumentiert werden. Da dies eine Beobachtungsstudie ist, werden keine Vorgaben zur Diagnostik gemacht. Bei der Behandlung eines Immunglobulinmangels ist zur Dokumentation des Therapieerfolgs die Messung des Ig-Wertes vor IVIG-Gabe (Ig-Talspiegel) empfehlenswert. Bei der Behandlung von Thrombozytopenien ist die Messung der Thrombozyten- Konzentration im Blut entscheidend für die Beurteilung des Therapieerfolges. Diese Werte sollen im CRF dokumentiert werden. Seite 3 von 8
4 4.2 Durchführung der Studie Dokumentation bei Einschluss Alter, Geschlecht, Größe, Gewicht Diagnose für die Immunglobulin-Gabe und ggf. zusätzliche Angabe der Grunderkrankung, Angabe vorhergehender IVIG-Behandlungen, begleitende Krankheiten und Medikation Erster bis sechster Therapiezyklus mit Privigen Ein Therapiezyklus beginnt mit dem ersten Behandlungstag, welcher einen Abstand von mindestens 18 Tagen zum Beginn des vorigen Therapiezyklus hat (Differenz der Daten 18 Tage) und umfasst alle folgenden Behandlungstage, die innerhalb eines Zeitraums von 17 Tagen nach dem Beginn des Therapiezyklus liegen (Differenz der Daten 17 Tage). Angabe des Datums Dokumentation unerwünschter Ereignisse, die nach dem letzten Besuch aufgetreten sind Dokumentation gemessener Laborwerte, insbesondere von IgG, Gamma-Globulin und ggf. Thrombozyten Angaben zur Privigen -Gabe (Menge, Infusionsraten) Dokumentation unerwünschter Arzneimittelwirkungen während oder unmittelbar nach der aktuellen Privigen -Applikation Angaben zur klinischen Wirksamkeit in Abhängigkeit von der behandelten Indikation (Immundefekt, idiopathische thrombozytopenische Purpura, Guillain-Barré-Syndrom, Kawasaki-Syndrom, chronische inflammatorische demyelinisierende Polyneuropathie) Abschlussdokumentation Ggf. Dokumentation unerwünschter IVIG-Wirkungen nach dem letzten Besuch Beurteilung von Wirksamkeit und Verträglichkeit der Privigen -Behandlung Bestätigung der Korrektheit der Angaben 5 MASSNAHMEN ZUR QUALITÄTSSICHERUNG Der gesamte Ablauf der Anwendungsbeobachtung und die übermittelten Dokumentationen werden laufend von einem neutralen Auftragsinstitut (INPADS GmbH) nach einer institutsinternen Standard Operating Procedure überwacht. Mit Hilfe von EDV-Programmen werden die erfassten Daten auf Plausibilität und Vollständigkeit der Zielparameter kontrolliert, ggf. beanstandet und zur Korrektur zurückgereicht. Gleichzeitig erfolgt eine Kontaktaufnahme bei den teilnehmenden Ärzten, falls unerwünschte Arzneimittelwirkungen unzureichend dokumentiert wurden. 6 STATISTIK Die Datenerfassung erfolgt Studien-begleitend durch Einscannen. Auftretende Freitexte werden von Hand nacherfasst. Seite 4 von 8
5 In die Auswertung werden alle eingeschlossenen Patienten eingehen (Intention to treat- Analyse). Sollten Patienten in nicht zugelassenen Indikationen eingeschlossen sein, wird eine weitere Analyse nach In-Label - und Off-Label - Anwendungen vorgenommen. Bei der Auswertung wird ggf. nach weiteren Subgruppen stratifiziert, um dokumentierte unerwünschte Arzneimittel-Wirkungen besser einordnen und beurteilen zu können. Von besonderem Interesse sind dabei die Unterschiede zwischen Patienten mit UAW und Patienten ohne UAW bezüglich der Dosierungen, der Infusionsgeschwindigkeiten und der Indikationen resp. der Grundkrankheiten. Alle Beobachtungen betreffend die Sicherheit und Verträglichkeit werden analysiert nach der klinischen Beschreibung, der durchgeführten Maßnahme, der Häufigkeit, der Schwere, der Wahrscheinlichkeit des Zusammenhangs und des Ausgangs sowie nach ihrer Korrelation mit der Dosis und der Infusionsgeschwindigkeit. Nebenwirkungen (Adverse Drug Reactions) werden kodiert nach MedDRA und gruppiert nach PT (Preferred Term) und SOC (System Organ Class). Alle dokumentierten Daten werden nach Abschluss des Projektes statistisch deskriptiv ausgewertet. Zwischenauswertungen zur Verlaufskontrolle der Anwendungsbeobachtung sind vorgesehen. Für kontinuierliche Variablen (Größe, Alter, Zeitspannen, etc.) werden die statistischen Kennwerte (n, Mittelwert, Minimum, Maximum, Standardabweichung, Median, Interquartilabstand, Perzentilen) tabellarisch aufgeführt. 7 UMGANG MIT UNERWÜNSCHTEN EREIGNISSEN 7.1 Definitionen Unerwünschtes Ereignis Ein unerwünschtes Ereignis (UE) ist jedes ungünstige medizinische Ereignis (einschließlich eines abweichenden klinisch bedeutsamen Laborbefunds), das im Verlauf der Anwendungsbeobachtung auftritt; es muss nicht notwendigerweise in ursächlichem Zusammenhang mit einem Arzneimittel stehen Schwerwiegendes unerwünschtes Ereignis Ein schwerwiegendes unerwünschtes Ereignis (SUE) ist jedes ungünstige medizinische Ereignis im Verlauf der Anwendungsbeobachtung, das zum Tod führt Das Ereignis muss die Todesursache sein, damit das SUE dieses Kriterium erfüllt. lebensbedrohlich ist Der Begriff lebensbedrohlich bezieht sich auf ein Ereignis, bei dem für den Patienten zum Zeitpunkt des Auftretens Lebensgefahr bestand; er bezieht sich nicht auf ein Ereignis, das hypothetisch zum Tode hätte führen können, wenn es schwerer ausgeprägt gewesen wäre. eine stationäre Behandlung oder deren Verlängerung erforderlich macht zu einer bleibenden oder signifikanten Behinderung führt eine angeborene Missbildung bzw. einen Geburtsfehler zur Folge hat Seite 5 von 8
6 medizinisch bedeutsam ist Ein medizinisch bedeutsames Ereignis ist definiert als ein Ereignis, das nicht notwendigerweise eines der obigen SUE-Kriterien erfüllt, das jedoch vom Arzt bzw. der Ärztin als mögliche Gefahr für den Patienten eingeschätzt wird, oder das eine medizinische oder eine chirurgische Maßnahme erfordert, um eine der vorstehend als SUE-Kriterien aufgeführten Komplikationen zu verhindern. Als medizinisch bedeutsames Ereignis gilt auch eine (vermutete) Übertragung eines Infektionserregers durch Blutkomponenten oder Plasmaderivate. Unerwünschte Ereignisse, die nicht unter die vorstehenden Kategorien fallen, werden als "nicht schwerwiegend" definiert Unerwünschte Arzneimittelwirkung (UAW) Unerwünschte Arzneimittelwirkungen sind alle schädlichen und unbeabsichtigten Reaktionen auf ein Arzneimittel. "Reaktion auf ein Arzneimittel" bedeutet in diesem Zusammenhang, dass ein ursächlicher Zusammenhang zwischen dem Arzneimittel und dem unerwünschten Ereignis nach vernünftigem Ermessen zumindest eine Möglichkeit darstellt Andere sicherheitsrelevante Ereignisse Die folgenden möglichen Ereignisse im Zusammenhang mit Privigen gelten im Rahmen dieser Anwendungsbeobachtung als "andere sicherheitsrelevante Ereignisse", auch wenn sie nicht mit einem UE verbunden sind: Missbräuchliche oder unsachgemäße Anwendung, Medikationsfehler und Exposition am Arbeitsplatz. 7.2 Erfassung unerwünschter Ereignisse Jedes UE, das im Verlauf der Anwendungsbeobachtung auftritt, wird vom Arzt bzw. von der Ärztin dahingehend eingeschätzt, ob nach vernünftigem Ermessen ein ursächlicher Zusammenhang zu Privigen zumindest vermutet werden kann, wobei die Formulierung nach vernünftigem Ermessen ein ursächlicher Zusammenhang im Allgemeinen bedeutet, dass Fakten (Evidenz) oder Argumente vorliegen, die auf einen ursächlichen Zusammenhang hindeuten.* In diesem Fall gilt das UE als UAW. * EMA ICH Topic E 2 A, CPMP/ICH/377/95, S. 5: The expression "reasonable causal relationship" is meant to convey in general that there are facts (evidence) or arguments to suggest a causal relationship. Sämtliche unerwünschten Ereignisse, die vom Arzt bzw. der Ärztin nicht als UAW im Zusammenhang mit Privigen eingestuft werden, werden im Dokumentationsbogen auf den "UE-Seiten" erfasst (mit Beschreibung des UE, Beginn, Ende, schwerwiegend ja/nein, ggf. Grund für Einstufung als "schwerwiegend"). Eine Ausnahme von dieser Regel stellen Infektionen dar, die nicht auf den UE-Seiten, sondern im CRF-Modul 4 des jeweiligen Therapiezyklus dokumentiert werden. Sämtliche unerwünschten Arzneimittelwirkungen im Zusammenhang mit der Gabe von Privigen werden auf dem Bericht über unerwünschte Arzneimittelwirkungen von CSL Behring festgehalten. Auf dem Berichtsformular werden die Patientenidentifikationsnummer und die CRF-Nummer vermerkt, wodurch es dem Patienten zugeordnet werden kann und die Pseudonymisierung trotzdem gewährleistet ist. Seite 6 von 8
7 Im Fall einer nicht schwerwiegenden UAW ist der ausgefüllte "Bericht über unerwünschte Arzneimittelwirkung" innerhalb von 5 Arbeitstagen nach Bekanntwerden der UAW an die auf dem Berichtsformular angegebene Nummer (06322/ ) zu faxen. Im Fall einer schwerwiegenden UAW beträgt die Meldefrist 1 Arbeitstag. (Diese Frist gilt als eingehalten, wenn der Bericht am Abend des Folgetages gefaxt wird.) Die Frage, ob die UAW schwerwiegend ist, muss in jedem UAW-Bericht beantwortet werden, desgleichen die unmittelbar darunter stehenden Fragen nach dem Ausgang der UAW und nach der Kausalität. Bei speziellen UAW kann CSL Behring im Rahmen ihrer Verpflichtungen als Zulassungsinhaberin zusätzliche Angaben erheben (z.b. mittels Pharmacovigilance-Fragebogen). Wenn ein UE, das nicht als UAW im Zusammenhang mit Privigen eingestuft wird, zum Tod des Patienten führt, ist der CRF umgehend zu vervollständigen und innerhalb von 3 Tagen per Post an INPADS GmbH, Dr.-Hugo-Bischoff-Str. 1a, Bad Dürkheim zu senden. (Bei elektronischer Dokumentation entfällt der Versand per Post, der CRF muss jedoch innerhalb von 3 Tagen vollständig ausgefüllt werden.) Dauert ein UE nach Abschluss der Studie weiter an, so obliegt es dem Arzt bzw. der Ärztin, den Patienten nachzubeobachten, bis das UE abklingt, sich stabilisiert oder der Patient nicht mehr zur Nachbeobachtung zur Verfügung steht. Alle relevanten Informationen sind an die Inpads GmbH weiterzuleiten. Tritt ein "anderes sicherheitsrelevantes Ereignis" ohne UE auf (Definition unter 7.1.4), ist innerhalb von 5 Arbeitstagen die medizinische Hotline der CSL Behring GmbH zu informieren (Tel. 069/ , Fax: 069/ ) 8 SCHWANGERSCHAFT Besteht während der Teilnahme an dieser Anwendungsbeobachtung eine Schwangeschaft, ist der beiliegende "Bericht über Arzneimittelexposition vor/während der Schwangerschaft" auszufüllen. Dies gilt unabhängig davon, ob die Schwangerschaft vor oder während der Teilnahme an der Anwendungsbeobachtung eingetreten ist. Der "Bericht über Arzneimittelexposition vor/während der Schwangerschaft" ist auch dann auszufüllen, wenn die Schwangerschaft in einem Zeitraum nach der letzten Privigen -Gabe eingetreten ist, innerhalb dessen noch von einer Wirkung des Präparats ausgegangen werden muss. Endet die Teilnahme an der Anwendungsbeobachtung vor dem Ende der Schwangerschaft, dann ist nach Ende der Schwangerschaft eine Nacherhebung der noch fehlenden Informationen vorzunehmen, insbesondere derjenigen in Modul 4 des Berichtsformulars (Schwangerschaftsverlauf und -ausgang). Die zusätzlichen Informationen sind an die auf dem Berichtsformular angegebene Nummer (06322/ ) zu faxen. Tritt eine durch Privigen verursachte unerwünschte Arzneimittelwirkung ein, die die Schwangere und/oder das ungeborene Kind betrifft, dann ist zusätzlich zum "Bericht über Arzneimittelexposition vor/während der Schwangerschaft" ein "Bericht über unerwünschte Arzneimittelwirkung" auszufüllen und mit den in Abschnitt 7 genannten Fristen an die auf dem Berichtsformular angegebene Nummer (06322/ ) zu faxen. Seite 7 von 8
8 9 REGULATORISCHE ANFORDERUNGEN 9.1 Patienten-Information und -Einwilligung Die Patienten müssen darüber informiert werden, dass ihre Behandlungsdaten pseudonymisiert in einer Datensammlung erfasst werden. Die schriftliche Einholung der Einwilligung des Patienten ist erforderlich. 9.2 Anzeigepflichten Die Durchführung dieser Studie wird den Behörden entsprechend den aktuellen deutschen Richtlinien ( 67 AMG) angezeigt. Dies umfasst auch monatlich aktualisierte Meldungen der teilnehmenden Ärzte mit Angabe der lebenslangen Arztnummern. 9.3 Ethikkommission Die Anwendungsbeobachtung wurde vor Beginn einer nach Landesrecht gebildeten unabhängigen interdisziplinär besetzten Ethik-Kommission vorgelegt und zustimmend bewertet, desgleichen alle relevanten Änderungen, die sich während der Durchführung als sinnvoll und notwendig erwiesen. 10 ABSCHLUSSBERICHT; PUBLIKATIONEN Nach Abschluss der statistischen Auswertung wird CSL Behring einen Abschlussbericht der Studie erstellen. Mit der Unterschrift unter den Studienvertrag stimmen die teilnehmenden Ärzte zu, dass CSL Behring die Studienergebnisse publizieren und verwerten darf. 11 KONTAKTADRESSEN Diese Studie wird betreut von: INPADS GMBH Dr.-Hugo-Bischoff-Str. 1a D Bad Dürkheim Tel.: 06322/ Fax: 06322/ Sponsor der Studie ist CSL Behring. Ansprechpartner für die Durchführung der Studie in Deutschland beim Sponsor ist: CSL Behring GmbH Philipp-Reis-Str. 2 D Hattersheim Tel.: Fax: Seite 8 von 8
Beobachtungsplan. Anwendungsbeobachtung BERINERT bei akutem Schub eines hereditären Angioödems
 CSL Behring GmbH Beobachtungsplan Anwendungsbeobachtung BERINERT bei akutem Schub eines hereditären Angioödems Studien-Code: Berinert-AWB 2009 Internationale Study ID: CE1145_5001 Eigentum von CSL Behring
CSL Behring GmbH Beobachtungsplan Anwendungsbeobachtung BERINERT bei akutem Schub eines hereditären Angioödems Studien-Code: Berinert-AWB 2009 Internationale Study ID: CE1145_5001 Eigentum von CSL Behring
Deutsches Psoriasis-Register zur Behandlung mit Biologika und Systemtherapeutika. CRF Case Report Forms
 Competenzzentrum Versorgungsforschung in der Dermatologie CVderm Förderprojekt der Deutschen Dermatologischen Gesellschaft DDG und des Berufsverbandes der Deutschen Dermatologen BVDD Deutsches Psoriasis-Register
Competenzzentrum Versorgungsforschung in der Dermatologie CVderm Förderprojekt der Deutschen Dermatologischen Gesellschaft DDG und des Berufsverbandes der Deutschen Dermatologen BVDD Deutsches Psoriasis-Register
Meldung von Serious Adverse Events (SAE) innerhalb von klinischen Studien
 Meldung von Serious Adverse Events (SAE) innerhalb von klinischen Studien Marga Lang-Welzenbach Strahlenklinik Warum dieses Thema beim Studientreffen? Ethikkommissionen empfehlen einen Qualifikationsnachweis
Meldung von Serious Adverse Events (SAE) innerhalb von klinischen Studien Marga Lang-Welzenbach Strahlenklinik Warum dieses Thema beim Studientreffen? Ethikkommissionen empfehlen einen Qualifikationsnachweis
Beobachtungsplan. Hizentra bei Patienten mit primären und sekundären Immundefekten
 Beobachtungsplan Hizentra bei Patienten mit primären und sekundären Immundefekten Studiencode: HZT-NIS-2011 Studienleitung: CSL Behring GmbH Philipp-Reis-Str. 2 65795 Hattersheim CSL Behring 1 von 12 VERTRAULICH
Beobachtungsplan Hizentra bei Patienten mit primären und sekundären Immundefekten Studiencode: HZT-NIS-2011 Studienleitung: CSL Behring GmbH Philipp-Reis-Str. 2 65795 Hattersheim CSL Behring 1 von 12 VERTRAULICH
Antrag bei der Krankenkasse Zur Übernahme der Behandlungskosten - Off Label Therapie bei Uveitis - Patient:, geb. Datum:
 Antrag bei der Krankenkasse Zur Übernahme der Behandlungskosten - Off Label Therapie bei Uveitis - Patient:, geb. Datum: Augen-Diagnosen (bitte alle auflisten): Uveitis bekannt seit: Symptome durch die
Antrag bei der Krankenkasse Zur Übernahme der Behandlungskosten - Off Label Therapie bei Uveitis - Patient:, geb. Datum: Augen-Diagnosen (bitte alle auflisten): Uveitis bekannt seit: Symptome durch die
Anhang III. Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage
 Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
IgPro10 (Privigen ) erhält EU-Zulassung zur Therapie der Chronisch inflammatorischen demyelinisierenden Polyneuropathie (CIDP)
 P R E S S E I N F O R M A T I O N IgPro10 (Privigen ) erhält EU-Zulassung zur Therapie der Chronisch inflammatorischen demyelinisierenden Polyneuropathie (CIDP) Hattersheim, 15. April 2013 Die Europäische
P R E S S E I N F O R M A T I O N IgPro10 (Privigen ) erhält EU-Zulassung zur Therapie der Chronisch inflammatorischen demyelinisierenden Polyneuropathie (CIDP) Hattersheim, 15. April 2013 Die Europäische
Erläuterung zum Ausfüllen des Formulars Erstanzeige einer Anwendungsbeobachtung nach 67 Abs. 6 AMG / nichtinterventionellen Unbedenklichkeitsprüfung
 Erläuterung zum Ausfüllen des Formulars Erstanzeige einer Anwendungsbeobachtung nach 67 Abs. 6 AMG / nichtinterventionellen Unbedenklichkeitsprüfung nach 63f Abs. Bitte verwenden Sie dieses Formular ausschließlich
Erläuterung zum Ausfüllen des Formulars Erstanzeige einer Anwendungsbeobachtung nach 67 Abs. 6 AMG / nichtinterventionellen Unbedenklichkeitsprüfung nach 63f Abs. Bitte verwenden Sie dieses Formular ausschließlich
Erläuterung zum Ausfüllen des Formulars Erstanzeige einer Anwendungsbeobachtung nach 67 Abs. 6 AMG / nichtinterventionellen Unbedenklichkeitsprüfung
 Erläuterung zum Ausfüllen des Formulars Erstanzeige einer Anwendungsbeobachtung nach 67 Abs. 6 AMG / nichtinterventionellen Unbedenklichkeitsprüfung nach 63f Abs. Bitte verwenden Sie dieses Formular ausschließlich
Erläuterung zum Ausfüllen des Formulars Erstanzeige einer Anwendungsbeobachtung nach 67 Abs. 6 AMG / nichtinterventionellen Unbedenklichkeitsprüfung nach 63f Abs. Bitte verwenden Sie dieses Formular ausschließlich
Als Krebspatient an einer Studie teilnehmen was sollte man wissen?
 Als Krebspatient an einer Studie teilnehmen was sollte man wissen? Krebsinformationsdienst, Heidelberg Dr. Susanne Weg-Remers Seite 2 Grundlage für evidenzbasiertes medizinisches Wissen sind klinische
Als Krebspatient an einer Studie teilnehmen was sollte man wissen? Krebsinformationsdienst, Heidelberg Dr. Susanne Weg-Remers Seite 2 Grundlage für evidenzbasiertes medizinisches Wissen sind klinische
Statistische Auswertung einer Anwendungsbeobachtung mit der Präparateserie ALBICANSAN
 Statistische Auswertung einer Anwendungsbeobachtung mit der Präparateserie ALBICANSAN in den Darreichungsformen Kapseln, Tropfen, Zäpfchen und Injektionslösung von Dr. Reiner Heidl 1. Einleitung In einer
Statistische Auswertung einer Anwendungsbeobachtung mit der Präparateserie ALBICANSAN in den Darreichungsformen Kapseln, Tropfen, Zäpfchen und Injektionslösung von Dr. Reiner Heidl 1. Einleitung In einer
Studieneintrag ins VfA Veröffentlichung von Ergebnissen aus abgeschlossenen NIS
 Studieneintrag ins VfA Veröffentlichung von Ergebnissen aus abgeschlossenen NIS Felder Studientitel Ziel/Fragestellung Marke/Handelsname Kommentare PIKOSO-Studie Populationsvergleich in der Rückenschmerztherapie
Studieneintrag ins VfA Veröffentlichung von Ergebnissen aus abgeschlossenen NIS Felder Studientitel Ziel/Fragestellung Marke/Handelsname Kommentare PIKOSO-Studie Populationsvergleich in der Rückenschmerztherapie
Statistische Auswertung einer Anwendungsbeobachtung mit SANUKEHL Prot D6 Tropfen
 Statistische Auswertung einer Anwendungsbeobachtung mit SANUKEHL Prot D6 Tropfen von Dr. Reiner Heidl 1 Einleitung In einer internistischen und zwei Allgemeinarztpraxen wurden vom Januar 1992 bis September
Statistische Auswertung einer Anwendungsbeobachtung mit SANUKEHL Prot D6 Tropfen von Dr. Reiner Heidl 1 Einleitung In einer internistischen und zwei Allgemeinarztpraxen wurden vom Januar 1992 bis September
Statistische Auswertung. in eine Anwendungsbeobachtung. SANUKEHL Pseu D6 Tropfen
 Statistische Auswertung einer Anwendungsbeobachtung mit SANUKEHL Pseu D6 Tropfen von Dr. Reiner Heidl Einleitung In einer internistischen, einer chirurgischen und zwei Allgemeinarztpraxen wurden zwischen
Statistische Auswertung einer Anwendungsbeobachtung mit SANUKEHL Pseu D6 Tropfen von Dr. Reiner Heidl Einleitung In einer internistischen, einer chirurgischen und zwei Allgemeinarztpraxen wurden zwischen
KURZFASSUNG DES PRÜFPROTOKOLLS 1839IL/0079 VOM
 KURZFASSUNG DES PRÜFPROTOKOLLS 1839IL/0079 VOM 11.11.02 RANDOMISIERTE, OFFENE, NICHT-KOMPARATIVE PHASE II STUDIE ZUR BEURTEILUNG DER WIRKSAMKEIT UND VERTRÄGLICHKEIT VON ZWEI DOSIERUNGEN ZD1839 BEI PATIENTEN
KURZFASSUNG DES PRÜFPROTOKOLLS 1839IL/0079 VOM 11.11.02 RANDOMISIERTE, OFFENE, NICHT-KOMPARATIVE PHASE II STUDIE ZUR BEURTEILUNG DER WIRKSAMKEIT UND VERTRÄGLICHKEIT VON ZWEI DOSIERUNGEN ZD1839 BEI PATIENTEN
Titel der Studie. Indikation Patientinnen mit primären, hormonrezeptor-positiven Mammakarzinom. Wirkstoff Letrozol. Marke/Handelsname FEMARA
 Titel der Studie Femara Anwendungsbeobachtung Eva Anwendungsbeobachtung zur Verträglichkeit, Wirksamkeit und Compliance in der adjuvanten Femara (Letrozol)- Therapie des primären, hormonrezeptor-positiven
Titel der Studie Femara Anwendungsbeobachtung Eva Anwendungsbeobachtung zur Verträglichkeit, Wirksamkeit und Compliance in der adjuvanten Femara (Letrozol)- Therapie des primären, hormonrezeptor-positiven
Statistische Auswertung einer Anwendungsbeobachtung mit SANUKEHL Acne D6 Tropfen
 Statistische Auswertung einer Anwendungsbeobachtung mit SANUKEHL Acne D6 Tropfen von Dr. Reiner Heidl 1 Einleitung In einer internistischen und zwei Allgemeinarztpraxen wurden vom August 1992 bis April
Statistische Auswertung einer Anwendungsbeobachtung mit SANUKEHL Acne D6 Tropfen von Dr. Reiner Heidl 1 Einleitung In einer internistischen und zwei Allgemeinarztpraxen wurden vom August 1992 bis April
Indikationsspezifischer Bericht zum DMP Asthma bronchiale für die Gemeinsame Einrichtung
 Indikationsspezifischer Bericht zum DMP Asthma bronchiale für die Gemeinsame Einrichtung Berichtszeitraum 01.01.2008 bis 30.06.2008 Erstellungstag: 01.08.2008 Erstellungssoftware: Rückmeldesystem / Copyright
Indikationsspezifischer Bericht zum DMP Asthma bronchiale für die Gemeinsame Einrichtung Berichtszeitraum 01.01.2008 bis 30.06.2008 Erstellungstag: 01.08.2008 Erstellungssoftware: Rückmeldesystem / Copyright
Paul-Ehrlich-Institut Bundesamt für Sera und Impfstoffe
 Bundesinstitut für Arzneimittel und Medizinprodukte Bundesamt für Sera und Impfstoffe Gemeinsame Empfehlungen des Bundesinstituts für Arzneimittel und Medizinprodukte und des s zur Planung, Durchführung
Bundesinstitut für Arzneimittel und Medizinprodukte Bundesamt für Sera und Impfstoffe Gemeinsame Empfehlungen des Bundesinstituts für Arzneimittel und Medizinprodukte und des s zur Planung, Durchführung
UNSERE VERANTWORTUNG FÜR DIE PATIENTENSICHERHEIT
 UNSERE VERANTWORTUNG FÜR DIE PATIENTENSICHERHEIT Im Gleichgewicht bleiben Ein gesunder Körper ist im Gleichgewicht. Wenn wir krank sind, bemüht sich der Körper, diese Balance wiederherzustellen. Doch manchmal
UNSERE VERANTWORTUNG FÜR DIE PATIENTENSICHERHEIT Im Gleichgewicht bleiben Ein gesunder Körper ist im Gleichgewicht. Wenn wir krank sind, bemüht sich der Körper, diese Balance wiederherzustellen. Doch manchmal
Zulassungsüberschreitende Anwendung von Arzneimitteln im Rahmen klinischer Studien ( 35c SGB V)
 Zulassungsüberschreitende Anwendung von Arzneimitteln im Rahmen klinischer Studien ( 35c SGB V) Berlin, 22. September 2009 Dr. Regina Skavron Abteilung Arzneimittel, Gemeinsamer Bundesausschuss Zulassungsüberschreitende
Zulassungsüberschreitende Anwendung von Arzneimitteln im Rahmen klinischer Studien ( 35c SGB V) Berlin, 22. September 2009 Dr. Regina Skavron Abteilung Arzneimittel, Gemeinsamer Bundesausschuss Zulassungsüberschreitende
Inhalt: Themenkomplex III:
 26.1.2018 Inhalt: Themenkomplex I: Themenkomplex II: Themenkomplex III: Definitionen FSCA Trendmeldungen I Themenkomplex: Definitionen 1 Frage: Wie ist eine schwerwiegende Verschlechterung des Gesundheitszustandes
26.1.2018 Inhalt: Themenkomplex I: Themenkomplex II: Themenkomplex III: Definitionen FSCA Trendmeldungen I Themenkomplex: Definitionen 1 Frage: Wie ist eine schwerwiegende Verschlechterung des Gesundheitszustandes
VPRIV (Velaglucerase alfa)
 VPRIV (Velaglucerase alfa) Schulungsmaterial für Ärzte Die hier aufgeführten Dokumente wurden von Shire im Rahmen der Verpflichtung zu Risikominimierungsmaβnahmen für VPRIV erstellt und dienen als Leitlinie
VPRIV (Velaglucerase alfa) Schulungsmaterial für Ärzte Die hier aufgeführten Dokumente wurden von Shire im Rahmen der Verpflichtung zu Risikominimierungsmaβnahmen für VPRIV erstellt und dienen als Leitlinie
Diagnostik und Versorgung von Patienten im Rahmen der pädiatrischen Kardiologie Anlage 3, Nr. 8
 Antrag nach 116 b SGB V Krankenhaus Diagnostik und Versorgung von Patienten im Rahmen der pädiatrischen Kardiologie Anlage 3, Nr. 8 1. Konkretisierung der Erkrankung und des Behandlungsauftrages mittels
Antrag nach 116 b SGB V Krankenhaus Diagnostik und Versorgung von Patienten im Rahmen der pädiatrischen Kardiologie Anlage 3, Nr. 8 1. Konkretisierung der Erkrankung und des Behandlungsauftrages mittels
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben?
 Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017
 Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017 Welche Nebenwirkungen sollten gemeldet werden? Erläuterung und Diskussion anhand von Fallbeispielen
Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017 Welche Nebenwirkungen sollten gemeldet werden? Erläuterung und Diskussion anhand von Fallbeispielen
Efficacy and safety of recombinant human activated protein C for severe sepsis Bernard, G.et al. N Engl J Med 2001; 344:
 RCT: Efficacy and safety of recombinant human activated protein C for severe sepsis Bernard, G.et al. Eignung der Studie für critical appraisal im Rahmen eines EbM Kurses: - typisches Beispiel für Arzneimittelstudie
RCT: Efficacy and safety of recombinant human activated protein C for severe sepsis Bernard, G.et al. Eignung der Studie für critical appraisal im Rahmen eines EbM Kurses: - typisches Beispiel für Arzneimittelstudie
Bewilligungsantrag Nucala (Mepolizumab) - Erstdokumentation
 Bewilligungsantrag - Erstdokumentation Sozialversicherungsnummer: Anwendungsgebiet: ist angezeigt als Zusatzbehandlung bei schwerem refraktärem eosinophilem Asthma bei erwachsenen Patienten (siehe Fachinformation
Bewilligungsantrag - Erstdokumentation Sozialversicherungsnummer: Anwendungsgebiet: ist angezeigt als Zusatzbehandlung bei schwerem refraktärem eosinophilem Asthma bei erwachsenen Patienten (siehe Fachinformation
Beobachtungsplan ixx2 /Trias -Implantate, Anwendungsbeobachtung
 Beobachtungsplan ixx2 /Trias -Implantate, Anwendungsbeobachtung Beim ixx2 /Trias / -Implantat handelt es sich um ein Medizinprodukt mit CE-Zertifizierung. Es besteht keinerlei Infektions- oder Allergisierungsrisiko,
Beobachtungsplan ixx2 /Trias -Implantate, Anwendungsbeobachtung Beim ixx2 /Trias / -Implantat handelt es sich um ein Medizinprodukt mit CE-Zertifizierung. Es besteht keinerlei Infektions- oder Allergisierungsrisiko,
Tragende Gründe zum Beschluss. des Gemeinsamen Bundesausschusses über die Änderung der Arzneimittel-Richtlinie (AM-RL):
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage 1 (OTC-Übersicht) Nr. 20 Ginkgo-biloba-Blätter-Extrakt Vom 14. April 2011 Inhaltsverzeichnis
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage 1 (OTC-Übersicht) Nr. 20 Ginkgo-biloba-Blätter-Extrakt Vom 14. April 2011 Inhaltsverzeichnis
ARBEITSBOGEN 11: ARZNEIMITTELBERATUNG ÄRZTLICHE VERORDNUNGEN
 I Hinweis zur Bearbeitung des Arbeitsbogens Informieren und beraten Sie einen Patienten über ein Fertigarzneimittel (FAM) bei der Abgabe im Rahmen einer ärztlichen Verordnung. Grundlage des Arbeitsbogens
I Hinweis zur Bearbeitung des Arbeitsbogens Informieren und beraten Sie einen Patienten über ein Fertigarzneimittel (FAM) bei der Abgabe im Rahmen einer ärztlichen Verordnung. Grundlage des Arbeitsbogens
EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR)
 EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR) IM ZUSAMMENHANG MIT BLUTKOMPONENTEN nach 63i Abs. 4 AMG Allgemeines: Durch
EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR) IM ZUSAMMENHANG MIT BLUTKOMPONENTEN nach 63i Abs. 4 AMG Allgemeines: Durch
STUDIEN PRO UND CONTRA
 V) WEITERE THEMEN STUDIEN PRO UND CONTRA Die Erfahrung hat gezeigt, dass Behandlungsergebnisse an mehr oder weniger kleinen Patientenzahlen von Autor zu Autor auch bei Einsatz gleicher Zytostatika zu unterschiedlichen,
V) WEITERE THEMEN STUDIEN PRO UND CONTRA Die Erfahrung hat gezeigt, dass Behandlungsergebnisse an mehr oder weniger kleinen Patientenzahlen von Autor zu Autor auch bei Einsatz gleicher Zytostatika zu unterschiedlichen,
Empfehlung für den Umgang mit multizentrischen Studien außerhalb von AMG oder MPG durch Ethik-Kommissionen I. Vorbemerkungen
 Empfehlung für den Umgang mit multizentrischen Studien außerhalb von AMG oder MPG durch Ethik-Kommissionen gemäß Beschluss des Arbeitskreises Medizinischer Ethik-Kommissionen in der Bundesrepublik Deutschland
Empfehlung für den Umgang mit multizentrischen Studien außerhalb von AMG oder MPG durch Ethik-Kommissionen gemäß Beschluss des Arbeitskreises Medizinischer Ethik-Kommissionen in der Bundesrepublik Deutschland
fortgeschrittenem Lungenemphysem
 PneumRx Coils: Neue randomisierte klinische Studien bestätigen wiederholt positive Ergebnisse bei Pa PneumRx Coils Neue randomisierte klinische Studien bestätigen wiederholt positive Ergebnisse bei Patienten
PneumRx Coils: Neue randomisierte klinische Studien bestätigen wiederholt positive Ergebnisse bei Pa PneumRx Coils Neue randomisierte klinische Studien bestätigen wiederholt positive Ergebnisse bei Patienten
Verordnung über Medizinprodukte - MPV (Medizinprodukte-Verordnung)
 Verordnung über Medizinprodukte - MPV (Medizinprodukte-Verordnung) Vom 20. Dezember 2001,Bundesgesetzblatt I Nr. 72, S. 3854 22. Dezember 2001, geändert durch Bundesgesetzblatt I S. 4456 vom 4. Dezember
Verordnung über Medizinprodukte - MPV (Medizinprodukte-Verordnung) Vom 20. Dezember 2001,Bundesgesetzblatt I Nr. 72, S. 3854 22. Dezember 2001, geändert durch Bundesgesetzblatt I S. 4456 vom 4. Dezember
startfaq BAG Beobachtungsstudie Bias
 Hier finden Sie die Erläuterung zu Fachbegriffen, welche in wissenschaftlichen Studien verwendet werden. Sollten Begriffe nicht aufgeführt sein, geben Sie uns doch ein Feedback, damit wir diese ergänzen
Hier finden Sie die Erläuterung zu Fachbegriffen, welche in wissenschaftlichen Studien verwendet werden. Sollten Begriffe nicht aufgeführt sein, geben Sie uns doch ein Feedback, damit wir diese ergänzen
Entwurf der Bekanntmachung zur Anzeige von AWBs und nichtinterventionellen PASS 75. Routinesitzung Bonn, 11. November 2014
 Entwurf der Bekanntmachung zur Anzeige von AWBs und nichtinterventionellen PASS 75. Routinesitzung Bonn, 11. November 2014 Bundesinstitut für Arzneimittel und Medizinprodukte Das BfArM ist ein Bundesinstitut
Entwurf der Bekanntmachung zur Anzeige von AWBs und nichtinterventionellen PASS 75. Routinesitzung Bonn, 11. November 2014 Bundesinstitut für Arzneimittel und Medizinprodukte Das BfArM ist ein Bundesinstitut
Richtlinie. in der Fassung vom 24. August 1989 veröffentlicht im Bundesarbeitsblatt Nr. 10 vom 29. September 1989 in Kraft getreten am 1.
 Richtlinie des Gemeinsamen Bundesausschusses über die Gesundheitsuntersuchungen zur Früherkennung von Krankheiten (Gesundheitsuntersuchungs-Richtlinie) in der Fassung vom 24. August 1989 veröffentlicht
Richtlinie des Gemeinsamen Bundesausschusses über die Gesundheitsuntersuchungen zur Früherkennung von Krankheiten (Gesundheitsuntersuchungs-Richtlinie) in der Fassung vom 24. August 1989 veröffentlicht
1. Zusatznutzen des Arzneimittels im Verhältnis zur zweckmäßigen Vergleichstherapie
 Alirocumab Beschluss vom: 4. Mai 2016 gültig bis: unbefristet In Kraft getreten am: 4. Mai 2016 BAnz AT 16.06.2016 B3 Zugelassenes Anwendungsgebiet vom 23. September 2015: Praluent ist, begleitend zu einer
Alirocumab Beschluss vom: 4. Mai 2016 gültig bis: unbefristet In Kraft getreten am: 4. Mai 2016 BAnz AT 16.06.2016 B3 Zugelassenes Anwendungsgebiet vom 23. September 2015: Praluent ist, begleitend zu einer
Richtlinien des Bundesausschusses der Zahnärzte und Krankenkassen
 Richtlinien des Bundesausschusses der Zahnärzte und Krankenkassen über die Einführung neuer Untersuchungs- und Behandlungsmethoden und die Überprüfung erbrachter vertragszahnärztlicher Leistungen (NUB-Richtlinien)
Richtlinien des Bundesausschusses der Zahnärzte und Krankenkassen über die Einführung neuer Untersuchungs- und Behandlungsmethoden und die Überprüfung erbrachter vertragszahnärztlicher Leistungen (NUB-Richtlinien)
Feedbackbericht DMP Asthma bronchiale (Kinder und Jugendliche) - 1. Halbjahr 2008
 Gemeinsame Einrichtung DMP Bayern, Elsenheimerstraße 39, 80687 München Herrn Dr.med. Max Mustermann Kinder- und Jugendarzt Musterstraße 1 81234 München Feedbackbericht DMP Asthma bronchiale (Kinder und
Gemeinsame Einrichtung DMP Bayern, Elsenheimerstraße 39, 80687 München Herrn Dr.med. Max Mustermann Kinder- und Jugendarzt Musterstraße 1 81234 München Feedbackbericht DMP Asthma bronchiale (Kinder und
Dossierbewertung A14-01 Version 1.0 Trastuzumab Emtansin Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Trastuzumab Emtansin gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Trastuzumab Emtansin gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf
Sicherheitsrelevante Hinweise für medizinische Fachkreise
 Sicherheitsrelevante Hinweise für medizinische Fachkreise für die Therapie des multiplen Myeloms mit Bortezomib in Abhängigkeit von den unterschiedlichen Indikationen im Rahmen der Indikationserweiterung
Sicherheitsrelevante Hinweise für medizinische Fachkreise für die Therapie des multiplen Myeloms mit Bortezomib in Abhängigkeit von den unterschiedlichen Indikationen im Rahmen der Indikationserweiterung
Anhang III. Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale
Anhang III Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale
Dossierbewertung A14-28 Version 1.0 Apixaban (neues Anwendungsgebiet) Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Apixaban (neues Anwendungsgebiet) gemäß 35a SGB V beauftragt. Die Bewertung
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Apixaban (neues Anwendungsgebiet) gemäß 35a SGB V beauftragt. Die Bewertung
Colchicinhaltige Arzneimittel, Risiko von Medikationsfehlern und Missbrauch, Anhörung nach dem Stufenplan zur Begrenzung der Packungsgröße
 Colchicinhaltige Arzneimittel, Risiko von Medikationsfehlern und Missbrauch, Anhörung nach dem Stufenplan zur Begrenzung der Packungsgröße 80. Routinesitzung am 16. Mai 2017 80. Routinesitzung 16. Mai
Colchicinhaltige Arzneimittel, Risiko von Medikationsfehlern und Missbrauch, Anhörung nach dem Stufenplan zur Begrenzung der Packungsgröße 80. Routinesitzung am 16. Mai 2017 80. Routinesitzung 16. Mai
IQWiG Herbstsymposium / Unterschied zwischen Risiko-Nutzenabwägung (nach AMG) und Nutzen-Schadenabwägung (nach SGB V)
 IQWiG Herbstsymposium 19.11./20.11.2010 Unterschied zwischen Risiko-Nutzenabwägung (nach AMG) und Nutzen-Schadenabwägung (nach SGB V) Referent: Maximilian Grüne, Justiziar Gemeinsamer Bundesausschuss Seite
IQWiG Herbstsymposium 19.11./20.11.2010 Unterschied zwischen Risiko-Nutzenabwägung (nach AMG) und Nutzen-Schadenabwägung (nach SGB V) Referent: Maximilian Grüne, Justiziar Gemeinsamer Bundesausschuss Seite
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Studien in der Onkologie Bewertung und Bedeutung
 Studien in der Onkologie Bewertung und Bedeutung Referentin Annette Schuster Münchner Studienzentrum am Klinikum rechts der Isar der Technischen Universität t MünchenM 1 eigentlich wollte ich nicht an
Studien in der Onkologie Bewertung und Bedeutung Referentin Annette Schuster Münchner Studienzentrum am Klinikum rechts der Isar der Technischen Universität t MünchenM 1 eigentlich wollte ich nicht an
Was sind klinische Prüfungen Eine Einführung. Dr. Thorsten Ruppert Senior Referent Grundsatzfragen Forschung/Entwicklung/Innovation, vfa
 Was sind klinische Prüfungen Eine Einführung Dr. Thorsten Ruppert Senior Referent Grundsatzfragen Forschung/Entwicklung/Innovation, vfa Berlin, 28. Januar 2016 Klinische Studie vs. Klinische Prüfung Wie
Was sind klinische Prüfungen Eine Einführung Dr. Thorsten Ruppert Senior Referent Grundsatzfragen Forschung/Entwicklung/Innovation, vfa Berlin, 28. Januar 2016 Klinische Studie vs. Klinische Prüfung Wie
Erivedge Schwangerschaftsverhütungs-Programm:
 Erivedge Schwangerschaftsverhütungs-Programm: Wichtige Informationen zu Empfängnisverhütung und Verhütungsmethoden für männliche und weibliche Patienten, die Erivedge einnehmen. Erivedge kann schwere Geburtsfehler
Erivedge Schwangerschaftsverhütungs-Programm: Wichtige Informationen zu Empfängnisverhütung und Verhütungsmethoden für männliche und weibliche Patienten, die Erivedge einnehmen. Erivedge kann schwere Geburtsfehler
Monate Präop Tabelle 20: Verteilung der NYHA-Klassen in Gruppe 1 (alle Patienten)
 Parameter zur Beschreibung der Leistungsfähigkeit Klassifikation der New-York-Heart-Association (NYHA) Gruppe 1 (alle Patienten): Die Eingruppierung der Patienten in NYHA-Klassen als Abbild der Schwere
Parameter zur Beschreibung der Leistungsfähigkeit Klassifikation der New-York-Heart-Association (NYHA) Gruppe 1 (alle Patienten): Die Eingruppierung der Patienten in NYHA-Klassen als Abbild der Schwere
Der Leitfaden zur Beratung. Informations- und Beratungshinweise in öffentlichen Apotheken
 Informations- und shinweise in öffentlichen Apotheken Dieser Leitfaden dient zur Eigen- und Fremdbeurteilung der und Information bei der Abgabe von Arzneimitteln auf ärztliche Verordnung sowie im Rahmen
Informations- und shinweise in öffentlichen Apotheken Dieser Leitfaden dient zur Eigen- und Fremdbeurteilung der und Information bei der Abgabe von Arzneimitteln auf ärztliche Verordnung sowie im Rahmen
Myositis - Erfahrungen mit Immunglobulintherapie
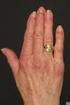 Myositis - Erfahrungen mit Immunglobulintherapie Dr. med. S. Geisenhof Klinikum Dritter Orden, München Städtisches Klinikum München - Klinikum Schwabing 1 Portkatheter - Was ist das? Reservoir (Port) dauerhaft
Myositis - Erfahrungen mit Immunglobulintherapie Dr. med. S. Geisenhof Klinikum Dritter Orden, München Städtisches Klinikum München - Klinikum Schwabing 1 Portkatheter - Was ist das? Reservoir (Port) dauerhaft
Wie funktioniert eine klinische Studie?
 Wie funktioniert eine klinische Studie? Bernhard Saller 3. Süddeutscher Hypophysen- und Nebennierentag München, 5. Mai 2007 Definitionen Ablauf klinischer Studien Klinische Arzneimittelprüfungen Zulassungsprozess
Wie funktioniert eine klinische Studie? Bernhard Saller 3. Süddeutscher Hypophysen- und Nebennierentag München, 5. Mai 2007 Definitionen Ablauf klinischer Studien Klinische Arzneimittelprüfungen Zulassungsprozess
Rhesus-Prophylaxe. Schutz für Mutter und Kind
 Rhesus-Prophylaxe Schutz für Mutter und Kind Der Begriff Rhesusunverträglichkeit Neben den Blutgruppen A, B und 0 existieren weitere Blutgruppenmerkmale, wie das Rhesussystem (D-System). Bei diesem System
Rhesus-Prophylaxe Schutz für Mutter und Kind Der Begriff Rhesusunverträglichkeit Neben den Blutgruppen A, B und 0 existieren weitere Blutgruppenmerkmale, wie das Rhesussystem (D-System). Bei diesem System
Frühe Nutzenbewertung aus Sicht des IQWiG. Jürgen Windeler
 Frühe Nutzenbewertung aus Sicht des IQWiG Jürgen Windeler AMNOG, aus der Begründung Die Datenlage für neue Wirkstoffe (insbesondere in der Onkologie) wird von Experten als unbefriedigend bezeichnet. Die
Frühe Nutzenbewertung aus Sicht des IQWiG Jürgen Windeler AMNOG, aus der Begründung Die Datenlage für neue Wirkstoffe (insbesondere in der Onkologie) wird von Experten als unbefriedigend bezeichnet. Die
Botulinumtoxin bei Hyperhidrose
 Botulinumtoxin bei Hyperhidrose EVIDENZ KOMPAKT Stand: 17.10.2017 EVIDENZ KOMPAKT Botulinumtoxin bei Hyperhidrose Stand: 17.10.2017 Autoren Dr. Dawid Pieper, MPH Institut für Forschung in der Operativen
Botulinumtoxin bei Hyperhidrose EVIDENZ KOMPAKT Stand: 17.10.2017 EVIDENZ KOMPAKT Botulinumtoxin bei Hyperhidrose Stand: 17.10.2017 Autoren Dr. Dawid Pieper, MPH Institut für Forschung in der Operativen
Antrag zur Erteilung einer Erlaubnis zum Versand apothekenpflichtiger Arzneimittel nach 11a Apothekengesetz
 Antrag zur Erteilung einer Erlaubnis zum Versand apothekenpflichtiger Arzneimittel nach 11a Apothekengesetz Antragsteller (Inhaber der Betriebserlaubnis): Name: Vorname Name und Anschrift der Versandapotheke
Antrag zur Erteilung einer Erlaubnis zum Versand apothekenpflichtiger Arzneimittel nach 11a Apothekengesetz Antragsteller (Inhaber der Betriebserlaubnis): Name: Vorname Name und Anschrift der Versandapotheke
Indikationsspezifischer Bericht zum DMP COPD für die Gemeinsame Einrichtung
 Indikationsspezifischer Bericht zum DMP COPD für die Gemeinsame Einrichtung Berichtszeitraum 01.07.2007 bis 31.12.2007 Erstellungstag: 26.01.2010 Erstellungssoftware: Rückmeldesystem / Copyright KBV Kassenärztliche
Indikationsspezifischer Bericht zum DMP COPD für die Gemeinsame Einrichtung Berichtszeitraum 01.07.2007 bis 31.12.2007 Erstellungstag: 26.01.2010 Erstellungssoftware: Rückmeldesystem / Copyright KBV Kassenärztliche
Anhang I. Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen
 Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Beschluss vom: 2. August 2012 gültig bis: unbefristet In Kraft getreten am: 2. August 2012 BAnz AT B3
 Beschluss vom: 2. August 202 gültig bis: unbefristet In Kraft getreten am: 2. August 202 BAnz AT 9.09.202 B3 Zugelassenes Anwendungsgebiet: Benlysta ist indiziert als Zusatztherapie bei erwachsenen Patienten
Beschluss vom: 2. August 202 gültig bis: unbefristet In Kraft getreten am: 2. August 202 BAnz AT 9.09.202 B3 Zugelassenes Anwendungsgebiet: Benlysta ist indiziert als Zusatztherapie bei erwachsenen Patienten
Paul-Ehrlich-Institut
 Bundesinstitut für Arzneimittel und Medizinprodukte Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel Empfehlungen des Bundesinstituts für Arzneimittel und Medizinprodukte und des s zur Planung,
Bundesinstitut für Arzneimittel und Medizinprodukte Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel Empfehlungen des Bundesinstituts für Arzneimittel und Medizinprodukte und des s zur Planung,
Optimierung der Epoetin-Therapie bei Patienten mit Tumorerkrankung durch intravenöse Eisengabe
 Optimierung der Epoetin-Therapie bei Patienten mit Tumorerkrankung durch intravenöse Eisengabe Interimsanalyse eines multizentrischen, offenen Qualitätssicherungsprojektes mit > 500 Patienten aus über
Optimierung der Epoetin-Therapie bei Patienten mit Tumorerkrankung durch intravenöse Eisengabe Interimsanalyse eines multizentrischen, offenen Qualitätssicherungsprojektes mit > 500 Patienten aus über
Dossierbewertung A16-10 Version 1.0 Ramucirumab (Kolorektalkarzinom)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ramucirumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ramucirumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
Stand: [Briefkopf Transplantationszentrum] Sehr geehrte Patientin, sehr geehrter Patient,
![Stand: [Briefkopf Transplantationszentrum] Sehr geehrte Patientin, sehr geehrter Patient, Stand: [Briefkopf Transplantationszentrum] Sehr geehrte Patientin, sehr geehrter Patient,](/thumbs/77/75831895.jpg) [Briefkopf Transplantationszentrum] Patienteninformation gemäß 15e Transplantationsgesetz (TPG) für die Datenübermittlung an die Transplantationsregisterstelle und an die Vertrauensstelle Stand: 14.02.2017
[Briefkopf Transplantationszentrum] Patienteninformation gemäß 15e Transplantationsgesetz (TPG) für die Datenübermittlung an die Transplantationsregisterstelle und an die Vertrauensstelle Stand: 14.02.2017
Anlage V zum 2. Kapitel VerfO
 Formular zur Übermittlung von Informationen über den Stand der wissenschaftlichen Erkenntnisse für die Bewertung einer neuen Untersuchungs- oder Behandlungsmethode mit Medizinprodukten hoher Risikoklasse
Formular zur Übermittlung von Informationen über den Stand der wissenschaftlichen Erkenntnisse für die Bewertung einer neuen Untersuchungs- oder Behandlungsmethode mit Medizinprodukten hoher Risikoklasse
Daten bestätigen Bedeutung einer frühen Behandlung von Patienten mit Multipler Sklerose (MS)
 Europäischer Multiple-Sklerose-Kongress ECTRIMS: Daten bestätigen Bedeutung einer frühen Behandlung von Patienten mit Multipler Sklerose (MS) - Studienergebnisse belegen kognitive Funktionseinschränkungen
Europäischer Multiple-Sklerose-Kongress ECTRIMS: Daten bestätigen Bedeutung einer frühen Behandlung von Patienten mit Multipler Sklerose (MS) - Studienergebnisse belegen kognitive Funktionseinschränkungen
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM- RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM- RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Antrag auf biometrische und datentechnische Unterstützung von medizinischen Forschungsprojekten
 Antrag auf biometrische und datentechnische Unterstützung von medizinischen Forschungsprojekten Angaben zur Person Anrede Frau Titel Professor Herr Doktor Name Vorname Email Telefon Klinik-/Institutsbezeichnung
Antrag auf biometrische und datentechnische Unterstützung von medizinischen Forschungsprojekten Angaben zur Person Anrede Frau Titel Professor Herr Doktor Name Vorname Email Telefon Klinik-/Institutsbezeichnung
Der informierte Patient als Wegbereiter der zukünftigen Forschung
 Der informierte Patient als Wegbereiter der zukünftigen Forschung Riegler S., Macheiner T., Riegler A. MedPro 2014, Brandenburg Agenda Die Rolle des informierten Patienten im Bereich Biobanking Der Einwilligungsprozess
Der informierte Patient als Wegbereiter der zukünftigen Forschung Riegler S., Macheiner T., Riegler A. MedPro 2014, Brandenburg Agenda Die Rolle des informierten Patienten im Bereich Biobanking Der Einwilligungsprozess
Bezeichnung des Arzneimittels: Vom Pharmazeutischen Unternehmer auszufüllen Pharmazeutischen Unternehmer:
 Fragebogen für Angehörige der Gesundheitsberufe zur Meldung einer Exposition gegenüber Mycophenolat-haltigen Arzneimitteln (z. B. CellCept, Myfortic und andere Arzneimittelnamen) während einer Schwangerschaft
Fragebogen für Angehörige der Gesundheitsberufe zur Meldung einer Exposition gegenüber Mycophenolat-haltigen Arzneimitteln (z. B. CellCept, Myfortic und andere Arzneimittelnamen) während einer Schwangerschaft
Abgrenzung klinischer Prüfungen Phase III und IV gegenüber nichtinterventionellen
 Abgrenzung klinischer Prüfungen Phase III und IV gegenüber nichtinterventionellen Studien Studien PHIII und IV versus Nichtinterventionelle Studien 1 Welche Aussagen sind richtig?? -1- Klinische Studien
Abgrenzung klinischer Prüfungen Phase III und IV gegenüber nichtinterventionellen Studien Studien PHIII und IV versus Nichtinterventionelle Studien 1 Welche Aussagen sind richtig?? -1- Klinische Studien
Klinische Prüfung: Planung, Verantwortlichkeiten und Organisation. Michael Fuchs Leiter der Studienzentrale der German Hodgkin Study Group
 Klinische Prüfung: Planung, Verantwortlichkeiten und Organisation Michael Fuchs Leiter der Studienzentrale der German Hodgkin Study Group Hämatologie im Wandel, Frankfurt 28. Februar 2015 2 Überblick Einführung
Klinische Prüfung: Planung, Verantwortlichkeiten und Organisation Michael Fuchs Leiter der Studienzentrale der German Hodgkin Study Group Hämatologie im Wandel, Frankfurt 28. Februar 2015 2 Überblick Einführung
Tabelle 1: Altersverteilung der Patienten (n = 42) in Jahren
 3. Ergebnisse Die 42 Patienten (w= 16, m= 26) hatten ein Durchschnittsalter von 53,5 Jahren mit einem Minimum von und einem Maximum von 79 Jahren. Die 3 Patientengruppen zeigten hinsichtlich Alters- und
3. Ergebnisse Die 42 Patienten (w= 16, m= 26) hatten ein Durchschnittsalter von 53,5 Jahren mit einem Minimum von und einem Maximum von 79 Jahren. Die 3 Patientengruppen zeigten hinsichtlich Alters- und
Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm
 Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm Sehr geehrte Frau Doktor, sehr geehrter Herr Doktor, Dieses
Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm Sehr geehrte Frau Doktor, sehr geehrter Herr Doktor, Dieses
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Pitolisant wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der -Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von n mit neuen Wirkstoffen nach 35a SGB V Vom 19. Januar 2017 Der
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der -Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von n mit neuen Wirkstoffen nach 35a SGB V Vom 19. Januar 2017 Der
imedication Identifizierung und Überwachung von unerwünschten Arzneimittelwirkungen
 imedication Identifizierung und Überwachung von unerwünschten Arzneimittelwirkungen DI Manuela Plößnig, MSc Salzburg Research 21. November 2012 Heilen ist eine Frage der Zeit, mitunter aber auch eine Frage
imedication Identifizierung und Überwachung von unerwünschten Arzneimittelwirkungen DI Manuela Plößnig, MSc Salzburg Research 21. November 2012 Heilen ist eine Frage der Zeit, mitunter aber auch eine Frage
Zeitliche Umsetzung des Europäischen Ausbildungscurriculums im primären Ausbildungszentrum ZKJM
 Zeitliche Umsetzung des Europäischen Ausbildungscurriculums Anlage 1 Zeitliche Umsetzung des Europäischen Ausbildungscurriculums im primären Ausbildungszentrum ZKJM Pflicht-Module Krankenhaus Labor Forschung
Zeitliche Umsetzung des Europäischen Ausbildungscurriculums Anlage 1 Zeitliche Umsetzung des Europäischen Ausbildungscurriculums im primären Ausbildungszentrum ZKJM Pflicht-Module Krankenhaus Labor Forschung
ANTRAG AUF GENEHMIGUNG für Arzneimittel für neuartige Therapien
 ANTRAG AUF GENEHMIGUNG für Arzneimittel für neuartige Therapien nach 4 b Abs. 3 i.v.m. 21a Abs. 2-8 des Arzneimittelgesetzes (AMG) Modul 0 Einstufung des Arzneimittels als Arzneimittel für neuartige Therapien
ANTRAG AUF GENEHMIGUNG für Arzneimittel für neuartige Therapien nach 4 b Abs. 3 i.v.m. 21a Abs. 2-8 des Arzneimittelgesetzes (AMG) Modul 0 Einstufung des Arzneimittels als Arzneimittel für neuartige Therapien
Look back Kommunikation zwischen Anwender & Pharmazeutischem Hersteller
 Look back Kommunikation zwischen Anwender & Pharmazeutischem Hersteller Blutspendedienst des BRK Dr. Petra Michel Stufenplanbeauftragte Hannover, 27. September 2011 Rückverfolgung Regulatorische Vorgaben
Look back Kommunikation zwischen Anwender & Pharmazeutischem Hersteller Blutspendedienst des BRK Dr. Petra Michel Stufenplanbeauftragte Hannover, 27. September 2011 Rückverfolgung Regulatorische Vorgaben
Anhang III. Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage
 Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
Dossierbewertung A15-20 Version 1.0 Secukinumab Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Secukinumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Secukinumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
505 Klassen der ICD-10-GM 2009
 Die Folien sind nur in Verbindung mit dem mündlichen Vortrag zu verwenden. Stand: 07.09.2010 Unerwünschte Arzneimittelwirkungen und Medikationsfehler in deutschen Krankenhäusern: Eine Analyse von Routinedaten
Die Folien sind nur in Verbindung mit dem mündlichen Vortrag zu verwenden. Stand: 07.09.2010 Unerwünschte Arzneimittelwirkungen und Medikationsfehler in deutschen Krankenhäusern: Eine Analyse von Routinedaten
Richtlinien. des Bundesausschusses der Ärzte und Krankenkassen
 Richtlinien des Bundesausschusses der Ärzte und Krankenkassen über die Gesundheitsuntersuchung zur Früherkennung von Krankheiten ( Gesundheitsuntersuchungs-Richtlinien ) in der Fassung vom 24. August 1989
Richtlinien des Bundesausschusses der Ärzte und Krankenkassen über die Gesundheitsuntersuchung zur Früherkennung von Krankheiten ( Gesundheitsuntersuchungs-Richtlinien ) in der Fassung vom 24. August 1989
NeuroBloc. Botulinumtoxin Typ B Injektionslösung 5000 E/ml. Wichtige Informationen zur Sicherheit für Ärzte
 NeuroBloc Botulinumtoxin Typ B Injektionslösung 5000 E/ml Wichtige Informationen zur Sicherheit für Ärzte Dieses Handbuch dient dazu, Ärzte, die für die Verschreibung und die Verabreichung von NeuroBloc
NeuroBloc Botulinumtoxin Typ B Injektionslösung 5000 E/ml Wichtige Informationen zur Sicherheit für Ärzte Dieses Handbuch dient dazu, Ärzte, die für die Verschreibung und die Verabreichung von NeuroBloc
Variablen-Übersicht des Kinder-Moduls im Kompetenznetz HIV/AIDS
 Variablen-Übersicht des Kinder-Moduls im Kompetenznetz HIV/AIDS Stand: März 2009 Variablen-Übersicht Kindermodul 2 Inhalt I. HIV-positive Kinder... 3 I.1. Registrierung / Soziodemographie... 3 I.2. Anamnese...
Variablen-Übersicht des Kinder-Moduls im Kompetenznetz HIV/AIDS Stand: März 2009 Variablen-Übersicht Kindermodul 2 Inhalt I. HIV-positive Kinder... 3 I.1. Registrierung / Soziodemographie... 3 I.2. Anamnese...
Beschluss vom: 15. Dezember 2016 gültig bis: unbefristet In Kraft getreten am: 15. Dezember 2016 BAnz AT B2
 (neues Anwendungsgebiet: follikuläres Lymphom) Beschluss vom: 15. Dezember 2016 gültig bis: unbefristet In Kraft getreten am: 15. Dezember 2016 BAnz AT 13.01.2017 B2 Zugelassenes Anwendungsgebiet (laut
(neues Anwendungsgebiet: follikuläres Lymphom) Beschluss vom: 15. Dezember 2016 gültig bis: unbefristet In Kraft getreten am: 15. Dezember 2016 BAnz AT 13.01.2017 B2 Zugelassenes Anwendungsgebiet (laut
Meldungen unerwünschter Wirkungen an das PEI
 Meldungen unerwünschter Wirkungen an das PEI Brigitte Keller-Stanislawski Markus Funk Annette Lohmann Paul-Ehrlich-Str. 5-59 635 Langen arzneimittelsicherheit@pei.de http://www.pei.de Hämovigilanz in Deutschland
Meldungen unerwünschter Wirkungen an das PEI Brigitte Keller-Stanislawski Markus Funk Annette Lohmann Paul-Ehrlich-Str. 5-59 635 Langen arzneimittelsicherheit@pei.de http://www.pei.de Hämovigilanz in Deutschland
Dossierbewertung A11-30 Version 1.0 Apixaban Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat mit Schreiben vom 14.12.2011 das IQWiG mit der Nutzenbewertung des Wirkstoffs Apixaban gemäß 35a SGB V beauftragt. Die Bewertung
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat mit Schreiben vom 14.12.2011 das IQWiG mit der Nutzenbewertung des Wirkstoffs Apixaban gemäß 35a SGB V beauftragt. Die Bewertung
Welt Lymphom Tag Seminar für Patienten und Angehörige 15. September 2007 Wien
 Welt Lymphom Tag Seminar für Patienten und Angehörige 15. September 2007 Wien Ein Vortrag von Univ. Prof. Dr. Johannes Drach Medizinische Universität Wien Univ. Klinik für Innere Medizin I Klinische Abteilung
Welt Lymphom Tag Seminar für Patienten und Angehörige 15. September 2007 Wien Ein Vortrag von Univ. Prof. Dr. Johannes Drach Medizinische Universität Wien Univ. Klinik für Innere Medizin I Klinische Abteilung
Wichtige Sicherheitshinweise in Bezug auf Schwangerschaften bei Patientinnen, die Odomzo -Kapseln (Sonidegib) einnehmen
 Wichtige Sicherheitshinweise in Bezug auf Schwangerschaften bei Patientinnen, die Odomzo -Kapseln (Sonidegib) einnehmen Diese Informationsbroschüre ist verpflichtender Teil der Zulassung von Odomzo (Sonidegib)
Wichtige Sicherheitshinweise in Bezug auf Schwangerschaften bei Patientinnen, die Odomzo -Kapseln (Sonidegib) einnehmen Diese Informationsbroschüre ist verpflichtender Teil der Zulassung von Odomzo (Sonidegib)
Anhang III. Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des
Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des
Studienkurztitel.: Monitoringbesuch Nr.: Prüfzentrums-Nr.: ggf. EudraCT Nr.: Besuchsdatum: On site von bis
 MO03-H-A1 1 Klinikkopf / KKS / Studienzentrale Bericht/Checkliste Besuch während der klinischen Prüfung Studienkurztitel.: Monitoringbesuch Nr.: Prüfzentrums-Nr.: ggf. EudraCT Nr.: Besuchsdatum: On site
MO03-H-A1 1 Klinikkopf / KKS / Studienzentrale Bericht/Checkliste Besuch während der klinischen Prüfung Studienkurztitel.: Monitoringbesuch Nr.: Prüfzentrums-Nr.: ggf. EudraCT Nr.: Besuchsdatum: On site
Akute venösen Thromboembolien (VTE) oder VTE in der Vorgeschichte, einschließlich tiefer Venenthrombose und Lungenembolie.
 Aktualisierte Indikation Behandlung der schweren Osteoporose: bei postmenopausalen Frauen, bei erwachsenen Männern, mit hohem Frakturrisiko, für die eine Behandlung mit anderen für die Osteoporosetherapie
Aktualisierte Indikation Behandlung der schweren Osteoporose: bei postmenopausalen Frauen, bei erwachsenen Männern, mit hohem Frakturrisiko, für die eine Behandlung mit anderen für die Osteoporosetherapie
Pharmaökonomiestudien (PÖS) unter Praxisbedingungen. Ein realistischer Weg zur Kosten-Effektivitäts-Bewertung von Arzneimitteln.
 Pharmaökonomiestudien (PÖS) unter Praxisbedingungen Ein realistischer Weg zur Kosten-Effektivitäts-Bewertung von Arzneimitteln. 6 Kernfragen der Wirtschaftlichkeitsbewertung einer Arzneimittelverordnung
Pharmaökonomiestudien (PÖS) unter Praxisbedingungen Ein realistischer Weg zur Kosten-Effektivitäts-Bewertung von Arzneimitteln. 6 Kernfragen der Wirtschaftlichkeitsbewertung einer Arzneimittelverordnung
Geriatrische Medikationsanalyse
 Klinische Pharmazie Geriatrische Medikationsanalyse Verbesserung der AMTS von Pflegeheimbewohnern Rheinland/Hamburg 30-Tages-Prävalenz vermeidbarer UAW in deutschen Pflegeheimen: 1 % Ziele der Studie Machbarkeits
Klinische Pharmazie Geriatrische Medikationsanalyse Verbesserung der AMTS von Pflegeheimbewohnern Rheinland/Hamburg 30-Tages-Prävalenz vermeidbarer UAW in deutschen Pflegeheimen: 1 % Ziele der Studie Machbarkeits
Impfstoffsicherheit in Deutschland
 Impfstoffsicherheit in Deutschland Eine Standortbestimmung 1. Nationale Konferenz für differenziertes Impfen Wuppertal, 2. Oktober 2010 Dr. med Klaus Hartmann, Wiesbaden Arzneimittelsicherheit in Deutschland
Impfstoffsicherheit in Deutschland Eine Standortbestimmung 1. Nationale Konferenz für differenziertes Impfen Wuppertal, 2. Oktober 2010 Dr. med Klaus Hartmann, Wiesbaden Arzneimittelsicherheit in Deutschland
