Klinische Forschung und Entwicklung. Beobachtungsplan (Nicht-Interventionelle Studie, NIS)
|
|
|
- Margarete Schmid
- vor 6 Jahren
- Abrufe
Transkript
1 JANSSEN-CILAG GmbH Klinische Forschung und Entwicklung Beobachtungsplan (Nicht-Interventionelle Studie, NIS) Version vom: 24. Januar 2017 Arzneimittel: Stelara (Ustekinumab) NIS-Nr.: CNTO1275PSO4051 Titel: Eine prospektive, neuartige, nicht-interventionelle Langzeitstudie von Stelara (Ustekinumab) bei Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis (PERSIST) Zusammenfassung: In dieser nicht-interventionellen Studie (NIS) soll die Therapie mit Stelara (Ustekinumab) prospektiv unter Routinebedingungen hinsichtlich ihrer Langzeitwirksamkeit, des Einflusses auf die Lebensqualität und weiteren Patientenbeurteilungen ( patient reported outcome, PRO) bei Patienten mit mittelschwerer bis schwerer Psoriasis untersucht werden. Die Behandlung mit Stelara erfolgt entsprechend der Fachinformation. Es ist vorgesehen, 300 Patienten an ca. 60 Zentren in ganz Deutschland zu beobachten. Die geplante Studiendauer pro Patient beträgt ca. 108 Wochen (ca. 2 Jahre). Studienleitung: Sponsor: Koordination: Data Management: JANSSEN-CILAG GmbH Johnson & Johnson Platz 1 D Neuss SCIderm GmbH Drehbahn 1-3 D Hamburg SCIderm GmbH Drehbahn 1-3 D Hamburg Dieser Beobachtungsplan enthält vertrauliche Informationen, die unter Wahrung absoluter Vertraulichkeit nur den Personen zugänglich gemacht werden dürfen, die für die Durchführung und Organisation der Studie verantwortlich sind. STUDIENPLAN_CNTO1275PSO4051 (PERSIST), FINAL Version 3.0, 24-JAN-2017 Seite 1 von 59 GERMANY/EG/PROTOKOLL-TEMPLATE NIS/VERSION 5.0/ effective date 15-APR-2010
2 Inhaltsverzeichnis ABKÜRZUNGEN AMENDMENT 1 VOM 13. JANUAR VORWORT STUDIENZUSAMMENFASSUNG (SYNOPSE) Ziel der nicht-interventionellen Studie (NIS): Patientenkollektiv und Dokumentationskriterien Studiendauer EINLEITUNG ARZNEIMITTELINFORMATION Klinische Wirksamkeit STUDIENDESIGN PATIENTENKOLLEKTIV UND DOKUMENTATIONSKRITERIEN Einschlusskriterien Ausschlusskriterien Beendigung der Dokumentation ABLAUFDIAGRAMM STUDIENPARAMETER UND STUDIENDAUER ALLGEMEINE INFORMATIONEN ZUR ARZNEIMITTELSICHERHEIT Definitionen und Klassifikationen Unerwünschtes Ereignis (UE) Schwerwiegendes unerwünschtes Ereignis (SUE) Unerwünschte Arzneimittelwirkung (UAW) Schwerwiegende unerwünschte Arzneimittelwirkung Unerwartetes unerwünschtes Ereignis / Referenzinformationen zur Sicherheit STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 2 von 59
3 Produktbeanstandungen (PQC) Spezielle Meldesituationen Definition von Kausalität und Schweregrad Schwangerschaft Pharmakovigilanz und Meldeverfahren Produktbeanstandungen für JANSSEN-CILAG Arzneimittel unter Beobachtung BETREUUNG / ABLAUF QUALITÄTSSICHERUNG Dokumentation Maßnahmen zur Qualitätssicherung, Monitoring Audit STATISTIK Endpunkte Primärer Endpunkt Sekundäre Endpunkte Stichprobenkalkulation Statistische Analysen ETHIKKOMMISSION ERGEBNISSE / PUBLIKATION ADMINISTRATIVES / ANZEIGEPFLICHT ARCHIVIERUNG ZUSTÄNDIGKEITEN LITERATURNACHWEISE UNTERSCHRIFTEN ANHÄNGE STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 3 von 59
4 21.1 Appendix I Total Body Surface Area (BSA total) Appendix II - Psoriasis Area and Severity Index (PASI) Appendix III - Kopfhaut Physician s Global Assessment (Kopfhaut PGA) Appendix IV Target-Nail (Zielnagel) Psoriasis Severity Index (NAPSI) Appendix V - Palmoplantar Physician s Global Assessment (Palmoplantar PGA) Appendix VI - Anogenital Physician s Global Assessment (Anogenital PGA) Appendix VII - Fragebogen zur Patientenzufriedenheit (Patient Preference Questionnaire Systemic Therapy, PPQ) Appendix VIII Fragebogen zur Patientenzufriedenheit (Patient Preference Questionnaire Systemic Therapy, STAQ) Appendix IX Fragebogen zur Bewertung der Anzeichen und Symptome der Schuppenflechte durch den Patienten (PSSD) Appendix X Fragebogen zur Beeinträchtigung von Arbeitsproduktivität und Aktivität: Schuppenflechte (WPAI-Pso) Appendix XII Fragebogen zur Lebensqualität (Dermatology Life Quality Index, DLQI) 58 TABELLEN Tabelle 1 Ablaufdiagramm STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 4 von 59
5 Abkürzungen AMG AWB BfArM BGBl. BSA CRF DLQI HADS HR-QoL IL NAPSI NIS PGA PASI PEI PPQ PQC PRO PsA PSSD Pso PUVA SAP STAQ SUE UE UAW VAS VFA WLQ WPAI-Pso Arzneimittelgesetz Anwendungsbeobachtung Bundesinstitut für Arzneimittel und Medizinprodukte Bundesgesetzblatt Body Surface Area Case Report Form, Dokumentationsbogen Dermatology Life Quality Index Hospital Anxiety and Depression Scale Health-Related Quality of Life Interleukin Nail Psoriasis Severity Index Nicht-Interventionelle Studie Physician s Global Assessment Psoriasis Area and Severity Index Paul-Ehrlich-Institut Patient Preference Questionnaire Product Quality Complaint Patient Reported Outcome Psoriatische Arthritis Psoriasis Symptom and Sign Diary Psoriasis Psoralen und Ultraviolett A Statistischer Analyseplan Systemic Therapy Adherence Questionnaire Schwerwiegendes unerwünschtes Ereignis Unerwünschtes Ereignis Unerwünschte Arzneimittelwirkung Visual Analog Scale Verein Forschender Pharmaunternehmen Work Limitations Questionnaire Work Productivity and Activity Impairment Questionnaire: Psoriasis STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 5 von 59
6 1. Amendment 1 vom 24. Januar 2017 Begründung für die Änderung: In Umsetzung einer unternehmensinternen Regelung (Risk Management Plan von Ustekinumab) wurde in den Studienplan die Meldung von Wachlist-Events für Ustekinumab aufgenommen. Bei Watchlist-Events handelt es sich um bestimmte unerwünschte Ereignisse, die im Gegensatz zu den anderen unerwünschten Ereignissen, beschleunigt innerhalb von 24 Stunden gemeldet werden müssen. Das beschleunigte Meldeverfahren ermöglicht eine engmaschigere Nachverfolgung bestimmter unerwünschter Ereignisse, stellt jedoch in keiner Weise ein erhöhtes Risiko für die Patienten unter Therapie mit Ustekinumab dar. Diese sogenannten Watchlist-Events sowie die entsprechenden Meldeprozesse sind unter dem neu eingefügten Kapitel beschrieben. Aufgrund einer hinter den Erwartungen liegenden Patientendokumentation innerhalb der Studie ist es erforderlich, die Planung entsprechend anzupassen, um die angestrebte Patientenzahl von 300 Patienten zu erreichen. Daher wird der Zeitraum zur Dokumentation neuer Patienten um fünf Monate bis Juni 2017 verlängert. Die Änderungen werden durch Streichungen gelöschter sowie Unterstreichung hinzugefügter Texte kenntlich gemacht: Allgemeiner Hinweis: Aufgrund der Einfügung des neuen Kapitels 1 Amendment 1 vom 13.Januar 2017 haben sich die darauffolgenden Kapitelzahlen geändert; die geänderten Kapitel und die entsprechenden Änderungen des Inhaltsverzeichnisses werden folgend aber nicht einzeln gelistet. Deckblatt Version Januar Koordination: SCIderm GmbH Drehbahn 1-3 D Hamburg STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 6 von 59
7 3. Studienzusammenfassung (Synopse) und Studiendauer Der geplante Beobachtungszeitraum pro Patient beträgt ca. 2 Jahre (ca. 108 Wochen). Wird die Therapie mit Stelara nicht fortgeführt, soll die Dokumentation im Rahmen der NIS beendet werden. Die Studie beginnt voraussichtlich im März 2016 und endet voraussichtlich im Januar Juni Patienten können bis ca. Januar Juni 2017 in die Dokumentation aufgenommen werden Unerwünschtes Ereignis (UE) neues Kapitel Unerwünschtes Ereignis mit beschleunigter Meldefrist ( Watchlist-Event ) Für Ustekinumab müssen bestimmte unerwünschte Ereignisse, sogenannte Watchlist-Events, im Gegensatz zu den anderen unerwünschten Ereignissen, beschleunigt innerhalb von 24 Stunden nach Kenntnisnahme gemäß Absatz 10.5 im ecrf dokumentiert sowie auf einem separaten Formblatt (GMS Solicited Adverse Event Report Template) gemeldet werden, auch wenn sie nicht als schwerwiegende unerwünschte Ereignisse eingestuft werden. Folgende Ereignisse zählen zu den Watchlist- Events : - Bösartige Tumorerkrankungen, Lymphomassoziierte bösartige Tumorerkrankungen - Pustuläre Psoriasis - SLE, Lupus demyelinisierend und Lupusassoziierte Ereignisse - Primäre, progressive multiple Sklerose - Guillain-Barre Syndrom - Neuromyotonie - Hepatobiliäre Funktionsstörungen 10.5 Pharmakovigilanz und Meldeverfahren Meldeverfahren für alle UEs (inkl. Watchlist-Events ) und spezielle Meldesituationen STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 7 von 59
8 Alle UEs (inkl. Watchlist-Events) und spezielle Meldesituationen (schwerwiegend und nicht schwerwiegend), die nach der Exposition gegenüber einem untersuchten Produkt auftraten, sind ungeachtet einer Kausalität systematisch im Dokumentationsbogen und in den Quellunterlagen des Patienten zu erfassen. Alle UEs (schwerwiegend und nicht schwerwiegend inkl. Watchlist-Events) sollten gemäß der klinischen Praxis nachbeobachtet werden. Diese Nachbeobachtung sollte in den Quellunterlagen des Patienten dokumentiert werden.. Meldeverfahren für alle SUEs: Alle Ereignisse, die unter die Watchlist-Events von Ustekinumab fallen (Absatz ), müssen dem Sponsor vom Studienarzt ebenfalls direkt innerhalb von 24 Stunden, nachdem er von diesen Kenntnis erlangt hat, mit dem Meldeformular GMS Solicited Adverse Event Report Template in Papierform per Fax an JANSSEN-CILAG Fax: Global Clinical Operations Johnson & Johnson Platz Neuss gemeldet sowie im ecrf dokumentiert werden. JANSSEN-CILAG übermittelt die über das Fax gemeldeten SUEs, Watchlist-Events und ggf. Nachfragen zu den gemeldeten Fällen sofort an das beauftragte Auftragsforschungsinstitut zwecks Vervollständigung und Nachverfolgung der Meldung. 20. Unterschriften Ich habe den Beobachtungsplan zur NIS CNTO1275PSO4051 in der Version vom STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 8 von 59
9 Januar gelesen und erkläre hiermit meine Zustimmung: 2. Vorwort Nicht-interventionelle Studien (NIS), zu denen in Deutschland insbesondere Anwendungsbeobachtungen (AWB) gehören, sind dazu bestimmt, Erkenntnisse bei der Anwendung zugelassener Arzneimittel zu gewinnen. Bereits mit der Veröffentlichung "Empfehlungen zur Planung und Durchführung von Anwendungsbeobachtungen" durch das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) im Bundesanzeiger im Jahr 1998 und der Gemeinsamen Empfehlung von BfArM und Paul-Ehrlich-Institut (PEI) vom 7. Juli 2010 wurden Bedingungen zur Planung, Durchführung und Auswertung definiert, deren Befolgung Validität und wissenschaftliche Akzeptanz derartiger Erhebungen gewährleisten sollen. Bedingt durch das dritte Gesetz zur Änderung arzneimittelrechtlicher und anderer Vorschriften vom 7. August 2013 (Bundesgesetzblatt (BGBI.) I S. 3108) werden umfangreiche Änderungen zur Einreichung von Anzeigen zu AWBs wirksam und die o.g. Empfehlung vom wird derzeit nach Ablauf der Konsultationsphase für den Entwurf einer gemeinsamen Bekanntmachung von BfArM und PEI vom entsprechend den neuen gesetzlichen Vorschriften aktualisiert. NIS 1-3 orientieren sich in Anlage und Durchführung an epidemiologischen Kohorten- Studien. Grundlage ist dabei stets die Nichtintervention durch den Sponsor 1,2. Der behandelnde Arzt entscheidet daher ohne spezifische Vorgaben, ob und mit welchen Arzneimitteln zu behandeln ist und wie die Modalitäten der Behandlung (Dosis, Applikationsform etc.) und deren Veränderungen gestaltet werden. Ferner müssen die Indikationsvorgaben den zugelassenen Indikationen entsprechen, und die Versorgung des Patienten mit Medikation erfolgt mit Handelsware durch Rezeptierung oder Ausgabe durch die Krankenhausapotheke. Weitere Voraussetzung ist, dass nach einem Studienplan gearbeitet wird, der dem aktuellen Stand der medizinischen und biometrischen Erkenntnisse entspricht und eine strukturierte systematische Beobachtung vorgibt. In den VFA Empfehlungen zu nicht-interventionellen Prüfungen mit Arzneimitteln (2007) werden weitere, über die bestehenden gesetzlichen Vorgaben hinausgehende Maßnahmen für die Planung, Durchführung und Auswertung von NIS definiert 3. Hierzu gehört u.a. die Beratung durch eine nach Landesrecht gebildete Ethikkommission und der Einsatz von Maßnahmen zur Qualitätssicherung, welche STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 9 von 59
10 die Validität und Repräsentativität der erhobenen Daten sicherstellen. Weiterhin wird empfohlen, vor Einbeziehung von Patienten in eine NIS eine schriftliche Patienteninformation und -einwilligungsklärung einzuholen 3. Bei interventionellen Studien mit vorgegebenen Untersuchungs- und Behandlungsmaßnahmen und einer Vielzahl an Ein- und Ausschlusskriterien lässt sich ein Selektionsbias hinsichtlich der Repräsentativität des untersuchten Patientenkollektivs nicht ausschließen. Eine NIS dagegen reflektiert aufgrund der fehlenden einschränkenden und modifizierenden Mechanismen die routinemäßige Anwendung von verkehrsfähigen Arzneimitteln durch Arzt und Patient. Sie ist daher das geeignete Instrument, repräsentative Daten zur Wirksamkeit und Verträglichkeit eines zugelassenen Medikaments unter Alltagsbedingungen zu generieren. 3. Studienzusammenfassung (Synopse) 3.1 Ziel der nicht-interventionellen Studie (NIS): Die PERSIST Studie ist eine prospektive NIS, welche den Einfluss einer Behandlung mit Stelara auf die Langzeitwirksamkeit, den Einfluss auf die Lebensqualität, Therapiezufriedenheit und weiteren Patientenbeurteilungen ( patient-reported outcome (PRO)) von 300 erwachsenen Patienten, die seit mindestens 2 Jahren an Psoriasis leiden, beobachten soll. Plaque-Psoriasis ist eine chronisch-entzündliche Erkrankung der Haut mit genetischer Prädisposition. Aufgrund der systemischen Entzündungsreaktion wird eine Komorbidität mit metabolischen und kardiovaskulären Erkrankungen beobachtet. Um eine kontinuierliche Kontrolle der Erkrankung zu gewährleisten, sind systemische Therapien wünschenswert, die eine gute Langzeitwirkung bei guter Verträglichkeit aufweisen. Bei konventionellen Therapien wie Methotrexat und Ciclosporin sind vor allem unerwünschte Wirkungen wie Hepatotoxizität und Nephrotoxizität limitierend. Biologika weisen in der Regel keine Organotoxizität auf, unterscheiden sich jedoch in Bezug auf Wirkmechanismus, Wirksamkeit, Sicherheit und Art der Anwendung. Die Therapieverweildauer auch als Persistenz bezeichnet wird durch alle diese Punkte beeinflusst und wird daher als guter Real-Life Marker für die Langzeitwirksamkeit eines Biologikums angesehen. Eine lange Persistenz ist bei einer chronischen Erkrankung wie der Psoriasis ein wichtiges Therapieziel. In diversen Registern ist die Persistenz von Stelara der Persistenz von anderen Biologikatherapien überlegen. In den bisherigen kontrollierten Studien wurde die Wirksamkeit von Stelara bei störenden Psoriasis-Manifestationen wie Kopfhaut- und Nagelbeteiligung, Juckreiz oder intertriginöse Psoriasis bisher nicht ausreichend untersucht. Allerdings helfen genau diese Daten und die detaillierte Beurteilung der Therapie aus Patientensicht der Dermatologin/dem Dermatologen, die optimale Therapie für ihre Patienten auszuwählen. Darüber hinaus beeinflusst die Wirksamkeit eines Medikaments auf besonders störende Psoriasis-Manifestation die Akzeptanz einer Therapie und damit ihre Persistenz wahrscheinlich mehr als die grobe Beurteilung der Gesamtwirksamkeit. STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 10 von 59
11 Ziele dieser Langzeit-NIS sind: Detaillierte Erfassung der Beurteilung des Krankheitsverlaufs aus Sicht der Patienten und Ärzte Beurteilung der Therapiezufriedenheit mit Stelara durch Patienten und Ärzte Erfassung der Wirksamkeit von Stelara bei Psoriasis in spezifischen Lokalisationen wie Kopfhaut- bzw. Nagelbeteiligung, intertriginöse Areale sowie den Einfluss auf die PRO Korrelationen der in dieser Studie erhobenen objektiven und subjektiven Daten, um ein möglichst umfassendes Bild der Stelara -Therapie bei Plaque- Psoriasis zu erstellen Dieser ganzheitliche Blick auf die Qualität einer Therapie mit Stelara aus Patientenund Ärztesicht soll das Verständnis von Einflussfaktoren auf die Persistenz einer Psoriasistherapie verbessern. Der primäre Endpunkt der Studie ist der Anteil an Patienten mit einer uneingeschränkten krankheitsspezifischen Lebensqualität, (DLQI-Wert 1) nach etwa 28 Wochen. Sekundäre Endpunkte sind die Entwicklung der Lebensqualität, die Einschätzung der Psoriasis durch den Patienten über 2 Jahre sowie Wirksamkeit und Verträglichkeit von Stelara. Ferner werden die Patienten und der behandelnde Arzt ihre Zufriedenheit mit dem Präparat, Eignung und Verträglichkeit mittels neu entwickelter Frageböge bewerten Patientenkollektiv und Dokumentationskriterien Die Identifizierung/Auswahl von Patienten erfolgt, nachdem im Rahmen der routinemäßigen Behandlung die Entscheidung über die Therapie getroffen wurde. Die Patienten werden darüber hinaus auch über die Einbeziehung in die NIS aufgeklärt. Vor Dokumentationsbeginn ist das schriftliche Einverständnis des Patienten zu einem direkten Quelldatenabgleich in Übereinstimmung mit den Bestimmungen des Datenschutzgesetzes einzuholen. Die Identifizierung / Auswahl von Patienten erfolgt nach folgenden Hauptselektionskriterien: 1. Patienten, die nach der Entscheidung des Arztes auf eine Therapie mit Stelara eingestellt werden sollen 2. Erstdiagnose einer Plaque-Psoriasis seit mindestens 2 Jahren 3. Mittelschwere bis schwere Plaque-Psoriasis, bei welcher andere systemische Therapien einschließlich Ciclosporin, Methotrexat oder PUVA (Psoralen und Ultraviolett A) nicht (ausreichend) angesprochen haben, kontraindiziert sind oder nicht vertragen wurden 4. Männlicher oder weiblicher Patient zwischen 18 und 75 Jahren STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 11 von 59
12 5. Schriftliche Einverständniserklärung des Patienten zur Datenerfassung, Auswertung, Speicherung und Weiterleitung. Von der Dokumentation ausgeschlossen sind Patienten, die neben Stelara gleichzeitig mit einem anderen Biologikum in der Indikation Psoriasis behandelt werden. Darüber hinaus sind die genannten Gegenanzeigen zu beachten Studiendauer Der geplante Beobachtungszeitraum pro Patient beträgt ca. 2 Jahre (ca. 108 Wochen). Wird die Therapie mit Stelara nicht fortgeführt, soll die Dokumentation im Rahmen der NIS beendet werden. Die Studie beginnt voraussichtlich im März 2016 und endet voraussichtlich im Juni Patienten können bis ca. Juni 2017 in die Dokumentation aufgenommen werden. STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 12 von 59
13 Tabelle 1 Allgemeine Daten Visite bei Studienabbruch Psoriasisuntersuchung Spezifische Zonen Ablaufdiagramm Dokumentationszeitpunkte Visite 1 Baseline Visite 2 Visite 3 Visite 4 Visite 5 und 6 Woche 0 ca. Woche 4 ca. Woche 16 ca. Woche 28 ca. Woche 52 und Woche 76 Visite 7 Studienende ca. Woche 100/104 Visitendatum X X X X X X X Ein/Ausschlusskriterien X Schriftliche Einwilligungserklärung X Datum und Dosierung von Stelara X X X X X X - Demographische Daten (Alter, Geschlecht, Körpergröße) X Körpergewicht X X X X X X X Klinische und medikamentöse Psoriasis Anamnese a X Aktuelle Begleitmedikation zur Psoriasistherapie b X X X X X X X Sonstige Begleitmedikation X X X X X X X BSA (total) X X X X X X X PASI X X X X X X X Präsenz von Psoriasis Arthritis, X X X X X X X Beurteilung der Arztzufriedenheit bzgl. der aktuellen Therapie (Sicherheit, Effektivität, Convenience) X - X X - X X Kopfhaut PGA X X X X X X X Zielnagel NAPSI (stärkster betroffener Finger) X - X X X X X Palmoplantar PGA X X X X X X X Anogenital PGA X X X X X X X PPQ - - X STUDIENPLAN_CNTO1275PSO4051 (PERSIST), FINAL Version 2.0, 20-JAN-2016 Seite 13 von 59 GERMANY/EG/PROTOKOLL-TEMPLATE NIS/VERSION 5.0/ effective date 15-APR-2010
14 Patientenbeurteilung (PRO) Dokumentationszeitpunkte Visite 1 Baseline Visite 2 Visite 3 Visite 4 Visite 5 und 6 Woche 0 ca. Woche 4 ca. Woche 16 ca. Woche 28 ca. Woche 52 und Woche 76 Visite 7 Studienende ca. Woche 100/104 STAQ (Abschnitt III Therapiezufriedenheit) X - - X - X X PSSD X - - X X X - WPAI-Pso X - - X - X X DLQI X - X X X X X Sicherheit (S)UEs X X X X X X X Studienabschlussdaten Grund für Therapieabbruch/ X Datum der letzten Stelara -Injektion X Art und Beginn der Ersatztherapie X Prüfung auf Vollständigkeit des Patientenfragebogens und der Dokumentation eventueller schwerer, unerwünschter Ereignisse. Visite bei Studienabbruch X X X X X X X Diagnostische und therapeutische Maßnahmen werden im Rahmen dieser NIS nicht vorgegeben, sie sind allein Entscheidung des behandelnden Arztes. Die vorgeschlagen Visitenstruktur orientiert sich an den Verschreibungsinformationen für Stelara und der üblichen ärztlichen Routine. a) Umfasst Diagnose, Alter bei Ersterkrankung, relevante Begleiterkrankungen, sowie Anzahl, Art und Dauer der vorherigen Psoriasistherapien, einschließlich Grund für die aktuelle Einstellung/Umstellung auf Stelara b) nur topische bzw. systemische Psoriasistherapie STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 14 von 59
15 Legende (alphabetisch) Anogenital PGA Anogential Physician Global Assessment; 5-Punkte Skala zur Psoriasis im anogenitalen Bereich 4 BSA Body Surface Area; vom Arzt bestimmter Prozentsatz der von Psoriasis betroffenen Körperfläche 5 DLQI Dermatology Life Quality Index; Patientenfragebogen zur dermatologischen HR-QoL (Health-Related Quality of Life) 6 Kopfhaut PGA Kopfhaut Physician s Global Assessment; 5-Punkte Skala zur Bewertung der Psoriasis der Kopfhaut 4 Palmoplantar PGA Palmoplantar Physician s Global Assessment; 5-Punkte Skala zur Bewertung der Psoriasis auf Hand und Fussinnenflächen 4 PASI Psoriasis Area and Severity Index; ärztliche Angabe zur Schwere der Psoriasis 7 PPQ Patient Preference Questionnaire; Patientenfragebogen zur Präferenz der jetzigen Therapie gegenüber einer vorherigen Therapie 8 PSSD Psoriasis Symptom and Sign Diary; Patiententagebuch zu Symptomen und Anzeichen der Psoriasis 9 STAQ Systemic Therapy Adherence Questionnaire; Patientenfragebogen zur Therapieadhärenz und Therapiezufriedenheit 8 (S)UE (Schwerwiegendes) unerwünschtes Ereignis Zielnagel-NAPSI Target Nail Psoriasis Severity Index; Ärztliche Angabe zur Schwere einer Nagelpsoriasis des am stärksten betroffenen Fingernagels mittels NAPSI 10 WPAI-Pso Work Productivity and Activity Impairment Questionnaire: Psoriasis; Fragebogen zur Behinderung bei der Arbeit und anderen Aktivitäten 11 STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 15 von 59
16 4. Einleitung Plaque-Psoriasis, auch Psoriasis vulgaris oder Schuppenflechte genannt, ist eine chronisch-entzündliche Erkrankung der Haut und potenziell des Gelenkapparates mit genetischer Prädisposition. Die Erkrankung tritt in zwei Altersgipfeln auf (Typ I vor, Typ II nach dem 40. Lebensjahr) und erfordert meist eine kontinuierliche Behandlung. Die Wahl einer geeigneten Therapie richtet sich nach Verlauf, Ausprägung und Schwere der Erkrankung sowie individuellen Faktoren und Begleiterkrankungen. Besonders bei schweren Verläufen treten gehäuft Komorbiditäten des metabolischen Formenkreises und psychische Erkrankungen auf. Bei leichter Ausprägung sind topische Therapien oft ausreichend. Bei mittelschweren bis schweren Verläufen sind systemische Therapien indiziert und erforderlich. Um eine kontinuierliche Kontrolle der Erkrankung zu gewährleisten, sind systemische Therapien wünschenswert, die eine gute Langzeitwirkung bei guter Verträglichkeit aufweisen. Bei den konventionellen Therapien wie Methotrexat und Ciclosporin sind vor allem die potenziellen unerwünschten Wirkungen wie Hepatotoxizität und Nephrotoxizität im Langzeitgebrauch limitierend. Biologika weisen in der Regel keine Organotoxizität auf. Sie unterscheiden sich jedoch in Bezug auf ihre initiale und langfristige Wirksamkeit sowie hinsichtlich des Infektionsrisikos. Die Therapieverweildauer auch als Persistenz bezeichnet wird durch alle diese Punkte beeinflusst und wird daher als guter Real-Life Marker für die Langzeitwirksamkeit eines Biologikums angesehen. Eine lange Persistenz ist bei einer chronischen Erkrankung wie der Psoriasis ein wichtiges Therapieziel, und eine hohe Persistenz in der täglichen Praxis wäre ein entscheidendes Kriterium für ein Langzeit-Therapeutikum. Bei gewissen Biologika (z.b. Infliximab) wird bereits nach 1-2 Jahren ein zum Teil deutlicher Wirksamkeitsverlust beobachtet. Psoriasis wird als T-Zell-dominierte Autoimmunerkrankung angesehen. Von zentraler Bedeutung sind Th1 und Th17 Zellen und deren Hauptzytokine Interleukin (IL)-12, IL-23, IL-17 und Tumornekrosefaktor-α. Neben T-Zellen sind auch neutrophile Granulozyten, Makrophagen und dendritische Zellen Teil der entzündlichen Kaskade. Das Biologikum Stelara (aktiver Wirkstoff: Ustekinumab) ist ein monoklonaler Antikörper, der gezielt an die gemeinsame p40 Untereinheit von IL-12 und IL-23 bindet und so deren pro-inflammatorische Funktion inhibiert 12. Stelara ist seit 2009 zur Therapie der mittelschweren bis schweren Plaque-Psoriasis zugelassen. Seit 2014 liegt auch die Zulassung für Psoriasis Arthritis vor. Die hohe klinische Wirksamkeit bei Psoriasis von zugelassenen und noch in der Entwicklung befindlichen Substanzen, die IL-23 oder das nachgeschaltete IL-17 antagonisieren, bestätigt dieses pathogenetische Konzept 13. Langzeitwirksamkeit und Verträglichkeit von Stelara wurden in der Vergangenheit durch die PHOENIX 1 und 2 Studien gezeigt 14-21, in denen die Wirksamkeit bei vielen Patienten über bis zu 5 Jahre nahezu konstant hoch blieb. Eine gute Langzeit-Verträglichkeit wurde bisher auch in den Registerdaten (z.b. PSOLAR und PsoBest) bestätigt 22,23. STUDIENPLAN_CNTO1275PSO4051 (PERSIST), FINAL, Version 2.0, 20-JAN-2016 Seite 16 von 59
17 Die PERSIST Studie ist eine prospektive, unter Routinebedingungen durchgeführte NIS, welche die Wirksamkeit und Verträglichkeit sowie den Einfluss einer Behandlung mit Stelara auf die Lebensqualität von 300 erwachsenen Patienten, welche seit mindestens 2 Jahren an mittelschwerer bis schwerer Plaque-Psoriasis leiden, beobachten soll. In der PERSIST Studie werden deshalb, unter anderem, zwei moderne Fragebögen verwendet, um die Faktoren, welche einen Einfluss auf die Adhärenz zu der verschriebenen Therapie haben, zu erfassen: 1. Fragebogen zur Adhärenz zu systemischen Medikamenten ( Systemic Treatment Adherence Questionnaire, STAQ, Abschnitt III Therapiezufriedenheit)) und 2. Fragebogen zur Patientenpräferenz ( Patient Preference Questionnaire, PPQ) 8. Ziele dieser Langzeit-NIS sind: Detaillierte Erfassung der Beurteilung des Krankheitsverlaufs aus Sicht der Patienten und Ärzte Beurteilung der Therapiezufriedenheit mit Stelara durch Patienten und Ärzte Erfassung der Wirksamkeit von Stelara bei Psoriasis in spezifischen Lokalisationen wie Kopfhaut- bzw. Nagelbeteiligung, intertriginöse Areale sowie den Einfluss auf die PRO Korrelationen der in dieser Studie erhobenen objektiven und subjektiven Daten, um ein möglichst umfassendes Bild der Stelara -Therapie bei Plaque-Psoriasis zu erstellen. Dieser ganzheitliche Blick auf die Qualität einer Therapie mit Stelara aus Patientenund Ärztesicht soll das Verständnis von Einflussfaktoren auf die Persistenz einer Psoriasistherapie verbessern. 5. Arzneimittelinformation Stelara (Ustekinumab) ist ein rein humaner monoklonaler Antikörper, der gegen IL12 und IL-23 gerichtet ist. Stelara ist für die Behandlung erwachsener Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis indiziert, bei denen andere systemische Therapien einschließlich Ciclosporin, Methotrexat oder PUVA nicht angesprochen haben, kontraindiziert sind oder nicht vertragen wurden. Stelara ist in einer Fertigspritze (45 mg/0,5 ml und 90 mg/1,0 ml Dosierung) verfügbar und wird subkutan in Bauch oder Oberschenkel injiziert. Nach der initialen Gabe erfolgt die zweite Injektion nach 4 Wochen, weitere Injektionen werden alle 12 Wochen verabreicht. Die Wahl der Dosierung erfolgt Gewichts-adaptiert: 45 mg pro Injektion bei Patienten bis 100 kg Körpergewicht, alternativ 90 mg bei Patienten mit mehr als 100 kg Körpergewicht. STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 17 von 59
18 5.1 Klinische Wirksamkeit Sicherheit und Wirksamkeit von Ustekinumab wurden in zwei randomisierten, placebokontrollierten Doppelblind-Studien mit Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis, die Kandidaten für eine Phototherapie oder eine systemische Therapie waren, untersucht. Zusätzlich wurden in einer randomisierten, studienarztverblindeten, aktiv kontrollierten Studie Ustekinumab und Etanercept bei Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis, bei denen inadäquates Ansprechen, Unverträglichkeit oder eine Kontraindikation gegen Ciclosporin, Methotrexat oder PUVA vorlagen, verglichen: In der Psoriasis-Studie 1 (PHOENIX 1) wurden 766 Patienten ausgewertet; 53 % dieser Patienten sprachen entweder auf eine andere systemische Therapie nicht an, vertrugen diese nicht, oder es bestand eine Kontraindikation. Die Ustekinumab randomisierten Patienten erhielten eine 45-mg- bzw. 90-mg-Dosis in Woche 0 und 4, gefolgt von der gleichen Dosis alle 12 Wochen. Patienten, die in Woche 0 und 4 randomisiert Placebo erhielten, wechselten auf Ustekinumab (entweder 45 mg oder 90 mg) in Woche 12 und 16, gefolgt von einer Dosisgabe alle 12 Wochen. Ursprünglich Ustekinumab-randomisierte Patienten, die sowohl in Woche 28 als auch 40 ein Ansprechen von 75 im Psoriasis Area and Severity Index (PASI) erreichten (Verbesserung von mindestens 75 % gegenüber dem Ausgangswert), wurden erneut randomisiert und erhielten entweder Ustekinumab alle 12 Wochen oder Placebo (d. h. Aussetzen der Therapie). In Woche 40 Placebo re-randomisierte Patienten begannen erneut mit Ustekinumab und dem ursprünglichen Dosierungsregime, wenn ein mindestens 50 %iger Verlust der in Woche 40 erreichten PASI-Verbesserung eintrat. Alle Patienten wurden bis zu 76 Wochen nach der ersten Verabreichung der Studienmedikation nachverfolgt. In der Psoriasis-Studie 2 (PHOENIX 2) wurden Patienten ausgewertet: 61 % dieser Patienten sprachen entweder auf eine andere systemische Therapie nicht an, vertrugen diese nicht, oder es bestand eine Kontraindikation. Ustekinumab randomisierte Patienten erhielten eine 45-mg- oder 90-mg-Dosis in Woche 0 und 4, gefolgt von einer zusätzlichen Dosis nach 16 Wochen. Patienten, die in Woche 0 und 4 randomisiert Placebo erhielten, wechselten in Woche 12 und 16 auf Ustekinumab (entweder 45 mg oder 90 mg). Alle Patienten wurden bis zu 52 Wochen nach der ersten Verabreichung der Studienbehandlung nachverfolgt. In der Psoriasis-Studie 3 (ACCEPT) wurden 903 Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis ausgewertet, die auf andere systemische Therapien nicht adäquat ansprachen, diese nicht vertrugen oder eine Kontraindikation aufwiesen. Die Studie verglich die Wirksamkeit von Ustekinumab gegenüber Etanercept und prüfte die Sicherheit von Ustekinumab und Etanercept. Während des 12-wöchigen, aktiv kontrollierten Teils der Studie erhielten die Patienten randomisiert zweimal wöchentlich 50 mg Etanercept, 45 mg Ustekinumab in den Wochen 0 und 4 oder 90 mg Ustekinumab in den Wochen 0 und 4. STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 18 von 59
19 In den Psoriasis-Studien 1 und 2 waren die Ausgangskrankheitsmerkmale generell in allen Behandlungsgruppen einheitlich, mit einem mittleren PASI-Ausgangsscore von 17 bis 18, einer mittleren Ausgangs- Body-Surface-Area (BSA) 20 und einem mittleren Dermatology Life Quality Index (DLQI) zwischen 10 und 12. Annähernd ein Drittel (Psoriasis-Studie 1) und ein Viertel (Psoriasis-Studie 2) der Studienteilnehmer hatten eine Psoriatische Arthritis (PsA). Eine ähnliche Krankheitsschwere wurde in der Psoriasis-Studie 3 beobachtet. Primärer Endpunkt in diesen Studien war der Anteil der Patienten, der ein PASI-75-Ansprechen von Studienbeginn bis Woche 12 erzielte. In der Psoriasis-Studie 1 war die Aufrechterhaltung des PASI-75 bei kontinuierlicher Behandlung im Vergleich zum Absetzen der Behandlung signifikant überlegen (p < 0,001). Ähnliche Ergebnisse wurden bei jeder Ustekinumab-Dosis gesehen. Nach einem Jahr (Woche 52) waren 89 % der Patienten, die in die Erhaltungstherapie rerandomisiert wurden, im Vergleich zu 63 % der Patienten, die in den Placebo-Arm re-randomisiert wurden (Abbruch der Behandlung), PASI-75-Responder (p < 0,001). Nach 18 Monaten (Woche 76) waren 84 % der Patienten, die in die Erhaltungstherapie re-randomisiert wurden, PASI-75-Responder im Vergleich zu 19 % der Patienten, die re-randomisiert Placebo erhielten (Abbruch der Behandlung). Nach 3 Jahren (Woche 148) waren 82 % der in die Erhaltungstherapie rerandomisierten Patienten PASI-75-Responder. Nach 5 Jahren (Woche 244) waren 80 % der in die Erhaltungstherapie re-randomisierten Patienten PASI-75- Responder. Von den Patienten, die re-randomisiert Placebo erhielten und die nach einem Verlust von 50 % der PASI-Verbesserung erneut mit ihrem ursprünglichen Ustekinumab-Behandlungsregime begannen, erlangten 85 % innerhalb von 12 Wochen nach Wiederaufnahme der Therapie ein PASI-75-Ansprechen. In der Psoriasis-Studie 1 zeigten sich im Vergleich zu Placebo in Woche 2 und Woche 12 in jeder Ustekinumab-Behandlungsgruppe im DLQI signifikante größere Verbesserungen zum Ausgangswert. Die Verbesserung wurde bis Woche 28 aufrechterhalten. In der Psoriasis-Studie 2 wurden in Woche 4 und 12 gleichermaßen signifikante Verbesserungen beobachtet, die bis Woche 24 aufrechterhalten wurden. In der Psoriasis-Studie 1 waren in jeder Ustekinumab- Behandlungsgruppe Verbesserungen der Nagel-Psoriasis ( Nail Psoriasis Severity Index (NAPSI)), in den Physical and Mental Component Summary Scores des SF-36 und in der Visuellen-Analog-Skala (VAS) für Juckreiz im Vergleich zu Placebo ebenfalls signifikant. In der Psoriasis-Studie 2 waren die Hospital Anxiety and Depression Scale (HADS) und der Work Limitations Questionnaire (WLQ) im Vergleich zu Placebo in jeder Ustekinumab-Behandlungsgruppe ebenfalls signifikant besser. STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 19 von 59
20 Die Zulassung von Stelara war mit einer Auflage zur Weitergabe bestimmter sicherheitsrelevanter Informationen an alle potentiellen Verschreiber und Patienten verbunden. Diese wurde mit dem PEI abgestimmt und bereits allen potentiellen Verschreibern zugänglich gemacht. Sie kann zusätzlich bezogen werden über JANSSEN-CILAG GmbH, Johnson & Johnson Platz 1, Neuss, Tel: 02137/ , oder (über Fachkreise-Login). Ustekinumab ist ein selektives Immunsuppressivum und kann unter Umständen das Risiko von Infektionen erhöhen und latente Infektionen reaktivieren. Klinisch relevante, aktive Infektionen (insbesondere eine aktive Tuberkulose) müssen deshalb vor Beginn der Therapie ausgeschlossen sein. Immunsuppressiva haben das Potenzial, das Risiko von malignen Tumoren zu erhöhen. Bei Patienten mit anamnestisch bekannten oder aktuellen malignen Tumoren soll mit Vorsicht vorgegangen werden, wenn eine Anwendung von Stelara in Erwägung gezogen wird. Alle Patienten mit einer längeren immunsuppressiven Therapie sollten hinsichtlich des Auftretens von nicht-melanozytärem Hautkrebs überwacht werden, insbesondere Patienten >60 Jahre oder jene mit PUVA-Vortherapie. In seltenen Fällen wurden nach der Anwendung von Ustekinumab schwerwiegende Überempfindlichkeitsreaktionen (einschließlich Anaphylaxie und Angioödem) beobachtet, auch mehrere Tage nach der Behandlung. Im Falle einer schwerwiegenden Überempfindlichkeitsreaktion soll die Verabreichung von Stelara sofort abgesetzt und eine adäquate Therapie / Notfallmaßnahmen eingeleitet werden. Die Nadelhülle der Fertigspritze wird aus Kautschuk hergestellt. Dieses kann allergische Reaktionen bei Patienten mit einer Überempfindlichkeit gegen Latex hervorrufen. Stelara darf in der Stillzeit nicht angewendet werden. Ausführliche Produktinformationen können der aktuellen Fachinformation zu Stelara sowie der Broschüre zu sicherheitsrelevanten Informationen zur Anwendung von Stelara (Bezugshinweise s.o.) entnommen werden. STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 20 von 59
21 6. Studiendesign Der vorliegenden Studie liegt ein prospektives, nicht-interventionelles Design zugrunde. Das bedeutet, Arzt und Patient folgen nicht einem vorab festgelegten Diagnostik- und Therapieschema; vielmehr steht die weitgehend unbeeinflusste Behandlungsroutine im Vordergrund, gefolgt von deren standardisierter Dokumentation. Randomisierte, kontrollierte klinische Studien mit engen vordefinierten Selektionskriterien bilden nicht immer die Behandlung in der klinischen Alltagsroutine ab. Auch die Studienendpunkte von Phase-III-Studien stimmen nicht immer mit den Parametern überein, die die Ärzte in der täglichen klinischen Praxis anwenden, um zu ermitteln, ob der Patient auf eine Behandlung anspricht und von dieser profitiert. In dieser Studie soll der Therapieverlauf einer Behandlung mit Stelara innerhalb der zugelassenen Indikation Psoriasis unter den Bedingungen der routinemäßigen Anwendung dokumentiert und untersucht werden. Die Wahl des methodischen Ansatzes einer NIS ergibt sich daher zwingend aus dem Untersuchungsgegenstand, wissenschaftliche Daten zu erheben, die möglichst realistisch die klinische Routinebehandlung widerspiegeln. In den bisherigen kontrollierten Studien wurde die Wirksamkeit von Stelara bei störenden Psoriasis-Manifestationen wie Kopfhaut- und Nagelbeteiligung, Juckreiz oder intertriginöse Psoriasis bisher nicht ausreichend untersucht. Allerdings helfen genau diese Daten und die detaillierte Beurteilung der Therapie aus Patientensicht der Dermatologin/dem Dermatologen, die optimale Therapie für ihre Patienten auszuwählen. Darüber hinaus beeinflusst die Wirksamkeit eines Medikaments auf besonders störende Psoriasis-Manifestation die Akzeptanz einer Therapie und damit ihre Persistenz wahrscheinlich mehr als die grobe Beurteilung der Gesamtwirksamkeit. 7. Patientenkollektiv und Dokumentationskriterien Die Identifizierung/Auswahl von Patienten erfolgt, nachdem im Rahmen der routinemäßigen Behandlung die Entscheidung über die Therapie getroffen wurde. Die Patienten werden darüber hinaus auch über die Einbeziehung in die NIS aufgeklärt. Vor Dokumentationsbeginn ist das schriftliche Einverständnis des Patienten zu einem direkten Quelldatenabgleich in Übereinstimmung mit den Bestimmungen des Datenschutzgesetzes einzuholen. STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 21 von 59
22 7.1 Einschlusskriterien Patienten, die nach der Entscheidung des Arztes auf eine Therapie mit Stelara eingestellt werden sollen Erstdiagnose einer Plaque-Psoriasis seit mindestens 2 Jahren Mittelschwere bis schwere Plaque-Psoriasis, bei welcher andere systemische Therapien einschließlich Ciclosporin, Methotrexat oder PUVA nicht angesprochen haben, kontraindiziert sind oder nicht vertragen wurden Männlicher oder weiblicher Patient zwischen 18 und 75 Jahren Schriftliche Einverständniserklärung des Patienten zur Datenerfassung, Auswertung, Speicherung und Weiterleitung 7.2 Ausschlusskriterien Die Ausschlusskriterien entsprechen den Gegenanzeigen der aktuellen Fachinformationen von Stelara, insbesondere, aber nicht ausschließlich: Überempfindlichkeit gegenüber Ustekinumab oder einen der sonstigen Bestandteile der Injektionsflüssigkeit Überempfindlichkeit gegenüber Naturlatex (Kautschuk), da das Behältnis dieses Arzneimittels Naturlatex (Kautschuk) enthält Schwangerschaft und Stillzeit Klinisch relevante aktive Infektion (z.b. aktive Tuberkulose) Insgesamt sollen 300 Patienten dokumentiert werden, die entsprechend der aktuellen Zulassung mit Stelara behandelt werden. An der Dokumentation beteiligte Ärzte sind Dermatologen, die in der Routine Psoriasis-Patienten behandeln. STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 22 von 59
23 7.3 Beendigung der Dokumentation Die Dokumentation wird beendet wenn die Behandlung mit Stelara beendet wird der Patient nicht mehr zu den Visiten erscheint und es auch keine Möglichkeit der Kontaktaufnahme mit dem Patienten gibt ( Lost to Follow-Up) der Patient die Einwilligung zur Teilnahme an der Studie zurückzieht. 8. Ablaufdiagramm Bitte beziehen Sie sich auf das Ablaufdiagramm in der Synopse (Seite 13). 9. Studienparameter und Studiendauer Tabelle 1, Seite 13, gibt eine Ablaufübersicht der Studie sowie der vorgeschlagenen Visiten der Studie. Diagnostische und therapeutische Maßnahmen werden im Rahmen dieser NIS nicht vorgegeben; sie sind allein Entscheidung des behandelnden Arztes. Um aber eine systematische Auswertung der erhobenen Daten zu ermöglichen, werden Art und Umfang der Dokumentation sowie das Zeitraster für die Beobachtung durch den Dokumentationsbogen standardisiert. Elektronische Dokumentationsbögen werden von JANSSEN-CILAG bzw. des zur Durchführung der Studie beauftragten Unternehmens zur Verfügung gestellt. Die Datenerhebung erfolgt ausschließlich in pseudonymisierter Form. Jedem dokumentierten Patienten wird vom Arzt ein Patientencode zugeordnet. Die Zuordnung von Patient und Patientencode ist demnach allein durch den dokumentierenden Arzt möglich. Um den Patientencode den individuellen Patienten zuordnen zu können, erhält der teilnehmende Arzt einen Patientenidentifikationsbogen, der als vertrauliches Dokument bei seinen Unterlagen verbleibt. Im Einklang mit der Patienteninformation und Einwilligungserklärung und der Deklaration von Helsinki kann ein Patient jederzeit ablehnen an der Prüfung teilzunehmen oder ohne Angabe von Gründen von der Teilnahme an der Prüfung zurücktreten. Wenn möglich wird der Grund für die Beendigung angegeben und eine Visite bei Beendigung der Therapie vereinbart. STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 23 von 59
24 Folgende Parameter sollen, soweit erhoben, dokumentiert werden: Demographische Daten (Geburtsjahr, Geschlecht, Größe, Gewicht) Anamnestische Daten (Alter bei Erstdiagnose, Diagnose, relevante Begleiterkrankungen) Allgemeine Daten (Datum der Visite, Dokumentationskriterien, Patienteneinwilligungserklärung) Vorherige Psoriasistherapien (Anzahl und Dauer, Art der Therapie), letzte Therapie einschließlich Grund der aktuellen Einstellung / Umstellung auf Stelara (Datum) Dosierung von Stelara ab Studien- / Behandlungsbeginn Begleitmedikation, die einen Einfluss auf die Psoriasistherapie haben könnte (nur topische bzw. systemische Psoriasistherapie) Sonstige Begleitmedikation Beteiligung der Nägel Beteiligung der Kopfhaut Beteiligung der intertriginösen Bereiche / Gesäßfalte (anogenitaler Bereich) Veränderung und Bewertung der klinischen Symptomatik im Verlauf durch den Untersucher ( Body Surface Area (BSA) (total), PASI, Präsenz von Psoriasis Arthritis, Beurteilung der Arztzufriedenheit, Kopfhaut Physician s Global Assessment (PGA), Zielnagel NAPSI (stärkster betroffener Fingernagel), Palmoplantar PGA, Anogential PGA Patientenbeurteilung/Fragebögen (PPQ, STAQ (nur Abschnitt III), Psoriasis Symptom and Sign Diary (PSSD), Work Productivity and Activity Impairment Questionnaire: Psoriasis (WPAI-Pso), DLQI) Unerwünschte Ereignisse (UE) Abschließende Bewertung der Wirksamkeit und Verträglichkeit von Stelara durch den behandelnden Arzt Die zu dokumentierenden Besuche des Patienten beim behandelnden Arzt sollten nach 0, 4, 16 und 28 Wochen und anschließend alle 6 Monate zu den Injektionszeitpunkten gemäß Fachinformation stattfinden. Ein Besuchsfenster von +/-4 Wochen wird für Abweichungen innerhalb der Routine vorgesehen. Die Dokumentationszeitpunkte der einzelnen Parameter sind im Ablaufdiagramm dargestellt. STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 24 von 59
25 Der geplante Beobachtungszeitraum pro Patient beträgt ca. 24 Monate. Wird die Therapie mit Stelara nicht fortgeführt, soll die Dokumentation im Rahmen der NIS beendet werden (Abbruchdokumentation). Spezielle Anforderungen für die Meldungen zur Arzneimittelsicherheit siehe unter Allgemeine Informationen zur Arzneimittelsicherheit. Die Studie beginnt voraussichtlich im März 2016 und endet im Juni Patienten können bis Juni 2017 aufgenommen werden. 10. Allgemeine Informationen zur Arzneimittelsicherheit Eine zeitnahe, genaue und vollständige Meldung und Prüfung der Informationen zur Arzneimittelsicherheit aus klinischen Studien ist entscheidend für den Schutz der Patienten, der Studienärzte und der Sponsoren solcher Studien und wird von den Zulassungsbehörden weltweit vorgeschrieben. Alle klinischen Studien, die von JANSSEN-CILAG oder von durch JANSSEN-CILAG beauftragte Unternehmen durchgeführt werden, werden weltweit nach festgelegten Verfahren und gemäß aufsichtsbehördlicher Anforderungen organisiert, um eine sachgemäße Meldung von Informationen zur Arzneimittelsicherheit sicherzustellen Definitionen und Klassifikationen Unerwünschtes Ereignis (UE) Ein UE ist jedes ungünstige medizinische Vorkommnis, das bei einem Patienten nach der Verabreichung eines Arzneimittels auftritt, (ungeachtet dessen, ob es sich um ein Prüfpräparat handelt oder nicht). Ein UE steht nicht zwangsläufig in einem kausalen Zusammenhang mit der Behandlung. Bei einem UE kann es sich um jegliche nachteiligen und unbeabsichtigten Anzeichen (einschließlich eines auffälligen Befundes oder des Ausbleibens einer erwarteten pharmakologischen Wirkung), Symptome oder Erkrankungen handeln, die in zeitlichem Zusammenhang mit der Anwendung eines Arzneimittels stehen, unabhängig davon, ob ein Zusammenhang mit dem betreffenden Arzneimittel besteht. Dies beinhaltet jedes Vorkommnis, das neu eingetreten ist oder dessen Schweregrad sich im Vergleich zum Ausgangszustand verschlechtert hat sowie auffällige Ergebnisse diagnostischer Verfahren, die im Rahmen der klinischen Praxis durchgeführt werden Unerwünschtes Ereignis mit beschleunigter Meldefrist ( Watchlist- Event ) Für Ustekinumab müssen bestimmte unerwünschte Ereignisse, sogenannte Watchlist-Events, im Gegensatz zu den anderen unerwünschten Ereignissen, beschleunigt innerhalb von 24 Stunden nach Kenntnisnahme gemäß Absatz 10.5 im ecrf dokumentiert sowie auf einem separaten Formblatt (GMS Solicited Adverse Event Report Template) gemeldet werden, auch wenn sie nicht als schwerwiegende unerwünschte Ereignisse eingestuft werden. STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 25 von 59
26 Folgende Ereignisse zählen zu den Watchlist-Events : - Bösartige Tumorerkrankungen, Lymphom-assoziierte bösartige Tumorerkrankungen - Pustuläre Psoriasis - SLE, Lupus demyelinisierend und Lupus-assoziierte Ereignisse - Primäre, progressive multiple Sklerose - Guillain-Barre Syndrom - Neuromyotonie - Hepatobiliäre Funktionsstörungen Schwerwiegendes unerwünschtes Ereignis (SUE) Jedes UE, das unabhängig von der Dosis: zum Tode führt lebensbedrohlich ist (d. h., der Patient war bei Eintreten des Ereignisses in Lebensgefahr; dies bezieht sich nicht auf ein Ereignis, das bei höherem Schweregrad theoretisch hätte zum Tod führen können) einen Krankenhausaufenthalt erforderlich macht oder verlängert zu einer bleibenden Schädigung oder Behinderung führt eine angeborene Missbildung / Geburtsfehler zur Folge hat Vermutlich in der Übertragung infektiöser Substanzen durch ein Arzneimittel besteht medizinisch relevant ist. Für Berichte über Krankenhausaufenthalte muss das schwerwiegende Symptom bzw. die Diagnose, die zur Hospitalisierung geführt hat, als SUE dokumentiert und gelistet werden. Krankenhausaufenthalte aus folgenden Gründen müssen nicht als schwerwiegende Ereignisse berichtet werden: Es sollte nach medizinischem und wissenschaftlichem Ermessen entschieden werden, ob weitere Situationen als schwerwiegend zu betrachten sind, z. B. bedeutsame medizinische Ereignisse, die möglicherweise nicht unmittelbar lebensbedrohlich sind, zum Tod führen oder einen Krankenhausaufenthalt erforderlich machen, aber den Patienten in Gefahr bringen oder einen Eingriff erforderlich machen könnten, um eines der oben aufgeführten Ereignisse zu verhindern. STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 26 von 59
27 Arzneimittelanwendung Soziale Indikation OP oder anderen Maßnahmen, die vor Aufnahme in diese Studie geplant und dokumentiert wurden stationärer Kuraufenthalt Unerwünschte Arzneimittelwirkung (UAW) Eine UAW ist definiert als eine Reaktion auf ein Arzneimittel, die schädlich und unbeabsichtigt ist. Der Ausdruck Reaktion auf ein Arzneimittel bedeutet, dass ein kausaler Zusammenhang zwischen einem Arzneimittel und einem UE mindestens eine Möglichkeit darstellt, d.h. der Zusammenhang kann nicht ausgeschlossen werden. Eine UAW ist im Gegensatz zu einem UE durch die Tatsache gekennzeichnet, dass ein Kausalzusammenhang zwischen dem Arzneimittel und dem Auftreten vermutet wird. Alle UEs, die vom meldenden Studienarzt oder vom Sponsor dahingehend beurteilt werden, dass sie einen möglichen Kausalzusammenhang mit einem Arzneimittel aufweisen, kennzeichnen eine UAW Schwerwiegende unerwünschte Arzneimittelwirkung Eine schwerwiegende UAW ist jede UAW, die unabhängig von der Dosis: zum Tod führt lebensbedrohlich ist (d. h., der Patient war bei Eintreten des Ereignisses in Lebensgefahr; dies bezieht sich nicht auf ein Ereignis, das bei höherem Schweregrad theoretisch hätte zum Tod führen können) einen stationären Krankenhausaufenthalt erforderlich macht oder verlängert zu einer bleibenden oder erheblichen Behinderung / Arbeitsunfähigkeit führt eine angeborene Missbildung / einen Geburtsdefekt zur Folge hat vermutlich in der Übertragung infektiöser Substanzen durch ein Arzneimittel besteht medizinisch bedeutsam ist. Es sollte nach medizinischem und wissenschaftlichem Ermessen entschieden werden, ob weitere Situationen als schwerwiegend zu betrachten sind, z. B. bedeutsame medizinische Ereignisse, die möglicherweise nicht unmittelbar lebensbedrohlich sind, zum Tod führen oder einen Krankenhausaufenthalt erforderlich machen, aber den Patienten in Gefahr bringen oder einen Eingriff erforderlich machen könnten, um eines der oben aufgeführten Ergebnisse zu verhindern. STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 27 von 59
28 Unerwartetes unerwünschtes Ereignis / Referenzinformationen zur Sicherheit Ein UE gilt als unerwartet, wenn es in Bezug auf Art und Schweregrad nicht mit der entsprechenden Referenzinformation zur Arzneimittelsicherheit (Fachinformation) übereinstimmt. Der Erwartungsgrad eines UE eines zugelassenen Arzneimittels richtet sich danach, ob es bereits in der entsprechenden Fachinformation aufgeführt ist. HINWEIS: Das Nichtaufgeführtsein eines Ereignisses ist nur für die Meldepflichten des Sponsors relevant. Es bestimmt nicht die Meldeanforderungen des teilnehmenden Arztes gegenüber dem Sponsor oder dem Inhaber der Zulassung Produktbeanstandungen (PQC) Eine Beschwerde in Zusammenhang mit der Produktqualität ( product quality complaint, PQC) ist jede schriftliche, elektronische oder mündliche Mitteilung, in der behauptet wird, dass ein Produkt nach seiner Freigabe zum Vertrieb Mängel bezüglich seiner Identität, Qualität, Langlebigkeit, Zuverlässigkeit, Sicherheit, Wirksamkeit oder Leistung aufweist. STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 28 von 59
29 10.2 Spezielle Meldesituationen Dies umfasst die Sicherheit betreffende Ereignisse von Interesse bei einem Produkt von JANSSEN-CILAG, die eine Meldung und / oder eine Sicherheitsbewertung erforderlich machen. Diese sind u.a., aber nicht beschränkt auf: Wechselwirkungen mit anderen Mitteln Missbrauch, Fehlgebrauch (z. B. Überdosierung) akzidentelle Exposition berufliche Exposition Gewöhnung, Abhängigkeit mangelnde Wirksamkeit des Arzneimittels Resistenzbildung Missbildungen maternale oder paternale Exposition in der Schwangerschaft Exposition durch Stillen Arzneimittelfälschungen unerwarteter therapeutischer Nutzen Übertragungen von infektiösen Erregern durch Arzneimittel Medikationsfehler bei einem Produkt (mit oder ohne Exposition des Patienten gegenüber dem untersuchten JANSSEN-CILAG-Produkt, z. B. durch Namensverwechslung) Diese, die Sicherheit betreffenden Ereignisse, erfüllen nicht die Definition eines UE; sie werden jedoch in derselben Weise behandelt wie UEs. Spezielle Meldesituationen sollen auf der Seite für UEs des Case Report Form (CRF) dokumentiert werden. Jede spezielle Meldesituation, die die Kriterien eines SUE erfüllt, wird auf dem Formular für SUEs dokumentiert und müssen dem lokalen Sponsor innerhalb von 24 Stunden nach ihrem Bekanntwerden gemeldet werden. STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 29 von 59
30 10.3 Definition von Kausalität und Schweregrad Für jedes UE muss eine Beurteilung des Kausalzusammenhangs zwischen UE und der Medikation unter Beobachtung gemäß folgender Definitionen vorgenommen werden: Kein Kausalzusammenhang ( not related ) Ein UE, das (nach Einschätzung des behandelnden Arztes) nicht in Zusammenhang mit der Anwendung des untersuchten Produktes steht. Unwahrscheinlich ( doubtful ) Ein UE, für das eine andere Erklärung wahrscheinlicher ist, z. B. eine Begleitmedikation / Begleiterkrankung und / oder die Tatsache, dass ein Kausalzusammenhang aufgrund des Zeitpunkts des Auftretens unwahrscheinlich ist. Ein Kausalzusammenhang zwischen einem UE und dem Arzneimittel unter Beobachtung besteht, wenn die Zuordnung möglich, wahrscheinlich oder sehr wahrscheinlich ist, entsprechend den nachfolgend aufgelisteten Definitionen: Möglich ( possible ) Ein UE / eine UAW, das / die auf die Anwendung des untersuchten Produktes zurückzuführen sein könnte. Eine andere Erklärung, z. B. eine Begleitmedikation / Begleiterkrankung, ist nicht schlüssig. Der zeitliche Zusammenhang ist plausibel. Daher kann ein Kausalzusammenhang nicht ausgeschlossen werden. Wahrscheinlich ( probable ) Ein UE / eine UAW, das / die auf die Anwendung des untersuchten Produktes zurückzuführen sein könnte. Der zeitliche Zusammenhang lässt auf einen Kausalzusammenhang schließen (z. B. bestätigt durch Absetzversuch). Eine andere Erklärung, z. B. eine Begleitmedikation / Begleiterkrankung, ist weniger wahrscheinlich. Sehr wahrscheinlich ( very likely ) Ein UE / eine UAW, das / die als mögliche unerwünschte Arzneimittelwirkung aufgeführt ist und für das / die keine plausible anderweitige Erklärung wie eine Begleitmedikation / Begleiterkrankung vorliegt. Der zeitliche Zusammenhang lässt dringend auf einen Kausalzusammenhang schließen (z. B. bestätigt durch Absetzversuch und erneute Exposition). STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 30 von 59
31 Falls zutreffend, wird eine Beurteilung des Schweregrades nach den folgenden allgemein kategorialen Deskriptoren vorgenommen: Leicht: Wahrnehmen von Symptomen, die leicht zu ertragen sind, minimale Beschwerden verursachen und die täglichen Aktivitäten nicht beeinträchtigen. Mäßig: Das Ausmaß der vorhandenen Beschwerden reicht aus, um eine Beeinträchtigung der normalen Aktivitäten zu verursachen. Schwer: Extreme Beschwerden, die eine erhebliche Beeinträchtigung der Funktionsfähigkeit oder Arbeitsunfähigkeit verursachen und normale tägliche Aktivitäten verhindern. Der Studienarzt sollte eine klinische Bewertung vornehmen durch Einschätzung der Schwere von Ereignissen, die vom Patienten nicht direkt wahrgenommen werden (z.b. anhand von auffälligen Laborwerten) Schwangerschaft Alle Berichte über eine Schwangerschaft, die in zeitlichem Zusammenhang mit der Verabreichung eines JANSSEN-CILAG Arzneimittels unter Beobachtung stehen, müssen dem Sponsor vom Personal des teilnehmenden Studienzentrums innerhalb von 24 Stunden, nachdem es von dem Ereignis Kenntnis erlangt hat, mit dem entsprechenden Meldebogen für Schwangerschaften gemeldet werden. Abnormale Schwangerschaftsverläufe (wie z. B. Spontanabort, Totgeburt und angeborene Missbildung) gelten als SUEs und müssen mit dem Formular für schwerwiegende Ereignisse gemeldet werden. Jede Patientin, die während der Studie schwanger wird, muss sofort aus der Studie ausscheiden Pharmakovigilanz und Meldeverfahren In dieser NIS ist Stelara das untersuchte JANSSEN-CILAG-Produkt. Der Sponsor stellt dem Personal der teilnehmenden Zentren entsprechende Schulungen zur Pharmakovigilanz zur Verfügung. Der Sponsor ist dafür verantwortlich, den Aufsichtsbehörden (schwerwiegende) UEs und bedeutsame Informationen zur Arzneimittelsicherheit, die aus der Datenerhebung für Arzneimittel von JANSSEN-CILAG hervorgehen, ordnungsgemäß zu melden (siehe länderspezifische Anhänge). Alle erhobenen UEs werden im abschließenden Studienbericht zusammengefasst. Die Kontaktdaten der Personen, die bei Problemen in Zusammenhang mit der Arzneimittelsicherheit und / oder -qualität kontaktiert werden sollten, sind am Ende des Beobachtungsplans unter Zuständigkeiten zu finden. STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 31 von 59
32 Meldeverfahren für alle UEs (inkl. Watchlist-Events ) und spezielle Meldesituationen Alle UEs (inkl. Watchlist-Events ) und spezielle Meldesituationen (schwerwiegend und nicht schwerwiegend), die nach der Exposition gegenüber einem untersuchten Produkt auftraten, sind ungeachtet einer Kausalität systematisch im Dokumentationsbogen und in den Quellunterlagen des Patienten zu erfassen. Die Erhebung von UEs sollte mit der ersten Anwendung des untersuchten Produkts im Rahmen der Studie beginnen und erstreckt sich ungeachtet des Schweregrads auf alle UEs, die innerhalb von 90 Tagen auftreten, nachdem der Patient das untersuchte Produkt im Rahmen der Studie zum letzten Mal angewendet hat. Alle UEs, die nach der Exposition gegenüber einem untersuchten Produkt auftreten, sollten vom teilnehmenden Arzt beurteilt werden, damit dieser seine Meinung bezüglich eines Zusammenhangs zwischen dem Ereignis und dem untersuchten Produkt dokumentieren kann. Der Kausalzusammenhang des UEs muss im Prüfbogen erfasst werden. Ein UE gilt als eine UAW, wenn es zumindest eine plausible Möglichkeit eines Kausalzusammenhangs gibt (d. h., ein Kausalzusammenhang ist möglich, wahrscheinlich oder sehr wahrscheinlich). Wenn nötig berichtet der Sponsor den lokalen Gesundheitsbehörden gemäß den geltenden Anforderungen über nicht-schwerwiegende UAWs. Alle UEs (schwerwiegend und nicht schwerwiegend, inkl. Watchlist-Events ) sollten gemäß der klinischen Praxis nachbeobachtet werden. Diese Nachbeobachtung sollte in den Quellunterlagen des Patienten dokumentiert werden. Nicht systematisch erhobene UEs (spontane UEs) Bei UEs und speziellen Meldesituationen, die nicht systematisch erhoben werden (z. B. bei einem anderen als dem / den untersuchten Arzneimittel(n) [oder bei UEs, die von der systematischen Datenerhebung im Rahmen der Studie ausgenommen wurden]), und wenn der teilnehmende Arzt in Betracht zieht, dass es einen [möglichen, wahrscheinlichen oder sehr wahrscheinlichen Zusammenhang mit einem Arzneimittel gibt (d. h. spontane UAW), muss der teilnehmende Arzt den Hersteller des Arzneimittels oder die betreffende zuständige Behörde / Aufsichtsbehörde schnellstmöglich über das nationale Spontanmeldesystem informieren. Bei UAWs und speziellen Meldesituationen in Zusammenhang mit einem nicht untersuchten JANSSEN-CILAG-Produkt muss das Ereignis direkt dem lokalen Sponsor gemeldet werden (siehe länderspezifische Anhänge). Verfügbare Berichte über spontane UAWs werden im klinischen Studienbericht zusammengefasst. STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 32 von 59
33 Meldeverfahren für alle SUEs: Alle SUEs, schwerwiegenden speziellen Meldesituationen und / oder Expositionen in der Schwangerschaft und Schwangerschaften von Partnerinnen bei einem JANSSEN-CILAG Arzneimittel unter Beobachtung müssen dem Sponsor vom Studienarzt direkt innerhalb von 24 Stunden, nachdem er von diesen Kenntnis erlangt hat, mit einem Meldeformular für SUEs in elektronischer oder Papierform oder gegebenenfalls mit einem Meldeformular für Schwangerschaften gemeldet werden. Dies geschieht mittels Eintrag in den elektronischen CRF und Ausdruck und Unterzeichnung des Formulars durch den behandelnden Arzt und Sendung des Formulars per Fax an JANSSEN-CILAG Fax: Global Clinical Operations Johnson & Johnson Platz Neuss Für den Fall, dass eine Generierung des SUE-Berichts aus dem elektronischen CRF nicht möglich ist, stehen dem Arzt im ausgehändigten Studienordner SUE- Formblätter in Papierform für eine Meldung mittels Fax zur Verfügung. Alle Ereignisse, die unter die Watchlist-Events von Ustekinumab fallen (Absatz ), müssen dem Sponsor vom Studienarzt ebenfalls direkt innerhalb von 24 Stunden, nachdem er von diesen Kenntnis erlangt hat, mit dem Meldeformular GMS Solicited Adverse Event Report Template in Papierform per Fax an JANSSEN-CILAG Fax: Global Clinical Operations Johnson & Johnson Platz Neuss gemeldet sowie im ecrf dokumentiert werden. JANSSEN-CILAG übermittelt die über das Fax gemeldeten SUEs, Watchlist- Events und ggf. Nachfragen zu den gemeldeten Fällen sofort an das beauftragte Auftragsforschungsinstitut zwecks Vervollständigung und Nachverfolgung der Meldung. Alle Folgeinformationen für SUEs, die am Ende der Studie oder zum Zeitpunkt des Ausscheidens des Patienten aus der Studie noch nicht gelöst sind, müssen dem Sponsor vom Studienarzt direkt innerhalb von 24 Stunden, nachdem er von diesen Kenntnis erlangt hat, mit einem Meldeformular für SUEs in elektronischer oder Papierform (oder einem lokalen Äquivalent) gemeldet werden. STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 33 von 59
34 Falls erforderlich informiert der Sponsor die zuständigen lokalen Gesundheitsbehörden nach den geltenden Bestimmungen für Einzelfallmeldungen und aggregierten Berichten Produktbeanstandungen für JANSSEN-CILAG Arzneimittel unter Beobachtung Alle PQCs, die ein JANSSEN-CILAG Arzneimittel unter Beobachtung betreffen, müssen dem Sponsor vom Personal des Studienzentrums innerhalb von 24 Stunden, nachdem es Kenntnis davon erlangt hat, formlos gemeldet werden. Die Namen der Personen, die hinsichtlich PQCs zu einem Arzneimittel von JANSSEN- CILAG kontaktiert werden sollen, sind auf der / den Seite(n) mit den Kontaktinformationen aufgelistet. Wenn die Produktbeanstandung zu einem JANSSEN-CILAG Arzneimittel unter Beobachtung mit einem SUE verbunden ist, muss das Personal des Studienzentrums die PQC dem Sponsor unter Einhaltung der Fristen für die Meldung von SUEs melden. Ein Muster des unter Verdacht stehenden Arzneimittels mit der darauf vermerkten Chargennummer sollte für weitere Untersuchungen aufbewahrt werden, falls dieses vom Sponsor angefordert wird. 11. Betreuung / Ablauf Die Betreuung und das Monitoring dieser NIS erfolgen durch autorisierte Mitarbeiter von JANSSEN-CILAG und / oder durch Mitarbeiter eines von JANSSEN-CILAG beauftragten Auftragsforschungsinstituts. Die Mitarbeiter stehen dem Arzt für alle Fragen zur Durchführung der Studie sowie der Verfahrensweise bei Dokumentation und Meldung von UEs zur Verfügung. Zu Beginn der Studie wird der Beobachtungsplan ausgegeben und eingehend besprochen. Voraussetzung für den Beginn ist das Vorliegen eines unterzeichneten Vertrages. 12. Qualitätssicherung 12.1 Dokumentation Um die Qualität der in dieser NIS erhobenen Daten sicherzustellen, ist eine Validierung dieser Daten erforderlich. Die Validierung erfolgt durch Abgleich der Dokumentation in der Krankenakte mit den Eintragungen im Dokumentationsbogen. Voraussetzung hierfür ist die sorgfältige Dokumentation aller diagnostischen und therapeutischen Maßnahmen und Befunde sowie aller auftretenden unerwünschten Ereignisse (UEs und SUEs) in der Krankenakte Maßnahmen zur Qualitätssicherung, Monitoring Die NIS wird in Anlehnung an die vom BfArM am 12. November 1998 herausgegebene Empfehlung zur Planung, Durchführung und Auswertung von Anwendungsbeobachtungen, die Gemeinsame Empfehlung von BfArM und PEI STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 34 von 59
35 vom 7. Juli 2010 und die VFA-Empfehlungen zu nicht-interventionellen Prüfungen mit Arzneimitteln (Version 2014) durchgeführt. Vor Beginn der Dokumentation werden die teilnehmenden Ärzte von autorisierten Mitarbeitern von JANSSEN-CILAG oder von Mitarbeitern eines von JANSSEN-CILAG autorisierten Auftragsforschungsinstituts über die Handhabung der elektronischen Datenerfassung, den Verlauf der NIS sowie insbesondere über den Umgang mit UEs informiert. Zur Beantwortung weiterer Fragen stehen die Mitarbeiter von JANSSEN-CILAG oder des beauftragten Auftragsforschungsinstitutes zur Verfügung. Autorisierte und zur Verschwiegenheit verpflichtete Mitarbeiter von JANSSEN- CILAG oder Beauftragte des Sponsors werden die Authentizität und die Qualität der dokumentierten Daten im Verlauf der NIS überprüfen. Der teilnehmende Arzt gestattet den Mitarbeitern die Überprüfung des Studienverlaufs so häufig wie erforderlich. Er stellt bei diesen Besuchen den Zugang zum elektronischen Dokumentationssystem bzw. Ausdrucke der elektronischen Krankenakte bereit und steht für Rückfragen zur Verfügung. Der Mitarbeiter überprüft die Daten (Alter und Geschlecht des Patienten ebenso wie krankheitsrelevante Parameter, Zielparameter, Ergebnisse von Tests) auf Vollständigkeit und Plausibilität. Dies geschieht unter Wahrung der datenschutzrechtlichen Bestimmungen durch direkte Einsichtnahme in die Krankenakte (direkter Quelldatenabgleich). Eine weitere Überprüfung der Daten auf Vollständigkeit und Plausibilität wird vom beauftragten statistischen Institut durchgeführt. Der teilnehmende Arzt verpflichtet sich, hieraus resultierende Fragen zu beantworten. Das schriftliche Einverständnis des Patienten, mit dem der Patient über die Teilnahme an der NIS und die Weitergabe der Daten informiert wird und einer direkten Einsichtnahme seiner Krankenakte durch Mitarbeiter von JANSSEN-CILAG oder autorisiertes Personal, unter Berücksichtigung der Datenschutzgesetzte, zustimmt, ist Voraussetzung für eine Dokumentation der Behandlung im Rahmen dieser Untersuchung Audit JANSSEN-CILAG behält sich vor, aus Gründen der Qualitätssicherung ein Audit durchzuführen bzw. von beauftragten Dritten durchführen zu lassen. Der teilnehmende Arzt verpflichtet sich hierüber zur erforderlichen Mitarbeit. STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 35 von 59
36 13. Statistik 13.1 Endpunkte Primärer Endpunkt Der primäre Endpunkt der Studie ist der prozentuale Anteil an Patienten, die einen DLQI-Wert von 0 oder 1 (keine krankheitsbedingte Beeinträchtigung der Lebensqualität) zu Woche 28 (Visite 4) erreichen Sekundäre Endpunkte Die folgenden sekundären Endpunkte wurden für diese Studie definiert: 1. Prozentualer Anteil an Patienten, die nach 1, 1,5 und 2 Jahren (Visite 5, 6 und 7) einen DLQI-Wert von 0 oder 1 erreichen 2. Durchschnittliche Verminderung der PSSD Signs bzw. Symptoms Subscores zu Woche 28 (Visite 4), zu Visite 5 und 6 sowie am Ende der Beobachtungsstudie (7 oder Visite bei Studienabbruch) 3. Analyse der Einzelkriterien Juckreiz, Schuppung und Schmerz des PSSD Fragebogens in den Subgruppen der Patienten, die an Baseline einen Wert von 1 für Juckreiz, Schuppung bzw. Schmerzen angegeben haben: durchschnittliche Verminderung der Einzelkriterien Juckreiz, Schuppung bzw. Schmerz (Visite 4-6 sowie Visite 7 oder Visite bei Studienabbruch) Anteil an Patienten, die einen Wert von 0 für Juckreiz, Schuppung bzw. Schmerz erreichen zu Woche 28 (Visite 4), zu Visite 5 und 6 sowie am Ende der Beobachtungsstudie (Visite 7 oder Visite bei Studienabbruch) erreichen 4. Bewertung der Wirksamkeit von Stelara zu Woche 28 (Visite 4) und bis zum Ende der Studie (Visite 5-6 sowie Visite 7 oder Visite bei Studienabbruch): Anteil der Patienten die eine mindestens 75 %ige (PASI-75) bzw. 90 %ige (PASI-90) Verbesserung im PASI Score erreichen im Vergleich zur Baseline Anteil der Patienten, die einen absoluten PASI Score aufweisen, der 5, 3 bzw. 1 ist BSA Gesamtscore inkl. Änderung zu Baseline Anteil der Patienten, die eine Verbesserung des Kopfhaut PGA, palmoplantar PGA bzw. anogenital PGA auf weisen, bei denen der jeweilige Baselinewert 1 war Anteil der Patienten mit einem Kopfhaut PGA, palmoplantar PGA bzw. anogenital PGA von 0 oder 1, bei denen der Baselinewert 2 war Mittlere Verbesserung des Zielnagel-NAPSI (stärkster betroffener Nagel) STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 36 von 59
37 5. Bewertung der Arztzufriedenheit bzgl. der aktuellen Therapie (Sicherheit, Effektivität, Annehmlichkeit) zu Woche 16 (Visite 3), Woche 28 (Visite 4) und am Ende der Studie (Visite 7 oder Visite bei Studienabbruch) 6. Beurteilung der Patientenzufriedenheit anhand des STAQ, Abschnitt Therapiezufriedenheit zu Woche 28 (Visite 4) und am Ende der Studie (Visite 7 oder Visite bei Studienabbruch): Gemittelter Score inkl. Änderung zur Vortherapie, gemessen als Änderung zu Baseline Anteil der Patienten, die eine Verbesserung des gemittelten Scores um 1 erreichen 7. Beurteilung der aktuellen Therapie im Vergleich zur vorangegangen Therapie durch den Patienten (PPQ): Gemittelter Score zu Woche 16 (Visite 3) 8. Erhebung des Einflusses der Psoriasis auf berufliche Aktivitäten (WPAI-Pso) zu Anfang der Studie (Baseline), zu Woche 28 (Visite 4) und am Ende der Studie (Visite 7 oder Visite bei Studienabbruch) 9. Durchschnittliche PSSD Signs bzw. Symptoms Subscores von Patienten, die einen DLQI 1 bzw. einen DLQI von > 1 haben (Visite 4-6 sowie Visite 7 bzw. Visite bei Studienabbruch) 10. Anteil der Patienten mit einem DLQI 1 bzw. einen DLQI von > 1, die einen Juckreiz-, Schmerz- bzw. Schuppungs-Score von 0 haben (Visite 4-6 sowie Visite 7 bzw. Visite bei Studienabbruch) 11. Therapiepersistenz der Patienten mit einem DLQI Wert von 0/1 bzw. DLQI > 1 an Woche 28 (Visite 4) mit einem Juckreiz-, Schuppungs- bzw. Schmerz-Score (PSSD) von 0 bzw. > 0 an Woche 28 (Visite 4) die an Woche 28 (Visite 4) mindestens eine 75 %ige Verbesserung ihres PASI Scores erreichen bzw. nicht erreichen Korrelation zwischen Therapiepersistenz und gemitteltem STAQ- Therapiezufriedensheits-Score sowie zwischen Therapiepersistenz und Einzelfragen des STAQs (Abschnitt Therapiezufriedenheit) zu Woche 28 (Visite 4) STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 37 von 59
38 13.2 Stichprobenkalkulation Es wird angenommen, dass 50 bis 60 % der Patienten, welche Stelara zur Behandlung ihrer Plaque-Psoriasis bekommen, den primären Endpunkt DLQI 0/1 nach 28 Wochen erreichen. Um eine Responderzahl von 100 Patienten in der DLQI 1/0 Gruppe an Woche 28 zu erreichen, wird deshalb geplant 240 Patienten in die Studie aufzunehmen. Geht man von einer Ausfallrate von 20 % aus, dann müssen insgesamt 300 Patienten für diese Studie rekrutiert werden. Folgende Subpopulationen sollen analysiert werden: Patienten mit Kopfhautpsoriasis (60-80 % der Patienten) Patienten mit Nagelpsoriasis (40-50 % der Patienten) Patienten mit Anogenitalpsoriasis (15-40 % der Patienten). Basierend auf diesen Proportionen wird erwartet, dass die geplante Gesamtzahl der Studienpopulation mindestens 30 Patienten pro Subpopulation enthält. Sollte die Anzahl der Patienten pro Subpopulation zu klein sein, um eine zuverlässige statistische Analyse durchführen zu können, plant der Sponsor die Gesamtzahl der Studienpopulation zu erhöhen Statistische Analysen Die Auswertung der Daten erfolgt durch ein unabhängiges biometrisches Institut. In die Auswertung zur Lebensqualität, Wirksamkeit und Verträglichkeit gehen alle Patienten ein, die in die NIS eingeschlossen wurden (bezeichnet als Full Analysis Set). Die statistische Analyse erfolgt mit Methoden der deskriptiven Statistik. Es werden alle erhobenen Daten deskriptiv beschrieben, stratifiziert nach Visite, sofern zutreffend. Für kontinuierliche Merkmale werden die Anzahl der Beobachtungen, Mittelwert, Standardabweichung und das 95 %-Konfidenzintervall des Mittelwerts sowie Minimum, Median und Maximum dargestellt. Kategorielle Merkmale werden mit absoluten und relativen Häufigkeiten dargestellt. UEs werden hierbei nach MedDRA und Begleitmedikation nach WHO ATC kodiert. Fehlende Werte werden nicht ersetzt. Alle Endpunkte werden für die gesamte Population sowie getrennt nach Subpopulation analysiert. Die betrachteten Subpopulationen sind (siehe auch Abschnitt 13.2): Patienten mit Kopfhautpsoriasis Patienten mit Nagelpsoriasis Patienten mit Anogenitalpsoriasis In einem Statistischen Analyseplan (SAP) werden die statistischen Methoden detailliert beschrieben. Der SAP wird vor Datenbankschluss der ersten Zwischenanalyse finalisiert. STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 38 von 59
39 Interimsanalyse Eine Interimsanalyse von Daten der ersten 150 Teilnehmer, welche den primären Endpunkt (Woche 28) erreicht haben, soll erste Ergebnisse liefern. Zur gleichen Zeit werden die Größe von Subpopulationen (z. B. Teilnehmer mit Nagelpsoriasis) ermittelt. Nachdem alle Teilnehmer die 1-Jahres Phase abgeschlossen haben, ist eine zusätzliche Interimsanalyse geplant. Zur Interimsanalyse soll der primäre Endpunkt, sowie die sekundären Endpunkte 1-10, soweit die Daten bis zu den jeweiligen Zeitpunkten der Interimsanalyse erhoben wurden, analysiert werden. Weitere Details zur statistischen Auswertung werden vor der Auswertung im SAP festgelegt. Neben der Endauswertung und der Auswertung der geplanten Interimsanalysen behält sich JANSSEN-CILAG vor, eine oder mehrere weitere Interimsanalysen (z. B. wenn alle Patienten Woche 28 abgeschlossen haben) durchzuführen. 14. Ethikkommission JANSSEN-CILAG wird die Studie von einer unabhängigen Ethikkommission beraten lassen. Vorgelegt werden: Beobachtungsplan Patienteninformation und einwilligungserklärung Lebenslauf des Studienleiters Sonstige, von der EK angeforderte Dokumente (z. B. Patientenfragebögen). STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 39 von 59
40 15. Ergebnisse / Publikation Sämtliche Daten zu UEs verbleiben im Studienzentrum, bis diese zu JANSSEN-CILAG gesendet werden oder von JANSSEN-CILAG eingeholt werden. Die Ergebnisse der NIS werden in einem statistischen und medizinischen Abschlussbericht dargestellt inklusive aller sicherheitsrelevanten Daten Die Publikation der Gesamtergebnisse der NIS erfolgt unter Koordination von JANSSEN-CILAG. Teilergebnisse können nicht ohne Rücksprache mit JANSSEN-CILAG und Genehmigung des koordinierenden Studienarztes publiziert werden. In Übereinstimmung mit den VFA-Empfehlungen zu nicht-interventionellen Prüfungen mit Arzneimitteln (Verband forschender Pharmaunternehmen, Version 2014) wird JANSSEN-CILAG vor Studienstart eine Zusammenfassung des Beobachtungsplans öffentlich zugänglich machen. 16. Administratives / Anzeigepflicht Die NIS wird in Anlehnung an die vom BfArM am 12. November 1998 herausgegebene Empfehlung zur Planung, Durchführung und Auswertung von Anwendungsbeobachtungen, die Gemeinsame Empfehlung von BfArM und PEI vom 7. Juli 2010 und den VFA-Empfehlungen zu nicht-interventionellen Prüfungen mit Arzneimitteln (Version 2014) durchgeführt. Berücksichtigung findet das Arzneimittelgesetz in der aktuellen Version sowie die europäischen Vorschriften zur Pharmakovigilanz. JANSSEN-CILAG oder ein von JANSSEN-CILAG autorisiertes Auftragsforschungsinstitut zeigt die NIS gemäß 67, Absatz 6, Arzneimittelgesetz (AMG) dem Bundesinstitut für Arzneimittel und Medizinprodukte sowie der Kassenärztlichen Bundesvereinigung und den Spitzenverbänden der Krankenkassen und dem Verband der Privaten Krankenversicherung e.v. an und übernimmt die regulatorischen Verantwortlichkeiten gemäß des geltenden Arzneimittelrechtes ( 63). Die Studie wird außerdem gemäß AMG 67(6) in einem öffentlichen Register veröffentlicht. 17. Archivierung Die erhobenen Daten sowie Unterlagen sind Eigentum des Sponsors. Alle Unterlagen werden für spätere Zugriffe und Auswertungen mindestens 10 Jahre archiviert. STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 40 von 59
41 18. Zuständigkeiten Studienkoordination und Anfragen: SCIderm GmbH Drehbahn 1-3 D Hamburg Medizinisches Konzept: JANSSEN-CILAG GmbH Johnson & Johnson Platz 1 D Neuss Pharmakovigilanz: JANSSEN-CILAG GmbH Johnson & Johnson Platz 1 D Neuss Datenmanagement: SCIderm GmbH Drehbahn 1-3 D Hamburg Biometrie: SCIderm GmbH Drehbahn 1-3 D Hamburg STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 41 von 59
42 19. Literaturnachweise 1. Empfehlungen zur Planung und Durchführung von Anwendungsbeobachtungen. Bundesanzeiger 1998; 229: und Entwurfsfassung der gemeinsamen Empfehlung des BfArMs und PEIs 09 Mai Notice to Marketing Authorization Holders Pharmacovigilance Guidelines. CPMP/PhVWO/108/99 corr VFA-Empfehlung zur Verbesserung der Qualität und Transparenz von nichtinterventionellen Studien (2007) 4. Langley RG, Feldman SR FAU - Nyirady J, Nyirady JF, van de Kerkhof PF, Papavassilis C. The 5-point Investigator's Global Assessment (IGA) Scale: A modified tool for evaluating plaque psoriasis severity in clinical trials. J Dermatolog Treat 2015;( (Electronic)). 5. Rhodes J, Clay C, Phillips M. The surface area of the hand and the palm for estimating percentage of total body surface area: results of a meta-analysis. Br J Dermatol Jul;169(1): Finlay AY, Khan GK. Dermatology Life Quality Index (DLQI) - A simple practical measure for routine clinical use. Clinical and Experimental Derm 1994; 19: Fredriksson T, Pettersson U. Severe psoriasis-oral therapy with a new retinoid. Dermatologica. 1978;157(4): Zschocke I, Mrowietz U, Lotzin A, Karakasili E, Reich K. Assessing adherence factors in patients under topical treatment: development of the Topical Therapy Adherence Questionnaire (TTAQ). Arch Dermatol Res Apr;306(3): Mathias SD, Feldman SR, Crosby RD, Colwell HH, McQuarrie K, Han C. Measurement properties of a patient-reported outcome measure assessing psoriasis severity: The psoriasis symptoms and signs diary. J Dermatolog Treat Dec 4: Rich P, Scher RK. Nail Psoriasis Severity Index: a useful tool for evaluation of nail psoriasis. J Am Acad Dermatol Aug;49(2): Reilly Associates. Health Outcomes Research Work Productivity and Activity Impairment Questionnaire (WPAI) Koutruba N, Emer J, Lebwohl M. Review of ustekinumab, an interleukin-12 and interleukin-23 inhibitor used for the treatment of plaque psoriasis. Ther Clin Risk Manag Apr 15;6: van de Kerkhof PC. Novel biologic therapies in development targeting IL- 12/IL-23. J Eur Acad Dermatol Venereol Oct;24 Suppl 6:5-9. STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 42 von 59
43 14. Papp KA, Langley RG, Lebwohl M, Krueger GG, Szapary P, Yeilding N, Guzzo C, Hsu MC, Wang Y, Li S, Dooley LT, Reich K; PHOENIX 2 study investigators. Efficacy and safety of ustekinumab, a human interleukin-12/23 monoclonal antibody, in patients with psoriasis: 52-week results from a randomised, double-blind, placebo-controlled trial (PHOENIX 2). Lancet May 17;371(9625): Leonardi CL, Kimball AB, Papp KA, Yeilding N, Guzzo C, Wang Y, Li S, Dooley LT, Gordon KB; PHOENIX 1 study investigators. Efficacy and safety of ustekinumab, a human interleukin-12/23 monoclonal antibody, in patients with psoriasis: 76-week results from a randomised, double-blind, placebo-controlled trial (PHOENIX 1). Lancet May 17;371(9625): Guenther L, Han C, Szapary P, Schenkel B, Poulin Y, Bourcier M, Ortonne JP, Sofen HL. Impact of ustekinumab on health-related quality of life and sexual difficulties associated with psoriasis: results from two phase III clinical trials. J Eur Acad Dermatol Venereol Jul;25(7): Kimball AB, Gordon KB, Fakharzadeh S, Yeilding N, Szapary PO, Schenkel B, Guzzo C, Li S, Papp KA. Long-term efficacy of ustekinumab in patients with moderate-to-severe psoriasis: results from the PHOENIX 1 trial through up to 3 years. Br J Dermatol Apr;166(4): Reich K, Papp KA, Griffiths CE, Szapary PO, Yeilding N, Wasfi Y, Ott E, Hsu MC, Lebwohl M, Gordon KB; PHOENIX 1, PHOENIX 2, and ACCEPT investigators. An update on the long-term safety experience of ustekinumab: results from the psoriasis clinical development program with up to four years of follow-up. J Drugs Dermatol Mar;11(3): Kimball AB, Papp KA, Wasfi Y, Chan D, Bissonnette R, Sofen H, Yeilding N, Li S, Szapary P, Gordon KB; PHOENIX 1 Investigators. Long-term efficacy of ustekinumab in patients with moderate-to-severe psoriasis treated for up to 5 years in the PHOENIX 1 study. J Eur Acad Dermatol Venereol. 2013Dec;27(12): Papp KA, Griffiths CE, Gordon K, Lebwohl M, Szapary PO, Wasfi Y, Chan D, Hsu MC, Ho V, Ghislain PD, Strober B, Reich K; PHOENIX 1 Investigators; PHOENIX 2 Investigators; ACCEPT Investigators. Long-term safety of ustekinumab in patients with moderate-to-severe psoriasis: final results from 5 years of follow-up. Br J Dermatol Apr;168(4): Langley RG, Lebwohl M, Krueger GG, Szapary PO, Wasfi Y, Chan D, Hsu MC, You Y, Poulin Y, Korman N, Prinz JC, Reich K; PHOENIX 2 Investigators. Longterm efficacy and safety of ustekinumab, with and without dosing adjustment, in patients with moderate-to-severe psoriasis: results from the PHOENIX 2 study through 5 years of follow-up. Br J Dermatol May;172(5): Krulig E, Gordon KB. Ustekinumab: an evidence-based review of its effectiveness in the treatment of psoriasis. Core Evid Jul 27;5: STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 43 von 59
44 23. Reich K, Schenkel B, Zhao N, Szapary P, Augustin M, Bourcier M, Guenther L, Langley RG. Ustekinumab decreases work limitations, improves work productivity, and reduces work days missed in patients with moderate-to-severe psoriasis: results from PHOENIX 2. J Dermatolog Treat Dec;22(6): STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 44 von 59
45 20. Unterschriften Ich habe den Beobachtungsplan zur NIS CNTO1275PSO4051 in der Version vom 24. Januar 2017 gelesen und erkläre hiermit meine Zustimmung: Datum: Studienleitung Datum: Study responsible Physician (JANSSEN-CILAG GmbH) Datum: Studienarzt (Name in Druckbuchstaben und Unterschrift) STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 45 von 59
46 21. Anhänge 21.1 Appendix I Total Body Surface Area (BSA total) Vom Arzt zu erheben: Der BSA gibt den Prozentsatz der befallenen Körperoberfläche an und kann Werte zwischen 0 % (Haut völlig frei) und 100 % (Haut komplett von Psoriasis betroffen) annehmen. Für diese Bestimmung ist die Handflächenmethode anwendbar: Eine Handfläche des Patienten ohne Fingerendgelenke entspricht ungefähr 1,0 % der Gesamtkörperoberfläche des entsprechenden Patienten. Der Studienarzt summiert die Anzahl der so bestimmten Handflächen für die gesamte Körperoberfläche (es erfolgt keine separate Dokumentation für einzelne Körperregionen). Abgeleitet von: Rhodes J, Clay C, Phillips M. 5 STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 46 von 59
47 21.2 Appendix II - Psoriasis Area and Severity Index (PASI) Vom Arzt zu erheben: Lediglich die Endwerte werden im CRF erfasst. Der PASI ist ein weit verbreitetes Messinstrument, mit dem der Schweregrad der Psoriasis beurteilt wird. Der PASI kann Werte zwischen 0 (Haut völlig erscheinungsfrei) und 72 (maximale Ausprägung der Psoriasis) annehmen. Der PASI sollte in dieser Beobachtungsstudie ausschließlich von Ärzten erhoben werden, die dies routinemäßig durchführen. Die exakte Berechnungsgrundlage wird daher hier nicht detailliert dargestellt. Fredriksson und Pettersson 7 STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 47 von 59
48 21.3 Appendix III - Kopfhaut Physician s Global Assessment (Kopfhaut PGA) Vom Arzt zu erheben: Bitte beurteilen Sie den Schweregrad der Psoriasis zum jetzigen Zeitpunkt bezogen auf die Kopfhaut anhand der folgenden Kategorien: Punktzahl Schweregrad Beschreibung 0 erscheinungsfrei Keine Zeichen von Psoriasis (postentzündliche Hyperpigmentierung kann vorhanden sein) 1 fast erscheinungsfrei Hautfarbener bis rosa Farbton der Läsionen; keine Induration; keine bis minimale Schuppung 2 mild 3 mittel 4 schwer Rosaroter bis hellroter Farbton der Läsion; geringfügige Induration; überwiegend feine Schuppung mit oder ohne Pusteln Hellrote, scharf abgegrenzte Erytheme; scharf abgrenzbare mittelstarke Induration; mittelgradige Schuppung mit oder ohne Pusteln Hell- bis dunkelroter Farbton der Läsion; sehr ausgeprägte Induration mit klaren Kanten; grobe, festhaftende Schuppung bei fast allen oder allen Läsionen und zahlreiche Fissuren mit oder ohne Pusteln Angelehnt/ übersetzt nach Langley 4 STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 48 von 59
49 21.4 Appendix IV Target-Nail (Zielnagel) Psoriasis Severity Index (NAPSI) Vom Arzt zu erheben: Der NAPSI wird in dieser Beobachtungsstudie nur für den zu Beginn der Behandlung am schlimmsten betroffenen Fingernagel bestimmt (= Target-NAPSI). Nur dieser Nagel wird im Verlauf der Studie weiter dokumentiert. Dabei wird der Fingernagel gedanklich in 4 Quadranten aufgeteilt (siehe Skizze unten). Die Beurteilung der Psoriasis erfolgt für jeden Quadranten separat für die Nagelmatrix (= sichtbare Veränderungen der Nagelplatte) und für das Nagelbett. Wenn in eine der betroffenen Quadranten wenigstens eine der nachfolgenden Veränderungen erkennbar ist, wird diesem Quadranten jeweils für Nagelmatrix und Nagelbett 1 Punkt zugewiesen, maximal also 2 Punkte pro Quadrant: Nagelmatrix (=Nagelplatte): Lunula-Erythem, Leukonychie, Tüpfel, Krümelnägel Nagelbett: Hyperkeratose Onycholyse, Ölfleck, Splitterhämorrhagien, subunguale Die Summe der beiden Werte ergibt den Gesamtwert für den betroffenen Fingernagel. Maximal kann an dem beurteilten Fingernagel ein Punktwert von 8 erreicht werden. Nagelbett Psoriasis Nagelmatrix Psoriasis 0 0 Frei 1 1 1/4 des Nagels 2 2 2/4 des Nagels 3 3 3/4 des Nagels 4 4 4/4 des Nagels Angepasst/übersetzt nach Rich und Scher 10 STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 49 von 59
50 21.5 Appendix V - Palmoplantar Physician s Global Assessment (Palmoplantar PGA) Vom Arzt zu erheben: Nur bei Patienten zu bestimmen, die eine Beteiligung der Handflächen und / oder Fußsohlen haben. Bitte beurteilen Sie den Schweregrad der Psoriasis zum jetzigen Zeitpunkt bezogen auf die Handflächen und Fußsohlen anhand der folgenden Kategorien: Punktzahl Schweregrad Beschreibung 0 erscheinungsfrei Keine Zeichen von Psoriasis (postentzündliche Hyperpigmentierung kann vorhanden sein) 1 fast erscheinungsfrei Hautfarbener bis rosa Farbton der Läsionen; keine Induration; keine bis minimale Schuppung 2 mild 3 mittel 4 schwer Rosaroter bis hellroter Farbton der Läsion; geringfügige Induration; überwiegend feine Schuppung mit oder ohne Pusteln Hellrote, scharf abgegrenzte Erytheme; scharf abgrenzbare mittelstarke Induration; mittelgradige Schuppung mit oder ohne Pusteln Hell- bis dunkelroter Farbton der Läsion; sehr ausgeprägte Induration mit klaren Kanten; grobe, festhaftende Schuppung bei fast allen oder allen Läsionen und zahlreiche Fissuren mit oder ohne Pusteln Angelehnt/ übersetzt nach Langley 4 STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 50 von 59
51 21.6 Appendix VI - Anogenital Physician s Global Assessment (Anogenital PGA) Vom Arzt zu erheben: Nur bei Patienten zu bestimmen, die eine Beteiligung des anogenitalen Bereiches haben. Bitte beurteilen Sie den Schweregrad der Psoriasis zum jetzigen Zeitpunkt bezogen auf den anogenitalen Bereiches anhand der folgenden Kategorien: Punktzahl Schweregrad Beschreibung 0 erscheinungsfrei Keine Zeichen von Psoriasis (postentzündliche Hyperpigmentierung kann vorhanden sein) 1 fast erscheinungsfrei Hautfarbener bis rosa Farbton der Läsionen; keine Induration; keine bis minimale Schuppung, kein Nässen, keine Mazeration 2 mild 3 mittel 4 schwer Rosaroter bis hellroter Farbton der Läsion; geringfügige Induration; überwiegend feine Schuppung oder geringes Nässen oder geringe Mazeration mit oder ohne Pusteln Hellrote, scharf abgegrenzte Erytheme; scharf abgrenzbare mittelstarke Induration; mittelgradige Schuppung oder mäßiges Nässen oder mäßige Mazeration mit oder ohne Pusteln Hell- bis dunkelroter Farbton der Läsion; sehr ausgeprägte Induration mit klaren Kanten; grobe, festhaftende Schuppung oder starkes Nässen oder starke Mazeration bei fast allen oder allen Läsionen mit oder ohne Pusteln Angelehnt/ übersetzt nach Langley 4 STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 51 von 59
52 21.7 Appendix VII - Fragebogen zur Patientenzufriedenheit (Patient Preference Questionnaire Systemic Therapy, PPQ) Vom Patienten auszufüllen: PPQ Systemtherapie Fragebogen zur Patientenpräferenz ( PATIENT PREFERENCE QUESTIONNAIRE Systemic Therapy ) Ziel dieses Fragebogens ist es herauszufinden, ob Sie Ihre aktuelle Therapie oder eine vorangegangene Therapie bevorzugen. Vergleichen Sie hierzu bitte Ihre aktuelle Therapie mit Ihrer letzten systemischen (innerlich angewandten) Therapie (z.b. Tabletten, Injektionen). Bitte lesen Sie jede Aussage sorgfältig durch und kreuzen Sie an, wie zutreffend die folgenden Aussagen für Sie sind. Falls eine Aussage Sie nicht betrifft, kreuzen Sie betrifft mich nicht an. Bitte kreuzen Sie zu jeder Aussage nur eine Antwortkategorie an und beantworten Sie alle Aussagen. Bitte überprüfen Sie noch einmal, ob Sie zu jeder Aussage ein Kreuz gesetzt haben. Herzlichen Dank für Ihre Unterstützung! I.Zschocke / U.Mrowietz / K.Reich (Feb 2014) Zschocke I, Mrowietz U, Lotzin A, Karakasili E, Reich K. 8 STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 52 von 59
53 21.8 Appendix VIII Fragebogen zur Patientenzufriedenheit (Patient Preference Questionnaire Systemic Therapy, STAQ) Vom Patienten auszufüllen: STAQ Fragebogen zur systemischen Therapie ( SYSTEMIC THERAPY ADHERENCE QUESTIONNAIRE ) Ziel dieses Fragebogens ist es herauszufinden, wie zufrieden Sie mit Ihrer aktuellen Systemtherapie (Medikamente, die innerlich angewendet werden, z.b. als Tablette) sind. Berücksichtigen Sie bei der Beantwortung der Aussagen die Erfahrungen mit Ihrer aktuellen Systemtherapie in Bezug auf die LETZTEN 4 BEHANDLUNGSWOCHEN. Bitte lesen Sie jede Aussage sorgfältig durch und kreuzen Sie an, wie zutreffend die folgenden Aussagen für Sie sind. Falls eine Aussage Sie nicht betrifft, kreuzen Sie betrifft mich nicht an. Bitte kreuzen Sie zu jeder Aussage nur eine Antwortkategorie an und beantworten Sie alle Aussagen. Bitte überprüfen Sie noch einmal, ob Sie zu jeder Aussage ein Kreuz gesetzt haben. Herzlichen Dank für Ihre Unterstützung! I.Zschocke / U.Mrowietz / K.Reich (Feb 2014) Angepasst nach Zschocke I, Mrowietz U, Lotzin A, Karakasili E, Reich K. 8 STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 53 von 59
54 21.9 Appendix IX Fragebogen zur Bewertung der Anzeichen und Symptome der Schuppenflechte durch den Patienten (PSSD) Vom Patienten auszufüllen: Nach Mathias et al. 9 STUDIENPLAN_CNTO1275PSO4051 (PERSIST), Version 3.0, 24-JAN-2016 Seite 54 von 59
Dossierbewertung A15-20 Version 1.0 Secukinumab Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Secukinumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Secukinumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
Fragebogen zur Versorgung von Kindern und Jugendlichen mit Psoriasis
 Alfried Krupp von Bohlen und Halbach-Stiftungslehrstuhl für Medizinmanagement Fragebogen zur Versorgung von Kindern und Jugendlichen mit Psoriasis Survey A: Ärzte 27. August 2010 Finale Version Prof. Dr.
Alfried Krupp von Bohlen und Halbach-Stiftungslehrstuhl für Medizinmanagement Fragebogen zur Versorgung von Kindern und Jugendlichen mit Psoriasis Survey A: Ärzte 27. August 2010 Finale Version Prof. Dr.
Anhang III. Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage
 Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Patienteninformation zur Behandlung der Psoriasis mit Ustekinumab
 Praxis Dr. Ralph von Kiedrowski Patienteninformation zur Behandlung der Psoriasis mit Ustekinumab Liebe Patientin, lieber Patient, dieses Informationsblatt soll Ihnen die vorgesehene Behandlung mit Ustekinumab
Praxis Dr. Ralph von Kiedrowski Patienteninformation zur Behandlung der Psoriasis mit Ustekinumab Liebe Patientin, lieber Patient, dieses Informationsblatt soll Ihnen die vorgesehene Behandlung mit Ustekinumab
Titel der Studie. Indikation Patientinnen mit primären, hormonrezeptor-positiven Mammakarzinom. Wirkstoff Letrozol. Marke/Handelsname FEMARA
 Titel der Studie Femara Anwendungsbeobachtung Eva Anwendungsbeobachtung zur Verträglichkeit, Wirksamkeit und Compliance in der adjuvanten Femara (Letrozol)- Therapie des primären, hormonrezeptor-positiven
Titel der Studie Femara Anwendungsbeobachtung Eva Anwendungsbeobachtung zur Verträglichkeit, Wirksamkeit und Compliance in der adjuvanten Femara (Letrozol)- Therapie des primären, hormonrezeptor-positiven
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben?
 Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Als Krebspatient an einer Studie teilnehmen was sollte man wissen?
 Als Krebspatient an einer Studie teilnehmen was sollte man wissen? Krebsinformationsdienst, Heidelberg Dr. Susanne Weg-Remers Seite 2 Grundlage für evidenzbasiertes medizinisches Wissen sind klinische
Als Krebspatient an einer Studie teilnehmen was sollte man wissen? Krebsinformationsdienst, Heidelberg Dr. Susanne Weg-Remers Seite 2 Grundlage für evidenzbasiertes medizinisches Wissen sind klinische
Paul-Ehrlich-Institut Bundesamt für Sera und Impfstoffe
 Bundesinstitut für Arzneimittel und Medizinprodukte Bundesamt für Sera und Impfstoffe Gemeinsame Empfehlungen des Bundesinstituts für Arzneimittel und Medizinprodukte und des s zur Planung, Durchführung
Bundesinstitut für Arzneimittel und Medizinprodukte Bundesamt für Sera und Impfstoffe Gemeinsame Empfehlungen des Bundesinstituts für Arzneimittel und Medizinprodukte und des s zur Planung, Durchführung
Visite 2 Monat 3 Arztbogen ID:
 1. Zwischenanamnese Datum: Haben sich seit der letzten Vorstellung des Patienten Änderungen im klinischen Typ der Psoriasis ergeben? nein ja Wenn ja, aktueller klinischer Typ? Nagelbeteiligung ja nein
1. Zwischenanamnese Datum: Haben sich seit der letzten Vorstellung des Patienten Änderungen im klinischen Typ der Psoriasis ergeben? nein ja Wenn ja, aktueller klinischer Typ? Nagelbeteiligung ja nein
Johnson & Johnson Platz 1 D 41470 Neuss
 KLINISCHE FORSCHUNG UND ENTWICKLUNG STUDIENPLAN INKL. AMENDMENT I (NICHT-INTERVENTIONELLE STUDIE, NIS) Version vom: 02.10.2014 V 2.0 inkl. redaktionelle Änderung vom 24.11.2014 NIS-Nr.: Titel: Zusammenfassung:
KLINISCHE FORSCHUNG UND ENTWICKLUNG STUDIENPLAN INKL. AMENDMENT I (NICHT-INTERVENTIONELLE STUDIE, NIS) Version vom: 02.10.2014 V 2.0 inkl. redaktionelle Änderung vom 24.11.2014 NIS-Nr.: Titel: Zusammenfassung:
PATIENTENINFORMATION. Caregiver Burden bei betreuenden Angehörigen schwer betroffener Parkinsonpatienten
 Version 1.2 Neurologische Klinik mit Klinischer Neurophysiologie Kommissarischer Direktor: Prof. Dr. med. M. Stangel PD Dr. med. F. Wegner Telefon: (0511) 532-3110 Fax: (0511) 532-3115 Carl-Neuberg-Straße
Version 1.2 Neurologische Klinik mit Klinischer Neurophysiologie Kommissarischer Direktor: Prof. Dr. med. M. Stangel PD Dr. med. F. Wegner Telefon: (0511) 532-3110 Fax: (0511) 532-3115 Carl-Neuberg-Straße
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
IIT / AWB / NIS. Investigator Initiated Trials. Investigator Initiated Trials (IIT) 11.11.2015. IIT = Investigator Initiated Trials
 IIT / AWB / NIS IIT = Investigator Initiated Trials AWB = Anwendungsbeobachtungen NIS = Nicht-interventionelle Studien Medical-Advisor-IIT-AWB-NIS 11.11.2015 Healthcare Marketing Dr. Umbach & Partner www.umbachpartner.com
IIT / AWB / NIS IIT = Investigator Initiated Trials AWB = Anwendungsbeobachtungen NIS = Nicht-interventionelle Studien Medical-Advisor-IIT-AWB-NIS 11.11.2015 Healthcare Marketing Dr. Umbach & Partner www.umbachpartner.com
Abgrenzung klinischer Prüfungen Phase III und IV gegenüber nichtinterventionellen
 Abgrenzung klinischer Prüfungen Phase III und IV gegenüber nichtinterventionellen Studien Studien PHIII und IV versus Nichtinterventionelle Studien 1 Welche Aussagen sind richtig?? -1- Klinische Studien
Abgrenzung klinischer Prüfungen Phase III und IV gegenüber nichtinterventionellen Studien Studien PHIII und IV versus Nichtinterventionelle Studien 1 Welche Aussagen sind richtig?? -1- Klinische Studien
Paul-Ehrlich-Institut
 Bundesinstitut für Arzneimittel und Medizinprodukte Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel Empfehlungen des Bundesinstituts für Arzneimittel und Medizinprodukte und des s zur Planung,
Bundesinstitut für Arzneimittel und Medizinprodukte Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel Empfehlungen des Bundesinstituts für Arzneimittel und Medizinprodukte und des s zur Planung,
Anhang III. Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale des Arzneimittels, der Etikettierung und
Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale des Arzneimittels, der Etikettierung und
KURZFASSUNG DES PRÜFPROTOKOLLS 1839IL/0079 VOM
 KURZFASSUNG DES PRÜFPROTOKOLLS 1839IL/0079 VOM 11.11.02 RANDOMISIERTE, OFFENE, NICHT-KOMPARATIVE PHASE II STUDIE ZUR BEURTEILUNG DER WIRKSAMKEIT UND VERTRÄGLICHKEIT VON ZWEI DOSIERUNGEN ZD1839 BEI PATIENTEN
KURZFASSUNG DES PRÜFPROTOKOLLS 1839IL/0079 VOM 11.11.02 RANDOMISIERTE, OFFENE, NICHT-KOMPARATIVE PHASE II STUDIE ZUR BEURTEILUNG DER WIRKSAMKEIT UND VERTRÄGLICHKEIT VON ZWEI DOSIERUNGEN ZD1839 BEI PATIENTEN
Humira jetzt bei polyartikulärer juveniler idiopathischer Arthritis für Kinder ab vier Jahren zugelassen
 EU-Zulassungserweiterung für Adalimumab (Humira ) Humira jetzt bei polyartikulärer juveniler idiopathischer Arthritis für Kinder ab vier Jahren zugelassen Wiesbaden/Ludwigshafen (1. Juli 2011) Die Europäische
EU-Zulassungserweiterung für Adalimumab (Humira ) Humira jetzt bei polyartikulärer juveniler idiopathischer Arthritis für Kinder ab vier Jahren zugelassen Wiesbaden/Ludwigshafen (1. Juli 2011) Die Europäische
Wie funktioniert eine klinische Studie?
 Wie funktioniert eine klinische Studie? Bernhard Saller 3. Süddeutscher Hypophysen- und Nebennierentag München, 5. Mai 2007 Definitionen Ablauf klinischer Studien Klinische Arzneimittelprüfungen Zulassungsprozess
Wie funktioniert eine klinische Studie? Bernhard Saller 3. Süddeutscher Hypophysen- und Nebennierentag München, 5. Mai 2007 Definitionen Ablauf klinischer Studien Klinische Arzneimittelprüfungen Zulassungsprozess
Welt Lymphom Tag Seminar für Patienten und Angehörige 15. September 2007 Wien
 Welt Lymphom Tag Seminar für Patienten und Angehörige 15. September 2007 Wien Ein Vortrag von Univ. Prof. Dr. Johannes Drach Medizinische Universität Wien Univ. Klinik für Innere Medizin I Klinische Abteilung
Welt Lymphom Tag Seminar für Patienten und Angehörige 15. September 2007 Wien Ein Vortrag von Univ. Prof. Dr. Johannes Drach Medizinische Universität Wien Univ. Klinik für Innere Medizin I Klinische Abteilung
Dossierbewertung A16-10 Version 1.0 Ramucirumab (Kolorektalkarzinom)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ramucirumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ramucirumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR)
 EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR) IM ZUSAMMENHANG MIT BLUTKOMPONENTEN nach 63i Abs. 4 AMG Allgemeines: Durch
EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR) IM ZUSAMMENHANG MIT BLUTKOMPONENTEN nach 63i Abs. 4 AMG Allgemeines: Durch
Calcineurininhibitoren zur topischen Anwendung: Pimecrolimus und Tacrolimus (Elidel, Douglan und Protopic )
 Calcineurininhibitoren zur topischen Anwendung: Pimecrolimus und Tacrolimus (Elidel, Douglan und Protopic ) Ergebnisse der europäischen Risiko- Bewertungs-Verfahren Anlass für die Risikobewertungsverfahren
Calcineurininhibitoren zur topischen Anwendung: Pimecrolimus und Tacrolimus (Elidel, Douglan und Protopic ) Ergebnisse der europäischen Risiko- Bewertungs-Verfahren Anlass für die Risikobewertungsverfahren
Johanniskraut Metaanalyse 2005
 Johanniskraut Metaanalyse 2005 Seit 1983 wurden 37 randomisierte klinische Studien mit Johanniskraut-Präparaten publiziert Davon: 26 Placebo-kontrolliert, 14 Verum-kontrolliert Studiendauer: 4 Wochen (10
Johanniskraut Metaanalyse 2005 Seit 1983 wurden 37 randomisierte klinische Studien mit Johanniskraut-Präparaten publiziert Davon: 26 Placebo-kontrolliert, 14 Verum-kontrolliert Studiendauer: 4 Wochen (10
DAUER DER STUDIE: Läuft seit Nov mindestens bis 2017.
 KLINISCHE STUDIE: Swiss Inflammatory Bowel Disease Cohort Study (SIBDCS) Multizentrische Beobachtungsstudie in der ganzen Schweiz (Basel, Bern, Genf, Lausanne, St-Gallen, Zürich) mit Patient die an einem
KLINISCHE STUDIE: Swiss Inflammatory Bowel Disease Cohort Study (SIBDCS) Multizentrische Beobachtungsstudie in der ganzen Schweiz (Basel, Bern, Genf, Lausanne, St-Gallen, Zürich) mit Patient die an einem
Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen
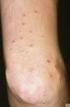 Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen München (1. Mai 2009) Die europäische Arzneimittelagentur EMEA hat mit Wirkung zum 1. Mai 2009 Protopic
Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen München (1. Mai 2009) Die europäische Arzneimittelagentur EMEA hat mit Wirkung zum 1. Mai 2009 Protopic
Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm
 Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm Sehr geehrte Frau Doktor, sehr geehrter Herr Doktor, Dieses
Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm Sehr geehrte Frau Doktor, sehr geehrter Herr Doktor, Dieses
Anhang III. Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage
 Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
1 Einführung 15 J. Sehouli 1.2 Das Aufklärungsgespräch 18
 Inhaltsverzeichnis 1 Einführung 15 J. Sehouli 1.2 Das Aufklärungsgespräch 18 2 Die klinische Studie 21 2.1 Definitionen 22 2.1.1 Klinische Prüfung 22 2.1.2 Nicht interventionelle Prüfung 27 2.1.3 Anwendungsbeobachtung
Inhaltsverzeichnis 1 Einführung 15 J. Sehouli 1.2 Das Aufklärungsgespräch 18 2 Die klinische Studie 21 2.1 Definitionen 22 2.1.1 Klinische Prüfung 22 2.1.2 Nicht interventionelle Prüfung 27 2.1.3 Anwendungsbeobachtung
kontrolliert wurden. Es erfolgte zudem kein Ausschluss einer sekundären Genese der Eisenüberladung. Erhöhte Ferritinkonzentrationen wurden in dieser S
 5.8 Zusammenfassung Auf der Grundlage der dargestellten Ergebnisse dieser Studie erscheint die laborchemische Bestimmung der Transferrinsättigung zur Abklärung einer unklaren Lebererkrankung und Verdacht
5.8 Zusammenfassung Auf der Grundlage der dargestellten Ergebnisse dieser Studie erscheint die laborchemische Bestimmung der Transferrinsättigung zur Abklärung einer unklaren Lebererkrankung und Verdacht
Verbesserte Lebensqualität für Brustkrebspatientinnen unter Chemotherapie
 Neue Studie zu Iscador Verbesserte Lebensqualität für Brustkrebspatientinnen unter Chemotherapie Schwäbisch-Gmünd (2. Dezember 2009) - Eine prospektive randomisierte offene Pilotstudie ergab eine Verbesserung
Neue Studie zu Iscador Verbesserte Lebensqualität für Brustkrebspatientinnen unter Chemotherapie Schwäbisch-Gmünd (2. Dezember 2009) - Eine prospektive randomisierte offene Pilotstudie ergab eine Verbesserung
FORMULAR FÜR DEN START DER BEHANDLUNG MIT TYSABRI
 Die europäischen Gesundheitsbehörden haben für die Markteinführung von TYSABRI Bedingungen auferlegt. Dieser verpflichtende Plan zur Risikoeinschränkung in Belgien - zu dem diese Information gehört - ist
Die europäischen Gesundheitsbehörden haben für die Markteinführung von TYSABRI Bedingungen auferlegt. Dieser verpflichtende Plan zur Risikoeinschränkung in Belgien - zu dem diese Information gehört - ist
PsoriaSol 247 Badezusatz dient der pflegenden Unterstützung von Hautarzt-Therapien und hat keine heilende Wirkung. Zur Regeneration der Haut
 PsoriaSol 247 Badezusatz dient der pflegenden Unterstützung von Hautarzt-Therapien und hat keine heilende Wirkung. Zur Regeneration der Haut z. Das Krankheitsbild der Psoriasis Die Psoriasis ist eine systemische
PsoriaSol 247 Badezusatz dient der pflegenden Unterstützung von Hautarzt-Therapien und hat keine heilende Wirkung. Zur Regeneration der Haut z. Das Krankheitsbild der Psoriasis Die Psoriasis ist eine systemische
Patienteninformation zur Behandlung der Psoriasis mit Ciclosporin
 Praxis Dr. Ralph von Kiedrowski Patienteninformation zur Behandlung der Psoriasis mit Ciclosporin Liebe Patientin, lieber Patient, dieses Informationsblatt soll Ihnen die vorgesehene Behandlung mit Ciclosporin-
Praxis Dr. Ralph von Kiedrowski Patienteninformation zur Behandlung der Psoriasis mit Ciclosporin Liebe Patientin, lieber Patient, dieses Informationsblatt soll Ihnen die vorgesehene Behandlung mit Ciclosporin-
Cimicifuga racemosa. Die Wirksamkeit ist dosisabhängig. Prof. Dr. med. Reinhard Saller Abteilung Naturheilkunde Universitätsspital Zürich
 Prof. Dr. med. Reinhard Saller Abteilung Naturheilkunde Universitätsspital Zürich Folie 1 Menopause relevante Beschwerden Hitzewallungen Schweissausbrüche Schlafstörungen Nervosität, Gereiztheit Depression
Prof. Dr. med. Reinhard Saller Abteilung Naturheilkunde Universitätsspital Zürich Folie 1 Menopause relevante Beschwerden Hitzewallungen Schweissausbrüche Schlafstörungen Nervosität, Gereiztheit Depression
STELARA 45 mg Injektionslösung in einer Fertigspritze
 1. BEZEICHNUNG DES ARZNEIMITTELS Injektionslösung in einer Fertigspritze 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Jede Fertigspritze für den Einmalgebrauch enthält 45 mg Ustekinumab in 0,5 ml. Ustekinumabisteinreinhumanermonoklonaler
1. BEZEICHNUNG DES ARZNEIMITTELS Injektionslösung in einer Fertigspritze 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Jede Fertigspritze für den Einmalgebrauch enthält 45 mg Ustekinumab in 0,5 ml. Ustekinumabisteinreinhumanermonoklonaler
Dossierbewertung A15-28 Version 1.0 Netupitant/Palonosetron Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Netupitant/Palonosetron gemäß 35a SGB V beauftragt. Die Bewertung erfolgte
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Netupitant/Palonosetron gemäß 35a SGB V beauftragt. Die Bewertung erfolgte
Anhang I. Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen
 Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Pressemitteilung der EMEA vom in deutscher Übersetzung:
 Pressemitteilung der EMEA vom 9. 12. 2004 in deutscher Übersetzung: Außerordentliche Sitzung des CHMP zu Paroxetin und anderen selektiven Serotonin-Wiederaufnahmehemmern Der Ausschuss für Humanarzneimittel
Pressemitteilung der EMEA vom 9. 12. 2004 in deutscher Übersetzung: Außerordentliche Sitzung des CHMP zu Paroxetin und anderen selektiven Serotonin-Wiederaufnahmehemmern Der Ausschuss für Humanarzneimittel
Qualitätssicherung in der Klinischen Forschung / SOPs, Audits und Inspektionen Katharina Thorn Vorsitzende DVMD e.v.
 Qualitätssicherung in der Klinischen Forschung / SOPs, Audits und Inspektionen Katharina Thorn Vorsitzende DVMD e.v. DVMD-Symposium Hannover / K. Thorn Warum Qualitätssicherung in der Klinischen Forschung?
Qualitätssicherung in der Klinischen Forschung / SOPs, Audits und Inspektionen Katharina Thorn Vorsitzende DVMD e.v. DVMD-Symposium Hannover / K. Thorn Warum Qualitätssicherung in der Klinischen Forschung?
Protokol ID: AGO-OVAR OP.4 (AGO DESKTOP OVAR III)
 EINE RANDOMISIERTE, MULTIZENTRISCHE STUDIE ZUM VERGLEICH DER WIRKSAMKEIT EINER ZUSÄTZLICHEN TUMORDEBULKING-OPERATION GEGEN EINE ALLEINIGE CHEMOTHERAPIE BEI PATIENTINNEN MIT EINEM PLATIN-SENSIBLEN OVARIALKARZINOM-REZIDIV
EINE RANDOMISIERTE, MULTIZENTRISCHE STUDIE ZUM VERGLEICH DER WIRKSAMKEIT EINER ZUSÄTZLICHEN TUMORDEBULKING-OPERATION GEGEN EINE ALLEINIGE CHEMOTHERAPIE BEI PATIENTINNEN MIT EINEM PLATIN-SENSIBLEN OVARIALKARZINOM-REZIDIV
Therapie mit Acitretin-haltigen Arzneimitteln: Was Sie wissen müssen
 Therapie mit Acitretin-haltigen Arzneimitteln: Was Sie wissen müssen Informationsbroschüre für männliche Patienten und Patientinnen, die nicht im gebärfähigen Alter sind Diese Informationsbroschüre wurde
Therapie mit Acitretin-haltigen Arzneimitteln: Was Sie wissen müssen Informationsbroschüre für männliche Patienten und Patientinnen, die nicht im gebärfähigen Alter sind Diese Informationsbroschüre wurde
Anhang I. Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen
 Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Statistische Auswertung einer Anwendungsbeobachtung mit der Präparateserie QUENTAKEHL
 Statistische Auswertung einer Anwendungsbeobachtung mit der Präparateserie QUENTAKEHL in den Darreichungsformen Kapseln, Tropfen, Zäpfchen und Injektionslösung von Dr. Reiner Heidl In 7 Arztpraxen (3 Allgemeinärzte,
Statistische Auswertung einer Anwendungsbeobachtung mit der Präparateserie QUENTAKEHL in den Darreichungsformen Kapseln, Tropfen, Zäpfchen und Injektionslösung von Dr. Reiner Heidl In 7 Arztpraxen (3 Allgemeinärzte,
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Wichtige Informationen zur Assoziation von Sprycel (Dasatinib) mit pulmonaler arterieller Hypertonie (PAH)
 2. August 2011 Wichtige Informationen zur Assoziation von Sprycel (Dasatinib) mit pulmonaler arterieller Hypertonie (PAH) Sehr geehrte Frau Doktor, sehr geehrter Herr Doktor, sehr geehrte Frau Apothekerin,
2. August 2011 Wichtige Informationen zur Assoziation von Sprycel (Dasatinib) mit pulmonaler arterieller Hypertonie (PAH) Sehr geehrte Frau Doktor, sehr geehrter Herr Doktor, sehr geehrte Frau Apothekerin,
Die Bedeutung der Qualitätssicherung in der klinischen Forschung
 Die Bedeutung der Qualitätssicherung in der klinischen Forschung Am Beispiel eines externen Qualitätsaudits Nadja Schachteli 1 Qualitätskontrolle und Qualitätssicherung, GCP 5.1.1 Der Sponsor ist für die
Die Bedeutung der Qualitätssicherung in der klinischen Forschung Am Beispiel eines externen Qualitätsaudits Nadja Schachteli 1 Qualitätskontrolle und Qualitätssicherung, GCP 5.1.1 Der Sponsor ist für die
Unabhängiger Arzneimittelberatungsdienst für Patienten
 Unabhängiger Arzneimittelberatungsdienst für Patienten Uta Heinrich-Gräfe, Apothekerin Projektleitung Arzneimittelberatungsdienst 1. Deutscher Kongress für patientenorientierte Arzneimittelinformation
Unabhängiger Arzneimittelberatungsdienst für Patienten Uta Heinrich-Gräfe, Apothekerin Projektleitung Arzneimittelberatungsdienst 1. Deutscher Kongress für patientenorientierte Arzneimittelinformation
Anhang III. Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen
 Anhang III Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen Anmerkung: Diese Änderungen der entsprechenden Abschnitte der Zusammenfassung
Anhang III Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen Anmerkung: Diese Änderungen der entsprechenden Abschnitte der Zusammenfassung
Patienteninformation zur Behandlung der Psoriasis mit Methotrexat
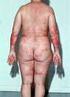 Praxis Dr. Ralph von Kiedrowski Patienteninformation zur Behandlung der Psoriasis mit Methotrexat Liebe Patientin, lieber Patient, dieses Informationsblatt soll Ihnen die vorgesehene Behandlung mit Methotrexat
Praxis Dr. Ralph von Kiedrowski Patienteninformation zur Behandlung der Psoriasis mit Methotrexat Liebe Patientin, lieber Patient, dieses Informationsblatt soll Ihnen die vorgesehene Behandlung mit Methotrexat
Konsens zur immunsuppressiven Therapie der erworbenen Hämophilie
 GTH-Arbeitsgruppe Erworbene Hämophilie Konsens zur immunsuppressiven Therapie der erworbenen Hämophilie Datum: 29.12.2010 Version 29.12.2010 1 Inhalt Inhalt... 2 Definitionen... 2 Komplette Remission (CR):...
GTH-Arbeitsgruppe Erworbene Hämophilie Konsens zur immunsuppressiven Therapie der erworbenen Hämophilie Datum: 29.12.2010 Version 29.12.2010 1 Inhalt Inhalt... 2 Definitionen... 2 Komplette Remission (CR):...
Mitteilung des Bundesamts für Sicherheit im Gesundheitswesen über Maßnahmen zur Gewährleistung der Arzneimittelsicherheit:
 Landeshauptleute Landessanitätsdirektionen Österreichische Apothekerkammer Österreichische Ärztekammer Landesärztekammern Anstaltsapotheken d. Universitätskliniken Datum: 16.11.2015 Kontakt: Mag. Rudolf
Landeshauptleute Landessanitätsdirektionen Österreichische Apothekerkammer Österreichische Ärztekammer Landesärztekammern Anstaltsapotheken d. Universitätskliniken Datum: 16.11.2015 Kontakt: Mag. Rudolf
Gesundheitsbezogene Lebensqualität 5 bis 10 Jahre nach einer Darmkrebsdiagnose
 07.09.2010 Gesundheitsbezogene Lebensqualität 5 bis 10 Jahre nach einer Darmkrebsdiagnose Eine prospektive Studie über 10 Jahre (VERDI) Lina Jansen¹, Antje Kiesel¹, Christa Stegmaier², Susanne Singer³,
07.09.2010 Gesundheitsbezogene Lebensqualität 5 bis 10 Jahre nach einer Darmkrebsdiagnose Eine prospektive Studie über 10 Jahre (VERDI) Lina Jansen¹, Antje Kiesel¹, Christa Stegmaier², Susanne Singer³,
Welche Behandlungsmöglichkeiten gibt es?
 Welche Behandlungsmöglichkeiten gibt es? Welche Behandlungsmöglichkeiten gibt es? Die Behandlung der Parkinson-Erkrankung setzt sich aus mehreren Elementen zusammen. Dazu gehört zunächst eine Aufklärung
Welche Behandlungsmöglichkeiten gibt es? Welche Behandlungsmöglichkeiten gibt es? Die Behandlung der Parkinson-Erkrankung setzt sich aus mehreren Elementen zusammen. Dazu gehört zunächst eine Aufklärung
Information Dimensionen der Bedeutsamkeit / Spiritualität bei Menschen mit Down-Syndrom
 ( Die folgenden 3 Seiten bitte entweder per Post oder per Email zusenden!) Sehr geehrte Damen und Herren, im Rahmen eines Promotionsvorhabens an der Universität Witten/Herdecke möchten wir Menschen mit
( Die folgenden 3 Seiten bitte entweder per Post oder per Email zusenden!) Sehr geehrte Damen und Herren, im Rahmen eines Promotionsvorhabens an der Universität Witten/Herdecke möchten wir Menschen mit
Amendment 3 zum Berichtsplan Glitazone zur Behandlung des Diabetes mellitus Typ 2. [Auftrag A05/05-A]
![Amendment 3 zum Berichtsplan Glitazone zur Behandlung des Diabetes mellitus Typ 2. [Auftrag A05/05-A] Amendment 3 zum Berichtsplan Glitazone zur Behandlung des Diabetes mellitus Typ 2. [Auftrag A05/05-A]](/thumbs/51/28779578.jpg) Amendment 3 zum Berichtsplan Glitazone zur Behandlung des Diabetes mellitus Typ 2 [Auftrag A05/05-A] 10.03.2007 Thema: Nutzenbewertung von Glitazonen zur Behandlung des Diabetes mellitus Typ 2 Auftraggeber:
Amendment 3 zum Berichtsplan Glitazone zur Behandlung des Diabetes mellitus Typ 2 [Auftrag A05/05-A] 10.03.2007 Thema: Nutzenbewertung von Glitazonen zur Behandlung des Diabetes mellitus Typ 2 Auftraggeber:
Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva
 Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva Darmstadt (19. Februar 2009) Die Merck KGaA hat heute bekannt gegeben, dass die europäische Arzneimittelbehörde EMEA
Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva Darmstadt (19. Februar 2009) Die Merck KGaA hat heute bekannt gegeben, dass die europäische Arzneimittelbehörde EMEA
PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Therapie mit Cyclophosphamid
 PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Therapie mit Cyclophosphamid Sehr geehrte Patientin! Sehr geehrter Patient! Sie leiden unter einer schwerwiegenden entzündlichen Erkrankung des rheumatischen
PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Therapie mit Cyclophosphamid Sehr geehrte Patientin! Sehr geehrter Patient! Sie leiden unter einer schwerwiegenden entzündlichen Erkrankung des rheumatischen
SOP allergische Reaktion Erwachsene
 1. Ziel und Zweck Diese SOP soll bei allen Patienten, die sich im zuständigen Rettungsdienstbereich mit der Symptomatik einer schweren allergischen/anaphylaktischen Reaktion an den Rettungsdienst wenden,
1. Ziel und Zweck Diese SOP soll bei allen Patienten, die sich im zuständigen Rettungsdienstbereich mit der Symptomatik einer schweren allergischen/anaphylaktischen Reaktion an den Rettungsdienst wenden,
Nutzen-Schaden-Bewertung von Arzneimitteln nach der Zulassung
 Nutzen-Schaden-Bewertung von Arzneimitteln nach der Zulassung U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Abteilung Pharmakovigilanz IQWiG im Dialog Köln, 19. Besuchen Sie unsere
Nutzen-Schaden-Bewertung von Arzneimitteln nach der Zulassung U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Abteilung Pharmakovigilanz IQWiG im Dialog Köln, 19. Besuchen Sie unsere
Spitzenergebnisse in der refraktiven Chirurgie
 Spitzenergebnisse in der refraktiven Chirurgie WaveLight REFRACTIVE PORTFOLIO Advancing REFRACTIVE SURGERY setzt den Standard bei LASIK-Ergebnissen Topographie-geführte LASIK: Ein großer Schritt nach vorne
Spitzenergebnisse in der refraktiven Chirurgie WaveLight REFRACTIVE PORTFOLIO Advancing REFRACTIVE SURGERY setzt den Standard bei LASIK-Ergebnissen Topographie-geführte LASIK: Ein großer Schritt nach vorne
Patienteninformation
 Patienteninformation Sehr geehrte Patientin, sehr geehrter Patient, Ihr Arzt hat Ihnen die Möglichkeit zur Teilnahme an einer klinischen Studie eröffnet. Vielleicht sind Sie auch durch eigene Initiative
Patienteninformation Sehr geehrte Patientin, sehr geehrter Patient, Ihr Arzt hat Ihnen die Möglichkeit zur Teilnahme an einer klinischen Studie eröffnet. Vielleicht sind Sie auch durch eigene Initiative
Dossierbewertung A15-31 Version 1.0 Tiotropium/Olodaterol Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung der Wirkstoffkombination Tiotropium/ Olodaterol gemäß 35a SGB V beauftragt. Die Bewertung
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung der Wirkstoffkombination Tiotropium/ Olodaterol gemäß 35a SGB V beauftragt. Die Bewertung
Mesalazin bei Colitis ulcerosa Sind alle therapeutischen Möglichkeiten ausgereizt?
 Mesalazin bei Colitis ulcerosa Sind alle therapeutischen Möglichkeiten ausgereizt? Von Prof. Dr. med. Stefan Schreiber Berlin (3. Oktober 2008) - Seit 1940 erstmals Sulfasalazine zur Therapie der entzündlichen
Mesalazin bei Colitis ulcerosa Sind alle therapeutischen Möglichkeiten ausgereizt? Von Prof. Dr. med. Stefan Schreiber Berlin (3. Oktober 2008) - Seit 1940 erstmals Sulfasalazine zur Therapie der entzündlichen
Studie bestätigt Wirksamkeit von Neurodoron
 Studie bestätigt Wirksamkeit von Neurodoron Schwäbisch Gmünd (12. August 2010) - Neurodoron von Weleda ist ein sehr gut wirksames und verträgliches Arzneimittel bei der Behandlung von Patienten, die stressbedingt
Studie bestätigt Wirksamkeit von Neurodoron Schwäbisch Gmünd (12. August 2010) - Neurodoron von Weleda ist ein sehr gut wirksames und verträgliches Arzneimittel bei der Behandlung von Patienten, die stressbedingt
Sehr geehrte Patientin! Sehr geehrter Patient!
 Univ. Klinik f. Innere Medizin LKH Graz Klinische Abteilung für Rheumatologie und Immunologie Univ. Prof. Dr. W. Graninger Auenbruggerplatz 15, A-8036 Graz Tel 0 316-385-12645 PATIENTENAUFKLÄRUNG ZUR THERAPIE
Univ. Klinik f. Innere Medizin LKH Graz Klinische Abteilung für Rheumatologie und Immunologie Univ. Prof. Dr. W. Graninger Auenbruggerplatz 15, A-8036 Graz Tel 0 316-385-12645 PATIENTENAUFKLÄRUNG ZUR THERAPIE
Dokumentation von SAEs in EDC-Studien Ist das selbst ein unerwünschtes Ereignis?
 Dokumentation von SAEs in EDC-Studien Ist das selbst ein unerwünschtes Ereignis? 10. DVMD-Fachtagung 1. - 4. April 2009 Ludwigshafen am Rhein Jens Knösel Metronomia Clinical Research GmbH Metronomia Clinical
Dokumentation von SAEs in EDC-Studien Ist das selbst ein unerwünschtes Ereignis? 10. DVMD-Fachtagung 1. - 4. April 2009 Ludwigshafen am Rhein Jens Knösel Metronomia Clinical Research GmbH Metronomia Clinical
Dossierbewertung A15-60 Version 1.0 Sacubitril/Valsartan Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Sacubitril/Valsartan gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Sacubitril/Valsartan gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf
Dossierbewertung A14-28 Version 1.0 Apixaban (neues Anwendungsgebiet) Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Apixaban (neues Anwendungsgebiet) gemäß 35a SGB V beauftragt. Die Bewertung
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Apixaban (neues Anwendungsgebiet) gemäß 35a SGB V beauftragt. Die Bewertung
Risiken bei Arzneimitteln und Medizinprodukten Maßnahmen in der Apotheke
 Leitlinie Kommentar Arbeitshilfe Leitlinie der Bundesapothekerkammer zur Qualitätssicherung Risiken bei Arzneimitteln und Medizinprodukten Maßnahmen in der Apotheke Stand der Revision: 23.11.2016 Inhaltsverzeichnis
Leitlinie Kommentar Arbeitshilfe Leitlinie der Bundesapothekerkammer zur Qualitätssicherung Risiken bei Arzneimitteln und Medizinprodukten Maßnahmen in der Apotheke Stand der Revision: 23.11.2016 Inhaltsverzeichnis
INFLECTRA (INFLIXIMAB): SICHERHEITSINFORMATION FÜR VERSCHREIBENDE ÄRZTE
 INFLECTRA (INFLIXIMAB): SICHERHEITSINFORMATION FÜR VERSCHREIBENDE ÄRZTE Infliximab kann mit schwerwiegenden, potentiell lebensbedrohlichen Nebenwirkungen einhergehen, die verhindert oder identifiziert
INFLECTRA (INFLIXIMAB): SICHERHEITSINFORMATION FÜR VERSCHREIBENDE ÄRZTE Infliximab kann mit schwerwiegenden, potentiell lebensbedrohlichen Nebenwirkungen einhergehen, die verhindert oder identifiziert
Gesundheitsbezogene Lebensqualität, körperliche Beschwerden, psychische Komorbidität und Interventionen bei Dyspepsie
 Medizinische Fakultät der Charité - Universitätsmedizin Berlin Campus Benjamin Franklin aus der Abteilung für Allgemeinmedizin mit Allgemeinpraxis Direktor: Prof. Dr. med. P. Mitznegg Gesundheitsbezogene
Medizinische Fakultät der Charité - Universitätsmedizin Berlin Campus Benjamin Franklin aus der Abteilung für Allgemeinmedizin mit Allgemeinpraxis Direktor: Prof. Dr. med. P. Mitznegg Gesundheitsbezogene
Aktuelle Warnungen und Diskussion zum Einsatz von HAES
 Aktuelle Warnungen und Diskussion zum Einsatz von HAES Sitzung der DGTI-Sektion 3 in Frankfurt am 21.11.2013 Prof. Dr. med. Erwin Strasser Obmann der DGTI-Sektion 3 Präparative und therapeutische Hämapherese
Aktuelle Warnungen und Diskussion zum Einsatz von HAES Sitzung der DGTI-Sektion 3 in Frankfurt am 21.11.2013 Prof. Dr. med. Erwin Strasser Obmann der DGTI-Sektion 3 Präparative und therapeutische Hämapherese
Behandlung der feuchten altersabhängigen Makuladegeneration (feuchte AMD) mit VEGF-Hemmern durch operative Medikamenteneingabe in das Auge
 Augenarztpraxis AltenKirchen Dr. med. Thomas Wehler Facharzt für Augenheilkunde Wilhelmstr. 32 Schlossweg 2 57610 Altenkirchen Tel 02681-1651 Fax 02681-6094 Mail info@ak-augenarzt.de Net www.ak-augenarzt.de
Augenarztpraxis AltenKirchen Dr. med. Thomas Wehler Facharzt für Augenheilkunde Wilhelmstr. 32 Schlossweg 2 57610 Altenkirchen Tel 02681-1651 Fax 02681-6094 Mail info@ak-augenarzt.de Net www.ak-augenarzt.de
i:fox WEB Arzneimittel-Therapie- Sicherheit und aktuellste Daten für Online-Apotheken
 Mit Sicherheit mehr Visits & Umsatz durch Online-Checks für Medikamente i:fox WEB Arzneimittel-Therapie- Sicherheit und aktuellste Daten für Online-Apotheken Mehr Information = mehr Visits = mehr Umsatz
Mit Sicherheit mehr Visits & Umsatz durch Online-Checks für Medikamente i:fox WEB Arzneimittel-Therapie- Sicherheit und aktuellste Daten für Online-Apotheken Mehr Information = mehr Visits = mehr Umsatz
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Register zur Langzeitdokumentation der Therapie der juvenilen idiopathischen Arthritis im Kindes- und Jugendalter
 Biologika in der Kinderrheumatologie Register zur Langzeitdokumentation der Therapie der juvenilen idiopathischen Arthritis im Kindes- und Jugendalter Ihre Unterlagen für die Dokumentation Version 3.1
Biologika in der Kinderrheumatologie Register zur Langzeitdokumentation der Therapie der juvenilen idiopathischen Arthritis im Kindes- und Jugendalter Ihre Unterlagen für die Dokumentation Version 3.1
Monate Präop Tabelle 20: Verteilung der NYHA-Klassen in Gruppe 1 (alle Patienten)
 Parameter zur Beschreibung der Leistungsfähigkeit Klassifikation der New-York-Heart-Association (NYHA) Gruppe 1 (alle Patienten): Die Eingruppierung der Patienten in NYHA-Klassen als Abbild der Schwere
Parameter zur Beschreibung der Leistungsfähigkeit Klassifikation der New-York-Heart-Association (NYHA) Gruppe 1 (alle Patienten): Die Eingruppierung der Patienten in NYHA-Klassen als Abbild der Schwere
Frage: Führt die antibiotische Behandlung der Helicobacter pylori Infektion bei Patienten mit funktioneller Dyspepsie zur Beschwerdefreiheit?
 Funktionelle Dyspepsie: Bei Patienten mit positivem Helicobacter pylori Nachweis hilft eine Eradikation, wenn überhaupt nur wenigen Patienten (Resultate von 2 Studien) Frage: Führt die antibiotische Behandlung
Funktionelle Dyspepsie: Bei Patienten mit positivem Helicobacter pylori Nachweis hilft eine Eradikation, wenn überhaupt nur wenigen Patienten (Resultate von 2 Studien) Frage: Führt die antibiotische Behandlung
Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten
 Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten Arzneimittelmarktneuordnungsgesetz (AMNOG) 35a Bewertung des Nutzens von Arzneimitteln
Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten Arzneimittelmarktneuordnungsgesetz (AMNOG) 35a Bewertung des Nutzens von Arzneimitteln
Therapieschritte bei der Psoriasis vulgaris
 Therapieschritte bei der Psoriasis vulgaris Barbara Schubert Gemeinschaftspraxis Dr. Schubert, Dr. Frank, Konrad, Priv. Doz. Dr. Dr. Eggert Hautärzte Allergologie Phlebologie Lymphologie Proktologie Onkologie
Therapieschritte bei der Psoriasis vulgaris Barbara Schubert Gemeinschaftspraxis Dr. Schubert, Dr. Frank, Konrad, Priv. Doz. Dr. Dr. Eggert Hautärzte Allergologie Phlebologie Lymphologie Proktologie Onkologie
S3-LEITLINIE ZUR DIAGNOSTIK, THERAPIE UND NACHSORGE DER PERIPHEREN ARTERIELLEN VERSCHLUSSKRANKHEIT
 S3-LEITLINIE ZUR DIAGNOSTIK, THERAPIE UND NACHSORGE DER PERIPHEREN ARTERIELLEN VERSCHLUSSKRANKHEIT Stand: 30. September 2015 95% der Fälle durch Arteriosklerose Herzinfarkt, Schlaganfall und PAVK In ungefähr
S3-LEITLINIE ZUR DIAGNOSTIK, THERAPIE UND NACHSORGE DER PERIPHEREN ARTERIELLEN VERSCHLUSSKRANKHEIT Stand: 30. September 2015 95% der Fälle durch Arteriosklerose Herzinfarkt, Schlaganfall und PAVK In ungefähr
Probleme der Bewertung und Meldung von unerwarteten schwerwiegenden Nebenwirkungen
 Probleme der Bewertung und Meldung von unerwarteten schwerwiegenden Nebenwirkungen PD Dr. med. Thomas Sudhop Abteilung Wissenschaftlicher Service Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM),
Probleme der Bewertung und Meldung von unerwarteten schwerwiegenden Nebenwirkungen PD Dr. med. Thomas Sudhop Abteilung Wissenschaftlicher Service Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM),
Hinweise zur Antragstellung
 ETHIK-KOMMISSION der Medizinischen Fakultät der Ruhr-Universität Bochum Vorsitzender: Prof. Dr. M. Zenz Geschäftsführende Ärztin: Christine Schnell Sekretariat: Gabriele Crüsemann Geschäftsstelle: Gesundheitscampus
ETHIK-KOMMISSION der Medizinischen Fakultät der Ruhr-Universität Bochum Vorsitzender: Prof. Dr. M. Zenz Geschäftsführende Ärztin: Christine Schnell Sekretariat: Gabriele Crüsemann Geschäftsstelle: Gesundheitscampus
Ein sorgfältig gepflegter Garten strahlt Schönheit aus und bereitet Freude. (Das gilt auch für die Gesundheit Ihrer Knochen.)
 Ein sorgfältig gepflegter Garten strahlt Schönheit aus und bereitet Freude. (Das gilt auch für die Gesundheit Ihrer Knochen.) Die Erhaltung Ihrer Knochen erfordert Ihre Pflege und Aufmerksamkeit. Wenn
Ein sorgfältig gepflegter Garten strahlt Schönheit aus und bereitet Freude. (Das gilt auch für die Gesundheit Ihrer Knochen.) Die Erhaltung Ihrer Knochen erfordert Ihre Pflege und Aufmerksamkeit. Wenn
Qualitätsbericht. der IKK classic. für das Behandlungsprogramm. IKK Promed Brustkrebs. in der Region Baden-Württemberg
 Qualitätsbericht der IKK classic für das Behandlungsprogramm IKK Promed Brustkrebs in der Region Baden-Württemberg vom 01.01.2013 bis 31.12.2013 Präambel Patienten können in Deutschland auf eine leistungsfähige
Qualitätsbericht der IKK classic für das Behandlungsprogramm IKK Promed Brustkrebs in der Region Baden-Württemberg vom 01.01.2013 bis 31.12.2013 Präambel Patienten können in Deutschland auf eine leistungsfähige
Gute Überlebensqualität Trastuzumab beim metastasierten Magenkarzinom
 Gute Überlebensqualität Trastuzumab beim metastasierten Magenkarzinom München (24. April 2012) - Mit dem monoklonalen Antikörper Trastuzumab (Herceptin ) steht bislang die einzige zielgerichtete Substanz
Gute Überlebensqualität Trastuzumab beim metastasierten Magenkarzinom München (24. April 2012) - Mit dem monoklonalen Antikörper Trastuzumab (Herceptin ) steht bislang die einzige zielgerichtete Substanz
NeuroBloc. Botulinumtoxin Typ B Injektionslösung 5000 E/ml. Wichtige Informationen zur Sicherheit für Ärzte
 NeuroBloc Botulinumtoxin Typ B Injektionslösung 5000 E/ml Wichtige Informationen zur Sicherheit für Ärzte Dieses Handbuch dient dazu, Ärzte, die für die Verschreibung und die Verabreichung von NeuroBloc
NeuroBloc Botulinumtoxin Typ B Injektionslösung 5000 E/ml Wichtige Informationen zur Sicherheit für Ärzte Dieses Handbuch dient dazu, Ärzte, die für die Verschreibung und die Verabreichung von NeuroBloc
Cosentyx 1/ 2 Fertigspritze/n 150mg/1 ml, Cosentyx/ -SensoReady 1/ 2 Auto-Injektor 150mg/1 ml
 Eidgenössisches Departement des Innern EDI Bundesamt für Gesundheit BAG Direktionsbereich Kranken- und Unfallversicherung (20311/ 20316) Cosentyx/ -SensoReady Cosentyx 1/ 2 Fertigspritze/n 150mg/1 ml,
Eidgenössisches Departement des Innern EDI Bundesamt für Gesundheit BAG Direktionsbereich Kranken- und Unfallversicherung (20311/ 20316) Cosentyx/ -SensoReady Cosentyx 1/ 2 Fertigspritze/n 150mg/1 ml,
14 Allgemeine Informationen. Juristische Aspekte
 14 Allgemeine Informationen Juristische Aspekte Unter Notfällen sind aus juristischer Sicht solche Ereignisse zu verstehen, die außerplanmäßige Behandlungen erforderlich machen. Grundsätzlich beinhaltet
14 Allgemeine Informationen Juristische Aspekte Unter Notfällen sind aus juristischer Sicht solche Ereignisse zu verstehen, die außerplanmäßige Behandlungen erforderlich machen. Grundsätzlich beinhaltet
AZ V /
 Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn An pharmazeutische Unternehmer nachrichtlich: Stufenplanbeteiligte Postanschrift: Kurt-Georg-Kiesinger-Allee
Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn An pharmazeutische Unternehmer nachrichtlich: Stufenplanbeteiligte Postanschrift: Kurt-Georg-Kiesinger-Allee
KLINISCHE PRÜFUNG EINE EINFÜHRUNG. ATA Conference 2003 - Elke Vogt-Arendt
 KLINISCHE PRÜFUNG EINE EINFÜHRUNG ATA Conference 2003 - Elke Vogt-Arendt Was ist eine klinische Prüfung? Überprüfung von Wirkung, Nebenwirkung, Dosierung usw. eines neuen Arzneimittels vor Markteinführung.
KLINISCHE PRÜFUNG EINE EINFÜHRUNG ATA Conference 2003 - Elke Vogt-Arendt Was ist eine klinische Prüfung? Überprüfung von Wirkung, Nebenwirkung, Dosierung usw. eines neuen Arzneimittels vor Markteinführung.
Bundesinstitut für Arzneimittel und Medizinprodukte Langwirksame Beta-Mimetika (LABA) Salmeterol/ Formoterol
 Langwirksame Beta-Mimetika (LABA) Salmeterol/ Formoterol Risikobewertung Änderung der Produktinformationen Anstoß der Diskussion Salmeterol-Studien: SMART-Studie (Salmeterol Multicenter Asthma Research
Langwirksame Beta-Mimetika (LABA) Salmeterol/ Formoterol Risikobewertung Änderung der Produktinformationen Anstoß der Diskussion Salmeterol-Studien: SMART-Studie (Salmeterol Multicenter Asthma Research
Was tun bei Fatigue? Florian Zettl, Abteilung Hämatologie/Onkologie und Palliativmedizin
 Was tun bei Fatigue? Florian Zettl, Abteilung Hämatologie/Onkologie und Palliativmedizin Tumor-assoziierte Fatigue Definition [CrF Cancer related Fatigue] Quälende Form der Erschöpfung Außerordentliche
Was tun bei Fatigue? Florian Zettl, Abteilung Hämatologie/Onkologie und Palliativmedizin Tumor-assoziierte Fatigue Definition [CrF Cancer related Fatigue] Quälende Form der Erschöpfung Außerordentliche
Tagesprofilbögen zeigen eine gute klinische Relevanz
 Neue Entwicklungen in der Pharmakotherapie der ADHS Aachen (16. März 2007) - Psychische Auffälligkeiten bei Kindern und Jugendlichen nehmen nach neuesten Erkenntnissen des Robert Koch-Instituts zur Kinder-
Neue Entwicklungen in der Pharmakotherapie der ADHS Aachen (16. März 2007) - Psychische Auffälligkeiten bei Kindern und Jugendlichen nehmen nach neuesten Erkenntnissen des Robert Koch-Instituts zur Kinder-
Die Regelung wurde eingeführt durch das GKV- Gesundheitsreformgesetz v mit Wirkung vom
 Exkurs Positivliste Der Gesetzgeber hatte in 33 a SGB V bestimmt, dass das BMGS ermächtigt wird, durch Rechtsverordnung eine Liste der verordnungsfähigen Arzneimittel zu erlassen. Die Regelung wurde eingeführt
Exkurs Positivliste Der Gesetzgeber hatte in 33 a SGB V bestimmt, dass das BMGS ermächtigt wird, durch Rechtsverordnung eine Liste der verordnungsfähigen Arzneimittel zu erlassen. Die Regelung wurde eingeführt
Leitliniengerechte Therapie bei metastasiertem kolorektalem Karzinom
 Leitliniengerechte Therapie bei metastasiertem kolorektalem Karzinom Case Report NZW Dresden 2010 Stefan Schalbaba stefan.schalbaba@klinikum-memmingen.de Patientenidentität und Subjektive Daten Patient
Leitliniengerechte Therapie bei metastasiertem kolorektalem Karzinom Case Report NZW Dresden 2010 Stefan Schalbaba stefan.schalbaba@klinikum-memmingen.de Patientenidentität und Subjektive Daten Patient
