YERVOY (Ipilimumab) Informationen zur Risikominimierung für medizinische Fachkräfte Leitfaden für die Anwendung
|
|
|
- Ralph Boer
- vor 6 Jahren
- Abrufe
Transkript
1 Behördlich genehmigtes Schulungsmaterial YERVOY (Ipilimumab) Konzentrat zur Herstellung einer Infusionslösung Informationen zur Risikominimierung für medizinische Fachkräfte Leitfaden für die Anwendung YERVOY (Ipilimumab) ist indiziert für die Behandlung von fortgeschrittenen (nicht resezierbaren oder metastasierten) Melanomen bei Erwachsenen. 1 Dieser Leitfaden zur Anwendung von Ipilimumab wurde als Teil der Zulassungsauflage erstellt und ist eine zusätzliche risikominimierende Maßnahme. wird medizinischen Fachkräften zur Verfügung gestellt, die an der Behandlung von Patienten mit Ipilimumab beteiligt sind. ist wichtig, um die sichere und wirksame Anwendung von Ipilimumab und die richtige Behandlung von immunvermittelten Nebenwirkungen sicherzustellen. muss vor der Verschreibung und Anwendung von Ipilimumab gelesen werden. führt die Patientenbroschüre und die Patientenkarte ein. Es ist wichtig, die Patientenbroschüre zusammen mit den Patienten vor jedem Behandlungszyklus zu besprechen, um das Verständnis der Nebenwirkungen und der Notwendigkeit, beim Auftreten von Nebenwirkungen einen Arzt zu kontaktieren, beim Patienten zu verfestigen. Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Sie können dabei helfen, indem Sie jede auftretende Nebenwirkung melden.
2 YERVOY - Informationen für medizinische Fachkräfte Inhalt 3 Zusammenfassung wichtiger Informationen 4 Leitfaden für die Verschreibung 5 Immunvermittelte Nebenwirkungen 5 Frühzeitige Erkennung und richtige Behandlung 6 Behandlungsmodifikationen 8 Behandlungsmodifikationen (Fortsetzung) 9 Wann muss die Behandlung mit Ipilimumab aufgeschoben werden? 9 Wann muss die Behandlung mit Ipilimumab dauerhaft abgesetzt werden? 10 Patientenbroschüre und Patientenkarte 11 Checkliste für den ersten oder die folgenden Besuche des Patienten
3 2 3 Zusammenfassung wichtiger Informationen Ipilimumab erhöht das Risiko schwerer immunvermittelter Nebenwirkungen, einschließlich Kolitis, Hepatitis, Entzündung der Haut, neurologischer Nebenwirkungen, Endokrinopathien, Entzündung der Augen und anderer immunvermittelter Nebenwirkungen. Diese können auch mehrere Monate nach der letzten Dosis Ipilimumab auftreten. Ein frühes Erkennen und Behandeln der immunvermittelten Nebenwirkungen sind wichtig, um lebensbedrohliche Komplikationen zu minimieren. Vermutete Nebenwirkungen müssen umgehend untersucht werden, um infektiöse oder andere alternative Ursachen auszuschließen. Je nach Schweregrad der Symptome sollte Ipilimumab aufgeschoben oder dauerhaft abgesetzt werden und eine systemische, hoch-dosierte Kortikosteroidtherapie kann erforderlich sein. Patienten müssen über die Symptome dieser immunvermittelten Nebenwirkungen informiert werden und die Notwendigkeit, diese sofort dem behandelnden Arzt mitzuteilen. Aus diesem Grund gibt es die Patientenbroschüre und die Patientenkarte. Den Patienten sollte geraten werden, die Patientenkarte immer bei sich zu haben und sie bei allen medizinischen Behandlungen dem Fachpersonal vorzulegen.
4 YERVOY - Informationen für medizinische Fachkräfte Leitfaden für die Verschreibung Ipilimumab ist ein Medikament, das durch Erhöhung der T-Zell Aktivität dazu beiträgt, dass das Immunsystem eine Anti-Tumor-Wirkung ausübt. Es ist ein vollständig humanisierter, monoklonaler IgG1-Antikörper, der CTLA-4 (das zytotoxische T-Lymphozyten-assoziierte Antigen-4) blockiert. CTLA-4 wird auf T-Zellen exprimiert und wirkt wie eine natürliche Bremse der Immunreaktion. 1 Vor der Verschreibung von Ipilimumab und vor jeder Infusion sollten Sie überprüfen: Leberfunktionstests, Schilddrüsenfunktionstests, jegliche Zeichen oder Symptome immunvermittelter Nebenwirkungen, einschließlich Diarrhö und Kolitis, ob die Patientin schwanger ist, eine Schwangerschaft plant oder stillt. Vorsicht Ipilimumab sollte bei Patienten mit schwerer aktiver Autoimmunerkrankung vermieden werden, da eine weitere Aktivierung des Immunsystems möglicherweise lebensbedrohliche Auswirkungen haben kann. 1 Weitere Informationen zu Ipilimumab können Sie auch der Fachinformation und dem Beipackzettel entnehmen.
5 4 5 Immunvermittelte Nebenwirkungen Bei der Behandlung mit Ipilimumab können immunvermittelte Nebenwirkungen auftreten, einschließlich: Kolitis, die sich bis zu einer Blutung oder Darmperforation verschlimmern kann. Hepatitis, die zu einem Leberversagen führen kann. Entzündung der Haut, die zu schweren Hautreaktionen (toxisch epidermale Nekrolyse [TEN], Arzneimittelexanthem mit Eosinophilie und systemischen Symptomen [DRESS]) führen kann. Neurologische Nebenwirkungen, die zu einer motorischen oder sensorischen Neuropathie führen können. Endokrinopathien, die die Hypophyse, Nebenniere oder Schilddrüse und deren Funktion beeinträchtigen. Entzündung der Augen In klinischen Studien traten vereinzelt Fälle von schweren Infusionsreaktionen auf. Weitere immunvermittelte Nebenwirkungen: Uveitis, Eosinophilie, Lipase-Anstieg und Glomerulonephritis. Außerdem wurden Iritis, hämolytische Anämie, Amylase-Anstieg, Multiorganversagen und Pneumonitis unter besonderen Umständen berichtet. Fälle von Vogt-Koyanagi-Harada-Syndrom wurden nach der Zulassung (im Postmarketing-Umfeld) berichtet. Frühzeitige Erkennung und richtige Behandlung Ein frühes Erkennen und Behandeln von Nebenwirkungen ist wichtig, um lebensbedrohliche Komplikationen zu minimieren. Hochdosierte, systemische Kortikosteroide mit oder ohne zusätzliche Immunsuppressiva können für die Behandlung schwerer immunvermittelter Nebenwirkungen nötig sein. 1 Leitlinien zur Behandlung finden Sie in der Fachinformation 1. Melden Sie bitte jegliche vermutete Nebenwirkung an die nationale Behörde entsprechend des nationalen Meldesystems. Immunvermittelte Nebenwirkungen können noch Monate nach der letzten Gabe von Ipilimumab auftreten. 1
6 YERVOY - Informationen für medizinische Fachkräfte Behandlungsmodifikationen Immunvermittelte Nebenwirkung Gastrointestinal (Diarrhö, Kolitis) Schweregrad Grad-Definition nach NCI CTCAE, v3 Grad 1 oder 2 Grad 3 oder 4 Empfohlene Behandlungsmodifikation Behandlung mit Ipilimumab kann fortgesetzt werden. Eine symptomatische Behandlung und eine engmaschige Beobachtung werden empfohlen. Wenn die Symptome erneut auftreten oder über 5-7 Tage anhalten, die Behandlung mit Ipilimumab aufschieben und eine Therapie mit Kortikosteroiden (z.b. Methylprednisolon) in einer Dosierung von 1 mg/kg oral einmal täglich beginnen. Die Behandlung mit Ipilimumab kann bei Besserung auf Grad 0-1 oder auf den Zustand vor der Behandlung fortgesetzt werden. Ipilimumab dauerhaft absetzen. Behandlung mit intravenösen Kortikosteroid einleiten (z.b. Methylprednisolon in einer Dosierung von 2 mg/kg/tag). Wenn die Symptome unter Kontrolle sind, kann die Kortikosteroidgabe nach klinischem Ermessen reduziert werden. Das Ausschleichen sollte über einen Zeitraum von mindestens 1 Monat erfolgen, um ein Wiederauftreten der Reaktionen zu vermeiden. Grad 2 Erhöhung der Transaminasen oder des Gesamtbilirubins Behandlung aufschieben und Leberfunktionswerte beobachten bis zur Normalisierung. Wenn sich die Leberfunktionswerte verbessert haben, kann die Behandlung mit Ipilimumab fortgesetzt werden. Hepatotoxitzität Grad 3 oder 4 Erhöhung der Transaminasen oder des Gesamtbilirubins Ipilimumab dauerhaft absetzen und Kortikosteroide (z.b. Methylprednisolon 2 mg/kg/tag i.v. oder einem oralen Äquivalent) einleiten. Wenn die Symptome unter Kontrolle sind, kann die Kortikosteroidgabe nach klinischem Ermessen reduziert werden. Das Ausschleichen sollte über einen Zeitraum von mindestens 1 Monat erfolgen, um ein Wiederauftreten der Reaktionen zu vermeiden.
7 6 7 Immunvermittelte Nebenwirkung Haut (Ausschlag, Pruritus, DRESS, TEN) Neurologisch (Guillain-Barré Syndrom, Myasthenia gravis ähnliche Symptome, Muskelschwäche, sensorische Neuropathie)) Schweregrad Grad-Definition nach NCI CTCAE, v3 Grad 1 oder 2 Hautausschlag oder Grad 1 Pruritus Grad 3 Hautausschlag oder Grad 2 Pruritus Grad 4 Hautausschlag oder Grad 3 Pruritus Grad 2 Neuropathie Grad 3 oder 4 (sensorische) Neuropathie Grad 3 oder 4 (motorische) Neuropathie Empfohlene Behandlungsmodifikation Behandlung mit Ipilimumab kann fortgesetzt werden. Eine symptomatische Behandlung (z.b. Antihistaminika) wird empfohlen. Wenn die Symptome über 1-2 Wochen anhalten und sich unter lokaler Kortikosteroid- Anwendung nicht bessern, sollte oral ein Kortikosteroid gegeben werden (z.b. Prednison 1 mg/kg/tag oder Äquivalent). Behandlung aufschieben. Wenn die Symptome sich auf Grad 1 oder ganz zurückbilden, kann die Behandlung mit Ipilimumab fortgesetzt werden. Ipilimumab dauerhaft absetzen und eine hochdosierte systemische Kortikosteroid- Therapie (z.b. Methylprednisolon 2 mg/kg/tag i.v. oder einem oralen Äquivalent) einleiten. Wenn die Symptome unter Kontrolle sind, kann die Kortikosteroidgabe nach klinischem Ermessen reduziert werden. Das Ausschleichen sollte über einen Zeitraum von mindestens 1 Monat erfolgen, um ein Wiederauftreten der Reaktionen zu vermeiden. Behandlung aufschieben, wenn ein wahrscheinlicher Zusammenhang zu Ipilimumab besteht. Wenn die Symptome auf Ausgangsniveau zurückgehen, kann die Behandlung mit Ipilimumab fortgesetzt werden. Ipilimumab dauerhaft absetzen, wenn ein Zusammenhang mit Ipilimumab vermutet wird. Entsprechend der Richtlinien für die Behandlung von sensorischen Neuropathien behandeln und eine Koritkosteroid-Behandlung (z.b. Methylprednisolon 2 mg/kg/tag i.v.) einleiten. Behandlung dauerhaft absetzen unabhängig von der Kausalität.
8 YERVOY - Informationen für medizinische Fachkräfte Behandlungsmodifikationen (Fortsetzung) Immunvermittelte Nebenwirkung Schweregrad Grad-Definition nach NCI CTCAE, v3 Zeichen einer adrenalen Krise Empfohlene Behandlungsmodifikation I.v. Kortikosteroide und Mineralokortikoide verabreichen. Patient auf Vorhandensein einer Sepsis oder Infektion untersuchen. Endokrinopathien (Hypophysitis, Hypopituitarismus, Nebenniereninsuffizienz, Hypothyreose) Zeichen einer Nebenniereninsuffizienz (keine Krise) Abnorme Ergebnisse bei der Darstellung der Hypophyse (MRT) oder der endokrinen Labortests Weitere Untersuchungen in Betracht ziehen (einschließlich Laboruntersuchungen und bildgebende Verfahren). Vor Einleitung einer Kortikosteroid-Therapie sollte eine Untersuchung der endokrinen Funktionen in Betracht gezogen werden. Behandlung aufschieben und eine kurzzeitige Therapie mit Kortikosteroiden beginnen (z.b. Dexamethason 4 mg alle 6 Stunden oder Äquivalent). Entsprechenden Hormonersatz initiieren. Wenn die Symptome unter Kontrolle sind, kann die Kortikosteroidgabe nach klinischem Ermessen reduziert werden. Das Ausschleichen sollte über einen Zeitraum von mindestens 1 Monat erfolgen, um ein Wiederauftreten der Reaktionen zu vermeiden. Andere immunvermittelte NW (Uveitis, Eosinophilie, Lipase- Anstieg, Glomerulonephritis, Iritis, hämolytische Anämie, Amylase- Anstieg, Multi- Organ-Versagen, Pneumonitis) Grad 3 oder 4 Ipilimumab assoziierte Uveitis, Iritis, Episkleritis Ipilimumab dauerhaft absetzen und hochdosierte systemische Kortikosteroid-Therapie (z.b. methylprednisolon 2 mg/kg/tag i.v.) einleiten. Kortikosteroid-haltige Augentropfen nach medizinischer Maßgabe in Betracht ziehen. Grad Definition nach NCI CTCAE v4
9 Wann muss die Behandlung mit Ipilimumab aufgeschoben werden? 8 9 Schieben Sie die nächste Gabe von Ipilimumab bei Patienten mit den folgenden immunvermittelten Nebenwirkungen auf: mäßige Diarrhö oder Kolitis, die nicht durch medizinische Behandlung zu kontrollieren ist, andauert (5-7 Tage) oder erneut auftritt Grad 2 Erhöhung der AST oder ALT oder des Gesamtbilirubins mäßiger bis schwerer (Grad 3) Hautausschlag oder weit ausgebreiteter/ intensiver Pruritus schwere endokrinologische Nebenwirkungen, die nicht adäquat mit Hormonersatztherapie oder immunsuppressiver Therapie kontrolliert sind Grad 2 ungeklärte motorische Neuropathien, Muskelschwäche oder sensorische Neuropathien (die mehr als 4 Tage anhalten) mäßige Nebenwirkungen außer mäßigen Infusionsreaktionen Wann muss die Behandlung mit Ipilimumab dauerhaft abgesetzt werden? Setzen Sie Ipilimumab bei Patienten mit den folgenden immunvermittelten Nebenwirkungen dauerhaft ab: Grad 3 oder 4 Diarrhö oder Kolitis Grad 3 oder 4 Erhöhung der AST oder ALT oder des Gesamtbilirubins Grad 4 Hautausschlag (einschließlich Stevens-Johnson Syndrom oder toxisch epidermale Nekrolyse) oder Grad 3 Pruritus Grad 3 oder 4 motorische oder sensorische Neuropathie Grad 3 immunvermittelte Reaktionen (außer Grad 3-4 Endokrinopathien, die mit Hormonersatztherapie kontrolliert sind) Grad 2 für immunvermittelte okuläre Nebenwirkungen, die nicht auf eine topische immunsuppressive Therapie ansprechen Schwere Infusionsreaktionen Die Behandlung dieser Nebenwirkungen kann die Gabe von hoch-dosierten systemischen Kortikosteroiden erfordern, wenn nachgewiesen wurde oder vermutet wird, dass sie immunvermittelt sind (siehe Fachinformation).
10 YERVOY - Informationen für medizinische Fachkräfte Patientenbroschüre und Patientenkarte Es ist wichtig, die Patientenbroschüre allen Patienten auszuhändigen, die Ipilimumab zum ersten Mal erhalten oder die nach einer neuen Kopie fragen. Sie können die Patientenbroschüre verwenden, um die Ipilimumab-Behandlung zu besprechen. Behördlich genehmigtes Schulungsmaterial 1 Ihr Wegweiser zur Therapie mit YERVOY (Ipilimumab) Informationsbroschüre für Patienten Diese Patientenbroschüre zur Anwendung von Ipilimumab wurde als Teil der Zulassungsaufl agen erstellt und ist eine zusätzliche risikominimierende Maßnahme. YERVOY enthält den Wirkstoff Ipilimumab, ein Protein, das Ihrem Immunsystem hilft, Krebszellen mit Hilfe der eigenen Immunzellen anzugreifen und zu zerstören. Diese Broschüre soll Ihnen helfen, mögliche Nebenwirkungen zu erkennen, die während Ihrer Behandlung mit Ipilimumab auftreten können. Ipilimumab wurde Ihnen zur Behandlung eines fortgeschrittenen Melanoms (eine Krebserkrankung der Haut) verschrieben. Ipilimumab kann schwere Nebenwirkungen in verschiedenen Körperteilen auslösen, die unabhängig vom Schweregrad sofort behandelt werden müssen. Symptome können Durchfall, Gelbfärbung der Augen oder der Haut, Hautausschlag mit oder ohne Juckreiz, verschwommenes Sehen, Schmerzen im Auge, Muskelschwäche, Taubheitsgefühl oder Kribbeln in den Beinen, Armen oder dem Gesicht oder Kopfschmerzen sein. Informieren Sie Ihren Arzt vor Beginn der Behandlung über alle Ihre Erkrankungen. Kontaktieren Sie Ihren Arzt sofort, wenn bei Ihnen eines der Symptome auftritt, die in dieser Broschüre beschrieben sind, oder andere Symptome oder wenn Symptome andauern oder sich verschlimmern. Tragen Sie die Patientenkarte immer bei sich und zeigen Sie sie jedem Arzt, der Sie behandelt. Weitere Informationen zu Ipilimumab finden Sie in der Packungsbeilage. For more information, please refer to YERVOY Package Leafl et. Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifi zierung neuer Erkenntnisse über die Sicherheit. Sie können dabei helfen, indem Sie jede auftretende Nebenwirkung melden. Behördlich genehmigtes Schulungsmaterial YERVOY (Ipilimumab) Patientenkarte Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifi zierung neuer Erkenntnisse über die Sicherheit. Sie können dabei helfen, indem Sie jede auftretende Nebenwirkung melden. Die Patientenbroschüre soll den Patienten helfen, ihre Behandlung zu verstehen und zu wissen, wie sie reagieren sollten, wenn sie Nebenwirkungen (z.b. immunvermittelte Nebenwirkungen) bekommen. Zusätzlich enthält sie die Patientenkarte mit den Kontaktdaten, die die Patienten immer bei sich tragen sollen.
11 Checkliste für den ersten oder die folgenden Besuche des Patienten Erster Besuch Händigen Sie die Patientenbroschüre aus und besprechen Sie die Behandlung mit dem Patienten. Füllen Sie die Patientenkarte aus und weisen Sie die Patienten an, diese immer bei sich zu tragen. Weisen Sie die Patienten darauf hin, dass sie ihre Symptome nicht selbst behandeln und sofort medizinische Hilfe aufsuchen sollen, wenn Nebenwirkungen auftreten oder sich verschlimmern. Informieren Sie die Patienten, dass es auch zu einem Wachstum des bestehenden Tumors oder zu einer Neubildung von Tumoren kommen kann. Überprüfen Sie die entsprechenden Laborwerte. Überprüfen Sie den Patienten auf Zeichen und Symptome von immunvermittelten Nebenwirkungen. Alle nachfolgenden Besuche Überprüfen Sie die entsprechenden Laborwerte. Überprüfen Sie den Patienten auf Zeichen und Symptome von immunvermittelten Nebenwirkungen. Erinnern Sie die Patienten daran, Symptome nicht selbst zu behandeln. Erinnern Sie die Patienten daran, Sie sofort zu kontaktieren, auch wenn eine leichte Nebenwirkung auftritt, da sich einige Nebenwirkungen unbehandelt schnell verschlimmern können. Erinnern Sie die Patienten daran, dass eine frühzeitige Erkennung und eine geeignete Behandlung essentiell sind, um lebensbedrohliche Komplikationen zu minimieren. 1. YERVOY -Fachinformation, aktueller Stand
12 Behördlich genehmigtes Schulungsmaterial Meldung des Verdachts auf Nebenwirkungen Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko- Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden an: Paul-Ehrlich-Institut Paul-Ehrlich-Straße Langen Tel: Fax: Website: oder Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) Tel: Fax: Pharmakovigilanz@akdae.de Website: Arzneimittelsicherheit/ UAW-Meldung/index.html oder Bristol-Myers Squibb GmbH & Co. KGaA Abteilung Arzneimittelsicherheit Arnulfstr München Tel: Fax: medwiss.info@bms.com Website: Wenn Sie weitere Informationen über die Verwendung von YERVOY benötigen, wenden Sie sich an die Abteilung Medical Information von Bristol-Myers Squibb unter der Telefonnummer: , medwiss.info@bms.com. Bristol-Myers Squibb, 09/2017. Version DE
YERVOY (ipilimumab) Dieses Arzneimittel unterliegt einer zusëtzlichen Überwachung. Patiëntenfolder
 Die De Europese Europäischen gezondheidsautoriteiten Gesundheitsbehörden hebben haben bepaalde an voorwaarden die Zulassung verbonden des Arzneimittels aan het in de handel YERVOY brengen bestimmte van
Die De Europese Europäischen gezondheidsautoriteiten Gesundheitsbehörden hebben haben bepaalde an voorwaarden die Zulassung verbonden des Arzneimittels aan het in de handel YERVOY brengen bestimmte van
OPDIVO 10 mg/ml Konzentrat zur Herstellung einer Infusionslösung 2. Qualitative und quantitative Zusammensetzung
 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
Gebrauchsinformation: Information für Patienten. Desloratadin Genericon 5 mg Filmtabletten. Wirkstoff: Desloratadin
 Gebrauchsinformation: Information für Patienten Desloratadin Genericon 5 mg Filmtabletten Wirkstoff: Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Gebrauchsinformation: Information für Patienten Desloratadin Genericon 5 mg Filmtabletten Wirkstoff: Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Hepatyrix Injektionssuspension Hepatitis-A-(inaktiviert) und Typhus-Polysaccharid-Impfstoff (adsorbiert) ab dem vollendeten 15.
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER 22.07.2009 Hepatyrix Injektionssuspension Hepatitis-A-(inaktiviert) und Typhus-Polysaccharid-Impfstoff (adsorbiert) ab dem vollendeten 15. Lebensjahr
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER 22.07.2009 Hepatyrix Injektionssuspension Hepatitis-A-(inaktiviert) und Typhus-Polysaccharid-Impfstoff (adsorbiert) ab dem vollendeten 15. Lebensjahr
Grad 3 Nephritis mit 3-facher Erhöhung von Serumkreatinin über dem oberen Normwert (ULN) Typ-1-Diabetes assoziiert mit einer Grad > 3 Hyperglykämie
 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. AERIUS 5 mg Filmtabletten Desloratadin
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN AERIUS 5 mg Filmtabletten Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN AERIUS 5 mg Filmtabletten Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. AERIUS 5 mg Schmelztabletten Desloratadin
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN AERIUS 5 mg Schmelztabletten Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN AERIUS 5 mg Schmelztabletten Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Patienteninformation zur Studie
 Patienteninformation zur Studie Rituximab-Gemcitabin/Oxaliplatin-Therapie bei indolenten Lymphomen Sehr geehrte Patientin! Sehr geehrter Patient! Sie wurden darüber aufgeklärt, dass Sie an einem niedrig
Patienteninformation zur Studie Rituximab-Gemcitabin/Oxaliplatin-Therapie bei indolenten Lymphomen Sehr geehrte Patientin! Sehr geehrter Patient! Sie wurden darüber aufgeklärt, dass Sie an einem niedrig
WICHTIGE INFORMATIONEN ÜBER CYPROTERONACETAT- UND ETHINYLESTRADIOL-HALTIGE KOMBINATIONSPRÄPARATE UND DAS RISIKO FÜR BLUTGERINNSEL
 Patienteninformationskarte, DE Version: 29.06.2014 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Sie
Patienteninformationskarte, DE Version: 29.06.2014 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Sie
Keytruda. Zusammensetzung. Galenische Form und Wirkstoffmenge pro Einheit. Indikationen/Anwendungsmöglichkeiten. Dosierung/Anwendung
 Keytruda MSD Merck Sharp & Dohme AG Zusammensetzung Wirkstoff: Pembrolizumab (humanisierter monoklonaler anti-programmed cell Death-1 (PD-1) Antikörper (IgG4/kappa Isotyp mit einer stabilisierenden Sequenzveränderung
Keytruda MSD Merck Sharp & Dohme AG Zusammensetzung Wirkstoff: Pembrolizumab (humanisierter monoklonaler anti-programmed cell Death-1 (PD-1) Antikörper (IgG4/kappa Isotyp mit einer stabilisierenden Sequenzveränderung
1. WAS IST DAFALGAN Zäpfchen UND WOFÜR WIRD ES ANGEWENDET?
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DAFALGAN Säuglinge 80 mg Zäpfchen DAFALGAN Kleinkinder 150 mg Zäpfchen DAFALGAN große Kinder 300 mg Zäpfchen Paracetamol Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DAFALGAN Säuglinge 80 mg Zäpfchen DAFALGAN Kleinkinder 150 mg Zäpfchen DAFALGAN große Kinder 300 mg Zäpfchen Paracetamol Lesen Sie die gesamte Packungsbeilage
EINVERSTÄNDISERKLÄRUNG ZUR SCHUTZIMPFUNG
 EINVERSTÄNDISERKLÄRUNG ZUR SCHUTZIMPFUNG Nimenrix - Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Meningokokken-Gruppen A, C, W-135 und Y-Konjugatimpfstoff BITTE
EINVERSTÄNDISERKLÄRUNG ZUR SCHUTZIMPFUNG Nimenrix - Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Meningokokken-Gruppen A, C, W-135 und Y-Konjugatimpfstoff BITTE
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. KEYTRUDA 50 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung Pembrolizumab
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN KEYTRUDA 50 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung Pembrolizumab Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung.
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN KEYTRUDA 50 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung Pembrolizumab Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung.
Patientenaufklärung. Patientenname:... Vorname:... Geburtsdatum:... Diagnose:... Das Aufklärungsgespräch erfolgte am:... durch:...
 Patientenaufklärung Patientenname:... Vorname:... Geburtsdatum:... Diagnose:... Das Aufklärungsgespräch erfolgte am:... durch:... Art der Erkrankung, Ziel der Chemotherapie und Zweck der Studie Sehr geehrte
Patientenaufklärung Patientenname:... Vorname:... Geburtsdatum:... Diagnose:... Das Aufklärungsgespräch erfolgte am:... durch:... Art der Erkrankung, Ziel der Chemotherapie und Zweck der Studie Sehr geehrte
Wie unsere Augen Erfahren Sie, wie wir sehen, und wie Sie Ihre Vision zu schützen.
 Wie unsere Augen Erfahren Sie, wie wir sehen, und wie Sie Ihre Vision zu schützen. Levobunolol ist ein Beta-Blocker, der den Druck im Inneren des Auges reduziert. Levobunolol Augen (Auge) ist für die Behandlung
Wie unsere Augen Erfahren Sie, wie wir sehen, und wie Sie Ihre Vision zu schützen. Levobunolol ist ein Beta-Blocker, der den Druck im Inneren des Auges reduziert. Levobunolol Augen (Auge) ist für die Behandlung
AUFKLÄRUNGSBLATT* ZUR IMPFUNG GEGEN DIE FSME (Frühsommer-Meningoenzephalitis) *(Auszug aus den jeweiligen Packungsinformationen)
 AUFKLÄRUNGSBLATT* ZUR IMPFUNG GEGEN DIE FSME (Frühsommer-Meningoenzephalitis) *(Auszug aus den jeweiligen Packungsinformationen) Lesen Sie die gesamte Information sorgfältig durch, bevor Sie sich bzw.
AUFKLÄRUNGSBLATT* ZUR IMPFUNG GEGEN DIE FSME (Frühsommer-Meningoenzephalitis) *(Auszug aus den jeweiligen Packungsinformationen) Lesen Sie die gesamte Information sorgfältig durch, bevor Sie sich bzw.
XGEVA 120 mg (Denosumab)
 München, 03.09.2014 XGEVA 120 mg (Denosumab) Wichtige aktualisierte Informationen für Angehörige der medizinischen Heilberufe, um die Risiken für das Auftreten von n und n zu minimieren. Sehr geehrte Frau
München, 03.09.2014 XGEVA 120 mg (Denosumab) Wichtige aktualisierte Informationen für Angehörige der medizinischen Heilberufe, um die Risiken für das Auftreten von n und n zu minimieren. Sehr geehrte Frau
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit.
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit.
KEYTRUDA 50 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
Ärzte sollten bei allen Patienten, vor einem Behandlungsbeginn mit Prolia, mögliche Risikofaktoren für Kieferosteonekrosen evaluieren.
 München, 03.09.2014 Prolia 60 mg (Denosumab) Wichtige aktualisierte Informationen für Angehörige der medizinischen Heilberufe, um die Risiken für das Auftreten von Kieferosteonekrosen und n zu minimieren.
München, 03.09.2014 Prolia 60 mg (Denosumab) Wichtige aktualisierte Informationen für Angehörige der medizinischen Heilberufe, um die Risiken für das Auftreten von Kieferosteonekrosen und n zu minimieren.
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Legalon SIL - Trockensubstanz zur Infusionsbereitung
 PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
Patienteninformation und Einwilligungserklärung
 Patienteninformation und Einwilligungserklärung Wirksamkeit und Sicherheit von 90Y-Ibritumomab Tiuxetan bei Patienten mit rezidiviertem oder refraktärem Mantelzell-Lymphom nach autologer Stamzelltransplantation
Patienteninformation und Einwilligungserklärung Wirksamkeit und Sicherheit von 90Y-Ibritumomab Tiuxetan bei Patienten mit rezidiviertem oder refraktärem Mantelzell-Lymphom nach autologer Stamzelltransplantation
Boehringer Ingelheim RCV GmbH & Co KG 06.10.2010 / Mac GI Mucosolvan 15 mg - Lutschpastillen Version 2.0 C 1 PACKUNGSBEILAGE
 Mucosolvan 15 mg - Lutschpastillen Version 2.0 C 1 PACKUNGSBEILAGE Mucosolvan 15 mg - Lutschpastillen Version 2.0 C 2 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Mucosolvan 15 mg - Lutschpastillen
Mucosolvan 15 mg - Lutschpastillen Version 2.0 C 1 PACKUNGSBEILAGE Mucosolvan 15 mg - Lutschpastillen Version 2.0 C 2 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Mucosolvan 15 mg - Lutschpastillen
Gebrauchsinformation: Information für Patienten
 Gebrauchsinformation: Information für Patienten Esberitox -Tabletten Trockenextrakt aus einer Mischung von Lebensbaumspitzen und -blättern, Purpursonnenhutwurzel, Blassfarbener Sonnenhutwurzel und Färberhülsenwurzel
Gebrauchsinformation: Information für Patienten Esberitox -Tabletten Trockenextrakt aus einer Mischung von Lebensbaumspitzen und -blättern, Purpursonnenhutwurzel, Blassfarbener Sonnenhutwurzel und Färberhülsenwurzel
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER SINUTAB 500/30 mg Tabletten SINUTAB FORTE 500/60 mg Tabletten Paracetamol und Pseudoephedrinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER SINUTAB 500/30 mg Tabletten SINUTAB FORTE 500/60 mg Tabletten Paracetamol und Pseudoephedrinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig
Packungsbeilage 1/7. Gebrauchsinformation: Information fûr den Anwender
 Packungsbeilage 1/7 Gebrauchsinformation: Information fûr den Anwender Cefuroxim Sandoz 250 mg überzogene Tabletten Cefuroxim Sandoz 500 mg überzogene Tabletten Cefuroxim Lesen Sie die gesamte Packungsbeilage
Packungsbeilage 1/7 Gebrauchsinformation: Information fûr den Anwender Cefuroxim Sandoz 250 mg überzogene Tabletten Cefuroxim Sandoz 500 mg überzogene Tabletten Cefuroxim Lesen Sie die gesamte Packungsbeilage
Hirnödeme bei HAE was Patienten wissen sollten
 Hirnödeme bei HAE was Patienten wissen sollten Dieser immer stärker werdende Druck... Starke Kopfschmerzen? Bei HAE kann auch ein Hirnödem die Ursache sein. 2 Ein kaum beachteter Zusammenhang Verspannungen,
Hirnödeme bei HAE was Patienten wissen sollten Dieser immer stärker werdende Druck... Starke Kopfschmerzen? Bei HAE kann auch ein Hirnödem die Ursache sein. 2 Ein kaum beachteter Zusammenhang Verspannungen,
Malignes Melanom. Aktuelles vom amerikanischen Krebskongress 2013
 Malignes Melanom Aktuelles vom amerikanischen Krebskongress 2013 Peter Kurschat Klinik für Dermatologie und Venerologie Centrum für Integrierte Onkologie CIO Mittwoch, 26.06.2013, Köln Wo standen wir vor
Malignes Melanom Aktuelles vom amerikanischen Krebskongress 2013 Peter Kurschat Klinik für Dermatologie und Venerologie Centrum für Integrierte Onkologie CIO Mittwoch, 26.06.2013, Köln Wo standen wir vor
Ärztlich kontrollierte Heimselbsttherapie auch bei Kindern bewährt
 319697 (2) April 12 Ärztlich kontrollierte Heimselbsttherapie auch bei Kindern bewährt Die Heimselbstbehandlung des HAE wird von Experten empfohlen. Es gibt aber ein paar Dinge, die Sie beachten sollten.
319697 (2) April 12 Ärztlich kontrollierte Heimselbsttherapie auch bei Kindern bewährt Die Heimselbstbehandlung des HAE wird von Experten empfohlen. Es gibt aber ein paar Dinge, die Sie beachten sollten.
Behandlung des Makulaödems bei Uveitis durch operative Medikamenteneingabe in das Auge
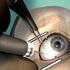 Patientendaten Behandlung des Makulaödems bei Uveitis durch operative Medikamenteneingabe in das Auge Aufklärung und Einverständniserklärung Sehr geehrte Patientin, sehr geehrter Patient, bei Ihnen ist
Patientendaten Behandlung des Makulaödems bei Uveitis durch operative Medikamenteneingabe in das Auge Aufklärung und Einverständniserklärung Sehr geehrte Patientin, sehr geehrter Patient, bei Ihnen ist
Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva
 Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva Darmstadt (19. Februar 2009) Die Merck KGaA hat heute bekannt gegeben, dass die europäische Arzneimittelbehörde EMEA
Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva Darmstadt (19. Februar 2009) Die Merck KGaA hat heute bekannt gegeben, dass die europäische Arzneimittelbehörde EMEA
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Magnevist 2 mmol/l Injektionslösung. Gadopentetsäure, Dimeglumin
 1 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Magnevist 2 mmol/l Injektionslösung Gadopentetsäure, Dimeglumin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor dieses Arzneimittel bei
1 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Magnevist 2 mmol/l Injektionslösung Gadopentetsäure, Dimeglumin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor dieses Arzneimittel bei
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. DELPHI 0,1% creme Triamcinolonacetonid
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DELPHI 0,1% creme Triamcinolonacetonid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DELPHI 0,1% creme Triamcinolonacetonid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses
Anhang I WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG ZUR ÄNDERUNG DER BEDINGUNGEN DER GENEHMIGUNGEN FÜR DAS INVERKEHRBRINGEN
 Anhang I WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG ZUR ÄNDERUNG DER BEDINGUNGEN DER GENEHMIGUNGEN FÜR DAS INVERKEHRBRINGEN Wissenschaftliche Schlussfolgerungen Der CHMP ist unter Berücksichtigung
Anhang I WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG ZUR ÄNDERUNG DER BEDINGUNGEN DER GENEHMIGUNGEN FÜR DAS INVERKEHRBRINGEN Wissenschaftliche Schlussfolgerungen Der CHMP ist unter Berücksichtigung
Gebrauchsinformation: Information für Anwender. Prednifluid 10 mg/ml Augentropfensuspension Prednisolonacetat
 Gebrauchsinformation: Information für Anwender Prednifluid 10 mg/ml Augentropfensuspension Prednisolonacetat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Anwender Prednifluid 10 mg/ml Augentropfensuspension Prednisolonacetat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Der HER2-Rezeptor & seine therapeutischen Ansprechpartner beim HER2-pos. Mammakarzinom
 Der HER2-Rezeptor & seine therapeutischen Ansprechpartner beim HER2-pos. Mammakarzinom Her2/neu (human epidermal growth factor receptor 2, erb-b2, c-erbb2) Der HER2-Rezeptor gehört zur Familie der epidermalen
Der HER2-Rezeptor & seine therapeutischen Ansprechpartner beim HER2-pos. Mammakarzinom Her2/neu (human epidermal growth factor receptor 2, erb-b2, c-erbb2) Der HER2-Rezeptor gehört zur Familie der epidermalen
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Tebofortan 40 mg - Filmtabletten. Wirkstoff: Trockenextrakt aus Ginkgo-biloba-Blättern
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tebofortan 40 mg - Filmtabletten Wirkstoff: Trockenextrakt aus Ginkgo-biloba-Blättern Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tebofortan 40 mg - Filmtabletten Wirkstoff: Trockenextrakt aus Ginkgo-biloba-Blättern Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Boehringer Ingelheim RCV GmbH & Co KG Mucosolvan 15 mg / 5 ml - Saft GI 1. 24.01.2014 / DrMü Version 4.2 C PACKUNGSBEILAGE
 1 PACKUNGSBEILAGE 2 Gebrauchsinformation: Information für Anwender Mucosolvan 15 mg / 5 ml - Saft für Kinder Wirkstoff: Ambroxolhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor
1 PACKUNGSBEILAGE 2 Gebrauchsinformation: Information für Anwender Mucosolvan 15 mg / 5 ml - Saft für Kinder Wirkstoff: Ambroxolhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Postinor 750 Mikrogramm Tabletten Levonorgestrel
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Postinor 750 Mikrogramm Tabletten Levonorgestrel Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Postinor 750 Mikrogramm Tabletten Levonorgestrel Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
Gebrauchsinformation: Information für den Anwender
 Wortlaut der für die Gebrauchsinformation vorgesehenen Angaben Stand: Mai 2008 1 Gebrauchsinformation: Information für den Anwender Harntee-Steiner, Teeaufgusspulver Zur Anwendung bei Heranwachsenden ab
Wortlaut der für die Gebrauchsinformation vorgesehenen Angaben Stand: Mai 2008 1 Gebrauchsinformation: Information für den Anwender Harntee-Steiner, Teeaufgusspulver Zur Anwendung bei Heranwachsenden ab
GEBRAUCHSINFORMATION. Wirkstoff: Acetylsalicylsäure. Z.Nr.: 3155
 Liebe Patientin, lieber Patient! Bitte lesen Sie diese Gebrauchsinformation aufmerksam, weil sie wichtige Informationen darüber enthält, was Sie bei der Einnahme dieses Arzneimittels beachten sollen. Wenden
Liebe Patientin, lieber Patient! Bitte lesen Sie diese Gebrauchsinformation aufmerksam, weil sie wichtige Informationen darüber enthält, was Sie bei der Einnahme dieses Arzneimittels beachten sollen. Wenden
Was ist AURORIX und wofür wird es angewendet? Was müssen Sie vor der Einnahme von AURORIX beachten?
 Was ist AURORIX und wofür wird es angewendet? AURORIX ist ein Arzneimittel zur Behandlung von Depressionen und bestimmten Angstzuständen (Sozialphobie). Moclobemid, der Wirkstoff von AURORIX, wirkt antriebssteigernd
Was ist AURORIX und wofür wird es angewendet? AURORIX ist ein Arzneimittel zur Behandlung von Depressionen und bestimmten Angstzuständen (Sozialphobie). Moclobemid, der Wirkstoff von AURORIX, wirkt antriebssteigernd
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Clarityn 10 mg - Brausetabletten Wirkstoff: Loratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Clarityn 10 mg - Brausetabletten Wirkstoff: Loratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen
PACKUNGSBEILAGE. Bisolvon Hustenlöser - Saft Version 4.1 1
 PACKUNGSBEILAGE Bisolvon Hustenlöser - Saft Version 4.1 1 Gebrauchsinformation: Information für Patienten Bisolvon Hustenlöser - Saft Wirkstoff: Bromhexinhydrochlorid Lesen Sie die gesamte Packungsbeilage
PACKUNGSBEILAGE Bisolvon Hustenlöser - Saft Version 4.1 1 Gebrauchsinformation: Information für Patienten Bisolvon Hustenlöser - Saft Wirkstoff: Bromhexinhydrochlorid Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Anwender. Cyprostol - Tabletten Wirkstoff: Misoprostol
 1 Gebrauchsinformation: Information für Anwender Cyprostol - Tabletten Wirkstoff: Misoprostol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
1 Gebrauchsinformation: Information für Anwender Cyprostol - Tabletten Wirkstoff: Misoprostol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Anwender. Delphi 0,1 % Creme Triamcinolonacetonid
 Gebrauchsinformation: Information für Anwender Delphi 0,1 % Creme Triamcinolonacetonid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Anwender Delphi 0,1 % Creme Triamcinolonacetonid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
Sehr geehrte Patientin! Sehr geehrter Patient!
 Univ. Klinik f. Innere Medizin LKH Graz Klinische Abteilung für Rheumatologie und Immunologie Univ. Prof. Dr. W. Graninger Auenbruggerplatz 15, A-8036 Graz Tel 0 316-385-12645 PATIENTENAUFKLÄRUNG ZUR THERAPIE
Univ. Klinik f. Innere Medizin LKH Graz Klinische Abteilung für Rheumatologie und Immunologie Univ. Prof. Dr. W. Graninger Auenbruggerplatz 15, A-8036 Graz Tel 0 316-385-12645 PATIENTENAUFKLÄRUNG ZUR THERAPIE
Gebrauchsinformation: Information für Patienten. Aerius 5 mg Filmtabletten Desloratadin
 Gebrauchsinformation: Information für Patienten Aerius 5 mg Filmtabletten Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Patienten Aerius 5 mg Filmtabletten Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. ALLEGRATAB 120 mg Filmtabletten Fexofenadinhydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER ALLEGRATAB 120 mg Filmtabletten Fexofenadinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER ALLEGRATAB 120 mg Filmtabletten Fexofenadinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen
Wird Ihr Leben von schwerem Asthma beherrscht? Ein Patienten-Leitfaden zur bronchialen Thermoplastie
 Wird Ihr Leben von schwerem Asthma beherrscht? Ein Patienten-Leitfaden zur bronchialen Thermoplastie Wird Ihr Leben von schwerem Asthma beherrscht? Es gibt ein neues innovatives Verfahren, das eine Lebensveränderung
Wird Ihr Leben von schwerem Asthma beherrscht? Ein Patienten-Leitfaden zur bronchialen Thermoplastie Wird Ihr Leben von schwerem Asthma beherrscht? Es gibt ein neues innovatives Verfahren, das eine Lebensveränderung
Österreichische Selbsthilfegruppe
 www.hae-austria.at Österreichische Selbsthilfegruppe für das Hereditäre Angioödem 1 Vorwort HAE ist gekennzeichnet durch ein wiederholtes Auftreten von zum Teil schmerzhaften Schwellungen (Ödem=Wasseransammlung)
www.hae-austria.at Österreichische Selbsthilfegruppe für das Hereditäre Angioödem 1 Vorwort HAE ist gekennzeichnet durch ein wiederholtes Auftreten von zum Teil schmerzhaften Schwellungen (Ödem=Wasseransammlung)
Immunsuppressive Therapie nach Lebertransplantation. Familientag 23.08.2015 Bianca Hegen
 Immunsuppressive Therapie nach Lebertransplantation Familientag 23.08.2015 Bianca Hegen Überblick Was passiert nach der Transplantation? Wie funktioniert das Immunsystem? Wie wird einer Abstoßung vorgebeugt?
Immunsuppressive Therapie nach Lebertransplantation Familientag 23.08.2015 Bianca Hegen Überblick Was passiert nach der Transplantation? Wie funktioniert das Immunsystem? Wie wird einer Abstoßung vorgebeugt?
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Meningitec-Injektionssuspension in Fertigspritze Konjugierter Oligosaccharid-Impfstoff gegen Meningokokken der Serogruppe C (adsorbiert) Lesen Sie die gesamte
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Meningitec-Injektionssuspension in Fertigspritze Konjugierter Oligosaccharid-Impfstoff gegen Meningokokken der Serogruppe C (adsorbiert) Lesen Sie die gesamte
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. PROGESTOGEL 1 % Gel. Progesteron
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER PROGESTOGEL 1 % Gel Progesteron Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER PROGESTOGEL 1 % Gel Progesteron Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Leuproreline Sandoz 3,6 mg Implantat. Leuprorelin
 PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Leuproreline Sandoz 3,6 mg Implantat Leuprorelin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Leuproreline Sandoz 3,6 mg Implantat Leuprorelin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Herzlich Willkommen in unserer Praxis!
 Herzlich Willkommen in unserer Praxis! Bevor wir uns in Ruhe über Ihre zahnmedizinischen Wünsche und Sorgen unterhalten, benötigen wir einige persönliche Angaben, um Ihnen eine problemlose und risikofreie
Herzlich Willkommen in unserer Praxis! Bevor wir uns in Ruhe über Ihre zahnmedizinischen Wünsche und Sorgen unterhalten, benötigen wir einige persönliche Angaben, um Ihnen eine problemlose und risikofreie
Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. NIX Creme Rinse, 10 mg/g lotion Permethrin
 BD Pagina: 1/5 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER NIX Creme Rinse, 10 mg/g lotion Permethrin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen
BD Pagina: 1/5 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER NIX Creme Rinse, 10 mg/g lotion Permethrin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen
Nebenwirkungen neuartiger Anti-Tumortherapien
 XVII. Onkologische Fachtagung für medizinische Berufe Berlin, 05.06.2014 Nebenwirkungen neuartiger Anti-Tumortherapien Dr. Christian Jakob Klinikum Ernst v. Bergmann Klinik für Hämatologie/Onkologie Charlottenstr.
XVII. Onkologische Fachtagung für medizinische Berufe Berlin, 05.06.2014 Nebenwirkungen neuartiger Anti-Tumortherapien Dr. Christian Jakob Klinikum Ernst v. Bergmann Klinik für Hämatologie/Onkologie Charlottenstr.
Patientenaufklärung und Einverständniserklärung zur intravitrealen Injektion nach retinalen Venenverschlüssen (RVV)
 Patientendaten Arzt-/Klinikstempel Patientenaufklärung und Einverständniserklärung zur intravitrealen Injektion nach retinalen Venenverschlüssen (RVV) Beim Makulaödem infolge eines retinalen Venenverschlusses
Patientendaten Arzt-/Klinikstempel Patientenaufklärung und Einverständniserklärung zur intravitrealen Injektion nach retinalen Venenverschlüssen (RVV) Beim Makulaödem infolge eines retinalen Venenverschlusses
Gebrauchsinformation: Information für Anwender Desloratadin Sandoz 5 mg Filmtabletten Desloratadin
 Gebrauchsinformation: Information für Anwender Desloratadin Sandoz 5 mg Filmtabletten Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
Gebrauchsinformation: Information für Anwender Desloratadin Sandoz 5 mg Filmtabletten Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
INFORMATIONSBROSCHÜRE FÜR PATIENTEN/BEZUGSPERSONEN. Bitte lies die Packungsbeilage vor der Anwendung des Arzneimittels ABILIFY sorgfältig durch.
 Die Europäischen Gesundheitsbehörden haben die Vermarktung des Arzneimittels ABILIFY an bestimmte Bedingungen geknüpft. Die vorliegenden Informationen sind Teil des obligatorischen Risikomanagementplans
Die Europäischen Gesundheitsbehörden haben die Vermarktung des Arzneimittels ABILIFY an bestimmte Bedingungen geknüpft. Die vorliegenden Informationen sind Teil des obligatorischen Risikomanagementplans
IMPLANON NXT Erläuternde Broschüre für Patientinnen
 Die Markteinführung von IMPLANON NXT wurde von den belgischen Gesundheitsbehörden an bestimmte Bedingungen geknüpft. Der vorgeschriebene Plan zur Risikominimierung in Belgien, der auch das vorliegende
Die Markteinführung von IMPLANON NXT wurde von den belgischen Gesundheitsbehörden an bestimmte Bedingungen geknüpft. Der vorgeschriebene Plan zur Risikominimierung in Belgien, der auch das vorliegende
MabThera wird bei Erwachsenen zur Behandlung folgender Erkrankungen angewendet:
 EMA/614203/2010 EMEA/H/C/000165 Zusammenfassung des EPAR für die Öffentlichkeit Rituximab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. in dem erläutert wird,
EMA/614203/2010 EMEA/H/C/000165 Zusammenfassung des EPAR für die Öffentlichkeit Rituximab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. in dem erläutert wird,
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Wirkstoff: Pilocarpinhydrochlorid (5 mg/ml)
 Spersacarpin 0,5% (5 mg/ml) Augentropfen Wirkstoff: Pilocarpinhydrochlorid (5 mg/ml) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. -
Spersacarpin 0,5% (5 mg/ml) Augentropfen Wirkstoff: Pilocarpinhydrochlorid (5 mg/ml) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. -
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER ISOPTO CARPINE 1% Augentropfen ISOPTO CARPINE 2% Augentropfen ISOPTO CARPINE 3% Augentropfen ISOPTO CARPINE 4% Augentropfen Pilocarpinhydrochlorid Lesen
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER ISOPTO CARPINE 1% Augentropfen ISOPTO CARPINE 2% Augentropfen ISOPTO CARPINE 3% Augentropfen ISOPTO CARPINE 4% Augentropfen Pilocarpinhydrochlorid Lesen
Avastin wird zur Behandlung von Erwachsenen mit den folgenden Krebsarten in Kombination mit anderen Arzneimitteln gegen Krebs angewendet:
 EMA/175824/2015 EMEA/H/C/000582 Zusammenfassung des EPAR für die Öffentlichkeit Bevacizumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
EMA/175824/2015 EMEA/H/C/000582 Zusammenfassung des EPAR für die Öffentlichkeit Bevacizumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Revlimid 25 mg Hartkapseln. Revlimid 10 mg Hartkapseln. Lenalidomid
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Revlimid 5 mg Hartkapseln Revlimid 10 mg Hartkapseln Revlimid 15 mg Hartkapseln Revlimid 25 mg Hartkapseln Lenalidomid Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Revlimid 5 mg Hartkapseln Revlimid 10 mg Hartkapseln Revlimid 15 mg Hartkapseln Revlimid 25 mg Hartkapseln Lenalidomid Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Patienten. Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench)
 Gebrauchsinformation: Information für Patienten Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Gebrauchsinformation: Information für Patienten Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Definition des akuten Leberversagens
 Definition des akuten Leberversagens Plötzlicher Beginn eines Leberversagens bei einem Patienten ohne Hinweis für eine chronische Lebererkrankung Ursachen des akuten Leberversagens virale Hepatitis A,
Definition des akuten Leberversagens Plötzlicher Beginn eines Leberversagens bei einem Patienten ohne Hinweis für eine chronische Lebererkrankung Ursachen des akuten Leberversagens virale Hepatitis A,
Größenvergleich zwischen verschiedenen Wirkstoffen
 Acetylsalicylsäure (ASS) Insulin monoklonaler Antikörper (Abbildung: vfa) 21 Atome 788 Atome ca. 20.000 Atome Größenvergleich zwischen verschiedenen Wirkstoffen Wichtige gentechnisch hergestellte Biopharmazeutika
Acetylsalicylsäure (ASS) Insulin monoklonaler Antikörper (Abbildung: vfa) 21 Atome 788 Atome ca. 20.000 Atome Größenvergleich zwischen verschiedenen Wirkstoffen Wichtige gentechnisch hergestellte Biopharmazeutika
ANWEISUNGSKARTE FÜR DEN PATIENTEN
 Der Plan zur Risikobegrenzung in Belgien, zu dem diese Information gehört, ist eine Maßnahme, die ergriffen wurde, um eine sichere und wirksame Anwendung fon ZypAdhera TM zu garantieren. (RMA modifizierte
Der Plan zur Risikobegrenzung in Belgien, zu dem diese Information gehört, ist eine Maßnahme, die ergriffen wurde, um eine sichere und wirksame Anwendung fon ZypAdhera TM zu garantieren. (RMA modifizierte
Gebrauchsinformation: Information für Anwender. Cevitol 500 mg-kautabletten Wirkstoff: Ascorbinsäure (Vitamin C)
 Gebrauchsinformation: Information für Anwender Cevitol 500 mg-kautabletten Wirkstoff: Ascorbinsäure (Vitamin C) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Gebrauchsinformation: Information für Anwender Cevitol 500 mg-kautabletten Wirkstoff: Ascorbinsäure (Vitamin C) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Patienteninformation zur Chemotherapie
 SLK-Kliniken Heilbronn GmbH, Klinikum Am Gesundbrunnen, Heilbronn Urologische Klinik Ärztlicher Direktor Prof. Dr. med. J. Rassweiler Am Gesundbrunnen 74064 Heilbronn Direktwahl (07131) 49-2401 Ambulanz
SLK-Kliniken Heilbronn GmbH, Klinikum Am Gesundbrunnen, Heilbronn Urologische Klinik Ärztlicher Direktor Prof. Dr. med. J. Rassweiler Am Gesundbrunnen 74064 Heilbronn Direktwahl (07131) 49-2401 Ambulanz
PHV-issue: Codein for the treatment of cough or cold in paediatric patients
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 27.05.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 27.05.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
Erkältung. Ein complexes Thema einfach erklärt. Trotz Erkältung voll im Leben.
 Erkältung Ein complexes Thema einfach erklärt Trotz Erkältung voll im Leben. Erkältung kaum einer entkommt ihr! Eine Erkältung ist weltweit die häufigste Erkrankung, von der Sahara bis nach Grönland. Würde
Erkältung Ein complexes Thema einfach erklärt Trotz Erkältung voll im Leben. Erkältung kaum einer entkommt ihr! Eine Erkältung ist weltweit die häufigste Erkrankung, von der Sahara bis nach Grönland. Würde
Naturheilkunde -Definition
 Dr. N. Sotoudeh Naturheilkunde -Definition Die Lehre von der Behandlung und Vorbeugung von Krankheiten unter Einsatz der natürlichen Umwelt entnommener und naturbelassener Heilmittel. Pschyrembel s Klinisches
Dr. N. Sotoudeh Naturheilkunde -Definition Die Lehre von der Behandlung und Vorbeugung von Krankheiten unter Einsatz der natürlichen Umwelt entnommener und naturbelassener Heilmittel. Pschyrembel s Klinisches
Tretinac. Wichtige Informationen für Patientinnen und Patienten
 Tretinac. Wichtige Informationen für Patientinnen und Patienten Diese Broschüre enthält wichtige Informationen über das Aknemedikament Tretinac. Falls Sie zusätzlich etwas wissen möchten, sprechen Sie
Tretinac. Wichtige Informationen für Patientinnen und Patienten Diese Broschüre enthält wichtige Informationen über das Aknemedikament Tretinac. Falls Sie zusätzlich etwas wissen möchten, sprechen Sie
EINVERSTÄNDISERKLÄRUNG ZUR SCHUTZIMPFUNG
 EINVERSTÄNDISERKLÄRUNG ZUR SCHUTZIMPFUNG FSME-IMMUN 0,25 ml Junior Injektionssuspension in einer Fertigspritze Frühsommer-Meningoenzephalitis (FSME) Impfstoff (Ganzvirus, inaktiviert) Wirkstoff: FSME-Virus-Antigen
EINVERSTÄNDISERKLÄRUNG ZUR SCHUTZIMPFUNG FSME-IMMUN 0,25 ml Junior Injektionssuspension in einer Fertigspritze Frühsommer-Meningoenzephalitis (FSME) Impfstoff (Ganzvirus, inaktiviert) Wirkstoff: FSME-Virus-Antigen
Wirkstoff: Der arzneilich wirksame Bestandteil ist Ibuprofen (vorliegend als Ibuprofen DL-Lysinsalz).
 Gebrauchsinformation Lesen Sie die gesamte Packungsbeilage (Gebrauchsinformation) sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel ist auch ohne ärztliche Verschreibung
Gebrauchsinformation Lesen Sie die gesamte Packungsbeilage (Gebrauchsinformation) sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel ist auch ohne ärztliche Verschreibung
1. Was sind Dorithricin Halstabletten und wofür werden sie angewendet?
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Dorithricin - Halstabletten Wirkstoffe: Tyrothricin, Benzalkoniumchlorid, Benzocain Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Dorithricin - Halstabletten Wirkstoffe: Tyrothricin, Benzalkoniumchlorid, Benzocain Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
1) Warum sollten Sie die Bindehautentzündung grundsätzlich vom Arzt behandeln lassen? 4. 2) Was ist eine Bindehautentzündung? 5
 1) Warum sollten Sie die Bindehautentzündung grundsätzlich vom Arzt behandeln lassen? 4 2) Was ist eine Bindehautentzündung? 5 3) Durch welche Symptome kann sich eine Bindehautentzündung bemerkbar machen?
1) Warum sollten Sie die Bindehautentzündung grundsätzlich vom Arzt behandeln lassen? 4 2) Was ist eine Bindehautentzündung? 5 3) Durch welche Symptome kann sich eine Bindehautentzündung bemerkbar machen?
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Androfin 5 mg - Filmtabletten Wirkstoff: Finasterid
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Androfin 5 mg - Filmtabletten Wirkstoff: Finasterid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Androfin 5 mg - Filmtabletten Wirkstoff: Finasterid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
Pseudotumor cerebri. Anatomie: Das Gehirn und das Rückenmark schwimmen in einer klaren Flüssigkeit, die als Liquor cerebrospinalis bezeichnet wird.
 Pseudotumor cerebri Ihr Arzt oder Ihre Ärztin vermutet bei Ihnen Pseudotumor cerebri. Es handelt sich dabei um eine Erkrankung, bei welcher erhöhter Druck innerhalb Ihres Kopfes (Hirndruck) zu Sehstörungen
Pseudotumor cerebri Ihr Arzt oder Ihre Ärztin vermutet bei Ihnen Pseudotumor cerebri. Es handelt sich dabei um eine Erkrankung, bei welcher erhöhter Druck innerhalb Ihres Kopfes (Hirndruck) zu Sehstörungen
Behandlung des Makulaödems bei retinalem Venenverschluss durch operative Medikamenteneingabe in das Auge
 Patientendaten Anlage 1c / Einverständniserklärung: Intravitreale Therapie des Makulaödems bei retinalen Venenverschlüssen Behandlung des Makulaödems bei retinalem Venenverschluss durch operative Medikamenteneingabe
Patientendaten Anlage 1c / Einverständniserklärung: Intravitreale Therapie des Makulaödems bei retinalen Venenverschlüssen Behandlung des Makulaödems bei retinalem Venenverschluss durch operative Medikamenteneingabe
Universitätsklinikum des Saarlandes
 Universitätsklinikum des Saarlandes Merkblatt zur Patienten/innenaufklärung Studientitel: Klinische Phase I/II Dosisfindungssstudie zur Ermittlung der maximal tolerierten Dosis (MTD) von rekombinantem
Universitätsklinikum des Saarlandes Merkblatt zur Patienten/innenaufklärung Studientitel: Klinische Phase I/II Dosisfindungssstudie zur Ermittlung der maximal tolerierten Dosis (MTD) von rekombinantem
B. PACKUNGSBEILAGE 46
 B. PACKUNGSBEILAGE 46 ALLGEMEINE RATSCHLÄGE GEBRAUCHSINFORMATION Bitte lesen Sie diese Gebrauchsinformation vor der Einnahme des Arzneimittels sorgfältig durch. Diese Gebrauchsinformation enthält eine
B. PACKUNGSBEILAGE 46 ALLGEMEINE RATSCHLÄGE GEBRAUCHSINFORMATION Bitte lesen Sie diese Gebrauchsinformation vor der Einnahme des Arzneimittels sorgfältig durch. Diese Gebrauchsinformation enthält eine
Informationen zur behandlung ihrer chronisch obstruktiven lungenerkrankung (copd)
 Informationen zur behandlung ihrer chronisch obstruktiven lungenerkrankung (copd) Ordinationsstempel Für Patienten, denen Daxas ärztlich verordnet wurde Nycomed Pharma GmbH, Technologiestr. 5, 1120 Wien
Informationen zur behandlung ihrer chronisch obstruktiven lungenerkrankung (copd) Ordinationsstempel Für Patienten, denen Daxas ärztlich verordnet wurde Nycomed Pharma GmbH, Technologiestr. 5, 1120 Wien
Patienteninformation
 AML 97 (OSHO-Protokoll #45) Rolle der allogenen Stammzelltransplantation (SCT) im Vergleich zu einer zweiten Konsolidierung auf das leukämiefreie Überleben (LFS) von Patienten über 60 Jahre in kompletter
AML 97 (OSHO-Protokoll #45) Rolle der allogenen Stammzelltransplantation (SCT) im Vergleich zu einer zweiten Konsolidierung auf das leukämiefreie Überleben (LFS) von Patienten über 60 Jahre in kompletter
Immunologie der Vaskulitis
 Querschnitt Immunologie-Infektiologie Montags 12.00 Uhr Hörsaalzentrum St. Joseph Immunologie der Vaskulitis Albrecht Bufe www.ruhr-uni-bochum.de/homeexpneu Ein Patient mit diesen Veränderungen kommt in
Querschnitt Immunologie-Infektiologie Montags 12.00 Uhr Hörsaalzentrum St. Joseph Immunologie der Vaskulitis Albrecht Bufe www.ruhr-uni-bochum.de/homeexpneu Ein Patient mit diesen Veränderungen kommt in
Checkliste für die Verordnung von Tocino
 Wirkstoff: Alitretinoin. Indikation: Zur Behandlung von Erwachsenen mit therapierefraktärem, schwerem chronischem Handekzem, die eine ausgebaute lokale Behandlung für mindestens 4 Wochen erhalten und nicht
Wirkstoff: Alitretinoin. Indikation: Zur Behandlung von Erwachsenen mit therapierefraktärem, schwerem chronischem Handekzem, die eine ausgebaute lokale Behandlung für mindestens 4 Wochen erhalten und nicht
Patientenaufklärung und Einverständniserklärung zur intravitrealen Injektion beim diabetischen Makulaödem
 Patientendaten Arzt-/Klinikstempel Patientenaufklärung und Einverständniserklärung zur intravitrealen Injektion beim diabetischen Makulaödem Das diabetische Makulaödem ist eine Verdickung der Netzhaut.
Patientendaten Arzt-/Klinikstempel Patientenaufklärung und Einverständniserklärung zur intravitrealen Injektion beim diabetischen Makulaödem Das diabetische Makulaödem ist eine Verdickung der Netzhaut.
Gebrauchsinformation: Information für Anwender. APOZEMA Bluthochdruck Crataegus complex Nr.10-Tropfen
 Gebrauchsinformation: Information für Anwender APOZEMA Bluthochdruck Crataegus complex Nr.10-Tropfen Wirkstoffe: Crataegus Dil. D4, Arnica Dil. D4, Aurum chloratum natronatum Dil. D5, Barium jodatum Dil.
Gebrauchsinformation: Information für Anwender APOZEMA Bluthochdruck Crataegus complex Nr.10-Tropfen Wirkstoffe: Crataegus Dil. D4, Arnica Dil. D4, Aurum chloratum natronatum Dil. D5, Barium jodatum Dil.
Biotechnologische Arzneimittel Von der Herstellung zur Anwendung
 Biotechnologische Arzneimittel Von der Herstellung zur Anwendung Abbildungen, Diagramme, Tabellen Acetylsalicylsäure Insulin monoklonaler Antikörper (ASS) 21 Atome 788 Atome ca. 20.000 Atome Größenvergleich
Biotechnologische Arzneimittel Von der Herstellung zur Anwendung Abbildungen, Diagramme, Tabellen Acetylsalicylsäure Insulin monoklonaler Antikörper (ASS) 21 Atome 788 Atome ca. 20.000 Atome Größenvergleich
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Anbinex 500 I.E. Trockensubstanz und Lösungsmittel zur Herstellung einer Injektionslösung Wirkstoff: Antithrombin vom Menschen Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Anwender Anbinex 500 I.E. Trockensubstanz und Lösungsmittel zur Herstellung einer Injektionslösung Wirkstoff: Antithrombin vom Menschen Lesen Sie die gesamte Packungsbeilage
Behandlung mit Biologika (Biologicals), Stand 01/2011
 Stadtspital Triemli Zürich Klinik für Rheumatologie Birmensdorferstrasse 497 8063 Zürich www.triemli.ch KD Dr. med. Marcel Weber Chefarzt PATIENTENINFORMATION Chefarztsekretariat 044 466 23 02 Fax 044
Stadtspital Triemli Zürich Klinik für Rheumatologie Birmensdorferstrasse 497 8063 Zürich www.triemli.ch KD Dr. med. Marcel Weber Chefarzt PATIENTENINFORMATION Chefarztsekretariat 044 466 23 02 Fax 044
