Abschnitt 4.2 sowie gastrointestinale, kardiovaskuläre unten cereebrovaskuläre Effekte unten).
|
|
|
- Helga Fiedler
- vor 8 Jahren
- Abrufe
Transkript
1 Diclobene rapid 50 mg-filmtabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Diclofenac-Kalium, 50 mg. Sonstiger Bestandteil mit bekannter Wirkung: Lactose Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt DARREICHUNGSFORM Filmtabletten. Rotbraune, runde, bikonvexe Filmtablette mit einem Durchmesser von 11,1 mm. 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete Zur symptomatischen Kurzzeitbehandlung folgender akuter Erkrankungen: Extraartikulärer Rheumatismus, posttraumatische und postoperative Entzündungs- und Schmerzzustände, auch in der Zahnheilkunde, primäre Dysmenorrhoe, Akutbehandlung bei Migräne mit oder ohne Aura. Diclobene rapid 50 mg Filmtabletten dürfen aufgrund des Diclofenac gehalts in jeder Tablette bei Kindern unter 16 Jahren nicht angewendet werden. 4.2 Dosierung und Art der Anwendung Dosierung Das Auftreten unerwünschter Wirkungen kann durch die Anwendung der niedrigsten effektiven Dosis über den kürzesten Zeitraum, der für die Erreichung der Beschwerdefreiheit notwendig ist, minimiert werden (siehe Abschnitt 4.4). Erwachsene und Jugendliche über 16 Jahre Die Initialdosis beträgt in der Regel mg täglich. In leichteren Fällen sind normalerweise mg/tag ausreichend. Die Tagesdosis sollte auf zwei bis drei Einzelgaben verteilt werden. Primäre Dysmenorrhoe: Die Dosis beträgt 50 bis 150 mg täglich verteilt auf zwei bis drei Einzelgaben. Die Dosis soll individuell angepasst werden. Anfangs soll eine geringere Dosis ( mg/tag) verabreicht und dann stufenweise im Verlauf der Folgezyklen gesteigert werden. Die Behandlung wird bei den ersten Symptomen begonnen und abhängig von der Stärke der Symptome einige Tage fortgeführt. Migräne: Die Behandlung eines Migräneanfalls soll mit den ersten Anzeichen eines bevorstehenden Anfalls in einer Dosierung von 50 mg begonnen werden. Tritt innerhalb von 2 Stunden nach Gabe der ersten Dosis keine Besserung ein, kann eine weitere Dosis von 50 mg verabreicht werden. Falls erforderlich, können zusätzliche Dosen von 50 mg in Abständen von 4 bis 6 Stunden gegeben werden; eine maximale Tagesdosis von 200 mg soll dabei nicht überschritten werden. Kinder und Jugendliche Diclobene rapid 50 mg Filmtabletten dürfen aufgrund des Diclofenac Gehalts in jeder Tablette bei Kindern und Jugendlichen unter 16 Jahren nicht angewendet werden. Art der Anwendung Zur oralen Anwendung. Die Tabletten sollen mit etwas Flüssigkeit vorzugsweise vor einer Mahlzeit eingenommen werden. 4.3 Gegenanzeigen Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile aktiver Magen- oder Darmulkus, Blutung oder Perforation ulzerative Duodenalentzündung gastrointestinale Blutung oder Perforation in der Anamnese, bedingt durch vorangegangene NSAR- Therapie aktive peptische Ulzera oder Blutungen bzw. wiederkehrende peptische Ulzera oder Blutungen (zwei o- der mehr Episoden nachgewiesener Ulzeration oder Blutung) letztes Trimester der Schwangerschaft (siehe Abschnitt 4.6) schwere Leber- oder Niereninsuffizienz (siehe Abschnitt 4.4) bestehende dekompensierte Herzinsuffizienz (NYHA II-IV), ischämische Herzerkrankung, periphere arterielle Erkrankung und/oder cerebrovaskuläre Erkrankung Porphyrie, hämatopoetische Störungen und Diathese wie andere nicht-steroidale entzündungshemmende Arzneimittel (NSAR) ist auch Diclofenac bei Patienten kontraindiziert, bei denen nach Einnahme von Acetylsalicylsäure oder anderen NSAR Anfälle von Asthma, Urtikaria oder akuter Rhinitis ausgelöst wurden. 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Allgemein Das Auftreten unerwünschter Wirkungen kann durch die Anwendung der niedrigsten effektiven Dosis über den kürzesten Zeitraum, der für die Erreichung der Beschwerdefreiheit notwendig ist, minimiert werden (siehe Abschnitt 4.2 sowie gastrointestinale, kardiovaskuläre unten cereebrovaskuläre Effekte unten).
2 Die gleichzeitige Anwendung von Diclofenac mit systemischen NSAR einschließlich der Zyklooxygenase 2 selektiven Inhibitoren ist aufgrund des Fehlens jeglicher Evidenz zum Nachweis synergistischer Vorteile und aufgrund des Potentials für additive Nebenwirkungen zu vermeiden (siehe Abschnitt 4.5). Bei älteren Personen ist auf Basis des medizinischen Zustandes Vorsicht angezeigt. Es wird vor allem empfohlen, dass die niedrigste wirksame Dosis bei gebrechlichen älteren Patienten oder solchen mit geringem Körpergewicht angewendet wird. Wie bei anderen NSAR können auch bei Diclofenac ohne vorherigen Kontakt mit dem Arzneimittel in seltenen Fällen allergische Reaktionen, einschließlich anaphylaktische/ anaphylaktoide Reaktionen, auftreten (siehe Abschnitt 4.8). Bei Patienten, die überempfindlich auf Acetylsalicylsäure oder andere NSAR sind, können während der Behandlung mit Diclofenac anaphylaktische Reaktionen verschiedenen Schweregrades auftreten. Um mögliche frühere Überempfindlichkeitsreaktionen zu erkennen, ist daher eine genauen Anamnese des Patienten erforderlich. Wie andere NSAR kann auch Diclofenac die Anzeichen und Symptome von Infektionen aufgrund seiner pharmakodynamischen Eigenschaften maskieren. Daher ist es mit Vorsicht bei Patienten einzusetzen, bei denen ein Risiko für Infektionen besteht. Die Langzeitanwendung jeglicher Art von Kopfschmerzmitteln kann zu einer Verschlechterung der Kopfschmerzen führen. Falls dies bemerkt oder vermutet wird, sollte ein Arzt aufgesucht und die Behandlung unterbrochen werden. Die Diagnose Medikamenteninduzierter Kopfschmerz ist bei Patienten zu vermuten, die trotz (oder wegen) der regelmäßigen Anwendung von Kopfschmerzmitteln häufig oder täglich Kopfschmerzen haben. Gastrointestinale Wirkungen Gastrointestinale Blutungen, Ulzeration oder Perforation, die tödlich verlaufen können, wurden im Zusammenhang mit allen NSAR, einschließlich Diclofenac, berichtet; sie können jederzeit während der Behandlung auftreten, mit Warnsymptomen oder auch ohne Warnsymptome und mit oder ohne schwerwiegenden gastrointestinalen Ereignissen in der Anamnese. Im Allgemeinen haben sie bei älteren Personen schwerwiegendere Konsequenzen. Wenn gastrointestinale Blutungen oder Ulzeration bei Patienten, die Diclofenac erhalten, auftreten, muss das Arzneimittel abgesetzt werden. Wie bei allen NSAR, einschließlich Diclofenac, ist eine engmaschige medizinische Überwachung erforderlich und besondere Vorsicht ist erforderlich, wenn Diclofenac bei Patienten mit Symptomen, die auf gastrointestinale Erkrankungen oder auf Magen- oder Darmulzera, Blutungen oder Perforation in der Anamnese hinweisen, verordnet wird (siehe Abschnitt 4.8.). Das Risiko gastrointestinaler Blutungen, Ulzeration oder Perforation ist höher mit steigender NSAR-Dosis und bei Patienten mit Ulkusanamnese, insbesondere mit Komplikationen wie Blutung oder Perforation (siehe Abschnitt 4.3). Ältere Patienten haben eine gesteigerte keit von Nebenwirkungen auf NSAR, vor allem gastrointestinale Blutung und Perforation, die tödlich enden können. Um das Risiko gastrointestinaler Toxizität bei Patienten mit einer Ulkusanamnese, vor allem solchen mit Komplikationen einer Blutung oder Perforation, und bei älteren Personen zu reduzieren, ist die Behandlung mit der niedrigsten wirksamen Dosis zu beginnen und fortzuführen. Für diese Patienten ist eine Kombinationstherapie mit protektiven Substanzen (z. B. Protonenpumpeninhibitoren oder Misoprostol) in Betracht zu ziehen und auch für Patienten, die eine gleichzeitige Anwendung von Arzneimitteln benötigen, die niedrig dosierte Acetylsalicylsäure (ASA/Aspirin) enthalten oder mit anderen Arzneimitteln, die wahrscheinlich das gastrointestinale Risiko erhöhen (siehe unten und Abschnitt 4.5). Patienten mit gastrointestinaler Toxizität in der Vorgeschichte, insbesondere wenn sie älter sind, haben jedes ungewöhnliche abdominale Symptom (insbesondere gastrointestinale Blutung) zu melden; dies gilt in besonderem Maße für die Anfangsphase der Therapie. Vorsicht wird empfohlen bei Patienten, mit gleichzeitiger Medikation, die das Ulzerations- oder Blutungsrisiko erhöhen kann, wie systemische Kortikosteroide, Antikoagulanzien wie Warfarin, Thrombozytenaggregationshemmer wie Acetylsalicylsäure (ASA/Aspirin) oder selektive Serotonin- Wiederaufnahmehemmer (siehe Abschnitt 4.5). Wenn bei Patienten unter Therapie mit Diclofenac gastrointestinale Blutung oder Ulzeration auftritt, muss die Behandlung sofort abgebrochen werden. Bei Patienten mit Colitis ulcerosa oder Morbus Crohn sind ebenfalls eine engmaschige medizinische Überwachung und Vorsicht auszuüben, da diese Erkrankungen verschlimmert werden können (siehe Abschnitt 4.8). Hepatische Effekte Engmaschige medizinische Überwachung ist erforderlich, wenn Diclofenac Patienten mit herabgesetzter Leberfunktion verordnet wird, da sich deren Zustand verschlechtern kann. Wie bei anderen NSAR, einschließlich Diclofenac, können die Werte von einem oder mehreren Leberenzymen ansteigen. Während einer Langzeittherapie mit Diclofenac, ist eine regelmäßige Überwachung der Leberfunktion als Vorsichtsmaßnahme indiziert. Wenn die Leberfunktionstests außerhalb der Norm bestehen bleiben oder sich noch verschlechtern, wenn sich klinische Anzeichen oder Symptome, die einer Lebererkrankung entsprechen, entwickeln oder wenn andere Manifestationen auftreten (z. B. Eosinophilie, Hautaus-
3 schlag), muss Diclofenac abgesetzt werden. Eine Hepatitis kann unter der Anwendung von Diclofenac ohne Prodromalsymptome auftreten. Vorsicht ist angezeigt, wenn Diclofenac bei Patienten mit hepatischer Porphyrie eingesetzt wird, da ein Anfall ausgelöst werden kann. Renale Effekte Da Flüssigkeitsretention und Ödeme im Zusammenhang mit NSAR-Therapie, einschließlich Diclofenac, berichtet wurden, ist besondere Vorsicht bei Patienten erforderlich mit herabgesetzter Herz- oder Nierenfunktion, Hypertonie in der Anamnese, älteren Personen, Patienten, die eine gleichzeitige Behandlung mit Diuretika oder Arzneimitteln erhalten, die die Nierenfunktion signifikant beeinträchtigen können, und bei Patienten mit substanzieller Volumendepletion jeglicher Ursache, z. B. vor und nach größeren Operationen (siehe Abschnitt 4.3). Die Überwachung der Nierenfunktion wird als Vorsichtsmaßnahme empfohlen, wenn Diclofenac in solchen Fällen verabreicht wird. Ein Absetzen der Therapie resultiert übelicherweise in einer Regeneration und Herstellung des Zustandes vor der Behandlung. Diclobene rapid 50 mg Filmtabletten werden nur zur Kurzzeitbehandlung empfohlen. Bei länger dauernder Behandlung mit Diclofenac werden regelmäßige Nierenfunktionskontrollen empfohlen. Hautreaktionen: wurden im Zusammenhang mit der Anwendung von NSAR schwere, manchmal tödlich verlaufende Hautreaktionen, einschließlich exfoliativer Dermatitis, Stevens-Johnson-Syndrom und toxischer epidermaler Nekrolyse berichtet (siehe Abschnitt 4.8). Es scheint, dass die Patienten das höchste Risiko für diese Reaktionen früh im Therapieverlauf haben: der Beginn der Reaktion trat in der Mehrzahl der Fälle innerhalb des ersten Behandlungsmonats ein. Diclofenac sollte beim ersten Auftreten von Exanthem, Schleimhautläsionen oder bei jedem anderen Anzeichen von Überempfindlichkeit abgesetzt werden. Kardiovaskuläre und cerebrovaskuläre Effekte Eine angemessene Überwachung und Beratung von Patienten mit Hypertonie und/oder leichter bis mittelschwerer dekompensierter Herzinsuffizienz in der Anamnese sind erforderlich, da Flüssigkeitseinlagerungen und Ödeme in Verbindung mit NSAR-Therapie berichtet wurden. Klinische Studien und epidemiologische Daten weisen einheitlich auf ein erhöhtes Risiko von arteriellen thrombotischen Ereignissen (z. B. Myokardinfarkt oder Schlaganfall) in Verbindung mit der Anwendung von Diclofenac hin, insbesondere bei hoher Dosierung (150 mg/tag) und im Rahmen einer Langzeitbehandlung (siehe Abschnitte 4.3 und 4.8). Patienten mit schwer einstellbarer Hypertonie, dekompensierter Herzinsuffizienz, bestehender ischämischer Herzerkrankung, peripherer arterieller Gefäßerkrankung und/oder cerebrovaskulärer Erkrankung sollten erst nach sorgfältiger Abwägung mit Diclofenac behandelt werden. Patienten mit signifikanten Risikofaktoren für kardiovaskuläre Ereignisse (z. B. Hypertonie, Hyperlipidämie, Diabetes mellitus, Rauchen) sollten erst nach sorgfältiger Abwägung mit Diclofenac behandelt werden. Da die kardiovaskulären Risiken von Diclofenac mit der Dosis und der Dauer der Exposition ansteigen können, ist die kürzest mögliche Dauer und die niedrigste wirksame Dosis anzuwenden. Der Bedarf des Patienten in Hinblick auf Symptombefreiung und das Ansprechen auf die Therapie sind regelmäßig zu reevaluieren. Hämatologische Effekte Diclobene rapid 50 mg Filmtabletten werden nur zur Kurzzeitbehandlung empfohlen. Bei länger dauernder Behandlung mit Diclofenac werden, wie bei allen NSAR, regelmäßige Blutbildkontrollen empfohlen. Wie andere NSAR kann Diclofenac vorübergehend die Thrombozytenaggregation hemmen. Patienten mit Gerinnungsstörungen und Patienten, die mit Antikoagulanzien behandelt werden, sollen sorgfältig überwacht werden (siehe Abschnitt 4.5). Vorbestehendes Asthma Bei Patienten mit Asthma, saisonaler allergischer Rhinitis, Schwellung der Nasenschleimhaut (d. h. Nasenpolypen), chronisch obstruktiven Lungenerkrankungen oder chronischen Infektionen des Respirationstraktes (besonders, wenn sie mit Symptomen ähnlich einer allergischen Rhinitis verbunden sind) sind Reaktionen auf NSAR, wie Verschlechterung von Asthma (sogenannte Analgetika-Unverträglichkeit/Analgetika-Asthma), Quincke-Ödem oder Urtikaria häufiger als bei anderen Patienten. Daher wird bei solchen Patienten besondere Vorsicht empfohlen (Bereitschaft für den Notfall). Das trifft auch auf Patienten zu, die allergisch auf andere Substanzen reagieren, z. B. mit Hautreaktionen, Pruritus oder Urtikaria. Vorsicht ist geboten bei Patienten, die an Asthma bronchiale leiden oder mit Asthma bronchiale in der Vorgeschichte, da über die Auslösung von Bronchospasmen durch NSAR bei diesen Patienten berichtet wurde. Fertilität: Die Anwendung von Diclofenac kann die weibliche Fertilität beeinträchtigen und wird bei Frauen, die eine Schwangerschaft planen, nicht empfohlen. Bei Frauen, die Schwierigkeiten haben, schwanger zu werden oder die sich Untersuchungen zur Infertilität unterziehen, sollte das Absetzen von Diclofenac in Erwägung gezogen werden. Sonstige Warnhinweise: NSAR können die diuretische Wirkung verringern und die Wirkung von kaliumsparenden Diuretika verstärken. Aus diesem Grund ist eine Kontrolle der Kaliumserumspiegel notwendig.
4 Diclofenac-Kalium ist nicht geeignet für die Behandlung von hemiplegischer Migräne, Basilarismigräne oder ophthalmoplegischer Migräne. Wie auch bei anderen Therapien von Migräneanfällen ist es notwendig, andere möglicherweise schwerwiegende neurologische Zustandsbilder auszuschließen, bevor eine Behandlung bei Kopfschmerzpatienten ohne Migränediagnose in der Vorgeschichte oder Migränepatienten mit atypischen Symptomen durchgeführt wird. Es ist zu beachten, dass bei Migränepatienten ein erhöhtes Risiko für bestimmte cerebrovaskuläre Ereignisse (z.b. Apoplexie oder TIA) besteht. Die Sicherheit und Wirksamkeit von Diclofenac-Kalium bei Anwendung während der Auraphase, vor der Kopfschmerzphase der Migräne, konnten in klinischen Studien nicht bestätigt werden. Sonstige Bestandteile Dieses Arzneimittel enthält Lactose. Patienten mit der seltenen, hereditären Galactose-Intoleranz, Lapp- Lactase-Mangel und Glucose-Galactose-Malabsorption sollten dieses Arzneimittel nicht einnehmen. 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Die folgenden Wechselwirkungen beinhalten solche, die mit Diclofenac Filmtabletten und/oder anderen Darreichungsformen von Diclofenac beobachtet wurden. Lithium: Bei gleichzeitiger Anwendung kann Diclofenac zu erhöhten Plasmaspiegeln von Lithium führen. Die Überwachung des Serum-Lithiumspiegels wird empfohlen. Digoxin: Bei gleichzeitiger Anwendung kann Diclofenac zu erhöhten Plasmaspiegeln von Digoxin führen. Die Überwachung des Serum-Digoxinspiegels wird empfohlen. Klinische Zeichen einer Überdosierung konnten in diesen Fällen nicht festgestellt werden. Diuretika und Antihypertensiva: Wie bei anderen NSAR kann die gleichzeitige Anwendung von Diclofenac mit Diuretika und Antihypertensiva (z. B. Betablocker, ACE-Hemmer und Angiotensin-II-Antagonisten) zu einer Reduktion der antihypertensiven Wirkung führen. Daher muss die gemeinsame Verabreichung mit Vorsicht erfolgen und Patienten (mit herabgesetzter Nierenfunktion, z. B. dehydrierte Patienten) insbesondere ältere Patienten müssen ihren Blutdruck regelmäßig kontrollieren. Die Patienten müssen ausreichend hydriert sein und die Kontrolle der Nierenfunktion muss nach Beginn der Kombinationstherapie und in regelmäßigen Abständen danach in Betracht gezogen werden. Das gilt besonders für Diuretika und ACE-Hemmer aufgrund eines erhöhten Risikos einer Nephrotoxizität. Arzneimittel, die Hyperkaliämie bewirken: Die gleichzeitige Behandlung mit kaliumsparenden Arzneimitteln kann mit erhöhten Kaliumserumwerten verbunden sein, weswegen eine häufige Kontrolle erfolgen sollte (siehe Abschnitt 4.4). Andere NSAR einschließlich Cyclooxygenase-2-selektiven Inhibitoren und Kortikosteroiden: Die gleichzeitige Verabreichung von Diclofenac und anderen systemischen NSAR einschließlich Cyclooxygenase-2-selektiven Inhibitoren und Kortikosteroiden kann die keit gastrointestinaler Nebenwirkungen erhöhen (siehe Abschnitt 4.4). Antikoagulanzien und thrombozytenaggregationshemmende Arzneimittel: Vorsicht wird empfohlen, da die gleichzeitige Anwendung das Risiko einer Blutung erhöhen kann (siehe Abschnitt 4.4). Obwohl klinische Untersuchungen anscheinend nicht darauf hinweisen, dass Diclofenac die Wirkung von Antikoagulanzien beeinflusst, gibt es Einzelberichte über ein erhöhtes Risiko einer Hämorrhagie bei Patienten, die Diclofenac gleichzeitig mit Antikoagulanzien erhalten. Daher wird eine engmaschige Kontrolle solcher Patienten empfohlen. Selektive Serotonin-Wiederaufnahme-Hemmer (SSRIs): Die gleichzeitige Verabreichung systemischer NSAR, einschließlich Diclofenac, mit SSRIs kann das Risiko gastrointestinaler Blutungen erhöhen (sieh Abschnitt 4.4). Antidiabetika: Klinische Untersuchungen haben gezeigt, dass Diclofenac gemeinsam mit oralen Antidiabetika verabreicht werden kann, ohne deren klinische Wirkung zu beeinflussen. Es gab allerdings vereinzelt Berichte über eine hypo- und hyperglykämische Wirkung, die eine Anpassung der Dosis des Antidiabetikums während der Therapie mit Diclofenac erforderlich machten. Aus diesem Grund wird die Überwachung des Blutzuckerspiegels als Vorsichtsmaßnahme während einer Kombinationstherapie empfohlen. Methotrexat: Diclofenac kann die tubuläre renale Clearance von Methotrexat hemmen, wodurch die Methotrexat-Spiegel erhöht werden. Vorsicht ist geboten, wenn NSAR, einschließlich Diclofenac, weniger als 24 Stunden vor oder nach einer Behandlung mit Methotrexat verabreicht werden, da der Plasmaspiegel und auch die Toxizität von Methotrexat erhöht sein können. Ciclosporin: Auf Grund der Wirkung auf renale Prostaglandine kann Diclofenac, wie andere NSAR, die renale Toxizität von Ciclosporin erhöhen. Daher sollte es in Dosen verabreicht werden, die niedriger sind als jene, die an Patienten verabreicht werden, die kein Ciclosporin erhalten. Chinolon-Antibiotika: Es gab Einzelberichte über Konvulsionen, die aufgrund der gleichzeitigen Gabe von Chinolonen und NSAR aufgetreten sein könnten. Das kann bei Patienten mit oder ohne Epilepsie oder Konvulsionen in der Anamnese auftreten. Daher ist Vorsicht geboten, wenn die Anwendung von Chinolonen bei Patienten, die schon ein NSAR bekommen, in Erwägung gezogen wird.
5 Phenytoin: Bei gleichzeitiger Verabreichung von Phenytoin mit Diclofenac wird aufgrund eines erwarteten Anstiegs der Phenytoinexpostion die Überwachung der Phenytoinkonzentrationen im Blut empfohlen. Colestipol und Colestyramin: Diese Substanzen können eine Verzögerung oder Verringerung der Resorption von Diclofenac bewirken. Daher wird empfohlen, Diclofenac zumindest eine Stunde vor oder 4 bis 6 Stunden nach der Verabreichung von Colestipol/Cholestyramin zu verabreichen. Potente CYP2C9-Inhibitoren: Vorsicht wird empfohlen, wenn Diclofenac mit einem potenten CYP2C9-Inhibitor (wie Sulfinpyrazon und Voriconazol) verordnet wird, da dies aufgrund einer Hemmung des Diclofenac-Metabolismus zu einem signifikanten Anstieg der Spitzenplasmakonzentrationen und der Exposition von Diclofenac führen kann. 4.6 Fertilität, Schwangerschaft und Stillzeit Schwangerschaft Die Hemmung der Prostaglandinsynthese kann die Schwangerschaft und/oder die Entwicklung des Embryo/Fötus nachteilig beeinflussen. Daten aus epidemiologischen Studien weisen auf ein erhöhtes Risiko von Fehlgeburt sowie kardialer Missbildung und Gastroschisis nach Anwendung von Prostaglandinsynthesehemmern in der frühen Schwangerschaft hin. Das absolute Risiko einer kardiovaskulären Missbildung erhöhte sich von weniger als 1% auf bis zu ca. 1,5%. Es wird angenommen, dass das Risiko mit der Dosis und Behandlungsdauer steigt. Bei Tieren zeigte sich, dass die Verabreichung eines Prostaglandinsynthesehemmers zu vermehrten Abgängen vor bzw. nach Implantation und embryofötaler Letalität führt. Weiters wurde bei Tieren, die einen Prostaglandinsynthesehemmer während der Organogenese erhielten, eine erhöhte Inzidenz von verschiedenen Missbildungen, einschließlich kardiovaskulärer, berichtet. Während des ersten und zweiten Trimesters der Schwangerschaft darf Diclofenac nur bei zwingenden Gründen verabreicht werden. Falls Diclofenac bei Frauen, die eine Schwangerschaft planen oder während des ersten und zweiten Trimesters der Schwangerschaft angewendet wird, muss die Dosis so gering wie möglich und die Behandlungsdauer so kurz wie möglich gehalten werden. Während des dritten Trimesters der Schwangerschaft können alle Prostaglandinsynthesehemmer: beim Fötus kardiopulmonale Toxizität (pulmonale Hypertonie mit vorzeitigem Verschluss des Ductus Botalli) und Nierenfunktionsstörungen auslösen, welche sich zu einem Nierenversagen mit Oligohydramnie entwickeln können; die Mutter und das Kind am Ende der Schwangerschaft einer möglichen Verlängerung der Blutungszeit aussetzen; diese aggregationshemmende Wirkung kann bereits bei sehr niedrigen Dosen auftreten. Gebärmutterkontraktionen verhindern und die Geburt verzögern/verlängern. Daher ist Diclofenac im dritten Schwangerschaftstrimester kontraindiziert. Stillzeit Wie andere NSAR tritt Diclofenac in kleinen Mengen in die Muttermilch über (nach oraler Einnahme von 150 mg/tag (50 mg alle 8 Stunden). Um unerwünschte Wirkungen beim Säugling zu vermeiden, soll Diclofenac nicht während der Stillzeit verabreicht werden. Fertilität Wie bei anderen NSAR kann die Anwendung von Diclofenac die weibliche Fertilität beeinträchtigen und die Einnahme wird bei Frauen, die beabsichtigen, schwanger zu werden, nicht empfohlen. Bei Frauen, die Probleme haben, schwanger zu werden oder die sich einer Untersuchung zur Infertilität unterziehen, soll ein Absetzen von Diclofenac erwogen werden (siehe Abschnitt 4.4). 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Patienten, bei denen Sehstörungen, Schwindel, Drehschwindel, Schläfrigkeit oder andere zentralnervöse Störungen während der Einnahme von Diclofenac auftreten, sollen nicht am Straßenverkehr teilnehmen bzw. keine Maschinen bedienen. 4.8 Nebenwirkungen Nebenwirkungen (Tabelle 1) werden unter der Rubrik keit gereiht, wobei die häufigsten zuerst unter Verwendung der folgenden Konvention gelistet sind: sehr häufig ( 1/10); häufig ( 1/100, <1/10); gelegentlich ( 1/1.000, <1/100); selten ( 1/10.000, <1/1000); sehr selten (<1/10.000); nicht bekannt(auf Grundlage der verfügbaren Daten nicht abschätzbar). Die folgenden Nebenwirkungen beinhalten Nebenwirkungen, die sowohl bei einer Kurzzeit- als auch bei einer Langzeittherapie berichtet wurden. Die am häufigsten beobachteten Nebenwirkungen sind gastrointestinaler Art. Peptische Ulzera, Perforationen oder gastrointestinale Blutungen können auftreten und können manchmal, insbesondere bei älteren Patienten, tödlich verlaufen (siehe Abschnitt 4.4). Nach der Anwendung wurden berichtet: Übelkeit, Erbrechen, Diarrhoe, Blähungen, Obstipation, Dyspepsie, Abdominalschmerz, Melaena, Haematemesis, ulzerative Stomatitis, Verstärkung von Colitis ulcerosa oder Morbus Crohn (siehe Abschnitt 4.4). Weniger häufig wurde Gastritis beobachtet. Tabelle 1 Erkrankungen des Blutes und des Lymphsystems
6 Erkrankungen des Immunsystems Psychiatrische Erkrankungen Erkrankungen des Nervensystems Thrombozytopenie, Leukopenie, Anämie (einschließlich hämolytische und aplastische Anämie), Agranulozytose. Überempfindlichkeit, anaphylaktische und anaphylaktoide Reaktionen (einschließlich Hypotonie und Schock). Angioneurotisches Ödem (einschließlich Gesichtsödem). Desorientierung, Depression, Schlaflosigkeit, Alpträume, Reizbarkeit, psychotische Störung Kopfschmerzen, Schwindel Schläfrigkeit Parästhesie, Gedächtnisstörungen, Konvulsionen, Angst, Zittern, aseptische Meningitis, Störungen der Geschmacksempfindung, zerebrovaskuläres Ereignis. Augenerkrankungen Sehstörungen, verschwommenes Sehen, Diplopie. Erkrankungen des Ohrs und des Labyrinths Vertigo. Tinnitus, Hörstörungen.. Herzerkrankungen Palpitationen, Schmerzen im Brustraum, Herzversagen, Myokardinfarkt. Gefäßerkrankungen Hypertonie, Vasculitis. Erkrankungen der Atemwege, des Brustraums und Mediastinums Asthma (einschließlich Dyspnoe). Pneumonitis. Erkrankungen des Gastrointestinaltrakts Übelkeit, Erbrechen, Diarrhö, Dyspepsie, Abdominalschmerzen, Blähungen, Anorexie. Gastritis, gastrointestinale Blutungen, Haematemesis, hämorrhagische Diarrhö, Melaena, gastrointestinale Ulzera (mit oder ohne Blutung o- der Perforation). Colitis (einschließlich hämorrhagische Colitis und Verstärkung von Colitis ulcerosa oder Morbus Crohn), Obstipation, Stomatitis (einschließlich ulzerative Stomatitis), Glossitis, Erkrankung des Ösophagus, diaphragmaartige intestinale Stenosen, Pankreatitis. Leber- und Gallenerkrankungen Erhöhung der Transaminasen Hepatitis, Gelbsucht, Lebererkrankung. Fulminante Hepatitis, Lebernekrose, Leberinsuffizienz. Erkrankungen der Haut und des Unterhautzellgewebes Hautausschlag. Urtikaria. Blasenausschlag, Ekzem, Erythem, Erythema multiforme, Stevens- Johnson-Syndrom, toxische epidermale Nekrolyse (Lyell-Syndrom), exfoliative Dermatitis, Haarausfall, photosensitive Reaktionen, Purpura, allergische Purpura, Pruritus. Erkrankungen der Nieren und Harnwege Akute Niereninsuffizienz, Hämaturie, Proteinurie, nephrotisches Syndrom, interstitielle Nephritis, Papillennekrose. Erkrankungen der Geschlechtsorgane und der Brustdrüse Impotenz. Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Ödem. Klinische Studien und epidemiologische Daten weisen einheitlich auf ein erhöhtes Risiko von arteriellen thrombotischen Ereignissen (z. B. Myokardinfarkt oder Schlaganfall) in Zusammenhang mit der Anwendung von Diclofenac, insbesondere bei hoher Dosierung (150 mg/tag) und im Rahmen einer Langzeitbe-
7 handlung (siehe Abschnitte 4.3 und 4.4). Meldung des Verdachts auf Nebenwirkungen Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung direkt über das nationale Meldesystem anzuzeigen: Bundesamt für Sicherheit im Gesundheitswesen Traisengasse Wien Österreich Fax: + 43 (0) Website: Überdosierung Symptome Ein typisches klinisches Erscheinungsbild einer Überdosierung von Diclofenac ist nicht bekannt. Eine Überdosierung kann Symptome wie Erbrechen, gastrointestinale Blutung, Diarrhö, Benommenheit, Tinnitus oder Konvulsionen verursachen. Bei schwerer Überdosierung soll unverzüglich eine Fachabteilung eines Krankenhauses kontaktiert werden. Im Fall einer signifikanten Vergiftung sind akutes Nierenversage und ein Leberschaden möglich. Therapeutische Maßnahmen Die Behandlung einer akuten Vergiftung mit NSAR, einschließlich Diclofenac, besteht hauptsächlich aus unterstützenden Maßnahmen und symptomatischer Behandlung. Unterstützenden Maßnahmen und eine symptomatische Behandlung ist indiziert bei Komplikationen wie Hypotonie, Niereninsuffizienz, Konvulsionen, gastrointestinalen Erkrankungen und Atemdepression. Spezielle Maßnahmen wie z. B. forcierte Diurese, Dialyse oder Hämoperfusion zeigen wahrscheinlich keine Wirkung bei der Elimination von NSAR, einschließlich Diclofenac, aufgrund der hohen Proteinbindungsrate und der ausgedehnten Metabolisierung. Die Resorption durch den Magen-Darm Trakt soll so schnell wie möglich verhindert werden. Aktivkohle kann nach der Einnahme einer potentiell toxischen Überdosis erwogen werden sowie eine gastrische Dekontamination (z. B. Erbrechen, Magenspülung) nach Einnahme einer potentiell lebensbedrohenden Überdosis. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften ATC-Code: M01AB05. Diclofenac ist ein nichtsteroidales Antirheumatikum, das zur Gruppe der Arylessigsäurederivate gehört. Diclofenac besitzt eine entzündungshemmende, schmerzstillende und fiebersenkende Wirkung. Die Wirkung (so wie die Wirkung aller NSAR) beruht zumindest teilweise auf der Inhibierung des Enzyms Cyclo- Oxygenase, das die Synthese der Prostaglandine aus Arachidonsäure katalysiert. Der Wirkstoff in Diclobene rapid 50 mg Filmtabletten ist Diclofenac-Kalium. Kinder und Jugendliche Es gibt nur begrenzte Erfahrung aus klinischen Studien zur Anwendung von Diclofenac bei pädiatrischen Patienten mit JRA (juveniler rheumatoider Arthritis)/(JIA (juveniler idiopathischer Arthritis). In einer randomisierten, doppel-blinden, 2-wöchigen, Parallelgruppen-Studie an Kindern im Alter von 3 bis 15 Jahren mit JRA/JIA wurde die Wirksamkeit und Sicherheit von 2-3 mg/kg KG/Tag Diclofenac mit Acetylsalicylsäure (ASS, mg/kg KG/Tag) und Placebo verglichen, wobei in jeder Gruppe 15 Patienten eingeschlossen waren. In der allgemeinen Auswertung zeigten 11 von 15 Patienten, die Diclofenac erhielten, 6 von 12 Patienen, die Aspirin erhielten und 4 von 15 Patienten, die Placebo erhielten eine Verbesserung mit einem statistisch signifikanten Unterschied (p <0,05). Die Anzahl der schmerzempfindlichen Gelenke sank unter Diclofenac und ASS, stieg jedoch unter Placebo. In einer zweiten randomisierten, doppel-blinden, 6-wöchigen Parallelgruppen-Studie an Kindern im Alter von 4 bis 15 Jahren mit JRA/JIA war die Wirksamkeit von Diclofenac (tägliche Dosis 2-3 mg/kg KG, n=22) vergleichbar mit der von Indomethacin (tägliche Dosis 2-3 mg/kg KG, n=33). 5.2 Pharmakokinetische Eigenschaften Nach oraler Verabreichung wird Diclofenac schnell und vollständig resorbiert. Die maximale Plasmakonzentration wird durchschnittlich 20 bis 60 Minuten nach Verabreichung einer 50 mg- Filmtablette erreicht. Wegen des First-Pass Effektes in der Leber beträgt die absolute orale Bioverfügbarkeit ungefähr 50%. Diclofenac wird zu 99,7% an Serumproteine gebunden, hauptsächlich an Albumin (99,4%). Die totale systemische Clearance von Diclofenac im Plasma beträgt ml/min (Mittelwert + Standardabweichung). Die terminale Halbwertszeit im Plasma beträgt 1-2 Stunden. Die Biotransformation von Diclofenac läuft teilweise über Glucuronidierung des intakten Moleküls, jedoch hauptsächlich durch Einfachund Mehrfachhydroxylierung und Methoxylierung. Circa 60% der verabreichten Dosis wird über den Urin in Form von Metaboliten ausgeschieden. Weniger als 1% wird als unveränderte Substanz ausgeschieden. Der Rest der Dosis wird in Form von Metaboliten biliofaecal ausgeschieden.
8 Das pharmakokinetische Verhalten ändert sich nicht nach wiederholter Verabreichung. Es kommt zu keiner Akkumulierung bei den empfohlenen Dosierungsintervallen. Es wurden keine relevanten altersabhängigen Unterschiede bei der Resorption, Metabolisierung oder Ausscheidung beobachtet. Bei Patienten, die an einer Nierenfunktionsstörung leiden, konnte keine Akkumulation von unverändertem Wirkstoff aus einer Single-Dose Kinetik abgeleitet werden, wenn das übliche Dosierungsschema angewendet wurde. Bei einer Kreatinin-Clearance von < 10ml/min ist der theoretische steadystate-plasmaspiegel von Hydroxymetaboliten ungefähr 4 mal höher als bei normalen Probanden. Jedoch werden die Metaboliten schließlich über die Galle ausgeschieden. Bei Patienten mit chronischer Hepatitis oder nicht-dekompensierter Zirrhose verhalten sich Kinetik und Metabolismus von Diclofenac genauso wie bei Patienten ohne Lebererkrankung. 5.3 Präklinische Daten zur Sicherheit Präklinische Daten zeigen keine spezielle Gefahr für Menschen, abgesehen von der Information, die in anderen Abschnitten der Fachinformation inkludiert ist. 6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile Mikrokristalline Cellulose Lactose-Monohydrat Maisstärke Croscarmellose-Natrium Magnesiumstearat Hochdisperses Siliciumdioxid Hypromellose Glycerol 85% Talkum Titandioxid (E171) Eisenoxid rot und gelb (E172) 6.2 Inkompatibilitäten Nicht zutreffend 6.3 Dauer der Haltbarkeit 5 Jahre. 6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Nicht über 25 C lagern. 6.5 Art und Inhalt des Behältnisses 10, 20, 20x1, 30, 50, 50x1, 100, 100x1 Filmtabletten in PVC/Al-Blisterpackungen. Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht. 6.6 Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung Keine besonderen Anforderungen. 7. Inhaber der Zulassung ratiopharm Arzneimittel Vertriebs-GmbH Albert Schweitzer-Gasse 3 A-1140 Wien info@ratiopharm.at 8. Zulassungsnummer Datum der Erteilung der Zulassung/Verlängerung der Zulassung 12.März 2001 / 28.August Stand der Information November 2014 Verschreibungspflicht/Apothekenpflicht: Rezept- und apothekenpflichtig.
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Heumann s Blasen- und Nierentee Solubitrat Wirkstoffe: Dickextrakt aus Birkenblättern, Dickextrakt aus Riesengoldrutenkraut Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Heumann s Blasen- und Nierentee Solubitrat Wirkstoffe: Dickextrakt aus Birkenblättern, Dickextrakt aus Riesengoldrutenkraut Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Tebofortan 40 mg - Filmtabletten. Wirkstoff: Trockenextrakt aus Ginkgo-biloba-Blättern
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tebofortan 40 mg - Filmtabletten Wirkstoff: Trockenextrakt aus Ginkgo-biloba-Blättern Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tebofortan 40 mg - Filmtabletten Wirkstoff: Trockenextrakt aus Ginkgo-biloba-Blättern Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen:
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 06.11.2014 Veronika Iro REGA +43 (0) 505 55 36247 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 06.11.2014 Veronika Iro REGA +43 (0) 505 55 36247 pv-implementation@ages.at
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Legalon SIL - Trockensubstanz zur Infusionsbereitung
 PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
1. WAS IST DAFALGAN Zäpfchen UND WOFÜR WIRD ES ANGEWENDET?
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DAFALGAN Säuglinge 80 mg Zäpfchen DAFALGAN Kleinkinder 150 mg Zäpfchen DAFALGAN große Kinder 300 mg Zäpfchen Paracetamol Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DAFALGAN Säuglinge 80 mg Zäpfchen DAFALGAN Kleinkinder 150 mg Zäpfchen DAFALGAN große Kinder 300 mg Zäpfchen Paracetamol Lesen Sie die gesamte Packungsbeilage
WAS finde ich WO im Beipackzettel
 WAS finde ich WO im Beipackzettel Sie haben eine Frage zu Ihrem? Meist finden Sie die Antwort im Beipackzettel (offiziell "Gebrauchsinformation" genannt). Der Aufbau der Beipackzettel ist von den Behörden
WAS finde ich WO im Beipackzettel Sie haben eine Frage zu Ihrem? Meist finden Sie die Antwort im Beipackzettel (offiziell "Gebrauchsinformation" genannt). Der Aufbau der Beipackzettel ist von den Behörden
Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Patienteninformationsbroschüre Valproat
 Patienteninformationsbroschüre Valproat Informationen für Patientinnen Die Informationen in dieser Broschüre sind für Frauen bestimmt, denen Valproat verschrieben wird und die schwanger werden können (Frauen
Patienteninformationsbroschüre Valproat Informationen für Patientinnen Die Informationen in dieser Broschüre sind für Frauen bestimmt, denen Valproat verschrieben wird und die schwanger werden können (Frauen
Gebrauchsinformation: Information für Anwender. LOMUSOL Augentropfen. Wirkstoff: Dinatriumcromoglicat
 Gebrauchsinformation: Information für Anwender LOMUSOL Augentropfen Wirkstoff: Dinatriumcromoglicat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Anwender LOMUSOL Augentropfen Wirkstoff: Dinatriumcromoglicat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Ibuprofen Sandoz 200 mg Filmtabletten Ibuprofen Sandoz 400 mg Filmtabletten Ibuprofen
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Ibuprofen Sandoz 200 mg Filmtabletten Ibuprofen Sandoz 400 mg Filmtabletten Ibuprofen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Ibuprofen Sandoz 200 mg Filmtabletten Ibuprofen Sandoz 400 mg Filmtabletten Ibuprofen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie
Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen
 Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen Sachverständigen-Ausschuss für Verschreibungspflicht 62. Sitzung am 13.01.2009 im Bundesinstitut für Arzneimittel- und
Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen Sachverständigen-Ausschuss für Verschreibungspflicht 62. Sitzung am 13.01.2009 im Bundesinstitut für Arzneimittel- und
Gebrauchsinformation: Information für Patienten
 Gebrauchsinformation: Information für Patienten Esberitox -Tabletten Trockenextrakt aus einer Mischung von Lebensbaumspitzen und -blättern, Purpursonnenhutwurzel, Blassfarbener Sonnenhutwurzel und Färberhülsenwurzel
Gebrauchsinformation: Information für Patienten Esberitox -Tabletten Trockenextrakt aus einer Mischung von Lebensbaumspitzen und -blättern, Purpursonnenhutwurzel, Blassfarbener Sonnenhutwurzel und Färberhülsenwurzel
Anhang III. Ergänzungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Ergänzungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage 20 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS [Der unten genannte Wortlaut
Anhang III Ergänzungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage 20 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS [Der unten genannte Wortlaut
Gebrauchsinformation: Information für den Anwender
 Wortlaut der für die Gebrauchsinformation vorgesehenen Angaben Stand: Mai 2008 1 Gebrauchsinformation: Information für den Anwender Harntee-Steiner, Teeaufgusspulver Zur Anwendung bei Heranwachsenden ab
Wortlaut der für die Gebrauchsinformation vorgesehenen Angaben Stand: Mai 2008 1 Gebrauchsinformation: Information für den Anwender Harntee-Steiner, Teeaufgusspulver Zur Anwendung bei Heranwachsenden ab
ratiodolor akut 400 mg Filmtabletten 2. Qualitative und quantitative Zusammensetzung Jede Filmtablette enthält 684 mg Ibuprofen-DL-Lysin,
 ratiodolor akut 400 mg Filmtabletten 2. Qualitative und quantitative Zusammensetzung Jede Filmtablette enthält 684 mg Ibuprofen-DL-Lysin, entsprechend 400 mg Ibuprofen. Die vollständige Auflistung der
ratiodolor akut 400 mg Filmtabletten 2. Qualitative und quantitative Zusammensetzung Jede Filmtablette enthält 684 mg Ibuprofen-DL-Lysin, entsprechend 400 mg Ibuprofen. Die vollständige Auflistung der
GEBRAUCHSINFORMATION. Wirkstoff: Acetylsalicylsäure. Z.Nr.: 3155
 Liebe Patientin, lieber Patient! Bitte lesen Sie diese Gebrauchsinformation aufmerksam, weil sie wichtige Informationen darüber enthält, was Sie bei der Einnahme dieses Arzneimittels beachten sollen. Wenden
Liebe Patientin, lieber Patient! Bitte lesen Sie diese Gebrauchsinformation aufmerksam, weil sie wichtige Informationen darüber enthält, was Sie bei der Einnahme dieses Arzneimittels beachten sollen. Wenden
Gebrauchsinformation: Information für Patienten. Desloratadin Genericon 5 mg Filmtabletten. Wirkstoff: Desloratadin
 Gebrauchsinformation: Information für Patienten Desloratadin Genericon 5 mg Filmtabletten Wirkstoff: Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Gebrauchsinformation: Information für Patienten Desloratadin Genericon 5 mg Filmtabletten Wirkstoff: Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Wirkstoffe: Trockenextrakt aus Birkenblättern, Trockenextrakt aus Goldrutenkraut
 Gebrauchsinformation: Information für Anwender HEUMANN Blasen- und Nierentee SOLUBITRAT uro Teeaufgusspulver Wirkstoffe: Trockenextrakt aus Birkenblättern, Trockenextrakt aus Goldrutenkraut Lesen Sie die
Gebrauchsinformation: Information für Anwender HEUMANN Blasen- und Nierentee SOLUBITRAT uro Teeaufgusspulver Wirkstoffe: Trockenextrakt aus Birkenblättern, Trockenextrakt aus Goldrutenkraut Lesen Sie die
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. PROGESTOGEL 1 % Gel. Progesteron
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER PROGESTOGEL 1 % Gel Progesteron Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER PROGESTOGEL 1 % Gel Progesteron Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
Erratum Benkert, Pocket Guide, Psychopharmaka von A bis Z. 3.Aufl. ISBN (print): 978-3-642-54766-9/ DOI 10.1007/978-3-642-54767-6
 Erratum Benkert, Pocket Guide, Psychopharmaka von A bis Z. 3.Aufl. ISBN (print): 978-3-642-54766-9/ DOI 10.1007/978-3-642-54767-6 Trotz sorgfältiger Erstellung des Buchs Benkert, Pocket Guide, Psychopharmaka
Erratum Benkert, Pocket Guide, Psychopharmaka von A bis Z. 3.Aufl. ISBN (print): 978-3-642-54766-9/ DOI 10.1007/978-3-642-54767-6 Trotz sorgfältiger Erstellung des Buchs Benkert, Pocket Guide, Psychopharmaka
Gebrauchsinformation: Information für Patienten. Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench)
 Gebrauchsinformation: Information für Patienten Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Gebrauchsinformation: Information für Patienten Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Nasa Rhinathiol 0,1 %ige Nasenspray, Lösung Xylometazolinhydrochlorid
 Seite 1/5 Packungsbeilage Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mir der Anwendung dieses Arzneimittels beginnen. Sie enthält wichtige Informationen für Ihre Behandlung. Wenn
Seite 1/5 Packungsbeilage Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mir der Anwendung dieses Arzneimittels beginnen. Sie enthält wichtige Informationen für Ihre Behandlung. Wenn
Wie unsere Augen Erfahren Sie, wie wir sehen, und wie Sie Ihre Vision zu schützen.
 Wie unsere Augen Erfahren Sie, wie wir sehen, und wie Sie Ihre Vision zu schützen. Levobunolol ist ein Beta-Blocker, der den Druck im Inneren des Auges reduziert. Levobunolol Augen (Auge) ist für die Behandlung
Wie unsere Augen Erfahren Sie, wie wir sehen, und wie Sie Ihre Vision zu schützen. Levobunolol ist ein Beta-Blocker, der den Druck im Inneren des Auges reduziert. Levobunolol Augen (Auge) ist für die Behandlung
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Vitagutt Vitamin E 670 mg, Weichkapsel Zur Anwendung bei Erwachsenen Wirkstoff: 1000 mg all-rac-alpha-tocopherolacetat (entsprechend 670 mg RRR-alpha- Tocopherol-Äquivalente).
Gebrauchsinformation: Information für Anwender Vitagutt Vitamin E 670 mg, Weichkapsel Zur Anwendung bei Erwachsenen Wirkstoff: 1000 mg all-rac-alpha-tocopherolacetat (entsprechend 670 mg RRR-alpha- Tocopherol-Äquivalente).
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Magnevist 2 mmol/l Injektionslösung. Gadopentetsäure, Dimeglumin
 1 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Magnevist 2 mmol/l Injektionslösung Gadopentetsäure, Dimeglumin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor dieses Arzneimittel bei
1 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Magnevist 2 mmol/l Injektionslösung Gadopentetsäure, Dimeglumin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor dieses Arzneimittel bei
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Viscosan - Augentropfen Wirkstoff: Hypromellose
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Viscosan - Augentropfen Wirkstoff: Hypromellose Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Viscosan - Augentropfen Wirkstoff: Hypromellose Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Protagent-Einmalaugentropfen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 ml Lösung (= ca. 30 Tropfen) enthält 20 mg
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Protagent-Einmalaugentropfen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 ml Lösung (= ca. 30 Tropfen) enthält 20 mg
Faltschachtel. Unverkäufliches Muster (Eindruck auf Linie) Teil einer Klinikpackung, Einzelverkauf unzulässig (Eindruck auf Linie)
 Packmittelmanuskript Nr. 64000/009/94/6 Seite 2 Faltschachtel HEUMANN PHARMA GmbH & Co. Generica KG Südwestpark 50 90449 Nürnberg Urso 400 Heumann Filmtabletten mit 400 mg Ursodeoxycholsäure Zur Auflösung
Packmittelmanuskript Nr. 64000/009/94/6 Seite 2 Faltschachtel HEUMANN PHARMA GmbH & Co. Generica KG Südwestpark 50 90449 Nürnberg Urso 400 Heumann Filmtabletten mit 400 mg Ursodeoxycholsäure Zur Auflösung
PHV-issue: Codein for the treatment of cough or cold in paediatric patients
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 27.05.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 27.05.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
Pulver zur Herstellung einer Lösung zum Einnehmen, verpackt in Beuteln.
 Fachinformation 1. BEZEICHNUNG DES ARZNEIMITTELS Dulcolax M Balance 10 g Pulver zur Herstellung einer Lösung zum Einnehmen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Jeder Beutel enthält 10 g Macrogol
Fachinformation 1. BEZEICHNUNG DES ARZNEIMITTELS Dulcolax M Balance 10 g Pulver zur Herstellung einer Lösung zum Einnehmen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Jeder Beutel enthält 10 g Macrogol
Gebrauchsinformation: Information für Anwender. Cyprostol - Tabletten Wirkstoff: Misoprostol
 1 Gebrauchsinformation: Information für Anwender Cyprostol - Tabletten Wirkstoff: Misoprostol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
1 Gebrauchsinformation: Information für Anwender Cyprostol - Tabletten Wirkstoff: Misoprostol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Kamillosan -Mundspray. Kamillenblütenauszug Pfefferminzöl Anisöl
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Kamillosan -Mundspray Kamillenblütenauszug Pfefferminzöl Anisöl Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Kamillosan -Mundspray Kamillenblütenauszug Pfefferminzöl Anisöl Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
LANSOYL Paraffine Gel zum Einnehmenv3.0_B2.0 1/5
 PIL September 2015 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER LANSOYL PARAFFINE 78,230 g/100 g Gel zum Einnehmen Paraffinöl Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
PIL September 2015 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER LANSOYL PARAFFINE 78,230 g/100 g Gel zum Einnehmen Paraffinöl Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Diabetes mellitus : Folgeschäden
 Diabetes mellitus : Folgeschäden Warum ist der Diabetes mellitus eine wichtige Erkrankung? a. Akute Probleme: Hypoglykämie Hyperglykämie Ketoazidose b. Chronische Probleme: Folgeschäden: Typische Schäden:
Diabetes mellitus : Folgeschäden Warum ist der Diabetes mellitus eine wichtige Erkrankung? a. Akute Probleme: Hypoglykämie Hyperglykämie Ketoazidose b. Chronische Probleme: Folgeschäden: Typische Schäden:
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. AERIUS 5 mg Filmtabletten Desloratadin
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN AERIUS 5 mg Filmtabletten Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN AERIUS 5 mg Filmtabletten Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Mefenam 500 mg-filmtabletten 2. Qualitative und quantitative Zusammensetzung Sonstiger Bestandteil: 3. Darreichungsform
 Mefenam 500 mg-filmtabletten 2. Qualitative und quantitative Zusammensetzung 1 Filmtablette enthält 500 mg Mefenaminsäure. Sonstiger Bestandteil: 32 mg Lactose, wasserfrei. Vollständige Auflistung der
Mefenam 500 mg-filmtabletten 2. Qualitative und quantitative Zusammensetzung 1 Filmtablette enthält 500 mg Mefenaminsäure. Sonstiger Bestandteil: 32 mg Lactose, wasserfrei. Vollständige Auflistung der
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. ALLEGRATAB 120 mg Filmtabletten Fexofenadinhydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER ALLEGRATAB 120 mg Filmtabletten Fexofenadinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER ALLEGRATAB 120 mg Filmtabletten Fexofenadinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. DOLCIDIUM GE 50 mg Zäpfchen DOLCIDIUM 100 mg Zäpfchen. Indometacin
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DOLCIDIUM GE 50 mg Zäpfchen DOLCIDIUM 100 mg Zäpfchen Indometacin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DOLCIDIUM GE 50 mg Zäpfchen DOLCIDIUM 100 mg Zäpfchen Indometacin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Packungsbeilage CORSODYL Mundspüllösung / Spray 03-2012 Seite 1/5 BE106802 / BE191764 Belgien GEBRAUCHINFORMATION: INFORMATION FÜR DEN ANWENDER
 Seite 1/5 BE106802 / BE191764 Belgien GEBRAUCHINFORMATION: INFORMATION FÜR DEN ANWENDER CORSODYL 200mg/100ml mundwasser CORSODYL 200mg/100ml spray zur Anwendung in der Mundhöhle Chlorhexidindigluconat
Seite 1/5 BE106802 / BE191764 Belgien GEBRAUCHINFORMATION: INFORMATION FÜR DEN ANWENDER CORSODYL 200mg/100ml mundwasser CORSODYL 200mg/100ml spray zur Anwendung in der Mundhöhle Chlorhexidindigluconat
1. Was sind Dorithricin Halstabletten und wofür werden sie angewendet?
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Dorithricin - Halstabletten Wirkstoffe: Tyrothricin, Benzalkoniumchlorid, Benzocain Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Dorithricin - Halstabletten Wirkstoffe: Tyrothricin, Benzalkoniumchlorid, Benzocain Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Packungsbeilage GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. NUSO-SAN Menthol 1mg/ml Nasenspray, Lösung. Xylometazolinhydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER NUSO-SAN Menthol 1mg/ml Nasenspray, Lösung Xylometazolinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER NUSO-SAN Menthol 1mg/ml Nasenspray, Lösung Xylometazolinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige
Sandoz Pharmaceuticals AG
 Die Pille danach. Was ist eine Notfallverhütung oder die sogenannte «Pille danach»? 1 Wann wird NorLevo Uno eingenommen? 2 Bei der «Pille danach» handelt es sich um eine Notfallverhütung, die eine unerwünschte
Die Pille danach. Was ist eine Notfallverhütung oder die sogenannte «Pille danach»? 1 Wann wird NorLevo Uno eingenommen? 2 Bei der «Pille danach» handelt es sich um eine Notfallverhütung, die eine unerwünschte
Gebrauchsinformation: Information für Anwender. Cevitol 500 mg-kautabletten Wirkstoff: Ascorbinsäure (Vitamin C)
 Gebrauchsinformation: Information für Anwender Cevitol 500 mg-kautabletten Wirkstoff: Ascorbinsäure (Vitamin C) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Gebrauchsinformation: Information für Anwender Cevitol 500 mg-kautabletten Wirkstoff: Ascorbinsäure (Vitamin C) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Gebrauchsinformation: Information für Anwender. APOZEMA Bluthochdruck Crataegus complex Nr.10-Tropfen
 Gebrauchsinformation: Information für Anwender APOZEMA Bluthochdruck Crataegus complex Nr.10-Tropfen Wirkstoffe: Crataegus Dil. D4, Arnica Dil. D4, Aurum chloratum natronatum Dil. D5, Barium jodatum Dil.
Gebrauchsinformation: Information für Anwender APOZEMA Bluthochdruck Crataegus complex Nr.10-Tropfen Wirkstoffe: Crataegus Dil. D4, Arnica Dil. D4, Aurum chloratum natronatum Dil. D5, Barium jodatum Dil.
2. Was müssen Sie vor der Einnahme von Asa Sandoz 100 mg Tabletten beachten?
 Gebrauchsinformation: Information für den anwender Asa Sandoz 100 mg Tabletten Acetylsalicylsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
Gebrauchsinformation: Information für den anwender Asa Sandoz 100 mg Tabletten Acetylsalicylsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
1 Filmtablette enthält 500 mg Mefenaminsäure. Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1
 FI\Parkemed 500 mg Filmtabletten 1 CDS Renewal 14 03 2007 / 03 04 2009 C ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Parkemed 500 mg - Filmtabletten 2. QUALITATIVE UND
FI\Parkemed 500 mg Filmtabletten 1 CDS Renewal 14 03 2007 / 03 04 2009 C ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Parkemed 500 mg - Filmtabletten 2. QUALITATIVE UND
!!! Folgeerkrankungen
 Ein zu hoher Blutzuckerspiegel kann Folgen auf Ihr Herzkreislaufsystem haben und zu Erkrankungen wie der Schaufensterkrankheit, einer Angina pectoris, einem Herzinfarkt oder einem Schlaganfall führen.
Ein zu hoher Blutzuckerspiegel kann Folgen auf Ihr Herzkreislaufsystem haben und zu Erkrankungen wie der Schaufensterkrankheit, einer Angina pectoris, einem Herzinfarkt oder einem Schlaganfall führen.
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Androfin 5 mg - Filmtabletten Wirkstoff: Finasterid
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Androfin 5 mg - Filmtabletten Wirkstoff: Finasterid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Androfin 5 mg - Filmtabletten Wirkstoff: Finasterid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
FACHINFORMATION. 5 ml Suspension zum Einnehmen enthalten als wirksamen Bestandteil 100 mg Ibuprofen.
 FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Ibuflam Kindersaft 2 % gegen Fieber und Schmerzen 20 mg/ml Suspension zum Einnehmen Wirkstoff: Ibuprofen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Ibuflam Kindersaft 2 % gegen Fieber und Schmerzen 20 mg/ml Suspension zum Einnehmen Wirkstoff: Ibuprofen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Patientenleitfaden für das Gespräch mit dem Arzt. Liebe Patientin, lieber Patient!
 Patientenleitfaden für das Gespräch mit dem Arzt Liebe Patientin, lieber Patient! Je besser Sie sich auf das Gespräch mit Ihrem Arzt vorbereiten, desto leichter wird es für sie/ihn sein, eine Diagnose
Patientenleitfaden für das Gespräch mit dem Arzt Liebe Patientin, lieber Patient! Je besser Sie sich auf das Gespräch mit Ihrem Arzt vorbereiten, desto leichter wird es für sie/ihn sein, eine Diagnose
Atronase 0,3 mg/ml Nasenspray, Lösung (Ipratropiumbromid)
 GEBRAUCHSINFORMATION ATRONASE 0,3 MG/ML NASENSPRAY, LÖSUNG Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel ist auch ohne Verschreibung
GEBRAUCHSINFORMATION ATRONASE 0,3 MG/ML NASENSPRAY, LÖSUNG Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel ist auch ohne Verschreibung
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. AERIUS 5 mg Schmelztabletten Desloratadin
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN AERIUS 5 mg Schmelztabletten Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN AERIUS 5 mg Schmelztabletten Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Fachinformation. (Zusammenfassung der Merkmale des Arzneimittels / SPC)
 Fachinformation (Zusammenfassung der Merkmale des Arzneimittels / SPC) Spalt Kopfschmerz 1. Bezeichnung des Arzneimittels 200 mg Weichkapseln 2. Qualitative und quantitative Zusammensetzung 1 Weichkapsel
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels / SPC) Spalt Kopfschmerz 1. Bezeichnung des Arzneimittels 200 mg Weichkapseln 2. Qualitative und quantitative Zusammensetzung 1 Weichkapsel
Dontisolon D Mundheilpaste
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER 5 mg/g Paste Wirkstoff: Prednisolonacetat (Ph.Eur.) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER 5 mg/g Paste Wirkstoff: Prednisolonacetat (Ph.Eur.) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Labortests für Ihre Gesundheit. Therapie nach Maß 26
 Labortests für Ihre Gesundheit Therapie nach Maß 26 01IPF Labortests für Ihre Gesundheit Therapie nach Maß Die individuelle Dosis finden Jeder Mensch ist einzigartig. Keiner gleicht dem anderen nicht nur
Labortests für Ihre Gesundheit Therapie nach Maß 26 01IPF Labortests für Ihre Gesundheit Therapie nach Maß Die individuelle Dosis finden Jeder Mensch ist einzigartig. Keiner gleicht dem anderen nicht nur
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Prosta Albin. Wirkstoffe: Pareira brava Dil. D2, Populus tremuloides Ø, Sabal serrulatum Ø
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Prosta Albin 50 ml Mischung zum Einnehmen Wirkstoffe: Pareira brava Dil. D2, Populus tremuloides Ø, Sabal serrulatum Ø Lesen Sie bitte die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Prosta Albin 50 ml Mischung zum Einnehmen Wirkstoffe: Pareira brava Dil. D2, Populus tremuloides Ø, Sabal serrulatum Ø Lesen Sie bitte die gesamte Packungsbeilage
? Kann ich mit Karotten zu viel Vitamin A
 Schwangere aus sozial schwachen Schichten Schwangere, die alkohol-, drogen- oder nikotinabhängig sind Schwangere, die aufgrund einer chronischen Erkrankung Medikamente einnehmen müssen, welche die Nährstoffverwertung
Schwangere aus sozial schwachen Schichten Schwangere, die alkohol-, drogen- oder nikotinabhängig sind Schwangere, die aufgrund einer chronischen Erkrankung Medikamente einnehmen müssen, welche die Nährstoffverwertung
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Teufelskralle ratiopharm 480 mg Filmtabletten. Wirkstoff: Teufelskrallenwurzel-Trockenextrakt
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Teufelskralle ratiopharm 480 mg Filmtabletten Wirkstoff: Teufelskrallenwurzel-Trockenextrakt Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Teufelskralle ratiopharm 480 mg Filmtabletten Wirkstoff: Teufelskrallenwurzel-Trockenextrakt Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor
Durchfall in der Pflege. Der kleine Ratgeber von Aplona
 Durchfallerkrankungen Durchfall in der Pflege Der kleine von Aplona Der kleine von Aplona 3 Fotos: Titel, Seite 2, 3 und 4: Fotolia.com Durchfall in der Pflege Akute Durchfallerkrankungen stellen eine
Durchfallerkrankungen Durchfall in der Pflege Der kleine von Aplona Der kleine von Aplona 3 Fotos: Titel, Seite 2, 3 und 4: Fotolia.com Durchfall in der Pflege Akute Durchfallerkrankungen stellen eine
10 Antworten zum Thema Generika
 10 Antworten zum Thema Generika Die mit dem Regenbogen Liebe Leserin, Lieber Leser Immer mehr Schweizerinnen und Schweizer leiden unter den jährlich steigenden Gesundheitskosten und Krankenkassenprämien.
10 Antworten zum Thema Generika Die mit dem Regenbogen Liebe Leserin, Lieber Leser Immer mehr Schweizerinnen und Schweizer leiden unter den jährlich steigenden Gesundheitskosten und Krankenkassenprämien.
Bijsluiter DE versie Imaverol 100 mg (glas) B. PACKUNGSBEILAGE 1
 B. PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION Imaverol 100 mg, Konzentrat zur örtlichen Anwendung 1.NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE
B. PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION Imaverol 100 mg, Konzentrat zur örtlichen Anwendung 1.NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE
Wirkstoff: Der arzneilich wirksame Bestandteil ist Ibuprofen (vorliegend als Ibuprofen DL-Lysinsalz).
 Gebrauchsinformation Lesen Sie die gesamte Packungsbeilage (Gebrauchsinformation) sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel ist auch ohne ärztliche Verschreibung
Gebrauchsinformation Lesen Sie die gesamte Packungsbeilage (Gebrauchsinformation) sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel ist auch ohne ärztliche Verschreibung
Labortests für ihre Gesundheit. Gerinnungsstörungen Vorbeugung für Mutter und Kind 12
 Labortests für ihre Gesundheit Gerinnungsstörungen Vorbeugung für Mutter und Kind 12 01IPF Labortests für ihre Gesundheit Gerinnungsstörungen Vorbeugung für Mutter und Kind Schwangerschaft ist etwas Schönes:
Labortests für ihre Gesundheit Gerinnungsstörungen Vorbeugung für Mutter und Kind 12 01IPF Labortests für ihre Gesundheit Gerinnungsstörungen Vorbeugung für Mutter und Kind Schwangerschaft ist etwas Schönes:
Boehringer Ingelheim RCV GmbH & Co KG Mucosolvan 15 mg / 5 ml - Saft GI 1. 24.01.2014 / DrMü Version 4.2 C PACKUNGSBEILAGE
 1 PACKUNGSBEILAGE 2 Gebrauchsinformation: Information für Anwender Mucosolvan 15 mg / 5 ml - Saft für Kinder Wirkstoff: Ambroxolhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor
1 PACKUNGSBEILAGE 2 Gebrauchsinformation: Information für Anwender Mucosolvan 15 mg / 5 ml - Saft für Kinder Wirkstoff: Ambroxolhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Candesartan Genericon 16 mg Tabletten Wirkstoff: Candesartan Cilexetil Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Candesartan Genericon 16 mg Tabletten Wirkstoff: Candesartan Cilexetil Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
UND WOFÜR WIRD ES ANGEWENDET?
 Gebrauchsinformation: Information für den Anwender Quadronal comp. gegen Kopfschmerzen 400 mg Paracetamol und 50 mg Coffein, Tablette Zur Anwendung bei Erwachsenen und Jugendlichen ab 12 Jahren Wirkstoffe:
Gebrauchsinformation: Information für den Anwender Quadronal comp. gegen Kopfschmerzen 400 mg Paracetamol und 50 mg Coffein, Tablette Zur Anwendung bei Erwachsenen und Jugendlichen ab 12 Jahren Wirkstoffe:
Betreff: Citalopram hältige Arzneispezialitäten Änderungen der Fach- und Gebrauchsinformationen
 Datum: 15.11.2011 Kontakt: Mag. pharm. Dr. Ulrike Rehberger Abteilung: Tel. / Fax: +43(0)505 55 36258, DW.Fax-36207 E-Mail: ulrike.rehberger@ages.at Unser Zeichen: 16c-111114-23425-A-PHV Ihr Zeichen: Betreff:
Datum: 15.11.2011 Kontakt: Mag. pharm. Dr. Ulrike Rehberger Abteilung: Tel. / Fax: +43(0)505 55 36258, DW.Fax-36207 E-Mail: ulrike.rehberger@ages.at Unser Zeichen: 16c-111114-23425-A-PHV Ihr Zeichen: Betreff:
ANWEISUNGSKARTE FÜR DEN PATIENTEN
 Der Plan zur Risikobegrenzung in Belgien, zu dem diese Information gehört, ist eine Maßnahme, die ergriffen wurde, um eine sichere und wirksame Anwendung fon ZypAdhera TM zu garantieren. (RMA modifizierte
Der Plan zur Risikobegrenzung in Belgien, zu dem diese Information gehört, ist eine Maßnahme, die ergriffen wurde, um eine sichere und wirksame Anwendung fon ZypAdhera TM zu garantieren. (RMA modifizierte
Gebrauchsinformation: Information für Anwender. Delphi 0,1 % Creme Triamcinolonacetonid
 Gebrauchsinformation: Information für Anwender Delphi 0,1 % Creme Triamcinolonacetonid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Anwender Delphi 0,1 % Creme Triamcinolonacetonid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Patienten. Candeblo 16 mg-tabletten Wirkstoff: Candesartan Cilexetil
 Gebrauchsinformation: Information für Patienten Candeblo 16 mg-tabletten Wirkstoff: Candesartan Cilexetil Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
Gebrauchsinformation: Information für Patienten Candeblo 16 mg-tabletten Wirkstoff: Candesartan Cilexetil Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
PARABIO 500 mg Tabletten Wirkstoff: Paracetamol
 Eine fiktive Packungsbeilage: Das Medikament PARABIO ist erfunden. In der Apotheke kann man jedoch mehrere Medikamente kaufen, die den gleichen Wirkstoff enthalten und die für die gleiche Anwendung bestimmt
Eine fiktive Packungsbeilage: Das Medikament PARABIO ist erfunden. In der Apotheke kann man jedoch mehrere Medikamente kaufen, die den gleichen Wirkstoff enthalten und die für die gleiche Anwendung bestimmt
Supracyclin Patienteninformation genehmigt 22.8.11
 Information für Patienten und Patientinnen Lesen Sie diese Packungsbeilage sorgfältig, bevor Sie das Arzneimittel einnehmen. Dieses Arzneimittel ist Ihnen persönlich verschrieben worden, und Sie sollten
Information für Patienten und Patientinnen Lesen Sie diese Packungsbeilage sorgfältig, bevor Sie das Arzneimittel einnehmen. Dieses Arzneimittel ist Ihnen persönlich verschrieben worden, und Sie sollten
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. IBUMED 200mg Tabletten Ibuprofen
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER IBUMED 200mg Tabletten Ibuprofen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER IBUMED 200mg Tabletten Ibuprofen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel
PACKUNGSBEILAGE. CORSODYL Zahngel, 10 mg Chlorhexidin digluconat pro g Zahngel
 Seite 1/5 981 IS 153 F7 Belgien PACKUNGSBEILAGE Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Wenn Sie weitere Fragen haben, wenden Sie sich an
Seite 1/5 981 IS 153 F7 Belgien PACKUNGSBEILAGE Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Wenn Sie weitere Fragen haben, wenden Sie sich an
Ausfüllanleitung. zum indikationsspezifischen Datensatz. für das strukturierte Behandlungsprogramm KHK
 Ausfüllanleitung zum indikationsspezifischen Datensatz für das strukturierte Behandlungsprogramm KHK Stand der letzten Bearbeitung: 10-11-2014 Version 4.1 Anamnese- und Befunddaten Angina pectoris Bitte
Ausfüllanleitung zum indikationsspezifischen Datensatz für das strukturierte Behandlungsprogramm KHK Stand der letzten Bearbeitung: 10-11-2014 Version 4.1 Anamnese- und Befunddaten Angina pectoris Bitte
Gefährlich hohe Blutzuckerwerte
 Gefährlich hohe Blutzuckerwerte In besonderen Situationen kann der Blutzuckerspiegel gefährlich ansteigen Wenn in Ausnahmefällen der Blutzuckerspiegel sehr hoch ansteigt, dann kann das für Sie gefährlich
Gefährlich hohe Blutzuckerwerte In besonderen Situationen kann der Blutzuckerspiegel gefährlich ansteigen Wenn in Ausnahmefällen der Blutzuckerspiegel sehr hoch ansteigt, dann kann das für Sie gefährlich
IMPLANON NXT Erläuternde Broschüre für Patientinnen
 Die Markteinführung von IMPLANON NXT wurde von den belgischen Gesundheitsbehörden an bestimmte Bedingungen geknüpft. Der vorgeschriebene Plan zur Risikominimierung in Belgien, der auch das vorliegende
Die Markteinführung von IMPLANON NXT wurde von den belgischen Gesundheitsbehörden an bestimmte Bedingungen geknüpft. Der vorgeschriebene Plan zur Risikominimierung in Belgien, der auch das vorliegende
Boehringer Ingelheim RCV GmbH & Co KG 06.10.2010 / Mac GI Mucosolvan 15 mg - Lutschpastillen Version 2.0 C 1 PACKUNGSBEILAGE
 Mucosolvan 15 mg - Lutschpastillen Version 2.0 C 1 PACKUNGSBEILAGE Mucosolvan 15 mg - Lutschpastillen Version 2.0 C 2 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Mucosolvan 15 mg - Lutschpastillen
Mucosolvan 15 mg - Lutschpastillen Version 2.0 C 1 PACKUNGSBEILAGE Mucosolvan 15 mg - Lutschpastillen Version 2.0 C 2 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Mucosolvan 15 mg - Lutschpastillen
PACKUNGSBEILAGE. Bisolvon Hustenlöser - Saft Version 4.1 1
 PACKUNGSBEILAGE Bisolvon Hustenlöser - Saft Version 4.1 1 Gebrauchsinformation: Information für Patienten Bisolvon Hustenlöser - Saft Wirkstoff: Bromhexinhydrochlorid Lesen Sie die gesamte Packungsbeilage
PACKUNGSBEILAGE Bisolvon Hustenlöser - Saft Version 4.1 1 Gebrauchsinformation: Information für Patienten Bisolvon Hustenlöser - Saft Wirkstoff: Bromhexinhydrochlorid Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Postinor 750 Mikrogramm Tabletten Levonorgestrel
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Postinor 750 Mikrogramm Tabletten Levonorgestrel Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Postinor 750 Mikrogramm Tabletten Levonorgestrel Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Candesartan Zentiva 16 mg Tabletten Wirkstoff: Candesartancilexetil Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Gebrauchsinformation: Information für Anwender Candesartan Zentiva 16 mg Tabletten Wirkstoff: Candesartancilexetil Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Patienteninformation Ich bin schwanger. Warum wird allen schwangeren Frauen ein Test auf
 Patienteninformation Ich bin schwanger. Warum wird allen schwangeren Frauen ein Test auf Schwangerschaftsdiabetes angeboten? Liebe Leserin, dieses Merkblatt erläutert, warum allen Schwangeren ein Test
Patienteninformation Ich bin schwanger. Warum wird allen schwangeren Frauen ein Test auf Schwangerschaftsdiabetes angeboten? Liebe Leserin, dieses Merkblatt erläutert, warum allen Schwangeren ein Test
Was ist AURORIX und wofür wird es angewendet? Was müssen Sie vor der Einnahme von AURORIX beachten?
 Was ist AURORIX und wofür wird es angewendet? AURORIX ist ein Arzneimittel zur Behandlung von Depressionen und bestimmten Angstzuständen (Sozialphobie). Moclobemid, der Wirkstoff von AURORIX, wirkt antriebssteigernd
Was ist AURORIX und wofür wird es angewendet? AURORIX ist ein Arzneimittel zur Behandlung von Depressionen und bestimmten Angstzuständen (Sozialphobie). Moclobemid, der Wirkstoff von AURORIX, wirkt antriebssteigernd
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Aricept 5 mg Filmtabletten Wirkstoff: Donepezilhydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Aricept 5 mg Filmtabletten Wirkstoff: Donepezilhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Aricept 5 mg Filmtabletten Wirkstoff: Donepezilhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER SINUTAB 500/30 mg Tabletten SINUTAB FORTE 500/60 mg Tabletten Paracetamol und Pseudoephedrinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER SINUTAB 500/30 mg Tabletten SINUTAB FORTE 500/60 mg Tabletten Paracetamol und Pseudoephedrinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig
Wenn Ihnen etwas auf den Magen schlägt, dann schlagen Sie zurück! Aber fragen Sie vorher besser Ihren Apotheker!
 Wenn Ihnen etwas auf den Magen schlägt, dann schlagen Sie zurück! Aber fragen Sie vorher besser Ihren Apotheker! Selbstmedikation Selbstmedikation ist ein weltweiter Trend Selbstmedikation ist praktisch
Wenn Ihnen etwas auf den Magen schlägt, dann schlagen Sie zurück! Aber fragen Sie vorher besser Ihren Apotheker! Selbstmedikation Selbstmedikation ist ein weltweiter Trend Selbstmedikation ist praktisch
Ausdruck 1 Kuchendiagramm Drogen
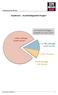 Ausdruck 1 Kuchendiagramm Drogen 1 Ausdruck 2 Auflösung Kuchendiagramm Drogen 2 Ausdruck 3 Gebrauchsinformation Alkohol A l k o h o l Wirkstoff: Ethanol C2H5OH Arzneimittel müssen für Kinder unzugänglich
Ausdruck 1 Kuchendiagramm Drogen 1 Ausdruck 2 Auflösung Kuchendiagramm Drogen 2 Ausdruck 3 Gebrauchsinformation Alkohol A l k o h o l Wirkstoff: Ethanol C2H5OH Arzneimittel müssen für Kinder unzugänglich
Besser leben mit Gicht. Seite 3 Seite 4 Seite 5 Seite 6. Zu starke Schweißbildung. besser natürlich behandeln. Gicht-Telegramm
 Besser leben mit Gicht GT II-2014 Seite 3 Seite 4 Seite 5 Seite 6 Purinrechner jetzt auf i-phone und Android Warnung vor dem Einsatz von NSAR wie Diclofenac Zu starke Schweißbildung besser natürlich behandeln
Besser leben mit Gicht GT II-2014 Seite 3 Seite 4 Seite 5 Seite 6 Purinrechner jetzt auf i-phone und Android Warnung vor dem Einsatz von NSAR wie Diclofenac Zu starke Schweißbildung besser natürlich behandeln
Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva
 Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva Darmstadt (19. Februar 2009) Die Merck KGaA hat heute bekannt gegeben, dass die europäische Arzneimittelbehörde EMEA
Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva Darmstadt (19. Februar 2009) Die Merck KGaA hat heute bekannt gegeben, dass die europäische Arzneimittelbehörde EMEA
Fachinformation. (Zusammenfassung der Merkmale des Arzneimittels / SPC) schwerer Leberfunktionsstörung s. Abschnitt 4.3).
 Fachinformation (Zusammenfassung der Merkmale des Arzneimittels / SPC) Spalt Migräne 1. Bezeichnung des Arzneimittels Spalt Migräne 400 mg Weichkapseln 2. Qualitative und quantitative Zusammensetzung 1
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels / SPC) Spalt Migräne 1. Bezeichnung des Arzneimittels Spalt Migräne 400 mg Weichkapseln 2. Qualitative und quantitative Zusammensetzung 1
Gebrauchsinformation: Information für Anwender. LIVOSTIN - Augentropfen Wirkstoff: Levocabastin-Hydrochlorid
 Gebrauchsinformation: Information für Anwender LIVOSTIN - Augentropfen Wirkstoff: Levocabastin-Hydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Anwender LIVOSTIN - Augentropfen Wirkstoff: Levocabastin-Hydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Vibrocil Nasenspray. Phenylephrin, Dimetindenmaleat
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Vibrocil Nasenspray Phenylephrin, Dimetindenmaleat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Vibrocil Nasenspray Phenylephrin, Dimetindenmaleat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Fragebogen Kopfschmerzen
 Fragebogen Kopfschmerzen Fragen an Dich Fragen an Dich Fragen an die Eltern Bei diesen Fragen geht es um Deine Kopfschmerzen. Es wäre schön, wenn Du darüber etwas sagst. Deine Antworten helfen, für Deine
Fragebogen Kopfschmerzen Fragen an Dich Fragen an Dich Fragen an die Eltern Bei diesen Fragen geht es um Deine Kopfschmerzen. Es wäre schön, wenn Du darüber etwas sagst. Deine Antworten helfen, für Deine
Ärzte sollten bei allen Patienten, vor einem Behandlungsbeginn mit Prolia, mögliche Risikofaktoren für Kieferosteonekrosen evaluieren.
 München, 03.09.2014 Prolia 60 mg (Denosumab) Wichtige aktualisierte Informationen für Angehörige der medizinischen Heilberufe, um die Risiken für das Auftreten von Kieferosteonekrosen und n zu minimieren.
München, 03.09.2014 Prolia 60 mg (Denosumab) Wichtige aktualisierte Informationen für Angehörige der medizinischen Heilberufe, um die Risiken für das Auftreten von Kieferosteonekrosen und n zu minimieren.
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Clarityn 10 mg - Brausetabletten Wirkstoff: Loratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Clarityn 10 mg - Brausetabletten Wirkstoff: Loratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Levetiracetam +pharma 500 mg Filmtabletten. Wirkstoff: Levetiracetam
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Levetiracetam +pharma 500 mg Filmtabletten Wirkstoff: Levetiracetam Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Levetiracetam +pharma 500 mg Filmtabletten Wirkstoff: Levetiracetam Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
