Chromoprobe Multiprobe -T System
|
|
|
- Jakob Weiß
- vor 8 Jahren
- Abrufe
Transkript
1 5. 500µl Counterstain (DAPI antifade (ES: 0.125µg/ml DAPI (4,6-diamidino- 2-phenylindole)) 6. 1 Cytocell Slide Surface Thermometer 7. 1 Cytocell Chromoprobe Multiprobe Hybridisation Chamber Warnings and Precautions 1. For in vitro diagnostic use. For professional use only. 2. Wear gloves when handling DNA probes and DAPI counterstain. 3. Hybridisation Solution contains formamide, which is a teratogen; do not breathe fumes or allow skin contact. Wear gloves, a lab coat, and handle in a fume hood. Upon disposal, flush with a large volume of water. 4. DAPI is a potential carcinogen. Handle with care; wear gloves and a lab coat. Upon disposal, flush with a large volume of water. 5. All hazardous materials should be disposed of according to your institution s guidelines for hazardous waste disposal. Instructions For Use REF: PMP 009 / PMP 008 / PMP 007 Chromoprobe Multiprobe -T System FOR PROFESSIONAL USE ONLY ENGLISH/FRANÇAIS/ITALIANO/DEUTSCH/ESPAÑOL Further information available at Fluorescence In Situ Hybridisation (FISH) is a technique that allows DNA sequences to be detected on metaphase chromosomes or in interphase nuclei from fixed cytogenetic samples. The technique uses DNA probes that hybridise to entire chromosomes or single unique sequences, and serves as a powerful adjunct to classic cytogenetics. Recent developments have meant that this valuable technique can now be applied as an essential diagnostic tool in prenatal, haematological and pathological chromosomal analysis. Target DNA, after fixation and denaturation, is available for annealing to a similarly denatured, fluorescently labelled DNA probe, which has a complementary sequence. Following hybridisation, unbound and non-specifically bound DNA probe is removed and the DNA is counterstained for visualisation. Fluorescence microscopy then allows the visualisation of the hybridised probe on the target material. Probe Information Chromosomal rearrangements involving the ends of chromosomes have emerged as an important cause of genetic disease given the gene-rich nature of the regions adjacent to the telomeres 1. The importance of such subtelomeric chromosome rearrangements has been clearly shown by their observed association with unexplained mental retardation and congenital abnormalities 2. Individual subtelomere specific probes have been used to focus on particular subtelomeric regions, and have resulted in the establishment of syndromes such as the chromosome 36 deletion syndrome 3,10 and the 13.3 deletion syndrome 4. The probes are also finding applications in the investigation of autistic disorders 5, recurrent miscarriages 6 and haematological malignancies 7. Cytocell's subtelomere specific probes are located in the most distal region of chromosome specific DNA on each chromosome. Beyond this unique sequence material is the 100 to 300Kb region of telomere associated repeat followed by the cap of between 3 to 20Kb of tandemly repeated (TTAGGG) n sequence 8. The probes have been chosen from the most distal unique sequence to provide the best possible specificity, whilst also being applicable for routine use for the examination of subtelomeric enumeration and integrity. The original second-generation set of probes is derived from PAC clones 9 and was established in conjunction with the Institute of Molecular Medicine, part of Oxford University, in the UK 11. Continuing product improvements have led to some substitutions with alternative cosmid (35-40Kb) or BAC (150Kb) clones to give improved signal strength or chromosome specificity. The average probe size is therefore 100Kb, and all have been mapped to within a maximum of 600Kb of the true telomere. Probe Specification Each square of the Chromoprobe Multiprobe -T device carries subtelomere specific probes for both the p-arm and the q-arm of one of the 23 chromosomes (except for the acrocentric chromosomes). The p-arm and the q-arm probes for each chromosome are labelled in different colours with two spectrally independent fluorophores (p-arms in green and q-arms in red respectively). These are located together in the corresponding Multiprobe square. This format provides each other with an internal hybridisation control and effective chromosome identification. Materials Provided Each kit contains the following reagents, which are sufficient for either 2 (PMP 009), 5 (PMP 008) or 10 (PMP 007) patient samples: 1. 2, 5 or 10 Chromoprobe Multiprobe -T devices coated with 42 directly labelled subtelomeric probes (minimum of 20ng of probe per square). 2. 4, 7 or 12 glass slides printed with a special template 3. 4, 7 or 12 large coverslips (24x60mm) µl Hybridisation Solution (Formamide, Dextran Sulphate, SSC) Storage and Handling The Chromoprobe Multiprobe kit should be stored at 2-8ºC until the expiry date indicated on the kit label. Do not freeze. The counterstain vial must be stored in the dark. Equipment Necessary but not Supplied 1. Hotplate (with a solid plate and accurate temperature control up to 80ºC). 2. Variable volume micropipettes and tips range 1µl - 200µl. 3. Water bath with accurate temperature control at 72ºC. 4. Microcentrifuge tubes (0.5ml). 5. Fluorescence microscope (Please see Fluorescence Microscope Recommendation section). 6. Plastic or glass coplin jars. 7. Forceps. 8. Fluorescence grade microscope lens immersion oil. 9. Bench top centrifuge. 10. Timer ºC water bath without stirrer. Fluorescence Microscope Recommendation For optimal visualisation of the probe we recommend a 100-watt mercury lamp and plan apochromat objectives x63 or x100. The Triple bandpass filter DAPI/FITC/Texas Red is optimal for viewing all fluorophores and DAPI simultaneously. Sample Preparation The Chromoprobe Multiprobe -T is designed for use on cultured peripheral blood cells fixed in Carnoy s fixative that should be prepared according to the laboratory or institution guidelines. Prepare air dried samples on Cytocell Chromoprobe Multiprobe template slides according to Cytocell s protocol below. Baking or otherwise ageing slides is not recommended as it may reduce signal fluorescence. Chromoprobe Multiprobe Protocol Please note: The probes used on the Chromoprobe Multiprobe device are directly labelled with fluorophores, which are light sensitive. Ensure that exposure of the probes to laboratory lights is limited at all times (it is not necessary to work in the dark). 1. Slide preparation a) Clean a template slide. Soak the template slide for 2 minutes in 100% methanol and polish dry with a clean soft tissue. b) Establish the correct mitotic index. It is important that the intended sample has a sufficiently high mitotic index to allow detection of chromosome abnormalities. To check the density of the sample, using a micropipette (e.g. a Gilson P10 or P20) pipette 2µl of the cell suspension onto one of the areas of the spare template slide and allow to air dry. The small volume used means that you usually have to gently touch the slide with the pipette tip to transfer the suspension. Examine by phase contrast microscopy. If the cell density is too high, dilute the suspension with fresh fixative. If the mitotic index is too low, spin down the fixed cell suspension at 160xg for 10 minutes. Note the volume of supernatant, remove, and resuspend the cell pellet in a smaller volume of fresh fixative. If cell sample density has been altered, spot 2µl of the concentrated sample onto another square of your test slide and re-examine by phase contrast microscopy. Please Note: 50µl is the minimum volume required for the protocol. c) Quality control of samples. Samples should be examined for cytoplasm since this will interfere with the in situ protocol. If the chromosomes appear to be enclosed by a granular material when examined under phase contrast microscopy, then this will compromise results. One method for reducing cytoplasm is to spot 2µl of your sample onto the template slide and watch the fixative as it spreads out: in the normal situation, the fixative will spread to maximum, recede and then evaporate. To clean up any cytoplasm we have found that effective results are achieved if a fresh drop of fixative is allowed to fall onto the spot at the point when the spreading fixative has reached its maximum. Allow the drop of fixative to evaporate and re-examine the spot. d) Spotting of the slide. Pipette 2µl of cell suspension onto all 24 areas of the template slide in a sequence of alternating squares as shown below. This will prevent the cell spreads from interfering with each other. Page 1 of 9
2 e) Once the first group of drops has air-dried, spot the remaining squares with 2µl drops in the same manner. After the slide has dried, examination of the slide under phase contrast will reveal whether any squares have been missed. If spots have been missed, or squares have too few cells, simply spot those squares again: it is not necessary to re-spot a new slide. If upon examination of the slide, a square has insufficient cells/metaphases, further drop(s) of suspension can be added to increase the cell density. Please note: If the metaphases appear overspread, then clean a new template slide thoroughly in methanol and re-spot allowing every spot to dry before proceeding to the next. 2. Preparation of the Chromoprobe Multiprobe device and template slide a) Ensure that the Chromoprobe Multiprobe Hybridisation Chamber is in the 37ºC water bath and allow it to equilibrate to 37ºC (+/- 1ºC). This may take up to an hour if the water bath has been switched on from cold. b) Mix the hybridisation solution by repeated pipetting and pre-warm a 25µl aliquot per device to 37ºC. Also pre-warm each device by placing it on a 37ºC hotplate label side down. Do not touch the raised surfaces of the device. c) Immerse template slides containing fixed samples in 2xSSC for 2 minutes at room temperature (RT) without agitation. d) Whilst the device is still at 37ºC, dehydrate template slides containing fixed samples through an ethanol series (2 minutes each in 70%, 85% and 100%) at RT, air dry and place at 37ºC hotplate to warm up. e) Add 1µl of pre-warmed hybridisation solution to each of the 24 areas on the pre-warmed device using a P10 micropipette while it remains on a 37ºC hotplate. 3. Positioning of the template slide over the device a) Carefully invert the template slide over the device such that the number 1, which is now upside down, is located over the top right hand area of the device (Figure 1). Figure 1. Location of the probes on the Chromoprobe Multiprobe -T System. To help locate square 1, its position on the device has been marked with a coloured label. b) Make sure that the template slide is carefully aligned with the matching areas on the device. Carefully lower the slide over the device so that the drops of hybridisation solution make contact with the slide. Apply gentle, even pressure to ensure that the hybridisation solution is spread to the edges of each of the raised areas on the device. c) Lift the slide carefully holding the frosted end of the glass slide and invert so that the template slide is underneath the device. Make sure the device does not smear across the template slide as this could cause crosscontamination of the probes. d) Place at 37ºC (+/- 1ºC) (hotplate or incubator) for 10 minutes. 4. Instructions for use of the Cytocell Slide Surface Thermometer a) The temperature of the 75ºC hotplate should be checked with the Cytocell Slide Surface Thermometer before proceeding to denaturation. b) To use the thermometer properly, place it onto the surface of the hotplate and wait until the different segments stop changing colour. The actual temperature is indicated by a deep aqua colour. Please note: c) When the segments appear granular and the colours no longer appear uniform and regular, the thermometer should be discarded as it is exhausted. The life span of each thermometer should, however, easily be sufficient for a ten-device kit. d) This thermometer is a liquid crystal device and although reusable, it must be treated with care to ensure a reasonable life span. The thermometer must only be used to check the temperature of a hotplate; it must not be used to monitor the hotplate performance over time. 5. Denaturation Please note: A PCR thermal cycler-heating block is NOT suitable for use in place of solid bed hotplate for this procedure. a) Transfer the slide/device sandwich to the hotplate taking particular care to hold it level. Ensure the sample slide is in good contact with the hotplate. b) Denature on the hotplate at 75ºC (+/- 1ºC) for 2 minutes. 6. Hybridisation Place the slide/device sandwich in the pre-warmed Chromoprobe Multiprobe Hybridisation Chamber, replace the lid and float the chamber in the 37ºC (+/- 1ºC) water bath (non-stirring) overnight. Please note: a) Do not seal the lid on the hybridisation chamber. b) Do not place a lid on the water bath. c) Do not hybridise in an incubator d) Please ensure that the hybridisation chamber is completely dry (i.e. no water or damp tissue inside the chamber). The humidity inside the chamber is vital for optimal hybridisation. The correct levels will be achieved following those steps. 7. Post-hybridisation stringent washes Please note: Avoid processing more than two slides through the stringency washes at any one time. a) Remove the device carefully from the slide. b) Immerse the slide in 0.4xSSC (ph 7.0) at 72ºC (+/- 1ºC) for 2 minutes without agitation. c) Drain the slide and immerse it in 2xSSC, 0.05% Tween-20 at RT (ph 7.0) for 30 seconds without agitation. 8. Mounting and visualisation of results a) Drain the slide and apply 20µl of DAPI antifade to each end of the slide. b) Cover with a coverslip (24x60mm), remove any bubbles and allow the colour to develop in the dark for 10 minutes. c) View with a fluorescence microscope. Please note: Certain types of microscope have slide holders, which make it difficult to view the extreme ends of the slide. If this occurs then simply turn the slide through 180, which will help with the viewing of the slide. Stability of Finished Slides FISHed slides remain analysable for up to 1 month if stored in the dark at/or below RT. Procedural Recommendations 1. Baking or ageing of slides is not recommended as it may reduce signal fluorescence. 2. Hybridisation conditions may be adversely affected by the use of reagents other than those provided or recommended by Cytocell Ltd. 3. The use of a calibrated thermometer is strongly recommended for measuring temperatures of solutions, waterbaths, and incubators as these temperatures are critical for optimum product performance. 4. The wash concentrations, ph and temperatures are important as low stringency can result in non-specific binding of the probe and too high stringency can result in a lack of signal. 5. Incomplete denaturation can result in lack of signal and over denaturation can also result in non-specific binding. Expected Results 1. A normal sample will show a signal in the telomeric region of each of the relevant chromosome homologues, or 2 signals in interphase cells. 2. The PAC (dj1011o17) detects the common polymorphism described by Macina et al in Should a deletion be detected, studies have stressed the importance of testing the deletion by FISH using a second probe mapping to the region 13 and to test the parents to determine its inheritance 14. To this end, the second BAC, 172I13, D2S447, which is more proximal and labelled in red, has been incorporated on square Y of the device. It is supplied with a control probe (ter) labelled in green. It must be stressed, however, that although further studies have been facilitated by the provision of the second clone on square Y of the device, any apparent deletions must be followed-up with testing of other family members to prevent the misinterpretation of a clinically significant distal deletion as a polymorphism or normal variant. Probe Known cross-hybridisations with and with,, 1 and with with 1 (interstitial) with and with and with with (interstitial) Limitations Reporting and interpretation of FISH results should be consistent with professional standards of practice and should take into consideration other clinical and diagnostic information. This kit is intended as an adjunct to other diagnostic laboratory tests and therapeutic action should not be initiated on the basis of the FISH result alone. Additional Information For additional product information please contact the Cytocell Technical Support Department. FRANÇAIS L hybridation in situ par fluorescence (FISH) est une technique qui permet de détecter des séquences ADN sur les chromosomes en métaphase ou sur les noyaux interphasiques d échantillons cytogénétiques fixés cultivés ou non cultivés. La technique utilise des sondes ADN qui s hybrident aux chromosomes entiers ou à des séquences spécifiques, et sert de test complémentaire à la cytogénétique classique. De récents développements ont démontré que cette technique informative peut maintenant être utilisée comme un outil diagnostic essentiel lors de l analyse des chromosomes en prénatal, hématologie et pathologie. L ADN cible, après fixation, est traité par la chaleur et à la formamide pour dénaturer la double hélice, la rendant simple hélice. L ADN cible est alors disponible pour hybridation avec une sonde ADN complémentaire simple brin, dénaturée de la même manière et marquée avec un fluorochrome. Après l hybridation, l ADN non hybridé et l ADN non lié spécifiquement sont éliminés par une série de lavages stringents et l ADN est ensuite contre-coloré. Un Page 2 of 9
3 microscope à fluorescence permet ensuite la visualisation de la sonde hybridée sur l ADN cible. Informations sur les sondes Les réarrangements chromosomiques impliquant les extrémités des chromosomes sont apparus comme une cause importante de maladies génétiques, compte tenu de la richesse en gènes des régions adjacentes aux télomères 1. L importance de tels réarrangements subtélomériques des chromosomes a été clairement été démontrée en observant de leur association avec des retards mentaux inexpliqués et des anomalies congénitales 2. Les sondes spécifiques pour les régions subtélomériques individuelles ont été utilisées pour cibler des régions subtélomériques particulières et elles ont permis la caractérisation de syndromes tels que les syndromes délétionnels 36 3,10 et Les sondes trouvent également des applications dans la recherche sur les troubles autistiques 5, les fausses couches récurrentes 6 et les hémopathies malignes 7. Les sondes spécifiques des régions subtélomériques de Cytocell couvrent la région la plus distale de l ADN chromosomique spécifique de chaque chromosome. Au-delà de ce matériel de séquence unique se trouve la région de répétition associée au télomère (100 à 300Kb), suivie par la coiffe télomérique (3 à 20Kb), formée de répétitions en tandem (TTAGGG) 8 n. Les sondes ont été choisies parmi la séquence unique la plus distale, pour fournir la meilleure spécificité possible, tout en pouvant également servir à l examen systématique du dénombrement et de l intégrité des séquences subtélomériques. L ensemble de sondes original de deuxième génération est dérivé de clones PAC 9 et a été élaboré en collaboration avec l Institut de médecine moléculaire de l'université d'oxford, au Royaume-Uni 11. Les améliorations continues du produit ont conduit à certaines substitutions par d autres clones de cosmide (35-40Kb) ou BAC (150Kb) permettant d obtenir une meilleure intensité du signal ou une meilleure spécificité chromosomique. La taille moyenne des sondes est donc de 100Kb, et toutes sont localisées à 600Kb maximum du télomère véritable. Caractéristiques de la sonde Chaque case du dispositif Chromoprobe Multiprobe-T comporte des sondes spécifiques des régions subtélomériques pour le bras court (p) et le bras long (q) de l un des 23 chromosomes (à l'exception des chromosomes acrocentriques). Les sondes p et q de chaque chromosome sont marquées par des couleurs différentes au moyen de deux fluorophores dont les spectres sont distincts (p en vert et q en rouge, respectivement). Celles-ci sont regroupées dans la case de sondes multiples correspondante. Ce format fournit mutuellement un contrôle d hybridation interne et une identification efficace des chromosomes. Conditionnement Chaque trousse contient les réactifs nécessaires pour tester 2 (PMP 009), 5 (PMP 008) ou 10 (PMP 007) échantillons de patient : 1. 2, 5 ou 10 dispositifs Chromoprobe Multiprobe -T comportant 42 sondes subtélomériques directement marquées (minimum de 20ng de sonde par case). 2. 4, 7 ou 12 lames en verre imprimées avec un motif particulier. 3. 4, 7 ou 12 grandes lamelles (24x60mm) µl de solution d'hybridation (formamide, sulfate de dextrane, SSC) µl de contre-colorant (DAPI antifade (ES: 0,125µg/mL DAPI (4,6-diamidino-2- phénylindole)) 6. 1 thermomètre de surface (Cytocell Slide Surface Thermometer) 7. 1 chambre d hybridation Cytocell Chromoprobe Multiprobe Avertissements et précautions 1. Pour utilisation en diagnostic in vitro. Pour usage professionnel uniquement. 2. Porter des gants lors de la manipulation des sondes ADN et du contre-colorant DAPI. 3. La solution d'hybridation contient du formamide, qui est un agent tératogène ; ne pas inhaler les vapeurs et éviter un contact avec la peau. Porter des gants, une blouse de laboratoire, et manipuler sous une hotte. Après élimination, rincer abondamment avec de l eau. 4. Le DAPI est un carcinogène potentiel. Manipuler avec précaution. Porter des gants et une blouse de laboratoire. Après élimination, rincer abondamment avec de l eau. 5. Toutes matières dangereuses doivent être éliminées selon les réglementations en vigueur dans votre institution pour l élimination des déchets dangereux. Conservation et manipulation La trousse Chromoprobe Multiprobe doit être conservée entre 2 et 8ºC jusqu'à la date de péremption indiquée sur l étiquette de la trousse. Ne pas congeler. Le flacon de contrecolorant doit être conservé dans l obscurité. Equipement nécessaire non fourni 1. Plaque chauffante (avec bloc et contrôle de la température jusqu à 80ºC). 2. Micropipettes 1µl - 200µl. 3. Bain-marie avec contrôle de la température à 72ºC. 4. Tubes à microcentrifugation (0.5ml). 5. Microscope à fluorescence (Voir la section Microscope et filtres). 6. Jarres en plastique ou en verre. 7. Forceps. 8. Huile à immersion pour microscope à fluorescence. 9. Centrifugeuse de paillasse. 10. Chronomètre. 11. Bain-marie à 37ºC sans agitateur. Microscope et filtres Pour une visualisation optimale de la sonde, nous recommandons l utilisation d une lampe à mercure de 100-watts et d objectifs plan apochromatiques x63 or x100. Le filtre triple bande DAPI/FITC/Texas Red est optimal pour la visualisation des 3 fluorochromes simultanément. Préparation des échantillons La trousse Chromoprobe Multiprobe -T est conçue pour une utilisation sur des cellules de sang périphérique cultivées, fixées avec le fixateur de Carnoy et devant être préparées selon les protocoles en vigueur dans le laboratoire ou l institution. Préparer les échantillons séchés à l air sur les lames échantillons Cytocell Chromoprobe Multiprobe selon le protocole Cytocell ci-dessous. La cuisson ou le vieillissement des lames n est pas recommandé, ceci pouvant réduire l intensité du signal fluorescent. Protocole Chromoprobe Multiprobe Remarque : les sondes utilisées pour le dispositif Chromoprobe Multiprobe sont directement marquées avec des fluorophores photosensibles. S'assurer que l exposition des sondes aux lumières du laboratoire est limitée en permanence (il n'est pas nécessaire de travailler dans l obscurité). 1. Préparation des lames a) Nettoyage d une lame échantillon. Plonger la lame échantillon dans un bain méthanol 100% pendant 2 minutes et sécher avec un tissu doux. b) Définir l index mitotique correct. Il est important que l échantillon ait un index mitotique élevé afin de permettre la détection d anomalies chromosomiques. Pour vérifier la densité de l échantillon, utiliser une micropipette (par exemple, Gilson P10 ou P20), pipeter 2µl de suspension cellulaire et déposer sur l une des surfaces de la lame échantillon de réserve, puis laisser sécher à l air. Vu le petit volume utilisé, vous devez généralement toucher légèrement la lame avec l embout de la pipette pour transférer la suspension. Examiner avec un microscope à contraste de phase. Si la densité cellulaire est trop élevée, diluer la suspension avec du fixateur frais. Si l index mitotique est trop faible, centrifuger la suspension de cellules fixées à 160g pendant 10 minutes. Noter le volume de surnageant, éliminer le et resuspendre le culot cellulaire dans un plus faible volume de fixateur frais. Si la densité de l échantillon cellulaire a été modifiée, déposer 2µl de l échantillon concentré sur une autre case de votre lame d essai, et vérifier de nouveau au microscope à contraste de phase. Remarque : un volume minimum de 50µl est requis par le protocole. c) Contrôle de la qualité des échantillons. Les échantillons doivent être examinés afin de s assurer de l absence de cytoplasme, celui-ci pouvant perturber le protocole in situ. Si les chromosomes semblent être enveloppés par une substance granulaire lors de l examen au microscope à contraste de phase, les résultats seront compromis. Une méthode pour réduire le cytoplasme consiste à déposer 2µl d échantillon sur la lame échantillon et observer la façon dont le fixateur s étale. Normalement, le fixateur s étale au maximum, se rétracte, puis s évapore. Pour éliminer le cytoplasme, nous avons constaté que des résultats efficaces sont obtenus si l on dépose une goutte de fixateur frais sur le dépôt lorsque l étalement du fixateur est maximal. Laisser la goutte de fixateur s évaporer et examiner de nouveau le dépôt. d) Dépôt sur la lame. Pipeter et déposer 2µl de suspension cellulaire sur chacune des 24 cases de la lame échantillon, selon un motif en quinconce comme illustré cidessous. Ceci évitera que les gouttes de suspension cellulaire interfèrent entre elles lors de leur étalement. e) Lorsque le premier groupe de gouttes a séché, déposer de la même façon 2µl de suspension cellulaire dans les cases restantes. Lorsque la lame est sèche, un examen de la lame en contraste de phase permettra de s assurer qu aucune case n a été oubliée. S il manque des gouttes, ou si des cases comportent trop peu de cellules, redéposer simplement d autres gouttes sur ces cases. Il n'est pas nécessaire de repréparer une nouvelle lame. Si après examen de la lame, une case ne présente pas suffisamment de cellules/métaphases, il est possible de redéposer d autres gouttes de suspension afin d augmenter la densité cellulaire. Remarque : si les métaphases semblent sur-étalées, nettoyer complètement une nouvelle lame échantillon dans du méthanol et effectuer un nouveau dépôt, puis laisser sécher chaque goutte avant de passer au dépôt suivant. 2. Préparation du dispositif Chromoprobe Multiprobe et de la lame échantillon a) Vérifier que la chambre d hybridation Chromoprobe Multiprobe se trouve dans un bain-marie à 37ºC et laisser équilibrer à 37 C (+/- 1ºC). Ceci peut prendre jusqu'à une heure au maximum si le bain-marie était froid au départ. b) Mélanger la solution d'hybridation en pipetant plusieurs fois et préchauffer un aliquote de 25µl par dispositif à 37ºC. Préchauffer également chaque dispositif en le plaçant sur une plaque chauffante à 37ºC et en vérifiant que l étiquette est placée au-dessous. Ne pas toucher les surfaces hautes du dispositif. c) Plonger les lames comportant les échantillons fixés dans du tampon 2xSSC pendant 2 minutes, à température ambiante sans agitation. d) Alors que le dispositif est toujours à 37ºC, déshydrater les lames comportant les échantillons fixés dans une série de bains d éthanol (2 minutes dans chaque bain, 70%, 85% et 100%) à température ambiante, laisser sécher à l air et placer sur la plaque chauffante à 37ºC pour démarrer. e) Ajouter 1µl de solution d'hybridation préchauffée sur chacune des 24 cases du dispositif préchauffé à l'aide d une micropipette P10 pendant que celui-ci est encore sur la plaque chauffante à 37ºC. 3. Positionnement de la lame échantillon sur le dispositif a) Retourner délicatement la lame échantillon sur le dispositif, de telle sorte que la case numéro 1, qui est à présent inversée, soit positionnée en haut et à droite du dispositif (figure 1). 2 Figure 1. Emplacement des sondes sur le dispositif Chromoprobe Multiprobe -T. Pour faciliter la localisation de la case 1, sa position sur le dispositif a été marquée avec une étiquette de couleur. b) Veillez à ce que la lame échantillon soit bien alignée sur les cases complémentaires du dispositif. Appliquer délicatement la lame sur le dispositif afin que les gouttes de solution d'hybridation entrent en contact avec la lame. Appuyer légèrement en exerçant la même pression, afin de garantir que la solution d'hybridation est étalée sur les bords de chacune des surfaces hautes du dispositif. c) Soulever délicatement la lame en tenant l extrémité dépolie de la lame de verre et retourner afin que la lame échantillon soit en dessous du dispositif. S'assurer que le dispositif ne glisse pas sur la lame échantillon, car ceci pourrait entraîner des contaminations croisées entre les sondes. d) Placer à 37ºC (+/- 1ºC) (plaque chauffante ou incubateur) pendant 10 minutes. 4. Mode d'emploi du thermomètre Cytocell Slide Surface Thermometer a) La température de la plaque chauffante (75ºC) doit être vérifiée avec le thermomètre Cytocell Slide Surface Thermometer avant de procéder à l étape de dénaturation. b) Pour utiliser le thermomètre correctement, le placer sur la surface de la plaque chauffante et attendre que les différents segments cessent de changer de couleur. La bonne température est indiquée par une couleur vert opale. Remarque : c) Si les segments apparaissent granuleux et de couleur non uniforme et non régulière, le thermomètre doit être jeté, car il est usé. Toutefois, la durée de vie de chaque thermomètre devrait être bien suffisante pour l utilisation d une trousse de 10 tests. d) Ce thermomètre est un dispositif à cristaux liquides et bien que réutilisable, il doit être manipulé avec précaution pour garantir une durée de vie raisonnable. Le thermomètre ne doit être utilisé que pour vérifier la température d une plaque chauffante ; il ne doit Page 3 of
4 pas être utilisé pour surveiller le fonctionnement de la plaque chauffante à mesure que le temps passe. 5. Dénaturation Remarque : un bloc chauffant de thermocycleur PCR NE peut PAS être utilisé pour remplacer une plaque chauffante en lit fixe pour ce protocole. a) Transférer l ensemble lame/dispositif sur la plaque chauffante en faisant bien attention de la maintenir horizontalement. S assurer que la lame échantillon est bien en contact avec la plaque chauffante. b) Dénaturer sur la plaque chauffante à 75ºC (+/- 1ºC) pendant 2 minutes. 6. Hybridation Placer l ensemble lame/dispositif dans la chambre d hybridation Chromoprobe Multiprobe, remettre le couvercle et laisser flotter la chambre dans un bain-marie à 37ºC (+/- 1ºC) (sans agitation) pendant une nuit. Remarque : a) Ne pas sceller le couvercle de la chambre d hybridation. b) Ne pas placer un couvercle sur le bain-marie. c) Ne pas hybrider dans un incubateur. d) Veuillez vous assurer que la chambre d hybridation est bien sèche (c est-à-dire, aucune eau ou tissu humide à l intérieur de la chambre). L humidité à l'intérieur de la chambre est cruciale pour une hybridation optimale. Les taux corrects seront obtenus en suivant ces étapes. 7. Lavages stringents de post-hybridation Remarque : éviter de traiter plus de 2 lames à la fois lors de l étape de lavages stringents. a) Retirer délicatement le dispositif de la lame. b) Plonger la lame dans un tampon 0,4xSSC (ph 7,0) à 72ºC (+/- 1ºC) pendant 2 minutes, sans agitation. c) Égoutter la lame et la plonger dans un tampon 2xSSC, Tween-20 à 0,05% à température ambiante (ph 7,0) pendant 30 secondes, sans agitation. 8. Montage et visualisation des résultats a) Égoutter la lame et déposer 20µl de DAPI antifade sur chaque extrémité de la lame. b) Couvrir avec une lamelle (24x60mm), éliminer toute bulle et laisser la couleur se développer dans l obscurité pendant 10 minutes. c) Visualiser avec un microscope à fluorescence. Remarque : certains types de microscope sont équipés de porte-lame, ce qui peut compliquer la visualisation des extrémités de la lame. Si c est le cas, tourner simplement la lame de 180 pour en faciliter la vue.] Stabilité des lames Les lames FISH sont analysables pendant un mois si elles sont conservées à l obscurité et à/ou au-dessous de la température ambiante. Recommandations 1. Cuire ou vieillir les lames n'est pas recommandé, ceci pouvant réduire l'intensité du signal. 2. Les conditions d hybridation peuvent être affectée par l utilisation de réactifs autres que ceux fournis ou recommandés par Cytocell Ltd. 3. L utilisation d un thermomètre calibré est fortement recommandé pour mesurer les températures des solutions, bains-marie et incubateurs. Ces températures sont essentielles pour une efficacité optimale du produit. 4. Les concentrations des lavages (stringence), ph et température sont importants. Une faible stringence peut résulter en une liaison non-spécifique de la sonde et une trop forte stringence peut résulter en une perte de signal. 5. Une dénaturation incomplète peut engendrer une perte de signal et une trop forte dénaturation une hybridation non-spécifique. Résultats attendus 1. Un échantillon normal présentera un signal dans la région télomérique de chacun des chromosomes homologues concernés, ou 2 signaux dans les cellules interphasiques. 2. Le PAC (dj1011o17) détecte le polymorphisme commun décrit par Macina et al en Néanmoins, si une délétion est détectée, des études ont montré l importance de tester la délétion par FISH en utilisant une deuxième sonde localisée dans la région 13 et de tester les parents afin de déterminer son hérédité 14. À cette fin, un deuxième BAC, 172I13, D2S447 qui est plus proximal et marqué en rouge, a été incorporé sur la case Y du dispositif. Il est fourni avec une sonde de contrôle (ter) marquée en vert. Il convient de noter, cependant, que bien que d autres études ont été facilitées par l apport du deuxième clone sur la case Y du dispositif, toute délétion apparente du doit être suivie par l analyse d autres membres de la famille afin d empêcher une mauvaise interprétation d une délétion distale cliniquement significative comme étant un polymorphisme ou un variant normal. Sonde Hybridations croisées connues avec et avec,, 1 et avec avec 1 (interstitielle) avec et avec et avec avec (interstitielle) Limitations Le reporting et l interprétation du test FISH devraient être effectués conformément aux normes professionnelles pour la pratique et tout en prenant en consideration autre information cliniques et diagnostiques. Le test été développé comme un complémentaire à la cytogénétique classique, pour cette raison des actions thérapeutiques ne devraient pas être lancées sur la seule base des résultats du test FISH. Informations supplémentaires Pour plus d informations sur le produit, veuillez contacter l Assistance technique Cytocell. ITALIANO L'ibridazione in situ in fluorescenza (Fluorescence In Situ Hybridisation - FISH) è una tecnica che permette di rilevare sequenze di DNA su cromosomi in metafase o in nuclei in interfase di campioni citogenetici fissati, o in coltura dopo prelievo. La tecnica prevede l'utilizzo di sonde di DNA in grado di ibridare con l'intero cromosoma o con singole sequenze. La FISH costituisce quindi un potente strumento in aggiunta alle tecniche citogenetiche classiche. Recenti sviluppi hanno reso possibile che questa preziosa tecnica può ora essere applicata come strumento diagnostico essenziale nell analisi cromosomica prenatale, ematologia e patologica. Il DNA bersaglio, dopo la fissazione, è sottoposto a denaturazione al calore in presenza di formamide. Il DNA bersaglio è così disponibile per l annealing con una sonda di DNA a singola elica a sequenza complemetare, marcata con una sostanza fluorescente. Terminata l ibridazione, la sonda di DNA non legata o legata in modo non specifico, è rimossa per mezzo di lavaggi stringenti ed il DNA è in seguito colorato con un colorante di contrasto. L ibridazione della sonda viene infine analizzata con un microscopio a fluorescenza. Informazioni sulle sonde Vista l elevata concentrazione di geni nelle regioni adiacenti ai telomeri, le riorganizzazioni cromosomiche che interessano le estremità dei cromosomi si sono rivelate una causa importante di malattie genetiche 1. L importanza di tali riorganizzazioni cromosomiche subtelomeriche è ben testimoniata dall associazione con il ritardo mentale e anomalie congenite da causa ignota 2. Utilizzando specifiche sonde subtelomeriche per singoli cromosomi, indirizzate su particolari regioni subtelomeriche, è stato possibile determinare sindromi quali la sindrome da delezione del cromosoma 36 3,10 e la sindrome da delezione Le sonde trovano applicazione anche nelle indagini su disturbi autistici 5, aborti ricorrenti 6 e neoplasie ematologiche 7. Le sonde subtelomeriche specifiche di Cytocell si situano nella regione più distale del DNA cromosomiale specifico di ciascun cromosoma. Oltre questo materiale con sequenza unica si trova la regione di Kb di ripetizioni telomero-associate seguite dal cappuccio di 3-20Kb della sequenza ripetuta in tandem (TTAGGG)n8. Le sonde sono state scelte in base alla sequenza unica più distale per fornire la massima specificità possibile, consentendo al tempo stesso l utilizzo di routine per l esame dell enumerazione e dell integrità subtelomerica. L originale serie di sonde di seconda generazione deriva dai cloni PAC 9 ed è stata determinata in collaborazione con l Istituto di Medicina molecolare dell Università di Oxford, nel Regno Unito 11. Nel continuo tentativo di migliorare il prodotto si è proceduto a effettuare alcune sostituzioni con cloni cosmidici (35-40Kb) o BAC (150Kb) alternativi per accrescere l intensità del segnale o la specificità cromosomica. La dimensione media delle sonde è quindi di 100Kb e tutte quante sono state mappate entro un massimo di 600Kb dal telomero reale. Specifiche della sonda Ogni riquadro del dispositivo Chromoprobe Multiprobe -T contiene specifiche sonde subtelomeriche sia per il braccio p che per il braccio q di uno dei 23 cromosomi (fatta eccezione per i cromosomi acrocentrici). Le sonde per il braccio p e per il braccio q di ciascun cromosoma sono marcate con colori differenti per mezzo di due fluorofori spettralmente indipendenti (rispettivamente, in verde per il braccio p e in rosso per il braccio q) e si trovano insieme nel corrispondente riquadro del Multiprobe. Tale sistemazione assicura a ciascuna delle due un controllo interno dell ibridizzazione e un efficace identificazione del cromosoma. Materiali forniti Ogni kit contiene i seguenti reagenti, sufficienti per 2 (PMP 009), 5 (PMP 008) o 10 (PMP 007) campioni del paziente: 1. 2, 5 o 10 dispositivi Chromoprobe Multiprobe -T rivestiti con 42 sonde subtelomeriche con marcatura diretta (minimo 20ng di sonda per riquadro). 2. 4, 7 o 12 vetrini con impresso uno stampo specifico 3. 4, 7 o 12 coprioggetti grandi (24 x 60mm) µl di soluzione di ibridizzazione (formamide, destrano solfato, SSC) µl di controcolorante (antifade DAPI (ES: 0,125µg/ml di DAPI (4,6-diamidino-2- fenilindolo)) 6. 1 termometro di superficie per vetrini Cytocell 7. 1 camera di ibridizzazione Chromoprobe Multiprobe Cytocell Avvertenze e misure precauzionali 1. Per uso diagnostico in vitro. Per uso professionale. 2. Quando si manipolano le sonde ed il colorante di contrasto DAPI è necessario indossare i guanti. 3. La soluzione di ibridizzazione contiene formamide, che è teratogena; non respirare i fumi ed evitare il contatto con la cute. Indossare i guanti, un camice da laboratorio e manipolare in una cappa aspirante. Eliminare sciacquando abbondantemente con acqua. 4. Il DAPI è un potenziale cancerogeno. Maneggiare con cura, indossare guanti ed un camice da laboratorio. Per lo smaltimento, lavare con grandi quantità di acqua. 5. Eseguire lo smaltimento dei materiali pericolosi nel rispetto delle normative interne dell'istituzione relative allo smaltimento dei residui tossici. Conservazione e utilizzo Il kit Chromoprobe Multiprobe deve essere conservato a 2-8 C fino alla data di scadenza indicata sull etichetta. Non congelare. Il flaconcino del controcolorante deve essere conservato al buio. Apparecchiature necessari non forniti 1. Piastra riscaldante (con - un controllo accurato della temperatura fino ad 80ºC). 2. Micropipette a volume variabile compreso tra 1µl - 200µl. 3. Bagno termostatato con controllo accurato della temperatura a 72ºC. 4. Provette da microcentrifuga (0,5ml). 5. Microscopio a fluorescenza (riferirsi alla sezione Configurazione ottimale del microscopio e dei filtri). 6. Contenitori di Coplin in plastica o vetro. 7. Pinzette. 8. Olio per lenti ad immersione del microscopio a fluorescenza. 9. Centrifuga da banco. 10. Timer. 11. Bagnomaria a 37 C senza agitatore. Configurazione ottimale del microscopio e dei filtri Per una visualizzazione ottimale della sonda si raccomanda di utilizzare una lampada a mercurio da 100-watt ed obiettivi plan apochromat 63x e 100x. Il filtro triplo DAPI/FITC/Texas Red è ottimale per visualizzare tutti e tre i fluorofori contemporaneamente. Preparazione del campione Il Chromoprobe Multiprobe -T è destinato all uso su cellule di sangue periferico in coltura fissate con fissativo di Carnoy da preparare seguendo le linee guida del laboratorio o dell istituzione. Preparare i campioni asciugati all aria sui vetrini a stampo del Chromoprobe Multiprobe Cytocell in conformità con il protocollo Cytocell riportato qui sotto. Si sconsiglia di essiccare a caldo o processare altrimenti i vetrini in quanto si potrebbe ridurre la fluorescenza del segnale. Page 4 of 9
5 Protocollo Chromoprobe Multiprobe N.B.: le sonde utilizzate con il dispositivo Chromoprobe Multiprobe sono marcate direttamente con fluorofori, che sono sensibili alla luce. Verificare che in ogni fase venga limitata l esposizione delle sonde alle luci del laboratorio (non è necessario lavorare al buio). 1. Preparazione del vetrino a) Pulire un vetrino a stampo. Immergerlo per 2 minuti in metanolo al 100% e asciugarlo minuziosamente con un panno morbido pulito. b) Determinare l indice mitotico corretto. È importante che i campioni designati abbiano un indice mitotico sufficientemente alto da consentire la rilevazione della anomalie cromosomiche. Per verificare la densità del campione, pipettare con una micropipetta (es. una Gilson P10 o P20) 2µl della sospensione cellulare su una delle aree del vetrino a stampo vuoto e lasciare asciugare all'aria. Vista l entità minima del volume utilizzato, di solito per trasferire la sospensione sarà necessario toccare delicatamente il vetrino con la punta della pipetta. Esaminare al microscopio a contrasto di fase. Se la densità cellulare è troppo elevata, diluire la sospensione con dell altro fissativo. Se l indice mitotico è troppo basso, centrifugare a bassa velocità la sospensione cellulare fissata a 160g per 10 minuti. Osservare il volume del surnatante, rimuoverlo e risospendere il pellet cellulare in un volume inferiore di fissativo. Se la densità del campione cellulare è stata modificata, trasferire 2µl del campione concentrato in un altro riquadro del vetrino per il test e riesaminarlo al microscopio a contrasto di fase. N.B.: 50µl è il volume minimo necessario per il protocollo. c) Controllo della qualità dei campioni. Si deve verificare l eventuale presenza di citoplasma nei campioni, che interferirebbe con il protocollo in situ. Se all osservazione al microscopio a contrasto di fase i cromosomi appaiono circondati da materiale granulare, i risultati del test saranno compromessi. Un metodo per ridurre la presenza di citoplasma è trasferire 2µl del campione sul vetrino a stampo e osservare la propagazione del fissativo. In condizioni normali, il fissativo raggiunge un espansione massima, si ritira e quindi evapora. Per ripulire efficacemente il campione da eventuali tracce di citoplasma, un sistema efficace consiste nel lasciare cadere una goccia di fissativo sul campione nel momento in cui il fissativo in espansione ha raggiunto il suo massimo. Lasciare evaporare la goccia di fissativo e riesaminare il campione. d) Trasferimento sul vetrino. Pipettare 2µl di sospensione cellulare su tutte le 24 aree del vetrino a stampo procedendo su riquadri alternati come indicato qui sotto. Così facendo si eviterà che l espansione delle cellule provochi interferenze reciproche. 4. Istruzioni per l uso del termometro di superficie per vetrini Cytocell a) Prima di procedere alla denaturazione, con il termometro di superficie per vetrini Cytocell controllare che la temperatura della piastra sia di 75ºC. b) Per utilizzare il termometro in modo appropriato, posizionarlo sulla superficie della piastra e attendere che i diversi segmenti smettano di cambiare colore. La temperatura effettiva è indicata da un colore turchese intenso. N.B.: c) Quando i segmenti hanno un aspetto granulare ed i colori non sono più uniformi e regolari, il termometro deve essere eliminato perché esaurito. La durata di ogni termometro, tuttavia, dovrebbe essere sufficiente per un kit da 10 dispositivi. d) Il termometro è un dispositivo a cristalli liquidi e, benché riutilizzabile, deve essere trattato con cura per garantire una durata adeguata. Il termometro deve essere utilizzato solo per controllare la temperatura delle piastre, non per effettuare il monitoraggio delle loro prestazioni nel tempo. 5. Denaturazione N.B.: per questa procedura NON è possibile utilizzare un blocco riscaldante del termociclatore per la PCR al posto di una piastra solida. a) Trasferire sulla piastra l insieme vetrino/dispositivo facendo molta attenzione a tenerlo in posizione orizzontale. Verificare che il vetrino con i campioni sia bene a contatto con la piastra. b) Denaturare sulla piastra a 75 C (+/- 1ºC) per 2 minuti. 6. Ibridizzazione Porre l insieme vetrino/dispositivo nella camera di ibridizzazione Chromoprobe Multiprobe preriscaldata, riposizionare il coperchio e far flottare la camera nel bagnomaria a 37 C (+/- 1ºC) (senza agitazione) per tutta la notte. N.B.: a) Non sigillare il coperchio sulla camera di ibridizzazione. b) Non chiudere il bagnomaria con un coperchio. c) Non effettuare l ibridizzazione in un incubatore. d) Accertarsi che la camera di ibridizzazione sia completamente asciutta (cioè che all'interno della camera non vi siano acqua o panni umidi). Il livello di umidità all'interno della camera è essenziale per una ibridizzazione ottimale. Per ottenere i livelli corretti procedere come indicato qui sotto. 7. Lavaggi stringenti post-ibridizzazione N.B.: non sottoporre alla procedura dei lavaggi stringenti più di due vetrini per volta. e) Una volta che la prima serie di gocce si è asciugata all aria, trasferire gocce da 2µl nei riquadri ancora vuoti, con la stessa modalità. Dopo che il vetrino si è asciugato, osservandolo al microscopio a contrasto di fase si potrà verificare se tutti i riquadri sono stati riempiti. Se così non fosse, o se qualche riquadro contenesse un numero insufficiente di cellule, basterà ripetere il trasferimento su questi riquadri: non è necessario ripetere il trasferimento su un altro vetrino. Se esaminando il vetrino si notasse un riquadro con un numero insufficiente di cellule o di metafasi, aggiungere una o più gocce di sospensione per aumentare la densità cellulare. N.B.: se le metafasi appaiono troppo diffuse, pulire accuratamente un nuovo vetrino a stampo in metanolo ed effettuare un nuovo trasferimento facendo asciugare ogni goccia prima di procedere con la successiva. 2. Preparazione del dispositivo Chromoprobe Multiprobe e del vetrino a stampo a) Accertarsi che la Camera di ibridizzazione Chromoprobe Multiprobe sia nel bagnomaria a 37 C e lasciare che si equilibri a 37 C (+/- 1ºC). Se il bagnomaria è stato acceso con acqua fredda potrebbe essere necessaria anche un'ora. b) Miscelare la soluzione di ibridizzazione pipettando ripetutamente e preriscaldare a 37 C un'aliquota da 25µl per dispositivo. Pre-riscaldare inoltre ogni dispositivo ponendolo su una piastra a 37 C con l'etichetta rivolta verso il basso. Non toccare le superfici in rilievo del dispositivo. c) Immergere i vetrini a stampo contenenti i campioni fissati in 2xSSC per 2 minuti a temperatura ambiente (TA) senza agitare. d) Mentre il dispositivo è ancora a 37 C, disidratare i vetrini a stampo contenenti i campioni fissati con diluizioni di etanolo in serie (70%, 85% e 100%, 2 minuti ciascuno) a TA, asciugare all aria e riscaldare su una piastra a 37 C. e) Aggiungere, con una micropipetta P10, 1µl di soluzione di ibridizzazione preriscaldata a ognuna delle 24 aree presenti sul dispositivo preriscaldato, mentre è ancora sulla piastra a 37 C. 3. Posizionamento del vetrino a stampo sul dispositivo a) Capovolgere con cura il vetrino a stampo sul dispositivo in modo che il numero 1, che ora è a testa in giù, si trovi sopra l'area in alto a destra del dispositivo (Figura 1). 2 Figura 1. Posizione delle sonde sul sistema Chromoprobe Multiprobe -T. Per facilitare la localizzazione del riquadro numero 1, la sua posizione sul dispositivo è stata contrassegnata da un etichetta colorata. b) Verificare il preciso allineamento del vetrino a stampo con le corrispondenti aree del dispositivo. Abbassare con cura il vetrino sul dispositivo in modo che le gocce di soluzione di ibridizzazione entrino in contatto con il vetrino. Applicare una pressione leggera ed uniforme per fare sì che la soluzione di ibridizzazione diffonda fino ai margini di ciascuna delle aree in rilievo del dispositivo. c) Sollevare con cura il vetrino tenendolo per l'estremità smerigliata e capovolgerlo in modo che il vetrino stesso si trovi al di sotto del dispositivo. Accertarsi che il dispositivo non strisci lungo il vetrino a stampo, causando la contaminazione crociata delle sonde. d) Porre su una piastra o un incubatore a 37 C (+/- 1 C) per 10 minuti a) Rimuovere con cura il dispositivo dal vetrino. b) Immergere il vetrino in 0,4xSCC (ph 7,0) a 72ºC (+/- 1ºC) per 2 minuti senza agitare. c) Fare sgocciolare il vetrino e immergerlo in 2xSCC, 0,05% Tween-20 a TA (ph 7,0) per 30 secondi senza agitare. 8. Montaggio e visualizzazione dei risultati a) Fare sgocciolare il vetrino e applicare a ogni estremità 20µl di antifade DAPI. b) Coprire con un coprioggetto (24 x 60mm), rimuovere eventuali bolle e lasciare che il colore si sviluppi al buio per 10 minuti. c) Osservare con un microscopio a fluorescenza. N.B.: alcuni microscopi hanno un supporto per vetrini che rende difficile visualizzare le estremità del vetrino stesso. In questo caso è sufficiente ruotare il vetrino di 180 per agevolarne la visualizzazione. Stabilità del vetrino finito I vetrini FISH restano analizzabili per circa 1 mese se conservati al buio a temperatura ambiente o inferiore. Raccomandazioni per l'uso 1. L eccessivo riscaldamento o l invecchiamento dei vetrini non è raccomandato in quanto suscettibili di ridurre la fluorescenza del segnale. 2. Le condizioni di ibridazione potrebbero essere influenzate negativamente dall impiego di reagenti differenti rispetto a quelli forniti o raccomandati da Cytocell Ltd. 3. L utilizzo di un termometro calibrato è fortemente raccomandato per la misurazione delle temperature delle soluzioni, dei bagni termostati e degli incubatori in quanto queste temperature sono di fondamentale importanza per la performance ottimale del prodotto. 4. Le concentrazioni del lavaggio (stringenza), il ph e la temperatura sono di fondamentale importanza in quanto condizioni di stringenza blande possono favorire un legame non specifico della sonda e condizioni di stringenza troppo elevate possono condurre alla perdita del segnale. 5. La denaturazione incompleta può tradursi in una perdita del segnale mentre una denaturazione eccessiva può anche tradursi in un legame non specifico. Risultati attesi 1. Un campione normale emetterà un segnale nella regione telomerica di ciascun cromosoma omologo interessato oppure 2 segnali nelle cellule in interfase. 2. Il PAC (dj1011o17) rileva il polimorfismo comune descritto da Macina et al in Qualora si rilevi una delezione, alcuni studi hanno sottolineato l importanza di analizzare la delezione riscontrata con la FISH effettuando una seconda mappatura della regione con la sonda 13 e di esaminare i genitori per determinare l ereditarietà 14. A tal fine, nel riquadro Y del dispositivo è stato incorporato il secondo BAC, 172I13, D2S447, più prossimale e marcato in rosso, fornito con una sonda di controllo ( ter) marcata in verde. La disponibilità del secondo clone sul riquadro Y del dispositivo ha facilitato l esecuzione di studi aggiuntivi, ma va comunque sottolineato che qualunque delezione apparente deve essere valutata analizzando gli altri membri della famiglia al fine di evitare di interpretare erroneamente una delezione distale clinicamente significativa come un polimorfismo o una variante normale. Sonda Ibridizzazioni crociate note con e con,, 1 e con con 1 (interstiziale) con e con e con con (interstiziale) Limitazioni Il reporting e l interpretazione di FISH devono essere coerente con gli standard professionali della pratica medica e dovrebbe prendere in considerazione altre informazioni cliniche e diagnostiche. Questo kit è concepito in aggiunta alla tecniche citogenetica classica e azione terapeutica non deve essere messa in atto esclusivamente sulla base del risultato di FISH. Informazioni aggiuntive Per informazioni aggiuntive sul prodotto contattare il Dipartimento di Assistenza Tecnica Cytocell. Page 5 of 9
6 DEUTSCH Die Fluoreszenz-in situ-hybridisierung (FISH) ist eine Technik, mit der DNA-Sequenzen auf Metaphase-Chromosomen oder Interphase-Kernen in fixierten zytogenetischen Proben nachgewiesen werden können. Dabei werden DNA-Sonden verwendet, die an ganze Chromosomen oder einzelne, einmalige Sequenzen hybridisieren. Kürzliche Entwicklungen haben gezeigt, dass diese nützliche Technik nun auch als essentielles diagnostisches Werkzeug für pränatale, hämatologische und pathologische Chromosomenanalysen eingesetzt werden kann. Nachdem die zu untersuchende DNA fixiert und denaturiert wurde, kann die Fluoreszenz markierte, einzelsträngige Sonde daran binden. Nach der Hybridisierung werden nicht gebundene sowie unspezifisch gebundene DNA-Sonden durch eine Reihe von Waschvorgängen entfernt und die DNA zur Visualisierung gegengefärbt. Unter dem Fluoreszenzmikroskop wird dann die hybridisierte Sonde am Zielmaterial erkennbar. Sondeninformation Chromosomenumordnungen unter Beteiligung der Enden von Chromosomen haben sich aufgrund des Genreichtums dieser Regionen neben den Telomeren als wichtige Ursache genetischer Erkrankungen erwiesen. 1 Die Bedeutung dieser subtelomeren Chromosomenumordnungen wurde durch den beobachteten Zusammenhang mit unklarer mentaler Retardierung und angeborenen Abnormalitäten eindeutig nachgewiesen. 2 Individuelle subtelomerspezifische Sonden wurden bereits zur Fokussierung auf spezielle subtelomere Regionen verwendet. Diese führten zum Auffinden von Syndromen wie dem Chromosom-36-Deletionssyndrom 3,10 und dem Deletionssyndrom 4. Die Sonden werden auch zur Untersuchung autistischer Störungen 5, wiederholter Fehlgeburten 6 und maligner hämatologischer Veränderungen 7 eingesetzt. Die subtelomerspezifischen Sonden von Cytocell sind in der distalsten Region der chromosomenspezifischen DNA jedes Chromosoms lokalisiert. Jenseits dieses eindeutigen Sequenzmaterials liegt die 100 bis 300Kb Region des telomerassoziierten Repeats, gefolgt von der 3 bis 20Kb langen Cap-Struktur mit (TTAGGG) n-tandem-repeat- Sequenz 8. Die Sonden sind aus der distalsten eindeutigen Sequenz gewählt, um die bestmögliche Spezifität zu liefern, aber gleichzeitig auch routinemäßig zur Untersuchung der subtelomeren Auszählung und Integrität anwendbar zu sein. Das ursprüngliche Sondenset der zweiten Generation leitet sich von PAC-Klonen 9 ab und wurde in Zusammenarbeit mit dem Institute of Molecular Medicine der Oxford University 11, Großbritannien, gefunden. Fortlaufende Produktverbesserungen haben zu einigen Substitutionen mit alternativen Cosmid- (35-40Kb) oder BAC- (150Kb) Klonen geführt, die Signalstärke oder Chromosomenspezifität verbessern. Die durchschnittliche Sondenlänge beträgt daher 100Kb, und alle sind innerhalb von maximal 600Kb des wahren Telomers gemappt. Sondenspezifikation Jedes Quadrat des Chromoprobe Multiprobe -T Geräts trägt subtelomerspezifische Sonden für sowohl den p-arm als auch den q-arm von einem der 23 Chromosomen (mit Ausnahme der akrozentrischen Chromosomen). Die p-arm- und die q-arm-sonden für jedes Chromosom sind in unterschiedlichen Farben mit zwei spektral unabhängigen Fluorophoren markiert (p-arme grün und q-arme rot). Sie befinden sich gemeinsam in dem entsprechenden Multiprobe-Quadrat. Durch dieses Format verfügen beide über eine interne Hybridisierungskontrolle und effektive Chromosomenidentifizierung. Kitkomponenten Jedes Kit enthält die folgenden Reagenzien, die für 2 (PMP 009), 5 (PMP 008) oder 10 (PMP 007) Patientenproben ausreichen: 1. 2, 5 oder 10 Chromoprobe Multiprobe -T Geräte, die mit 42 direkt markierten subtelomeren Sonden (Minimum 20ng Sonde pro Quadrat) beschichtet sind 2. 4, 7 oder 12 Glasobjektträger, die mit einem speziellen Templat bedruckt sind 3. 4, 7 oder 12 große Deckgläser (24x60mm) µl Hybridisierungslösung (Formamid, Dextransulfat, SSC) µl Gegenfärbung (DAPI Antifade (ES: 0,125µg/ml DAPI (4,6-Diamidino-2-phenylindol)) 6. 1 Cytocell Oberflächenthermometer für Objektträger 7. 1 Cytocell Chromoprobe Multiprobe Hybridisierungskammer Warnungen und Vorsichtsmaßnahmen 1. Zur Verwendung in der in vitro Diagnostik. Nur für die professionelle Verwendung. 2. Beim Umgang mit DNA-Sonden und der DAPI-Gegenfärbung Handschuhe tragen. 3. Die Hybridisierungslösung enthält Formamid, das teratogen ist. Keine Dämpfe einatmen und Hautkontakt vermeiden. Handschuhe und Labormantel tragen und unter einer Abzugshaube arbeiten. Bei der Entsorgung mit viel Wasser nachspülen. 4. DAPI ist ein potentielles Karzinogen. Vorsichtig damit umgehen, Handschuhe und Labormantel tragen. Bei der Entsorgung mit viel Wasser nachspülen. 5. Alle Gefahrstoffe sollten gemäß den Richtlinien Ihrer Einrichtung zur Gefahrstoffentsorgung entsorgt werden. Lagerung und Behandlung Das Chromoprobe Multiprobe Kit wird bis zum Ablauf des auf dem Kitetikett angegebenen Haltbarkeitsdatums bei 2-8ºC gelagert. Nicht einfrieren. Das Röhrchen mit der Gegenfärbung wird lichtgeschützt aufbewahrt. Benötigte, aber nicht mitgelieferte Laborgeräte 1. Heizplatte (mit stabiler Heizplatte und genauer Temperaturregelung bis 80ºC). 2. Mikropipetten mit variablem Volumen von 1 µl 200µl. 3. Wasserbad mit genauer Temperaturkontrolle bei 72ºC. 4. Mikro-Zentrifugenröhrchen (0,5ml). 5. Fluoreszenzmikroskop (siehe auch Empfehlungen zum Fluoreszenzmikroskop ). 6. Coplin-Färbetrog aus Kunststoff oder Glas. 7. Pinzette. 8. Für Fluoreszenzobjektive geeignetes Immersionsöl. 9. Tischzentrifuge. 10. Timer. 11. Wasserbad mit 37 C ohne Rührer. Empfehlungen zum Fluoreszenzmikroskop Zur bestmöglichen Beobachtung der Probe empfehlen wir die Verwendung einer 100-Watt Quecksilberdampflampe und von Plan Achromat Objektiven mit 63-facher oder 100-facher Vergrößerung. Das Dreifach-Bandpasssfilter DAPI/FITC/Texasrot ist für die simultane Beobachtung aller drei Fluorophore optimal geeignet. Probenvorbereitung Chromoprobe Multiprobe -T ist für die Verwendung mit kultivierten peripheren Blutzellen, die in Carnoy s Fixativ fixiert sind, ausgelegt und sollte nach den Leitlinien des Labors oder Instituts vorbereitet werden. Präparieren Sie die luftgetrocknete Proben auf Cytocell Chromoprobe Multiprobe Templat-Objektträgern gemäß dem folgenden Cytocell Protokoll. Wärmebehandlung oder Reifung der Objektträger ist nicht empfehlenswert, da dies zu einer verringerten Signalfluoreszenz führen kann. Chromoprobe Multiprobe Protokoll Bitte beachten: Die mit dem Chromoprobe Multiprobe Gerät verwendeten Sonden sind direkt mit Fluorophoren markiert und somit lichtempfindlich. Bitte stellen Sie sicher, dass die Sonde nur in begrenztem Umfang der Strahlung von Laborlampen ausgesetzt ist (es ist nicht notwendig, im Dunklen zu arbeiten). 1. Vorbereitung des Objektträgers a) Einen Templat-Objektträger reinigen. Den Templat-Objektträger 2 min lang in 100% Methanol eintauchen und mit einem sauberen, weichen Tissuetuch trockenpolieren. b) Korrekten Mitoseindex bestimmen. Der Nachweis von Chromosomenabnormalitäten ist nur dann möglich, wenn die vorgesehene Probe einen ausreichend hohen Mitoseindex aufweist. Zur Überprüfung der Dichte der Probe mithilfe einer Mikropipette (z. B. Gilson P10 oder P20) 2µl der Zellsuspension auf einen der Bereiche des freien Templat-Objektträgers pipettieren und an der Luft trocknen lassen. Das kleine Volumen bedeutet, dass der Objektträger leicht mit der Pipettenspitze berührt werden sollte, um die Suspension zu transferieren. Mittels Phasenkontrastmikroskopie untersuchen. Wenn die Zelldichte zu hoch ist, die Suspension mit frischem Fixativ verdünnen. Wenn der Mitoseindex zu niedrig ist, die fixierte Zellsuspension mit 160xg 10 min lang zentrifugieren. Das Volumen des Überstands notieren, diesen abgießen und das Zellpellet in einem kleineren Volumen an frischem Fixativ erneut suspendieren. Nach Änderung der Zellprobendichte 2µl der konzentrierten Probe auf ein weiteres Quadrat des Objektträgers tüpfeln und erneut durch Phasenkontrastmikroskopie untersuchen. Bitte beachten: Für das Protokoll ist ein Mindestvolumen von 50µl erforderlich. c) Qualitätskontrolle der Proben. Proben müssen auf Zytoplasma untersucht werden, da dies das In-situ-Protokoll stört. Wenn die Chromosomen bei der Untersuchung mittels Phasenkontrastmikroskopie von einem granulösen Material eingeschlossen zu sein scheinen, können keine exakten Ergebnisse erzielt werden. Eine Methode zur Reduktion des Zytoplasmas besteht darin, 2µl der Probe auf den Templat-Objektträger zu tüpfeln und das Fixativ bei der Ausbreitung zu beobachten: Das Fixativ breitet sich unter normalen Umständen maximal aus, weicht zurück und verdampft dann. Wir haben festgestellt, dass die Aufreinigung von Zytoplasma dann am erfolgreichsten ist, wenn in dem Augenblick, in dem das sich ausbreitende Fixativ seine maximal Ausdehnung erreicht hat, ein frischer Tropfen Fixativ auf den Flecken fallen gelassen wird. Den Tropfen Fixativ verdampfen lassen und den Flecken neu untersuchen. d) Tüpfeln des Objektträgers. 2µl Zellsuspension in einer Sequenz von alternierenden Quadraten wie anschließend gezeigt auf alle 24 Bereiche des Templat- Objektträgers pipettieren. Dies verhindert, dass sich ausbreitende Proben gegenseitig stören. e) Nachdem dem Trocknen der ersten Gruppe von Tropfen an Luft 2µl in derselben Weise auf die restlichen Quadrate tüpfeln. Nach dem Trocknen des Objektträgers zeigt die Untersuchung des Objektträgers unter Phasenkontrast, ob Quadrate ausgelassen wurden. Wenn Quadrate nicht getüpfelt wurden oder zu wenig Zellen aufweisen, diese Quadrate einfach erneut tüpfeln. Das Präparieren eines neuen Objektträgers ist nicht erforderlich. Wenn ein Quadrat bei der Untersuchung des Objektträgers zu wenige Zellen/Metaphasen aufweist, können 1 oder mehrere Tropfen Suspension zugefügt werden, um die Zelldichte zu erhöhen. Bitte beachten: Wenn die Metaphasen zu stark ausgebreitet erscheinen, wird ein neuer Templat-Objektträger gründlich in Methanol gereinigt und erneut getüpfelt, wobei jeder Fleck trocknen muss, ehe der nächste aufgetüpfelt wird. 2. Vorbereitung von Chromoprobe Multiprobe Gerät und Templat- Objektträger a) Kontrollieren, dass sich die Chromoprobe Multiprobe Hybridisierungskammer im 37 C warmen Wasserbad befindet. Kammer auf 37ºC (+/- 1ºC) erwärmen lassen. Dies kann bis zu einer Stunde dauern, wenn das Wasserbad kalt eingeschaltet wird. b) Hybridisierungslösung durch wiederholtes Pipettieren mischen, und pro Gerät eine 25µl Aliquote auf 37 C erwärmen. Auch jedes Gerät vorwärmen, indem es mit der Etikettenseite nach unten auf eine 37 C warme Heizplatte gelegt wird. Die erhabenen Oberflächen des Geräts nicht berühren. c) Templat-Objektträger, die fixierte Proben enthalten, 2 min bei Raumtemperatur (RT) ohne Schütteln in 2xSSC eintauchen. d) Während das Gerät noch 37 C warm ist, die Templat-Objektträger, welche fixierte Proben enthalten, mithilfe einer Ethanolreihe (jeweils 2 min in 70%, 85% und 100%) bei RT entwässern, an der Luft trocknen lassen und zum Aufwärmen auf eine 37 C warme Heizplatte legen. e) 1µl vorgewärmte Hybridisierungslösung mithilfe einer P10 Mikropipette auf jeden der 24 Bereiche des vorgewärmten Geräts geben, während es auf der 37 C warmen Heizplatte bleibt, 3. Positionierung des Templat-Objektträgers über dem Gerät a) Templat-Objektträger über dem Gerät vorsichtig umdrehen, so dass sich die Nummer 1, die nun nach unten weist, über dem oberen rechten Bereich des Geräts befindet (Abbildung 1). 2 Abbildung 1. Position der Sonden im Chromoprobe Multiprobe -T System. Um Quadrat 1 leichter finden zu können, ist dessen Position auf dem Gerät mit einem farbigen Etikett markiert. b) Kontrollieren, dass der Templat-Objektträger sorgfältig an den entsprechenden Bereichen des Geräts ausgerichtet ist. Objektträger vorsichtig über dem Gerät Page 6 of 9
7 absenken, damit die Tropfen der Hybridisierungslösung Kontakt mit dem Objektträger erhalten. Sanften gleichmäßigen Druck ausüben, damit sichergestellt ist, dass sich die Hybridisierungslösung zu den Rändern jedes der erhabenen Bereiche auf dem Gerät ausbreitet. c) Objektträger vorsichtig anheben, dazu das gefrostete Ende des Glasobjektträgers halten und den Träger umdrehen, so dass sich der Templat-Objektträger unter dem Gerät befindet. Kontrollieren, dass der Templat-Objektträger nicht durch das Gerät verschmiert wird, da dies zu Kreuzverunreinigung der Sonden führen kann. d) 10 min lang bei 37 C (+/- 1 C) (Heizplatte oder Inkubator) stehen lassen. 4. Anweisungen zur Verwendung des Cytocell Oberflächenthermometers für Objektträger a) Vor Beginn der Denaturierung mithilfe des Cytocell Oberflächenthermometers für Objektträger überprüfen, ob die Heizplatte 75 C warm ist. b) Korrekte Anwendung des Thermometers: Thermometer auf die Oberfläche der Heizplatte legen und warten, bis die verschiedenen Segmente ihre Farbe nicht mehr ändern. Die tatsächliche Temperatur wird durch eine tiefblaue Farbe angezeigt. Bitte beachten: c) Wenn die Segmente körnig aussehen und die Farben nicht länger einheitlich und regelmäßig erscheinen, ist das Thermometer verbraucht und muss entsorgt werden. Die Lebensdauer jedes Thermometers sollte jedoch für ein Kit mit 10 Geräten ohne Weiteres ausreichen. d) Das Thermometer ist ein Flüssigkristallgerät. Obgleich es wiederverwendbar ist, muss es achtsam behandelt werden, um eine angemessene Lebensdauer sicherzustellen. Das Thermometer darf nur zur Prüfung der Temperatur einer Heizplatte verwendet werden. Es darf nicht eingesetzt werden, um die Leistung der Heizplatte über eine längere Zeit zu überwachen. 5. Denaturierung Bitte beachten: Für dieses Verfahren darf die Festbett-Heizplatte NICHT durch den Heizblock eines PCR Thermocyclers ersetzt werden. a) Die sandwichförmige Objektträger/Gerät-Anordnung auf die Heizplatte transferieren, wobei besonders darauf geachtet werden muss, sie waagerecht zu halten. Kontrollieren, dass der Probenobjektträger ausreichend Kontakt mit der Heizplatte hat. b) Auf der Heizplatte bei 75 C (+/- 1 C) 2 min lang denaturieren. 6. Hybridisierung Die sandwichförmige Objektträger/Gerät-Anordnung in die vorgewärmte Chromoprobe Multiprobe Hybridisierungskammer legen, den Deckel wieder auflegen und die Kammer im 37ºC (+/- 1ºC) warmen Wasserbad mit (ohne Rühren) über Nacht schweben lassen. Bitte beachten: a) Deckel auf der Hybridisierungskammer nicht versiegeln. b) Keinen Deckel auf das Wasserbad legen. c) Nicht in einem Inkubator hybridisieren. d) Bitte sicherstellen, dass die Hybridisierungskammer vollständig trocken ist (d. h. weder Wasser noch feuchtes Gewebe im Inneren der Kammer ist). Die Feuchtigkeit in der Kammer ist für die optimale Hybridisierung sehr wichtig. Das korrekte Niveau mithilfe der obigen Schritte aufrechterhalten. 7. Stringente Wäschen nach der Hybridisierung Bitte beachten: Nicht mehr als zwei Objektträger gleichzeitig während der stringenten Wäschen verarbeiten. a) Gerät vorsichtig von dem Objektträger entfernen. b) Objektträger 2 min lang ohne Rühren in 0,4xSSC (ph 7,0) eintauchen. c) Objektträger abtropfen lassen und 30 Sekunden lang ohne Durchmischen in 2xSSC, 0,05 % Tween-20 bei RT (ph 7,0) eintauchen. 8. Aufziehen und Visualisierung der Ergebnisse a) Objektträger abtropfen lassen und an jedem Ende des Objektträgers 20µl DAPI Antifade aufbringen. b) Mit einem Deckglas (24x60mm) abdecken, die Luftblasen entfernen und die Farbe 10 min lang im Dunkeln entwickeln lassen. c) Unter dem Fluoreszenzmikroskop betrachten. Bitte beachten: Einige Mikroskoptypen haben Objektträgerhalter, die es erschweren, die äußersten Enden des Objektträgers zu betrachten. Falls dies vorkommt, einfach den Objektträger um 180 C drehen, um seine Betrachtung zu erleichtern. Stabilität der fertigen Objektträger Objektträger mit FISH-Proben können bis zu einem Monat lang analysiert werden, wenn sie im Dunkeln bei oder unter Raumtemperatur gelagert werden. Empfehlungen zur Durchführung 1. Wärmebehandlung oder Reifung der Proben ist nicht empfehlenswert, da dies zu einer verminderten Signalfluoreszenz führen kann. 2. Durch die Verwendung von anderen Reagenzien, als den von Cytocell Ltd. empfohlenen, können die Hybridisierungsbedingungen negativ beeinflusst werden. 3. Es wird dringend empfohlen, zur Temperaturmessung von Lösungen, Wasserbädern und Inkubatoren ein geeichtes Thermometer zu verwenden, da diese Temperaturen für die optimale Leistung des Produkts ausschlaggebend sind. 4. Die Konzentrationen der Waschlösungen (Stringenz), ph und Temperatur sind wichtig, da niedrig stringente Bedingungen zu nicht-spezifischer Bindung der Sonde führen kann und zu hohe Stringenz zum Verlust des Signals. 5. Unvollständige Denaturierung kann zu einem Verlust des Signals führen und übermäßige Denaturierung kann zu nicht-spezifischer Bindung der Sonde führen. Zu erwartende Ergebnisse 1. Eine normale Probe zeigt ein Signal in der telomeren Region jedes der relevanten Chromosomhomologen oder 2 Signale in Interphasenzellen. 2. Mit PAC (dj1011o17) lässt sich der von Macina et al. im Jahr beschriebene häufige Polymorphismus nachweisen. Falls eine -Deletion nachgewiesen wird, ist es wichtig, die Deletion mittels FISH unter Verwendung eines zweiten Sonden-Mappings auf die Region zu testen 13 und auch die Eltern zu testen, um die Vererbung zu bestimmen 14. Die Bedeutung dieser Tests ist durch Studien belegt. Hierzu dient die zweite BAC, 172I13, D2S447, die proximaler liegt, rot markiert ist und in Quadrat Y des Geräts aufgenommen wurde. Sie wird mit einer grün markierten Kontrollsonde (ter) geliefert. Die weitere Untersuchung wird zwar durch Bereitstellung des zweiten Klons auf Quadrat Y des Geräts erleichtert, trotz muss, das sei ausdrücklich betont, jeder scheinbaren -Deletion durch Testen anderer Familienmitgliedern nachgegangen werden, um die Fehlinterpretation einer klinisch signifikanten distalen -Deletion als Polymorphismus einer Normvariante zu verhindern. Sonde Bekannte Kreuzhybridisierungen mit und mit,, 1 und mit mit 1 (interstitiell) mit und mit und mit mit (interstitiell) Einschränkungen Protokollierung und Interpretation der FISH Tests sollte nach professionellen Standards für die Praxis und unter Berücksichtigung anderer klinischer und diagnostischer Informationen. Der Test ist als Ergänzung zur klassischen Zytogenetik. Daher sollten therapeutische Maßnahmen nicht allein auf Grundlage der FISH-Ergebnisse veranlasst. Weitere Informationen: Weitere Produktinformationen erhalten Sie vom Technischen Kundendienst von Cytocell. ESPAÑOL La hibridación in situ fluorescente (FISH) es una técnica que permite detectar secuencias de ADN en cromosomas metafásicos o núcleos interfásicos en muestras citogenéticas y fijadas. En la técnica se utiliza una sonda de ADN que hibrida los cromosomas completos o las secuencias únicas simples y es un complemento útil para la citogenética clásica. Recientes estudios indican que esta es una técnica que puede aplicarse como herramienta esencial de diagnóstico prenatal, hematológico y patológico. Después de la fijación, el ADN diana se trata con calor para desnaturalizar el ADN bicatenario haciendo que resulte monocatenario. El ADN diana queda entonces disponible para hibridarlo con una sonda de ADN igualmente desnaturalizado, monocatenario marcado con fluorescencia que tiene una secuencia complementaria. Después de la hibridación la sonda de ADN no específicamente hibridada y no hibridada se elimina y se aplica un contraste al ADN para su visualización. El uso de un microscopio de fluorescencia permite la visualización de la sonda hibridada en el material utilizado. Información sobre las sondas Se ha descubierto que las reordenaciones cromosómicas que afectan a los extremos de los cromosomas son una causa importante de enfermedad genética debido a la abundancia de genes presentes en las regiones adyacentes a los telómeros 1. La importancia de estas reordenaciones cromosómicas subteloméricas se ha demostrado claramente gracias a la asociación observada entre este fenómeno y el retraso mental y las anomalías congénitas que no se puede explicar 2. Se han empleado sondas subteloméricas específicas individuales para estudiar regiones subteloméricas concretas, y de este modo se han establecido síndromes como el de deleción del cromosoma 36 3,10 y el síndrome de deleción de Las sondas también se están aplicando en la investigación de los trastornos autistas 5, de abortos espontáneos recurrentes 6 y de neoplasias hematológicas 7. Las sondas subteloméricas específicas de Cytocell están situadas en la región más distal del ADN cromosómico específico de cada cromosoma. Más allá de esta secuencia única se encuentra la región de 100 a 300Kb de la región de repetición telomérica seguida de la caperuza de entre 3 a 20Kb de la secuencia de repeticiones en tándem (TTAGGG) 8 n. Las sondas se han elegido de entre la secuencia única más distal para conseguir la mayor especificidad posible y para que, además, sean aplicables al análisis de rutina de la enumeración e integridad subteloméricas. El conjunto original de sondas de segunda generación deriva de los clones PAC 9 y se ha establecido en colaboración con el Instituto de Medicina Molecular, que forma parte de la Universidad de Oxford, en el Reino Unido 11. La mejora continua de los productos ha supuesto algunas sustituciones con cósmidos alternativos (35-40Kb) o clones BAC (150Kb) para mejorar la potencia de la señal o la especificidad de cromosoma. Por lo tanto, el tamaño medio de cada sonda es de 100Kb, y todas han sido mapeadas a un máximo de 600Kb del telómero real. Especificaciones de las sondas Cada casilla del aparato Chromoprobe Multiprobe -T contiene sondas subteloméricas específicas para el brazo p y el brazo q de uno de los 23 cromosomas (excepto los cromosomas acrocéntricos). Las sondas del brazo p y del brazo q para cada cromosoma están marcadas en distintos colores con dos fluorocromos de espectros independientes (brazos p en verde y brazos q en rojo respectivamente). Estas se encuentran juntas en la casilla correspondiente del Multiprobe. Gracias a este formato se cuenta con un control de hibridación interno para ambas y una identificación eficaz del cromosoma. Material incluido Cada kit contiene los siguientes reactivos, suficiente para 2 (PMP 009), 5 (PMP 008) o 10 (PMP 007) muestras de pacientes: 8. 2, 5 o 10 aparatos Chromoprobe Multiprobe -T recubiertos con 42 sondas subteloméricas marcadas directamente (mínimo de 20ng de sonda por casilla). 9. 4, 7 o 12 portas de vidrio impresos con una rejilla especial 10. 4, 7 o 12 cubres de tamaño grande (24 x 60mm) µl de solución de hibridación (formamida, sulfato de dextrano, SSC) µl de contratinción (DAPI antifade (ES: 0,125µg/ml de DAPI (4,6-diamidino-2- fenilindol)) termómetro para la superficie de los portas Cytocell cámara de hibridación del Chromoprobe Multiprobe de Cytocell Advertencias y precauciones 1. Para diagnóstico in vitro. Sólo para uso profesional. 2. Utilizar guantes al manipular las sondas de ADN y la contratinción DAPI. 3. La solución de hibridación contiene formamida, que es teratógena; no respire los vapores y evite el contacto con la piel. Utilice guantes y bata de laboratorio y trabaje bajo una campana de ventilación. Al eliminarla, lavar con agua abundante. 4. La El DAPI y PI puede producir cáncer. Manipular con cuidado; utilizar guantes y bata de laboratorio. Al eliminarla, rociar con gran cantidad de agua. 5. Las sustancias peligrosas deben eliminarse de acuerdo con las instrucciones de su institución en relación con la eliminación de sustancias peligrosas. Almacenamiento y manejo El kit Chromoprobe Multiprobe debe almacenarse a 2-8ºC hasta la fecha de caducidad que se indica en el envase. No congelar. El vial de contratinción debe almacenarse resguardado de la luz. Equipo necesarios pero no proporcionados 1. Placa caliente (con una placa sólida y un control de temperatura preciso hasta 80ºC). 2. Micropipetas de volumen variable (rango 1µl - 200µl). 3. Baño de agua con control preciso de temperatura a 72ºC. 4. Tubos de microcentrifugado (0.5ml). 5. Microscopio de fluorescencia (lea la sección Recomendaciones para el microscopio de fluorescencia). 6. Recipientes de cristal y de plástico. 7. Pinzas. 8. Microscopio de fluorescencia con objetivo de inmersión en aceite. 9. Centrífuga de banco. Page 7 of 9
8 10. Cronómetro. 11. Baño maría a 37ºC sin agitador. Recomendaciones para el microscopio de fluorescencia Para una visualización óptima de la sonda, se recomienda utilizar una lámpara de mercurio de 100 vatios y objetivos x63 o x100 Plan-Apochromat. El filtro de triple banda DAPI/FITC/Texas Red es óptimo para ver simultáneamente los tres fluorocromos. Preparación de la muestra El Chromoprobe Multiprobe -T está diseñado para trabajar con células de sangre periférica fijadas con la solución de fijación de Carnoy que debe prepararse según las instrucciones del laboratorio o la institución. Prepare las muestras secadas al aire en los portas con rejilla Chromoprobe Multiprobe de Cytocell según el protocolo de Cytocell que se incluye a continuación. No se recomienda calentar ni madurar los portas de otro modo ya que puede reducir la fluorescencia de la señal. Protocolo para Chromoprobe Multiprobe Observación: Las sondas que se emplean en el aparato Chromoprobe Multiprobe están marcadas directamente con fluorocromos sensibles a la luz. Asegúrese de que las sondas están expuestas a las luces del laboratorio durante el mínimo tiempo posible (no es necesario trabajar sin luz). 1. Preparación de los portas a) Limpieza de un porta con rejilla. Sumerja el porta con rejilla durante 2 minutos en metanol 100% y seque y abrillante con un paño suave. b) Determinación del índice mitótico correcto. Es importante que la muestra que vaya a emplear tenga un índice mitótico lo suficientemente alto para poder detectar anomalías en los cromosomas. Para comprobar la densidad de la muestra, pipetee 2µl de la suspensión celular con ayuda de una micropipeta (por ejemplo una Gilson P10 o P20) en una de las áreas libres del porta con rejilla y déjelos secar al aire. Como el volumen que se usa es muy pequeño, normalmente debe tocar suavemente el porta con la punta de la pipeta para a transferir la suspensión. Examine el porta al microscopio de contraste de fases. Si la densidad celular es demasiado alta, diluya la suspensión con fijador preparado reciente. Si el índice mitótico es demasiado bajo, centrifugue la suspensión celular a 160xg durante 10 minutos. Anote el volumen del sobrenadante, descártelo y resuspenda el sedimento de células en un volumen menor de fijador reciente. Si se ha alterado la densidad de la muestra de células, siembre 2µl de la muestra concentrada sobre otra casilla de prueba del porta y vuelva a examinar al microscopio de contraste de fases. Observación: El volumen mínimo necesario para el protocolo es de 50µl. c) Control de calidad de las muestras. Las muestras deben examinarse para determinar la presencia de citoplasma, ya que este interfiere con el protocolo in situ. Si los cromosomas parecen estar incluidos en un material granuloso cuando se examinan al microscopio de contraste de fases, los resultados se verán afectados. Un método para reducir el citoplasma es sembrar 2µl de la muestra sobre el porta con rejilla y observar cómo se extiende el fijador: en situación normal, el fijador se extenderá al máximo, retrocederá y después se evaporará. Para limpiar el citoplasma, se ha comprobado que se consiguen buenos resultados si se deja caer una gota de fijador reciente sobre el punto en que se ha realizado la siembra cuando la extensión del fijador haya alcanzado el máximo. Deje evaporar el fijador y vuelva a examinar la siembra. d) Siembra del porta. Pipetee 2µl de suspensión celular en las 24 zonas del porta con rejilla según la secuencia de casillas alternas que se muestra a continuación. Esto evitará que las siembras de células interfieran entre sí. Figura 1. Localización de las sondas en el Sistema Chromoprobe Multiprobe -T. Para facilitar la localización de la casilla 1, su posición en el aparato se ha señalado con un marcador de color. b) Asegúrese de que el porta con rejilla queda perfectamente alineado con las zonas correspondientes del aparato. Con cuidado ponga el porta sobre el aparato de forma que las gotas de la solución de hibridación entren en contacto con el porta. Aplique una presión suave y homogénea para asegurarse de que la solución de hibridación se extiende hasta los bordes de cada una de las zonas elevadas del aparato. c) Levante el porta con cuidado sujetándolo por el extremo esmerilado del porta de vidrio e inviértalo de forma que el porta con rejilla quede por debajo del aparato. Asegúrese de que el aparato no gotee sobre el porta con rejilla ya que esto podría provocar contaminación cruzada de las sondas. d) Póngalo a 37ºC (+/- 1ºC) (placa calefactora o incubadora) durante 10 minutos. 4. Instrucciones del termómetro de superficie para los portas Cytocell a) Debe comprobarse que la temperatura de la placa calefactora está a 75ºC con el termómetro de superficie para los portas Cytocell antes de realizar la desnaturalización. b) Para usar el termómetro correctamente, colóquelo sobre la superficie de la placa calefactora y espere hasta que los distintos segmentos dejen de cambiar de color. La temperatura real se indica con un marcado color aqua. Observación: c) Si los segmentos tienen aspecto granuloso y los colores no son uniformes y regulares, debe desecharse el termómetro ya que se ha gastado. La vida útil de cada termómetro debería, fácilmente, ser suficiente para un kit de diez aparatos. d) Este termómetro es un aparato de cristal líquido y, aunque reutlizable, debe tratarse con cuidado para que la vida útil sea razonable. El termómetro únicamente debe emplearse para controlar la temperatura de la placa calefactora; no debe usarse para controlar la función de la placa calefactora durante todo el tiempo. 5. Desnaturalización 2 Observación: Para este procedimiento NO puede emplearse un bloque calefactor de ciclado térmico para PCR en lugar de la placa calefactora de lecho sólido. a) Transfiera el sándwich de porta y aparato a la placa calefactora poniendo especial atención a que esté horizontal. Asegúrese de que el porta con las muestras hace buen contacto con la placa calefactora. b) Desnaturalice sobre la placa calefactora a 75ºC (+/- 1ºC) durante 2 minutos. 7. Hibridación Introduzca el sándwich de porta y aparato en la cámara de hibridación precalentada del Chromoprobe Multiprobe, vuelva a poner la tapa y deje la cámara flotando al baño maría a 37ºC (+/- 1ºC) (sin agitar) toda la noche. Observación: a) No selle la tapa de la cámara de hibridación. b) No cubra el baño maría. c) No realice la hibridación en una incubadora. d) Asegúrese de que la cámara de hibridación está totalmente seca (es decir, que no queda agua ni materiales húmedos en la cámara). La humedad del interior de la cámara es vital para una hibridación óptima. Para conseguir un nivel correcto, debe seguir estos pasos Lavados estringentes posthibridación e) Una vez que se ha secado al aire el primer grupo de gotas, siembre las casillas restantes con gotas de 2µl del mismo modo. Cuando se haya secado el porta, examínelo al microscopio de contraste de fases para comprobar que no falta ninguna de las casillas. Si falta alguna, o si las casillas tienen pocas células, simplemente vuelva a sembrar esas casillas: no es necesario utilizar un porta nuevo. Si al examinar el porta, una casilla tiene un número insuficiente de células/metafases, pueden añadirse más gota(s) de la suspensión para aumentar la densidad celular. Observación: Si las metafases aparecen demasiado dispersas, limpie un nuevo porta con rejilla cuidadosamente en metanol y vuelva a sembrar dejando que cada gota se seque antes de pasar a la siguiente. 2. Preparación del aparato Chromoprobe Multiprobe y del porta con rejilla a) Asegúrese de que la cámara de hibridación del Chromoprobe Multiprobe está al baño maría a 37ºC y déjelo llegar al equilibrio a 37ºC (+/- 1ºC). Esto puede llevar hasta una hora si el baño maría se enciende estando frío. b) Mezcle la solución de hibridación pipeteando repetidamente y precaliente una alícuota de 25µl por cada aparato a 37ºC. Precaliente también cada aparato colocándolo sobre una placa calefactora a 37ºC con el lado de la etiqueta hacia abajo. No toque las superficies elevadas del aparato. c) Sumerja los portas con rejilla que contienen las muestras fijadas en 2xSSC durante 2 minutos a temperatura ambiente (TA) sin agitar. d) Mientras el aparato está todavía a 37ºC, deshidrate los portas con rejilla que contienen las muestras fijadas en una serie de etanol (2 minutos para cada una de las concentraciones: 70%, 85% y 100%) a TA, déjelos secar al aire y colóquelos sobre una placa calefactora a 37 ºC para calentarlos. e) Usando una micropipeta P10, añada 1 µl de solución de hibridación precalentada a cada una de las 24 zonas del aparato precalentado sobre una placa calefactora a 37ºC. 3. Colocación del porta con rejilla sobre el aparato a) Con cuidado invierta el porta con rejilla sobre el aparato de tal forma que el número 1, que ahora está boca arriba, quede en la zona superior derecha del aparato (Figura 1). Observación: Evite realizar los lavados estringentes con más de dos portas a la vez. a) Retire el aparato del porta con cuidado. b) Sumerja el porta en 0,4xSSC (ph 7,0) a 72ºC (+/- 1ºC) durante 2 minutos sin agitar. c) Escurra el porta y sumérjalo en 2xSSC, Tween-20 al 0,05% a TA (ph 7,0) durante 30 segundos sin agitar. 8. Montaje y visualización de los resultados a) Escurra el porta y aplique 20µl de DAPI antifade en cada extremo del porta. b) Tápelo con un cubre (24 x 60mm), quite las burbujas y deje que el color aparezca durante 10 minutos. c) Obsérvelo al microscopio de fluorescencia. Observación: Algunos tipos de microscopio tienen pinzas de sujeción para los portas que pueden dificultar la visualización de los extremos del porta. Si esto sucediera, simplemente gire el porta 180, lo que ayudará a la observación del porta. Estabilidad de los portaobjetos terminados Los portaobjetos de FISH permanecen analizables durante 1 mes si se han almacenado en la oscuridad y por debajo de la temperatura ambiente. Recomendaciones de procedimiento 1. No se recomienda calentar ni envejecer los portaobjetos ya que se podría reducir la fluorescencia de la señal. 2. Las condiciones de hibridación pueden verse afectadas negativamente con el uso de reactivos distintos de los suministrados o recomendados por Cytocell Ltd. 3. Se recomienda encarecidamente el uso de un termómetro calibrado para medir las temperaturas de soluciones, baños de agua e incubadores ya que estas temperaturas son cruciales para el rendimiento óptimo del producto. 4. Las concentraciones del lavado (estringencia), el ph y la temperatura son importantes ya que una estringencia baja puede provocar una fijación no específica de la sonda y demasiada estringencia puede derivar en una falta de señal. 5. Una desnaturalización incompleta puede provocar falta de señal y una desnaturalización excesiva también puede originar una fijación no específica. Resultados esperados 1. Una muestra normal presentará una señal en la región telomérica de cada uno de los homólogos de los cromosomas en estudio o 2 señales en las células en interfase. 2. La PAC (dj1011o17) detecta el polimorfismo frecuente descrito por Macina et al en Si se detectara una deleción, los estudios han enfatizado la Page 8 of 9
9 importancia de analizar la deleción por FISH usando un segundo mapeo con sondas de la región 13 y analizar a los padres para determinar si es hereditaria 14. Para ello, se ha incorporado la segunda BAC, 172I13, D2S447, que está más proximal y marcada en rojo, en la casilla Y del aparato. Se presenta con una sonda de control (ter) marcada en verde. Debe enfatizarse, sin embargo, que aunque con el segundo clon de la casilla Y del aparato se posibilita un segundo análisis, debe realizarse un seguimiento de las supuestas deleciones analizando a los otros miembros de la familia para evitar confundir una deleción distal clínicamente importante con un polimorfismo o una variante normal. Sonda Hibridaciones cruzadas conocidas con y con,, 1 y con con 1 (intersticial) con y con y con con (intersticial) Limitaciones La comunicación y la interpretación de FISH debe ser conforme a los estándares de prácticas profesionales, y debe tener en consideración otros información clínica y de diagnóstico. Esta prueba está diseñada como un complemento de la citogenética clásica y no deben tomarse medidas terapéuticas basándose únicamente en el resultado de FISH. Información adicional Si desea obtener información adicional sobre el producto, póngase en contacto con el Departamento de soporte técnico de Cytocell. References/Bibliographie/Bibliographia/Literatur/Bibliografía 1. Saccone S et al., Proc Natl Acad Sci USA 1992;89: Flint J et al., Nat Genet 1997;15(3): Heilstedt HA et al., Clin Genet 2003;64(4): Luciani JJ et al., J Med Genet 2003;40(9): Wolff DJ et al., Genet in Med 2002;4(1): Yakut S et al., Clin Genet 2002;61(1): Tosi S et al., Genes Chrom Cancer 1999;25(4): Moyzis RK et al., Proc Natl Acad Sci USA 1988;85: Knight SJL et al., Am J Hum Genet 2000;67: Institute of Molecular Medicine and National Institute of Health Collaboration, Nat Genet 1997;14: Knight SJL et al., Eur J Hum Genet 1997;5: Macina RA et al., Hum Mol Genet 1994;3(10): Fan YS et al., Genet Med 2001;3(6): Knight SJ, Flint J, J Med Genet 2000;37(6):401-9 REF CONT EN: Catalogue number DE: Bestellnummer FR: Référence du catalogue IT: Riferimento di Catalogo ES: Número de catálogo EN: In vitro diagnostic device DE: In-vitro-Diagnostikum FR: Dispositif médical de diagnostic in vitro IT: Dispositivo medico-diagnostico in vitro ES: Producto sanitario para diagnóstico in vitro EN: Batch code DE: Loscode FR: Code du lot IT: Codice di lotto ES: Código EN: Consult instructions for use DE: Gebrauchsanweisung beachten FR: Consulter la notice d'utilisation IT: Consultare le istruzioni per l'uso ES: Consúltense las instrucciones de uso EN: Manufacturer DE: Hersteller FR: Fabricant IT: Fabbricante ES: Fabricante EN: Use by DE: Verwendbar bis FR: Utiliser jusqu au IT: Utilizzare entro ES: Fecha de caducidad EN: Temperature limitation DE: Temperaturbegrenzung FR: Limites de température IT: Limiti di temperatura ES: Limitación de temperatura EN: Sufficient for <n> tests DE: Ausreichend für FR: Suffisant pour IT: Sufficiente per ES: Válido para EN: Contents DE: Inhalt FR: Contenu IT: Contenuto ES: Contenido Patents and Trademarks Chromoprobe, Cytocell and Chromoprobe Multiprobe are registered trademarks of Cytocell Ltd. The Chromoprobe principle is covered by international patents WO , EP The design of the Multiprobe is a registered design and is also covered by a Design Patent No. 420,745. This product contains technology licensed from Life Technologies Corporation and is available for human diagnostics or life science research use only. Cytocell Ltd. 3-4 Technopark Newmarket Road Cambridge, CB5 8PB, UK. T: +44(0) F: +44(0) E: probes@cytocell.com Page 9 of 9
11 EN 81-70 Page 1 of 2 Standard: INTERPRETATION RELATED TO. Clause(s): 5.4.2.3
 CEN RELATED TO 11 Page 1 of 2 Standard: Edition: 2003 Clause(s): 5.4.2.3 Valid from: 15/09/2010 Date of modification: Key-word(s): Car operating panel, Two entrance lift Replacing interpretation No.: QUESTION
CEN RELATED TO 11 Page 1 of 2 Standard: Edition: 2003 Clause(s): 5.4.2.3 Valid from: 15/09/2010 Date of modification: Key-word(s): Car operating panel, Two entrance lift Replacing interpretation No.: QUESTION
TAVOLI DA LAVORO SU GAMBE WORK TABLES TABLES DE TRAVAIL CABINETS ARBEITSTISCHE
 IT I nuovi tavoli su gambe sono costruiti con un rivoluzionario sistema che permette di assemblare il prodotto in pochi secondi, consentendo rapidità di montaggio e al contempo permettendo di ridurre i
IT I nuovi tavoli su gambe sono costruiti con un rivoluzionario sistema che permette di assemblare il prodotto in pochi secondi, consentendo rapidità di montaggio e al contempo permettendo di ridurre i
VGM. VGM information. HAMBURG SÜD VGM WEB PORTAL USER GUIDE June 2016
 Overview The Hamburg Süd VGM Web portal is an application that enables you to submit VGM information directly to Hamburg Süd via our e-portal Web page. You can choose to enter VGM information directly,
Overview The Hamburg Süd VGM Web portal is an application that enables you to submit VGM information directly to Hamburg Süd via our e-portal Web page. You can choose to enter VGM information directly,
Electrical tests on Bosch unit injectors
 Valid for Bosch unit injectors with order numbers 0 414 700 / 0 414 701 / 0 414 702 Parts Kit Magnet*: - F00H.N37.925 - F00H.N37.933 - F00H.N37.934 * For allocation to the 10-place Bosch order number,
Valid for Bosch unit injectors with order numbers 0 414 700 / 0 414 701 / 0 414 702 Parts Kit Magnet*: - F00H.N37.925 - F00H.N37.933 - F00H.N37.934 * For allocation to the 10-place Bosch order number,
Snap-in switch for switches PSE, MSM and MCS 30
 Product manual Snap-in switch for switches PSE, MSM and MCS 30 CONTENTS 1. PRODUCT DESCRIPTION 2. DATA AND DIMENSIONAL DRAWINGS 2.1. Technical Data 2.2. Dimensions of PSE with a Mounting Diameter 19 mm
Product manual Snap-in switch for switches PSE, MSM and MCS 30 CONTENTS 1. PRODUCT DESCRIPTION 2. DATA AND DIMENSIONAL DRAWINGS 2.1. Technical Data 2.2. Dimensions of PSE with a Mounting Diameter 19 mm
VGM. VGM information. HAMBURG SÜD VGM WEB PORTAL - USER GUIDE June 2016
 Overview The Hamburg Süd VGM-Portal is an application which enables to submit VGM information directly to Hamburg Süd via our e-portal web page. You can choose to insert VGM information directly, or download
Overview The Hamburg Süd VGM-Portal is an application which enables to submit VGM information directly to Hamburg Süd via our e-portal web page. You can choose to insert VGM information directly, or download
INSTALLAZIONE INSTALLATION MONTAGE EINBAU
 INSTALLAZIONE INSTALLATION MONTAGE EINBAU MANUTENZIONE SOFFIONI MySlim ISPEZIONABILI MAINTENANCE OF MySlim INSPECTABLE&SERVICEABLE SHOWER HEADS ENTRETIEN DES POMMES DE DOUCHE MySlim INSPECTABLES WARTUNG
INSTALLAZIONE INSTALLATION MONTAGE EINBAU MANUTENZIONE SOFFIONI MySlim ISPEZIONABILI MAINTENANCE OF MySlim INSPECTABLE&SERVICEABLE SHOWER HEADS ENTRETIEN DES POMMES DE DOUCHE MySlim INSPECTABLES WARTUNG
Electrical testing of Bosch common rail piezo injectors
 Applies to generation CRI 3: Bosch 10-position order number 0 445 115 = CRI 3-16 (CRI 3.0) 1600 bar 0 445 116 = CRI 3-18 (CRI 3.2) 1800 bar 0 445 117 = CRI 3-20 (CRI 3.3) 2000 bar Tools required: Hybrid
Applies to generation CRI 3: Bosch 10-position order number 0 445 115 = CRI 3-16 (CRI 3.0) 1600 bar 0 445 116 = CRI 3-18 (CRI 3.2) 1800 bar 0 445 117 = CRI 3-20 (CRI 3.3) 2000 bar Tools required: Hybrid
OPERATING INSTRUCTIONS Test pump ZG 5.1. and ZG 5.2.
 Elektromotoren und Gerätebau Barleben GmbH OPERATING INSTRUCTIONS Test pump ZG 5.1. and ZG 5.2. Elektromotoren und Gerätebau Barleben GmbH 2 Inhaltsverzeichnis Page 1 Use 4 2 Design features 4 2.1 Test
Elektromotoren und Gerätebau Barleben GmbH OPERATING INSTRUCTIONS Test pump ZG 5.1. and ZG 5.2. Elektromotoren und Gerätebau Barleben GmbH 2 Inhaltsverzeichnis Page 1 Use 4 2 Design features 4 2.1 Test
2 IP X4 WLS/FL IP24. Montage-Anleitung Instructions de montage Assembling instructions. 225 cm. 60 cm 0
 WLS/FL IP Arbeiten an den elektrischen Anlagen dürfen nur von autorisierten Fachleuten nach den örtlichen Vorschriften ausgeführt werden. Für nicht fachgerechte Installation wird jegliche Haftung abgelehnt.
WLS/FL IP Arbeiten an den elektrischen Anlagen dürfen nur von autorisierten Fachleuten nach den örtlichen Vorschriften ausgeführt werden. Für nicht fachgerechte Installation wird jegliche Haftung abgelehnt.
Electrical testing of Bosch common rail solenoid valve (MV) injectors
 Applies to MV injector, generation: -CRI 1.0 / 2.0 / 2.1 / 2.2 -CRIN 1 / 2 / 3, with K oder AK plug Bosch 10-position order number Bosch-Bestellnummer CRI: 0 445 110 xxx Bosch-Bestellnummer CRIN: 0 445
Applies to MV injector, generation: -CRI 1.0 / 2.0 / 2.1 / 2.2 -CRIN 1 / 2 / 3, with K oder AK plug Bosch 10-position order number Bosch-Bestellnummer CRI: 0 445 110 xxx Bosch-Bestellnummer CRIN: 0 445
p^db=`oj===pìééçêíáåñçêã~íáçå=
 p^db=`oj===pìééçêíáåñçêã~íáçå= Error: "Could not connect to the SQL Server Instance" or "Failed to open a connection to the database." When you attempt to launch ACT! by Sage or ACT by Sage Premium for
p^db=`oj===pìééçêíáåñçêã~íáçå= Error: "Could not connect to the SQL Server Instance" or "Failed to open a connection to the database." When you attempt to launch ACT! by Sage or ACT by Sage Premium for
QuickGEN Sample Preparation Filtration
 QuickGEN Filtration INSTITUT FÜR ANGEWANDTE LABORANALYSEN GMBH QuickGEN Sample Preparation Filtration Art. Nr./ Order No.: FSE 0100 Version 11/16 GEN-IAL GmbH Tel: 0049 2241 2522980 Fax: 0049 2241 2522989
QuickGEN Filtration INSTITUT FÜR ANGEWANDTE LABORANALYSEN GMBH QuickGEN Sample Preparation Filtration Art. Nr./ Order No.: FSE 0100 Version 11/16 GEN-IAL GmbH Tel: 0049 2241 2522980 Fax: 0049 2241 2522989
p^db=`oj===pìééçêíáåñçêã~íáçå=
 p^db=`oj===pìééçêíáåñçêã~íáçå= How to Disable User Account Control (UAC) in Windows Vista You are attempting to install or uninstall ACT! when Windows does not allow you access to needed files or folders.
p^db=`oj===pìééçêíáåñçêã~íáçå= How to Disable User Account Control (UAC) in Windows Vista You are attempting to install or uninstall ACT! when Windows does not allow you access to needed files or folders.
 Verwenden Sie nur Original-KRONE-Ersatzteile! Das gibt Sicherheit und spart Kosten! Use Original-KRONE parts only This will increase operational reliability and help to save costs! N'utiliser que des piéces
Verwenden Sie nur Original-KRONE-Ersatzteile! Das gibt Sicherheit und spart Kosten! Use Original-KRONE parts only This will increase operational reliability and help to save costs! N'utiliser que des piéces
 Verwenden Sie nur Original-KRONE-Ersatzteile! Das gibt Sicherheit und spart Kosten! Use Original-KRONE parts only This will increase operational reliability and help to save costs! N'utiliser que des piéces
Verwenden Sie nur Original-KRONE-Ersatzteile! Das gibt Sicherheit und spart Kosten! Use Original-KRONE parts only This will increase operational reliability and help to save costs! N'utiliser que des piéces
 Verwenden Sie nur Original-KRONE-Ersatzteile! Das gibt Sicherheit und spart Kosten! Use Original-KRONE parts only This will increase operational reliability and help to save costs! N'utiliser que des piéces
Verwenden Sie nur Original-KRONE-Ersatzteile! Das gibt Sicherheit und spart Kosten! Use Original-KRONE parts only This will increase operational reliability and help to save costs! N'utiliser que des piéces
Simplex Easy DNA kit
 Simplex Easy DNA INSTITUT FÜR ANGEWANDTE LABORANALYSEN GMBH Simplex Easy DNA kit Schnelle DNA-Extraktion aus Bakterien und Hefen Fast DNA-extraction from bacteria and yeast Art. Nr./ Order No.: SE 0100;
Simplex Easy DNA INSTITUT FÜR ANGEWANDTE LABORANALYSEN GMBH Simplex Easy DNA kit Schnelle DNA-Extraktion aus Bakterien und Hefen Fast DNA-extraction from bacteria and yeast Art. Nr./ Order No.: SE 0100;
Scheduling. chemistry. math. history. physics. art
 Scheduling Consider the following problem: in a university, assign exams to time slots in such a way: ) every student can do the exams of the courses he is taking; ) the total number of used time slots
Scheduling Consider the following problem: in a university, assign exams to time slots in such a way: ) every student can do the exams of the courses he is taking; ) the total number of used time slots
Test Report. Test of resitance to inertia effects of Zirkona Backwall. Sled Test (Frontal Impact) 20 g / 30 ms
 Test Report Test of resitance to inertia effects of Zirkona Backwall Sled Test (Frontal Impact) 20 g / 30 ms This report serves solely as a documentation of test results. 93XS0002-00_TdC.doc Page 1 1.
Test Report Test of resitance to inertia effects of Zirkona Backwall Sled Test (Frontal Impact) 20 g / 30 ms This report serves solely as a documentation of test results. 93XS0002-00_TdC.doc Page 1 1.
durlum GmbH
 6 LUMEO -R, der elegante Klassiker unter den Lichtflächen, setzt Architektur gekonnt in Szene. In unterschiedlichen Größen verfügbar, ist die als Einbau-, Anbau- oder Pendelvariante verfügbare Leuchte
6 LUMEO -R, der elegante Klassiker unter den Lichtflächen, setzt Architektur gekonnt in Szene. In unterschiedlichen Größen verfügbar, ist die als Einbau-, Anbau- oder Pendelvariante verfügbare Leuchte
Cleaning & Disinfection of Eickview Videoendoscopes
 Cleaning & Disinfection of Eickview Videoendoscopes EICKEMEYER KG Eltastrasse 8 78532 Tuttlingen T +497461 96 580 0 F +497461 96 580 90 E info@eickemeyer.de www.eickemeyer.de Preparation Cleaning should
Cleaning & Disinfection of Eickview Videoendoscopes EICKEMEYER KG Eltastrasse 8 78532 Tuttlingen T +497461 96 580 0 F +497461 96 580 90 E info@eickemeyer.de www.eickemeyer.de Preparation Cleaning should
Programmieranleitung CADAS 100 LPG 158
 Kupfer Programmieranleitung CADAS 100 LPG 158 Küvetten-Test LCK 529 Seite 1 Ausgabe 98/04 Achtung! Das Ausgabedatum dieser Programmieranleitung muß mit dem Ausgabedatum der Arbeitsvorschrift der Reagenzien
Kupfer Programmieranleitung CADAS 100 LPG 158 Küvetten-Test LCK 529 Seite 1 Ausgabe 98/04 Achtung! Das Ausgabedatum dieser Programmieranleitung muß mit dem Ausgabedatum der Arbeitsvorschrift der Reagenzien
Magic Figures. We note that in the example magic square the numbers 1 9 are used. All three rows (columns) have equal sum, called the magic number.
 Magic Figures Introduction: This lesson builds on ideas from Magic Squares. Students are introduced to a wider collection of Magic Figures and consider constraints on the Magic Number associated with such
Magic Figures Introduction: This lesson builds on ideas from Magic Squares. Students are introduced to a wider collection of Magic Figures and consider constraints on the Magic Number associated with such
1. General information... 2 2. Login... 2 3. Home... 3 4. Current applications... 3
 User Manual for Marketing Authorisation and Lifecycle Management of Medicines Inhalt: User Manual for Marketing Authorisation and Lifecycle Management of Medicines... 1 1. General information... 2 2. Login...
User Manual for Marketing Authorisation and Lifecycle Management of Medicines Inhalt: User Manual for Marketing Authorisation and Lifecycle Management of Medicines... 1 1. General information... 2 2. Login...
SAMPLE EXAMINATION BOOKLET
 S SAMPLE EXAMINATION BOOKLET New Zealand Scholarship German Time allowed: Three hours Total marks: 24 EXAMINATION BOOKLET Question ONE TWO Mark There are three questions. You should answer Question One
S SAMPLE EXAMINATION BOOKLET New Zealand Scholarship German Time allowed: Three hours Total marks: 24 EXAMINATION BOOKLET Question ONE TWO Mark There are three questions. You should answer Question One
Mock Exam Behavioral Finance
 Mock Exam Behavioral Finance For the following 4 questions you have 60 minutes. You may receive up to 60 points, i.e. on average you should spend about 1 minute per point. Please note: You may use a pocket
Mock Exam Behavioral Finance For the following 4 questions you have 60 minutes. You may receive up to 60 points, i.e. on average you should spend about 1 minute per point. Please note: You may use a pocket
Multi Device. Ein Vertrag eine Rufnummer Surfen und telefonieren mit mehreren Geräten.
 Multi Device Ein Vertrag eine Rufnummer Surfen und telefonieren mit mehreren Geräten. Un contrat un numéro de téléphone Surfez et téléphonez avec plusieurs appareils. Un contratto un numero di telefono
Multi Device Ein Vertrag eine Rufnummer Surfen und telefonieren mit mehreren Geräten. Un contrat un numéro de téléphone Surfez et téléphonez avec plusieurs appareils. Un contratto un numero di telefono
08/12. Gebrauchsanleitung Trekkingrucksäcke Trekking rucksacks Instructions for use Notice d'emploi pour sacs à dos de trek
 08/12 Gebrauchsanleitung Trekkingrucksäcke Trekking rucksacks Instructions for use Notice d'emploi pour sacs à dos de trek X-TRANSITION Bedingungen der JACK WOLFSKIN 3-Jahres-Gewährleistung Terms and
08/12 Gebrauchsanleitung Trekkingrucksäcke Trekking rucksacks Instructions for use Notice d'emploi pour sacs à dos de trek X-TRANSITION Bedingungen der JACK WOLFSKIN 3-Jahres-Gewährleistung Terms and
Programmieranleitung CADAS 100 LPG 210
 Programmieranleitung CADAS 100 LPG 210 Küvetten-Test LCK 555 Seite 1 BSB 5 BSB [n] Ausgabe 9804 Achtung! Das Ausgabedatum dieser Programmieranleitung muß mit dem Ausgabedatum der Arbeitsvorschrift der
Programmieranleitung CADAS 100 LPG 210 Küvetten-Test LCK 555 Seite 1 BSB 5 BSB [n] Ausgabe 9804 Achtung! Das Ausgabedatum dieser Programmieranleitung muß mit dem Ausgabedatum der Arbeitsvorschrift der
Electrical testing of Bosch common rail Injectors
 Electrical testing of Bosch common rail Injectors Contents: 1. Adapter cable for Hybridtester FSA 050 (article number 0 684 010 050 / 1 687 023 571) 2. Electrical testing of Bosch common rail solenoid
Electrical testing of Bosch common rail Injectors Contents: 1. Adapter cable for Hybridtester FSA 050 (article number 0 684 010 050 / 1 687 023 571) 2. Electrical testing of Bosch common rail solenoid
 Verwenden Sie nur Original-KRONE-Ersatzteile! Das gibt Sicherheit und spart Kosten! Use Original-KRONE parts only This will increase operational reliability and help to save costs! N'utiliser que des piéces
Verwenden Sie nur Original-KRONE-Ersatzteile! Das gibt Sicherheit und spart Kosten! Use Original-KRONE parts only This will increase operational reliability and help to save costs! N'utiliser que des piéces
 Verwenden Sie nur Original-KRONE-Ersatzteile! Das gibt Sicherheit und spart Kosten! Use Original-KRONE parts only This will increase operational reliability and help to save costs! N'utiliser que des piéces
Verwenden Sie nur Original-KRONE-Ersatzteile! Das gibt Sicherheit und spart Kosten! Use Original-KRONE parts only This will increase operational reliability and help to save costs! N'utiliser que des piéces
 Verwenden Sie nur Original-KRONE-Ersatzteile! Das gibt Sicherheit und spart Kosten! Use Original-KRONE parts only This will increase operational reliability and help to save costs! N'utiliser que des piéces
Verwenden Sie nur Original-KRONE-Ersatzteile! Das gibt Sicherheit und spart Kosten! Use Original-KRONE parts only This will increase operational reliability and help to save costs! N'utiliser que des piéces
 Verwenden Sie nur Original-KRONE-Ersatzteile! Das gibt Sicherheit und spart Kosten! Use Original-KRONE parts only This will increase operational reliability and help to save costs! N'utiliser que des piéces
Verwenden Sie nur Original-KRONE-Ersatzteile! Das gibt Sicherheit und spart Kosten! Use Original-KRONE parts only This will increase operational reliability and help to save costs! N'utiliser que des piéces
Johannes Bachmann, Silvia Keilholz
 Johannes Bachmann, Silvia Keilholz Spring mortality *common carps die with few or without any pathological signs *average body condition *no death causing organisms/ explanations *First detection of CEV
Johannes Bachmann, Silvia Keilholz Spring mortality *common carps die with few or without any pathological signs *average body condition *no death causing organisms/ explanations *First detection of CEV
DIBELS TM. German Translations of Administration Directions
 DIBELS TM German Translations of Administration Directions Note: These translations can be used with students having limited English proficiency and who would be able to understand the DIBELS tasks better
DIBELS TM German Translations of Administration Directions Note: These translations can be used with students having limited English proficiency and who would be able to understand the DIBELS tasks better
NEWSLETTER. FileDirector Version 2.5 Novelties. Filing system designer. Filing system in WinClient
 Filing system designer FileDirector Version 2.5 Novelties FileDirector offers an easy way to design the filing system in WinClient. The filing system provides an Explorer-like structure in WinClient. The
Filing system designer FileDirector Version 2.5 Novelties FileDirector offers an easy way to design the filing system in WinClient. The filing system provides an Explorer-like structure in WinClient. The
Brand Label. Daimler Brand & Design Navigator
 Daimler Brand & Design Navigator 30. März 2016 Brand Label FUSO Financial uses the FUSO letters in combination with the word Financial in the font Daimler CS for name and label. Black lettering is set
Daimler Brand & Design Navigator 30. März 2016 Brand Label FUSO Financial uses the FUSO letters in combination with the word Financial in the font Daimler CS for name and label. Black lettering is set
DENTAL IMPLANTS BY CAMLOG medical
 IMPLANT PASS DENTAL IMPLANTS BY CAMLOG medical devices made in germany for your well-being and a natural appearance. Personal data Surname First name Address ZIP code City Date of birth Health insurance
IMPLANT PASS DENTAL IMPLANTS BY CAMLOG medical devices made in germany for your well-being and a natural appearance. Personal data Surname First name Address ZIP code City Date of birth Health insurance
Rev. Proc Information
 Rev. Proc. 2006-32 Information 2006, CPAs 1 Table 1-Total loss of the home Table 2- Near total loss is water to the roofline. Completely gut the home from floor to rafters - wiring, plumbing, electrical
Rev. Proc. 2006-32 Information 2006, CPAs 1 Table 1-Total loss of the home Table 2- Near total loss is water to the roofline. Completely gut the home from floor to rafters - wiring, plumbing, electrical
Englisch-Grundwortschatz
 Englisch-Grundwortschatz Die 100 am häufigsten verwendeten Wörter also auch so so in in even sogar on an / bei / in like wie / mögen their with but first only and time find you get more its those because
Englisch-Grundwortschatz Die 100 am häufigsten verwendeten Wörter also auch so so in in even sogar on an / bei / in like wie / mögen their with but first only and time find you get more its those because
Programmieranleitung CADAS 100 LPG 158
 Programmieranleitung CADAS 100 LPG 158 Ammonium-Stickstoff Küvetten-Test LCK 304 Seite 1 Ausgabe 98/04 Achtung! Das Ausgabedatum dieser Programmieranleitung muß mit dem Ausgabedatum der Arbeitsvorschrift
Programmieranleitung CADAS 100 LPG 158 Ammonium-Stickstoff Küvetten-Test LCK 304 Seite 1 Ausgabe 98/04 Achtung! Das Ausgabedatum dieser Programmieranleitung muß mit dem Ausgabedatum der Arbeitsvorschrift
Rat Control HZ-DEV99RC 001 2016-04. Rat control sera suitable for internal control quality of the following HOELZEL ELISAs:
 Rat Control Rat control sera suitable for internal control quality of the following HOELZEL ELISAs: Testosterone rat/mouse Corticosterone rat/mouse Prolactin rat TSH rat (HZ-DEV9911) (HZ-DEV9922) (HZ-DEV9966)
Rat Control Rat control sera suitable for internal control quality of the following HOELZEL ELISAs: Testosterone rat/mouse Corticosterone rat/mouse Prolactin rat TSH rat (HZ-DEV9911) (HZ-DEV9922) (HZ-DEV9966)
Programmieranleitung CADAS 100 LPG 158
 Wasserhärte Programmieranleitung CADAS 100 LPG 158 Küvetten-Test LCK 327 Seite 1 Ausgabe 97/06 Achtung! Das Ausgabedatum dieser Programmieranleitung muß mit dem Ausgabedatum der Arbeitsvorschrift der Reagenzien
Wasserhärte Programmieranleitung CADAS 100 LPG 158 Küvetten-Test LCK 327 Seite 1 Ausgabe 97/06 Achtung! Das Ausgabedatum dieser Programmieranleitung muß mit dem Ausgabedatum der Arbeitsvorschrift der Reagenzien
Word-CRM-Upload-Button. User manual
 Word-CRM-Upload-Button User manual Word-CRM-Upload for MS CRM 2011 Content 1. Preface... 3 2. Installation... 4 2.1. Requirements... 4 2.1.1. Clients... 4 2.2. Installation guidelines... 5 2.2.1. Client...
Word-CRM-Upload-Button User manual Word-CRM-Upload for MS CRM 2011 Content 1. Preface... 3 2. Installation... 4 2.1. Requirements... 4 2.1.1. Clients... 4 2.2. Installation guidelines... 5 2.2.1. Client...
Cycling. and / or Trams
 Cycling and / or Trams Experiences from Bern, Switzerland Roland Pfeiffer, Departement for cycling traffic, City of Bern Seite 1 A few words about Bern Seite 2 A few words about Bern Capital of Switzerland
Cycling and / or Trams Experiences from Bern, Switzerland Roland Pfeiffer, Departement for cycling traffic, City of Bern Seite 1 A few words about Bern Seite 2 A few words about Bern Capital of Switzerland
prorm Budget Planning promx GmbH Nordring Nuremberg
 prorm Budget Planning Budget Planning Business promx GmbH Nordring 100 909 Nuremberg E-Mail: support@promx.net Content WHAT IS THE prorm BUDGET PLANNING? prorm Budget Planning Overview THE ADVANTAGES OF
prorm Budget Planning Budget Planning Business promx GmbH Nordring 100 909 Nuremberg E-Mail: support@promx.net Content WHAT IS THE prorm BUDGET PLANNING? prorm Budget Planning Overview THE ADVANTAGES OF
Hama GmbH & Co KG D Monheim/Germany
 Hama GmbH & Co KG D-86651 Monheim/Germany www.hama.com All listed brands are trademarks of the corresponding companies. Errors and omissions excepted, and subject to technical changes. Our general terms
Hama GmbH & Co KG D-86651 Monheim/Germany www.hama.com All listed brands are trademarks of the corresponding companies. Errors and omissions excepted, and subject to technical changes. Our general terms
Registration of residence at Citizens Office (Bürgerbüro)
 Registration of residence at Citizens Office (Bürgerbüro) Opening times in the Citizens Office (Bürgerbüro): Monday to Friday 08.30 am 12.30 pm Thursday 14.00 pm 17.00 pm or by appointment via the Citizens
Registration of residence at Citizens Office (Bürgerbüro) Opening times in the Citizens Office (Bürgerbüro): Monday to Friday 08.30 am 12.30 pm Thursday 14.00 pm 17.00 pm or by appointment via the Citizens
Cycling and (or?) Trams
 Cycling and (or?) Trams Can we support both? Experiences from Berne, Switzerland Roland Pfeiffer, Departement for cycling traffic, City of Bern Seite 1 A few words about Bern Seite 2 A few words about
Cycling and (or?) Trams Can we support both? Experiences from Berne, Switzerland Roland Pfeiffer, Departement for cycling traffic, City of Bern Seite 1 A few words about Bern Seite 2 A few words about
Die Bedeutung neurowissenschaftlicher Erkenntnisse für die Werbung (German Edition)
 Die Bedeutung neurowissenschaftlicher Erkenntnisse für die Werbung (German Edition) Lisa Johann Click here if your download doesn"t start automatically Download and Read Free Online Die Bedeutung neurowissenschaftlicher
Die Bedeutung neurowissenschaftlicher Erkenntnisse für die Werbung (German Edition) Lisa Johann Click here if your download doesn"t start automatically Download and Read Free Online Die Bedeutung neurowissenschaftlicher
All waves. Toutes les Vagues. Alle wellen. Tutte le onde
 Household Master File Master File Ménage Haushalt Master File Master File economia All waves Toutes les Vagues Alle wellen Tutte le onde Légende Legende Legenda Legend Original Variable issue directement
Household Master File Master File Ménage Haushalt Master File Master File economia All waves Toutes les Vagues Alle wellen Tutte le onde Légende Legende Legenda Legend Original Variable issue directement
Newest Generation of the BS2 Corrosion/Warning and Measurement System
 Newest Generation of the BS2 Corrosion/Warning and Measurement System BS2 System Description: BS2 CorroDec 2G is a cable and energyless system module range for detecting corrosion, humidity and prevailing
Newest Generation of the BS2 Corrosion/Warning and Measurement System BS2 System Description: BS2 CorroDec 2G is a cable and energyless system module range for detecting corrosion, humidity and prevailing
Uhrenbeweger Watch winders. Crystal
 Uhrenbeweger Watch winders Crystal Sehr geehrter Kunde, unsere Uhrenbeweger sind so konstruiert, dass sie trotz kompakter Abmessungen nur geringe Laufgeräusche verursachen. Jeder Antrieb erzeugt jedoch
Uhrenbeweger Watch winders Crystal Sehr geehrter Kunde, unsere Uhrenbeweger sind so konstruiert, dass sie trotz kompakter Abmessungen nur geringe Laufgeräusche verursachen. Jeder Antrieb erzeugt jedoch
Level 1 German, 2012
 90886 908860 1SUPERVISOR S Level 1 German, 2012 90886 Demonstrate understanding of a variety of German texts on areas of most immediate relevance 9.30 am Tuesday 13 November 2012 Credits: Five Achievement
90886 908860 1SUPERVISOR S Level 1 German, 2012 90886 Demonstrate understanding of a variety of German texts on areas of most immediate relevance 9.30 am Tuesday 13 November 2012 Credits: Five Achievement
Algorithms for graph visualization
 Algorithms for graph visualization Project - Orthogonal Grid Layout with Small Area W INTER SEMESTER 2013/2014 Martin No llenburg KIT Universita t des Landes Baden-Wu rttemberg und nationales Forschungszentrum
Algorithms for graph visualization Project - Orthogonal Grid Layout with Small Area W INTER SEMESTER 2013/2014 Martin No llenburg KIT Universita t des Landes Baden-Wu rttemberg und nationales Forschungszentrum
Wissen schafft Fortschritt
 Wissen schafft Fortschritt» Thermal analysis of six heat-reflective exterior paints on concrete under irradiation 20130730 Dr. Julius Nickl Geschäftsführer Senior-Experte für industrielle Prozesse und
Wissen schafft Fortschritt» Thermal analysis of six heat-reflective exterior paints on concrete under irradiation 20130730 Dr. Julius Nickl Geschäftsführer Senior-Experte für industrielle Prozesse und
Guidance Notes for the eservice 'Marketing Authorisation & Lifecycle Management of Medicines' Contents
 Guidance Notes for the eservice 'Marketing Authorisation & Lifecycle Management of Medicines' Contents Login... 2 No active procedure at the moment... 3 'Active' procedure... 4 New communication (procedure
Guidance Notes for the eservice 'Marketing Authorisation & Lifecycle Management of Medicines' Contents Login... 2 No active procedure at the moment... 3 'Active' procedure... 4 New communication (procedure
Lukas Hydraulik GmbH Weinstraße 39 D Erlangen. Mr. Sauerbier. Lukas Hydraulik GmbH Weinstraße 39 D Erlangen
 Technical Report No. 028-71 30 95685-350 of 22.02.2017 Client: Lukas Hydraulik GmbH Weinstraße 39 D-91058 Erlangen Mr. Sauerbier Manufacturing location: Lukas Hydraulik GmbH Weinstraße 39 D-91058 Erlangen
Technical Report No. 028-71 30 95685-350 of 22.02.2017 Client: Lukas Hydraulik GmbH Weinstraße 39 D-91058 Erlangen Mr. Sauerbier Manufacturing location: Lukas Hydraulik GmbH Weinstraße 39 D-91058 Erlangen
Tube Analyzer LogViewer 2.3
 Tube Analyzer LogViewer 2.3 User Manual Stand: 25.9.2015 Seite 1 von 11 Name Company Date Designed by WKS 28.02.2013 1 st Checker 2 nd Checker Version history Version Author Changes Date 1.0 Created 19.06.2015
Tube Analyzer LogViewer 2.3 User Manual Stand: 25.9.2015 Seite 1 von 11 Name Company Date Designed by WKS 28.02.2013 1 st Checker 2 nd Checker Version history Version Author Changes Date 1.0 Created 19.06.2015
Texte en français plus bas Testo in italiano sotto
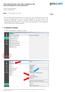 Thema Videovermittung / Relais vidéo / Collegamento video Video-Einstellungen der Anrufer-Applikationen Texte en français plus bas Testo in italiano sotto Datum 12.01.2018/17.01.2018 Technik Die unterstehenden
Thema Videovermittung / Relais vidéo / Collegamento video Video-Einstellungen der Anrufer-Applikationen Texte en français plus bas Testo in italiano sotto Datum 12.01.2018/17.01.2018 Technik Die unterstehenden
Funktion der Mindestreserve im Bezug auf die Schlüsselzinssätze der EZB (German Edition)
 Funktion der Mindestreserve im Bezug auf die Schlüsselzinssätze der EZB (German Edition) Philipp Heckele Click here if your download doesn"t start automatically Download and Read Free Online Funktion
Funktion der Mindestreserve im Bezug auf die Schlüsselzinssätze der EZB (German Edition) Philipp Heckele Click here if your download doesn"t start automatically Download and Read Free Online Funktion
1,2-1,8 TON TWIST 100 TWIST 100
 1,2-1,8 TWIST 100 L attuatore idraulico bi-direzionale Cangini permette di inclinare attrezzature o attacchi rapidi fino ad un angolazione di, facilitando le operazioni di scavo, anche in posizioni difficili
1,2-1,8 TWIST 100 L attuatore idraulico bi-direzionale Cangini permette di inclinare attrezzature o attacchi rapidi fino ad un angolazione di, facilitando le operazioni di scavo, anche in posizioni difficili
Martin Luther. Click here if your download doesn"t start automatically
 Die schönsten Kirchenlieder von Luther (Vollständige Ausgabe): Gesammelte Gedichte: Ach Gott, vom Himmel sieh darein + Nun bitten wir den Heiligen Geist... der Unweisen Mund... (German Edition) Martin
Die schönsten Kirchenlieder von Luther (Vollständige Ausgabe): Gesammelte Gedichte: Ach Gott, vom Himmel sieh darein + Nun bitten wir den Heiligen Geist... der Unweisen Mund... (German Edition) Martin
Lukas Hydraulik GmbH Weinstraße 39 D Erlangen. Mr. Sauerbier. Lukas Hydraulik GmbH Weinstraße 39 D Erlangen. edraulic rescue equipment
 Technical Report No. 028-7130 95685-050 of 22.02.2017 Client: Lukas Hydraulik GmbH Weinstraße 39 D-91058 Erlangen Mr. Sauerbier Manufacturing location: Lukas Hydraulik GmbH Weinstraße 39 D-91058 Erlangen
Technical Report No. 028-7130 95685-050 of 22.02.2017 Client: Lukas Hydraulik GmbH Weinstraße 39 D-91058 Erlangen Mr. Sauerbier Manufacturing location: Lukas Hydraulik GmbH Weinstraße 39 D-91058 Erlangen
Montageanleitung Installation Instructions Notice de Montage
 Montageanleitung Installation Instructions Notice de Montage R Reflexlichtschranke / Reflexlichttaster Retro-reflective sensor / Diffuse reflection sensor Système réflex / Système réflexion directe OE
Montageanleitung Installation Instructions Notice de Montage R Reflexlichtschranke / Reflexlichttaster Retro-reflective sensor / Diffuse reflection sensor Système réflex / Système réflexion directe OE
CABLE TESTER. Manual DN-14003
 CABLE TESTER Manual DN-14003 Note: Please read and learn safety instructions before use or maintain the equipment This cable tester can t test any electrified product. 9V reduplicated battery is used in
CABLE TESTER Manual DN-14003 Note: Please read and learn safety instructions before use or maintain the equipment This cable tester can t test any electrified product. 9V reduplicated battery is used in
Programmieranleitung CADAS 100 LPG 210
 Phosphat-Phosphor Programmieranleitung CADAS 100 PG 210 Küvetten-Test Seite 1 CK 350 Ausgabe 91/03 Achtung! Das Ausgabedatum dieser Programmieranleitung muß mit dem Ausgabedatum der Arbeitsvorschrift der
Phosphat-Phosphor Programmieranleitung CADAS 100 PG 210 Küvetten-Test Seite 1 CK 350 Ausgabe 91/03 Achtung! Das Ausgabedatum dieser Programmieranleitung muß mit dem Ausgabedatum der Arbeitsvorschrift der
DAS ERSTE MAL UND IMMER WIEDER. ERWEITERTE SONDERAUSGABE BY LISA MOOS
 Read Online and Download Ebook DAS ERSTE MAL UND IMMER WIEDER. ERWEITERTE SONDERAUSGABE BY LISA MOOS DOWNLOAD EBOOK : DAS ERSTE MAL UND IMMER WIEDER. ERWEITERTE Click link bellow and free register to download
Read Online and Download Ebook DAS ERSTE MAL UND IMMER WIEDER. ERWEITERTE SONDERAUSGABE BY LISA MOOS DOWNLOAD EBOOK : DAS ERSTE MAL UND IMMER WIEDER. ERWEITERTE Click link bellow and free register to download
Titelbild1 ANSYS. Customer Portal LogIn
 Titelbild1 ANSYS Customer Portal LogIn 1 Neuanmeldung Neuanmeldung: Bitte Not yet a member anklicken Adressen-Check Adressdaten eintragen Customer No. ist hier bereits erforderlich HERE - Button Hier nochmal
Titelbild1 ANSYS Customer Portal LogIn 1 Neuanmeldung Neuanmeldung: Bitte Not yet a member anklicken Adressen-Check Adressdaten eintragen Customer No. ist hier bereits erforderlich HERE - Button Hier nochmal
rtube.nl/red975 Sold separately MN180008_ Off Price GmbH Rodenkirchener Str Hürth Copyright MICRO-USB RCD2002
 RCD2002 MICRO-USB 1x 1x 1x Sold separately A B QR rtube.nl/red975 1/4 1/8 A W B F = W - 4 cm F = W - 4,5 cm W Min. W = 50 cm Min. W = 50 cm 1 2 W F = W - 4 cm F F 3 4 0,5 cm 5 F - 1,0 cm 2/4 2/8 A B 1
RCD2002 MICRO-USB 1x 1x 1x Sold separately A B QR rtube.nl/red975 1/4 1/8 A W B F = W - 4 cm F = W - 4,5 cm W Min. W = 50 cm Min. W = 50 cm 1 2 W F = W - 4 cm F F 3 4 0,5 cm 5 F - 1,0 cm 2/4 2/8 A B 1
1_Togliere il. 2_Mettere le lampadine. Put the bulbs. 3_Mettere il vetro e riporre
 _Togliere il lamierino. Take off the metal tab. _Mettere le lampadine. Put the bulbs. _Mettere il vetro e riporre lamierino. Put the glass and the metal tab. 5_Fissare staffa e fare cablare. Secure the
_Togliere il lamierino. Take off the metal tab. _Mettere le lampadine. Put the bulbs. _Mettere il vetro e riporre lamierino. Put the glass and the metal tab. 5_Fissare staffa e fare cablare. Secure the
Level 2 German, 2015
 91126 911260 2SUPERVISOR S Level 2 German, 2015 91126 Demonstrate understanding of a variety of written and / or visual German text(s) on familiar matters 2.00 p.m. Friday 4 December 2015 Credits: Five
91126 911260 2SUPERVISOR S Level 2 German, 2015 91126 Demonstrate understanding of a variety of written and / or visual German text(s) on familiar matters 2.00 p.m. Friday 4 December 2015 Credits: Five
Neue Fahrzeugauswahl (KW/CV)
 Update Software Rel.: 9,23 Nuova selezione del veicolo (KW/CV) New vehicle selection (KW/CV) Nouvelle selection du vehicule (KW/CV) Nueva selecion del vehiculo (KW/CV) Neue Fahrzeugauswahl (KW/CV) 1 Update
Update Software Rel.: 9,23 Nuova selezione del veicolo (KW/CV) New vehicle selection (KW/CV) Nouvelle selection du vehicule (KW/CV) Nueva selecion del vehiculo (KW/CV) Neue Fahrzeugauswahl (KW/CV) 1 Update
DPM_flowcharts.doc Page F-1 of 9 Rüdiger Siol :28
 Contents F TOOLS TO SUPPORT THE DOCUMENTATION... F-2 F.1 GRAPHIC SYMBOLS AND THEIR APPLICATION (DIN 66 001)... F-2 F.1.1 Flow of control... F-3 F.1.2 Terminators and connectors... F-4 F.1.3 Lines, arrows
Contents F TOOLS TO SUPPORT THE DOCUMENTATION... F-2 F.1 GRAPHIC SYMBOLS AND THEIR APPLICATION (DIN 66 001)... F-2 F.1.1 Flow of control... F-3 F.1.2 Terminators and connectors... F-4 F.1.3 Lines, arrows
Outdoor-Tasche. Operating Instructions Bedienungsanleitung GB D
 00 181243 Outdoor Case Outdoor-Tasche Splish Splash Operating Instructions Bedienungsanleitung GB D A B C D OPEN G Operating instruction 1. Important Notes Children are not permitted to play with the device.
00 181243 Outdoor Case Outdoor-Tasche Splish Splash Operating Instructions Bedienungsanleitung GB D A B C D OPEN G Operating instruction 1. Important Notes Children are not permitted to play with the device.
Non users after Cochlear Implantation in Single Sided Deafness
 Non users after Cochlear Implantation in Single Sided Deafness W. Pethe*, J. Langer*, S. Lissel**, K. Begall* *HNO-Klinik, AMEOS Klinikum Halberstadt **Cochlear Implant Rehabilitationszentrum Sachsen-Anhalt
Non users after Cochlear Implantation in Single Sided Deafness W. Pethe*, J. Langer*, S. Lissel**, K. Begall* *HNO-Klinik, AMEOS Klinikum Halberstadt **Cochlear Implant Rehabilitationszentrum Sachsen-Anhalt
FACHKUNDE FüR KAUFLEUTE IM GESUNDHEITSWESEN FROM THIEME GEORG VERLAG
 FACHKUNDE FüR KAUFLEUTE IM GESUNDHEITSWESEN FROM THIEME GEORG VERLAG DOWNLOAD EBOOK : FACHKUNDE FüR KAUFLEUTE IM GESUNDHEITSWESEN Click link bellow and free register to download ebook: FACHKUNDE FüR KAUFLEUTE
FACHKUNDE FüR KAUFLEUTE IM GESUNDHEITSWESEN FROM THIEME GEORG VERLAG DOWNLOAD EBOOK : FACHKUNDE FüR KAUFLEUTE IM GESUNDHEITSWESEN Click link bellow and free register to download ebook: FACHKUNDE FüR KAUFLEUTE
Mixed tenses revision: German
 Mixed tenses revision: Gman Teaching notes This is a whole class game in wh one team (the red team) has to try to win hexagons in a row across the PowPoint grid from left to right, while the oth team (the
Mixed tenses revision: Gman Teaching notes This is a whole class game in wh one team (the red team) has to try to win hexagons in a row across the PowPoint grid from left to right, while the oth team (the
Wie man heute die Liebe fürs Leben findet
 Wie man heute die Liebe fürs Leben findet Sherrie Schneider Ellen Fein Click here if your download doesn"t start automatically Wie man heute die Liebe fürs Leben findet Sherrie Schneider Ellen Fein Wie
Wie man heute die Liebe fürs Leben findet Sherrie Schneider Ellen Fein Click here if your download doesn"t start automatically Wie man heute die Liebe fürs Leben findet Sherrie Schneider Ellen Fein Wie
Max und Moritz: Eine Bubengeschichte in Sieben Streichen (German Edition)
 Max und Moritz: Eine Bubengeschichte in Sieben Streichen (German Edition) Wilhelm Busch Click here if your download doesn"t start automatically Max und Moritz: Eine Bubengeschichte in Sieben Streichen
Max und Moritz: Eine Bubengeschichte in Sieben Streichen (German Edition) Wilhelm Busch Click here if your download doesn"t start automatically Max und Moritz: Eine Bubengeschichte in Sieben Streichen
Analogtechnik 2, Semestertest Technique analogique 2, Test de semestre
 Analogtechnik 2, Semestertest Technique analogique 2, Dr. Theo Kluter 05. 06. 2011 Name/Nom : Vorname/Prénom : Klasse/Classe : Aufgabe/ Punkte maximal/ Punkte erreicht/ Problème : Points maximaux : Points
Analogtechnik 2, Semestertest Technique analogique 2, Dr. Theo Kluter 05. 06. 2011 Name/Nom : Vorname/Prénom : Klasse/Classe : Aufgabe/ Punkte maximal/ Punkte erreicht/ Problème : Points maximaux : Points
2 IP X4 TAI/LED IP44, CH IP24. Montage-Anleitung Instructions de montage Assembling instructions. 225 cm. 60 cm 0
 Montage-Anleitung Instructions de montage Assembling instructions TAI/LED IP, CH IP Sensor-Schalter aussen unten rechts Interrupteur sensitif en bas à l'extérieur à droite Sensor switch outside right below
Montage-Anleitung Instructions de montage Assembling instructions TAI/LED IP, CH IP Sensor-Schalter aussen unten rechts Interrupteur sensitif en bas à l'extérieur à droite Sensor switch outside right below
Konische Kappen und Stopfen. tapered caps & plugs. Die T-Serie war die erste Serie, die im Jahr 1948 produziert wurde.
 Konische Kappen und Stopfen Konische Kappen und Stopfen bieten eine komplette, flexible und vielseitige Lösung. Sie können als Kappe oder als Schutzstopfen für Bohrungen verwendet werden. Die konische
Konische Kappen und Stopfen Konische Kappen und Stopfen bieten eine komplette, flexible und vielseitige Lösung. Sie können als Kappe oder als Schutzstopfen für Bohrungen verwendet werden. Die konische
Exercise (Part V) Anastasia Mochalova, Lehrstuhl für ABWL und Wirtschaftsinformatik, Kath. Universität Eichstätt-Ingolstadt 1
 Exercise (Part V) Notes: The exercise is based on Microsoft Dynamics CRM Online. For all screenshots: Copyright Microsoft Corporation. The sign ## is you personal number to be used in all exercises. All
Exercise (Part V) Notes: The exercise is based on Microsoft Dynamics CRM Online. For all screenshots: Copyright Microsoft Corporation. The sign ## is you personal number to be used in all exercises. All
IP X4 MOA/SL/FL IP44, CH IP24. Montage-Anleitung Instructions de montage Assembling instructions. 225 cm. 60 cm 0
 MOA/SL/FL IP44, CH IP4 Arbeiten an den elektrischen Anlagen dürfen nur von autorisierten Fachleuten nach den örtlichen Vorschriften ausgeführt werden. Für nicht fachgerechte Installation wird jegliche
MOA/SL/FL IP44, CH IP4 Arbeiten an den elektrischen Anlagen dürfen nur von autorisierten Fachleuten nach den örtlichen Vorschriften ausgeführt werden. Für nicht fachgerechte Installation wird jegliche
!! Um!in!ADITION!ein!HTML51Werbemittel!anzulegen,!erstellen!Sie!zunächst!ein!neues! Werbemittel!des!Typs!RichMedia.!!!!!!
 HTML5&Werbemittel/erstellen/ Stand:/06/2015/ UminADITIONeinHTML51Werbemittelanzulegen,erstellenSiezunächsteinneues WerbemitteldesTypsRichMedia. Hinweis:// DasinADITIONzuhinterlegende RichMedia1Werbemittelbestehtimmer
HTML5&Werbemittel/erstellen/ Stand:/06/2015/ UminADITIONeinHTML51Werbemittelanzulegen,erstellenSiezunächsteinneues WerbemitteldesTypsRichMedia. Hinweis:// DasinADITIONzuhinterlegende RichMedia1Werbemittelbestehtimmer
Deceleration Technology. Rotary Dampers with high-torque range WRD-H 0607 WRD-H 0805 WRD-H 1208 WRD-H 1610 WRD-H
 Rotary Dampers with high-torque range WRD-H 67 WRD-H 85 WRD-H 128 WRD-H 161 WRD-H 21 Deceleration Technology ONLINE CALCULATION AND 2D / 3D CAD DOWNLOAD M m L F Benefits Applications: - Mechanical and
Rotary Dampers with high-torque range WRD-H 67 WRD-H 85 WRD-H 128 WRD-H 161 WRD-H 21 Deceleration Technology ONLINE CALCULATION AND 2D / 3D CAD DOWNLOAD M m L F Benefits Applications: - Mechanical and
PONS DIE DREI??? FRAGEZEICHEN, ARCTIC ADVENTURE: ENGLISCH LERNEN MIT JUSTUS, PETER UND BOB
 Read Online and Download Ebook PONS DIE DREI??? FRAGEZEICHEN, ARCTIC ADVENTURE: ENGLISCH LERNEN MIT JUSTUS, PETER UND BOB DOWNLOAD EBOOK : PONS DIE DREI??? FRAGEZEICHEN, ARCTIC ADVENTURE: Click link bellow
Read Online and Download Ebook PONS DIE DREI??? FRAGEZEICHEN, ARCTIC ADVENTURE: ENGLISCH LERNEN MIT JUSTUS, PETER UND BOB DOWNLOAD EBOOK : PONS DIE DREI??? FRAGEZEICHEN, ARCTIC ADVENTURE: Click link bellow
Ein Stern in dunkler Nacht Die schoensten Weihnachtsgeschichten. Click here if your download doesn"t start automatically
 Ein Stern in dunkler Nacht Die schoensten Weihnachtsgeschichten Click here if your download doesn"t start automatically Ein Stern in dunkler Nacht Die schoensten Weihnachtsgeschichten Ein Stern in dunkler
Ein Stern in dunkler Nacht Die schoensten Weihnachtsgeschichten Click here if your download doesn"t start automatically Ein Stern in dunkler Nacht Die schoensten Weihnachtsgeschichten Ein Stern in dunkler
FEM Isoparametric Concept
 FEM Isoparametric Concept home/lehre/vl-mhs--e/folien/vorlesung/4_fem_isopara/cover_sheet.tex page of 25. p./25 Table of contents. Interpolation Functions for the Finite Elements 2. Finite Element Types
FEM Isoparametric Concept home/lehre/vl-mhs--e/folien/vorlesung/4_fem_isopara/cover_sheet.tex page of 25. p./25 Table of contents. Interpolation Functions for the Finite Elements 2. Finite Element Types
Information zu den Drucksachen
 Information zu den Drucksachen Ihre persönlichen Einladungen sind uns sehr wichtig. Deshalb übernehmen wir den Versand und die Portokosten. Wir bitten Sie um Verständnis dafür, dass wir diesen Service
Information zu den Drucksachen Ihre persönlichen Einladungen sind uns sehr wichtig. Deshalb übernehmen wir den Versand und die Portokosten. Wir bitten Sie um Verständnis dafür, dass wir diesen Service
Where are we now? The administration building M 3. Voransicht
 Let me show you around 9 von 26 Where are we now? The administration building M 3 12 von 26 Let me show you around Presenting your company 2 I M 5 Prepositions of place and movement There are many prepositions
Let me show you around 9 von 26 Where are we now? The administration building M 3 12 von 26 Let me show you around Presenting your company 2 I M 5 Prepositions of place and movement There are many prepositions
mineral finishes Finiture a base di calce per interni ed esterni - Mineral finishes for interiors and exteriors
 mineral finishes Finiture a base di calce per interni ed esterni - Mineral finishes for interiors and exteriors mineral finishes FINITURE A BASE DI CALCE PER INTERNI ED ESTERNI MINERAL FINISHES offre una
mineral finishes Finiture a base di calce per interni ed esterni - Mineral finishes for interiors and exteriors mineral finishes FINITURE A BASE DI CALCE PER INTERNI ED ESTERNI MINERAL FINISHES offre una
MQ964..GB MQ965..GB. en Operating instructions ar
 MQ964..GB MQ965..GB en Operating instructions ar MQ964-965GB-Uniklein_en-ar.book Seite 2 Donnerstag, 4. Dezember 2014 4:39 16 en English...........................................................3 ar...........................................................6.................................................
MQ964..GB MQ965..GB en Operating instructions ar MQ964-965GB-Uniklein_en-ar.book Seite 2 Donnerstag, 4. Dezember 2014 4:39 16 en English...........................................................3 ar...........................................................6.................................................
Überlaufrinne System Wiesbaden mit Ausklinkung für Mosaikbekleidung
 04/2012 System Wiesbaden 7.1.0 Beckenkopfausbildung/hochliegender Wasserspiegel Exécution de la tête du bassin/niveau d eau élevé Execution of the pool head/elevated water level Esecuzione del bordo/livello
04/2012 System Wiesbaden 7.1.0 Beckenkopfausbildung/hochliegender Wasserspiegel Exécution de la tête du bassin/niveau d eau élevé Execution of the pool head/elevated water level Esecuzione del bordo/livello
Der Login Bereich: / The login mask: / Le secteur login: Das/ The / Le Personal Portal :
 Der Login Bereich: / The login mask: / Le secteur login: Das/ The / Le Personal Portal : Um Ihr persönliches Profil darstellen zu lassen, klicken Sie bitte auf den Drop Down Pfeil. Please click on the
Der Login Bereich: / The login mask: / Le secteur login: Das/ The / Le Personal Portal : Um Ihr persönliches Profil darstellen zu lassen, klicken Sie bitte auf den Drop Down Pfeil. Please click on the
Magische weiße Karten
 Magische weiße Karten Bedienungsanleitung Ein Stapel gewöhnlicher Karten wird aufgedeckt, um die Rückseite und die Vorderseite zu zeigen. Wenn eine Karte ausgewählt wurde, ist der Magier in der Lage, alle
Magische weiße Karten Bedienungsanleitung Ein Stapel gewöhnlicher Karten wird aufgedeckt, um die Rückseite und die Vorderseite zu zeigen. Wenn eine Karte ausgewählt wurde, ist der Magier in der Lage, alle
