Helvetia setzt Energien frei Eine heterogene Katalyse
|
|
|
- Innozenz Roth
- vor 8 Jahren
- Abrufe
Transkript
1 Helvetia setzt Energien frei Eine heterogene Katalyse Peter Bützer Der Unterschied zwischen einem Zauberer und einem Chemiker ist der: Der Zauberer täuscht dich mit einem raffinierten Trick. Der Chemiker täuscht dich nicht - der kann einfach etwas, von dem du keine Ahnung hast. Ekkehard Unger, Chemiker Abbildung 1: 50 Rappen Münze aus Silber mit dem Bild der Helvetia Inhalt 1 Wasserstoffperoxid und die Katalyse Reaktionsgleichung Der Katalysator Messung Durchführung Hinweis Frage Entsorgung Simulation Simulationsdiagramm (Typ 2, Typ 10) Zeitdiagramm Dokumentation (Gleichungen, Parameter) Vergleich von Messung und Simulation Interpretation Literatur Hintergrundbild: Sauerstoffblasen auf der Münze Prof. Dr. Peter Bützer
2 Peter Bützer 2 1 Wasserstoffperoxid und die Katalyse Der französische Chemiker Louis Jacques Thénard ( ) fand 1799 das Wasserstoffperoxid (H 2 O 2 ) 2 und Johann Salomo Christoph Schweigger ( ) untersuchte dessen Zersetzung mit Platin (Pt), Silber (Ag) 3 und Silberoxid (Ag 2 O). Johann Wolfgang Döbereiner ( ) hat 1823 das Phänomen der Katalyse an einer Festkörperoberfläche erstmals technisch nutzbar gemacht. In Form eines Feuerzeugs, das keinen Zündfunken braucht, entzündete er den gasförmigen Wasserstoff selbständig, als Sauerstoff der Luft über fein verteiltes, metallisches Platin strömte 4. Die Katalyse von Wasserstoffperoxid ist von Jöns Jakob Berzelius ( ) erst später, , definiert und von Wilhelm Ostwald ( ) 6 genauer untersucht worden beschrieb ihn Ostwald 7 : "Ein Katalysator ist jeder Stoff, der, ohne im Endprodukt einer chemischen Reaktion zu erscheinen, ihre Geschwindigkeit verändert." Wasserstoffperoxid, früher auch Wasserstoffsuperoxid genannt, ist instabil, denn nach Pauling gilt 8 : Die Elektronenpaarbindung ist auch besonders unstabil, wenn sie zwei gleichsinnig polarisierte Atome zusammenhalten soll. H O O H 2.2 H 3.5 O O 3.5 H 2.2 I+ H I- O O I- Polaritäten Elektronegativitäten Oxidationszahlen Abbildung 2: Wichtige chemische und physikalische Eigenschaften von Wasserstoffperoxid H I+ stick and ball -Modell mit der Elektronenoberfläche (rot: hohe Dichte, blau: kleine Dichte) HOMO Highest Occupied Molecular Orbital LUMO Lowest Unoccupied Molecular Orbital freie Elektronenpaare Abbildung 3: Molekülmodelle von Wasserstoffperoxid (H 2 O 2 ) Das instabile Wasserstoffperoxid ist ein starkes Oxidationsmittel, weil der Sauerstoff mit der Oxidationszahl I- bis zu einem stabilen Zustand noch ein Elektron zur Oxidationszahl II- aufnehmen kann. Die Reaktivität der Oxidationskraft ist so gross, dass hohe Konzentrationen (>70%) als Raketentreibstoffe verwendet wurden. Selbst schwere Unfälle mit 70%igen Lösungen und organischen Stoffen als Explosionen sind bekannt 9.
3 Peter Bützer 3 Tabelle 1: Das Oxidationspotential von H 2 O 2 im Vergleich Substanz Oxidationspotential, V Fluor (F 2 ) Hydroxyl Radikal (HO ) Ozon (O 3 ) Wasserstoffperoxid (H 2 O 2 ) Kaliumpermanganat (KMnO 4 ) Chlordioxid (ClO 2 ) Chlor (Cl 2 ) H 2 O 2 kommt auch im menschlichen Stoffwechsel vor, wo es durch das Enzym Catalase abgebaut wird. Besonders spannend ist der Einsatz beim Bombardierkäfer (Brachininae). Die Zersetzung, oder besser die Disproportionierung vom instabilen Wasserstoffperoxid mit einem Katalysator 10,11 zeigt sich darin, dass die Oxidationszahl von Sauerstoff in H 2 O 2 mit I- in II- im Wasser und 0 im O 2 aufgespalten wird: 2 H 2 I+ O 2 I- 2 H 2I+ O II- + O 2 0 Gerold Karl Schwarzenbach ( ) erwähnt : Besonders wirksame Katalysatoren für die Zersetzung von Wasserstoffperoxid sind Cu 2+ -, Fe 3+ -, Cr 3+ - und Zn 2+ -Salze, während Al- und Sn-Salze ohne Wirkung sind. Das hochaktive Platin (Pt), Silber (Ag), Gold (Au), Braunstein (MnO 2 ), Iodid (I - ), Iodat IO - 3 ) und Hydoxyl (OH-) sind bei Holeman erwähnt 18. Ebenfalls wirksam sind Silberoxid (Ag 2 O), Chromate (CrO - 3 ), Bichromate (Cr 2 O 2-7 ) 13 und grosse Oberflächen (z.b. 14 Aktivkohle). Aufgrund seiner starken Oxidationswirkung ist Wasserstoffperoxid ein seit 1874 bekanntes Desinfektionsmittel 15. Es findet Anwendung zur Gewebe- und Wunddesinfektion 16. Das Oxidationsmittel Wasserstoffperoxid gibt beim Kontakt mit Gewebe (Peroxidase) atomaren Sauerstoff ab. Die Kombination auf der Basis von Wasserstoffperoxid und Silber ist besonders wirksam 17. Sie ist bakterizid, fungizid, viruzid, sporozid, und begrenzt protozooizid. Die beiden Bestandteile Silber und Wasserstoffperoxid potenzieren sich in ihrer bioziden Wirksamkeit, was die Kombination wesentlich stärker als handelsübliches Wasserstoffperoxid macht. Die bakterizide Wirkung von Silber beruht darauf, dass sich das einwertige Silberion sehr fest an bakterielle Proteine bindet und diese dadurch inaktiviert oder ausfällt. Die Desinfektion mit Wasserstoffperoxid-Dampf ist einfach und sehr wirksam. Wasserstoffperoxid wird industriell als Bleichmittel und kosmetisch auch als Zahnbleichmittel verwendet. Auch hier wird die oxidierende Wirkung ausgenützt. Die Weltjahresproduktion von H 2 O 2 beträgt ca. 1.6 Mio.Tonnen.
4 Peter Bützer 4 2 Reaktionsgleichung Die Zersetzung von Wasserstoffperoxid folgt vereinfacht der Reaktionsgleichung: 2 H 2 O 2 (l) 2 H 2 O (l) + O 2 (g); H = kj/mol; Es handelt sich um eine exotherme Reaktion (sie setzt Wärme frei). Trotz der grossen Instabilität von H 2 O 2 ist die Zerfallsgeschwindigkeit von Wasserstoffperoxid bei Raumtemperatur kaum messbar (30%ige Lösung bei RT: ca mol/s). Grund dafür ist die grosse Aktivierungsenergie, die aufgewendet werden muss um H 2 O 2 in die zwei Radikale HO zu spalten 18 : H 2 O 2 2 HO ; H = +211 kj/mol; Die Folgereaktionen sind: HO + H 2 O 2 H 2 O + HO 2 HO 2 + H 2 O 2 H 2 O + O 2 + HO Es wird deutlich, wo der Katalysator eingreift: Bei der Zerlegung in 2 OH Aber hier ist der Katalysator mit seiner ganz genauen Wirkung auf die Elektronenstruktur chemisch eine Black-Box: H2O2 Katalysator H2O + O2 Sicher sind drei Reaktionsschritte mit dem heterogenen Katalysator notwendig 19 : Adsorption der Edukte an den Katalysator Reaktion Desorption der Produkte 3 Der Katalysator Abbildung 4: Gediegenes Silber (Ag) mit Silberoxidschicht (AgO) (Foto: Josef Bischofberger)
5 Peter Bützer 5 4 Messung 4.1 Durchführung Material: Verwendete Lösung: GHS-Klassierung Wasserstoffperoxid: H-Sätze: 30% H271: Kann Brand oder Explosion verursachen; starkes Oxidationsmittel. Gefahr H302: Gesundheitsschädlich bei Verschlucken. H314: Verursacht schwere Verätzungen der Haut und schwere Augenschäden. H332: Gesundheitsschädlich bei Einatmen. Nach der Reaktion: Wasserstoffperoxid: 5%<w<8% P-Sätze: P221: Vermischung mit brennbaren Stoffen/... unter allen Umständen vermeiden. P280: Schutzhandschuhe / Schutzkleidung / Augenschutz / Gesichtsschutz tragen. P305 + P351 + P338: BEI BERÜHRUNG MIT DEN AUGEN: Einige Minuten lang behutsam mit Wasser ausspülen. Eventuell vorhandene Kontaktlinsen nach Möglichkeit entfernen. Weiter ausspülen. P310: Sofort GIFTINFORMATIONSZENTRUM oder Arzt anrufen. P405: Unter Verschluss aufbewahren. Katalysator: Silbermünze (genauer: die Oberfläche der Münze) Durchführung: In ein 10 ml Becherglas wird die Münze (Katalysator) gelegt. Dann wird der Thermosensor (oder das Thermometer positioniert. Mit dem Start der Messung werden 4 ml 30%iges Wasserstoffperoxid zugegeben. Temperatur-Sensor: Vernier, Stainless-Steel, Interface: Go-Link, Software: LoggerPro
6 Peter Bützer Hinweis Der Reaktionsverlauf ist abhängig von der Grösse, der Form und dem Material des Reaktionsgefässes. Auch die Unterlage, auf der das Reaktionsgefäss steht, ist wichtig. Grund: Die Wärmeabgabe des Reaktionsgefässes an die Umgebung! 4.3 Frage Wie müsste das Gefäss gewählt werden um eine möglichst hohe Temperatur zu erreichen? 4.4 Entsorgung Bei der Reaktion bildet sich nur Wasser und Sauerstoffgas. Die Zersetzungs-Reaktion selbst ist eine eigentliche Entgiftung! Abbildung 5: Messung der katalytischen Zersetzung von H 2 O 2 mit Silber. Die Lage der Münze ist auch entscheidend dafür, wie viel von der Katalysatoroberfläche belegt ist. Beobachtungen: An der Oberfläche der Silbermünze bilden sich Blasen von Sauerstoff. Die Reaktion nimmt mit der Zeit an Heftigkeit zu. Die Silberoberfläche wird braun (AgO) auch die Helvetia.
7 Peter Bützer 7 5 Simulation Annahmen Wasserstoffperoxid wird in einem Reaktionsschritt zersetzt. Die Zersetzung liefert Energie (Wärme). Die Reaktionsgeschwindigkeit ist abhängig von der Menge Katalysator und der Konzentration von Wasserstoffperoxid. Die Reaktionsenergie heizt das Reaktionsgemisch auf. Die Zunahme der Temperatur führt zu einer Erhöhung der Reaktionsgeschwindigkeit (positive Rückkopplung). Der Einfluss der Temperatur auf die Reaktionsgeschwindigkeit wird mit der RGT-Regel ausgedrückt. Der Energieinhalt ist durch das Volumen und die Konzentration von Wasserstoffperoxid (H 2 O 2 ) bestimmt. Das Reaktionsgefäss (und der Temperatursensor) kühlt sich durch Wärmeabgabe ab. 5.1 Simulationsdiagramm (Typ 2, Typ 10) 20 Katalysator Basis T10 Tz Wärme Kapazität Aussen Temperatur Temperatur Verlauf Einheiten kr Q10 ka Edukt reagieren Produkt abkühlen Abbildung 6: Simulationsdiagramm der katalytischen Zersetzung von H 2 O 2 mit Silber mit der 21 RGT-Regel (Simulation mit Vensim PLE)10F Die Simulation teilt sich auf in: Die chemische Reaktion mit dem Katalysator (reagieren) Die Rückkopplung über die Temperatur Tz (mit der RGT-Regel) Die temperaturabhängige Abkühlung (abkühlen)
8 Peter Bützer Zeitdiagramm Temperaturverlauf C Time (Second) Temperatur Verlauf : Helvetia Abbildung 7: Zeitdiagramm der Simulation Der Temperaturverlauf hat keine mathematisch triviale Form! Der Anstieg ist von der Energie der Edukte und der Produkte abhängig, also keine ganz simple Differentialgleichung. Für die Simulation muss jedoch keine Differentialgleichung gelöst werden, das macht die Software. 5.3 Dokumentation (Gleichungen, Parameter) (01) abkühlen= ka*tz Units: kj/second [0,?] Das ist die Abkühlgeschwindigkeit der Reaktion (02) Aussen Temperatur= 24 Units: C [10,30] Anfangswert der Messung, gemessene Raumtemperatur (03) Basis= 2.3 Units: Dmnl [1,3] Die RG nimmt um einen Faktor 1-3 zu bei einer Erhöhung der Temperatur um 10 K (04) Edukt= INTEG (-reagieren, 3.36) Units: kj [0,?] Verfügbare Energie des Edukts, 30% H2O2 --> 300 g/l, MG = 34 g/mol, 4 ml -- > 3.36 kj; (05) Einheiten= 1*1 Units: C/K Die Temperaturzunahme in K entspricht der Temperaturzunahme in K (06) FINAL TIME = 3600 Units: Second The final time for the simulation. (07) INITIAL TIME = 0 Units: Second The initial time for the simulation.
9 Peter Bützer 9 (08) ka= 8e-005 Units: kj/second/k [1e-005,0.0001] Abkühlkonstante, wie rasch kühlt sich das Reaktionsgemisch (mit Gefäss) ab. ka hängt auch von der Grösse, der Form und vom Material des Reaktionsgefässes ab, ebenso vom Material auf dem das Gefäss steht. (09) Katalysator= 0.3 Units: Dmnl [0,1] Katalysator, Der verwendete Wert ist durch die aktive Oberfläche bestimmt (10) kr= Units: 1/Second [0.001,0.005] Reaktions-Geschwindigkeits-Konstante k = ln(2)/hwz, Wert aus dem Anstieg bei den Messungen kr=0.11, daraus leitet sich der Wert für den Katalysator ab. (11) Produkt= INTEG (reagieren-abkühlen, 0.001) Units: kj [0,?] Total freigesetzte Energie = Summe aller bei der Reaktion freigesetzten Energien (12) Q10= Basis^(Tz/T10) Units: Dmnl [0,?] RGT-Regel: Faktor um den die Geschwindigkeit bei einer Temperaturzunahme um 10 K steigt. (13) reagieren= kr*q10*edukt*katalysator Units: kj/second [0,?] Das ist die Reaktionsgeschwindigkeit der Reaktion (14) SAVEPER = 1 Units: Second [0,?] The frequency with which output is stored. (15) T10= 10*1 Units: K [0,?] Pro 10 K verdoppelt sich die RG (16) Temperatur Verlauf= Tz*Einheiten+Aussen Temperatur Units: C [0,?] (17) TIME STEP = 1 Units: Second [0,?] The time step for the simulation. (18) Tz= Produkt/Wärme Kapazität-4 Units: K [0,?] Temperaturzunahme der Reaktionsmischung (19) Wärme Kapazität= 0.04 Units: kj/k [0.01,0.05] Wärmekapazität des Reaktionsgemisches mit Gefäss; Wasser hat eine Wärmekapazität von etwa 4,2 kj/kg/k
10 Peter Bützer Vergleich von Messung und Simulation Die Vielzahl der Reaktionen wurde in eine einzige Reaktion zusammengefasst und die Einflüsse der Messung selbst in der Simulation vernachlässigt. Es geht hier vielmehr darum zu zeigen, dass die grundlegenden Prozesse, wie beispielsweise die Katalyse, die positive Rückkopplung und die Abkühlung verstanden sind Temp. ( C) Zeit (s) Simulation Messung Abbildung 8: Vergleich von Messung und Simulation Kleine Abweichungen sind gut erkennbar. Das ist erklärbar, weil das Modell nur die wichtigsten Teile des Gesamtsystems erfasst. 6 Interpretation Die Simulation gibt den Temperaturverlauf sehr gut wieder. Die Temperatur zeigt einen ungefähr exponentiellen Anstieg. Die Ursache ist in der exothermen Reaktion zu suchen. Je rascher die Reaktion läuft, desto mehr erhitzt sich die Reaktionslösung. Je höher die Temperatur der Reaktionslösung, desto rascher die Reaktion eine positive Rückkopplung. Die Reaktion kann so rasch werden, dass sie nur schwer zu kontrollieren ist, eine sogenannten Runaway- Reaction 22,23. Wissenschaft ist die Überprüfung von Hypothesen. Das ist genau das, was hier mit dem Modell, der Simulation und dem Vergleich mit der Messung gemacht wurde. Die Katalyse ist ein zentrales Element der Biochemie, eine Schlüsseltechnologie der Chemie und sehr wichtig für die chemischen Industrie. Die Menschen hatten immer ein Bedürfnis nach Erklärungen für Naturprozesse. Jostein Gaarder (1952-) norwegischer Schriftsteller 24
11 Peter Bützer 11 Bei der Simulation nicht berücksichtigt sind nebst den erwähnten Faktoren 25 : Die Änderung des Siedepunkts (H 2 O 2 : 30% ca. 107 C, 0% 100 C). Verdampfen der Flüssigkeit (Energieverbrauch). Blasenbildung in der Flüssigkeit (Wärmetransport). Änderung der Verdampfungswärme (H 2 O 2 : 30% 0%; ca. 10%). Änderung der Wärmekapazität (H 2 O 2 : 30% 0%; ca. 13%). Lage der Oberfläche der Münze (waagrecht, senkrecht, schräg etc.) und damit die reaktive Oberfläche (ca. 20%). Messfehler (Messkonstante des Thermometers, Wärmeabfuhr durch das Thermometer etc.) Alle wissenschaftliche Arbeit richtet sich auf den Fortschritt der objektiven Erkenntnis. Wir sind Arbeiter, die zum Wachstum der objektiven Erkenntnis beitragen, so wie Steinmetze an einem Dom arbeiten. Karl R. Popper, ( ) britischer Erkenntnisphilosoph
12 Peter Bützer 12 7 Literatur 1 Unger Ekkehard, Auweia Chemie!. Wiley-VCH-Verlag GmbH, Weinheim, 1998, S.2 2 Thénard, Louis Jacques, The Columbia Encyclopedia, Sixth Edition , Böhm Walter, Die Naturwissenschaftler und ihre Philosophie, Herder & Co. Wien, 1961, S Hintsches Eugen, Katalytische Kraft, SCHWERpunkt, Max Planck Forschung, 4, 2002, S.48 5 Berzelius J.J., Edinburg New Philosophical Journal, 1836: The substances that cause the decomposition of H 2 O 2 do not achieve this goal by being incorporated into the new compounds (H 2 O and O 2 ); in each case they remain unchanged and hence act by means of an inherent force whose nature is still unknown... So long as the nature of the new force remains hidden, it will help our researches and discussions about it if we have a special name for it. I hence will name it the catalytic force of the substances, and I will name decomposition by this force catalysis. The catalytic force is reflected in the capacity that some substances have, by their mere presence and not by their own reactivity, to awaken activities that are slumbering in molecules at a given temperature. 6 Wilhelm Ostwald (Nobelpreis 1909): "in recognition of his work on catalysis and for his investigations into the fundamental principles governing chemical equilibria and rates of reaction" 7 Hauffe Karl, Katalyse - Ausgewählte Kapitel aus der Katalyse einfacher Reaktionen, Walter de Gruyter Verlag, Berlin /New York, 1976, S Schwarzenbach Gerold, Allgemeine und anorganische Chemie, Georg Thieme Verlag, Stuttgart, 1950, S.97 9 Dorias Heinz, Gefährliche Güter, Springer Verlag, Berlin, 1984, S Bützer Peter, Coray Reto, Eine thermische Runaway-Reaktion: Ein Demonstrationsexperiment, Praxis der Naturwissenschaften, 8/40, 1991, S Bützer Peter, Roth Markus, Chemische Reaktionen als dynamische Systeme, T^3- Schweiz, August, 2002, S Schwarzenbach Gerold, Allgemeine und anorganische Chemie, Georg Thieme Verlag, Stuttgart, 1950, S Jansen Walter, Ralle Bernd, Peper Renate, Reaktionskinetik und chemisches Gleichgewicht, Aulis Verlag Deubner & Co KG, Köln 1984, S Winkler Hans-Georg, Die Reaktionsgeschwindigkeit, Aulis Verlag Deubner & Co. KG, Köln, 1963, S Ludwig R., Zur Wirkung von Wasserstoffperoxid auf Tetanustoxin in Hautwunden, Zentralblatt für Chirurgie, 1874, S Biochemisches Institut der Universität Zürich, H 2 O 2 Wasserstoffperoxid, Sanosil, Holleman Arnold F., Lehrbuch der Anorganischen Chemie, Walter de Gruyter Verlag, Berlin/New York, 1995, S Stevens B., Chemical Kinetics, Chapman & Hall, London 1961, p Bützer Peter, Roth Markus, Die Zeit im Griff, Systemdynamik in Chemie und Biochemie, verlag pestalozzianum, Zürich 2006, S. 43ff
13 Peter Bützer Vensim PLE, Simulations software, Ventana Systems Inc., Berthold W., Löffler U., Lexikon sicherheitstechnischer Begriffe in der Chemie, Verlag Chemie, Weinheim, 1981, S Bützer Peter, Rückkopplung im Experiment: Eine Runaway-Reaktion; Erfahrung mit einer entscheidenden Funktion in vernetzten Systemen, Spektrum, 2, 1990, Gaarder Jostein, Sofies Welt, Carl Hanser Verlag, München/Wien, 1993, S US Peroxide, Product Information, Introduction to Hydrogen Peroxide, physical and chemical properties of hydrogen peroxide,
Gipshärtung Energiefreisetzung, Systemdynamik
 Gipshärtung Energiefreisetzung, Systemdynamik Inhalt 1 Reaktion... 1 2 Experiment... 2 3 Simulation... 3 3.1 Simulationsdiagramm... 3 3.2 Dokumentation (Gleichungen, Parameter)... 3 3.3 Zeitdiagramm...
Gipshärtung Energiefreisetzung, Systemdynamik Inhalt 1 Reaktion... 1 2 Experiment... 2 3 Simulation... 3 3.1 Simulationsdiagramm... 3 3.2 Dokumentation (Gleichungen, Parameter)... 3 3.3 Zeitdiagramm...
Kohlenmonoxid aus Ethanal, CH 3 -CHO
 Kohlenmonoxid aus Ethanal, CH 3 -CHO Peter Bützer Chemiker haben viele nette Reaktionen! Inhalt 1 Einleitung/Theorie... 1 2 Aufgabenstellung... 2 2.1 Beobachtungen/Messungen, Datenbasis... 2 2.2 Reaktionsgleichungen/Berechnungen...
Kohlenmonoxid aus Ethanal, CH 3 -CHO Peter Bützer Chemiker haben viele nette Reaktionen! Inhalt 1 Einleitung/Theorie... 1 2 Aufgabenstellung... 2 2.1 Beobachtungen/Messungen, Datenbasis... 2 2.2 Reaktionsgleichungen/Berechnungen...
Michaelis-Menten-Kinetik
 Michaelis-Menten-Kinetik Peter Bützer Inhalt 1 Einführung... 1 2 Modell... 2 2.1 Modellannahmen... 2 2.2 Drei Fälle... 2. Simulationsdiagramm (Typ ), Systemdynamik... 2.4 Dokumentation (Gleichungen, Parameter)...
Michaelis-Menten-Kinetik Peter Bützer Inhalt 1 Einführung... 1 2 Modell... 2 2.1 Modellannahmen... 2 2.2 Drei Fälle... 2. Simulationsdiagramm (Typ ), Systemdynamik... 2.4 Dokumentation (Gleichungen, Parameter)...
Titration einer Säure mit einer Base
 Titration einer Säure mit einer Base Peter Bützer Inhalt 1 Einleitung... 1 2 Modellannahmen (Systemdynamik)... 2 3 Simulationsdiagramm (Typ 1)... 2 4 Dokumentation (Gleichungen, Parameter)... 3 5 Simulation...
Titration einer Säure mit einer Base Peter Bützer Inhalt 1 Einleitung... 1 2 Modellannahmen (Systemdynamik)... 2 3 Simulationsdiagramm (Typ 1)... 2 4 Dokumentation (Gleichungen, Parameter)... 3 5 Simulation...
Systemdynamik der Katalyse H 2 O 2 /FeCl 3
 1 Systemdynamik der Katalyse H 2 O 2 /FeCl 3 Inhalt 1 Dynamik in der Chemie... 1 2 Schritte der Systemdynamik... 2 3 Ein Katalysator... 2 4 Das Experiment... 3 4.1 Durchführung... 3 4.2 Beobachtung...
1 Systemdynamik der Katalyse H 2 O 2 /FeCl 3 Inhalt 1 Dynamik in der Chemie... 1 2 Schritte der Systemdynamik... 2 3 Ein Katalysator... 2 4 Das Experiment... 3 4.1 Durchführung... 3 4.2 Beobachtung...
Ethanolbildung in Bananen
 Ethanolbildung in Bananen Peter Bützer Inhalt 1 Einführung... 1 2 Modell... 2 2.1 Annahmen:... 2 2.2 Simulation(Typ 1)... 2 2.3 Dokumentation (Gleichungen, Parameter)... 3 2.4 Vergleich der Simulation
Ethanolbildung in Bananen Peter Bützer Inhalt 1 Einführung... 1 2 Modell... 2 2.1 Annahmen:... 2 2.2 Simulation(Typ 1)... 2 2.3 Dokumentation (Gleichungen, Parameter)... 3 2.4 Vergleich der Simulation
Hefewachstum. Peter Bützer
 Hefewachstum Peter Bützer Inhalt 1 Hefe... 1 2 Das System als Black Box... 2 3 Messung des... 2 4 Modell... 3 5 Simulation (Typ 9)... 3 5.1 Simulationsdiagramm... 4 5.2 Messung... 4 5.3 Dokumentation (Gleichungen,
Hefewachstum Peter Bützer Inhalt 1 Hefe... 1 2 Das System als Black Box... 2 3 Messung des... 2 4 Modell... 3 5 Simulation (Typ 9)... 3 5.1 Simulationsdiagramm... 4 5.2 Messung... 4 5.3 Dokumentation (Gleichungen,
Monod-Kinetik. Peter Bützer
 Monod-Kinetik Peter Bützer Inhalt 1 Einleitung... 1 1.1 Modell... 1 1.2 Modellannahmen... 2 1. Gleichung... 2 1.4 Drei Fälle... 2 Simulation, Systemdynamik... 2.1 Simulationsdiagramm (Typ 1)... 2.2 Dokumentation
Monod-Kinetik Peter Bützer Inhalt 1 Einleitung... 1 1.1 Modell... 1 1.2 Modellannahmen... 2 1. Gleichung... 2 1.4 Drei Fälle... 2 Simulation, Systemdynamik... 2.1 Simulationsdiagramm (Typ 1)... 2.2 Dokumentation
Säureangriff auf die Zähne
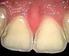 Säureangriff auf die Zähne Eine erfolgreiche Reduktion ist vielleicht die erfolgreichste Form aller wissenschaftlichen Erklärungen, die man sich vorstellen kann. 1 Karl R. Popper, (1902-199) britischer
Säureangriff auf die Zähne Eine erfolgreiche Reduktion ist vielleicht die erfolgreichste Form aller wissenschaftlichen Erklärungen, die man sich vorstellen kann. 1 Karl R. Popper, (1902-199) britischer
Sauerstoffbindung im Blut
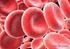 Sauerstoffbindung im Blut Die Fähigkeit uns zu wundern, ist das Einzige, was wir brauchen, um gute Philosophen zu werden. Gaarder Jostein, Sofies Welt 1 Inhalt 1 Einleitung/Theorie... 1 2 Aufgabenstellung...
Sauerstoffbindung im Blut Die Fähigkeit uns zu wundern, ist das Einzige, was wir brauchen, um gute Philosophen zu werden. Gaarder Jostein, Sofies Welt 1 Inhalt 1 Einleitung/Theorie... 1 2 Aufgabenstellung...
Eine Brennstoffzelle, die Umkehr der Wasserelektrolyse
 Wasserelektrolyse Peter Bützer Inhalt Eine Brennstoffzelle, die Umkehr der Wasserelektrolyse 1 Einleitung/Theorie... 1 2 Datenbasis... 2 2.1 Aufgabenstellung... 2 2.2 Durchführung... 2 2.3 Beobachtungen/Messungen...
Wasserelektrolyse Peter Bützer Inhalt Eine Brennstoffzelle, die Umkehr der Wasserelektrolyse 1 Einleitung/Theorie... 1 2 Datenbasis... 2 2.1 Aufgabenstellung... 2 2.2 Durchführung... 2 2.3 Beobachtungen/Messungen...
4.3 Reaktionsgeschwindigkeit und Katalysator
 4.3 Reaktionsgeschwindigkeit und Katalysator Neben der thermodynamischen Lage des chemischen Gleichgewichts ist der zeitliche Ablauf der Reaktion, also die Geschwindigkeit der Einstellung des Gleichgewichts,
4.3 Reaktionsgeschwindigkeit und Katalysator Neben der thermodynamischen Lage des chemischen Gleichgewichts ist der zeitliche Ablauf der Reaktion, also die Geschwindigkeit der Einstellung des Gleichgewichts,
Daisyworld. Peter Bützer. 1 Eine kurze Theorie. Inhalt
 Daisyworld Peter Bützer Inhalt 1 Eine kurze Theorie... 1 2 Aufgabe... 2 3 Simulation, Lösung (Typ 3), Systemdynamik... 3 3.1 Annahmen... 3 3.2 Simulationsdiagramm... 3 3.3 Zeitdiagramm... 4 3.4 Dokumentation
Daisyworld Peter Bützer Inhalt 1 Eine kurze Theorie... 1 2 Aufgabe... 2 3 Simulation, Lösung (Typ 3), Systemdynamik... 3 3.1 Annahmen... 3 3.2 Simulationsdiagramm... 3 3.3 Zeitdiagramm... 4 3.4 Dokumentation
Eine Runaway-Reaktion
 Eine Runaway-Reaktion Peter Bützer, Markus Roth Inhalt 0H1 1H2 2H3 3H4 8H5 15H6 17H7 18H8 19H9 20H10 Dynamik in der Chemie... 21H1 Schritte der Systemdynamik... 22H2 Ein Katalysator... 23H3 Das Experiment...
Eine Runaway-Reaktion Peter Bützer, Markus Roth Inhalt 0H1 1H2 2H3 3H4 8H5 15H6 17H7 18H8 19H9 20H10 Dynamik in der Chemie... 21H1 Schritte der Systemdynamik... 22H2 Ein Katalysator... 23H3 Das Experiment...
Phototrope Gläser. Dr. Peter Bützer. Inhalt
 1 Phototrope Gläser Inhalt 1 Einleitung/Theorie... 2 2 Experiment... 2 2.1 Aufgabenstellung... 2 2.2 Durchführung... 2 2.3 Beobachtungen/Messungen... 3 2.4 Reaktionsgleichungen/Berechnungen... 3 3 Simulation,
1 Phototrope Gläser Inhalt 1 Einleitung/Theorie... 2 2 Experiment... 2 2.1 Aufgabenstellung... 2 2.2 Durchführung... 2 2.3 Beobachtungen/Messungen... 3 2.4 Reaktionsgleichungen/Berechnungen... 3 3 Simulation,
Kohlendioxidfreisetzung aus Champagner. 1 Einleitung/Theorie. Peter Bützer. Inhalt
 Kohlendioxidfreisetzung aus Champagner Inhalt 1 Einleitung/Theorie... 1 2 Experiment... 2 2.1 Aufgabenstellung... 2 2.2 Durchführung... 2 2.3 Beobachtungen/Messungen... 2 2.4 Reaktionsgleichungen/Berechnungen...
Kohlendioxidfreisetzung aus Champagner Inhalt 1 Einleitung/Theorie... 1 2 Experiment... 2 2.1 Aufgabenstellung... 2 2.2 Durchführung... 2 2.3 Beobachtungen/Messungen... 2 2.4 Reaktionsgleichungen/Berechnungen...
Atmung, Dissimilation
 Atmung, Dissimilation Peter Bützer Abbildung 1: Atmung Inhalt 1 Physiologisches... 1 2 Atmung, eine Reaktion 0. Ordnung... 2 3 Simulation... 2 4 Interpretation... 4 5 Mikroökologie im Zimmer... 4 6 Interpretation...
Atmung, Dissimilation Peter Bützer Abbildung 1: Atmung Inhalt 1 Physiologisches... 1 2 Atmung, eine Reaktion 0. Ordnung... 2 3 Simulation... 2 4 Interpretation... 4 5 Mikroökologie im Zimmer... 4 6 Interpretation...
Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo
 Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de innere Energie U Energieumsatz bei
Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de innere Energie U Energieumsatz bei
4.3 Reaktionsgeschwindigkeit und Katalysator
 4.3 Reaktionsgeschwindigkeit und Katalysator - Neben der thermodynamischen Lage des chemischen Gleichgewichts ist der zeitliche Ablauf der Reaktion, also die Geschwindigkeit der Ein- Einstellung des Gleichgewichts,
4.3 Reaktionsgeschwindigkeit und Katalysator - Neben der thermodynamischen Lage des chemischen Gleichgewichts ist der zeitliche Ablauf der Reaktion, also die Geschwindigkeit der Ein- Einstellung des Gleichgewichts,
2 NO 2 N 2 O 4, ein einfaches Gleichgewicht
 2 NO 2 N 2 O 4, ein einfaches Gleichgewicht Peter Bützer Inhalt 1 Einführung... 1 2 Grundlagen zur Reaktion... 1 3 Simulation (Typ 3), Systemdynamik... 4 3.1 Das einfache Gleichgewicht... 4 3.2 Das Prinzip
2 NO 2 N 2 O 4, ein einfaches Gleichgewicht Peter Bützer Inhalt 1 Einführung... 1 2 Grundlagen zur Reaktion... 1 3 Simulation (Typ 3), Systemdynamik... 4 3.1 Das einfache Gleichgewicht... 4 3.2 Das Prinzip
Systemdynamik: Iodwasserstoff-Gleichgewicht
 1 Systemdynamik: Iodwasserstoff-Gleichgewicht Inhalt 1 Einleitung... 1 2 Reaktionsgleichung, Substanzdaten... 2 3 Simulation... 3 3.1 Simulationsdiagramm (Reaktions Typ 3)... 3 3.2 Zeitdiagramme... 3 3.3
1 Systemdynamik: Iodwasserstoff-Gleichgewicht Inhalt 1 Einleitung... 1 2 Reaktionsgleichung, Substanzdaten... 2 3 Simulation... 3 3.1 Simulationsdiagramm (Reaktions Typ 3)... 3 3.2 Zeitdiagramme... 3 3.3
Wasserstoffperoxid, Peroxide
 Universität Regensburg Institut für Anorganische Chemie Lehrstuhl Prof. Dr. A. Pfitzner Übungen im Vortragen mit Demonstrationen im Wintersemester 2012/2013 Dozentin: Dr. M. Andratschke Wasserstoffperoxid,
Universität Regensburg Institut für Anorganische Chemie Lehrstuhl Prof. Dr. A. Pfitzner Übungen im Vortragen mit Demonstrationen im Wintersemester 2012/2013 Dozentin: Dr. M. Andratschke Wasserstoffperoxid,
Grundwissen Chemie 9. Jahrgangsstufe
 Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Gefahrenstoffe. 7 Bechergläser (100 ml), 1 Becherglas (1 L), Spatel, Wasser, Messzylinder, Glaswanne, Kartoffel
 1.1 Zersetzung von H 2O 2 mithilfe verschiedener Katalysatoren [4] Der Zerfall von Wasserstoffperoxid kann mithilfe vieler verschiedener Katalysatoren beschleunigt werden. In diesem Versuch sollen einige
1.1 Zersetzung von H 2O 2 mithilfe verschiedener Katalysatoren [4] Der Zerfall von Wasserstoffperoxid kann mithilfe vieler verschiedener Katalysatoren beschleunigt werden. In diesem Versuch sollen einige
Themen heute: Reaktionsgleichungen, chemische Gleichgewichte
 Wiederholung der letzten Vorlesungsstunde: Ionenbindung, Coulomb-Gesetz, Ionen- (Kristall-)strukturen, NaCl, CsCl, ZnS, Elementarzelle, 7 Kristallsysteme Themen heute: Reaktionsgleichungen, chemische Gleichgewichte
Wiederholung der letzten Vorlesungsstunde: Ionenbindung, Coulomb-Gesetz, Ionen- (Kristall-)strukturen, NaCl, CsCl, ZnS, Elementarzelle, 7 Kristallsysteme Themen heute: Reaktionsgleichungen, chemische Gleichgewichte
Indigokarmin, Indigotin - Metabolismus
 Indigokarmin, Indigotin - Metabolismus Inhalt 1.1 Chemische Charakterisierung,... 1 1.2 Verwendung und physiologische Eigenschaften... 3 1.3 Simulation des Metabolismus (Simulations-Typ 4), Systemdynamik...
Indigokarmin, Indigotin - Metabolismus Inhalt 1.1 Chemische Charakterisierung,... 1 1.2 Verwendung und physiologische Eigenschaften... 3 1.3 Simulation des Metabolismus (Simulations-Typ 4), Systemdynamik...
Übung 4. SS 2013 Übung - Einführung in die Verbrennung - Methling, Özuylasi 1
 Ziel: Grundlagen der chemischen Reaktionskinetik verstehen Verstehen qualitativer Reaktionsverläufe Aufstellung des Zeitgesetzes Umgang mit nicht reagierenden Stoßpartner (M) Berechnung Geschwindigkeitskoeffizient
Ziel: Grundlagen der chemischen Reaktionskinetik verstehen Verstehen qualitativer Reaktionsverläufe Aufstellung des Zeitgesetzes Umgang mit nicht reagierenden Stoßpartner (M) Berechnung Geschwindigkeitskoeffizient
Zink, ein wichtiges Spurenelement
 Zink, ein wichtiges Spurenelement Peter Bützer Inhalt 1 Einleitung... 1 2 Aufgaben... 2 3 Lösungen... 3 3.1 Simulationsdiagramm (Typ 1)... 3 3.2 Dokumentation (Gleichungen, Parameter)... 3 3.3 Zeitdiagramm...
Zink, ein wichtiges Spurenelement Peter Bützer Inhalt 1 Einleitung... 1 2 Aufgaben... 2 3 Lösungen... 3 3.1 Simulationsdiagramm (Typ 1)... 3 3.2 Dokumentation (Gleichungen, Parameter)... 3 3.3 Zeitdiagramm...
Von Bekir Ada & Edin Terzic ANORGANISCHE PEROXIDE & RADIKALE
 Von Bekir Ada & Edin Terzic ANORGANISCHE PEROXIDE & RADIKALE THEMEN Radikale Was sind Radikale Verwendung Stickstoffmonoxid Wasserstoffperoxid Halogen Polymerisation Peroxide Was sind Peroxide Natriumperoxid
Von Bekir Ada & Edin Terzic ANORGANISCHE PEROXIDE & RADIKALE THEMEN Radikale Was sind Radikale Verwendung Stickstoffmonoxid Wasserstoffperoxid Halogen Polymerisation Peroxide Was sind Peroxide Natriumperoxid
Kinetik: a) Reaktionsgeschwindigkeit (zeitlicher Verlauf) b) Reaktionsweg (Mechanismus)
 Kinetik Kinetik: a) Reaktionsgeschwindigkeit (zeitlicher Verlauf) b) Reaktionsweg (Mechanismus) Klassifizierung chem. Reaktionen nach kinetischen Aspekten a) Reaktionsmolekularität: wie viele Teilchen
Kinetik Kinetik: a) Reaktionsgeschwindigkeit (zeitlicher Verlauf) b) Reaktionsweg (Mechanismus) Klassifizierung chem. Reaktionen nach kinetischen Aspekten a) Reaktionsmolekularität: wie viele Teilchen
3.4 Energieumsatz bei Reaktionen
 3.4 Energieumsatz bei Reaktionen Versuch: Verbrennen eines Stückes Holz Beobachtung: Energie wird freigesetzt in Form von Wärme. Jede Reaktion ist mit einem Energieumsatz gekoppelt. Reaktionen, bei denen
3.4 Energieumsatz bei Reaktionen Versuch: Verbrennen eines Stückes Holz Beobachtung: Energie wird freigesetzt in Form von Wärme. Jede Reaktion ist mit einem Energieumsatz gekoppelt. Reaktionen, bei denen
Chemische Reaktionen. Dienstag, 22. Mai 12
 1 Die Umwandlung von Stoffen 1 Die Umwandlung von Stoffen Die Reaktionsgleichung 1 Die Umwandlung von Stoffen Die Reaktionsgleichung Der Energieumsatz bei chemischen Reaktionen 1 Die Umwandlung von Stoffen
1 Die Umwandlung von Stoffen 1 Die Umwandlung von Stoffen Die Reaktionsgleichung 1 Die Umwandlung von Stoffen Die Reaktionsgleichung Der Energieumsatz bei chemischen Reaktionen 1 Die Umwandlung von Stoffen
0.1 Geschwindigkeit bei Reaktionen
 1 0.1 Geschwindigkeit bei Reaktionen Salzsäure reagiert mit Magnesium Erklärung 2HCl + Mg MgCl 2 + H 2 Das M g-pulver reagiert schneller mit der Salzsäure als die Mg-Späne. Definition: Reaktionsgeschwindigkeit
1 0.1 Geschwindigkeit bei Reaktionen Salzsäure reagiert mit Magnesium Erklärung 2HCl + Mg MgCl 2 + H 2 Das M g-pulver reagiert schneller mit der Salzsäure als die Mg-Späne. Definition: Reaktionsgeschwindigkeit
Grundwissenkarten Hans-Carossa-Gymnasium. 9. Klasse. Chemie SG
 Grundwissenkarten Hans-Carossa-Gymnasium 9. Klasse Chemie SG Es sind insgesamt 18 Karten für die 9. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Grundwissenkarten Hans-Carossa-Gymnasium 9. Klasse Chemie SG Es sind insgesamt 18 Karten für die 9. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
3. Übung Grundlagen der Hauptgruppenchemie
 Allgemeine und Anorganische Chemie 3. Übung Grundlagen der Hauptgruppenchemie Aufgabe 1: Beschreiben Sie die Herstellung von Schwefelsäure nach dem Kontaktverfahren mit Hilfe von chemischen Gleichungen
Allgemeine und Anorganische Chemie 3. Übung Grundlagen der Hauptgruppenchemie Aufgabe 1: Beschreiben Sie die Herstellung von Schwefelsäure nach dem Kontaktverfahren mit Hilfe von chemischen Gleichungen
1. Klausur: Veranstaltung Allgemeine und Anorganische Chemie
 1. Klausur: Veranstaltung Allgemeine und Anorganische Chemie Geowissenschaften (BSc, Diplom), Mathematik (BSc, Diplom), Informatik mit Anwendungsfach Chemie und andere Naturwissenschaften 1. Klausur Modulbegleitende
1. Klausur: Veranstaltung Allgemeine und Anorganische Chemie Geowissenschaften (BSc, Diplom), Mathematik (BSc, Diplom), Informatik mit Anwendungsfach Chemie und andere Naturwissenschaften 1. Klausur Modulbegleitende
Bundesrealgymnasium Imst. Chemie 2010-11. Klasse 4. Chemische Reaktionen
 Bundesrealgymnasium Imst Chemie 2010-11 Klasse 4 Chemische Reaktionen Inhalt 6 Chemische Reaktionen... 18 6.1 Reaktionsgleichungen... 18 6.2 Mol, molare Masse... 19 6.3 Säuren und Laugen... 19 6.4 Neutralisationsreaktionen...
Bundesrealgymnasium Imst Chemie 2010-11 Klasse 4 Chemische Reaktionen Inhalt 6 Chemische Reaktionen... 18 6.1 Reaktionsgleichungen... 18 6.2 Mol, molare Masse... 19 6.3 Säuren und Laugen... 19 6.4 Neutralisationsreaktionen...
Anorganische Peroxide und Radikale. von Benjamin Scharbert
 Anorganische Peroxide und Radikale von Benjamin Scharbert Inhalt: 1. Anorganische Peroxide: 2. Radikale: 1.1 Grundsätzliches 1.2 Na 2 O 2 1.3 BaO 2 1.4 H 2 O 2 2.1 Grundsätzliches 2.2 Sauerstoff 2.3 Stickstoffmonoxid
Anorganische Peroxide und Radikale von Benjamin Scharbert Inhalt: 1. Anorganische Peroxide: 2. Radikale: 1.1 Grundsätzliches 1.2 Na 2 O 2 1.3 BaO 2 1.4 H 2 O 2 2.1 Grundsätzliches 2.2 Sauerstoff 2.3 Stickstoffmonoxid
Reduktion und Oxidation. Oxidationszahlen (OZ)
 Redox-Reaktionen Reduktion und Oxidation Oxidationszahlen (OZ) REDOX Reaktionen / - Gleichungen Das elektrochemische Potential Die Spannungsreihe der Chemischen Elemente Die Nernstsche Gleichung Definitionen
Redox-Reaktionen Reduktion und Oxidation Oxidationszahlen (OZ) REDOX Reaktionen / - Gleichungen Das elektrochemische Potential Die Spannungsreihe der Chemischen Elemente Die Nernstsche Gleichung Definitionen
Probleme sind Gelegenheiten zu zeigen, was man kann. Duke Ellington, amerikanischer Jazz-Musiker (1899-1974)
 1 H 2 -Atemtest (Lactose-Toleranztest) Inhalt Probleme sind Gelegenheiten zu zeigen, was man kann. Duke Ellington, amerikanischer Jazz-Musiker (1899-1974) 1 Lactose-Intoleranz: Einführung... 1 2 Wasserstoff...
1 H 2 -Atemtest (Lactose-Toleranztest) Inhalt Probleme sind Gelegenheiten zu zeigen, was man kann. Duke Ellington, amerikanischer Jazz-Musiker (1899-1974) 1 Lactose-Intoleranz: Einführung... 1 2 Wasserstoff...
Chemie-Grundwissen der 9.Klasse
 Chemie-Grundwissen der 9.Klasse Stoffebene = Makroskopische (sichtbare) Ebene Betrachtung einer Stoffportion mit den erkennbaren und messbaren Eigenschaften Teilchenebene = Submikroskopische Ebene Betrachtung
Chemie-Grundwissen der 9.Klasse Stoffebene = Makroskopische (sichtbare) Ebene Betrachtung einer Stoffportion mit den erkennbaren und messbaren Eigenschaften Teilchenebene = Submikroskopische Ebene Betrachtung
Kläranlage, biologischer Teil (Abwasserreinigungsanlage, ARA)
 Kläranlage, biologischer Teil (Abwasserreinigungsanlage, ARA) Peter Bützer Inhalt 1 Abwasser?... 1 2 Einleitung... 2 3 Aufgabe... 2 3.1 Substanzdaten... 2 3.2 Daten für das Kläranlagemodell... 3 3.3 Anlage...
Kläranlage, biologischer Teil (Abwasserreinigungsanlage, ARA) Peter Bützer Inhalt 1 Abwasser?... 1 2 Einleitung... 2 3 Aufgabe... 2 3.1 Substanzdaten... 2 3.2 Daten für das Kläranlagemodell... 3 3.3 Anlage...
Das Chemische Gleichgewicht
 Universität Regensburg Institut für Anorganische Chemie Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsvorträge im Sommersemester 27.07.2011 Betreuung: Dr. M. Andratschke Referent: Hofmann, Martin Das Chemische
Universität Regensburg Institut für Anorganische Chemie Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsvorträge im Sommersemester 27.07.2011 Betreuung: Dr. M. Andratschke Referent: Hofmann, Martin Das Chemische
Lösungsenthalpie / Lösungswärme unterschiedlicher Zinksulfat-Hydrate
 Lösungsenthalpie / Lösungswärme unterschiedlicher Zinksulfat-Hydrate Zeitbedarf für die Versuchsdurchführung: ca. 10 Min. Geräte: Magnetrührer mit Magnetrührstäbchen Thermometer (min. 0,5 C Genauigkeit)
Lösungsenthalpie / Lösungswärme unterschiedlicher Zinksulfat-Hydrate Zeitbedarf für die Versuchsdurchführung: ca. 10 Min. Geräte: Magnetrührer mit Magnetrührstäbchen Thermometer (min. 0,5 C Genauigkeit)
CHEMIE WIEDERHOLUNG: KAPITEL 5 REAKTIONEN DER ANORGANISCHEN CHEMIE. Timm Wilke. Georg-August-Universität Göttingen. Wintersemester 2013 / 2014
 CHEMIE WIEDERHOLUNG: KAPITEL 5 REAKTIONEN DER ANORGANISCHEN CHEMIE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Einführung Brennendes Magnesiumband reagiert mit Sauerstoff
CHEMIE WIEDERHOLUNG: KAPITEL 5 REAKTIONEN DER ANORGANISCHEN CHEMIE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Einführung Brennendes Magnesiumband reagiert mit Sauerstoff
Reaktionskinetik. bimolekularen Reaktion. Für die Konzentraton des Dinitrochlorbenzols [a] gilt: = k
![Reaktionskinetik. bimolekularen Reaktion. Für die Konzentraton des Dinitrochlorbenzols [a] gilt: = k Reaktionskinetik. bimolekularen Reaktion. Für die Konzentraton des Dinitrochlorbenzols [a] gilt: = k](/thumbs/42/22840880.jpg) Versuche des Kapitel 7 Reaktionskinetik Einleitung Die Reaktion von Piperidin mit Dinitrochlorbenzol zum gelben Dinitrophenylpiperidin soll auf die Geschwindigkeitskonstante und die Arrheniusparameter
Versuche des Kapitel 7 Reaktionskinetik Einleitung Die Reaktion von Piperidin mit Dinitrochlorbenzol zum gelben Dinitrophenylpiperidin soll auf die Geschwindigkeitskonstante und die Arrheniusparameter
Praktikum Physikalische Chemie I 30. Januar Aktivierungsenergie. Guido Petri Anastasiya Knoch PC111/112, Gruppe 11
 Praktikum Physikalische Chemie I 30. Januar 2016 Aktivierungsenergie Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1 Aufgabenstellung Für die Reaktion von Saccharose mit Wasser zu Glucose und Fructose
Praktikum Physikalische Chemie I 30. Januar 2016 Aktivierungsenergie Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1 Aufgabenstellung Für die Reaktion von Saccharose mit Wasser zu Glucose und Fructose
Chemie Protokoll. Versuch 2 3 (RKV) Reaktionskinetik Esterverseifung. Stuttgart, Sommersemester 2012
 Chemie Protokoll Versuch 2 3 (RKV) Reaktionskinetik Esterverseifung Stuttgart, Sommersemester 202 Gruppe 0 Jan Schnabel Maximilian Möckel Henri Menke Assistent: Durmus 20. Mai 202 Inhaltsverzeichnis Theorie
Chemie Protokoll Versuch 2 3 (RKV) Reaktionskinetik Esterverseifung Stuttgart, Sommersemester 202 Gruppe 0 Jan Schnabel Maximilian Möckel Henri Menke Assistent: Durmus 20. Mai 202 Inhaltsverzeichnis Theorie
Reaktionskinetik: - Geschwindigkeit chemischer Reaktionen - Untersuchung (bzw. Bestimmung) der Reaktionsmechanismen. c(a) t. v = -
 REAKTIONSKINETIK 1 Reaktionskinetik Reaktionskinetik: - Geschwindigkeit chemischer Reaktionen - Untersuchung (bzw. Bestimmung) der Reaktionsmechanismen Anwendung: - Vorgänge in den lebenden Organismen
REAKTIONSKINETIK 1 Reaktionskinetik Reaktionskinetik: - Geschwindigkeit chemischer Reaktionen - Untersuchung (bzw. Bestimmung) der Reaktionsmechanismen Anwendung: - Vorgänge in den lebenden Organismen
Richtung chemischer Reaktionen, chemisches Gleichgewicht. Massenwirkungsgesetz
 Richtung chemischer Reaktionen, chemisches Gleichgewicht a A + b B K [C] [A] c a [D] [B] c C + d D d b K = Gleichgewichtskonstante Massenwirkungsgesetz [ ] = in Lösung: Konzentration (in mol L -1 ), für
Richtung chemischer Reaktionen, chemisches Gleichgewicht a A + b B K [C] [A] c a [D] [B] c C + d D d b K = Gleichgewichtskonstante Massenwirkungsgesetz [ ] = in Lösung: Konzentration (in mol L -1 ), für
!!! Du darfst eine Teilaufgabe von Nr. 2 und zwei der Teilaufgaben von Nr 4 streichen!!!
 1 Klassenarbeit Chemie 1/5 A TIPP alle Rechenaufgaben mit Einheit, Ergebnis und Antwortsatz! In der Tabelle links stehende Elemente haben eher die maximale Wertigkeit! In der Tabelle rechts stehende Elemente
1 Klassenarbeit Chemie 1/5 A TIPP alle Rechenaufgaben mit Einheit, Ergebnis und Antwortsatz! In der Tabelle links stehende Elemente haben eher die maximale Wertigkeit! In der Tabelle rechts stehende Elemente
Richtung chemischer Reaktionen, Chemisches Gleichgewicht. Massenwirkungsgesetz
 Richtung chemischer Reaktionen, Chemisches Gleichgewicht a A + b B K = [C] [A] c a [D] [B] c C + d D d b Massenwirkungsgesetz K = Gleichgewichtskonstante [ ] = in Lösung: Konzentration (in mol L -1 ),
Richtung chemischer Reaktionen, Chemisches Gleichgewicht a A + b B K = [C] [A] c a [D] [B] c C + d D d b Massenwirkungsgesetz K = Gleichgewichtskonstante [ ] = in Lösung: Konzentration (in mol L -1 ),
Grundwissen Chemie. Jahrgangsstufe 9 (SG) von Christiane Markreiter und Thomas Gerl
 Grundwissen Chemie Jahrgangsstufe 9 (SG) von Christiane Markreiter und Thomas Gerl Ludwig-Thoma-Gymnasium Seestr. 25b 83209 Prien am Chiemsee Tel.: 08051 / 96 404 0 Fax.: 08051 / 96 404 100 thomas.gerl@gmx.de
Grundwissen Chemie Jahrgangsstufe 9 (SG) von Christiane Markreiter und Thomas Gerl Ludwig-Thoma-Gymnasium Seestr. 25b 83209 Prien am Chiemsee Tel.: 08051 / 96 404 0 Fax.: 08051 / 96 404 100 thomas.gerl@gmx.de
SI-Handbuch Naturwissenschaftliche Grundlagen
 .1 Physikalische Eigenschaften 3.2 Wasserdichte 6.3 Viskosität 7.4 h, x-diagramm für feuchte Luft 8 Dieses Kapitel wurde erstellt unter Mitwirkung von: 5. Auflage: Otto Fux, Masch. Ing. SIA, dipl. Sanitärplaner,
.1 Physikalische Eigenschaften 3.2 Wasserdichte 6.3 Viskosität 7.4 h, x-diagramm für feuchte Luft 8 Dieses Kapitel wurde erstellt unter Mitwirkung von: 5. Auflage: Otto Fux, Masch. Ing. SIA, dipl. Sanitärplaner,
Katalyse. Martin Babilon 14/07/2011. Katalyse. Martin Babilon Universität Paderborn. 14 Juli Montag, 18. Juli 2011
 Katalyse Universität Paderborn 14 Juli 2011 1 Übersicht Motivation & Einleitung Katalyse-Zyklus homogene Katalyse heterogene Katalyse 2 Motivation 3 Geschichte der Katalyse 6000 v. Christus: Alkoholvergärung
Katalyse Universität Paderborn 14 Juli 2011 1 Übersicht Motivation & Einleitung Katalyse-Zyklus homogene Katalyse heterogene Katalyse 2 Motivation 3 Geschichte der Katalyse 6000 v. Christus: Alkoholvergärung
EinFaCh 1. Studienvorbereitung Chemie. Einstieg in Freibergs anschauliches Chemiewissen Teil 1: Redoxreaktionen und Elektrochemie.
 Studienvorbereitung Chemie EinFaCh 1 Einstieg in Freibergs anschauliches Chemiewissen Teil 1: Redoxreaktionen und Elektrochemie www.tu-freiberg.de http://tu-freiberg.de/fakultaet2/einfach Was ist eine
Studienvorbereitung Chemie EinFaCh 1 Einstieg in Freibergs anschauliches Chemiewissen Teil 1: Redoxreaktionen und Elektrochemie www.tu-freiberg.de http://tu-freiberg.de/fakultaet2/einfach Was ist eine
Energetik und Kinetik chemischer Reaktionen
 Energetik und Kinetik chemischer Reaktionen Reaktionsenergetik als Teil der Thermodynamik - wann läuft eine chemische Reaktion freiwillig ab? - in welchem Umfang läuft eine Reaktion ab? - wie viel Energie
Energetik und Kinetik chemischer Reaktionen Reaktionsenergetik als Teil der Thermodynamik - wann läuft eine chemische Reaktion freiwillig ab? - in welchem Umfang läuft eine Reaktion ab? - wie viel Energie
spaltet. Der Sauerstoff entflammt den Glimmspan. Bei der katalytischen Substanz handelt es sich um das Enzym Katalase.
 ENZYMATIK 1. Vorversuch Versuch Spaltung von Wasserstoffperoxid (H 2 O 2 ) Material: Bäckerhefe, Braunstein (MnO 2 ), Wasserstoffperoxid, Rundkolben, Stativ, Brenner, Glimmspan Durchführung 1: 5ml Wasserstoffperoxid
ENZYMATIK 1. Vorversuch Versuch Spaltung von Wasserstoffperoxid (H 2 O 2 ) Material: Bäckerhefe, Braunstein (MnO 2 ), Wasserstoffperoxid, Rundkolben, Stativ, Brenner, Glimmspan Durchführung 1: 5ml Wasserstoffperoxid
Selbsteinschätzungstest zum Vorkurs Anorganische Chemie
 WS 15/16 1/7 Selbsteinschätzungstest zum Vorkurs Anorganische Chemie Liebe Studierende! Der Vorkurs frischt Ihr Schulwissen auf, vermittelt aber NICHT die späteren Studieninhalte. Die Inhalte des Vorkurses
WS 15/16 1/7 Selbsteinschätzungstest zum Vorkurs Anorganische Chemie Liebe Studierende! Der Vorkurs frischt Ihr Schulwissen auf, vermittelt aber NICHT die späteren Studieninhalte. Die Inhalte des Vorkurses
Die Freie Aktivierungsenthalpie
 Die Freie Aktivierungsenthalpie E A G k Ae RT e = = RT G: Freie Aktivierungsenthalpie G = H T S e G RT = e S R e H RT e S R A H E A Katalyse: der aktivierte Übergangskomplex H E A Katalysatoren beeinflussen
Die Freie Aktivierungsenthalpie E A G k Ae RT e = = RT G: Freie Aktivierungsenthalpie G = H T S e G RT = e S R e H RT e S R A H E A Katalyse: der aktivierte Übergangskomplex H E A Katalysatoren beeinflussen
V 2 Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration und der Temperatur bei der Reaktion von Kaliumpermanganat mit Oxalsäure in Lösung
 V 2 Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration und der Temperatur bei der Reaktion von Kaliumpermanganat mit Oxalsäure in Lösung Bei diesem Versuch geht es darum, die Geschwindigkeit
V 2 Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration und der Temperatur bei der Reaktion von Kaliumpermanganat mit Oxalsäure in Lösung Bei diesem Versuch geht es darum, die Geschwindigkeit
D1 Abhängigkeit der Reaktionsgeschwindigkeit von der Temperatur
 Chemische Reaktionen verlaufen nicht alle mit der gleichen Geschwindigkeit. Sehr schnelle Reaktionen, wie z.b. die Neutralisationsreaktion oder die Knallgasreaktion erfolgen in Bruchteilen einer Sekunde.
Chemische Reaktionen verlaufen nicht alle mit der gleichen Geschwindigkeit. Sehr schnelle Reaktionen, wie z.b. die Neutralisationsreaktion oder die Knallgasreaktion erfolgen in Bruchteilen einer Sekunde.
 www.zaubervorlesung.de Institut für Anorganische Chemie Institut für Anorganische Chemie Universität Erlangen-Nürnberg Donnerstag 19. Okt. 2006 Einlass: 18:00 Uhr Beginn: 20:00 Uhr Getränke dürfen nur
www.zaubervorlesung.de Institut für Anorganische Chemie Institut für Anorganische Chemie Universität Erlangen-Nürnberg Donnerstag 19. Okt. 2006 Einlass: 18:00 Uhr Beginn: 20:00 Uhr Getränke dürfen nur
Redoxreaktionen. Mg + ½ O 2. MgO. 3 Mg + N 2 Mg 3 N 2. Mg ½ O + 2 e O 2. 3 Mg 3 Mg e
 Redoxreaktionen Mg + ½ O 2 MgO 3 Mg + N 2 Mg 3 N 2 2 Mg ½ O + 2 e 2+ Mg + 2 e O 2 3 Mg 3 Mg 2+ + 6 e N + 6 e 2 N 3 2 1 Redoxreaktionen 2 Oxidation und Reduktion Eine Oxidation ist ein Elektronenverlust
Redoxreaktionen Mg + ½ O 2 MgO 3 Mg + N 2 Mg 3 N 2 2 Mg ½ O + 2 e 2+ Mg + 2 e O 2 3 Mg 3 Mg 2+ + 6 e N + 6 e 2 N 3 2 1 Redoxreaktionen 2 Oxidation und Reduktion Eine Oxidation ist ein Elektronenverlust
Protokoll zur Herstellung von Essigsäureethylester
 Protokoll zur Herstellung von Essigsäureethylester 1) Ziel des Versuches: Herstellung von Essigsäureethylester unter säurekatalytischen Bedingungen. 2) Theoretischer Hintergrund: Ester sind eine Klasse
Protokoll zur Herstellung von Essigsäureethylester 1) Ziel des Versuches: Herstellung von Essigsäureethylester unter säurekatalytischen Bedingungen. 2) Theoretischer Hintergrund: Ester sind eine Klasse
Verbrennungsrechnung als kinetischer Simulationsansatz
 Verbrennungsrechnung als kinetischer Simulationsansatz Simulationsansatz mit CHEMCAD Die Daten für Flammpunkt, Zündtemperatur, Explosionsgrenzen diverser Stoffe sind weitestgehend bekannt. Methoden zur
Verbrennungsrechnung als kinetischer Simulationsansatz Simulationsansatz mit CHEMCAD Die Daten für Flammpunkt, Zündtemperatur, Explosionsgrenzen diverser Stoffe sind weitestgehend bekannt. Methoden zur
Vorlesung Allgemeine Chemie Teil Physikalische Chemie WS 2009/10
 Vorlesung Allgemeine Chemie Teil Physikalische Chemie WS 2009/10 Dr. Lars Birlenbach Physikalische Chemie, Universität Siegen Raum AR-F0102 Tel.: 0271 740 2817 email: birlenbach@chemie.uni-siegen.de Lars
Vorlesung Allgemeine Chemie Teil Physikalische Chemie WS 2009/10 Dr. Lars Birlenbach Physikalische Chemie, Universität Siegen Raum AR-F0102 Tel.: 0271 740 2817 email: birlenbach@chemie.uni-siegen.de Lars
Urease. Peter Bützer. 1 Das Enzym Urease. Inhalt
 Urease Inhalt 1 Das Enzym Urease... 1 2 Das Substrat arnstoff... 2 3 Die chemische Reaktion... 2 4 Folgerung... 4 5 Messung... 4 6 Aufgabenstellung... 5 6.1 Simulation... 5 6.1.1 Annahmen... 5 6.1.2 Simulationsdiagramm
Urease Inhalt 1 Das Enzym Urease... 1 2 Das Substrat arnstoff... 2 3 Die chemische Reaktion... 2 4 Folgerung... 4 5 Messung... 4 6 Aufgabenstellung... 5 6.1 Simulation... 5 6.1.1 Annahmen... 5 6.1.2 Simulationsdiagramm
Wasserstoffbrückenbindung, H 2 O, NH 3, HF, Wasserstoff im PSE, Isotope, Vorkommen, exotherme Reaktion mit Sauerstoff zu Wasser, Energieinhalt,
 Wiederholung der letzten Vorlesungsstunde: Das Element Wasserstoff und seine Verbindungen Wasserstoffbrückenbindung, H 2 O, NH 3, HF, Wasserstoff im PSE, Isotope, Vorkommen, exotherme Reaktion mit Sauerstoff
Wiederholung der letzten Vorlesungsstunde: Das Element Wasserstoff und seine Verbindungen Wasserstoffbrückenbindung, H 2 O, NH 3, HF, Wasserstoff im PSE, Isotope, Vorkommen, exotherme Reaktion mit Sauerstoff
Bei einer chemischen Reaktion tauschen die Atome ihre Bindungspartner
 3. DIE CHEMISCHE REAKTION ARBEITSBLATT 3.1 DIE MASSE BEI CHEMISCHEN REAKTIONEN Bei einer chemischen Reaktion tauschen die Atome ihre Bindungspartner Wie ändert sich die Masse bei einer chemischen Reaktion?
3. DIE CHEMISCHE REAKTION ARBEITSBLATT 3.1 DIE MASSE BEI CHEMISCHEN REAKTIONEN Bei einer chemischen Reaktion tauschen die Atome ihre Bindungspartner Wie ändert sich die Masse bei einer chemischen Reaktion?
Abhängigkeit der Reaktionsgeschwindigkeit (RG) von der Konzentration: Kalk (CaCO 3 ) + Salzsäure (HCl)
 Abhängigkeit der Reaktionsgeschwindigkeit Abhängigkeit der Reaktionsgeschwindigkeit (RG) von der Konzentration: Kalk (CaCO 3 ) + Salzsäure (HCl) Beim Lösen von Kalk in Salzsäure bildet sich ein gut wasserlösliches
Abhängigkeit der Reaktionsgeschwindigkeit Abhängigkeit der Reaktionsgeschwindigkeit (RG) von der Konzentration: Kalk (CaCO 3 ) + Salzsäure (HCl) Beim Lösen von Kalk in Salzsäure bildet sich ein gut wasserlösliches
Anorganische Peroxide und Radikale. Von Aktivsauerstoff und Treibhauseffekt
 Anorganische Peroxide und Radikale Von Aktivsauerstoff und Treibhauseffekt Peroxide Peroxobindung -O-O- Peroxidanion O 2 2- Zwei gleichsinnig polarisierte R-O Bindungen Lange Bindung zwischen den Sauerstoffatomen
Anorganische Peroxide und Radikale Von Aktivsauerstoff und Treibhauseffekt Peroxide Peroxobindung -O-O- Peroxidanion O 2 2- Zwei gleichsinnig polarisierte R-O Bindungen Lange Bindung zwischen den Sauerstoffatomen
Klausur : Allgemeine und Anorganische Chemie. Name...Fachrichtung... Matr.-Nr...
 Klausur : Allgemeine und Anorganische Chemie Mo. 1.03.11 : 13.30 16.30 Uhr 1 Beantworten Sie maximal zehn Fragen. Für jede Frage gibt es maximal 10 Punkte; die Klausur gilt als bestanden, wenn 50 Punkte
Klausur : Allgemeine und Anorganische Chemie Mo. 1.03.11 : 13.30 16.30 Uhr 1 Beantworten Sie maximal zehn Fragen. Für jede Frage gibt es maximal 10 Punkte; die Klausur gilt als bestanden, wenn 50 Punkte
Bundesrealgymnasium Imst. Chemie 2010-11. Klasse 4. Einführung Stoffe
 Bundesrealgymnasium Imst Chemie 2010-11 Einführung Stoffe Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
Bundesrealgymnasium Imst Chemie 2010-11 Einführung Stoffe Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
Klausur zur Vorlesung "Grundzüge der Chemie" für Studierende des Maschinenbaus BITTE AUSFÜLLEN BITTE HALTEN SIE IHREN STUDENTAUSWEIS BEREIT
 1 PUNKTZAL NTE Klausur zur Vorlesung "Grundzüge der hemie" für Studierende des Maschinenbaus Termin: 17. Juni 2003 rt: Z 10 Zeit: 9.30-11.30 Uhr Dauer: 120 Minuten BITTE AUSFÜLLEN BITTE ALTEN SIE IREN
1 PUNKTZAL NTE Klausur zur Vorlesung "Grundzüge der hemie" für Studierende des Maschinenbaus Termin: 17. Juni 2003 rt: Z 10 Zeit: 9.30-11.30 Uhr Dauer: 120 Minuten BITTE AUSFÜLLEN BITTE ALTEN SIE IREN
Wilhelm Ostwald -100 Jahre Nobelpreis-
 Wilhelm Ostwald -100 Jahre Nobelpreis- 2. Jahrestreffen der Senior Expert Chemists (SEC) Hanau 7. bis 9.5. 2009 Nobelpreisurkunde für seine Leistungen über Katalyse und seine grundlegenden Untersuchungen
Wilhelm Ostwald -100 Jahre Nobelpreis- 2. Jahrestreffen der Senior Expert Chemists (SEC) Hanau 7. bis 9.5. 2009 Nobelpreisurkunde für seine Leistungen über Katalyse und seine grundlegenden Untersuchungen
1.3. Fragen zu chemischen Reaktionen
 1.3. Fragen zu chemischen Reaktionen Reaktionsgleichungen Ergänze die fehlenden Koeffizienten: a) PbI 4 PbI 2 + I 2 b) PbO 2 PbO + O 2 c) CO + O 2 CO 2 d) SO 2 + O 2 SO 3 e) N 2 + H 2 NH 3 f) N 2 + O 2
1.3. Fragen zu chemischen Reaktionen Reaktionsgleichungen Ergänze die fehlenden Koeffizienten: a) PbI 4 PbI 2 + I 2 b) PbO 2 PbO + O 2 c) CO + O 2 CO 2 d) SO 2 + O 2 SO 3 e) N 2 + H 2 NH 3 f) N 2 + O 2
Präparat 11: Dibenzylidenaceton (Aldolkondensation)
 Institut für Organische Chemie Grundpraktikum Organische Chemie (OC1P) WS 2016/17 Präparat 11: (Aldolkondensation) Darstellung von Literatur: H. G. O. Becker et al., Organikum, Wiley-VCH, Weinheim, 23.
Institut für Organische Chemie Grundpraktikum Organische Chemie (OC1P) WS 2016/17 Präparat 11: (Aldolkondensation) Darstellung von Literatur: H. G. O. Becker et al., Organikum, Wiley-VCH, Weinheim, 23.
10TG. Training II2. 1. Schreibe die Reaktionsgleichungen folgender Reaktionen. Benenne die Produkte. Erkläre die Teilchenebene.
 Training II2 1. Schreibe die Reaktionsgleichungen folgender Reaktionen. Benenne die Produkte. Erkläre die Teilchenebene. (4X4=1 X4=16P) a. Verbrennung von Kohlenstoff C + O2 CO2 Kohlenstoffdioxid b. Thermolyse
Training II2 1. Schreibe die Reaktionsgleichungen folgender Reaktionen. Benenne die Produkte. Erkläre die Teilchenebene. (4X4=1 X4=16P) a. Verbrennung von Kohlenstoff C + O2 CO2 Kohlenstoffdioxid b. Thermolyse
Institut für Physikalische und Theoretische Chemie Physikalisch-Chemisches Praktikum für Studenten L2
 Institut für Physikalische und Theoretische Chemie Physikalisch-Chemisches Praktikum für Studenten L2 10. Temperaturabhängigkeit der Reaktionsgeschwindigkeit: Arrhenius-Beziehung Thema In diesem Versuch
Institut für Physikalische und Theoretische Chemie Physikalisch-Chemisches Praktikum für Studenten L2 10. Temperaturabhängigkeit der Reaktionsgeschwindigkeit: Arrhenius-Beziehung Thema In diesem Versuch
Allgemeine Chemie für r Studierende der Zahnmedizin
 Allgemeine Chemie für r Studierende der Zahnmedizin Allgemeine und Anorganische Chemie Teil 3 Dr. Ulrich Schatzschneider Institut für Anorganische und Angewandte Chemie, Universität Hamburg Lehrstuhl für
Allgemeine Chemie für r Studierende der Zahnmedizin Allgemeine und Anorganische Chemie Teil 3 Dr. Ulrich Schatzschneider Institut für Anorganische und Angewandte Chemie, Universität Hamburg Lehrstuhl für
Beispiel: Fällung von Bariumsulfat aus einer Sulfat-Ionen enthaltenden Lösung mit Hilfe von Bariumchlorid
 Reaktionsgleichungen In der Chemie ist eine Reaktionsgleichung die Kurzschreibweise für eine chemische Reaktion. Sie gibt die Ausgangs und Endstoffe (Reaktanten und Produkte) einer Stoffumwandlung in richtigem
Reaktionsgleichungen In der Chemie ist eine Reaktionsgleichung die Kurzschreibweise für eine chemische Reaktion. Sie gibt die Ausgangs und Endstoffe (Reaktanten und Produkte) einer Stoffumwandlung in richtigem
Posten 1a. Antworten: a) Newton b) Sievert c) Joule d) Watt. (=> Posten 2a) (=> Posten 3d) (=> Posten 4j) (=> Posten 5s) Bor
 Posten 1a Welche Einheit hat die Arbeit? a) Newton b) Sievert c) Joule d) Watt (=> Posten 2a) (=> Posten 3d) (=> Posten 4j) (=> Posten 5s) Posten 1f Welche Eigenschaft gehört nicht zu den drei wichtigen
Posten 1a Welche Einheit hat die Arbeit? a) Newton b) Sievert c) Joule d) Watt (=> Posten 2a) (=> Posten 3d) (=> Posten 4j) (=> Posten 5s) Posten 1f Welche Eigenschaft gehört nicht zu den drei wichtigen
Wasser à. Nachweis: Wasser ist
 Arbeitsblatt zu Kap. 5. Atome Bausteine der Stoffe 5.1 Elemente und Verbindungen Elektrolyse des Reinstoffes Wasser Wasser à Nachweis: Wasser ist Stoffeinteilung 5.2 Von den Elementen zu den Atomen Synthese
Arbeitsblatt zu Kap. 5. Atome Bausteine der Stoffe 5.1 Elemente und Verbindungen Elektrolyse des Reinstoffes Wasser Wasser à Nachweis: Wasser ist Stoffeinteilung 5.2 Von den Elementen zu den Atomen Synthese
3 Mg 3 Mg e N e 2 N 3
 Redoxreaktionen Mg + ½ O 2 MgO 3 Mg + N 2 Mg 3 N 2 Mg Mg 2+ + 2 e ½ O 2 + 2 e O 2 3 Mg 3 Mg 2+ + 6 e N 2 + 6 e 2 N 3 1 Redoxreaktionen 2 Oxidation und Reduktion Eine Oxidation ist ein Elektronenverlust
Redoxreaktionen Mg + ½ O 2 MgO 3 Mg + N 2 Mg 3 N 2 Mg Mg 2+ + 2 e ½ O 2 + 2 e O 2 3 Mg 3 Mg 2+ + 6 e N 2 + 6 e 2 N 3 1 Redoxreaktionen 2 Oxidation und Reduktion Eine Oxidation ist ein Elektronenverlust
Versuch: Reaktionskinetik
 Versuch: Reaktionskinetik Befindet sich eine chemische Reaktion im thermodynamischen Gleichgewicht, so lassen sich die Bedingungen für diesen Zustand durch eine energetische Betrachtungsweise mithilfe
Versuch: Reaktionskinetik Befindet sich eine chemische Reaktion im thermodynamischen Gleichgewicht, so lassen sich die Bedingungen für diesen Zustand durch eine energetische Betrachtungsweise mithilfe
Heterogen katalysierte Reaktionen sind von enormer technischer Bedeutung.
 Heterogene Katalyse Heterogen katalysierte Reaktionen sind von enormer technischer Bedeutung. Zahlreiche Prozesse laufen an der Oberfläche fester Katalysatoren mit hoher Geschwindigkeit und Selektivität
Heterogene Katalyse Heterogen katalysierte Reaktionen sind von enormer technischer Bedeutung. Zahlreiche Prozesse laufen an der Oberfläche fester Katalysatoren mit hoher Geschwindigkeit und Selektivität
Anionen-Nachweis durch Fällungsreaktionen
 Lehrer-/Dozentenblatt Anionen-Nachweis durch Fällungsreaktionen (Artikelnr.: P7511300) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Allgemeine Chemie- Einführung
Lehrer-/Dozentenblatt Anionen-Nachweis durch Fällungsreaktionen (Artikelnr.: P7511300) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Allgemeine Chemie- Einführung
MgO. Mg Mg e ½ O e O 2. 3 Mg 3 Mg e N e 2 N 3
 Redox-Reaktionen Mg + ½ O 2 MgO 3 Mg + N 2 Mg 3 N 2 Mg Mg 2+ + 2 e ½ O 2 + 2 e O 2 3 Mg 3 Mg 2+ + 6 e N 2 + 6 e 2 N 3 Redox-Reaktionen Oxidation und Reduktion Eine Oxidation ist ein Elektronenverlust Na
Redox-Reaktionen Mg + ½ O 2 MgO 3 Mg + N 2 Mg 3 N 2 Mg Mg 2+ + 2 e ½ O 2 + 2 e O 2 3 Mg 3 Mg 2+ + 6 e N 2 + 6 e 2 N 3 Redox-Reaktionen Oxidation und Reduktion Eine Oxidation ist ein Elektronenverlust Na
Fachschule für f. r Technik. Dipl.FL. D.Strache
 Dipl.FL. Chemie Grundlagen Stoffe Eisen, Sauerstoff, Schwefelsäure, Benzin, Luft Reine Stoffe Eisen, Sauerstoff, Schwefelsäure, Benzin Chemische Elemente Eisen, Sauerstoff Chemische Verbindungen Schwefelsäure,
Dipl.FL. Chemie Grundlagen Stoffe Eisen, Sauerstoff, Schwefelsäure, Benzin, Luft Reine Stoffe Eisen, Sauerstoff, Schwefelsäure, Benzin Chemische Elemente Eisen, Sauerstoff Chemische Verbindungen Schwefelsäure,
* Die Gesamtnote im Bereich Naturwissenschaften setzt sich aus den Noten in den drei Prüfungsteilen (Biologie, Chemie, Physik) zusammen.
 Eidgenössisches Departement des Innern EDI Schweizerische Maturitätskommission SMK Schweizerische Maturitätsprüfung Prüfung gemäss neuem Recht (Prüfungsverordnung, Stand am 1. Januar 2012) Grundlagenfach
Eidgenössisches Departement des Innern EDI Schweizerische Maturitätskommission SMK Schweizerische Maturitätsprüfung Prüfung gemäss neuem Recht (Prüfungsverordnung, Stand am 1. Januar 2012) Grundlagenfach
[ ] 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe + - Moleküle aus gleichen Atomen. Ionen. Moleküle aus verschiedenen Atomen
![[ ] 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe + - Moleküle aus gleichen Atomen. Ionen. Moleküle aus verschiedenen Atomen [ ] 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe + - Moleküle aus gleichen Atomen. Ionen. Moleküle aus verschiedenen Atomen](/thumbs/68/58264490.jpg) 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe Gemische Reinstoffe Elemente Verbindungen gleiche Atome Moleküle aus gleichen Atomen Moleküle aus verschiedenen Atomen Ionen + Kation Anion z.b.
1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe Gemische Reinstoffe Elemente Verbindungen gleiche Atome Moleküle aus gleichen Atomen Moleküle aus verschiedenen Atomen Ionen + Kation Anion z.b.
REDOX-REAKTIONEN Donator-Akzeptor-Konzept! So geht s: schrittweises Aufstellen von Redoxgleichungen Chemie heute
 REDOXREAKTIONEN In den letzten Wochen haben wir uns mit SäureBaseReaktionen und Redoxreaktionen beschäftigt. Viele Phänomene in uns und um uns herum sind solche Redoxreaktionen. Nun müssen wir unseren
REDOXREAKTIONEN In den letzten Wochen haben wir uns mit SäureBaseReaktionen und Redoxreaktionen beschäftigt. Viele Phänomene in uns und um uns herum sind solche Redoxreaktionen. Nun müssen wir unseren
Robert-Koch-Gymnasium Deggendorf. Grundwissen Chemie. 8. Jahrgangsstufe
 Robert-Koch-Gymnasium Deggendorf Grundwissen Chemie 8. Jahrgangsstufe Teilchenmodell und Stoffeigenschaften Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, vereinfacht dargestellt als Kugeln.
Robert-Koch-Gymnasium Deggendorf Grundwissen Chemie 8. Jahrgangsstufe Teilchenmodell und Stoffeigenschaften Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, vereinfacht dargestellt als Kugeln.
Fakultät Mathematik und Naturwissenschaften, Anorganische Chemie Professur AC I. Seminar zum Brückenkurs 2016 TU Dresden, 2017 Folie 1
 Seminar zum Brückenkurs 2016 TU Dresden, 2017 Folie 1 Seminar zum Brückenkurs Chemie 2017 Chemische Bindung, Molekülbau, Stöchiometrie Dr. Jürgen Getzschmann Dresden, 19.09.2017 Zeichnen von Valenzstrichformeln
Seminar zum Brückenkurs 2016 TU Dresden, 2017 Folie 1 Seminar zum Brückenkurs Chemie 2017 Chemische Bindung, Molekülbau, Stöchiometrie Dr. Jürgen Getzschmann Dresden, 19.09.2017 Zeichnen von Valenzstrichformeln
Film der Einheit Wasserstoff
 Film der Einheit Wasserstoff Vorkommen im Universum und auf der Erde Atombau und Platz des Wasserstoffs im PSE Kovalente Bindung (Atombindung) im H 2 - Molekül Eigenschaften des Wasserstoffs: Dichte, Diffusion,
Film der Einheit Wasserstoff Vorkommen im Universum und auf der Erde Atombau und Platz des Wasserstoffs im PSE Kovalente Bindung (Atombindung) im H 2 - Molekül Eigenschaften des Wasserstoffs: Dichte, Diffusion,
Lösungen zu den Übungen zur Experimentalvorlesung AC
 Lösungen zu den Übungen zur Experimentalvorlesung AC 1. Stöchiometrisches Rechnen 1.1. n (S = mol n (S 8 = 0,5 mol 1.. n (P = 8 mol n (P = mol 1.3. m (P =,8 g m (P =,8 g m (P = 1, g 1.. m (1/3 As 3+ =
Lösungen zu den Übungen zur Experimentalvorlesung AC 1. Stöchiometrisches Rechnen 1.1. n (S = mol n (S 8 = 0,5 mol 1.. n (P = 8 mol n (P = mol 1.3. m (P =,8 g m (P =,8 g m (P = 1, g 1.. m (1/3 As 3+ =
