Kohlenmonoxid aus Ethanal, CH 3 -CHO
|
|
|
- Julian Brauer
- vor 8 Jahren
- Abrufe
Transkript
1 Kohlenmonoxid aus Ethanal, CH 3 -CHO Peter Bützer Chemiker haben viele nette Reaktionen! Inhalt 1 Einleitung/Theorie Aufgabenstellung Beobachtungen/Messungen, Datenbasis Reaktionsgleichungen/Berechnungen Folgerungen Lösung Simulation Simulationsdiagramm (Typ 1) Zeitdiagramm Dokumentation (Gleichungen, Parameter) Vergleich von Messung und Simulation Interpretation Folgerung Simulation der Reaktion mit der RGT-Regel Dokumentation (Gleichungen, Parameter) Einleitung/Theorie Herstellung von Kohlenmonoxid (CO) aus Ethanal/ Acetaldehyd (CH 3 CHO) durch Pyrolyse. Unter Pyrolyse 1 versteht man die thermische Zersetzung von chemischen Verbindungen. Die chemischen Reaktionen bei hohen Temperaturen gehen meistens mit dem Bruch von chemischen Bindungen der beteiligten Substanzen einher, man spricht dann von Hochtemperaturchemie. Dabei werden, wie dieses Beispiel zeigt, aus kompliziert aufgebauten Abbildung 1: Kehrichtverbrennungsanlage Verbindungen nur kleinere und meist einfacher gebaute Moleküle gebildet. Die Pyrolyse spielt bei allen Verbrennungen mit Sauerstoffunterschuss (Sauerstoffmangel) eine wichtige Rolle, so auch bei den Kehrichtverbrennungsanlagen. 1 Pyrolyse stammt von griechisch pyr als Feuer und lysis als Auflösung.
2 Peter Bützer 2 2 Aufgabenstellung Der Verlauf des gemessenen Druckes einer Pyrolyse von Ethanal (Acetaldehyd, CH 3 -CHO) ist mit einem Modell, einer Simulation nachzubilden. 2.1 Beobachtungen/Messungen, Datenbasis Folgende Werte wurden experimentell bei 518 C bestimmt 2 : Druck (Pa) Zeit (s) Druck (Pa) Zeit (s) Abbildung 2: Pyrolysedruck in Funktion der Zeit Die Pyrolyse von Acetaldehyd wurde in einem Bereich von 700K bis 1000K untersucht. Folgende Geschwindigkeitskonstanten kp konnten ermittelt werden: Tabelle 1: Abhängigkeit der Reaktionsgeschwindigkeit der Pyrolyse von der Temperatur (Messungen) T [K] kp [mol/ls] Man bestimme die Aktivierungsenergie dieser Reaktion. 2.2 Reaktionsgleichungen/Berechnungen CH 3 CHO CO + CH 4 ; Das Kohlenmonoxid, CO, kann dann mit Sauerstoff zu CO 2 verbrannt werden. 2 Stevens B., Chemical Kinetics, Chapman & Hall Ltd., London, 1961, 12
3 Peter Bützer Folgerungen Aus einem Molekül Ethanal bilden sich 2 Moleküle. Das Gasvolumen nimmt daher zu. In dem verwendeten, geschlossenen Gefäss steigt der Druck proportional zur Gasmenge (allg. Gasgleichung: p V=n R T p 1 /n 1 = p 2 /n 2 ). Pyrolysereaktionen laufen in vielfältigster Weise bei Verbrennungen und Bränden ab. Dabei bilden sich viele verschiedene Stoffe, oft auch toxische, wie hier das CO. 3 Lösung Die Messdaten zeigen den Druckverlauf in Funktion der Zeit. Der Druck ist eine intensive Grösse, die Simulation verlangt als Level jedoch eine extensive Grösse. Wenn man das Volumen V des Systems jedoch konstant lässt, dann gilt p 1 /n 1 = p 2 /n 2 welches aussagt, dass der Druck der Gasmenge proportional ist. Für den Druck p 2 ist dann: p 2 =p 1 n 2 /n 1. Der Anfangsdruck ist p 1 = Pa, die Druckzunahme muss mindestens p = = Pa sein. Die Reaktionsgeschwindigkeits-Konstante kp kann durch Anpassung der Simulation an die Messdaten ermittelt werden. 4 Simulation Annahmen: Die Pyrolyse ist nur abhängig von der Konzentration von Acetaldehyd. Die Reaktionsmechanismen bleibe über den ganzen Temperaturbereich gleich. 4.1 Simulationsdiagramm 3 (Typ 1) 4 kp Acetaldehyd pyrolysieren CO Abbildung 3: Einfaches Simulationsdiagramm der Pyrolyse von Acetaldehyd 3 VENSIM (2006): Ventana Systems, Inc., Simulationssoftware Vensim PLE Bützer Peter, Roth Markus, Die Zeit im Griff, Systemdynamik in Chemie und Biochemie, verlag pestalozzianum, Zürich 2006, 37ff
4 Peter Bützer Zeitdiagramm 100,000 CO 85,000 Pa 70,000 55,000 40,000 CO : Current Time (Second) Abbildung 4: Zeitdiagramm der Pyrolyse von Acetaldehyd 4.3 Dokumentation (Gleichungen, Parameter) (1) Acetaldehyd= INTEG (-Pyrolyse, 42000) Units: Pa [0,?] (2) CO= INTEG ( Pyrolyse, 43000) Units: Pa [0,?] (3) FINAL TIME = 1500 Units: Second The final time for the simulation. (4) INITIAL TIME = 0 Units: Second The initial time for the simulation. (5) kp= (Anpassung, bis die Kurve gut angepasst ist) Units: 1/Second [0,?] (6) Pyrolyse= kp*acetaldehyd (Reaktionsgeschwindigkeit) Units: Pa/Second [0,?] Es werden umso mehr Moleküle pyrolysiert, je grösser deren Konzentration ist. Die Reaktionsgeschwindigkeitskonstante ist im Wesentlichen durch die Reaktivität der Teilchen und die Temperatur bestimmt. (7) SAVEPER = TIME STEP Units: Second [0,?] The frequency with which output is stored. (8) TIME STEP = 10 Units: Second [0,?] The time step for the simulation.
5 Peter Bützer Vergleich von Messung und Simulation Druck (Pa) Druck (Pa) Simulation Zeit (s) Abbildung 5: Vergleich von Messungen und Simulation 5 Interpretation Das Modell dieser Pyrolysereaktion ist einfach und leicht verständlich, obwohl die chemischen Einzelreaktionen höchst komplex sind (vier Folgereaktionen 5 ). Die Reaktion kann als Reaktion 1. Ordnung beschrieben werden, bei welcher die Reaktionsgeschwindigkeit von der Konzentration von Ethanal abhängig ist. Die Reaktionsgeschwindigkeits-Konstante der Reaktion kann mit der Simulation ermittelt werden, sie ist k = /s, damit ist die Halbwertszeit von Ethanal t ½ = 198 Sekunden. Die Aktivierungsenergie kann mit einem erweiterten Arrhenius-Plot bestimmt werden, bei welchem als x-achse 1000/(R x T) aufgetragen wird. Damit ist der negative Wert der Steigung der Geraden die Aktivierungsenergie in kj/mol. 5 Rice-Herzfeld-Mechanismen
6 Peter Bützer y = x R 2 = ln(k) /(R x T) Abbildung 6: Modifizierter Arrhenius-Plot um die Aktivierungsenergie der Reaktion zu bestimmen. Die Ausgleichsgerade liegt, wie die Korrelation zeigt, sehr gut auf den Messwerten. 6 Folgerung Die Aktivierungsenergie beträgt 188 kj/mol. Das ist ein sehr hoher Wert, ist er doch in der Grössenordnung der mittleren Bindungsenthalpie für eine Si-Si-Bindung. Tabelle 2: Reaktionsgeschwindigkeit in Funktion der Temperatur. Messungen und Abschätzungen mit der RGT-Regel T [K] kp [mol/ls] Mit RGT abgeschätzt Die RGT-Regel ist bei diesen hohen Temperaturen mit einem Faktor (Q10) von ca. 1.4 nicht schlecht erfüllt Ausnahme bildet die höchste Temperatur von 1000K. Das bestätigt einmal mehr die Einschränkung der RGT-Regel auf nicht zu grosse Temperaturbereiche. Der Grund für diese Einschränkung ist in der Tatsache zu finden, dass die Aktivierungsenergie selbst temperaturabhängig ist. Bei der Pyrolyse ist zudem zu erwarten, dass die Reaktionsmechanismen nicht über den ganzen Temperaturbereich gleich bleiben.
7 Peter Bützer Simulation der Reaktion mit der RGT-Regel Reaktionstemperatur Q10 Referenztemperatur k k0 10 K Acetaldehyd rgam rgak Methan Kohlenstoffdioxid Abbildung 7: Simulationsdiagramm der Pyrolyse mit der RGT-Regel 6.2 Dokumentation (Gleichungen, Parameter) (01) "10 K"= 10*1 Units: K (02) Acetaldehyd= INTEG (-rgak-rgam, 1) Units: mol (03) FINAL TIME = 120 Units: Second The final time for the simulation. (04) INITIAL TIME = 0 Units: Second The initial time for the simulation. (05) k= k0*((reaktionstemperatur-referenztemperatur)/"10 K")^Q10 Units: 1/Second (06) k0= 0.011*1 Units: 1/Second (07) Kohlenstoffdioxid= INTEG (rgak, 0) Units: mol (08) Methan= INTEG (rgam, 0) Units: mol (09) Q10= 1.4 Units: Dmnl (10) Reaktionstemperatur= 700 Units: K [700,1000] (11) Referenztemperatur= 690*1 Units: K (12) rgak= rgam Units: mol/second (13) rgam= k*acetaldehyd/2 Units: mol/second
8 Peter Bützer 8 (14) SAVEPER = TIME STEP Units: Second [0,?] The frequency with which output is stored. (15) TIME STEP = 0.1 Units: Second [0,?] The time step for the simulation.
Titration einer Säure mit einer Base
 Titration einer Säure mit einer Base Peter Bützer Inhalt 1 Einleitung... 1 2 Modellannahmen (Systemdynamik)... 2 3 Simulationsdiagramm (Typ 1)... 2 4 Dokumentation (Gleichungen, Parameter)... 3 5 Simulation...
Titration einer Säure mit einer Base Peter Bützer Inhalt 1 Einleitung... 1 2 Modellannahmen (Systemdynamik)... 2 3 Simulationsdiagramm (Typ 1)... 2 4 Dokumentation (Gleichungen, Parameter)... 3 5 Simulation...
Kohlendioxidfreisetzung aus Champagner. 1 Einleitung/Theorie. Peter Bützer. Inhalt
 Kohlendioxidfreisetzung aus Champagner Inhalt 1 Einleitung/Theorie... 1 2 Experiment... 2 2.1 Aufgabenstellung... 2 2.2 Durchführung... 2 2.3 Beobachtungen/Messungen... 2 2.4 Reaktionsgleichungen/Berechnungen...
Kohlendioxidfreisetzung aus Champagner Inhalt 1 Einleitung/Theorie... 1 2 Experiment... 2 2.1 Aufgabenstellung... 2 2.2 Durchführung... 2 2.3 Beobachtungen/Messungen... 2 2.4 Reaktionsgleichungen/Berechnungen...
Säureangriff auf die Zähne
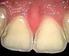 Säureangriff auf die Zähne Eine erfolgreiche Reduktion ist vielleicht die erfolgreichste Form aller wissenschaftlichen Erklärungen, die man sich vorstellen kann. 1 Karl R. Popper, (1902-199) britischer
Säureangriff auf die Zähne Eine erfolgreiche Reduktion ist vielleicht die erfolgreichste Form aller wissenschaftlichen Erklärungen, die man sich vorstellen kann. 1 Karl R. Popper, (1902-199) britischer
Monod-Kinetik. Peter Bützer
 Monod-Kinetik Peter Bützer Inhalt 1 Einleitung... 1 1.1 Modell... 1 1.2 Modellannahmen... 2 1. Gleichung... 2 1.4 Drei Fälle... 2 Simulation, Systemdynamik... 2.1 Simulationsdiagramm (Typ 1)... 2.2 Dokumentation
Monod-Kinetik Peter Bützer Inhalt 1 Einleitung... 1 1.1 Modell... 1 1.2 Modellannahmen... 2 1. Gleichung... 2 1.4 Drei Fälle... 2 Simulation, Systemdynamik... 2.1 Simulationsdiagramm (Typ 1)... 2.2 Dokumentation
Phototrope Gläser. Dr. Peter Bützer. Inhalt
 1 Phototrope Gläser Inhalt 1 Einleitung/Theorie... 2 2 Experiment... 2 2.1 Aufgabenstellung... 2 2.2 Durchführung... 2 2.3 Beobachtungen/Messungen... 3 2.4 Reaktionsgleichungen/Berechnungen... 3 3 Simulation,
1 Phototrope Gläser Inhalt 1 Einleitung/Theorie... 2 2 Experiment... 2 2.1 Aufgabenstellung... 2 2.2 Durchführung... 2 2.3 Beobachtungen/Messungen... 3 2.4 Reaktionsgleichungen/Berechnungen... 3 3 Simulation,
Ethanolbildung in Bananen
 Ethanolbildung in Bananen Peter Bützer Inhalt 1 Einführung... 1 2 Modell... 2 2.1 Annahmen:... 2 2.2 Simulation(Typ 1)... 2 2.3 Dokumentation (Gleichungen, Parameter)... 3 2.4 Vergleich der Simulation
Ethanolbildung in Bananen Peter Bützer Inhalt 1 Einführung... 1 2 Modell... 2 2.1 Annahmen:... 2 2.2 Simulation(Typ 1)... 2 2.3 Dokumentation (Gleichungen, Parameter)... 3 2.4 Vergleich der Simulation
Michaelis-Menten-Kinetik
 Michaelis-Menten-Kinetik Peter Bützer Inhalt 1 Einführung... 1 2 Modell... 2 2.1 Modellannahmen... 2 2.2 Drei Fälle... 2. Simulationsdiagramm (Typ ), Systemdynamik... 2.4 Dokumentation (Gleichungen, Parameter)...
Michaelis-Menten-Kinetik Peter Bützer Inhalt 1 Einführung... 1 2 Modell... 2 2.1 Modellannahmen... 2 2.2 Drei Fälle... 2. Simulationsdiagramm (Typ ), Systemdynamik... 2.4 Dokumentation (Gleichungen, Parameter)...
6. Tag: Chemisches Gleichgewicht und Reaktionskinetik
 6. Tag: Chemisches Gleichgewicht und Reaktionskinetik 1 6. Tag: Chemisches Gleichgewicht und Reaktionskinetik 1. Das chemische Gleichgewicht Eine chemische Reaktion läuft in beiden Richtungen ab. Wenn
6. Tag: Chemisches Gleichgewicht und Reaktionskinetik 1 6. Tag: Chemisches Gleichgewicht und Reaktionskinetik 1. Das chemische Gleichgewicht Eine chemische Reaktion läuft in beiden Richtungen ab. Wenn
EINE KERZE INTERPRETATIONEN BEOBACHTUNGEN FLAMME REAKTIONEN WACHS DOCHT GASE. Reaktionsgleichungen Prozesse. Theorien
 Reaktionsgleichungen Prozesse INTERPRETATIONEN BEOBACHTUNGEN Theorien Licht Produkte Reaktionsgleichungen Thermodynamik Geschwindigkeit REAKTIONEN EINE KERZE FLAMME Farbe Form Bewegung Einflüsse WACHS
Reaktionsgleichungen Prozesse INTERPRETATIONEN BEOBACHTUNGEN Theorien Licht Produkte Reaktionsgleichungen Thermodynamik Geschwindigkeit REAKTIONEN EINE KERZE FLAMME Farbe Form Bewegung Einflüsse WACHS
Chemie Zusammenfassung KA 2
 Chemie Zusammenfassung KA 2 Wärmemenge Q bei einer Reaktion Chemische Reaktionen haben eine Gemeinsamkeit: Bei der Reaktion wird entweder Energie/Wärme frei (exotherm). Oder es wird Wärme/Energie aufgenommen
Chemie Zusammenfassung KA 2 Wärmemenge Q bei einer Reaktion Chemische Reaktionen haben eine Gemeinsamkeit: Bei der Reaktion wird entweder Energie/Wärme frei (exotherm). Oder es wird Wärme/Energie aufgenommen
Professionelle Seminare im Bereich MS-Office
 Der Name BEREICH.VERSCHIEBEN() ist etwas unglücklich gewählt. Man kann mit der Funktion Bereiche zwar verschieben, man kann Bereiche aber auch verkleinern oder vergrößern. Besser wäre es, die Funktion
Der Name BEREICH.VERSCHIEBEN() ist etwas unglücklich gewählt. Man kann mit der Funktion Bereiche zwar verschieben, man kann Bereiche aber auch verkleinern oder vergrößern. Besser wäre es, die Funktion
Gipshärtung Energiefreisetzung, Systemdynamik
 Gipshärtung Energiefreisetzung, Systemdynamik Inhalt 1 Reaktion... 1 2 Experiment... 2 3 Simulation... 3 3.1 Simulationsdiagramm... 3 3.2 Dokumentation (Gleichungen, Parameter)... 3 3.3 Zeitdiagramm...
Gipshärtung Energiefreisetzung, Systemdynamik Inhalt 1 Reaktion... 1 2 Experiment... 2 3 Simulation... 3 3.1 Simulationsdiagramm... 3 3.2 Dokumentation (Gleichungen, Parameter)... 3 3.3 Zeitdiagramm...
Probleme sind Gelegenheiten zu zeigen, was man kann. Duke Ellington, amerikanischer Jazz-Musiker (1899-1974)
 1 H 2 -Atemtest (Lactose-Toleranztest) Inhalt Probleme sind Gelegenheiten zu zeigen, was man kann. Duke Ellington, amerikanischer Jazz-Musiker (1899-1974) 1 Lactose-Intoleranz: Einführung... 1 2 Wasserstoff...
1 H 2 -Atemtest (Lactose-Toleranztest) Inhalt Probleme sind Gelegenheiten zu zeigen, was man kann. Duke Ellington, amerikanischer Jazz-Musiker (1899-1974) 1 Lactose-Intoleranz: Einführung... 1 2 Wasserstoff...
Hefewachstum. Peter Bützer
 Hefewachstum Peter Bützer Inhalt 1 Hefe... 1 2 Das System als Black Box... 2 3 Messung des... 2 4 Modell... 3 5 Simulation (Typ 9)... 3 5.1 Simulationsdiagramm... 4 5.2 Messung... 4 5.3 Dokumentation (Gleichungen,
Hefewachstum Peter Bützer Inhalt 1 Hefe... 1 2 Das System als Black Box... 2 3 Messung des... 2 4 Modell... 3 5 Simulation (Typ 9)... 3 5.1 Simulationsdiagramm... 4 5.2 Messung... 4 5.3 Dokumentation (Gleichungen,
c C 2 K = c A 2 c B 2mol /l 2 0,5mol /l 2 4 mol /l K =4l /mol
 Berechnungen zum Massenwirkungsgesetz 1/13 Jakob 2010 Fall 1a: Gegeben: Gleichgewichtskonzentrationen aller Stoffe; Gesucht: Gleichgewichtskonstante Die Reaktion 2A + B 2C befindet sich im Gleichgewicht.
Berechnungen zum Massenwirkungsgesetz 1/13 Jakob 2010 Fall 1a: Gegeben: Gleichgewichtskonzentrationen aller Stoffe; Gesucht: Gleichgewichtskonstante Die Reaktion 2A + B 2C befindet sich im Gleichgewicht.
Abb. 1: Exotherme und endotherme Reaktionen Quelle: http://www.seilnacht.com/lexikon/aktivi.htm#diagramm
 Energie bei chemischen Reaktionen Chemische Reaktionen sind Stoffumwandlungen bei denen Teilchen umgeordnet und chemische Bindungen gespalten und neu geknüpft werden, wodurch neue Stoffe mit neuen Eigenschaften
Energie bei chemischen Reaktionen Chemische Reaktionen sind Stoffumwandlungen bei denen Teilchen umgeordnet und chemische Bindungen gespalten und neu geknüpft werden, wodurch neue Stoffe mit neuen Eigenschaften
Musterprüfung Chemie Klassen: MPL 09 Datum: 14. 16. April 2010
 1 Musterprüfung Chemie Klassen: MPL 09 Datum: 14. 16. April 2010 Themen: Metallische Bindungen (Skript S. 51 53, inkl. Arbeitsblatt) Reaktionsverlauf (Skript S. 54 59, inkl. Arbeitsblatt, Merke, Fig. 7.2.1
1 Musterprüfung Chemie Klassen: MPL 09 Datum: 14. 16. April 2010 Themen: Metallische Bindungen (Skript S. 51 53, inkl. Arbeitsblatt) Reaktionsverlauf (Skript S. 54 59, inkl. Arbeitsblatt, Merke, Fig. 7.2.1
SWOT Analyse zur Unterstützung des Projektmonitorings
 SWOT Analyse zur Unterstützung des Projektmonitorings Alle QaS-Dokumente können auf der QaS-Webseite heruntergeladen werden, http://qas.programkontoret.se Seite 1 Was ist SWOT? SWOT steht für Stärken (Strengths),
SWOT Analyse zur Unterstützung des Projektmonitorings Alle QaS-Dokumente können auf der QaS-Webseite heruntergeladen werden, http://qas.programkontoret.se Seite 1 Was ist SWOT? SWOT steht für Stärken (Strengths),
Organische Chemie I Chemie am 16.11.2012. Inhaltsverzeichnis Lewisformeln von Kohlenstoffverbindungen korrekt zeichnen!... 2
 Organische Chemie I Inhaltsverzeichnis Lewisformeln von Kohlenstoffverbindungen korrekt zeichnen!... 2 Verstehen was Organische Chemie heisst und die Entstehung von Kohlenstoffverbindungen kennen!... 2
Organische Chemie I Inhaltsverzeichnis Lewisformeln von Kohlenstoffverbindungen korrekt zeichnen!... 2 Verstehen was Organische Chemie heisst und die Entstehung von Kohlenstoffverbindungen kennen!... 2
Kapitel 13: Laugen und Neutralisation
 Kapitel 13: Laugen und Neutralisation Alkalimetalle sind Natrium, Kalium, Lithium (und Rubidium, Caesium und Francium). - Welche besonderen Eigenschaften haben die Elemente Natrium, Kalium und Lithium?
Kapitel 13: Laugen und Neutralisation Alkalimetalle sind Natrium, Kalium, Lithium (und Rubidium, Caesium und Francium). - Welche besonderen Eigenschaften haben die Elemente Natrium, Kalium und Lithium?
Übungen zur VL Chemie für Biologen und Humanbiologen 05.12.2011 Lösung Übung 6
 Übungen zur VL Chemie für Biologen und Humanbiologen 05.12.2011 Lösung Übung 6 Thermodynamik und Gleichgewichte 1. a) Was sagt die Enthalpie aus? Die Enthalpie H beschreibt den Energiegehalt von Materie
Übungen zur VL Chemie für Biologen und Humanbiologen 05.12.2011 Lösung Übung 6 Thermodynamik und Gleichgewichte 1. a) Was sagt die Enthalpie aus? Die Enthalpie H beschreibt den Energiegehalt von Materie
Katalysatoren - Chemische Partnervermittlung im virtuellen Labor
 Seite 1 von 6 Katalysatoren - Chemische Partnervermittlung im virtuellen Labor Katalysatoren Der Katalysator in der Großindustrie Was passiert im Inneren? Das virtuelle Labor. Katalysatoren Katalysatoren
Seite 1 von 6 Katalysatoren - Chemische Partnervermittlung im virtuellen Labor Katalysatoren Der Katalysator in der Großindustrie Was passiert im Inneren? Das virtuelle Labor. Katalysatoren Katalysatoren
Daisyworld. Peter Bützer. 1 Eine kurze Theorie. Inhalt
 Daisyworld Peter Bützer Inhalt 1 Eine kurze Theorie... 1 2 Aufgabe... 2 3 Simulation, Lösung (Typ 3), Systemdynamik... 3 3.1 Annahmen... 3 3.2 Simulationsdiagramm... 3 3.3 Zeitdiagramm... 4 3.4 Dokumentation
Daisyworld Peter Bützer Inhalt 1 Eine kurze Theorie... 1 2 Aufgabe... 2 3 Simulation, Lösung (Typ 3), Systemdynamik... 3 3.1 Annahmen... 3 3.2 Simulationsdiagramm... 3 3.3 Zeitdiagramm... 4 3.4 Dokumentation
Einführung. KLASSE: 9TE NAME: Vorname: Datum: LTAM Naturwissenschaften 9e Chemische Gleichungen 1 -
 Einführung Ein Gärtner bestellt beim Großhändler Blumen. Dort werden Tulpen in Dreier-Sträußen und Vergissmeinnichtchen in Zweier-Sträußen angeboten. Für Valentinstag, möchte der Gärtner ein Sonderangebot
Einführung Ein Gärtner bestellt beim Großhändler Blumen. Dort werden Tulpen in Dreier-Sträußen und Vergissmeinnichtchen in Zweier-Sträußen angeboten. Für Valentinstag, möchte der Gärtner ein Sonderangebot
Modellbildungssysteme: Pädagogische und didaktische Ziele
 Modellbildungssysteme: Pädagogische und didaktische Ziele Was hat Modellbildung mit der Schule zu tun? Der Bildungsplan 1994 formuliert: "Die schnelle Zunahme des Wissens, die hohe Differenzierung und
Modellbildungssysteme: Pädagogische und didaktische Ziele Was hat Modellbildung mit der Schule zu tun? Der Bildungsplan 1994 formuliert: "Die schnelle Zunahme des Wissens, die hohe Differenzierung und
Download. Mathematik üben Klasse 8 Funktionen. Differenzierte Materialien für das ganze Schuljahr. Jens Conrad, Hardy Seifert
 Download Jens Conrad, Hard Seifert Mathematik üben Klasse 8 Funktionen Differenzierte Materialien für das ganze Schuljahr Downloadauszug aus dem Originaltitel: Mathematik üben Klasse 8 Funktionen Differenzierte
Download Jens Conrad, Hard Seifert Mathematik üben Klasse 8 Funktionen Differenzierte Materialien für das ganze Schuljahr Downloadauszug aus dem Originaltitel: Mathematik üben Klasse 8 Funktionen Differenzierte
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren
 Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
Würfelt man dabei je genau 10 - mal eine 1, 2, 3, 4, 5 und 6, so beträgt die Anzahl. der verschiedenen Reihenfolgen, in denen man dies tun kann, 60!.
 040304 Übung 9a Analysis, Abschnitt 4, Folie 8 Die Wahrscheinlichkeit, dass bei n - maliger Durchführung eines Zufallexperiments ein Ereignis A ( mit Wahrscheinlichkeit p p ( A ) ) für eine beliebige Anzahl
040304 Übung 9a Analysis, Abschnitt 4, Folie 8 Die Wahrscheinlichkeit, dass bei n - maliger Durchführung eines Zufallexperiments ein Ereignis A ( mit Wahrscheinlichkeit p p ( A ) ) für eine beliebige Anzahl
Ideale und Reale Gase. Was ist ein ideales Gas? einatomige Moleküle mit keinerlei gegenseitiger WW keinem Eigenvolumen (punktförmig)
 Ideale und Reale Gase Was ist ein ideales Gas? einatomige Moleküle mit keinerlei gegenseitiger WW keinem Eigenvolumen (punktförmig) Wann sind reale Gase ideal? Reale Gase verhalten sich wie ideale Gase
Ideale und Reale Gase Was ist ein ideales Gas? einatomige Moleküle mit keinerlei gegenseitiger WW keinem Eigenvolumen (punktförmig) Wann sind reale Gase ideal? Reale Gase verhalten sich wie ideale Gase
Lichtbrechung an Linsen
 Sammellinsen Lichtbrechung an Linsen Fällt ein paralleles Lichtbündel auf eine Sammellinse, so werden die Lichtstrahlen so gebrochen, dass sie durch einen Brennpunkt der Linse verlaufen. Der Abstand zwischen
Sammellinsen Lichtbrechung an Linsen Fällt ein paralleles Lichtbündel auf eine Sammellinse, so werden die Lichtstrahlen so gebrochen, dass sie durch einen Brennpunkt der Linse verlaufen. Der Abstand zwischen
Thermodynamik. Basics. Dietmar Pflumm: KSR/MSE. April 2008
 Thermodynamik Basics Dietmar Pflumm: KSR/MSE Thermodynamik Definition Die Thermodynamik... ist eine allgemeine Energielehre als Teilgebiet der Chemie befasst sie sich mit den Gesetzmässigkeiten der Umwandlungsvorgänge
Thermodynamik Basics Dietmar Pflumm: KSR/MSE Thermodynamik Definition Die Thermodynamik... ist eine allgemeine Energielehre als Teilgebiet der Chemie befasst sie sich mit den Gesetzmässigkeiten der Umwandlungsvorgänge
Protokoll des Versuches 7: Umwandlung von elektrischer Energie in Wärmeenergie
 Name: Matrikelnummer: Bachelor Biowissenschaften E-Mail: Physikalisches Anfängerpraktikum II Dozenten: Assistenten: Protokoll des Versuches 7: Umwandlung von elektrischer Energie in ärmeenergie Verantwortlicher
Name: Matrikelnummer: Bachelor Biowissenschaften E-Mail: Physikalisches Anfängerpraktikum II Dozenten: Assistenten: Protokoll des Versuches 7: Umwandlung von elektrischer Energie in ärmeenergie Verantwortlicher
B 2. " Zeigen Sie, dass die Wahrscheinlichkeit, dass eine Leiterplatte akzeptiert wird, 0,93 beträgt. (genauerer Wert: 0,933).!:!!
 Das folgende System besteht aus 4 Schraubenfedern. Die Federn A ; B funktionieren unabhängig von einander. Die Ausfallzeit T (in Monaten) der Federn sei eine weibullverteilte Zufallsvariable mit den folgenden
Das folgende System besteht aus 4 Schraubenfedern. Die Federn A ; B funktionieren unabhängig von einander. Die Ausfallzeit T (in Monaten) der Federn sei eine weibullverteilte Zufallsvariable mit den folgenden
Mean Time Between Failures (MTBF)
 Mean Time Between Failures (MTBF) Hintergrundinformation zur MTBF Was steht hier? Die Mean Time Between Failure (MTBF) ist ein statistischer Mittelwert für den störungsfreien Betrieb eines elektronischen
Mean Time Between Failures (MTBF) Hintergrundinformation zur MTBF Was steht hier? Die Mean Time Between Failure (MTBF) ist ein statistischer Mittelwert für den störungsfreien Betrieb eines elektronischen
Statuten in leichter Sprache
 Statuten in leichter Sprache Zweck vom Verein Artikel 1: Zivil-Gesetz-Buch Es gibt einen Verein der selbstbestimmung.ch heisst. Der Verein ist so aufgebaut, wie es im Zivil-Gesetz-Buch steht. Im Zivil-Gesetz-Buch
Statuten in leichter Sprache Zweck vom Verein Artikel 1: Zivil-Gesetz-Buch Es gibt einen Verein der selbstbestimmung.ch heisst. Der Verein ist so aufgebaut, wie es im Zivil-Gesetz-Buch steht. Im Zivil-Gesetz-Buch
Wichtiges Thema: Ihre private Rente und der viel zu wenig beachtete - Rentenfaktor
 Wichtiges Thema: Ihre private Rente und der viel zu wenig beachtete - Rentenfaktor Ihre private Gesamtrente setzt sich zusammen aus der garantierten Rente und der Rente, die sich aus den über die Garantieverzinsung
Wichtiges Thema: Ihre private Rente und der viel zu wenig beachtete - Rentenfaktor Ihre private Gesamtrente setzt sich zusammen aus der garantierten Rente und der Rente, die sich aus den über die Garantieverzinsung
Aufgaben Wechselstromwiderstände
 Aufgaben Wechselstromwiderstände 69. Eine aus Übersee mitgebrachte Glühlampe (0 V/ 50 ma) soll mithilfe einer geeignet zu wählenden Spule mit vernachlässigbarem ohmschen Widerstand an der Netzsteckdose
Aufgaben Wechselstromwiderstände 69. Eine aus Übersee mitgebrachte Glühlampe (0 V/ 50 ma) soll mithilfe einer geeignet zu wählenden Spule mit vernachlässigbarem ohmschen Widerstand an der Netzsteckdose
Elektrischer Widerstand
 In diesem Versuch sollen Sie die Grundbegriffe und Grundlagen der Elektrizitätslehre wiederholen und anwenden. Sie werden unterschiedlichen Verfahren zur Messung ohmscher Widerstände kennen lernen, ihren
In diesem Versuch sollen Sie die Grundbegriffe und Grundlagen der Elektrizitätslehre wiederholen und anwenden. Sie werden unterschiedlichen Verfahren zur Messung ohmscher Widerstände kennen lernen, ihren
Administratives BSL PB
 Administratives Die folgenden Seiten sind ausschliesslich als Ergänzung zum Unterricht für die Schüler der BSL gedacht (intern) und dürfen weder teilweise noch vollständig kopiert oder verbreitet werden.
Administratives Die folgenden Seiten sind ausschliesslich als Ergänzung zum Unterricht für die Schüler der BSL gedacht (intern) und dürfen weder teilweise noch vollständig kopiert oder verbreitet werden.
Che1 P / CheU P Praktikum Allgemeine und Anorganische Chemie. Gasmessung. 15. September 2008
 15. September 2008 1 1 Aufgabe und Lernziele... 3 2 Vorbereitung... 3 3 Einführung... 4 3.1 Grundlagen... 4 3.1.1Kohlenstoffdioxid... 4 3.2.2 Luftuntersuchungen mit Prüfröhrchen... 4 4 Praxis... 5 4.1
15. September 2008 1 1 Aufgabe und Lernziele... 3 2 Vorbereitung... 3 3 Einführung... 4 3.1 Grundlagen... 4 3.1.1Kohlenstoffdioxid... 4 3.2.2 Luftuntersuchungen mit Prüfröhrchen... 4 4 Praxis... 5 4.1
GEVITAS Farben-Reaktionstest
 GEVITAS Farben-Reaktionstest GEVITAS Farben-Reaktionstest Inhalt 1. Allgemeines... 1 2. Funktionsweise der Tests... 2 3. Die Ruhetaste und die Auslösetaste... 2 4. Starten der App Hauptmenü... 3 5. Auswahl
GEVITAS Farben-Reaktionstest GEVITAS Farben-Reaktionstest Inhalt 1. Allgemeines... 1 2. Funktionsweise der Tests... 2 3. Die Ruhetaste und die Auslösetaste... 2 4. Starten der App Hauptmenü... 3 5. Auswahl
Erfahrungen mit Hartz IV- Empfängern
 Erfahrungen mit Hartz IV- Empfängern Ausgewählte Ergebnisse einer Befragung von Unternehmen aus den Branchen Gastronomie, Pflege und Handwerk Pressegespräch der Bundesagentur für Arbeit am 12. November
Erfahrungen mit Hartz IV- Empfängern Ausgewählte Ergebnisse einer Befragung von Unternehmen aus den Branchen Gastronomie, Pflege und Handwerk Pressegespräch der Bundesagentur für Arbeit am 12. November
Es soll eine schriftliche Ausarbeitung abgegeben werden (1 Exemplar pro Gruppe).
 Gruppe 1 Thema: Wissenswertes über Essig 1. Bestimme den ph-wert von Haushaltsessig. 2. Wie viel Essigsäure (in mol/l und in g/l) ist in Haushaltsessig enthalten? 3. Wie wird Essigsäure hergestellt (Ausgangsstoffe,
Gruppe 1 Thema: Wissenswertes über Essig 1. Bestimme den ph-wert von Haushaltsessig. 2. Wie viel Essigsäure (in mol/l und in g/l) ist in Haushaltsessig enthalten? 3. Wie wird Essigsäure hergestellt (Ausgangsstoffe,
IT-SICHERHEIT IM UNTERNEHMEN Mehr Sicherheit für Ihre Entscheidung
 IT-SICHERHEIT IM UNTERNEHMEN Mehr Sicherheit für Ihre Entscheidung IT-SICHERHEIT IM UNTERNEHMEN Mehr Sicherheit für ihre Entscheidung Entdecken Sie was IT Sicherheit im Unternehmen bedeutet IT Sicherheit
IT-SICHERHEIT IM UNTERNEHMEN Mehr Sicherheit für Ihre Entscheidung IT-SICHERHEIT IM UNTERNEHMEN Mehr Sicherheit für ihre Entscheidung Entdecken Sie was IT Sicherheit im Unternehmen bedeutet IT Sicherheit
Gefährlich hohe Blutzuckerwerte
 Gefährlich hohe Blutzuckerwerte In besonderen Situationen kann der Blutzuckerspiegel gefährlich ansteigen Wenn in Ausnahmefällen der Blutzuckerspiegel sehr hoch ansteigt, dann kann das für Sie gefährlich
Gefährlich hohe Blutzuckerwerte In besonderen Situationen kann der Blutzuckerspiegel gefährlich ansteigen Wenn in Ausnahmefällen der Blutzuckerspiegel sehr hoch ansteigt, dann kann das für Sie gefährlich
Kapitel 4: Chemische. Woher stammen die chemischen Symbole?
 Kapitel 4: Chemische Symbole Woher stammen die chemischen Symbole? Das sind die Anfangsbuchstaben (manchmal auch die ersten beiden Anfangsbuchstaben) der lateinischen oder griechischen Namen der Elemente.
Kapitel 4: Chemische Symbole Woher stammen die chemischen Symbole? Das sind die Anfangsbuchstaben (manchmal auch die ersten beiden Anfangsbuchstaben) der lateinischen oder griechischen Namen der Elemente.
Webseiten mit fragwürdigen Aufrufen von "spy & track" - Unternehmen
 Webseiten mit fragwürdigen Aufrufen von "spy & track" - Unternehmen Die vorliegende Dokumentation umfasst eine kleine Auswahl von Webseiten, bei denen automatisch (ohne Benutzer vorab zu informieren oder
Webseiten mit fragwürdigen Aufrufen von "spy & track" - Unternehmen Die vorliegende Dokumentation umfasst eine kleine Auswahl von Webseiten, bei denen automatisch (ohne Benutzer vorab zu informieren oder
1. Die Maße für ihren Vorbaurollladen müssen von außen genommen werden.
 Vorbaurollladen Massanleitung Sehr geehrte Kunden, diese Maßanleitung dient zur korrekten Ermittlung der für den RDEMCHER Vorbaurollladen Konfigurator notwendigen Maße. Um diese nleitung optimal nutzen
Vorbaurollladen Massanleitung Sehr geehrte Kunden, diese Maßanleitung dient zur korrekten Ermittlung der für den RDEMCHER Vorbaurollladen Konfigurator notwendigen Maße. Um diese nleitung optimal nutzen
Titrationskurve einer starken Säure (HCl) mit einer starken Base (NaOH)
 Titrationskurve einer starken Säure (HCl) mit einer starken Base (NaOH) Material 250 mlbecherglas 100 ml Messzylinder 50 mlbürette, Magnetrührer, Magnetfisch, Stativmaterial phmeter Chemikalien Natronlauge
Titrationskurve einer starken Säure (HCl) mit einer starken Base (NaOH) Material 250 mlbecherglas 100 ml Messzylinder 50 mlbürette, Magnetrührer, Magnetfisch, Stativmaterial phmeter Chemikalien Natronlauge
Bernadette Büsgen HR-Consulting www.buesgen-consult.de
 Reiss Profile Es ist besser mit dem Wind zu segeln, als gegen ihn! Möchten Sie anhand Ihres Reiss Rofiles erkennen, woher Ihr Wind weht? Sie haben verschiedene Möglichkeiten, Ihr Leben aktiv zu gestalten.
Reiss Profile Es ist besser mit dem Wind zu segeln, als gegen ihn! Möchten Sie anhand Ihres Reiss Rofiles erkennen, woher Ihr Wind weht? Sie haben verschiedene Möglichkeiten, Ihr Leben aktiv zu gestalten.
Versuch 3. Frequenzgang eines Verstärkers
 Versuch 3 Frequenzgang eines Verstärkers 1. Grundlagen Ein Verstärker ist eine aktive Schaltung, mit der die Amplitude eines Signals vergößert werden kann. Man spricht hier von Verstärkung v und definiert
Versuch 3 Frequenzgang eines Verstärkers 1. Grundlagen Ein Verstärker ist eine aktive Schaltung, mit der die Amplitude eines Signals vergößert werden kann. Man spricht hier von Verstärkung v und definiert
Mathematischer Vorbereitungskurs für Ökonomen
 Mathematischer Vorbereitungskurs für Ökonomen Dr. Thomas Zehrt Wirtschaftswissenschaftliches Zentrum Universität Basel Gleichungen Inhalt: 1. Grundlegendes 2. Lineare Gleichungen 3. Gleichungen mit Brüchen
Mathematischer Vorbereitungskurs für Ökonomen Dr. Thomas Zehrt Wirtschaftswissenschaftliches Zentrum Universität Basel Gleichungen Inhalt: 1. Grundlegendes 2. Lineare Gleichungen 3. Gleichungen mit Brüchen
Auktionen erstellen und verwalten mit dem GV Büro System und der Justiz Auktion
 Auktionen erstellen und verwalten mit dem GV Büro System und der Justiz Auktion Workshop Software GmbH Siemensstr. 21 47533 Kleve 02821 / 731 20 02821 / 731 299 www.workshop-software.de Verfasser: SK info@workshop-software.de
Auktionen erstellen und verwalten mit dem GV Büro System und der Justiz Auktion Workshop Software GmbH Siemensstr. 21 47533 Kleve 02821 / 731 20 02821 / 731 299 www.workshop-software.de Verfasser: SK info@workshop-software.de
Erweiterung der Aufgabe. Die Notenberechnung soll nicht nur für einen Schüler, sondern für bis zu 35 Schüler gehen:
 VBA Programmierung mit Excel Schleifen 1/6 Erweiterung der Aufgabe Die Notenberechnung soll nicht nur für einen Schüler, sondern für bis zu 35 Schüler gehen: Es müssen also 11 (B L) x 35 = 385 Zellen berücksichtigt
VBA Programmierung mit Excel Schleifen 1/6 Erweiterung der Aufgabe Die Notenberechnung soll nicht nur für einen Schüler, sondern für bis zu 35 Schüler gehen: Es müssen also 11 (B L) x 35 = 385 Zellen berücksichtigt
MARCANT - File Delivery System
 MARCANT - File Delivery System Dokumentation für Administratoren Der Administrationsbereich des File Delivery Systems ist ebenfall leicht zu bedienen. Die wichtigsten drei Abschnitte sind: 1. Profil, 2.
MARCANT - File Delivery System Dokumentation für Administratoren Der Administrationsbereich des File Delivery Systems ist ebenfall leicht zu bedienen. Die wichtigsten drei Abschnitte sind: 1. Profil, 2.
1. Einführung. 2. Alternativen zu eigenen Auswertungen. 3. Erstellen eigener Tabellen-Auswertungen
 1. Einführung Über die Tabellen-Auswertungen können Sie eigene Auswertungen nach Ihren Wünschen erstellen. Diese Auswertungen werden immer anhand der aktuellen Daten aus orgamax ermittelt, Sie können also
1. Einführung Über die Tabellen-Auswertungen können Sie eigene Auswertungen nach Ihren Wünschen erstellen. Diese Auswertungen werden immer anhand der aktuellen Daten aus orgamax ermittelt, Sie können also
Lernaufgabe Industriekauffrau/Industriekaufmann Angebot und Auftrag: Arbeitsblatt I Auftragsbeschreibung
 Angebot und Auftrag: Arbeitsblatt I Auftragsbeschreibung Ein Kunde hat Interesse an einem von Ihrem Unternehmen hergestellten Produkt gezeigt. Es handelt sich dabei um einen batteriebetriebenen tragbaren
Angebot und Auftrag: Arbeitsblatt I Auftragsbeschreibung Ein Kunde hat Interesse an einem von Ihrem Unternehmen hergestellten Produkt gezeigt. Es handelt sich dabei um einen batteriebetriebenen tragbaren
Whitepaper. Produkt: combit Relationship Manager 7. combit Relationship Manager email-rückläufer Script. combit GmbH Untere Laube 30 78462 Konstanz
 combit GmbH Untere Laube 30 78462 Konstanz Whitepaper Produkt: combit Relationship Manager 7 combit Relationship Manager email-rückläufer Script Inhalt Einleitung 3 Notwendige Anpassungen 3 crm Solution
combit GmbH Untere Laube 30 78462 Konstanz Whitepaper Produkt: combit Relationship Manager 7 combit Relationship Manager email-rückläufer Script Inhalt Einleitung 3 Notwendige Anpassungen 3 crm Solution
Zugversuch. Laborskript für WP-14 WS 13/14 Zugversuch. 1) Theoretische Grundlagen: Seite 1
 Laborskript für WP-14 WS 13/14 Zugversuch Zugversuch 1) Theoretische Grundlagen: Mit dem Zugversuch werden im Normalfall mechanische Kenngrößen der Werkstoffe unter einachsiger Beanspruchung bestimmt.
Laborskript für WP-14 WS 13/14 Zugversuch Zugversuch 1) Theoretische Grundlagen: Mit dem Zugversuch werden im Normalfall mechanische Kenngrößen der Werkstoffe unter einachsiger Beanspruchung bestimmt.
Übungen zur VL Chemie für Biologen und Humanbiologen 04.11.2011 Lösung Übung 2
 Übungen zur VL Chemie für Biologen und Humanbiologen 04.11.2011 Lösung Übung 2 1. Wie viel mol Eisen sind in 12 x 10 23 Molekülen enthalten? ca. 2 Mol 2. Welches Volumen Litern ergibt sich wenn ich 3 mol
Übungen zur VL Chemie für Biologen und Humanbiologen 04.11.2011 Lösung Übung 2 1. Wie viel mol Eisen sind in 12 x 10 23 Molekülen enthalten? ca. 2 Mol 2. Welches Volumen Litern ergibt sich wenn ich 3 mol
Fachbereich Physik Dr. Wolfgang Bodenberger
 UniversitätÉOsnabrück Fachbereich Physik Dr. Wolfgang Bodenberger Der Transistor als Schalter. In vielen Anwendungen der Impuls- und Digital- lektronik wird ein Transistor als einfacher in- und Aus-Schalter
UniversitätÉOsnabrück Fachbereich Physik Dr. Wolfgang Bodenberger Der Transistor als Schalter. In vielen Anwendungen der Impuls- und Digital- lektronik wird ein Transistor als einfacher in- und Aus-Schalter
Übungsblatt zu Säuren und Basen
 1 Übungsblatt zu Säuren und Basen 1. In einer wässrigen Lösung misst die Konzentration der Oxoniumionen (H 3 O + ) 10 5 M. a) Wie gross ist der ph Wert? b) Ist die Konzentration der OH Ionen grösser oder
1 Übungsblatt zu Säuren und Basen 1. In einer wässrigen Lösung misst die Konzentration der Oxoniumionen (H 3 O + ) 10 5 M. a) Wie gross ist der ph Wert? b) Ist die Konzentration der OH Ionen grösser oder
Informatik Kurs Simulation. Hilfe für den Consideo Modeler
 Hilfe für den Consideo Modeler Consideo stellt Schulen den Modeler kostenlos zur Verfügung. Wenden Sie sich an: http://consideo-modeler.de/ Der Modeler ist ein Werkzeug, das nicht für schulische Zwecke
Hilfe für den Consideo Modeler Consideo stellt Schulen den Modeler kostenlos zur Verfügung. Wenden Sie sich an: http://consideo-modeler.de/ Der Modeler ist ein Werkzeug, das nicht für schulische Zwecke
Serienbrieferstellung in Word mit Kunden-Datenimport aus Excel
 Sehr vielen Mitarbeitern fällt es schwer, Serienbriefe an Kunden zu verschicken, wenn sie die Serienbrieffunktion von Word nicht beherrschen. Wenn die Kunden mit Excel verwaltet werden, genügen nur ein
Sehr vielen Mitarbeitern fällt es schwer, Serienbriefe an Kunden zu verschicken, wenn sie die Serienbrieffunktion von Word nicht beherrschen. Wenn die Kunden mit Excel verwaltet werden, genügen nur ein
Einführungskurs MOODLE Themen:
 Einführungskurs MOODLE Themen: Grundlegende Einstellungen Teilnehmer in einen Kurs einschreiben Konfiguration der Arbeitsunterlagen Konfiguration der Lernaktivitäten Die Einstellungen für einen Kurs erreichst
Einführungskurs MOODLE Themen: Grundlegende Einstellungen Teilnehmer in einen Kurs einschreiben Konfiguration der Arbeitsunterlagen Konfiguration der Lernaktivitäten Die Einstellungen für einen Kurs erreichst
Downloadfehler in DEHSt-VPSMail. Workaround zum Umgang mit einem Downloadfehler
 Downloadfehler in DEHSt-VPSMail Workaround zum Umgang mit einem Downloadfehler Downloadfehler bremen online services GmbH & Co. KG Seite 2 Inhaltsverzeichnis Vorwort...3 1 Fehlermeldung...4 2 Fehlerbeseitigung...5
Downloadfehler in DEHSt-VPSMail Workaround zum Umgang mit einem Downloadfehler Downloadfehler bremen online services GmbH & Co. KG Seite 2 Inhaltsverzeichnis Vorwort...3 1 Fehlermeldung...4 2 Fehlerbeseitigung...5
A Lösungen zu Einführungsaufgaben zu QueueTraffic
 A Lösungen zu Einführungsaufgaben zu QueueTraffic 1. Selber Phasen einstellen a) Wo im Alltag: Baustelle, vor einem Zebrastreifen, Unfall... 2. Ankunftsrate und Verteilungen a) poissonverteilt: b) konstant:
A Lösungen zu Einführungsaufgaben zu QueueTraffic 1. Selber Phasen einstellen a) Wo im Alltag: Baustelle, vor einem Zebrastreifen, Unfall... 2. Ankunftsrate und Verteilungen a) poissonverteilt: b) konstant:
Säure-Base-Titrationen
 Säure-Base-Titrationen Dieses Skript gehört: Säure Base - Titrationen Seite 2 Hinweis: Mit den Säuren und Basen ist vorsichtig umzugehen, um Verätzungen zu vermeiden! Versuch 1: Herstellen einer Natronlauge
Säure-Base-Titrationen Dieses Skript gehört: Säure Base - Titrationen Seite 2 Hinweis: Mit den Säuren und Basen ist vorsichtig umzugehen, um Verätzungen zu vermeiden! Versuch 1: Herstellen einer Natronlauge
Festigkeit von FDM-3D-Druckteilen
 Festigkeit von FDM-3D-Druckteilen Häufig werden bei 3D-Druck-Filamenten die Kunststoff-Festigkeit und physikalischen Eigenschaften diskutiert ohne die Einflüsse der Geometrie und der Verschweißung der
Festigkeit von FDM-3D-Druckteilen Häufig werden bei 3D-Druck-Filamenten die Kunststoff-Festigkeit und physikalischen Eigenschaften diskutiert ohne die Einflüsse der Geometrie und der Verschweißung der
13. Lineare DGL höherer Ordnung. Eine DGL heißt von n-ter Ordnung, wenn Ableitungen y, y, y,... bis zur n-ten Ableitung y (n) darin vorkommen.
 13. Lineare DGL höherer Ordnung. Eine DGL heißt von n-ter Ordnung, wenn Ableitungen y, y, y,... bis zur n-ten Ableitung y (n) darin vorkommen. Sie heißt linear, wenn sie die Form y (n) + a n 1 y (n 1)
13. Lineare DGL höherer Ordnung. Eine DGL heißt von n-ter Ordnung, wenn Ableitungen y, y, y,... bis zur n-ten Ableitung y (n) darin vorkommen. Sie heißt linear, wenn sie die Form y (n) + a n 1 y (n 1)
Standardisierte kompetenzorientierte schriftliche Reifeprüfung AHS. 11. Mai 2015. Mathematik. Teil-2-Aufgaben. Korrekturheft. öffentliches Dokument
 Standardisierte kompetenzorientierte schriftliche Reifeprüfung AHS 11. Mai 2015 Mathematik Teil-2-Aufgaben Korrekturheft Aufgabe 1 200-m-Lauf a) Lösungserwartung: s (t) = 7 75 t + 1,4 s (t) = 7 75 s (t)
Standardisierte kompetenzorientierte schriftliche Reifeprüfung AHS 11. Mai 2015 Mathematik Teil-2-Aufgaben Korrekturheft Aufgabe 1 200-m-Lauf a) Lösungserwartung: s (t) = 7 75 t + 1,4 s (t) = 7 75 s (t)
Arbeitspunkt einer Diode
 Arbeitspunkt einer Diode Liegt eine Diode mit einem Widerstand R in Reihe an einer Spannung U 0, so müssen sich die beiden diese Spannung teilen. Vom Widerstand wissen wir, dass er bei einer Spannung von
Arbeitspunkt einer Diode Liegt eine Diode mit einem Widerstand R in Reihe an einer Spannung U 0, so müssen sich die beiden diese Spannung teilen. Vom Widerstand wissen wir, dass er bei einer Spannung von
Korrelation (II) Korrelation und Kausalität
 Korrelation (II) Korrelation und Kausalität Situation: Seien X, Y zwei metrisch skalierte Merkmale mit Ausprägungen (x 1, x 2,..., x n ) bzw. (y 1, y 2,..., y n ). D.h. für jede i = 1, 2,..., n bezeichnen
Korrelation (II) Korrelation und Kausalität Situation: Seien X, Y zwei metrisch skalierte Merkmale mit Ausprägungen (x 1, x 2,..., x n ) bzw. (y 1, y 2,..., y n ). D.h. für jede i = 1, 2,..., n bezeichnen
Atmung, Dissimilation
 Atmung, Dissimilation Peter Bützer Abbildung 1: Atmung Inhalt 1 Physiologisches... 1 2 Atmung, eine Reaktion 0. Ordnung... 2 3 Simulation... 2 4 Interpretation... 4 5 Mikroökologie im Zimmer... 4 6 Interpretation...
Atmung, Dissimilation Peter Bützer Abbildung 1: Atmung Inhalt 1 Physiologisches... 1 2 Atmung, eine Reaktion 0. Ordnung... 2 3 Simulation... 2 4 Interpretation... 4 5 Mikroökologie im Zimmer... 4 6 Interpretation...
Sehr geehrte Damen und Herren
 Sehr geehrte Damen und Herren Im Infobrief 3 von Netzwerk Elternschaft von Menschen mit geistiger Behinderung, haben wir Sie aufgefordert, Ihre Kenntnisse über Eltern mit einer geistigen Behinderung und
Sehr geehrte Damen und Herren Im Infobrief 3 von Netzwerk Elternschaft von Menschen mit geistiger Behinderung, haben wir Sie aufgefordert, Ihre Kenntnisse über Eltern mit einer geistigen Behinderung und
Behörde für Bildung und Sport Abitur 2008 Lehrermaterialien zum Leistungskurs Mathematik
 Abitur 8 II. Insektenpopulation LA/AG In den Tropen legen die Weibchen einer in Deutschland unbekannten Insektenpopulation jedes Jahr kurz vor Beginn der Regenzeit jeweils 9 Eier und sterben bald darauf.
Abitur 8 II. Insektenpopulation LA/AG In den Tropen legen die Weibchen einer in Deutschland unbekannten Insektenpopulation jedes Jahr kurz vor Beginn der Regenzeit jeweils 9 Eier und sterben bald darauf.
AGROPLUS Buchhaltung. Daten-Server und Sicherheitskopie. Version vom 21.10.2013b
 AGROPLUS Buchhaltung Daten-Server und Sicherheitskopie Version vom 21.10.2013b 3a) Der Daten-Server Modus und der Tresor Der Daten-Server ist eine Betriebsart welche dem Nutzer eine grosse Flexibilität
AGROPLUS Buchhaltung Daten-Server und Sicherheitskopie Version vom 21.10.2013b 3a) Der Daten-Server Modus und der Tresor Der Daten-Server ist eine Betriebsart welche dem Nutzer eine grosse Flexibilität
OECD Programme for International Student Assessment PISA 2000. Lösungen der Beispielaufgaben aus dem Mathematiktest. Deutschland
 OECD Programme for International Student Assessment Deutschland PISA 2000 Lösungen der Beispielaufgaben aus dem Mathematiktest Beispielaufgaben PISA-Hauptstudie 2000 Seite 3 UNIT ÄPFEL Beispielaufgaben
OECD Programme for International Student Assessment Deutschland PISA 2000 Lösungen der Beispielaufgaben aus dem Mathematiktest Beispielaufgaben PISA-Hauptstudie 2000 Seite 3 UNIT ÄPFEL Beispielaufgaben
Wir machen neue Politik für Baden-Württemberg
 Wir machen neue Politik für Baden-Württemberg Am 27. März 2011 haben die Menschen in Baden-Württemberg gewählt. Sie wollten eine andere Politik als vorher. Die Menschen haben die GRÜNEN und die SPD in
Wir machen neue Politik für Baden-Württemberg Am 27. März 2011 haben die Menschen in Baden-Württemberg gewählt. Sie wollten eine andere Politik als vorher. Die Menschen haben die GRÜNEN und die SPD in
Leere Zeilen aus Excel-Dateien entfernen
 Wissenselement Leere Zeilen aus Excel-Dateien entfernen Betrifft: CODE.3, Report/LX (Explorer/LX) Stand: 2012-09-12 1. Hintergrund ibeq Für den Excel-Export setzen wir fertige Libraries des Herstellers
Wissenselement Leere Zeilen aus Excel-Dateien entfernen Betrifft: CODE.3, Report/LX (Explorer/LX) Stand: 2012-09-12 1. Hintergrund ibeq Für den Excel-Export setzen wir fertige Libraries des Herstellers
Abituraufgabe zur Stochastik, Hessen 2009, Grundkurs (TR)
 Abituraufgabe zur Stochastik, Hessen 2009, Grundkurs (TR) Eine Firma stellt USB-Sticks her. Sie werden in der Fabrik ungeprüft in Packungen zu je 20 Stück verpackt und an Händler ausgeliefert. 1 Ein Händler
Abituraufgabe zur Stochastik, Hessen 2009, Grundkurs (TR) Eine Firma stellt USB-Sticks her. Sie werden in der Fabrik ungeprüft in Packungen zu je 20 Stück verpackt und an Händler ausgeliefert. 1 Ein Händler
1.3.2 Resonanzkreise R L C. u C. u R. u L u. R 20 lg 1 , (1.81) die Grenzkreisfrequenz ist 1 RR C . (1.82)
 3 Schaltungen mit frequenzselektiven Eigenschaften 35 a lg (8) a die Grenzkreisfrequenz ist Grenz a a (8) 3 esonanzkreise 3 eihenresonanzkreis i u u u u Bild 4 eihenresonanzkreis Die Schaltung nach Bild
3 Schaltungen mit frequenzselektiven Eigenschaften 35 a lg (8) a die Grenzkreisfrequenz ist Grenz a a (8) 3 esonanzkreise 3 eihenresonanzkreis i u u u u Bild 4 eihenresonanzkreis Die Schaltung nach Bild
Die innere Energie eines geschlossenen Systems ist konstant
 Rückblick auf vorherige Vorlesung Grundsätzlich sind alle möglichen Formen von Arbeit denkbar hier diskutiert: Mechanische Arbeit: Arbeit, die nötig ist um einen Massepunkt von A nach B zu bewegen Konservative
Rückblick auf vorherige Vorlesung Grundsätzlich sind alle möglichen Formen von Arbeit denkbar hier diskutiert: Mechanische Arbeit: Arbeit, die nötig ist um einen Massepunkt von A nach B zu bewegen Konservative
Aber zuerst: Was versteht man unter Stromverbrauch im Standby-Modus (Leerlaufverlust)?
 Ich habe eine Umfrage durchgeführt zum Thema Stromverbrauch im Standby Modus! Ich habe 50 Personen befragt und allen 4 Fragen gestellt. Ich werde diese hier, anhand von Grafiken auswerten! Aber zuerst:
Ich habe eine Umfrage durchgeführt zum Thema Stromverbrauch im Standby Modus! Ich habe 50 Personen befragt und allen 4 Fragen gestellt. Ich werde diese hier, anhand von Grafiken auswerten! Aber zuerst:
Prinzip der Zylinderdruckmessung mittels des piezoelektrischen Effektes
 Prinzip der Zylinderdruckmessung mittels des piezoelektrischen Effektes Messprinzip: Ein Quarz der unter mechanischer Belastung steht, gibt eine elektrische Ladung ab. Die Ladung (Einheit pc Picocoulomb=10-12
Prinzip der Zylinderdruckmessung mittels des piezoelektrischen Effektes Messprinzip: Ein Quarz der unter mechanischer Belastung steht, gibt eine elektrische Ladung ab. Die Ladung (Einheit pc Picocoulomb=10-12
micura Pflegedienste München/Dachau GmbH
 micura Pflegedienste München/Dachau GmbH 2 PFLEGE UND BETREUUNG ZUHAUSE 3 Im Laufe eines Lebens verändern sich die Bedürfnisse. micura Pflegedienste München/ Dachau schließt die Lücke einer eingeschränkten
micura Pflegedienste München/Dachau GmbH 2 PFLEGE UND BETREUUNG ZUHAUSE 3 Im Laufe eines Lebens verändern sich die Bedürfnisse. micura Pflegedienste München/ Dachau schließt die Lücke einer eingeschränkten
ACDSee 10. ACDSee 10: Fotos gruppieren und schneller durchsuchen. Was ist Gruppieren? Fotos gruppieren. Das Inhaltsverzeichnis zum Gruppieren nutzen
 In diesem Tutorial erfahren Sie, wie man Fotos gruppiert. Mit der Option "Gruppieren nach" werden die Fotos in der Dateiliste nach Gruppen geordnet. Wenn Sie beispielsweise auf "Bewertung" klicken, werden
In diesem Tutorial erfahren Sie, wie man Fotos gruppiert. Mit der Option "Gruppieren nach" werden die Fotos in der Dateiliste nach Gruppen geordnet. Wenn Sie beispielsweise auf "Bewertung" klicken, werden
2m Band der Freiwilligen. Feuerwehren im. Lkr. Rottal-Inn
 Funkrufnamenkonzept im 2m Band der Freiwilligen Feuerwehren im Lkr. Rottal-Inn Ersteller: Team TKS: Ortmaier Andreas, Kommandant FF Tann Eichinger Martin, Kommandant FF Kirchdorf am Inn Pilger Markus,
Funkrufnamenkonzept im 2m Band der Freiwilligen Feuerwehren im Lkr. Rottal-Inn Ersteller: Team TKS: Ortmaier Andreas, Kommandant FF Tann Eichinger Martin, Kommandant FF Kirchdorf am Inn Pilger Markus,
Outlook und Outlook Express
 1 von 8 24.02.2010 12:16 Outlook und Outlook Express Bevor Sie anfangen: Vergewissern Sie sich, dass Sie eine kompatible Version von Outlook haben. Outlook 97 wird nicht funktionieren, wohl aber Outlook
1 von 8 24.02.2010 12:16 Outlook und Outlook Express Bevor Sie anfangen: Vergewissern Sie sich, dass Sie eine kompatible Version von Outlook haben. Outlook 97 wird nicht funktionieren, wohl aber Outlook
Ein Buch entsteht. Ein langer Weg
 Ein Buch entsteht ilo 2003 Ein langer Weg Wenn ein Schriftsteller oder eine Schriftstellerin eine Geschichte schreibt, dann ist das noch ein langer Weg bis daraus ein Buch wird. Der Autor Alles fängt damit
Ein Buch entsteht ilo 2003 Ein langer Weg Wenn ein Schriftsteller oder eine Schriftstellerin eine Geschichte schreibt, dann ist das noch ein langer Weg bis daraus ein Buch wird. Der Autor Alles fängt damit
Anspruchsvolle Dreierausdrücke zum selbstständigen Lernen
 Anspruchsvolle Dreierausdrücke zum selbstständigen Lernen von Frank Rothe Das vorliegende Übungsblatt ist als Anregung gedacht, die Sie in Ihrer Klasse in unterschiedlicher Weise umsetzen können. Entwickelt
Anspruchsvolle Dreierausdrücke zum selbstständigen Lernen von Frank Rothe Das vorliegende Übungsblatt ist als Anregung gedacht, die Sie in Ihrer Klasse in unterschiedlicher Weise umsetzen können. Entwickelt
Übungsaufgaben Tilgungsrechnung
 1 Zusatzmaterialien zu Finanz- und Wirtschaftsmathematik im Unterricht, Band 1 Übungsaufgaben Tilgungsrechnung Überarbeitungsstand: 1.März 2016 Die grundlegenden Ideen der folgenden Aufgaben beruhen auf
1 Zusatzmaterialien zu Finanz- und Wirtschaftsmathematik im Unterricht, Band 1 Übungsaufgaben Tilgungsrechnung Überarbeitungsstand: 1.März 2016 Die grundlegenden Ideen der folgenden Aufgaben beruhen auf
Informationsblatt Induktionsbeweis
 Sommer 015 Informationsblatt Induktionsbeweis 31. März 015 Motivation Die vollständige Induktion ist ein wichtiges Beweisverfahren in der Informatik. Sie wird häufig dazu gebraucht, um mathematische Formeln
Sommer 015 Informationsblatt Induktionsbeweis 31. März 015 Motivation Die vollständige Induktion ist ein wichtiges Beweisverfahren in der Informatik. Sie wird häufig dazu gebraucht, um mathematische Formeln
Bundesverband Flachglas Großhandel Isolierglasherstellung Veredlung e.v. U g -Werte-Tabellen nach DIN EN 673. Flachglasbranche.
 Bundesverband Flachglas Großhandel Isolierglasherstellung Veredlung e.v. U g -Werte-Tabellen nach DIN EN 673 Ug-Werte für die Flachglasbranche Einleitung Die vorliegende Broschüre enthält die Werte für
Bundesverband Flachglas Großhandel Isolierglasherstellung Veredlung e.v. U g -Werte-Tabellen nach DIN EN 673 Ug-Werte für die Flachglasbranche Einleitung Die vorliegende Broschüre enthält die Werte für
Kennlinienaufnahme elektronische Bauelemente
 Messtechnik-Praktikum 06.05.08 Kennlinienaufnahme elektronische Bauelemente Silvio Fuchs & Simon Stützer 1 Augabenstellung 1. a) Bauen Sie eine Schaltung zur Aufnahme einer Strom-Spannungs-Kennlinie eines
Messtechnik-Praktikum 06.05.08 Kennlinienaufnahme elektronische Bauelemente Silvio Fuchs & Simon Stützer 1 Augabenstellung 1. a) Bauen Sie eine Schaltung zur Aufnahme einer Strom-Spannungs-Kennlinie eines
Permanent Magnet Motor Konzept
 Permanent Magnet Motor Konzept QuickField Simulation (Studentenversion) ROTOR STATOR www.magnetmotor.at Dietmar Hohl, Linz/AUSTRIA Jän. 2010 Rev. D Seite 1 von 13 Beginnen wir mit zwei dreieckigen Magneten.
Permanent Magnet Motor Konzept QuickField Simulation (Studentenversion) ROTOR STATOR www.magnetmotor.at Dietmar Hohl, Linz/AUSTRIA Jän. 2010 Rev. D Seite 1 von 13 Beginnen wir mit zwei dreieckigen Magneten.
SCHRITT 1: Öffnen des Bildes und Auswahl der Option»Drucken«im Menü»Datei«...2. SCHRITT 2: Angeben des Papierformat im Dialog»Drucklayout«...
 Drucken - Druckformat Frage Wie passt man Bilder beim Drucken an bestimmte Papierformate an? Antwort Das Drucken von Bildern ist mit der Druckfunktion von Capture NX sehr einfach. Hier erklären wir, wie
Drucken - Druckformat Frage Wie passt man Bilder beim Drucken an bestimmte Papierformate an? Antwort Das Drucken von Bildern ist mit der Druckfunktion von Capture NX sehr einfach. Hier erklären wir, wie
Titration von Speise-Essig
 Titration von Speise-Essig Wir werden in diesem Versuch die Titration [frz.titer = Feingehalt] Konzentration der Essigsäure in Analytisches Verfahren, bei dem die Reagenzlösung tropfenweise zugesetzt wird,
Titration von Speise-Essig Wir werden in diesem Versuch die Titration [frz.titer = Feingehalt] Konzentration der Essigsäure in Analytisches Verfahren, bei dem die Reagenzlösung tropfenweise zugesetzt wird,
1. Kennlinien. 2. Stabilisierung der Emitterschaltung. Schaltungstechnik 2 Übung 4
 1. Kennlinien Der Transistor BC550C soll auf den Arbeitspunkt U CE = 4 V und I C = 15 ma eingestellt werden. a) Bestimmen Sie aus den Kennlinien (S. 2) die Werte für I B, B, U BE. b) Woher kommt die Neigung
1. Kennlinien Der Transistor BC550C soll auf den Arbeitspunkt U CE = 4 V und I C = 15 ma eingestellt werden. a) Bestimmen Sie aus den Kennlinien (S. 2) die Werte für I B, B, U BE. b) Woher kommt die Neigung
Viele Bilder auf der FA-Homepage
 Viele Bilder auf der FA-Homepage Standardmäßig lassen sich auf einer FA-Homepage nur 2 Bilder mit zugehörigem Text unterbringen. Sollen es mehr Bilder sein, muss man diese als von einer im Internet
Viele Bilder auf der FA-Homepage Standardmäßig lassen sich auf einer FA-Homepage nur 2 Bilder mit zugehörigem Text unterbringen. Sollen es mehr Bilder sein, muss man diese als von einer im Internet
