Chlorgas trifft auf elementares Natrium
|
|
|
- Birgit Pfeiffer
- vor 7 Jahren
- Abrufe
Transkript
1 Reaktionsgleichungen Na (s) Na(l) Na (l) + Cl (g) NaCl (s) Zeitbedarf Vorbereitung: 60 min. Durchführung: 3 min. Nachbereitung: 30 min. Chemikalienliste Edukte Chemikalien Summenformel R-Sätze S-Sätze Gefahrensymbole Schuleinsatz Natrium Na (s) 14/ F, C S1 Chlorgas Cl (g) 23-36/37/ T, N S1 Wasser H 2 O (l) S1 Natriumhydrogencarbonat NaHCO 3 (s) /25 - S1 Schwefelsäure (konz., w = 96 %) H 2 SO 4 (l) C S1 Natriumthiosulfat Na 2 S 2 O 3 (s) S1 Produkte Chemikalien Summenformel R-Sätze S-Sätze Gefahrensymbole Schuleinsatz Natriumchlorid NaCl (s) S1 Gefahrensymbole Materialien und Geräte Filterpapier, Pinzette, Messer, Stativmaterial (2 Platten, 4 Stangen, 6 Doppelmuffen, 6 Hakenmuffen), 1 Stativring, 9 Schlauchschellen, 3 Keckklemmen, 3 Gaswaschflaschen, 1 langes Glasrohr (ø = 1,5 cm, l = 25 cm), 2 durchbohrte Stopfen für das lange Glasrohr, 2 kurze Glasrohre, 3 kurze PVC-Schläuche (l = 3 cm), 2 lange PVC-Schläuche (l = cm)
2 Versuchsaufbau Abb. 1: Versuchsaufbau (Chlorgaszuleitung von links) Durchführung Augenschutz benutzen Schutzhandschuhe benutzen Schutzkleidung benutzen Der Versuch muss unbedingt in einem gut funktionierenden Abzug durchgeführt werden! Als erstes wird eine gesättigte Natriumthiosulfat-Lösung in Griffweite gestellt. Anschließend wird der Versuch gemäß Abbildung 1 aufgebaut. Dabei werden die zweite Gaswaschflasche von links mit konzentrierter Schwefelsäure und die rechte Gaswaschflasche mit gesättigter Natriumhydrogencarbonat-Lösung gefüllt. Dann wird ein etwa erbsengroßes Stück Natrium zurechtgeschnitten und im Reaktionsrohr platziert. Nun wird der Hahn der Chlorgasbombe geöffnet und das Chlorgas durch die Apparatur geleitet. Mithilfe des Bunsenbrenners wird dann das Natrium erhitzt, bis es zu glühen beginnt. Sobald dies erreicht ist, wird der Bunsenbrenner entfernt und die Reaktion beobachtet. Beobachtungen Bei Einleiten des Chlorgases entstehen in der Schwefelsäure und in der Natriumhydrogencarbonat- Lösung Gasblasen. Das Natrium schmilzt während des Erhitzens und bildet eine silbrig glänzende Kugel, welche sich kurz darauf mit einer schwarzen Schicht überzieht. Sie beginnt stark zu glühen und zu rauchen. Auch eine intensiv gelbe Flamme ist zu sehen. Währenddessen färbt sich der Gasraum in der ersten und zweiten Gaswaschflasche grün. In der dritten Gaswaschflasche bildet sich ein weißer Nebel/Rauch.
3 Abb. 2: Ablaufende Reaktion Nachdem die Reaktion beendet ist, ist ein weißer Rückstand im Reaktionsrohr zu sehen (Abb. 3). Abb. 3: Reaktionsprodukt Entsorgung Zunächst lässt man die Apparatur, insbesondere die Gaswaschflaschen, im Abzug ausgasen. Anschließend wird die Schwefelsäure neutralisiert (z.b. mit Natriumhydroxid) und in den Ausguss entsorgt. Die Natriumhydrogencarbonat-Lösung wird mit der äquivalenten Menge an Natriumthiosulfat-Lösung versetzt und anschließend in den Ausguss gegeben. 4 Cl 2 g + 10 NaHCO 3 aq + Na 2 S 2 O 3 aq 2 Na 2 SO 4 aq + 8 NaCl aq + 10 CO 2 g + 5 H 2 O l Alle Teile der Apparatur, die wiederverwendet werden sollen (z.b. die Gaswaschflaschen), werden mit Natriumthiosulfat-Lösung durchgespült. Die restlichen Teile (wie Schlauchstücke) werden in den Feststoffabfall entsorgt. Das Reaktionsrohr kann für Versuch A07 Nachweis der Kochsalzbestandteile aufgehoben oder ebenfalls in den Feststoffabfall entsorgt werden. Fachliche Analyse Unter den Metallen reagieren die Alkalimetalle (z.b. Natrium) am heftigsten mit Chlor. Dabei werden große Energiemengen frei, welche hier vor allem in Form von Licht abgegeben werden: 2 Na (s) + Cl 2 (g) 2 NaCl (s) + 822,56 kj Im Versuch werden zwei Elemente aus verschiedenen Bereichen des Periodensystems (PSE) kombiniert. Natrium aus der 1. Gruppe (links im PSE) und Chlor aus der 17. Gruppe (rechts im PSE). Bei den chemischen Reaktionen zwischen den Atomen sind nur die Valenzelektronen beteiligt, davon
4 besitzt Natrium nur eines und Chlor sieben. Alle Atome sind aber bestrebt, eine abgeschlossene Außenschale, d.h. acht Valenzelektronen zu besitzen. Dazu gibt Natrium bereitwillig ein Elektron ab und Chlor nimmt dieses auf. Nun besitzen beide Atome ein sog. Elektronenoktett, d.h. acht Valenzelektronen. Da Natrium nun aber noch immer 11 positiv geladene Protonen im Kern enthält, ihm aber ein negativ geladenes Elektron fehlt, ergibt sich für das Natrium die Ladung +1 und es wird nun als Ion (Kation) bezeichnet. Ähnliches gilt für das Chloratom: Es besitzt noch immer 17 Protonen im Kern, hat aber nun 18 Elektronen, wodurch sich eine Ladung von -1 für das Chlorid-Ion (ein Anion) ergibt. In einer Reaktionsgleichung werden die Valenzelektronen meist als Punkte dargestellt: Na + Cl Na + + Cl - In der Darstellung nach dem Bohrschen Schalenmodell sieht es wie folgt aus: Aufgrund der unterschiedlichen Ladungen werden die Ionen zusammengehalten. Die Anziehungskraft wird als elektrostatische Anziehung und die auf diesem Wege gebildete Bindung als Ionenbindung bezeichnet. Das durch die Ladung induzierte elektrische Feld eines Ions ist in der Regel nicht gerichtet, d.h. es zielt nicht nur auf ein Ion der entgegengesetzten Ladung, sondern in alle Richtungen auf benachbarte Ionen in gleichem Maße. Daher lagern sich Stoffe, welche durch Ionenbindungen zusammengehalten werden, wie z.b. das hier gebildete Natriumchlorid, in Form von Ionenkristallen zusammen. Darin liegen die Anionen (z.b. Cl - ) und die Kationen (z.b. Na + ) abwechselnd nebeneinander. Solche Stoffe werden Salze genannt.
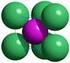
5 Abb. 4: 3D-Modell der Natriumchloridstruktur (Chlor = grün, Natrium = blau) [1b] Die Ionenbindungen treten vor allem bei Verbindungen auf, bei denen die Elektronegativitäten (EN) der Reaktionspartner eine Differenz von > 2 aufweisen. Eine Differenz von 2 entspricht in etwa einem 50 %igen ionischen Charakter. Bei geringeren Differenzen liegen überwiegend kovalente, bei größeren Differenzen überwiegend ionische Bindungen vor. Stoffe die aus einem Halogenatom und einem Metallatom bestehen, werden auch als Halogenide bezeichnet. Bei ihrer Benennung wird zuerst das Metall und dann das Halogen genannt. Der entstehende Name wird dann um die Endung -id ergänzt: Natrium + Chlor = Natriumchlorid Natriumchlorid (NaCl, Steinsalz ) ist den meisten als Kochsalz bekannt. Es ist in großen Salzlagerstätten in der norddeutschen Tiefebene, in Galizien oder im Salzkammergut in Österreich zu finden. Darüber hinaus sind riesige Mengen (3, t) an Natriumchlorid im Meerwasser gelöst und t liegen als festes Steinsalz darin vor. Gewonnen wird es entweder durch bergmännischen Abbau, durch Aussolung (Eindampfen wässriger Lösungen) oder durch Einleiten des Meerwassers in sog. Salzgärten warmer Länder (die Sonne lässt das Wasser verdunsten und das Salz bleibt zurück). Verwendung findet es als Speisesalz zum Würzen und zum Konservieren von Lebensmitteln (Pökelsalz). In der chemischen Industrie dient es zum Aussalzen organischer Verbindungen sowie zur Darstellung fast aller Natriumverbindungen wie Soda (Natriumcarbonat, Na 2 CO 3 ), Ätznatron (Natriumhydroxid, NaOH) oder Glaubersalz (Natriumsulfat, Na 2 SO 4 ). Die Schwefelsäure in der ersten Gaswaschflasche hat nur die Funktion, durch ihre stark hygroskopische Wirkung die im Chlorgas eventuell vorhandene Feuchtigkeit zu binden, damit das Gas möglichst trocken und rein zum Natrium gelangt. Die Natriumhydrogencarbonat-Lösung nimmt einen eventuellen Überschuss an Chlorgas auf, damit dieses möglichst nicht aus der Apparatur ausströmt. Anschließend werden die gelösten Stoffe mit Natriumthiosulfat-Lösung in ungefährliche Produkte überführt.
6 Methodisch didaktische Analyse Einordnung Nach dem hessischen Lehrplan G8 ist der Versuch in die Stufe 8G.2 im Thema Ordnung in der Vielfalt, Atombau und Periodensystem und in das Unterthema 2.4 Alkalimetalle einzuordnen. Dabei sollen chemische Reaktionen gezeigt werden, wobei dieser einen ausgezeichneten Alltagsbezug herstellt, da jeder Schüler Kochsalz als Speisesalz, aber meist nicht als chemische Verbindung kennt. Darüber hinaus kann hier gut auf die Gruppen der Salze und Halogenide übergeleitet werden. Daher kann der Versuch auch unter Punkt 2.5 Halogene in der gleichen Jahrgangsstufe eingesetzt werden. Die Schüler sollten dazu mit dem Schalenmodell zum Aufbau von Atomen vertraut sein. Als Nachfolgeversuch bietet sich A07 Nachweis der Kochsalzbestandteile an, in welchem das Produkt aus dem vorliegenden Versuch analysiert wird. Aufwand Die Vor- und Nachbereitung sind sehr aufwendig, vor allem der Aufbau nimmt sehr viel Zeit in Anspruch. Die Kosten halten sich in Grenzen, nur die Schläuche müssen jedes Mal ausgetauscht werden, da sie durch das stark ätzende Chlorgas angegriffen werden. Der Geräteaufwand ist auch relativ groß, aber die Materialien sollten alle in der Sammlung vorhanden sein. Bei Chlorgas könnte dem nicht so sein. Durchführung Der Versuch funktioniert sehr gut, wenn das Chlorgas zu Beginn durch die Apparatur strömt. Stellt man den Gasstrom erst an, wenn das Natrium zu glühen beginnt (wie in der Vorschrift angegeben), so verglüht ein Großteil zu einem schwarzen Rückstand, bevor das Gas das Natrium erreicht und reagiert nicht zu Natriumchlorid. Der Versuch sollte aufgrund des giftigen Chlorgases nur vom Lehrer in einem gut funktionierenden Abzug durchgeführt werden. Aufgrund des hohen Aufwands wird aber empfohlen, das vorliegende Video zu zeigen. Zunächst wurde überlegt, das Chlor in einer angeschlossenen Apparatur selbst zu entwickeln, anstatt eine Chlorbombe einzusetzen. Allerdings zeigte sich beim Probedurchlauf ein unzureichender, weil unregelmäßiger Gasstrom, welcher nicht genug Chlor lieferte, um die gewünschten Effekte zu erzielen. Fazit Ein sehr effektvoller, anschaulicher Versuch zur exothermen Reaktion zwischen Alkalimetallen und Halogenen, wobei Salze (hier das aus dem Alltag bekannte Kochsalz) gebildet werden. Nur der Aufbau ist unter Umständen relativ zeitaufwendig.
7 Literaturangaben Versuchsquelle Boeck, H.: Chemische Schulexperimente Band 3, Seite 381ff (V 504 d). Frankfurt/M.: Verlag Harri Deutsch Sekundärliteratur [1a] FIZ CHEMIE (Fachinformationszentrum Chemie GmbH): Encyclopedia - ChemgaPedia. Zu finden unter URL: Letzter Zugriff am [1b] ] FIZ CHEMIE (Fachinformationszentrum Chemie GmbH): Encyclopedia - ChemgaPedia. Zu finden unter URL: Letzter Zugriff am [2] Hessisches Kultusministerium: Lehrplan Chemie Gymnasialer Bildungsgang Jahrgangsstufen 7G bis 12G Zu finden unter URL: Letzter Zugriff am [3] Hollemann, A. F.; Wiberg, E.; Wiberg, N.: Lehrbuch der Anorganischen Chemie. Seiten 120f, 146f, 437, 1281f. 102., stark umgearbeitete und verbesserte Auflage. Berlin, New York: de Gruyter [4] Mortimer, C. E.: Chemie Das Basiswissen der Chemie. Seiten , korrigierte Auflage. Stuttgart, New York: Georg Thieme Verlag [5] Unfallkasse Hessen; Hessisches Kultusministerium: Hessisches Gefahrstoffinformationssystem Schule - HessGISS. Version /2009.
Schuleinsatz Calciumfluorid CaF 2 (s) 22-24/ S1 Schwefelsäure, (konz., w = 96 %)
 Reaktionsgleichungen F + (aq ) + H (aq ) HF (g) 4 HF (g) + SiO 2 (s) SiF 4 g + 2 H 2 O (l) Zeitbedarf Vorbereitung: 5min. Durchführung: 5 min. Nachbereitung: 5 min. Chemikalienliste Edukte Chemikalien
Reaktionsgleichungen F + (aq ) + H (aq ) HF (g) 4 HF (g) + SiO 2 (s) SiF 4 g + 2 H 2 O (l) Zeitbedarf Vorbereitung: 5min. Durchführung: 5 min. Nachbereitung: 5 min. Chemikalienliste Edukte Chemikalien
Sublimation & Resublimation
 Reaktionsgleichung I 2 (s) I2 (g) I 2 (s) Zeitbedarf Vorbereitung: 15 min. Durchführung: 7 Std. Nachbereitung: 20 min. Chemikalienliste Edukte Chemikalien Summenformel R-Sätze S-Sätze Gefahrensymbole Schuleinsatz
Reaktionsgleichung I 2 (s) I2 (g) I 2 (s) Zeitbedarf Vorbereitung: 15 min. Durchführung: 7 Std. Nachbereitung: 20 min. Chemikalienliste Edukte Chemikalien Summenformel R-Sätze S-Sätze Gefahrensymbole Schuleinsatz
Darstellen eines flüssigen Elements
 Reaktionsgleichungen 2 KBr (s) + H 2 SO 4 (l) K 2 SO 4 (solv ) + 2 HBr (g) 2 HBr (g) + H 2 O 2 (aq ) Br 2 (g) + 2 H 2 O (l) Zeitbedarf Vorbereitung: 30 min. Durchführung: 10 min. Nachbereitung: 10 min.
Reaktionsgleichungen 2 KBr (s) + H 2 SO 4 (l) K 2 SO 4 (solv ) + 2 HBr (g) 2 HBr (g) + H 2 O 2 (aq ) Br 2 (g) + 2 H 2 O (l) Zeitbedarf Vorbereitung: 30 min. Durchführung: 10 min. Nachbereitung: 10 min.
Nachweis der Kochsalzbestandteile
 Reaktionsgleichungen + NaCl (aq ) + AgNO 3 (aq ) AgCl (s) + NO 3 (aq ) + Na (aq ) Na Na h ν Na Zeitbedarf Vorbereitung: 5 min. Durchführung: 5 min. Nachbereitung: 5 min. Chemikalienliste Edukte Chemikalien
Reaktionsgleichungen + NaCl (aq ) + AgNO 3 (aq ) AgCl (s) + NO 3 (aq ) + Na (aq ) Na Na h ν Na Zeitbedarf Vorbereitung: 5 min. Durchführung: 5 min. Nachbereitung: 5 min. Chemikalienliste Edukte Chemikalien
Schneiden der Alkalimetalle und Autoxidation
 Reaktionsgleichungen 4 Li s + O 2 g 2 Li 2 O s 2 Na s + O 2 g Na 2 O 2 s K s + O 2 g KO 2 s Zeitbedarf Vorbereitung: 1 min. Durchführung: 10 min. Nachbereitung: 1 min. Chemikalienliste Edukte Chemikalien
Reaktionsgleichungen 4 Li s + O 2 g 2 Li 2 O s 2 Na s + O 2 g Na 2 O 2 s K s + O 2 g KO 2 s Zeitbedarf Vorbereitung: 1 min. Durchführung: 10 min. Nachbereitung: 1 min. Chemikalienliste Edukte Chemikalien
Reaktion der Alkalimetalle mit Wasser
 Reaktionsgleichungen 2 Li (s) + 2 H 2 O (l) 2 Li (aq ) + 2 OH (aq ) + H 2 (g) 2 Na (s) + 2 H 2 O (l) 2 Na (aq ) + 2 OH (aq ) + H 2 (g) 2 K (s) + 2 H 2 O (l) 2 K (aq ) + 2 OH (aq ) + H 2 (g) Zeitbedarf
Reaktionsgleichungen 2 Li (s) + 2 H 2 O (l) 2 Li (aq ) + 2 OH (aq ) + H 2 (g) 2 Na (s) + 2 H 2 O (l) 2 Na (aq ) + 2 OH (aq ) + H 2 (g) 2 K (s) + 2 H 2 O (l) 2 K (aq ) + 2 OH (aq ) + H 2 (g) Zeitbedarf
Reaktion zwischen Aluminiumpulver und Iod
 Reaktionsgleichung 2 Al (s) + 3 2 (s) Al 2 6 (s) Zeitbedarf Vorbereitung: 5 min. Durchführung: 15 min. Nachbereitung: 20 min. Chemikalienliste Edukte Chemikalien Summenformel Menge R-Sätze S-Sätze Gefahrensymbole
Reaktionsgleichung 2 Al (s) + 3 2 (s) Al 2 6 (s) Zeitbedarf Vorbereitung: 5 min. Durchführung: 15 min. Nachbereitung: 20 min. Chemikalienliste Edukte Chemikalien Summenformel Menge R-Sätze S-Sätze Gefahrensymbole
Die sprühende Vereinigung von Aluminium und Brom
 Reaktionsgleichung 3 2 l + 2 Al s 2 Al 3 solv Zeitbedarf Vorbereitung: 10 min. Durchführung: 5 min. Nachbereitung: 10 min. Chemikalienliste Edukte Chemikalien Summen- Menge R-Sätze S-Sätze formel Schuleinsatz
Reaktionsgleichung 3 2 l + 2 Al s 2 Al 3 solv Zeitbedarf Vorbereitung: 10 min. Durchführung: 5 min. Nachbereitung: 10 min. Chemikalienliste Edukte Chemikalien Summen- Menge R-Sätze S-Sätze formel Schuleinsatz
Reaktion von elementarem Natrium in Wasser und Nachweis der Reaktionsprodukte
 Reaktionsgleichungen + 2 Na (s) + 2 H 2 (l) 2 Na (aq ) + 2 H (aq ) + H 2 (g) 2 H 2 (g) + 2 (g) 2 H 2 (g) + HInd (aq ) + NaH (aq ) H 2 (aq ) + Ind (aq ) + Na (aq ) Zeitbedarf Vorbereitung: 30 min. Durchführung:
Reaktionsgleichungen + 2 Na (s) + 2 H 2 (l) 2 Na (aq ) + 2 H (aq ) + H 2 (g) 2 H 2 (g) + 2 (g) 2 H 2 (g) + HInd (aq ) + NaH (aq ) H 2 (aq ) + Ind (aq ) + Na (aq ) Zeitbedarf Vorbereitung: 30 min. Durchführung:
Summenformel Menge R-Sätze S-Sätze. n. V. n. V. n. V. n. V. S1 Natriumthiosulfat- Lösung (ges.) Summen- Menge R-Sätze S-Sätze formel
 Reaktionsgleichungen Cu (s) + 2 H (aq ) Cu 2 (s) + H 2 (g) Cu 2 s Cu 2+ s + 2 g 2+ Cu 2+ (s) Cu h ν 2+ (s) Cu (s) Zeitbedarf Vorbereitung: 10 min. Durchführung: 10 min. Nachbereitung: 10 min. Chemikalienliste
Reaktionsgleichungen Cu (s) + 2 H (aq ) Cu 2 (s) + H 2 (g) Cu 2 s Cu 2+ s + 2 g 2+ Cu 2+ (s) Cu h ν 2+ (s) Cu (s) Zeitbedarf Vorbereitung: 10 min. Durchführung: 10 min. Nachbereitung: 10 min. Chemikalienliste
Darstellung und Nachweis eines gasförmigen Halogens
 Reaktionsgleichungen 4 HCl aq + MnO 2 s Cl 2 g + MnCl 2 aq + 2 H 2 O l Cl 2 g + 2 I aq I 2 s + 2 Cl aq Zeitbedarf Vorbereitung: 60 min. Durchführung: 10 min. Nachbereitung: 25 min. Chemikalienliste Edukte
Reaktionsgleichungen 4 HCl aq + MnO 2 s Cl 2 g + MnCl 2 aq + 2 H 2 O l Cl 2 g + 2 I aq I 2 s + 2 Cl aq Zeitbedarf Vorbereitung: 60 min. Durchführung: 10 min. Nachbereitung: 25 min. Chemikalienliste Edukte
Bleitiegelprobe (Wassertropfenprobe)
 Reaktionsgleichungen Na 2 SiO 3 + 2 CaF 2 + 3 H 2 SO 4 SiF 4 + 3 H 2 O + 2 CaSO 4 + Na 2 SO 4 SiF 4 + 3 H 2 O H 2 SiO 3 + 4 HF Zeitbedarf Vorbereitung: 20 min. Durchführung: 20 min. Nachbereitung: 10 min.
Reaktionsgleichungen Na 2 SiO 3 + 2 CaF 2 + 3 H 2 SO 4 SiF 4 + 3 H 2 O + 2 CaSO 4 + Na 2 SO 4 SiF 4 + 3 H 2 O H 2 SiO 3 + 4 HF Zeitbedarf Vorbereitung: 20 min. Durchführung: 20 min. Nachbereitung: 10 min.
V 1 Herstellung von Natriumchlorid
 1 V 1 Herstellung von Natriumchlorid In diesem Versuch wird Natriumchlorid, im Alltag als Kochsalz bekannt, aus den Edukten Natrium und Chlorgas hergestellt. Dieser Versuch ist eine Reaktion zwischen einem
1 V 1 Herstellung von Natriumchlorid In diesem Versuch wird Natriumchlorid, im Alltag als Kochsalz bekannt, aus den Edukten Natrium und Chlorgas hergestellt. Dieser Versuch ist eine Reaktion zwischen einem
Die Reaktivitätsreihe der Halogene
 Reaktionsgleichungen Cl 2 (aq ) + 2 Br (aq ) 2 Cl (aq ) + Br 2 (solv ) Cl 2 aq + 2 I aq 2 Cl aq + I 2 solv Br 2 aq + 2 Cl aq Br 2 aq + 2 I aq 2 Br aq + I 2 solv I 2 (aq ) + 2 Cl (aq ) I 2 (aq ) + 2 Br
Reaktionsgleichungen Cl 2 (aq ) + 2 Br (aq ) 2 Cl (aq ) + Br 2 (solv ) Cl 2 aq + 2 I aq 2 Cl aq + I 2 solv Br 2 aq + 2 Cl aq Br 2 aq + 2 I aq 2 Br aq + I 2 solv I 2 (aq ) + 2 Cl (aq ) I 2 (aq ) + 2 Br
Erhitzen von Lithium, Natrium und Kalium
 Reaktionsgleichungen 4 Li s + O 2 g 2 Li 2 O s 2 Na s + O 2 g Na 2 O 2 s K s + O 2 (g) KO 2 (s) Zeitbedarf Vorbereitung: 10 min. Durchführung: 10 min. Nachbereitung: 5 min. Chemikalienliste Edukte Chemikalien
Reaktionsgleichungen 4 Li s + O 2 g 2 Li 2 O s 2 Na s + O 2 g Na 2 O 2 s K s + O 2 (g) KO 2 (s) Zeitbedarf Vorbereitung: 10 min. Durchführung: 10 min. Nachbereitung: 5 min. Chemikalienliste Edukte Chemikalien
Schuleinsatz Lithiumchlorid LiCl (s) 22-36/38 - Xn S1 Natriumbromid NaBr (s) - - Xi S1 Kaliumiodid KI (s) S1 Salzsäure (c = 1 mol*l -1 )
 Reaktionsgleichungen LiCl (aq ) + AgNO 3 (aq ) AgCl (s) + NO 3 (aq ) + Li (aq ) NaBr (aq ) + AgNO 3 (aq ) AgBr (s) + NO 3 (aq ) + Na (aq ) KI (aq ) + AgNO 3 (aq ) AgI (s) + NO 3 (aq ) + K (aq ) Zeitbedarf
Reaktionsgleichungen LiCl (aq ) + AgNO 3 (aq ) AgCl (s) + NO 3 (aq ) + Li (aq ) NaBr (aq ) + AgNO 3 (aq ) AgBr (s) + NO 3 (aq ) + Na (aq ) KI (aq ) + AgNO 3 (aq ) AgI (s) + NO 3 (aq ) + K (aq ) Zeitbedarf
Versuch: Elektrophile Addition von Brom an Ethen
 Philipps-Universität Marburg 03.12.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 3, Alkene / Alkine Versuch: Elektrophile Addition von
Philipps-Universität Marburg 03.12.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 3, Alkene / Alkine Versuch: Elektrophile Addition von
Ionenbindung Lehrerinformation
 Lehrerinformation 1/5 Arbeitsauftrag Ziel Material Sozialform Zeit Die SuS erarbeiten sich chemische Informationen zu Kochsalz. Sie kennen die Bestandteile und wissen, wie Salz chemisch aufgebaut ist.
Lehrerinformation 1/5 Arbeitsauftrag Ziel Material Sozialform Zeit Die SuS erarbeiten sich chemische Informationen zu Kochsalz. Sie kennen die Bestandteile und wissen, wie Salz chemisch aufgebaut ist.
Gruppe 13 vorgegebener Versuch. Polyelektrolyte im Haargel
 Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 17.06.09 SS 09 Gruppe 13 vorgegebener Versuch Polyelektrolyte
Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 17.06.09 SS 09 Gruppe 13 vorgegebener Versuch Polyelektrolyte
Grundwissen Chemie 9. Jahrgangsstufe
 Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Von Arrhenius zu Brönsted
 Schulversuchspraktikum Name Annika Münch Sommersemester 2015 Klassenstufen 9/10 Von Arrhenius zu Brönsted Kurzprotokoll Auf einen Blick: Für die Unterrichtseinheit zum Themas Säure-Base-Konzepte und im
Schulversuchspraktikum Name Annika Münch Sommersemester 2015 Klassenstufen 9/10 Von Arrhenius zu Brönsted Kurzprotokoll Auf einen Blick: Für die Unterrichtseinheit zum Themas Säure-Base-Konzepte und im
Versuchsprotokoll: Zuckerwürfel in Kaliumchlorat
 Versuchsprotokoll: Zuckerwürfel in Kaliumchlorat Zeitaufwand: Aufbau: 5 Minuten Durchführung: 10 Minuten Entsorgung: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz
Versuchsprotokoll: Zuckerwürfel in Kaliumchlorat Zeitaufwand: Aufbau: 5 Minuten Durchführung: 10 Minuten Entsorgung: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz
Versuch: Bromierung von n-hexan. Chemikalien Menge R-Sätze S-Sätze Gefahrensymbol Bemerkung
 Philipps-Universität Marburg 25.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 2: Alkane Versuch: omierung von n-hexan Zeitbedarf: Vorbereitung:
Philipps-Universität Marburg 25.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 2: Alkane Versuch: omierung von n-hexan Zeitbedarf: Vorbereitung:
Vorkurs Allgemeine Chemie für Ingenieure und Biologen 20. Oktober 2015 Dr. Helmut Sitzmann, Apl.-Professor für Anorganische Chemie
 Vorkurs Allgemeine Chemie für Ingenieure und Biologen 20. Oktober 2015 Dr. Helmut Sitzmann, Apl.-Professor für Anorganische Chemie DIE CHEMISCHE BINDUNG Ionische Bindung, Beispiel Natriumchlorid Trifft
Vorkurs Allgemeine Chemie für Ingenieure und Biologen 20. Oktober 2015 Dr. Helmut Sitzmann, Apl.-Professor für Anorganische Chemie DIE CHEMISCHE BINDUNG Ionische Bindung, Beispiel Natriumchlorid Trifft
Gruppe 2 eigener Versuch. Veränderung einer Kerzenflamme in Feuerzeuggas
 Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 20.05.09 SS 09 Gruppe 2 eigener Versuch Veränderung einer Kerzenflamme
Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 20.05.09 SS 09 Gruppe 2 eigener Versuch Veränderung einer Kerzenflamme
Gruppe 01: Elementarnachweis: Kohlenstoff- und Wasserstoffnachweis
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 01: Elementarnachweis: Kohlenstoff- und Wasserstoffnachweis Reaktion:
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 01: Elementarnachweis: Kohlenstoff- und Wasserstoffnachweis Reaktion:
Wie sind Atome aufgebaut Welche Informationen enthält das Periodensystem?
 2. DIE KLEINSTEN TEILCHEN ARBEITSBLATT 2.1 DER ATOMAUFBAU FRAGE Wie sind Atome aufgebaut Welche Informationen enthält das Periodensystem? Bausteine der Atome Ladung (+, -, 0) Masse (hoch, sehr gering)
2. DIE KLEINSTEN TEILCHEN ARBEITSBLATT 2.1 DER ATOMAUFBAU FRAGE Wie sind Atome aufgebaut Welche Informationen enthält das Periodensystem? Bausteine der Atome Ladung (+, -, 0) Masse (hoch, sehr gering)
Wiederholungsthema: Ionenbindung und Salze. Zusammenfassung: Ionen und Ionenbildung
 Wiederholungsthema: Ionenbindung und Salze Zusammenfassung: Ionen und Ionenbildung Wie sich Atome auch immer verbinden mögen, so versuchen sie doch stets dabei die Edelgaskonfiguration (Abb.3) zu erhalten,
Wiederholungsthema: Ionenbindung und Salze Zusammenfassung: Ionen und Ionenbildung Wie sich Atome auch immer verbinden mögen, so versuchen sie doch stets dabei die Edelgaskonfiguration (Abb.3) zu erhalten,
Schulart: WG Klasse: WG 11/3 Fachlehrer: Die Ionenbindung. Atombindung, Anomalie des Wassers
 Fachleiter: Kurs: Referendar: UNTERRICHTSTHEMA Schulart: WG Klasse: WG 11/3 Fachlehrer: Die Ionenbindung Datum: Ort: Zeit: THEMA DER VORAUSGEGANGENEN UNTERRICHTSSTUNDE / UNTERRICHTSEINHEIT Atombindung,
Fachleiter: Kurs: Referendar: UNTERRICHTSTHEMA Schulart: WG Klasse: WG 11/3 Fachlehrer: Die Ionenbindung Datum: Ort: Zeit: THEMA DER VORAUSGEGANGENEN UNTERRICHTSSTUNDE / UNTERRICHTSEINHEIT Atombindung,
Robert-Koch-Gymnasium Deggendorf. Grundwissen Chemie. 8. Jahrgangsstufe
 Robert-Koch-Gymnasium Deggendorf Grundwissen Chemie 8. Jahrgangsstufe Teilchenmodell und Stoffeigenschaften Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, vereinfacht dargestellt als Kugeln.
Robert-Koch-Gymnasium Deggendorf Grundwissen Chemie 8. Jahrgangsstufe Teilchenmodell und Stoffeigenschaften Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, vereinfacht dargestellt als Kugeln.
Versuchsprotokoll: Reaktion von Zucker mit Schwefelsäure
 Versuchsprotokoll: Reaktion von Zucker mit Schwefelsäure Zeitaufwand: Aufbau: Durchführung: Abbau/Entsorgung: 5 Minuten 10 Minuten 5 Minuten Chemikalien: Chemikalie Menge RSätze SSätze Gefahrensymbol Schwefelsäure
Versuchsprotokoll: Reaktion von Zucker mit Schwefelsäure Zeitaufwand: Aufbau: Durchführung: Abbau/Entsorgung: 5 Minuten 10 Minuten 5 Minuten Chemikalien: Chemikalie Menge RSätze SSätze Gefahrensymbol Schwefelsäure
Versuchsprotokoll: Fehling- Spaltung von Saccharose
 Versuchsprotokoll: Fehling- Spaltung von Saccharose Zeitaufwand: Vorbereitung: 5 Minuten Durchführung: 15 Minuten Abbau/Entsorgung: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol
Versuchsprotokoll: Fehling- Spaltung von Saccharose Zeitaufwand: Vorbereitung: 5 Minuten Durchführung: 15 Minuten Abbau/Entsorgung: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol
Kochsalz-Kristalle (Halit) Wichtige Stoffgruppen Atomverband Stoffgruppe Metall Metall: Metallische Stoffe Salzartige Stoffe Metall Nichtmetall:
 Kochsalz-Kristalle (Halit) 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter)
Kochsalz-Kristalle (Halit) 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter)
Grundwissen Chemie 8. Klasse NTG
 Grundwissen Chemie 8. Klasse NTG Reinstoff hat gleich bleibende Eigenschaften (Stoffebene) besteht aus einer Sorte gleichartiger Teilchen z.b.: dest. Wasser, Kupfer, Gold, Salz 8.1 C NTG Element sind nicht
Grundwissen Chemie 8. Klasse NTG Reinstoff hat gleich bleibende Eigenschaften (Stoffebene) besteht aus einer Sorte gleichartiger Teilchen z.b.: dest. Wasser, Kupfer, Gold, Salz 8.1 C NTG Element sind nicht
Grundwissen 8. Klasse 1 Grundwissen 8. Klasse 1. Grundwissen 8. Klasse 2 Grundwissen 8. Klasse 2. Stoffebene
 Grundwissen 8. Klasse 1 Grundwissen 8. Klasse 1 Stoff Einteilung der Stoffe Reinstoff mischen Gemisch Stelle in einem Fließdiagramm folgende Begriffe zueinander in Beziehung: Stoff, Reinstoff, Gemisch,
Grundwissen 8. Klasse 1 Grundwissen 8. Klasse 1 Stoff Einteilung der Stoffe Reinstoff mischen Gemisch Stelle in einem Fließdiagramm folgende Begriffe zueinander in Beziehung: Stoff, Reinstoff, Gemisch,
chemische Vorgänge spielen sich in erster Linie in der Atomhülle ab, sind also mit einer Änderung der Energiezustände der Elektronen verbunden.
 1 Atomhülle - Elektronen chemische Vorgänge spielen sich in erster Linie in der Atomhülle ab, sind also mit einer Änderung der Energiezustände der Elektronen verbunden. Energie der Elektronen Die Energie
1 Atomhülle - Elektronen chemische Vorgänge spielen sich in erster Linie in der Atomhülle ab, sind also mit einer Änderung der Energiezustände der Elektronen verbunden. Energie der Elektronen Die Energie
Versuchsprotokoll. Züchtung von Kandiszucker-Kristallen
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 15.1.09 Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll Züchtung von Kandiszucker-Kristallen
Anna-Lena Eicke Philipps-Universität Marburg rganisch-chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 15.1.09 Schulversuche Assistentin: Katrin Hohmann Versuchsprotokoll Züchtung von Kandiszucker-Kristallen
Atomverband mit festem Atomzahlverhältnis. Anzahl der Atome veränderlich? (bei festem Atomzahlverhältnis) Elektrisch Leitend?
 L3 1 Atomverband mit festem Atomzahlverhältnis. Ja Anzahl der Atome veränderlich? (bei festem Atomzahlverhältnis) Nein Ja Elektrisch Leitend? Nur in der Schmelze? Nein Ionenkristall Beliebig erweiterbar
L3 1 Atomverband mit festem Atomzahlverhältnis. Ja Anzahl der Atome veränderlich? (bei festem Atomzahlverhältnis) Nein Ja Elektrisch Leitend? Nur in der Schmelze? Nein Ionenkristall Beliebig erweiterbar
Versuch: Isolierung von Citronensäure aus Zitronen
 Philipps-Universität Marburg 10.02.2008 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 11, Naturstoffe und Lebensmittel Versuch: Isolierung
Philipps-Universität Marburg 10.02.2008 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 11, Naturstoffe und Lebensmittel Versuch: Isolierung
Schuleigener Lehrplan Chemie (Grundlage: KLP 2008) Klasse 8. Schuleigener Lehrplan. Chemie - Klasse 8 -
 Schuleigener Lehrplan Chemie - Klasse 8 - 5 Elementfamilien, Atombau und Periodensystem Alkali- oder Erdalkalimetalle Halogene Nachweisreaktionen Kern-Hülle-Modell Elementarteilchen Atomsymbole Schalenmodell
Schuleigener Lehrplan Chemie - Klasse 8 - 5 Elementfamilien, Atombau und Periodensystem Alkali- oder Erdalkalimetalle Halogene Nachweisreaktionen Kern-Hülle-Modell Elementarteilchen Atomsymbole Schalenmodell
SÄUREN, BASE, SALZE GRUNDLAGEN CHEMIE
 SÄUREN, BASE, SALZE GRUNDLAGEN CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE Wikipedia: Die organische Chemie (kurz: OC), häufig auch kurz Organik, ist ein Teilgebiet der
SÄUREN, BASE, SALZE GRUNDLAGEN CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE Wikipedia: Die organische Chemie (kurz: OC), häufig auch kurz Organik, ist ein Teilgebiet der
Chemie. Elemente Elemente sind Stoffe, die nur aus einer Sorte von Atomen bestehen. 1. Metalle ; 2. Nichtmetalle ; 3. Halbmetalle
 Chemie 1. Wiederholung Elemente Elemente sind Stoffe, die nur aus einer Sorte von Atomen bestehen. 1. Metalle ; 2. Nichtmetalle ; 3. Halbmetalle Moleküle Moleküle sind zwei oder mehr Atome zusammen verbunden.
Chemie 1. Wiederholung Elemente Elemente sind Stoffe, die nur aus einer Sorte von Atomen bestehen. 1. Metalle ; 2. Nichtmetalle ; 3. Halbmetalle Moleküle Moleküle sind zwei oder mehr Atome zusammen verbunden.
+ 30,5 O 2 (g) 20 CO 2 (g) + 21 H 2 O
 Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah Henkel Datum: 11.11.2008 Gruppe 1: Einführung der OC Versuch: Nachweis
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah Henkel Datum: 11.11.2008 Gruppe 1: Einführung der OC Versuch: Nachweis
Lernaufgabe: Periodensystem Erklärung von Tendenzen in der Reaktionsfähigkeit der Alkali-, Erdalkalimetalle und der Halogene
 ETH Institut für Verhaltenswissenschaften Seite 1/5 Lernaufgabe: Periodensystem Erklärung von Tendenzen in der Reaktionsfähigkeit der Alkali-, Erdalkalimetalle und der Halogene Hilfreiche Angaben: 1. Unterrichtsfach:
ETH Institut für Verhaltenswissenschaften Seite 1/5 Lernaufgabe: Periodensystem Erklärung von Tendenzen in der Reaktionsfähigkeit der Alkali-, Erdalkalimetalle und der Halogene Hilfreiche Angaben: 1. Unterrichtsfach:
Gruppe 9 vorgegebener Versuch. Verbrennung eines Gummibärchens in der Kaliumchlorat-Schmelze
 Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 23.06.09 SS 09 Gruppe 9 vorgegebener Versuch Verbrennung eines
Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 23.06.09 SS 09 Gruppe 9 vorgegebener Versuch Verbrennung eines
Versuchsprotokoll:Stärkespaltung
 Versuchsprotokoll:Stärkespaltung Zeitaufwand: Aufbau: 5 Minuten Durchführung: 20 Minuten Abbau/Entsorgung:: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz Pentahydrat
Versuchsprotokoll:Stärkespaltung Zeitaufwand: Aufbau: 5 Minuten Durchführung: 20 Minuten Abbau/Entsorgung:: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz Pentahydrat
Atomverbände. In stabilen Verbindungen, die auf der Erde existieren besitzen die Elemente meist die Elektronenkonfiguration
 Atomverbände Möglichkeit 1: Abgabe von Elektronen bei gleichzeitiger Aufnahme durch einen Reaktionspartner --> SALZE In stabilen Verbindungen, die auf der Erde existieren besitzen die Elemente meist die
Atomverbände Möglichkeit 1: Abgabe von Elektronen bei gleichzeitiger Aufnahme durch einen Reaktionspartner --> SALZE In stabilen Verbindungen, die auf der Erde existieren besitzen die Elemente meist die
Grundpraktikum für Biologen 2016
 Grundpraktikum für Biologen 2016 31.03.2016 Übersicht # 2 Kovalente Bindung Freies Elektronenpaar Einzelnes Elektron Oktett erfüllt Einzelne Chloratome haben einen Elektronenmangel Reaktion zu Cl 2 erfüllt
Grundpraktikum für Biologen 2016 31.03.2016 Übersicht # 2 Kovalente Bindung Freies Elektronenpaar Einzelnes Elektron Oktett erfüllt Einzelne Chloratome haben einen Elektronenmangel Reaktion zu Cl 2 erfüllt
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Julia Konen Name: Johannes Hergt Datum: 17.12.2010 Gruppe 9: Kohlenhydrate Versuch (Nachweis):
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Julia Konen Name: Johannes Hergt Datum: 17.12.2010 Gruppe 9: Kohlenhydrate Versuch (Nachweis):
Lernmaterial Lernfeld 1 Grundlagen Physik und Chemie. Chemische Grundlagen, Bindungsarten. Zu Erinnerung : Schematischer Aufbau eines Wasserstoffatoms
 Chemische Grundlagen, Bindungsarten Zu Erinnerung : Schematischer Aufbau eines Wasserstoffatoms Hier ist ein Lithiumatom schematisch dargestellt. Elektronen umkreisen den Kern in diskreten Bahnen IQ Technikum
Chemische Grundlagen, Bindungsarten Zu Erinnerung : Schematischer Aufbau eines Wasserstoffatoms Hier ist ein Lithiumatom schematisch dargestellt. Elektronen umkreisen den Kern in diskreten Bahnen IQ Technikum
Saure, neutrale und alkalische Reaktionen von Salzlösungen (Artikelnr.: P )
 Saure, neutrale und alkalische Reaktionen von Salzlösungen (Artikelnr.: P1145600) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Anorganische Chemie Unterthema:
Saure, neutrale und alkalische Reaktionen von Salzlösungen (Artikelnr.: P1145600) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Anorganische Chemie Unterthema:
Name: Punktzahl: von 57 Note:
 Testen Sie Ihr Wissen! Übungsprobe zu den Tertia-Themen und Säure-Base-Reaktionen Name: Punktzahl: von 57 Note: Für die folgenden Fragen haben Sie 60 Minuten Zeit. Viel Erfolg! Hilfsmittel: das ausgeteilte
Testen Sie Ihr Wissen! Übungsprobe zu den Tertia-Themen und Säure-Base-Reaktionen Name: Punktzahl: von 57 Note: Für die folgenden Fragen haben Sie 60 Minuten Zeit. Viel Erfolg! Hilfsmittel: das ausgeteilte
Elemente des Periodensystems. Natürliche Häufigkeit der Elemente
 Elemente des Periodensystems Natürliche Häufigkeit der Elemente 1 Der Wasserstoff Vorkommen Eigenschaften Gewinnung Verwendung Verbindungen 2 Vorkommen Interstellare Wasserstoffwolken Orion-Nebel und auf
Elemente des Periodensystems Natürliche Häufigkeit der Elemente 1 Der Wasserstoff Vorkommen Eigenschaften Gewinnung Verwendung Verbindungen 2 Vorkommen Interstellare Wasserstoffwolken Orion-Nebel und auf
Versuch: Blitze unter Wasser
 Philipps-Universität Marburg 25.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 1, Einführung in die OC Versuch: Blitze unter Wasser
Philipps-Universität Marburg 25.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 1, Einführung in die OC Versuch: Blitze unter Wasser
Anionen-Nachweis durch Fällungsreaktionen
 Lehrer-/Dozentenblatt Anionen-Nachweis durch Fällungsreaktionen (Artikelnr.: P7511300) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Allgemeine Chemie- Einführung
Lehrer-/Dozentenblatt Anionen-Nachweis durch Fällungsreaktionen (Artikelnr.: P7511300) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Allgemeine Chemie- Einführung
Alkalimetalle. 1. Alkalimetalle Die 1. Hauptgruppe des Periodensystems der Elemente [1-4]
![Alkalimetalle. 1. Alkalimetalle Die 1. Hauptgruppe des Periodensystems der Elemente [1-4] Alkalimetalle. 1. Alkalimetalle Die 1. Hauptgruppe des Periodensystems der Elemente [1-4]](/thumbs/31/14796766.jpg) Universität Regensburg Institut für Anorganische Chemie - Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsversuche im Wintersemester 2009/2010 20.11. 2009 Betreuung: Dr. M. Andratschke Referenten: Andreas
Universität Regensburg Institut für Anorganische Chemie - Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsversuche im Wintersemester 2009/2010 20.11. 2009 Betreuung: Dr. M. Andratschke Referenten: Andreas
Atomverbände. Möglichkeit 1: Abgabe von Elektronen bei gleichzeitiger Aufnahme durch einen Reaktionspartner SALZE
 Atomverbände Möglichkeit 1: Abgabe von Elektronen bei gleichzeitiger Aufnahme durch einen Reaktionspartner --> SALZE 1 Einstieg: Schreck lass nach! Dieser Winter hat viele Teile der Schweiz mit seinen
Atomverbände Möglichkeit 1: Abgabe von Elektronen bei gleichzeitiger Aufnahme durch einen Reaktionspartner --> SALZE 1 Einstieg: Schreck lass nach! Dieser Winter hat viele Teile der Schweiz mit seinen
Alle Stoffe bestehen aus kleinen Teilchen, die sich bewegen. Je mehr Energie sie besitzen, desto mehr bewegen sie sich.
 Grundwissen 8. Klasse 1. Stoffe und Teilchen Teilchenmodell: Atome Ionen Alle Stoffe bestehen aus kleinen Teilchen, die sich bewegen. Je mehr Energie sie besitzen, desto mehr bewegen sie sich. von atomos
Grundwissen 8. Klasse 1. Stoffe und Teilchen Teilchenmodell: Atome Ionen Alle Stoffe bestehen aus kleinen Teilchen, die sich bewegen. Je mehr Energie sie besitzen, desto mehr bewegen sie sich. von atomos
Grundwissen Chemie 8. Jahrgangsstufe
 Grundwissen Chemie 8. Jahrgangsstufe 1. Stoffeigenschaften und Teilchenmodell Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, die man sich am einfachsten als Kugeln vorstellen kann (Kugelteilchenmodell).
Grundwissen Chemie 8. Jahrgangsstufe 1. Stoffeigenschaften und Teilchenmodell Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, die man sich am einfachsten als Kugeln vorstellen kann (Kugelteilchenmodell).
NH 3. CCl 4 CO 2. Lösungen zur Lernzielkontrolle Sekunda. Hilfsmittel: PSE, Taschenrechner
 Lösungen zur Lernzielkontrolle Sekunda Hilfsmittel: PSE, Taschenrechner 1 Stoffklassen / Bindungslehre / Zwischenmolekulare Kräfte (1) 1.1 Elektrische Leitfähigkeit verschiedener Stoffe (3) leitfähig,
Lösungen zur Lernzielkontrolle Sekunda Hilfsmittel: PSE, Taschenrechner 1 Stoffklassen / Bindungslehre / Zwischenmolekulare Kräfte (1) 1.1 Elektrische Leitfähigkeit verschiedener Stoffe (3) leitfähig,
Kerncurriculum und Schulcurriculum (2 Wochenstunden) Themen und Inhalte. Bezug zu den Standards. Kerncurriculum / Schulcurriculum
 Chemie: Klasse 9 Kerncurriculum und Schulcurriculum (2 Wochenstunden) Zeit Themen und Inhalte Umsetzung Bezug zu den Standards Kerncurriculum / Schulcurriculum 10 Atombau und Periodensystem - Das Kern-Hülle-Modell
Chemie: Klasse 9 Kerncurriculum und Schulcurriculum (2 Wochenstunden) Zeit Themen und Inhalte Umsetzung Bezug zu den Standards Kerncurriculum / Schulcurriculum 10 Atombau und Periodensystem - Das Kern-Hülle-Modell
Repetitionen Chemie und Werkstoffkunde
 BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 2 Begriffe der Chemie und Werkstoffkunde Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1,
BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 2 Begriffe der Chemie und Werkstoffkunde Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1,
Repetitionen Chemie und Werkstoffkunde
 BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 2 Begriffe der Chemie und Werkstoffkunde Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1,
BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 2 Begriffe der Chemie und Werkstoffkunde Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1,
Periodensystem (PSE)
 Periodensystem (PSE) - Wie sind die Elemente im PSE angeordnet? - Warum und nach welchen Kritierien können sie so angeordnet werden? - Was kann man aus dem PSE ablesen, außer der Massenzahl? Fragen zum
Periodensystem (PSE) - Wie sind die Elemente im PSE angeordnet? - Warum und nach welchen Kritierien können sie so angeordnet werden? - Was kann man aus dem PSE ablesen, außer der Massenzahl? Fragen zum
Abschlussklausur Allgemeine und Anorganische Chemie Teil 2 (Geologie, Geophysik und Mineralogie)
 Abschlussklausur Allgemeine und Anorganische Chemie Teil 2 (Geologie, Geophysik und Mineralogie) Teilnehmer/in:... Matrikel-Nr.:... - 1. Sie sollen aus NaCl und Wasser 500 ml einer Lösung herstellen, die
Abschlussklausur Allgemeine und Anorganische Chemie Teil 2 (Geologie, Geophysik und Mineralogie) Teilnehmer/in:... Matrikel-Nr.:... - 1. Sie sollen aus NaCl und Wasser 500 ml einer Lösung herstellen, die
Versuch: Thermisches Cracken von Paraffinöl
 Philipps-Universität Marburg 21.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 2, Alkane Versuch: Thermisches Cracken von Paraffinöl
Philipps-Universität Marburg 21.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 2, Alkane Versuch: Thermisches Cracken von Paraffinöl
Gruppe 9 eigener Versuch. Reaktion von Saccharose und Schwefelsäure
 Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: err Dr. Reiß Datum: 3.06.09 SS 09 Gruppe 9 eigener Versuch Reaktion von Saccharose
Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: err Dr. Reiß Datum: 3.06.09 SS 09 Gruppe 9 eigener Versuch Reaktion von Saccharose
Chemieepoche Klasse 11. Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen
 Chemieepoche Klasse 11 Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen Eisengewinnung (Schülervortrag) Fortsetzung Chemische Bindungen Warum sind im Wassermolekül zwei Wasserstoffatome mit
Chemieepoche Klasse 11 Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen Eisengewinnung (Schülervortrag) Fortsetzung Chemische Bindungen Warum sind im Wassermolekül zwei Wasserstoffatome mit
Grundwissen 8.Klasse 1 Grundwissen 8.Klasse 1. Grundwissen 8.Klasse 2 Grundwissen 8.Klasse 2. Stoffebene. Teilchen -ebene
 Grundwissen 8.Klasse 1 Grundwissen 8.Klasse 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp., Löslichkeit,
Grundwissen 8.Klasse 1 Grundwissen 8.Klasse 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp., Löslichkeit,
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09. Name: Sarah Henkel Datum:
 Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah enkel Datum: 28.11.2008 Gruppe 3: Alkene, Alkine Versuch: omierung von
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah enkel Datum: 28.11.2008 Gruppe 3: Alkene, Alkine Versuch: omierung von
0.6 Einfache Modelle der chemischen Bindung
 0.6 Einfache Modelle der chemischen Bindung Ionenbindung Ionenbindungen entstehen durch Reaktion von ausgeprägt metallischen Elementen (Alkalimetalle und Erdalkalimetalle mit geringer Ionisierungsenergie)
0.6 Einfache Modelle der chemischen Bindung Ionenbindung Ionenbindungen entstehen durch Reaktion von ausgeprägt metallischen Elementen (Alkalimetalle und Erdalkalimetalle mit geringer Ionisierungsenergie)
[ ] 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe + - Moleküle aus gleichen Atomen. Ionen. Moleküle aus verschiedenen Atomen
![[ ] 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe + - Moleküle aus gleichen Atomen. Ionen. Moleküle aus verschiedenen Atomen [ ] 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe + - Moleküle aus gleichen Atomen. Ionen. Moleküle aus verschiedenen Atomen](/thumbs/68/58264490.jpg) 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe Gemische Reinstoffe Elemente Verbindungen gleiche Atome Moleküle aus gleichen Atomen Moleküle aus verschiedenen Atomen Ionen + Kation Anion z.b.
1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe Gemische Reinstoffe Elemente Verbindungen gleiche Atome Moleküle aus gleichen Atomen Moleküle aus verschiedenen Atomen Ionen + Kation Anion z.b.
Die elektrophile Addition
 Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Chemie Zusammenfassung III
 Chemie Zusammenfassung III Inhaltsverzeichnis Atombau & Kernphysik... 2 Aufbau der Atome... 2 Atomkern... 2 Atomhülle... 2 Atomgrösse und Kernladung... 3 Reaktivität und Gruppen des Periodensystems...
Chemie Zusammenfassung III Inhaltsverzeichnis Atombau & Kernphysik... 2 Aufbau der Atome... 2 Atomkern... 2 Atomhülle... 2 Atomgrösse und Kernladung... 3 Reaktivität und Gruppen des Periodensystems...
Stoffgemisch. Reinstoff. Homogenes Gemisch. Heterogenes Gemisch. ( 8. Klasse NTG 1 / 48 ) ( 8. Klasse NTG 2 / 48 ) ( 8. Klasse NTG 3 / 48 )
 Stoffgemisch ( 8. Klasse NTG 1 / 48 ) besteht aus zwei oder mehr verschiedenen Reinstoffen Gemisch unterschiedlicher kleinster Teilchen Trennung durch physikalische Methoden möglich Reinstoff ( 8. Klasse
Stoffgemisch ( 8. Klasse NTG 1 / 48 ) besteht aus zwei oder mehr verschiedenen Reinstoffen Gemisch unterschiedlicher kleinster Teilchen Trennung durch physikalische Methoden möglich Reinstoff ( 8. Klasse
Betriebsanweisung nach 20 Gefahrstoffverordnung. Verwendete Chemikalien /37/ Kupfer (Pulver) - -
 Versuche 85-91 3 Problemfeld Stoffkreisläufe Betriebsanweisung nach 20 Gefahrstoffverordnung Verwendete Chemikalien Bezeichnung R-Sätze S-Sätze Gefährlichkeits merkmale Ammoniumdiammintetrathiocyanatochromat(III)
Versuche 85-91 3 Problemfeld Stoffkreisläufe Betriebsanweisung nach 20 Gefahrstoffverordnung Verwendete Chemikalien Bezeichnung R-Sätze S-Sätze Gefährlichkeits merkmale Ammoniumdiammintetrathiocyanatochromat(III)
Musterprüfung Welche der Elemente Lithium, Kohlenstoff, Wasserstoff, Sauerstoff, Magnesium, Aluminium und Calcium sind Nichtmetalle?
 Module: Atombau und Periodensystem Chemische Bindungen Chemische Reaktionen 1 Musterprüfung 1. Teil: Atombau und Periodensystem 1.1. Welche Art von Teilchen befinden sich a) im Atomkern b) in der Elektronenhülle
Module: Atombau und Periodensystem Chemische Bindungen Chemische Reaktionen 1 Musterprüfung 1. Teil: Atombau und Periodensystem 1.1. Welche Art von Teilchen befinden sich a) im Atomkern b) in der Elektronenhülle
+ 2 [Ag(NH 3 ) 2 ]+ + 2 OH - 2 Ag + 4 NH 3. Versuch: Tollensprobe mit Glucose und Saccharose
![+ 2 [Ag(NH 3 ) 2 ]+ + 2 OH - 2 Ag + 4 NH 3. Versuch: Tollensprobe mit Glucose und Saccharose + 2 [Ag(NH 3 ) 2 ]+ + 2 OH - 2 Ag + 4 NH 3. Versuch: Tollensprobe mit Glucose und Saccharose](/thumbs/54/33374656.jpg) Philipps-Universität Marburg 27.01.2008 rganisches Grundpraktikum (LA) Katrin ohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 9, Kohlenhydrate Versuch: Tollensprobe mit Glucose
Philipps-Universität Marburg 27.01.2008 rganisches Grundpraktikum (LA) Katrin ohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 9, Kohlenhydrate Versuch: Tollensprobe mit Glucose
Schulversuch-Protokoll Jan gr. Austing
 Organisch-chemisches Praktikum für Studierende des Lehramts WS 06/07 Leitung: Prof. Hilt/ Dr. Reiß Schulversuch-Protokoll 6.1.007 Jan gr. Austing 1) Versuchsbezeichnung: Bromierung von Butan ) Reaktionsgleichung:
Organisch-chemisches Praktikum für Studierende des Lehramts WS 06/07 Leitung: Prof. Hilt/ Dr. Reiß Schulversuch-Protokoll 6.1.007 Jan gr. Austing 1) Versuchsbezeichnung: Bromierung von Butan ) Reaktionsgleichung:
Zuusammenfassung Klasssenarbeit Chemie
 Zuusammenfassung Klasssenarbeit Chemie Moritz F. Kuntze 10. November 2016 1 Inhaltsverzeichnis 1 Wertigkeit 3 1.1 Bestimmung der Wertigkeit......................... 3 1.2 Nutzen der Wertigkeit............................
Zuusammenfassung Klasssenarbeit Chemie Moritz F. Kuntze 10. November 2016 1 Inhaltsverzeichnis 1 Wertigkeit 3 1.1 Bestimmung der Wertigkeit......................... 3 1.2 Nutzen der Wertigkeit............................
Schmelzpunkt als NaI (660 C)? Antworten: a) Brom ist giftiger als Iod (=> Posten 5c) b) Ladungenn sind grösser beim Brom als
 Posten 1a Wieso hat NaBr (747 C) einen höheren Schmelzpunkt als NaI (660 C)? a) Brom ist giftiger als Iod (=> Posten 5c) b) Ladungenn sind grösser beim Brom als beim Iod (=> Posten 13q) c) Abstand zwischen
Posten 1a Wieso hat NaBr (747 C) einen höheren Schmelzpunkt als NaI (660 C)? a) Brom ist giftiger als Iod (=> Posten 5c) b) Ladungenn sind grösser beim Brom als beim Iod (=> Posten 13q) c) Abstand zwischen
Musterprüfung Welche der Elemente Lithium, Kohlenstoff, Wasserstoff, Sauerstoff, Magnesium, Aluminium und Calcium sind Nichtmetalle?
 1 Module: Atombau und Periodensystem Chemische Bindungen Chemische Reaktionen Musterprüfung 1. Teil: Atombau und Periodensystem 1.1. Welche Art von Teilchen befinden sich a) im Atomkern b) in der Elektronenhülle
1 Module: Atombau und Periodensystem Chemische Bindungen Chemische Reaktionen Musterprüfung 1. Teil: Atombau und Periodensystem 1.1. Welche Art von Teilchen befinden sich a) im Atomkern b) in der Elektronenhülle
Welches Element / Ion hat die Elektronenkonfiguration 1s 2 2s 2 2p 6 3s 2 3p 6. Geben Sie isoelektronische Ionen zu den folgenden Atomen an
 Übung 05.11.13 Welches Element / Ion hat die Elektronenkonfiguration 1s 2 2s 2 2p 6 Ne / F - / O 2- / N 3- / Na + / Mg 2+ / Al 3+. Welches Element / Ion hat die Elektronenkonfiguration 1s 2 2s 2 2p 6 3s
Übung 05.11.13 Welches Element / Ion hat die Elektronenkonfiguration 1s 2 2s 2 2p 6 Ne / F - / O 2- / N 3- / Na + / Mg 2+ / Al 3+. Welches Element / Ion hat die Elektronenkonfiguration 1s 2 2s 2 2p 6 3s
Grundwissen C8 NTG. 1. Stoffe und Reaktionen. Reinstoff
 Grundwissen C8 NTG 1. Stoffe und Reaktionen Reinstoff Stoffgemisch - besitzt unter bestimmten Bedingungen (z.b. Temperatur, Druck ) kennzeichnende Eigenschaften, z.b. Farbe, Geruch, Geschmack, Dichte,
Grundwissen C8 NTG 1. Stoffe und Reaktionen Reinstoff Stoffgemisch - besitzt unter bestimmten Bedingungen (z.b. Temperatur, Druck ) kennzeichnende Eigenschaften, z.b. Farbe, Geruch, Geschmack, Dichte,
Schulversuchspraktikum. Name: Jennifer Kölling. Sommersemester: Klassenstufen: 9/10. Salze
 Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 9/10 Salze 1 Schulversuchspraktikum 1 Auf einen Blick:. Die Thematik der Salze ist sehr umfangreich. Die hier dargestellten
Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 9/10 Salze 1 Schulversuchspraktikum 1 Auf einen Blick:. Die Thematik der Salze ist sehr umfangreich. Die hier dargestellten
Versuchsprotokoll. Reaktion von Natrium mit Ethanol
 Anna-Lena Eicke Philipps-Universität Marburg Organisch-Chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 26.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Reaktion von Natrium mit Ethanol
Anna-Lena Eicke Philipps-Universität Marburg Organisch-Chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 26.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Reaktion von Natrium mit Ethanol
Werkstoffkunde Chemische Bindungsarten
 Folie 1/27 Die Elektronen auf der äußersten Schale eines Atoms (Außenelektronen oder Valenzelektronen genannt) bestimmen maßgeblich die chemischen Eigenschaften. Jedes Atom hat dabei das Bestreben die
Folie 1/27 Die Elektronen auf der äußersten Schale eines Atoms (Außenelektronen oder Valenzelektronen genannt) bestimmen maßgeblich die chemischen Eigenschaften. Jedes Atom hat dabei das Bestreben die
Philipps-Universität Marburg Organisch-chemisches Praktikum für das Lehramt (LA) Torsten Lasse Leitung: Dr. P. Reiß Assistentin: Beate Abé
 Philipps-Universität Marburg 14.11.2008 rganisch-chemisches Praktikum für das Lehramt (LA) Torsten Lasse Leitung: Dr. P. Reiß WS 2008/09 Assistentin: Beate Abé Schulversuch (Gruppe 4/Assistentenversuch):
Philipps-Universität Marburg 14.11.2008 rganisch-chemisches Praktikum für das Lehramt (LA) Torsten Lasse Leitung: Dr. P. Reiß WS 2008/09 Assistentin: Beate Abé Schulversuch (Gruppe 4/Assistentenversuch):
Grundwissen 9.Klasse SG 1 Grundwissen 9.Klasse SG 1. Grundwissen 9.Klasse SG 2 Grundwissen 9.Klasse SG 2. Stoffebene.
 Grundwissen 9.Klasse SG 1 Grundwissen 9.Klasse SG 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp.,
Grundwissen 9.Klasse SG 1 Grundwissen 9.Klasse SG 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp.,
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Julia Konen Name: Johannes Hergt Datum: 14.12.2010 Gruppe 9: Kohlenhydrate Versuch (Assi):
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Julia Konen Name: Johannes Hergt Datum: 14.12.2010 Gruppe 9: Kohlenhydrate Versuch (Assi):
erweiterter Redoxbegriff
 Schulversuchspraktikum Thomas Polle Sommersemester 2015 Klassenstufen 7 & 8 erweiterter Redoxbegriff 2 Auf einen Blick: Der erweiterte Redoxbegriff beschreibt die Redoxreaktion als Elektronenübertragungsreaktion,
Schulversuchspraktikum Thomas Polle Sommersemester 2015 Klassenstufen 7 & 8 erweiterter Redoxbegriff 2 Auf einen Blick: Der erweiterte Redoxbegriff beschreibt die Redoxreaktion als Elektronenübertragungsreaktion,
Voransicht. Ein Übungszirkel zum Thema Salzbildung. Hintergrundinformationen. Jolanda Hermanns, Potsdam
 Ein Übungszirkel zum Thema Salzbildung Jolanda Hermanns, Potsdam Niveau: Dauer: Sek. I 6 Unterrichtsstunden Bezug zu den KMK-Bildungsstandards Fachkompetenz: Anwendung und Verknüpfung von Inhalten aus
Ein Übungszirkel zum Thema Salzbildung Jolanda Hermanns, Potsdam Niveau: Dauer: Sek. I 6 Unterrichtsstunden Bezug zu den KMK-Bildungsstandards Fachkompetenz: Anwendung und Verknüpfung von Inhalten aus
Schulversuchspraktikum. Till Beuermann. Sommersemester Klassenstufen 9 & 10. Alkalimetalle
 Schulversuchspraktikum Till Beuermann Sommersemester 2013 Klassenstufen 9 & 10 Alkalimetalle 1 Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Dieses Protokoll beschäftigt sich mit
Schulversuchspraktikum Till Beuermann Sommersemester 2013 Klassenstufen 9 & 10 Alkalimetalle 1 Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Dieses Protokoll beschäftigt sich mit
Einheiten und Einheitenrechnungen
 Chemie für Studierende der Human- und Zahnmedizin WS 2013/14 Übungsblatt 1: allgemeine Chemie, einfache Berechnungen, Periodensystem, Orbitalbesetzung, Metalle und Salze Einheiten und Einheitenrechnungen
Chemie für Studierende der Human- und Zahnmedizin WS 2013/14 Übungsblatt 1: allgemeine Chemie, einfache Berechnungen, Periodensystem, Orbitalbesetzung, Metalle und Salze Einheiten und Einheitenrechnungen
2. Verhalten der Elemente bei einer Reaktion: Warum funkt s bei unterschiedlichen
 1. Atombau und Periodensystem 1a) Nach welchem Gesichtspunkt sind die Elemente im Periodensystem von 1- ca. 103 angeordnet? 1b) Nach welchem Gesichtspunkt ist ein Element einer PERIODE zugeordnet? 1c)
1. Atombau und Periodensystem 1a) Nach welchem Gesichtspunkt sind die Elemente im Periodensystem von 1- ca. 103 angeordnet? 1b) Nach welchem Gesichtspunkt ist ein Element einer PERIODE zugeordnet? 1c)
Chemie-Grundwissen der 9.Klasse
 Chemie-Grundwissen der 9.Klasse Stoffebene = Makroskopische (sichtbare) Ebene Betrachtung einer Stoffportion mit den erkennbaren und messbaren Eigenschaften Teilchenebene = Submikroskopische Ebene Betrachtung
Chemie-Grundwissen der 9.Klasse Stoffebene = Makroskopische (sichtbare) Ebene Betrachtung einer Stoffportion mit den erkennbaren und messbaren Eigenschaften Teilchenebene = Submikroskopische Ebene Betrachtung
Die Stoffteilchen (II): Ionengruppen und ihre Ionen
 Die Stoffteilchen (II): Ionengruppen und ihre Ionen Ionen sind die Bausteine der Ionengruppen, den gedachten Stoffteilchen der Salze. Was haben Ionengruppen mit der Formel von Salzen zu tun? DARUM GEHT
Die Stoffteilchen (II): Ionengruppen und ihre Ionen Ionen sind die Bausteine der Ionengruppen, den gedachten Stoffteilchen der Salze. Was haben Ionengruppen mit der Formel von Salzen zu tun? DARUM GEHT
bestimmte mehratomige Anionen mit Sauerstoff werden mit dem lateinischen Namen benannt und enden auf at.
 DIE BINDUNGSARTEN UND DAS PERIODENSYSTEM 1) IONISCHE VERBINDUNGEN SALZE Wenn die Atome Ionen bilden, haben sie meist die gleiche Elektronenzahl, wie das nächstgelegene neutrale Edelgas. Na bildet dann
DIE BINDUNGSARTEN UND DAS PERIODENSYSTEM 1) IONISCHE VERBINDUNGEN SALZE Wenn die Atome Ionen bilden, haben sie meist die gleiche Elektronenzahl, wie das nächstgelegene neutrale Edelgas. Na bildet dann
Gruppe 1 Pflichtversuch. Qualitative Analyse: Nachweis von Kohlenstoff als Kohlendioxid
 Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 19.05.09 SS 09 Gruppe 1 Pflichtversuch Qualitative Analyse: Nachweis
Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 19.05.09 SS 09 Gruppe 1 Pflichtversuch Qualitative Analyse: Nachweis
