Institut für Geologie Lehrstuhl für Hydrogeologie. Vorlesung Grundwasserbeschaffenheit
|
|
|
- Benedikt Klein
- vor 7 Jahren
- Abrufe
Transkript
1 Institut für Geologie Lehrstuhl für Hydrogeologie Vorlesung Grundwasserbeschaffenheit 1. H 2 O Grundlagen Thermodynamik 2. Lösung / Fällung Silicium, Aluminium 3. Natrium, Kalium Ionenaustausch 4. Kohlenstoff Henry-Gesetz 5. lcium, Magnesium Wasserhärte, KKG Prof. B. Merkel, Dipl.-Geoökol. M. Schipek www: Vorlesungsunterlagen 1
2 Literaturhinweise Merkel & Sperling 1996 Merkel & Planer- Friedrich 2008 / 2002 Appelo & Postma 1999 Sigg & Stumm aus Gesteinen (geogen) Element-Verteilung in Erdkruste [Gew%] Si 26% Al 8% Fe 4% O 50% 3% Mg 2% Na 2% K 2% alle anderen 3% die häufigsten Elemente 2
3 lcium, Magnesium Mg : 3.6 % Mg: 2.1 % 5. häufigstes Element 8. häufigstes Element Vorkommen: Gesteinsbildende Minerale Austauscherbelegung Tonminerale, Hydroxide, org. Komplexe : Bindemittel in Sandsteinen : Gips, Apatit, Halide Mg: vorrangig in magmatischen Gesteinen Geogene Herkunft von Gesteinsbildende Minerale Magmat. Gesteine: Feldspäte, Pyroxene, Amphibole Labradorit (-Feldspat) Metam. Gesteine: Diopsid, Enstatit Sedimentgesteine: rbonate, Sulfate, Oxide, Hydroxide Diopsid Gips (Anhydrit) 3
4 Horn & Adams Geogene Herkunft von Mg Gesteinsbildende Minerale Magmat. Gesteine: Olivin, Pyroxene, Amphibole, Glimmer Olivin Metam. Gesteine: Chlorite, Serpentinite Biotit Sedimentgesteine: Chlorite, Dolomit, Magnesium-lcite, Brucit Brucit Elementverteilung Gesteine 4
5 Anthropogene Herkunft von, Mg Mg Löschkalk, Gips, Zement Glas lciumcarbid Legierungen Thermische Reduktion von Metallverbindungen Kathode in Batterien MgO feuerfestes Material, keramischer Wärmespeicher Mg 3 (PO 4 ) 2 und Dolomit Dünger lcium, Magnesium Mg keine Toxizität, sondern essentiell keine Grenzwerte in TrinkwV 2001 und EPA 2002 Verweilzeit im Ozean: 10 6 a Mg 10 7 a 5
6 (SCHLEYER & KERNDORFF 1992) lcium-, Magnesium-Spezies 2+ CO 30, HCO + 3 SO 0, 4 HSO + 4 OH + (CH 3 COO) 20, (CH 3 COO) + B(OH) + 4 Cl +, Cl 20, F + H 2 PO 4+, HPO 40, P 2 O 7 PO - 4 NO + 3 Mg 2+ MgCO 30, MgHCO + 3 MgSO 40, MgHSO + 4 MgOH + lcium, Magnesium in Wasser Aquifer [mg/l] Mg [mg/l] Lockergesteine Kalk/Dolomit Buntsandstein Festgesteine
7 lcium-isotope Isotop Vorkom men % Atommasse Zerfallsart Halbwertszeit stabil stabil stabil stabil b - stabil b - stabil b d 4.7 d 8.8 min Magnesium-Isotope Isotop 23 Mg 24 Mg 25 Mg 26 Mg 27 Mg 28 Mg Atommasse Vorkommen % Zerfallsart b + stabil stabil stabil b - b - Halbwerts-zeit 12 s 9.5 min 21.3 h 7
8 Wasserhärte 1 d (deutsch) 10 mg/l O 1 f (französisch) 10 mg/l CO 3 1 e (englisch) 10 mg CO 3 in 0.7 L 1 a (USA) 1 mg/l CO 3 Gesamthärte rbonathärte + Nichtcarbonathärte Wasserhärte 1 d = 10mg/l O 10mg/L : 56mg/mmol = mmol/L mmol/l * 2 = meq/l 2+ 1 mmol/l = 5.6 dh 1 meq/l = 2.8 dh 8
9 Härtebereiche (Gesamthärte) 1 dh meq/l Bereich <4 < 1,43 sehr weich 4-8 1,43-2,86 weich ,86-4,28 mittelhart 118 4,28-6,42 ziemlich hart ,42-10,72 hart >30 > 10,72 sehr hart Härtestufen Waschmittelgesetz 1 dh meq/l Härtebereich < 7,3 < 2,6 1 7,3-14 2,6 5, ,3 5,0 7,6 3 > 21,3 > 7,6 4 9
10 Kalk-Kohlensäuregleichgewicht: Definition = weder Kalklösung noch Kalkausscheidung veraltete Begriffe: gebundene Kohlensäure freie zugehörige Kohlensäure überschüssige Kohlensäure kalkaggressive Kohlensäure rostschutzverhindernde Kohlensäure Kalk-Kohlensäuregleichgewicht: Temperaturabhängigkeit Abhängigkeit Kalklösung von Temperatur PhreeqC-Database (Wateq4F): lcite 12 CO3 = +2 + CO3-2 log_k (Löslichkeitsprodukt) delta_h kcal (Enthalpie) AB = A + B (MWG) mit K h = negativ G < 0 (Gibbs sche freie Energie), da - G = -R*T*lnK (R: allg. Gaskonstante, T: Temperatur, lnk: Log. Löslichkeitsprodukt) d.h. mit steigender Temperatur (T ) nimmt der Logarithmus des Löslichkeitsproduktes ab (lnk ) und somit auch die Löslichkeitskonstante/Komplexbildungskonste K (K ) Temperatur = Minerallöslichkeit (exotherme Reaktion!) 10
11 Kalk-Kohlensäuregleichgewicht: Abhängigkeit der lcit-lösung Kalk-Kohlensäuregleichgewicht: Abhängigkeit der lcit-lösung CO CO 3 H 2 O H + + OH - CO 3 + H + HCO 3 - Erhöhung von H + Verbrauch CO 3 CO 3 löst sich Erhöhung von H + möglich: durch Zugabe von Säure (HCl, H 2 SO 4, HNO 3 ) aber auch von CO 2 11
12 Konzentration [mmol/l] Kalk-Kohlensäuregleichgewicht: Abhängigkeit der lcit-lösung CO 2 + H 2 O H 2 CO 3 H + + HCO 3-1% je mehr CO 2 desto mehr CO 3 löst sich p(co 2 ) = Löslichkeit CO 3 aber: Löslichkeit von Gasen in Wasser auch abhängig von der Temperatur: Temperatur = Löslichkeit von Gasen Temperatur = Löslichkeit CO 3 lcit Lösung in Abhängigkeit von p(co 2 ) und Temperatur Temperatur [ C] lcit-lösung Temperatur p(co 2 ) 0 0,03 5 0,5 8 0, ,
13 Lösung und Fällung von Kalk Warum bildet sich die Höhle? Warum bilden sich dann plötzlich Stalagmiten und Stalagtiten? lcit - Lösung in Abh. von p(co 2 ) offenes / geschlossenes System CO 2 CO 2 CO 2 Wasser lcit Wasser lcit Wo löst sich mehr lcit? offenes System: geschlossenes System: Materie- und Energie-Austausch Energie-Austausch 13
14 Konzentration [mmol/l] lcit - Lösung in Abh. von p(co 2 ) offenes / geschlossenes System CO 2 CO 2 CO 2 Umgebungsdruck 2 Vol%: 20 Vol%: Wasser lcit Entgasung von 3.4 Vol% auf 2 Vol% Gasanstieg von 3.4 Vol% auf 20 Vol% Beispiel: Wasser CO Vol% Wasser lcit kaum Entgasung (von 3.4 auf 2.95 Vol%) kaum Gasanstieg (von 3.4 Vol% auf Vol%) lcit Lösung bei gleichzeitiger Anwesenheit von Dolomit Tem peratur [ C] lcit allein Dolom it lcit 14
15 Berechnung lcit-lösung nach MWG CO CO 3 log k = K 2+ CO CO 3 3 LP { 2+ } {CO 3 } da { 2+ } = {CO 3 } LP {CO 3 } } {CO {CO3 } mol/l mmol/l Molmasse CO 3 : = 60 g/mol; Molmasse 2+ = 40 g/mol mmol/l 60 mg/mmol = 3.42 mg/l mmol/l 40 mg/mmol = 2.28 mg/l richtig? Aktivitäten! Umrechnung Aktivität - Konzentration a i f i c i 2 I 0.5 c i z i 15
16 Debye-Hückel-Gleichung (1923) log( f ) -A z I I < 0,005 mol/kg i 2 i Güntelberg-Gleichung (1926) 2 log( fi) -0,5zi 1 + 1,4 Davies-Gleichung (1962, 1938) 2 log( fi) -A zi ( - 0,3 I) 1+ WATEQ Debye-Hückel-Gleichung (1974) 2 -A zi I log( fi) + bi I 1+ B a I i I I I I I < 0,1 mol/kg I < 0,5 mol/kg I < 1,0 mol/kg Ionendissoziationstheorie endet spätestens bei 1 mol/kg! Interaktionstheorie: Ionenstärke > 1 mol/kg, z.b. hochsalinare Wässer Pitzer-Gleichung (1973) Ionendissoziationstheorie Erweiterte Debye-Hückel-Gleichung 2 -A zi I log( fi) I < 0,1 mol/kg 1 + B a I i Berechnung I 1 = 0.5 c i z i 2 = = 0.5 (0.057 mmol/l mmol/l 2 2 ) = mmol/l = = mol/l Umrechnung Aktivität - Konzentration f i = a i = f i c i c i = a i : f i c i = mmol/l : = mmol/l 16
17 Umrechnung Aktivität - Konzentration I 2 = 0.5 ( mmol/l 4 2) = mmol/l f i = c i = mmol/l : = mmol/l I 3 = 0.5 ( mmol/l 4 2) = mmol/l f i = 0.93 c i = mmol/l : 0.93 = mmol/l usw. Ergebnis: Aktivität = mmol/l Konzentration = mmol/l CO 3 nicht 3.42 mg/l sondern 3.66 mg/l 2+ nicht 2.28 mg/l sondern 2.44 mg/l richtig? Folge-/ Parallel-Reaktionen CO 3(s) 2+ + CO 3 H 2 O H + + OH - CO 3 + H + HCO CO 3 CO HCO 3 - HCO OH - OH + CO 2(g) CO 2(aq) CO 2(aq) + H 2 O HCO 3- + H + 17
18 Kalk-Kohlensäuregleichgewicht: Bestimmung Marmorlösungsversuch nach HEYER (DIN C-10-2) CO Berechnung 3 nach Langelier 2+ + CO / Tillmann 3 Formeln CO 3 + H + HCO - 3 Thermodynamische Berechnung des phc Thermodynamische Berechnung des Sättigungsindex Relevanz des KKG in der Wasserversorgung Leitungsnetz = bis zu 90% des Investments einer Wasserversorgung weder Kalkausfällung und Rohrkorrosion erwünscht Maßnahmen: Offene und geschlossene Belüftung Aufsättigung Mischen 18
19 Kalk-Kohlensäure-Gleichgewicht: Kinetik Bestimmung Lösungskinetik 19
20 Zusammenfassung Zusammenfassung 20
1. H 2 O Grundlagen Thermodynamik 2. Lösung / Fällung Silicium, Aluminium 3. Natrium, Kalium Ionenaustausch
 Institut für Geologie Lehrstuhl für Hydrogeologie Vorlesung Grundwasserbeschaffenheit 1. H 2 O Grundlagen Thermodynamik 2. Lösung / Fällung Silicium, Aluminium 3. trium, Kalium Ionenaustausch Prof. B.
Institut für Geologie Lehrstuhl für Hydrogeologie Vorlesung Grundwasserbeschaffenheit 1. H 2 O Grundlagen Thermodynamik 2. Lösung / Fällung Silicium, Aluminium 3. trium, Kalium Ionenaustausch Prof. B.
Voraussetzung für Teilnahme: V Grundwasserbeschaffenheit
 Institut für Geologie Lehrstuhl für Hydrogeologie Seminar WS 2008/09 Hydrogeochemische Modellierung mit PhreeqC begleitende Übung zur Vorlesung Grundwasserbeschaffenheit Prof. B. Merkel, Dipl.-Geoökol.
Institut für Geologie Lehrstuhl für Hydrogeologie Seminar WS 2008/09 Hydrogeochemische Modellierung mit PhreeqC begleitende Übung zur Vorlesung Grundwasserbeschaffenheit Prof. B. Merkel, Dipl.-Geoökol.
zum per mail an:
 Institut für Geologie Lehrstuhl für Hydrogeologie Blockkurs Geowissenschaftliches Modellieren SS 2009 Modul: Hydrogeochemische Modellierung mit PhreeqC Prof. B. Merkel, Dipl.-Geoökol. M. Schipek Anmerkungen
Institut für Geologie Lehrstuhl für Hydrogeologie Blockkurs Geowissenschaftliches Modellieren SS 2009 Modul: Hydrogeochemische Modellierung mit PhreeqC Prof. B. Merkel, Dipl.-Geoökol. M. Schipek Anmerkungen
Prof. Dr. Christian Wolkersdorfer
 Prof. Dr. Christian Wolkersdorfer Abriss der Hydrogeologie Wechselwirkungen Wasser Gestein Veranstaltung im Wintersemester 2008/2009 Präsentation basiert auf Einführung Hydrogeologie Prof. Dr. habil Broder
Prof. Dr. Christian Wolkersdorfer Abriss der Hydrogeologie Wechselwirkungen Wasser Gestein Veranstaltung im Wintersemester 2008/2009 Präsentation basiert auf Einführung Hydrogeologie Prof. Dr. habil Broder
Temperatur Wasser C i.o. Gesamthärte mmol/l 3.21 hart siehe Abs. 2.2 Kalziumhärte mmol/l 2.65 nicht i.o. Magnesiumhärte mmol/l 0.68 nicht i.o.
 1. Wasseranalyse 2.1 Ergebniss-Angaben Wasserversorgung Strengelbach Wichtige Daten für die Bestimmung der Materialien. Temperatur Wasser C 10.00 i.o. Gesamthärte mmol/l 3.21 hart siehe Abs. 2.2 Kalziumhärte
1. Wasseranalyse 2.1 Ergebniss-Angaben Wasserversorgung Strengelbach Wichtige Daten für die Bestimmung der Materialien. Temperatur Wasser C 10.00 i.o. Gesamthärte mmol/l 3.21 hart siehe Abs. 2.2 Kalziumhärte
Lösung Sauerstoff: 1s 2 2s 2 2p 4, Bor: 1s 2 2s 2 2p 1, Chlor: 1s 2 2s 2 2p 6 3s 2 3p 5 Neon: 1s 2 2s 2 2p 6
 1 of 6 10.05.2005 10:56 Lösung 1 1.1 1 mol Natrium wiegt 23 g => 3 mol Natrium wiegen 69 g. 1 mol Na enthält N A = 6.02 x 10 23 Teilchen => 3 mol enthalten 1.806 x 10 24 Teilchen. 1.2 Ein halbes mol Wasser
1 of 6 10.05.2005 10:56 Lösung 1 1.1 1 mol Natrium wiegt 23 g => 3 mol Natrium wiegen 69 g. 1 mol Na enthält N A = 6.02 x 10 23 Teilchen => 3 mol enthalten 1.806 x 10 24 Teilchen. 1.2 Ein halbes mol Wasser
Inhaltsverzeichnis 1 Theorie...1
 Inhaltsverzeichnis 1 Theorie...1 1.1 Gleichgewichtsreaktionen...1 1.1.1 Einführung...1 1.1.2 Thermodynamische Grundlagen...5 1.1.2.1 Massenwirkungsgesetz...5 1.1.2.2 Gibbs sche freie Energie...7 1.1.2.3
Inhaltsverzeichnis 1 Theorie...1 1.1 Gleichgewichtsreaktionen...1 1.1.1 Einführung...1 1.1.2 Thermodynamische Grundlagen...5 1.1.2.1 Massenwirkungsgesetz...5 1.1.2.2 Gibbs sche freie Energie...7 1.1.2.3
Zentrale Trinkwasserenthärtung in der Gemeinde Aidlingen
 Untersuchung zur Möglichkeit einer zentralen Trinkwasserenthärtung in der Gemeinde Zentrale Trinkwasserenthärtung in der Gemeinde 1 Themenübersicht Übersicht über die Wasserversorgung Grundlagen zum Kalk-
Untersuchung zur Möglichkeit einer zentralen Trinkwasserenthärtung in der Gemeinde Zentrale Trinkwasserenthärtung in der Gemeinde 1 Themenübersicht Übersicht über die Wasserversorgung Grundlagen zum Kalk-
Anlage 7.1. Schmidt und Partner - Beratende Hydrogeologen BDG - Beratende Ingenieure VBI Calciumcarbonatsättigung nach Osningstr.
 CVUA Probenahmeort/Probenahmedatum Quelle 1, 27.05.2015 Probenahmestelle/Probenbezeichnung Quelle 1, 27.05.2015 Bezeichnung Ergebnisse Quelle 1, 27.05.2015 Datum 11.04.16; 12:46 Bewertungstemperatur (tb)
CVUA Probenahmeort/Probenahmedatum Quelle 1, 27.05.2015 Probenahmestelle/Probenbezeichnung Quelle 1, 27.05.2015 Bezeichnung Ergebnisse Quelle 1, 27.05.2015 Datum 11.04.16; 12:46 Bewertungstemperatur (tb)
Seminar Hydrogeochemische Modellierung WS 07/08_Block_I_
 Institut für Geologie Lehrstuhl für Hydrogeologie Seminar WS 07/08 Hydrogeochemische Modellierung mit PhreeqC begleitende Übung zur Vorlesung Grundwasserbeschaffenheit Prof. B. Merkel, Dipl.-Geol. A. Berger
Institut für Geologie Lehrstuhl für Hydrogeologie Seminar WS 07/08 Hydrogeochemische Modellierung mit PhreeqC begleitende Übung zur Vorlesung Grundwasserbeschaffenheit Prof. B. Merkel, Dipl.-Geol. A. Berger
Säurekapazität in der Belebung einer Kläranlage
 LV Bayern, Besprechung der Lehrer Kläranlagen-Nachbarschaft 2014 Säurekapazität in der Belebung einer Kläranlage Dipl.-Ing. Annette Schlicher, Struktur- und Genehmigungsdirektion Süd, Regionalstelle Wasserwirtschaft,
LV Bayern, Besprechung der Lehrer Kläranlagen-Nachbarschaft 2014 Säurekapazität in der Belebung einer Kläranlage Dipl.-Ing. Annette Schlicher, Struktur- und Genehmigungsdirektion Süd, Regionalstelle Wasserwirtschaft,
Prüfbericht. Untersuchungsergebnisse der Parameter nach TrinkwV. Anlage 1-4, vom Gladenbach-Rachelshausen
 Betreiber : Messstellen- (HLfU) : 7101 Probenart : U-13 U13 Untersuchungs- (Labor) : B141770/CH140527 TrinkwV. Anlage 1, Teil I Parameter Einheit Prüfergebnis GW 1) BG 2) Verfahren 2. Enterokokken KBE/100ml
Betreiber : Messstellen- (HLfU) : 7101 Probenart : U-13 U13 Untersuchungs- (Labor) : B141770/CH140527 TrinkwV. Anlage 1, Teil I Parameter Einheit Prüfergebnis GW 1) BG 2) Verfahren 2. Enterokokken KBE/100ml
DEFINITIONEN REINES WASSER
 SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13
 Kantonsschule Kreuzlingen, Klaus Hensler Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13 Grundregeln für stöchiometrische Berechnungen Wenn es um Reaktionen geht zuerst die chem. Gleichung aufstellen
Kantonsschule Kreuzlingen, Klaus Hensler Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13 Grundregeln für stöchiometrische Berechnungen Wenn es um Reaktionen geht zuerst die chem. Gleichung aufstellen
Der Zusammenhang zwischen Flockung und Säurekapazität
 Der Zusammenhang zwischen Flockung und Säurekapazität Februar 2015 SBF, Ulrich Klatte 1 Säurekapazität Grundlagen Säurekapazität Definition: Säurekapazität K s ist das Aufnahmevermögen eines Wassers für
Der Zusammenhang zwischen Flockung und Säurekapazität Februar 2015 SBF, Ulrich Klatte 1 Säurekapazität Grundlagen Säurekapazität Definition: Säurekapazität K s ist das Aufnahmevermögen eines Wassers für
HA + B A - + HB + Säuren und Basen. Definition nach Brønsted: Eine Säure ist ein Protonen-Donor, eine Base ein Protonen-Akzeptor!
 Säuren und Basen Definition nach Brønsted: Eine Säure ist ein Protonen-Donor, eine Base ein Protonen-Akzeptor! Die Tendenz ein Proton abzuspalten (Säure) bzw. aufzunehmen (Base) bezeichnet man als Säure-
Säuren und Basen Definition nach Brønsted: Eine Säure ist ein Protonen-Donor, eine Base ein Protonen-Akzeptor! Die Tendenz ein Proton abzuspalten (Säure) bzw. aufzunehmen (Base) bezeichnet man als Säure-
Gesteinskunde. Bestimmung magmatischer Minerale. Christopher Giehl, Uni Tübingen 20.10.2011
 Gesteinskunde Bestimmung magmatischer Minerale Christopher Giehl, Uni Tübingen 20.10.2011 Christopher Giehl (Universität Tübingen) 20.10.2011 1 / 18 1 Wiederholung 2 Klassifikation magmatischer Gesteine
Gesteinskunde Bestimmung magmatischer Minerale Christopher Giehl, Uni Tübingen 20.10.2011 Christopher Giehl (Universität Tübingen) 20.10.2011 1 / 18 1 Wiederholung 2 Klassifikation magmatischer Gesteine
Chemie für Geowissenschaftler. SSem Wiederholungsklausur. Datum
 Chemie für Geowissenschaftler SSem 2009 Wiederholungsklausur Datum 15.10.2009 Name: Vorname: Matr.-Nr.: Erreichte Punktzahl: 1. Am Ozeanboden wird Methangas durch sulfat-reduzierende Bakterien in Hydrogen-carbonat
Chemie für Geowissenschaftler SSem 2009 Wiederholungsklausur Datum 15.10.2009 Name: Vorname: Matr.-Nr.: Erreichte Punktzahl: 1. Am Ozeanboden wird Methangas durch sulfat-reduzierende Bakterien in Hydrogen-carbonat
Übung 6 Plausibilitätstest Gruppe 1, 4
 Übung 6 Plausibilitätstest Gruppe 1, 4 Gegeben ist folgende Wasseranalyse [Konzentrationen in mg/l]: LF 390 µs/cm temp 71.6 ph.1 pe 9.4 F.1 Cl 30 Br 0.17 N(+5) 0.018 as NO3- S(+6) 1350 as SO4- C(+4) 3.5
Übung 6 Plausibilitätstest Gruppe 1, 4 Gegeben ist folgende Wasseranalyse [Konzentrationen in mg/l]: LF 390 µs/cm temp 71.6 ph.1 pe 9.4 F.1 Cl 30 Br 0.17 N(+5) 0.018 as NO3- S(+6) 1350 as SO4- C(+4) 3.5
Hydrogeochemische Modellierung mit PhreeqC
 ( Blockkurs Geowissenschaftliches Modellieren (01. 03.04.2009) Aufgabe 1: Erhöhung CO 2 -Gehalt in der Atmosphäre durch Änderung der Lufttemperatur? Aus vielen Untersuchungen (z.b. an Eiskernen) wissen
( Blockkurs Geowissenschaftliches Modellieren (01. 03.04.2009) Aufgabe 1: Erhöhung CO 2 -Gehalt in der Atmosphäre durch Änderung der Lufttemperatur? Aus vielen Untersuchungen (z.b. an Eiskernen) wissen
Übung 6 Plausibilitätstest Gruppe 1,4
 Übung 6 Plausibilitätstest Gruppe 1,4 Gegeben ist folgende Wasseranalyse [Konzentrationen in mg/l]: LF 1360 µs/cm temp 6.4 ph 3.4 pe 7.7 F 1.6 Cl 193 Br 0.69 N(+5) 0.018 as NO3- S(+6) 338 as SO4- C(+4)
Übung 6 Plausibilitätstest Gruppe 1,4 Gegeben ist folgende Wasseranalyse [Konzentrationen in mg/l]: LF 1360 µs/cm temp 6.4 ph 3.4 pe 7.7 F 1.6 Cl 193 Br 0.69 N(+5) 0.018 as NO3- S(+6) 338 as SO4- C(+4)
3.2. Aufgaben zu Säure-Base-Gleichgewichten
 .. Aufgaben zu Säure-Base-Gleichgewichten Aufgabe : Herstellung saurer und basischer Lösungen Gib die Reaktionsgleichungen für die Herstellung der folgenden Lösungen durch Reaktion der entsprechenden Oxide
.. Aufgaben zu Säure-Base-Gleichgewichten Aufgabe : Herstellung saurer und basischer Lösungen Gib die Reaktionsgleichungen für die Herstellung der folgenden Lösungen durch Reaktion der entsprechenden Oxide
Chemie aquatischer Systeme. Herbstsemester 2013
 Chemie aquatischer Systeme Herbstsemester 2013 Ziele der Vorlesung Verständnis der chemischen Zusammensetzung der Gewässer aufgrund chemischer Prozesse Verknüpfung chemischer Prozesse mit biologischen
Chemie aquatischer Systeme Herbstsemester 2013 Ziele der Vorlesung Verständnis der chemischen Zusammensetzung der Gewässer aufgrund chemischer Prozesse Verknüpfung chemischer Prozesse mit biologischen
Qualitative anorganische Analyse
 Dirk Häfner Arbeitsbuch Qualitative anorganische Analyse für Pharmazie- und Chemiestudenten unter Mitarbeit von Alice Stephan Gyyi Govi-Verlag Inhalt Vorwort zur 5. Auflage 9 Vorwort zur 4. Auflage 10
Dirk Häfner Arbeitsbuch Qualitative anorganische Analyse für Pharmazie- und Chemiestudenten unter Mitarbeit von Alice Stephan Gyyi Govi-Verlag Inhalt Vorwort zur 5. Auflage 9 Vorwort zur 4. Auflage 10
BITTE AUSFÜLLEN BITTE HALTEN SIE IHREN STUDENTAUSWEIS BEREIT. Matr.-Nr. Name: Vorname: Unterschrift:
 PUNKTZAHL NOTE 1 12.06.2001 Klausur zur Vorlesung "Grundzüge der Chemie" für Studierende des Maschinenbaus und des Studiengangs Umwelttechnik und Ressourcenmanagement Termin: 12. Juni 2001 Ort: HMA 10
PUNKTZAHL NOTE 1 12.06.2001 Klausur zur Vorlesung "Grundzüge der Chemie" für Studierende des Maschinenbaus und des Studiengangs Umwelttechnik und Ressourcenmanagement Termin: 12. Juni 2001 Ort: HMA 10
Säuren und Basen. 18 UE Präsenz - Selbststudium 1,3 ECTS
 Säuren und Basen 18 UE Präsenz - Selbststudium 1,3 ECTS Überblick 1. Schülervorstellungen Phänomenologische Begriffsbestimmung 2. Verschiedene Definitionen der Begriffe 3. Stärke von Säuren und Basen 4.
Säuren und Basen 18 UE Präsenz - Selbststudium 1,3 ECTS Überblick 1. Schülervorstellungen Phänomenologische Begriffsbestimmung 2. Verschiedene Definitionen der Begriffe 3. Stärke von Säuren und Basen 4.
Seminar zum Grundpraktikum Anorganische Chemie
 Seminar zum Grundpraktikum Anorganische Chemie Sommersemester 2012 Christoph Wölper Universität Duisburg-Essen Analyse 2 (NH 4 ) 2 CO 3 -Gruppe Ba 2+ Sr 2+ Ca 2+ Lösliche Gruppe Na + Mg 2+ NH 4+ Eigenschaften
Seminar zum Grundpraktikum Anorganische Chemie Sommersemester 2012 Christoph Wölper Universität Duisburg-Essen Analyse 2 (NH 4 ) 2 CO 3 -Gruppe Ba 2+ Sr 2+ Ca 2+ Lösliche Gruppe Na + Mg 2+ NH 4+ Eigenschaften
Wasseruntersuchungsbefund-Nr / 0007 / 003. Untersuchung nach der Trinkwasser-Verordnung 2012
 Untersuchung nach der Trinkwasser-Verordnung 2012 Auftraggeber: Gemeinde Fränkisch-Crumbach Entnahmedatum: 15.05.2017 Rodensteiner Str. 8 Prüfbeginn: 15.05.2017 64407 Fränkisch-Crumbach Prüfende: 26.07.2017
Untersuchung nach der Trinkwasser-Verordnung 2012 Auftraggeber: Gemeinde Fränkisch-Crumbach Entnahmedatum: 15.05.2017 Rodensteiner Str. 8 Prüfbeginn: 15.05.2017 64407 Fränkisch-Crumbach Prüfende: 26.07.2017
Nachklausur zum Praktikum Allgemeine und Anorganische Chemie für Naturwissenschaftler Sommersemester 2007
 Nachklausur zum Praktikum Allgemeine und Anorganische Chemie für Naturwissenschaftler Sommersemester 2007 Name: Matr. Nr.: Studiengang (Bachelor/Diplom): Ergebnis: Punkte/Note: Aufg 1 2 3 4 5 6 7 8 9 10
Nachklausur zum Praktikum Allgemeine und Anorganische Chemie für Naturwissenschaftler Sommersemester 2007 Name: Matr. Nr.: Studiengang (Bachelor/Diplom): Ergebnis: Punkte/Note: Aufg 1 2 3 4 5 6 7 8 9 10
1/37. Das Protolysegleichgewicht. Wie könnte man die Stärke einer Säure quantitativ definieren?
 Das Protolysegleichgewicht 1/37 Wie könnte man die Stärke einer Säure quantitativ definieren? Das Protolysegleichgewicht 2/37 Wie könnte man die Stärke einer Säure quantitativ definieren? Ein erster Ansatz
Das Protolysegleichgewicht 1/37 Wie könnte man die Stärke einer Säure quantitativ definieren? Das Protolysegleichgewicht 2/37 Wie könnte man die Stärke einer Säure quantitativ definieren? Ein erster Ansatz
Trinkwasseranalyse Qualitätsdaten des Trinkwassers aus der Kaufbeurer Wasserversorgung - Jahresmittelwerte
 Trinkwasseranalyse 2016 Qualitätsdaten des Trinkwassers aus der Kaufbeurer Wasserversorgung - Jahresmittelwerte Mikrobiologische Parameter, Anlage 1 - Teil 1 Escherichia coli (E.coli) Anzahl/100 ml 0 0
Trinkwasseranalyse 2016 Qualitätsdaten des Trinkwassers aus der Kaufbeurer Wasserversorgung - Jahresmittelwerte Mikrobiologische Parameter, Anlage 1 - Teil 1 Escherichia coli (E.coli) Anzahl/100 ml 0 0
ph-wert Berechnung für starke Säuren / Basen
 ph-wert Berechnung für starke Säuren / Basen 0.1 mol/l HCl: HCl + H 2 O H 3 O + + Cl starke Säure, vollständige Dissoziation [H 3 O + ] = 10 1 mol/l; ph = 1 0.1 mol/l NaOH: NaOH + H 2 O Na + aq + OH starke
ph-wert Berechnung für starke Säuren / Basen 0.1 mol/l HCl: HCl + H 2 O H 3 O + + Cl starke Säure, vollständige Dissoziation [H 3 O + ] = 10 1 mol/l; ph = 1 0.1 mol/l NaOH: NaOH + H 2 O Na + aq + OH starke
Trinkwasseranalyse 2017
 Trinkwasseranalyse 2017 Qualitätsdaten des Trinkwassers aus der Kaufbeurer Wasserversorgung Jahresmittelwerte aus dem Verteilungsnetz Schieberkeller im Hochbehälter Oberbeuren Mikrobiologische Parameter,
Trinkwasseranalyse 2017 Qualitätsdaten des Trinkwassers aus der Kaufbeurer Wasserversorgung Jahresmittelwerte aus dem Verteilungsnetz Schieberkeller im Hochbehälter Oberbeuren Mikrobiologische Parameter,
Wintersemester 2017 Seminar Stöchiometrie
 Wintersemester 2017 Seminar Stöchiometrie Themenüberblick Kurze Wiederholung der wichtigsten Formeln Neue Themen zur Abschlussklausur: 1. Elektrolytische Dissoziation 2. ph-wert Berechnung 3. Puffer Wiederholung
Wintersemester 2017 Seminar Stöchiometrie Themenüberblick Kurze Wiederholung der wichtigsten Formeln Neue Themen zur Abschlussklausur: 1. Elektrolytische Dissoziation 2. ph-wert Berechnung 3. Puffer Wiederholung
Massenwirkungsgesetz (MWG) und Reaktionskombinationen
 Massenwirkungsgesetz (MWG) und Reaktionskombinationen Das Massenwirkungsgesetz stellt den Zusammenhang zwischen Aktivitäten (bzw. Konzentrationen) der Produkte und der Edukte einer chemischen Reaktion,
Massenwirkungsgesetz (MWG) und Reaktionskombinationen Das Massenwirkungsgesetz stellt den Zusammenhang zwischen Aktivitäten (bzw. Konzentrationen) der Produkte und der Edukte einer chemischen Reaktion,
ph-wert Berechnung für starke Säuren / Basen
 ph-wert Berechnung für starke Säuren / Basen 0.1 mol/l HCl: HCl + H 2 O H 3 O + + Cl starke Säure, vollständige Dissoziation [H 3 O + ] = 10 1 mol/l; ph = 1 0.1 mol/l NaOH: NaOH Na + aq + OH starke Base,
ph-wert Berechnung für starke Säuren / Basen 0.1 mol/l HCl: HCl + H 2 O H 3 O + + Cl starke Säure, vollständige Dissoziation [H 3 O + ] = 10 1 mol/l; ph = 1 0.1 mol/l NaOH: NaOH Na + aq + OH starke Base,
Säuren, Basen, Salze
 Säuren, Basen, Salze Namensgebung (=Nomenklatur) Es gibt für chemische Verbindungen grundsätzlich zwei Arten von Namen: Trivialname der alltäglich bzw. umgangssprachlich benutzte Name z. B.: Wasser, Salzsäure,
Säuren, Basen, Salze Namensgebung (=Nomenklatur) Es gibt für chemische Verbindungen grundsätzlich zwei Arten von Namen: Trivialname der alltäglich bzw. umgangssprachlich benutzte Name z. B.: Wasser, Salzsäure,
AC2 ÜB12 Säuren und Basen LÖSUNGEN Seite 1 von 7
 AC2 ÜB12 Säuren und Basen LÖSUNGEN Seite 1 von 7 1. a) CH3COOH, C0=0.125 mol/l Schwache Säure pks = 4.75 (aus Tabelle) => ph = 0.5*(4.75-Log(0.125))= 2.83 b) H24, C0=0.1 mol/l Erste Protolysestufe starke
AC2 ÜB12 Säuren und Basen LÖSUNGEN Seite 1 von 7 1. a) CH3COOH, C0=0.125 mol/l Schwache Säure pks = 4.75 (aus Tabelle) => ph = 0.5*(4.75-Log(0.125))= 2.83 b) H24, C0=0.1 mol/l Erste Protolysestufe starke
Lösungen V 9. Gesättigte Lösung: ein gelöstes Salz steht mit seiner festen Phase, dem Bodenkörper, im Gleichgewicht
 Gesättigte Lösung: ein gelöstes Salz steht mit seiner festen Phase, dem Bodenkörper, im Gleichgewicht Löslichkeit: maximale Masse an in Lösung gehenden Salzen bezogen auf eine Lösungsmittelmenge; (T-abhängig)
Gesättigte Lösung: ein gelöstes Salz steht mit seiner festen Phase, dem Bodenkörper, im Gleichgewicht Löslichkeit: maximale Masse an in Lösung gehenden Salzen bezogen auf eine Lösungsmittelmenge; (T-abhängig)
Wasseruntersuchungsbefund-Nr / 0008 / 170. Untersuchung nach der Trinkwasser-Verordnung 2012
 Untersuchung nach der Trinkwasser-Verordnung 2012 Auftraggeber: SW Michelstadt Entnahmedatum: 13..2017 Frankfurter Str. 3a Prüfbeginn: 13..2017 64720 Michelstadt Prüfende: 09.10.2017 Bezeichnung: Hochbehälter
Untersuchung nach der Trinkwasser-Verordnung 2012 Auftraggeber: SW Michelstadt Entnahmedatum: 13..2017 Frankfurter Str. 3a Prüfbeginn: 13..2017 64720 Michelstadt Prüfende: 09.10.2017 Bezeichnung: Hochbehälter
Chem. Grundlagen. ure-base Begriff. Das Protonen-Donator-Akzeptor-Konzept. Wasserstoff, Proton und Säure-Basen. Basen-Definition nach Brønsted
 Der SäureS ure-base Begriff Chem. Grundlagen Das Protonen-Donator-Akzeptor-Konzept Wasserstoff, Proton und Säure-Basen Basen-Definition nach Brønsted Wasserstoff (H 2 ) Proton H + Anion (-) H + = Säure
Der SäureS ure-base Begriff Chem. Grundlagen Das Protonen-Donator-Akzeptor-Konzept Wasserstoff, Proton und Säure-Basen Basen-Definition nach Brønsted Wasserstoff (H 2 ) Proton H + Anion (-) H + = Säure
VL Limnochemie
 VL Limnochemie Redoxreaktionen und -gleichgewichte WIEDERHOLUNG: SAUERSTOFF 1 Henry-Gesetz Massenwirkungsgesetz für den Fall: gasförmiger Stoff löst sich in Wasser A gas A fl K H = c(a fl ) c(a gas ) Henry-
VL Limnochemie Redoxreaktionen und -gleichgewichte WIEDERHOLUNG: SAUERSTOFF 1 Henry-Gesetz Massenwirkungsgesetz für den Fall: gasförmiger Stoff löst sich in Wasser A gas A fl K H = c(a fl ) c(a gas ) Henry-
Wasser. Flora und Fauna. Wichtigste chemische Verbindung in Lebewesen. Menschen benötigt mindestens 1kg H 2 O pro Tag
 Wasser Flora und Fauna Wichtigste chemische Verbindung in Lebewesen Menschen benötigt mindestens 1kg H 2 O pro Tag Löslichkeit von Sauerstoff in Wasser in Abhängigkeit von der Temperatur mg/l Zustandsdiagramm
Wasser Flora und Fauna Wichtigste chemische Verbindung in Lebewesen Menschen benötigt mindestens 1kg H 2 O pro Tag Löslichkeit von Sauerstoff in Wasser in Abhängigkeit von der Temperatur mg/l Zustandsdiagramm
Einführung in die Geologie
 Einführung in die Geologie Teil 4: Minerale - Baustoffe der Gesteine Prof. Dr. Rolf Bracke International Geothermal Centre Lennershofstraße 140 44801 Bochum Übersicht Definition der Minerale Minerale und
Einführung in die Geologie Teil 4: Minerale - Baustoffe der Gesteine Prof. Dr. Rolf Bracke International Geothermal Centre Lennershofstraße 140 44801 Bochum Übersicht Definition der Minerale Minerale und
7.4 Fällungs- und Komplexbildungsreaktionen
 7.4 Fällungs- und Komplexbildungsreaktionen Ionenaustausch-Reaktionen Bei Ionenaustausch-Reaktionen von Ionenverbindungen tauschen Kationen und Anionen ihre Bindungspartner aus. Die Triebkräfte der Reaktionen
7.4 Fällungs- und Komplexbildungsreaktionen Ionenaustausch-Reaktionen Bei Ionenaustausch-Reaktionen von Ionenverbindungen tauschen Kationen und Anionen ihre Bindungspartner aus. Die Triebkräfte der Reaktionen
Zweckverband Mittelhessische Wasserwerke Teichweg Gießen
 Zweckverband Mittelhessische Wasserwerke Teichweg 24 35396 Gießen Ansprechpartner: Dr. H. Bodes-Fischer K. Greb-Bender Telefon: 06421-30908-10 Telefax: 06421-30908-44 Mail: info@umwelthygiene-marburg.de
Zweckverband Mittelhessische Wasserwerke Teichweg 24 35396 Gießen Ansprechpartner: Dr. H. Bodes-Fischer K. Greb-Bender Telefon: 06421-30908-10 Telefax: 06421-30908-44 Mail: info@umwelthygiene-marburg.de
Themen heute: Säuren und Basen, Redoxreaktionen
 Wiederholung der letzten Vorlesungsstunde: Massenwirkungsgesetz, Prinzip des kleinsten Zwangs, Löslichkeitsprodukt, Themen heute: Säuren und Basen, Redoxreaktionen Vorlesung Allgemeine Chemie, Prof. Dr.
Wiederholung der letzten Vorlesungsstunde: Massenwirkungsgesetz, Prinzip des kleinsten Zwangs, Löslichkeitsprodukt, Themen heute: Säuren und Basen, Redoxreaktionen Vorlesung Allgemeine Chemie, Prof. Dr.
Prüfbericht über Wasseruntersuchungen gemäß TrinkwV 2001
 Zweckverband Wassererversorgung und Abwasserbeseitigung Grimmen Grellenberger Straße 6 1857 Grimmen Tel. ( 38326 ) 63- / Fax ( 38326 ) 63-12 Zweckverband Wasserversorgung und Abwasserbeseitigung Grimmen
Zweckverband Wassererversorgung und Abwasserbeseitigung Grimmen Grellenberger Straße 6 1857 Grimmen Tel. ( 38326 ) 63- / Fax ( 38326 ) 63-12 Zweckverband Wasserversorgung und Abwasserbeseitigung Grimmen
Wasser und Beton Ein zwiespältiges Verhältnis
 Wasser und Beton Ein zwiespältiges Verhältnis Dr. Andreas Saxer Universität Innsbruck Institut für Konstruktion und Materialwissenschaften Arbeitsbereich Materialtechnologie Janus: römischer Gott des Anfangs
Wasser und Beton Ein zwiespältiges Verhältnis Dr. Andreas Saxer Universität Innsbruck Institut für Konstruktion und Materialwissenschaften Arbeitsbereich Materialtechnologie Janus: römischer Gott des Anfangs
Kapiteltest 1.1. Kapiteltest 1.2
 Kapiteltest 1.1 a) Perchlorsäure hat die Formel HClO 4. Was geschieht bei der Reaktion von Perchlorsäure mit Wasser? Geben Sie zuerst die Antwort in einem Satz. Dann notieren Sie die Reaktionsgleichung.
Kapiteltest 1.1 a) Perchlorsäure hat die Formel HClO 4. Was geschieht bei der Reaktion von Perchlorsäure mit Wasser? Geben Sie zuerst die Antwort in einem Satz. Dann notieren Sie die Reaktionsgleichung.
TRINKWASSERANALYSE 2015 GEM. TRINKWASSERVERORDNUNG VOM
 TRINKWASSERANALYSE 2015 GEM. TRINKWASSERVERORDNUNG VOM 03.05.2011 ALSFELD LIEDERBACH, ALTENBURG, EIFA, LEUSEL, ANGENROD, BILLERTSHAUSEN, REIBERTENROD, EUDORF, MÜNCH-LEUSEL, SCHWABENROD Routinemäßige Untersuchungen
TRINKWASSERANALYSE 2015 GEM. TRINKWASSERVERORDNUNG VOM 03.05.2011 ALSFELD LIEDERBACH, ALTENBURG, EIFA, LEUSEL, ANGENROD, BILLERTSHAUSEN, REIBERTENROD, EUDORF, MÜNCH-LEUSEL, SCHWABENROD Routinemäßige Untersuchungen
Aufgabe 1: Geben Sie die korrespondierenden Basen zu folgenden Verbindungen an: a) H 3 PO 4 b) H 2 PO 4
 Übungsaufgaben zum Thema Säuren, Basen und Puffer Säure/Base Definition nach Brǿnsted: Säuren sind Stoffe, die Protonen abgeben können (Protonendonatoren). Basen sind Stoffe, die Protonen aufnehmen können
Übungsaufgaben zum Thema Säuren, Basen und Puffer Säure/Base Definition nach Brǿnsted: Säuren sind Stoffe, die Protonen abgeben können (Protonendonatoren). Basen sind Stoffe, die Protonen aufnehmen können
Wasseruntersuchungsbefund-Nr. 2016/ 0004/ 100. Untersuchung nach der Trinkwasser-Verordnung 2012
 Untersuchung nach der Trinkwasser-Verordnung 2012 Auftraggeber: SW Michelstadt Entnahmedatum: 21.07.2016 Frankfurter Str. 3a Prüfbeginn: 21.07.2016 64720 Michelstadt Prüfende: 16.09.2016 Bezeichnung: Hochbehälter
Untersuchung nach der Trinkwasser-Verordnung 2012 Auftraggeber: SW Michelstadt Entnahmedatum: 21.07.2016 Frankfurter Str. 3a Prüfbeginn: 21.07.2016 64720 Michelstadt Prüfende: 16.09.2016 Bezeichnung: Hochbehälter
Wasseruntersuchungsbefund-Nr. 2016/ 0004/ 092. Untersuchung nach der Trinkwasser-Verordnung 2012
 Untersuchung nach der Trinkwasser-Verordnung 2012 Auftraggeber: SW Michelstadt Entnahmedatum: 21.07.2016 Frankfurter Str. 3a Prüfbeginn: 21.07.2016 64720 Michelstadt Prüfende: 16.09.2016 Bezeichnung: Hochbehälter
Untersuchung nach der Trinkwasser-Verordnung 2012 Auftraggeber: SW Michelstadt Entnahmedatum: 21.07.2016 Frankfurter Str. 3a Prüfbeginn: 21.07.2016 64720 Michelstadt Prüfende: 16.09.2016 Bezeichnung: Hochbehälter
Hausarbeit. Das Fällungs- und Löslichkeitsgleichgewicht. über. von Marie Sander
 Hausarbeit über Das Fällungs- und Löslichkeitsgleichgewicht von Marie Sander Inhaltsverzeichnis 1. Einstieg in das Thema 2. Einflüsse auf das Löslichkeitsgleichgewicht - Das Prinzip von Le Chatelier 3.
Hausarbeit über Das Fällungs- und Löslichkeitsgleichgewicht von Marie Sander Inhaltsverzeichnis 1. Einstieg in das Thema 2. Einflüsse auf das Löslichkeitsgleichgewicht - Das Prinzip von Le Chatelier 3.
Weiches Wasser - Bovenden. Diskussionsveranstaltung --- Bovenden --- Ralf Kömen Weiches Wasser - gut für Bovenden!? AWIA Umwelt GmbH
 GLIEDERUNG 1. Wasserhärte 2. Inhibitor-Dosierung 3. Chlorung 1. Wasserhärte www.desangosse.de 1. Wasserhärte Gesamthärte GW Bovenden aus der Bestimmung im August 2015: Brunnen Osterberg + Weendespring
GLIEDERUNG 1. Wasserhärte 2. Inhibitor-Dosierung 3. Chlorung 1. Wasserhärte www.desangosse.de 1. Wasserhärte Gesamthärte GW Bovenden aus der Bestimmung im August 2015: Brunnen Osterberg + Weendespring
Fällung und Flockung. Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen. Übung zur Vorlesung Verfahrenstechnik der Abwasserreinigung
 Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen Fällung und Flockung Übung zur Vorlesung Verfahrenstechnik der Abwasserreinigung Betül Morcali 27.01.2017 Agenda Auffrischung Definition
Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen Fällung und Flockung Übung zur Vorlesung Verfahrenstechnik der Abwasserreinigung Betül Morcali 27.01.2017 Agenda Auffrischung Definition
Name: Punktzahl: von 57 Note:
 Testen Sie Ihr Wissen! Übungsprobe zu den Tertia-Themen und Säure-Base-Reaktionen Name: Punktzahl: von 57 Note: Für die folgenden Fragen haben Sie 60 Minuten Zeit. Viel Erfolg! Hilfsmittel: das ausgeteilte
Testen Sie Ihr Wissen! Übungsprobe zu den Tertia-Themen und Säure-Base-Reaktionen Name: Punktzahl: von 57 Note: Für die folgenden Fragen haben Sie 60 Minuten Zeit. Viel Erfolg! Hilfsmittel: das ausgeteilte
Wasserhärte und Tropfsteine. Ein Beitrag von Andre Bauersachs und Stephanie Möller
 Ein Beitrag von Andre Bauersachs und Gliederung I. Einführung II. III. i. Definition ii. Bestimmung iii. Ursprung der iv. Auswirkungen v. Enthärtung Tropfsteine IV. Literatur I. Einführung verschiedene
Ein Beitrag von Andre Bauersachs und Gliederung I. Einführung II. III. i. Definition ii. Bestimmung iii. Ursprung der iv. Auswirkungen v. Enthärtung Tropfsteine IV. Literatur I. Einführung verschiedene
Klausurvorbereitung. Chemie im Nebenfach. Vorlesung Allgemeine Chemie, Prof. Dr. Martin Köckerling 1
 Klausurvorbereitung Chemie im Nebenfach Vorlesung Allgemeine Chemie, Prof. Dr. Martin Köckerling 1 Atombau Bestandteile eines Atoms? Proton (p) Neutron (n) Elektron (e) 14 N Anzahl Proton (p) = Elektron
Klausurvorbereitung Chemie im Nebenfach Vorlesung Allgemeine Chemie, Prof. Dr. Martin Köckerling 1 Atombau Bestandteile eines Atoms? Proton (p) Neutron (n) Elektron (e) 14 N Anzahl Proton (p) = Elektron
1.3 Chemische Reaktionen des Wassers - Bildung von Säuren und Basen
 1.3 Chemische Reaktionen des Wassers Bildung von Säuren und Basen Säure und Basebegriff nach Arrhenius (1887) Wasser reagiert mit Nichtmetalloxiden (Säureanhydriden) zu Säuren. Die gebildete Säure löst
1.3 Chemische Reaktionen des Wassers Bildung von Säuren und Basen Säure und Basebegriff nach Arrhenius (1887) Wasser reagiert mit Nichtmetalloxiden (Säureanhydriden) zu Säuren. Die gebildete Säure löst
Sommersemester 2016 Seminar Stöchiometrie
 Sommersemester 2016 Seminar Stöchiometrie Themenüberblick Kurze Wiederholung der wichtigsten Formeln Neue Themen zur Abschlussklausur: 1. Elektrolytische Dissoziation 2. ph-wert Berechnung 3. Puffer Wiederholung
Sommersemester 2016 Seminar Stöchiometrie Themenüberblick Kurze Wiederholung der wichtigsten Formeln Neue Themen zur Abschlussklausur: 1. Elektrolytische Dissoziation 2. ph-wert Berechnung 3. Puffer Wiederholung
Wintersemester 2016 Seminar Stöchiometrie
 Wintersemester 2016 Seminar Stöchiometrie Tutorien Raum Termin Hörsaal OSZ H5 Mo. 19.12., 18-20 Uhr Hörsaal OSZ H5 Fr. 13.1.,16-18 Uhr Hörsaal OSZ H5 Mo. 30.01., 18-20 Uhr Hörsaal OSZ H5 Mo. 06.02., 18-20
Wintersemester 2016 Seminar Stöchiometrie Tutorien Raum Termin Hörsaal OSZ H5 Mo. 19.12., 18-20 Uhr Hörsaal OSZ H5 Fr. 13.1.,16-18 Uhr Hörsaal OSZ H5 Mo. 30.01., 18-20 Uhr Hörsaal OSZ H5 Mo. 06.02., 18-20
Gemeinde Wettswil, Wasserversorgung, 8907 Wettswil. Untersuchungsbericht. Trinkwasserkontrolle Wettswil. Wettswil. Annette Rust
 Schlieren, 13. März 2006 AR/AR Wasserversorgung Ettenbergstr. 1 8907 Wettswil Untersuchungsbericht Auftrags-Nr. Bachema Probennummer Bachema Tag der Probenahme Eingang Bachema Probenahmeort Entnommen durch
Schlieren, 13. März 2006 AR/AR Wasserversorgung Ettenbergstr. 1 8907 Wettswil Untersuchungsbericht Auftrags-Nr. Bachema Probennummer Bachema Tag der Probenahme Eingang Bachema Probenahmeort Entnommen durch
Wasserchemie Modul 3. Titration Kalkkohlensäuregleichgewicht. Sauerstoff nach Winkler Titration von Metallen Kohlensäurespecies
 Wasserchemie Modul Titration Kalkkohlensäuregleichgewicht TIC-DOC DOC-TOC 1 1. Titrimetrische Bestimmungen Überblick Sauerstoff nach Winkler Titration von Metallen Kohlensäurespecies (KKG) Chloridbestimmung
Wasserchemie Modul Titration Kalkkohlensäuregleichgewicht TIC-DOC DOC-TOC 1 1. Titrimetrische Bestimmungen Überblick Sauerstoff nach Winkler Titration von Metallen Kohlensäurespecies (KKG) Chloridbestimmung
Massenwirkungsgesetz (MWG) und Reaktionskombination
 Universität des Saarlandes - Fachrichtung Anorganische Chemie C h e m i s c h e s E i n f ü h r u n g s p r a k t i k u m Massenwirkungsgesetz (MWG) und Reaktionskombination Das Massenwirkungsgesetz stellt
Universität des Saarlandes - Fachrichtung Anorganische Chemie C h e m i s c h e s E i n f ü h r u n g s p r a k t i k u m Massenwirkungsgesetz (MWG) und Reaktionskombination Das Massenwirkungsgesetz stellt
Inhaltsverzeichnis. Vorwort Zur Gestaltung des Buches
 Hans Rudolf Christen Struktur Stoff Reaktion Allgemeine und anorganische Chemie Sekundarstufe I 5401 Diesterweg Salle Frankfurt am Main Berlin München Verlag Sauerländer Aarau Vorwort Zur Gestaltung des
Hans Rudolf Christen Struktur Stoff Reaktion Allgemeine und anorganische Chemie Sekundarstufe I 5401 Diesterweg Salle Frankfurt am Main Berlin München Verlag Sauerländer Aarau Vorwort Zur Gestaltung des
Allgemeine Chemie I 2008/09 ÜBUNGSPRÜFUNG. Prof. J. Hulliger
 Allgemeine Chemie I 2008/09 ÜBUNGSPRÜFUNG Prof. J. Hulliger 15.10.08 Aufgabe 1 (1 Punkt) Vervollständigen Sie nachstehende Reaktionen, (stöchiometrische Koeffizienten, Pfeile, Zustände wie ionisch, aq,
Allgemeine Chemie I 2008/09 ÜBUNGSPRÜFUNG Prof. J. Hulliger 15.10.08 Aufgabe 1 (1 Punkt) Vervollständigen Sie nachstehende Reaktionen, (stöchiometrische Koeffizienten, Pfeile, Zustände wie ionisch, aq,
Lösungen zu den Übungsaufgaben zur Thematik Säure/Base (Zwei allgemeine Hinweise: aus Zeitgründen habe ich auf das Kursivsetzen bestimmter Zeichen
 Lösungen zu den Übungsaufgaben zur Thematik Säure/Base (Zwei allgemeine Hinweise: aus Zeitgründen habe ich auf das Kursivsetzen bestimmter Zeichen verzichtet; Reaktionsgleichungen sollten den üblichen
Lösungen zu den Übungsaufgaben zur Thematik Säure/Base (Zwei allgemeine Hinweise: aus Zeitgründen habe ich auf das Kursivsetzen bestimmter Zeichen verzichtet; Reaktionsgleichungen sollten den üblichen
Studienbegleitende Prüfung Modul 12 Anorganisch-Chemisches Grundpraktikum WS 2002/
 Studienbegleitende Prüfung Modul 12 Anorganisch-Chemisches Grundpraktikum WS 2002/2003 22.04.2003 Name: Vorname: Matrikelnummer: Fachsemester: Punkte: Note: Frage 1 Welche Flammenfärbung zeigen folgende
Studienbegleitende Prüfung Modul 12 Anorganisch-Chemisches Grundpraktikum WS 2002/2003 22.04.2003 Name: Vorname: Matrikelnummer: Fachsemester: Punkte: Note: Frage 1 Welche Flammenfärbung zeigen folgende
Anorganische-Chemie. Michael Beetz Arbeitskreis Prof. Bein. Grundpraktikum für Biologen 2017
 Michael Beetz Arbeitskreis Prof. Bein Butenandstr. 11, Haus E, E 3.027 michael.beetz@cup.uni-muenchen.de Anorganische-Chemie Grundpraktikum für Biologen 2017 Trennungsgänge und Nachweise # 2 Trennungsgänge
Michael Beetz Arbeitskreis Prof. Bein Butenandstr. 11, Haus E, E 3.027 michael.beetz@cup.uni-muenchen.de Anorganische-Chemie Grundpraktikum für Biologen 2017 Trennungsgänge und Nachweise # 2 Trennungsgänge
SÄUREN, BASEN, ph-wert
 8. Einheit: SÄUREN, BASEN, ph-wert Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 23 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Säuren, Basen, ph-wert.. können Sie die Begriffe Säure und Base in
8. Einheit: SÄUREN, BASEN, ph-wert Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 23 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Säuren, Basen, ph-wert.. können Sie die Begriffe Säure und Base in
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Teilnahmebescheinigungen Mail an christoph.woelper@uni-due.de
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Teilnahmebescheinigungen Mail an christoph.woelper@uni-due.de
Boden Versauerung Dynamik-Gefährdung
 Rochuspark I Erdbergstraße 10/33 I 1020 Wien T (+43 1) 236 10 30 33 I M (+43 0) 676 364 10 30 E office@bodenoekologie.com I www.bodenoekologie.com Boden Versauerung Dynamik-Gefährdung Univ. Lek. DI Hans
Rochuspark I Erdbergstraße 10/33 I 1020 Wien T (+43 1) 236 10 30 33 I M (+43 0) 676 364 10 30 E office@bodenoekologie.com I www.bodenoekologie.com Boden Versauerung Dynamik-Gefährdung Univ. Lek. DI Hans
Das Formelpuzzle Kopiervorlage
 Das Formelpuzzle Kopiervorlage Die Vorlage wird foliert, die einzelnen Bausteine werden ausgeschnitten. Durch einfaches Aneinanderlegen von Kationen und Anionen können die Formeln von Säuren, Basen und
Das Formelpuzzle Kopiervorlage Die Vorlage wird foliert, die einzelnen Bausteine werden ausgeschnitten. Durch einfaches Aneinanderlegen von Kationen und Anionen können die Formeln von Säuren, Basen und
Einführung in die Geowissenschaften I Geomaterialien Teil II WS 2016/2017
 Einführung in die Geowissenschaften I Geomaterialien Teil II WS 2016/2017 13. Dez. Kristallchemie der Silikate Was ist ein Mineral? Was ist ein Gestein? Gesteinsbildende Minerale 20. Dez Das System Erde:
Einführung in die Geowissenschaften I Geomaterialien Teil II WS 2016/2017 13. Dez. Kristallchemie der Silikate Was ist ein Mineral? Was ist ein Gestein? Gesteinsbildende Minerale 20. Dez Das System Erde:
Prüfbericht für Probe:
 2017103940 Rosenheim, Hochbehälter Kreut, Kammer 2 1230018700555 10:20 Mikrobiologische Kenngrößen M Koloniezahl 22 C KBE/ml 0 100 TrinkwV 2001, Anl. 5 I d) bb) bbb) M Koloniezahl 36 C KBE/ml 0 100 TrinkwV
2017103940 Rosenheim, Hochbehälter Kreut, Kammer 2 1230018700555 10:20 Mikrobiologische Kenngrößen M Koloniezahl 22 C KBE/ml 0 100 TrinkwV 2001, Anl. 5 I d) bb) bbb) M Koloniezahl 36 C KBE/ml 0 100 TrinkwV
Welcher Indikator ist für die Titration von Essigsäure (pks =4.76) mit Natronlauge am besten geeignet?
 1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen ist falsch? A) Säuren erhöhen durch Abgabe eines Protons an Wasser die H3O + -Konzentration einer Lösung. B)
1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen ist falsch? A) Säuren erhöhen durch Abgabe eines Protons an Wasser die H3O + -Konzentration einer Lösung. B)
Essigsäure färbt ph-papier rot. Natronlauge färbt ph-papier blau
 5. SÄUREN UND BASEN ARBEITSBLATT 5.1 WAS SIND INDIKATOREN? DER PH-WERT SÄUREN und BASEN sind Stoffe die sich gegenseitig in ihrer Wirkung aufheben. INDIKATOREN sind Farbstoffe, die über Farbänderungen
5. SÄUREN UND BASEN ARBEITSBLATT 5.1 WAS SIND INDIKATOREN? DER PH-WERT SÄUREN und BASEN sind Stoffe die sich gegenseitig in ihrer Wirkung aufheben. INDIKATOREN sind Farbstoffe, die über Farbänderungen
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bislang geschah Kinetik Reaktionsgeschwindigkeit Konzentrationsabhängigkeit
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bislang geschah Kinetik Reaktionsgeschwindigkeit Konzentrationsabhängigkeit
Übungen zur VL Chemie für Biologen und Humanbiologen 05.12.2011 Lösung Übung 6
 Übungen zur VL Chemie für Biologen und Humanbiologen 05.12.2011 Lösung Übung 6 Thermodynamik und Gleichgewichte 1. a) Was sagt die Enthalpie aus? Die Enthalpie H beschreibt den Energiegehalt von Materie
Übungen zur VL Chemie für Biologen und Humanbiologen 05.12.2011 Lösung Übung 6 Thermodynamik und Gleichgewichte 1. a) Was sagt die Enthalpie aus? Die Enthalpie H beschreibt den Energiegehalt von Materie
endotherme Reaktionen
 Exotherme/endotherme endotherme Reaktionen Edukte - H Produkte Exotherme Reaktion Edukte Produkte + H Endotherme Reaktion 101 Das Massenwirkungsgesetz Das Massenwirkungsgesetz Gleichgewicht chemischer
Exotherme/endotherme endotherme Reaktionen Edukte - H Produkte Exotherme Reaktion Edukte Produkte + H Endotherme Reaktion 101 Das Massenwirkungsgesetz Das Massenwirkungsgesetz Gleichgewicht chemischer
Arbeitsblatt. Puffer
 Arbeitsblatt Ziele: Vertiefen des konzeptes Anwenden der Henderson-Hasselbalch Gleichung: i) Berechnen der ph-änderung bei Zugabe von Säure (mit konkreten Konzentrationen durchgeführte Repetition des Wandtafelbeispiels)
Arbeitsblatt Ziele: Vertiefen des konzeptes Anwenden der Henderson-Hasselbalch Gleichung: i) Berechnen der ph-änderung bei Zugabe von Säure (mit konkreten Konzentrationen durchgeführte Repetition des Wandtafelbeispiels)
Säuren- und Basendefinition nach Arrhenius
 Säuren und Basen - Definitionen - Ionenprodukt des Wassers - ph-wert - Säure- und Basenstärke / ph-wert Bestimmungen - Neutralisationen - Puffersysteme Säuren- und Basendefinition nach Arrhenius Säure:
Säuren und Basen - Definitionen - Ionenprodukt des Wassers - ph-wert - Säure- und Basenstärke / ph-wert Bestimmungen - Neutralisationen - Puffersysteme Säuren- und Basendefinition nach Arrhenius Säure:
Säuren- und Basendefinition nach Arrhenius
 Säuren und Basen - Definitionen - Ionenprodukt des Wassers - ph-wert - Säure- und Basenstärke / ph-wert Bestimmungen - Neutralisationen - Puffersysteme Säuren- und Basendefinition nach Arrhenius Säure:
Säuren und Basen - Definitionen - Ionenprodukt des Wassers - ph-wert - Säure- und Basenstärke / ph-wert Bestimmungen - Neutralisationen - Puffersysteme Säuren- und Basendefinition nach Arrhenius Säure:
Essentielle Mineralstoffe
 Essentielle Mineralstoffe Justus v. Liebig: Justus v. Liebig Die Nährstoffe können sich nicht gegenseitig vertreten. Der edarf an mineralischen Nährstoffen ist artverschieden. Gesetz vom Minimum Der jeweils
Essentielle Mineralstoffe Justus v. Liebig: Justus v. Liebig Die Nährstoffe können sich nicht gegenseitig vertreten. Der edarf an mineralischen Nährstoffen ist artverschieden. Gesetz vom Minimum Der jeweils
Kochsalz-Kristalle (Halit) Wichtige Stoffgruppen Atomverband Stoffgruppe Metall Metall: Metallische Stoffe Salzartige Stoffe Metall Nichtmetall:
 Kochsalz-Kristalle (Halit) 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter)
Kochsalz-Kristalle (Halit) 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter)
PFLANZEN RICHTIG ERNÄHREN IN DER INNENRAUMBEGRÜNUNG
 PFLANZEN RICHTIG ERNÄHREN IN DER INNENRAUMBEGRÜNUNG Dr. Heinz-Dieter Molitor Hochschule Geisenheim University Innenraumbegrünung Objekte und Schadensfälle MOLITOR 2010 1 Gliederung Ernährungssituation
PFLANZEN RICHTIG ERNÄHREN IN DER INNENRAUMBEGRÜNUNG Dr. Heinz-Dieter Molitor Hochschule Geisenheim University Innenraumbegrünung Objekte und Schadensfälle MOLITOR 2010 1 Gliederung Ernährungssituation
Grundlegende Definitionen
 Grundlegende Definitionen 2 In diesem Kapitel werden die wichtigsten und grundlegenden Definitionen, welche für das Verständnis der Kohlensäuregleichgewichte notwendig sind, definiert und erläutert (Appelo
Grundlegende Definitionen 2 In diesem Kapitel werden die wichtigsten und grundlegenden Definitionen, welche für das Verständnis der Kohlensäuregleichgewichte notwendig sind, definiert und erläutert (Appelo
Probe: Brunnen Samnaun (Wasserversorgung) Probenahme Datum: Zeit: 07:00-10:00 Probeneingang:
 [meq/l] 695.8 Probe: Brunnen Samnaun (Wasserversorgung) Probenahme Datum: 5.9.7 Zeit: 7:: Probeneingang: 8.9.7 Wassertemperatur: 8. C Kationen: Kationen Anionen NH 4
[meq/l] 695.8 Probe: Brunnen Samnaun (Wasserversorgung) Probenahme Datum: 5.9.7 Zeit: 7:: Probeneingang: 8.9.7 Wassertemperatur: 8. C Kationen: Kationen Anionen NH 4
Chemische-technische hygienische Parameter
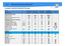 Chemische-technische hygienische Parameter Datum 13.04.2016 15.09.2016 12.04.2017 14.09.2017 Sensorische Prüfungen Färbung (vor Ort) farblos farblos farblos farblos Geruch (vor Ort) ohne ohne ohne ohne
Chemische-technische hygienische Parameter Datum 13.04.2016 15.09.2016 12.04.2017 14.09.2017 Sensorische Prüfungen Färbung (vor Ort) farblos farblos farblos farblos Geruch (vor Ort) ohne ohne ohne ohne
Das chemische Gleichgewicht, Massenwirkungsgesetz, Löslichkeit von Salzen in Flüssigkeiten, Löslichkeitsprodukt, Chemische Gleichgewichte, Säuren und
 Wiederholung der letzten Vorlesungsstunde: Das chemische Gleichgewicht, Massenwirkungsgesetz, Löslichkeit von Salzen in Flüssigkeiten, Löslichkeitsprodukt, Thema heute: Chemische Gleichgewichte, Säuren
Wiederholung der letzten Vorlesungsstunde: Das chemische Gleichgewicht, Massenwirkungsgesetz, Löslichkeit von Salzen in Flüssigkeiten, Löslichkeitsprodukt, Thema heute: Chemische Gleichgewichte, Säuren
1 Fortsetzung Gleichgewichtsreaktionen
 1 Fortsetzung Gleichgewichtsreaktionen 1.3 Atmosphäre - Grundwasser - Lithosphäre Aufgabe 12: Niederschlag unter Einfluss des Boden-CO 2 Im Boden entstehen erhebliche Mengen Kohlenstoffdioxid durch mikrobielle
1 Fortsetzung Gleichgewichtsreaktionen 1.3 Atmosphäre - Grundwasser - Lithosphäre Aufgabe 12: Niederschlag unter Einfluss des Boden-CO 2 Im Boden entstehen erhebliche Mengen Kohlenstoffdioxid durch mikrobielle
Trinkwasser-Untersuchungsergebnisse der Linzer Wasserwerke Netzeinspeisung
 MONAT: Jänner 2014 GOLDWÖRTH SCHARLINZ PLESCHING HEILHAM FISCHDORF HAID CHEM.BEFUND Temperatur C 11,0 11,8 12,0 11,9 9,4 8,9 ph-wert 7,30 7,18 7,30 7,60 7,60 7,60 Gesamthärte dh 14,5 20,5 18,0 18,8 14,8
MONAT: Jänner 2014 GOLDWÖRTH SCHARLINZ PLESCHING HEILHAM FISCHDORF HAID CHEM.BEFUND Temperatur C 11,0 11,8 12,0 11,9 9,4 8,9 ph-wert 7,30 7,18 7,30 7,60 7,60 7,60 Gesamthärte dh 14,5 20,5 18,0 18,8 14,8
Prüfbericht für Probe:
 2019022182 WV, Brunnen 1 4110803600009 08:20 Mikrobiologische Kenngrößen M Koloniezahl 22 C KBE/ml 0 100 TrinkwV 15 (1c) M Koloniezahl 36 C KBE/ml 0 100 TrinkwV 15 (1c) M Coliforme Bakterien KBE/100 ml
2019022182 WV, Brunnen 1 4110803600009 08:20 Mikrobiologische Kenngrößen M Koloniezahl 22 C KBE/ml 0 100 TrinkwV 15 (1c) M Koloniezahl 36 C KBE/ml 0 100 TrinkwV 15 (1c) M Coliforme Bakterien KBE/100 ml
6. Seminar. Prof. Dr. Christoph Janiak. Literatur: Jander,Blasius, Lehrb. d. analyt. u. präp. anorg. Chemie, 15. Aufl., 2002
 ALBERT-LUDWIGS- UNIVERSITÄT FREIBURG 6. Seminar Prof. Dr. Christoph Janiak Literatur: Jander,Blasius, Lehrb. d. analyt. u. präp. anorg. Chemie, 15. Aufl., 2002 Riedel, Anorganische Chemie, 5. Aufl., 2002
ALBERT-LUDWIGS- UNIVERSITÄT FREIBURG 6. Seminar Prof. Dr. Christoph Janiak Literatur: Jander,Blasius, Lehrb. d. analyt. u. präp. anorg. Chemie, 15. Aufl., 2002 Riedel, Anorganische Chemie, 5. Aufl., 2002
PRÜFBERICHT
 Tel.: +49 (843) 79, Fax: +49 (843) 724 [@ANALYNR_START=252739] [@BARCODE= R] Dr.Blasy-Dr.Busse Moosstr. 6A, 82279 Eching Lindenstraße 3 87648 Aitrang DOC-5-359656-DE-P PRÜFBERICHT 735-252739 Auftrag Analysennr.
Tel.: +49 (843) 79, Fax: +49 (843) 724 [@ANALYNR_START=252739] [@BARCODE= R] Dr.Blasy-Dr.Busse Moosstr. 6A, 82279 Eching Lindenstraße 3 87648 Aitrang DOC-5-359656-DE-P PRÜFBERICHT 735-252739 Auftrag Analysennr.
Übung 6. Allgemeine Chemie I Herbstsemester O(l) H 3. (g), (4) G 0 R = ( 32.89) kj/mol ( ) kj/mol (5) G 0 R = 101.
 Übung 6 Allgemeine Chemie I Herbstsemester 01 1. Aufgabe MM Aufgabe 1.10 Wir betrachten zuerst den Fall X = F. Reaktionsgleichung: BX 3 (g) + 3 H O(l) H 3 BO 3 (aq) + 3 HX(g) (X = F oder Cl) G 0 R = i
Übung 6 Allgemeine Chemie I Herbstsemester 01 1. Aufgabe MM Aufgabe 1.10 Wir betrachten zuerst den Fall X = F. Reaktionsgleichung: BX 3 (g) + 3 H O(l) H 3 BO 3 (aq) + 3 HX(g) (X = F oder Cl) G 0 R = i
Zweckverband Mittelhessische Wasserwerke Teichweg Gießen
 Zweckverband Mittelhessische Wasserwerke Teichweg 24 35396 Gießen Ansprechpartner: Dr. H. Bodes-Fischer K. Greb-Bender Telefon: 06421-30908-10 Telefax: 06421-30908-44 Mail: info@umwelthygiene-marburg.de
Zweckverband Mittelhessische Wasserwerke Teichweg 24 35396 Gießen Ansprechpartner: Dr. H. Bodes-Fischer K. Greb-Bender Telefon: 06421-30908-10 Telefax: 06421-30908-44 Mail: info@umwelthygiene-marburg.de
