Stellungnahme zur Nutzenbewertung des G-BA von Arzneimitteln für seltene Leiden gemäß 35a SGB V und der Bewertung im IQWiG Bericht Nr. 181.
|
|
|
- Gotthilf Weber
- vor 5 Jahren
- Abrufe
Transkript
1 DGHO e. V. Alexanderplatz Berlin Gemeinsamer Bundesausschuss Wegelystr Berlin Hauptstadtbüro der DGHO Alexanderplatz Berlin Tel Fax: info@dgho.de 22. August 2013 Stellungnahme zur Nutzenbewertung des G-BA von Arzneimitteln für seltene Leiden gemäß 35a SGB V und der Bewertung im IQWiG Bericht Nr. 181 Bosutinib veröffentlicht am 1. August 2013 Vorgangsnummer D Zusammenfassung 2. Einleitung 3. Stand des Wissens Imatinib-Resistenz Imatinib-Unverträglichkeit Nebenwirkungen von TKI Bosutinib 4. Dossier und Bewertung von Bosutinib Zweckmäßige Vergleichstherapie Endpunkte: Ansprechen und Gesamtüberleben Chronische Phase Zweitlinientherapie nach Imatinib Chronische Phase Dritt- bzw. Viertlinientherapie Akzelerierte Phase / Blastenkrise Endpunkt: Nebenwirkungen Endpunkt: Lebensqualität 5 Ausmaß des Zusatznutzens 6. Literatur Geschäftsführender Vorsitzender Prof. Dr. med. Mathias Freund Vorsitzende Priv.-Doz. Dr. med. Diana Lüftner Sekretär und Schatzmeister komm.: Prof. Dr. med. Mathias Freund Amtsgericht Charlottenburg Registernummer 95 VR Nz Steuer-Nr. 1127/640/53399 USt-IdNr. DE Postgiroamt Karlsruhe BLZ Konto IBAN DE BIC PBNKDEFF info@dgho.de
2 Seite 2 von 8 1. Zusammenfassung Die Frühe Nutzenbewertung von Bosutinib (Bosulif ) wird im Rahmen seines Status als Medikament zur Behandlung einer seltenen Erkrankung (Orphan Drug) durchgeführt. Bosutinib ist zugelassen für Patienten mit Chronischer Myeloischer Leukämie, die mit einem oder mehreren Tyrosinkinase-Inhibitoren (TKI) vorbehandelt sind, und bei denen die Behandlung mit einem der anderen TKI Imatinib, Nilotinib oder Dasatinib nicht geeignet sind. Diese Bedingungen werden im Verfahren der Nutzenbewertung als Versorgungslücke bezeichnet. Der pharmazeutische Unternehmer beantragt die Feststellung eines erheblichen Zusatznutzens. Unsere Anmerkungen zum Dossier des pharmazeutischen Unternehmers und zum Bericht des G-BA sind: Die Durchführung einer Phase I/II Studie ist bei dieser seltenen Erkrankung und in dieser Therapiesituation angemessen (Orphan Drug). Von den 288 in die 3160A4-200-WW Studie eingeschlossenen Patienten erfüllten 52 die Kriterien der Versorgungslücke. Bosutinib ist ein weiterer, hoch wirksamer oraler Tyrosinkinase-Inhibitor. Er führt auch in der Zweit-, Dritt- und Viertlinientherapie zu dauerhaften Remissionen. Die bisher bekannten Nebenwirkungen von Bosutinib sind klinisch relevant, aber beherrschbar und reversibel. Der G-BA Bericht ist sehr detailliert. Er enthält keinen Vorschlag für die Kategorisierung des Zusatznutzens. Bosutinib stellt bei Problem-Patienten eine wertvolle Bereicherung der medikamentösen Therapie dar. Bosutinib hat einen klaren Nutzen in der Behandlung der CML. Wir halten es nicht für möglich, den Zusatznutzen auf der Basis der bisherigen Datenlage exakt zu quantifizieren. 2. Einleitung Die chronische myeloische Leukämie (CML) gehört zu den hämatologischen Neoplasien. Ihre Inzidenz beträgt etwa 1,5/ Einwohner und Jahr. In Deutschland erkranken jährlich etwa Patienten. Männer sind etwas häufiger betroffen als Frauen. Die CML kommt in allen Altersgruppen vor, der Erkrankungsgipfel liegt bei Jahren [1]. Der Tyrosinkinase-Inhibitor Imatinib war ein Durchbruch in der Behandlung der CML. In allen Prognosegruppen und in jedem Alter wurde eine deutliche Überlegenheit von Imatinib gegenüber einer IFN-basierten Therapie beobachtet und das langfristige Überleben von CML-Patienten erheblich verbessert [2]. Imatinib ist auch in fortgeschrittenen Stadien der CML wirksam. 3. Stand des Wissens Nach dem Erfolg von Imatinib wurden weitere TKI mit verbesserter Wirksamkeit entwickelt. Inzwischen stehen als Arzneimittel für die Behandlung der CML zur Verfügung: 2
3 Seite 3 von 8 - Imatinib (Glivec ) - Nilotinib (Tasigna ) - Dasatinib (Sprycel ) - Bosutinib (Bosulif ) - Ponatinib (Iclusig ) Daten vergleichender Studien zur Wirksamkeit neuer TKI versus Imatinib in der Erstlinientherapie sind in Tabelle 1 zusammengestellt. Tabelle 1: Vergleich der Wirksamkeit von neuen TKI versus Imatinib in der Erstlinientherapie der CML in chronischer Phase [1] Studie Kontrolle Neue N 1 CCgR 4 MMR 5 PFÜ 6 ÜL 7 Therapie ENESTnd Imatinib Nilotinib vs vs ,2 vs 98, ,3 vs 97,4 14 Saglio,2010 [3] p < 0,0001 p < 0,0001 p = 0,0736 Kantarjian, 2011 [4] DASISION Imatinib Dasatinib vs vs ,1 vs 93, ,2 vs 95,3 14 Kantarjian, 2010 [5], 2012 [6] 11 p < 0,0001 Radich, 2012 [7] Imatinib Dasatinib vs vs vs vs >97 15 p = 0,04 BELA Imatinib Bosutinib vs vs vs >99 11 Cortes, 2012 [8] p < 0,001 1 N Anzahl Patienten; 4 CCgR Rate kompletter zytogenetischer Remissionen nach 12 Monaten, außer wenn anders gekennzeichnet; 5 MMR Rate Majorer Molekularer Remissionen nach 12 Monaten, außer wenn anders gekennzeichnet; 6 PFÜ - Progressionsfreie Überlebensrate nach 12 Monaten, außer wenn anders gekennzeichnet; 7 ÜL Überlebensrate nach 12 Monaten, außer wenn anders gekennzeichnet; 9 Therapie: Bosutinib 500 mg/tag, Dasatinib 100 mg/tag, Imatinib 400 mg/tag, Nilotinib 300 mg/tag; 10 Ergebnis für Kontrolle, Ergebnis für Neue Therapie, 11 - nicht signifikant; 13 nach 3 Monaten; 14 nach 2 Jahren; 15 nach 3 Jahren; Die neuen TKI haben durchweg eine höhere Wirksamkeit als Imatinib in Bezug auf zytogenetische (CCgR) und molekulare Remissionen (MMR). Da Nilotinib und Dasatinib in den bisherigen Analysen das progressionsfreie und das Gesamtüberleben nicht signifikant gegenüber Imatinib verbessern, hält die DGHO alle drei TKI als Erstlinientherapie für geeignet [1], in Übereinstimmung mit den aktuellen Empfehlungen des European Leukemia Net (ELN) [9]. 3
4 Seite 4 von Imatinib-Resistenz In der Zulassungsstudie von Imatinib lag die jährliche Rate von Ereignissen, die eine Resistenz auf Imatinib anzeigten, zwischen 7,5% im zweiten und 0,4% im sechsten Jahr [10]. Die häufigste Ursache der TKI-Resistenz sind BCR-ABL-Punktmutationen mit verminderter bis aufgehobener Wirksamkeit von Imatinib. Inzwischen sind mehr als 100 Mutationen bekannt. Dazu kommen andere, punktmutationsunabhängige Resistenzmechanismen, deren Bedeutung jedoch noch nicht vollständig geklärt ist. Bei Imatinib-Resistenz wird der Wechsel auf einen der anderen zugelassenen Tyrosinkinase- Inhibitoren empfohlen. Nur in einer Minderheit der betroffenen Patienten kann diese Entscheidung mit hoher Zielgenauigkeit auf der Basis der resistenzverursachenden Mutation und des Wirkspektrums des am besten passenden TKI der zweiten Generation getroffen werden. Eine besonders hohe Wirksamkeit bei Patienten mit Mutation T315I hat nur Ponatinib (Iclusig ). Es wurde Anfang Juli 2013 von der EMA zugelassen Imatinib-Unverträglichkeit Insgesamt ist Imatinib ein gut verträgliches Medikament. Die Rate von nichthämatologischen Nebenwirkungen Grad 3/4 liegt unter 5% [11]. Allerdings sind auch einige der in der CTCAE Einteilung als weniger schwer eingestuften Nebenwirkungen für Patienten in der Langzeitbehandlung sehr belastend. Dazu gehören z. B. Muskelkrämpfe, Hautausschlag, Ödeme oder allgemeine Schwäche. Die Rate von Patienten, die wegen Unverträglichkeit eine Imatinib-Therapie abbrechen, liegt zwischen 2 und 5% [11, 12] Nebenwirkungen von TKI Das Nebenwirkungsspektrum der zugelassenen TKI unterscheidet sich deutlich. Das ist durch die verschiedenen Zielkinasen bedingt. Nilotinib (Tasigna ) hemmt neben BCR-ABL genauso wie Imatinib auch die Tyrosinkinasen PDGFR und c-kit, zeigt jedoch eine bessere zelluläre Bioverfügbarkeit und bindet mit höherer Affinität an die Zielstrukturen. Nilotinibassoziierte Nebenwirkungen sind Hyperglykämie, Fettstoffwechselstörungen, eine Häufung peripherer arterieller Verschlusskrankheit und anderer atherosklerotischer Erkrankungen. Dasatinib (Sprycel ) ist ein Multikinase-Inhibitor mit Wirkung u. a. gegen ABL, SRC, PDGFR und c-kit. Hauptnebenwirkung von Dasatinib ist neben Pleuraergüssen vor allem die Hämatotoxizität, im Vordergrund Thrombozytopenie. In seltenen Fällen ist pulmonale Hypertonie aufgetreten. Die Vermeidung langfristiger, für den Patienten belastender und/oder irreversibler Nebenwirkungen ist neben dem Erreichen des optimalen Ansprechens ein zentrales Ziel in der CML Therapie Bosutinib (Bosulif ) Bosutinib ist wie Dasatinib ein dualer SRC/ABL-Inhibitor. Es hat in vitro eine höhere inhibitorische Wirksamkeit gegen BCR-ABL als Imatinib, weist aber im Unterschied zu allen bisher für die Behandlung der CML zugelassenen TKI keine signifikante Hemmung 4
5 Seite 5 von 8 gegenüber den PDGF-Rezeptoren und c-kit auf. In der Erstlinientherapie führte es zu einer signifikant höheren Rate molekularer Remissionen, siehe Tabelle Dossier und Bewertung von Bosutinib Grundlage der Nutzenbewertung ist die Untergruppe einer Phase I/II Studie an insgesamt 288, mindestens mit Imatinib vorbehandelten Patienten. Aus dieser Studie wurde ein Kollektiv von Patienten identifiziert, für die es eine Versorgungslücke (EMA: unmet medical need) gibt. Diese CML Patienten befanden sich in chronischer Phase (n=36, davon 15 Patienten in Zweitlinientherapie und 21 Patienten in späteren Therapielinien), in akzelerierter Phase (n=5) oder einer Blastenkrise (n=11). Sie wurden bereits mit mindestens einem TKI behandelt und waren nicht geeignet für eine weitere Behandlung mit Imatinib, Dasatinib oder Nilotinib. 52 Patienten der 3160A4-200-WW Studie erfüllten diese Bedingung Zweckmäßige Vergleichstherapie Entsprechend der aktuellen Verfahrensordnung hat der G-BA keine zweckmäßige Vergleichstherapie in diesem Verfahren für seltene Leiden festgelegt. Vergleichstherapie für die Patienten mit einer Versorgungslücke ist die allogene Stammzelltransplantation bei geeigneten Patienten bzw. die Chemotherapie mit Hydroxyharnstoff bei für die Transplantation nicht-geeigneten Patienten Endpunkte: Ansprechen und Gesamtüberleben Objektive Endpunkte für das Therapieansprechen sind bei der CML neben der hämatologischen Remission mit Verbesserung bzw. Normalisierung des Blutbildes vor allem die zytogenetische Remission mit Rückgang der Ph+ Zellen sowie die molekulare Remission mit Rückgang der BCR-ABL Transkripte [1]. Für das Gesamtüberleben wurde im Dossier des pu jeweils die Anzahl der Todesfälle angegeben. Ergebnisse werden separat nach den unterschiedlichen Krankheitsphasen dargestellt. Einschränkend ist anzumerken, dass weder im Dossier des pu noch in der Publikation [] Daten zur Therapie nach Bosutinib aufgeführt sind. Insbesondere fehlen Angaben, ob und wie viele Patienten eine allogene Stammzelltransplantation erhielten Chronische Phase Zweitlinientherapie nach Imatinib 15 Patienten gehörten in diese Gruppe. 9 erreichten eine zytogenetische Remission mit <35% Ph+ Zellen (gute zytogenetische Remission). Daten zum hämatologischen Ansprechen sind dem Dossier des pu nicht zu entnehmen. 6 der 15 Patienten verstarben in der Nachbeobachtungszeit der Studie. In der Gesamtgruppe der 288 Patienten lagen die 2 Jahres-Überlebensraten bei 90,6%. Patienten mit einer Imatinib-Intoleranz hatten eine bessere Prognose als Patienten mit Imatinib-Resistenz (97,6 vs 87,6%) Chronische Phase Dritt- bzw. Viertlinientherapie 5
6 Seite 6 von 8 7 der 21 Patienten in dieser Gruppe erreichten eine komplette hämatologische Remission, 9 Patienten eine gute zytogenetische Remission. 5 der 21 Patienten verstarben Akzelerierte Phase / Blastenkrise 16 Patienten gehörten in diese Gruppe. 4 von 5 Patienten in der akzelerierten Phase zeigten ein hämatologisches, zytogenetisches und/oder molekulares Ansprechen. Von den 11 Patienten in der Blastenkrise erreichten 3 Patienten ein gutes hämatologisches oder zytogenetisches Ansprechen und konnten über mehr als 24 Wochen behandelt werden. 12 der 16 Patienten verstarben während der Laufzeit der Studie bzw. der Nachbeobachtungszeit Endpunkt: Nebenwirkungen Im Vordergrund der Nebenwirkungen von Bosutinib stehen gastrointestinale Symptome. Im Gesamtkollektiv der 288 Patienten der 3160A4-200-WW Studie trat Diarrhoe im Grad 3/4 bei 8%, in der BELA Studie bei 11% der Patienten auf. Weitere Nebenwirkungen im Grad 3/4 sind Übelkeit/Erbrechen (3160A4-200-WW Studie 1%, BELA Studie 3%) und Hautausschlag (3160A4-200-WW Studie 4%, BELA Studie 1%). Die Nebenwirkungen von Bosutinib sind klinisch relevant, aber beherrschbar und reversibel Endpunkt: Lebensqualität Die Erhebung der Lebensqualität wurde mit dem FACT-Leu Fragebogen durchgeführt. Er ist für Leukämie-Patienten konzipiert und validiert. Bei Auswertung aller Subgruppen zeigte sich eine signifikante Verbesserung der Lebensqualität bei Patienten in akzelerierter Phase bzw. Blastenkrise, während eine Verbesserung der Lebensqualität bei Patienten in chronischer Phase nicht oder nur in Untergruppen und nur zu einzelnen Zeitpunkten auftrat. Das Ergebnis ist plausibel und korreliert mit der stärkeren subjektiven Krankheitsbelastung der Patienten in fortgeschrittenen Krankheitsstadien. Eine separate Auswertung der 52 Patienten, die die Kriterien der Versorgungslücke erfüllen, ist dem Dossier nicht zu entnehmen. 5. Ausmaß des Zusatznutzens Der pharmazeutische Unternehmer beantragt die Feststellung eines erheblichen Zusatznutzens. Der G-BA Bericht enthält keinen Vorschlag für eine Kategorisierung. Wir halten es nicht für möglich, den Nutzen auf der Basis der bisherigen Datenlage mit kleinen Patientenzahlen in mehreren klinisch relevanten Subgruppen zu quantifizieren. Unter Bosutinib sind bisher, im Unterschied zu anderen Zweitgenerations-TKI, keine irreversiblen Nebenwirkungen aufgetreten. 6. Literatur 1. Hochhaus A et al.: Chronische myeloische Leukämie. Leitlinien von DGHO, OeGHO, SGMO und SGH+SSH, Status Januar
7 Seite 7 von 8 onkopedia.de/de/onkopedia/leitlinien/cml 2. Hehlmann R, Hochhaus A, Baccarani M: Chronic myeloid leukaemia. Lancet 370: , DOI: /S (07) Saglio G, Kim DW, Issaragrisil S, le Coutre P et al.: Nilotinib versus imatinib for newly diagnosed chronic myeloid leukemia. N Engl J Med 362:2251-9, PMID: Kantarjian HM, Hochhaus A, Saglio G et al.: Nilotinib versus imatinib for the treatment of patients with newly diagnosed chronic phase, philadelphia chromosome-positive, chronic myeloid leukaemia: 24-month minimum follow-up of the phase 3 randomised enestnd trial. Lancet Oncol 2011;12: DOI: /S (11) Kantarjian H, Shah NP, Hochhaus A et al.: Dasatinib versus imatinib in newly diagnosed chronic-phase chronic myeloid leukemia. N Engl J Med 362: , PMID: Kantarjian HM, Shah NP, Cortes JE et al.: Dasatinib or imatinib in newly diagnosed chronic phase chronic myeloid leukemia: 2-year follow-up from a randomized phase 3 trial (Dasision). Blood 119: , DOI: /blood Radich JP, Kopecky KJ, Appelbaum FR et al.: A randomized trial of dasatinib 100 mg versus imatinib 400 mg in newly diagnosed chronic-phase chronic myeloid leukemia. Blood 120: , DOI: /blood Cortes JE, Baccarani M, Guilhot F et al.: Phase III, randomized, open-label study of daily imatinib mesylate 400 mg versus 800 mg in patients with newly diagnosed, previously untreated chronic myeloid leukemia in chronic phase using molecular end points: Tyrosine kinase inhibitor optimization and selectivity study. J Clin Oncol 28: , DOI: /JCO Baccarani M, Deininger MW, Rosti G et al.: European LeukemiaNet recommendations for the management of chronic myeloid leukemia: Blood 122: , DOI: /blood Druker BJ, Guilhot F, O'Brien SG et al.: Five-year follow-up of patients receiving imatinib for chronic myeloid leukemia. N Engl J Med 355: , PMID: Kantarjian H, Sawyers C, Hochhaus A et al.: Hematologic and cytogenetic responses to imatinib mesylate in chronic myelogenous leukemia. N Engl J Med 2002;346: PMID: Gambacorti-Passertini C, Antolini L, Mahon XF et al.: Multicenter independent assessment of oucomes in chronic myeloid leukemia patients treated with imatinib. J Natl Cancer Inst 103: , DOI: /jnci/djr060 Die Stellungnahme wurde von Prof. Dr. B. Wörmann in Kooperation mit Prof. Dr. T. H. Brümmendorf (Universitätsklinikum Aachen, Med. Klinik IV, Hämatologie und Onkologie, Aachen), Prof. Dr. A. Hochhaus (Universitätsklinikum Jena, Klinik für Innere Medizin II, Abteilung Hämatologie & Onkologie, Jena), Prof. Dr. P. le Coutre (Charité Universitätsmedizin Berlin, Campus Virchow Klinikum, Med. Klinik mit Schwerpunkt Hämatologie, Onkologie und Tumorimmunologie, Berlin), Prof. Dr. C. Thiede (Universitätsklinikum Dresden, Medizinische Klinik und Poliklinik I, Dresden) und Prof. Dr. D. Wolf (Universitätsklinikum Bonn, Innere Medizin III für Hämatologie und Onkologie, Bonn) erstellt. 7
8 Seite 8 von 8 Mit freundlichen Grüßen Prof. Dr. med. Mathias Freund Geschäftsführender Vorsitzender Priv.-Doz. Dr. med. Diana Lüftner Vorsitzende Prof. Dr. med. Martin Wilhelm Mitglied im Vorstand - Sekretär 8
ICLUSIG erweitert die Therapieoptionen der Chronischen Myeloischen Leukämie und der Philadelphia-C
 ICLUSIG erweitert die Therapieoptionen der Chronischen Myeloischen Leukämie und der Philadelphia-C ICLUSIG erweitert die Therapieoptionen der Chronischen Myeloischen Leukämie und der Philadelphia-Chromosom
ICLUSIG erweitert die Therapieoptionen der Chronischen Myeloischen Leukämie und der Philadelphia-C ICLUSIG erweitert die Therapieoptionen der Chronischen Myeloischen Leukämie und der Philadelphia-Chromosom
Umgang mit der gezielten Krebstherapie lernen
 Pfizer nimmt Bosulif vom deutschen Markt Nutzen, Nebenwirkungen und Kosten - den Umgang mit der gezielten Krebstherapie lernen Berlin (15. November 2013) Heute wurde die Marktrücknahme des gezielten Medikamentes
Pfizer nimmt Bosulif vom deutschen Markt Nutzen, Nebenwirkungen und Kosten - den Umgang mit der gezielten Krebstherapie lernen Berlin (15. November 2013) Heute wurde die Marktrücknahme des gezielten Medikamentes
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Ponatinib wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Stellungnahme zur Nutzenbewertung gemäß 35a SGB V. Vemurafenib
 DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Bosutinib wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Prof J Passweg Klinik Hämatologie
 Prof J Passweg Klinik Hämatologie Leukozytose Ausschwemmung aller Vorstufen Thrombozytose Splenomegalie 1 Genetische Anomalie -> 1 Maligne Erkrankung Klonale Evolution Gezielte Therapie: Tyrosinkinaseinhibitor
Prof J Passweg Klinik Hämatologie Leukozytose Ausschwemmung aller Vorstufen Thrombozytose Splenomegalie 1 Genetische Anomalie -> 1 Maligne Erkrankung Klonale Evolution Gezielte Therapie: Tyrosinkinaseinhibitor
Stellungnahme zur Nutzenbewertung gemäß 35a SGB V. Ipilimumab. veröffentlicht am 17. März 2014 Vorgangsnummer D-090 IQWiG Bericht Nr.
 DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
(Imatinib) aufweisen. Durch die Zulassung von Tasigna können wir mehr Patienten mit CML helfen. Mit Glivec als Primärtherapie
 Tasigna (Nilotinib) erhält in der Europäischen Union die Zulassung für die Zweitlinientherapie von CML-Patienten Frankfurt am Main (17. Dezember 2007) - Tasigna führte zu einem guten zytogenetischen Ansprechen
Tasigna (Nilotinib) erhält in der Europäischen Union die Zulassung für die Zweitlinientherapie von CML-Patienten Frankfurt am Main (17. Dezember 2007) - Tasigna führte zu einem guten zytogenetischen Ansprechen
Stellungnahme zur Nutzenbewertung des IQWiG gemäß 35a SGB V. Cabozantinib
 DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
CML. Myeloproliferation. CML Klinischer Verlauf. CML: Modellerkrankung. Philadelphia Chromosom. Chronische Phase. Blastenkrise
 CML Myeloproliferation rof J assweg Klinik Hämatologie Leukozytose Ausschwemmung aller Vorstufen Thrombozytose Splenomegalie CML: Modellerkrankung CML Klinischer Verlauf Klonale Evolution 1 Genetische
CML Myeloproliferation rof J assweg Klinik Hämatologie Leukozytose Ausschwemmung aller Vorstufen Thrombozytose Splenomegalie CML: Modellerkrankung CML Klinischer Verlauf Klonale Evolution 1 Genetische
Bosutinib (neues Anwendungsgebiet: neu diagnostizierte chronische myeloische Leukämie)
 Bosutinib (neues Anwendungsgebiet: neu diagnostizierte chronische myeloische Leukämie) Beschluss vom: 22. ovember 2018 gültig bis: 01.06.2021 In Kraft getreten am: 22. ovember 2018 BAnz AT 17.12.2018 B3
Bosutinib (neues Anwendungsgebiet: neu diagnostizierte chronische myeloische Leukämie) Beschluss vom: 22. ovember 2018 gültig bis: 01.06.2021 In Kraft getreten am: 22. ovember 2018 BAnz AT 17.12.2018 B3
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V Bosutinib
Beschluss des Gemeinsamen Bundesausschusses über eine der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V Bosutinib
Stellungnahme zur Nutzenbewertung des G-BA von Arzneimitteln gemäß 35a SGB V. Osimertinib
 DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
Lenvatinib (neues Anwendungsgebiet, Nierenzellkarzinom)
 DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
LebensMUT-Patiententag: Grundlagen und neue Entwicklungen zur Behandlung der CML
 Technische Universität München LebensMUT-Patiententag: Grundlagen und neue Entwicklungen zur Behandlung der CML 21.09.2013 Philipp J. Jost Roman-Herzog-Krebszentrum Comprehensive Cancer Center Technische
Technische Universität München LebensMUT-Patiententag: Grundlagen und neue Entwicklungen zur Behandlung der CML 21.09.2013 Philipp J. Jost Roman-Herzog-Krebszentrum Comprehensive Cancer Center Technische
Stellungnahme zur Nutzenbewertung des IQWiG gemäß 35a SGB V. Fidaxomicin
 DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Mathias Freund Geschäftsführender Vorsitzender Priv.-Doz. Dr. med. Diana Lüftner Vorsitzende
DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Mathias Freund Geschäftsführender Vorsitzender Priv.-Doz. Dr. med. Diana Lüftner Vorsitzende
Stellungnahme zur Nutzenbewertung des IQWiG gemäß 35a SGB V. Vandetanib
 DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
Ibrutinib (neues Anwendungsgebiet, nach Überschreiten der Umsatzgrenze)
 DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
Stellungnahme zur Nutzenbewertung gemäß 35a SGB V. TrastuzumabEmtansin
 DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27876089-0 Fax: 030.27 87 60 89-18 info@dgho.de
DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27876089-0 Fax: 030.27 87 60 89-18 info@dgho.de
Stellungnahme zur Nutzenbewertung gemäß 35a SGB V. Enzalutamid (neues Anwendungsgebiet)
 DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
Cabozantinib (neues Anwendungsgebiet, Nierenzellkarzinom)
 DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
Imatinib. Imatinib. nach wie vor Standard in der Therapie der chronischen myeloischen Leukämie 1. Imatinib Koanaa 100 mg und 400 mg Filmtabletten
 Imatinib Koanaa 100 mg und 400 mg Filmtabletten Imatinib nach wie vor Standard in der Therapie der chronischen myeloischen Leukämie 1 1. A. Hochhaus et.al New England Journal of Medicine March 9, 2017
Imatinib Koanaa 100 mg und 400 mg Filmtabletten Imatinib nach wie vor Standard in der Therapie der chronischen myeloischen Leukämie 1 1. A. Hochhaus et.al New England Journal of Medicine March 9, 2017
Chronische myeloische Leukämie Update 2013
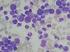 Chronische myeloische Leukämie Update 2013 Während 10 Jahren war Imatinib (Glivec ) die Standardbehandlung der chronischen myeloischen Leukämie (CML). In den letzten Jahren wurden mit Nilotinib (Tasigna
Chronische myeloische Leukämie Update 2013 Während 10 Jahren war Imatinib (Glivec ) die Standardbehandlung der chronischen myeloischen Leukämie (CML). In den letzten Jahren wurden mit Nilotinib (Tasigna
Aktuell rekrutierende Studien. für erwachsene CML-Patienten. Stand.10/2017
 Aktuell rekrutierende Studien für erwachsene CML-Patienten Stand.10/2017 Liebe Kolleginnen und Kollegen, als Studiengruppe möchten wir allen CML-Patienten den Zugang zu zukunftsweisenden Therapieoptionen
Aktuell rekrutierende Studien für erwachsene CML-Patienten Stand.10/2017 Liebe Kolleginnen und Kollegen, als Studiengruppe möchten wir allen CML-Patienten den Zugang zu zukunftsweisenden Therapieoptionen
Stellungnahme zur Nutzenbewertung des IQWiG gemäß 35a SGB V. Pixantron
 DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 20.01.2011 Dossier zur Nutzenbewertung gemäß 35a SGB V Ponatinib (Iclusig ) ARIAD Pharmaceuticals (Germany) GmbH Modul 1 Zusammenfassung der Aussagen im Dossier Stand: 01.08.2013
Dokumentvorlage, Version vom 20.01.2011 Dossier zur Nutzenbewertung gemäß 35a SGB V Ponatinib (Iclusig ) ARIAD Pharmaceuticals (Germany) GmbH Modul 1 Zusammenfassung der Aussagen im Dossier Stand: 01.08.2013
Anlage III - Vorlage zur Abgabe einer schriftlichen Stellungnahme zur Nutzenbewertung nach 35a SGB V und Kosten-Nutzen-Bewertung nach 35b SGB V
 Anlage III - Vorlage zur Abgabe einer schriftlichen Stellungnahme zur Nutzenbewertung nach 35a SGB V und Kosten-Nutzen-Bewertung nach 35b SGB V Datum 24. September 2018 Stellungnahme zu Bosutinib (chronische
Anlage III - Vorlage zur Abgabe einer schriftlichen Stellungnahme zur Nutzenbewertung nach 35a SGB V und Kosten-Nutzen-Bewertung nach 35b SGB V Datum 24. September 2018 Stellungnahme zu Bosutinib (chronische
Chronische myeloproliferative Neoplasien. Philipp le Coutre
 Chronische myeloproliferative Neoplasien Philipp le Coutre 1. CML: 50 Jahre Philadelphia Chromosom (Nowell & Hungerford Science 1960) 2. Ph negative CMPN: 5 Jahre JAKII Mutation (Kralovics et al. NEJM
Chronische myeloproliferative Neoplasien Philipp le Coutre 1. CML: 50 Jahre Philadelphia Chromosom (Nowell & Hungerford Science 1960) 2. Ph negative CMPN: 5 Jahre JAKII Mutation (Kralovics et al. NEJM
Ibrutinib (erneute Nutzenbewertung)
 DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
Stellungnahme zur Nutzenbewertung gemäß 35a SGB V. Regorafenib. veröffentlicht am 2. Januar 2014 Vorgangsnummer D-077 IQWiG Bericht Nr.
 DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
Leukämie (CML) Was ist Chronische Myeloische Leukämie? Download. Published on Novartis Austria (https://www.novartis.at)
 Published on Novartis Austria (https://www.novartis.at) Home > Printer-friendly PDF > Leukämie (CML) Leukämie (CML) Was ist Chronische Myeloische Leukämie? Die chronische myeloische Leukämie (CML) ist
Published on Novartis Austria (https://www.novartis.at) Home > Printer-friendly PDF > Leukämie (CML) Leukämie (CML) Was ist Chronische Myeloische Leukämie? Die chronische myeloische Leukämie (CML) ist
Chronisch myeloische Leukämie Erstlinentherapien (TKI+ PegIFN) Neuer Wirkmechanismus Update TKI-STOP
 Höhepunkte des Amerikanischen Hämatologie-Kongresses Orlando, 2015 Dr. Sebastian Saur, Med. Klinik II, Universitätsklinik Tübingen Chronisch myeloische Leukämie Erstlinentherapien (TKI+ PegIFN) Neuer Wirkmechanismus
Höhepunkte des Amerikanischen Hämatologie-Kongresses Orlando, 2015 Dr. Sebastian Saur, Med. Klinik II, Universitätsklinik Tübingen Chronisch myeloische Leukämie Erstlinentherapien (TKI+ PegIFN) Neuer Wirkmechanismus
Hämatologische Erkrankungen - Neue Behandlungsmöglichkeiten bei CLL / CML
 Hämatologische Erkrankungen - Neue Behandlungsmöglichkeiten bei CLL / CML Von Priv.-Doz. Dr. R. Liersch Gemeinschaftspraxis für Hämatologie und Onkologie, Münster Innere Medizin III (Hämatologie/Onkologie)Clemenshospital
Hämatologische Erkrankungen - Neue Behandlungsmöglichkeiten bei CLL / CML Von Priv.-Doz. Dr. R. Liersch Gemeinschaftspraxis für Hämatologie und Onkologie, Münster Innere Medizin III (Hämatologie/Onkologie)Clemenshospital
Stellungnahme zur Nutzenbewertung gemäß 35a SGB V. Afatinib. veröffentlicht am 17. August 2015 Vorgangsnummer D-163 IQWiG Bericht Nr.
 DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
Stellungnahme zur Nutzenbewertung des G-BA gemäß 35a SGB V. Olaratumab. veröffentlicht am 1. März 2017 Vorgangsnummer D-265
 DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
Stellungnahme zum Abschlussbericht des IQWiG Stammzelltransplantation bei Multiplem Myelom N05-03C
 Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin An das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen IQWiG Stellungnahme zum Absclussbericht N05-03C Prof. Dr. med. Jürgen Windeler
Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin An das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen IQWiG Stellungnahme zum Absclussbericht N05-03C Prof. Dr. med. Jürgen Windeler
CHRONISCHE MYELOISCHE LEUKÄMIE CML: CHRONISCHE MYELOISCHE LEUKÄMIE
 Technische Universität München Technische Universität München CHRONISCHE MYELOISCHE LEUKÄMIE CML: CHRONISCHE MYELOISCHE LEUKÄMIE oeine bösartige Erkrankung der blutbildenden Zellen und seltene Form der
Technische Universität München Technische Universität München CHRONISCHE MYELOISCHE LEUKÄMIE CML: CHRONISCHE MYELOISCHE LEUKÄMIE oeine bösartige Erkrankung der blutbildenden Zellen und seltene Form der
Cabozantinib (Nierenzellkarzinom, Neubewertung nach Fristablauf)
 DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin 5. Februar 2018 Stellungnahme zur Nutzenbewertung gemäß 35a SGB V Cabozantinib (Nierenzellkarzinom, Neubewertung
DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin 5. Februar 2018 Stellungnahme zur Nutzenbewertung gemäß 35a SGB V Cabozantinib (Nierenzellkarzinom, Neubewertung
TKI-Therapie bei CML: Wann ist es genug?
 TKI-Therapie bei CML: Wann ist es genug? Dr. med. Jürgen Wehmeyer, Facharzt für Innere Medizin, Hämatologie und internistische Onkologie, Gemeinschaftspraxis für Hämatologie und Onkologie, Münster 23.12.2016
TKI-Therapie bei CML: Wann ist es genug? Dr. med. Jürgen Wehmeyer, Facharzt für Innere Medizin, Hämatologie und internistische Onkologie, Gemeinschaftspraxis für Hämatologie und Onkologie, Münster 23.12.2016
Stellungnahme zur Nutzenbewertung des G-BA von Arzneimitteln für seltene Leiden gemäß 35a SGB V. Ixazomib
 DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
Primum non nocere und Profitstreben der pharmazeutischen Industrie ein unauflösbarer Widerspruch in der Onkologie?
 AMB 2013, 47, 33 Primum non nocere und Profitstreben der pharmazeutischen Industrie ein unauflösbarer Widerspruch in der Onkologie? Zusammenfassung: Obwohl inzwischen fünf, teilweise miteinander konkurrierende
AMB 2013, 47, 33 Primum non nocere und Profitstreben der pharmazeutischen Industrie ein unauflösbarer Widerspruch in der Onkologie? Zusammenfassung: Obwohl inzwischen fünf, teilweise miteinander konkurrierende
Pharmazeutische Biologie SS2011. Wie zielgerichtet sind Arzneimittel heute schon?
 Pharmazeutische Biologie SS2011 Wie zielgerichtet sind Arzneimittel heute schon? Prof. Theo Dingermann Institut für Pharmazeutische Biologie Biozentrum Max-von Laue-Str. 9 60438 Frankfurt am Main Dingermann@em.uni-frankfurt.de
Pharmazeutische Biologie SS2011 Wie zielgerichtet sind Arzneimittel heute schon? Prof. Theo Dingermann Institut für Pharmazeutische Biologie Biozentrum Max-von Laue-Str. 9 60438 Frankfurt am Main Dingermann@em.uni-frankfurt.de
Nivolumab (neues Anwendungsgebiet)
 DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
Stellungnahme zur Nutzenbewertung gemäß 35a SGB V. Cobimetinib. veröffentlicht am 15. März 2016 Vorgangsnummer D-196 IQWiG Bericht Nr.
 DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
Ipilimumab (neues Anwendungsgebiet, Melanom, Jugendliche ab 12 Jahren)
 DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin 5. Juni 2018 Stellungnahme zur Nutzenbewertung des G-BA von Arzneimitteln gemäß 35a SGB V (neues Anwendungsgebiet,
DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin 5. Juni 2018 Stellungnahme zur Nutzenbewertung des G-BA von Arzneimitteln gemäß 35a SGB V (neues Anwendungsgebiet,
Bosutinib (vorbehandelte chronische myeloische Leukämie)
 IQWiG-Berichte Nr. 682 Bosutinib (vorbehandelte chronische myeloische Leukämie) Nutzenbewertung gemäß 35a SGB V Dossierbewertung Auftrag: A18-54 Version: 1.0 Stand: 28.11.2018 Impressum Herausgeber: Institut
IQWiG-Berichte Nr. 682 Bosutinib (vorbehandelte chronische myeloische Leukämie) Nutzenbewertung gemäß 35a SGB V Dossierbewertung Auftrag: A18-54 Version: 1.0 Stand: 28.11.2018 Impressum Herausgeber: Institut
CML-Therapie im Wandel TFR als mögliches Behandlungsziel. Martin C. Müller. Onko-Update 2017 Duisburg, 24. Juni 2017
 Onko-Update 2017 Duisburg, 24. Juni 2017 CML-Therapie im Wandel TFR als mögliches Behandlungsziel Martin C. Müller Institut für Hämatologie und Onkologie (IHO) GmbH c/o Haematologie-Labor Mannheim und
Onko-Update 2017 Duisburg, 24. Juni 2017 CML-Therapie im Wandel TFR als mögliches Behandlungsziel Martin C. Müller Institut für Hämatologie und Onkologie (IHO) GmbH c/o Haematologie-Labor Mannheim und
Dossierbewertung A16-64 Version 1.1 Idelalisib (chronische lymphatische Leukämie)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Idelalisib für das im September 2016 neu zugelassene Anwendungsgebiet gemäß
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Idelalisib für das im September 2016 neu zugelassene Anwendungsgebiet gemäß
Bosutinib Bewertung gemäß 35a Abs. 1 Satz 10 SGB V Dossierbewertung
 IQWiG-Berichte Nr. 181 Bosutinib Bewertung gemäß 35a Abs. 1 Satz 10 SGB V Dossierbewertung Auftrag: G13-01 Version: 1.0 Stand: 22.07.2013 Impressum Herausgeber: Institut für Qualität und Wirtschaftlichkeit
IQWiG-Berichte Nr. 181 Bosutinib Bewertung gemäß 35a Abs. 1 Satz 10 SGB V Dossierbewertung Auftrag: G13-01 Version: 1.0 Stand: 22.07.2013 Impressum Herausgeber: Institut für Qualität und Wirtschaftlichkeit
Stellungnahme zur Nutzenbewertung des IQWiG gemäß 35a SGB V. Vandetanib
 DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin 9. Mai 2017 Stellungnahme zur Nutzenbewertung des IQWiG gemäß 35a SGB V Vandetanib Vorgangsnummer 2017-01-15-D-270
DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin 9. Mai 2017 Stellungnahme zur Nutzenbewertung des IQWiG gemäß 35a SGB V Vandetanib Vorgangsnummer 2017-01-15-D-270
Pharmazeutische Biologie SS2011. Wie zielgerichtet sind Arzneimittel heute schon?
 Pharmazeutische Biologie SS2011 Wie zielgerichtet sind Arzneimittel heute schon? Prof. Theo Dingermann Institut für Pharmazeutische Biologie Biozentrum Max-von Laue-Str. 9 60438 Frankfurt am Main Dingermann@em.uni-frankfurt.de
Pharmazeutische Biologie SS2011 Wie zielgerichtet sind Arzneimittel heute schon? Prof. Theo Dingermann Institut für Pharmazeutische Biologie Biozentrum Max-von Laue-Str. 9 60438 Frankfurt am Main Dingermann@em.uni-frankfurt.de
Dossierbewertung A13-41 Version 1.0 Afatinib Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Afatinib gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis eines
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Afatinib gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis eines
Stellungnahme zur Nutzenbewertung des G-BA von Arzneimitteln für seltene Leiden gemäß 35a SGB V. Daratumumab
 DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
Obinutuzumab (neues Anwendungsgebiet)
 DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
Stellungnahme zur Nutzenbewertung gemäß 35a SGB V. Nintedanib. veröffentlicht am 1. April 2015 Vorgangsnummer D-147 IQWiG Bericht Nr.
 DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
Nivolumab (neues Anwendungsgebiet: Melanom, in Kombination mit Ipilimumab)
 DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
Nivolumab (neues Anwendungsgebiet, Nierenzellkarzinom)
 DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
Mündliche Anhörung. gemäß 5. Kapitel 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses. hier: Wirkstoff Bosutinib
 Mündliche Anhörung gemäß 5. Kapitel 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses hier: Wirkstoff Bosutinib Sitzung im Hause des Gemeinsamen Bundesausschusses in Berlin am 7. Januar 2019
Mündliche Anhörung gemäß 5. Kapitel 19 Abs. 2 Verfahrensordnung des Gemeinsamen Bundesausschusses hier: Wirkstoff Bosutinib Sitzung im Hause des Gemeinsamen Bundesausschusses in Berlin am 7. Januar 2019
Vorsitzender Dr. med. Friedrich Overkamp
 Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de Berlin, 22. September 2010 Stellungnahme
Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de Berlin, 22. September 2010 Stellungnahme
Vismodegib (Neubewertung nach Fristablauf)
 DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
Nivolumab Erstlinientherapie des BRAF V600-Wildtyp-Melanoms in Kombination mit Ipilimumab Neubewertung nach erneutem Fristablauf
 DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
Qualitätssicherung in der Behandlung von Leukämiepatienten
 Qualitätssicherung in der Behandlung von Leukämiepatienten Leitlinien Netzwerke Patienteninformation Prof. Dr. med. Bernhard Wörmann Berlin, 20. September 2014 Hämatologie und Medizinische Onkologie Herausforderungen
Qualitätssicherung in der Behandlung von Leukämiepatienten Leitlinien Netzwerke Patienteninformation Prof. Dr. med. Bernhard Wörmann Berlin, 20. September 2014 Hämatologie und Medizinische Onkologie Herausforderungen
22. Onkologisches Symposium Große Fortschritte in der Leukämietherapie
 22. Onkologisches Symposium - 21.01.2017 Große Fortschritte in der Leukämietherapie Prof. Dr. Wolfgang Herr Klinik und Poliklinik für Innere Medizin III - Hämatologie und intern. Onkologie Leukämien (Patienten
22. Onkologisches Symposium - 21.01.2017 Große Fortschritte in der Leukämietherapie Prof. Dr. Wolfgang Herr Klinik und Poliklinik für Innere Medizin III - Hämatologie und intern. Onkologie Leukämien (Patienten
Stellungnahme zur Nutzenbewertung gemäß 35a SGB V. Afatinib. veröffentlicht am 17. Februar 2014 Vorgangsnummer D-082 IQWiG Bericht Nr.
 DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Hauptstadtbüro der DGHO Alexanderplatz 1 10178 Berlin Tel. 030.27 87 60 89-0 Fax: 030.27 87 60 89-18 info@dgho.de
Dossierbewertung A16-25 Version 1.0 Nivolumab (nicht plattenepitheliales NSCLC)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Nivolumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis eines
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Nivolumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis eines
Persönliche PDF-Datei für A. Hochhaus
 Persönliche PDF-Datei für A. Hochhaus Mit den besten Grüßen vom Georg Thieme Verlag www.thieme.de Therapiekonzepte der chronischen myeloischen Leukämie (CML) 10.1055/s-0041-111338 TumorDiagn u Ther 2016;
Persönliche PDF-Datei für A. Hochhaus Mit den besten Grüßen vom Georg Thieme Verlag www.thieme.de Therapiekonzepte der chronischen myeloischen Leukämie (CML) 10.1055/s-0041-111338 TumorDiagn u Ther 2016;
Bosutinib (Bosulif )
 Bosutinib (Bosulif ) Tyrosinkinase-Inhibitoren (TKIs) sind seit mehr als zehn Jahren ein fester Bestandteil in der Behandlung der chronisch myeloischen Leukämie (CML). Imatinib (Glivec ) revolutionierte
Bosutinib (Bosulif ) Tyrosinkinase-Inhibitoren (TKIs) sind seit mehr als zehn Jahren ein fester Bestandteil in der Behandlung der chronisch myeloischen Leukämie (CML). Imatinib (Glivec ) revolutionierte
Crizotinib (Neubewertung nach Fristablauf)
 DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
Neues vom ASH Rudolf Weide Koblenz. Chronisch Myeloische Leukämie
 Neues vom ASH 2016 Rudolf Weide Koblenz Chronisch Myeloische Leukämie 1 2 3 -Paper 627: -Dasatinib stimuliert die NK-Zellfunktion -Dasatinib induziert einen reiferen Immunphänotyp -Interferon induziert
Neues vom ASH 2016 Rudolf Weide Koblenz Chronisch Myeloische Leukämie 1 2 3 -Paper 627: -Dasatinib stimuliert die NK-Zellfunktion -Dasatinib induziert einen reiferen Immunphänotyp -Interferon induziert
Abirateron (neues Anwendungsgebiet)
 DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Mathias Freund Geschäftsführender Vorsitzender Priv.-Doz. Dr. med. Diana Lüftner Vorsitzende
DGHO e. V. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Mathias Freund Geschäftsführender Vorsitzender Priv.-Doz. Dr. med. Diana Lüftner Vorsitzende
Dabrafenib (neues Anwendungsgebiet)
 DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
Chronische myeloische Leukämie (CML)
 1/14 Chronische myeloische Leukämie (CML) Diagnostische Empfehlung Methode Antikoagulans Empfehlung Zytomorphologie EDTA obligat Immunphänotypisierung Heparin obligat Chromosomenanalyse EDTA oder Heparin
1/14 Chronische myeloische Leukämie (CML) Diagnostische Empfehlung Methode Antikoagulans Empfehlung Zytomorphologie EDTA obligat Immunphänotypisierung Heparin obligat Chromosomenanalyse EDTA oder Heparin
Dossierbewertung A16-11 Version 1.0 Ramucirumab (Lungenkarzinom)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ramucirumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ramucirumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
Dossierbewertung A16-24 Version 1.0 Nivolumab (Nierenzellkarzinom)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Nivolumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis eines
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Nivolumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis eines
Stellungnahme zur Nutzenbewertung des G-BA von Arzneimitteln gemäß 35a SGB V. Sonidegib
 DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Michael Hallek Geschäftsführender Vorsitzender Prof. Dr. med. Carsten Bokemeyer Vorsitzender
DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Michael Hallek Geschäftsführender Vorsitzender Prof. Dr. med. Carsten Bokemeyer Vorsitzender
Stellungnahme zur Nutzenbewertung des G-BA von Arzneimitteln für seltene Leiden gemäß 35a SGB V. Venetoclax
 DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
Dossierbewertung A16-60 Version 1.0 Ibrutinib (chronische lymphatische Leukämie)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ibrutinib in Kombination mit Bendamustin und Rituximab (Ibrutinib + BR) gemäß
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ibrutinib in Kombination mit Bendamustin und Rituximab (Ibrutinib + BR) gemäß
Beschluss. im Alter von 5 Jahren und älter)
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Abirateron (neues Anwendungsgebiet, metastasiertes hormonsensitives Prostatakarzinom)
 Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin 5. April 2018 Gemeinsame Stellungnahme zur Nutzenbewertung gemäß 35a SGB V Abirateron (neues Anwendungsgebiet, metastasiertes hormonsensitives Prostatakarzinom)
Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin 5. April 2018 Gemeinsame Stellungnahme zur Nutzenbewertung gemäß 35a SGB V Abirateron (neues Anwendungsgebiet, metastasiertes hormonsensitives Prostatakarzinom)
Chronische Myeloische Leukämie (CML)
 Chronische Myeloische Leukämie (CML) Bundesverband der Selbsthilfeorganisationen zur Unterstützung von Erwachsenen mit Leukämien und Lymphomen e.v. Unter der Schirmherrschaft von DLH-Geschäftsstelle: Thomas-Mann-Str.
Chronische Myeloische Leukämie (CML) Bundesverband der Selbsthilfeorganisationen zur Unterstützung von Erwachsenen mit Leukämien und Lymphomen e.v. Unter der Schirmherrschaft von DLH-Geschäftsstelle: Thomas-Mann-Str.
Dossierbewertung A14-01 Version 1.0 Trastuzumab Emtansin Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Trastuzumab Emtansin gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Trastuzumab Emtansin gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf
Heute geschlossene Veranstaltung? AMNOG Anhörung. Bernhard Wörmann. Brennpunkt, 27. November 2013
 Heute geschlossene Veranstaltung? AMNOG Anhörung Bernhard Wörmann Brennpunkt, 27. November 2013 pu IQWiG G-BA Kostenträger Fachgesellschaft Patienten Zulassung Dossier Bericht Kommentar Anhörung Festlegung
Heute geschlossene Veranstaltung? AMNOG Anhörung Bernhard Wörmann Brennpunkt, 27. November 2013 pu IQWiG G-BA Kostenträger Fachgesellschaft Patienten Zulassung Dossier Bericht Kommentar Anhörung Festlegung
Dossierbewertung A16-10 Version 1.0 Ramucirumab (Kolorektalkarzinom)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ramucirumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ramucirumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
Afatinib (neues Anwendungsgebiet, Plattenepithelkarzinom)
 Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin 22. August 2016 Gemeinsame Stellungnahme zur Nutzenbewertung gemäß 35a SGB V Afatinib (neues Anwendungsgebiet, Plattenepithelkarzinom) veröffentlicht
Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin 22. August 2016 Gemeinsame Stellungnahme zur Nutzenbewertung gemäß 35a SGB V Afatinib (neues Anwendungsgebiet, Plattenepithelkarzinom) veröffentlicht
Pembrolizumab (neues Anwendungsgebiet, nichtkleinzelliges Lungenkarzinom, Zweitlinie)
 DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
Stellungnahme zur Nutzenbewertung des G-BA von Arzneimitteln für seltene Leiden gemäß 35a SGB V. Crizotinib
 DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
EU-Zulassungsaktualisierung von Nilotinib: Wird das Absetzen der Therapie zum gängigen Behandlungsziel?
 EU-Zulassungsaktualisierung von Nilotinib: Wird das Absetzen der Therapie zum gängigen Behandlungsziel? Jens Haenig, PhD Medical Director CML Stuttgart, 30. September 2017 Freigegeben zur Präsentation
EU-Zulassungsaktualisierung von Nilotinib: Wird das Absetzen der Therapie zum gängigen Behandlungsziel? Jens Haenig, PhD Medical Director CML Stuttgart, 30. September 2017 Freigegeben zur Präsentation
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Stellungnahme zur Nutzenbewertung des G-BA von Arzneimitteln für seltene Leiden gemäß 35a SGB V. Brentuximab Vedotin
 DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
Pomalidomid (erneute Nutzenbewertung)
 DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
DGHO e.v. Alexanderplatz 1 10178 Berlin Gemeinsamer Bundesausschuss Wegelystr. 8 10623 Berlin Prof. Dr. med. Carsten Bokemeyer Geschäftsführender Vorsitzender Prof. Dr. med. Michael Hallek Vorsitzender
EU-Kommission erteilt Zulassung für IRESSA
 Erste personalisierte Therapie von Lungenkrebs EU-Kommission erteilt Zulassung für IRESSA Frankfurt am Main (1.Juli 2009) - Die Europäische Kommission hat für das Krebsmedikament IRESSA (Gefitinib) die
Erste personalisierte Therapie von Lungenkrebs EU-Kommission erteilt Zulassung für IRESSA Frankfurt am Main (1.Juli 2009) - Die Europäische Kommission hat für das Krebsmedikament IRESSA (Gefitinib) die
AMNOG: Wenn Innovation aufs System trifft: Ist das AMNOG System fit für Innovation- Beispiel Onkologie
 AMNOG: Wenn Innovation aufs System trifft: Ist das AMNOG System fit für Innovation- Beispiel Onkologie Dr. Jutta Wendel-Schrief Direktor Market Access MSD SHARP & DOHME GMBH Was sind Innovationen? Neue
AMNOG: Wenn Innovation aufs System trifft: Ist das AMNOG System fit für Innovation- Beispiel Onkologie Dr. Jutta Wendel-Schrief Direktor Market Access MSD SHARP & DOHME GMBH Was sind Innovationen? Neue
