Komplette Zusammenfassung der wissenschaftlichen Beurteilung von Arzneimitteln, die Bisphosphonate enthalten (siehe Anhang I)
|
|
|
- Lennart Hoch
- vor 7 Jahren
- Abrufe
Transkript
1 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Zusammenfassungen der Merkmale des Arzneimittels und von Packungsbeilagen, die von der EMA vorgelegt wurden 240
2 Wissenschaftliche Schlussfolgerungen Komplette Zusammenfassung der wissenschaftlichen Beurteilung von Arzneimitteln, die Bisphosphonate enthalten (siehe Anhang I) Bisphosphonate sind Arzneimittel, die zur Behandlung und Prävention von Knochenerkrankungen wie Hyperkalziämie und zur Prävention von Knochenproblemen bei Patienten mit Krebs und zur Behandlung von Osteoporose und der Paget-Krankheit verwendet werden. Nach einer Prüfung durch die Arbeitsgruppe Pharmakovigilanz (PhVWP) im Jahr 2008 wurde beschlossen, dass in Europa eine Warnung bezüglich atypischer Stressfrakturen des proximalen Femurschafts in die Produktinformation für Arzneimittel, die Alendronsäure enthalten, aufgenommen werden soll. Im April 2010 wurde diese Angelegenheit erneut von der PhVWP aufgegriffen, da Fälle berichtet wurden, die die Einschätzung stützen, dass es sich bei den atypischen Stressfrakturen um einen Klasseneffekt von Bisphosphonaten handelt. Aufgrund der Diskussionen des PhVWP und dem Auftauchen von Daten aus der veröffentlichten Literatur und Berichten nach der Markteinführung, die darauf hindeuten, dass atypische Stressfrakturen ein Klasseneffekt von Bisphosphonaten sein könnten, ersuchte Großbritannien den Ausschuss für Humanarzneimittel (CHMP) im September 2010 um Erstellung eines Gutachtens nach Artikel 31 der Richtlinie 2001/83 EWG in der geänderten Fassung bezüglich der Frage, ob die Genehmigungen für das Inverkehrbringen für Arzneimittel, die Bisphosphonate enthalten, beibehalten, geändert, ruhen gelassen oder entzogen werden sollen. Der CHMP prüfte die verfügbaren Daten aus nicht klinischen und histologischen Studien, relevanten klinischen Studien, epidemiologischen Studien, Berichten nach der Markteinführung und der veröffentlichten Literatur. Nicht klinische Daten Auch wenn präklinische Studien nur beschränkte Informationen über das Risiko atypischer Frakturen mit Bisphosphonaten geliefert haben, haben einige von ihnen gezeigt, dass die Hemmung des Knochenumbaus durch Bisphosphonate die Anhäufung von Mikroschäden und die Anhäufung von glykierten Endprodukten ( advanced glycation end-products ) steigern kann, was zu Veränderungen der biomechanischen Eigenschaften des Knochens führt (Brennan et al., 2011, Hofstaetter et al., 2010, Mashiba et al., 2000, O Neal et al., Tang et al., ). Allerdings zeigten sich nicht in allen präklinischen Studien unerwünschte Wirkungen von Alendronsäure auf den Knochen (Burr et al. 2 ). Definition von atypischer Femurfraktur Die Task Force der American Society for Bone and Mineral Research (ASBMR) zu atypischen subtrochantären und diaphysären Femurfrakturen hat Haupt- und Nebenkriterien der atypischen Femurfraktur definiert (Shane et al., ) und empfahl, dass ein Fall dann als atypische 1 Brennan O et al. The effects of estrogen deficiency and bisphosphonate treatment on tissue mineralisation and stiffness in an ovine model of osteoporosis. J Biomech 2011; 44: Hofstaetter JG et al. The effects of high-dose, long-term alendronate treatment on microarchitecture and bone mineral density of compact and trabecular bone in the proximal femur of adult male rabbits. Arch Orthop Trauma Surg 2010; 30: Mashiba T et al. Suppressed bone turnover by bisphosphonates increases microdamage accumulation and reduces some biomechanical properties in dog rib. J Bone Miner Res 2000; 15: O Neal JM et al. One year of alendronate treatment lowers microstructural stresses associated with trabeclar microdamage initiation. Bone 2010; 47: Tang SY et al. Changes in non-enzymatic glycation and its association with altered mechanical properties following 1-year treatment with risedronate or alendronate. Osteoporosis Int 2009; 20: Burr DB et al. Effects of one to three years treatment with alendronate on mechanical properties of the femoral shaft in a canine model: implications for subtrochanteric femoral fracture risk. J Orthop Res 2009; 27: Shane E et al. Atypical subtrochanteric and diaphyseal femoral fractures: report of a task force of the American Society for Bone and Mineral Research. J Bone Miner Res 2010; 25:
3 Femurfraktur angesehen werden sollte, wenn alle Hauptkriterien vorliegen, wohingegen die Nebenkriterien zwar meist in Fällen von atypischen Femurfrakturen beschrieben wurden, aber nicht bei allen Patienten vorliegen. Aufgrund der kleinen Zahl von spontanen Berichten einer atypischen Femurtrümmerfraktur im Zusammenhang mit Bisphosphonaten, einem veröffentlichten Fallbericht (Schneider, ) sowie vorläufigen Daten, die auf der Oktobersitzung des ASBMR präsentiert wurden (Nitche et al., ), einigte sich der CHMP für den Zweck seiner Beurteilung auf eine modifizierte Falldefinition, bei der Nicht-Trümmerfraktur als Nebenkriterium statt als Hauptkriterium für eine atypische Femurfraktur aufgeführt wird. Mechanismus atypischer Frakturen Der oder die Mechanismen für die Entstehung atypischer Frakturen bei Patienten, die Bisphosphonate nehmen, ist nicht bekannt. Es wurden jedoch eine Reihe von möglichen Mechanismen atypischer Frakturen im Zusammenhang mit der Verwendung von Bisphosphonaten postuliert. Der hauptsächliche postulierte Mechanismus ist die Hemmung des Knochenumbaus, die indirekt zur Knochenalterung und Verzögerung oder Verhinderung der Reparatur von natürlich auftretenden Stressfrakturen führt, auch wenn die Nachweise nicht schlüssig sind. Epidemiologische Studien Während einige epidemiologische Studien nahelegen, dass es sich bei den subtrochantären Frakturen und Femurschaftfrakturen um normale osteoporotische Frakturen handeln könnte (Abrahamsen et al., , Abrahamsen, , Vestergaard et al., ) deuten andere Studien darauf hin, dass die Langzeitverwendung von Bisphosphonaten das Risiko für subtrochantäre und Femurschaftfrakturen erhöhen kann (Park-Wyllie et al., , Wang & Bhattacharyya, ). Allerdings beziehen sich diese Studien nicht speziell auf atypische Femurfrakturen, da sie keine Angaben zum radiographischen Frakturmuster enthalten. Erkenntnisse aus Studien, die spezifische Angaben bezüglich radiographisch bestätigter atypischer Femurfrakturen enthalten, deuten darauf hin, dass diese Frakturen mit der Verwendung von Bisphosphonaten zusammenhängen können. Fall-Kontroll-Studien berichteten einen signifikanten Zusammenhang zwischen atypischem Femurfrakturmuster und der Verwendung von Bisphosphonaten (Lenart et al., , Isaacs et al., ). Aus anderen Studien mit radiographischem Nachweis wurde ebenfalls eine erhöhte Inzidenz atypischer Femurfrakturen bei Patienten, die mit 4 Schneider P. Should bisphosphonates be continued indefinitely? An unusual fracture in a healthy woman on longterm alendronate. Geriatrics 2006; 61: Nitche J et al. Subtrochanteric femoral stress fractures in patients on chronic bisphosphonate therapy: a case series. J Bone Miner Res 25 (Suppl 1) 2010; Zugang unter d073267b2a47. Aufgerufen 5. April Abrahamsen B et al. Subtrochanteric and diaphyseal femur fractures in patients treated with alendronate: a register-based national cohort study. J Bone Miner Res 2009; 24: Abrahamsen B et al. Cumulative alendronate dose and the long term absolute risk of subtrochanteric and diaphyseal femur fractures: a register-based national cohort analysis. J Clin Endocrinol Metab 2010; 95: Vestergaard P et al. Risk of femoral shaft and subtrochanteric fractures among users of bisphosphonates and raloxifene. Osteoporos Int 2010; DOI /s y 9 Park-Wyllie LY et al. Bisphosphonate Use and the Risk of Subtrochanteric or Femoral Shaft Fractures in Older Women. JAMA 2011; 305: Wang Z & Bhattacharyya T Trends in Incidence of Subtrochanteric Fragility Fractures and Bisphosphonate Use Among the US Elderly, J Bone Miner Res 2011; DOI /jbmr Lenart BA et al. Association of low-energy femoral fractures with prolonged bisphosphonate use: a case control study. Osteoporos Int 2009; 20: Isaacs JD et al. Femoral insufficiency fractures associated with prolonged bisphosphonate therapy. Clin Orthop Relat Res 2010; 468:
4 Bisphosphonaten behandelt wurden, im Vergleich mit nicht exponierten Patienten berichtet, die mit der Dauer der Bisphosphonat-Behandlung zunehmen kann (Dell et al., , Schilcher et al., ). Berichte nach der Markteinführung Die Zahl der Berichte möglicher atypischer Femurfrakturen, bei denen ein Zusammenhang mit Bisphosphonaten vermutet wird, hat seit der Prüfung durch die PhVWP im Jahr 2008 zugenommen. Auch wenn die höchste Zahl möglicher atypischer Femurfrakturen weiterhin im Zusammenhang mit Alendronsäure für Osteoporose berichtet wird, gab es auch Berichte nach der Markteinführung für andere Bisphosphonate zur Osteoporosebehandlung (Etidronsäure, Ibandronsäure, Risedronsäure und Zoledronat), für die Paget-Krankheit (Zoledronat) sowie für onkologische Anwendungsgebiete (Ibandronsäure, Pamidronsäure und Zoledronat), was darauf hindeutet, dass es sich bei diesen Frakturen um einen Klasseneffekt von Bisphosphonaten handeln kann. Das Fehlen von Berichten im Zusammenhang mit den übrigen Bisphosphonaten Clodronsäure, Neridronsäure und Tiludronsäure kann durch die geringere Exposition dieser Arzneimittel im Vergleich mit anderen Bisphosphonaten bedingt sein, und es kann nicht ausgeschlossen werden, dass hier kein Zusammenhang besteht. Derzeit liegen aus der Literatur und spontanen Berichten wenig Hinweise vor, die einen Zusammenhang zwischen Bisphosphonaten und atypischen Frakturen an anderen Stellen als am Femur stützen würden. Die fehlenden Hinweise können dadurch bedingt sein, dass atypische Frakturen an anderen Stellen als am Femur während der Verwendung von Bisphosphonaten oft nicht erkannt bzw. nicht berichtet werden, oder es ist möglich, dass die einzigartigen Charakteristika des Femurs als dem bedeutendsten gewichtstragenden Knochen des Körpers bedeuten, dass atypische Frakturen nur an dieser Stelle auftreten. Das potenzielle Risiko atypischer Frakturen an anderen Stellen als dem Femur wird weiter überprüft. Risikofaktoren Für atypische Femurfrakturen im Zusammenhang mit Bisphosphonaten wurde eine Reihe von möglichen Risikofaktoren angeführt. Als Hauptrisikofaktor für atypische Femurfrakturen wird die Langzeitverwendung von Bisphosphonaten angesehen. Allerdings ist die optimale Dauer der Verwendung von Bisphosphonaten bei Osteoporose nicht bekannt. Derzeit liegen keine robusten Nachweise zum Wert einer Unterbrechung der Behandlung mit Bisphosphonaten vor. Glukokortikoide und Protonenpumpeninhibitoren (PPI) wurden als mögliche wichtige Risikofaktoren für eine atypische Femurfraktur genannt. Die gleichzeitige Behandlung mit anderen antiresorptiven Arzneimitteln wie Hormonersatztherapien und Raloxifen wurde ebenfalls als möglicher Risikofaktor genannt. Außer Osteoporose waren die häufigsten Komorbiditäten bei Patienten mit atypischer Femurfraktur chronisch obstruktive Lungenerkrankung oder Asthma, rheumatoide Arthritis und Diabetes. Zusammenfassende Schlussfolgerungen Unter Berücksichtigung aller verfügbarer Anhaltspunkte schloss der CHMP, dass die Verwendung von Bisphosphonaten ein Risiko für atypische Femurfrakturen darstellen kann und empfahl deshalb die Aufnahme folgender Angaben in die Produktinformation aller Bisphosphonate: Aufnahme eines Warnhinweises in Kapitel 4.4 der Zusammenfassung der Merkmale des Arzneimittels (Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung), der das 13 Dell R et al. A retrospective analysis of all atypical femur fractures seen in a large California HMO from the years 2007 to J Bone Miner Res 25 (Suppl 1) 2010; Zugang unter Aufgerufen 15. Februar Schilcher J et al. Incidence of stress fractures of the femoral shaft in women treated with bisphosphonates. Acta Orthopaedica 2009; 80:
5 Risiko, die Hauptmerkmale dieser Frakturen und die potenzielle Notwendigkeit eines Abbruchs der Behandlung, wenn Verdacht auf eine Fraktur besteht, beinhaltet. Aufnahme der atypischen Femurfraktur in Kapitel 4.8 (Nebenwirkungen) der Zusammenfassung der Merkmale des Arzneimittels, zusammen mit einer Aussage, dass diese unerwünschte Wirkung ein Klasseneffekt aller Bisphosphonate ist. Außerdem empfahl der CHMP angesichts des Mangels an Hinweisen bezüglich der optimalen Dauer der Behandlung mit Bisphosphonaten bei Osteoporose und angesichts der Tatsache, dass die Dauer der Behandlung ein Risikofaktor für atypische Femurfrakturen ist, dass ein Hinweis in Kapitel 4.2. der Produktinformation für Bisphosphonate, die für Osteoporose zugelassen sind, aufgenommen werden soll, dass die Notwendigkeit der Fortsetzung der Bisphosphonat-Behandlung regelmäßig individuell für jeden Patienten geprüft werden muss, insbesondere nach 5-jähriger Behandlung. Der CHMP gelangte zu der Auffassung, dass die Erkenntnisse dieser Überprüfung nicht das globale Risiko-Nutzen-Verhältnis einzelner Bisphosphonate in ihren autorisierten Indikationen ändert. Begründung für die Änderung der Zusammenfassungen der Merkmale des Arzneimittels und der Packungsbeilagen In Erwägung folgender Gründe: Der Ausschuss befasste sich mit dem Verfahren gemäß Artikel 31 der Richtlinie 2001/83/EG in der geänderten Fassung zu Arzneimitteln, die Bisphosphonate enthalten. Der Ausschuss berücksichtigte alle verfügbaren vorgelegten Daten (präklinische, klinische, epidemiologische Studien, Berichte nach Markteinführung, veröffentlichte Literatur) im Zusammenhang mit dem Risiko für atypische Femurfrakturen unter Bisphosphonaten. Auf der Basis der verfügbaren Hinweise, hauptsächlich aus epidemiologischen Studien und Berichten nach der Markteinführung, schloss der Ausschuss, dass die Verwendung von Bisphosphonaten mit einem Risiko für atypische Femurfrakturen einhergehen kann. Außerdem schloss der CHMP, dass der Hauptrisikofaktor im Zusammenhang mit diesen Frakturen die Langzeitbehandlung mit Bisphosphonaten zu sein scheint. Der Ausschuss schloss, dass die Produktinformation aller Bisphosphonate einen Warnhinweis in Kapitel 4.4 zum Risiko atypischer Femurfrakturen enthalten sollte, und diese unerwünschte Wirkung sollte auch im Kapitel 4.8 der Zusammenfassungen der Merkmale des Arzneimittels aufgeführt werden. Der Ausschuss gelangte außerdem zu der Auffassung, dass ein Hinweis in Kapitel 4.2. der Produktinformation für Bisphosphonate, die für Osteoporose zugelassen sind, aufgenommen werden soll, der besagt, dass die Notwendigkeit für die Fortsetzung der Bisphosphonat-Behandlung regelmäßig, insbesondere nach 5-jähriger Behandlung, für jeden Patienten individuell zu prüfen ist. hat der CHMP die Änderung der Bedingungen der Genehmigung für das Inverkehrbringen für Arzneimittel, die Bisphosphonate enthalten (siehe Anhang I), deren relevante Kapitel der Zusammenfassung der Merkmale des Arzneimittels und Packungsbeilagen in Anhang III aufgeführt sind, und unter den in Anhang IV dieses Gutachtens dargelegten Bedingungen empfohlen. 244
6 Anhang III Änderungen an den Zusammenfassungen der Merkmale des Arzneimittels und den Packungsbeilagen 245
7 Änderungen der Zusammenfassung der Merkmale des Arzneimittels für alle Bisphosphonate: Zusammenfassung der Merkmale des Arzneimittels Abschnitt 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Atypische Femurfrakturen Atypische subtrochantäre und diaphysäre Femurfrakturen wurden unter Bisphosphonat-Therapie berichtet, vor allem bei Patienten unter Langzeitbehandlung gegen Osteoporose. Diese transversalen oder kurzen Schrägfrakturen können überall entlang des Oberschenkelknochens auftreten, direkt unterhalb des Trochanter minor bis direkt oberhalb der Femurkondylen. Diese Frakturen entstehen nach einem minimalen Trauma oder ohne Trauma und manche Patienten verspüren Oberschenkeloder Leistenschmerzen oft im Zusammenhang mit Anzeichen einer Niedrig-Energie Fraktur in bildgebenden Verfahren Wochen bis Monate vor dem Auftreten einer manifesten Femurfraktur. Frakturen treten häufig bilateral auf. Aus diesem Grund sollte bei Patienten, die mit Bisphosphonaten behandelt werden und eine Femurschaftfraktur hatten, der kontralaterale Femur ebenfalls untersucht werden. Über eine schlechte Heilung dieser Frakturen ist ebenfalls berichtet worden. Bei Patienten mit Verdacht auf eine atypische Femurfraktur sollte ein Absetzen der Bisphosphonat-Therapie, vorbehaltlich einer Beurteilung des Patienten, auf Grundlage einer individuellen Nutzen-Risiko- Bewertung in Betracht gezogen werden. Während einer Behandlung mit Bisphosphonaten sollte den Patienten geraten werden, über jegliche Oberschenkel-, Hüft- oder Leistenschmerzen zu berichten und jeder Patient mit diesen Symptomen sollte auf eine unvollständige Femurfraktur hin untersucht werden. Abschnitt 4.8 Nebenwirkungen Nach Markeinführung wurden die folgenden Nebenwirkungen berichtet (Häufigkeit selten): Atypische subtrochantäre und diaphysäre Femurfrakturen (unerwünschte Wirkung der Substanzklasse der Bisphosphonate). Packungsbeilage Abschnitt 4. Welche Nebenwirkungen sind möglich Ungewöhnliche (atypische) Brüche des Oberschenkelknochens, insbesondere bei Patienten unter Langzeitbehandlung gegen Osteoporose, können selten auftreten. Wenden Sie sich an Ihren Arzt, wenn Sie Schmerzen, Schwäche oder Beschwerden in Oberschenkel, Hüfte oder Leiste verspüren, da es sich dabei um ein frühes Anzeichen eines möglichen Oberschenkelknochenbruchs handeln könnte. Zusätzliche Änderung der Zusammenfassung der Merkmale des Arzneimittels für Bisphosphonate mit Anwendungsgebiet Osteoporose : Zusammenfassung der Merkmale des Arzneimittels Abschnitt 4.2 Dosierung, Art und Dauer der Anwendung Die optimale Dauer einer Bisphosphonat-Behandlung bei Osteoporose ist nicht festgelegt. Die Notwendigkeit einer Weiterbehandlung sollte in regelmäßigen Abständen auf Grundlage des Nutzens und potenzieller Risiken von [Produktname] für jeden Patienten individuell beurteilt werden, insbesondere bei einer Anwendung über 5 oder mehr Jahre. 246
8 Anhang IV Bedingungen der Genehmigung für das Inverkehrbringen 247
9 Für alle Bisphosphonate haben die zuständigen nationalen Behörden, gegebenenfalls koordiniert durch den Referenzmitgliedstaat, Folgendes zu gewährleisten: Die Inhaber der Genehmigung für das Inverkehrbringen haben Risikomanagementpläne vorzulegen bzw. dahingehend zu aktualisieren, dass atypische Femurfrakturen als potenzielles Risiko aufgenommen werden. Die Inhaber der Genehmigung für das Inverkehrbringen sollen sich innerhalb von 2 Monaten nach der Entscheidung der Kommission mit den zuständigen nationalen Behörden auf einen Zeitplan für das Vorlegen der Risikomanagementpläne verständigen. Die zuständigen nationalen Behörden haben zu gewährleisten, dass die Ärzteschaft über die vom CHMP abgestimmten Maßnahmen zur Minimierung des Risikos atypischer Femurfrakturen informiert wird. Die Mitteilung sollte auf dem vom CHMP abgestimmten Key Communication Messages Document basieren, das dem Bewertungsbericht beigefügt ist. 248
Komplette Zusammenfassung der wissenschaftlichen Beurteilung von Arzneimitteln, die Bisphosphonate enthalten (siehe Anhang I)
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Zusammenfassungen der Merkmale des Arzneimittels und von Packungsbeilagen, die von der EMA vorgelegt wurden 240 Wissenschaftliche
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Zusammenfassungen der Merkmale des Arzneimittels und von Packungsbeilagen, die von der EMA vorgelegt wurden 240 Wissenschaftliche
Atypische Oberschenkelfrakturen unter Osteoporosetherapie
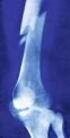 Atypische Oberschenkelfrakturen unter Osteoporosetherapie Peter Mikosch Privatklinik Döbling Wien Osteoporoseseminar 2016 Pörtschach 11.-12.11.2016 Übersicht Definition atypische Femurfraktur (AFF) Pathogenese
Atypische Oberschenkelfrakturen unter Osteoporosetherapie Peter Mikosch Privatklinik Döbling Wien Osteoporoseseminar 2016 Pörtschach 11.-12.11.2016 Übersicht Definition atypische Femurfraktur (AFF) Pathogenese
Anhang I. Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen
 Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang I. Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen
 Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang I. Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen
 Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang I. Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen
 Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
ENDGÜLTIGES GUTACHTEN DES AUSSCHUSSES FÜR ARZNEISPEZIALITÄTEN GEMÄSS ARTIKEL 12 DER RICHTLINIE 75/319/EWG DES RATES, EINSCHLIESSLICH ÄNDERUNGEN, FÜR
 The European Agency for the Evaluation of Medicinal Products Human Medicines Evaluation Unit CPMP/375/97-DE ENDGÜLTIGES GUTACHTEN DES AUSSCHUSSES FÜR ARZNEISPEZIALITÄTEN GEMÄSS ARTIKEL 12 DER RICHTLINIE
The European Agency for the Evaluation of Medicinal Products Human Medicines Evaluation Unit CPMP/375/97-DE ENDGÜLTIGES GUTACHTEN DES AUSSCHUSSES FÜR ARZNEISPEZIALITÄTEN GEMÄSS ARTIKEL 12 DER RICHTLINIE
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen
 Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen Wissenschaftliche Schlussfolgerungen Der CHMP ist unter Berücksichtigung
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen Wissenschaftliche Schlussfolgerungen Der CHMP ist unter Berücksichtigung
ANHANG III. Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 ANHANG III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Die zuständigen Behörden der Mitgliedstaaten müssen die Zusammenfassung der
ANHANG III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Die zuständigen Behörden der Mitgliedstaaten müssen die Zusammenfassung der
Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der Europäischen Arzneimittel-Agentur für das befürwortende Gutachten für die Genehmigung für das Inverkehrbringen mit einer Auflage und die
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der Europäischen Arzneimittel-Agentur für das befürwortende Gutachten für die Genehmigung für das Inverkehrbringen mit einer Auflage und die
ANHANG I VERZEICHNIS DER BEZEICHNUNGEN UND DER STÄRKEN DES ARZNEIMITTELS UND DER INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN IN DEN
 ANHANG I VERZEICHNIS DER BEZEICHNUNGEN UND DER STÄRKEN DES ARZNEIMITTELS UND DER INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN IN DEN MITGLIEDSTAATEN Anhang A - Chlormezanon Mitgliedstaat Inhaber der
ANHANG I VERZEICHNIS DER BEZEICHNUNGEN UND DER STÄRKEN DES ARZNEIMITTELS UND DER INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN IN DEN MITGLIEDSTAATEN Anhang A - Chlormezanon Mitgliedstaat Inhaber der
Anhang IV. Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen
 Anhang IV Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen Wissenschaftliche Schlussfolgerungen Der CHMP berücksichtigte
Anhang IV Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen Wissenschaftliche Schlussfolgerungen Der CHMP berücksichtigte
Komplette Zusammenfassung der wissenschaftlichen Beurteilung von Nimesulid enthaltenden Arzneimitteln zur systemischen Anwendung (siehe Anhang I)
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der EMA für die Änderungen der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage 41 Wissenschaftliche Schlussfolgerungen
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der EMA für die Änderungen der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage 41 Wissenschaftliche Schlussfolgerungen
Anhang II. Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen 203 Wissenschaftliche Schlussfolgerungen Die Koordinierungsgruppe
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen 203 Wissenschaftliche Schlussfolgerungen Die Koordinierungsgruppe
Anhang III. Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen
 Anhang III Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen Anmerkung: Diese Änderungen der entsprechenden Abschnitte der Zusammenfassung
Anhang III Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen Anmerkung: Diese Änderungen der entsprechenden Abschnitte der Zusammenfassung
Datum: Kontakt: Abteilung: Tel. / Fax: Unser Zeichen: Ihr Zeichen:
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 14.03.2016 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 14.03.2016 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION
 ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION Diese Änderungen von SPC und Packungsbeilage treten zum Zeitpunkt der Kommissionsentscheidung in Kraft.
ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION Diese Änderungen von SPC und Packungsbeilage treten zum Zeitpunkt der Kommissionsentscheidung in Kraft.
Zu den wichtigsten Nebenwirkungen gehören schwere Nierenfunktionsstörungen und Kieferosteonekrosen.
 Zoledronsäure AL (Zoledronsäure 5 mg/100 ml Infusionslösung) Leitfaden für Ärzte Dieser Leitfaden für Ärzte zur Anwendung von Zoledronsäure 5 mg wurde als Teil der Zulassungsauflagen erstellt. Im Rahmen
Zoledronsäure AL (Zoledronsäure 5 mg/100 ml Infusionslösung) Leitfaden für Ärzte Dieser Leitfaden für Ärzte zur Anwendung von Zoledronsäure 5 mg wurde als Teil der Zulassungsauflagen erstellt. Im Rahmen
Anhang III. Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage
 Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Datum: Kontakt: Abteilung: Tel. / Fax: Unser Zeichen: Ihr Zeichen:
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 25.10.2017 Ing. Veronika Iro, B.Sc. REGA +43 (0) 505 55 36247 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 25.10.2017 Ing. Veronika Iro, B.Sc. REGA +43 (0) 505 55 36247 pv-implementation@ages.at
Anhang II. Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen 10 Wissenschaftliche Schlussfolgerungen Solu-Medrol 40 mg Pulver und Lösungsmittel zur Herstellung einer Injektionslösung (im Folgenden Solu-Medrol genannt)
Anhang II Wissenschaftliche Schlussfolgerungen 10 Wissenschaftliche Schlussfolgerungen Solu-Medrol 40 mg Pulver und Lösungsmittel zur Herstellung einer Injektionslösung (im Folgenden Solu-Medrol genannt)
Anhang I. Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen
 Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Akute venösen Thromboembolien (VTE) oder VTE in der Vorgeschichte, einschließlich tiefer Venenthrombose und Lungenembolie.
 Aktualisierte Indikation Behandlung der schweren Osteoporose: bei postmenopausalen Frauen, bei erwachsenen Männern, mit hohem Frakturrisiko, für die eine Behandlung mit anderen für die Osteoporosetherapie
Aktualisierte Indikation Behandlung der schweren Osteoporose: bei postmenopausalen Frauen, bei erwachsenen Männern, mit hohem Frakturrisiko, für die eine Behandlung mit anderen für die Osteoporosetherapie
Anhang III. Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale des Arzneimittels, der Etikettierung und
Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale des Arzneimittels, der Etikettierung und
Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für den Widerruf oder die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen und die detaillierte Erklärung der Abweichungen
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für den Widerruf oder die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen und die detaillierte Erklärung der Abweichungen
Position of the Co-ordination Group for Mutual Recognition and Decentralised Procedures for human use on Periodic Safety Update Reports for
 London, 30 January 2019 EMA/28476/2019 Co-ordination group for Human Use PSUSA/00010665/201805 Position of the Co-ordination Group for Mutual Recognition and Decentralised Procedures for human use on Periodic
London, 30 January 2019 EMA/28476/2019 Co-ordination group for Human Use PSUSA/00010665/201805 Position of the Co-ordination Group for Mutual Recognition and Decentralised Procedures for human use on Periodic
Epidemiologie und gesellschaftliche Kosten der Osteoporose. Mosekilde, Bone Miner 1990; 10: 13-35
 Epidemiologie und gesellschaftliche Kosten der Osteoporose Mosekilde, Bone Miner 199; 1: 13-35 Dr. E. Edelmann Rheumatologische Schwerpunktpraxis Bad Aibling 1/23 Definition u. Häufigkeit der Osteoporose
Epidemiologie und gesellschaftliche Kosten der Osteoporose Mosekilde, Bone Miner 199; 1: 13-35 Dr. E. Edelmann Rheumatologische Schwerpunktpraxis Bad Aibling 1/23 Definition u. Häufigkeit der Osteoporose
Anhang IV. Wissenschaftliche Schlussfolgerungen
 Anhang IV Wissenschaftliche Schlussfolgerungen 1 Wissenschaftliche Schlussfolgerungen Vier Fälle von schwerwiegenden Leberschäden, die eine Lebertransplantation erforderlich machten, wurden seit dem Inverkehrbringen
Anhang IV Wissenschaftliche Schlussfolgerungen 1 Wissenschaftliche Schlussfolgerungen Vier Fälle von schwerwiegenden Leberschäden, die eine Lebertransplantation erforderlich machten, wurden seit dem Inverkehrbringen
Anhang II. Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen 74 Wissenschaftliche Schlussfolgerungen Am 7. Juli 2016 veranlasste das Vereinigte Königreich ein Verfahren nach Artikel 31 der Richtlinie 2001/83/EG aufgrund
Anhang II Wissenschaftliche Schlussfolgerungen 74 Wissenschaftliche Schlussfolgerungen Am 7. Juli 2016 veranlasste das Vereinigte Königreich ein Verfahren nach Artikel 31 der Richtlinie 2001/83/EG aufgrund
Risikoüberwachung von Arzneimitteln - Aktuelle Situation
 Risikoüberwachung von Arzneimitteln - Aktuelle Situation U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte Abteilung Pharmakovigilanz Fortbildung für den Öffentlichen Dienst Berlin, 2. April
Risikoüberwachung von Arzneimitteln - Aktuelle Situation U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte Abteilung Pharmakovigilanz Fortbildung für den Öffentlichen Dienst Berlin, 2. April
Wirksamkeit und Sicherheit von generischen und originalen wöchentlichen Bisphosphonaten
 Wirksamkeit und Sicherheit von generischen und originalen wöchentlichen Bisphosphonaten Von Prof. Dr. med. Johann D. Ringe, Leverkusen Falkenstein (23. Januar 2009) - Die Osteoporose gehört nach Angaben
Wirksamkeit und Sicherheit von generischen und originalen wöchentlichen Bisphosphonaten Von Prof. Dr. med. Johann D. Ringe, Leverkusen Falkenstein (23. Januar 2009) - Die Osteoporose gehört nach Angaben
Anhang III. Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des
Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des
Evidenz in der Präventionsmedizin
 Evidenz in der Präventionsmedizin Symposium Ist Vorsorgen Immer Besser als Heilen? 20. und 21. Februar 2008 Dr. Gerald Gartlehner, MPH, Department für evidenzbasierte Medizin und klinische Epidemiologie
Evidenz in der Präventionsmedizin Symposium Ist Vorsorgen Immer Besser als Heilen? 20. und 21. Februar 2008 Dr. Gerald Gartlehner, MPH, Department für evidenzbasierte Medizin und klinische Epidemiologie
Name. Actonel Combi D. Norsedcombi 35 mg mg/880 IU. Norsed plus Calcium D. Optinate Plus Ca &D. Opticalcio D3 35 mg mg/880 IU
 ANHANG I VERZEICHNIS DER BEZEICHNUNGEN, DARREICHUNGSFORMEN, STÄRKEN DES ARZNEIMITTELS, ART DER ANWENDUNG, ANTRAGSTELLER UND INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN IN DEN MITGLIEDSTAATEN 1 Mitgliedstaat
ANHANG I VERZEICHNIS DER BEZEICHNUNGEN, DARREICHUNGSFORMEN, STÄRKEN DES ARZNEIMITTELS, ART DER ANWENDUNG, ANTRAGSTELLER UND INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN IN DEN MITGLIEDSTAATEN 1 Mitgliedstaat
UNSERE VERANTWORTUNG FÜR DIE PATIENTENSICHERHEIT
 UNSERE VERANTWORTUNG FÜR DIE PATIENTENSICHERHEIT Im Gleichgewicht bleiben Ein gesunder Körper ist im Gleichgewicht. Wenn wir krank sind, bemüht sich der Körper, diese Balance wiederherzustellen. Doch manchmal
UNSERE VERANTWORTUNG FÜR DIE PATIENTENSICHERHEIT Im Gleichgewicht bleiben Ein gesunder Körper ist im Gleichgewicht. Wenn wir krank sind, bemüht sich der Körper, diese Balance wiederherzustellen. Doch manchmal
Was Sie über MabThera wissen sollten
 Die Gesundheitsbehörden der Europäischen Union haben die Markteinführung des Medikaments MabThera an bestimmte Bedingungen gebunden. Der vorgeschriebene Plan zur Risikominimierung in Belgien und im Großherzogtum
Die Gesundheitsbehörden der Europäischen Union haben die Markteinführung des Medikaments MabThera an bestimmte Bedingungen gebunden. Der vorgeschriebene Plan zur Risikominimierung in Belgien und im Großherzogtum
Pressemitteilung der EMEA vom in deutscher Übersetzung:
 Pressemitteilung der EMEA vom 9. 12. 2004 in deutscher Übersetzung: Außerordentliche Sitzung des CHMP zu Paroxetin und anderen selektiven Serotonin-Wiederaufnahmehemmern Der Ausschuss für Humanarzneimittel
Pressemitteilung der EMEA vom 9. 12. 2004 in deutscher Übersetzung: Außerordentliche Sitzung des CHMP zu Paroxetin und anderen selektiven Serotonin-Wiederaufnahmehemmern Der Ausschuss für Humanarzneimittel
Anhang IV. Wissenschaftliche Schlussfolgerungen
 Anhang IV Wissenschaftliche Schlussfolgerungen 1 Wissenschaftliche Schlussfolgerungen Inhibitoren des Natrium-Glukose-Cotransporters 2 (SGLT2-Inhibitoren) werden zusammen mit Diät und Sport bei Patienten
Anhang IV Wissenschaftliche Schlussfolgerungen 1 Wissenschaftliche Schlussfolgerungen Inhibitoren des Natrium-Glukose-Cotransporters 2 (SGLT2-Inhibitoren) werden zusammen mit Diät und Sport bei Patienten
Empfehlungen des PRAC zu Signalen für die Aktualisierung der Produktinformationen
 23 April 2015 EMA/PRAC/273924/2015 Pharmacovigilance Risk Assessment Committee Empfehlungen des PRAC zu Signalen für die Aktualisierung der Produktinformationen Verabschiedet im Rahmen der PRAC-Sitzung
23 April 2015 EMA/PRAC/273924/2015 Pharmacovigilance Risk Assessment Committee Empfehlungen des PRAC zu Signalen für die Aktualisierung der Produktinformationen Verabschiedet im Rahmen der PRAC-Sitzung
(Zoledronsäure 5 mg/100 ml Infusionslösung) Leitfaden für Ärzte
 Clastizol (Zoledronsäure 5 mg/100 ml Infusionslösung) Leitfaden für Ärzte Dieser Leitfaden für Ärzte zur Anwendung von Zoledronsäure 5 mg wurde als Teil der Zulassungsauflagen erstellt. Im Rahmen des Risikomanagement-Plans
Clastizol (Zoledronsäure 5 mg/100 ml Infusionslösung) Leitfaden für Ärzte Dieser Leitfaden für Ärzte zur Anwendung von Zoledronsäure 5 mg wurde als Teil der Zulassungsauflagen erstellt. Im Rahmen des Risikomanagement-Plans
Gepostet am 14. September :07h. Freie Redaktion Keine Kommentare»
 Flensburg online Angst vor Osteoporose: Was ist mit meiner Lebensqualität? Gepostet am 14. September 2009 6:07h. Freie Redaktion Keine Kommentare» Denver (ots/prnewswire) - International Osteoporosis Foundation
Flensburg online Angst vor Osteoporose: Was ist mit meiner Lebensqualität? Gepostet am 14. September 2009 6:07h. Freie Redaktion Keine Kommentare» Denver (ots/prnewswire) - International Osteoporosis Foundation
High fracture risk: How to define, how to treat?
 High fracture risk: How to define, how to treat? Dr Emmanuel BIVER Department of Bone Diseases Geneva University Hospitals and Faculty of Medicine 8. Basler Fortbildung in praktischer Osteologie, Universitätsspital
High fracture risk: How to define, how to treat? Dr Emmanuel BIVER Department of Bone Diseases Geneva University Hospitals and Faculty of Medicine 8. Basler Fortbildung in praktischer Osteologie, Universitätsspital
Datum: Kontakt: Abteilung: Tel. / Fax: Unser Zeichen: Ihr Zeichen:
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 25.06.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 25.06.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
Anhang II. Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen 7 Wissenschaftliche Schlussfolgerungen Zusammenfassung der wissenschaftlichen Beurteilung methadonhaltiger Arzneimittel zum Einnehmen, in denen Povidon enthalten
Anhang II Wissenschaftliche Schlussfolgerungen 7 Wissenschaftliche Schlussfolgerungen Zusammenfassung der wissenschaftlichen Beurteilung methadonhaltiger Arzneimittel zum Einnehmen, in denen Povidon enthalten
Volkskrankheit Osteoporose
 Volkskrankheit Osteoporose Volkskrankheit Osteoporose Definition Problem und Prävalenz Einfluss von Frakturen Mortalitätsdaten Osteoporose in Deutschland Kosten der Osteoporose Anforderungen an eine Osteoporosetherapie
Volkskrankheit Osteoporose Volkskrankheit Osteoporose Definition Problem und Prävalenz Einfluss von Frakturen Mortalitätsdaten Osteoporose in Deutschland Kosten der Osteoporose Anforderungen an eine Osteoporosetherapie
Methotrexat - Risiko der Überdosierung durch Anwendungsfehler. Verfahren nach Art. 31 der Richtlinie 2001/83/EG
 Methotrexat - Risiko der Überdosierung durch Anwendungsfehler Verfahren nach Art. 31 der Richtlinie 2001/83/EG 82. Routinesitzung, 19. April 2018 82. Routinesitzung 19. April 2018 Seite 1 Einleitung eines
Methotrexat - Risiko der Überdosierung durch Anwendungsfehler Verfahren nach Art. 31 der Richtlinie 2001/83/EG 82. Routinesitzung, 19. April 2018 82. Routinesitzung 19. April 2018 Seite 1 Einleitung eines
Bundesinstitut für Arzneimittel und Medizinprodukte Langwirksame Beta-Mimetika (LABA) Salmeterol/ Formoterol
 Langwirksame Beta-Mimetika (LABA) Salmeterol/ Formoterol Risikobewertung Änderung der Produktinformationen Anstoß der Diskussion Salmeterol-Studien: SMART-Studie (Salmeterol Multicenter Asthma Research
Langwirksame Beta-Mimetika (LABA) Salmeterol/ Formoterol Risikobewertung Änderung der Produktinformationen Anstoß der Diskussion Salmeterol-Studien: SMART-Studie (Salmeterol Multicenter Asthma Research
Zusammenfassung der wissenschaftlichen Beurteilung der Befassung zu Antifibrinolytika Aprotinin enthaltende Arzneimittel (siehe Anhang I)
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der EMA für die Aufhebung der Aussetzung und die Änderung der Genehmigungen für das Inverkehrbringen für Aprotinin enthaltende Arzneimittel
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der EMA für die Aufhebung der Aussetzung und die Änderung der Genehmigungen für das Inverkehrbringen für Aprotinin enthaltende Arzneimittel
Anhang III. Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale
Anhang III Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale
DELEGIERTE VERORDNUNG (EU).../... DER KOMMISSION. vom
 EUROPÄISCHE KOMMISSION Brüssel, den 24.11.2016 C(2016) 7495 final DELEGIERTE VERORDNUNG (EU).../... DER KOMMISSION vom 24.11.2016 zur Änderung der Delegierten Verordnung (EU) 2016/1675 der Kommission zur
EUROPÄISCHE KOMMISSION Brüssel, den 24.11.2016 C(2016) 7495 final DELEGIERTE VERORDNUNG (EU).../... DER KOMMISSION vom 24.11.2016 zur Änderung der Delegierten Verordnung (EU) 2016/1675 der Kommission zur
Tragende Gründe. Vom 7. Januar 2016
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
Hydroxyethylstärke (HES) - Infusionslösungen Effektivität der angeordneten Risikominimierungsmaßnahmen Verfahren nach Art. 107i
 Hydroxyethylstärke (HES) - Infusionslösungen Effektivität der angeordneten Risikominimierungsmaßnahmen Verfahren nach Art. 107i 81. Routinesitzung, 16. November 2017 81. Routinesitzung 16. November 2017
Hydroxyethylstärke (HES) - Infusionslösungen Effektivität der angeordneten Risikominimierungsmaßnahmen Verfahren nach Art. 107i 81. Routinesitzung, 16. November 2017 81. Routinesitzung 16. November 2017
Denosumab: Neue Behandlungsoption für Männer mit Osteoporose und erhöhtem Frakturrisiko
 Anstieg der Knochendichte an allen gemessenen Skelettlokalisationen Denosumab: Neue Behandlungsoption für Männer mit Osteoporose und erhöhtem Frakturrisiko München (11. Juli 2014) Für die Behandlung von
Anstieg der Knochendichte an allen gemessenen Skelettlokalisationen Denosumab: Neue Behandlungsoption für Männer mit Osteoporose und erhöhtem Frakturrisiko München (11. Juli 2014) Für die Behandlung von
Chronische Niereninsuffizienz. Nicht jeder der pinkelt hat auch gesunde Nieren.
 Chronische Niereninsuffizienz Nicht jeder der pinkelt hat auch gesunde Nieren. Chronische Niereninsufizienz 1) 1) Was hat sich nicht geändert? 2) 2) Was hat sich geändert? 3) 3) Was könnte sich ändern?
Chronische Niereninsuffizienz Nicht jeder der pinkelt hat auch gesunde Nieren. Chronische Niereninsufizienz 1) 1) Was hat sich nicht geändert? 2) 2) Was hat sich geändert? 3) 3) Was könnte sich ändern?
Neufassung des Wortlauts der Produktinformationen Auszüge aus den Empfehlungen des PRAC zu Signalen
 17 December 2015 EMA/PRAC/835772/2015 Rev 1 Pharmacovigilance Risk Assessment Committee (PRAC) Neufassung des Wortlauts der Produktinformationen Auszüge aus den Empfehlungen des PRAC zu Verabschiedet im
17 December 2015 EMA/PRAC/835772/2015 Rev 1 Pharmacovigilance Risk Assessment Committee (PRAC) Neufassung des Wortlauts der Produktinformationen Auszüge aus den Empfehlungen des PRAC zu Verabschiedet im
Die Aufgaben des Pharmacovigilance Risk Assessment Committee (PRAC)
 Die Aufgaben des Pharmacovigilance Risk Assessment Committee (PRAC) November 2012 Hintergrund Verordnung (EU) Nr. 1235/2010 des Europäischen Parlaments und des Rates vom 15. Dezember 2010 (8) Um sicherzustellen,
Die Aufgaben des Pharmacovigilance Risk Assessment Committee (PRAC) November 2012 Hintergrund Verordnung (EU) Nr. 1235/2010 des Europäischen Parlaments und des Rates vom 15. Dezember 2010 (8) Um sicherzustellen,
Plazebo: Risiko in klinischen Prüfungen und ethisch bedenklich?
 Plazebo: Risiko in klinischen Prüfungen und ethisch bedenklich? Dr. Karl Broich Bundesinstitut für Arzneimittel Kurt-Georg-Kiesinger-Allee 38, D-53175 Bonn Schein-OP (Sham-Procedures) Ideales Arzneimittel
Plazebo: Risiko in klinischen Prüfungen und ethisch bedenklich? Dr. Karl Broich Bundesinstitut für Arzneimittel Kurt-Georg-Kiesinger-Allee 38, D-53175 Bonn Schein-OP (Sham-Procedures) Ideales Arzneimittel
Realistisches Thromboserisiko bei Pille und HRT
 Realistisches Thromboserisiko bei Pille und HRT Ekkehard Schleußner Klinik für Frauenheilkunde und Geburtshilfe Universitätsklinikum Jena Freidrich-Schiller-Universität jena Was ist das Problem? Hormonelle
Realistisches Thromboserisiko bei Pille und HRT Ekkehard Schleußner Klinik für Frauenheilkunde und Geburtshilfe Universitätsklinikum Jena Freidrich-Schiller-Universität jena Was ist das Problem? Hormonelle
Anhang IV. Bedingungen der Genehmigungen für das Inverkehrbringen
 Anhang IV Bedingungen der Genehmigungen für das Inverkehrbringen 66 Bedingungen der Genehmigung(en) für das Inverkehrbringen Die Inhaber der Genehmigungen für das Inverkehrbringen müssen innerhalb der
Anhang IV Bedingungen der Genehmigungen für das Inverkehrbringen 66 Bedingungen der Genehmigung(en) für das Inverkehrbringen Die Inhaber der Genehmigungen für das Inverkehrbringen müssen innerhalb der
Bisphosphonate und der RANKL-Antikörper Denosumab
 Diagnostik und Therapie primärer und metastasierter Mammakarzinome D Bisphosphonate und der RANKL-Antikörper Denosumab Bisphosphonate und RANKL-Antikörper Denosumab Versionen bis 2011: Diel / Fehm/ Friedrich/
Diagnostik und Therapie primärer und metastasierter Mammakarzinome D Bisphosphonate und der RANKL-Antikörper Denosumab Bisphosphonate und RANKL-Antikörper Denosumab Versionen bis 2011: Diel / Fehm/ Friedrich/
Revision RL 93/42/EWG Aufgaben der Benannten Stelle
 RICHTLINIE 2007/47/EG DES EUROPÄISCHEN PARLAMENTS UND DES RATES vom 5. September 2007 zur Änderung der Richtlinien 90/385/EWG des Rates zur Angleichung der Rechtsvorschriften der Mitgliedstaaten über aktive
RICHTLINIE 2007/47/EG DES EUROPÄISCHEN PARLAMENTS UND DES RATES vom 5. September 2007 zur Änderung der Richtlinien 90/385/EWG des Rates zur Angleichung der Rechtsvorschriften der Mitgliedstaaten über aktive
Anhang II. Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen 13 Wissenschaftliche Schlussfolgerungen Haldol, das den Wirkstoff Haloperidol enthält, ist ein Antipsychotikum aus der Gruppe der Butyrophenone. Es handelt
Anhang II Wissenschaftliche Schlussfolgerungen 13 Wissenschaftliche Schlussfolgerungen Haldol, das den Wirkstoff Haloperidol enthält, ist ein Antipsychotikum aus der Gruppe der Butyrophenone. Es handelt
ANLAGE 4. Final wording for SPC and package leaflet (PL)
 ANLAGE 4 NON-SELECTIVE NSAIDS FOR SYSTEMIC ADMINISTRATION OVER THE COUNTER (OTC) PRODUCTS Final wording for SPC and package leaflet (PL) As agreed by the PhVWP in December 2006, revised in January 2007
ANLAGE 4 NON-SELECTIVE NSAIDS FOR SYSTEMIC ADMINISTRATION OVER THE COUNTER (OTC) PRODUCTS Final wording for SPC and package leaflet (PL) As agreed by the PhVWP in December 2006, revised in January 2007
Levonoraristo 1,5 mg, Levonorgestrel STADA 1,5 mg, Navela 1,5 mg, Pidana 1,5 mg, Postinor 1500 µg, unofem HEXAL 1,5 mg
 Anhang 1 Notfallkontrazeptiva Levonorgestrel (LNG) und Ulipristalacetat (UPA) im Vergleich* Arzneistoff (Wirkstoffklasse) In Deutschland im Handel befindliche Präparate (Stand Februar 2018) Wirkungsmechanismus
Anhang 1 Notfallkontrazeptiva Levonorgestrel (LNG) und Ulipristalacetat (UPA) im Vergleich* Arzneistoff (Wirkstoffklasse) In Deutschland im Handel befindliche Präparate (Stand Februar 2018) Wirkungsmechanismus
ANHANG III ÄNDERUNGEN DER ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND PACKUNGSBEILAGE
 ANHANG III ÄNDERUNGEN DER ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND PACKUNGSBEILAGE 25 KORREKTUREN, DIE IN DIE JEWEILIGEN ABSCHNITTE DER ZUSAMMENFASSUNG DER PRODUKTEIGENSCHAFTEN FÜR BROMOCRIPTIN-HALTIGE
ANHANG III ÄNDERUNGEN DER ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND PACKUNGSBEILAGE 25 KORREKTUREN, DIE IN DIE JEWEILIGEN ABSCHNITTE DER ZUSAMMENFASSUNG DER PRODUKTEIGENSCHAFTEN FÜR BROMOCRIPTIN-HALTIGE
MITTEILUNG DER KOMMISSION
 MITTEILUNG DER KOMMISSION Mitteilung der Kommission über die Anwendung neuer Verfahren für die Zulassung von Human- und Tierarzneimitteln gemäß der Verordnung (EWG) Nr. 2309/93 des Rates vom 22. Juli 1993
MITTEILUNG DER KOMMISSION Mitteilung der Kommission über die Anwendung neuer Verfahren für die Zulassung von Human- und Tierarzneimitteln gemäß der Verordnung (EWG) Nr. 2309/93 des Rates vom 22. Juli 1993
Aclasta. Leitfaden für Ärzte. (Zoledronsäure 5 mg/100 ml Infusionslösung)
 Aclasta (Zoledronsäure 5 mg/100 ml Infusionslösung) Leitfaden für Ärzte Dieser Leitfaden für Ärzte zur Anwendung von Zoledron säure 5 mg wurde als Teil der Zulassungsauflagen erstellt. Im Rahmen des Risikomanagement-Plans
Aclasta (Zoledronsäure 5 mg/100 ml Infusionslösung) Leitfaden für Ärzte Dieser Leitfaden für Ärzte zur Anwendung von Zoledron säure 5 mg wurde als Teil der Zulassungsauflagen erstellt. Im Rahmen des Risikomanagement-Plans
Neues zur Epidemiologie von Stürzen und Frakturen
 Neues zur Epidemiologie von Stürzen und Frakturen 2. Sturzpräventionstagung D-A-CH, 27. 28.11.2015 Stuttgart Priv. Doz. Dr. med. Kilian Rapp Oberarzt Klinik für Geriatrische Rehabilitation Robert-Bosch-Krankenhaus
Neues zur Epidemiologie von Stürzen und Frakturen 2. Sturzpräventionstagung D-A-CH, 27. 28.11.2015 Stuttgart Priv. Doz. Dr. med. Kilian Rapp Oberarzt Klinik für Geriatrische Rehabilitation Robert-Bosch-Krankenhaus
Anhang II. Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen 357 Wissenschaftliche Schlussfolgerungen und Begründung für
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen 357 Wissenschaftliche Schlussfolgerungen und Begründung für
1 - Komplette Zusammenfassung der wissenschaftlichen Beurteilung des PRAC
 Anhang IV Wissenschaftliche Schlussfolgerungen, Begründung der Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen und detaillierte Erklärung der wissenschaftlichen Gründe für die Abweichungen
Anhang IV Wissenschaftliche Schlussfolgerungen, Begründung der Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen und detaillierte Erklärung der wissenschaftlichen Gründe für die Abweichungen
HINWEISE FÜR MEDIZINISCHES FACHPERSONAL ZUR ANWENDUNG VON TENOFOVIRDISOPROXIL BEI HIV-INFIZIERTEN JUGENDLICHEN
 HINWEISE FÜR MEDIZINISCHES FACHPERSONAL ZUR ANWENDUNG VON TENOFOVIRDISOPROXIL BEI HIV-INFIZIERTEN JUGENDLICHEN Dieses Informationsmaterial zur Anwendung von Tenofovirdisoproxil wurde als Teil der Zulassungsauflagen
HINWEISE FÜR MEDIZINISCHES FACHPERSONAL ZUR ANWENDUNG VON TENOFOVIRDISOPROXIL BEI HIV-INFIZIERTEN JUGENDLICHEN Dieses Informationsmaterial zur Anwendung von Tenofovirdisoproxil wurde als Teil der Zulassungsauflagen
Neufassung des Wortlauts der Produktinformationen Auszüge aus den Empfehlungen des PRAC zu Signalen
 25 January 2018 EMA/PRAC/35610/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Neufassung des Wortlauts der Produktinformationen Auszüge aus den Empfehlungen des PRAC zu Verabschiedet im Rahmen
25 January 2018 EMA/PRAC/35610/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Neufassung des Wortlauts der Produktinformationen Auszüge aus den Empfehlungen des PRAC zu Verabschiedet im Rahmen
Änderung der Verordnung (EG) Nr. 726/2004: Weitreichende Auswirkungen auf die frühe Nutzenbewertung
 22.03.2016 Änderung der Verordnung (EG) Nr. 726/2004: Weitreichende Auswirkungen auf die frühe Nutzenbewertung Die Europäische Kommission hat am 10.09.2014 einen Vorschlag für eine Verordnung des Europäischen
22.03.2016 Änderung der Verordnung (EG) Nr. 726/2004: Weitreichende Auswirkungen auf die frühe Nutzenbewertung Die Europäische Kommission hat am 10.09.2014 einen Vorschlag für eine Verordnung des Europäischen
KOMPLETTE ZUSAMMENFASSUNG DER WISSENSCHAFTLICHEN BEURTEILUNG VON ARZNEIMITTELN, DIE VALPROINSÄURE/VALPROAT ENTHALTEN (siehe Anhang I)
 ANHANG II WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG DER EUROPÄISCHEN ARZNEIMITTEL-AGENTUR FÜR DIE ÄNDERUNG DER ZUSAMMENFASSUNGEN DER MERKMALE DER ARZNEIMITTEL UND DER PACKUNGSBEILAGEN 127 WISSENSCHAFTLICHE
ANHANG II WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG DER EUROPÄISCHEN ARZNEIMITTEL-AGENTUR FÜR DIE ÄNDERUNG DER ZUSAMMENFASSUNGEN DER MERKMALE DER ARZNEIMITTEL UND DER PACKUNGSBEILAGEN 127 WISSENSCHAFTLICHE
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
ANHANG IV WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN
 ANHANG IV WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN Wissenschaftliche Schlussfolgerungen Aufgrund der sich überschneidenden Übertragungsmodi sind Koinfektionen mit dem Hepatitis-В-Virus (HBV) und dem Hepatitis-C-Virus
ANHANG IV WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN Wissenschaftliche Schlussfolgerungen Aufgrund der sich überschneidenden Übertragungsmodi sind Koinfektionen mit dem Hepatitis-В-Virus (HBV) und dem Hepatitis-C-Virus
VORICONAZOL-haltige Arzneimittel: Checkliste für medizinisches Fachpersonal
 VORICONAZOL-haltige Arzneimittel: Checkliste für medizinisches Fachpersonal Bitte füllen Sie diese Checkliste bei jedem Besuch Ihres Patienten, der mit VORICONAZOL-haltigen Arzneimitteln behandelt wird,
VORICONAZOL-haltige Arzneimittel: Checkliste für medizinisches Fachpersonal Bitte füllen Sie diese Checkliste bei jedem Besuch Ihres Patienten, der mit VORICONAZOL-haltigen Arzneimitteln behandelt wird,
Testosteron, Verfahren nach Art. 31 RL 2001/83/EG 75. Routinesitzung, 11. November 2014
 Testosteron, Verfahren nach Art. 31 RL 2001/83/EG 75. Routinesitzung, 11. November 2014 Initiative von Estland im März 2014 Berichterstatter: Dänemark, Estland Grund für das Verfahren: Mögliche erhöhte
Testosteron, Verfahren nach Art. 31 RL 2001/83/EG 75. Routinesitzung, 11. November 2014 Initiative von Estland im März 2014 Berichterstatter: Dänemark, Estland Grund für das Verfahren: Mögliche erhöhte
Anhang III Änderungen an den Zusammenfassungen der Merkmale des Arzneimittels und den Packungsbeilagen
 Anhang III Änderungen an den Zusammenfassungen der Merkmale des Arzneimittels und den Packungsbeilagen Hinweis: Diese Änderungen der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
Anhang III Änderungen an den Zusammenfassungen der Merkmale des Arzneimittels und den Packungsbeilagen Hinweis: Diese Änderungen der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
Anhang III. Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage
 Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
Wissenschaftliche Schlussfolgerungen der Europäischen Arzneimittel- Agentur
 Anhang I Wissenschaftliche Schlussfolgerungen, Schlussfolgerungen über die Ähnlichkeit und Ausnahme und Begründung für die Versagung der Europäischen Arzneimittel-Agentur Wissenschaftliche Schlussfolgerungen
Anhang I Wissenschaftliche Schlussfolgerungen, Schlussfolgerungen über die Ähnlichkeit und Ausnahme und Begründung für die Versagung der Europäischen Arzneimittel-Agentur Wissenschaftliche Schlussfolgerungen
Einleitung und Leseanweisung
 VII Einleitung und Leseanweisung Für wen ist dieses Buch? Der Pocket Guide ist für alle klinisch tätigen Psychiater geschrieben, denen das Kompendium der Psychiatrischen Pharmakotherapie für die Kitteltasche
VII Einleitung und Leseanweisung Für wen ist dieses Buch? Der Pocket Guide ist für alle klinisch tätigen Psychiater geschrieben, denen das Kompendium der Psychiatrischen Pharmakotherapie für die Kitteltasche
Erstmals Zahlen zu jährlichen Neuerkrankungen
 BEST-Studie: Neueste Daten zur Volkskrankheit Osteoporose Erstmals Zahlen zu jährlichen Neuerkrankungen - Jedes Jahr erleidet mehr als jeder zehnte Osteoporose-Patient eine Fraktur - Tendenz zu Verbesserungen
BEST-Studie: Neueste Daten zur Volkskrankheit Osteoporose Erstmals Zahlen zu jährlichen Neuerkrankungen - Jedes Jahr erleidet mehr als jeder zehnte Osteoporose-Patient eine Fraktur - Tendenz zu Verbesserungen
Raloxifen. Indikation. Empfehlungen zur wirtschaftlichen Verordnungsweise (1 3) Bei der Behandlung der Osteoporose sollte eine
 Ausgabe 4/2014 Wirkstoff AKTUELL Wirkstoff AKTUELL Raloxifen - - Indikation - Empfehlungen zur wirtschaftlichen Verordnungsweise (1 3) Bei der Behandlung der Osteoporose sollte eine - - amin-d- und Kalziumsupplementierung
Ausgabe 4/2014 Wirkstoff AKTUELL Wirkstoff AKTUELL Raloxifen - - Indikation - Empfehlungen zur wirtschaftlichen Verordnungsweise (1 3) Bei der Behandlung der Osteoporose sollte eine - - amin-d- und Kalziumsupplementierung
(Text von Bedeutung für den EWR)
 L 299/10 DE DURCHFÜHRUNGSVERORDNUNG (EU) Nr. 1090/2014 DER KOMMISSION vom 16. Oktober 2014 zur von Permethrin als alten Wirkstoff zur Verwendung in Biozidprodukten der Produktarten 8 und 18 (Text von Bedeutung
L 299/10 DE DURCHFÜHRUNGSVERORDNUNG (EU) Nr. 1090/2014 DER KOMMISSION vom 16. Oktober 2014 zur von Permethrin als alten Wirkstoff zur Verwendung in Biozidprodukten der Produktarten 8 und 18 (Text von Bedeutung
Internationales Multiples Myelom Symposium für PatientInnen und Angehörige 5.Mai 2007 Kardinal König Haus in Wien
 Internationales Multiples Myelom Symposium für PatientInnen und Angehörige 5.Mai 2007 Kardinal König Haus in Wien Ein Vortrag von Dr. Dr. Arno Wutzl Medizinische Universität Wien Bisphosphonat - assoziierte
Internationales Multiples Myelom Symposium für PatientInnen und Angehörige 5.Mai 2007 Kardinal König Haus in Wien Ein Vortrag von Dr. Dr. Arno Wutzl Medizinische Universität Wien Bisphosphonat - assoziierte
EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR)
 EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR) IM ZUSAMMENHANG MIT BLUTKOMPONENTEN nach 63i Abs. 4 AMG Allgemeines: Durch
EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR) IM ZUSAMMENHANG MIT BLUTKOMPONENTEN nach 63i Abs. 4 AMG Allgemeines: Durch
Denosumab reduziert das Risiko von vertebralen Frakturen und Hüftfrakturen effektiv und langanhaltend 1
 Osteoporosetherapie heute: Das Ziel heisst optimierte Patientenversorgung Denosumab reduziert das Risiko von vertebralen Frakturen und Hüftfrakturen effektiv und langanhaltend 1 Weimar (8. März 2013) Der
Osteoporosetherapie heute: Das Ziel heisst optimierte Patientenversorgung Denosumab reduziert das Risiko von vertebralen Frakturen und Hüftfrakturen effektiv und langanhaltend 1 Weimar (8. März 2013) Der
Gebrauchsinformation Zintona
 Gebrauchsinformation Bitte aufmerksam lesen Sehr geehrte Patientin, sehr geehrter Patient, bitte lesen Sie folgende Gebrauchsinformation aufmerksam, weil sie wichtige Informationen darüber enthält, was
Gebrauchsinformation Bitte aufmerksam lesen Sehr geehrte Patientin, sehr geehrter Patient, bitte lesen Sie folgende Gebrauchsinformation aufmerksam, weil sie wichtige Informationen darüber enthält, was
Gebrauchsinformation: Information für den Anwender
 Gebrauchsinformation: Information für den Anwender OPTOVIT forte 1 Weichkapsel enthält 134,2 mg RRR--Tocopherol (Vitamin E) Liebe Patientin, lieber Patient, bitte lesen Sie die gesamte Gebrauchsinformation
Gebrauchsinformation: Information für den Anwender OPTOVIT forte 1 Weichkapsel enthält 134,2 mg RRR--Tocopherol (Vitamin E) Liebe Patientin, lieber Patient, bitte lesen Sie die gesamte Gebrauchsinformation
MYCOPHENOLAT-MOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN. Information über die Risiken für das ungeborene Baby
 MYCOPHENOLAT-MOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN Information über die Risiken für das ungeborene Baby Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen
MYCOPHENOLAT-MOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN Information über die Risiken für das ungeborene Baby Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen
L 59/20 Amtsblatt der Europäischen Union
 L 59/20 Amtsblatt der Europäischen Union 28.2.2014 DURCHFÜHRUNGSVERORDNUNG (EU) Nr. 192/2014 R KOMMISSION vom 27. Februar 2014 zur des Wirkstoffs 1,4-Dimethylnaphthalin gemäß der Verordnung (EG) Nr. 1107/2009
L 59/20 Amtsblatt der Europäischen Union 28.2.2014 DURCHFÜHRUNGSVERORDNUNG (EU) Nr. 192/2014 R KOMMISSION vom 27. Februar 2014 zur des Wirkstoffs 1,4-Dimethylnaphthalin gemäß der Verordnung (EG) Nr. 1107/2009
DELEGIERTE VERORDNUNG (EU).../... DER KOMMISSION. vom
 EUROPÄISCHE KOMMISSION Brüssel, den 24.3.2017 C(2017) 1951 final DELEGIERTE VERORDNUNG (EU).../... DER KOMMISSION vom 24.3.2017 zur Änderung der Delegierten Verordnung (EU) 2016/1675 zur Ergänzung der
EUROPÄISCHE KOMMISSION Brüssel, den 24.3.2017 C(2017) 1951 final DELEGIERTE VERORDNUNG (EU).../... DER KOMMISSION vom 24.3.2017 zur Änderung der Delegierten Verordnung (EU) 2016/1675 zur Ergänzung der
MDR - WIE SPÜRBAR FÜR EIN GROSSUNTERNEHMEN?
 MDR - WIE SPÜRBAR FÜR EIN GROSSUNTERNEHMEN? Dr. Roland Prestel Berlin, 22. Juni 2018 FACTS AND FIGURES 2 MDR Patientensicherheit MDR, Erwägung (2) Ausgehend von einem hohen Gesundheitsschutzniveau für
MDR - WIE SPÜRBAR FÜR EIN GROSSUNTERNEHMEN? Dr. Roland Prestel Berlin, 22. Juni 2018 FACTS AND FIGURES 2 MDR Patientensicherheit MDR, Erwägung (2) Ausgehend von einem hohen Gesundheitsschutzniveau für
Wichtige Informationen zur Assoziation von Sprycel (Dasatinib) mit pulmonaler arterieller Hypertonie (PAH)
 2. August 2011 Wichtige Informationen zur Assoziation von Sprycel (Dasatinib) mit pulmonaler arterieller Hypertonie (PAH) Sehr geehrte Frau Doktor, sehr geehrter Herr Doktor, sehr geehrte Frau Apothekerin,
2. August 2011 Wichtige Informationen zur Assoziation von Sprycel (Dasatinib) mit pulmonaler arterieller Hypertonie (PAH) Sehr geehrte Frau Doktor, sehr geehrter Herr Doktor, sehr geehrte Frau Apothekerin,
Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der EMA für die Änderung der Zusammenfassungen der Merkmale des Arzneimittels und der Packungsbeilagen 77 Wissenschaftliche Schlussfolgerungen
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der EMA für die Änderung der Zusammenfassungen der Merkmale des Arzneimittels und der Packungsbeilagen 77 Wissenschaftliche Schlussfolgerungen
