Biochemische Labormethoden
|
|
|
- Ursula Adler
- vor 9 Jahren
- Abrufe
Transkript
1 Biochemische Labormethoden, Seite 1 Biochemische Labormethoden Einführung Mit den Versuchen an diesem ersten Praktikumstag sollen Sie wichtige Methoden wiederholen bzw. ergänzen, die Sie bereits im Chemischen Praktikum kennengelernt haben. Diese Fertigkeiten werden Sie in den folgenden Praktikumsversuchen immer wieder benötigen. Methoden zum Abmessen von Feststoffen: Wägung Methoden zum Abmessen von Flüssigkeiten: Pipettieren mit Mikroliterpipetten Herstellung von Lösungen definierter Zusammensetzung: Ansetzen von Lösungen und Puffern, Herstellen von Verdünnungsreihen, Konzentrationsberechnungen Analyse charakteristischer Eigenschaften von Lösungen: Messung des ph-wertes, Bestimmung der Lichtabsorption Methoden zur Abschätzung von Fehlern: Streuung von Messwerten, statistische Auswertung von Messergebnissen Stichworte zur Vorbereitung Stoffmenge und Konzentration: mol, Molmasse, molare Konzentration, Molarität, Verdünnen und Mischen von Lösungen, Rechnen mit Konzentrationen.Photometrie: Absorption (Absorption), Lambert-Beersches Gesetz, Absorptionskoeffizient. Säuren und Basen: Dissoziation, ph-wert, pk- Wert, Puffer, Pufferkapazität, Natronlauge, Phosphorsäure, Salzsäure, Histidin, Glutaminsäure, Natriumcarbonat, NAD+, NADH. Grundlagen der Statistik: Normalverteilung, Mittelwert, Standardabweichung, Variationskoeffizient. Bei der Vorbereitung beachten Sie bitte die Einleitung zum Praktikumsbuch und den Anhang zu diesem Versuch. Versuch 1: Messgenauigkeit beim Pipettieren und Wiegen In diesem Experiment sollen Sie das Pipettieren kleiner Volumina mit den im Praktikum verwendeten Kolbenpipetten üben und dabei die Genauigkeit solcher Pipettierungen ermitteln. Aufgabe: Pipettieren und Wiegen. Lassen Sie sich als erstes in die Bedienung der Waage einweisen. Üben Sie unter Anleitung das Pipettieren. Bestimmen Sie dann die Genauigkeit der Pipette, indem Sie 40mal je 100 µl bzw µl Wasser (Dichte bei 25 C etwa g * cm -3 ) pipettieren und das Gewicht jeder einzelnen Pipettierung mit der Waage bestimmen. Am besten pipettieren Sie in ein Gefäss, das auf der Waage steht. Am Anfang und nach jedem Pipettierschritt wird das Gewicht notiert. Die jeweils pipettierte Wassermenge ermittel der Rechner aus den Gewichtsdifferenzen. Auswerten: Erstellen Sie mit Hilfe des Computers aus den 40 Pipettierungen ein Diagramm. Dazu müssen Sie sich in die Benutzung des der Software einweisen lassen. Das Protokoll sollte die erstellte Grafik enthalten und die folgenden Fragen beantworten: 1. Wie gross sind der Mittelwert und die Standardabweichung der Pipettierungen? Angabe in mg. 2. Zeigt die Pipette einen signifikanten systematischen Fehler (d.h. eine echte Abweichung zwischen Mittelwert und Sollwert)? Angabe der Abweichung in % des Sollwerts. 3. Mit welchem Variationskoeffizienten (VK) haben Sie pipettiert? Angabe in %.
2 Biochemische Labormethoden, Seite 2 Versuch 2: Titration biologisch wichtiger Puffersubstanzen und Puffergruppen Dabei sollen Sie die Lösung einer Säure gegen eine Lauge titrieren (bzw. umgekehrt) und durch Messung des ph-wertes die pk-werte der puffernden Substanz und die Pufferkapazität ermitteln. Zur Auswahl stehen die folgenden fertigen Lösungskombinationen: in der Vorlage (20 ml) 1 24 mm Natriumcarbonat mit 140 mm Natriumchlorid Titration mit (in Schritten von 100 µl) 240 mm Salzsäure mm Phosphorsäure 1 M Natronlauge 3 50 mm Glutaminsäure mit 80 mm Salzsäure 4 25 mm Histidin mit 50 mm Salzsäure 1 M Natronlauge 250 mm Natronlauge Aufgabe: Titrieren und ph-messen. Pipettieren Sie 20 ml einer der Lösungen (1, 2, 3 oder 4) in ein kleines Becherglas (30-50 ml) und bestimmen Sie den ph-wert der Lösung. Geben Sie in 100 µl-schritten mit einer Pipette die rechts davon angegebene Lösung hinzu und notieren Sie jeweils den ph-wert, nachdem die Lösungen durch Rühren mit dem Magnetrührer gut durchmischt sind. Insgesamt sind Pipettierschritte erforderlich. Zeichnen und Auswerten: Zeichnen Sie die Titrationskurve wieder mit Hilfe des Computers. In dem Ausdruck sollen Sie die folgenden Auswertungen mit Farbstift vornehmen: 1. Kennzeichnen Sie auf dem Diagramm die ph-bereiche, in dem die titrierte Substanz puffert. 2. Ermitteln Sie grafisch die pk-werte der puffernden Substanz und ordnen sie sie den einzelnen funktionellen Gruppen des titrierten Moleküls zu. 3. Berechnen Sie die Pufferkapazität. Dazu ermitteln Sie grafisch in einem der Pufferbereiche den Konzentrationszuwachs von Lauge bzw. Säure, der zu einer ph-wert-änderung um eine Einheit führt (Angabe in mol l -1 /ph, siehe Anhang).
3 Biochemische Labormethoden, Seite 3 Versuch 3: Photometrie, Absorptionsspektrum, Absorptionskoeffizient In diesem Versuch sollen Sie bereitstehende Lösung von NAD + bzw. NADH verdünnen und das Absorptionsspektrum der Lösungen (d.h. die Absorption als Funktion der Wellenlänge) messen. Ausserdem ermitteln Sie die Wellenlänge am Absorptionsmaximum und den molaren Absorptionskoeffizienten von NADH. Schliesslich nehmen Sie eine Eichkurve für NADH auf und ermitteln daraus die Konzentration einer unbekannten NADH-Lösung. Aufgabe1: Absorption bei verschiedenen Wellenlängen messen. Pipettieren Sie 300 µl von einer der beiden bereitstehenden Lösungen (entweder 1 mm NAD + oder 1 mm NADH) in ein Reagenzglas und verdünnen Sie durch Zugabe von destilliertem Wasser auf eine Konzentration von 100 µm. Geben Sie diese Lösung in eine Küvette und messen Sie die Absorption im Bereich von 320 bis 400 nm in 5 nm-schritten gegen einen Leerwert (Wasser). Bei jeder neuen Wellenlänge muss der Leerwert auf A= 0 abgeglichen werden. Zeichnen und Auswerten. Zeichnen Sie mit Hilfe des Computers das Absorptionsspektrum (y-achse: gemessene Absorption E; x-achse: eingestellte Wellenlänge). Lesen Sie die Wellenlänge λ des Absorptionsmaximums ab und bestimmen Sie den molaren Absorptionskoeffizienten ε bei dieser Wellenlänge (das geht nur, wenn ein Maximum erkennbar ist!) Aufgabe 2: Verdünnen und Absorption messen. Verdünnen Sie die bereitstehende 1 mm NADH-Lösung in den Volumenverhältnissen 1:10, 1:20, 1:40 und 1:80 mit Wasser und bestimmen Sie die Absorption dieser Lösungen bei 340 nm. Die Nucleotid-Lösung ist nicht billig. Setzen Sie deshalb von jeder Verdünnung nur maximal 5 ml an! Zeichnen und Auswerten. Zeichnen Sie (von Hand, siehe Anhang) den Zusammenhang zwischen Konzentration und gemessener Absorption (y-achse: gemessene Absorption A; x-achse: berechnete Konzentration). Bestimmen Sie auch aus diesen Werten den Absorptionskoeffizienten. Aufgabe 3: Absorption einer unbekannten Lösung messen. Füllen Sie etwa 3 ml der ausstehenden unbekannten NADH-Lösung in eine Küvette und messen Sie die Absorption bei 340 nm gegen einen Leerwert. Auswerten. Berechnen Sie die unbekannte Konzentration mit Hilfe der ε-werte aus Aufgabe 1 und 2 (Angabe in mol l -1 ). Welcher Wert von ist der zuverlässigere?
4 Biochemische Labormethoden, Seite 4 Fragen 1. Wie berechnet man den Mittelwert einer Messreihe? Was versteht man unter Streuung der Messwerte und wie gibt man sie quantitativ an? 2. Wieviel NaCl (Molmasse 58,5) benötigen Sie zum Ansetzen von 2 Litern einer M Lösung? Wie stellen Sie diese Lösung her? 3. Wieviel mg NADH-Na 2 (rel. Molmasse 709,4) müssen Sie abwiegen, um 5 ml einer 1 mm Lösung herzustellen? 4. Welche Konzentration erhält man beim Verdünnen von 2 ml einer M Lösung auf 10 ml? 5. Wie gross ist die Konzentration von Wasser (Angabe in mol * l -1 ) in reinem Wasser? 6. Wie ist der ph-wert einer Lösung definiert? Von welchen Grössen hängt er ab? 7. Wie hoch sind die H + -Konzentration und der ph-wert von reinem Wasser bei 25 o C? 8. Warum kann Wasser sowohl eine Säure als auch eine Base sein? 9. Aufgrund welcher chemischen Eigenschaft ist Essigsäure sauer? 10. Wie gibt man die Stärke einer Säure oder Base an? 11. Welche ph-werte haben eine 1 M, eine 0,1 M und eine 10 mm wässrige Salzsäure-Lösung? 12. In welchen Formen kann Phosphorsäure in wässriger Lösung auftreten? Welche davon sind im Blut die häufigsten? 13. Wieviele Ladungen trägt Glutaminsäure a) bei ph 1, b) bei ph 6? 14. Wie lautet das Lambert-Beer sche Gesetz? Unter welchen Bedingungen ist es gültig? 15. Von welchen Parametern ist die Absorption (Absorption) einer Lösung abhängig? 16. Warum wird in der Photometrie monochromatisches Licht verwendet? 17. Welche Reaktionen finden bei der Titration von salzsaurer Histidin-Lösung mit Natronlauge nacheinander statt?
5 Biochemische Labormethoden, Seite 5 Anhang 1: Konzentrationsberechnungen Einheit der Stoffmenge Einheit der Stoffkonzentration : mol : mol l -1, abgekürzt: M ( molar ) 1 M (molar) : die Lösung enthält pro Liter 1 mol des Stoffes 1 mm (millimolar) : die Lösung enthält pro Liter 10-3 mol des Stoffes 1 M (mikromolar) : die Lösung enthält pro Liter 10-6 mol des Stoffes 1 nm (nanomolar) : die Lösung enthält pro Liter 10-9 mol des Stoffes Rechnen mit kleinen Zahlen Beim Umgang mit kleinen Konzentrationen bedient man sich am besten der Potenzdarstellung, d.h. 1 = 10 0 = = 10-1 = = 10-2 = = 10-3 = usw. Man schreibt kleine Zahlen als Produkt einer Zahl zwischen 1 und 10 und der zugehörigen Zehnerpotenz, also z.b als Multiplikation: (x 10 a ) (y 10 b ) = x y 10 (a+b) Beispiel: = (2-4) = Division: (x 10 a ) / y 10 b = (x / y) 10 (a-b) Beispiel: / = (1/4) 10-4 (-6) = = 25 Verdünnen und Mischen Beim Verdünnen und Mischen geht kein gelöster Stoff verloren, d.h. die Stoffmenge (= Konzentration Volumen) bleibt gleich. Verdünnt man V 1 ml einer Lösung der Konzentration c 1 mit reinem Lösungsmittel auf ein Endvolumen von V 2 ml, gilt c 1 V 1 = c 2 V 2, d.h. c 2 = c 1 (V 1 /V 2 ) Beispiel: 5 ml einer Lösung der Konzentration M werden auf 250 ml verdünnt. Die entstehende Lösung hat in diesem Fall die Konzentration c 2 = (5/250) M = M. b) Beim Mischen von Lösungen der Konzentrationen c 1 und c 2 gilt für Konzentration c 3 c 3 = (c 1 V 1 + c 2 V 2 ) / (V 1 + V 2 ) Beispiel: 4 ml einer Lösung der Konzentration M werden mit 6 ml einer M Lösung gemischt. Die neue Konzentration ist dann c 3 = ( ) / 10 = M
6 Biochemische Labormethoden, Seite 6 Anhang 2: Grundlagen der Statistik Bei rein zufälligen Fehlern gilt die Gauss sche Normalverteilung. Sie ist charakterisiert durch den Mittelwert m und die Standardabweichung s. Als Faustregel kann man sich merken, dass ein systematischer Fehler wahrscheinlich dann vorliegt, wenn sich Mittelwert und Sollwert um mindestens 2 s unterscheiden. Gauss'sche Normalverteilung m-s s m s m + s hier: s = 16.0 m = Häufigkeit m = Σ x i / n s = Σ (x i - m) 2 / (n-1) Varianz = s 2 VK = 100. s / m (%) Meßwert Anhang 3: Titrationskurven und Pufferkapazität Im Beispiel handelt es sich um eine zweiprotonige Säure mit pk-werten von 3 und 10. Zur Bestimmung der Pufferkapazität wurde im Pufferbereich 2 durch ein Steigungsdreieck graphisch ermittelt, dass zur Erhöhung des ph-werts um 2 Einheiten (von 8-10) 1 ml NaOH nötig war. Wenn wir annehmen, dass die zur Titration verwendet NaOH die Konzentration 1 M hatte und das Ausgangsvolumen der zu titrierenden Lösung 20 ml betrug, ergibt sich aus der Abbildung eine maximale Pufferkapazität der Lösung von ungefähr mol l -1 (Näherungsrechnung: 1ml 1 M NaOH wurde auf etwa 21.5 ml verdünnt. Wie kann man ein genaues Ergebnis erhalten?). 12 ph pk 2 V ph 4 2 pk 1 Pufferbereich ml NaOH Pufferkapazität = c / ph ( in m ol / l)
7 Biochemische Labormethoden, Seite 7 Eichkurve NADH+H Absorption NADH-Konzentration (mol l -1 ) Verdünnung 1 : 10 1 : 20 1 : 40 1 : 80 unbekannte Lsg. Konzentration (mol l 1 ) ε = l mol -1 cm -1 Absorption (gemessen) Name: Gruppe:...
8 Biochemische Labormethoden, Seite 8
Labormethoden. Versuch 1: Messgenauigkeit beim Pipettieren und Wiegen
 Labormethoden Einführung Mit den Versuchen an diesem ersten Praktikumstag sollen Sie wichtige Methoden wiederholen bzw. ergänzen, die Sie bereits im Chemischen Praktikum kennengelernt haben. Diese Fertigkeiten
Labormethoden Einführung Mit den Versuchen an diesem ersten Praktikumstag sollen Sie wichtige Methoden wiederholen bzw. ergänzen, die Sie bereits im Chemischen Praktikum kennengelernt haben. Diese Fertigkeiten
Standardabweichung und Variationskoeffizient. Themen. Prinzip. Material TEAS Qualitätskontrolle, Standardabweichung, Variationskoeffizient.
 Standardabweichung und TEAS Themen Qualitätskontrolle, Standardabweichung,. Prinzip Die Standardabweichung gibt an, wie hoch die Streuung der Messwerte um den eigenen Mittelwert ist. Sie ist eine statistische
Standardabweichung und TEAS Themen Qualitätskontrolle, Standardabweichung,. Prinzip Die Standardabweichung gibt an, wie hoch die Streuung der Messwerte um den eigenen Mittelwert ist. Sie ist eine statistische
Protokoll Tag 4, Teil 1
 Protokoll Tag 4, Teil 1 D. Titrationsverfahren D.1. Einführung in die quantitative Analyse; D.2. Acidimetrie (Bestimmung der Konzentration einer Säure) Am heutigen letzten Tag des Praktikums geht es um
Protokoll Tag 4, Teil 1 D. Titrationsverfahren D.1. Einführung in die quantitative Analyse; D.2. Acidimetrie (Bestimmung der Konzentration einer Säure) Am heutigen letzten Tag des Praktikums geht es um
Für enzymkinetische Untersuchungen legen Sie 0.2 ml einer 5 mm Substratlösung vor. Der fertige Inkubationsansatz hat ein Volumen von 2 ml.
 Die Gehschule ist ein Teil der Biochemischen Übungen für das Bakkalaureat LMBT. Der Test wird im Anschluss an die Prüfung aus Grundlagen der Biochemie angeboten, welche 90 min dauert (also bei der Türe
Die Gehschule ist ein Teil der Biochemischen Übungen für das Bakkalaureat LMBT. Der Test wird im Anschluss an die Prüfung aus Grundlagen der Biochemie angeboten, welche 90 min dauert (also bei der Türe
A. Wieviel molar ist eine 30 % Wasserstoffperoxidlösung (d = 1.11, M = 34)
 Grundlagen der Biochemie 29. 2. 2008 Einfache Rechenfragen: A. Wieviel molar ist eine 30 % Wasserstoffperoxidlösung (d = 1.11, M = 34) B. Welche Stoffmenge enthalten 2 µl einer 5 µm Lösung? Richtige Einheit
Grundlagen der Biochemie 29. 2. 2008 Einfache Rechenfragen: A. Wieviel molar ist eine 30 % Wasserstoffperoxidlösung (d = 1.11, M = 34) B. Welche Stoffmenge enthalten 2 µl einer 5 µm Lösung? Richtige Einheit
Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1. Lambert Beer sches Gesetz - Zerfall des Manganoxalations
 Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 34 Lambert Beer sches Gesetz - Zerfall des Manganoxalations Aufgabe: 1. Bestimmen Sie die Wellenlänge maximaler Absorbanz λ max eines
Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 34 Lambert Beer sches Gesetz - Zerfall des Manganoxalations Aufgabe: 1. Bestimmen Sie die Wellenlänge maximaler Absorbanz λ max eines
Säure-Base-Titrationen
 Säure-Base-Titrationen Dieses Skript gehört: Säure Base - Titrationen Seite 2 Hinweis: Mit den Säuren und Basen ist vorsichtig umzugehen, um Verätzungen zu vermeiden! Versuch 1: Herstellen einer Natronlauge
Säure-Base-Titrationen Dieses Skript gehört: Säure Base - Titrationen Seite 2 Hinweis: Mit den Säuren und Basen ist vorsichtig umzugehen, um Verätzungen zu vermeiden! Versuch 1: Herstellen einer Natronlauge
Dr. Tobias Schafmeier, BZH
 Dr. Tobias Schafmeier, BZH Einführungsversuche A: Genauigkeit und Präzision des Pipettierens mit Kolbenhubpipette B: Bestimmung des Extinktionskoeffizienten von Methylenblau Absorptionsspektrum von NADH/NAD
Dr. Tobias Schafmeier, BZH Einführungsversuche A: Genauigkeit und Präzision des Pipettierens mit Kolbenhubpipette B: Bestimmung des Extinktionskoeffizienten von Methylenblau Absorptionsspektrum von NADH/NAD
Säurekonstante des p-nitrophenols
 Säurekonstante des p-nitrophenols Grundlagen Sie bestimmen spektralphotometrisch die Säurekonstante einer schwachen Säure. Voraussetzung dafür ist, dass die undissoziierte Säure in einem anderen Spektralbereich
Säurekonstante des p-nitrophenols Grundlagen Sie bestimmen spektralphotometrisch die Säurekonstante einer schwachen Säure. Voraussetzung dafür ist, dass die undissoziierte Säure in einem anderen Spektralbereich
Martin Raiber Chemie Protokoll Nr Gruppe 2 (Schrankseite) Untersuchung von Glycin
 Martin Raiber Chemie Protokoll Nr.4 5.3.2006 Gruppe 2 (Schrankseite) Untersuchung von Glycin Chemikalien: Glycin ( c=0,1 mol/l ) Essigsäure ( c=0,1 mol/l ) 0,75g Glycin Salzsäure ( 100ml, c=0,1 mol/l )
Martin Raiber Chemie Protokoll Nr.4 5.3.2006 Gruppe 2 (Schrankseite) Untersuchung von Glycin Chemikalien: Glycin ( c=0,1 mol/l ) Essigsäure ( c=0,1 mol/l ) 0,75g Glycin Salzsäure ( 100ml, c=0,1 mol/l )
Typische Fragen für den Gehschul-Teil: Typ 1: Mengen und Konzentrationen:
 Die Gehschule ist ein Teil der Biochemischen Übungen für das Bakkalaureat LMBT. Aus organisatorischen Gründen wird dieser Test gleichzeitig mit der Prüfung aus Grundlagen der Biochemie angeboten. Das Abschneiden
Die Gehschule ist ein Teil der Biochemischen Übungen für das Bakkalaureat LMBT. Aus organisatorischen Gründen wird dieser Test gleichzeitig mit der Prüfung aus Grundlagen der Biochemie angeboten. Das Abschneiden
G1 pk S -Wert Bestimmung der Essigsäure
 G1 pk S -Wert Bestimmung der Essigsäure Bürette Rührer, Rührfisch ph-meter mit Einstabmesskette Stativ Becherglas Essigsäure H: 226, 314 P: 210, 260, 280.1+3, 303+361+353, 304+340, 305+351+338, 310 Phenolphthalein
G1 pk S -Wert Bestimmung der Essigsäure Bürette Rührer, Rührfisch ph-meter mit Einstabmesskette Stativ Becherglas Essigsäure H: 226, 314 P: 210, 260, 280.1+3, 303+361+353, 304+340, 305+351+338, 310 Phenolphthalein
ph-wert Berechnung für starke Säuren / Basen
 ph-wert Berechnung für starke Säuren / Basen 0.1 mol/l HCl: HCl + H 2 O H 3 O + + Cl starke Säure, vollständige Dissoziation [H 3 O + ] = 10 1 mol/l; ph = 1 0.1 mol/l NaOH: NaOH Na + aq + OH starke Base,
ph-wert Berechnung für starke Säuren / Basen 0.1 mol/l HCl: HCl + H 2 O H 3 O + + Cl starke Säure, vollständige Dissoziation [H 3 O + ] = 10 1 mol/l; ph = 1 0.1 mol/l NaOH: NaOH Na + aq + OH starke Base,
merken!!! 29,22 g NaCl abwiegen, in einem Becher mit etwa 800 ml Wasser lösen, dann im Messzylinder auf 1000 ml auffüllen.
 Das ABC der Stöchiometrie Lösungen aus Feststoffen Molare Lösungen herstellen (m = M c V) Beispiel 1: 1 L einer 500 mm NaCl-Lösung herstellen. Masse: Volumen: Stoffmenge: Dichte: m (kg) V (L) n (mol) (kg/l)
Das ABC der Stöchiometrie Lösungen aus Feststoffen Molare Lösungen herstellen (m = M c V) Beispiel 1: 1 L einer 500 mm NaCl-Lösung herstellen. Masse: Volumen: Stoffmenge: Dichte: m (kg) V (L) n (mol) (kg/l)
ph-wert Berechnung für starke Säuren / Basen
 ph-wert Berechnung für starke Säuren / Basen 0.1 mol/l HCl: HCl + H 2 O H 3 O + + Cl starke Säure, vollständige Dissoziation [H 3 O + ] = 10 1 mol/l; ph = 1 0.1 mol/l NaOH: NaOH + H 2 O Na + aq + OH starke
ph-wert Berechnung für starke Säuren / Basen 0.1 mol/l HCl: HCl + H 2 O H 3 O + + Cl starke Säure, vollständige Dissoziation [H 3 O + ] = 10 1 mol/l; ph = 1 0.1 mol/l NaOH: NaOH + H 2 O Na + aq + OH starke
Vorpraktikum Grundoperationen im chemischen Laboratorium
 Vorpraktikum Grundoperationen im chemischen Laboratorium Stand: 23. April 2019 Inhalt: Volumetrische Messgeräte Säure-Base-Titration Analysenwaagen Fest-Flüssig-Trennverfahren Wasserlöslichkeit Verdünnung
Vorpraktikum Grundoperationen im chemischen Laboratorium Stand: 23. April 2019 Inhalt: Volumetrische Messgeräte Säure-Base-Titration Analysenwaagen Fest-Flüssig-Trennverfahren Wasserlöslichkeit Verdünnung
Biochemisches Grundpraktikum
 Biochemisches Grundpraktikum Versuch Nummer G-01 01: Potentiometrische und spektrophotometrische Bestim- mung von Ionisationskonstanten Gliederung: I. Titrationskurve von Histidin und Bestimmung der pk-werte...
Biochemisches Grundpraktikum Versuch Nummer G-01 01: Potentiometrische und spektrophotometrische Bestim- mung von Ionisationskonstanten Gliederung: I. Titrationskurve von Histidin und Bestimmung der pk-werte...
Gefahrenstoffe. 2 Bechergläser (230 ml), Bürette, Magnetrührer, Trichter, Rührschwein, Pipette, Stativ, Muffe, ph-meter
 1.1 V1 Titration von Cola In diesem Versuch wird die in Cola enthaltene Phosphorsäure mittels Säure-Base-Titration titriert und bestimmt. Ebenfalls wird mit den erhaltenen Werten gerechnet um das chemische
1.1 V1 Titration von Cola In diesem Versuch wird die in Cola enthaltene Phosphorsäure mittels Säure-Base-Titration titriert und bestimmt. Ebenfalls wird mit den erhaltenen Werten gerechnet um das chemische
Physikalische Chemie Praktikum. Elektrolyte: Dissoziationskonstante von Essigsäure λ von NaCl ist zu ermitteln
 Hochschule Emden/Leer Physikalische Chemie Praktikum Vers. Nr. 16 April 2017 Elektrolyte: Dissoziationskonstante von Essigsäure λ von NaCl ist zu ermitteln In diesem Versuch soll die Dissoziationskonstante
Hochschule Emden/Leer Physikalische Chemie Praktikum Vers. Nr. 16 April 2017 Elektrolyte: Dissoziationskonstante von Essigsäure λ von NaCl ist zu ermitteln In diesem Versuch soll die Dissoziationskonstante
Säure-Base Titrationen
 Chemie Praktikum Säure-Base Titrationen WS 2006/2007 Verfasser: Lorenz Germann, Lukas Bischoff Versuchsteilnehmer: Lorenz Germann, Lukas Bischoff Datum: 29.11.2006 Assistent: Lera Tomasic E-mail: [email protected]
Chemie Praktikum Säure-Base Titrationen WS 2006/2007 Verfasser: Lorenz Germann, Lukas Bischoff Versuchsteilnehmer: Lorenz Germann, Lukas Bischoff Datum: 29.11.2006 Assistent: Lera Tomasic E-mail: [email protected]
Lösungen zu den Übungen zur Einführung in die Spektroskopie für Studenten der Biologie (SS 2011)
 Universität Konstanz Fachbereich Biologie Priv.-Doz. Dr. Jörg H. Kleinschmidt http://www.biologie.uni-konstanz.de/folding/home.html Datum: 26.5.211 Lösungen zu den Übungen zur Einführung in die Spektroskopie
Universität Konstanz Fachbereich Biologie Priv.-Doz. Dr. Jörg H. Kleinschmidt http://www.biologie.uni-konstanz.de/folding/home.html Datum: 26.5.211 Lösungen zu den Übungen zur Einführung in die Spektroskopie
Vorpraktikum Grundoperationen im chemischen Laboratorium
 Vorpraktikum Grundoperationen im chemischen Laboratorium Stand: 09. April 2018 Inhalt: Volumetrische Messgeräte Analysenwaagen Fest-Flüssig-Trennverfahren Flüssig-Flüssig-Trennverfahren Wasserlöslichkeit
Vorpraktikum Grundoperationen im chemischen Laboratorium Stand: 09. April 2018 Inhalt: Volumetrische Messgeräte Analysenwaagen Fest-Flüssig-Trennverfahren Flüssig-Flüssig-Trennverfahren Wasserlöslichkeit
(Atommassen: Ca = 40, O = 16, H = 1;
 1.) Welche Molarität hat eine 14,8%ige Ca(OH) 2 - Lösung? (Atommassen: Ca = 40, O = 16, H = 1; M: mol/l)! 1! 2! 2,5! 3! 4 M 2.) Wieviel (Gewichts)%ig ist eine 2-molare Salpetersäure der Dichte 1,100 g/cm
1.) Welche Molarität hat eine 14,8%ige Ca(OH) 2 - Lösung? (Atommassen: Ca = 40, O = 16, H = 1; M: mol/l)! 1! 2! 2,5! 3! 4 M 2.) Wieviel (Gewichts)%ig ist eine 2-molare Salpetersäure der Dichte 1,100 g/cm
C Säure-Base-Reaktionen
 -V.C1- C Säure-Base-Reaktionen 1 Autoprotolyse des Wassers und ph-wert 1.1 Stoffmengenkonzentration Die Stoffmengenkonzentration eines gelösten Stoffes ist der Quotient aus der Stoffmenge und dem Volumen
-V.C1- C Säure-Base-Reaktionen 1 Autoprotolyse des Wassers und ph-wert 1.1 Stoffmengenkonzentration Die Stoffmengenkonzentration eines gelösten Stoffes ist der Quotient aus der Stoffmenge und dem Volumen
Versuch 1: Extraktion von ß-Carotin aus Lebensmitteln
 Name Datum Versuch 1: Extraktion von aus Lebensmitteln Geräte: 4 Reagenzgläser, 4 Gummistopfen, Reagenzglasständer, 1 Erlenmeyerkolben mit Stopfen, Messer, Mörser, Spatel, Messpipette, 1 kleine Petrischale,
Name Datum Versuch 1: Extraktion von aus Lebensmitteln Geräte: 4 Reagenzgläser, 4 Gummistopfen, Reagenzglasständer, 1 Erlenmeyerkolben mit Stopfen, Messer, Mörser, Spatel, Messpipette, 1 kleine Petrischale,
Technische Universität Chemnitz Chemisches Grundpraktikum
 Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP5 - Massanalytische Bestimmungsverfahren (Volumetrie)» Martin Wolf Betreuerin: Frau Sachse Datum:
Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP5 - Massanalytische Bestimmungsverfahren (Volumetrie)» Martin Wolf Betreuerin: Frau Sachse Datum:
Protokoll 2. Labor für Physikalische Chemie. Modul IV. Versuch 6
 Protokoll 2 Labor für Physikalische Chemie Modul IV Versuch 6 Herstellung einer Titerbestimmung von 500mL einer Salzsäure Maßlösung mit der Äquivalentkonzentration c(hcl) = 0,1 mol/l Fachbereich MT 1 Wintersemester
Protokoll 2 Labor für Physikalische Chemie Modul IV Versuch 6 Herstellung einer Titerbestimmung von 500mL einer Salzsäure Maßlösung mit der Äquivalentkonzentration c(hcl) = 0,1 mol/l Fachbereich MT 1 Wintersemester
Identifizierung des Farbstoffes in blauen M&Ms durch Dünnschichtchromatographie
 Name Datum Identifizierung des Farbstoffes in blauen M&Ms durch Dünnschichtchromatographie Material: DC-Karten (Kieselgel), Glas mit Deckel(DC-Kammer), Kapillare, Messzylinder Chemikalien: Blaue M&Ms,
Name Datum Identifizierung des Farbstoffes in blauen M&Ms durch Dünnschichtchromatographie Material: DC-Karten (Kieselgel), Glas mit Deckel(DC-Kammer), Kapillare, Messzylinder Chemikalien: Blaue M&Ms,
Amt für Lehrerbildung Abteilung IV - Fortbildung. Bericht über eine Fortbildungsveranstaltung. Sondermaßnahme Chemie/Physik/Biologie
 Amt für Lehrerbildung Abteilung IV - Fortbildung Bericht über eine Fortbildungsveranstaltung Sondermaßnahme Chemie/Physik/Biologie Titel der Veranstaltung: BFF NaWi Fachmathematische Anforderungen Ort,
Amt für Lehrerbildung Abteilung IV - Fortbildung Bericht über eine Fortbildungsveranstaltung Sondermaßnahme Chemie/Physik/Biologie Titel der Veranstaltung: BFF NaWi Fachmathematische Anforderungen Ort,
Einführung Fehlerrechnung
 Einführung Fehlerrechnung Bei jeder Messung, ob Einzelmessung oder Messreihe, muss eine Aussage über die Güte ( Wie groß ist der Fehler? ) des Messergebnisses gemacht werden. Mögliche Fehlerarten 1. Systematische
Einführung Fehlerrechnung Bei jeder Messung, ob Einzelmessung oder Messreihe, muss eine Aussage über die Güte ( Wie groß ist der Fehler? ) des Messergebnisses gemacht werden. Mögliche Fehlerarten 1. Systematische
Versuch 6.14 ph-abhängigkeit eines Indikators am Beispiel Thymolblau
 Versuch 6.14 ph-abhängigkeit eines Indikators am Beispiel Thymolblau Einleitung Lösungen mit verschiedenen ph-werten von stark sauer bis stark basisch werden mit gleich viel Thymolblau-Lösung versetzt.
Versuch 6.14 ph-abhängigkeit eines Indikators am Beispiel Thymolblau Einleitung Lösungen mit verschiedenen ph-werten von stark sauer bis stark basisch werden mit gleich viel Thymolblau-Lösung versetzt.
wird titriert mit Salzsäure der Konzentration c(hcl) = 1 mol/l.
 1 Problemstellung 1 Liter Natronlauge der Konzentration c(naoh) = 1 mol/l wird titriert mit Salzsäure der Konzentration c(hcl) = 1 mol/l. Der ph-wert Lösung soll für verschiedene zugegebene HCl-Volumina
1 Problemstellung 1 Liter Natronlauge der Konzentration c(naoh) = 1 mol/l wird titriert mit Salzsäure der Konzentration c(hcl) = 1 mol/l. Der ph-wert Lösung soll für verschiedene zugegebene HCl-Volumina
Verdünnungsaufgaben aus dem Laboralltag
 Verdünnungsaufgaben aus dem Laboralltag Biolaboranten 1. Aus einer lösung mit β 0 = 50 mg/l soll eine Verdünnungsreihe mit 4 Verdünnungen hergestellt werden. Zusammen sollen die 5 Lösungen den Konzentrationsbereich
Verdünnungsaufgaben aus dem Laboralltag Biolaboranten 1. Aus einer lösung mit β 0 = 50 mg/l soll eine Verdünnungsreihe mit 4 Verdünnungen hergestellt werden. Zusammen sollen die 5 Lösungen den Konzentrationsbereich
Beispiele zu Neutralisationsreaktionen
 Beispiele zu Neutralisationsreaktionen Einleitung: Im Zuge des folgenden Blocks wird die Titration als Beispiel einer gängigen quantitativen Bestimmungsmethode in der Chemie genauer besprochen und für
Beispiele zu Neutralisationsreaktionen Einleitung: Im Zuge des folgenden Blocks wird die Titration als Beispiel einer gängigen quantitativen Bestimmungsmethode in der Chemie genauer besprochen und für
Lösung 7. Allgemeine Chemie I Herbstsemester Je nach Stärke einer Säure tritt eine vollständige oder nur eine teilweise Dissoziation auf.
 Lösung 7 Allgemeine Chemie I Herbstsemester 2012 1. Aufgabe Je nach Stärke einer Säure tritt eine vollständige oder nur eine teilweise Dissoziation auf. Chlorwasserstoff ist eine starke Säure (pk a = 7),
Lösung 7 Allgemeine Chemie I Herbstsemester 2012 1. Aufgabe Je nach Stärke einer Säure tritt eine vollständige oder nur eine teilweise Dissoziation auf. Chlorwasserstoff ist eine starke Säure (pk a = 7),
Chemie Klausur SS Aminosäuren (11.5 Punkte) a) Benennen Sie die unten stehenden Aminosäuren:
 Chemie Klausur SS14 1. Aminosäuren (11.5 Punkte) a) Benennen Sie die unten stehenden Aminosäuren: b) Bestimmen Sie den isoelektrischen Punkt der Aminosäure Lysin (unterer Graph)! pks1 = 2,0 pks2 = 9,1
Chemie Klausur SS14 1. Aminosäuren (11.5 Punkte) a) Benennen Sie die unten stehenden Aminosäuren: b) Bestimmen Sie den isoelektrischen Punkt der Aminosäure Lysin (unterer Graph)! pks1 = 2,0 pks2 = 9,1
Aufnahme einer Extinktionskurve. Themen. Prinzip. Material TEAS Photometrie, Extinktion, Verdünnung, Extinktionskurve
 Aufnahme einer TEAS Themen Photometrie, Extinktion, Verdünnung, Prinzip Eine Farbstofflösung wird zunächst hergestellt und anschließend die Extinktion bei verschiedenen Wellenlängen gemessen. Anschließend
Aufnahme einer TEAS Themen Photometrie, Extinktion, Verdünnung, Prinzip Eine Farbstofflösung wird zunächst hergestellt und anschließend die Extinktion bei verschiedenen Wellenlängen gemessen. Anschließend
8. Löslichkeit verschiedener Salze bestimmen
 Praktikum Chemie N 8 Classe : Date de la remise : Note sur 10 : Nom(s) : 8. Löslichkeit verschiedener Salze bestimmen Video Löslichkeit Die Löslichkeit eines Stoffes gibt an, in welchem Umfang ein Reinstoff
Praktikum Chemie N 8 Classe : Date de la remise : Note sur 10 : Nom(s) : 8. Löslichkeit verschiedener Salze bestimmen Video Löslichkeit Die Löslichkeit eines Stoffes gibt an, in welchem Umfang ein Reinstoff
Titration von Aminosäuren, Lösung. 1. Aufnahme der Titrationskurve
 1. Aufnahme der Titrationskurve Beobachtung: Zu Beginn hat die Lösung einen ph-wert von etwa 2. Der ph-wert steigt nur langsam. Nach Zugabe von etwa 9 ml Natronlauge steigt der ph-wert sprunghaft an. Anschießend
1. Aufnahme der Titrationskurve Beobachtung: Zu Beginn hat die Lösung einen ph-wert von etwa 2. Der ph-wert steigt nur langsam. Nach Zugabe von etwa 9 ml Natronlauge steigt der ph-wert sprunghaft an. Anschießend
CHEMIE KAPITEL 4 SÄURE-BASE. Timm Wilke. Georg-August-Universität Göttingen. Wintersemester 2013 / 2014
 CHEMIE KAPITEL 4 SÄURE-BASE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Aufgaben In einen Liter Wasser werden 2 g NH - 2 (starke Base) eingeleitet welchen ph-wert hat
CHEMIE KAPITEL 4 SÄURE-BASE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Aufgaben In einen Liter Wasser werden 2 g NH - 2 (starke Base) eingeleitet welchen ph-wert hat
Titration von Phosphorsäure mit Natronlauge mit pks-wertbestimmung
 Prinzip Phosphorsäure wird mit Natronlauge titriert. Durch Ermittlung eines Äquivalenzpunktes lässt sich der Gehalt der Säure berechnen, durch Ermittlung der Halbäquivalenzpunkte die pks- Werte. Aufbau
Prinzip Phosphorsäure wird mit Natronlauge titriert. Durch Ermittlung eines Äquivalenzpunktes lässt sich der Gehalt der Säure berechnen, durch Ermittlung der Halbäquivalenzpunkte die pks- Werte. Aufbau
Physikalisches Anfaengerpraktikum. Dissoziationsgrad und Gefrierpunkterniedrigung
 Physikalisches Anfaengerpraktikum Dissoziationsgrad und Gefrierpunkterniedrigung Ausarbeitung von Marcel Engelhardt & David Weisgerber (Gruppe ) Montag, 1. Februar 00 1. Versuchsaufbau Um den Dissoziationsgrad
Physikalisches Anfaengerpraktikum Dissoziationsgrad und Gefrierpunkterniedrigung Ausarbeitung von Marcel Engelhardt & David Weisgerber (Gruppe ) Montag, 1. Februar 00 1. Versuchsaufbau Um den Dissoziationsgrad
Versuchsprotokoll Kapitel 6
 Versuchsprotokoll Kapitel 6 Felix, Sebastian, Tobias, Raphael, Joel 1. Semester 21 Inhaltsverzeichnis Einleitung...3 Versuch 6.1...3 Einwaagen und Herstellung der Verdünnungen...3 Photospektrometrisches
Versuchsprotokoll Kapitel 6 Felix, Sebastian, Tobias, Raphael, Joel 1. Semester 21 Inhaltsverzeichnis Einleitung...3 Versuch 6.1...3 Einwaagen und Herstellung der Verdünnungen...3 Photospektrometrisches
Kurstag 3. Pufferlösungen, Herstellung eines Essigsäure-Acetat-Puffers
 Kurstag 3 Pufferlösungen, Herstellung eines Essigsäure-Acetat-Puffers Stichworte zur Vorbereitung Pufferlösungen, Henderson-Hasselbalch, Pufferkapazität, Pufferoptimum, Herstellen eines Puffers, physiologische
Kurstag 3 Pufferlösungen, Herstellung eines Essigsäure-Acetat-Puffers Stichworte zur Vorbereitung Pufferlösungen, Henderson-Hasselbalch, Pufferkapazität, Pufferoptimum, Herstellen eines Puffers, physiologische
E1: Bestimmung der Dissoziationskonstante einer schwachen Säure durch Messung der elektrischen Leitfähigkeit der Elektrolytlösung
 Versuch E1/E2 1 Versuch E1/E2 E1: Bestimmung der Dissoziationskonstante einer schwachen Säure durch Messung der elektrischen Leitfähigkeit der Elektrolytlösung E2: Konduktometrische Titration I Aufgabenstellung
Versuch E1/E2 1 Versuch E1/E2 E1: Bestimmung der Dissoziationskonstante einer schwachen Säure durch Messung der elektrischen Leitfähigkeit der Elektrolytlösung E2: Konduktometrische Titration I Aufgabenstellung
2. Teilklausur zum Chemischen Grundpraktikum im WS 2016/17 vom
 2. Teilklausur zum Chemischen Grundpraktikum im WS 2016/17 vom 25.01.2017 A1 A2 A3 F4 R5 E6 Note 10 10 5 8 9 8 50 NAME/VORNAME:... Matrikelnummer:... Pseudonym für Ergebnisveröffentlichung Schreiben Sie
2. Teilklausur zum Chemischen Grundpraktikum im WS 2016/17 vom 25.01.2017 A1 A2 A3 F4 R5 E6 Note 10 10 5 8 9 8 50 NAME/VORNAME:... Matrikelnummer:... Pseudonym für Ergebnisveröffentlichung Schreiben Sie
Seminar: Photometrie
 Seminar: Photometrie G. Reibnegger und W. Windischhofer (Teil II zum Thema Hauptgruppenelemente) Ziel des Seminars: Theoretische Basis der Photometrie Lambert-Beer sches Gesetz Rechenbeispiele Literatur:
Seminar: Photometrie G. Reibnegger und W. Windischhofer (Teil II zum Thema Hauptgruppenelemente) Ziel des Seminars: Theoretische Basis der Photometrie Lambert-Beer sches Gesetz Rechenbeispiele Literatur:
European Union Science Olympiad Test 2 Dublin, 10. April Stunden Bearbeitungszeit
 European Union Science Olympiad Test 2 Dublin, 10. April 2003 4 Stunden Bearbeitungszeit Bitte unbedingt zuerst lesen! 1. Es ist nicht erlaubt, irgendwelche Hilfsmittel ins Labor zu bringen. 2. Sie erhalten
European Union Science Olympiad Test 2 Dublin, 10. April 2003 4 Stunden Bearbeitungszeit Bitte unbedingt zuerst lesen! 1. Es ist nicht erlaubt, irgendwelche Hilfsmittel ins Labor zu bringen. 2. Sie erhalten
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2017/18 vom
 Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2017/18 vom 22.09.2017 A1 A2 A3 A4 A5 Note 10 10 10 10 10 NAME:... VORNAME:... Pseudonym für Ergebnisveröffentlichung:... Schreiben Sie bitte gut leserlich:
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2017/18 vom 22.09.2017 A1 A2 A3 A4 A5 Note 10 10 10 10 10 NAME:... VORNAME:... Pseudonym für Ergebnisveröffentlichung:... Schreiben Sie bitte gut leserlich:
 Die Farbstofflösung in einer Küvette absorbiert 90% des einfallenden Lichtes. Welche Extinktion hat diese Lösung? 0 0,9 1,9 keine der Aussagen ist richtig Eine Küvette mit einer wässrigen Farbstofflösung
Die Farbstofflösung in einer Küvette absorbiert 90% des einfallenden Lichtes. Welche Extinktion hat diese Lösung? 0 0,9 1,9 keine der Aussagen ist richtig Eine Küvette mit einer wässrigen Farbstofflösung
Nachklausur zum Praktikum Allgemeine und Anorganische Chemie für Naturwissenschaftler Sommersemester 2007
 Nachklausur zum Praktikum Allgemeine und Anorganische Chemie für Naturwissenschaftler Sommersemester 2007 Name: Matr. Nr.: Studiengang (Bachelor/Diplom): Ergebnis: Punkte/Note: Aufg 1 2 3 4 5 6 7 8 9 10
Nachklausur zum Praktikum Allgemeine und Anorganische Chemie für Naturwissenschaftler Sommersemester 2007 Name: Matr. Nr.: Studiengang (Bachelor/Diplom): Ergebnis: Punkte/Note: Aufg 1 2 3 4 5 6 7 8 9 10
Maßanalytische Bestimmung von Formaldehyd und Acetaldehyd
 Illumina-Chemie.de - Artikel Analytik Maßanalytische Bestimmung von Formaldehyd und Acetaldehyd Im Folgenden beschreibe ich eine Methode, den Gehalt einer Formaldehyd- oder Acetaldehyd-Lösung durch Titration
Illumina-Chemie.de - Artikel Analytik Maßanalytische Bestimmung von Formaldehyd und Acetaldehyd Im Folgenden beschreibe ich eine Methode, den Gehalt einer Formaldehyd- oder Acetaldehyd-Lösung durch Titration
Anorganisch-chemisches Praktikum für Human- und Molekularbiologen
 Anorganisch-chemisches Praktikum für uman- und Molekularbiologen. Praktikumstag Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: [email protected] Säure-Base-Definition
Anorganisch-chemisches Praktikum für uman- und Molekularbiologen. Praktikumstag Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: [email protected] Säure-Base-Definition
H1 Bestimmung des Löslichkeitsprodukts von Magnesiumhydroxid
 H Löslichkeitsprodukt und Komplexgleichgewichte Auch bei den Komplex-Reaktionen beschäftigen wir uns im Wesentlichen mit Gleichgewichtsreaktionen, in denen Liganden ausgetauscht werden. Dabei sollen Kriterien
H Löslichkeitsprodukt und Komplexgleichgewichte Auch bei den Komplex-Reaktionen beschäftigen wir uns im Wesentlichen mit Gleichgewichtsreaktionen, in denen Liganden ausgetauscht werden. Dabei sollen Kriterien
Dissoziationsgrad und Gefrierpunkterniedrigung (DIS) Gruppe 8 Simone Lingitz, Sebastian Jakob
 Dissoziationsgrad und Gefrierpunkterniedrigung (DIS) Gruppe Simone Lingitz, Sebastian Jakob . Versuch. Versuchsaufbau Durch die Bestimmung der Gefrierpunktserniedrigung beim Lösen von KNO bzw. NaNO in
Dissoziationsgrad und Gefrierpunkterniedrigung (DIS) Gruppe Simone Lingitz, Sebastian Jakob . Versuch. Versuchsaufbau Durch die Bestimmung der Gefrierpunktserniedrigung beim Lösen von KNO bzw. NaNO in
1. Ziel des Versuchs. 2. Versuchsaufbau und Durchführung. Dennis Fischer Gruppe 9 Magdalena Boeddinghaus
 Versuch Nr. 7: Lambert-Beersches Gesetz 1. Ziel des Versuchs Ziel des Versuches ist es, die Abhängigkeiten der Absorption eines Stoffes von der Konzentration, der Schichtdicke und der Wellenlänge zu ermitteln.
Versuch Nr. 7: Lambert-Beersches Gesetz 1. Ziel des Versuchs Ziel des Versuches ist es, die Abhängigkeiten der Absorption eines Stoffes von der Konzentration, der Schichtdicke und der Wellenlänge zu ermitteln.
Chemisches Praktikum für Biologen
 Chemisches Praktikum für Biologen Klausur am 17.11.2015 Name: Vorname: Matrikelnummer: Aufgabe Maximale Punktzahl Erreichte Punktzahl 1 3 2 3 3 3 4 3 5 3 6 3 7 3 8 3 Gesamt 24 Bestanden: Die Klausur besteht
Chemisches Praktikum für Biologen Klausur am 17.11.2015 Name: Vorname: Matrikelnummer: Aufgabe Maximale Punktzahl Erreichte Punktzahl 1 3 2 3 3 3 4 3 5 3 6 3 7 3 8 3 Gesamt 24 Bestanden: Die Klausur besteht
Es soll eine schriftliche Ausarbeitung abgegeben werden (1 Exemplar pro Gruppe).
 Gruppe 1 Thema: Wissenswertes über Essig 1. Bestimme den ph-wert von Haushaltsessig. 2. Wie viel Essigsäure (in mol/l und in g/l) ist in Haushaltsessig enthalten? 3. Wie wird Essigsäure hergestellt (Ausgangsstoffe,
Gruppe 1 Thema: Wissenswertes über Essig 1. Bestimme den ph-wert von Haushaltsessig. 2. Wie viel Essigsäure (in mol/l und in g/l) ist in Haushaltsessig enthalten? 3. Wie wird Essigsäure hergestellt (Ausgangsstoffe,
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2013/14 vom
 Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2013/14 vom 20.09.2013 A1 A2 A3 A4 A5 A6 Σ Note 8 8 8 8 8 10 50 NAME/VORNAME:... Matrikelnummer: Pseudonym für Ergebnisveröffentlichung:... Schreiben
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2013/14 vom 20.09.2013 A1 A2 A3 A4 A5 A6 Σ Note 8 8 8 8 8 10 50 NAME/VORNAME:... Matrikelnummer: Pseudonym für Ergebnisveröffentlichung:... Schreiben
Aufgabe 1: Geben Sie die korrespondierenden Basen zu folgenden Verbindungen an: a) H 3 PO 4 b) H 2 PO 4
 Übungsaufgaben zum Thema Säuren, Basen und Puffer Säure/Base Definition nach Brǿnsted: Säuren sind Stoffe, die Protonen abgeben können (Protonendonatoren). Basen sind Stoffe, die Protonen aufnehmen können
Übungsaufgaben zum Thema Säuren, Basen und Puffer Säure/Base Definition nach Brǿnsted: Säuren sind Stoffe, die Protonen abgeben können (Protonendonatoren). Basen sind Stoffe, die Protonen aufnehmen können
Handbuch zum Chemischen Praktikum für Studierende der Human- und Zahnmedizin. Steffen Blaurock Thomas Zimmermann
 Handbuch zum Chemischen Praktikum für Studierende der Human- und Zahnmedizin Steffen Blaurock Thomas Zimmermann 1.1 Einleitung Titrationen werden in der chemischen Analytik durchgeführt, um die Stoffmenge
Handbuch zum Chemischen Praktikum für Studierende der Human- und Zahnmedizin Steffen Blaurock Thomas Zimmermann 1.1 Einleitung Titrationen werden in der chemischen Analytik durchgeführt, um die Stoffmenge
Chemisches Grundpraktikum für Ingenieure. 2. Praktikumstag. Andreas Rammo
 Chemisches Grundpraktikum für Ingenieure. Praktikumstag Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: [email protected] Das chemische Gleichgewicht Säure-Base-Reaktionen
Chemisches Grundpraktikum für Ingenieure. Praktikumstag Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: [email protected] Das chemische Gleichgewicht Säure-Base-Reaktionen
Simultane UV/VIS-Zweikomponentenanalyse
 Einleitung Polycyclische Aromaten treten als Begleiter des bei der Verbrennung entstehenden Rußes, z. B. beim Betrieb von Dieselfahrzeugen, auf. Da Substanzen aus dieser Stoffklasse stark cancerogen wirken,
Einleitung Polycyclische Aromaten treten als Begleiter des bei der Verbrennung entstehenden Rußes, z. B. beim Betrieb von Dieselfahrzeugen, auf. Da Substanzen aus dieser Stoffklasse stark cancerogen wirken,
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 2,
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr., 6.04.11 1. Sie legen 100 ml einer 0, mol/l Natronlauge vor. Als Titrant verwenden Sie eine 0,8 mol/l Salzsäure. Berechnen
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr., 6.04.11 1. Sie legen 100 ml einer 0, mol/l Natronlauge vor. Als Titrant verwenden Sie eine 0,8 mol/l Salzsäure. Berechnen
Säuren und Basen. Der ph-wert Zur Feststellung, ob eine Lösung sauer oder basisch ist genügt es, die Konzentration der H 3 O H 3 O + + OH -
 Der ph-wert Zur Feststellung, ob eine Lösung sauer oder basisch ist genügt es, die Konzentration der H 3 O + (aq)-ionen anzugeben. Aus der Gleichung: H 2 O + H 2 O H 3 O + + OH - c(h 3 O + ) c(oh - ) K
Der ph-wert Zur Feststellung, ob eine Lösung sauer oder basisch ist genügt es, die Konzentration der H 3 O + (aq)-ionen anzugeben. Aus der Gleichung: H 2 O + H 2 O H 3 O + + OH - c(h 3 O + ) c(oh - ) K
Titrationskurve einer starken Säure (HCl) mit einer starken Base (NaOH)
 Titrationskurve einer starken Säure (HCl) mit einer starken Base (NaOH) Material 250 mlbecherglas 100 ml Messzylinder 50 mlbürette, Magnetrührer, Magnetfisch, Stativmaterial phmeter Chemikalien Natronlauge
Titrationskurve einer starken Säure (HCl) mit einer starken Base (NaOH) Material 250 mlbecherglas 100 ml Messzylinder 50 mlbürette, Magnetrührer, Magnetfisch, Stativmaterial phmeter Chemikalien Natronlauge
Essigsäure färbt ph-papier rot. Natronlauge färbt ph-papier blau
 5. SÄUREN UND BASEN ARBEITSBLATT 5.1 WAS SIND INDIKATOREN? DER PH-WERT SÄUREN und BASEN sind Stoffe die sich gegenseitig in ihrer Wirkung aufheben. INDIKATOREN sind Farbstoffe, die über Farbänderungen
5. SÄUREN UND BASEN ARBEITSBLATT 5.1 WAS SIND INDIKATOREN? DER PH-WERT SÄUREN und BASEN sind Stoffe die sich gegenseitig in ihrer Wirkung aufheben. INDIKATOREN sind Farbstoffe, die über Farbänderungen
Arbeitskreis Bestimmung des Gehalts und der pks-werte F 06 Kappenberg der Phosphorsäure Seite 1 / 6. Prinzip:
 Kappenberg der Phosphorsäure Seite 1 / 6 Prinzip: Phosphorsäure wird mit Natronlauge titriert. Durch Ermittlung eines Äquivalenzpunktes lässt sich der Gehalt der Säure berechnen, durch Ermittlung der Halbäquivalenzpunkte
Kappenberg der Phosphorsäure Seite 1 / 6 Prinzip: Phosphorsäure wird mit Natronlauge titriert. Durch Ermittlung eines Äquivalenzpunktes lässt sich der Gehalt der Säure berechnen, durch Ermittlung der Halbäquivalenzpunkte
Qualitative und quantitative Analysen
 Qualitative und quantitative Analysen Dichtebestimmung: [1] 15.02.2003 Elisabeth Haas, Patrick Dijkstra Durchführung: Pyknometer beschriften (1a, 1b, 1c, 5a, 5b, 5c) Einzelne Pyknometer wiegen -Sorten
Qualitative und quantitative Analysen Dichtebestimmung: [1] 15.02.2003 Elisabeth Haas, Patrick Dijkstra Durchführung: Pyknometer beschriften (1a, 1b, 1c, 5a, 5b, 5c) Einzelne Pyknometer wiegen -Sorten
Laborbericht Säure-/ Basen Reaktionen
 Laborbericht Säure-/ Basen Reaktionen Sonia Töller Anna Senn 06.01.2005 24.02.2005 Inhaltsverzeichnis 1. Allgemeine Definitionen und Begriffe... 1 1. Der ph-wert... 1 2. Definition Säuren und Basen:...
Laborbericht Säure-/ Basen Reaktionen Sonia Töller Anna Senn 06.01.2005 24.02.2005 Inhaltsverzeichnis 1. Allgemeine Definitionen und Begriffe... 1 1. Der ph-wert... 1 2. Definition Säuren und Basen:...
Stöchiometrie-Seminar Wintersemester 2017 Leonie Gellrich
 Stöchiometrie-Seminar Wintersemester 2017 Themen/Inhalte der Zwischenklausur Seminar I und III 1. Allgemeine Definitionen - Präfixe - Stoffmenge - Stoffmengenkonzentration - Massenkonzentration - Dichte
Stöchiometrie-Seminar Wintersemester 2017 Themen/Inhalte der Zwischenklausur Seminar I und III 1. Allgemeine Definitionen - Präfixe - Stoffmenge - Stoffmengenkonzentration - Massenkonzentration - Dichte
AnC I Protokoll: 2.2 Potenziometrische Titration von Essigsäure mit NaOH-Lösung! SS Analytische Chemie I. Versuchsprotokoll
 Analytische Chemie I Versuchsprotokoll 2.2 Potenziometrische Titration von Essigsäure mit NaOH-Lösung 1.! Theoretischer Hintergrund Die Potenziometrische Bestimmung wird mit einem ph-meter durchgeführt.
Analytische Chemie I Versuchsprotokoll 2.2 Potenziometrische Titration von Essigsäure mit NaOH-Lösung 1.! Theoretischer Hintergrund Die Potenziometrische Bestimmung wird mit einem ph-meter durchgeführt.
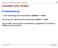
ph-wert Berechnung für starke Säuren / Basen starke Säure, vollständige Dissoziation [H 3 O + ] = 10 1 mol/l; ph = 1
![ph-wert Berechnung für starke Säuren / Basen starke Säure, vollständige Dissoziation [H 3 O + ] = 10 1 mol/l; ph = 1 ph-wert Berechnung für starke Säuren / Basen starke Säure, vollständige Dissoziation [H 3 O + ] = 10 1 mol/l; ph = 1](/thumbs/33/16365353.jpg) ph-wert Berechnung für starke Säuren / Basen 0.1 mol/l HCl: HCl + H 2 O H 3 O + + Cl starke Säure, vollständige Dissoziation [H 3 O + ] = 10 1 mol/l; ph = 1 0.1 mol/l NaOH: NaOH + H 2 O Na + aq + OH starke
ph-wert Berechnung für starke Säuren / Basen 0.1 mol/l HCl: HCl + H 2 O H 3 O + + Cl starke Säure, vollständige Dissoziation [H 3 O + ] = 10 1 mol/l; ph = 1 0.1 mol/l NaOH: NaOH + H 2 O Na + aq + OH starke
Klausur in Anorganischer Chemie
 1 Klausur in Anorganischer Chemie zum Praktikum Chemie für Biologen, SS2000 Kurse SS Sa 20.05.2000 Name:... Vorname:... Wenn Nachschreiber aus einem der Vorkurse, bitte eintragen: Geb. am in Semester des
1 Klausur in Anorganischer Chemie zum Praktikum Chemie für Biologen, SS2000 Kurse SS Sa 20.05.2000 Name:... Vorname:... Wenn Nachschreiber aus einem der Vorkurse, bitte eintragen: Geb. am in Semester des
Biochemische UE Alkaline Phosphatase.
 Biochemische UE Alkaline Phosphatase [email protected] Alkaline Phosphatase: Katalysiert die Hydrolyse von Phosphorsäure-Estern: O - O - Ser-102 R O P==O O - H 2 O R OH + HO P==O O - ph-optimum im
Biochemische UE Alkaline Phosphatase [email protected] Alkaline Phosphatase: Katalysiert die Hydrolyse von Phosphorsäure-Estern: O - O - Ser-102 R O P==O O - H 2 O R OH + HO P==O O - ph-optimum im
7. Chemische Reaktionen
 7. Chemische Reaktionen 7.1 Thermodynamik chemischer Reaktionen 7.2 Säure Base Gleichgewichte Grundlagen Lösung: homogene Phase aus Lösungsmittel und gelösten Stoff Lösungsmittel liegt im Überschuss vor
7. Chemische Reaktionen 7.1 Thermodynamik chemischer Reaktionen 7.2 Säure Base Gleichgewichte Grundlagen Lösung: homogene Phase aus Lösungsmittel und gelösten Stoff Lösungsmittel liegt im Überschuss vor
E3: Potentiometrische Titration
 Theoretische Grundlagen Als potentiometrische Titration bezeichnet man ein Analyseverfahren, bei dem durch Messung der Gleichgewichtsspannung einer galvanischen Kette auf die Menge des zu titrierenden
Theoretische Grundlagen Als potentiometrische Titration bezeichnet man ein Analyseverfahren, bei dem durch Messung der Gleichgewichtsspannung einer galvanischen Kette auf die Menge des zu titrierenden
LF - Leitfähigkeit / Überführung
 Verfasser: Matthias Ernst, Tobias Schabel Gruppe: A 11 Betreuer: G. Heusel Datum: 18.11.2005 Aufgabenstellung LF - Leitfähigkeit / Überführung 1) Es sind die Leitfähigkeiten von zwei unbekanten Elektrolyten
Verfasser: Matthias Ernst, Tobias Schabel Gruppe: A 11 Betreuer: G. Heusel Datum: 18.11.2005 Aufgabenstellung LF - Leitfähigkeit / Überführung 1) Es sind die Leitfähigkeiten von zwei unbekanten Elektrolyten
ph-messung mit Glaselektrode: Bestimmung der Dissoziationskonstanten schwacher Säuren durch Titrationskurven
 Übungen in physikalischer Chemie für Studierende der Pharmazie Versuch Nr.: 11 Version 2016 Kurzbezeichnung: ph-messung ph-messung mit Glaselektrode: Bestimmung der Dissoziationskonstanten schwacher Säuren
Übungen in physikalischer Chemie für Studierende der Pharmazie Versuch Nr.: 11 Version 2016 Kurzbezeichnung: ph-messung ph-messung mit Glaselektrode: Bestimmung der Dissoziationskonstanten schwacher Säuren
Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2004/
 Nachklausur zum Anorganisch-Chemischen Grundpraktikum, 28.04.05 Seite 1 von 10 Punkte: von 90 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2004/2005 28.04.2005 Matrikelnummer: Name:
Nachklausur zum Anorganisch-Chemischen Grundpraktikum, 28.04.05 Seite 1 von 10 Punkte: von 90 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2004/2005 28.04.2005 Matrikelnummer: Name:
Versuch 412: Photometrische Bestimmung von Phosphatspuren als "Phosphormolybdänblau"
 Instrumentelle Bestimmungsverfahren 131 Versuch 412: Photometrische Bestimmung von Phosphatspuren als "Phosphormolybdänblau" Phosphationen reagieren mit Molybdat MoO 4 in saurer Lösung zur 2 gelben Dodekamolybdatophosphorsäure
Instrumentelle Bestimmungsverfahren 131 Versuch 412: Photometrische Bestimmung von Phosphatspuren als "Phosphormolybdänblau" Phosphationen reagieren mit Molybdat MoO 4 in saurer Lösung zur 2 gelben Dodekamolybdatophosphorsäure
Michaelis-Menten-Gleichung
 Physikalisch-Chemische Praktika Michaelis-Menten-Gleichung Versuch K4 1 Aufgabe Experimentelle Bestimmung der Kinetik der Zersetzung von Harnsto durch Urease. 2 Grundlagen Im Bereich der Biochemie spielen
Physikalisch-Chemische Praktika Michaelis-Menten-Gleichung Versuch K4 1 Aufgabe Experimentelle Bestimmung der Kinetik der Zersetzung von Harnsto durch Urease. 2 Grundlagen Im Bereich der Biochemie spielen
Titration. Weiterbildung für fachfremd unterrichtende Lehrkräfte
 Titration Weiterbildung für fachfremd unterrichtende Lehrkräfte Chromatografi e von Blattfarbstoffen Destillation von Rotwein Zerlegung der Verbindung Wasser Herstellung von Natronlauge Öltröpfchen versuch
Titration Weiterbildung für fachfremd unterrichtende Lehrkräfte Chromatografi e von Blattfarbstoffen Destillation von Rotwein Zerlegung der Verbindung Wasser Herstellung von Natronlauge Öltröpfchen versuch
Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1. Spezifische Drehung von gelöstem Rohrzucker - Rohrzuckerinversion
 Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 33 Spezifische Drehung von gelöstem Rohrzucker - Rohrzuckerinversion Aufgabe: 1. Bestimmen Sie den Drehwinkel für Rohrzucker für
Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 33 Spezifische Drehung von gelöstem Rohrzucker - Rohrzuckerinversion Aufgabe: 1. Bestimmen Sie den Drehwinkel für Rohrzucker für
K1: Lambert-Beer`sches Gesetz
 K1: Lambert-Beer`sches Gesetz Einleitung In diesem Versuch soll die Entfärbung von Kristallviolett durch atronlauge mittels der Absorptionsspektroskopie untersucht werden. Sowohl die Reaktionskinetik als
K1: Lambert-Beer`sches Gesetz Einleitung In diesem Versuch soll die Entfärbung von Kristallviolett durch atronlauge mittels der Absorptionsspektroskopie untersucht werden. Sowohl die Reaktionskinetik als
Mehrprotonige Säuren; als Beispiel Cola
 Mehrprotonige Säuren; als Beispiel Cola Arbeitsauftrag: Führe den nachstehenden Versuch Titration von Cola gemäß der Durchführung durch und notiere deine Messwerte: Materialien: 2 Bechergläser (230 ml),
Mehrprotonige Säuren; als Beispiel Cola Arbeitsauftrag: Führe den nachstehenden Versuch Titration von Cola gemäß der Durchführung durch und notiere deine Messwerte: Materialien: 2 Bechergläser (230 ml),
Die spezifische Leitfähigkeit κ ist umgekehrt proportional zum Widerstand R:
 Institut für Physikalische Chemie Lösungen zu den Übungen zur Vorlesung Physikalische Chemie II im WS 206/207 Prof. Dr. Eckhard Bartsch / M. Werner M.Sc. Aufgabenblatt 3 vom..6 Aufgabe 3 (L) Leitfähigkeiten
Institut für Physikalische Chemie Lösungen zu den Übungen zur Vorlesung Physikalische Chemie II im WS 206/207 Prof. Dr. Eckhard Bartsch / M. Werner M.Sc. Aufgabenblatt 3 vom..6 Aufgabe 3 (L) Leitfähigkeiten
Analytische Chemie. B. Sc. Chemieingenieurwesen. 13. Juli 2017, Uhr. Prof. Dr. T. Jüstel, Dr. Stephanie Möller.
 Analytische Chemie B. Sc. Chemieingenieurwesen 13. Juli 2017, 8.30 11.30 Uhr Prof. Dr. T. Jüstel, Dr. Stephanie Möller Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
Analytische Chemie B. Sc. Chemieingenieurwesen 13. Juli 2017, 8.30 11.30 Uhr Prof. Dr. T. Jüstel, Dr. Stephanie Möller Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges
2. Teilklausur zum Chemischen Grundpraktikum im WS 2013/14 vom
 2. Teilklausur zum Chemischen Grundpraktikum im WS 2013/14 vom 29.01.2014 A1 A2 A3 F4 R5 E6 Σ Note 8 7 10 8 9 8 50 NAME/VORNAME:... Matrikelnummer:... Pseudonym für Ergebnisveröffentlichung Schreiben Sie
2. Teilklausur zum Chemischen Grundpraktikum im WS 2013/14 vom 29.01.2014 A1 A2 A3 F4 R5 E6 Σ Note 8 7 10 8 9 8 50 NAME/VORNAME:... Matrikelnummer:... Pseudonym für Ergebnisveröffentlichung Schreiben Sie
Praktikum Chemie für Mediziner und Zahnmediziner 37
 Praktikum Chemie für Mediziner und Zahnmediziner 37 3. Studieneinheit Lernziele Komplexbildungsreaktionen Beeinflussung der Komplexgleichgewichte durch verschiedene Parameter Farbigkeit von Komplexen,
Praktikum Chemie für Mediziner und Zahnmediziner 37 3. Studieneinheit Lernziele Komplexbildungsreaktionen Beeinflussung der Komplexgleichgewichte durch verschiedene Parameter Farbigkeit von Komplexen,
Beispiele: Monocarbonsäuren, Di- und Tricarbonsäuren, gesättigte und ungesättigte Säuren, Hydroxycarbonsäuren
 Carbonsäuren (=> 6-8 Std.) Beispiele: Monocarbonsäuren, Di- und Tricarbonsäuren, gesättigte und ungesättigte Säuren, Hydroxycarbonsäuren Quellen: CD-Römpp http://www.chemieunterricht.de/dc2/facharbeit/alkansau.html
Carbonsäuren (=> 6-8 Std.) Beispiele: Monocarbonsäuren, Di- und Tricarbonsäuren, gesättigte und ungesättigte Säuren, Hydroxycarbonsäuren Quellen: CD-Römpp http://www.chemieunterricht.de/dc2/facharbeit/alkansau.html
K2: Acetonjodierung. Theoretische Grundlagen. Absorptionsspektroskopie. Physikalische Chemie für Pharmazeuten
 In diesem Versuch wird die Konzentrationsänderung von Iod während einer Reaktion erster Ordnung (Acetonjodierung) mittels quantitativer Absorptionsspektroskopie untersucht. Die Geschwindigkeitskonstanten
In diesem Versuch wird die Konzentrationsänderung von Iod während einer Reaktion erster Ordnung (Acetonjodierung) mittels quantitativer Absorptionsspektroskopie untersucht. Die Geschwindigkeitskonstanten
2. Bestimmen Sie die Geschwindigkeitskonstante k der Rohrzuckerinversion in s -1.
 Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 33 Spezifische Drehung von gelöstem Rohrzucker - Rohrzuckerinversion Aufgabe: 1. Bestimmen Sie den Drehwinkel α für Rohrzucker für
Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 33 Spezifische Drehung von gelöstem Rohrzucker - Rohrzuckerinversion Aufgabe: 1. Bestimmen Sie den Drehwinkel α für Rohrzucker für
3. Säure-Base-Beziehungen
 3.1 Das Ionenprodukt des Wassers In reinen Wasser sind nicht nur Wassermoleküle vorhanden. Ein kleiner Teil liegt als Ionenform H 3 O + und OH - vor. Bei 25 C sind in einem Liter Wasser 10-7 mol H 3 O
3.1 Das Ionenprodukt des Wassers In reinen Wasser sind nicht nur Wassermoleküle vorhanden. Ein kleiner Teil liegt als Ionenform H 3 O + und OH - vor. Bei 25 C sind in einem Liter Wasser 10-7 mol H 3 O
Die spezifische Leitfähigkeit κ ist umgekehrt proportional zum Widerstand R:
 Institut für Physikalische Chemie Lösungen zu den Übungen zur Vorlesung Physikalische Chemie II im WS 205/206 Prof. Dr. Eckhard Bartsch / M. Werner M.Sc. Aufgabenblatt 3 vom 3..5 Aufgabe 3 (L) Leitfähigkeiten
Institut für Physikalische Chemie Lösungen zu den Übungen zur Vorlesung Physikalische Chemie II im WS 205/206 Prof. Dr. Eckhard Bartsch / M. Werner M.Sc. Aufgabenblatt 3 vom 3..5 Aufgabe 3 (L) Leitfähigkeiten
STÖCHIOMETRIE. die Lehre von der mengenmäßigen Zusammensetzung chemischer Verbindungen und den Mengenverhältnissen bei chemischen Reaktionen
 1 STÖCHIOMETRIE die Lehre von der mengenmäßigen Zusammensetzung chemischer Verbindungen und den Mengenverhältnissen bei chemischen Reaktionen 1) STOFFMENGE n(x) reine Zählgröße Menge der Elementarteilchen
1 STÖCHIOMETRIE die Lehre von der mengenmäßigen Zusammensetzung chemischer Verbindungen und den Mengenverhältnissen bei chemischen Reaktionen 1) STOFFMENGE n(x) reine Zählgröße Menge der Elementarteilchen
