Lösung zu Aufgabe
|
|
|
- Rüdiger Förstner
- vor 7 Jahren
- Abrufe
Transkript
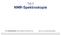
1 Lösung zu Aufgabe 1 1. Chemische Verschiebung der Methylgruppe In deren Nachbarstellung findet sich eine Methylengruppe, der übernächste Nachbar wäre das Säurechlorid. Für die Methylengruppe gibt es im Inkrementenschema überhaupt kein Inkrement, für das Säurechlorid müßte der Rest -CR herhalten. Die Rechnung ergibt 0.9 (Grundwert für C 3 -Gruppe) = Multiplizität der Methylgruppe Am benachbarten Kohlenstoffatom befinden sich zwei äquivalente Protonen. Dadurch spaltet das Signal der Methylgruppe (n+1) zum Triplett auf. Entsprechend dem Pascalschen Dreieck erwartet man die drei Linien im Verhältnis 1:2:1. 3. Chemische Verschiebung der Methylengruppe Direkt benachbart sind sowohl Methyl- als auch die Säurechloridgruppierung. Für die Methylgruppe gibt es wieder kein Inkrement. Für die Säuregruppe hält wieder das Inkrement für -CR her. ier ergibt die Rechnung 1.2 (Grundwert für C 2 -Gruppe) = Multiplizität der Methylengruppe Am benachbarten Kohlenstoff der Methylengruppe befinden sich die drei äquivalenten Protonen der Methylgruppe. Daraus resultiert für die Methylenprotonen eine Aufspaltung zum Quartett (3+1). Für die Einzellinie ergibt das Pascalsche Dreieck hier eine Verteilung von 1:3:3:1. Zum Vergleich: das experimentelle Spektrum. ppm Einführung (Lösung) 1
2 Lösung zu Aufgabe 2 Es werden drei Protonenmultiplett beobachtet: 4.5 ppm, 2, Quartett (q), 2.0 ppm, 3, Singulett (s) und 1.2 ppm, 3, Triplett (t). Die Protonen bei 4.5 und 1.2 ppm sind an benachbarten Kohlenstoffatomen gebunden, nur bei diesen Multipletts wird eine (jeweils gleich große) Kopplung beobachtet. Das zugehörige Strukturfragment wäre eine Ethylgruppe. Den Methylprotonen (1.2 ppm, 3) sind die beiden Protonen der Methylengruppe benachbart. Als Aufspaltungsbild resultiert ein Triplett (n+1) im Verhältnis von 1:2:1 für die Einzellinien. Umgekehrt sind den Methylenprotonen (4.05 ppm, 2) die drei Methylprotonen benachbart, hieraus resultiert eine Signalaufspaltung zum Quartett (3+1). Drei identische Protonen (Singulett, 3, 2.0 ppm) können nur eine Methylgruppe ohne weitere Protonen an Nachbarkohlenstoffatomen sein. Aus der Summenformel abzüglich Methyl- und Ethylgruppe verbleibt ein Rest von C 2. Dieser läßt sich nur als Estergruppierung zwischen Methyl- und Ethylgruppe anordnen. Das ergäbe jetzt zwei mögliche Strukturen: Essigsäureethylester und Propionsäuremethylester. Die Abschätzung der chemischen Verschiebung für die C 2 -Protonen in den beiden Verbindungen mit ilfe der Schoolery-Regeln hilft weiter. Man erhält für Essigsäureethylester: = 3.83 Propionsäuremethylester : = Eindeutige Lösung: Essigsäureethylester. 2 Einführung (Lösung)
3 Lösung zu Aufgabe 3 Aus der Summenformel resultiert kein Doppelbindungsäquivalent. Damit liegt als Struktur ein Propylamin vor. Die beiden denkbaren Strukturen wären N 2 und N 2 Die Analyse im Detail. In dem Spektrum lassen sich vier Multipletts separieren. Die Tabelle faßt die Eigenschaften der Multipletts zusammen. Multiplett δ [ppm] Integralstufenhöhe Multiplizität cm Triplett (t) cm Sextett cm Singulett (s) cm Triplett (t) Unter vorübergehender Vernachlässigung des ominösen Singuletts kann es sich bei der Verbindung nur um n-propylamin handeln. Im iso-propylamin würde man nur drei Gruppen chemisch unterschiedlicher Protonen beobachten. Das Gesamtintegral mißt 6.1 cm, bei 9 Protonen (Summenformel) entspricht dies etwa 0.65 cm/proton. Entsprechend kann man die Tabelle um die Anzahl der Protonen ergänzen. 1 Das Triplett könnte besser aussehen. Für das Intensitätsverhältnis (genauer: Integralverhältnis) der Einzellinien erwartet man einen Wert von 1:2:1. Die beobachtete Abweichung kann nicht sicher erklärt werden. 2 Sextett? Woher sollen eigentlich 5 äquivalente Nachbarprotonen kommen? 3 Wieso Singulett? Für jedes der Protonen der Verbindung gibt es im Abstand von drei Bindungen mindestens einen Kopplungspartner, d.h. ein weiteres Proton. Einführung (Lösung) 3
4 Multiplett δ [ppm] Integralstufenhöhe Protonenanzahl Multiplizität cm 2 Triplett (t) cm 2 Sextett cm 2 Singulett (s) cm 3 Triplett (t) Multiplett 4 gehört schon vom Integral her zur Methylgruppe. Die Aufspaltung zum Triplett erklärt sich durch die beiden Protonen der benachbarten Methylengruppe. Diese Methylengruppe sieht zum einen die drei Protonen der Methylgruppe als auch zum anderen die zwei Protonen der zweiten Methylengruppe als Nachbarn. Als Multiplett erwartet man ein Triplett von Quartetts, d.h. insgesamt 12 Linien. Tatsächlich sind wegen der freien Rotation um die Einfachbindungen die Kopplungskonstanten in beide Richtungen etwa gleich groß. Die insgesamt 5 Nachbarprotonen werden als näherungsweise identisch gesehen, als Kopplungsbild beobachtet man ein Pseudosextett. Die Methylengruppe in Nachbarstellung zur Aminogruppe wird schließlich durch das Multiplett 1 repräsentiert. Eine Multiplizität von 3 (Triplett) erscheint angesichts von insgesamt 4 benachbarten Protonen unerwartet. Tatsächlich kann sowohl zu N- als auch zu -Protonen meist keine Kopplung beobachtet werden. Entsprechend beobachtet man die Methylengruppe als Triplett und das verbleibende Singulett 3 für die N 2 -Gruppe als Singulett. Unter welchen Bedingungen eine Kopplung zu N- bzw. -Protonen beobachtet werden kann und unter welchen nicht, soll an dieser Stelle noch nicht erörtert werden. 4 Einführung (Lösung)
5 Lösung zu Aufgabe 4 Das Spektrum zeigt von tiefen nach hohem Feld drei Signalgruppen im Integralverhältnis 2:2:3. Das Triplett bei etwa 1 ppm sollte wegen seines Integrals von 3 einer Methylgruppe entspringen. Die Triplettstruktur weist auf zwei äquivalente Nachbarprotonen (vermutlich eine C 2 -Gruppe) hin. Ein weiteres Triplett - diesmal mit einem Integral von 2 - wird bei ca. 4.4 ppm beobachtet. Es sollte sich jetzt um eine C 2 -Gruppe handeln. Wegen der Triplettstruktur sind auch dieser Methylengruppe zwei äquivalente Protonen (vermutlich wieder eine C 2 -Gruppe) benachbart. Kopplungspartner sowohl für die Methylgruppe als auch die Methylengruppe bei 4.4 ppm kann jetzt eigentlich nur eine Methylengruppe mit dem Protonensignal bei ca. 2.1 ppm sein. Dieses Multiplett zeigt eine Multiplizität von 6 entsprechend 5 Nachbarprotonen. Genauer betrachtet handelt es sich hierbei um ein Pseudosextett, das dadurch entsteht, daß die Kopplungskonstante zwischen den Methylenprotonen bei 2.1 ppm und den Methylprotonen etwa genauso groß ist, wie die Kopplungskonstante zwischen den beiden verschiedenen Methylenprotonen. Die exakte Struktur des Multipletts wäre ein Quartett von Tripletts. Nach der bis jetzt gefundenen Propylgruppe verbleibt nur noch ein Rest von N 2 nicht zugeordnet. Das wird vermutlich eine Nitrogruppe sein, resultierende Struktur wäre dann Nitropropan. 2 N (4.4) 2 C C C 3 (1.0) 2 (2.1) Auch Propylnitrit wäre als Lösung denkbar. Zur Entscheidung kann man die chemische Verschiebung der Methylenprotonen in Nachbarschaft zur funktionellen Gruppe abschätzen. ierfür eignet sich ein Inkrementenschema für methylenische Protonen unter der Voraussetzung, daß sowohl für die Nitro- als auch die Nitritgruppe Werte verfügbar sind. 2 C =N === 4.80 C 2 C 3 2 C 2 N === 4.40 C 2 C 3 Die Rechnung spricht für das Nitropropan. Trotzdem ein wenig Vorsicht: Eine per Inkrementenschema ermittelte Differenz von 0.4 ppm stellt keine 100%ige Sicherheit dar. Einführung (Lösung) 5
6 Lösung zu Aufgabe 5 Als erster Schritt wäre zu klären, welche Produkte im Gemisch überhaupt vorkommen können. Bei der Photochlorierung wird nur an der Seitenkette radikalisch substituiert. Als Ausgangs- und Reaktionsprodukte kommen damit die Verbindungen C 3 C 2 Cl CCl 2 CCl 3 Toluol Benzylchlorid Benzalchlorid Benzotrichlorid in Frage. Die Signale der aromatischen Protonen aller vier Verbindungen werden im Bereich zwischen 7.2 und 7.5 ppm erwartet. Eine getrennte Zuordnung der dort beobachteten Signale zu den potentiellen 4 Verbindungen ist im gegebenen Spektrum auf alle Fälle ausgeschlossen und dürfte selbst bei deutlich höherer Meßfrequenz kaum gelingen. Eine quantitative Bestimmung von Benzotrichlorid und selbst von Benzalchlorid - wie sich gleich zeigen wird - gestaltet sich damit auf alle Fälle schwierig. Eine chemische Überlegung hilft weiter. Die Reaktivität bei der Photochlorierung nimmt von Stufe zu Stufe grob geschätzt jeweils eine Größenordnung ab. Anders gesagt: wenn das erste Benzotrichlorid in beobachtbaren Mengen gebildet wird, liegt nahezu kein Toluol als Ausgangsprodukt mehr vor. Zumindest die nicht vollständig chlorierten Verbindungen sollte man mit ilfe der Seitenkettensignale im Protonenspektrum identifizieren können. Man erhält δ(c 3 )[ppm] = = 2.30 (Toluol) δ(c 2 )[ppm] = = 4.80 (Benzylchlorid) δ(c)[ppm] = = 7.35 (Benzalchlorid) Benzalchlorid wäre damit auf alle Fälle auch schwer zu identifizieren, da dessen Methinsignal der Seitenkette im Bereich der aromatischen Protonen erscheint. Die Annahme, daß die Photochlorierung gerade erste begonnen hat und damit im wesentlichen nur ein Gemisch aus Toluol und Benzylchlorid vorliegt, ist zumindest eine Überprüfung wert. Für die Integrale der Singuletts bei 2.4 (Toluol) und 4.6 ppm (Benzylchlorid) gilt: I 2.4 = c 3 x Toluol und I 4.6 = c 2 x Benzylchlorid, wobei c die geräteabhängige und stets unbekannte Proportionalitätskonstante der Integration und x die Molenbrüche der beiden Komponenten bezeichnen. Im Zweikomponentengemisch gilt 6 Einführung (Lösung)
7 x Toluol = 1 - x Benzylchlorid und damit c 3 x Toluol c 2 (1 x Toluol 2.0cm = ) 2.1cm, woraus die Lösungen und x Toluol = x Benzylchlorid = folgen. Der Proportionalitätskoeffizient c ergibt sich damit für diese Messung in Verbindung mit dem gewählten Abbildungsmaßstab zu c = 1.72 cm. Für die aromatischen Protonen erwartet man unter der Annahme des binären Gemisches jetzt I = c 5 x Toluol + c 5 x Benzylchlorid = c 5 = 8.6 cm in sehr guter Übereinstimmung mit den gemessenen 8.55 cm. Damit können sich im Bereich der aromatischen Protonen bestenfalls eine oder mehrere weitere Komponenten mit einem sehr geringen Anteil am Gemisch verbergen. Andernfalls würde das beobachtete Integral größer als der erwartete Wert ausfallen. Das Gemisch besteht damit aus den Komponenten Toluol und Benzylchlorid in der oben genannten Zusammensetzung. Einführung (Lösung) 7
8 Lösung zu Aufgabe 6 Es liegen drei Signalgruppen im Integralverhältnis 1 (4.5 ppm) : 6 (3.3 ppm) : 3 (1.2 ppm) vor. Das tieffeldigste und das höchstfeldige Multiplett gehören zu benachbarten Protonen. Aus Integral und Multiplizität resultiert hierfür ein Strukturfragment C 3 - C <. Prinzipiell käme freilich auch Methanol für das gleiche Aufspaltungsbild in Frage, nur wäre das Molekül dann schon fertig gebaut und die restlichen Atome der Summenformel könnten nicht mehr aufgebraucht werden. Nach Abzug diesen Fragments verbleibt ein Rest von C Das Singulett mit dem Integral von 6 gehört dann wohl zu zwei identischen Methylgruppen. Insgesamt hätten wir jetzt die Fragmente C3 - C <, 2 x C3 - und 2 x - -. Die insgesamt 6 freien Valenzen dieser Fragmente lassen nur eine einzige Kombination zu, wenn die beiden Methylgruppen identisch sein sollen: C 3 3 C C C 3 Das ist das Acetaldehyddimethylacetal. 8 Einführung (Lösung)
9 Lösung zu Aufgabe 7 Zunächst einmal ergibt sich aus der Summenformel ein Doppelbindungsäquivalent. Im Protonenspektrum lassen sich vier Signalgruppen unterscheiden (Tabelle). Multiplett δ [ppm] Integral Multiplizität a Quartett b Septett c Triplett d Dublett Das Septett mit einem Integralverhältnis von 1:5:15:20:15:6:1 für die Einzellinien kann natürlich leicht übersehen werden - daher auch die Vergrößerung des Multipletts. Speziell bei stärkerem Rauschen verschwinden leicht die beiden äußeren Linien und es wird nur ein Quintet beobachtet. Aus der Septettstruktur resultieren natürlich unmittelbar sechs äquivalente Nachbarprotonen. Zu finden bei Multiplett d. Desssen Aufspaltung zum Dublett korrespondiert sehr gut mit dem Integral 1 von Multiplett b. Sechs identische Protonen? C 6? Zwei identische C 3 -Gruppen tun es auch. Das zum Multiplett b gehörige Proton kann nur an einem Kohlenstoffatom gebunden sein, mit dem alternativen Kopplungspartner hätten wir an dieser Stelle Isopropanol und damit bereits ein fertiges Molekül. Die Multipletts b und d gehören damit zu einer Isopropylgruppe. Aus den Mutipletts a und c resultiert dann aus ähnlicher Überlegung eine Ethylgruppe. Jetzt wären noch ein Rest von C 2 zusammen mit einem Doppelbindungsäquivalent zu vergeben. Mit den bereits gefundenen Fragmenten -C(C 3 ) 2 und -C 2 -C 3 wären die Strukturen 3 C C 2 2 C 3 C C 3 C C C 3 C 3 C 3 möglich. Die einfache Inkrementrechnung ergibt Einführung (Lösung) 9
10 C 3 C C C C C 2 C C C 3 C und angesichts der gefundenen Methingruppe bei 2.5 ppm und der Methylengruppe bei 4.1 ppm lautet die Entscheidung eindeutig Isobuttersäureethylester. 10 Einführung (Lösung)
11 Lösung zu Aufgabe 8 Zur Konstitution: Ein disubstituierter Benzolring weist die Summenformel C 6 4 auf. Damit verbleibt ein Rest von N 2 2 2, den man am besten einer Amino- und einer Nitrogruppe zuordnet. Eine weitere denkbare - wenn auch recht exotische - Lösung, soll an dieser Stelle vorerst ausgeklammert bleiben. Das Lösungsmittel: Sowohl im unteren als im mittleren Spektrum fällt ein Singulett zwischen 7.2 und 7.3 ppm mit absonderlichem Integral auf. Es handelt sich um das Restprotonensignal des als Lösungsmittel eingesetzten CDCl 3. Im oberen Spektrum ist das Restprotonensignal nicht leicht zu finden. Die notwendige Symmetrie der Multipletts hilft hier weiter. Im vergrößerten Ausschnitt findet sich das Lösungsmittelsignal als 6. Peak von rechts. Unter Auslassung des Lösungsmittelsignals verbleibt ein symmetrisches Triplett. Von der Zielverbindung sind die drei Isomeren o-nitroanilin, m-nitroanilin und p-nitroanilin denkbar. p-nitroanilin: Wegen der Molekülsymmetrie erwartet man drei Protonenmultipletts ( , und N 2 ) im Integralverhältnis 2:2:2. Erfüllt wird diese Forderung nur vom unteren Spektrum. m-nitroanilin Man erwartet 5 Protonenmultipletts im Integralverhältnis 1:1:1:1:2. Ein aromatisches Proton weist eine Besonderheit gegenüber allen anderen aromatischen Protonen auch in den beiden übrigen Isomeren auf: der nächste Kopplungspartner von -2 befindet sich 4 Bindungen entfernt. Alle weiteren aromatischen Protonen (auch in der p- und o- Verbindung) sehen den nächsten Kopplungspartner im Abstand von drei Bindungen. Entsprechend kann man im Multiplett von -2 nur kleine Kopplungskonstanten finden. Ein Triplett mit besonders kleinen Kopplungskonstanten findet man im oberen Spektrum im linken Drittel der Ausschnittsvergrößerung o-nitroanilin Entsprechend dem oben gesagten sollten die Kopplungskonstanten in allen Multipletts in etwa gleich groß ausfallen. Eine Ausnahme gegenüber den beiden anderen Isomeren bildet das breite Signal der Aminogruppe. Durch die intramolekulare Wasserstoffbrückenbindung erscheint deren Protonensignal bei ca. 6 ppm im Gegensatz zum o- und m- Isomeren mit einer chemischen Verschiebung der Einführung (Lösung) 11
12 Aminoprotonensignals um 4 ppm. Dort ist keine intramolekulare Wasserstoffbrückenbindung möglich. Die getroffene Zuordnung soll mit ilfe eines Inkrementenschemas überprüft werden. Zunächst zum p-derivat. N δ -2 = I o (N 2 ) + I m (N 2 ) = = 6.69 δ -3 = I m (N 2 ) + I o (N 2 ) = = 7.98 N 2 Jetzt das m-derivat. δ -2 = = 7.47 δ -4 = = 7.59 δ -5 = = 7.20 δ -6 = = N N 2 Beide Inkrementenrechnungen stehen in hervorragender Übereinstimmung mit den experimentellen Werten. Dazu im Vergleich jetzt das o-derivat. N 2 N 2 δ -3 = = δ -4 = = 6.81 δ -5 = = 7.36 δ -6 = = 6.69 Womit dann leider nicht bewiesen wäre, was zu beweisen war. Im Falle o- disubstituierter Aromaten versagt das Inkrementenschema wegen sterischer Wechselwirkungen im Regelfalle. Wenigstens wird ja die Reihenfolge der Signale von -4 und -6 vertauscht wiedergegeben. 12 Einführung (Lösung)
13 Lösung zu Aufgabe 9 C 9 9 Cl ( 1 ; Mz) x ppm Im Spektrum lassen sich insgesamt 4 Signalgruppen identifizieren. Die Protonen verteilen sich beginnend von tiefem Feld (Multiplett bei etwa 8 ppm) im Verhältnis von 2:2:2:3. Zur besseren Erkennung wurden alle Multipletts um den Faktor 4 in der Frequenzdimension gespreizt und neben den riginalmultipletts dargestellt. Bisher liegen folgende Aussagen vor: chem. Verschiebung Multiplizität Integral 8 ppm Pseudo-d ppm Pseudo-d ppm t ppm q 3 Dabei bedeuten: d-dublett, t-triplett und q-quartett. Die tieffeldigen Signale sind eindeutig aromatischen Protonen zuzuordnen. Die Anzahl der Protonengruppen als auch das Aufspaltungsbild sprechen für eine p-disubstitution; im Falle einer m-substitution wären 4 Protonengruppen zu erwarten, im Falle einer o- Substitution mit zwei verschiedenen Substituenten ebenfalls 4 Protonengruppen bzw. ein deutlich anderes Aufspaltungsbild im Falle zweier identischer Substituenten (Beispiel: o-dichlorbenzen). Das beobachtete Spinsystem gehört zum Typ AA XX bzw. [AX] 2. Das Multiplett bei 2.7 ppm, bestehend aus zwei Protonen, weist drei identische Nachbarprotonen auf, umgekehrt weisen die drei Protonen bei 1.3 ppm zwei Nachbarprotonen auf. Beide Multipletts zusammen bilden das eindeutige Muster einer Ethylgruppe. Nach dem Abzug des aromatischen Ringes und der Ethylgruppe verbleibt von der Summenformel nur der Rest CCl bei noch ungeklärter Verknüpfung zwischen diesen Bestandteilen. Insgesamt sind mit den Elementen nur zwei Konstitutionen möglich: Einführung (Lösung) 13
14 Cl-C 6 4 -C-C 2 -C 3 und Cl-C-C 6 4 -C 2 -C 3 Eine eindeutige Entscheidung zugunsten einer Struktur soll an dieser Stelle aus den gemessenen Daten nicht abgeleitet werden. Einen inweis liefert jedoch die Berechnung der chemischen Verschiebung für die Methylenprotonen mit ilfe eines Inkrementenschematas. Für die Methylengruppe im p-chlor-propiophenon (links) berechnet man für die Methylenprotonen eine chemische Verschiebung um 2 ppm (die verschiedenen Inkrementenschemata können leicht verschiedene Werte liefern). Die Berechnung für das p-ethyl-benzoylchlorid liefert einen Wert (nachvollziehen!), der den gemessenen 2.7 ppm wesentlich näher kommt. Insgesamt kann die Anwendung von Inkrementenschemata zur Konstitutionsaufklärung meist nur Anhaltswerte liefern. 14 Einführung (Lösung)
15 Lösung zu Aufgabe 10 Nach der Integration lassen sich die drei Signalgruppen wie folgt charakterisieren. Multiplett δ [ppm] Multiplizität Integral a 7.25 m (Multiplett) 2 b 6.82 m 2 c 3.78 s (Singulett) 3 Da Multiplett c ein Singulett bildet, können nur die zu a und b gehörigen Protonen miteinander koppeln. berflächlich betrachtet liegt hier ein AX-System vor. Die Tieffeldverschiebung der Signale weist sofort auf einen 1,4-disubstituierten Aromaten hin. Das zugehörige Spinsystem gehört zum Typ AA XX bzw. [AX] 2. Das Aufspaltungsbild höherer rdnung rührt daher, daß ausgehend von -2 zwei Kopplungen unterschiedlicher Größe zu den chemisch äquivalenten Protonen -3 und -5 auftreten. Die analoge Aussage gilt für die übrigen Protonen. Da das Singulett bei 3.78 ppm eindeutig zu einer Methylgruppe gehört, bleiben nur - - und -Cl bisher nicht einer Struktureinheit zugeordnet. Es gibt nur zwei Verknüpfungsmöglichkeiten aller Komponenten Cl Me Cl Me a) b) Abgesehen von der chemisch ziemlich unwahrscheinlichen linken Struktur, wird die richtige rechte Struktur durch die chemische Verschiebung der Methylprotonen (es genügt eine Übersichtstabelle der 1 -chemischen Verschiebungen) bestätigt. Das Methylsignal in Verbindung a) würde in der Region ppm erscheinen. Die Methoxygruppe als stärkerer +M-Substituent im Vergleich zum Cl-Atom führt zu einer Elektronenanreicherung in den Positionen 3 und 5 der Lösungsstruktur b). Damit verbunden ist eine stärkere Abschirmung der dort gebundenen Protonen. Das Signal der Protonen -3 und -5 wird entsprechend nach höherem Feld (6.82 ppm) verschoben. Einführung (Lösung) 15
16 Lösung zu Aufgabe 11 Eine erste Analyse des Spektrums liefert 6 Signalgruppen. Die leicht extrahierbaren Parameter bilden chemische Verschiebung, Integralstufenhöhe, Multiplizität und evtl. Kopplungskonstanten. Die Tabelle faßt diese Parameter zusammen. Multiplett δ [ppm] Integral Multiplizität Kopplungen mm Dublett (d) 7.4 z mm Multiplett (m) mm Multiplett (m) mm Dublett (d) 16.1 z mm Singulett (s) mm Dublett von Dubletts (dd) 7.4 z; 16.1 z Multiplett 5 mit seinem ausgefallenen Integral gehört nicht zur Verbindung und stellt eine Verunreinigung dar. Im konkreten Fall handelt es sich um das Restprotonensignal des als Lösungsmittel eingesetzten CDCl 3. Die insgesamt 7 Protonen der Verbindung lassen sich nun leicht den verbliebenen 5 Signalgruppen zuordnen. Die entsprechende korrigierte Tabelle gilt als Bezugspunkt für die weitere Diskussion. Multiplett δ [ppm] Protonenanzahl Multiplizität Kopplungen Dublett (d) 7.4 z Multiplett (m) Multiplett (m) Dublett (d) 16.1 z Dublett von Dubletts (dd) 7.4 z; 16.1 z Funktionelle Gruppen mit chemischen Verschiebungen der Protonensignale im Bereich von 10 ppm sind ziemlich selten. In der Übersicht der chemischen Verschiebungen findet man Carbonsäuren, Aldehyde und enolisierte -Gruppen. Wegen der beobachteten Kopplung kommt für Multiplett 1 nur ein Aldehyd in Frage. Die Multipletts 4 und 5 beinhalten beiden eine Kopplungskonstante von 16.1 z. Es handelt sich um eine typische Kopplung zwischen zwei E-ständigen olefinischen Protonen, womit sich das Strukturfragment 16 Einführung (Lösung)
17 C C ergibt. Da Multiplett 5 zugleich die im Aldehydproton beobachtete Kopplungskonstanten von 7.4 z beinhaltet, ergibt sich eine Strukturfragment (7.53) C C C (9.78) (6.80) mit der angegebenen Signalzuordnung. Entsprechend der vorgegebenen Summenformel beinhaltet die Verbindung 7 Doppelbindungsäquivalente, wovon das bisher bekannte Strukturfragment nur 2 enthält. Die bisher nicht zugeordneten Multipletts 2 uns 3 sind typisch für ein p-disubstituiertes Benzol. berflächlich betrachtet bilden die Multipletts 2 und 3 zwei Dubletts. Das würde zwei benachbarten Protonen (-2 und -3 bzw. -5 und -6 in einem disubstituierten Benzolring) entsprechen. In einem Aromaten treten jedoch homonuklearen Kopplungen über mehr als drei Bindungen auf, die die hier beobachtete Feinstruktur hervorrufen. Eine nähere Diskussion der Feinstruktur soll hier nicht erfolgen. Unter der Annahme des disubstituierten Benzols verbleibt ein nicht zugeordnetes Strukturfragment der Summenformel N 2. Dies könnte sowohl eine Nitro- (-N 2 ) als auch eine Nitritgruppe (--N=) sein. Eine genaue Entscheidung wäre mit ilfe eines Inkrementenschemas für aromatische Protonen möglich. Sowohl für das Vinylfragment als auch das Nitrit sind geeignete Inkremente leider nicht gar zu einfach zu finden. Die Entscheidung zwischen -N 2 oder --N= soll hier nicht abschließend geklärt werden. Die Nitroverbindung läßt sich natürlich chemisch viel einfacher synthetisieren. Die korrekte Lösung wäre dann p-nitrozimtaldehyd. Einführung (Lösung) 17
18 Lösung zu Aufgabe 12 Die - in beiden Spektren identische - Summenformel ergibt ein Doppelbindungsäquivalent. Ein Kohlenstoffsignal bei ppm bzw ppm kann dann nur einer Carbonylgruppe zugeordnet werden. Mangels eines aldehydischen Protons, dessen Signal man bei ca. 10 ppm im Protonenspektrum erwarten sollte, liegt damit ein Keton vor. Das hier vorliegende Pentanon kann in drei isomeren Strukturen vorliegen: C 3 2 C 2 C C 3 3 C 2 C C C C C 3 C Propan-3-on, Diethylketon (a) Propan-2-on, Methylpropylketon (b) C 3 3-Methyl-butan-2-on, Methylisopropylketon (c) In Verbindung a sind die beiden Ethylgruppen identisch, man erwartet damit insgesamt 3 Kohlenstoffsignale. In Verbindung b liegt keinerlei Symmetrie vor, damit sollte man alle 5 Kohlenstoffsignale sehen. In Verbindung c schließlich sind die beiden Methylgruppen des Isopropylrestes äquivalent. Damit sollten hier insgesamt 4 Kohlenstoffsignale beobachtet werden. Als Lösung handelt es sich damit bei der Verbindung auf Blatt 1 um Propan-3-on und bei der Verbindung auf Blatt 2 um Propan-2-on. Zur Berechnung der chemischen Verschiebungen im Kohlenstoffspektrum von Propan-2-on steht nur ein sinnvolles Carbonylfragment zur Verfügung. Die Tabelle bietet hier die Acetylgruppe. Zur Berechnung der Signale der C-Atome 3 bis 5 des Propan-2-ons betrachtet man die Verbindung formal einfach als Acetylpropan. Zunächst werden die chemischen Verschiebungen der C-Atome des reinen Propans berechnet. 2 C 3 C -2.3 C x Das Propan wird mit der Acetylgruppe substituiert: 18 Einführung (Lösung)
19 3 C C C 15.9 C Für das C-Atom in 1-Stellung bleibt nur die Näherung, die Gesamtverbindung als Acetylmethan zu betrachten. In analoger Rechnung (Methangrundwert: -2.3 ppm) erhält man für C-1 eine chemische Verschiebung von 28.6 ppm. Die berechneten Werte befinden sich in guter Übereinstimmung mit den gemessenen. Daraus resultiert die folgende Zuordnung: (2.02) 3 C (1.50) 2 C 17.1 C C (2.30) 13.4 (0.81) Einführung (Lösung) 19
20 Lösung zu Aufgabe 13 Alle sechs abgebildeten Spektren zeigen 2 Signalgruppen. Ethanol mit drei chemisch unterschiedlichen Protonen scheidet damit von vornherein aus der weiteren Betrachtung aus. Für die übrigen Verbindungen hilft eine Zusammenstellung von erwarteter Signalmultiplizität und zugehörigem Integral. a) Cl 2 C - C 2 - CCl 2 Triplett (2), Triplett (2) b) (C 3 ) 2 C - CN Dublett (6), Septett (1) c) CCl 2 - CCl - CCl 2 Dublett (2), Triplett (1) d) CCl 2 - C Dublett (1), Dublett (1) e) N C - C 2 - C 2 - Cl Triplett (2), Triplett (2) f) CCl 2 - CCl 2 Singulett (2) g) C 3 - C 2 - Cl Triplett (3), Quartett (2) h) C 2 Br - C 2 - C 2 Br Quintett (2), Triplett (4) i) C 3 - C 2 - Br Triplett (3), Quartett (2) j) C 3 - CCl 2 Dublett (3), Quartett (1) k) (C 3 ) 2 C C N Dublett (6), Septett (1) Es gibt weder Spektren mit einem Singulett (f), einem Septett (b, k) oder zwei Dubletts (d). Die genannten Verbindungen scheiden damit aus der weiteren Betrachtung aus. Ein Quintett tauscht sowohl in der Spektrensammlung als auch der Multiplettaufstellung nur einmal auf. Spektrum (Mitte, rechts) - C 2 Br - C 2 - C 2 Br Jeweils unikal fällt auch die Kombination Dublett-Triplett aus. Spektrum (unten, links) - CCl 2 - CCl - CCl 2 Gleiches gilt auch für Dublett-Quartett. Spektrum (Mitte, links) - C 3 - CCl 2 Für das Spektrum rechts unten kommen jetzt die Verbindungen a) und e) in Frage, für die beiden oberen Spektren die Verbindungen g) und i). Zunächst zu den beiden Tripletts. ier hilft eine Inkrementenrechnung weiter. 20 Einführung (Lösung)
21 N C - C 2 - C 2 - Cl Cl 2 C - C 2 - CCl ==== ==== ==== ==== Die Entscheidung fällt klar aus. Spektrum (unten, rechts) - N C - C 2 - C 2 - Cl Bliebe noch eine Entscheidung zwischen Ethylchlorid und Ethylbromid. Die Inkrementenrechnung (selbst ausführen) ergibt keine klare Entscheidung, beide berechneten Spektren passen auf beide gemessenen. Damit ist eine wissenschaftlich begründete Zuordnung nicht möglich, wohl aber eine unter Anwendung des berühmten gesunden Menschenverstandes. Eines der oberen Spektren wurde gemessen, eines simuliert; Ethylbromid ist bei Raumtemperatur eine Flüssigkeit, Ethylchlorid ein Gas. Noch Fragen? Einführung (Lösung) 21
22 Lösung zu Aufgabe 14 Die Auswertung der beiden Multipletts ergibt zunächst die tabellarisch zusammengefaßten Werte. Multiplett δ [ppm] Multiplizität Integral a 3.81 Septett 2 b 1.10 d (Dublett) 12 Bei der Integration muß natürlich außer dem Spektrum (ergibt ein Integralverhältnis von 1:6) auch die Summenformel berücksichtigt werden. Das Dublett b weist auf ein Nachbarproton hin. Das kann nur das reguläre Septett bei 3.81 ppm mit einem Integral von 2 sein. Dieses Integral läßt sich nur durch die Annahme von zwei identischen Strukturfragmenten innerhalb der Verbindung erklären. Das Septett a mit einem Intensitätsverhältnis der Linien von 1:6:15:20:15:6:1 wird durch 6 Nachbarprotonen verursacht. Es spricht nichts dagegen die 6 Protonen auf zwei identische Methylgruppen zu verteilen, die beide direkt mit der Methingruppe verknüpft sind. Daraus resultiert das zweimal vorhandene Fragment -C(C 3 ) 2. Aus zwei solchen Fragmenten ergibt sich durch Verknüpfung mit dem Sauerstoffatom mit (C 3 ) 2 C--C(C 3 ) 2 die gesuchte Verbindung. 22 Einführung (Lösung)
23 Lösung zu Aufgabe 15 Das Spektrum zeigt 4 Protonengruppen. Die einfach zu extrahierenden Informationen lassen sich tabellarisch zusammenfassen. Multiplett δ [ppm] Multiplizität Integral a 7.3 m (Multiplett) 2 b 6.95 m 3 c 4.05 q (Quartett) 2 d 1.45 t (Triplett) 3 Die Multipletts a und b gehören offensichtlich zu einem monosubstituierten Aromaten (Phenylrest). Durch das Integralverhältnis 2:3 läßt sich mit Sicherheit das zur Substitutionsstelle p-ständige Proton erkennen. Es ist im Multiplett b mit enthalten. Die o- und m-ständigen Protonen können eindeutig zugeordnet werden. Durch Kopplung zu den o- und p-protonen zeigen die m-protonen eine triplettartige Struktur (7.3 ppm). Wegen des Integrals gehört Multiplett d offensichtlich zu einer Methylgruppe. Die Triplettstruktur weist auf 2 Nachbarprotonen (Multiplett c) hin. Umgekehrt deutet die Quartettstruktur von c auf die benachbarte Methylgruppe hin. Aus den Multipletts c und d folgt das Strukturelement -C 2 -C 3. Das noch nicht erfaßte Sauerstoffatom aus der Summenformel kann nur als Brücke zwischen Phenyl- und Ethylrest fungieren. Mit der gefundenen Struktur läßt sich auch die ochfeldverschiebung der o- und p- Protonen qualitativ erklären. Der Ethersauerstoff besitzt einen ausgeprägten +M- Effekt. Da durch tritt eine partielle negative Ladung an den o- und p-c-atomen auf. Die Elektronendichte an den o- und p-protonen steigt, das magnetische Feld wird stärker abgeschirmt. Einführung (Lösung) 23
24 Lösung zu Aufgabe 16 Zu dieser Aufgabe liegt noch keine ausgearbeitete Lösung vor. 24 Einführung (Lösung)
25 Lösung zu Aufgabe 17 Die Integration liefert ein Verhältnis von 2:2:3:3 für die Protonenmultipletts bei 8.0, 6.9, 3.9 und 3.85 ppm. Die Singuletts lassen sich natürlich sofort zwei Methylgruppen zuordnen. Die beiden Multipletts im Bereich der aromatischen Protonen entsprechen oberflächlich betrachtet Dubletts, entsprechend einem AX-Spinsystem. Die tatsächlich beobachtete Feinstruktur der Multipletts resultiert aus einem AA XX - bzw. [AX] 2 -Spinsystem. Ein solches Spinsystem tritt typischerweise in einem 1,4-disubstituierten Benzol auf Die große Dublettaufspaltung wird durch die Kopplung zwischen den Protonen 2 und 3 bzw. 4 und 5 hervorgerufen. Dabei sind die Protonen 2 und 6, sowie 3 und 5 chemisch äquivalent und zeigen damit identische chemische Verschiebungen. Die Protonen 2 und 6 sind aber nicht magnetisch äquivalent, weil sich die Kopplungskonstanten 5 J -2,-5 und 3 J -5,-6 unterscheiden. Analoges gilt für die Protonen -3 und -5. Alle Protonen sind somit den drei Fragmenten C 6 4 und 2 x C 3 zugeordnet. Mit dem verbleibenden Kohlenstoff- und den drei Sauerstoffatomen ergeben sich zwei denkbare Strukturen: C a) C 3 C 3 b) C 3 Eine einfache Unterscheidung ist bereits mit einer Übersichtstafel der chemischen Verschiebungen möglich. Das Signal der Methylprotonen einer Acetylgruppe erscheint um 2 ppm, Methoxyprotonen ergeben Signale um 4 ppm. Nur b) weist zwei Methoxygruppen mit Protonensignalen um 4 ppm auf. Die Zuordnung der aromatischen Protonen ist durch eine einfache qualitative Betrachtung möglich. Die Methoxygruppe zeigt einen ausgeprägten +M-Effekt. Als Folge tritt eine erhöhte Elektronendichte an den C-Atomen 2, 4 und 6 auf. Dadurch werden die Protonen -2 und -6 stärker abgeschirmt, deren Signal wird ausgeprägt nach hohem Feld (6.9 ppm) verschoben. Einführung (Lösung) 25
26 Lösung zu Aufgabe 18 Beide Spektren weisen drei Protonengruppen bei etwa den chemischen Verschiebungen 8 ppm, 4.5 ppm und 1.5 ppm auf. Die Integration ergibt ein ganzzahliges Protonenverhältnis zwischen den drei Signalgruppen von 2:2:3 bzw. 4:4:6, womit bereits alle 14 Protonen "verteilt" wären. Die beiden Signale bei etwa 4.5 und 1.5 ppm entsprechen von der Multiplizität und dem Integral ganz klar Ethylgruppen (2x). Wegen der ausgeprägten Tieffeldverschiebung der Methylenprotonen (Quartett um 4.5 ppm), sind die beiden äquivalenten Ethylgruppen an einen starken elektronegativen Bindungspartner gebunden. Unter Ausschluß exotischer Strukturen können die vier Protonen um 8 ppm nur einem zweifach substituierten Benzolring entstammen. Nach der bisherigen Zuordnung verbleibt ein Rest C 2 4, den man am besten zwei Carboxylgruppen zuordnet. Die beiden Carboxylgruppen müssen mit dem Kohlenstoffatom am Phenylring und dem Sauerstoffatom an der Ethylgruppe gebunden sein. Bei vertauschter Anordnung (Sauerstoff am Phenylring) erschiene das Protonensignal der Methylengruppe bei etwa 3 ppm (mit Inkrementschema nachprüfen!). Im unteren Spektrum sind alle vier aromatischen Protonen äquivalent. Das ist ausschließlich bei p-ständiger Anordnung der beiden Estergruppierungen (-C-- C 2 5 ) möglich. Die prinzipiell mögliche m-ständige Anordnung würde zumindest drei Signalgruppen im Aromatenbereich ergeben. Es verbleibt für das obere Spektrum die o-ständige Anordnung der Estergruppen. Das resultierende aromatische Spinsystem ist nicht trivial. Im vorliegenden Fall liegt ein AA XX ([AX] 2 )-System vor. Lösung: oben: Phthalsäurediethylester (Diethylphthalat) unten: Terephthalsäurediethylester 26 Einführung (Lösung)
27 Lösung zu Aufgabe 19 Bei der Integration lassen sich nur zwei Bereiche auflösen. Trotz der etwas unsauberen Integration der Signalgruppe bei 1.1 ppm kann ein Intensitätsverhältnis von 2:12 eindeutig abgeleitet werden (die Alternativen 1:13 und 3:11 scheiden eindeutig aus). Das Quartett bei 3.4 ppm gehört zu einer Methylengruppe (Intensität), die benachbarte Protonengruppe muß folglich als Triplett erscheinen. Die Intensität der Nachbarprotonengruppe muß 3 sein, um die Aufspaltung der Methylenprotonensignale zum Quartett erklären zu können. Das erwartete Triplett mit einem Intensitätsverhältnis der drei Multiplettlinien von 1:2:1 kann nur bei der Signalgruppe um 1.1 ppm zu finden sein. Zwei der erwarteten Linie sind direkt (rechts bzw. hochfeldig neben der intensiven Linie) beobachtbar. Die tieffeldigste der drei Linien kann nur unter dem intensiven Singulett liegen. Das damit gefundene erste Teilfragment ist eine Ethylgruppe. Das restliche Molekül mit einer Summenformel von C 4 9 ergibt im NMR-Spektrum nur ein Singulett. Von der Summenformel her kann es sich nur um einen Butoxyrest handeln. Bei den vier denkbaren Isomeren treten nur im t-butoxyrest wegen der Isochronie der Methylprotonen keine Signalaufspaltungen auf. Daraus ergibt sich als Gesamtstruktur: C 3 -C 2 --C(C 3 ) 3 Einführung (Lösung) 27
28 Lösung zu Aufgabe 20 Man findet folgende Multipletts im Spektrum: 3.9 ppm (ddd, 2), 5.13 ppm (ddt, 1), 5.3 ppm (ddt, 1), 6.01 ppm (ddt, 1). Aus der Summenformel errechnet sich ein Doppelbindungsäquivalent. Damit kann man die korrekte Struktur fast erraten. Es bieten sich die folgenden vier Konstitutionen an (die mögliche Isomerie kann vernachlässigt werden, wie sich gleich zeigen wird): Cyclopropylbromid, 1-Brompropen, 2-Brompropen und 3-Brompropen. Von dieser Aufstellung scheiden 1- und 2-Brompropen als denkbare Lösungen aus, weil sich im NMR-Spektrum ein Multiplett mit dem Integral 3 finden müßte. Damit spielen auch die beiden möglichen Konfigurationsisomere im Falle des 1- Brompropens keine Rolle. Cyclopropylbromid scheidet wegen des erwarteten Integralverhältnisses von 1:2:2 aus. Lösungsstruktur: d d Br a b c c 16.8 z 9.9 z 7.35 z Die Analyse der Multipletts beginnt man am besten mit c. Als Feinstruktur dieses Multipletts erwartet man ein Dublett von Dubletts von Tripletts. Ein entsprechendes Signal wird bei 6.01 ppm gefunden. Die vier mittleren Linien der Tripletts lassen sich leicht finden. Diese bilden dann noch ein Dublett von Dubletts mit für olefinische Strukturen typischen Kopplungskonstanten. Man beobachtet eine Z-Kopplung zwischen b und c (9.9 z), sowie eine E-Kopplung zwischen a und c (16.8 z). b ist damit dem Multiplett zuzuordnen, in dem die Kopplungskonstante von 9.9 z ein zweites Mal beobachtet wird. Es handelt sich um das Signal bei 28 Einführung (Lösung)
29 b 9.9 z 5.13 ppm. Schließlich beobachtet man in dem Multiplett bei 5.3 ppm die Kopplungskonstanten von 16.8 z ein zweites Mal, womit dieses Multiplett eindeutig a zuzuordnen a ist. 1.2 z Sowohl im Multiplett von a als auch im Multiplett von b taucht die 0.6 z Kopplungskonstante von 1.2 z auf. ierbei handelt 16.8 z 1.2 z es sich um die geminale Kopplungskonstante 1.2 z 2 J (a),(b) zwischen den beiden Protonen. Das Vorzeichen der geminalen Kopplungskonstante ist meist negativ, die Angabe des Absolutbetrags trägt der Unsicherheit bei der d Angabe des Vorzeichens Rechnung. Bei 3.9 ppm findet man schließlich das Signal der 7.35 z Methylengruppe. Das Dublett von Dublett von 1.2 z Dubletts erklärt sich durch eine vicinale Kopplungskonstante von 7.35 z zu c, eine allylische Weitbereichskopplung über 0.6 z 4 Bindungen zu a mit einer Kopplungskonstante von 1.2 z und eine weitere allylische Weitbereichskopplung über 4 Bindungen zu b mit einer Kopplungskonstanten von 0.6 z. Einführung (Lösung) 29
30 Lösung zu Aufgabe 21 Die Integration liefert für die drei Signalgruppen ein Intensitätsverhältnis von 5:2:1. Das Singulett bei etwa 1.6 ppm ist zu klein, um zum Molekül zu gehören. Es handelt sich um Wasserspuren im Chloroform. Die Multipletts bei 4.7 und 1.8 ppm bilden offensichtlich ein Spinsystem resultierend aus einem Strukturfragment X - X 2, wobei X an dieser Stelle noch nicht näher spezifiziert werden soll. X ergibt bedingt durch die zwei Nachbarprotonen ein Triplett der Intensität 1 (1.8 ppm). Für X 2 ergibt sich durch das eine Nachbarproton ein Dublett der Intensität 2 (4.7 ppm). Das Multiplett im Bereich der aromatischen Protonen bei 7.4 ppm der Intensität 5 sollte man immer zuerst einem Phenylrest zuordnen, sofern die Summenformel dies zuläßt. Unter Berücksichtigung des bereits gefundenen Fragments (siehe oben) erhält man jetzt eine formale Summenformel C 6 X 2 8 d.h. ein X entspricht einem C-Atom, ein weiteres X einem Sauerstoffatom. Daraus ergibt sich nur eine mögliche Struktur: Eine Kopplung zu -Protonen, wie in diesem Beispiel läßt sich üblicherweise nicht beobachten. Durch einen schnellen intermolekularen Austausch der -Protonen erscheinen diese normalerweise als Singuletts. Im vorliegenden Fall würde dann auch die C 2 -Gruppe als Singulett erscheinen. In DMS-d 6 oder säurefreiem CDCl 3 wie im vorliegenden Beispiel ist der Austausch stark verlangsamt, die Kopplung kann beobachtet werden und liefert damit einen wesentlichen zusätzlichen inweis zur Strukturaufklärung. 30 Einführung (Lösung)
31 Lösung zu Aufgabe 22 Das Protonenspektrum zeigt nur zwei Signalgruppen: ein Quartett mit einem Proton bei ca. 9.3 ppm und ein Dublett mit drei Protonen bei ca. 1.6 ppm. Das kann nur ein Fragment C 3 X sein. Mit X = hätten wir Methanol mit nur einem C-Atom. Zwei C-Signale werden (neben dem Lösungsmittelsignal) beobachtet, also C 3 - C <. Das Kohlenstoffsignal der Methylgruppe findet man bei ppm. Das extrem tieffeldige Signal des zweiten C-Atoms spricht für ein Keton, ein Aldehyd oder mit Einschränkungen eine Carboxylgruppe. Im vorliegenden Fall kommt wegen des Protonensignals bei ca. 9.3 ppm nur das Aldehyd in Frage. Lösung: Acetaldehyd (C 2 4 ). Das Spektrum wurde in deuteriertem Benzol gemessen. Das Kohlenstoffsignal von Benzol wird typisch bei ppm erwartet. Die Aufspaltung zum Triplett im Integralverhältnis 1:1.1 wird durch das direkt gebundene Deuteriumatom verursacht. Einführung (Lösung) 31
32 Lösung zu Aufgabe 23 Die drei Protonen lassen sich problemlos drei Signalgruppen mit je einem Proton zuordnen. Jede der drei Signalgruppen bildet ein Dublett von Dubletts. Die weiteren Eigenschaften faßt man am besten tabellarisch zusammen. Multiplett δ [ppm] Kopplungskonstanten z, z z, z z, z Das ist ganz klar ein substituiertes Ethylen. Es verbleibt ein nicht zugeordneter Rest CN aus der Summenformel und damit die einzig mögliche Lösung Acrylnitril. 32 Einführung (Lösung)
33 Lösung zu Aufgabe 24 Das obere Spektrum kann nur zu Anilin gehören. Es zeigt drei Multipletts: 7.2 ppm (2), 6.8 ppm (2) und 6.7 ppm (1). Für das untere Spektrum ergäben sich die Alternativen Phenylnitrit und Nitrobenzol. Auch hier treten drei Multipletts auf: 8.2 ppm (2), 7.7 ppm (1) und 7.55 ppm (2). Die Inkrementenrechnung. N δ -2 [ppm] = = 6.52 (expt.: 6.7) δ -3 [ppm] = = 7.03 (expt.: 7.2) δ -4 [ppm] = = 6.70 (expt.: 6.8) Die Übereinstimmung fällt mäßig aus. δ -2 [ppm] = = 8.22 (expt.: 8.2) δ -3 [ppm] = = 7.44 (expt.: 7.55) δ -4 [ppm] = = 7.60 (expt.: 7.7) 6 5 N ier geht es recht gut. Für die - - N = -Gruppe ist kein Inkrement verfügbar. Einführung (Lösung) 33
34 Lösung zu Aufgabe 25 Die zwei Multipletts B und C (jeweils Tripletts mit 2 Protonen) gehören zu einem Fragment - C 2 - C 2 -. Fünf Protonen im aromatischen Bereich mit zusammen 4 Doppelbindungsäquivalenten sprechen für einen Phenylrest. Die beiden verbleibende Atome aus der Summenformel lassen nur eine Struktur zu: Cl Bei genauer Betrachtung findet man im Aromatenteil des Spektrums ein Multiplett mit 2 Protonen und einem Triplett als Grundstruktur (7.32 ppm), ein Multiplett mit einem Proton und Triplettgrundstruktur (7.01 ppm) und ein Multiplett mit zwei Protonen und Dublettgrundstruktur (6.95 ppm). Damit lassen sich die aromatischen Protonen problemlos zuordnen. Cl Einführung (Lösung)
35 Lösung zu Aufgabe 26 Zu dieser Aufgabe liegt noch keine ausgearbeitete Lösung vor. Einführung (Lösung) 35
36 Lösung zu Aufgabe 27 Die zahlreichen Singuletts zwischen 2 und 2.5 ppm gehören wegen deren geringer Integrale offensichtlich zu einer Verunreinigung. Es verbleiben vier Protonenmultipletts, die sich wie folgt tabellarisch zusammenfassen lassen. Multiplett δ [ppm] Multiplizität Integral a 5.2 q (Quartett) 1 b 4.25 q (Quartett) 2 c 1.75 d (Dublett) 3 d 1.28 t (Triplett) 3 Prinzipiell können die Protonen auch an N oder gebunden sein und zeigen dann teilweise auch homonukleare Kopplungen. Angesichts von 5 vorhandenen Kohlenstoffatomen ist es durchaus sinnvoll, die Multipletts a bis d zunächst generell C x -Gruppen (x=1,2,3) zuzuordnen. Multiplett a entspricht damit wegen des Integrals einer C-Gruppe. Die Aufspaltung zum Quartett läßt sich nur durch eine benachbarte C 3 -Gruppe erklären. Diese C 3 - Gruppe erscheint wegen des nur einen benachbarten Protons selbst als Dublett. Damit lassen sich die Multipletts a und c einem Strukturfragment >C-C 3 zuordnen. Durch analoge Überlegungen kann man die Multipletts b und d der Gruppierung -C 2 -C 3 zuordnen. Damit sind alle 9 Protonen "verbraucht", es verbleibt ein Molekülfragment der Summenformel CN 4. Unter ausschließlicher Verwendung des Protonenspektrums und der Summenformel läßt sich jetzt kein eindeutig beschreitbarer Weg zur Ermittlung der Konstitution mehr angeben. Die verbleibenden Atome müssen mit den beiden bekannten Fragmenten versuchsweise verknüpft werden und die erhaltene Struktur auf ihre Sinnfälligkeit überprüft werden. Einige inweise bieten sich hierzu an: Alle homonuklearen Kopplungen im Spektrum können mit den beiden bekannten Strukturfragmenten beschrieben werden. Diese beiden Fragmente sind nicht direkt miteinander verknüpft. Das Stickstoffatom kann nur Sauerstoff und/oder Kohlenstoff als Nachbarn tragen. Die vorhandenen Protonen wurden ausnahmslos mit Kohlenstoffatomen verknüpft. Die Ethylgruppe kann eigentlich nur ein Sauerstoffatom als Nachbarn tragen. Der inweis hierauf ist die ausgeprägte Tieffeldverschiebung des Multipletts b (siehe Übersicht über die 1 -chemischen Verschiebungen). 36 Einführung (Lösung)
37 Die extreme Tieffeldverschiebung des Methinprotons (Multiplett a) läßt sich nur durch zwei elektronenziehende Substituenten am zugehörigen Kohlenstoffatom oder eine Doppelbindung an selbigem erklären. Das fünfte Kohlenstoffatom der Verbindung trägt natürlich auch kein Proton. Eine mögliche Lösung wäre die folgende Struktur. C 3 -C(N 2 )--C-C 2 -C 3 Für die Methylengruppe errechnet sich nach den Schoolery-Regeln (Inkrementenschemata für aliphatische Protonen) die chemische Verschiebung zu δ C2 = = 2.25 ppm. Dieser Wert steht im deutlichen Gegensatz zu dem gemessenen Wert von 4.25 ppm. In der alternativen Struktur C 3 -C(N 2 )-C--C 2 -C 3 ergibt sich für die Methylengruppe eine theoretische chemische Verschiebung von 3.83 ppm in vernünftiger Übereinstimmung mit dem experimentellen Wert von 4.25 ppm. Die angegebene Struktur ist natürlich richtig. In diesem Fall würden sich jedoch auf alle Fälle unterstützende Strukturuntersuchungen (z.b. IR) anbieten. hne die bei der Aufgabenstellung getroffenen Einschränkungen wären die beiden weiteren alternativen Strukturen und C 3 -C(N)--C--C 2 -C 3 C 3 -C(N)-C---C 2 -C 3 denkbar, die unter ausschließlicher Betrachtung des eindimensionalen Protonenspektrums nicht ohne weiteres ausgeschlossen werden können. Einführung (Lösung) 37
38 Lösung zu Aufgabe 28 Zu dieser Aufgabe liegt noch keine ausgearbeitete Lösung vor. 38 Einführung (Lösung)
39 Lösung zu Aufgabe 29 Das Quartett mit 2 Protonen bei 4 ppm und das Triplett mit drei Protonen bei 1.4 ppm gehören zweifelsfrei zu einer Ethylgruppe. Aus der Tieffeldverschiebung des von der Methylengruppe abgeleiteten Quartetts resultiert ein stark elektronenziehender Nachbar. Brom scheidet aus, da Ethylbromid bereits ein vollständiges Molekül wäre, bliebe Sauerstoff und damit die Ethoxygruppe - - C 2 - C 3 als erste Teillösung. Das verbleibende Fragment C 6 4 Br beinhaltet alle vier Doppelbindungsäquivalente. Die naheliegende Lösung besteht in einem mit der Ethoxygruppe substituierten Brombenzol. Nur im Fall der p-disubstitution werden im Aromatenteil des Protonenspektrums zwei Signalgruppen mit je zwei Protonen erwartet, im Falle einer m- oder o-disubtitution wären jeweils alle vier aromatischen Protonen nicht äquivalent. Die vollständige Lösung wäre p-bromphenetol (Br - C C 2 - C 3 ). Einführung (Lösung) 39
40 Lösung zu Aufgabe 30 Die besondere Schwierigkeit bei der Auswertung des keinesfalls trivialen Spektrums liegt in der Gestalt des Multipletts bei 1.9 ppm. Den ersten Schritt bildet die Integration. Von tiefem nach hohem Feld (von links nach rechts) ergibt sich ein Verhältnis von 5:1:1:3 für die vier Protonengruppen. Die fünf aromatischen Protonen (vgl. Übersicht der 1 -chemischen Verschiebungen) gehören wohl zu einem Phenylrest. Damit verteilen sich die übrigen drei Protonengruppen zwischen 1.5 und 5 ppm auf ein Fragment mit der Summenformel C 2 5. Das Multiplett bei 4.9 ppm zeigt eine Intensitätsverteilung der Einzellinien von etwa 1:1:3:3:3:3:1:1. Dies läßt sich als Dublett von Quartetts interpretieren. Dem Quartett entspricht eine benachbarte Methylgruppe (3 Protonen bei 1.5 ppm). Das Proton mit der chemischen Verschiebung von 4.9 ppm kann nur an ein Kohlenstoffatom gebunden sein, da es mindestens zwei Nachbarn besitzt. Dies wäre für natürlich nicht möglich. Zusammen leitet sich aus den beiden Multipletts bei 4.9 und 1.5 ppm das Strukturfragment >C-C 3 ab. Nicht zugeordnet verbleibt nur ein Fragment der Summenformel. Es ist nur eine Kombination der drei bis hier bekannten Fragmente möglich. C C 3 Das Methinproton erfährt seine Aufspaltung durch die Methylgruppe (q) und durch die -Gruppe (d). Unter Standardmeßbedingungen läßt sich die durch die -Gruppe hervorgerufene Aufspaltung nicht beobachten. Das Methinproton erscheint als Quartett, die -Gruppe als Singulett. Ursache dafür sind Säurespuren in den gängigen Lösungsmitteln, die einen schnellen intermolekularen Austausch der - Protonen katalysieren. Da die -Protonen (wie auch alle anderen Protonen) etwa gleich verteilt mit α- und β-rientierung vorliegen, kann bei schnellem Austausch keine Kopplung beobachtet werden. Im vorliegenden Fall wurde ein sehr reines Lösungsmittel verwendet. An sich sollte man jetzt ein Dublett für die -Gruppe erwarten. Die chemische Verschiebung von -Protonen ist jedoch außerordentlich temperaturabhängig. Eine Temperaturänderung um 1 K kann die chemische Verschiebung um mehrere 10 z ändern. Bei dieser Messung arbeitete die Temperaturregelung nicht völlig stabil. Für die Messung selbst wurden für ein besseres Signal-Rausch-Verhältnis 16 Einzelmessungen addiert. Die bei jeder Einzelmessung geringfügig andere Lage des -Dubletts addierte sich zu dem dargestellten Multiplett. Die Gestalt ist recht zufällig, hängt von der Regelkonstante der Temperiereinheit, dem zeitlichen Abstand 40 Einführung (Lösung)
41 zwischen den Einzelmessungen und der Empfindlichkeit des -Signals gegenüber Temperaturschwankungen zusammen. Einführung (Lösung) 41
42 Lösung zu Aufgabe 31 Zu dieser Aufgabe liegt noch keine ausgearbeitete Lösung vor. 42 Spinsysteme (Lösung)
43 Lösung zu Aufgabe 32 Unter Vernachlässigung der Signale mit einem Integral unter 1 separiert man im Spektrum vier Signalgruppen: 4.2 ppm (q, 2), 3.4 ppm (s, 2), 2.2 ppm (s, 3) und 1.2 ppm (t, 3). Das Quartett und das Triplett gehören offenbar zu einer Ethoxygruppe. Die drei Methylprotonen spalten durch die vier benachbarten Methylenprotonen zum Triplett auf, die zwei Methylenprotonen durch die benachbarten drei Methylprotonen zum Quartett. Die Methylengruppe muß direkt an ein Sauerstoffatom gebunden sein, anders läßt sich bei der gegebenen Summenformel die ausgeprägte Tieffeldverschiebung der Methylenprotonen nicht erklären. -C 2 -C 3 Die Verbindung verfügt über zwei Doppelbindungsäquivalente. Am einfachsten ordnet man diese zwei Carbonylgruppen zu. Alle anderen Varianten führen zu teilweise sehr exotischen Annahmen (z.b. Peroxide). Da die fünf bisher nicht zugeordneten Protonen nicht miteinander koppeln, kommt nur eine Lösungsstruktur in Frage. (2.2) (3.4) (4.2) (1.2) Selbstverständlich läßt sich bei dieser Verbindung eine Keto-Enol-Tautomerie beobachten. (4.2) (2.2) (3.4) (1.2) (1.9) (4.9) Die -Protonen werden durch die Chelatbildung zu sehr tiefem Feld (ca. 15 ppm) verschoben und können im angegebenen Spektrenausschnitt nicht beobachtet werden. Das Signal der Methylgruppe erscheint im Enol etwa bei 1.9 ppm, das der olefinischen Methingruppe bei 4.9 ppm. Im Quartett sind ebenfalls Signale für die Enolform zu beobachten. Spinsysteme (Lösung) 43
Kurs "Spektroskopische Methoden in der Anorganischen und Organischen Chemie" Kernresonanzspektroskopie - Übungen Lösung zu NMR-6 (Blatt 1)
 Kernresonanzspektroskopie - Übungen Lösung zu NMR-6 (Blatt ) Zum Lösungsmittel: Das Kohlenstoffspektrum zeigt bei 77 ppm drei gleich große äquidistante Signale. Diese stammen von CDC 3. Chemische Verschiebungen
Kernresonanzspektroskopie - Übungen Lösung zu NMR-6 (Blatt ) Zum Lösungsmittel: Das Kohlenstoffspektrum zeigt bei 77 ppm drei gleich große äquidistante Signale. Diese stammen von CDC 3. Chemische Verschiebungen
Übungsaufgaben zur NMR-Spektrometrie
 Übungsaufgaben NMR 33 Übungsaufgaben zur NMR-Spektrometrie Aufgabe 1 a) Wieviele unterschiedliche Orientierungen des Kernmomentes relativ zu einem externen Magnetfeld sind beim 14 N-Kern (I = 1, γ = 1.932
Übungsaufgaben NMR 33 Übungsaufgaben zur NMR-Spektrometrie Aufgabe 1 a) Wieviele unterschiedliche Orientierungen des Kernmomentes relativ zu einem externen Magnetfeld sind beim 14 N-Kern (I = 1, γ = 1.932
Spektroskopiemodul II. H-NMR und 13 C-NMR
 Spektroskopiemodul II 1 H-NMR und 13 C-NMR 1 1. Was gehört zu einer vollständigen Spektreninterpretation zur Strukturaufklärung? 1.1. 1 H-NMR-Spektren Man muss die chemische Verschiebung jedes einzelnen
Spektroskopiemodul II 1 H-NMR und 13 C-NMR 1 1. Was gehört zu einer vollständigen Spektreninterpretation zur Strukturaufklärung? 1.1. 1 H-NMR-Spektren Man muss die chemische Verschiebung jedes einzelnen
Kombinierte Übungen zur Spektroskopie Beispiele für die Bearbeitung
 Im folgenden soll gezeigt werden, daß es großen Spaß macht, spektroskopische Probleme zu lösen. Es gibt kein automatisches Lösungsschema, sondern höchstens Strategien, wie beim "Puzzle Lösen"; häufig hilft
Im folgenden soll gezeigt werden, daß es großen Spaß macht, spektroskopische Probleme zu lösen. Es gibt kein automatisches Lösungsschema, sondern höchstens Strategien, wie beim "Puzzle Lösen"; häufig hilft
Teil 2 NMR-Spektroskopie. Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18
 Teil 2 NMR-Spektroskopie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18 www.ruhr-uni-bochum.de/chirality 1 Rückblick Chemische Verschiebung Chemische Umgebung Funktionelle Gruppen Signalintensitäten
Teil 2 NMR-Spektroskopie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18 www.ruhr-uni-bochum.de/chirality 1 Rückblick Chemische Verschiebung Chemische Umgebung Funktionelle Gruppen Signalintensitäten
Spektroskopie-Seminar SS NMR-Spektroskopie. H-NMR-Spektroskopie. nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie
 1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 4.1 Allgemeines Spektroskopische Methode zur Untersuchung von Atomen: elektronische Umgebung Wechselwirkung
1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 4.1 Allgemeines Spektroskopische Methode zur Untersuchung von Atomen: elektronische Umgebung Wechselwirkung
Spektroskopie-Seminar SS NMR-Spektroskopie. H-NMR-Spektroskopie. nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie
 1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 4 NMR-Spektroskopie 5.1 1 H-NMR-Spektroskopie Wasserstoffatome ( 1 H, natürliche Häufigkeit 99,985 %) mit
1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 4 NMR-Spektroskopie 5.1 1 H-NMR-Spektroskopie Wasserstoffatome ( 1 H, natürliche Häufigkeit 99,985 %) mit
P105. Konstitution. Massenspektrum 100 % m/z
 1 P105 Konstitution 7 1 2 6 8 4 5 Massenspektrum 100 % 4 116 50 7 101 29 55 88 15 61 10 14 158 0 0 50 100 150 m/z 2 Direkte Fragmentierungen: 4 115 11 45 129 29 85 7 Damit lassen sich die prominenten Signale
1 P105 Konstitution 7 1 2 6 8 4 5 Massenspektrum 100 % 4 116 50 7 101 29 55 88 15 61 10 14 158 0 0 50 100 150 m/z 2 Direkte Fragmentierungen: 4 115 11 45 129 29 85 7 Damit lassen sich die prominenten Signale
Kernmagnetische Resonanzspektroskopie (NMR) Spektroskopische Methoden
 Kernmagnetische Resonanzspektroskopie (NMR) Spektroskopische Methoden Grundlagen Die meisten Atomkerne führen eine Drehbewegung um die eigene Achse aus ("Spin"). Da sie geladene Teilchen (Protonen) enthalten,
Kernmagnetische Resonanzspektroskopie (NMR) Spektroskopische Methoden Grundlagen Die meisten Atomkerne führen eine Drehbewegung um die eigene Achse aus ("Spin"). Da sie geladene Teilchen (Protonen) enthalten,
Aufgabe 1. Kein Spektrum zu dieser Aufgabe
 Aufgabe 1 Kein Spektrum zu dieser Aufgabe Übungen, Beispiel 1: Ermitteln Sie mit Hilfe des Inkrementenschemas für CH-, CH 2 - und CH 3 -Gruppen das Strichspektrum für Propionsäurechlorid! Es gibt kein
Aufgabe 1 Kein Spektrum zu dieser Aufgabe Übungen, Beispiel 1: Ermitteln Sie mit Hilfe des Inkrementenschemas für CH-, CH 2 - und CH 3 -Gruppen das Strichspektrum für Propionsäurechlorid! Es gibt kein
13 C, 1 H-Kopplungskonstanten. 13 C, 1 H-Kopplungen hier leichter erkannt werden können. Spektroskopie in der Organischen Chemie
 Spektroskopie in der Organischen hemie 13, 1 -Kopplungskonstanten NMR-Signalaufspaltungen aufgrund von skalaren Kopplungen treten grundsätzlich bei beiden Kopplungspartnern auf. Entsprechend kann man 13,
Spektroskopie in der Organischen hemie 13, 1 -Kopplungskonstanten NMR-Signalaufspaltungen aufgrund von skalaren Kopplungen treten grundsätzlich bei beiden Kopplungspartnern auf. Entsprechend kann man 13,
Spinsysteme. AX 3 -Spinsystem
 Spinsysteme Eine Gruppe aus zwei oder mehreren Kernspins, die miteinander eine magnetische Wechselwirkung eingehen, bezeichnet man als ein Spinsystem. Die Struktur eines hochaufgelösten NMR-Spektrums und
Spinsysteme Eine Gruppe aus zwei oder mehreren Kernspins, die miteinander eine magnetische Wechselwirkung eingehen, bezeichnet man als ein Spinsystem. Die Struktur eines hochaufgelösten NMR-Spektrums und
Spektroskopie-Seminar WS 17/18 5 NMR-Spektroskopie. H-NMR-Spektroskopie. nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie
 WS 17/18 1 -NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 1 5.1 1 -NMR-Spektroskopie NMR-Spektrum liefert folgende Informationen: Chemische Verschiebung δ(in
WS 17/18 1 -NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 1 5.1 1 -NMR-Spektroskopie NMR-Spektrum liefert folgende Informationen: Chemische Verschiebung δ(in
Spektroskopie in der Organischen Chemie. 1 H, 1 H-Kopplungskonstanten. Geminale Kopplungen
 Spektroskopie in der rganischen hemie Geminale Kopplungen 1, 1 -Kopplungskonstanten Wenn sich die beiden Kopplungspartner (wie Zwillinge; lat.: gemini) am gleichen Kohlenstoffatom befinden, also nur zwei
Spektroskopie in der rganischen hemie Geminale Kopplungen 1, 1 -Kopplungskonstanten Wenn sich die beiden Kopplungspartner (wie Zwillinge; lat.: gemini) am gleichen Kohlenstoffatom befinden, also nur zwei
Chemische und Magnetische Äquivalenz
 Chemische und Magnetische Äquivalenz Das Aussehen von NMR-Signalen in Mehr-Spinsystemen wird ganz wesentlich davon beeinflusst, ob es äquivalente Kerne gibt oder nicht. ierbei sind zwei wichtige Arten
Chemische und Magnetische Äquivalenz Das Aussehen von NMR-Signalen in Mehr-Spinsystemen wird ganz wesentlich davon beeinflusst, ob es äquivalente Kerne gibt oder nicht. ierbei sind zwei wichtige Arten
Übungen zur Spektroskopie 2
 Übungen zur Spektroskopie 2 C. Dubler und Dr. D. S. Stephenson Department Chemie, Universität München Sie finden diese Übungen und alte Klausuren (mit Lösung) auf unserer Homepage: http://cicum200.cup.unimuenchen.de/intranet/depch/analytik/nmr_f/index.php
Übungen zur Spektroskopie 2 C. Dubler und Dr. D. S. Stephenson Department Chemie, Universität München Sie finden diese Übungen und alte Klausuren (mit Lösung) auf unserer Homepage: http://cicum200.cup.unimuenchen.de/intranet/depch/analytik/nmr_f/index.php
4 Synthesen antiprionen-aktiver Verbindungen
 4 Synthesen antiprionen-aktiver Verbindungen Quinacrinanaloga (Grundstruktur C) 77 4 Synthesen antiprionen-aktiver Verbindungen 4.1 Synthesen der Quinacrinanaloga (Grundstruktur C) Die Synthesen der Quinacrinanaloga
4 Synthesen antiprionen-aktiver Verbindungen Quinacrinanaloga (Grundstruktur C) 77 4 Synthesen antiprionen-aktiver Verbindungen 4.1 Synthesen der Quinacrinanaloga (Grundstruktur C) Die Synthesen der Quinacrinanaloga
Spektroskopie-Seminar SS NMR-Spektroskopie. H-NMR-Spektroskopie. nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie
 1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 5.1 1 H-NMR-Spektroskopie NMR-Spektrum liefert folgende Informationen: Chemische Verschiebung d (in ppm):
1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 5.1 1 H-NMR-Spektroskopie NMR-Spektrum liefert folgende Informationen: Chemische Verschiebung d (in ppm):
Z 12 1) BESTIMMUNG DER SUMMENFORMEL: a. AUS DEN MASSENPROZENTEN
 ANALYTIK 1) BESTIMMUNG DER SUMMENFORMEL: a. AUS DEN MASSENPROZENTEN Ziel: Ermittlung einer Summenformel einer Substanz aus C, und O wenn die Massenprozent der Elemente und die Molmasse M r der Substanz
ANALYTIK 1) BESTIMMUNG DER SUMMENFORMEL: a. AUS DEN MASSENPROZENTEN Ziel: Ermittlung einer Summenformel einer Substanz aus C, und O wenn die Massenprozent der Elemente und die Molmasse M r der Substanz
7 Kernresonanz-Spektroskopische Untersuchungen
 7 Kernresonanz-Spektroskopische Untersuchungen 79 7 Kernresonanz-Spektroskopische Untersuchungen 7.1 1 H-MR-Signale Die 1 H-MR-Spektroskopie liefert aufgrund der charakteristischen chemischen Verschiebung
7 Kernresonanz-Spektroskopische Untersuchungen 79 7 Kernresonanz-Spektroskopische Untersuchungen 7.1 1 H-MR-Signale Die 1 H-MR-Spektroskopie liefert aufgrund der charakteristischen chemischen Verschiebung
NMR-Lösungsmittel. 1 H-NMR. Bei der Verwendung der normalen, nichtdeuterierten Lösungsmittel. Spektroskopie in der Organischen Chemie
 NMR-Lösungsmittel In der werden i.a. deuterierte Lösungsmittel verwendet. ie Substitution der leichten durch die schweren Wasserstoffatome hat zwei Vorteile: - euterium als Spin-1-Kern hat ebenfalls ein
NMR-Lösungsmittel In der werden i.a. deuterierte Lösungsmittel verwendet. ie Substitution der leichten durch die schweren Wasserstoffatome hat zwei Vorteile: - euterium als Spin-1-Kern hat ebenfalls ein
Der Kern-Overhauser-Effekt (Nuclear Overhauser Effect, NOE)
 Der Kern-verhauser-Effekt (Nuclear verhauser Effect, NE) Die Intensität eines 1 H-Signals kann durch ein Entkopplungsexperiment verändert werden. Wird der Übergang eines ausgewählten 1 H-Kerns S für eine
Der Kern-verhauser-Effekt (Nuclear verhauser Effect, NE) Die Intensität eines 1 H-Signals kann durch ein Entkopplungsexperiment verändert werden. Wird der Übergang eines ausgewählten 1 H-Kerns S für eine
Die Strukturabhängigkeit der chemischen Verschiebung
 Die Strukturabhängigkeit der chemischen Verschiebung. Abschirmung in einem Atom (wie bisher geschildert) Die Elektronenverteilung in einem Wasserstoffatom ist sphärisch. B 0 0 0000000 000000000 000000000
Die Strukturabhängigkeit der chemischen Verschiebung. Abschirmung in einem Atom (wie bisher geschildert) Die Elektronenverteilung in einem Wasserstoffatom ist sphärisch. B 0 0 0000000 000000000 000000000
Einführung in die NMR-Spektroskopie. NMR-Spektroskopie. Teil 1: Einführung und Grundlagen der 1 H NMR. Das NMR Spektrometer
 NMR-Spektroskopie Einführung in die NMR-Spektroskopie m I = - /2 (β) Teil : Einführung und Grundlagen der NMR E E. Physikalische und apparative Grundlagen m I = + /2 (α).2 Das D NMR Experiment.3 Die chemische
NMR-Spektroskopie Einführung in die NMR-Spektroskopie m I = - /2 (β) Teil : Einführung und Grundlagen der NMR E E. Physikalische und apparative Grundlagen m I = + /2 (α).2 Das D NMR Experiment.3 Die chemische
NMR Spektroskopie. Aufgaben
 hemische Verschiebung 1. Zeichnen Sie zu den nachfolgend aufgeführten Stoffen die Strukturformeln! Unterscheiden Sie dann zwischen chemisch äquvalenten und nichtäquivalenten Kernen. Bezeichnen Sie die
hemische Verschiebung 1. Zeichnen Sie zu den nachfolgend aufgeführten Stoffen die Strukturformeln! Unterscheiden Sie dann zwischen chemisch äquvalenten und nichtäquivalenten Kernen. Bezeichnen Sie die
Teil 2 NMR-Spektroskopie. Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17
 Teil 2 NMR-Spektroskopie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17 www.ruhr-uni-bochum.de/chirality 1 Rückblick Kerne haben magn. Moment, dass sich entlang der Magnetfeldlinien eines statischen
Teil 2 NMR-Spektroskopie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17 www.ruhr-uni-bochum.de/chirality 1 Rückblick Kerne haben magn. Moment, dass sich entlang der Magnetfeldlinien eines statischen
Teil 2 NMR-Spektroskopie. Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18
 Teil 2 NMR-Spektroskopie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18 www.ruhr-uni-bochum.de/chirality 1 Rückblick Kerne haben magn. Moment, dass sich entlang der Magnetfeldlinien eines statischen
Teil 2 NMR-Spektroskopie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18 www.ruhr-uni-bochum.de/chirality 1 Rückblick Kerne haben magn. Moment, dass sich entlang der Magnetfeldlinien eines statischen
NMR-Spektroskopie Teil 2
 BC 3.4 : Analytische Chemie I NMR Teil 2 NMR-Spektroskopie Teil 2 Stefanie Wolfram Stefanie.Wolfram.1@uni-jena.de Raum 228, TO Vom Spektrum zur Struktur 50000 40000 Peaks u. Integrale 30000 Chemische Verschiebung
BC 3.4 : Analytische Chemie I NMR Teil 2 NMR-Spektroskopie Teil 2 Stefanie Wolfram Stefanie.Wolfram.1@uni-jena.de Raum 228, TO Vom Spektrum zur Struktur 50000 40000 Peaks u. Integrale 30000 Chemische Verschiebung
M U S T E R L Ö S U N G
 Prof. Dr.. eiser Prof. Dr. A. Geyer achholklausur zur 3. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 2002 am Freitag, dem 2. August 2002 ame:...vorname:...
Prof. Dr.. eiser Prof. Dr. A. Geyer achholklausur zur 3. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 2002 am Freitag, dem 2. August 2002 ame:...vorname:...
NMR-Spektroskopie. Magnet. Steuerung. Probenrohr Spinner. Shimspulen. B -Spulen. Gradient 2. Vorverstärker
 NMR-Spektroskopie Magnet Steuerung He He CPU Frequenz Pulsform Pulsleistung Zeitkontrolle Temperierung Gradienten Shim/Lock/Gas Vorverstärker N N Probenrohr Spinner Shimspulen B -Spulen Gradient 2 H K
NMR-Spektroskopie Magnet Steuerung He He CPU Frequenz Pulsform Pulsleistung Zeitkontrolle Temperierung Gradienten Shim/Lock/Gas Vorverstärker N N Probenrohr Spinner Shimspulen B -Spulen Gradient 2 H K
Kernmagnetismus und Magnetfelder
 Kernmagnetismus und Magnetfelder. Kernspin Die meisten Kerne besitzen einen Eigendrehimpuls oder P ist gequantelt P = h I(I + ) h = h und h: das Plancksche Wirkungsquantum. π I: Kernspinquantenzahl (kurz:
Kernmagnetismus und Magnetfelder. Kernspin Die meisten Kerne besitzen einen Eigendrehimpuls oder P ist gequantelt P = h I(I + ) h = h und h: das Plancksche Wirkungsquantum. π I: Kernspinquantenzahl (kurz:
Übungsaufgaben NMR-Spektroskopie (1)
 Übungsaufgaben NMR-Spektroskopie (1) 1. Kerne haben drei wichtige Eigenschaften: Masse m, Ladung Q und Eigendrehimpuls p. Kernsorte Spin natürliche Häufigkeit Gyromagnet. Verhältnis γ [Tsec] 1 1 H 1/2
Übungsaufgaben NMR-Spektroskopie (1) 1. Kerne haben drei wichtige Eigenschaften: Masse m, Ladung Q und Eigendrehimpuls p. Kernsorte Spin natürliche Häufigkeit Gyromagnet. Verhältnis γ [Tsec] 1 1 H 1/2
Schriftliche Prüfung BSc Frühling 2006 D CHAB/BIOL. Musterlösung. für den Teil Spektroskopie
 Prüfungen Analytische Chemie Mittwoch, 8. März 2006 Schriftliche Prüfung BSc Frühling 2006 D CAB/BIL Musterlösung für den Teil Spektroskopie Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die
Prüfungen Analytische Chemie Mittwoch, 8. März 2006 Schriftliche Prüfung BSc Frühling 2006 D CAB/BIL Musterlösung für den Teil Spektroskopie Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die
2. Synthese der α,β-ungesättigten Kupplungskomponenten
 2. Synthese der α,β-ungesättigten Kupplungskomponenten 2.1. Allgemeine Anmerkungen Die für die intermolekularen eck-eaktionen benötigten Modellverbindungen sind Arylhalogenide mit unterschiedlicher Funktionalität
2. Synthese der α,β-ungesättigten Kupplungskomponenten 2.1. Allgemeine Anmerkungen Die für die intermolekularen eck-eaktionen benötigten Modellverbindungen sind Arylhalogenide mit unterschiedlicher Funktionalität
M U S T E R L Ö S U N G
 Prof. Dr.. Reiser Prof. Dr. A. Geyer 3. Klausur zum Praktikum rganische hemie I für Studierende der hemie und der Biochemie im SS 2002 am Dienstag, dem 16. Juli 2002 ame:... Vorname:... Matrikelnummer:...
Prof. Dr.. Reiser Prof. Dr. A. Geyer 3. Klausur zum Praktikum rganische hemie I für Studierende der hemie und der Biochemie im SS 2002 am Dienstag, dem 16. Juli 2002 ame:... Vorname:... Matrikelnummer:...
NMR-Spektroskopie Teil 2
 BC 3.4 : Analytische Chemie I NMR Teil 2 NMR-Spektroskopie Teil 2 Stefanie Wolfram Stefanie.Wolfram.1@uni-jena.de Raum 228, TO Vom Spektrum zur Struktur 50000 40000 Peaks u. Integrale 30000 Chemische Verschiebung
BC 3.4 : Analytische Chemie I NMR Teil 2 NMR-Spektroskopie Teil 2 Stefanie Wolfram Stefanie.Wolfram.1@uni-jena.de Raum 228, TO Vom Spektrum zur Struktur 50000 40000 Peaks u. Integrale 30000 Chemische Verschiebung
Aufgabe 1: (18 Punkte)
 Aufgabe 1: (18 Punkte) In der Arbeitsgruppe Hilt wurde folgende Reaktionssequenz durchgeführt: A H 10 H B O O O 1 1 2 2 + 10 3 3 4 4 Δ DA- Produkt 6-9 5 5 6-9 2 Ph Ph Co(dppe) 2 3 3 4 4 Im ersten Reaktionsschritt
Aufgabe 1: (18 Punkte) In der Arbeitsgruppe Hilt wurde folgende Reaktionssequenz durchgeführt: A H 10 H B O O O 1 1 2 2 + 10 3 3 4 4 Δ DA- Produkt 6-9 5 5 6-9 2 Ph Ph Co(dppe) 2 3 3 4 4 Im ersten Reaktionsschritt
Übungsaufgaben - Analytik
 Übungsaufgaben - Analytik Übung 1 Von einer Substanz soll der molare Extinktionskoeffizient bestimmt werden. Der Laborant hat mässig exakt verdünnt. Er hat jeweils die auf der x-achse angegbene Zahl an
Übungsaufgaben - Analytik Übung 1 Von einer Substanz soll der molare Extinktionskoeffizient bestimmt werden. Der Laborant hat mässig exakt verdünnt. Er hat jeweils die auf der x-achse angegbene Zahl an
Homonukleare Korrelationsspektroskopie (COSY)
 Homonukleare Korrelationsspektroskopie (COSY) Hier wird ähnlich wie bei HETCOR in beiden Dimensionen die chemische Verschiebung abgebildet. Im homonuklearen Fall ( 1 H, 1 H COSY) jedoch, ist es in beiden
Homonukleare Korrelationsspektroskopie (COSY) Hier wird ähnlich wie bei HETCOR in beiden Dimensionen die chemische Verschiebung abgebildet. Im homonuklearen Fall ( 1 H, 1 H COSY) jedoch, ist es in beiden
Spektroskopie in der Organischen Chemie. Spin-Entkopplung
 Spin-Entkopplung Spin-Spin-Kopplung zwischen nichtäquivalenten Kernen führt zur Aufspaltung der Signale der Kopplungspartner: im Falle größerer Spinsysteme können komplexe Multiplettsignale entstehen.
Spin-Entkopplung Spin-Spin-Kopplung zwischen nichtäquivalenten Kernen führt zur Aufspaltung der Signale der Kopplungspartner: im Falle größerer Spinsysteme können komplexe Multiplettsignale entstehen.
NMR - Seite 1. NMR (Kernresonanzspektroskopie) Allgemeines zur Theorie
 NMR - Seite 1 NMR (Kernresonanzspektroskopie) Allgemeines zur Theorie Protonen besitzen ebenso wie Elektronen einen eigenen Spin (Drehung um die eigene Achse).Allerdings gibt es mehrere Möglichkeiten als
NMR - Seite 1 NMR (Kernresonanzspektroskopie) Allgemeines zur Theorie Protonen besitzen ebenso wie Elektronen einen eigenen Spin (Drehung um die eigene Achse).Allerdings gibt es mehrere Möglichkeiten als
INADEQUATE 13 C, 13 C-COSY
 INADEQUATE 13 C, 13 C-COSY Die bisher diskutierten Korrelationsmethoden beruhen auf Protonen. Da das eigentliche Skelett eines organischen Moleküls das Kohlenstoffgerüst ist, wäre es in einigen Fällen
INADEQUATE 13 C, 13 C-COSY Die bisher diskutierten Korrelationsmethoden beruhen auf Protonen. Da das eigentliche Skelett eines organischen Moleküls das Kohlenstoffgerüst ist, wäre es in einigen Fällen
Schriftliche Prüfung BSc Frühling 2014
 Prüfungen Analytische Chemie Samstag, 1. Februar 2014 Schriftliche Prüfung BSc Frühling 2014 D CHAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Samstag, 1. Februar 2014 Schriftliche Prüfung BSc Frühling 2014 D CHAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Schriftliche Prüfung BSc Herbst 2007 D CHAB/BIOL. Musterlösung. für den Teil Spektroskopie
 Prüfungen Analytische Chemie Montag, 3. September 2007 Schriftliche Prüfung BSc Herbst 2007 D CHAB/BIOL Musterlösung für den Teil Spektroskopie Vorname:... Name:... Jede Aufgabe wird separat bewertet.
Prüfungen Analytische Chemie Montag, 3. September 2007 Schriftliche Prüfung BSc Herbst 2007 D CHAB/BIOL Musterlösung für den Teil Spektroskopie Vorname:... Name:... Jede Aufgabe wird separat bewertet.
Schriftliche Prüfung BSc Frühling 2006
 Prüfungen Analytische Chemie Mittwoch, 8. März 2006 Schriftliche Prüfung BSc Frühling 2006 D CAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt 36.
Prüfungen Analytische Chemie Mittwoch, 8. März 2006 Schriftliche Prüfung BSc Frühling 2006 D CAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt 36.
Studiengang Chemie Gruppen Nr. : 2 OCP II Übung Nr. : 2. Jael Bürki. NMR-Kurs OCP II Beginn: Ende: Abgabe:
 Studiengang Chemie Gruppen Nr. : 2 OCP II Übung Nr. : 2 Verfasser: Dozent: Michael Ott Jael Bürki Dr. Stefan Höck NMR-Kurs OCP II Beginn: 23.02.13 Ende: 09.04.13 Abgabe: 09.04.13 Inhaltsverzeichnis 1 Aufgabenstellung...
Studiengang Chemie Gruppen Nr. : 2 OCP II Übung Nr. : 2 Verfasser: Dozent: Michael Ott Jael Bürki Dr. Stefan Höck NMR-Kurs OCP II Beginn: 23.02.13 Ende: 09.04.13 Abgabe: 09.04.13 Inhaltsverzeichnis 1 Aufgabenstellung...
Chemisches Grundpraktikum II (270002) Kernresonanzspektroskopie. NMR-Spektroskopie
 hemisches Grundpraktikum II (270002) Kernresonanzspektroskopie NMR-Spektroskopie (Nuclear Magnetic Resonance). Kählig, SS 2010 Von der Substanz zur Struktur Substanz NMR - Spektren Struktur N N 1 Spektroskopie
hemisches Grundpraktikum II (270002) Kernresonanzspektroskopie NMR-Spektroskopie (Nuclear Magnetic Resonance). Kählig, SS 2010 Von der Substanz zur Struktur Substanz NMR - Spektren Struktur N N 1 Spektroskopie
Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Winter 2011/2012 BSc D-CHAB/BIOL
 Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Winter 2011/2012 BSc D-CHAB/BIOL Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich
Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Winter 2011/2012 BSc D-CHAB/BIOL Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich
 hemie-protokoll 11.11.02, Seite 1 von 5 Lukman Iwan, 12.11.02 Stundenprotokoll vom Montag, 11. ovember 2002 Es fehlen: Janine und Jeannette Zettel 1&2: Aromatische eterocyclen http://www.oci.unizh.ch/edu/lectures/material/a_bii/kap6/kap6.html
hemie-protokoll 11.11.02, Seite 1 von 5 Lukman Iwan, 12.11.02 Stundenprotokoll vom Montag, 11. ovember 2002 Es fehlen: Janine und Jeannette Zettel 1&2: Aromatische eterocyclen http://www.oci.unizh.ch/edu/lectures/material/a_bii/kap6/kap6.html
NMR Spektroskopie (Nuclear Magnetic Resonance Kern-Magnetische Resonanz)
 NMR Spektroskopie (Nuclear Magnetic Resonance Kern-Magnetische Resonanz) Viele Atomkerne besitzen einen von Null verschiedenen Eigendrehimpuls (Spin) p = ħ I, der ganz - oder halbzahlige Werte von ħ betragen
NMR Spektroskopie (Nuclear Magnetic Resonance Kern-Magnetische Resonanz) Viele Atomkerne besitzen einen von Null verschiedenen Eigendrehimpuls (Spin) p = ħ I, der ganz - oder halbzahlige Werte von ħ betragen
Schriftliche Prüfung BSc Herbst 2010
 Prüfungen Analytische Chemie Dienstag, 24. August 2010 Schriftliche Prüfung BSc Herbst 2010 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Dienstag, 24. August 2010 Schriftliche Prüfung BSc Herbst 2010 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
M U S T E R L Ö S U N G
 Prof. Dr. B. König Prof. Dr.. Geyer 3. Klausur zum Praktikum rganische hemie I für Studierende der hemie und der Biochemie im SS 2001 am Donnerstag, dem 26. Juli 2001 M U S T E R L Ö S U G ame:...vorname:...
Prof. Dr. B. König Prof. Dr.. Geyer 3. Klausur zum Praktikum rganische hemie I für Studierende der hemie und der Biochemie im SS 2001 am Donnerstag, dem 26. Juli 2001 M U S T E R L Ö S U G ame:...vorname:...
Analytische Methoden in Org. Chemie und optische Eigenschaften von chiralen Molekülen
 Analytische Methoden in Org. Chemie und optische Eigenschaften von chiralen Molekülen Seminar 5. 0. 200 Teil : NMR Spektroskopie. Einführung und Physikalische Grundlagen.2 H NMR Parameter: a) Chemische
Analytische Methoden in Org. Chemie und optische Eigenschaften von chiralen Molekülen Seminar 5. 0. 200 Teil : NMR Spektroskopie. Einführung und Physikalische Grundlagen.2 H NMR Parameter: a) Chemische
6. Carbonyl-Verbindungen
 6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2004
 Prüfungen Analytische Chemie Dienstag, 1. September 4 Schriftliche Prüfung. Vordiplom / BSc erbst 4 D CAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Dienstag, 1. September 4 Schriftliche Prüfung. Vordiplom / BSc erbst 4 D CAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Die Anwendung der Kernmagnetischen Resonanz (NMR) Spektroskopie zur Strukturaufklärung
 Die Anwendung der Kernmagnetischen Resonanz (NMR) Spektroskopie zur Strukturaufklärung - eine kurze Einführung im Rahmen des C Grundpraktikums - Prof. Dr. Reinhard Meusinger Leiter der NMR Abteilung am
Die Anwendung der Kernmagnetischen Resonanz (NMR) Spektroskopie zur Strukturaufklärung - eine kurze Einführung im Rahmen des C Grundpraktikums - Prof. Dr. Reinhard Meusinger Leiter der NMR Abteilung am
Dynamische Prozesse Chemischer Austausch
 Dynamische Prozesse Chemischer Austausch Weil die Messfrequenz der Kernresonanz (100 bis 900 MHz, also ca. 10 8 bis 10 9 s -1 ) in einem Frequenzbereich liegt, in dem auch viele Molekülbewegungen (Moleküldynamik)
Dynamische Prozesse Chemischer Austausch Weil die Messfrequenz der Kernresonanz (100 bis 900 MHz, also ca. 10 8 bis 10 9 s -1 ) in einem Frequenzbereich liegt, in dem auch viele Molekülbewegungen (Moleküldynamik)
2. Elektroneneffekte in den organischen Molekülen
 2. Elektroneneffekte in den organischen Molekülen Induktive und mesomere Effekte Die Ladungsverteilung in einer Kohlenwasserstoffkette wird durch Substituenten (Halogen, OH, NH 2 usw.) beeinflusst. Man
2. Elektroneneffekte in den organischen Molekülen Induktive und mesomere Effekte Die Ladungsverteilung in einer Kohlenwasserstoffkette wird durch Substituenten (Halogen, OH, NH 2 usw.) beeinflusst. Man
NMR-Spektroskopie an Peptiden. Peptide. Worum soll es heute gehen? Peptide. 2D-NMR-Spektroskopie. Seminar AG Rademann
 2/52 Seminar AG Rademann 3.11.2005 Worum soll es heute gehen? 2D-NMR-Spektroskopie Sequenzspezifische Zuordnung Bestimmung der 3D-Struktur 3/52 4/52 Die Primärstruktur 5/52 6/52 20 natürliche Aminosäuren
2/52 Seminar AG Rademann 3.11.2005 Worum soll es heute gehen? 2D-NMR-Spektroskopie Sequenzspezifische Zuordnung Bestimmung der 3D-Struktur 3/52 4/52 Die Primärstruktur 5/52 6/52 20 natürliche Aminosäuren
Spinsysteme und skalare Kopplung
 Spinsysteme und skalare Kopplung Ein Spin-1/2-Kern X ( 1 oder 13 C) kann zwei Energieniveaus mit einem gegebenen Energieunterschied ΔE besetzen (Grundzustand 1/2 bzw. α und angeregter Zustand +1/2 bzw.
Spinsysteme und skalare Kopplung Ein Spin-1/2-Kern X ( 1 oder 13 C) kann zwei Energieniveaus mit einem gegebenen Energieunterschied ΔE besetzen (Grundzustand 1/2 bzw. α und angeregter Zustand +1/2 bzw.
Seminar WiSe 2015/2016. PD Dr. Markus Nett. Leibniz Institut für Naturstoff Forschung und Infektionsbiologie E mail: jena.
 Kernresonanzspektroskopie Seminar WiSe 2015/2016 PD Dr. Markus Nett Nachwuchsgruppenleiter Leibniz Institut für Naturstoff Forschung und Infektionsbiologie E mail: markus.nett@hki jena.de NMR = nuclear
Kernresonanzspektroskopie Seminar WiSe 2015/2016 PD Dr. Markus Nett Nachwuchsgruppenleiter Leibniz Institut für Naturstoff Forschung und Infektionsbiologie E mail: markus.nett@hki jena.de NMR = nuclear
5 Die Photolyse von Methyl-Semiquadratsäureamid
 44 5 Die Photolyse von Methyl-Semiquadratsäureamid 5 Die Photolyse von Methyl-Semiquadratsäureamid 5.1 Vorbemerkungen: Methylsemiquadratsäureamid (53) unterscheidet sich von Semiquadratsäureamid (48) nur
44 5 Die Photolyse von Methyl-Semiquadratsäureamid 5 Die Photolyse von Methyl-Semiquadratsäureamid 5.1 Vorbemerkungen: Methylsemiquadratsäureamid (53) unterscheidet sich von Semiquadratsäureamid (48) nur
Chemie für Biologen, 2017
 Chemie für Biologen, 2017 Übung 10 Stereochemie (Thema 11.1 11.4) Aufgabe 1: a) Zeichnen Sie den Isomeren-Stammbaum auf. b) Erklären Sie folgende Isomerie-Arten: i) Konstitutionsisomere Konstitutionsisomere
Chemie für Biologen, 2017 Übung 10 Stereochemie (Thema 11.1 11.4) Aufgabe 1: a) Zeichnen Sie den Isomeren-Stammbaum auf. b) Erklären Sie folgende Isomerie-Arten: i) Konstitutionsisomere Konstitutionsisomere
6 NMR-Charakterisierung der Einzelkomponenten aus der Nanokapsel-Synthese
 6 NM-harakterisierung der Einzelkomponenten aus der Nanokapsel-Synthese 6 NM-harakterisierung der Einzelkomponenten aus der Nanokapsel-Synthese 6.1 Miglyol 812 6.1.1 Zuordnung der Kohlenstoff-NM-esonanzlinien
6 NM-harakterisierung der Einzelkomponenten aus der Nanokapsel-Synthese 6 NM-harakterisierung der Einzelkomponenten aus der Nanokapsel-Synthese 6.1 Miglyol 812 6.1.1 Zuordnung der Kohlenstoff-NM-esonanzlinien
Klausur OC1 (BA-Studiengang) PIN: :00 16:00 Uhr N10. Name: Punkte: Matrikel Nr. Note:
 Klausur OC1 (BA-Studiengang) PIN: 10.02.2011 13:00 16:00 Uhr N10 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7 52-50=3.0 49-48=3.3
Klausur OC1 (BA-Studiengang) PIN: 10.02.2011 13:00 16:00 Uhr N10 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7 52-50=3.0 49-48=3.3
NMR Spektroskopie. 1nm Frequenz X-ray UV/VIS Infrared Microwave Radio
 NMR Spektroskopie 1nm 10 10 2 10 3 10 4 10 5 10 6 10 7 Frequenz X-ray UV/VIS Infrared Microwave Radio Anregungsmodus electronic Vibration Rotation Nuclear Spektroskopie X-ray UV/VIS Infrared/Raman NMR
NMR Spektroskopie 1nm 10 10 2 10 3 10 4 10 5 10 6 10 7 Frequenz X-ray UV/VIS Infrared Microwave Radio Anregungsmodus electronic Vibration Rotation Nuclear Spektroskopie X-ray UV/VIS Infrared/Raman NMR
Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2004 D CHAB/BIOL. Musterlösung
 Prüfungen Analytische Chemie Dienstag, 21. September 4 Schriftliche Prüfung 2. Vordiplom / BSc erbst 4 D CAB/BIL Musterlösung Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Prüfungen Analytische Chemie Dienstag, 21. September 4 Schriftliche Prüfung 2. Vordiplom / BSc erbst 4 D CAB/BIL Musterlösung Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Sommer 2011 BSc D-CHAB/BIOL
 Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Sommer 2011 BSc D-CHAB/BIOL Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre
Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Sommer 2011 BSc D-CHAB/BIOL Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre
Schriftliche Prüfung BSc Frühling 2008 D CHAB/BIOL. Musterlösung. für den Teil Spektroskopie
 Prüfungen Analytische Chemie Samstag, 9. Februar 2008 Schriftliche Prüfung BSc Frühling 2008 D CHAB/BIL Musterlösung für den Teil Spektroskopie Vorname:... Name:... Jede Aufgabe wird separat bewertet.
Prüfungen Analytische Chemie Samstag, 9. Februar 2008 Schriftliche Prüfung BSc Frühling 2008 D CHAB/BIL Musterlösung für den Teil Spektroskopie Vorname:... Name:... Jede Aufgabe wird separat bewertet.
Schriftliche Prüfungen Smesterkurs Analytische Chemie I Instrumentalanalyse organischer Vebindungen Sommer 2011
 Schriftliche Prüfungen Smesterkurs Analytische Chemie I Instrumentalanalyse organischer Vebindungen Sommer 2011 Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120
Schriftliche Prüfungen Smesterkurs Analytische Chemie I Instrumentalanalyse organischer Vebindungen Sommer 2011 Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120
NMR Spektroskopie I = 0 : C, 16 O (sogenannte gg-kerne haben immer I=0!) I = 1/2: 1 H, 13 C, 15 N, 19 F, 31 P,... I = 1: 2. H=D, 6 Li, 14 N I = 3/2: 7
 NMR Spektroskopie folie00 Viele Atomkerne besitzen einen von Null verschiedenen Eigendrehimpuls (Spin) p=ħ I, der ganz oder halbzahlige Werte von ħ betragen kann. I bezeichnet die Kernspin-Quantenzahl.
NMR Spektroskopie folie00 Viele Atomkerne besitzen einen von Null verschiedenen Eigendrehimpuls (Spin) p=ħ I, der ganz oder halbzahlige Werte von ħ betragen kann. I bezeichnet die Kernspin-Quantenzahl.
Schriftliche Prüfung Analytische Chemie I&II Winter 2012/2013
 Schriftliche Prüfung Analytische Chemie I&II Winter 2012/2013 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre Zeit gut ein.
Schriftliche Prüfung Analytische Chemie I&II Winter 2012/2013 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre Zeit gut ein.
Schriftliche Prüfung BSc Herbst 2007
 Prüfungen Analytische Chemie Montag, 3. September 2007 Schriftliche Prüfung BSc Herbst 2007 D CHAB/BIOL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Montag, 3. September 2007 Schriftliche Prüfung BSc Herbst 2007 D CHAB/BIOL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2006
 Prüfungen Analytische Chemie Mittwoch, 27. September 2006 Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2006 D CHAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Prüfungen Analytische Chemie Mittwoch, 27. September 2006 Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2006 D CHAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
IR-Spektroskopie Seminar Analytische Chemie I (BC3.4, MCB B1; WS2016/17) Dr. Peter Bellstedt NMR Plattform IAAC & IOMC
 IR-Spektroskopie Seminar Analytische Chemie I (BC3.4, MCB B1; WS2016/17) Dr. Peter Bellstedt NMR Plattform IAAC & IOMC Peter.Bellstedt@uni-jena.de Terminübersicht (14 täg.) Gruppe 1 Gruppe 2 1. Seminar
IR-Spektroskopie Seminar Analytische Chemie I (BC3.4, MCB B1; WS2016/17) Dr. Peter Bellstedt NMR Plattform IAAC & IOMC Peter.Bellstedt@uni-jena.de Terminübersicht (14 täg.) Gruppe 1 Gruppe 2 1. Seminar
Teil 2: Spin-Spin Kopplung
 NMR-Spektroskopie Teil 2: Spin-Spin Kopplung 1. Die skalare Spin-Spin Kopplung 2. Multiplizitaet und Intensitaetsverteilung 3. Geminale, vicinale und allylische Kopplungskonstanten 4. Anschauliche Beschreibung
NMR-Spektroskopie Teil 2: Spin-Spin Kopplung 1. Die skalare Spin-Spin Kopplung 2. Multiplizitaet und Intensitaetsverteilung 3. Geminale, vicinale und allylische Kopplungskonstanten 4. Anschauliche Beschreibung
Schreiben Sie Ihre ö AUSSCHLIEßLICH!!! auf. die leeren Seiten 5 8!
 1. Ermitteln Sie die Konstitution der Verbindung aus MQ, Protonen und protonenbreitbandentkoppeltem Kohlenstoffspektrum. a. Ermitteln Sie alle chemischen Verschiebungen ( 1 und 13 ) und Kopplungskonstanten
1. Ermitteln Sie die Konstitution der Verbindung aus MQ, Protonen und protonenbreitbandentkoppeltem Kohlenstoffspektrum. a. Ermitteln Sie alle chemischen Verschiebungen ( 1 und 13 ) und Kopplungskonstanten
Stereochemische Einflüsse Topizität
 Stereochemische Einflüsse Topizität Lage und Form von NMR-Signalen werden nicht nur durch die unmittelbare chemische Umgebung der betreffenden Kerne, also durch die Konstitution, beeinflusst, sondern auch
Stereochemische Einflüsse Topizität Lage und Form von NMR-Signalen werden nicht nur durch die unmittelbare chemische Umgebung der betreffenden Kerne, also durch die Konstitution, beeinflusst, sondern auch
Multipuls-NMR in der Organischen Chemie. 1 H, 1 H, 1 H Relayed-COSY und TOCSY
 1 H, 1 H, 1 H Relayed-COSY und TOCSY Das 1 H, 1 H, 1 H-Relay-COSY-Experiment gehört historisch zu den älteren und wurde später durch das weit überlegene TOCSY-Experiment ersetzt. Dennoch sei es hier kurz
1 H, 1 H, 1 H Relayed-COSY und TOCSY Das 1 H, 1 H, 1 H-Relay-COSY-Experiment gehört historisch zu den älteren und wurde später durch das weit überlegene TOCSY-Experiment ersetzt. Dennoch sei es hier kurz
Lineares Gleichungssystem - Vertiefung
 Lineares Gleichungssystem - Vertiefung Die Lösung Linearer Gleichungssysteme ist das "Gauß'sche Eliminationsverfahren" gut geeignet - schon erklärt unter Z02. Alternativ kann mit einem Matrixformalismus
Lineares Gleichungssystem - Vertiefung Die Lösung Linearer Gleichungssysteme ist das "Gauß'sche Eliminationsverfahren" gut geeignet - schon erklärt unter Z02. Alternativ kann mit einem Matrixformalismus
Spektroskopie-Seminar SS NMR-Spektroskopie. C-NMR-Spektroskopie und 2D-Spektroskopie
 13 C-NMR-Spektroskopie und 2D-Spektroskopie 6.1 Allgemeines Kernresonanz: Wechselwirkungen zwischen dem magnetischen Moment von Atomkernen mit einem magnetischen Wechselfeld Nur solche Isotope können untersucht
13 C-NMR-Spektroskopie und 2D-Spektroskopie 6.1 Allgemeines Kernresonanz: Wechselwirkungen zwischen dem magnetischen Moment von Atomkernen mit einem magnetischen Wechselfeld Nur solche Isotope können untersucht
Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen.
 1 Lösung 5 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Falls Sie Fragen zur Vorlesung/Übung/generellen Konzepten haben schreiben
1 Lösung 5 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Falls Sie Fragen zur Vorlesung/Übung/generellen Konzepten haben schreiben
Fragen zum Thema funktionelle Gruppen Alkohol und Phenol
 1. Was sind Derivate? 2. Was sind Substituenten? 3. Wann werden neu angehängte Atome oder Gruppen als Substituent bezeichnet? 4. Warum sind Substituenten so wichtig für organische Verbindungen? Alkohol
1. Was sind Derivate? 2. Was sind Substituenten? 3. Wann werden neu angehängte Atome oder Gruppen als Substituent bezeichnet? 4. Warum sind Substituenten so wichtig für organische Verbindungen? Alkohol
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Bereich der 1 H-chemischen Verschiebung (Abb. nach: Friebolin)
 Bereich der 1 -chemischen Verschiebung (Abb. nach: Friebolin) 1 -NM-Spektroskopie 1 Der esonanzbereich der Protonen in organischen Molekülen ist ca. 10 ppm breit. Nur saure Protonen (z.b. COO oder SO 3
Bereich der 1 -chemischen Verschiebung (Abb. nach: Friebolin) 1 -NM-Spektroskopie 1 Der esonanzbereich der Protonen in organischen Molekülen ist ca. 10 ppm breit. Nur saure Protonen (z.b. COO oder SO 3
Schriftliche Prüfung S Analytische Chemie I Sommer 2015
 Schriftliche Prüfung 529-0051- 00S Analytische Chemie I Sommer 2015 Vorname: Name: Legi-Nr.: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen Sie sich Ihre Zeit gut
Schriftliche Prüfung 529-0051- 00S Analytische Chemie I Sommer 2015 Vorname: Name: Legi-Nr.: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen Sie sich Ihre Zeit gut
Infrarot Spektroskopie organischer Verbindungen
 Infrarot Spektroskopie organischer Verbindungen Praktikum (B.C. 3.4) Lehrstuhl für Instrumentelle Analytik Michael Deicke Michael.Deicke@uni-jena.de Ziele des Praktikums IR-Spektren organischer Verbindungen
Infrarot Spektroskopie organischer Verbindungen Praktikum (B.C. 3.4) Lehrstuhl für Instrumentelle Analytik Michael Deicke Michael.Deicke@uni-jena.de Ziele des Praktikums IR-Spektren organischer Verbindungen
Teil 3 2D-NMR-Spektroskopie. Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17
 Teil 3 2D-NMR-Spektroskopie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17 www.ruhr-uni-bochum.de/chirality 1 Protonen-Protonen-Korrelation durch J-Kopplung Pulssequenz für ein klassisches 1D- 1 H-NMR
Teil 3 2D-NMR-Spektroskopie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17 www.ruhr-uni-bochum.de/chirality 1 Protonen-Protonen-Korrelation durch J-Kopplung Pulssequenz für ein klassisches 1D- 1 H-NMR
