Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen.
|
|
|
- Alexa Gerber
- vor 5 Jahren
- Abrufe
Transkript
1 1 Lösung 5 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Falls Sie Fragen zur Vorlesung/Übung/generellen Konzepten haben schreiben Sie diese auf die Übungen, so dass ihre Assistenten die Fragen für die nächste Übungsstunde vorbereiten können. 5.1 Säuren und Basen a) Ordnen Sie folgende Carbonsäuren nach ihrer Säurestärke und begründen Sie Ihre Antwort. Schätzen Sie die pks Werte der Verbindungen. Essigsäure: pka = Fluoropropanansäure = ca Fluoroessigsäure: pka = 2.59 Trifluoroessigsäure: pka = 0.23 Der induktive Effekt beschreibt den elektrostatischen Einfluss eines kovalent gebunden Substituenten (hier Fluor) auf die Änderung der Ladungsverteilung in einem Molekül. Substituenten mit einer hohen Elektronegativität oder einer positiven Ladunge ziehen besonders stark Elektronen an. Trifluoroessigsäure hat den grössten induktiven Effekt mit 3 Fluor in α-position und ist daher die stärkste Säure. Der induktive Effekt hängt stark vom Abstand der benachbarten funktionellen Gruppen ab. Daher ist Fluoroessigsäure die stärkere Säure verglichen mit 3-Fluoropropansäure, welches das Fluor in der β-position hat. b) Welche der folgenden zwei Verbindungen ist die stärkere Säure? Begründen Sie ihre Antwort.
2 2 Lösung 5 AC/OC I, HS Methyloxonium ist positiv geladen, was energetisch sehr ungüstig ist. (Die positive Ladung ist auf einem elektronegativen Atom!) - Methanol ist keine starke Säure (pks = 15.5). Durch das deprotonieren von Methanol entsteht das entsprechende Methanolate (konjugierte Base) welches eine nicht resonanzstabilisierte negative Ladung trägt. Dies ist wiederum energetisch sehr ungünstig. c) Vergleichen Sie die Acidität der markierten Protonen und entscheiden Sie welches acider ist. Begründen Sie ihre Wahl. Der grosse Unterschied in der Acidität der Protonen liegt in der geometrischen Andordnung des entstehenden, nichtbindenden Elektronenpaars. Im Fall von Proton A (rot) befinden sich die Elektronen in einem p-orbital, welches parallel zu den p-oribtalen der Carbonylgruppe orientiert ist (diese parallele Anordnung ermöglicht Resonanzstabilisierung mit der Carbonylgruppe). Im Gegensatz dazu befinden sich die nichtbindenden Elektronen im Fall B (grün) in einem sp 2 -Hybridorbital senkrecht zur p-ebene der Carbonylgruppe, womit keine Resonanzstabilisierung möglich ist.
3 3 Lösung 5 AC/OC I, HS 2017 d) Zeichnen Sie in das Energiediagramm die Orbitale, welche für die Brønsteg-Säure- Base Reaktion zwischen Wasser (H2O: Lewis Base) und Chlorwasserstoff (HCl: Lewis Säure) relevant sind. Säure-Base Reaktion: Aus Übung 2 kennen wir die Moleküorbitale von H2O. Der Sauerstoff ist sp 3 hypridisiert. HOMO LUMO In einem Molekül stehen verschiedene Molekülorbitale zur Verfügung, die von den vorhandenen Elektronen besetzt werden. Für eine Reaktion zwischen zwei Reaktionspartner sind zwei Orbitale relevant: Das HOMO (Highest Occupied Molecular Orbital) ist das energiereichste besetzte Orbital und das LUMO (Lowest Unoccupied Molecular Orbital). In der Säure-Base Reaktion sind das HOMO der Base (H2O) und das LUMO der Säure (HCl) relevant. Generell gilt: Umso kleiner die Energiedifferenz zwischen HOMO und LUMO, desto grosser ist die Energiegewinn der Reaktion. Die Bindung wir zwischen dem freien Elektronenpaar des H2O-Moleküls (HOMO) und dem LUMO des HCl- Moleküls ausgebildet. LUMO HOMO
4 4 Lösung 5 AC/OC I, HS 2017 e) Welches ist das acideste Proton in den unten gezeigten Molekülen? Welche Verbindung von beiden ist die stärkere Säure? Begründen Sie mit Hilfe von Resonanzstrukturen. Beide deprotonierten Moleküle haben je drei Grenzstrukturen. Das linke Molekül (5-Imino- 1,5-dihydro-2H-pyrrol-2-on) hat allerdings eine Resonanzstruktur, bei dem die negative Ladung auf dem elektronegativen Sauerstoff liegt, während die negative Ladung beim rechten Molekül (5-Methylene-1,5-dihydro-2H-pyrrol-2-imine) auf dem weniger elektronegativen Kohlenstoff liegt. Deshalb ist die negative Ladung beim linken Molekül besser stabilisiert (delokalisiert) und dieses somit sauer. Der pka von Pyrrolen liegt im Bereich von 20. f) Schätzen Sie die pks-werte der folgenden Verbindungen ab. Begründen Sie Ihre Antwort.
5 5 Lösung 5 AC/OC I, HS 2017 pks-werte in H2O von Methansulfonsäure: -2.6; Malonsäuredimethylester: 13. Die Methansulfonsäure kann ihre negative Ladung über drei Sauerstoffatome und einem Schwefelatom stabilisieren und ist daher die stärkste Säure. Die α-protonen im Malonsäuredimethylester sind aufgrund der Stabilisierung der negativen Ladung über zwei Sauerstoffatome und einem Kohlenstoffatom sauer. g) Ordnen Sie folgende Verbindungen nach ihrer Säurestärke und begründen Sie Ihre Antwort. i)
6 6 Lösung 5 AC/OC I, HS 2017 Das Ethylammoniumsalz ist die stärkste Säure, weil die konjugierte Base keine Ladung trägt und daher am stabilsten ist. Die konjugierte Base von Methanol, das Methanolat, trägt eine negative Ladung auf dem elektronegativen Sauerstoffatom und ist deshalb stabiler als die konjugierte Base von Methan, ein Carbanion, welche die negative Ladung auf dem Kohlenstoffatom trägt. ii)
7 7 Lösung 5 AC/OC I, HS Nitrophenol ist die stärkste Säure, weil die konjugierte Base über die moisten Resonanzstrukturen verfügt und daher stabiler ist ald die konjugierte Base von 3- Nitrophenol. 3-Nitrophenol und Phenol verfügen über die gleiche Anzahl von Resonazstrukturen. 3-Nitrophenol ist die stärkere Säure, weil die elektronenziehende Nitrogruppe in 3-Nitrophenol einen negative induktiven Effekt ausübt und somit die negative Ladung der konjugierten Base stabilisieren kann. Phenol: pks-wert (DMSO) = 18.0; 4-Nitrophenol: pks-wert (DMSO) = 10.8; 3-Nitrophenol: pks-wert (DMSO) = Fischer-Projektion Überführen Sie die Keilstrichformeln in Fischer-Projektionen und umgekehrt.
8 8 Lösung 5 AC/OC I, HS Reaktivität Wieso sind Amide stabiler als Ester gegenüber Wasser?
9 9 Lösung 5 AC/OC I, HS 2017 Amide sind unreaktiver als Ester. Die positive Ladung wird auf dem elektronegativeren Sauerstoff (Ester) schlechter stabilisiert als auf dem weniger elektronegativeren Stickstoff (Amide). Deshalb sind Amide besser resonanzstabilisiert. Zusatzinformation: Zusätzlich sind Amine schlechtere Abgansgruppen als Alkohole. Dies ist auf die Stabilität der Abgangsgruppe zurückzuführen (konjugierte Base).
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) OH H + - H 2 O. (aus H 3 PO 4 H 2 SO 4 ) - H + Stichpunkte zum E1-Mechanismus:
 Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen.
 1 Lösung 3 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Zum Nachlesen/Vertiefen des Vorlesungsstoffs von heute siehe Maitland
1 Lösung 3 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Zum Nachlesen/Vertiefen des Vorlesungsstoffs von heute siehe Maitland
2-01. Das Ethen-Molekül. Perspektivische Darstellung des Ethen-Moleküls.
 Das Ethen-Molekül 2-01 Perspektivische Darstellung des Ethen-Moleküls. Rot: Sigma-Bindungen σ mit je zwei Bindungselektronen Blau: pz-orbitale mit je einem Elektron Die C-Atome sind sp 2 -hybridisiert,
Das Ethen-Molekül 2-01 Perspektivische Darstellung des Ethen-Moleküls. Rot: Sigma-Bindungen σ mit je zwei Bindungselektronen Blau: pz-orbitale mit je einem Elektron Die C-Atome sind sp 2 -hybridisiert,
Organische Chemie. Kapitel 1. Organic Chemistry 4 th Edition Paula Yurkanis Bruice. Organische Verbindungen enthalten Kohlenstoff
 rganic Chemistry 4 th Edition Paula Yurkanis Bruice Kapitel 1 Elektronische Struktur und Bindung Säuren und Basen rganische Chemie rganische Verbindungen enthalten Kohlenstoff Kohlenstoff ist weder ein
rganic Chemistry 4 th Edition Paula Yurkanis Bruice Kapitel 1 Elektronische Struktur und Bindung Säuren und Basen rganische Chemie rganische Verbindungen enthalten Kohlenstoff Kohlenstoff ist weder ein
Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen.
 1 Übung 13 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Ms: Mesyl-Gruppe (CH 3 SO 3 -), Tf: Triflyl-Gruppe (CF 3 SO 3 -), Ts:
1 Übung 13 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Ms: Mesyl-Gruppe (CH 3 SO 3 -), Tf: Triflyl-Gruppe (CF 3 SO 3 -), Ts:
2. Elektroneneffekte in den organischen Molekülen
 2. Elektroneneffekte in den organischen Molekülen Induktive und mesomere Effekte Die Ladungsverteilung in einer Kohlenwasserstoffkette wird durch Substituenten (Halogen, OH, NH 2 usw.) beeinflusst. Man
2. Elektroneneffekte in den organischen Molekülen Induktive und mesomere Effekte Die Ladungsverteilung in einer Kohlenwasserstoffkette wird durch Substituenten (Halogen, OH, NH 2 usw.) beeinflusst. Man
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
1.1 Darstellung organischer Verbindungen
 1 Lösung 1 AC/OC I, HS 2017 1.1 Darstellung organischer Verbindungen Organische Verbindungen können auf verschiedene Weise dargestellt werden. Ergänzen Sie die untenstehenden Beispiele von Harnstoff, Ethylenglykol
1 Lösung 1 AC/OC I, HS 2017 1.1 Darstellung organischer Verbindungen Organische Verbindungen können auf verschiedene Weise dargestellt werden. Ergänzen Sie die untenstehenden Beispiele von Harnstoff, Ethylenglykol
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 5, 17./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 5, 17./18.05.11 Wiederholung: Säurestärke organischer Verbindungen 1. a) Wovon hängt die Säurestärke einer organischen
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 5, 17./18.05.11 Wiederholung: Säurestärke organischer Verbindungen 1. a) Wovon hängt die Säurestärke einer organischen
a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten!
 Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
6. Carbonyl-Verbindungen
 6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
Basisprüfung Allgemeine Chemie (Teil OC) Montag, 3. September 2007
 Basisprüfung Allgemeine Chemie (Teil C) Montag, 3. September 2007 1. omenklatur (20 Pt) 1.1 (10Pt) Benennen Sie die Verbindungen A - D nach IUPAC inkl. stereochemischer Deskriptoren. A B (2E,5E)4-Prop-1-inylhepta-2,5-dien
Basisprüfung Allgemeine Chemie (Teil C) Montag, 3. September 2007 1. omenklatur (20 Pt) 1.1 (10Pt) Benennen Sie die Verbindungen A - D nach IUPAC inkl. stereochemischer Deskriptoren. A B (2E,5E)4-Prop-1-inylhepta-2,5-dien
Chemie Stufe 13 / Aromaten / Phenol Folie 01. Das Phenol-Molekül. δ δ+ sp 3. sp 2
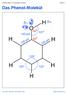 Chemie Stufe 13 / Aromaten / Phenol Folie 01 Das Phenol-Molekül δ δ+ sp 3 sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 02 Das Phenolat-Ion sp 3 H + sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 03 Grenzstrukturen
Chemie Stufe 13 / Aromaten / Phenol Folie 01 Das Phenol-Molekül δ δ+ sp 3 sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 02 Das Phenolat-Ion sp 3 H + sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 03 Grenzstrukturen
6. Rechenübung Organik (27.01./ )
 1 6. Rechenübung Organik (27.01./03.02.2009) Literatur: 2.) Mortimer : hemie Basiswissen hemie ISBN 3 13 484308 0 Paula Y. Bruice : Organische hemie ISBN 978 3 8273 7190 4 Gesättigtes Atom Atom, nur mit
1 6. Rechenübung Organik (27.01./03.02.2009) Literatur: 2.) Mortimer : hemie Basiswissen hemie ISBN 3 13 484308 0 Paula Y. Bruice : Organische hemie ISBN 978 3 8273 7190 4 Gesättigtes Atom Atom, nur mit
(Anmerkung: Es sind weitere möglich. Spektren zeigen Diradikal.)
 eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
Aufgabe 1.1 Welche der folgenden Aussagen in Bezug auf nachfolgende Reaktionsgleichung ist falsch? HCl + NH3 NH4 + + Cl -
 1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen in Bezug auf nachfolgende Reaktionsgleichung ist falsch? HCl + NH3 NH4 + + Cl - A) Salzsäure ist eine stärkere
1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen in Bezug auf nachfolgende Reaktionsgleichung ist falsch? HCl + NH3 NH4 + + Cl - A) Salzsäure ist eine stärkere
Basisprüfung Allgemeine Chemie (Teil OC) Montag, 3. September 2007
 Basisprüfung Allgemeine Chemie (Teil C) Montag, 3. September 2007 1. Nomenklatur (20 Pt) 1.1 (10Pt) Benennen Sie die Verbindungen A - D nach IUPAC inkl. stereochemischer Deskriptoren. A B C D N 1.2 (10
Basisprüfung Allgemeine Chemie (Teil C) Montag, 3. September 2007 1. Nomenklatur (20 Pt) 1.1 (10Pt) Benennen Sie die Verbindungen A - D nach IUPAC inkl. stereochemischer Deskriptoren. A B C D N 1.2 (10
Chemisches Praktikum für Biologen
 Chemisches Praktikum für Biologen Klausur am 13.02.2017 Die Klausur besteht aus 10 Seiten. Bitte zu den folgenden Aufgaben die jeweils richtige Antwort (A, B, C, D) bzw. den berechneten Wert (ohne Maßeinheit)
Chemisches Praktikum für Biologen Klausur am 13.02.2017 Die Klausur besteht aus 10 Seiten. Bitte zu den folgenden Aufgaben die jeweils richtige Antwort (A, B, C, D) bzw. den berechneten Wert (ohne Maßeinheit)
1.2 Vergleichen Sie die Reaktionsbedingungen für die Bromierung von A und B und begründen Sie unter Mitverwendung von Grenzformeln den Unterschied!
 Aufgabe II Die aromatischen Ringsysteme folgender Verbindungen sollen zu Monobromderivaten umgesetzt werden: Benzol (A), Anilin (B) und Aniliniumchlorid (C). 1.1 Erläutern Sie unter Mitverwendung von Strukturformeln
Aufgabe II Die aromatischen Ringsysteme folgender Verbindungen sollen zu Monobromderivaten umgesetzt werden: Benzol (A), Anilin (B) und Aniliniumchlorid (C). 1.1 Erläutern Sie unter Mitverwendung von Strukturformeln
2.2 Intermolekulare Wechselwirkungen
 2.2 Intermolekulare Wechselwirkungen -15-2.2 Intermolekulare Wechselwirkungen Die Bildung der hier vorgestellten molekularen Aggregate beruht auf schwachen Wechselwirkungen zwischen Atomen oder Molekülen.
2.2 Intermolekulare Wechselwirkungen -15-2.2 Intermolekulare Wechselwirkungen Die Bildung der hier vorgestellten molekularen Aggregate beruht auf schwachen Wechselwirkungen zwischen Atomen oder Molekülen.
Die elektrophile Addition
 Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
 hemie-protokoll 11.11.02, Seite 1 von 5 Lukman Iwan, 12.11.02 Stundenprotokoll vom Montag, 11. ovember 2002 Es fehlen: Janine und Jeannette Zettel 1&2: Aromatische eterocyclen http://www.oci.unizh.ch/edu/lectures/material/a_bii/kap6/kap6.html
hemie-protokoll 11.11.02, Seite 1 von 5 Lukman Iwan, 12.11.02 Stundenprotokoll vom Montag, 11. ovember 2002 Es fehlen: Janine und Jeannette Zettel 1&2: Aromatische eterocyclen http://www.oci.unizh.ch/edu/lectures/material/a_bii/kap6/kap6.html
Übungen zur VL Chemie für Biologen und Humanbiologen Lösung Übung 9
 Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Auf der rechten Seite sind Beispiele für kovalente Bindungen.
 Bei einem Gemisch aus Natrium und Chlorid wird einen Ionenverbindung entstehen und sich ein Ionengitter ausbilden. Wenn Natrium nicht vorhanden ist, hat Chlorid aber natürlich noch immer das Bedürfnis,
Bei einem Gemisch aus Natrium und Chlorid wird einen Ionenverbindung entstehen und sich ein Ionengitter ausbilden. Wenn Natrium nicht vorhanden ist, hat Chlorid aber natürlich noch immer das Bedürfnis,
Valenz-Bindungstheorie H 2 : s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie
 Valenz-Bindungstheorie Beschreibung von Molekülen mit Hilfe von Orbitalen H H H 2 : H 2 s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie um die interatomare
Valenz-Bindungstheorie Beschreibung von Molekülen mit Hilfe von Orbitalen H H H 2 : H 2 s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie um die interatomare
Chemische Bindungen Atombindung
 Atombindung Das Lewis Modell der kovalenten Bindung Die Entstehung von Molekülen beruht auf der Bildung von gemeinsamen, bindenden Elektronenpaaren in dem Bestreben der Atome, eine energetisch stabile
Atombindung Das Lewis Modell der kovalenten Bindung Die Entstehung von Molekülen beruht auf der Bildung von gemeinsamen, bindenden Elektronenpaaren in dem Bestreben der Atome, eine energetisch stabile
Inhaltsverzeichnis. Teil I Volle Kraft voraus: Die Chemie des Kohlenstoffs 23. Einführung 17. Kapitel 1 Die wundervolle Welt der organischen Chemie 25
 Inhaltsverzeichnis Inhaltsverzeichnis Über den Autor 7 Einführung 17 Über dieses Buch 18 Konventionen in diesem Buch 19 Törichte Annahmen über den Leser 19 Wie dieses Buch aufgebaut ist 20 Teil I: Es war
Inhaltsverzeichnis Inhaltsverzeichnis Über den Autor 7 Einführung 17 Über dieses Buch 18 Konventionen in diesem Buch 19 Törichte Annahmen über den Leser 19 Wie dieses Buch aufgebaut ist 20 Teil I: Es war
Spektroskopie-Seminar SS UV-Vis-Spektroskopie. UV-Vis-Spektroskopie
 UV-Vis-Spektroskopie 7.1 Allgemeines UV-Vis-Spektroskopie verwendet elektromagnetische Strahlung im sichtbaren und UV-Bereich. 190 nm bis 700 nm. Dabei kommt es zur Anregung von Elektronen ( Elektronenspektroskopie
UV-Vis-Spektroskopie 7.1 Allgemeines UV-Vis-Spektroskopie verwendet elektromagnetische Strahlung im sichtbaren und UV-Bereich. 190 nm bis 700 nm. Dabei kommt es zur Anregung von Elektronen ( Elektronenspektroskopie
10. Jahrgangsstufe Organische Chemie Skript Einführungsklasse
 4. Die Eigenschaften von Alkanen 4.1 Der Aggregatszustand bzw. die Siedetemperatur Der Aggregatszustand von Alkanen bei Raumtemperatur ist von der Siedetemperatur abhängig und steht in Zusammenhang mit
4. Die Eigenschaften von Alkanen 4.1 Der Aggregatszustand bzw. die Siedetemperatur Der Aggregatszustand von Alkanen bei Raumtemperatur ist von der Siedetemperatur abhängig und steht in Zusammenhang mit
A) Bei zweiprotonigen Säuren wird zur vollständigen Neutralisation exakt ein
 1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen ist richtig? A) Bei zweiprotonigen Säuren wird zur vollständigen Neutralisation exakt ein Äquivalent an Natronlauge
1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen ist richtig? A) Bei zweiprotonigen Säuren wird zur vollständigen Neutralisation exakt ein Äquivalent an Natronlauge
Praktikumsrelevante Themen
 Praktikumsrelevante Themen Säuren und Basen Säure-Base-Konzepte Säure-Base-Gleichgewichte Säurestärke, Basenstärke ph-, poh-, pk-werte Pufferlösungen Titrationen 1 Säure-Base-Definition nach ARRHENIUS
Praktikumsrelevante Themen Säuren und Basen Säure-Base-Konzepte Säure-Base-Gleichgewichte Säurestärke, Basenstärke ph-, poh-, pk-werte Pufferlösungen Titrationen 1 Säure-Base-Definition nach ARRHENIUS
Nucleophile Substitution: S N 2-Reaktion
 Nucleophile Substitution: S N 2-Reaktion Diese teilweise Verschiebung von Elektronendichte und die damit einhergehende Polarisierung kann z.b. durch den griechischen Buchstaben und das hochgestellte entsprechende
Nucleophile Substitution: S N 2-Reaktion Diese teilweise Verschiebung von Elektronendichte und die damit einhergehende Polarisierung kann z.b. durch den griechischen Buchstaben und das hochgestellte entsprechende
Aktuelle Beispiele aus der Forschung
 Vorlesung: Allgemeine Chemie Organische Chemie 05.12.; 08.12.; Prof. Dr. C. Meier Eine Einführung in die Organische Chemie Themen: Elektronenstruktur, kovalente Bindung, Säure-Basen-Eigenschaften in Abhängigkeit
Vorlesung: Allgemeine Chemie Organische Chemie 05.12.; 08.12.; Prof. Dr. C. Meier Eine Einführung in die Organische Chemie Themen: Elektronenstruktur, kovalente Bindung, Säure-Basen-Eigenschaften in Abhängigkeit
Chemie für Biologen WS 2005/6 Arne Lützen Institut für Organische Chemie der Universität Duisburg-Essen (Teil 5: )
 Chemie für Biologen WS 2005/6 Arne Lützen Institut für rganische Chemie der Universität Duisburg-Essen (Teil 5: 23.11.2005) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung von Bindungen
Chemie für Biologen WS 2005/6 Arne Lützen Institut für rganische Chemie der Universität Duisburg-Essen (Teil 5: 23.11.2005) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung von Bindungen
12. Die Carbonylgruppe : Reaktionen in a-stellung
 Inhalt Index 12. Die Carbonylgruppe : Reaktionen in a-stellung In Kapiteln 10 und 11 wurde gezeigt, dass die Carbonylgruppe von Elektrophilen am Sauerstoff und von Nucleophilen am Kohlenstoff angegriffen
Inhalt Index 12. Die Carbonylgruppe : Reaktionen in a-stellung In Kapiteln 10 und 11 wurde gezeigt, dass die Carbonylgruppe von Elektrophilen am Sauerstoff und von Nucleophilen am Kohlenstoff angegriffen
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Reak%onen an der Carbonylgruppe
 Reak%onen an der Carbonylgruppe H. Wünsch 2013 1.1 Struktur der Carbonylgruppe Die Carbonylgruppe entsteht bei der OxidaBon primärer und sekundärer Alkohole. Kohlenstoff und Sauerstoff sind doppelt gebunden,
Reak%onen an der Carbonylgruppe H. Wünsch 2013 1.1 Struktur der Carbonylgruppe Die Carbonylgruppe entsteht bei der OxidaBon primärer und sekundärer Alkohole. Kohlenstoff und Sauerstoff sind doppelt gebunden,
Übungen zur VL Chemie für Biologen und Humanbiologen
 Übungen zur VL Chemie für Biologen und Humanbiologen 28.01.2011 1. Zeichnen Sie die Valenzstrichformeln folgender Verbindungen und benutzen Sie im Falle unbestimmter Alkylreste ein R: a) ein tertiärer
Übungen zur VL Chemie für Biologen und Humanbiologen 28.01.2011 1. Zeichnen Sie die Valenzstrichformeln folgender Verbindungen und benutzen Sie im Falle unbestimmter Alkylreste ein R: a) ein tertiärer
4. Alkene und Alkine : Reaktionen und Darstellung
 Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Übungen zur Vorlesung Physikalische Chemie II Lösungsvorschlag zu Blatt 5
 Wintersemester 006 / 007 04.1.006 1. Aufgabe Die Wellenfunktionen unterscheiden sich gar nicht. Während der Lösung der elektronischen Schrödingergleichung werden die Kerne als ruhend betrachtet. Es kommt
Wintersemester 006 / 007 04.1.006 1. Aufgabe Die Wellenfunktionen unterscheiden sich gar nicht. Während der Lösung der elektronischen Schrödingergleichung werden die Kerne als ruhend betrachtet. Es kommt
P Station 1: Darstellung der Carbonsäuren
 P Station 1: Darstellung der Carbonsäuren Carbonsäuren lassen sich durch Oxidation der entsprechenden Aldehyde darstellen. Die Oxidation der Aldehyde kann in einem Versuch mit heißem Kupferoxid im Abzug
P Station 1: Darstellung der Carbonsäuren Carbonsäuren lassen sich durch Oxidation der entsprechenden Aldehyde darstellen. Die Oxidation der Aldehyde kann in einem Versuch mit heißem Kupferoxid im Abzug
Modul: Allgemeine Chemie
 Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
4. Alkene und Alkine : Reaktionen und Darstellung
 Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
Energie. 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital
 sp 2 -ybridisierung sp 2 -ybridisierung sp 2 -ybridisierung 1 x 2p Orbital Energie 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital z y x planare Anordnung in sp 2 -hybridisierten -Atomen: Alle 4 (3 s- und
sp 2 -ybridisierung sp 2 -ybridisierung sp 2 -ybridisierung 1 x 2p Orbital Energie 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital z y x planare Anordnung in sp 2 -hybridisierten -Atomen: Alle 4 (3 s- und
2 Die Atombindung im Wasserstoff-Molekül
 2.1 Lernziele 1. Sie wissen, wie eine chemische Bindung zwischen zwei Wasserstoff-Atomen zustande kommt. 2. Sie können den bindenden vom antibindenden Zustand unterscheiden. 3. Sie wissen, weshalb das
2.1 Lernziele 1. Sie wissen, wie eine chemische Bindung zwischen zwei Wasserstoff-Atomen zustande kommt. 2. Sie können den bindenden vom antibindenden Zustand unterscheiden. 3. Sie wissen, weshalb das
Oktett-Theorie von Lewis
 Oktett-Theorie von Lewis Oktettregel Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst ein Elektronenoktett zu erlangen. allgemeiner: Edelgasregel Atome streben durch Vereinigung
Oktett-Theorie von Lewis Oktettregel Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst ein Elektronenoktett zu erlangen. allgemeiner: Edelgasregel Atome streben durch Vereinigung
Übung Nr. 13. Vorlesung Allgemeine Chemie II Teil Organische Chemie Frühjahrssemester Mi bzw. Fr
 Übung Nr. 13 Mi. 30.05.2012 bzw. Fr. 01.06.2012 1. Eliminierungen I Geben Sie für die untenstehenden Reaktionen die jeweiligen Produkte an! Um welche Namensreaktion handelt es sich? Welcher Typ Eliminierung
Übung Nr. 13 Mi. 30.05.2012 bzw. Fr. 01.06.2012 1. Eliminierungen I Geben Sie für die untenstehenden Reaktionen die jeweiligen Produkte an! Um welche Namensreaktion handelt es sich? Welcher Typ Eliminierung
Chemie Zusammenfassung III
 Chemie Zusammenfassung III Inhaltsverzeichnis Atombau & Kernphysik... 2 Aufbau der Atome... 2 Atomkern... 2 Atomhülle... 2 Atomgrösse und Kernladung... 3 Reaktivität und Gruppen des Periodensystems...
Chemie Zusammenfassung III Inhaltsverzeichnis Atombau & Kernphysik... 2 Aufbau der Atome... 2 Atomkern... 2 Atomhülle... 2 Atomgrösse und Kernladung... 3 Reaktivität und Gruppen des Periodensystems...
Darstellung von Phenolphthalein und Fluorescein
 Philipps-Universität Marburg 04. Juli 2007 Fachbereich 15: Chemie rganisch-chemisches Grundpraktikum für Lehramtskandidaten Praktikumsleiter: Dr. Philipp Reiß SS 2007 Mario Gerwig Versuch: Darstellung
Philipps-Universität Marburg 04. Juli 2007 Fachbereich 15: Chemie rganisch-chemisches Grundpraktikum für Lehramtskandidaten Praktikumsleiter: Dr. Philipp Reiß SS 2007 Mario Gerwig Versuch: Darstellung
 INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
VII INHALTSVERZEICHNIS
 VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
Institut für Chemie und Biochemie der Freien Universität Berlin Organische Chemie III Datum: Date: Verfasser Author: C. C.
 Institut für Chemie und Biochemie der Freien Universität Berlin Organische Chemie III Datum: 02.03.2017 Date: Verfasser Author: C. C. Tzschucke Höchstpunktzahl / Max. of points 200 Mindestpunktzahl / Min
Institut für Chemie und Biochemie der Freien Universität Berlin Organische Chemie III Datum: 02.03.2017 Date: Verfasser Author: C. C. Tzschucke Höchstpunktzahl / Max. of points 200 Mindestpunktzahl / Min
SÄUREN, BASE, SALZE GRUNDLAGEN CHEMIE
 SÄUREN, BASE, SALZE GRUNDLAGEN CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE Wikipedia: Die organische Chemie (kurz: OC), häufig auch kurz Organik, ist ein Teilgebiet der
SÄUREN, BASE, SALZE GRUNDLAGEN CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE Wikipedia: Die organische Chemie (kurz: OC), häufig auch kurz Organik, ist ein Teilgebiet der
Chemie Tutorien zur Vorbereitung auf das Vorphysikum der Zahnmediziner Samstag, Uhr Allgemeine Chemie
 Seite 1 von 6 LMU Co.Med (Curriculumsoptimierung Medizin) Chemie Tutorien zur Vorbereitung auf das Vorphysikum der Zahnmediziner 25.02. 04.03.2017 Samstag, 25.02.17 15.00 17.00 Uhr Allgemeine Chemie Mittwoch,
Seite 1 von 6 LMU Co.Med (Curriculumsoptimierung Medizin) Chemie Tutorien zur Vorbereitung auf das Vorphysikum der Zahnmediziner 25.02. 04.03.2017 Samstag, 25.02.17 15.00 17.00 Uhr Allgemeine Chemie Mittwoch,
Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie,
 Wiederholung der letzten Vorlesungsstunde: Thema: Chemische h Bindungen Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie, unterschiedliche Arten chemischer Bindungen, Atombindung, kovalente
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische h Bindungen Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie, unterschiedliche Arten chemischer Bindungen, Atombindung, kovalente
Grundpraktikum für Biologen 2016
 Grundpraktikum für Biologen 2016 31.03.2016 Übersicht # 2 Kovalente Bindung Freies Elektronenpaar Einzelnes Elektron Oktett erfüllt Einzelne Chloratome haben einen Elektronenmangel Reaktion zu Cl 2 erfüllt
Grundpraktikum für Biologen 2016 31.03.2016 Übersicht # 2 Kovalente Bindung Freies Elektronenpaar Einzelnes Elektron Oktett erfüllt Einzelne Chloratome haben einen Elektronenmangel Reaktion zu Cl 2 erfüllt
Reaktionstypen der Aliphate
 Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Arzneistoff der Woche. Alkohole. Eliminierungen. Organische Chemie Agenda. Johann Wolfgang Goethe -Universität Frankfurt am Main
 Agenda Arzneistoff der Woche Alkohole Eliminierungen 1 Prof. Dr. Manfred Schubert-Zsilavecz Dabigatran - Struktur 2 Prof. Dr. Manfred Schubert-Zsilavecz Lucas-Test 3 Prof. Dr. Manfred Schubert-Zsilavecz
Agenda Arzneistoff der Woche Alkohole Eliminierungen 1 Prof. Dr. Manfred Schubert-Zsilavecz Dabigatran - Struktur 2 Prof. Dr. Manfred Schubert-Zsilavecz Lucas-Test 3 Prof. Dr. Manfred Schubert-Zsilavecz
Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006
 Übungsaufgaben zur Vorlesung hemie für Biologen, WS 2005/2006 Themenbereiche Atombau, chemische Bindung, Stöchiometrie, Aggregatzustände 1. Ergänzen Sie folgende Tabelle: Symbol Z M Protonen eutronen Elektronen
Übungsaufgaben zur Vorlesung hemie für Biologen, WS 2005/2006 Themenbereiche Atombau, chemische Bindung, Stöchiometrie, Aggregatzustände 1. Ergänzen Sie folgende Tabelle: Symbol Z M Protonen eutronen Elektronen
Übungen zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe. 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit
 O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
Ionisierungsenergie und Elektronenaffinität. Bindigkeit Valenzstrichformel Molekülgeometrie
 Tendenzen im Periodensystem Ionisierungsenergie und Elektronenaffinität Atombindung (Elektronenpaarbindung) Bindigkeit Valenzstrichformel Molekülgeometrie Räumlicher Bau einfacher Moleküle Polare Atombindung
Tendenzen im Periodensystem Ionisierungsenergie und Elektronenaffinität Atombindung (Elektronenpaarbindung) Bindigkeit Valenzstrichformel Molekülgeometrie Räumlicher Bau einfacher Moleküle Polare Atombindung
Beobachtung [Jeweils] exotherme Reaktion unter Gasentwicklung (H 2 )
![Beobachtung [Jeweils] exotherme Reaktion unter Gasentwicklung (H 2 ) Beobachtung [Jeweils] exotherme Reaktion unter Gasentwicklung (H 2 )](/thumbs/74/69784240.jpg) 1 25.01.2006 0.1 Alkohole Alkohole enthalten neben den Elementen C und H auch O. Sie leiten sich aber dennoch von den Kohlenwasserstoffen ab. Beispiel: C 2 H 6 O als Summenformel Strukturformel: C C O
1 25.01.2006 0.1 Alkohole Alkohole enthalten neben den Elementen C und H auch O. Sie leiten sich aber dennoch von den Kohlenwasserstoffen ab. Beispiel: C 2 H 6 O als Summenformel Strukturformel: C C O
Klausur zur Vorlesung "Grundzüge der Chemie" für Studierende des Maschinenbaus BITTE AUSFÜLLEN BITTE HALTEN SIE IHREN STUDENTAUSWEIS BEREIT
 1 PUNKTZAL NTE Klausur zur Vorlesung "Grundzüge der hemie" für Studierende des Maschinenbaus Termin: 17. Juni 2003 rt: Z 10 Zeit: 9.30-11.30 Uhr Dauer: 120 Minuten BITTE AUSFÜLLEN BITTE ALTEN SIE IREN
1 PUNKTZAL NTE Klausur zur Vorlesung "Grundzüge der hemie" für Studierende des Maschinenbaus Termin: 17. Juni 2003 rt: Z 10 Zeit: 9.30-11.30 Uhr Dauer: 120 Minuten BITTE AUSFÜLLEN BITTE ALTEN SIE IREN
13. Amine und ihre Derivate
 Inhalt Index 13. Amine und ihre Derivate Amine sind Derivate des Ammoniaks, bei dem ein bis drei Wasserstoffatome durch Alkyloder Arylgruppen ersetzt wurden. Entsprechend gibt es primäre Amine, sekundäre
Inhalt Index 13. Amine und ihre Derivate Amine sind Derivate des Ammoniaks, bei dem ein bis drei Wasserstoffatome durch Alkyloder Arylgruppen ersetzt wurden. Entsprechend gibt es primäre Amine, sekundäre
Übungen zur VL Chemie für Biologen und Humanbiologen 18.11.2011 Lösung Übung 3
 Übungen zur VL Chemie für Biologen und Humanbiologen 18.11.2011 Lösung Übung 3 Teil 1: Die Geometrie organischer Verbindungen 1. Welche Form hat ein s-orbital? Welche Form haben p-orbitale? Skizzieren
Übungen zur VL Chemie für Biologen und Humanbiologen 18.11.2011 Lösung Übung 3 Teil 1: Die Geometrie organischer Verbindungen 1. Welche Form hat ein s-orbital? Welche Form haben p-orbitale? Skizzieren
Chemie für Biologen, a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride?
 Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
1 Struktur und Bindung organischer Moleküle
 1 Struktur und Bindung organischer Moleküle 20. (sowie 21 und 25, s. unten) (a) (b) Die Dreifachbindung ist fur die Ausbildung der Oktette an C und N erforderlich. (c) d + d H:O :Cl: (d) Man beachte, dass
1 Struktur und Bindung organischer Moleküle 20. (sowie 21 und 25, s. unten) (a) (b) Die Dreifachbindung ist fur die Ausbildung der Oktette an C und N erforderlich. (c) d + d H:O :Cl: (d) Man beachte, dass
ALDEHYDE & KETONE. Referat über die Carbonylverbindungen: Aldehyde und Ketone Patrick König und Robert Bozsak LK C2 Sigmund-Schuckert-Gymnasium
 ALDEHYDE & KETONE Referat über die Carbonylverbindungen: und Patrick König und Robert Bozsak LK C2 Sigmund-Schuckert-Gymnasium 1 1 GLIEDERUNG 1. Allgemeiner Vergleich der & Struktur Nomenklatur / Beispiele
ALDEHYDE & KETONE Referat über die Carbonylverbindungen: und Patrick König und Robert Bozsak LK C2 Sigmund-Schuckert-Gymnasium 1 1 GLIEDERUNG 1. Allgemeiner Vergleich der & Struktur Nomenklatur / Beispiele
Die Strukturabhängigkeit der chemischen Verschiebung
 Die Strukturabhängigkeit der chemischen Verschiebung. Abschirmung in einem Atom (wie bisher geschildert) Die Elektronenverteilung in einem Wasserstoffatom ist sphärisch. B 0 0 0000000 000000000 000000000
Die Strukturabhängigkeit der chemischen Verschiebung. Abschirmung in einem Atom (wie bisher geschildert) Die Elektronenverteilung in einem Wasserstoffatom ist sphärisch. B 0 0 0000000 000000000 000000000
Bachelorprüfung im Fach Biologie, Teilfach Chemie am a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel
 Bachelorprüfung im Fach Biologie, Teilfach Chemie am 30.07.2018 2 Aufgabe 1 a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel CH 2 O ein, die die folgenden Eigenschaften
Bachelorprüfung im Fach Biologie, Teilfach Chemie am 30.07.2018 2 Aufgabe 1 a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel CH 2 O ein, die die folgenden Eigenschaften
Name, Vorname: Matrikelnummer: Studienrichtung: Fragen auf den folgenden Seiten: Musterlösung zur Klausur zur Experimentalvorlesung Organische Chemie
 rganisch-chemisches nstitut Fakultät für Chemie und Geowissenschaften Universität eidelberg 23. Juni 2015 Musterlösung zur Klausur zur Experimentalvorlesung rganische Chemie von Prof. Stephen ashmi Name,
rganisch-chemisches nstitut Fakultät für Chemie und Geowissenschaften Universität eidelberg 23. Juni 2015 Musterlösung zur Klausur zur Experimentalvorlesung rganische Chemie von Prof. Stephen ashmi Name,
im Molekül eine Dreifachbindung (eine σ-bindung,
 1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
13.1. Struktur der Carbonyl-Gruppe, Prinzipielle Reaktivität
 13. arbonyl -Verbindungen 13.1. Struktur der arbonyl-gruppe, Prinzipielle Reaktivität 13.2. Aldehyde & Ketone 13.2.1 Nomenklatur 13.2.2 Darstellungen xidationen 13.2.3 Reaktionen Additionen an der = Acetale
13. arbonyl -Verbindungen 13.1. Struktur der arbonyl-gruppe, Prinzipielle Reaktivität 13.2. Aldehyde & Ketone 13.2.1 Nomenklatur 13.2.2 Darstellungen xidationen 13.2.3 Reaktionen Additionen an der = Acetale
Bindungskonzepte in der. Organischen Chemie. 1.1 Hybridisierung
 O:/Wiley/Organische_Chemie_Aufl_1/3d/c01.3d from 19.07.2012 09:18:28 1 Bindungskonzepte in der 1 Organischen Chemie In diesem Kapitel Die Organische Chemie wird gemeinhin als die Chemie der Kohlenstoffverbindungen
O:/Wiley/Organische_Chemie_Aufl_1/3d/c01.3d from 19.07.2012 09:18:28 1 Bindungskonzepte in der 1 Organischen Chemie In diesem Kapitel Die Organische Chemie wird gemeinhin als die Chemie der Kohlenstoffverbindungen
Themengebiet: 1 HA + H 2 O A - + H 3 O + H 3 O + : Oxonium- oder Hydroxoniumion. Themengebiet: 2 B + H 2 O BH + + OH - OH - : Hydroxidion
 1 1 Säuren sind Protonendonatoren, d.h. Stoffe, die an einen Reaktionspartner ein oder mehrere Protonen abgeben können; Säuredefinition nach Brönsted Im Falle von Wasser: HA + H 2 O A - + H 3 O + H 3 O
1 1 Säuren sind Protonendonatoren, d.h. Stoffe, die an einen Reaktionspartner ein oder mehrere Protonen abgeben können; Säuredefinition nach Brönsted Im Falle von Wasser: HA + H 2 O A - + H 3 O + H 3 O
4 Die Atombindung im Wasserstoff-Molekül
 4.1 Übersicht und Lernziele Thema Bis jetzt haben wir nur von Atomen gesprochen. In der Chemie beschäftigen wir uns aber normalerweise mit Molekülen oder Ionen. Wir wollen deshalb in diesem Kapitel auf
4.1 Übersicht und Lernziele Thema Bis jetzt haben wir nur von Atomen gesprochen. In der Chemie beschäftigen wir uns aber normalerweise mit Molekülen oder Ionen. Wir wollen deshalb in diesem Kapitel auf
Ahmad Mudzakir (Autor) Zur Chemie des carbenanalogen 1,3-Dimethyl-1,2,3- benzotriazoliumiodids
 Ahmad Mudzakir (Autor) Zur hemie des carbenanalogen 1,3-Dimethyl-1,2,3- benzotriazoliumiodids htts://cuvillier.de/de/sho/ublications/2798 oyright: uvillier Verlag, Inhaberin Annette Jentzsch-uvillier,
Ahmad Mudzakir (Autor) Zur hemie des carbenanalogen 1,3-Dimethyl-1,2,3- benzotriazoliumiodids htts://cuvillier.de/de/sho/ublications/2798 oyright: uvillier Verlag, Inhaberin Annette Jentzsch-uvillier,
Frage 1. Klausuraufgaben Grundvorlesung Testat vom , Seite 1 Punkte. Bitte eintragen: Matrikelnummer: Bitte ankreuzen: Biotechnologie Pharmazie
 Klausuraufgaben Grundvorlesung Testat vom 8.1.02, Seite 1 Punkte Matrikelnummer: Name: Bitte eintragen: Vorname: Bitte ankreuzen: Fachrichtung: Chemie Biotechnologie Pharmazie Frage 1 Skizzieren Sie die
Klausuraufgaben Grundvorlesung Testat vom 8.1.02, Seite 1 Punkte Matrikelnummer: Name: Bitte eintragen: Vorname: Bitte ankreuzen: Fachrichtung: Chemie Biotechnologie Pharmazie Frage 1 Skizzieren Sie die
Vom Atom zum Molekül
 Vom Atom zum Molekül Ionenverbindungen Na + Cl NaCl lebensgefährlich giftig lebensgefährlich giftig lebensessentiell Metall + Nichtmetall Salz Beispiel Natriumchlorid Elektronenkonfiguration: 11Na: 1s(2)
Vom Atom zum Molekül Ionenverbindungen Na + Cl NaCl lebensgefährlich giftig lebensgefährlich giftig lebensessentiell Metall + Nichtmetall Salz Beispiel Natriumchlorid Elektronenkonfiguration: 11Na: 1s(2)
Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne
 1 Lösung 6 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne 6.1 Konformationsanalyse a) Zeichnen Sie für 2-Methylbutan die Konformationen als Newman-Projektionen
1 Lösung 6 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne 6.1 Konformationsanalyse a) Zeichnen Sie für 2-Methylbutan die Konformationen als Newman-Projektionen
Das Lewis-Modell zur Erklärung kovalenter Bindungen
 Das Lewis-Modell zur Erklärung kovalenter Bindungen Erarbeiten Sie sich, innerhalb der Expertengruppe, einen Überblick über das Lewis-Modell zur Erklärung kovalenter Bindungen! Gehen Sie zusätzlich auf
Das Lewis-Modell zur Erklärung kovalenter Bindungen Erarbeiten Sie sich, innerhalb der Expertengruppe, einen Überblick über das Lewis-Modell zur Erklärung kovalenter Bindungen! Gehen Sie zusätzlich auf
Organik-Beispiel. Inhaltsverzeichnis
 Inhaltsverzeichnis I. Säure-Basen-Gleichungen... 2 a) Nach Arrhenius:... 2 b) Nach Broensted:... 2 c) Nach Lewis:... 2 II. H 2 O + HCl?... 4 a) Was ist in der Reaktion passiert? Welche Produkte entstehen?...
Inhaltsverzeichnis I. Säure-Basen-Gleichungen... 2 a) Nach Arrhenius:... 2 b) Nach Broensted:... 2 c) Nach Lewis:... 2 II. H 2 O + HCl?... 4 a) Was ist in der Reaktion passiert? Welche Produkte entstehen?...
Organische Chemie 1 Teil 2 2. Vorlesung, Freitag
 Inhalte der 2. Vorlesung: Wdh. 1. Vorlesung 1. Die eaktivität organischer Moleküle 1.4 Der Einfluss von Ladungen 1.5 Der Einfluss von rbitalen 1.6 Das ukleophil-elektrophil-modell 1.7 Die Verwendung von
Inhalte der 2. Vorlesung: Wdh. 1. Vorlesung 1. Die eaktivität organischer Moleküle 1.4 Der Einfluss von Ladungen 1.5 Der Einfluss von rbitalen 1.6 Das ukleophil-elektrophil-modell 1.7 Die Verwendung von
Übungsblatt 9: Reaktionsdiversität
 1 Übungsblatt 9: Reaktionsdiversität Warm Up Benennen Sie die folgenden (Thio )Ether: Aufgaben 1) Alkohole und Thiole i. Während das 1,2 Dibromethan bevorzugt in der fully staggered Konformation vorliegt,
1 Übungsblatt 9: Reaktionsdiversität Warm Up Benennen Sie die folgenden (Thio )Ether: Aufgaben 1) Alkohole und Thiole i. Während das 1,2 Dibromethan bevorzugt in der fully staggered Konformation vorliegt,
Vorlesung "Organische Chemie 1" Übungsblatt 4
 Vorlesung "Organische hemie 1" Übungsblatt 4 Ü1: Beim Steamcracken wird eine komplexe Mischung von Kohlenwasserstoffen durch kurzzeitiges Erhitzen in Gegenwart von Wasserdampf in eine Mischung von leichter
Vorlesung "Organische hemie 1" Übungsblatt 4 Ü1: Beim Steamcracken wird eine komplexe Mischung von Kohlenwasserstoffen durch kurzzeitiges Erhitzen in Gegenwart von Wasserdampf in eine Mischung von leichter
Seminarplan zum. Chemischen Praktikum für Biologen ohne Prüfungsfach Chemie. (Lehramt) TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE
 Seminarplan zum Chemischen Praktikum für Biologen ohne Prüfungsfach Chemie (Lehramt) TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE TEIL II: ORGANISCHE CHEMIE 1 TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE Einführung
Seminarplan zum Chemischen Praktikum für Biologen ohne Prüfungsfach Chemie (Lehramt) TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE TEIL II: ORGANISCHE CHEMIE 1 TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE Einführung
CHE 102.1: Grundlagen der Chemie - Organische Chemie
 CHE 102.1: Grundlagen der Chemie - Organische Chemie Prof Dr. E. Landau und Prof. Dr. J. A. Robinson 1. Struktur und Bindung organischer Moleküle 1.1 Atomstruktur: Die Ordnungszahl (oder Atomzahl /Atomnummer
CHE 102.1: Grundlagen der Chemie - Organische Chemie Prof Dr. E. Landau und Prof. Dr. J. A. Robinson 1. Struktur und Bindung organischer Moleküle 1.1 Atomstruktur: Die Ordnungszahl (oder Atomzahl /Atomnummer
σ-bindung beide Kohlenstoffatome sp-hybridisiert => Bindungswinkel 180 eine lineare Struktur
 VIII. Alkine Die C/C-Dreifachbindung als funktionelle Gruppe erste π-bindung σ-bindung zweite π-bindung orthogonal zur ersten beide Kohlenstoffatome sp-hybridisiert => Bindungswinkel 180 eine lineare Struktur
VIII. Alkine Die C/C-Dreifachbindung als funktionelle Gruppe erste π-bindung σ-bindung zweite π-bindung orthogonal zur ersten beide Kohlenstoffatome sp-hybridisiert => Bindungswinkel 180 eine lineare Struktur
Übungen zur VL Chemie für Biologen und Humanbiologen Diese Aufgaben werden in der Übung besprochen.
 Übungen zur VL Chemie für Biologen und umanbiologen 03.10.2010 Diese Aufgaben werden in der Übung besprochen. Die Geometrie organischer Verbindungen 1. Welche Form hat ein s-orbital? Welche Form haben
Übungen zur VL Chemie für Biologen und umanbiologen 03.10.2010 Diese Aufgaben werden in der Übung besprochen. Die Geometrie organischer Verbindungen 1. Welche Form hat ein s-orbital? Welche Form haben
Chemie-Vorkurs für Pharmaziestudenten SoSe Gerd Bendas Fachbereich Pharmazie Rheinische Friedrich Wilhelms Universität Bonn
 Chemie-Vorkurs für Pharmaziestudenten SoSe 2018 Gerd Bendas Fachbereich Pharmazie Rheinische Friedrich Wilhelms Universität Bonn gbendas@uni-bonn.de Einteilung der Veranstaltungen: die Veranstaltungen
Chemie-Vorkurs für Pharmaziestudenten SoSe 2018 Gerd Bendas Fachbereich Pharmazie Rheinische Friedrich Wilhelms Universität Bonn gbendas@uni-bonn.de Einteilung der Veranstaltungen: die Veranstaltungen
Alkane. Name: Summenformel: vereinfachte Formel: Zustand: Methan CH 4 CH 4 g (gaseous) Ethan C 2 H 6 CH 3 CH 3 g. Propan C 3 H 8 CH 3 CH 2 CH 3 g
 Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
N N. Chinolin. Pyridin. Imidazol
 6. eterocyclische Verbindungen 51 Als carbocyclisch bezeichnet man ingmoleküle, deren inge nur aus Kohlenstoffatomen aufgebaut sind. In den sogenannten eterocyclen ist mindestens ein Kohlenstoff des ings
6. eterocyclische Verbindungen 51 Als carbocyclisch bezeichnet man ingmoleküle, deren inge nur aus Kohlenstoffatomen aufgebaut sind. In den sogenannten eterocyclen ist mindestens ein Kohlenstoff des ings
Chemie für Biologen, Carbonylverbindungen / Carbonsäuren und ihre Derivate (Thema ) iii) Carbonsäure iv) Dicarbonsäure
 Chemie für Biologen, 2017 Übung 12 Carbonylverbindungen / Carbonsäuren und ihre Derivate (Thema 13.1 14.3) Aufgabe 1: a) Es gibt verschiedene Klassen von Carbonylverbindungen. Zeichnen Sie zu folgenden
Chemie für Biologen, 2017 Übung 12 Carbonylverbindungen / Carbonsäuren und ihre Derivate (Thema 13.1 14.3) Aufgabe 1: a) Es gibt verschiedene Klassen von Carbonylverbindungen. Zeichnen Sie zu folgenden
Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang
 Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang 2004 1985/IV/1 Zunächst wird Methan bei Licht bromiert: 4 2 3 Gemäß der FriedelraftSynthese unter Verwendung
Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang 2004 1985/IV/1 Zunächst wird Methan bei Licht bromiert: 4 2 3 Gemäß der FriedelraftSynthese unter Verwendung
CHE 172.1: Organische Chemie für die Life Sciences
 1 CHE 172.1: Organische Chemie für die Life Sciences Prof Dr. J. A. Robinson 1. Struktur und Bindung organischer Moleküle 1.1 Atomstruktur : Die Ordnungszahl (oder Atomzahl /Atomnummer = Atomic number)
1 CHE 172.1: Organische Chemie für die Life Sciences Prof Dr. J. A. Robinson 1. Struktur und Bindung organischer Moleküle 1.1 Atomstruktur : Die Ordnungszahl (oder Atomzahl /Atomnummer = Atomic number)
