Vorlesung. Analytik (für Biologen und Pharmazeuten) Einführung in spektroskopische Methoden der Strukturaufklärung organischer Verbindungen
|
|
|
- Herta Amsel
- vor 7 Jahren
- Abrufe
Transkript
1 Vorlesung Analytik (für Biologen und Pharmazeuten) Einführung in spektroskopische Methoden der Strukturaufklärung organischer Verbindungen Zusammenfassung des Teils "Spektroskopie" für die Prüfung BSc S 2015
2
3 1 Massenspektrometrie Die Massenspektrometrie ist keine Spektroskopie im herkömmlichen Sinn. Man bestrahlt die Probe nicht mit Photonen einer bestimmten Energie, um deren Absorption zu beobachten. Bei der Massenspektrometrie beschiesst man die Moleküle mit schnellen Elektronen, die sehr viel Energie besitzen. Dadurch werden die Moleküle nicht nur ionisiert, sie können auch sehr stark angeregt werden. Sie zerbrechen dadurch in kleinere Fragmente. Es gibt eine Vielfalt von chemischen Reaktionen, die meist im Detail nicht verstanden werden. Die entstehenden geladenen Bruchstücke werden in elektrischen und allenfalls magnetischen Feldern nach ihrer Masse getrennt, und ihre äufigkeit wird bestimmt. Die weitaus meisten entstehenden Ionen sind einfach positiv geladen. Ein Massenspektrometer trennt die Ionen eigentlich nach dem Verhältnis von Masse zu Ladung m/z. Da aber die Ladung z fast ausschliesslich 1 ist, kann man annehmen, dass auf der Abszissenachse eines Massenspektrums die Masse aufgetragen ist. Dies gilt zumindest für die oben beschriebene klassische Elektronenstoss-Ionisation (EI), die hier ausschliesslich behandelt wird. eutzutage gibt es eine Vielfalt von Möglichkeiten, Ionen zu bilden und zu trennen. Die Massenspektrometrie entwickelt sich stürmisch. Wir können hier nicht auf alle Möglichkeiten eingehen. Damit von einer Probe ein Massenspektrum gemessen werden kann, muss die Substanz in die Gasphase gebracht werden können. Dies bedingt eine gewisse Flüchtigkeit. Ein Massenspektrum wird meist als Strichdiagramm dargestellt. Die relative äufigkeit der erzeugten Ionen wird gegen das Verhältnis von Masse zu Ladung aufgetragen. Dabei wird dem grössten Signal willkürlich die äufigkeit 100% zugewiesen. Man bezeichnet dieses Signal als Basispeak. äufigkeit der Ionen [ % ] 100 Basispeak Molekülion Masse 0 m/z Anzahl Ladungen Die meisten chemischen Elemente bestehen aus einem Gemisch von Isotopen. Was man als Molekülion M +. bezeichnet, ist das einfach positiv geladene Molekül, das aus den Isotopen mit der jeweils grössten natürlichen äufigkeit besteht. Zufälligerweise sind die Isotopen mit der grössten äufigkeit für die wichtigsten Elemente in der organischen Chemie gleichzeitig auch die leichtesten. Dies gilt für die Elemente, C, N, O, F, Si, P, S,, Br, I. (Die Elemente F, P, I sind monoisotopisch.) Die Signale von Spezies, die nicht durchwegs die Isotopen mit der höchsten äufigkeit enthalten, werden als Isotopensignale bezeichnet. Die Massen der Atome sind nahezu ganze Zahlen. Die aus diesen ganzen Zahlen zusammengesetzte Masse eines Ions bezeichnet man als nominale Masse. Sie ist also ebenfalls eine ganze Zahl. Die nominale Masse eines Ions ist daher nicht identisch mit der Summe der im Periodensystem der chemischen Elemente aufgeführten
4 2 Massen. Letztere stellen einen Mittelwert über die in der Natur vorkommenden Isotope der Elemente dar. Aus der öhe des Signals bei M kann man die maximal mögliche Anzahl Kohlenstoffatome im Molekül berechnen: I M + +1 [in % M+ ] 1,1 % = C max Es handelt sich nur um die maximale Anzahl. In der Ionenquelle kann ein Proton von einem Molekül zu einem anderen übertragen werden, was dann ebenfalls zu einem Signal bei M+1 führt, das dem C-Isotopensignal überlagert ist. Es gibt keine Garantie, dass das Molekülion im Spektrum sichtbar ist. Die Molekülionen einiger Verbindungen zerfallen so schnell, dass nur Fragmente im Spektrum erscheinen. Wenn man die Molmasse nicht kennt, ist man prinzipiell nie sicher, ob das Signal beim höchsten m/z (das nicht als Isotopensignal oder protoniertes Molekülion verstanden werden kann) wirklich das Molekülion ist. Es gibt allerdings einen Schnelltest, der allenfalls das Gegenteil nachweisen kann. Sämtliche Fragmente, die im Massenspektrum erscheinen, entstehen letztlich aus dem Molekülion. Sämtliche Massendifferenzen Δm zwischen Molekülion und den anderen Signalen (die nicht Isotopensignale sind) müssen daher chemisch sinnvoll sein. Als nicht sinnvoll gelten die folgenden Massendifferenzen: Δm = 3, wenn Δm = 1 fehlt Δm = 4 bis Δm = 14 Δm = 21, wenn Δm = 1 fehlt Δm = 22 bis Δm = 24 Δm = 37, wenn Δm = 1 fehlt Erkennung von bestimmten Elementen im Molekül F ist erkennbar an M +. 19, M und m/z = 20 (F +. ) N O M +. ungerade bei ungerader Anzahl N Δm = 18 Wasser-Elimination, M (auch bei sehr kleiner Intensität). m/z = 31, 45, n.14 "O-Bruchstücke" 32, 46, n.14 S / Si / / Br erkennt man an der Intensität von M +. +2, zu dem jedes Atom dieser Elemente 4,4 % (S), 3,4 % (Si), 32,4 % () und 98 % (Br) relativ zu ihrem Signal bei M +. beitragen. Besonders die alogene ergeben sehr auffallende Intensitätsverteilungen. Mehrere alogenatome in einer Verbindung geben durch statistische Kombination sehr charakteristische Isotopenverteilungsbilder, aus denen die Zahl und Art dieser Elemente unmittelbar abgelesen werden können (vgl. Isotopenverteilungsmuster Seite T 2). Die Signale liegen jeweils um zwei Masseneinheiten auseinander.
5 3 I ist an der auffallend kleinen Intensität von M gemessen an der grossen Masse M +. erkennbar, die durch die hohe Atommasse (127) des monoisotopischen alogens verursacht wird. Fragmentierungsregeln Zur Interpretation von Massenspektren sind eine Anzahl von Regeln für die direkte Fragmentierung von Einfachbindungen nützlich. Die Regeln dürfen nur auf das Molekülion und nur für die erste Fragmentierung angewandt werden. Regel I: Die Stabilität des Fragment-Ions bzw. des neutralen Fragments bestimmt in der Regel den Verlauf der Fragmentierung. Regel I ist sehr allgemein gehalten. Die Regeln II-V sind Anwendungen davon. Regel II: In Alkanketten fragmentieren Bindungen an verzweigten C-Atomen bevorzugt, wobei eine Präferenz für den Verlust des grössten Alkylradikals gefunden wird. Die Intensität von M +. nimmt mit zunehmender Verzweigung ab. Beispiel: 2 1 Bevorzugt sind die Spaltungen neben der C-Gruppe. Die mit "1" bezeichnete Spaltung ist dabei zusätzlich bevorzugt, da sie zum grösseren Alkylfragment führt (Ethyl statt Methyl). Falls für einen Molekülteil zusätzlich auch eine der Regeln III IV angewandt werden kann, hat jene Priorität. Regel III: C=C-Doppelbindungen fördern die Spaltung der allylischen bzw. benzylischen Bindung (radikalinduzierte α-spaltung). In einfachen Alkenen können die Doppelbindungen meistens massenspektrometrisch trotzdem nicht lokalisiert werden, da oft -Verschiebungen (Isomerisierung der Doppelbindung) der Fragmentierung vorgelagert sind. Sehr viel zuverlässiger ist die Anwendung der Regel bei aromatischen Verbindungen, bei denen eine Isomerisierung energetisch ungünstig ist: Beispiel:
6 4 Bevorzugt ist die gezeigte Spaltung. Es wird also nicht direkt neben der Doppelbindung gespalten, sondern eine Einfachbindung weiter entfernt. In diesem ausgewählten Fall ist die Spaltung zusätzlich favorisiert, da ein besonders stabiles Kation entstehen kann: + C + 2 C + Das entstehende Tropylium-Kation ist ein ückel-aromat mit sechs Elektronen im Ring. Regel IV: Elektronendonatoren (eteroatome) fördern die Spaltung der Bindung zum C-Atom, welches das eteroatom trägt. Es bricht also nicht die Bindung zum eteroatom, sondern die daneben liegende. Beispiel: O Es ist unklar, welches Bruchstück die positive Ladung mitbekommt und damit im Massenspektrum erscheint. Es ist möglich, dass nur eines der Fragmente sichtbar ist. Es können aber auch beide im Spektrum erscheinen. Das grössere der hier gezeigten Fragmente hat die Masse 45 und ist ein O- Indikator (siehe oben über das Erkennen von Elementen). Regel V: Wenn die Bindung zu einem elektronegativen eteroatom bricht, ist die Ladung bevorzugt auf der C-Seite lokalisiert (induktive Spaltung). Beispiel: O O Die Spaltung wird in diesem Fall nach Regel IV vom O-Atom der Carbonylgruppe gesteuert. Weil hier die Bindung zu einem eteroatom bricht, findet man eher das Fragment mit der Masse 57 (statt 31) im Spektrum. Nur geladene Teilchen können im Spektrum erscheinen.
7 5 IR-Spektroskopie Bei Infrarot-Spektren hat sich eingebürgert, die Absorption nicht gegen die Wellenlänge aufzutragen, sondern gegen den Kehrwert davon. Die Einheit ist cm -1. Der diagnostisch brauchbare Bereich geht von 4000 cm -1 bis etwa 400 cm -1. Mit der infraroten Strahlung können die Moleküle in Schwingung versetzt werden. Die Absorption ist dort besonders gross, wo eine Eigenfrequenz des Moleküls getroffen wird. Die Schwingung kann aber nur angeregt werden, wenn funktionelle Gruppen mit starkem Dipolcharakter an der Schwingung beteiligt sind. Die Interpretation von IR-Spektren ist im Allgemeinen nur oberhalb von 1500 cm -1 sinnvoll möglich. In diesem Bereich schwingen nur wohldefinierte kleine Teile des Moleküls. Das erlaubt die Identifikation von gewissen funktionellen Gruppen. Das Gebiet unterhalb von 1500 cm -1 heisst Fingerprint-Bereich. Grosse Teile des Moleküls schwingen in individueller Art. Dieser Bereich ist sehr wertvoll zur Überprüfung der Gleichheit zweier Spektren. at man das Spektrum eines Kandidaten in einer Datenbank gefunden, kann die Gleichheit anhand der übereinstimmenden Fingerprint-Bereiche erkannt werden. Aufnahmebedingungen: Die Wahl des Lösungsmittels kann aufschlussreich sein. Man verwendet Chloroform als Lösungsmittel, wenn immer möglich. Chloroform beeinflusst die gelösten Moleküle nur wenig, macht sich also nicht bemerkbar. Als Nachteil muss man zwei Sperrgebiete im Fingerprintbereich in Kauf nehmen (siehe unten). Ist die Substanz in Chloroform unlöslich, muss auf Alternativen ausgewichen werden. Sehr polare Verbindungen werden oft als KBr-Pille oder Nujol-Suspension aufgenommen. Dabei überlagern sich die Spektren von Substanz und Suspensionsmittel. Die Spektren der Suspensionsmittel findet man auf der Seite T20. Sperrgebiete: Das Spektrum des Lösungsmittels wird im Allgemeinen durch Kompensation eliminiert. Es gibt aber bei jedem gängigen Lösungsmittel Bereiche, die für infrarotes Licht praktisch vollständig undurchsichtig sind. ier ist keine sinnvolle Kompensation möglich. In diesen Bereichen ist daher eine Interpretation des Spektrums unzulässig. Sperrgebiete erkennt man im Spektrum als perfekt horizontale Linien. Die Lage der Sperrgebiete kann man auf den Seiten T18-T19 nachschlagen. Intensität der Banden: Die Intensität einer Bande ist gross, wenn sich das Dipolmoment während der Schwingung stark ändert. Dies ist im Allgemeinen dann der Fall, wenn sich starke lokale Bindungsdipole bewegen. Paradebeispiel ist die Carbonylgruppe C==O, die ihre Spuren im Bereich von cm -1 hinterlässt. Die intensive Bande der Carbonyl-Streckschwingung dominiert das Spektrum in diesem Bereich. Schärfe der Banden: Einige Teile von Molekülen sind sehr flexibel, z. B. lange C 2 -Ketten. Diese Teile ändern dauernd ihre Konformation, was zu einer Vielfalt von räumlichen Anordnungen führt. Zu jeder dieser Anordnungen gehört im Prinzip ein eigenes individuelles IR-Spektrum. Da die Änderungen der Konformation im Vergleich zu den angeregten Schwingungen langsam sind, sieht man eine Überlagerung von allen individuellen IR- Spektren. Das resultierende Spektrum weist daher zum Teil breite Banden auf, wenn die entsprechenden Molekülteile, die für die Schwingung verantwortlich sind, flexibel sind. Zusätzlich können protische funktionelle Gruppen miteinander in Wechselwirkung treten, auch intermolekular. Typisches Beispiel ist die Bildung von Dimeren über Wasserstoff-
8 6 brücken. So zeigen Carbonsäuren extrem breite Banden, wenn die O-Gruppe der Carboxylgruppe an der Schwingung beteiligt ist. Konzentrationseffekte: Wenn die Probemoleküle miteinander in Wechselwirkung treten können, ist das Spektrum von der Konzentration der Probe im Lösungsmittel abhängig. Typisch ist die Bildung von Dimeren über Wasserstoffbrücken, wie sie z. B. bei Carbonsäuren auftreten. In letzterem Fall tritt eine breite Bande bei 930 cm -1 auf, die nur von Dimeren stammt. Die Intensität und Lage der Bande ist von der Konzentration abhängig. In sehr verdünnten Lösungen wird die Bande schwach, da die wenig stabilen Dimere nicht lange bestehen bleiben und zwei Moleküle sich nur selten zur Bildung eines Dimers finden. Besonders stark sind die Effekte, wenn die Substanz als Flüssigkeitsfilm aufgenommen wird. Die Abwesenheit eines Lösungsmittels ermöglicht starke Interaktionen zwischen den Molekülen der Probe. Ebenfalls starke Effekte können auftreten, wenn die Substanz als Festkörper vorliegt, also bei der Nujol-Suspension und der KBr-Pille. UV-Spektroskopie Vom UV-Spektrum interessiert man sich im Allgemeinen nur für die Lage und die Intensität des längstwelligen Absorptionsmaximums. Molarer Absorptionskoeffizient ε λ max Wellenlänge λ Die UV-Strahlung unterhalb von 180 nm wird von praktisch allen Substanzen, inklusive Lösungsmitteln, stark absorbiert. Daher sind die spektralen Anteile im sehr kurzwelligen Bereich für diagnostische Zwecke unbrauchbar. Die Energie eines UV-Photons in diesem Bereich ist derart gross, dass die meisten Moleküle sich unter Absorption des Photons elektronisch anregen lassen. Dabei können Einfachbindungen gebrochen werden, oder die Moleküle werden durch die Anregung sehr reaktiv. Es findet also eine chemische Reaktion statt (Photochemie, Sonnenbrand). Die strukturellen Eigenheiten, die zur intensiven Absorption von UV-Strahlung führen, sind konjugierte Doppelbindungen, also ein System von alternierenden Doppel- und Einfachbindungen. Je mehr Doppelbindungen an einem konjugierten System beteiligt sind, desto grösser ist die Absorption von UV-Strahlung. Wichtiger aber ist die Verschiebung des Absorptionsmaximums zu grösseren Wellenlängen. Wenn mindestens 6 konjugierte
9 7 Doppelbindungen vorhanden sind, werden erstmals sichtbare Strahlen in nennenswertem Ausmass absorbiert. Dadurch wird die Substanz gefärbt. Die meisten Farbstoffe verfügen also über viele konjugierte Doppelbindungen. Wenn zwei Systeme von konjugierten Doppelbindungen in einem Molekül vorhanden sind, die untereinander nicht verbunden sind, kann man annehmen, es handle sich um ein Gemisch von zwei Substanzen, von denen jede über eines der konjugierten Systeme verfügt: = + Wenn jedoch die konjugierten Systeme verbunden werden, ändert sich das UV-Spektrum dramatisch. Die Lage des längstwelligen Maximums verschiebt sich zu höheren Wellenlängen. Ein UV-Spektrometer ist ein beliebter Detektor in der Flüssigchromatographie. Ein UV-Detektor ist unkompliziert und billig. Viele Verbindungen verfügen über mindestens eine Doppelbindung. Das genügt bereits für eine ausreichende Absorption im UV-Bereich bei einer Wellenlänge von 220 nm. Als Lösungsmittel eignen sich Wasser, Methanol, Acetonitril, exan und ähnliche Verbindungen ohne konjugierte Doppelbindungen. Als Fenstermaterial eignet sich Quarzglas, das bis 180 nm durchsichtig ist. NMR-Spektroskopie Einige Atomkerne benehmen sich wie kleine Magnetchen. Sie richten sich in einem Magnetfeld aus. In der Quantenwelt können sie aber nicht jede beliebige Position einnehmen. Die für uns wichtigsten Kerne (Spinquantenzahl I=1/2) kennen nur zwei Richtungen, parallel und antiparallel zum Magnetfeld. Zwischen diesen beiden Zuständen gibt es einen extrem kleinen Energieunterschied, der mit einem Photon überwunden werden kann. Die Wellenlänge der entsprechenden Strahlung liegt im Bereich der Radiowellen. Ein möglichst grosser Energieunterschied wird gewünscht. Da dieser proportional zur Magnetfeldstärke ist, strebt man mit viel Aufwand nach möglichst starken Magneten. Die wichtigsten Nuklide und ihre Resonanzfrequenzen sind in der folgenden Graphik aufgetragen. Die Magnetfeldstärke beträgt Tesla, was einem heutigen Routinegerät entspricht:
10 8 15 N 2 13 C 31 P 19 F Frequenz / Mz Chemische Verschiebung Auf der Skala der obigen Figur ist ein NMR-Spektrum nicht sinnvoll darzustellen. Bei einem NMR-Experiment bringt man primär ein einziges Nuklid zur Resonanz. Wenn man die Skala extrem dehnt, erkennt man, dass die Kerne eines Nuklids nicht an der genau gleichen Stelle zu einem Signal führen. Kleine Effekte in der molekularen Umgebung der Kerne führen zu zusätzlichen magnetischen Feldern, die die Resonanzfrequenz um einen kleinen Betrag verschieben (chemische Verschiebung). Die Effekte sind aber so klein, dass sie in ppm (parts per million) der nominalen Frequenz gemessen werden, mithin auf der obigen Skala gar nicht zu erkennen sind. Wir beschränken uns hier auf Experimente mit den Kernen 1 und 13 C. Als Nullpunkt der Skala wird willkürlich die Frequenz der Substanz Tetramethylsilan (TMS) definiert. Dies gilt für die 1 -NMR- als auch für die 13 C-NMR-Spektroskopie. Kerne mit gleicher chemischer Verschiebung bezeichnet man als isochron. Die chemische Verschiebung ist unabhängig von der Feldstärke des Magneten, wenn sie in ppm der nominalen Frequenz angegeben wird. Die chemische Verschiebung eines Kerns gibt inweise auf seine chemische Umgebung. Elektronegative Atome in der unmittelbaren Nachbarschaft können zu einer Verschiebung zu grösseren ppm-zahlen führen (Verschiebung nach links). Es existieren umfangreiche Tabellenwerke und Computerprogramme zur Abschätzung der chemischen Verschiebung aufgrund der chemischen Umgebung. Es ist nicht sinnvoll, Substituenteneffekte auswendig zu lernen. Wichtig ist zu wissen, wo man allenfalls nachsehen kann. Was man sich merken sollte: Die chemischen Verschiebungen von direkt aneinander gebundenen 1 - und 13 C- Kernen sind stark korreliert. Ein Substituent, der die chemische Verschiebung im 13 C- NMR-Spektrum vergrössert, tut das im Wesentlichen auch für das entsprechende Signal im 1 -NMR-Spektrum. Grosse Elektronendichte bei den 1 - und 13 C-Atomen heisst Abschirmung des äusseren Feldes. Das führt zu einer kleinen chemischen Verschiebung.
11 9 Die chemische Verschiebung von aliphatischen C-Atomen liegt grundsätzlich unterhalb von 100 ppm. Jene von -Atomen, die an ein aliphatisches C-Atom gebunden sind, liegt grundsätzlich unterhalb von 5 ppm. Geht von einem C-Atom eine Doppelbindung aus, liegt die chemische Verschiebung grundsätzlich oberhalb von 100 ppm, jene direkt gebundener -Atome oberhalb von 5 ppm. Im aliphatischen Bereich ziehen elektronegative Substituenten (O, N, niedere alogene, NO 2 ) Elektronen zu sich. Diese Elektronen fehlen an den benachbarten 1 - und 13 C- Atomen. Deren chemische Verschiebung wird dadurch vergrössert. Dieser Effekt der Entschirmung wirkt besonders stark auf die unmittelbaren Nachbarn und abgeschwächt auf die weiter entfernten. Siehe untenstehende Figur O Chemische Verschiebungen, oben 1, unten 13 C, Angaben in ppm Im Bereich der ungesättigten Kohlenstoffumgebungen kommen noch Effekte mit π- Elektronen dazu. So können O, N und alogene die Elektronendichte am benachbarten 13 C erhöhen, weil sie doppelt besetzte p-orbitale besitzen. Typisches Beispiel: Carbonylgruppen O ppm O ppm Chemische Verschiebungen geben inweise auf die chemische Umgebung. Sie dürfen nie dogmatisch interpretiert werden. Man findet für fast jede Regel eine Ausnahme. Kopplungsmuster Die Signale eines 1 -NMR-Spektrums sind in charakteristischer Weise aufgespalten. Die Muster geben Auskunft über die Anzahl Protonen in der Umgebung eines bestimmten Kerns. Da die Kerne entweder parallel oder antiparallel zum äusseren Magnetfeld ausgerichtet sind, gibt es Moleküle, in denen das äussere Feld durch die zusätzlichen Magnetchen in der Umgebung verstärkt wird. In anderen Molekülen wird das Feld geschwächt. Das NMR-Spektrometer sieht ein Gemisch von allen möglichen Anordnungen. O Br äusseres Br Feld Br Br
12 10 Das eingekreiste spürt nicht nur das äussere Magnetfeld, sondern dazu noch das kleine Feld, das vom benachbarten Proton stammt. Bei der älfte aller Moleküle ist das Proton parallel zum äusseren Feld angeordnet (links), in der anderen älfte entgegengesetzt. Im Spektrum erscheinen daher zwei Linien gleicher Intensität, ein so genanntes Dublett. Den Abstand der Linien bezeichnet man als Kopplungskonstante. Kopplungskonstante Damit die Kopplungskonstante von der äusseren Feldstärke unabhängig ist, misst man sie nicht auf der relativen ppm-skala der chemischen Verschiebungen, sondern auf der absoluten Skala der Frequenz. Um Kopplungskonstanten aus dem Spektrum ablesen zu können, muss man also die Feldstärke kennen. Kopplungen sind gegenseitig. Beobachtet man das benachbarte Proton, wird auch dessen Signal in zwei Linien aufgespalten. Die Linienabstände der beiden Dublette sind gleich gross. Kompliziertere Aufspaltungsmuster ergeben sich, wenn mehrere Nachbarkerne vorhanden sind. Br Br äusseres Feld Br Br Schon bei zwei Nachbarn gibt es vier Möglichkeiten der Ausrichtung der Spins. Es gibt also im Prinzip vier Linien, für jede Anordnung eine. Die Kopplungskonstanten zu den beiden Protonen werden vorerst aber als gleich angenommen. Solche (isochronen) Protonen nennt man magnetisch äquivalent. Die Linien, die zu den Anordnungen oben rechts und unten links gehören, fallen damit zusammen. Es gibt daher nur 3 Linien mit gleichem Abstand, von denen die mittlere aber doppelt so intensiv ist. Diese Anordnung bezeichnet man als Triplett.
13 11 Kopplungskonstante Allgemein ergeben sich bei der Kopplung mit n magnetisch äquivalenten Nachbarn n+1 Linien. Die Signalintensitäten entsprechen den Binominalkoeffizienten (a+b) n, Sie lassen sich mit dem Pascal'schen Dreieck berechnen und darstellen: Signalintensitäten Bezeichnung Aufspaltungsmuster 1 Singlett 1 1 Dublett Triplett Quartett, Quadruplett Quintett Sextett Septett Oktett Nonett Jede Zahl entspricht der Summe der beiden darüber stehenden. Aufspaltungsmuster mit vielen Linien, die nicht notwendigerweise dem obigen Schema entsprechen müssen, bezeichnet man generell als Multiplett. Es ist zu beachten, dass sich die Kopplungen der Kerne innerhalb einer Gruppe von magnetisch äquivalenten Kernen im Spektrum nicht äussern. Dies lässt sich mit einfachen Modellvorstellungen nicht verstehen. Bei Kopplungen mit mehreren nicht magnetisch äquivalenten Kopplungspartnern, also mit unterschiedlichen Kopplungskonstanten, ist das entstehende Aufspaltungsmuster komplizierter als im obigen Fall. Um die Lage der Signale und ihre Intensitäten zu bestimmen, kann folgendes Verfahren angewandt werden: Man behandelt die Kopplungspartner nacheinander. Man beginnt mit einem beliebigen Kopplungspartner Nr. 1 (oder einer Gruppe von magnetisch äquivalenten Kopplungspartnern) und bestimmt das Kopplungsmuster Nr. 1 gemäss obigem Schema. Dann geht man zum Kopplungspartner Nr. 2 (oder einer Gruppe von magnetisch äquivalenten Kopplungspartnern) und spaltet jede Linie des Kopplungsmusters Nr. 1 gemäss dem Kopplungsmuster von Nr. 2 auf. So verfährt man mit weiteren Kopplungspartnern. Die Reihenfolge der Kopplungspartner spielt keine Rolle. Das Vorgehen wird am besten anhand eines Beispiels erläutert.
14 12 J MX J AX C C 2 Betrachtet wird das eingekreiste Proton in der Figur. Wir bezeichnen es mit X. Es gibt einen ersten Kopplungspartner M mit der Kopplungskonstanten J MX. Zwei weitere Kopplungspartner A werden als Gruppe behandelt, weil die Kopplungskonstanten J AX als gleich angenommen werden. Betrachtet wird der Fall J MX >> J AX. X X J MX J AX J AX J AX J AX J AX J AX J MX J MX Links wird zuerst die grosse Kopplung J MX betrachtet. Ohne weitere Kopplungspartner ergäbe sich ein Dublett. Aufgrund der zweiten Kopplung J AX, die für sich allein zu einem Triplett führen würde, spalten beide Linien des Dubletts in ein Triplett auf. Es ergeben sich also 6 Linien mit dem Intensitätsverhältnis 1:2:1:1:2:1. Rechts wird die Kopplung zu A zuerst behandelt. Es ergibt sich ein enges Triplett. Von diesem werden alle Linien in ein weites Dublett aufgespalten. Wie man sieht, führt dies zum gleichen Spektrum wie im Vorgehen links. Dieses Verfahren ist nur gerechtfertigt, wenn es sich um ein System erster Ordnung handelt. Es muss also gewährleistet sein, dass die chemischen Verschiebungen von X, M und A, sowie von anderen möglichen Kopplungspartnern genügend unterschiedlich sind. Als genügend kann man einen Unterschied bezeichnen, wenn er mindestens das Zehnfache der Kopplungskonstanten beträgt. Chemische Verschiebungen und Kopplungskonstanten J MX
15 13 misst man aber auf unterschiedlichen Skalen, damit sie jeweils unabhängig von der Feldstärke sind. Man muss für einen Vergleich also eine der Grössen auf die andere Skala umrechnen. Dazu ist die Kenntnis der magnetischen Feldstärke bzw. der damit verknüpften nominalen Frequenz nötig. Ein Unterschied von 1 ppm in einem 1 -NMR-Spektrum, das auf einem 500 Mz-Gerät registriert wird, beträgt also 500 z (ein Millionstel der nominalen Frequenz). Wie man sieht, kann man durch Erhöhen der Feldstärke bisweilen ein Spektrum höherer Ordnung in eines erster Ordnung überführen. Die chemische Verschiebung eines Signals mit Feinstruktur entspricht dem Schwerpunkt der Signalgruppe. Aufgrund der natürlichen Linienbreite muss eine Kopplungskonstante genügend gross sein, damit man die Linien getrennt sehen kann. Auf heutigen Routinegeräten muss die Kopplungskonstante mindestens 1 z betragen. Kleinere Kopplungen nimmt man allenfalls als Linienverbreiterungen wahr. Der räumliche Abstand der Kerne spielt keine Rolle für die Kopplung. Protonen koppeln genügend stark, wenn sie drei oder weniger Bindungen Abstand haben. Das bedeutet, dass die entsprechenden Atome, an die sie gebunden sind, selbst unmittelbar aneinander gebunden sein müssen. C C Es gibt Beispiele von kleinen Kopplungen über mehr als 3 Bindungen (Long-Range- Kopplungen), die im Spektrum sichtbar sind. Sie interessieren uns hier nur ausnahmsweise (meta-ständige Protonen in Benzolringen, siehe Übungen). Dacheffekt Man verbindet die Spitzen zweier Linien eines Multipletts, die aufgrund einer Kopplung in einem Spektrum erster Ordnung die gleiche Intensität hätten, mit einer Geraden. Zeichnet man nun auf dieser Geraden einen Pfeil nach oben, zeigt der Pfeil entweder nach links oder rechts. In dieser Richtung im Spektrum ist das Signal des Kopplungspartners zu suchen:
16 14 Integral Die Intensität der Signale ist abhängig von der Anzahl Protonen, die für das Signal verantwortlich sind. Erhöht man die Konzentration der Probemoleküle, erhält man ein stärkeres Signal. Es kann vorkommen, dass zwei oder mehrere Protonen in einem Molekül die gleiche chemische Verschiebung haben. In diesem Fall ist es nützlich, die relative Intensität der Signale untereinander zu vergleichen. Da die Signale oft in mehrere Linien aufgespalten sind, ist es nicht so klar, was mit der Intensität eines Signals gemeint ist. Die Fläche unter der ganzen Signalgruppe, also das Integral, ist proportional zur Anzahl Protonen, die das Signal verursachen. Man kann aus einem Spektrum die Integralverhältnisse ablesen. Da es nicht so einfach ist, die Fläche unter einer Kurve abzulesen, wird über das eigentliche Spektrum eine Stammfunktion, also das Integral des Spektrums, gezeichnet. Durch Ausmessen der Differenz zwischen Anfang und Ende der Stammfunktion können die Integralverhältnisse einfach erhalten werden Die Integralverhältnisse geben noch nicht die wirkliche Anzahl Protonen an. Wenn man aber eine reine Probesubstanz hat, müssen die Integrale ganzen Zahlen entsprechen. Man findet daher die wirkliche Anzahl Protonen schnell, zumal bei kleinen Molekülen, die uns hier ausschliesslich interessieren. Protonen an eteroatomen Protonen, die an Sauerstoff-, Stickstoff- oder andere eteroatome gebunden sind, zeigen zusätzliche Effekte. Die Protonen von O-Gruppen oder den N-Gruppen von Aminen können von einem Molekül zu einem anderen hüpfen (chemischer Austausch). Dadurch kann eine an sich mögliche Kopplung zu anderen Protonen verschwinden, oder es können starke Linienverbreiterungen auftreten. Die N-Gruppen von Amiden koppeln mit dem 14 N-Kern und können ebenfalls starke Linienverbreiterungen zeigen. Die auftretenden Effekte sind zudem von der Temperatur, von der Wahl des Lösungsmittels und von der Feldstärke abhängig. 13 C-NMR: In der 13 C-NMR-Spektroskopie werden Integrale im Allgemeinen nicht interpretiert. Die Spektren werden nicht in einer Art und Weise aufgenommen, dass die Signalintensitäten mit der Anzahl Kerne zusammenhängen. Da die natürliche äufigkeit von 13 C im Kohlenstoff nur 1.1% beträgt, sind die meisten C-Atome für das Spektrometer unsichtbar. Man betrachtet also ein Gemisch von Isotopomeren. Nur Moleküle, die an einer bestimmten C-
17 15 Position ein 13 C-Atom besitzen, tragen zum entsprechenden Signal bei. Kopplungen zwischen 13 C-Atomen sind im Allgemeinen nicht sichtbar. Dazu ist die Wahrscheinlichkeit zu klein, dass der Nachbar eines beobachteten 13 C-Atoms auch wieder 13 C ist. Kopplungen zu direkt gebundenen -Atomen sind dagegen im Prinzip sichtbar. Das Signal einer Methylgruppe würde also in ein Quartett aufspalten. Diese Kopplungen sind aber unerwünscht, da sie das Spektrum enorm komplizieren. Man sorgt daher durch geeignete Aufnahmebedingungen dafür, dass Kopplungen zu Protonen unterdrückt werden (breitbandentkoppeltes Spektrum). In diesem Spektrum äussert sich jede Kernsorte als ein einziges Signal. Die Anzahl direkt an den Kohlenstoff gebundener -Atome ermittelt man durch Zusatzexperimente, von denen die DEPT-Spektren in der Vorlesung vorgestellt wurden. Vorgehen beim Auswerten der Spektren Im 1 -NMR-Spektrum werden zuerst die Integrale ausgemessen. Dabei sollen Verhältnisse mit ganzen Zahlen entstehen. Schwierigkeiten können bei sehr schmalen und sehr breiten Signalen auftreten. Schmale Signale haben manchmal ein zu kleines Integral. Breite Signale verschmelzen leicht mit anderen Signalen, was das Ausmessen der Integrale erschwert. Bei sehr breiten Signalen lässt sich Anfang und Ende des Peaks nicht leicht erkennen, was zu kleine Integrale bewirken kann. Feuchtigkeit in der Probe kann zu einem zusätzlichen Wasserpeak führen oder das Integral eines anderen Peaks (chemischer Austausch) vergrössern. Die chemischen Verschiebungen reichen im 1 -NMR-Spektrum etwa von 0 10 ppm, im 13 C-NMR-Spektrum etwa von ppm, wobei ohne weiteres auch Signale ausserhalb dieses Bereiches gefunden werden können. Aliphatische Umgebungen (nur Einfachbindungen) äussern sich durch kleine chemische Verschiebungen, typischerweise unterhalb von 5 ppm ( 1 ) bzw. 100 ppm ( 13 C), wobei elektronegative eteroatome in der Nachbarschaft zu grossen chemischen Verschiebungen führen. Oberhalb dieser Grenzen findet man hauptsächlich aromatische und olefinische Umgebungen (Doppelbindungen). Der Einfluss von eteroatomen ist dabei schwieriger vorherzusagen. Am wertvollsten in der NMR-Spektroskopie ist die Kopplungsinformation. Die Aufspaltungsmuster in einem 1 -NMR-Spektrum sind aber nicht immer einfach zu interpretieren. Die Überlagerung von Signalen und Effekte höherer Ordnung können zu Schwierigkeiten führen. Dabei können mehrdimensionale Verfahren Abhilfe schaffen. In der Vorlesung wurden die Experimante,-COSY, SQC und MBC vorgestellt. Die Spektren sind zwar sehr einfach zu interpretieren, Effekte höherer Ordnung sowie Abweichungen von den vorausgesetzten experimentellen Parametern können jedoch zu Artefakten führen.
P105. Konstitution. Massenspektrum 100 % m/z
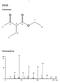 1 P105 Konstitution 7 1 2 6 8 4 5 Massenspektrum 100 % 4 116 50 7 101 29 55 88 15 61 10 14 158 0 0 50 100 150 m/z 2 Direkte Fragmentierungen: 4 115 11 45 129 29 85 7 Damit lassen sich die prominenten Signale
1 P105 Konstitution 7 1 2 6 8 4 5 Massenspektrum 100 % 4 116 50 7 101 29 55 88 15 61 10 14 158 0 0 50 100 150 m/z 2 Direkte Fragmentierungen: 4 115 11 45 129 29 85 7 Damit lassen sich die prominenten Signale
Kernmagnetische Resonanzspektroskopie (NMR) Spektroskopische Methoden
 Kernmagnetische Resonanzspektroskopie (NMR) Spektroskopische Methoden Grundlagen Die meisten Atomkerne führen eine Drehbewegung um die eigene Achse aus ("Spin"). Da sie geladene Teilchen (Protonen) enthalten,
Kernmagnetische Resonanzspektroskopie (NMR) Spektroskopische Methoden Grundlagen Die meisten Atomkerne führen eine Drehbewegung um die eigene Achse aus ("Spin"). Da sie geladene Teilchen (Protonen) enthalten,
Z 12 1) BESTIMMUNG DER SUMMENFORMEL: a. AUS DEN MASSENPROZENTEN
 ANALYTIK 1) BESTIMMUNG DER SUMMENFORMEL: a. AUS DEN MASSENPROZENTEN Ziel: Ermittlung einer Summenformel einer Substanz aus C, und O wenn die Massenprozent der Elemente und die Molmasse M r der Substanz
ANALYTIK 1) BESTIMMUNG DER SUMMENFORMEL: a. AUS DEN MASSENPROZENTEN Ziel: Ermittlung einer Summenformel einer Substanz aus C, und O wenn die Massenprozent der Elemente und die Molmasse M r der Substanz
Schriftliche Prüfung BSc Frühling 2006 D CHAB/BIOL. Musterlösung. für den Teil Spektroskopie
 Prüfungen Analytische Chemie Mittwoch, 8. März 2006 Schriftliche Prüfung BSc Frühling 2006 D CAB/BIL Musterlösung für den Teil Spektroskopie Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die
Prüfungen Analytische Chemie Mittwoch, 8. März 2006 Schriftliche Prüfung BSc Frühling 2006 D CAB/BIL Musterlösung für den Teil Spektroskopie Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die
Übungsaufgaben zur NMR-Spektrometrie
 Übungsaufgaben NMR 33 Übungsaufgaben zur NMR-Spektrometrie Aufgabe 1 a) Wieviele unterschiedliche Orientierungen des Kernmomentes relativ zu einem externen Magnetfeld sind beim 14 N-Kern (I = 1, γ = 1.932
Übungsaufgaben NMR 33 Übungsaufgaben zur NMR-Spektrometrie Aufgabe 1 a) Wieviele unterschiedliche Orientierungen des Kernmomentes relativ zu einem externen Magnetfeld sind beim 14 N-Kern (I = 1, γ = 1.932
Spektroskopie-Seminar SS NMR-Spektroskopie. H-NMR-Spektroskopie. nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie
 1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 4.1 Allgemeines Spektroskopische Methode zur Untersuchung von Atomen: elektronische Umgebung Wechselwirkung
1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 4.1 Allgemeines Spektroskopische Methode zur Untersuchung von Atomen: elektronische Umgebung Wechselwirkung
NMR-Spektroskopie Teil 2
 BC 3.4 : Analytische Chemie I NMR Teil 2 NMR-Spektroskopie Teil 2 Stefanie Wolfram Stefanie.Wolfram.1@uni-jena.de Raum 228, TO Vom Spektrum zur Struktur 50000 40000 Peaks u. Integrale 30000 Chemische Verschiebung
BC 3.4 : Analytische Chemie I NMR Teil 2 NMR-Spektroskopie Teil 2 Stefanie Wolfram Stefanie.Wolfram.1@uni-jena.de Raum 228, TO Vom Spektrum zur Struktur 50000 40000 Peaks u. Integrale 30000 Chemische Verschiebung
Schriftliche Prüfung BSc Herbst 2007 D CHAB/BIOL. Musterlösung. für den Teil Spektroskopie
 Prüfungen Analytische Chemie Montag, 3. September 2007 Schriftliche Prüfung BSc Herbst 2007 D CHAB/BIOL Musterlösung für den Teil Spektroskopie Vorname:... Name:... Jede Aufgabe wird separat bewertet.
Prüfungen Analytische Chemie Montag, 3. September 2007 Schriftliche Prüfung BSc Herbst 2007 D CHAB/BIOL Musterlösung für den Teil Spektroskopie Vorname:... Name:... Jede Aufgabe wird separat bewertet.
Spektroskopiemodul II. H-NMR und 13 C-NMR
 Spektroskopiemodul II 1 H-NMR und 13 C-NMR 1 1. Was gehört zu einer vollständigen Spektreninterpretation zur Strukturaufklärung? 1.1. 1 H-NMR-Spektren Man muss die chemische Verschiebung jedes einzelnen
Spektroskopiemodul II 1 H-NMR und 13 C-NMR 1 1. Was gehört zu einer vollständigen Spektreninterpretation zur Strukturaufklärung? 1.1. 1 H-NMR-Spektren Man muss die chemische Verschiebung jedes einzelnen
Kernmagnetismus und Magnetfelder
 Kernmagnetismus und Magnetfelder. Kernspin Die meisten Kerne besitzen einen Eigendrehimpuls oder P ist gequantelt P = h I(I + ) h = h und h: das Plancksche Wirkungsquantum. π I: Kernspinquantenzahl (kurz:
Kernmagnetismus und Magnetfelder. Kernspin Die meisten Kerne besitzen einen Eigendrehimpuls oder P ist gequantelt P = h I(I + ) h = h und h: das Plancksche Wirkungsquantum. π I: Kernspinquantenzahl (kurz:
Teil 2 NMR-Spektroskopie. Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18
 Teil 2 NMR-Spektroskopie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18 www.ruhr-uni-bochum.de/chirality 1 Rückblick Chemische Verschiebung Chemische Umgebung Funktionelle Gruppen Signalintensitäten
Teil 2 NMR-Spektroskopie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18 www.ruhr-uni-bochum.de/chirality 1 Rückblick Chemische Verschiebung Chemische Umgebung Funktionelle Gruppen Signalintensitäten
Spektroskopie-Seminar SS NMR-Spektroskopie. H-NMR-Spektroskopie. nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie
 1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 4 NMR-Spektroskopie 5.1 1 H-NMR-Spektroskopie Wasserstoffatome ( 1 H, natürliche Häufigkeit 99,985 %) mit
1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 4 NMR-Spektroskopie 5.1 1 H-NMR-Spektroskopie Wasserstoffatome ( 1 H, natürliche Häufigkeit 99,985 %) mit
NMR - Seite 1. NMR (Kernresonanzspektroskopie) Allgemeines zur Theorie
 NMR - Seite 1 NMR (Kernresonanzspektroskopie) Allgemeines zur Theorie Protonen besitzen ebenso wie Elektronen einen eigenen Spin (Drehung um die eigene Achse).Allerdings gibt es mehrere Möglichkeiten als
NMR - Seite 1 NMR (Kernresonanzspektroskopie) Allgemeines zur Theorie Protonen besitzen ebenso wie Elektronen einen eigenen Spin (Drehung um die eigene Achse).Allerdings gibt es mehrere Möglichkeiten als
Schriftliche Prüfung BSc Frühling 2014
 Prüfungen Analytische Chemie Samstag, 1. Februar 2014 Schriftliche Prüfung BSc Frühling 2014 D CHAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Samstag, 1. Februar 2014 Schriftliche Prüfung BSc Frühling 2014 D CHAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Kombinierte Übungen zur Spektroskopie Beispiele für die Bearbeitung
 Im folgenden soll gezeigt werden, daß es großen Spaß macht, spektroskopische Probleme zu lösen. Es gibt kein automatisches Lösungsschema, sondern höchstens Strategien, wie beim "Puzzle Lösen"; häufig hilft
Im folgenden soll gezeigt werden, daß es großen Spaß macht, spektroskopische Probleme zu lösen. Es gibt kein automatisches Lösungsschema, sondern höchstens Strategien, wie beim "Puzzle Lösen"; häufig hilft
Schriftliche Prüfung BSc Frühling 2008 D CHAB/BIOL. Musterlösung. für den Teil Spektroskopie
 Prüfungen Analytische Chemie Samstag, 9. Februar 2008 Schriftliche Prüfung BSc Frühling 2008 D CHAB/BIL Musterlösung für den Teil Spektroskopie Vorname:... Name:... Jede Aufgabe wird separat bewertet.
Prüfungen Analytische Chemie Samstag, 9. Februar 2008 Schriftliche Prüfung BSc Frühling 2008 D CHAB/BIL Musterlösung für den Teil Spektroskopie Vorname:... Name:... Jede Aufgabe wird separat bewertet.
Spinsysteme. AX 3 -Spinsystem
 Spinsysteme Eine Gruppe aus zwei oder mehreren Kernspins, die miteinander eine magnetische Wechselwirkung eingehen, bezeichnet man als ein Spinsystem. Die Struktur eines hochaufgelösten NMR-Spektrums und
Spinsysteme Eine Gruppe aus zwei oder mehreren Kernspins, die miteinander eine magnetische Wechselwirkung eingehen, bezeichnet man als ein Spinsystem. Die Struktur eines hochaufgelösten NMR-Spektrums und
Schriftliche Prüfung BSc Frühling 2008
 Prüfungen Analytische Chemie Samstag, 9. Februar 2008 Schriftliche Prüfung BSc Frühling 2008 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Samstag, 9. Februar 2008 Schriftliche Prüfung BSc Frühling 2008 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Einführung in die NMR-Spektroskopie. NMR-Spektroskopie. Teil 1: Einführung und Grundlagen der 1 H NMR. Das NMR Spektrometer
 NMR-Spektroskopie Einführung in die NMR-Spektroskopie m I = - /2 (β) Teil : Einführung und Grundlagen der NMR E E. Physikalische und apparative Grundlagen m I = + /2 (α).2 Das D NMR Experiment.3 Die chemische
NMR-Spektroskopie Einführung in die NMR-Spektroskopie m I = - /2 (β) Teil : Einführung und Grundlagen der NMR E E. Physikalische und apparative Grundlagen m I = + /2 (α).2 Das D NMR Experiment.3 Die chemische
Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2004
 Prüfungen Analytische Chemie Dienstag, 1. September 4 Schriftliche Prüfung. Vordiplom / BSc erbst 4 D CAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Dienstag, 1. September 4 Schriftliche Prüfung. Vordiplom / BSc erbst 4 D CAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2004 D CHAB/BIOL. Musterlösung
 Prüfungen Analytische Chemie Dienstag, 21. September 4 Schriftliche Prüfung 2. Vordiplom / BSc erbst 4 D CAB/BIL Musterlösung Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Prüfungen Analytische Chemie Dienstag, 21. September 4 Schriftliche Prüfung 2. Vordiplom / BSc erbst 4 D CAB/BIL Musterlösung Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Spektroskopische Methoden in der Organischen Chemie (OC IV) NMR Spektroskopie 1. Physikalische Grundlagen
 NMR Spektroskopie 1. Physikalische Grundlagen Viele Atomkerne besitzen einen von Null verschiedenen Eigendrehimpuls (Spin) p=ħ I, der ganz oder halbzahlige Werte von ħ betragen kann. I bezeichnet die Kernspin-Quantenzahl.
NMR Spektroskopie 1. Physikalische Grundlagen Viele Atomkerne besitzen einen von Null verschiedenen Eigendrehimpuls (Spin) p=ħ I, der ganz oder halbzahlige Werte von ħ betragen kann. I bezeichnet die Kernspin-Quantenzahl.
Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2006
 Prüfungen Analytische Chemie Mittwoch, 27. September 2006 Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2006 D CHAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Prüfungen Analytische Chemie Mittwoch, 27. September 2006 Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2006 D CHAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Spektroskopie-Seminar SS NMR-Spektroskopie. H-NMR-Spektroskopie. nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie
 1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 5.1 1 H-NMR-Spektroskopie NMR-Spektrum liefert folgende Informationen: Chemische Verschiebung d (in ppm):
1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 5.1 1 H-NMR-Spektroskopie NMR-Spektrum liefert folgende Informationen: Chemische Verschiebung d (in ppm):
Schriftliche Prüfung BSc Frühling 2006
 Prüfungen Analytische Chemie Mittwoch, 8. März 2006 Schriftliche Prüfung BSc Frühling 2006 D CAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt 36.
Prüfungen Analytische Chemie Mittwoch, 8. März 2006 Schriftliche Prüfung BSc Frühling 2006 D CAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt 36.
Kurs "Spektroskopische Methoden in der Anorganischen und Organischen Chemie" Kernresonanzspektroskopie - Übungen Lösung zu NMR-6 (Blatt 1)
 Kernresonanzspektroskopie - Übungen Lösung zu NMR-6 (Blatt ) Zum Lösungsmittel: Das Kohlenstoffspektrum zeigt bei 77 ppm drei gleich große äquidistante Signale. Diese stammen von CDC 3. Chemische Verschiebungen
Kernresonanzspektroskopie - Übungen Lösung zu NMR-6 (Blatt ) Zum Lösungsmittel: Das Kohlenstoffspektrum zeigt bei 77 ppm drei gleich große äquidistante Signale. Diese stammen von CDC 3. Chemische Verschiebungen
13 C, 1 H-Kopplungskonstanten. 13 C, 1 H-Kopplungen hier leichter erkannt werden können. Spektroskopie in der Organischen Chemie
 Spektroskopie in der Organischen hemie 13, 1 -Kopplungskonstanten NMR-Signalaufspaltungen aufgrund von skalaren Kopplungen treten grundsätzlich bei beiden Kopplungspartnern auf. Entsprechend kann man 13,
Spektroskopie in der Organischen hemie 13, 1 -Kopplungskonstanten NMR-Signalaufspaltungen aufgrund von skalaren Kopplungen treten grundsätzlich bei beiden Kopplungspartnern auf. Entsprechend kann man 13,
Schriftliche Prüfung BSc Herbst 2013
 Prüfungen Analytische Chemie Dienstag, 13. August 2013 Schriftliche Prüfung BSc Herbst 2013 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Dienstag, 13. August 2013 Schriftliche Prüfung BSc Herbst 2013 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
III. Strukturbestimmung organischer Moleküle
 III. Strukturbestimmung organischer Moleküle Röntgenstrukturbestimmung g Spektroskopie UV-VIS IR NMR Massenspektrometrie (MS) Röntgenstruktur eines bakteriellen Kohlenhydrats O O O O O O O C3 Röntgenstruktur
III. Strukturbestimmung organischer Moleküle Röntgenstrukturbestimmung g Spektroskopie UV-VIS IR NMR Massenspektrometrie (MS) Röntgenstruktur eines bakteriellen Kohlenhydrats O O O O O O O C3 Röntgenstruktur
Spektroskopie-Seminar WS 17/18 5 NMR-Spektroskopie. H-NMR-Spektroskopie. nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie
 WS 17/18 1 -NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 1 5.1 1 -NMR-Spektroskopie NMR-Spektrum liefert folgende Informationen: Chemische Verschiebung δ(in
WS 17/18 1 -NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 1 5.1 1 -NMR-Spektroskopie NMR-Spektrum liefert folgende Informationen: Chemische Verschiebung δ(in
Die Strukturabhängigkeit der chemischen Verschiebung
 Die Strukturabhängigkeit der chemischen Verschiebung. Abschirmung in einem Atom (wie bisher geschildert) Die Elektronenverteilung in einem Wasserstoffatom ist sphärisch. B 0 0 0000000 000000000 000000000
Die Strukturabhängigkeit der chemischen Verschiebung. Abschirmung in einem Atom (wie bisher geschildert) Die Elektronenverteilung in einem Wasserstoffatom ist sphärisch. B 0 0 0000000 000000000 000000000
NMR Spektroskopie. 1nm Frequenz X-ray UV/VIS Infrared Microwave Radio
 NMR Spektroskopie 1nm 10 10 2 10 3 10 4 10 5 10 6 10 7 Frequenz X-ray UV/VIS Infrared Microwave Radio Anregungsmodus electronic Vibration Rotation Nuclear Spektroskopie X-ray UV/VIS Infrared/Raman NMR
NMR Spektroskopie 1nm 10 10 2 10 3 10 4 10 5 10 6 10 7 Frequenz X-ray UV/VIS Infrared Microwave Radio Anregungsmodus electronic Vibration Rotation Nuclear Spektroskopie X-ray UV/VIS Infrared/Raman NMR
Schriftliche Prüfung 2. Vordiplom Herbst 2003
 Prüfungen Analytische hemie Mittwoch, 1. ktober 2003 Schriftliche Prüfung 2. Vordiplom erbst 2003 D AB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische hemie Mittwoch, 1. ktober 2003 Schriftliche Prüfung 2. Vordiplom erbst 2003 D AB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Spektroskopie-Seminar SS Infrarot-Spektroskopie. Infrarot-Spektroskopie
 Infrarot-Spektroskopie 3.1 Schwingungsmodi Moleküle werden mit Licht im Infrarot-Bereich (400-4000 cm -1 ) bestrahlt Durch Absorption werden Schwingungen im Molekül angeregt Im IR-Spektrum werden die absorbierten
Infrarot-Spektroskopie 3.1 Schwingungsmodi Moleküle werden mit Licht im Infrarot-Bereich (400-4000 cm -1 ) bestrahlt Durch Absorption werden Schwingungen im Molekül angeregt Im IR-Spektrum werden die absorbierten
Merke: Zwei Oszillatoren koppeln am stärksten, wenn sie die gleiche Eigenfrequenz besitzen. RESONANZ
 Merke: Zwei Oszillatoren koppeln am stärksten, wenn sie die gleiche Eigenfrequenz besitzen. RESONANZ Viele Kerne besitzen einen Spindrehimpuls. Ein Kern mit der Spinquantenzahl I hat einen Drehimpuls (L)
Merke: Zwei Oszillatoren koppeln am stärksten, wenn sie die gleiche Eigenfrequenz besitzen. RESONANZ Viele Kerne besitzen einen Spindrehimpuls. Ein Kern mit der Spinquantenzahl I hat einen Drehimpuls (L)
Spektroskopie-Seminar SS 18 8 Massenspektrometrie Massenspektrometrie
 SS 18 Massenspektrometrie 1 8.1 Prinzip Methode zur Bestimmung der Masse von Molekülen Analyt wird in die Gasphase überführt Moleküle werden ionisiert und durch elektrisches Feld beschleunigt Auftrennung
SS 18 Massenspektrometrie 1 8.1 Prinzip Methode zur Bestimmung der Masse von Molekülen Analyt wird in die Gasphase überführt Moleküle werden ionisiert und durch elektrisches Feld beschleunigt Auftrennung
Spektroskopie-Seminar WS 17/18 3 Infrarot-Spektroskopie. Infrarot-Spektroskopie
 WS 17/18 Infrarot-Spektroskopie 1 3.1 Schwingungsmodi Moleküle werden mit Licht im Infrarot-Bereich (400-4000 cm -1 ) bestrahlt Durch Absorption werden Schwingungen im Molekül angeregt Im IR-Spektrum werden
WS 17/18 Infrarot-Spektroskopie 1 3.1 Schwingungsmodi Moleküle werden mit Licht im Infrarot-Bereich (400-4000 cm -1 ) bestrahlt Durch Absorption werden Schwingungen im Molekül angeregt Im IR-Spektrum werden
Spektroskopie-Seminar SS NMR-Spektroskopie. C-NMR-Spektroskopie und 2D-Spektroskopie
 13 C-NMR-Spektroskopie und 2D-Spektroskopie 6.1 Allgemeines Kernresonanz: Wechselwirkungen zwischen dem magnetischen Moment von Atomkernen mit einem magnetischen Wechselfeld Nur solche Isotope können untersucht
13 C-NMR-Spektroskopie und 2D-Spektroskopie 6.1 Allgemeines Kernresonanz: Wechselwirkungen zwischen dem magnetischen Moment von Atomkernen mit einem magnetischen Wechselfeld Nur solche Isotope können untersucht
18. Strukturaufklärung in der Organischen Chemie
 Inhalt Index 18. Strukturaufklärung in der Organischen Chemie Die Kenntnis der zahlreichen organischen Reaktionen und funktionellen Gruppen, die in den vorangegangenen Kapiteln vorgestellt wurden, sollten
Inhalt Index 18. Strukturaufklärung in der Organischen Chemie Die Kenntnis der zahlreichen organischen Reaktionen und funktionellen Gruppen, die in den vorangegangenen Kapiteln vorgestellt wurden, sollten
Kernmagnetische Resonanzspektroskopie. N Nuclear M Magnetic R Resonance Beobachtung magnetisch aktiver Kerne in einem äußeren Magnetfeld
 NMR- SPEKTROSKOPIE Prüfungsfrage Radiospektroskopische Methode: NMR. Das Spin und magnetische Moment, die Bedingung der Resonanz, Spektralspaltung, chemische Verschiebung. Kernmagnetische Resonanzspektroskopie
NMR- SPEKTROSKOPIE Prüfungsfrage Radiospektroskopische Methode: NMR. Das Spin und magnetische Moment, die Bedingung der Resonanz, Spektralspaltung, chemische Verschiebung. Kernmagnetische Resonanzspektroskopie
Chemisches Grundpraktikum II (270002) Kernresonanzspektroskopie. NMR-Spektroskopie
 hemisches Grundpraktikum II (270002) Kernresonanzspektroskopie NMR-Spektroskopie (Nuclear Magnetic Resonance). Kählig, SS 2010 Von der Substanz zur Struktur Substanz NMR - Spektren Struktur N N 1 Spektroskopie
hemisches Grundpraktikum II (270002) Kernresonanzspektroskopie NMR-Spektroskopie (Nuclear Magnetic Resonance). Kählig, SS 2010 Von der Substanz zur Struktur Substanz NMR - Spektren Struktur N N 1 Spektroskopie
Übungen Atom- und Molekülphysik für Physiklehrer (Teil 2)
 Übungen Atom- und Molekülphysik für Physiklehrer (Teil ) Aufgabe 38) Welche J-Werte sind bei den Termen S, P, 4 P und 5 D möglich? Aufgabe 39) Welche Werte kann der Gesamtdrehimpuls eines f-elektrons im
Übungen Atom- und Molekülphysik für Physiklehrer (Teil ) Aufgabe 38) Welche J-Werte sind bei den Termen S, P, 4 P und 5 D möglich? Aufgabe 39) Welche Werte kann der Gesamtdrehimpuls eines f-elektrons im
Protokoll. Kombinierte Anwendung verschiedener Spektroskopischer Methoden
 Protokoll Kombinierte Anwendung verschiedener Spektroskopischer Methoden Zielstellung: Durch die Auswertung von IR-, Raman-, MR-, UV-VIS- und Massenspektren soll die Struktur einer unbekannten Substanz
Protokoll Kombinierte Anwendung verschiedener Spektroskopischer Methoden Zielstellung: Durch die Auswertung von IR-, Raman-, MR-, UV-VIS- und Massenspektren soll die Struktur einer unbekannten Substanz
Infrarot-Spektroskopie
 SoSe 19 Infrarot-Spektroskopie E = h v = h c ሚθ E = Energie; h = Planck sches Wirkungsquantum; v = Frequenz; c = Lichtgeschwindigkeit, ሚθ = Wellenzahl 1 3.1 Schwingungsmodi T / % Moleküle werden mit Licht
SoSe 19 Infrarot-Spektroskopie E = h v = h c ሚθ E = Energie; h = Planck sches Wirkungsquantum; v = Frequenz; c = Lichtgeschwindigkeit, ሚθ = Wellenzahl 1 3.1 Schwingungsmodi T / % Moleküle werden mit Licht
Massenspektrometrie (MS)
 Massenspektrometrie (MS) Die Massenspektrometrie ist unter den heute routinemäßig verwendeten Methoden die jüngste, denn ihre Anwendung begann erst um 1960. Seit den Arbeiten von BIEMANN über Fragmentierungsmuster
Massenspektrometrie (MS) Die Massenspektrometrie ist unter den heute routinemäßig verwendeten Methoden die jüngste, denn ihre Anwendung begann erst um 1960. Seit den Arbeiten von BIEMANN über Fragmentierungsmuster
Schriftliche Prüfung BSc Frühling 2010
 Prüfungen Analytische Chemie Donnerstag, 11. Februar 2010 Schriftliche Prüfung BSc Frühling 2010 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Donnerstag, 11. Februar 2010 Schriftliche Prüfung BSc Frühling 2010 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Wechselwirkung zwischen Licht und chemischen Verbindungen
 Photometer Zielbegriffe Photometrie. Gesetz v. Lambert-Beer, Metallkomplexe, Elektronenanregung, Flammenfärbung, Farbe Erläuterungen Die beiden Versuche des 4. Praktikumstages sollen Sie mit der Photometrie
Photometer Zielbegriffe Photometrie. Gesetz v. Lambert-Beer, Metallkomplexe, Elektronenanregung, Flammenfärbung, Farbe Erläuterungen Die beiden Versuche des 4. Praktikumstages sollen Sie mit der Photometrie
Schriftliche Prüfung BSc Herbst 2013 D CHAB/BIOL. Musterlösung
 Prüfungen Analytische Chemie Dienstag, 13. August 2013 Schriftliche Prüfung BSc Herbst 2013 D CHAB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl
Prüfungen Analytische Chemie Dienstag, 13. August 2013 Schriftliche Prüfung BSc Herbst 2013 D CHAB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl
Finale (O-ho!) Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17
 Finale (O-ho!) Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17 www.ruhr-uni-bochum.de/chirality Rückblick: IR Schwingung von Atomen kann im klassischen Bild als harmonische Schwingung (harmonischer
Finale (O-ho!) Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17 www.ruhr-uni-bochum.de/chirality Rückblick: IR Schwingung von Atomen kann im klassischen Bild als harmonische Schwingung (harmonischer
NMR Spektroskopie (Nuclear Magnetic Resonance Kern-Magnetische Resonanz)
 NMR Spektroskopie (Nuclear Magnetic Resonance Kern-Magnetische Resonanz) Viele Atomkerne besitzen einen von Null verschiedenen Eigendrehimpuls (Spin) p = ħ I, der ganz - oder halbzahlige Werte von ħ betragen
NMR Spektroskopie (Nuclear Magnetic Resonance Kern-Magnetische Resonanz) Viele Atomkerne besitzen einen von Null verschiedenen Eigendrehimpuls (Spin) p = ħ I, der ganz - oder halbzahlige Werte von ħ betragen
Finale (O-ho!) Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18
 Finale (O-ho!) Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18 www.ruhr-uni-bochum.de/chirality Rückblick: IR Schwingung von Atomen kann im klassischen Bild als harmonische Schwingung (harmonischer
Finale (O-ho!) Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18 www.ruhr-uni-bochum.de/chirality Rückblick: IR Schwingung von Atomen kann im klassischen Bild als harmonische Schwingung (harmonischer
Spektroskopie in der Organischen Chemie. 1 H, 1 H-Kopplungskonstanten. Geminale Kopplungen
 Spektroskopie in der rganischen hemie Geminale Kopplungen 1, 1 -Kopplungskonstanten Wenn sich die beiden Kopplungspartner (wie Zwillinge; lat.: gemini) am gleichen Kohlenstoffatom befinden, also nur zwei
Spektroskopie in der rganischen hemie Geminale Kopplungen 1, 1 -Kopplungskonstanten Wenn sich die beiden Kopplungspartner (wie Zwillinge; lat.: gemini) am gleichen Kohlenstoffatom befinden, also nur zwei
Analytische Methoden in Org. Chemie und optische Eigenschaften von chiralen Molekülen
 Analytische Methoden in Org. Chemie und optische Eigenschaften von chiralen Molekülen Seminar 5. 0. 200 Teil : NMR Spektroskopie. Einführung und Physikalische Grundlagen.2 H NMR Parameter: a) Chemische
Analytische Methoden in Org. Chemie und optische Eigenschaften von chiralen Molekülen Seminar 5. 0. 200 Teil : NMR Spektroskopie. Einführung und Physikalische Grundlagen.2 H NMR Parameter: a) Chemische
1 Terminologie. 1) Die Bezeichnung Massenspektroskop wird praktisch nicht mehr verwendet; für Massenspektrograph siehe Abschnitt
 O:/Wiley/Budzikiewicz/3d/c01.3d from 13.06.2012 13:11:03 Teil I Grundlagen O:/Wiley/Budzikiewicz/3d/c01.3d from 13.06.2012 13:11:03 O:/Wiley/Budzikiewicz/3d/c01.3d from 13.06.2012 13:11:03 3 1 Terminologie
O:/Wiley/Budzikiewicz/3d/c01.3d from 13.06.2012 13:11:03 Teil I Grundlagen O:/Wiley/Budzikiewicz/3d/c01.3d from 13.06.2012 13:11:03 O:/Wiley/Budzikiewicz/3d/c01.3d from 13.06.2012 13:11:03 3 1 Terminologie
Schriftliche Prüfung BSc Herbst 2007
 Prüfungen Analytische Chemie Montag, 3. September 2007 Schriftliche Prüfung BSc Herbst 2007 D CHAB/BIOL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Montag, 3. September 2007 Schriftliche Prüfung BSc Herbst 2007 D CHAB/BIOL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
NMR-Spektroskopie Teil 2
 BC 3.4 : Analytische Chemie I NMR Teil 2 NMR-Spektroskopie Teil 2 Stefanie Wolfram Stefanie.Wolfram.1@uni-jena.de Raum 228, TO Vom Spektrum zur Struktur 50000 40000 Peaks u. Integrale 30000 Chemische Verschiebung
BC 3.4 : Analytische Chemie I NMR Teil 2 NMR-Spektroskopie Teil 2 Stefanie Wolfram Stefanie.Wolfram.1@uni-jena.de Raum 228, TO Vom Spektrum zur Struktur 50000 40000 Peaks u. Integrale 30000 Chemische Verschiebung
Bestimmung der Struktur einer (un)bekannten Verbindung
 Bestimmung der Struktur einer (un)bekannten Verbindung Elementaranalyse Massenspektrometrie andere spektroskopische Methoden Röntgen- Strukturanalyse Kernmagnetische Resonanz - Spektroskopie H 3 C H 3
Bestimmung der Struktur einer (un)bekannten Verbindung Elementaranalyse Massenspektrometrie andere spektroskopische Methoden Röntgen- Strukturanalyse Kernmagnetische Resonanz - Spektroskopie H 3 C H 3
NMR-Spektroskopie. Magnet. Steuerung. Probenrohr Spinner. Shimspulen. B -Spulen. Gradient 2. Vorverstärker
 NMR-Spektroskopie Magnet Steuerung He He CPU Frequenz Pulsform Pulsleistung Zeitkontrolle Temperierung Gradienten Shim/Lock/Gas Vorverstärker N N Probenrohr Spinner Shimspulen B -Spulen Gradient 2 H K
NMR-Spektroskopie Magnet Steuerung He He CPU Frequenz Pulsform Pulsleistung Zeitkontrolle Temperierung Gradienten Shim/Lock/Gas Vorverstärker N N Probenrohr Spinner Shimspulen B -Spulen Gradient 2 H K
Schriftliche Prüfung 2. Vordiplom Frühling 2004 D CHAB/BIOL. Musterlösung
 Prüfungen Analytische Chemie Montag, 10. März 004 Schriftliche Prüfung. Vordiplom Frühling 004 D CAB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl
Prüfungen Analytische Chemie Montag, 10. März 004 Schriftliche Prüfung. Vordiplom Frühling 004 D CAB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl
Schriftliche Prüfung 2. Vordiplom / BSc Frühling 2005 D CHAB/BIOL. Musterlösung
 Prüfungen Analytische Chemie Dienstag, 1. März 2005 Schriftliche Prüfung 2. Vordiplom / BSc Frühling 2005 D CHAB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Prüfungen Analytische Chemie Dienstag, 1. März 2005 Schriftliche Prüfung 2. Vordiplom / BSc Frühling 2005 D CHAB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
2. Elektroneneffekte in den organischen Molekülen
 2. Elektroneneffekte in den organischen Molekülen Induktive und mesomere Effekte Die Ladungsverteilung in einer Kohlenwasserstoffkette wird durch Substituenten (Halogen, OH, NH 2 usw.) beeinflusst. Man
2. Elektroneneffekte in den organischen Molekülen Induktive und mesomere Effekte Die Ladungsverteilung in einer Kohlenwasserstoffkette wird durch Substituenten (Halogen, OH, NH 2 usw.) beeinflusst. Man
4 Synthesen antiprionen-aktiver Verbindungen
 4 Synthesen antiprionen-aktiver Verbindungen Quinacrinanaloga (Grundstruktur C) 77 4 Synthesen antiprionen-aktiver Verbindungen 4.1 Synthesen der Quinacrinanaloga (Grundstruktur C) Die Synthesen der Quinacrinanaloga
4 Synthesen antiprionen-aktiver Verbindungen Quinacrinanaloga (Grundstruktur C) 77 4 Synthesen antiprionen-aktiver Verbindungen 4.1 Synthesen der Quinacrinanaloga (Grundstruktur C) Die Synthesen der Quinacrinanaloga
IR-Spektroskopie Seminar Analytische Chemie I (BC3.4, MCB B1; WS2016/17) Dr. Peter Bellstedt NMR Plattform IAAC & IOMC
 IR-Spektroskopie Seminar Analytische Chemie I (BC3.4, MCB B1; WS2016/17) Dr. Peter Bellstedt NMR Plattform IAAC & IOMC Peter.Bellstedt@uni-jena.de Terminübersicht (14 täg.) Gruppe 1 Gruppe 2 1. Seminar
IR-Spektroskopie Seminar Analytische Chemie I (BC3.4, MCB B1; WS2016/17) Dr. Peter Bellstedt NMR Plattform IAAC & IOMC Peter.Bellstedt@uni-jena.de Terminübersicht (14 täg.) Gruppe 1 Gruppe 2 1. Seminar
Massenspektrometrie (MS)
 Massenspektrometrie (MS) Die Massenspektrometrie ist unter den heute routinemäßig verwendeten Methoden die jüngste, denn ihre Anwendung begann erst um 1960. Seit den Arbeiten von BIEMANN über Fragmentierungsmuster
Massenspektrometrie (MS) Die Massenspektrometrie ist unter den heute routinemäßig verwendeten Methoden die jüngste, denn ihre Anwendung begann erst um 1960. Seit den Arbeiten von BIEMANN über Fragmentierungsmuster
Kernmagnetische Resonanz NMR
 Kernmagnetische Resonanz: NMR F. Bloch E.M. Purcell: NMR 195 Physik Standard-Technik zur Strukturanalyse in der Organischen Chemie Kernmagnetische Resonanz NMR Kern: Eigenschaft der Atomkerne wird Kernspin
Kernmagnetische Resonanz: NMR F. Bloch E.M. Purcell: NMR 195 Physik Standard-Technik zur Strukturanalyse in der Organischen Chemie Kernmagnetische Resonanz NMR Kern: Eigenschaft der Atomkerne wird Kernspin
Übungsaufgaben NMR-Spektroskopie (1)
 Übungsaufgaben NMR-Spektroskopie (1) 1. Kerne haben drei wichtige Eigenschaften: Masse m, Ladung Q und Eigendrehimpuls p. Kernsorte Spin natürliche Häufigkeit Gyromagnet. Verhältnis γ [Tsec] 1 1 H 1/2
Übungsaufgaben NMR-Spektroskopie (1) 1. Kerne haben drei wichtige Eigenschaften: Masse m, Ladung Q und Eigendrehimpuls p. Kernsorte Spin natürliche Häufigkeit Gyromagnet. Verhältnis γ [Tsec] 1 1 H 1/2
Schriftliche Prüfung 2. Vordiplom Frühling 2004
 Prüfungen Analytische Chemie Montag, 10. März 2004 Schriftliche Prüfung 2. Vordiplom Frühling 2004 D CAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Montag, 10. März 2004 Schriftliche Prüfung 2. Vordiplom Frühling 2004 D CAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Terminologie. Die Ausdrücke Massenspektrometer
 I Grundlagen Massenspektrometrie, Fünfte Auflage. H. Budzikiewicz, M. Schäfer Copyright 2005 WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim ISBN: 3-527-30822-9 7 1 Terminologie Ein Massenspektrometer ist
I Grundlagen Massenspektrometrie, Fünfte Auflage. H. Budzikiewicz, M. Schäfer Copyright 2005 WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim ISBN: 3-527-30822-9 7 1 Terminologie Ein Massenspektrometer ist
Vorbereitung. µ z = mγ h (1) γ = gq 2m wobei q die Ladung und m die Masse des Teilchens beschreiben.
 Physikalisches Fortgeschrittenenpraktikum NMR-Spektroskopie Vorbereitung Armin Burgmeier Robert Schittny 1. Theoretische Grundlagen 1.1. Kerndrehimpuls und magnetisches Moment Nach der Quantentheorie besitzt
Physikalisches Fortgeschrittenenpraktikum NMR-Spektroskopie Vorbereitung Armin Burgmeier Robert Schittny 1. Theoretische Grundlagen 1.1. Kerndrehimpuls und magnetisches Moment Nach der Quantentheorie besitzt
Teil 3 2D-NMR-Spektroskopie. Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17
 Teil 3 2D-NMR-Spektroskopie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17 www.ruhr-uni-bochum.de/chirality 1 Protonen-Protonen-Korrelation durch J-Kopplung Pulssequenz für ein klassisches 1D- 1 H-NMR
Teil 3 2D-NMR-Spektroskopie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17 www.ruhr-uni-bochum.de/chirality 1 Protonen-Protonen-Korrelation durch J-Kopplung Pulssequenz für ein klassisches 1D- 1 H-NMR
Schriftliche Prüfung BSc Herbst 2010
 Prüfungen Analytische Chemie Dienstag, 24. August 2010 Schriftliche Prüfung BSc Herbst 2010 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Dienstag, 24. August 2010 Schriftliche Prüfung BSc Herbst 2010 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Spektroskopie in der Organischen Chemie. Massenspektren
 Massenspektren In der Frühzeit der MS wurden Spektren auf Fotopapier registriert, wobei das Spektrum mehrfach mit unterschiedlicher Ordinatenauslenkung ausgeschrieben wurde, um sehr schwache neben sehr
Massenspektren In der Frühzeit der MS wurden Spektren auf Fotopapier registriert, wobei das Spektrum mehrfach mit unterschiedlicher Ordinatenauslenkung ausgeschrieben wurde, um sehr schwache neben sehr
NMR Spektroskopie I = 0 : C, 16 O (sogenannte gg-kerne haben immer I=0!) I = 1/2: 1 H, 13 C, 15 N, 19 F, 31 P,... I = 1: 2. H=D, 6 Li, 14 N I = 3/2: 7
 NMR Spektroskopie folie00 Viele Atomkerne besitzen einen von Null verschiedenen Eigendrehimpuls (Spin) p=ħ I, der ganz oder halbzahlige Werte von ħ betragen kann. I bezeichnet die Kernspin-Quantenzahl.
NMR Spektroskopie folie00 Viele Atomkerne besitzen einen von Null verschiedenen Eigendrehimpuls (Spin) p=ħ I, der ganz oder halbzahlige Werte von ħ betragen kann. I bezeichnet die Kernspin-Quantenzahl.
Strukturaufklärung (BSc-Chemie): Einführung
 Strukturaufklärung (BSc-Chemie): Einführung Prof. S. Grimme OC [TC] 13.10.2009 Prof. S. Grimme (OC [TC]) Strukturaufklärung (BSc-Chemie): Einführung 13.10.2009 1 / 25 Teil I Einführung Prof. S. Grimme
Strukturaufklärung (BSc-Chemie): Einführung Prof. S. Grimme OC [TC] 13.10.2009 Prof. S. Grimme (OC [TC]) Strukturaufklärung (BSc-Chemie): Einführung 13.10.2009 1 / 25 Teil I Einführung Prof. S. Grimme
Schriftliche Prüfung BSc Herbst 2011
 Prüfungen Analytische Chemie Montag, 29. August 2011 Schriftliche Prüfung BSc Herbst 2011 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt 36.
Prüfungen Analytische Chemie Montag, 29. August 2011 Schriftliche Prüfung BSc Herbst 2011 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt 36.
PN 2 Einführung in die Experimentalphysik für Chemiker
 PN 2 Einführung in die Experimentalphysik für Chemiker 9. Vorlesung 13.6.08 Evelyn Plötz, Thomas Schmierer, Gunnar Spieß, Peter Gilch Lehrstuhl für BioMolekulare Optik Department für Physik Ludwig-Maximilians-Universität
PN 2 Einführung in die Experimentalphysik für Chemiker 9. Vorlesung 13.6.08 Evelyn Plötz, Thomas Schmierer, Gunnar Spieß, Peter Gilch Lehrstuhl für BioMolekulare Optik Department für Physik Ludwig-Maximilians-Universität
Der Kern-Overhauser-Effekt (Nuclear Overhauser Effect, NOE)
 Der Kern-verhauser-Effekt (Nuclear verhauser Effect, NE) Die Intensität eines 1 H-Signals kann durch ein Entkopplungsexperiment verändert werden. Wird der Übergang eines ausgewählten 1 H-Kerns S für eine
Der Kern-verhauser-Effekt (Nuclear verhauser Effect, NE) Die Intensität eines 1 H-Signals kann durch ein Entkopplungsexperiment verändert werden. Wird der Übergang eines ausgewählten 1 H-Kerns S für eine
Teil 1 Schwingungsspektroskopie (Raman-Spektroskopie) Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17
 Teil 1 Schwingungsspektroskopie (Raman-Spektroskopie) Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17 www.ruhr-uni-bochum.de/chirality Rückblick: Die Essentials der letzten Vorlesung Funktionelle Gruppen
Teil 1 Schwingungsspektroskopie (Raman-Spektroskopie) Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17 www.ruhr-uni-bochum.de/chirality Rückblick: Die Essentials der letzten Vorlesung Funktionelle Gruppen
INADEQUATE 13 C, 13 C-COSY
 INADEQUATE 13 C, 13 C-COSY Die bisher diskutierten Korrelationsmethoden beruhen auf Protonen. Da das eigentliche Skelett eines organischen Moleküls das Kohlenstoffgerüst ist, wäre es in einigen Fällen
INADEQUATE 13 C, 13 C-COSY Die bisher diskutierten Korrelationsmethoden beruhen auf Protonen. Da das eigentliche Skelett eines organischen Moleküls das Kohlenstoffgerüst ist, wäre es in einigen Fällen
Die Anzahl der Protonen und Neutronen entspricht der Atommassenzahl.
 Atom Der Begriff Atom leitet sich von atomos her, was unteilbar heisst. Diese Definition ist alt, da man heutzutage fähig ist, Atome zu teilen. Atommassenzahl Die Anzahl der Protonen und Neutronen entspricht
Atom Der Begriff Atom leitet sich von atomos her, was unteilbar heisst. Diese Definition ist alt, da man heutzutage fähig ist, Atome zu teilen. Atommassenzahl Die Anzahl der Protonen und Neutronen entspricht
Multipuls-NMR in der Organischen Chemie. 1 H, 1 H, 1 H Relayed-COSY und TOCSY
 1 H, 1 H, 1 H Relayed-COSY und TOCSY Das 1 H, 1 H, 1 H-Relay-COSY-Experiment gehört historisch zu den älteren und wurde später durch das weit überlegene TOCSY-Experiment ersetzt. Dennoch sei es hier kurz
1 H, 1 H, 1 H Relayed-COSY und TOCSY Das 1 H, 1 H, 1 H-Relay-COSY-Experiment gehört historisch zu den älteren und wurde später durch das weit überlegene TOCSY-Experiment ersetzt. Dennoch sei es hier kurz
Schriftliche Prüfung BSc Herbst 2014
 Prüfungen Analytische Chemie Montag, 25. August 2014 Schriftliche Prüfung BSc Herbst 2014 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt 36.
Prüfungen Analytische Chemie Montag, 25. August 2014 Schriftliche Prüfung BSc Herbst 2014 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt 36.
Schmelz- und Siedepunkte von typischen reinen Stoffen. Symbolik der Elektronenpaarbindung
 Prof. Dr..-U. Reißig 2.01 Schmelz- und Siedepunkte von typischen reinen Stoffen Salzartig Diamantartig Flüchtige Stoffe Ionengitter Atomgitter diskrete Moleküle (Nal) (af 2 ) (Al 2 O 3 ) 4 6 6 l 4 O 2
Prof. Dr..-U. Reißig 2.01 Schmelz- und Siedepunkte von typischen reinen Stoffen Salzartig Diamantartig Flüchtige Stoffe Ionengitter Atomgitter diskrete Moleküle (Nal) (af 2 ) (Al 2 O 3 ) 4 6 6 l 4 O 2
Schriftliche Prüfung BSc Herbst 2015 D CHAB/BIOL. Musterlösung
 Prüfungen Analytische Chemie Mittwoch, 4. Februar 2015 Schriftliche Prüfung BSc Herbst 2015 D CHAB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl
Prüfungen Analytische Chemie Mittwoch, 4. Februar 2015 Schriftliche Prüfung BSc Herbst 2015 D CHAB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl
Elektronenspektroskopie
 Elektronenspektroskopie Die Elektronenspektroskopie befasst sich mit der Wechselwirkung elektromagnetischer Strahlung des Wellenlängenbereichs von etwa 100 bis 800 nm mit Materie. Es werden dabei Elektronen
Elektronenspektroskopie Die Elektronenspektroskopie befasst sich mit der Wechselwirkung elektromagnetischer Strahlung des Wellenlängenbereichs von etwa 100 bis 800 nm mit Materie. Es werden dabei Elektronen
Schwingungsspektroskopie
 In N atomigen Molekülen haben wir 3N 5 (linear) bzw. 3N 6 (nichtlinear) Freiheitsgrade der Schwingung, welche die Position der Atome relativ zueinander beschreiben. Der Potentialterm wird zu einer komplizierten
In N atomigen Molekülen haben wir 3N 5 (linear) bzw. 3N 6 (nichtlinear) Freiheitsgrade der Schwingung, welche die Position der Atome relativ zueinander beschreiben. Der Potentialterm wird zu einer komplizierten
Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen.
 1 Lösung 5 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Falls Sie Fragen zur Vorlesung/Übung/generellen Konzepten haben schreiben
1 Lösung 5 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Falls Sie Fragen zur Vorlesung/Übung/generellen Konzepten haben schreiben
 hemie-protokoll 11.11.02, Seite 1 von 5 Lukman Iwan, 12.11.02 Stundenprotokoll vom Montag, 11. ovember 2002 Es fehlen: Janine und Jeannette Zettel 1&2: Aromatische eterocyclen http://www.oci.unizh.ch/edu/lectures/material/a_bii/kap6/kap6.html
hemie-protokoll 11.11.02, Seite 1 von 5 Lukman Iwan, 12.11.02 Stundenprotokoll vom Montag, 11. ovember 2002 Es fehlen: Janine und Jeannette Zettel 1&2: Aromatische eterocyclen http://www.oci.unizh.ch/edu/lectures/material/a_bii/kap6/kap6.html
Die chemische Verschiebung - 1
 Die chemische Verschiebung - 1 Die Messfrequenz ν einer Kernsorte, hier: 1 H (Protonen), hängt bei einem isolierten Kern ausschließlich vom äußeren Magnetfeld (B 0 ) und ihrem magnetogyrischen Verhältnis
Die chemische Verschiebung - 1 Die Messfrequenz ν einer Kernsorte, hier: 1 H (Protonen), hängt bei einem isolierten Kern ausschließlich vom äußeren Magnetfeld (B 0 ) und ihrem magnetogyrischen Verhältnis
3 Elektronengas-Modell und Polyene
 3.1 Lernziele 1. Sie können die Anregungsenergie ΔE für den Ügang vom höchsten besetzten (HOMO) zum niedrigsten unbesetzten (LUMO) Niveau von Polyenen mit dem Elektronengas-Modell echnen. 2. Sie sind in
3.1 Lernziele 1. Sie können die Anregungsenergie ΔE für den Ügang vom höchsten besetzten (HOMO) zum niedrigsten unbesetzten (LUMO) Niveau von Polyenen mit dem Elektronengas-Modell echnen. 2. Sie sind in
Physik IV Einführung in die Atomistik und die Struktur der Materie
 Physik IV Einführung in die Atomistik und die Struktur der Materie Sommersemester 2011 Vorlesung 20 29.06.2011 Physik IV - Einführung in die Atomistik Vorlesung 20 Prof. Thorsten Kröll 29.06.2011 1 Anmeldung
Physik IV Einführung in die Atomistik und die Struktur der Materie Sommersemester 2011 Vorlesung 20 29.06.2011 Physik IV - Einführung in die Atomistik Vorlesung 20 Prof. Thorsten Kröll 29.06.2011 1 Anmeldung
Teil 2 NMR-Spektroskopie. Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18
 Teil 2 NMR-Spektroskopie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18 www.ruhr-uni-bochum.de/chirality 1 Rückblick: Kopplungskonstanten Kopplungskonstante ist abhängig von der Entfernung der Kopplungspartner:
Teil 2 NMR-Spektroskopie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18 www.ruhr-uni-bochum.de/chirality 1 Rückblick: Kopplungskonstanten Kopplungskonstante ist abhängig von der Entfernung der Kopplungspartner:
Teil 2 NMR-Spektroskopie. Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17
 Teil 2 NMR-Spektroskopie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17 www.ruhr-uni-bochum.de/chirality 1 Rückblick Kerne haben magn. Moment, dass sich entlang der Magnetfeldlinien eines statischen
Teil 2 NMR-Spektroskopie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17 www.ruhr-uni-bochum.de/chirality 1 Rückblick Kerne haben magn. Moment, dass sich entlang der Magnetfeldlinien eines statischen
Teil 2 NMR-Spektroskopie. Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18
 Teil 2 NMR-Spektroskopie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18 www.ruhr-uni-bochum.de/chirality 1 Rückblick Kerne haben magn. Moment, dass sich entlang der Magnetfeldlinien eines statischen
Teil 2 NMR-Spektroskopie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18 www.ruhr-uni-bochum.de/chirality 1 Rückblick Kerne haben magn. Moment, dass sich entlang der Magnetfeldlinien eines statischen
Übungsaufgaben - Analytik
 Übungsaufgaben - Analytik Übung 1 Von einer Substanz soll der molare Extinktionskoeffizient bestimmt werden. Der Laborant hat mässig exakt verdünnt. Er hat jeweils die auf der x-achse angegbene Zahl an
Übungsaufgaben - Analytik Übung 1 Von einer Substanz soll der molare Extinktionskoeffizient bestimmt werden. Der Laborant hat mässig exakt verdünnt. Er hat jeweils die auf der x-achse angegbene Zahl an
