Statement zur Pressekonferenz Bestandsmarktreport
|
|
|
- Manfred Geiger
- vor 7 Jahren
- Abrufe
Transkript
1 Prof. Dr. Gerd Glaeske, Universität Bremen Statement zur Pressekonferenz Bestandsmarktreport Am 1. nuar 2011 ist das Arzneimittelmarktneuordnungsgesetz (AMNOG) in Kraft getreten und mit ihm eine Frühbewertung neu zugelassener Arzneimittel, die für Versicherte der Gesetzlichen Krankenversicherung (GKV) verordnet werden sollen. Diese Frühbewertung ist Teil der Kosten Nutzen Bewertung, die nun endlich auch auf dem GKV Arzneimittelmarkt eingeführt worden ist. Ursprünglich war vorgesehen, auch die wichtigen und vielverordneten Mittel, die bereits vor dem nuar 2011 auf dem Markt angeboten wurden, einer AMNOG Bewertung zu unterziehen. Diese sinnvolle und auch begründete Übertragung des AMNOG Prozesses auf wichtige und viel verordnete Mittel des Bestandsmarktes wurde allerdings mit dem vom Bundestag am 20. Februar 2014 verabschiedeten 14. Gesetz zur Änderung des SGB V und der anschließenden Zustimmung des Bundesrates am 14. März 2014 aufgehoben. Seit dem 1. April 2014 ist die ursprüngliche gesetzliche Ankündigung der Bestandsmarktprüfung damit Geschichte. Die Hersteller können auch weiterhin für die schon im Markt befindlichen Arzneimittel werben, selbst wenn keine gute Evidenz aus klinischen Studien vorliegt. Die GKV und letztlich die Versicherten mit Blick auf ihre Beiträge werden also auch weiterhin mit Ausgaben für Arzneimittel ohne nachgewiesenen Nutzen belastet werden von dem möglicherweise unbestätigten Nutzen in der Behandlung ganz zu schweigen. Damit geht also nicht nur ein hohes Einsparpotenzial verloren, es wird auch das Ziel einer qualitativen und wirtschaftlichen Arzneimittelversorgung verfehlt statt rund 200 Millionen Euro durch das AMNOG Verfahren könnten derzeit bereits rund 2 Milliarden Euro durch eine konsequente Bestandsmarktprüfung und die Substitution unnötig teurer Me too Produkte durch bewährte Generika eingespart werden. Diese Ausgangssituation hat uns im Zentrum für Sozialpolitik bewogen, der Techniker Krankenkasse (TK) die Erstellung eines Bestandsmarktreportes vorzuschlagen, um für bestimmte Arzneimittelgruppen das Bewertungsverfahren weiterzuführen, das der Gemeinsame Bundesausschuss mit bestimmten Mitteln aus dem Bestandsmarkt bereits begonnen, dann aber nicht weitergeführt hat. Die TK hat uns dankenswerterweise ihre Unterstützung zugesagt und auch die Daten zur Verfügung gestellt, mit denen wir die Marktentwicklung ausgewählter Arzneimittelgruppen darstellen konnten. Dies hat dazu geführt, dass wir nun den ersten Bestandsmarktreport vorlegen können. Die Schwerpunkte der Bewertung liegen auf den Arzneimittelgruppen Neue Orale Antikoagulanzien (NOAK) und neuere Antidiabetika aus der Gruppe der GLP 1 Agonisten und DPP 4 Inhibitoren sowie aus der Gruppe von Arzneimitteln zur Behandlung der Rheumatoiden Arthritis. Insgesamt wurden 17 Wirkstoffe auf der Basis einer Literaturrecherche im Bezug auf ihren patientenorientierten Zusatznutzen im Vergleich zu bereits vorhandenen medikamentösen Therapieoptionen bewertet. Hierfür haben wir wiederum, wie bereits in den Innovationsreporten 2013 und 2014, das bewährte Ampelschema genutzt, welches mit rot, gelb und grün die Aspekte verfügbare Therapie, nachgewiesener (Zusatz)Nutzen und Kosten bewertet. Als Beispiel werden hier die drei NOAK gezeigt:
2 NOAK: Zusammenfassung und Fazit Wirkstoff (Präparat) Pharm. Unternehmer Verfügbare Therapien Bewertung (Zusatz ) Kosten Nutzen Gesamt Score Eingang in Leitlinien Besonderheiten nach Markteinführung Apixaban (Eliquis ) Bristol/Pfizer AkdÄ Info zu Apixaban, Dabigatran und Rivaroxaban (2013): Risikofaktoren und Anwendungshinweise Dabigatran (Pradaxa ) Boehringer Ingelheim Rivaroxaban (Xarelto ) Bayer Vital Rote Hand Brief (2011): Überprüfung der Nierenfunktion; AkdÄ Info zu Apixaban, Dabigatran und Rivaroxaban (2013): Risikofaktoren und Anwendungshinweise; Rote Hand Brief (2013): Gegenanzeige künstliche Herzklappen AkdÄ Info zu Apixaban, Dabigatran und Rivaroxaban (2013): Risikofaktoren und Anwendungshinweise Erläuterung: Gesamt Score ab: rot= höchstens 2 Punkte, gelb= 3 oder 4 Punkte, grün = 5 Punkte und mehr. Die Punktevergabe bei den drei Kategorien basiert auf den Ampel Bewertungen. Größtes Gewicht erhält dabei der (Zusatz )Nutzen: Verfügbare Therapien: rote Ampel = 0 Punkte, gelbe Ampel = 1 Punkt, grüne Ampel= 2 Punkte; (Zusatz ) Nutzen: rote Ampel = 0 Punkte, gelbe Ampel = 2 Punkte, grüne Ampel = 4 Punkte; Kosten: rote Ampel = 0 Punkte, gelbe Ampel = 1 Punkt, grüne Ampel = 2 Punkte. Die Begründung für diese Bewertung ist, wie auch bei den meisten anderen Wirkstoffen, die untersucht wurden, dass derzeit noch keine direkten Vergleiche zwischen den einzelnen NOAK Wirkstoffen und den bisher üblicherweise eingesetzten Arzneimitteln im Hinblick auf den Nutzen und die Risiken vorliegen, weshalb belastbare Aussagen über einen Zusatznutzen eines NOAK gegenüber einem anderen Vertreter dieser Wirkstoffgruppe oder auch gegenüber dem bewährten Phenprocoumon nicht möglich sind. Daten aus einem Antikoagulanzien Register reichen für eine solche Bewertung nicht aus. Die aktuelle Datenlage spricht bezogen auf die Indikation nicht valvuläres Vorhofflimmern (VHF) am ehesten für Apixaban (Eliquis ) als Mittel der ersten Wahl für diejenigen Patienten, für die Vitamin K Antagonisten wie Phenprocoumon (Marcumar u.a.) nicht geeignet sind. Dieses Arzneimittel weist für die VHF Indikation auch die niedrigsten hrestherapiekosten auf, weshalb Apixaban als einziger Vertreter eine gelbe Kostenampel erhalten hat. Sämtliche NOAK sind deutlich teurer als Phenprocoumon. Für die bewerteten Arzneimittel wurden auch jeweils Verordnungsanalysen erstellt. Im hr 2013 wurden an TK Versicherte insgesamt 8,8 Mio. definierte Tagesdosen (DDD) von NOAK verordnet (Umsatz: 30,8 Mio. ). Die Abbildung zeigt die Verordnungsentwicklung der NOAK über die hre 2011 bis Ende Der stärkste Anstieg des DDD Volumens kann bei Rivaroxaban beobachtet werden. Im Dezember 2013 wurde es mit annähernd DDD mehr als doppelt so viel verschrieben wie die anderen beiden NOAK zusammen.
3 Verordnungen der neuen oralen Antikoagulanzien (NOAK) in definierten Tagesdosen (Defined Daily Doses, DDD) ( ) hrestherapiekosten der NOAK für die Indikation Schlaganfallprophylaxe bei Vorhofflimmern im Vergleich zu Phenprocoumon Wirkstoff Behandlungs Modus Behandlungstage* hrestherapiekosten** zu bewertendes Arzneimittel 1) Apixaban 2 x 5 mg ,22 Dabigatran 2 x 150 mg ,36 Rivaroxaban 1 x 20 mg ,72 Vergleichstherapie Phenprocoumon 2)3) 1 x 3 mg ,63 *) hresdurchschnittsverbrauch; **) Stand Lauer Taxe ; 1) Dosierungen laut FI; 2) Erhaltungsdosis laut FI: ½ 1½ Tbl, Angabe des Behandlungsdosis richtet sich hier nach DDD; 3) Generikum Insgesamt zeigen diese Daten, dass trotz einer noch nicht endgültig gesicherten Nutzen Schaden Relation die Verordnungsanstiege und Kostenentwicklungen auffällig sind. Eine AMNOG Bewertung hätte sowohl für die verordnenden Ärzte als auch für die behandelten Patientinnen und Patienten mehr Sicherheit bedeutet. Spezifische Antidote zu den NOAK sind noch immer nicht verfügbar. Bei akuten Blutungskomplikationen, auch wenn diese unter der Behandlung mit den NOAK möglicherweise seltener als unter Phenprocoumon vorkommen, gibt es keine validierte Therapiestrategie. Die eingesetzten Erythrozyten und Prothrombinkonzentrate, sowie das gefrorene Frischplasma, stellen Blutprodukte dar, die aufgrund ihrer Galenik und Verfügbarkeit sehr hohe Preise haben und die Behandlung in Fällen schwerer Blutungen extrem verteuern. Ob diese tatsächlich einen Nutzen in einer akut lebensbedrohlichen Situation haben, ist bis heute nicht durch klinische Studien belegt. Auf der Basis von Studienergebnissen für die im Rahmen einer Dabigatran Therapie aufgetretenen Blutungen wurden folgende Ursachen beschrieben: Verschreibungsfehler, Niereninsuffizienz, Alter sowie auch das Fehlen eines Antidots. Die regelmäßigen Kontrollen wie bei einer Therapie mit Phenprocoumon sind unter den NOAK zwar nicht mehr notwendig, dies könnte aber möglicherweise ein Nachteil für die Betreuung und Sicherheit der Patienten bergen. Die INR Werte eignen sich dafür nicht. Wenn die Kenntnis der NOAK Exposition (Apixaban, Rivaroxaban) hilfreich sein kann, um klinische Entscheidungen zu treffen (z.b. im Fall einer Überdosierung oder bei
4 Notfalloperationen), können die mit einem kalibrierten, quantitativen Anti Faktor Xa Test bestimmten Spiegel helfen. Dabei handelt es sich allerdings nicht um eine routinemäßige Untersuchung, sondern laut Fachinformation der Hersteller um Ausnahmesituationen. In gleicher Weise wurden die Antidiabetika und die Mittel zur Behandlung der Rheumatoiden Arthritis bewertet und mit Blick auf die Verordnungen evaluiert. In der Übersicht ergaben sich folgende Ergebnisse: Neuere Antidiabetika GLP 1 Agonisten und DPP 4 Inhibitoren (Gliptine) Wirkstoff (Präparat) Pharm. Unternehmer Verfügbare Therapien Bewertung (Zusatz ) Kosten Nutzen Gesamt Score Eingang in Leitlinien Besonderheiten nach Markteinführung Exenatid (Byetta ) AkdÄ Info (2008): Pankreatitis BMS/AstraZeneca Liraglutid (Victoza ) FDA Warnung (2011): Pankreatitis und Schilddrüsentumoren Novo Nordisk Lixisenatid (Lyxumia ) Marktrücknahme 2014 Sanofi Saxagliptin (Onglyza u.a.) Drug Safety Mail (2012): Überempfindlichkeitsreaktion und Pankreatitis BMS/AstraZeneca Sitaglitptin (nuvia ) Drug Safety Mail (2010): Hepatitis MSD Vildagliptin (Galvus u.a.) Marktrücknahme 2014 Novartis Erläuterung: Gesamt Score ab: rot= höchstens 2 Punkte, gelb= 3 oder 4 Punkte, grün = 5 Punkte und mehr (Bei Lixisenatid und Vildagliptin wurde aus Gründen der Marktrücknahme keine Kostenberechnung durchgeführt. Da Kosten hier nicht mit Punkten berücksichtigt werden können, ist ein anderer Gesamtscore eingesetzt worden: rot = höchstens 1 Punkt, gelb = 2 oder 3 Punkte, grün = 4 Punkte und mehr). Die Punktevergabe bei den drei Kategorien basiert auf den Ampel Bewertungen. Größtes Gewicht erhält dabei der (Zusatz )Nutzen: Verfügbare Therapien: rote Ampel = 0 Punkte, gelbe Ampel = 1 Punkt, grüne Ampel= 2 Punkte; (Zusatz ) Nutzen: rote Ampel = 0 Punkte, gelbe Ampel = 2 Punkte, grüne Ampel = 4 Punkte; Kosten: rote Ampel = 0 Punkte, gelbe Ampel = 1 Punkt, grüne Ampel = 2 Punkte.
5 Rheuma Biologika: Zusammenfassung der Bewertung Wirkstoff (Präparat) Pharm. Unternehmer Verfügbare Therapien Bewertung (Zusatz ) Kosten Nutzen Gesamt Score Eingang in Leitlinien Besonderheiten nach Markteinführung Adalimumab (Humira ) AbbVie Rote Hand Brief (2008): Auftreten von hepatosplenalen T Zell Lymphomen Certolizumab pegol (Cimzia ) Drug Safety Mail (2009) zum Risiko von Lymphomen u.a. bei Kindern und Jugendlichen (für alle TNF α Blocker) UCB Etanercept (Enbrel ) Pfizer Drug Safety Mail (2009) zum Risiko von Lymphomen u.a. bei Kindern und Jugendlichen (für alle TNF α Blocker) Golimumab (Simponi ) MSD Drug Safety Mail (2009) zum Risiko von Lymphomen u.a. bei Kindern und Jugendlichen (für alle TNF α Blocker) Infliximab (Remicade ) Rote Hand Brief (2006): Auftreten von hepatosplenalen T Zell Lymphomen MSD Abatacept (Orencia ) BMS Rituximab (MabThera ) Roche Tocilizumab (RoActemra ) Rote Hand Brief (2008/2009): Auftreten von PML; Rote Hand Brief (2011): tödliche infusionsbedingte Reaktionen; Rote Hand Brief (2013): toxische epidermale Nekrolyse und Stevens Johnson Syndrom; Rote Hand Brief (2013): Hepatitis B Virus Screening Rote Hand Brief (2010): Anaphylaxie; Drug Safety Mail (2014): Psoriasis Roche Erläuterung: Gesamt Score ab: rot= höchstens 2 Punkte, gelb= 3 oder 4 Punkte, grün = 5 Punkte und mehr. Die Punktevergabe bei den drei Kategorien basiert auf den Ampel Bewertungen. Größtes Gewicht erhält dabei der (Zusatz )Nutzen: Verfügbare Therapien: rote Ampel = 0 Punkte, gelbe Ampel = 1 Punkt, grüne Ampel= 2 Punkte; (Zusatz ) Nutzen: rote Ampel = 0 Punkte, gelbe Ampel = 2 Punkte, grüne Ampel = 4 Punkte; Kosten: rote Ampel = 0 Punkte, gelbe Ampel = 1 Punkt, grüne Ampel = 2 Punkte. Aufgrund des Mangels an aussagekräftigen Direktvergleichen, lässt sich momentan nicht eindeutig feststellen, welche der Biologika in der Zweitlinientherapie von Erwachsenen bei der Rheumatoiden Arthritis besser oder schlechter geeignet sind. Generell wünschenswert sind weitere Langzeitdaten, um die Therapiesicherheit und den Langzeitnutzen z.b. im Hinblick auf strukturelle Gelenkveränderungen besser beurteilen zu können. Die hrestherapiekosten der klassischen Rheuma Biologika liegen etwa zwischen und Allein das ursprünglich aus der Krebstherapie stammende Biologikum Rituximab kostet bei einem Behandlungszyklus nur knapp die Hälfte wie ein günstiger TNF α Blocker und auch bei zwei Zyklen mehr sind pro hr nicht üblich immer noch knapp weniger. Dennoch lässt sich auf Basis der Datenlage keine eindeutige Wirtschaftlichkeitsempfehlung zugunsten von Rituximab ableiten. Nicht nur aus Wirtschaftlichkeitsaspekten, sondern vor dem Hintergrund des Nebenwirkungsspektrums sind insbesondere auch aus Gründen der Arzneimitteltherapiesicherheit bei anhaltendender Remission Deeskalationen von der Biologika Dosisreduktion bis hin zur Beendigung der Biologika Therapie in Betracht zu
6 ziehen. Neue Wirtschaftlichkeitspotenziale in der Rheuma Therapie könnten in Zukunft Biosimilars also Nachahmerprodukte von biotechnologisch hergestellten Arzneimitteln bieten. Die biosimilaren Antikörper gelten als gigantischer Wachstumsmarkt, zumal bis 2020 zwölf der umsatzstärksten Biologika ihren Patentschutz verlieren, darunter auch hochpreisige monoklonale Antikörper, die bei RA eingesetzt werden können, wie Rituximab (Patentablauf im hr 2013), Infliximab (2014) und Etanercept (2015). (hres )Therapiekosten der Rheuma Biologika im Vergleich zu MTX Wirkstoff zu bewertendes Arzneimittel Adalimumab Certolizumab pegol Behandlungsmodus 2 x 40 mg alle 14 Tage (1 x 40 mg / Woche) 1 x 200 mg alle 2 Wochen 26 Behandlungstage* (hres )Therapiekosten** ,60 (52) (39.487,20 ) ,68 1 Etanercept 1 x 50 mg / ,48 Woche Golimumab 1 x 50 mg / ,20 Monat Infliximab 3 mg/kg KG ,09 1 alle 8 Wochen Abatacept 750 mg alle ,52 1 Wochen Rituximab 2 x mg ,04 2 pro Zyklus Tocilizumab 576 mg alle ,86 Wochen Vergleichstherapie 3 Methotrexat 25 mg / Woche ,00 *) hresdurchschnittsverbrauch; **) Stand Lauer Taxe ; 1) normale Erhaltungsdosis; 2) Voraussetzung: ein Behandlungszyklus ausreichend; 3) der Begriff Vergleichstherapie ist nicht ganz treffend, da Biologika in der Regel als Add on zu MTX eingesetzt werden ; 4) maximale Erhaltungsdosis laut Fachinformation Insgesamt wurde keinem der Arzneimittel bei einem der Indikatoren ein grün zugeteilt, von den 17 untersuchten Wirkstoffen erhielten beispielsweise alle sechs untersuchten Antidiabetika ein rot beim Zusatznutzen, bei den Kosten gab es nur zwei Mal die Farbe gelb, was letztlich bedeutet, dass von den 15 noch im Markt befindlichen Mitteln (zwei Antidiabetika wurden von den Herstellern vom Markt genommen, weil sie ihre Preiserwartungen nicht umsetzen konnten) nur zwei Arzneimittel zwar immer noch teurer waren als Vergleichstherapien bzw. Mittel der 1. Wahl, aber im Verhältnis zu Arzneimitteln aus der gleichen Wirkstoffklasse günstiger waren. Die beiden gelben Arzneimittel sind Rituximab bei den Antirheumatika und Apixaban bei den NOAK. Insgesamt macht dieses Ergebnis deutlich, wie notwendig die AMNOG Bestandsmarktprüfung gewesen wäre, um die Effizienz der Arzneimittelversorgung zu verbessern. Die Ergebnisse dieses nun vorliegenden Bestandsmarktreports werden daher den verordnenden Ärztinnen und Ärzten zur Verfügung gestellt werden.
7 Erstverordnungen durch einen Krankenhausaufenthalt beeinflusst? Zusätzlich zu den Bewertungen der 17 Wirkstoffe aus dem Bestandsmarkt wurde der Frage nachgegangen, ob diese Mittel eher in der stationären oder in der ambulanten Versorgung erstmalig zur Therapie eingesetzt bzw. verordnet werden. Oftmals ist schließlich die Klage niedergelassener Vertragsärztinnen und Vertragsärzte zu hören, dass sie gerade bei neuen und teuren Arzneimitteln der Ersteinstellung im Krankenhaus folgen müssen und daher nur bedingt das Wirtschaftlichkeitsgebot einhalten können. In diese Analyse wurden die NOAK und die neuen Antidiabetika einbezogen, daneben auch die einzelnen Arzneimittel Brilique (Wirkstoff Ticragelor, Zusatznutzen in bestimmten Indikation belegt) und Targin (Kombination aus Oxycodon und Naloxon, allgemein als teures Me too bewertet). Insgesamt wurden neben auffälligen regionalen Unterschieden folgende Ergebnisse gefunden: NOAK: Es wurden weniger Umstellungen als erwartet gefunden: Die Mehrheit der Patienten mit Vorhofflimmern wird auf NOAK eingestellt, ohne dass es eine Phenprocoumon Vortherapie gab. Die Umstellungen von Phenprocoumon (z.b. Marcumar ) auf NOAK kamen wider Erwarten häufiger im ambulanten als im stationären Bereich vor. 34,9 % der ambulanten Erstverordnungen von NOAK bei VHF Patienten konnten im Zusammenhang mit einem vorher stattgefundenen Krankenhausaufenthalt festgestellt werden (hr 2013, Q1 3). Durchschnittlich wurden etwas mehr Erstverordnungen von NOAK für Vorhofflimmern Patienten im Zusammenhang mit Aufenthalten in kleinen Kliniken im Vergleich zu großen gesehen. Die NOAK Verordnungsanteile an allen oralen Antikoagulanzien sind in Nordrhein Westfalen am niedrigsten, im Südwesten und Osten am höchsten. Antidiabetika: Die Erstgabe von GLP 1 Analoga und Gliptinen ist in der Regel nicht assoziiert mit einem vorhergehenden Krankenhausaufenthalt, es gibt in nur 7,4 % der Neueinstellungen einen Zusammenhang zu einer stationären Behandlung. Häufig kommt eine direkte Neueinstellung auf Gliptine oder GLP 1 Analoga ohne antidiabetische Ersttherapie vor. Bei der Erstverordnung von Fixkombis mit Metformin und Gliptin wird oftmals keine vorherige Metformin Monotherapie angewendet. Targin : Es zeigen sich die niedrigsten Verordnungsprävalenzen in Sachsen und Bayern (andere regionale Verteilung als beispielsweise bei NOAK und Gliptin Verordnungshäufigkeiten). 38,4 % der Neueinstellungen auf das Betäubungsmittel Targin stehen in einem Zusammenhang mit einem Krankenhausaufenthalt (hr 2013, Q1 3). Targin wird häufiger zur Behandlung von Rückenschmerzen als zur Behandlung von Tumorschmerzen eingesetzt. Targin wird im Zusammenhang mit Aufenthalten in kleinen Kliniken häufiger erstmalig verordnet als in großen Krankenhäusern. Brilique (Ticagrelor): Im Süden und Nordosten Deutschlands sind die wenigsten Ticagrelor Verordnungen zu verzeichnen. Zielwerte in Arzneimittelvereinbarungen sind dort wirksam, aber sind Quoten bezogen auf den generikafähigen im Falle des patentgeschützten und in bestimmten Indikationen mit einem positiven Zusatznutzen versehenen Ticagrelor vielleicht auch kontraproduktiv? Im ambulanten Bereich finden die meisten Erstverordnungen unmittelbar nach Krankenhausbehandlungen statt (71,2 % im hr 2013). Bei nicht hospitalisierten Patienten erfolgt Ticagrelor (Erst)einsatz häufiger in Indikationen mit Zusatznutzen Belegen als bei hospitalisierten Patienten. Während der letzten hre nimmt der Ticagrelor Einsatz bei Indikationen ohne Zusatznutzen leicht
8 ab. Im Gegensatz zu NOAK und Targin gibt es bei Ticagrelor keine Assoziation zwischen kleinen Kliniken und vermehrten Erstverordnungen. In Kooperation mit Frau Prof. Dr. Petra Thürmann vom Philipp Institut für klinische Pharmakologie der Helios Kliniken in Wuppertal wurde die Arzneimittelversorgung im Krankenhaus und deren Einfluss auf die ambulanten Verordnungen charakterisiert. Danach ist die Bewerbung von Arzneimitteln in Krankenhäusern grundsätzlich ähnlich wie die im ambulanten Bereich. Allerdings bestehen in vielen Krankenhäusern ge und beschlossene Arzneimittellisten der Produkte, die in den jeweiligen Krankenhäusern angewendet und für die sich eine Arzneimittelkommission in dem jeweiligen Krankenhaus entschieden hat. Dies hat verschiedene Ursachen: eine Krankenhausapotheke hat nur begrenzte Lagerkapazitäten, so dass nicht der gesamte deutsche Arzneimittelmarkt bevorratet werden kann. Hinzu kommt, dass der Medikationsprozess gerade im Krankenhaus einen Risikoprozess mit einer hohen Fehlerwahrscheinlichkeit darstellt: Zu viele und wechselnde Präparate stellen eine unnötige Fehlerquelle dar gerade für Ärzte in Weiterbildung und die zeitlich hoch belastete Pflege. In der Mehrzahl, v.a. der größeren Krankenhäuser sind Arzneimittelkommissionen (AMK) etabliert. Die Aufgaben dieser AMK umfassen im Wesentlichen die Auswahl der im Krankenhaus verwendeten Arzneistoffe (Auswahl des Herstellers kann i.d.r. von der Apotheke ausgewählt werden), diese orientiert sich an der Zahl und Art der beteiligten Fachdisziplinen, aber auch an den Verhandlungsmöglichkeiten der Krankenhausapotheke. Im notwendigen Ausmaß werden Evidenz und Risiken abgewogen, klinische Studien und Leitlinien zugrunde gelegt und ggf. Bewertungen des IQWiG herangezogen (letztere werden jedoch für Arzneimittel im stationären Bereich nicht erstellt). Das Ausmaß der Beratung von arzneimittelanfordernden Ärzten ist unterschiedlich und ein Monitoring der tatsächlichen Arzneimittelverbräuche wird nicht in allen Kliniken konsequent durchgeführt. Bei der Erstellung der Hausliste muss auch ins Kalkül gezogen werden, welche Arzneimittel häufig ambulant verordnet und bei stationärem Aufenthalt weitergeführt werden müssen und nur mit erheblichem Aufwand durch andere ersetzt werden können. So gehen Pharmareferenten oft den Weg, Ärzte auf den für die jeweiligen Arzneimittel wichtigen Stationen zu besuchen und sie vom Nutzen der von ihnen angebotenen Arzneimittel zu überzeugen. Dies kann dann zu Sonderanforderungen führen, also zu Anforderungen von Arzneimitteln aus der Krankenhausapotheke oder von externen krankenhausversorgenden Apotheken außerhalb der Arzneimittellisten. Und wenn dies nur oft genug geschieht, werden diese Arzneimittel letztlich doch von der Arzneimittelkommission in die Arzneimittelliste aufgenommen, weil dann auch der Einkauf solcher Mittel mit günstigen Rabatten durch die Apotheke möglich wird. Der Vorteil für die Firmen: Wenn diese Mittel im Krankenhaus verordnet werden, finden sie sich typischerweise auch in den Krankenhausentlassungsbriefen an die ambulant tätigen Ärztinnen und Ärzten wieder. Dabei handelt es sich zumeist um kostenintensive neue Arzneimittel, die die weiterverordnenden ambulant tätigen Ärztinnen und Ärzte nur schwer wieder gegen andere Arzneimittel austauschen können. Die Umstellung der Krankenhaus Entlassungsmedikation sei es aus fachlichen oder aus ökonomischen Gründen bedeutet für niedergelassene Kollegen einen erheblichen Zeitaufwand und ist oftmals von Misstrauen seitens der Patienten begleitet.
9 Im Hinblick auf die Besuche von Pharmareferenten ist eine Regelung der HELIOS Kliniken vielversprechend (Konzernregelung Transparenz): Einkaufsentscheidungen nur durch Verantwortliche: Entscheidungen über die bei HELIOS eingesetzten Produkte, insbesondere Arzneimittel, Medizinprodukte und technische Geräte, werden bei HELIOS ausschließlich unter Einbeziehung der zuständigen Fachgremien, u. a. der medizinischen Fachgruppen, sowie den Produktverantwortlichen getroffen. ( ) HELIOS Mitarbeiter empfangen deshalb Vertriebsmitarbeiter von Industrieunternehmen nur in begründeten Ausnahmefällen. Solche oder ähnliche Regelungen wären sicherlich für alle Krankenhäuser mit Blick auf die Arzneimittelversorgung im stationären Bereich sinnvoll.
Bestandsmarktreport 2014
 Bestandsmarktreport 2014 mit Auswertungsergebnissen von Routinedaten der Techniker Krankenkasse (TK) aus den Jahren 2011 bis 2013 Daniela Boeschen, Roland Windt, Gerd Glaeske Universität Bremen, Zentrum
Bestandsmarktreport 2014 mit Auswertungsergebnissen von Routinedaten der Techniker Krankenkasse (TK) aus den Jahren 2011 bis 2013 Daniela Boeschen, Roland Windt, Gerd Glaeske Universität Bremen, Zentrum
Ansatz: Bessere Therapie rechnet sich
 9. Kongress des BDRh Tim Steimle, Fachbereichsleiter Arzneimittel, 17. Mai 2014 Ansatz: Bessere Therapie rechnet sich 2 Rheumavertrag der TK mit dem Berufsverband Deutscher Rheumatologen (BDRh) - Tim Steimle,
9. Kongress des BDRh Tim Steimle, Fachbereichsleiter Arzneimittel, 17. Mai 2014 Ansatz: Bessere Therapie rechnet sich 2 Rheumavertrag der TK mit dem Berufsverband Deutscher Rheumatologen (BDRh) - Tim Steimle,
Innovationsreport 2016
 Innovationsreport 2016 Auswertungsergebnisse von Routinedaten der Techniker Krankenkasse (TK) aus den Jahren 2013 bis 2015 Gerd Glaeske, Wolf-Dieter Ludwig, Petra Thürmann (Hrsg.) Kein Interessenkonflikt
Innovationsreport 2016 Auswertungsergebnisse von Routinedaten der Techniker Krankenkasse (TK) aus den Jahren 2013 bis 2015 Gerd Glaeske, Wolf-Dieter Ludwig, Petra Thürmann (Hrsg.) Kein Interessenkonflikt
Verordnungen innovativer Arzneimittel in der Rheumatologie
 Verordnungen innovativer Arzneimittel in der Rheumatologie Was bedeutet dies für den Arzt? Satelliten-Symposium Abbvie Berlin, 04.05.2013 Dr. med. Ulrich v. Hinüber, Praxis für Rheumatologie und Osteologie
Verordnungen innovativer Arzneimittel in der Rheumatologie Was bedeutet dies für den Arzt? Satelliten-Symposium Abbvie Berlin, 04.05.2013 Dr. med. Ulrich v. Hinüber, Praxis für Rheumatologie und Osteologie
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um die Wirkstoffkombination Insulin degludec/liraglutid wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
1. Zusatznutzen des Arzneimittels im Verhältnis zur zweckmäßigen Vergleichstherapie
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Bundesministerium für Gesundheit
 BAnz. Nr. (S. 54) vom 9.0.0 Bundesministerium für Gesundheit Bekanntmachung [40 A] eines Beschlusses des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII
BAnz. Nr. (S. 54) vom 9.0.0 Bundesministerium für Gesundheit Bekanntmachung [40 A] eines Beschlusses des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII
Infektionen, insbesondere Tuberkulose, ausschließen. Keine Impfung mit Lebendimpfstoffen. Kombination mit MTX empfohlen.
 Abatacept (Blocker der T- Lymphozyten Aktivierung) Orencia 10 mg pro kg Körpergewicht zur intravenösen Infusion. Wiederholung nach 2 und 4 Wochen, dann alle 4 Lebendimpfstoffen. Kombinationstherapie mit
Abatacept (Blocker der T- Lymphozyten Aktivierung) Orencia 10 mg pro kg Körpergewicht zur intravenösen Infusion. Wiederholung nach 2 und 4 Wochen, dann alle 4 Lebendimpfstoffen. Kombinationstherapie mit
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Vedolizumab wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
ausschließen. Keine Impfung mit Lebendimpfstoffen. Kombinationstherapie mit MTX. Nicht mit TNF-Alpha-Blockern kombinieren.
 Abatacept (Blocker der T- Lymphozyten Aktivierung) Orencia 10 mg pro kg Körpergewicht zur intravenösen Infusion. Wiederholung nach 2 und 4 Wochen, dann alle 4 Lebendimpfstoffen. Kombinationstherapie mit
Abatacept (Blocker der T- Lymphozyten Aktivierung) Orencia 10 mg pro kg Körpergewicht zur intravenösen Infusion. Wiederholung nach 2 und 4 Wochen, dann alle 4 Lebendimpfstoffen. Kombinationstherapie mit
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um die Wirkstoffkombination Dapagliflozin/Metformin wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
TNF-alpha-Blocker: Versorgungssituation und regionale Unterschiede
 TNF-alpha-Blocker: Versorgungssituation und regionale Unterschiede Dr. Roland Windt Universität Bremen Zentrum für Sozialpolitik - Kein Interessenkonflikt im Sinne der Uniform Requirements for Manuscripts
TNF-alpha-Blocker: Versorgungssituation und regionale Unterschiede Dr. Roland Windt Universität Bremen Zentrum für Sozialpolitik - Kein Interessenkonflikt im Sinne der Uniform Requirements for Manuscripts
BAnz AT B5. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
1. Die Angaben zu Perampanel in der Fassung des Beschlusses vom 7. März 2013 (BAnz AT B4) werden aufgehoben.
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
AMNOG-Report 2015 Arzneimittelreform auf dem Prüfstand
 AMNOG-Report 2015 Arzneimittelreform auf dem Prüfstand Prof. Dr. Wolfgang Greiner Julian Witte M.Sc. Universität Bielefeld Fakultät für Gesundheitswissenschaften Reporting im Arzneimittelmarkt GAP Umfassende
AMNOG-Report 2015 Arzneimittelreform auf dem Prüfstand Prof. Dr. Wolfgang Greiner Julian Witte M.Sc. Universität Bielefeld Fakultät für Gesundheitswissenschaften Reporting im Arzneimittelmarkt GAP Umfassende
 Antikoagulation bei DermatochirurgischenEingriffen Bochum 9.9.2017 Dr. Pia Dücker Dilemma -Risikoabwägung Thrombembolieim arteriellen Bereich 20% tödlich, 40% bleibende Behinderung Venöse Thrombembolie6%
Antikoagulation bei DermatochirurgischenEingriffen Bochum 9.9.2017 Dr. Pia Dücker Dilemma -Risikoabwägung Thrombembolieim arteriellen Bereich 20% tödlich, 40% bleibende Behinderung Venöse Thrombembolie6%
Arzneimittel im Bestandsmarkt Wie erkenne ich therapeutischen Fortschritt, Me-too-Präparate und Evergreening -Strategien? Wolf-Dieter Ludwig
 Arzneimittel im Bestandsmarkt Wie erkenne ich therapeutischen Fortschritt, Me-too-Präparate und Evergreening -Strategien? Wolf-Dieter Ludwig HELIOS Klinikum Berlin-Buch Klinik für Hämatologie, Onkologie
Arzneimittel im Bestandsmarkt Wie erkenne ich therapeutischen Fortschritt, Me-too-Präparate und Evergreening -Strategien? Wolf-Dieter Ludwig HELIOS Klinikum Berlin-Buch Klinik für Hämatologie, Onkologie
Auswirkungen des LSG-Beschlusses zu Mischpreisen auf die Verordnung von neuen Arzneimitteln. Pressegespräch Berlin,
 Auswirkungen des LSG-Beschlusses zu Mischpreisen auf die Verordnung von neuen Arzneimitteln Pressegespräch Berlin, 26.04.2017 Pressegespräch zu den Auswirkungen des LSG-Beschlusses 26.04.2017 2 Frühe Nutzenbewertung
Auswirkungen des LSG-Beschlusses zu Mischpreisen auf die Verordnung von neuen Arzneimitteln Pressegespräch Berlin, 26.04.2017 Pressegespräch zu den Auswirkungen des LSG-Beschlusses 26.04.2017 2 Frühe Nutzenbewertung
Dossierbewertung A15-15 Version 1.0 Insulin degludec/liraglutid Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung der Wirkstoffkombination Insulin degludec/liraglutid gemäß 35a SGB V beauftragt. Die Bewertung
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung der Wirkstoffkombination Insulin degludec/liraglutid gemäß 35a SGB V beauftragt. Die Bewertung
V I N VerordnungsInfo Nordrhein
 V I N VerordnungsInfo Nordrhein Vitamin-K-Antagonisten (VKA*) oder neue orale Antikoagulantien (NOAK**) bei nicht valvulärem Vorhofflimmern? Seit der Einführung der neuen oralen Antikoagulantien (NOAKs)
V I N VerordnungsInfo Nordrhein Vitamin-K-Antagonisten (VKA*) oder neue orale Antikoagulantien (NOAK**) bei nicht valvulärem Vorhofflimmern? Seit der Einführung der neuen oralen Antikoagulantien (NOAKs)
Behandlung mit Biologika (Biologicals), Stand 01/2011
 Stadtspital Triemli Zürich Klinik für Rheumatologie Birmensdorferstrasse 497 8063 Zürich www.triemli.ch KD Dr. med. Marcel Weber Chefarzt PATIENTENINFORMATION Chefarztsekretariat 044 466 23 02 Fax 044
Stadtspital Triemli Zürich Klinik für Rheumatologie Birmensdorferstrasse 497 8063 Zürich www.triemli.ch KD Dr. med. Marcel Weber Chefarzt PATIENTENINFORMATION Chefarztsekretariat 044 466 23 02 Fax 044
BAnz AT 11.11.2014 B1. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B6. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um die Wirkstoffkombination Tafluprost/Timolol wie folgt ergänzt:
 BAnz AT 1.07.201 B4 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
BAnz AT 1.07.201 B4 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
Vorstellung des Innovationsreports 2017
 Vorstellung des Innovationsreports 2017 Auch für Arzneimittel gilt: "Neu" ist nicht immer gleichbedeutend mit "besser". Zusätzlich muss es aber noch heißen: "Neu" ist meistens viel teurer. Seit fünf Jahren
Vorstellung des Innovationsreports 2017 Auch für Arzneimittel gilt: "Neu" ist nicht immer gleichbedeutend mit "besser". Zusätzlich muss es aber noch heißen: "Neu" ist meistens viel teurer. Seit fünf Jahren
Neue Antikoagulanzien
 1. Unabhängiger Fortbildungskongress der Ärztekammer Berlin, Berlin 1.12.2012 Workshop 2: Neue Antikoagulanzien Hans Wille Institut für Klinische Pharmakologie Klinikum Bremen Mitte ggmbh www.pharmakologie
1. Unabhängiger Fortbildungskongress der Ärztekammer Berlin, Berlin 1.12.2012 Workshop 2: Neue Antikoagulanzien Hans Wille Institut für Klinische Pharmakologie Klinikum Bremen Mitte ggmbh www.pharmakologie
Arzneimittelversorgung in Deutschland
 Arzneimittelversorgung in Deutschland Erfahrungen mit dem Arzneimittelmarkt-Neuordnungsgesetz AMNOG-Update 2013 - Lernendes System 44. Tagung der deutsch-österreichischen Kommission Salzburg, 12. September
Arzneimittelversorgung in Deutschland Erfahrungen mit dem Arzneimittelmarkt-Neuordnungsgesetz AMNOG-Update 2013 - Lernendes System 44. Tagung der deutsch-österreichischen Kommission Salzburg, 12. September
BAnz AT B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Mehrfache Gerinnungshemmung bei Vorhofflimmern und KHK - Wie geht man heute vor? Dr. med. D. Enayat
 Mehrfache Gerinnungshemmung bei Vorhofflimmern und KHK - Wie geht man heute vor? Dr. med. D. Enayat An der Blutgerinnung sind beteiligt: Blutplättchen (Thrombozyten) Gerinnungsfaktoren - im Blutplasma
Mehrfache Gerinnungshemmung bei Vorhofflimmern und KHK - Wie geht man heute vor? Dr. med. D. Enayat An der Blutgerinnung sind beteiligt: Blutplättchen (Thrombozyten) Gerinnungsfaktoren - im Blutplasma
Akute venösen Thromboembolien (VTE) oder VTE in der Vorgeschichte, einschließlich tiefer Venenthrombose und Lungenembolie.
 Aktualisierte Indikation Behandlung der schweren Osteoporose: bei postmenopausalen Frauen, bei erwachsenen Männern, mit hohem Frakturrisiko, für die eine Behandlung mit anderen für die Osteoporosetherapie
Aktualisierte Indikation Behandlung der schweren Osteoporose: bei postmenopausalen Frauen, bei erwachsenen Männern, mit hohem Frakturrisiko, für die eine Behandlung mit anderen für die Osteoporosetherapie
Chronische Polyarthritis - CP Diagnose Behandlungsmöglichkeiten
 Chronische Polyarthritis - CP Diagnose Behandlungsmöglichkeiten Dr.Thomas Müller FA f. Innere Medizin u. Rheumatologie Pestalozzistr.6, 8010 Graz ordination@rheumadoc.at www.rheumadoc.at Chronische Polyarthritis
Chronische Polyarthritis - CP Diagnose Behandlungsmöglichkeiten Dr.Thomas Müller FA f. Innere Medizin u. Rheumatologie Pestalozzistr.6, 8010 Graz ordination@rheumadoc.at www.rheumadoc.at Chronische Polyarthritis
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B1. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Biosimilars aus Sicht der Kostenträger - BfArM im Dialog
 Biosimilars aus Sicht der Kostenträger - BfArM im Dialog Bonn, 27. Juni 2016 Dr. Antje Haas GKV-Spitzenverband Abteilung Arznei- und Heilmittel Biologische Arzneimittel, ein problematischer Teilmarkt GKV-Umsatz
Biosimilars aus Sicht der Kostenträger - BfArM im Dialog Bonn, 27. Juni 2016 Dr. Antje Haas GKV-Spitzenverband Abteilung Arznei- und Heilmittel Biologische Arzneimittel, ein problematischer Teilmarkt GKV-Umsatz
BAnz AT 07.07.2016 B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Dossierbewertung A14-28 Version 1.0 Apixaban (neues Anwendungsgebiet) Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Apixaban (neues Anwendungsgebiet) gemäß 35a SGB V beauftragt. Die Bewertung
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Apixaban (neues Anwendungsgebiet) gemäß 35a SGB V beauftragt. Die Bewertung
Frühe Nutzenbewertung aus Sicht des IQWiG. Jürgen Windeler
 Frühe Nutzenbewertung aus Sicht des IQWiG Jürgen Windeler AMNOG, aus der Begründung Die Datenlage für neue Wirkstoffe (insbesondere in der Onkologie) wird von Experten als unbefriedigend bezeichnet. Die
Frühe Nutzenbewertung aus Sicht des IQWiG Jürgen Windeler AMNOG, aus der Begründung Die Datenlage für neue Wirkstoffe (insbesondere in der Onkologie) wird von Experten als unbefriedigend bezeichnet. Die
Frühe Nutzenbewertung im Gemeinsamen Bundesausschuss
 im Gemeinsamen Bundesausschuss Vortrag im Rahmen des 13. DGRA-Jahreskongresses in Bonn Referent: Dr. jur. Rainer Hess, G-BA Seite 1 3. Mai 2011 13. DGRA-Jahreskongress in Bonn 2011, Dr. jur. Rainer Hess
im Gemeinsamen Bundesausschuss Vortrag im Rahmen des 13. DGRA-Jahreskongresses in Bonn Referent: Dr. jur. Rainer Hess, G-BA Seite 1 3. Mai 2011 13. DGRA-Jahreskongress in Bonn 2011, Dr. jur. Rainer Hess
Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten
 Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten Arzneimittelmarktneuordnungsgesetz (AMNOG) 35a Bewertung des Nutzens von Arzneimitteln
Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten Arzneimittelmarktneuordnungsgesetz (AMNOG) 35a Bewertung des Nutzens von Arzneimitteln
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Lurasidon wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
HIV-Therapie: Pharmaanbieter Gilead hält die Preise hoch
 Wissenschaftliches Institut der AOK Pressemitteilung Berlin, den 27. November 2017 HAUSANSCHRIFT Rosenthaler Str. 31 D-10178 Berlin POSTANSCHRIFT Postfach 11 02 46 D-10832 Berlin TELEFON +49 30 34646-2393
Wissenschaftliches Institut der AOK Pressemitteilung Berlin, den 27. November 2017 HAUSANSCHRIFT Rosenthaler Str. 31 D-10178 Berlin POSTANSCHRIFT Postfach 11 02 46 D-10832 Berlin TELEFON +49 30 34646-2393
Marktentwicklung: Umsatz-, Mengen- und Strukturentwicklung bei Fertigarzneimitteln
 Faktenblatt Thema: Arzneimittelmarkt Ausgaben Arzneimittel (Quelle: Amtliche Statistik KV 45) 2014: 33,3 Mrd. Euro 2013: 30,4 Mrd. Euro 2012: 29,6 Mrd. Euro 2011: 29,2 Mrd. Euro Ausgaben für Arzneimittel
Faktenblatt Thema: Arzneimittelmarkt Ausgaben Arzneimittel (Quelle: Amtliche Statistik KV 45) 2014: 33,3 Mrd. Euro 2013: 30,4 Mrd. Euro 2012: 29,6 Mrd. Euro 2011: 29,2 Mrd. Euro Ausgaben für Arzneimittel
Versorgung und Finanzen. Dr. Norbert Gerbsch, stv. Hauptgeschäftsführer Bundesverband der Pharmazeutischen Industrie e.v.
 Versorgung und Finanzen Dr. Norbert Gerbsch, stv. Hauptgeschäftsführer Bundesverband der Pharmazeutischen Industrie e.v. AMNOG: Versorgungs- u. Finanzeffekte AMNOG: Rabatte aus Erstattungsbeträgen in Mio.
Versorgung und Finanzen Dr. Norbert Gerbsch, stv. Hauptgeschäftsführer Bundesverband der Pharmazeutischen Industrie e.v. AMNOG: Versorgungs- u. Finanzeffekte AMNOG: Rabatte aus Erstattungsbeträgen in Mio.
BAnz AT B7. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um die Wirkstoffkombination Netupitant/Palonosetron wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Zugelassenes Anwendungsgebiet (laut Zulassung vom 11. Mai 2016):
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Vertrag über ein strukturiertes Arzneimittel-Management von Biologika und Biosimilars (Biolike) in Hamburg nach 84 Abs.
 Vertrag über ein strukturiertes Arzneimittel-Management von Biologika und Biosimilars (Biolike) in Hamburg nach 84 Abs. 1 Satz 5 SGB V zwischen der Kassenärztlichen Vereinigung Hamburg Heidenkampsweg 99,
Vertrag über ein strukturiertes Arzneimittel-Management von Biologika und Biosimilars (Biolike) in Hamburg nach 84 Abs. 1 Satz 5 SGB V zwischen der Kassenärztlichen Vereinigung Hamburg Heidenkampsweg 99,
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Apixaban wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Patientenindividuelle Therapie als zweckmäßige Vergleichstherapie
 Beratung für Hersteller von Arzneimitteln, Diagnostika und Medizinprodukten Malte Kühl, Dr. Birgit Ohlendorf, Dr. Claudia Pütz TU Berlin, den 15.03.2016 Patientenindividuelle Therapie als zweckmäßige Vergleichstherapie
Beratung für Hersteller von Arzneimitteln, Diagnostika und Medizinprodukten Malte Kühl, Dr. Birgit Ohlendorf, Dr. Claudia Pütz TU Berlin, den 15.03.2016 Patientenindividuelle Therapie als zweckmäßige Vergleichstherapie
Nutzenbewertung nach 35a SGB V: Beschlüsse des Gemeinsamen Bundesausschusses (G-BA) im 3. Quartal 2015
 Foto: istockphoto.com Verordnung Aktuell Arzneimittel Eine Information der Kassenärztlichen Vereinigung Bayerns Verordnungsberatung@kvb.de www.kvb.de/verordnungen Stand: Nutzenbewertung nach 35a SGB V:
Foto: istockphoto.com Verordnung Aktuell Arzneimittel Eine Information der Kassenärztlichen Vereinigung Bayerns Verordnungsberatung@kvb.de www.kvb.de/verordnungen Stand: Nutzenbewertung nach 35a SGB V:
BAnz AT B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
TVT-Therapie. Bayer HealthCare: Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Präventio
 Bayer HealthCare: Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Präventio Bayer HealthCare Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Prävention
Bayer HealthCare: Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Präventio Bayer HealthCare Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Prävention
BAnz AT B5. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Nutzenbewertung und unabhängige Arzneimittelinformationen
 Gemeinsame Fortbildungs- und Informationsveranstaltung der AkdÄ und der AMK Berlin, 11. Juli 2015 Nutzenbewertung und unabhängige Arzneimittelinformationen Dr. med. Katrin Bräutigam Geschäftsführerin der
Gemeinsame Fortbildungs- und Informationsveranstaltung der AkdÄ und der AMK Berlin, 11. Juli 2015 Nutzenbewertung und unabhängige Arzneimittelinformationen Dr. med. Katrin Bräutigam Geschäftsführerin der
1. Zusatznutzen des Arzneimittels im Verhältnis zur zweckmäßigen Vergleichstherapie
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM- RL):Anlage XII Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM- RL):Anlage XII Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V
Die frühe Nutzenbewertung und ihre rechtlichen Herausforderungen
 und ihre rechtlichen Herausforderungen Rechtssymposium Die frühe Nutzenbewertung von Arzneimitteln nach AMNOG G-BA, Berlin Referent: Dr. jur. Rainer Hess, G-BA Seite 1 16. November 2010 Rechtssymposium
und ihre rechtlichen Herausforderungen Rechtssymposium Die frühe Nutzenbewertung von Arzneimitteln nach AMNOG G-BA, Berlin Referent: Dr. jur. Rainer Hess, G-BA Seite 1 16. November 2010 Rechtssymposium
Angriffspunkte bei der Behandlung von Autoimmunerkrankungen
 Angriffspunkte bei der Behandlung von Autoimmunerkrankungen Dr. Ilse Zündorf Institut für Pharmazeutische Biologie Goethe-Universität Frankfurt zuendorf@em.uni-frankfurt.de Autoimmunerkrankungen Grundlagen
Angriffspunkte bei der Behandlung von Autoimmunerkrankungen Dr. Ilse Zündorf Institut für Pharmazeutische Biologie Goethe-Universität Frankfurt zuendorf@em.uni-frankfurt.de Autoimmunerkrankungen Grundlagen
Einleitung und Leseanweisung
 VII Einleitung und Leseanweisung Für wen ist dieses Buch? Der Pocket Guide ist für alle klinisch tätigen Psychiater geschrieben, denen das Kompendium der Psychiatrischen Pharmakotherapie für die Kitteltasche
VII Einleitung und Leseanweisung Für wen ist dieses Buch? Der Pocket Guide ist für alle klinisch tätigen Psychiater geschrieben, denen das Kompendium der Psychiatrischen Pharmakotherapie für die Kitteltasche
BAnz AT B3. Beschluss
 BAnz AT 6.05.0 B Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
BAnz AT 6.05.0 B Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Daratumumab wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Ausgaben in der GKV 2016 (SpiBu 2017)
 1 Ausgaben in der GKV 2016 (SpiBu 2017) Steigerungen der Arzneimittelausgaben (SpiBu 2017) Die 20 führenden Präparate nach Industrieumsatz im Jahr 2016 Rang Präparat (Hersteller) (Wirkstoff) Anwendungsgebiet
1 Ausgaben in der GKV 2016 (SpiBu 2017) Steigerungen der Arzneimittelausgaben (SpiBu 2017) Die 20 führenden Präparate nach Industrieumsatz im Jahr 2016 Rang Präparat (Hersteller) (Wirkstoff) Anwendungsgebiet
Das Arzneimittelmarktneuordnungsgesetz (AMNOG) - Welche Auswirkungen hat das Gesetz auf die Apotheken?
 Das Arzneimittelmarktneuordnungsgesetz (AMNOG) - Welche Auswirkungen hat das Gesetz auf die Apotheken? Dr. rer. nat. Holger Knoth, Leiter der Klinik-Apotheke Seite 1 Welche Tätigkeitsfelder in der Apotheke
Das Arzneimittelmarktneuordnungsgesetz (AMNOG) - Welche Auswirkungen hat das Gesetz auf die Apotheken? Dr. rer. nat. Holger Knoth, Leiter der Klinik-Apotheke Seite 1 Welche Tätigkeitsfelder in der Apotheke
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um die Wirkstoffkombination Indacaterol/Glycopyrronium wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Vortioxetin wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Der Arzneimittelmarkt in Deutschland
 GAmSi GKV Arzneimittel Schnellinformation Der Arzneimittelmarkt in Deutschland Januar bis Dezember 2006 (Stand: 29. März 2007) Projektträger der GKV-Arzneimittel-Schnellinformation: AOK-Bundesverband BKK
GAmSi GKV Arzneimittel Schnellinformation Der Arzneimittelmarkt in Deutschland Januar bis Dezember 2006 (Stand: 29. März 2007) Projektträger der GKV-Arzneimittel-Schnellinformation: AOK-Bundesverband BKK
: Schulungsmaterial (Educational Material) für medizinisches Fachpersonal
 Kadcyla : Schulungsmaterial (Educational Material) für medizinisches Fachpersonal EU Information für medizinisches Fachpersonal Januar 2017 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung.
Kadcyla : Schulungsmaterial (Educational Material) für medizinisches Fachpersonal EU Information für medizinisches Fachpersonal Januar 2017 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung.
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Einsatz neuer Medikamente: GLP1-Analoga & DPP4-Hemmer
 16. Welt Diabetes Tag an der Charité Einsatz neuer Medikamente: GLP1-Analoga & DPP4-Hemmer Lenka Bosanska Was bedeutet: GLP-1 DPP-4 Hormone des Glucosestoffwechsels Pankreas (Bauchspeicheldrüse) Insulin
16. Welt Diabetes Tag an der Charité Einsatz neuer Medikamente: GLP1-Analoga & DPP4-Hemmer Lenka Bosanska Was bedeutet: GLP-1 DPP-4 Hormone des Glucosestoffwechsels Pankreas (Bauchspeicheldrüse) Insulin
Faktenblatt Thema: Arzneimittelmarkt
 Ausgaben Arzneimittel (Quelle: amtliche Statistiken) 2012: 29,41 Mrd. Euro 2011: 28,98 Mrd. Euro 2010: 30,18 Mrd. Euro 2009: 30,00 Mrd. Euro 2008: 28,39 Mrd. Euro 2000: 20,12 Mrd. Euro 1998: 17,72 Mrd.
Ausgaben Arzneimittel (Quelle: amtliche Statistiken) 2012: 29,41 Mrd. Euro 2011: 28,98 Mrd. Euro 2010: 30,18 Mrd. Euro 2009: 30,00 Mrd. Euro 2008: 28,39 Mrd. Euro 2000: 20,12 Mrd. Euro 1998: 17,72 Mrd.
Medikamentöse Therapie rheumatischer Erkrankungen
 Medikamentöse Therapie rheumatischer Erkrankungen Nichtsteroidale Antirheumatika/ Cox 2-Hemmer u. a. Diclofenac, Ibuprofen Celecoxib, Etoricoxib DMARDs/Basistherapeutika u. a. Hydroxychloroquin, Sulfasalazin,
Medikamentöse Therapie rheumatischer Erkrankungen Nichtsteroidale Antirheumatika/ Cox 2-Hemmer u. a. Diclofenac, Ibuprofen Celecoxib, Etoricoxib DMARDs/Basistherapeutika u. a. Hydroxychloroquin, Sulfasalazin,
Rolapitant wird in Kombination mit einem 5-Hydroxytryptamin (5-HT 3 )- Rezeptorantagonisten und Dexamethason verabreicht.
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Rolapitant gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis eines
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Rolapitant gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis eines
28. Oktober 2015 I Seite 1. Der Vertragsarzt im Spannungsfeld zwischen Verordnungsfähigkeit und Regressgefahr
 28. Oktober 2015 I Seite 1 Der Vertragsarzt im Spannungsfeld zwischen Verordnungsfähigkeit und Regressgefahr Dipl.-Med. Jutta Eckert Forum Ambulant-stationärer Dialog, 21. Oktober 2015 DEGAM Leitlinie
28. Oktober 2015 I Seite 1 Der Vertragsarzt im Spannungsfeld zwischen Verordnungsfähigkeit und Regressgefahr Dipl.-Med. Jutta Eckert Forum Ambulant-stationärer Dialog, 21. Oktober 2015 DEGAM Leitlinie
Anlage 2 Regeln zur Berechnung von Messzahlen
 Anlage 2 Regeln zur Berechnung von Messzahlen 1. ABSCHNITT: VORBEMERKUNG... 2 2. ABSCHNITT: GRUNDREGELN... 2 3. ABSCHNITT: FRAGENKATALOG ZUR ERMITTLUNG VON MESSZAHLEN... 4 4. ABSCHNITT: ZUSATZREGELN ZUR
Anlage 2 Regeln zur Berechnung von Messzahlen 1. ABSCHNITT: VORBEMERKUNG... 2 2. ABSCHNITT: GRUNDREGELN... 2 3. ABSCHNITT: FRAGENKATALOG ZUR ERMITTLUNG VON MESSZAHLEN... 4 4. ABSCHNITT: ZUSATZREGELN ZUR
Tragende Gründe zum Beschluss. des Gemeinsamen Bundesausschusses über die Änderung der Arzneimittel-Richtlinie (AM-RL):
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage 1 (OTC-Übersicht) Nr. 20 Ginkgo-biloba-Blätter-Extrakt Vom 14. April 2011 Inhaltsverzeichnis
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage 1 (OTC-Übersicht) Nr. 20 Ginkgo-biloba-Blätter-Extrakt Vom 14. April 2011 Inhaltsverzeichnis
Dossierbewertung A16-60 Version 1.0 Ibrutinib (chronische lymphatische Leukämie)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ibrutinib in Kombination mit Bendamustin und Rituximab (Ibrutinib + BR) gemäß
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ibrutinib in Kombination mit Bendamustin und Rituximab (Ibrutinib + BR) gemäß
Dossierbewertung A17-25 Version 1.0 Etelcalcetid (sekundärer Hyperparathyreoidismus)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Etelcalcetid gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Etelcalcetid gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis
Tragende Gründe. Vom 22. November Inhalt 1. Rechtsgrundlage Eckpunkte der Entscheidung Verfahrensablauf... 4
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses zur ambulanten Sanierungsbehandlung von Trägern des Methicillin-resistenten Staphylococcus aureus (MRSA) zu Lasten der gesetzlichen Krankenversicherung
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses zur ambulanten Sanierungsbehandlung von Trägern des Methicillin-resistenten Staphylococcus aureus (MRSA) zu Lasten der gesetzlichen Krankenversicherung
BAnz AT 12.10.2015 B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BARMERGEK Arzneimittel-Report 2010
 Berlin, den 09.06.2010 BARMERGEK Arzneimittel-Report 2010 Prof. Dr. Gerd Glaeske, Dr. Christel Schicktanz Universität Bremen, Zentrum für Sozialpolitik (ZeS) Kein Interessenskonflikt im Sinne der Uniform
Berlin, den 09.06.2010 BARMERGEK Arzneimittel-Report 2010 Prof. Dr. Gerd Glaeske, Dr. Christel Schicktanz Universität Bremen, Zentrum für Sozialpolitik (ZeS) Kein Interessenskonflikt im Sinne der Uniform
Vitamin-K- Antagonisten NOAK VKA. Neue orale Antikoagulanzien. Informationen für Ärzte: Umstellung von NOAK auf VKA
 Vitamin-K- Antagonisten NOAK VKA vs Neue orale Antikoagulanzien Informationen für Ärzte: Umstellung von NOAK auf VKA Better Care. Better Life. Better Care. Better Life. Alere. Alere. Alere INRatio 2: Das
Vitamin-K- Antagonisten NOAK VKA vs Neue orale Antikoagulanzien Informationen für Ärzte: Umstellung von NOAK auf VKA Better Care. Better Life. Better Care. Better Life. Alere. Alere. Alere INRatio 2: Das
Fallbeispiele. Fallbeispiel 1
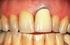 Fallbeispiele Prof. Dr. med. habil. Paracelsus Harz-Klinik Bad Suderode Medizinische Fakultät der Martin Luther-Universität Halle-Wittenberg 1 Fallbeispiel 1-61-Jähriger - Guter Allgemeinzustand - Adipöser
Fallbeispiele Prof. Dr. med. habil. Paracelsus Harz-Klinik Bad Suderode Medizinische Fakultät der Martin Luther-Universität Halle-Wittenberg 1 Fallbeispiel 1-61-Jähriger - Guter Allgemeinzustand - Adipöser
Antikoagulation und Thrombozytenaggregationshemmung
 Antikoagulation und Thrombozytenaggregationshemmung Kurze Übersicht der aktuellen Therapieoptionen Peter Bobbert Innere Medizin 26. Oktober 2015 Akademisches Lehrkrankenhaus der Charité Universitätsmedizin
Antikoagulation und Thrombozytenaggregationshemmung Kurze Übersicht der aktuellen Therapieoptionen Peter Bobbert Innere Medizin 26. Oktober 2015 Akademisches Lehrkrankenhaus der Charité Universitätsmedizin
Patienteninformation Blutverdünnung bei Vorhofflimmern
 Patienteninformation Blutverdünnung bei Vorhofflimmern Über diese Patienteninformation Vorhofflimmern ist die häufigste Herz-Rhythmusstörung, sie tritt bei 1 2 % der Bevölkerung auf. Die Häufigkeit des
Patienteninformation Blutverdünnung bei Vorhofflimmern Über diese Patienteninformation Vorhofflimmern ist die häufigste Herz-Rhythmusstörung, sie tritt bei 1 2 % der Bevölkerung auf. Die Häufigkeit des
Orale Antikoagulation
 A. Plehn? Orale Antikoagulation NOAC Rivaroxaban (Xarelto) // Faktor-Xa-Hemmung Dabigatran (Pradaxa) // Faktor-IIa-Hemmung (Thrombin) Apixaban (Eliquis) // Faktor-Xa-Hemmung (Edoxaban // Faktor-Xa-Hemmung)
A. Plehn? Orale Antikoagulation NOAC Rivaroxaban (Xarelto) // Faktor-Xa-Hemmung Dabigatran (Pradaxa) // Faktor-IIa-Hemmung (Thrombin) Apixaban (Eliquis) // Faktor-Xa-Hemmung (Edoxaban // Faktor-Xa-Hemmung)
Blutgerinnung. Folie 1. Arzneistoffe mit Wirkung auf die Blutgerinnung. Blutgerinnungshemmende Arzneistoffe Antikoagulantien
 Folie 1 Blutgerinnung Arzneistoffe mit Wirkung auf die Blutgerinnung Blutgerinnungshemmende Arzneistoffe 1 Folie 2 Arzneistoffe/ Fertigarzneimittel mit Wirkung auf die Blutgerinnung: Marcumar, Marcuphen,
Folie 1 Blutgerinnung Arzneistoffe mit Wirkung auf die Blutgerinnung Blutgerinnungshemmende Arzneistoffe 1 Folie 2 Arzneistoffe/ Fertigarzneimittel mit Wirkung auf die Blutgerinnung: Marcumar, Marcuphen,
Fakten und Zahlen Thema: Arzneimittelfestbeträge
 Festbeträge kurbeln Preiswettbewerb an Festbeträge für Arzneimittel wurden mit dem Gesundheitsreformgesetz 1989 eingeführt, um den starken Anstieg der Arzneimittel- Ausgaben durch Intensivierung des Preiswettbewerbs
Festbeträge kurbeln Preiswettbewerb an Festbeträge für Arzneimittel wurden mit dem Gesundheitsreformgesetz 1989 eingeführt, um den starken Anstieg der Arzneimittel- Ausgaben durch Intensivierung des Preiswettbewerbs
Fachgruppenspezifische Zielquoten
 Anlage 1 zur Arzneimittel-Vereinbarung vom 7. Dezember 2016 der KV RLP mit den Verbänden der Krankenkassen für das Jahr 2017 Fachgruppenspezifische n Für die nachfolgenden Fach- / Prüfgruppen werden für
Anlage 1 zur Arzneimittel-Vereinbarung vom 7. Dezember 2016 der KV RLP mit den Verbänden der Krankenkassen für das Jahr 2017 Fachgruppenspezifische n Für die nachfolgenden Fach- / Prüfgruppen werden für
Aflibercept (Eylea) bei altersbedingter Makuladegeneration
 verstehen abwägen entscheiden Aflibercept (Eylea) bei altersbedingter Makuladegeneration Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) Inhaltsverzeichnis Überblick Einleitung
verstehen abwägen entscheiden Aflibercept (Eylea) bei altersbedingter Makuladegeneration Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) Inhaltsverzeichnis Überblick Einleitung
Anhang 3 zu Anlage 12
 Qualitätszuschläge Rationale Pharmakotherapie Die Vertragspartner streben durch diesen Vertrag die Umsetzung einer Rationalen Pharmakotherapie an. Die ärztliche Hoheit und Verantwortung bei der Verordnung
Qualitätszuschläge Rationale Pharmakotherapie Die Vertragspartner streben durch diesen Vertrag die Umsetzung einer Rationalen Pharmakotherapie an. Die ärztliche Hoheit und Verantwortung bei der Verordnung
Bundesministerium für Gesundheit. Bekanntmachung
 Seite 1 7 Bundesministerium für Gesundheit eines Beschlusses des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung Arzneimitteln
Seite 1 7 Bundesministerium für Gesundheit eines Beschlusses des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung Arzneimitteln
Antikoagulation bei Niereninsuffizienz. J. Jacobi Medizinische Klinik 4, Universität Erlangen-Nürnberg
 Antikoagulation bei Niereninsuffizienz J. Jacobi Medizinische Klinik 4, Universität Erlangen-Nürnberg das Dilemma der Nephrologen das Dilemma der Nephrologen Nierenfunktionseinschränkung regelhaft Ausschlußkriterium
Antikoagulation bei Niereninsuffizienz J. Jacobi Medizinische Klinik 4, Universität Erlangen-Nürnberg das Dilemma der Nephrologen das Dilemma der Nephrologen Nierenfunktionseinschränkung regelhaft Ausschlußkriterium
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Management der frühen rheumatoiden Arthritis
 publiziert bei: AWMF-Register Nr. 060/002 Klasse: S3 Kurzfassung und Abstimmungsergebnisse Management der frühen rheumatoiden Arthritis Empfohlene Diagnostik: s. Kap. 2.4 GCP Stellen Sie Patienten mit
publiziert bei: AWMF-Register Nr. 060/002 Klasse: S3 Kurzfassung und Abstimmungsergebnisse Management der frühen rheumatoiden Arthritis Empfohlene Diagnostik: s. Kap. 2.4 GCP Stellen Sie Patienten mit
