Michael Pieper Universität-Oldenburg - SoSe 2003
|
|
|
- Lieselotte Hertz
- vor 6 Jahren
- Abrufe
Transkript
1 1. Klassifizierung (von : eliminare = aus dem Haus treiben). Allgemeinen Reaktionen bei denen zwei Gruppen (Atome, Ionen, Moleküle) aus einem Substrat abgespalten werden. Die Klassifizierung in α-, β- und γ -Eliminierung erfolgt anhand der relativen Stellung der Kohlenstoffatome, von denen die Eliminierung erfolgt. Bei einer α-eliminierung werden beide Abgangsgruppen von dem gleichen Kohlenstoffatom abgespalten, wobei Carbene gebildet werden. Befinden sich beide Abgangsgruppen an benachbarten Kohlenstoffatomen entsteht eine Doppelbindung und man spricht von einer β-eliminierung. Im seltenen Fall der γ-eliminierung werden beide Abgangsgruppen von einem α- und einem γ-atom unter Bildung von Cyclopropanderivaten abgespalten. 1.1 α-eliminierung Produkte der α-eliminierung sind instabile Spezies mit zweiwertigen Kohlenstoffatomen (Carbene).Sie sind sehr reaktiv und addieren sich gerne an Doppelbindungen, wobei sie Cyclopropane bilden, oder schieben sich in eine C-H Binding ein. Allgemein geringe Aktivierungsenergie. Seite 1 von 11
2 1.2 β-eliminierung Die β-eliminierung wird nach Reaktionsmechanismus in E1- E1cb- und E2 Eliminierung unterteilt. Die E1-Eliminierung (unimolekulare Eliminierung) ist ein zweistufiger Prozess. Der Geschwindigkeitsbestimmende Schritt ist, wie im S N 1 Mechanismus zu dem die E1- Eiminierung in Konkurrenz steht, die Bildung eines Carbeniumions. Das ist die Folge des Austretens der Abgangsgruppe. Anschließend folgt die schnelle Abspaltung eines Protons. Der E1cb-Mechansimus ist, wie der E1-Mechanismus, ein zweistufiger Prozess. Die Reihenfolge der Schritte ist dabei genau umgekehrt. Im ersten Schritt wird ein Proton unter Bildung eines Carbanions abgespalten, erst dann tritt die Abgangsgruppe aus. Der E2-Mechanismus (bimolekulare Eliminierung) ist durch einen bimolekularen Übergangszustand unter Beteiligung der Base gekennzeichnet, bei dem die Abspaltung des Protons, in β-stellung zur Abgangsgruppe, und der Austritt der Abgangsgruppe gleichzeitig erfolgen. Die Reaktion verläuft über den energetisch günstigsten Weg. Viele β-eliminierungen verlaufen in der Realität nach Mechanismen die zwischen diesen Granzfällen liegen und hängen von den Reaktionsbedingungen ab. 2. Reaktionen nach dem E1- und E1cb-Mechanismus 2.1 Stabilisierungseffekte beim E1- und E1cb-Mechanismus Vorraussetzung für eine Reaktion die bevorzugt nach einem E1- bzw. E1cb-Mechanismus abläuft, ist die Stabilisierung des intermediären Carbenium- bzw. Carban-Ions. Betrachtet man beispielsweise die HCL-Eliminierung aus Ethylchlorid, so wird wegen der hohen Energie der Zwischenprodukte von E1 und E1cb der Reaktionsweg über den energetisch günstigeren E2-Pfad bevorzugt. Seite 2 von 11
3 Die Stabilität von Carbeniom-Ionen nimmt mit zunehmender Zahl von Alkylsubstituenten zu: Die Stabilisierung erfolgt zum einen durch den positiven induktiven Effekte der Alkylgruppen und zum anderen durch Hyperkonjugation mit benachbarten C-H Bindungen der Alkylsubstituenten. Abb. : Hyperkonjugation (grüne gestrichelte Linen) zwischen gefüllten sp 3 -Hybridorbitalen und einem leeren p- Orbital. Bei der Hyperkonjugation wird die Elektronendichte aus benachbarten C-H Bindungen in das leere p-orbital übertragen. Die daraus resultierende Delokalisierung der Elektronendichte hat einen stabilisierenden Effekt auf das Carbenium-Ion. Sekundäre und tertiäre Carbenium-Ionen erfahren eine zusätzliche Stabilisierung durch die Abnahme der sterischen Wechselwirkung der Substituenten, da sich diese nun planar und nicht tetraedrisch anordnen. Reaktionen nach dem E1cb-Mechanismus beschränken sich auf Rektanden mit Substituenten, welche das intermediäre Carban-Ion stabilisieren und wird bei Alkylhalogeniden nicht beobachtet. Er tritt eher auf, wenn wie Abgangsgruppen in β-stellung zu einer Carbonyl-, Nitro-, Cyan-, Sulfonyl-, oder einer anderen Carbanionen-stabilisierenden Gruppe steht. 2.2 E1-Mechanismus Der Geschwindigkeitsbestimmende Schritt ist derselbe wie bei der S N 1 Reaktion, nämlich die Dissoziation zu einem Carbeniom-Ion. Polare Lösungsmittel erleichtern die heterolytische Spaltung der C-X Bindung. Die Base spielt keine Rolle für die Reaktionsgeschwindigkeit. Seite 3 von 11
4 Aufgrund des Induktiven Effektes und der Beteiligung an der Hyperkonjugation ist die C-H Bindung geschwächt. Anschließend wird in einem schnellen Schritt das Proton an das Lösungsmittel übertragen. Dieser Schritt erfolgt leichter in Gegenwart einer Base, wodurch auch das Produktverhältnis zwischen Eliminierung und der konkurrierenden S N 1 Reaktion zugunsten der Eliminierung verschoben wird Konkurrenzreaktionen S N 1 Reaktion Die S N 1 Reaktion findet unter den gleichen Bedingungen statt wie die Eliminierung und steht daher mit ihr in Konkurrenz. Durch Zugabe einer Base wie NaOH, die wesentlich stärker ist als Wasser oder Ethanol (als normale Lösungsmittel) wird die Eliminierungsreaktion stark begünstigt. Seite 4 von 11
5 Umlagerung Primäre bzw. sekubdäre Carbenium-Ionen können sich spontan zu sekundären bzw. tertiären Carbenium-Ionen umlagern, da diese stabiler und daher energetisch günstiger sind. Dieser Effekt zählt zu den stabilisierenden Effekten, jedoch auch zu den Konkurrenzreaktionen, da die Struktur des Carbenium-Ions die Lage der Doppelbindung beeinflusst. 2.3 E1cb-Mechanismus Eine starke Base abstrahiert ein dem Reaktionszentrum benachbartes Wasserstoffatom, wobei sich ein Carban-Ion bildet. Anschließend erfolgt der Austritt der Abgangsgruppe. 2.4 Regiochemie und Orientierung E1-Mechanismus Da der E1-Mechanismus über zwei Stufen verläuft, hängt das Produkt von der Struktur des Carbenium-Ions ab. Bei Alkenen sind meist höher substituierte und daher stabilere begünstigt. Da die Reaktion immer über das selbe Zwischenprodukt erfolgt, ist die Reaktion begünstig, welche das stabilere Produkt liefert. Seite 5 von 11
6 E1cb- Mechanismus Die Eliminierungsrichtung wird dadurch gelenkt, wie leicht die jeweiligen β-protonen entfernt werden können. Allgemein muss betrachtet werden: - sterische Hindering o große Base o Substituenten - eventuelle Resonanzstabilisierung beim Produkt o die sich bildende Doppelbindung könne in Konjugation mit bereits bestehenden treten - polare Effekte benachbarter Substituenten o Beim E1cb-Mechanismus führen Alkyl-Substituenten (+I-Effekt) zu einer Verlangsamung der Abspaltung von β-protonen, da sich dabei ein Carban-Ion bildet (Diradikal am C-Atom). 3. E2-Mechanismus (bimolekulare Eliminierun) Die bimolekulare Eliminierung ist dadurch gekennzeichnet, dass die Bildungsgeschwindigkeit des Alkens ist sowohl proportional zur Konzentration des Halogenids als auch zur Konzentration der Base. Die Bildung erfolgt über einen Übergangszustand, an dem sowohl das Substrat als auch die Base beteiligt ist. Starke Basen können ein dem Reaktionszentrum benachbartes Wasserstoffatom angreifen, bevor sich ein Carbenium-Ion bildet. Der E2-Eliminierung steht in Konkurrenz zum S N 2-Mechanismus. 3.1 Mechanismus Es erfolgt gleichzeitig: - Bindungsbildung zw. Base (B ) und Proton - Rehybridisierung von sp 3 zu sp 2 - Ausbildung der Doppelbindung - Lösen der Bindung zur Abgangsgruppe Seite 6 von 11
7 3.1.1 Orientierung und Regiochemie Die Eliminierung kann in unterschiedlichen Stellungen erfolgen: Es erfolgt eine trans β-eliminierung bzw. anti-eliminierung. (durch die Lage der p-orbitele ist die Eliminierung in dieser Stellung energetisch am günstigsten und wird daher bevorzugt) Es erfolgt eine cis β-eliminierung bzw. syn-eliminierung Resultate einer E2-Eliminirung sind Alkene mit definierter Konfiguration: Das Edukt liegt schon bevorzugt in anti-stellung vor, daher erfolgt eine anti-eliminierung. Eine syn-eliminierung lieg meist vor, wenn die anti-eliminierung gehindert ist oder nicht möglich ist. Bsp.1: Die Eliminierung in anti-stellung ist sterisch gehindert. Bsp.2: Beim all-trans-1,2,3,4,5,6- Hexachloridcyclohexan gibt es keinen Wasserstoff in anti- Stellung zu einem Chloratom. Seite 7 von 11
8 Das Produkt hängt in jedem Fall von der Struktur des Übergangszustandes ab: Reaktion A Es wird das energetisch günstigere Produkt gebildet (Doppelbindungen an höher alkylsubstituerten Kohlenstoffatomen sind stabiler) und erfolgt wegen der sterisch ungehinderten Base über einen energetisch günstigen Übergangszustand (siehe Diagramm). Reaktion B In diesem Fall wird das energetisch ungünstigere Produkt bevorzugt gebildet, da dieser Weg aufgrund einer sterisch gehinderten Base über den energetisch günstigsten Übergangszustand verläuft (siehe Diagramm). Erklärung: Mit einer sterisch gehinderten Base ist die Abstaplung eines Protons vom C3 schwierig. Seite 8 von 11
9 Dieser Befund wird mit den folgenden Regeln konkretisiert: Saytzev-Regel (Reaktion A) Nach dieser Regel wird bei der Bildung von Olefinen durch Dehydratisierung von sekundären und tertiären Alkoholen oder Dehydrohalogenierung von sekundären oder tertiären Alkylhalogeniden dasjenige Alken bevorzugt gebildet, das den höchsten Alky- Substitutionsgrad aufweist. Das höher substituierte Alken ist thermodynamisch stabiler und wird aufgrund des günstigeren Übergangszustandes schneller gebildet. Hoffmann-Regel (Reaktion B) Bei schlechten Abgangsgruppen und sterisch gehinderten Basen u.ä. würde die Bildung des Saytzev-Produktes über einen energetisch ungünstigeren Übergangszustand verlaufen, als bei der Bildung des Hoffmann-Produktes, welches daher bevorzugt gebildet wird, obwohl es nicht das thermidynamisch stabilste Produkt ist. Ergänzung: Bredt sche Regel Die Bredt schen-regel besagt, dass in bicyclischen Verbindungen, bei denen eine C=C oder C=N Doppelbindung ausgeht nicht durch Eliminierungsreaktionen gebildet werden. In einer solchen Verbindung stünden die p-orbitale senkrecht aufeinander und könnten damit nicht überlappen. Seite 9 von 11
10 4. Wichtige Reaktionen 4.1 Thermische cis β-eliminierung am Beispiel der Ester-Protolyse (Temp. Ca. 500 ) Die Eliminierung verläuft über einen cyclischen Übergangszustand und bei hohen Temperaturen. 4.2 Säure- und Base-katalysierte trans β- Eliminierung Dehydrohalogenierung Wasserstoff- und Halogen-Atom werdsen aus der selben Verbindung abgaspalten. Die Eliminierung führt zu Olefinen (bei 1,2-Stellung von H und X -->Saytzev-Regel) oder Cyclopropan-Derrivaten (bei 1,3-Stellung). Base-katalysiert Dehydratisierung von Alkoholen zu Alkenen unimolekulare Dahydratisierung bimolekulare Dahydratisierung Seite 10 von 11
11 5 Literaturverzeichnis [1] Carey & Sundberg, Organische Chemie, 1. Auflage, VCH Verlagsgesellschaft mbh, 1995 [2] Vollhardt, Organische Chemie, 3. Auflage, Willey-VCH Verlag GmbH, 2000 [3] CD Römpp Chemie Lexikon Version 1.0, Stuttgart/New York: Georg Thieme Verlag 1995 Seite 11 von 11
4. Alkene und Alkine : Reaktionen und Darstellung
 Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
4. Alkene und Alkine : Reaktionen und Darstellung
 Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
Die elektrophile Addition
 Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Kapitel 4: Eliminierung - Übersicht
 » Reaktionstypen - 1,1-, 1,2-, 1,3-, 1,4-Eliminierung (α-, β-, γ-, δ- Eliminierung), thermische Fragmentierung, cis-eliminierung» Regel - Eliminierung wird begünstigt durch hohe Temperatur, starke Basen,
» Reaktionstypen - 1,1-, 1,2-, 1,3-, 1,4-Eliminierung (α-, β-, γ-, δ- Eliminierung), thermische Fragmentierung, cis-eliminierung» Regel - Eliminierung wird begünstigt durch hohe Temperatur, starke Basen,
N H H. Carbanionen Lewis-Basen Olefine (Alkane) Die Stärke der Nucleophilie wird von versch. Faktoren beeinflußt z.b.
 Organische hemie Nucleophil = kernliebend Nucleophil = Teilchen oder Gruppe, die Lewis-basische Eigenschaften aufweist (also mind. ein freies Elektronenpaar besitzt), es gibt neutrale Nucleophile sowie
Organische hemie Nucleophil = kernliebend Nucleophil = Teilchen oder Gruppe, die Lewis-basische Eigenschaften aufweist (also mind. ein freies Elektronenpaar besitzt), es gibt neutrale Nucleophile sowie
Die verschiedenen Mechanismen der Nucleophilen Substitution
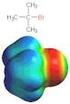 Die verschiedenen Mechanismen der Nucleophilen Substitution Dinah Shafry 21. Juni 2010 Inhalt Vom Alkan zum Alkohol...2 Struktur der Alkane...2 Die Lösung des Problems...2 Die nucleophile Substitution...2
Die verschiedenen Mechanismen der Nucleophilen Substitution Dinah Shafry 21. Juni 2010 Inhalt Vom Alkan zum Alkohol...2 Struktur der Alkane...2 Die Lösung des Problems...2 Die nucleophile Substitution...2
Alkene / Additions-, Eliminierungsreaktionen
 2.2.2. Alkene / Additions-, Eliminierungsreaktionen 64 65 Struktur und Bindung in Ethen Ethen ist planar 2 trigonale C-Atome Bindungswinkel annähernd 120 o C ist sp2-hybridisiert Einfachbindung durch Überlapp
2.2.2. Alkene / Additions-, Eliminierungsreaktionen 64 65 Struktur und Bindung in Ethen Ethen ist planar 2 trigonale C-Atome Bindungswinkel annähernd 120 o C ist sp2-hybridisiert Einfachbindung durch Überlapp
Übung Nr. 13. Vorlesung Allgemeine Chemie II Teil Organische Chemie Frühjahrssemester Mi bzw. Fr
 Übung Nr. 13 Mi. 30.05.2012 bzw. Fr. 01.06.2012 1. Eliminierungen I Geben Sie für die untenstehenden Reaktionen die jeweiligen Produkte an! Um welche Namensreaktion handelt es sich? Welcher Typ Eliminierung
Übung Nr. 13 Mi. 30.05.2012 bzw. Fr. 01.06.2012 1. Eliminierungen I Geben Sie für die untenstehenden Reaktionen die jeweiligen Produkte an! Um welche Namensreaktion handelt es sich? Welcher Typ Eliminierung
Reaktionstypen der Aliphate
 Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
CHE 172.1: Organische Chemie für die Life Sciences
 1 E 172.1: Organische hemie für die Life Sciences Prof Dr. J. A. Robinson 4. Alkene und Alkine : Reaktionen und erstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken
1 E 172.1: Organische hemie für die Life Sciences Prof Dr. J. A. Robinson 4. Alkene und Alkine : Reaktionen und erstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken
a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten!
 Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen.
 Tuesday, January 30, 2001 Allgemeine Chemie B II Page: 1 Inhalt Index 3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1 Die Nomenklatur der Alkene
Tuesday, January 30, 2001 Allgemeine Chemie B II Page: 1 Inhalt Index 3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1 Die Nomenklatur der Alkene
Eliminierungsreaktionen: E1- und E2- Mechanismen; Olefine
 Eliminierungsreaktionen: E1 und E2 chanismen; lefine Allgemeine Gleichung der Eliminierung: Base X X Die Bindung wird am Atom gebrochen. Für die Qualität der Abgangsgruppe X gelten die selben egeln wie
Eliminierungsreaktionen: E1 und E2 chanismen; lefine Allgemeine Gleichung der Eliminierung: Base X X Die Bindung wird am Atom gebrochen. Für die Qualität der Abgangsgruppe X gelten die selben egeln wie
Mechanismen nucleophiler Substitutionen am aliphatischen Kohlenstoff
 Vorlesung 16 Mechanismen nucleophiler Substitutionen am aliphatischen Kohlenstoff Bimolekulare nucleophile Substitutionen (S N 2-Reaktionen) In Vorlesung 11 hatten wir bereits die nucleophile Substitution
Vorlesung 16 Mechanismen nucleophiler Substitutionen am aliphatischen Kohlenstoff Bimolekulare nucleophile Substitutionen (S N 2-Reaktionen) In Vorlesung 11 hatten wir bereits die nucleophile Substitution
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Organische Chemie I/II. Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter!
 Organische Chemie I/II Name: Fachprüfung Vorname: 5. Februar 2003, 15 30-18 30 h Matr.-Nr.: Raum 250 Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter! Jede Aufgabe wird mit 10
Organische Chemie I/II Name: Fachprüfung Vorname: 5. Februar 2003, 15 30-18 30 h Matr.-Nr.: Raum 250 Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter! Jede Aufgabe wird mit 10
Vorlesung Organische Chemie II Reaktionsmechanismen (3. Sem.)
 Vorlesung Organische Chemie II Reaktionsmechanismen (3. Sem.) Gliederung Grundlagen der physikalisch-organischen Chemie Radikalreaktionen Nukleophile und elektrophile Substitution am gesättigten C-Atom
Vorlesung Organische Chemie II Reaktionsmechanismen (3. Sem.) Gliederung Grundlagen der physikalisch-organischen Chemie Radikalreaktionen Nukleophile und elektrophile Substitution am gesättigten C-Atom
Klausur - Lösungsbogen
 Prof. Dr. J. Daub Februar 2005 Klausur - Lösungsbogen zur Vorlesung "rganische Chemie II (Reaktionen, Reaktionsmechanismen) für Studierende der Chemie und der Biochemie 3. Semester" WS 2004/2005 14. Februar
Prof. Dr. J. Daub Februar 2005 Klausur - Lösungsbogen zur Vorlesung "rganische Chemie II (Reaktionen, Reaktionsmechanismen) für Studierende der Chemie und der Biochemie 3. Semester" WS 2004/2005 14. Februar
n Pentan 2- Methylbutan 2,2, dimethylpropan ( Wasserstoffatome sind nicht berücksichtigt )
 Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Übungsklausur zur Vorlesung Organische Chemie für Biologen im Sommersemester am
 Übungsklausur zur Vorlesung Organische Chemie für Biologen im Sommersemester 2014 am 18.06.2014 Name: Matrikelnummer: Studiengang: Unterschrift: Aufgabe 1 2 3 4 5 6 7 8 9 10 Gesamt max. Punktzahl 10 10
Übungsklausur zur Vorlesung Organische Chemie für Biologen im Sommersemester 2014 am 18.06.2014 Name: Matrikelnummer: Studiengang: Unterschrift: Aufgabe 1 2 3 4 5 6 7 8 9 10 Gesamt max. Punktzahl 10 10
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 5, 17./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 5, 17./18.05.11 Wiederholung: Säurestärke organischer Verbindungen 1. a) Wovon hängt die Säurestärke einer organischen
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 5, 17./18.05.11 Wiederholung: Säurestärke organischer Verbindungen 1. a) Wovon hängt die Säurestärke einer organischen
6. Tag: Chemisches Gleichgewicht und Reaktionskinetik
 6. Tag: Chemisches Gleichgewicht und Reaktionskinetik 1 6. Tag: Chemisches Gleichgewicht und Reaktionskinetik 1. Das chemische Gleichgewicht Eine chemische Reaktion läuft in beiden Richtungen ab. Wenn
6. Tag: Chemisches Gleichgewicht und Reaktionskinetik 1 6. Tag: Chemisches Gleichgewicht und Reaktionskinetik 1. Das chemische Gleichgewicht Eine chemische Reaktion läuft in beiden Richtungen ab. Wenn
Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie,
 Wiederholung der letzten Vorlesungsstunde: Thema: Chemische h Bindungen Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie, unterschiedliche Arten chemischer Bindungen, Atombindung, kovalente
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische h Bindungen Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie, unterschiedliche Arten chemischer Bindungen, Atombindung, kovalente
Beispiele. Polysubstituierte Benzole. Chapter 16. Organic Chemistry. Reaktionen of Substituierter Benzole. Bezeichnung durch Numerierung oder Präfix
 Organic Chemistry 4 th Edition Paula Yurkanis Bruice Beispiele Chapter 16 Reaktionen of Substituierter Benzole Irene Lee Case Western Reserve University Cleveland, OH 2004, Prentice Hall Bezeichnung durch
Organic Chemistry 4 th Edition Paula Yurkanis Bruice Beispiele Chapter 16 Reaktionen of Substituierter Benzole Irene Lee Case Western Reserve University Cleveland, OH 2004, Prentice Hall Bezeichnung durch
Referat: Katalytische Hydrierungen
 Referat: Katalytische Hydrierungen Inhalt 1.1 Allgemein über Hydrierungen (Anlagerung von Wasserstoff) Seite 3 Die chemische Reaktion, katalytische Hydrierung 1.2 Die Beeinflussung der Hydrierdauer Seite
Referat: Katalytische Hydrierungen Inhalt 1.1 Allgemein über Hydrierungen (Anlagerung von Wasserstoff) Seite 3 Die chemische Reaktion, katalytische Hydrierung 1.2 Die Beeinflussung der Hydrierdauer Seite
Organik-Beispiel. Inhaltsverzeichnis
 Inhaltsverzeichnis I. Säure-Basen-Gleichungen... 2 a) Nach Arrhenius:... 2 b) Nach Broensted:... 2 c) Nach Lewis:... 2 II. H 2 O + HCl?... 4 a) Was ist in der Reaktion passiert? Welche Produkte entstehen?...
Inhaltsverzeichnis I. Säure-Basen-Gleichungen... 2 a) Nach Arrhenius:... 2 b) Nach Broensted:... 2 c) Nach Lewis:... 2 II. H 2 O + HCl?... 4 a) Was ist in der Reaktion passiert? Welche Produkte entstehen?...
Organische Chemie für MST 5. Lienkamp/ Prucker/ Rühe
 Organische Chemie für MST 5 Lienkamp/ Prucker/ Rühe Inhalt 5 Aromaten Struktur und Bindung im Benzol, Hückel-Regel, mesomeregrenzstrukturen, ortho-, meta-, para-substitution, elektrophile Substitution
Organische Chemie für MST 5 Lienkamp/ Prucker/ Rühe Inhalt 5 Aromaten Struktur und Bindung im Benzol, Hückel-Regel, mesomeregrenzstrukturen, ortho-, meta-, para-substitution, elektrophile Substitution
Bindungskonzepte in der. Organischen Chemie. 1.1 Hybridisierung
 O:/Wiley/Organische_Chemie_Aufl_1/3d/c01.3d from 19.07.2012 09:18:28 1 Bindungskonzepte in der 1 Organischen Chemie In diesem Kapitel Die Organische Chemie wird gemeinhin als die Chemie der Kohlenstoffverbindungen
O:/Wiley/Organische_Chemie_Aufl_1/3d/c01.3d from 19.07.2012 09:18:28 1 Bindungskonzepte in der 1 Organischen Chemie In diesem Kapitel Die Organische Chemie wird gemeinhin als die Chemie der Kohlenstoffverbindungen
Übungsblatt 6 - Lösung
 Übungen rganische hemie für Studierende der Lehrämter und der Biologie (Diplom), WS 2003/04 Dr.. abrele Übungsblatt 6 - Lösung 1. n-butylbromid, sec-butylbromid und tert-butylbromid werden jeweils mit
Übungen rganische hemie für Studierende der Lehrämter und der Biologie (Diplom), WS 2003/04 Dr.. abrele Übungsblatt 6 - Lösung 1. n-butylbromid, sec-butylbromid und tert-butylbromid werden jeweils mit
Kapitel 2: Eliminierungen unter Bildung von Alkenen + H 2
 Vorlesung C-II für Nebenfächler Kapitel : Eliminierungen unter Bildung von Alkenen Alkene sind wichtige technische Grundchemikalien für die organische Synthese und für die industrielle Produktion. Die
Vorlesung C-II für Nebenfächler Kapitel : Eliminierungen unter Bildung von Alkenen Alkene sind wichtige technische Grundchemikalien für die organische Synthese und für die industrielle Produktion. Die
Organisch-Chemisches Institut Fakultät für Chemie und Geowissenschaften Universität Heidelberg 4. September 2015
 Organisch-Chemisches Institut Fakultät für Chemie und Geowissenschaften Universität Heidelberg 4. September 2015 Musterlösung Zwischennachklausur II zur Experimentalvorlesung Organische Chemie von Prof.
Organisch-Chemisches Institut Fakultät für Chemie und Geowissenschaften Universität Heidelberg 4. September 2015 Musterlösung Zwischennachklausur II zur Experimentalvorlesung Organische Chemie von Prof.
Inhaltsverzeichnis. Teil I Volle Kraft voraus: Die Chemie des Kohlenstoffs 23. Einführung 17. Kapitel 1 Die wundervolle Welt der organischen Chemie 25
 Inhaltsverzeichnis Inhaltsverzeichnis Über den Autor 7 Einführung 17 Über dieses Buch 18 Konventionen in diesem Buch 19 Törichte Annahmen über den Leser 19 Wie dieses Buch aufgebaut ist 20 Teil I: Es war
Inhaltsverzeichnis Inhaltsverzeichnis Über den Autor 7 Einführung 17 Über dieses Buch 18 Konventionen in diesem Buch 19 Törichte Annahmen über den Leser 19 Wie dieses Buch aufgebaut ist 20 Teil I: Es war
Entschlüsseln Sie die Bedeutung der folgenden Abkürzungen: PMB tbu TBS Ph Ts Bz TPS MOM Bn Ms TES
 rganisch-chemisches Grundpraktikum Leseauftrag: rganikum (23. Auflage): Kapitel D3 Brückner (3. Auflage): Kapitel 4 Leseempfehlung: Carey, Sundberg (4. engl. Auflage): Band A, Kapitel 1(!) und 6 P. Y.
rganisch-chemisches Grundpraktikum Leseauftrag: rganikum (23. Auflage): Kapitel D3 Brückner (3. Auflage): Kapitel 4 Leseempfehlung: Carey, Sundberg (4. engl. Auflage): Band A, Kapitel 1(!) und 6 P. Y.
10. Die Carbonylgruppe : Aldehyde und Ketone - Nucleophile Addition
 Inhalt Index 10. Die Carbonylgruppe : Aldehyde und Ketone - Nucleophile Addition Die C=O Doppelbindung der Carbonylgruppe ist die wichtigste funktionelle Gruppe der organischen Chemie. Dieses Kapitel befasst
Inhalt Index 10. Die Carbonylgruppe : Aldehyde und Ketone - Nucleophile Addition Die C=O Doppelbindung der Carbonylgruppe ist die wichtigste funktionelle Gruppe der organischen Chemie. Dieses Kapitel befasst
Organische Chemie. Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter!
 Organische Chemie Name: Fachprüfung Vorname: 11. März 2002, 8 00-10 00 h Matr.-Nr.: Raum 204 + 206 Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter! Jede Aufgabe wird mit 10 Punkten
Organische Chemie Name: Fachprüfung Vorname: 11. März 2002, 8 00-10 00 h Matr.-Nr.: Raum 204 + 206 Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter! Jede Aufgabe wird mit 10 Punkten
Eine Auswahl typischer Carbonylreaktionen
 Eine Auswahl typischer Carbonylreaktionen Aldol-eaktion ( anschließende Aldol-Kondensation) Kondensation = Abspaltung von Wasser Aldol-eaktion kann basenkatalysiert oder säurekatalysiert durchgeführt werden.
Eine Auswahl typischer Carbonylreaktionen Aldol-eaktion ( anschließende Aldol-Kondensation) Kondensation = Abspaltung von Wasser Aldol-eaktion kann basenkatalysiert oder säurekatalysiert durchgeführt werden.
8. Halogenalkane : Nucleophile Substitutions- und Eliminerungsreaktionen
 Inhalt Index 8. Halogenalkane : Nucleophile Substitutions- und Eliminerungsreaktionen Halogenalkane sind in der organischen Synthese sehr wichtig, und werden auch in der Industrie als Lösungsmittel, im
Inhalt Index 8. Halogenalkane : Nucleophile Substitutions- und Eliminerungsreaktionen Halogenalkane sind in der organischen Synthese sehr wichtig, und werden auch in der Industrie als Lösungsmittel, im
1. Klausur zur Vorlesung. Einführung in die organische Chemie WS 03/04 11.12.2003
 1. Klausur zur Vorlesung Einführung in die organische Chemie WS 03/04 11.12.2003 Vorname (bitte deutlich schreiben): Nachname (bitte deutlich schreiben): Matrikelnummer: Studiengang: o Chemie (Diplom)
1. Klausur zur Vorlesung Einführung in die organische Chemie WS 03/04 11.12.2003 Vorname (bitte deutlich schreiben): Nachname (bitte deutlich schreiben): Matrikelnummer: Studiengang: o Chemie (Diplom)
10. Die Carbonylgruppe : Aldehyde und Ketone - Nucleophile Addition
 Friday, February 2, 2001 Allgemeine Chemie B II Page: 1 Inhalt Index 10. Die Carbonylgruppe : Aldehyde und Ketone - Nucleophile Addition Die C=O Doppelbindung der Carbonylgruppe ist die wichtigste funktionelle
Friday, February 2, 2001 Allgemeine Chemie B II Page: 1 Inhalt Index 10. Die Carbonylgruppe : Aldehyde und Ketone - Nucleophile Addition Die C=O Doppelbindung der Carbonylgruppe ist die wichtigste funktionelle
Butan, Hexan, 3-Methyl-Pentan,...,Di-Chlor Ethan, 1,2-Di-Chlorethen, 1-Chlor-Butan, 2- Chlor Butan,...
 Butan, exan, 3-Methyl-Pentan,...,Di-Chlor Ethan, 1,2-Di-Chlorethen, 1-Chlor-Butan, 2- Chlor Butan,... Diese Oxidationsreaktion ist eine Radikalische ( bezogen auf auf das AGENS!) Substitution ( bezogen
Butan, exan, 3-Methyl-Pentan,...,Di-Chlor Ethan, 1,2-Di-Chlorethen, 1-Chlor-Butan, 2- Chlor Butan,... Diese Oxidationsreaktion ist eine Radikalische ( bezogen auf auf das AGENS!) Substitution ( bezogen
Halogenderivate der Alkane
 Halogenderivate der Alkane Einteilung - gesättigte und ungesättigte Halogenverb. - nach der Anzahl der -Atome, = 1,2,3, - Dihalogenide: n geminale vicinale disjunkt H 2 H 2 H H 2 primäre, sekundäre, terciäre
Halogenderivate der Alkane Einteilung - gesättigte und ungesättigte Halogenverb. - nach der Anzahl der -Atome, = 1,2,3, - Dihalogenide: n geminale vicinale disjunkt H 2 H 2 H H 2 primäre, sekundäre, terciäre
Organische Chemie 2 SPF BCH am Inhaltsverzeichnis Sie kennen alle Karteikärtchen zum Thema... 2
 Organische Chemie 2 Inhaltsverzeichnis Sie kennen alle Karteikärtchen zum Thema.... 2 Sie kennen vier Grundtypen von Reaktionen mit ihren Mechanismen (S. 239) mit aliphatischen, organischen Stoffen und
Organische Chemie 2 Inhaltsverzeichnis Sie kennen alle Karteikärtchen zum Thema.... 2 Sie kennen vier Grundtypen von Reaktionen mit ihren Mechanismen (S. 239) mit aliphatischen, organischen Stoffen und
Übungssblatt 3: Alkene und weitere cyclische Kohlenwasserstoffe
 1 Übungssblatt 3: Alkene und weitere cyclische Kohlenwasserstoffe Warm Up 1) Erweitern Sie die Ihnen bekannten Regeln der Nomenklatur für Alkene und benennen danach folgende Verbindungen. Die Regel zur
1 Übungssblatt 3: Alkene und weitere cyclische Kohlenwasserstoffe Warm Up 1) Erweitern Sie die Ihnen bekannten Regeln der Nomenklatur für Alkene und benennen danach folgende Verbindungen. Die Regel zur
9. Alkohole, Ether und Phenole
 Friday, February 2, 2001 Allgemeine Chemie B II Page: 1 Inhalt Index 9. Alkohole, Ether und Phenole Bis jetzt haben wir fast bei jedem Kapitel eine neue funktionelle Gruppe und auch eine wichtige neue
Friday, February 2, 2001 Allgemeine Chemie B II Page: 1 Inhalt Index 9. Alkohole, Ether und Phenole Bis jetzt haben wir fast bei jedem Kapitel eine neue funktionelle Gruppe und auch eine wichtige neue
H = kj/mol. DH = +435 kj/mol
 4. REAKTIONEN DER ALKANE Die in diesem Teil verwendeten Abbildungen stammen aus: K. P. C. Vollhardt, N. E. Schore, Organische Chemie, 4. Auflage, Wiley-VCH. Homolytischer und heterolytischer Bindungsbruch
4. REAKTIONEN DER ALKANE Die in diesem Teil verwendeten Abbildungen stammen aus: K. P. C. Vollhardt, N. E. Schore, Organische Chemie, 4. Auflage, Wiley-VCH. Homolytischer und heterolytischer Bindungsbruch
1.) Organometallverbindungen sind wichtige Reagenzien für C C-Bindungsbildungen. Der am Metall gebundene Kohlenstoff ist nukleophil (10 Punkte).
 Lösung zur Übung 7 1.) rganometallverbindungen sind wichtige Reagenzien für C C-Bindungsbildungen. Der am Metall gebundene Kohlenstoff ist nukleophil (10 Punkte). a) para-bromtoluol A wird mit n-butyllithium
Lösung zur Übung 7 1.) rganometallverbindungen sind wichtige Reagenzien für C C-Bindungsbildungen. Der am Metall gebundene Kohlenstoff ist nukleophil (10 Punkte). a) para-bromtoluol A wird mit n-butyllithium
Lösungen zu Übungsaufgaben Mechanismen 1 LK 12/1 Chemie
 1. Die radikalische Substitution 2-Methylbutan soll mit Brom im Sinne einer radikalischen Substitution reagieren. Betrachtet sei zunächst nur die Monobromierung. a) Formulieren Sie die Summengleichung
1. Die radikalische Substitution 2-Methylbutan soll mit Brom im Sinne einer radikalischen Substitution reagieren. Betrachtet sei zunächst nur die Monobromierung. a) Formulieren Sie die Summengleichung
CHE 172.1: Organische Chemie für die Life Sciences
 1 CHE 172.1: Organische Chemie für die Life Sciences Prof Dr. J. A. Robinson 1. Struktur und Bindung organischer Moleküle 1.1 Atomstruktur : Die Ordnungszahl (oder Atomzahl /Atomnummer = Atomic number)
1 CHE 172.1: Organische Chemie für die Life Sciences Prof Dr. J. A. Robinson 1. Struktur und Bindung organischer Moleküle 1.1 Atomstruktur : Die Ordnungszahl (oder Atomzahl /Atomnummer = Atomic number)
Kapitel 5. Aromatische Substitutionsreaktionen. 5.1 Elektrophile Substitutionen
 Kapitel 5 Aromatische Substitutionsreaktionen In der organischen Chemie ist der Reaktionstyp der Substitutionsreaktionen sehr zahlreich und weitverbreitet. Dabei ist bekannt, daß die Wahl des Lösungsmittels
Kapitel 5 Aromatische Substitutionsreaktionen In der organischen Chemie ist der Reaktionstyp der Substitutionsreaktionen sehr zahlreich und weitverbreitet. Dabei ist bekannt, daß die Wahl des Lösungsmittels
Katalyse. Martin Babilon 14/07/2011. Katalyse. Martin Babilon Universität Paderborn. 14 Juli Montag, 18. Juli 2011
 Katalyse Universität Paderborn 14 Juli 2011 1 Übersicht Motivation & Einleitung Katalyse-Zyklus homogene Katalyse heterogene Katalyse 2 Motivation 3 Geschichte der Katalyse 6000 v. Christus: Alkoholvergärung
Katalyse Universität Paderborn 14 Juli 2011 1 Übersicht Motivation & Einleitung Katalyse-Zyklus homogene Katalyse heterogene Katalyse 2 Motivation 3 Geschichte der Katalyse 6000 v. Christus: Alkoholvergärung
KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen
 KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen Ketone werden nicht weiter oxidiert Ether R1 - O - R2 R-O- ersetzt H bei einem Alkan Ether: MTBE (Antiklopfmittel) Tertiäre Alkohole
KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen Ketone werden nicht weiter oxidiert Ether R1 - O - R2 R-O- ersetzt H bei einem Alkan Ether: MTBE (Antiklopfmittel) Tertiäre Alkohole
Organische Chemie. Kapitel 1. Organic Chemistry 4 th Edition Paula Yurkanis Bruice. Organische Verbindungen enthalten Kohlenstoff
 rganic Chemistry 4 th Edition Paula Yurkanis Bruice Kapitel 1 Elektronische Struktur und Bindung Säuren und Basen rganische Chemie rganische Verbindungen enthalten Kohlenstoff Kohlenstoff ist weder ein
rganic Chemistry 4 th Edition Paula Yurkanis Bruice Kapitel 1 Elektronische Struktur und Bindung Säuren und Basen rganische Chemie rganische Verbindungen enthalten Kohlenstoff Kohlenstoff ist weder ein
REAKTIONEN DER ORGANISCHEN CHEMIE
 REAKTIONEN DER ORGANISCHEN CHEMIE 1) ÜBERSICHT VON DEN REAKTIONEN AUSGEHEND: Die Reaktion der OC lassen sich auf 4 Grundtypen zurückführen: Grundtyp Addition Substitution Eliminierung Umlagerung allg A
REAKTIONEN DER ORGANISCHEN CHEMIE 1) ÜBERSICHT VON DEN REAKTIONEN AUSGEHEND: Die Reaktion der OC lassen sich auf 4 Grundtypen zurückführen: Grundtyp Addition Substitution Eliminierung Umlagerung allg A
Vorgehen bei der qualitativen Analyse. Nachweisreaktion. Nachweisreaktionen. molekular gebauter Stoffe
 Vorgehen bei der qualitativen Analyse 1. Vorprobe liefert Hinweise auf die mögliche Zusammensetzung der Probe ; Bsp. Flammenfärbung 2. Blindprobe zeigt aus Aussehen der Nachweisreagenzien; Vergleichsprobe
Vorgehen bei der qualitativen Analyse 1. Vorprobe liefert Hinweise auf die mögliche Zusammensetzung der Probe ; Bsp. Flammenfärbung 2. Blindprobe zeigt aus Aussehen der Nachweisreagenzien; Vergleichsprobe
Kohlenwasserstoffe. Alkane. Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind.
 2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
1. Struktur und Bindung organischer Moleküle (Siehe Kapitel 6. in Allgemeine Chemie B, I. Teil)
 Tuesday, January 30, 2001 Allgemeine Chemie B II. Kapitel 1 Page: 1 Inhalt Index 1. Struktur und Bindung organischer Moleküle (Siehe Kapitel 6. in Allgemeine Chemie B, I. Teil) 1.1 Atomstruktur Die Ordnungszahl
Tuesday, January 30, 2001 Allgemeine Chemie B II. Kapitel 1 Page: 1 Inhalt Index 1. Struktur und Bindung organischer Moleküle (Siehe Kapitel 6. in Allgemeine Chemie B, I. Teil) 1.1 Atomstruktur Die Ordnungszahl
Organische Chemie für Bioinformatiker. Dozentin: Dr. Stefanie Kellner 3. Stock BioSysM: Raum 03.
 Organische Chemie für Bioinformatiker Dozentin: Dr. Stefanie Kellner Email: stefanie.kellner@cup.lmu.de 3. Stock BioSysM: Raum 03.037F 1 BioSysM 2 Vorlesungsplan Reaktionen in der organischen Chemie Elektrophile
Organische Chemie für Bioinformatiker Dozentin: Dr. Stefanie Kellner Email: stefanie.kellner@cup.lmu.de 3. Stock BioSysM: Raum 03.037F 1 BioSysM 2 Vorlesungsplan Reaktionen in der organischen Chemie Elektrophile
Thermodynamik & Kinetik
 Thermodynamik & Kinetik Inhaltsverzeichnis Ihr versteht die Begriffe offenes System, geschlossenes System, isoliertes System, Enthalpie, exotherm und endotherm... 3 Ihr kennt die Funktionsweise eines Kalorimeters
Thermodynamik & Kinetik Inhaltsverzeichnis Ihr versteht die Begriffe offenes System, geschlossenes System, isoliertes System, Enthalpie, exotherm und endotherm... 3 Ihr kennt die Funktionsweise eines Kalorimeters
Organische Chemie IV: Reaktive Zwischenstufen (OCIV)
 Prof. Dr. P. Rademacher Organische Chemie IV OCIV-SS2005Teil1 Organische Chemie IV: Reaktive Zwischenstufen (OCIV) Sommersemester 2005 V2, Di 8-10, S05 R03 H20 (12.04.2005) Inhaltsverzeichnis 1. Reaktionsmechanismen
Prof. Dr. P. Rademacher Organische Chemie IV OCIV-SS2005Teil1 Organische Chemie IV: Reaktive Zwischenstufen (OCIV) Sommersemester 2005 V2, Di 8-10, S05 R03 H20 (12.04.2005) Inhaltsverzeichnis 1. Reaktionsmechanismen
Organische Chemie. 11. Juli 2002, h Matr.-Nr.: Raum 183. Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter!
 Organische Chemie Name: Fachprüfung Vorname: 11. Juli 2002, 8 00-10 00 h Matr.-Nr.: Raum 183 Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter! Jede Aufgabe wird mit 10 Punkten
Organische Chemie Name: Fachprüfung Vorname: 11. Juli 2002, 8 00-10 00 h Matr.-Nr.: Raum 183 Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter! Jede Aufgabe wird mit 10 Punkten
Organische Chemie 1 Teil 2 1. Vorlesung, Dienstag
 Inhalte der 1. Vorlesung: 1. Die Reaktivität organischer Moleküle 1.1 Warum geschehen Chemische Reaktionen 1.2 Gleichgewichtsreaktionen, Ungleichgewichtsreaktionen 1.2.1 Triebkraft chemischer Reaktionen
Inhalte der 1. Vorlesung: 1. Die Reaktivität organischer Moleküle 1.1 Warum geschehen Chemische Reaktionen 1.2 Gleichgewichtsreaktionen, Ungleichgewichtsreaktionen 1.2.1 Triebkraft chemischer Reaktionen
Methan CH4. 0,6 Anzahl der C-Atome im n-alkan. Begründe die unterschiedlichen Viskositätswerte bei den angegebenen Alkanen.
 Fragenkatalog für die 0. Klasse des sprachlichen Zweiges in Chemie Alle Fragen beziehen sich auf das Grundwissen Die angegeben Karten hinter dem Thema der Frage bezeichnen nur den Schwerpunkt der Frage.
Fragenkatalog für die 0. Klasse des sprachlichen Zweiges in Chemie Alle Fragen beziehen sich auf das Grundwissen Die angegeben Karten hinter dem Thema der Frage bezeichnen nur den Schwerpunkt der Frage.
Umwandlung von Alkoholen in Ester (Vollhardt, 3. Aufl. S , 4. Aufl., S )
 Vorlesung 17 Umwandlung von Alkoholen in Ester (Vollhardt, 3. Aufl. S. 343-347, 4. Aufl., S. 392-397) Ester erhält man formal dadurch, dass in organischen oder anorganischen Säuren der saure Wasserstoff
Vorlesung 17 Umwandlung von Alkoholen in Ester (Vollhardt, 3. Aufl. S. 343-347, 4. Aufl., S. 392-397) Ester erhält man formal dadurch, dass in organischen oder anorganischen Säuren der saure Wasserstoff
Organische Chemie Chemielaboranten 1-12
 Organische Chemie Chemielaboranten 1-12 1.2 Alkene Alkene- und Cycloalkene sind aliphatische respektive cycloaliphatische, ungesättigte Kohlenwasserstoffe mit einer oder mehreren Doppelbindungen. Die Endung
Organische Chemie Chemielaboranten 1-12 1.2 Alkene Alkene- und Cycloalkene sind aliphatische respektive cycloaliphatische, ungesättigte Kohlenwasserstoffe mit einer oder mehreren Doppelbindungen. Die Endung
Carbonyl- und Enolatchemie
 Carbonyl- und Enolatchemie 1 Addition von rganometall-eagenzien an Carbonylverbindungen eformatzky-eaktion: Zn-eagenz weniger reaktiv als Grignard, greift keine Ester an! Br 2 Zn ZnBr 2 Br Zn 2 1 2 Barbier-eaktion:
Carbonyl- und Enolatchemie 1 Addition von rganometall-eagenzien an Carbonylverbindungen eformatzky-eaktion: Zn-eagenz weniger reaktiv als Grignard, greift keine Ester an! Br 2 Zn ZnBr 2 Br Zn 2 1 2 Barbier-eaktion:
5.3. Homodesmische Reaktionen (wird nicht geprüft)
 5.3. Homodesmische Reaktionen (wird nicht geprüft) Es wird oft beobachtet, dass einige Moleküle stabiler bzw. unstabiler als Verbindungen ähnlicher Struktur sind. Z. B. ist Benzol sehr viel stabiler als
5.3. Homodesmische Reaktionen (wird nicht geprüft) Es wird oft beobachtet, dass einige Moleküle stabiler bzw. unstabiler als Verbindungen ähnlicher Struktur sind. Z. B. ist Benzol sehr viel stabiler als
Chemie Zusammenfassung III
 Chemie Zusammenfassung III Inhaltsverzeichnis Atombau & Kernphysik... 2 Aufbau der Atome... 2 Atomkern... 2 Atomhülle... 2 Atomgrösse und Kernladung... 3 Reaktivität und Gruppen des Periodensystems...
Chemie Zusammenfassung III Inhaltsverzeichnis Atombau & Kernphysik... 2 Aufbau der Atome... 2 Atomkern... 2 Atomhülle... 2 Atomgrösse und Kernladung... 3 Reaktivität und Gruppen des Periodensystems...
Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo
 Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de innere Energie U Energieumsatz bei
Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de innere Energie U Energieumsatz bei
3-01. Triphenylmethan
 Triphenylmethan 3-01 Triphenylmethan ist ein farbloser Feststoff. Die Verbindung kann aus Benzol und Trichlormethan durch FRIEDL-CRAFTS-Alkylierung (elektrophile Substitution) hergestellt werden. Die H-Atome
Triphenylmethan 3-01 Triphenylmethan ist ein farbloser Feststoff. Die Verbindung kann aus Benzol und Trichlormethan durch FRIEDL-CRAFTS-Alkylierung (elektrophile Substitution) hergestellt werden. Die H-Atome
Versuch 1.6/1: Benutzung des Wasserabscheiders zur Synthese von 2 (m Nitrophenyl) 1,3 dioxalan
 Endersch, Jonas 16.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Gruppe 3, Platz 53 Versuchsprotokoll Versuch 1.6/1: Benutzung des Wasserabscheiders zur Synthese von 2 (m Nitrophenyl) 1,3 dioxalan Reaktionsgleichung:
Endersch, Jonas 16.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Gruppe 3, Platz 53 Versuchsprotokoll Versuch 1.6/1: Benutzung des Wasserabscheiders zur Synthese von 2 (m Nitrophenyl) 1,3 dioxalan Reaktionsgleichung:
Technische Universität Dresden Institut für Organische Chemie Organisch-chemisches Grundpraktikum. Aufgabe Max. Punkte Punkte
 Name: Praktikum SS 003: Platz-Nr.: Assistent: Nachschreiber: Praktikum SS Platz-Nr.: Aufgabe 5 6-6 Max. Punkte 33 33 3 100 Punkte Zeichnen Sie sorgfältig und richtig! Die Fähigkeit richtig zeichnen zu
Name: Praktikum SS 003: Platz-Nr.: Assistent: Nachschreiber: Praktikum SS Platz-Nr.: Aufgabe 5 6-6 Max. Punkte 33 33 3 100 Punkte Zeichnen Sie sorgfältig und richtig! Die Fähigkeit richtig zeichnen zu
Thermodynamik. Thermodynamik
 Geschlossenes System: Energieaustausch, aber kein Materieaustausch mit der Umgebung. Innere Energie: Jeder Stoff hat in sich Energie in irgendeiner Form gespeichert: die innere Energie U. U 1 = innere
Geschlossenes System: Energieaustausch, aber kein Materieaustausch mit der Umgebung. Innere Energie: Jeder Stoff hat in sich Energie in irgendeiner Form gespeichert: die innere Energie U. U 1 = innere
Allgemeines schulinternes Curriculum für die gymnasiale Oberstufe. Einführungsphase (EF):
 Allgemeines schulinternes Curriculum für die gymnasiale Oberstufe Einführungsphase (EF): Themenfeld A : Reaktionsfolge aus der organischen Chemie: Vom Alkohol zum Aromastoff Themenfeld B : Ein technischer
Allgemeines schulinternes Curriculum für die gymnasiale Oberstufe Einführungsphase (EF): Themenfeld A : Reaktionsfolge aus der organischen Chemie: Vom Alkohol zum Aromastoff Themenfeld B : Ein technischer
Versuch: Bromierung von n-hexan. Chemikalien Menge R-Sätze S-Sätze Gefahrensymbol Bemerkung
 Philipps-Universität Marburg 25.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 2: Alkane Versuch: omierung von n-hexan Zeitbedarf: Vorbereitung:
Philipps-Universität Marburg 25.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 2: Alkane Versuch: omierung von n-hexan Zeitbedarf: Vorbereitung:
Basiskenntnistest - Chemie
 Basiskenntnistest - Chemie 1.) Welche Aussage trifft auf Alkohole zu? a. ) Die funktionelle Gruppe der Alkohole ist die Hydroxygruppe. b. ) Alle Alkohole sind ungiftig. c. ) Mehrwertige Alkohole werden
Basiskenntnistest - Chemie 1.) Welche Aussage trifft auf Alkohole zu? a. ) Die funktionelle Gruppe der Alkohole ist die Hydroxygruppe. b. ) Alle Alkohole sind ungiftig. c. ) Mehrwertige Alkohole werden
Fragen zum Thema chemische Reaktionen Klasse 4 1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion
 1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion vorliegen? 3. Wie nennt man die Stoffe, die nach der Reaktion vorliegen? 4. Womit wird die Richtung
1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion vorliegen? 3. Wie nennt man die Stoffe, die nach der Reaktion vorliegen? 4. Womit wird die Richtung
[4+2] Cycloaddition Diels Alder
![[4+2] Cycloaddition Diels Alder [4+2] Cycloaddition Diels Alder](/thumbs/53/32900999.jpg) [4+2] Cycloaddition Diels Alder Additionsreaktion zwischen einem 1,3 Dien und einem Alken (Dienophil). Methode zur Synthese von einfach ungesättigten 6 Ringen. 3 Bindungen werden zu 2 Bindungen und einer
[4+2] Cycloaddition Diels Alder Additionsreaktion zwischen einem 1,3 Dien und einem Alken (Dienophil). Methode zur Synthese von einfach ungesättigten 6 Ringen. 3 Bindungen werden zu 2 Bindungen und einer
Verrechnungspunkte: Gesamtpunkte: Note:
 Säure-Base-Reaktionen: E. 5. 2 Die Base Ammoniak Bearbeitungszeit: zweimal 45 Minuten Hilfsmittel: Taschenrechner Verrechnungspunkte: Gesamtpunkte: Note: Aufgaben 1 Ammoniak wird heute großtechnisch nach
Säure-Base-Reaktionen: E. 5. 2 Die Base Ammoniak Bearbeitungszeit: zweimal 45 Minuten Hilfsmittel: Taschenrechner Verrechnungspunkte: Gesamtpunkte: Note: Aufgaben 1 Ammoniak wird heute großtechnisch nach
Gruppe 2 vorgegebener Versuch Darstellung und Bromierung von Ethen
 Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: err Dr. Reiß Datum: 15.05.09 SS 09 Gruppe 2 vorgegebener Versuch Darstellung und omierung
Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: err Dr. Reiß Datum: 15.05.09 SS 09 Gruppe 2 vorgegebener Versuch Darstellung und omierung
1. Gruppe: Nucleophile Substitution
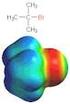 1. Gruppe: ucleophile ubstitution 1 1. ubstitutionstypen: C Y C Y Klassifizierung der ubstitution je nach atur von Y: - Y kann ein ukleophil sein: (ersetzt das ukleophil => Lewis - Base): δ δ a, 3, BuMg
1. Gruppe: ucleophile ubstitution 1 1. ubstitutionstypen: C Y C Y Klassifizierung der ubstitution je nach atur von Y: - Y kann ein ukleophil sein: (ersetzt das ukleophil => Lewis - Base): δ δ a, 3, BuMg
12. Die Carbonylgruppe : Reaktionen in a-stellung
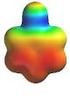 Inhalt Index 12. Die Carbonylgruppe : Reaktionen in a-stellung In Kapiteln 10 und 11 wurde gezeigt, dass die Carbonylgruppe von Elektrophilen am Sauerstoff und von Nucleophilen am Kohlenstoff angegriffen
Inhalt Index 12. Die Carbonylgruppe : Reaktionen in a-stellung In Kapiteln 10 und 11 wurde gezeigt, dass die Carbonylgruppe von Elektrophilen am Sauerstoff und von Nucleophilen am Kohlenstoff angegriffen
Fragmentierungs-Reaktionen - 1
 Spektroskopie in der rganischen hemie Fragmentierungs-Reaktionen - 1 Weil nicht alle Bindungen in einem Molekül gleich fest sind, verlaufen Fragmentierungen nicht regellos und zufällig, sondern meist nach
Spektroskopie in der rganischen hemie Fragmentierungs-Reaktionen - 1 Weil nicht alle Bindungen in einem Molekül gleich fest sind, verlaufen Fragmentierungen nicht regellos und zufällig, sondern meist nach
Zweite Klausur zur Vorlesung Grundlagen der Organischen Chemie
 Prof. Dr. Jens Christoffers 28. Februar 2011 Universität ldenburg Zweite Klausur zur Vorlesung Grundlagen der rganischen Chemie für Studierende der Chemie (Fach-Bachelor und Zwei-Fächer-Bachelor, Wert:
Prof. Dr. Jens Christoffers 28. Februar 2011 Universität ldenburg Zweite Klausur zur Vorlesung Grundlagen der rganischen Chemie für Studierende der Chemie (Fach-Bachelor und Zwei-Fächer-Bachelor, Wert:
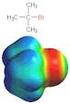
3. Wieviel bindig sind folgende Elemente in kovalenten Bindungen? Einige Elemente können auch verschiedene Bindigkeiten zeigen
 Übungen zur VL Chemie für Biologen und umanbiologen 26. 11.2010 1. ennen Sie mindestens 2 Arten der chemischen Bindungen und geben Sie je 2 Beispielverbindungen dafür an (Strukturformel). 1) Ionische Bindung:
Übungen zur VL Chemie für Biologen und umanbiologen 26. 11.2010 1. ennen Sie mindestens 2 Arten der chemischen Bindungen und geben Sie je 2 Beispielverbindungen dafür an (Strukturformel). 1) Ionische Bindung:
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II
 Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II Elektronenpaarbindung, Elektronegativität, polare Atombindung, Dipolmoment, Hybridisierung von Atomorbitalen, sp 3 -, sp 2 -, sp-hybridorbitale,
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II Elektronenpaarbindung, Elektronegativität, polare Atombindung, Dipolmoment, Hybridisierung von Atomorbitalen, sp 3 -, sp 2 -, sp-hybridorbitale,
Hybridorbitale und ihre Bedeutung
 Hybridorbitale und ihre Bedeutung Roland Heynkes 27.4.2005, Aachen Die Chemie wird kaum von den Atomkernen und den inneren Elektronenschalen, sondern hauptsächlich von der jeweils äußersten Elektronenschale
Hybridorbitale und ihre Bedeutung Roland Heynkes 27.4.2005, Aachen Die Chemie wird kaum von den Atomkernen und den inneren Elektronenschalen, sondern hauptsächlich von der jeweils äußersten Elektronenschale
Organische Chemie I Chemie am 16.11.2012. Inhaltsverzeichnis Lewisformeln von Kohlenstoffverbindungen korrekt zeichnen!... 2
 Organische Chemie I Inhaltsverzeichnis Lewisformeln von Kohlenstoffverbindungen korrekt zeichnen!... 2 Verstehen was Organische Chemie heisst und die Entstehung von Kohlenstoffverbindungen kennen!... 2
Organische Chemie I Inhaltsverzeichnis Lewisformeln von Kohlenstoffverbindungen korrekt zeichnen!... 2 Verstehen was Organische Chemie heisst und die Entstehung von Kohlenstoffverbindungen kennen!... 2
Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler
 Prof. Dr. J. Christoffers Institut für Organische Chemie Universität Stuttgart 29.04.2003 Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. Einführung 2.
Prof. Dr. J. Christoffers Institut für Organische Chemie Universität Stuttgart 29.04.2003 Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. Einführung 2.
Nucleophile Substitution
 3. Nucleophile Substitution 3.1 Nucleophile Substitution Vom alogenalkan zum Alkohol Erhitzt man eine heterogene Mischung aus Bromethan und Kalilauge, so wird das Gemisch homogen. Es entsteht das wasserlösliche
3. Nucleophile Substitution 3.1 Nucleophile Substitution Vom alogenalkan zum Alkohol Erhitzt man eine heterogene Mischung aus Bromethan und Kalilauge, so wird das Gemisch homogen. Es entsteht das wasserlösliche
Enzyme (Teil 2) Enzymatische Reaktion, Thermodynamik & Enzyme im Detail. Mag. Gerald Trutschl
 Enzyme (Teil 2) Enzymatische Reaktion, Thermodynamik & Enzyme im Detail Mag. Gerald Trutschl 1 Inhalt 1. Enzym Reaktion im Detail 2. Thermodynamische Reaktion 3. Katalysemechanismen 4. Michaelis-Menten-Konstante
Enzyme (Teil 2) Enzymatische Reaktion, Thermodynamik & Enzyme im Detail Mag. Gerald Trutschl 1 Inhalt 1. Enzym Reaktion im Detail 2. Thermodynamische Reaktion 3. Katalysemechanismen 4. Michaelis-Menten-Konstante
Gruppe 5 eigener Versuch. Hydrolyse von 2-Chlor-2-methylpropan
 Philipps- Universität Marburg FB 15 Chemie rganisch-chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: err Dr. eiß Datum: 27.05.09 SS 09 Gruppe 5 eigener Versuch ydrolyse von 2-Chlor-2-methylpropan
Philipps- Universität Marburg FB 15 Chemie rganisch-chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: err Dr. eiß Datum: 27.05.09 SS 09 Gruppe 5 eigener Versuch ydrolyse von 2-Chlor-2-methylpropan
Organische Chemie für MST 2
 Organische Chemie für MST 2 Lienkamp/ Prucker/ Rühe Inhalt 2 Funktionelle Gruppen in MST-Materialien (2) Halogenalkane nucleophilesubsitution(s N 1, S N 2, nucleophilesubstitution im Photoresist) Eliminierungsreaktionen
Organische Chemie für MST 2 Lienkamp/ Prucker/ Rühe Inhalt 2 Funktionelle Gruppen in MST-Materialien (2) Halogenalkane nucleophilesubsitution(s N 1, S N 2, nucleophilesubstitution im Photoresist) Eliminierungsreaktionen
+ MnO MnO 3. Oxidierbarkeit primärer, sekundärer und tertiärer Alkohole. Chemikalien. Materialien
 DaChS xidierbarkeit primärer, sekundärer und tertiärer Alkohole 1 Versuch Nr. 005 xidierbarkeit primärer, sekundärer und tertiärer Alkohole C 3 Mn - 4 (violett) 3 C Mn 2 (braun) 3 C C 3 Mn - 4 (violett)
DaChS xidierbarkeit primärer, sekundärer und tertiärer Alkohole 1 Versuch Nr. 005 xidierbarkeit primärer, sekundärer und tertiärer Alkohole C 3 Mn - 4 (violett) 3 C Mn 2 (braun) 3 C C 3 Mn - 4 (violett)
Kapitel 4. Die Grundlagen der Kinetik
 Kapitel 4. Die Grundlagen der Kinetik Monomolekulare Reaktion erster rdnung A Produkte; v = k [A] (S N 1) bimolekulare Reaktion zweiter rdnung (S N 2) A + B Produkte; v = k [A] [B] Einfluss der Aktivierungsbarrieren
Kapitel 4. Die Grundlagen der Kinetik Monomolekulare Reaktion erster rdnung A Produkte; v = k [A] (S N 1) bimolekulare Reaktion zweiter rdnung (S N 2) A + B Produkte; v = k [A] [B] Einfluss der Aktivierungsbarrieren
Wasserstoffbrückenbindung, H 2 O, NH 3, HF, Wasserstoff im PSE, Isotope, Vorkommen, exotherme Reaktion mit Sauerstoff zu Wasser, Energieinhalt,
 Wiederholung der letzten Vorlesungsstunde: Das Element Wasserstoff und seine Verbindungen Wasserstoffbrückenbindung, H 2 O, NH 3, HF, Wasserstoff im PSE, Isotope, Vorkommen, exotherme Reaktion mit Sauerstoff
Wiederholung der letzten Vorlesungsstunde: Das Element Wasserstoff und seine Verbindungen Wasserstoffbrückenbindung, H 2 O, NH 3, HF, Wasserstoff im PSE, Isotope, Vorkommen, exotherme Reaktion mit Sauerstoff
Kapitel 09: Reaktionen und Reaktionsmechanismen
 Kapitel 09: Reaktionen und Reaktionsmechanismen Organische hemie - 09 - Reaktionen und Reaktionsmechanismen 2 nhalt Kapitel 09: Reaktionen und Reaktionsmechanismen... 1 nhalt... 2 Übersicht über die drei
Kapitel 09: Reaktionen und Reaktionsmechanismen Organische hemie - 09 - Reaktionen und Reaktionsmechanismen 2 nhalt Kapitel 09: Reaktionen und Reaktionsmechanismen... 1 nhalt... 2 Übersicht über die drei
Bereich der 1 H-chemischen Verschiebung (Abb. nach: Friebolin)
 Bereich der 1 -chemischen Verschiebung (Abb. nach: Friebolin) 1 -NM-Spektroskopie 1 Der esonanzbereich der Protonen in organischen Molekülen ist ca. 10 ppm breit. Nur saure Protonen (z.b. COO oder SO 3
Bereich der 1 -chemischen Verschiebung (Abb. nach: Friebolin) 1 -NM-Spektroskopie 1 Der esonanzbereich der Protonen in organischen Molekülen ist ca. 10 ppm breit. Nur saure Protonen (z.b. COO oder SO 3
Beuth Hochschule für Technik Berlin, Studiengang Pharma- und Chemietechnik Tutorium Organische Chemie 1 (SS 2011), Tutor: Sascha Behne
 IUPAC-Nomenklatur 1.) Zeichnen Sie die Struktur von: a) 4-(1-Methylethyl)heptan b) 2,3,4,4-Tetramethylhexan c) cis-1,2-dimethylcyclohexan d) 6-Brom-7-(chlormethyl)nonan-2,3-diol e) Isopren f) trans-1,2-diethylcyclopropan
IUPAC-Nomenklatur 1.) Zeichnen Sie die Struktur von: a) 4-(1-Methylethyl)heptan b) 2,3,4,4-Tetramethylhexan c) cis-1,2-dimethylcyclohexan d) 6-Brom-7-(chlormethyl)nonan-2,3-diol e) Isopren f) trans-1,2-diethylcyclopropan
