ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
|
|
|
- Ulrike Michel
- vor 6 Jahren
- Abrufe
Transkript
1 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1
2 1. BEZEICHNUNG DES ARZNEIMITTELS Remicade 100 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung. 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Jede Durchstechflasche Remicade enthält 100 mg Infliximab, einen chimären, monoklonalen IgG1- Antikörper, der aus einer mittels kontinuierlicher Perfusion kultivierten rekombinanten Zell-Linie hergestellt wird. Nach Rekonstitution enthält jeder ml 10 mg Infliximab. Hilfsstoffe siehe Abschnitt DARREICHUNGSFORM Pulver für ein Konzentrat zur Herstellung einer Infusionslösung. 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete Rheumatoide Arthritis Remicade ist indiziert zur: Reduktion der Symptomatik und Verbesserung der körperlichen Funktionsfähigkeit bei Patienten mit aktiver Erkrankung, die nur unzureichend auf krankheitsmodifizierende Präparate, einschließlich Methotrexat, angesprochen haben. Bei diesen Patienten wurde anhand von radiologischen Untersuchungen eine Reduktion der Progressionsrate der Gelenkschäden nachgewiesen (siehe Abschnitt 5.1). Die Wirksamkeit und die Verträglichkeit sind nur für die kombinierte Anwendung mit Methotrexat belegt. Morbus Crohn Remicade ist indiziert zur: Behandlung eines schwergradigen, aktiven Morbus Crohn bei Patienten, die trotz einer vollständigen und adäquaten Therapie mit einem Kortikosteroid und einem Immunsuppressivum nicht angesprochen haben oder die eine Unverträglichkeit oder medizinische Gegenanzeige für solche Therapien haben. Behandlung von aktivem Morbus Crohn mit Fistelbildung bei Patienten, die trotz einer vollständigen und adäquaten Therapie mit einer konventionellen Behandlung (einschließlich Antibiotika, Drainage und immunsuppressiver Therapie) nicht angesprochen haben. Ankylosierende Spondylitis Remicade ist indiziert zur: Behandlung der ankylosierenden Spondylitis bei Patienten mit schwerer Wirbelsäulensymptomatik und erhöhten serologischen Entzündungsparametern, die auf eine konventionelle Therapie unzureichend angesprochen haben. 4.2 Dosierung, Art und Dauer der Anwendung Remicade wird bei Erwachsenen intravenös verabreicht. Es wurde nicht bei Kindern (0-17 Jahre) geprüft. Die Behandlung mit Remicade ist unter der Aufsicht und Kontrolle eines spezialisierten Arztes durchzuführen, der in der Diagnose und der Therapie der rheumatoiden Arthritis, entzündlicher Darmerkrankungen oder ankylosierenden Spondylitis erfahren ist. Mit Remicade behandelten Patienten sollte die Gebrauchsinformation und die spezielle Warnhinweiskarte ausgehändigt werden. 2
3 Die empfohlene Infusionszeit ist 2 Stunden. Alle Patienten, denen Remicade verabreicht wurde, sind nach der Infusion mindestens 1 2 Stunden hinsichtlich des Auftretens von akuten, im Zusammenhang mit der Infusion stehenden Reaktionen zu beobachten. Eine Notfallausrüstung, wie z.b. Adrenalin, Antihistaminika, Kortikosteroide und geeignetes Instrumentarium für eine künstliche Beatmung, muss zur Verfügung stehen. Patienten können z.b. mit einem Anthistaminikum, Hydrokortison und/oder Paracetamol vorbehandelt werden, ebenso kann die Infusionsgeschwindigkeit gesenkt werden, um das Risiko für Reaktionen im Zusammenhang mit einer Infusion herabzusetzen, vor allem, wenn bereits früher derartige Reaktionen aufgetreten waren (siehe Abschnitt 4.4). Während der Behandlung mit Remicade sollten andere Begleittherapien, z.b. Kortikosteroide und Immunsuppressiva optimiert werden. Rheumatoide Arthritis Eine Dosis von 3 mg/kg wird als intravenöse Infusion über einen Zeitraum von 2 Stunden verabreicht. Der Erstinfusion folgen weitere Infusionen mit einer Dosierung von 3 mg/kg nach 2 und 6 Wochen, danach alle 8 Wochen. Remicade muss zusammen mit Methotrexat verabreicht werden. Aus den verfügbaren Daten geht hervor, dass ein klinisches Ansprechen auf die Therapie üblicherweise innerhalb von 12 Wochen erfolgt. Die Fortführung der Behandlung muss bei Patienten, die innerhalb dieser Zeit keinen nachweislichen therapeutischen Nutzen daraus ziehen, sorgfältig überdacht werden. Schwergradige, aktive Form eines Morbus Crohn Eine Dosis von 5 mg/kg wird als intravenöse Infusion über einen Zeitraum von 2 Stunden verabreicht. Eine Fortführung der Infliximab-Behandlung bei Patienten, die innerhalb von 2 Wochen nach der Erstinfusion nicht auf die Therapie angesprochen haben, wird durch die vorliegenden Daten nicht unterstützt. Bei Patienten, die auf die Therapie angesprochen haben, gibt es folgende Alternativen in der Fortführung der Behandlung: Erhaltungstherapie: Weitere Infusionen mit 5 mg/kg 2 und 6 Wochen nach der Initialdosis, gefolgt von Infusionen alle 8 Wochen oder Wiederholungstherapie: Infusion mit 5 mg/kg bei Wiederauftreten der Krankheitssymptomatik (siehe Wiederholungstherapie unten und Abschnitt 4.4). Aktive Form eines Morbus Crohn mit Fistelbildung Einer ersten Infusion von 5 mg/kg, die über einen Zeitraum von 2 Stunden verabreicht wird, folgen weitere Infusionen von 5 mg/kg 2 und 6 Wochen nach der Erstinfusion. Spricht der Patient nach diesen 3 Dosen nicht auf die Therapie an, darf keine weiter Behandlung mit Infliximab erfolgen. Bei Patienten, die auf die Therapie angesprochen haben, sind die Strategien für die weitere Behandlung folgende: Weitere Infusionen von 5 mg/kg alle 8 Wochen oder als Wiederholungstherapie bei Wiederauftreten der Krankheitssymptomatik folgen 5 mg/kg alle 8 Wochen (siehe Wiederholungstherapie unten und in Abschnitt 4.4). Bei Morbus Crohn liegen nur begrenzte Erfahrungen mit der Wiederholungstherapie bei Wiederauftreten der Symptomatik vor. Vergleichsdaten zum Nutzen-/Risikoverhältnis für die Alternativstrategien für die weitere Therapie fehlen. Ankylosierende Spondylitis Eine Dosis von 5 mg/kg wird als intravenöse Infusion über einen Zeitraum von 2 Stunden verabreicht, gefolgt von weiteren Infusionen mit 5 mg/kg in Woche 2 und 6 nach der ersten Infusion, danach alle 6 bis 8 Wochen. Bei einem ausbleibenden Ansprechen auf die Therapie nach 6 Wochen (d. h. nach 2 Dosen) sollte keine weitere Therapie mit Infliximab erfolgen. Wiederholungstherapie bei Morbus Crohn und bei rheumatoider Arthritis 3
4 Bei Wiederauftreten der Krankheitssymptomatik kann Remicade innerhalb von 16 Wochen nach der letzten Infusion erneut verabreicht werden. Bei erneuter Anwendung von Remicade nach einer Therapiepause von 2 bis 4 Jahren nach der vorherigen Infusion kam es bei einer signifikanten Anzahl von Patienten mit Morbus Crohn zu einer Überempfindlichkeitsreaktion vom verzögerten Typ (siehe Abschnitt 4.4 und Abschnitt 4.8: Verzögerte Überempfindlichkeitsreaktion ). Das Risiko einer Überempfindlichkeitsreaktion vom verzögerten Typ nach einer erneuten Behandlung nach einer Therapiepause von >16 Wochen bis 2 Jahren ist nicht bekannt. Daher kann eine erneute Anwendung nach einer Therapiepause von mehr als 16 Wochen nicht empfohlen werden. Dies gilt sowohl für Patienten mit Morbus Crohn als auch für Patienten mit rheumatoider Arthritis. Wiederholungstherapie bei ankylosierender Spondylitis Die Verträglichkeit und die Wirksamkeit einer Wiederholungstherapie, ist nur für Infusionen alle 6 bis 8 Wochen belegt. Hinweise zur Zubereitung und zur Verabreichung siehe Abschnitt Gegenanzeigen Patienten mit Tuberkulose oder anderen schweren Infektionen wie Sepsis, Abszessen und opportunistischen Infektionen (siehe Abschnitt 4.4). Patienten mit mäßiggradiger oder schwerer Herzinsuffizienz (NYHA Klasse III/IV) (siehe Abschnitt 4.4 und 4.8). Remicade darf nicht Patienten verabreicht werden, bei denen aus der Anamnese eine Überempfindlichkeit gegenüber Infliximab (siehe Abschnitt 4.8), gegenüber anderen murinen Proteinen oder irgendeinem der Hilfsstoffe bekannt ist. 4.4 Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Infusionsreaktionen und Überempfindlichkeit Infliximab wurde mit akuten infusionsbedingten Reaktionen, die einen anaphylaktischen Schock und verzögerte Überempfindlichkeitsreaktionen einschlossen, in Zusammenhang gebracht (siehe Abschnitt 4.8 Nebenwirkungen ). Akute infusionsbedingte Reaktionen, einschließlich anaphylaktische Reaktionen können während (innerhalb von Sekunden) oder innerhalb von wenigen Stunden nach der Infusion auftreten. Wenn akute infusionsbedingte Reaktionen auftreten, ist die Infusion sofort zu unterbrechen. Eine Notfallausrüstung, wie z.b. Adrenalin, Antihistaminika, Kortikosteroide und geeignetes Instrumentarium für eine künstliche Beatmung, muss zur Verfügung stehen. Patienten können z. B. mit einem Antihistaminikum, Hydrokortison und/oder Paracetamol zur Verhinderung leichter und vorübergehender Zwischenfälle vorbehandelt werden. Es können sich Antikörper gegen Infliximab entwickeln, die mit einer erhöhten Häufigkeit für Infusionsreaktionen in Zusammenhang gebracht wurden. Bei einem geringen Anteil der Infusionsreaktionen handelte es sich um schwerwiegende allergische Reaktionen. Bei Morbus-Crohn- Patienten wurde auch ein Zusammenhang zwischen der Bildung von Antikörpern gegen Infliximab und einem kürzeren therapeutischen Ansprechen beschrieben. Die begleitende Anwendung von Immunmodulatoren war mit einer geringeren Inzidenz an Antikörpern gegen Infliximab und einer geringeren Häufigkeit von Infusionsreaktionen assoziiert. Die Wirkung einer immunmodulatorischen Begleittherapie war bei intervallweise behandelten Patienten ausgeprägter als bei den Patienten, die eine Erhaltungstherapie erhielten. Patienten, die Immunsuppressiva vor oder während der Behandlung mit Remicade absetzen, haben ein höheres Risiko, diese Antikörper zu bilden. Antikörper gegen Infliximab sind nicht immer in Serumproben nachweisbar. Bei Auftreten von schweren Reaktionen muss eine symptomatische Behandlung eingeleitet werden und weitere Remicade-Infusionen dürfen nicht erfolgen (siehe Abschnitt 4.8: Immunogenität ). 4
5 Eine verzögerte Überempfindlichkeitsreaktion wurde bei einer signifikanten Anzahl von Patienten mit Morbus Crohn (25%) beobachtet, die mit Infliximab nach einem Zeitraum von 2 bis 4 Jahren ohne Infliximab-Behandlung erneut behandelt wurden. Die Symptomatik, welche innerhalb von 12 Tagen nach der Wiederbehandlung auftrat, beinhaltete Myalgie und/oder Arthralgie mit Fieber und/oder Hautausschlag. Einige Patienten entwickelten auch Pruritus, Gesichts-, Hand- oder Lippenödem, Dysphagie, Urtikaria sowie Hals- und/oder Kopfschmerzen. Die Patienten sind darauf hinzuweisen, dass sie sich bei einer verzögert auftretenden Nebenwirkung unverzüglich an ihren Arzt wenden müssen (siehe Abschnitt 4.8: Verzögerte Überempfindlichkeitsreaktion ). Falls Patienten nach langer Zeit wiederbehandelt werden, müssen sie hinsichtlich des Auftretens der Symptomatik einer verzögerten Überempfindlichkeitsreaktion sorgfältig überwacht werden. Infektionen Die Patienten sind im Bezug auf Infektionen, einschließlich Tuberkulose, vor, während und nach der Behandlung mit Remicade genau zu überwachen. Da die Elimination von Infliximab bis zu sechs Monate dauern kann, sollte die Beobachtung über diesen Zeitraum fortgesetzt werden. Eine weitere Behandlung mit Remicade darf nicht erfolgen, wenn der Patient schwere Infektionen oder Sepsis entwickelt. Tumor-Nekrose-Faktor alpha (TNFα) vermittelt Entzündungen und moduliert zelluläre Immunantworten. Experimentelle Daten zeigen, dass TNFα für die Behebung von intrazellulären Infektionen wichtig ist. Klinische Erfahrungen zeigen, dass Abwehrreaktionen des Wirtsorganismus gegen Infektionen bei einigen mit Infliximab behandelten Patienten beeinträchtigt sind. Es ist zu beachten, dass die Unterdrückung des TNFα auch die Symptome einer Infektion wie z.b. Fieber maskieren kann. Über opportunistische Infektionen und andere Infektionen, einschließlich Sepsis, wurde bei mit Infliximab behandelten Patienten berichtet; einige dieser Infektionen hatten einen letalen Verlauf. Bei mit Remicade behandelten Patienten wurde über Fälle aktiver Tuberkulose einschließlich Miliartuberkulose und Tuberkulose mit extrapulmonaler Lokalisation berichtet. Einige dieser Fälle hatten einen letalen Verlauf. Bevor mit der Remicade-Behandlung begonnen wird, müssen alle Patienten hinsichtlich einer aktiven oder inaktiven ( latenten ) Tuberkulose diagnostiziert werden. Die Diagnose sollte eine detaillierte medizinische Anamnese, einschließlich einer Tuberkulosevorerkrankung oder eines möglichen Kontakts zu Tuberkulose-Kranken und einer vorherigen und/oder derzeitigen immunsuppressiven Therapie, umfassen. Geeignete Untersuchungen, d.h. Tuberkulinhauttest und Thoraxröntgenaufnahme sollten bei allen Patienten durchgeführt werden (lokale Empfehlungen können herangezogen werden). Es wird empfohlen, dass die Durchführung dieser Untersuchungen in der Warnhinweiskarte des Patienten festgehalten wird. Die verschreibenden Ärzte werden an das Risiko falsch negativer Tuberkulinhauttest-Ergebnisse insbesondere bei schwerkranken oder immunsupprimierten Patienten erinnert. Wird eine aktive Tuberkulose diagnostiziert, so darf die Remicade-Therapie nicht begonnen werden (siehe Abschnitt 4.3). Falls eine inaktive ( latente ) Tuberkulose diagnostiziert wird, so muss eine prophylaktische Anti- Tuberkulose-Therapie entsprechend der lokalen Empfehlungen vor der Verabreichung von Remicade eingeleitet werden. In diesem Fall sollte das Nutzen-Risiko-Verhältnis einer Remicade-Therapie sorgfältig erwogen werden. Bei Patienten mit Morbus Crohn mit Fistelbildung und akut eitrigen Fisteln darf die Therapie mit Remicade erst eingeleitet werden, nachdem eine mögliche Infektionsquelle, insbesondere ein Abszess ausgeschlossen wurde (siehe Abschnitt 4.3). 5
6 Alle Patienten sollten darüber informiert sein, ärztlichen Rat einzuholen, wenn Anzeichen/Symptome (z.b. anhaltender Husten, Kräfteverfall, Gewichtsverlust, leichtes Fieber) während oder nach der Remicade-Behandlung auftreten, die auf eine Tuberkulose hindeuten. Gleichzeitige Anwendung eines TNF-alpha-Inhibitors und Anakinra Die gleichzeitige Anwendung von Etanercept (ein anderer Wirkstoff, der TNFα hemmt) und Anakinra (einer rekombinanten, nicht-glykosylierten Form des humanen Interleukin-1-Rezeptorantagonisten) war, im Vergleich zur Monotherapie mit diesen Arzneimitteln, mit einem erhöhten Risiko für schwerwiegende Infektionen und für eine Neutropenie assoziiert und war mit keinem zusätzlichen Nutzen verbunden. Die Verträglichkeit und die Wirksamkeit von Anakinra bei kombinierter Anwendung mit Infliximab sind nicht belegt. Daher wird eine kombinierte Anwendung von Infliximab und Anakinra nicht empfohlen Autoimmunprozesse Der durch die Anti-TNF-Behandlung bedingte relative TNFα-Mangel kann zur Auslösung eines Autoimmunprozesses führen. Entwickelt ein Patient nach der Behandlung mit Remicade Symptome, die auf ein Lupus-ähnliches Syndrom hinweisen und fällt der Antikörperbefund gegen doppelsträngige DNS positiv aus, darf eine weitere Behandlung mit Remicade nicht erfolgen (siehe Abschnitt 4.8: Antinukleäre Antikörper (ANA)/Antikörper gegen doppelsträngige DNS (dsdns) ). Neurologische Ereignisse Infliximab und andere Substanzen, die TNFα hemmen, wurden in seltenen Fällen mit einer Optikusneuritis, Krampfanfällen und dem erstmaligen Auftreten oder einer Verschlechterung der klinischen Symptome und/oder radiologischem Nachweis einer demyelinisierenden Erkrankung, einschließlich Multipler Sklerose in Verbindung gebracht. Bei Patienten mit vorbestehenden oder kürzlich aufgetretenen demyelinisierenden Erkrankungen des Zentralnervensystems muss vor der Einleitung der Behandlung mit Remicade das Nutzen-Risiko-Verhältnis sorgfältig abgewogen werden. Maligne und lymphoproliferative Erkrankungen Es ist nicht bekannt, ob eine Verabreichung von Infliximab das Risiko, diese Erkrankungen zu entwickeln, erhöhen kann (siehe Abschnitt 4.8). Herzinsuffizienz Remicade ist mit Vorsicht bei Patienten mit leichter Herzinsuffizienz (NYHA Klasse I/II) anzuwenden. Die Patienten sind genau zu überwachen und Remicade darf nicht weiter bei den Patienten angewendet werden, die neue oder sich verschlechternde Symptome einer Herzinsuffizienz entwickeln (siehe Abschnitt 4.3 und 4.8). Andere Die Anwendung von Remicade wurde nicht geprüft bei Kindern im Alter von 0 17 Jahren mit rheumatoider Arthritis oder Morbus Crohn. Solange keine Daten zu Sicherheit und Wirksamkeit bei Kindern vorliegen, ist eine Anwendung bei dieser Altersgruppe zu vermeiden. Bei geriatrischen Patienten wurde die Pharmakokinetik von Infliximab nicht geprüft. Bei Patienten mit Leber- oder Nierenerkrankung wurden keine Studien durchgeführt (siehe Abschnitt 5.2). Es liegen nur ungenügende präklinischen Daten vor, um Schlußfolgerungen hinsichtlich der Wirkung von Infliximab auf die Fertilität und die allgemeine reproduktive Funktion ziehen zu können (siehe Abschnitt 5.3). Es gibt nur begrenzte Erfahrung in Bezug auf die Sicherheit für chirurgische Verfahren bei mit Remicade behandelten Patienten. Die lange Halbwertszeit von Remicade sollte in Betracht gezogen werden, wenn chirurgische Maßnahmen beabsichtigt sind. Ein Patient, der einen chirurgischen Eingriff benötigt, während er Remicade erhält, sollte im Hinblick auf Infektionen genau beobachtet werden und geeignete Maßnahmen sind zu ergreifen. 6
7 Es liegen nur begrenzte Daten zur Verträglichkeit der Remicade-Therapie für Patienten vor, bei denen ein Gelenksersatz durchgeführt wurde. Die Behandlung von Patienten, die aufgrund eines Morbus Crohn intestinale Stenosen haben, wird nicht empfohlen, da das Risiko-/Nutzenverhältnis bei dieser Patientengruppe nicht bekannt ist. 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Bei Patienten mit rheumatoider Arthritis und bei Morbus-Crohn-Patienten liegen Hinweise darauf vor, dass bei einer gleichzeitigen Behandlung mit Methotrexat oder sonstigen Immunmodulatoren die Bildung von Antikörpern gegen Infliximab reduziert wird und dass die Plasmakonzentrationen von Infliximab ansteigen. Diese Ergebnisse sind jedoch aufgrund von methodischen Grenzen bei der Serumanalyse auf Infliximab und auf Antikörper gegen Infliximab unsicher. Kortikosteroide scheinen die Pharmakokinetik von Infliximab nicht in klinisch relevanter Weise zu beeinflussen. Es liegen keine Erkenntnisse zu möglichen Wechselwirkungen zwischen Infliximab und anderen wirksamen Substanzen vor. 4.6 Schwangerschaft und Stillzeit Es liegen keine klinischen Daten zur Anwendung von Infliximab während der Schwangerschaft vor. Wegen der TNFα-Hemmung könnte durch die Anwendung von Infliximab während der Schwangerschaft die normale Immunantwort des Neugeborenen beeinflusst werden. Eine Studie zur Entwicklungstoxizität, die an Mäusen mit einem analogen Antikörper durchgeführt wurden, der die funktionelle Aktivität des murinen TNFα selektiv hemmt, lieferte keinen Hinweis auf eine maternale Toxizität, eine Embryotoxizität oder eine Teratogenität (siehe Abschnitt 5.3). Infliximab sollte während der Schwangerschaft nicht verabreicht werden. Frauen im gebärfähigen Alter müssen eine adäquate Empfängnisverhütung anwenden und diese über mindestens 6 Monate nach der letzten Remicade-Behandlung fortführen. Es ist nicht bekannt, ob Infliximab in die Muttermilch übergeht oder nach der Aufnahme systemisch resorbiert wird. Da Humanimmunglobuline in die Muttermilch übergehen, dürfen Frauen nach der Remicade-Behandlung mindestens 6 Monate lang nicht stillen. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen Es wurden keine Studien zur Auswirkung auf die Verkehrstüchtigkeit und das Bedienen von Maschinen durchgeführt. 4.8 Nebenwirkungen In klinischen Studien mit Infliximab wurden Nebenwirkungen bei 61% der mit Infliximab behandelten Patienten und bei 39% der mit Placebo behandelten Patienten beobachtet. Die Nebenwirkungen sind in der Tabelle 1 nach Organsystemen und nach der Häufigkeit (häufig > 1/100, < 1/10; gelegentlich > 1/1000, < 1/100; selten > 1/10.000, < 1/1000) geordnet. Die Häufigkeitsangabe basiert auf dem vermehrten Auftreten von Nebenwirkungen im Vergleich zu Placebo aus gepoolten Daten von klinischen Studien, in die 227 mit Placebo behandelte Patienten und 1442 mit Infliximab behandelte Patienten (vorwiegend Patienten mit rheumatoider Arthritis und Morbus Crohn) eingeschlossen waren. Infusionsbedingte Reaktionen waren die am häufigsten berichteten Nebenwirkungen. Infusionsbedingte Reaktionen (Dyspnoe, Urtikaria und Kopfschmerzen) waren die häufigsten Ursachen für das Absetzen der Behandlung. 7
8 Infektionen und parasitäre Erkrankungen Immunsystem Blutbildendes System Psyche Tabelle 1 Nebenwirkungen in klinischen Studien Häufig: Gelegentlich: Selten: Häufig: Gelegentlich: Zentrales und peripheres Nervensystem Häufig: Gelegentlich: Sehvermögen und Gehör Herz-Kreislaufsystem Respirationstrakt Gastrointestinaltrakt Hepatobiliäres System Virusinfektion (z.b. Influenza, Herpes-Infektionen), Fieber Abszess, Cellulitis, Candidose, Sepsis, verzögerte Wundheilung, bakterielle Infektion, Tuberkulose, Pilzinfektion Granulomatöse Läsion Serumkrankheit-ähnliche Rektionen Autoantikörper, Lupus-ähnliches Syndrom, Störungen des Komplementsystems Gelegentlich: Anämie, Leukopenie, Lymphadenopathie, Lymphozytose, Lymphopenie, Neutropenie, Thrombozytopenie Gelegentlich: Depression, Verwirrtheit, Agitation, Amnesie, Apathie, Nervosität, Somnolenz, Schlaflosigkeit Selten: Kopfschmerzen, Schwindel/Benommenheit Verschlechterung einer demyelinisierenden Erkrankung mit Verdacht auf Multiple Sklerose Meningitis Gelegentlich: Konjunktivitis, Endophthalmitis, Keratokonjunktivitis Häufig: Gelegentlich: Selten: Häufig: Gelegentlich: Selten Häufig: Gelegentlich: Selten: Selten Häufig: Gelegentlich: Selten: Haut und Hautanhangsgebilde Häufig: Gelegentlich: Hitzegefühl Ekchymose/Hämatom, Hypertonie, Hypotonie, Synkope, Petechien, Thrombophlebitis, Bradykardie, Herzklopfen, Gefäßspasmus, Zyanose, periphere Ischämie, Arrhythmie, Verschlechterung der Herzinsuffizienz Kreislaufversagen, Tachykardie Infektion des oberen Respirationstrakts, Infektion des unteren Respirationstrakts (z.b. Bronchitis, Pneumonie), Dyspnoe, Sinusitis Epistaxis, Bronchospasmus, Pleuritis, allergische Reaktion des Respirationstrakts, Lungenödem Pleuraerguss Übelkeit, Diarrhoe, Abdominalschmerzen, Dyspepsie Obstipation, gastroösophagealer Reflux, Cheilitis, Divertikulitis Darmwandperforation, Darmstenose, gastrointestinale Hämorrhagie Erhöhte Leber-Transaminasen Leberfunktionsstörung, Cholezystitis Hepatitis Hautausschlag, Pruritus, Urtikaria, vermehrte Schweißsekretion, Hauttrockenheit Mykosen der Haut/Onychomykose, Ekzem/Seborrhoe, Hordeolum, Blasenbildung, Furunkulose, periorbitales Ödem, 8
9 Hyperkeratose, Rosacea, Verruca, Pigmentanomalie / Hautverfärbung, Alopezie Muskel- und Skelettsystem Gelegentlich: Myalgie, Arthralgie, Rückenschmerzen Nieren und Harnwege Gelegentlich: Harnwegsinfektion, Pyelonephritis Geschlechtsorgane Gelegentlich: Vaginitis Gesamter Körper Häufig: Ermüdung, thorakale Schmerzen, infusionsbedingte Reaktionen Gelegentlich: Ödem, Hitzewallungen, Schmerzen, Frösteln/Schüttelfrost, anaphylaktische Reaktionen Behandlungs-/Applikationsstelle Gelegentlich: Reaktionen an der Injektionsstelle Tabelle 2 Nebenwirkungen in Berichten nach Markteinführung (häufig > 1/100, < 1/10; gelegentlich > 1/1000, < 1/100; selten > 1/10.000, < 1/1000; sehr selten < 1/10.000, einschließlich Einzelfallberichte). Neurologische Ereignisse Blut Hepatobiliäres System Gesamter Körper Selten: Sehr selten: Selten: Seht selten: Selten: Sehr selten: Häufig: Gelegentlich: Selten: Infektionen und parasitäre Erkrankungen Selten: Demyelisierende Erkrankungen (wie Multiple Sklerose und Optikusneuritis), Guillain-Barré Syndrom, Neuropathien, Taubheitsgefühl, Kribbeln, Krampfanfälle Myelitis transversa Panzytopenie Hämolytische Anämie, idiopatische thrombozytopenische Purpura, thrombotisch-thrombozytopenische Purpura Hepatitis Leberzellschaden Infusionsbedingte Reaktionen Anaphylaktische Reaktionen Anaphylaktischer Schock Opportunistische Infektionen (wie Tuberkulose, atypische Mykobakterien, Pneumocystose, Histoplasmose, Coccidioidomykose, Kryptokokkose, Aspergillose, Listeriose und Candidose Salmonellose Sehr selten: Respirationstrakt Selten: Interstitielle Pneumonitis/Fibrose Immunsystem Selten: Serumkrankheit, Vaskulitis Herz Sehr selten: Perikarderguss Haut und Hautanhangsgebilde Selten: Vaskulitis (primär der Haut) Infusionsbedingte Reaktionen: Eine infusionsbedingte Reaktion war im Rahmen klinischer Studien definiert als jegliches unerwünschtes Ereignis, das während der Infusion oder 1 bis 2 Stunden nach 9
10 einer Infusion auftrat. In den klinischen Studien kam es bei 20% der mit Infliximab behandelten Patienten im Vergleich zu 9% der mit Placebo behandelten Patienten zu einer infusionsbedingten Reaktion. Unter all den Remicade-Infusionen waren ungefähr 3% von nichtspezifischen Symptomen wie Fieber oder Schüttelfrost, <1% von Pruritus oder Urtikaria, 1% von kardiopulmonalen Reaktionen (primär thorakale Schmerzen, erniedrigter Blutdruck, erhöhter Blutdruck oder Dyspnoe) und 0,1% von kombinierten Symptomen eines Pruritus/Urtikaria und kardiopulmonalen Reaktionen begleitet. Bei 2% der Patienten kam es zum Therapieabbruch, wobei sich alle Patienten mit oder ohne medizinische Therapie wieder erholten. Erfahrungen nach Markteinführung zeigen Fälle von anaphylaktisch-ähnlichen Reaktionen einschließlich laryngeale/pharyngeale Ödeme und schwere Bronchospasmen sowie Krampfanfälle, die mit der Gabe von Remicade assoziiert waren. Verzögerte Überempfindlichkeit: In einer klinischen Studie mit 41 Patienten, die nach einem Zeitraum von 2 bis 4 Jahren ohne Infliximab-Behandlung erneut mit Infliximab behandelt wurden, kam es bei 10 Patienten 3 bis 12 Tage nach der Infusion zu Nebenwirkungen. Bei 6 dieser Patienten wurden die Wirkungen als schwerwiegend erachtet. Die Symptomatik beinhaltete Myalgie und/oder Arthralgie mit Fieber und/oder Hautausschlag. Einige Patienten entwickelten auch Pruritus, Gesichts-, Handoder Lippenödem, Dysphagie, Urtikaria oder Hals- und/oder Kopfschmerzen. In allen anderen klinischen Studien, in denen insgesamt 771 Patienten 4797 Infusionen in Intervallen von überwiegend 14 Wochen oder weniger (Spannbreite von 1 bis 55 Wochen) erhielten, wurden keine vergleichbaren verzögerten Überempfindlichkeitsreaktionen beobachtet. In noch andauernden Studien und Anwendungsbeobachtungen waren diese Ereignisse selten und traten in Intervallen von weniger als 1 Jahr auf. In einer 1-jährigen Studie mit wiederholten Infusionen bei Patienten mit Morbus Crohn (ACCENT I- Studie) betrug die Inzidenz an Serumkrankheit-ähnlichen Reaktionen 2,4%. Immunogenität:Patienten, die Antikörper gegen Infliximab entwickelten, neigten eher (ungefähr 2-3 mal häufiger) dazu, eine infusionsbedingte Reaktion zu haben als solche die Antikörper-negativ waren. Die gleichzeitige Gabe von Immunsuppressiva schien die Häufigkeit von infusionsbedingten Reaktionen zu reduzieren. In klinischen Studien, in denen Einzel- und Mehrfachdosen von Infliximab im Bereich von 1 bis 20 mg/kg angewendet wurden, wurden Antikörper gegen Infliximab bei 140 von 980 Patienten (14%) mit einer immunsuppressiven Therapie und bei 92 von 383 Patienten (24 %) ohne immunsuppressive Therapie entdeckt. Bei Patienten mit rheumatoider Arthritis, welche das empfohlene Dosierungsschema zur Wiederholungsbehandlung mit Methotrexat erhalten hatten, entwickelten 6 von 77 Patienten (8%) Antikörper gegen Infliximab. Bei ungefähr 6 13 % der Morbus- Crohn-Patienten, die eine Erhaltungstherapie erhielten, kam es zur Bildung von Antikörpern. Bei den intervallweise behandelten Patienten war die Inzidenz der Antikörperbildung 2 3-mal höher. Aufgrund methodischer Grenzen schloss jedoch ein negatives Ergebnis das Vorhandensein von Antikörpern gegen Infliximab nicht aus. Bei einigen Patienten, die hohe Titer von Antikörpern gegen Infliximab entwickelten, lag ein Hinweis auf eine verminderte Wirksamkeit vor (siehe Abschnitt 4.4 Infusionsreaktionen und Überempfindlichkeit ). Infektionen: In den klinischen Studien wurden 35% der mit Infliximab behandelten Patienten im Vergleich zu 22% der mit Placebo behandelten Patienten gegen Infektionen behandelt. Schwerwiegende Infektionen, wie etwa eine Pneumonie, wurden bei jeweils 5% der mit Infliximab behandelten Patienten und der mit Placebo behandelten Patienten beobachtet (siehe Abschnitt 4.4). In Spontanmeldungen nach Markteinführung sind Infektionen die am häufigsten berichteten schweren Nebenwirkungen. Einige der Fälle hatten einen letalen Verlauf. Fast 50% der berichteten Todesfälle waren mit Infektionen verbunden. Über Tuberkulosefälle, manchmal tödlich, einschließlich Miliartuberkulose und Tuberkulose mit extrapulmonaler Lokalisation wurde berichtet (siehe Abschnitt 4.4). 10
11 Malignome und lymphoproliferative Erkrankungen: In klinischen Studien mit Infliximab und während der dreijährigen Langzeitbeobachtung (dies entspricht 2914 Patientenjahren) wurden in sechs Fällen ein Lymphom und in 18 Fällen andere Malignome festgestellt. Demgegenüber wurden bei den mit Placebo behandelten Patienten während 389 Patientenjahren vier Malignome festgestellt. Die beobachteten Raten und Inzidenzen entsprachen den für die geprüften Patientenpopulationen zu erwartenden. Von August 1998 bis August 2002 wurde über 483 Fälle vermutlicher bösartiger Erkrankungen berichtet, 107 bei Patienten mit M. Crohn, 300 bei Patienten mit rheumatoider Arthritis und 76 bei Patienten mit anderen Erkrankungen. Es wird geschätzt, dass während dieses Zeitraumes etwa Patienten mit Infliximab behandelt wurden. Es ist nicht geklärt, ob eine Exposition gegenüber Infliximab die Inzidenz dieser Erkrankungen erhöhen kann. Bei gleichzeitiger Anwendung von Methotrexat und Infliximab sind langfristige immunsuppressive Wirkungen nicht bekannt. Herzinsuffizienz: In einer Phase-II-Studie zur Beurteilung von Remicade bei dekompensierter Herzinsuffizienz (CHF) wurde bei mit Remicade behandelten Patienten eine höhere Inzidenz an Mortalität aufgrund einer Verschlechterung der Herzinsuffizienz gefunden, insbesondere bei denen, die mit der höheren Dosis von 10 mg/kg (d.h. dem Doppelten der zugelassenen Dosis) behandelt wurden. In dieser Studie wurden 150 Patienten mit NYHA Klasse III-IV CHF (linksventrikuläre Auswurffraktion 35%) mit 3 Remicade-Infusionen mit 5 mg/kg, 10 mg/kg oder Placebo über 6 Wochen behandelt. Bis Woche 38 verstarben 9 von 101 mit Remicade behandelten Patienten (2 unter 5 mg/kg und 7 unter 10 mg/kg) im Vergleich zu 1 Todesfall unter den 49 Placebo-Patienten. Antinukleäre Antikörper (ANA)/ Antikörper gegen doppelsträngige DNS (dsdns): Ungefähr 52% der 1261 Patienten, die in klinischen Studien mit Infliximab behandelt wurden und bei denen vor der Behandlung ein negativer ANA-Befund vorlag, entwickelten während der Studie einen positiven ANA-Befund. Der entsprechende Prozentsatz bei den 129 Patienten der Placebogruppe betrug ca. 19%. In den klinischen Studien bildeten sich neue Antikörper gegen dsdna bei etwa 261 (17%) der 1507 mit Infliximab behandelten Patienten, verglichen mit 0% der 162 mit Placebo behandelten Patienten. Bei der letzten Evaluierung blieben 150 dieser 261 mit Infliximab behandelten Patienten (57%) anti-dsdna-positiv. Von Lupus oder Lupus-ähnlichen Syndromen wurde nach wie vor nur in seltenen Fällen berichtet. 4.9 Überdosierung Einzeldosen von bis zu 20 mg/kg wurden ohne toxische Wirkungen verabreicht. Es liegt keine klinische Erfahrung zur Überdosierung vor. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Selektiv immunsuppressive Wirkstoffe, ATC-Code: L04A A12. Pharmakodynamische Eigenschaften: Infliximab ist ein chimärer, human-muriner, monoklonaler Antikörper, der mit hoher Affinität sowohl an lösliche als auch an transmembrane Formen von TNFα, aber nicht an Lymphotoxin-α (TNFß) bindet. Infliximab hemmt die funktionelle Aktivität von TNFα bei einer Vielzahl von in-vitro-bioassays. Infliximab verhinderte die Erkrankung bei transgenen Mäusen, die Polyarthritis aufgrund einer veranlagungsbedingten Expression von menschlichem TNFα entwickelt hatten. Wurde Infliximab nach dem Ausbruch der Krankheit verabreicht, so ermöglichte es eine Heilung der Gelenke mit Erosionen. In vivo bildet Infliximab rasch stabile Komplexe mit menschlichem TNFα, ein Vorgang, der mit dem Verlust der TNFα-Bioaktivität einhergeht. In den Gelenken von Patienten mit rheumatoider Arthritis wurden erhöhte Konzentrationen von TNFα gefunden. Sie korrelieren mit einer erhöhten Krankheitsaktivität. Bei rheumatoider Arthritis reduziert die Behandlung mit Infliximab sowohl die Infiltration von Entzündungszellen in den entzündeten Bereichen der Gelenke als auch die Expression von Molekülen, die die zelluläre Adhäsion, die Chemotaxis und den Abbau von Gewebe vermitteln. Nach der Behandlung mit Infliximab zeigten die Patienten im Vergleich zu den Ausgangswerten erniedrigte Spiegel von Serum-Interleukin 6 (IL-6) und C-reaktivem Protein (CRP). Des Weiteren zeigten die Lymphozyten aus dem peripheren 11
12 Blutkreislauf keine signifikante Erniedrigung in Bezug auf die Anzahl bzw. auf die proliferative Antwort gegenüber einer mitogenen Stimulation in vitro im Vergleich zu den Zellen von unbehandelten Patienten. Die histologische Evaluierung von Kolonbiopsien, die vor und vier Wochen nach der Verabreichung von Infliximab gewonnen wurden, ergab eine deutliche Reduktion an nachweisbarem TNFα. Die Behandlung von Morbus-Crohn-Patienten mit Infliximab ging darüber hinaus mit einer deutlichen Reduktion des normalerweise erhöhten Entzündungsmarkers im Serum, dem CRP, einher. Die Gesamtzahl der peripheren Leukozyten war bei den mit Infliximab behandelten Patienten nur unwesentlich verändert, wobei sich die Veränderung der Anzahl der Lymphozyten, der Monozyten und der neutrophilen Granulozyten im Normbereich bewegte. Mononukleäre Zellen aus dem peripheren Blutkreislauf (PBMC) von Patienten, die mit Infliximab behandelt wurden, sprachen im Vergleich zu denjenigen von unbehandelten Patienten mit einer uneingeschränkten Proliferation auf Stimuli an. Darüber hinaus wurden im Anschluss an eine Behandlung mit Infliximab keine wesentlichen Veränderungen der Zytokinproduktion durch stimulierte PBMC beobachtet. Eine Analyse von mononukleären Zellen aus der Lamina propria, die durch eine Biopsie der intestinalen Mukosa gewonnen wurden, zeigte, dass die Behandlung mit Infliximab die Anzahl von Zellen reduzierte, die in der Lage waren, TNFα und Interferonγ zu exprimieren. Zusätzliche histologische Studien erbrachten den Nachweis, dass eine Behandlung mit Infliximab die Infiltration von Entzündungszellen in den betroffenen Darmbereichen und die Anzahl von Entzündungsmarkern an diesen Stellen verringerte. Klinische Wirksamkeit Rheumatoide Arthritis Die Verträglichkeit und Wirksamkeit von Infliximab wurden in einer randomisierten, doppelblinden und Placebo-kontrollierten Studie nach 30, 54 und 102 Wochen bei 428 Patienten geprüft, die trotz Behandlung mit Methotrexat eine aktive rheumatoide Arthritis hatten (ATTRACT-Studie). Annähernd 50% der Patienten waren der funktionellen Klassifikation III zugeordnet. Die Patienten erhielten Placebo, 3 mg/kg oder 10 mg/kg Infliximab in den Wochen 0, 2 und 6 sowie nachfolgend alle 4 oder 8 Wochen Alle Patienten erhielten in den 6 Monaten vor der Aufnahme in die Studie eine stabile Methotrexat-Dosis (Median: 15 mg/woche) und sollten während des gesamten Verlaufs der Studie auf stabilen Dosen gehalten werden. Eine Begleitmedikation mit stabilen Dosen von oralen Kortikosteroiden ( 10 mg/tag) und/oder nicht-steroidalen Antiphlogistika war zulässig. Zusätzlich wurde den Patienten Folsäure gegeben. Die primären Endpunkte waren die Reduktion der Symptomatik gemäß den Kriterien des American College of Rheumatology, die Verhinderung von Gelenkschäden und die Verbesserung der körperlichen Funktionsfähigkeit. Eine Reduktion der Symptomatik war als mindestens 20%ige Verbesserung (ACR20) der Anzahl druckschmerzhafter und geschwollener Gelenke sowie als Vorliegen von 3 der folgenden 5 Kriterien definiert: Gesamtbewertung des Arztes, Gesamtbewertung des Patienten, Messung der Funktion/Behinderung, visuelle analoge Schmerzskala und Blutkörperchensenkungsgeschwindigkeit oder C-reaktives Protein. Die Gelenkschäden (Erosionen und Verschmälerung des Gelenkspalts) in beiden Händen und Füßen wurden als Änderung vom Ausgangswert nach dem von van der Heijde modifizierten Sharp Gesamtscore (0-440) gemessen. Der Health Assessment Questionnaire (HAQ; Skalierung 0-3) wurde zur Messung des Verlaufs der durchschnittlichen Änderung der körperlichen Funktionsfähigkeit der Patienten im Vergleich zum Ausgangs-Score verwendet. Die Ergebnisse der Woche 54 (ACR20, HAQ und von van der Heijde modifizierter Sharp Gesamtscore) sind in Tabelle 3 dargestellt. In der Woche 54 zeigte ein höherer prozentualer Anteil an Patienten in allen mit Infliximab behandelten Gruppen eine signifikante Reduktion der Symptomatik im Vergleich zur alleinigen Gabe von Methotrexat. Dieses klinische Ansprechen war ab 2 Wochen festzustellen und wurde im Verlauf von 102 Behandlungswochen aufrechterhalten. Ein höhergradiges klinisches Ansprechen (ACR50 und ACR70) im Vergleich zur alleinigen Gabe von Methotrexat wurde in den Wochen 30 und 54 beobachtet. 12
13 Eine Reduktion der Progressionsrate der Gelenkschäden (Erosionen und Verschmälerung des Gelenkspalts) wurde in allen mit Infliximab behandelten Gruppen nach 54 Wochen festgestellt (Tabelle 3). Die klinischen Ergebnisse, die nach 54 Wochen festgestellt wurden, konnten über 102 Wochen aufrechterhalten werden. Aufgrund der Anzahl von Behandlungsabbrüchen während der Studie, kann der Unterschied zwischen der mit Infliximab und der mit Methotrexat allein behandelten Gruppe nicht quantifiziert werden. 13
14 Tabelle 3 Klinische Ergebnisse hinsichtlich ACR20, Gelenkschäden und körperlicher Funktionsfähigkeit in Woche 54 Infliximab b 3 mg/kg 3 mg/kg 10 mg/kg 10 mg/kg Gesamt Kontrolle a alle 8 Wo. alle 4 Wo. alle 8 Wo. alle 4 Wo. Infliximab b Patienten mit ACR20 Ansprechen/ ausgewertete Patienten (%) c 15/88 (17%) 36/86 (42%) 41/86 (48%) 51/87 (59%) 48/81 (59%) 176/340 (52%) Gesamt-Score d (von van der Heijde modifizierter Sharp-Score) Änderung vom Ausgangswert (Mittelwert ± SD c ) Median c (Interquartiler Bereich) 7,0 ± 10,3 1,3 ± 6,0 1,6 ± 8,5 0,2 ± 3,6-0,7 ± 3,8 0,6 ± 5,9 4,0 (0,5;9,7) Patienten ohne Verschlechterung/ ausgewertete Patienten (%) c 13/64 (20%) 0,5 (-1,5;3,0) 34/71 (48%) 0,1 (-2,5;3,0) 35/71 (49%) 0,5 (-1,5;2,0) 37/77 (48%) -0,5 (-3,0;1,5) 44/66 (67%) 0,0 (-1,8;2,0) 150/285 (53%) HAQ-Änderung gegenüber Ausgangswert e (ausgewertete Patienten) Mittelwert ± SD c 0,2 ± 0,3 0,4 ± 0,3 0,5 ± 0,4 0,5 ± 0,5 0,4 ± 0,4 0,4 ± 0,4 a: Kontrolle = Alle Patienten hatten eine aktive RA trotz Behandlung mit stabilen Methotrexat-Dosen über 6 Monate vor Einschluss in die Studie und sollten während des gesamten Verlaufs der Studie auf stabilen Dosen gehalten werden. Eine Begleitmedikation mit stabilen Dosen von oralen Kortikosteroiden ( 10 mg/tag) und/oder nicht-steroidalen Antiphlogistika war zulässig. Zusätzlich wurde den Patienten Folsäure gegeben. b: Alle Verabreichungen von Infliximab in Kombination mit Methotrexat und Folsäure, sowie teilweise mit Kortikosteroiden und/oder nicht-steroidalen Antiphlogistika c: p < 0,001, für jede Infliximab-Behandlungsgruppe vs. Kontrolle d: Höhere Werte zeigen größere Gelenkschäden an. e: HAQ = Health Assessment Questionnaire; höhere Werte zeigen eine geringere Funktionseinschränkung an. Morbus Crohn Die Verträglichkeit und die Wirksamkeit einer Einmaldosis-Behandlung von Infliximab wurde bei 108 Patienten mit einer aktiven Form von Morbus Crohn (Morbus Crohn-Aktivitätsindex (CDAI) ) in einer randomisierten, doppelblinden, Placebo-kontrollierten Dosis-Wirkungsstudie geprüft. Von diesen 108 Patienten wurden 27 mit der empfohlenen Dosierung von 5 mg/kg Infliximab behandelt. Alle Patienten hatten auf konventionelle Therapieformen nicht angemessen angesprochen. Die gleichzeitige Behandlung mit stabilen Dosen konventioneller Therapien war zulässig, und 92% der Patienten erhielten weiterhin diese Medikationen. Der primäre Endpunkt war der Anteil von Patienten, die ein klinisches Ansprechen aufwiesen. Dies war als eine Absenkung des CDAI um 70 Punkte bezogen auf den Ausgangswert bei einer Bewertung nach 4 Wochen und ohne Erhöhung der Begleitmedikation oder Durchführung chirurgischer Maßnahmen zur Behandlung des Morbus Crohn definiert. Patienten, die in Woche 4 ein Ansprechen zeigten, wurden bis Woche 12 weiter beobachtet. Sekundäre Endpunkte waren der Anteil an Patienten mit klinischer Remission in Woche 4 (CDAI < 150) und die Dauer des klinischen Ansprechens. In Woche 4 war nach einer Einzeldosis der Studienmedikation bei 22/27 (81%) der mit Infliximab behandelten Patienten, die eine Dosis von 5 mg/kg erhielten, im Vergleich zu 4/25 (16%) der mit Placebo behandelten Patienten ein klinisches Ansprechen erkennbar (p < 0,001). Ebenfalls in Woche 4 wurde bei 13/27 (48%) der mit Infliximab behandelten Patienten im Vergleich zu 1/25 (4%) der mit 14
15 Placebo behandelten Patienten eine klinische Remission (CDAI < 150) erreicht. Der Beginn des Ansprechens wurde innerhalb von 2 Wochen beobachtet, das maximale Ansprechen wurde nach 4 Wochen erreicht. Bei der letzten Untersuchung nach 12 Wochen war bei 13/27 (48%) der mit Infliximab behandelten Patienten immer noch ein Ansprechen vorhanden. Die Verträglichkeit und die Wirksamkeit von wiederholten Infusionen mit Infliximab wurden in einer 1-jährigen Studie geprüft. Insgesamt 573 Patienten mit aktivem Morbus Crohn (CDAI 220 und 400) erhielten eine Einzelinfusion von 5 mg/kg in Woche 0. Achtundsechzig dieser Patienten (12%) gehörten der in der Indikation angegebenen Patientengruppe an (siehe Abschnitt 4.1). 335 Patienten (58%), die in Woche 2 auf die Infusion mit 5 mg/kg angesprochen hatten, wurden in randomisierter Weise einer der drei Behandlungsgruppen zugewiesen: Erhaltungstherapie mit Placebo, Erhaltungstherapie mit 5 mg/kg Infliximab und Erhaltungstherapie mit 10 mg/kg Infliximab. Es erfolgten wiederholte Infusionen in den Wochen 2 und 6 und danach alle acht Wochen. In Woche 30 erzielte ein signifikant höherer Anteil an Patienten in der kombinierten Infliximab- Erhaltungstherapiegruppe (42%) eine klinische Remission, verglichen mit den Patienten der Placebo- Erhaltungstherapiegruppe (21%). Die mediane Zeit bis zum Verlust des Ansprechens betrug 46 Wochen in der kombinierten Infliximab-Erhaltungstherapiegruppe versus 19 Wochen in der Placebo-Erhaltungstherapiegruppe (p < 0,001). Subgruppenanalysen der in der Indikation angegebenen Population erbrachten entsprechende Ergebnisse (siehe Abschnitt 4.1). Eine Verbesserung der Parameter der Lebensqualität wurde sowohl für den IBDQ-als auch für den SF- 36-Score in der Infliximab-Erhaltungstherapiegruppe im Vergleich zur Placebo- Erhaltungstherapiegruppe in 30. Woche erzielt (p < 0,001). Die Verträglichkeit und Wirksamkeit wurde auch in einer randomisierten, Placebo-kontrollierten Doppelblindstudie an 94 Patienten mit Fistelbildung bei Morbus Crohn überprüft, deren Fisteln mindestens seit 3 Monaten bestanden. Einunddreißig dieser Patienten wurden mit 5 mg/kg Infliximab behandelt. Ungefähr 93% der Patienten hatten vorher eine antibiotische oder immunsuppressive Behandlung erhalten. Die gleichzeitige Verabreichung stabiler Dosen konventioneller Therapien war zulässig und 83% der Patienten erhielten weiterhin mindestens eines dieser Arzneimittel. Die Patienten erhielten dreimalig, in Woche 0, 2 und 6, eine Dosis Placebo oder Infliximab. Das Follow-up der Patienten dauerte 26 Wochen. Der primäre Endpunkt war der Anteil der Patienten, die ein klinisches Ansprechen aufwiesen, ohne dass die Medikation erhöht oder chirurgische Maßnahmen durchgeführt wurden. Das klinische Ansprechen wurde definiert als 50% Reduktion der Anzahl der auf leichten Druck sezernierenden Fisteln bezogen auf die Ausgangszahl der Fisteln bei mindestens zwei aufeinander folgenden Untersuchungen (4 Wochen Abstand). Bei 68% (21/31) der mit Infliximab behandelten Patienten, die eine Dosierung von 5 mg/kg erhielten, wurde im Vergleich zu 26% (8/31) der mit Placebo behandelten Patienten ein klinisches Ansprechen erreicht (p = 0,002). Die mittlere Zeit bis zum Einsetzen des Ansprechens der mit Infliximab behandelten Gruppe betrug 2 Wochen. Die mittlere Dauer des Ansprechens betrug 12 Wochen. Zusätzlich wurde bei 55% der mit Infliximab behandelten Patienten im Vergleich zu 13% der mit Placebo behandelten Patienten ein Verschluss aller Fisteln erreicht (p = 0,001). Die Verträglichkeit und Wirksamkeit von wiederholten Infusionen mit Infliximab bei Patienten mit Morbus Crohn mit Fistelbildung wurden in einer 1-jährigen Studie geprüft. Insgesamt erhielten 306 Patienten 3 Dosen von Infliximab 5 mg/kg in den Wochen 0, 2 und 6. Vor der Behandlung wiesen 87% der Patienten perianale Fisteln auf, 14% hatten Abdominalfisteln, 9% rektovaginale Fisteln. Der mediane CDAI-Score betrug Patienten, die auf die 3 Dosen (Definition des Ansprechens siehe Beschreibung der primären Zielgröße für die oben genannte Studie) ansprachen, wurden in Woche 14 in randomisierter Weise entweder Placebo oder Infliximab 5 mg/kg alle 8 Wochen bis Woche 46 zugewiesen. Eine signifikant längere Zeit bis zum Verlust des Ansprechens wurde bei der Gruppe der Patienten, die die Infliximab-Erhaltungstherapie erhalten hatte, festgestellt (p < 0,001). 15
16 Die mediane Zeit bis zum Verlust des Ansprechens betrug > 40 Wochen in der Infliximab- Behandlungsgruppe im Vergleich zu 14 Wochen in der Placebogruppe. Bei den meisten Patienten kam es zum Verlust des Ansprechens infolge einer Dosiserhöhung der Medikation zur Behandlung des Morbus Crohn und nicht aufgrund eines Rückgangs der Anzahl der sezernierenden Fisteln von < 50%. In Woche 54 zeigte sich in der Infliximab-Behandlungsgruppe eine größere Verbesserung des CDAI- Scores gegenüber dem Ausgangswert als in der Placebogruppe (p = 0,04). Hinsichtlich des Anteils der Patienten mit anhaltendem Verschluss aller Fisteln bis Woche 54, mit Symptomen wie Proktalgie, mit Abszessen und mit Harnwegsinfektionen und hinsichtlich der Anzahl neuer Fisteln während der Therapie bestand kein signifikanter Unterschied zwischen Placebo und Infliximab. Ankylosierende Spondylitis Die Wirksamkeit und die Verträglichkeit wurden in einer Prüfarzt-initiierten, placebokontrollierten, multizentrischen Doppelblindstudie zu Infliximab bei 70 Patienten mit aktiver ankylosierender Spondylitis (Krankheitsaktivität [Bath Ankylosing Spondylitis Disease Activity Index (BASDAI) Score > 4] und Schmerzen [NRS-Score > 4]) geprüft. Während der 3-monatigen doppelblinden Phase erhielten die Patienten in den Wochen 0, 2, 6 entweder Infliximab in einer Dosierung von 5 mg/kg oder Placebo (35 Patienten pro Gruppe). Ab Woche 12 wurden die Patienten der Placebogruppe auf Infliximab umgestellt, und alle Patienten erhielten dann Infliximab 5 mg/kg alle 6 Wochen bis Woche 54. Die Behandlung mit Infliximab führte zu einer Besserung der Symptomatik, beurteilt anhand des BASDAI, wobei 57% der mit Infliximab behandelten Patienten eine Reduktion des BASDAI-Scores um mindestens 50% gegenüber dem Ausgangswert erzielten (der mittlere Ausgangsscore betrug 6,5 in der Infliximab-Behandlungsgruppe und 6,3 in der Placebogruppe), verglichen mit 9% der Patienten der Placebogruppe (p < 0,01). Eine Besserung wurde in Woche 2 festgestellt und konnte bis Woche 54 aufrechterhalten werden. Es wurde auch eine entsprechende Verbesserung der Leistungsfähigkeit und der Lebensqualität (SF36) erzielt. In dieser Studie wurde eine Wirksamkeit bei HLA-B27-negativen Patienten nicht belegt (n = 7). 5.2 Pharmakokinetische Eigenschaften Einmalige intravenöse Infusionen von 1, 3, 5, 10 oder 20 mg/kg Infliximab führten zu einem linearen, dosisproportionalen Anstieg der maximalen Serumkonzentration (C max ) sowie der Fläche unter der Konzentration-Zeit-Kurve (AUC). Das Verteilungsvolumen im Steady State (mittleres V d von 3,0 bis 4,1 Liter) war von der verabreichten Dosis unabhängig und deutete darauf hin, dass Infliximab hauptsächlich in das vaskuläre Kompartiment verteilt wird. Eine Zeitabhängigkeit der Pharmakokinetik wurde nicht beobachtet. Die Eliminationswege für Infliximab wurden nicht ermittelt. Im Urin wurde kein unverändertes Infliximab nachgewiesen. Es wurden keine wesentlichen altersbedingten oder vom Körpergewicht abhängigen Unterschiede hinsichtlich der Clearance oder des Verteilungsvolumens bei Patienten mit rheumatoider Arthritis beobachtet. Die Pharmakokinetik von Infliximab wurde bei geriatrischen Patienten nicht untersucht. Untersuchungen an Patienten mit Leber- und Nierenerkrankungen wurden nicht durchgeführt. Bei Einzeldosen von 3, 5 oder 10 mg/kg betrugen die mittleren Werte für C max 77, 118 bzw. 277 Mikrogramm/ml. Die mittlere terminale Halbwertszeit war bei diesen Dosen im Bereich von 8 bis 9,5 Tagen. Bei den meisten Patienten konnte Infliximab bei der empfohlenen Einzeldosis von 5 mg/kg für Morbus Crohn und der Erhaltungsdosis von 3 mg/kg alle 8 Wochen für rheumatoide Arthritis über mindestens 8 Wochen im Serum nachgewiesen werden. Die wiederholte Anwendung von Infliximab (5 mg/kg in den Wochen 0, 2 und 6 bei Morbus Crohn mit Fistelbildung, 3 mg/kg oder 10 mg/kg alle 4 oder 8 Wochen bei rheumatoider Arthritis) führte nach der Applikation der zweiten Dosis zu einer leichten Kumulation von Infliximab im Serum. Im weiteren zeitlichen Verlauf wurde keine klinisch relevante Kumulation beschrieben. Nach der Anwendung dieses Therapieschemas war Infliximab bei den meisten Morbus-Crohn-Patienten mit Fisteln über 12 Wochen (Bereich von 4 28 Wochen) im Serum nachweisbar. 16
17 5.3 Präklinische Daten zur Sicherheit Infliximab zeigt keine Kreuzreaktion mit TNFα anderer Spezies als Mensch und Schimpanse. Daher sind die konventionellen Daten zur präklinischen Sicherheit von Infliximab beschränkt. Eine Studie zur Entwicklungstoxizität, die an Mäusen mit einem analogen Antikörper durchgeführt wurde, der die funktionelle Aktivität von murinem TNFα selektiv hemmt, lieferte keinen Hinweis auf eine maternale Toxizität, Embryotoxizität oder Teratogenität. In einer Studie zur Fertilität und zur allgemeinen reproduktiven Funktion war die Anzahl trächtiger Mäuse nach Anwendung des gleichen analogen Antikörpers reduziert. Es ist nicht geklärt, ob dieses Ergebnis auf die Wirkung auf männliche oder weibliche Tiere zurückzuführen ist. In einer Toxizitätsstudie über 6 Monate bei wiederholter Gabe an Mäusen, bei der derselbe analoge Antikörper gegen murinen TNFα verwendet wurde, wurden bei einigen der behandelten männlichen Mäuse kristalline Ablagerungen auf der Linsenkapsel beobachtet. Spezifische ophthalmologische Untersuchungen sind an Patienten bisher nicht durchgeführt worden, um die Bedeutung dieses Befundes für den Menschen zu ermitteln. Es wurden keine Langzeituntersuchungen durchgeführt, um das kanzerogene Potential von Infliximab zu beurteilen. Studien an TNFα-defizienten Mäusen zeigten keinen Anstieg an Tumoren bei Verwendung von bekannten Tumorinitiatoren und/oder Tumorpromotoren. 6. PHARMAZEUTISCHE ANGABEN 6.1 Hilfsstoffe Saccharose, Polysorbat 80, Dinatriumhydrogenphosphat, Natriumdihydrogenphosphat. 6.2 Inkompatibilitäten Da keine Verträglichkeitsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden. 6.3 Dauer der Haltbarkeit 3 Jahre. Die gebrauchsfertige Lösung ist bei Raumtemperatur (25 C) über 24 Stunden chemisch und physikalisch stabil Aus mikrobiologischer Sicht sollte das Präparat so bald wie möglich, jedoch innerhalb von 3 Stunden nach der Rekonstitution und Herstellung der gebrauchsfertigen Lösung appliziert werden. Wird die Lösung nicht unverzüglich appliziert, unterliegen Dauer und Bedingungen für die Aufbewahrung nach Rekonstitution der Verantwortung des Anwenders. Die Infusionslösung sollte innerhalb von 24 Stunden verwendet werden, sofern sie bei 2 C bis 8 C aufbewahrt wird. 6.4 Besondere Lagerungshinweise Bei 2 C 8 C lagern. Nicht einfrieren. 6.5 Art und Inhalt des Behältnisses Remicade wird als lyophilisiertes Pulver in Durchstechflaschen zum einmaligen Gebrauch (Typ 1) mit Gummistopfen und Aluminiumbördelverschluss, der durch eine Kunststoffkappe geschützt ist, geliefert. Remicade ist in Packungen mit 1, 2 oder 3 Durchstechflaschen verfügbar. Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht. 6.6 Hinweise für die Handhabung 1. Berechnen Sie die Dosis und die Anzahl der benötigten Remicade-Durchstechflaschen. Jede Remicade-Durchstechflasche enthält 100 mg Infliximab. Berechnen Sie das benötigte Gesamtvolumen an hergestellter Remicade-Lösung. 17
INFLECTRA (INFLIXIMAB): SICHERHEITSINFORMATION FÜR VERSCHREIBENDE ÄRZTE
 INFLECTRA (INFLIXIMAB): SICHERHEITSINFORMATION FÜR VERSCHREIBENDE ÄRZTE Infliximab kann mit schwerwiegenden, potentiell lebensbedrohlichen Nebenwirkungen einhergehen, die verhindert oder identifiziert
INFLECTRA (INFLIXIMAB): SICHERHEITSINFORMATION FÜR VERSCHREIBENDE ÄRZTE Infliximab kann mit schwerwiegenden, potentiell lebensbedrohlichen Nebenwirkungen einhergehen, die verhindert oder identifiziert
Gebrauchsinformation: Information für Patienten. Allernon 10 mg-tabletten Wirkstoff: Loratadin
 Gebrauchsinformation: Information für Patienten Allernon 10 mg-tabletten Wirkstoff: Loratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Patienten Allernon 10 mg-tabletten Wirkstoff: Loratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Anhang III. Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage
 Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
Cefavora - Tropfen. Gebrauchsinformation: Information für Anwender
 1 von 5 Cefavora - Tropfen Gebrauchsinformation: Information für Anwender Wirkstoffe: Ginkgo biloba Ø / Viscum album Ø / Crataegus Ø Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor sie mit
1 von 5 Cefavora - Tropfen Gebrauchsinformation: Information für Anwender Wirkstoffe: Ginkgo biloba Ø / Viscum album Ø / Crataegus Ø Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor sie mit
REMICADE 100 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
 1. BEZEICHNUNG DES ARZNEIMITTELS Pulver für ein Konzentrat zur Herstellung einer Infusionslösung. 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Jede Durchstechflasche enthält 100 mg Infliximab. Infliximab
1. BEZEICHNUNG DES ARZNEIMITTELS Pulver für ein Konzentrat zur Herstellung einer Infusionslösung. 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Jede Durchstechflasche enthält 100 mg Infliximab. Infliximab
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei akuten Hals- und Rachenschmerzen Belladonna D4/D6/D12
 Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei akuten Hals- und Rachenschmerzen Belladonna D4/D6/D12 Wirkstoff: Atropa bella-donna D4/D6/D12 Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei akuten Hals- und Rachenschmerzen Belladonna D4/D6/D12 Wirkstoff: Atropa bella-donna D4/D6/D12 Lesen Sie die gesamte Packungsbeilage
auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4.
 Seite 4 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Folsäure Heumann 5 mg Tabletten Folsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Seite 4 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Folsäure Heumann 5 mg Tabletten Folsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei Heiserkeit und Reizhusten Phosphorus D4/D6/D12
 Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei Heiserkeit und Reizhusten Phosphorus D4/D6/D12 Wirkstoff: Phosphorus D4/D6/D12 Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei Heiserkeit und Reizhusten Phosphorus D4/D6/D12 Wirkstoff: Phosphorus D4/D6/D12 Lesen Sie die gesamte Packungsbeilage sorgfältig
Mydocalm Filmtablette mit 50 mg Tolperisonhydrochlorid
 Gebrauchsinformation: Information für den Anwender Mydocalm Filmtablette mit 50 mg Tolperisonhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
Gebrauchsinformation: Information für den Anwender Mydocalm Filmtablette mit 50 mg Tolperisonhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
Calcineurininhibitoren zur topischen Anwendung: Pimecrolimus und Tacrolimus (Elidel, Douglan und Protopic )
 Calcineurininhibitoren zur topischen Anwendung: Pimecrolimus und Tacrolimus (Elidel, Douglan und Protopic ) Ergebnisse der europäischen Risiko- Bewertungs-Verfahren Anlass für die Risikobewertungsverfahren
Calcineurininhibitoren zur topischen Anwendung: Pimecrolimus und Tacrolimus (Elidel, Douglan und Protopic ) Ergebnisse der europäischen Risiko- Bewertungs-Verfahren Anlass für die Risikobewertungsverfahren
Behandlung mit Biologika (Biologicals), Stand 01/2011
 Stadtspital Triemli Zürich Klinik für Rheumatologie Birmensdorferstrasse 497 8063 Zürich www.triemli.ch KD Dr. med. Marcel Weber Chefarzt PATIENTENINFORMATION Chefarztsekretariat 044 466 23 02 Fax 044
Stadtspital Triemli Zürich Klinik für Rheumatologie Birmensdorferstrasse 497 8063 Zürich www.triemli.ch KD Dr. med. Marcel Weber Chefarzt PATIENTENINFORMATION Chefarztsekretariat 044 466 23 02 Fax 044
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN ECHINACIN MADAUS -TROPFEN. Wirkstoff: Presssaft aus Purpursonnenhutkraut
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN ECHINACIN MADAUS -TROPFEN Wirkstoff: Presssaft aus Purpursonnenhutkraut Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN ECHINACIN MADAUS -TROPFEN Wirkstoff: Presssaft aus Purpursonnenhutkraut Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. EXACYL 500 mg/5 ml Injektionslösung
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN EXACYL 500 mg/5 ml Injektionslösung Tranexamsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN EXACYL 500 mg/5 ml Injektionslösung Tranexamsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
1. Was ist Apis/Belladonna cum Mercurio und wofür wird es angewendet?
 WALA Gebrauchsinformation: Information für Anwender Apis/Bella-donna cum Mercurio Wirkstoffe: Apis mellifica ex animale toto Gl Dil. D4, Atropa bella-donna e fructibus maturis ferm 33a Dil. D3, Mercurius
WALA Gebrauchsinformation: Information für Anwender Apis/Bella-donna cum Mercurio Wirkstoffe: Apis mellifica ex animale toto Gl Dil. D4, Atropa bella-donna e fructibus maturis ferm 33a Dil. D3, Mercurius
Ihr Wegweiser zu. Information für Patienten
 Ihr Wegweiser zu Information für Patienten Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Sie können
Ihr Wegweiser zu Information für Patienten Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Sie können
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Terbinafin HCL acis 10 mg/g Creme Wirkstoff: Terbinafinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Terbinafin HCL acis 10 mg/g Creme Wirkstoff: Terbinafinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
Anhang III. Ergänzungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Ergänzungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage 20 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS [Der unten genannte Wortlaut
Anhang III Ergänzungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage 20 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS [Der unten genannte Wortlaut
Wortlaut der für die Packungsbeilage vorgesehenen Angaben
 Zulassungsnummer: 6312395.00.00 Seite 1 von 5 Apothekenpflichtig TUSSISANA Mischung 20 und 50 ml Stoff Darreichungsform Menge Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation:
Zulassungsnummer: 6312395.00.00 Seite 1 von 5 Apothekenpflichtig TUSSISANA Mischung 20 und 50 ml Stoff Darreichungsform Menge Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation:
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Legalon SIL - Trockensubstanz zur Infusionsbereitung
 PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
GEBRAUCHSINFORMATION Purevax RCPCh Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension
 GEBRAUCHSINFORMATION Purevax RCPCh Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR
GEBRAUCHSINFORMATION Purevax RCPCh Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR
MediPreis Produktsteckbrief
 MediPreis Produktsteckbrief DOCPELIN NACHTSTERNE DOCPELIN Nachtsterne Filmtabletten Pelikan-Apotheke PZN: 04386054 Menge: 20 St Art: Filmtabletten Link: https://www.medipreis.de/04386054 Anwendungsgebiete
MediPreis Produktsteckbrief DOCPELIN NACHTSTERNE DOCPELIN Nachtsterne Filmtabletten Pelikan-Apotheke PZN: 04386054 Menge: 20 St Art: Filmtabletten Link: https://www.medipreis.de/04386054 Anwendungsgebiete
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Remicade 100 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung. 2. QUALITATIVE UND QUANTITATIVE
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Remicade 100 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung. 2. QUALITATIVE UND QUANTITATIVE
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Aspirine 500 Brause, 500 mg, Brausetabletten Acetylsalicylsäure
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Aspirine 500 Brause, 500 mg, Brausetabletten Acetylsalicylsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Aspirine 500 Brause, 500 mg, Brausetabletten Acetylsalicylsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
INHALTSVERZEICHNIS.
 INHALTSVERZEICHNIS 1. Einleitung 1 1.1. Geschichte der Nierentransplantation 1 1.2. Geschichte von Ciclosporin 3 1.3. Nomenklatur von Ciclosporin ' 4 1.4. Ciclosporin: chemische Struktur, physikalische
INHALTSVERZEICHNIS 1. Einleitung 1 1.1. Geschichte der Nierentransplantation 1 1.2. Geschichte von Ciclosporin 3 1.3. Nomenklatur von Ciclosporin ' 4 1.4. Ciclosporin: chemische Struktur, physikalische
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Vom unklaren Symptomkomplex zur ganzheitlichen Diagnose
 Morbus Fabry - Niereninsuffizienz Kardiomyopathie Neurologische Störungen - Vom unklaren Sympto Morbus Fabry Niereninsuffizienz Kardiomyopathie Neurologische Störungen Vom unklaren Symptomkomplex zur ganzheitlichen
Morbus Fabry - Niereninsuffizienz Kardiomyopathie Neurologische Störungen - Vom unklaren Sympto Morbus Fabry Niereninsuffizienz Kardiomyopathie Neurologische Störungen Vom unklaren Symptomkomplex zur ganzheitlichen
Captin Zäpfchen 500 mg sind erhältlich in Packungen mit 10 Zäpfchen (N1). Schmerzstillendes und fiebersenkendes Arzneimittel
 Gebrauchsinformation Liebe Patientin, lieber Patient! Bitte lesen Sie folgende Gebrauchsinformation aufmerksam, weil sie wichtige Informationen darüber enthält, was Sie bei der Anwendung dieses Arzneimittels
Gebrauchsinformation Liebe Patientin, lieber Patient! Bitte lesen Sie folgende Gebrauchsinformation aufmerksam, weil sie wichtige Informationen darüber enthält, was Sie bei der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Anwender. nasic - Nasenspray für Kinder 5 mg/500 mg. Xylometazolinhydrochlorid 5 mg + Dexpanthenol 500 mg
 Gebrauchsinformation: Information für Anwender nasic - Nasenspray für Kinder 5 mg/500 mg Xylometazolinhydrochlorid 5 mg + Dexpanthenol 500 mg Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor
Gebrauchsinformation: Information für Anwender nasic - Nasenspray für Kinder 5 mg/500 mg Xylometazolinhydrochlorid 5 mg + Dexpanthenol 500 mg Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor
VASOCEDINE PSEUDOEPHEDRINE 60 mg, Filmtabletten Pseudoephedrinhydrochlorid
 VASOCEDINE PSEUDOEPHEDRINE 60 mg, Filmtabletten Pseudoephedrinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen. - Heben Sie
VASOCEDINE PSEUDOEPHEDRINE 60 mg, Filmtabletten Pseudoephedrinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen. - Heben Sie
Ödeme, Hypertonie und Herzinsuffizienz wurden im Zusammenhang mit NSAID - Behandlung berichtet.
 Alle rezeptpflichtigen nicht-selektiven NSAIDs zur systemischen Anwendung Für alle Präparate ohne fixes Dosierungsschema: 4.2. Dosierung, Art und Dauer der Anwendung 4.3. Gegenanzeigen Schwere Herzinsuffizienz
Alle rezeptpflichtigen nicht-selektiven NSAIDs zur systemischen Anwendung Für alle Präparate ohne fixes Dosierungsschema: 4.2. Dosierung, Art und Dauer der Anwendung 4.3. Gegenanzeigen Schwere Herzinsuffizienz
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Remicade 100 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung. 2. QUALITATIVE UND QUANTITATIVE
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Remicade 100 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung. 2. QUALITATIVE UND QUANTITATIVE
Gebrauchsinformation: Information für Anwender. Euphrasia D3 Augentropfen Weleda
 1/5 Gebrauchsinformation: Information für Anwender Euphrasia D3 Augentropfen Weleda Wirkstoff: Euphrasia officinalis D3 Dilution Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
1/5 Gebrauchsinformation: Information für Anwender Euphrasia D3 Augentropfen Weleda Wirkstoff: Euphrasia officinalis D3 Dilution Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Patienteninformation
 I Patientenaufklärung und Einverständniserklärung Liebe Patientin, lieber Patient! Sie leiden unter einer Erkrankung des rheumatischen Formenkreises. Dazu zählen sowohl entzündliche (Arthritis) als auch
I Patientenaufklärung und Einverständniserklärung Liebe Patientin, lieber Patient! Sie leiden unter einer Erkrankung des rheumatischen Formenkreises. Dazu zählen sowohl entzündliche (Arthritis) als auch
MabThera wird bei Erwachsenen zur Behandlung folgender Erkrankungen angewendet:
 EMA/614203/2010 EMEA/H/C/000165 Zusammenfassung des EPAR für die Öffentlichkeit Rituximab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. in dem erläutert wird,
EMA/614203/2010 EMEA/H/C/000165 Zusammenfassung des EPAR für die Öffentlichkeit Rituximab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. in dem erläutert wird,
Sachverständigenausschuss für Verschreibungspflicht (SVA) 72. Sitzung, TOP 7 Famciclovir
 Sachverständigenausschuss für Verschreibungspflicht (SVA) 72. Sitzung, TOP 7 Famciclovir Antrag auf Entlassung aus der Verschreibungspflicht Famciclovir zur oralen Behandlung von rezidivierenden Episoden
Sachverständigenausschuss für Verschreibungspflicht (SVA) 72. Sitzung, TOP 7 Famciclovir Antrag auf Entlassung aus der Verschreibungspflicht Famciclovir zur oralen Behandlung von rezidivierenden Episoden
Mitteilung des Bundesamts für Sicherheit im Gesundheitswesen über Maßnahmen zur Gewährleistung der Arzneimittelsicherheit:
 Landeshauptleute Landessanitätsdirektionen Österreichische Apothekerkammer Österreichische Ärztekammer Landesärztekammern Anstaltsapotheken d. Universitätskliniken Datum: 16.11.2015 Kontakt: Mag. Rudolf
Landeshauptleute Landessanitätsdirektionen Österreichische Apothekerkammer Österreichische Ärztekammer Landesärztekammern Anstaltsapotheken d. Universitätskliniken Datum: 16.11.2015 Kontakt: Mag. Rudolf
Tropfen, Sirup, Suppositorien «neue Dosierung» Husten und Reizhusten bei Erkältungen. Zusammensetzung
 Tropfen, Sirup, «neue Dosierung» Husten und Reizhusten bei Erkältungen Zusammensetzung Wirkstoffe Tropfen Sirup (1 ml = 32 10 ml = 2 Tropfen) Messlöffel) Noscapinum HCl 15,12 mg 30 mg (Mikrokapseln) Extract.
Tropfen, Sirup, «neue Dosierung» Husten und Reizhusten bei Erkältungen Zusammensetzung Wirkstoffe Tropfen Sirup (1 ml = 32 10 ml = 2 Tropfen) Messlöffel) Noscapinum HCl 15,12 mg 30 mg (Mikrokapseln) Extract.
Gebrauchsinformation: Information für Anwender. APOZEMA Blutarmut China complex Nr.38-Tropfen
 Gebrauchsinformation: Information für Anwender APOZEMA Blutarmut China complex Nr.38-Tropfen Wirkstoffe: China Dil. D5, Arsenicum album Dil. D6, Chininum arsenicosum Dil D6 und Pulsatilla Dil. D4 Lesen
Gebrauchsinformation: Information für Anwender APOZEMA Blutarmut China complex Nr.38-Tropfen Wirkstoffe: China Dil. D5, Arsenicum album Dil. D6, Chininum arsenicosum Dil D6 und Pulsatilla Dil. D4 Lesen
GEBRAUCHSINFORMATION Previcox 57 mg Kautabletten für Hunde Previcox 227 mg Kautabletten für Hunde
 GEBRAUCHSINFORMATION Previcox 57 mg Kautabletten für Hunde Previcox 227 mg Kautabletten für Hunde 1. NAME/FIRMA UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR
GEBRAUCHSINFORMATION Previcox 57 mg Kautabletten für Hunde Previcox 227 mg Kautabletten für Hunde 1. NAME/FIRMA UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Levocetirizin Genericon 5 mg Filmtabletten. Levocetirizindihydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Levocetirizin Genericon 5 mg Filmtabletten Levocetirizindihydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Levocetirizin Genericon 5 mg Filmtabletten Levocetirizindihydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
1. WAS IST DAFALGAN Zäpfchen UND WOFÜR WIRD ES ANGEWENDET?
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DAFALGAN Säuglinge 80 mg Zäpfchen DAFALGAN Kleinkinder 150 mg Zäpfchen DAFALGAN große Kinder 300 mg Zäpfchen Paracetamol Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DAFALGAN Säuglinge 80 mg Zäpfchen DAFALGAN Kleinkinder 150 mg Zäpfchen DAFALGAN große Kinder 300 mg Zäpfchen Paracetamol Lesen Sie die gesamte Packungsbeilage
Mesalazin bei Colitis ulcerosa Sind alle therapeutischen Möglichkeiten ausgereizt?
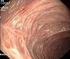 Mesalazin bei Colitis ulcerosa Sind alle therapeutischen Möglichkeiten ausgereizt? Von Prof. Dr. med. Stefan Schreiber Berlin (3. Oktober 2008) - Seit 1940 erstmals Sulfasalazine zur Therapie der entzündlichen
Mesalazin bei Colitis ulcerosa Sind alle therapeutischen Möglichkeiten ausgereizt? Von Prof. Dr. med. Stefan Schreiber Berlin (3. Oktober 2008) - Seit 1940 erstmals Sulfasalazine zur Therapie der entzündlichen
1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE VERANTWORTLICH IST
 GEBRAUCHSINFORMATION Zylexis Lyophilisat und Lösungsmittel zur Herstellung einer Suspension zur Injektion für Hunde, Katzen, Pferde, Rinder und Schweine 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND,
GEBRAUCHSINFORMATION Zylexis Lyophilisat und Lösungsmittel zur Herstellung einer Suspension zur Injektion für Hunde, Katzen, Pferde, Rinder und Schweine 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND,
Phase I Studie: Bendamustin bei Patienten mit Niereninsuffizienz. Preiss et al. (2003) The Hematology Journal, Vol. 4, Suppl.
 Phase I Studie: Bendamustin bei Patienten mit Niereninsuffizienz Preiss et al. (2003) The Hematology Journal, Vol. 4, Suppl. 1, Abstract 394 Ziele der Studie Untersuchung der Pharmakokinetik und des renalen
Phase I Studie: Bendamustin bei Patienten mit Niereninsuffizienz Preiss et al. (2003) The Hematology Journal, Vol. 4, Suppl. 1, Abstract 394 Ziele der Studie Untersuchung der Pharmakokinetik und des renalen
Frage: Führt die antibiotische Behandlung der Helicobacter pylori Infektion bei Patienten mit funktioneller Dyspepsie zur Beschwerdefreiheit?
 Funktionelle Dyspepsie: Bei Patienten mit positivem Helicobacter pylori Nachweis hilft eine Eradikation, wenn überhaupt nur wenigen Patienten (Resultate von 2 Studien) Frage: Führt die antibiotische Behandlung
Funktionelle Dyspepsie: Bei Patienten mit positivem Helicobacter pylori Nachweis hilft eine Eradikation, wenn überhaupt nur wenigen Patienten (Resultate von 2 Studien) Frage: Führt die antibiotische Behandlung
GEBRAUCHSINFORMATION Eurican SHPPi2LT Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension für Hunde
 GEBRAUCHSINFORMATION Eurican SHPPi2LT Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension für Hunde 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS,
GEBRAUCHSINFORMATION Eurican SHPPi2LT Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension für Hunde 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS,
Folsan 5 mg Tabletten
 1 Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation: Information für den Anwender Folsan 5 mg Tabletten Wirkstoff: Folsäure Lesen Sie die gesamte Packungsbeilage sorgfältig
1 Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation: Information für den Anwender Folsan 5 mg Tabletten Wirkstoff: Folsäure Lesen Sie die gesamte Packungsbeilage sorgfältig
MEDICA HALSSPRAY MENTHOL, 20 mg/10 ml; 5 mg/10 ml, Spray zur Anwendung in der Mundhöhle Chlorhexidingluconat - Lidocain Hydrochlorid
 MEDICA HALSSPRAY MENTHOL, 20 mg/10 ml; 5 mg/10 ml, Spray zur Anwendung in der Mundhöhle Chlorhexidingluconat - Lidocain Hydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
MEDICA HALSSPRAY MENTHOL, 20 mg/10 ml; 5 mg/10 ml, Spray zur Anwendung in der Mundhöhle Chlorhexidingluconat - Lidocain Hydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Gebrauchsinformation: Information für den Anwender
 Gebrauchsinformation: Information für den Anwender Microlax Rektallösung Natriumcitrat 450 mg/5 ml Dodecyl(sulfoacetat), Natriumsalz 70 % 64,5 mg/5 ml Sorbitol-Lösung 70 % (kristallisierend) (Ph.Eur.)
Gebrauchsinformation: Information für den Anwender Microlax Rektallösung Natriumcitrat 450 mg/5 ml Dodecyl(sulfoacetat), Natriumsalz 70 % 64,5 mg/5 ml Sorbitol-Lösung 70 % (kristallisierend) (Ph.Eur.)
GEBRAUCHSINFORMATION Information für den Anwender
 GEBRAUCHSINFORMATION Information für den Anwender ViroMed 400 mg - Tabletten Wirkstoff: Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
GEBRAUCHSINFORMATION Information für den Anwender ViroMed 400 mg - Tabletten Wirkstoff: Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
GEBRAUCHSINFORMATION: Information für den Anwender
 Wortlaut der für die Gebrauchsinformation vorgesehenen Angaben GEBRAUCHSINFORMATION: Information für den Anwender Dexagel 1 g viskosierte Augentropfen enthält 0,985 mg Dexamethasondihydrogenphosphat-Dinatrium
Wortlaut der für die Gebrauchsinformation vorgesehenen Angaben GEBRAUCHSINFORMATION: Information für den Anwender Dexagel 1 g viskosierte Augentropfen enthält 0,985 mg Dexamethasondihydrogenphosphat-Dinatrium
Neues subkutanes Immunglobulin. Hochkonzentriert. High-Speed. Hizentra. Immune Globulin Subcutaneous (Human) 20%Liquid
 Neues subkutanes Immunglobulin Hochkonzentriert. High-Speed. Hizentra. Hizentra bietet Hohe Konzentration und geringes Infusionsvolumen Kurze Infusionsdauer Exzellenten Infektionsschutz Sehr gute Verträglichkeit
Neues subkutanes Immunglobulin Hochkonzentriert. High-Speed. Hizentra. Hizentra bietet Hohe Konzentration und geringes Infusionsvolumen Kurze Infusionsdauer Exzellenten Infektionsschutz Sehr gute Verträglichkeit
Rheumatische Erkrankungen: Grundsätze der Therapie
 Rheumatische Erkrankungen: Grundsätze der Therapie Kausale (kurative) Therapie nur in experimentellen Ansätzen möglich Verhinderung von Schmerz und Behinderung Kombination aus verschiedenen Medikamenten
Rheumatische Erkrankungen: Grundsätze der Therapie Kausale (kurative) Therapie nur in experimentellen Ansätzen möglich Verhinderung von Schmerz und Behinderung Kombination aus verschiedenen Medikamenten
Eisenmangel. 1. Definitionen. 2. Risikogruppen. 3. Hepcidin und Eisenhaushalt. 4. Diagnostik des Eisenmangels. 5. Therapie des Eisenmangels
 1. Definitionen 2. Risikogruppen 3. Hepcidin und Eisenhaushalt 4. Diagnostik des s 5. Therapie des s Eisendefiziente ohne Anämie Leere Eisenspeicher Normaler Zustand Leere Speicher ohne Anämie anämie anämie
1. Definitionen 2. Risikogruppen 3. Hepcidin und Eisenhaushalt 4. Diagnostik des s 5. Therapie des s Eisendefiziente ohne Anämie Leere Eisenspeicher Normaler Zustand Leere Speicher ohne Anämie anämie anämie
Gebrauchsinformation: Information für Patienten. Stärkungsmittel Similasan
 1/5 Gebrauchsinformation: Information für Patienten Stärkungsmittel Similasan Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie
1/5 Gebrauchsinformation: Information für Patienten Stärkungsmittel Similasan Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie
Gebrauchsinformation: Information für Anwender. PRANOX 0,1 %, Augentropfen. Pranoprofen
 Gebrauchsinformation: Information für Anwender PRANOX 0,1 %, Augentropfen Pranoprofen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Anwender PRANOX 0,1 %, Augentropfen Pranoprofen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
FAKTEN. Migräne. von Stefan Evers. 1. Auflage. Thieme Verlag C.H. Beck im Internet: ISBN
 FAKTEN. Migräne von Stefan Evers 1. Auflage Thieme 2006 Verlag C.H. Beck im Internet: www.beck.de ISBN 78 3 13 143631 3 schnell und portofrei erhältlich bei beck-shop.de DIE FACHBUCHHANDLUNG 78 7 Besondere
FAKTEN. Migräne von Stefan Evers 1. Auflage Thieme 2006 Verlag C.H. Beck im Internet: www.beck.de ISBN 78 3 13 143631 3 schnell und portofrei erhältlich bei beck-shop.de DIE FACHBUCHHANDLUNG 78 7 Besondere
Gebrauchsinformation: Information für Anwender. Azyter 15 mg/g Augentropfen im Einzeldosisbehältnis Azithromycin 2 H 2 O
 Gebrauchsinformation: Information für Anwender Azyter 15 mg/g Augentropfen im Einzeldosisbehältnis Azithromycin 2 H 2 O Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Gebrauchsinformation: Information für Anwender Azyter 15 mg/g Augentropfen im Einzeldosisbehältnis Azithromycin 2 H 2 O Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. VITAMINE B12 STEROP 1mg/1ml Injektionslösung Lösung zum Einnehmen. Cyanocobalamin
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER VITAMINE B12 STEROP 1mg/1ml Injektionslösung Lösung zum Einnehmen Cyanocobalamin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER VITAMINE B12 STEROP 1mg/1ml Injektionslösung Lösung zum Einnehmen Cyanocobalamin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Gebrauchsinformation: Information für Patienten. Omega-3-Säurenethylester 90
 Gebrauchsinformation: Information für Patienten omega-3 biomo 1000 mg Weichkapseln Omega-3-Säurenethylester 90 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Gebrauchsinformation: Information für Patienten omega-3 biomo 1000 mg Weichkapseln Omega-3-Säurenethylester 90 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Empfehlungen zur Antibiotikaverschreibung bei häufigen ambulant erworbenen Infektionen. Kriterien für die Antibiotikaverschreibung
 Empfehlungen zur Antibiotikaverschreibung bei häufigen ambulant erworbenen Infektionen für Sentinella Ärzte und Ärztinnen Kriterien für die Antibiotikaverschreibung Sentinella, Pediatric Infectious Disease
Empfehlungen zur Antibiotikaverschreibung bei häufigen ambulant erworbenen Infektionen für Sentinella Ärzte und Ärztinnen Kriterien für die Antibiotikaverschreibung Sentinella, Pediatric Infectious Disease
B. PACKUNGSBEILAGE 1
 B. PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION FÜR Metomotyl 2,5 mg/ml Injektionslösung für Katzen und Hunde 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR
B. PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION FÜR Metomotyl 2,5 mg/ml Injektionslösung für Katzen und Hunde 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Dexagenta-POS 5 mg/ml + 1 mg/ml Augentropfen, Lösung
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Dexagenta-POS 5 mg/ml + 1 mg/ml Augentropfen, Lösung Gentamicinsulfat Dexamethasondihydrogenphosphat-Dinatrium Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Dexagenta-POS 5 mg/ml + 1 mg/ml Augentropfen, Lösung Gentamicinsulfat Dexamethasondihydrogenphosphat-Dinatrium Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Patienten
 Gebrauchsinformation: Information für Patienten AFLUBIN -Grippetabletten Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie enthält
Gebrauchsinformation: Information für Patienten AFLUBIN -Grippetabletten Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie enthält
1. Was sind Dorithricin Halstabletten und wofür werden sie angewendet?
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Dorithricin - Halstabletten Wirkstoffe: Tyrothricin, Benzalkoniumchlorid, Benzocain Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Dorithricin - Halstabletten Wirkstoffe: Tyrothricin, Benzalkoniumchlorid, Benzocain Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Mirfulan. Salbe. täglich auftragen. Vitaminreiche Wund- und Heilsalbe
 1 Mirfulan Salbe Dosierung: Je nach Bedarf mehrmals täglich auftragen. Patienteninformation Bitte aufmerksam lesen! Vitaminreiche Wund- und Heilsalbe 2 Liebe Patientin, lieber Patient! Bitte lesen Sie
1 Mirfulan Salbe Dosierung: Je nach Bedarf mehrmals täglich auftragen. Patienteninformation Bitte aufmerksam lesen! Vitaminreiche Wund- und Heilsalbe 2 Liebe Patientin, lieber Patient! Bitte lesen Sie
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Fasturtec 1,5 mg/ml Pulver und Lösungsmittel zur Herstellung eines Infusionslösungskonzentrats Rasburicase Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Anwender Fasturtec 1,5 mg/ml Pulver und Lösungsmittel zur Herstellung eines Infusionslösungskonzentrats Rasburicase Lesen Sie die gesamte Packungsbeilage sorgfältig
Allergie-Ratgeber. Spezifische Immuntherapie (Hyposensibilisierung)
 Allergie-Ratgeber Spezifische Immuntherapie (Hyposensibilisierung) Gezielt das Immunsystem neu lernen lassen Bei einer Allergie reagiert das Immunsystem auf einen an sich harmlosen, körperfremden Stoff
Allergie-Ratgeber Spezifische Immuntherapie (Hyposensibilisierung) Gezielt das Immunsystem neu lernen lassen Bei einer Allergie reagiert das Immunsystem auf einen an sich harmlosen, körperfremden Stoff
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Skinoren 20% Creme. Wirkstoff: Azelainsäure
 1 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Skinoren 20% Creme Wirkstoff: Azelainsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
1 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Skinoren 20% Creme Wirkstoff: Azelainsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Patienten
 1/5 Gebrauchsinformation: Information für Patienten Tropfen gegen starkes Schwitzen Similasan Wirkstoffe: Aristolochia clematitis D12, Salvia officinalis D10, Sambucus nigra D6 Lesen Sie die gesamte Packungsbeilage
1/5 Gebrauchsinformation: Information für Patienten Tropfen gegen starkes Schwitzen Similasan Wirkstoffe: Aristolochia clematitis D12, Salvia officinalis D10, Sambucus nigra D6 Lesen Sie die gesamte Packungsbeilage
AUFKLÄRUNGSBLATT* ZUR IMPFUNG GEGEN DIE FSME (Frühsommer-Meningoenzephalitis) *(Auszug aus den jeweiligen Packungsinformationen)
 AUFKLÄRUNGSBLATT* ZUR IMPFUNG GEGEN DIE FSME (Frühsommer-Meningoenzephalitis) *(Auszug aus den jeweiligen Packungsinformationen) Lesen Sie die gesamte Information sorgfältig durch, bevor Sie sich bzw.
AUFKLÄRUNGSBLATT* ZUR IMPFUNG GEGEN DIE FSME (Frühsommer-Meningoenzephalitis) *(Auszug aus den jeweiligen Packungsinformationen) Lesen Sie die gesamte Information sorgfältig durch, bevor Sie sich bzw.
Gebrauchsinformation: Information für Patienten. Allergodil 0,5 mg/ml Augentropfen. Azelastinhydrochlorid
 Gebrauchsinformation: Information für Patienten Allergodil 0,5 mg/ml Augentropfen Azelastinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Patienten Allergodil 0,5 mg/ml Augentropfen Azelastinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Wirkstoff: Natriumchondroitinsulfat
 Gebrauchsinformation: Information für Anwender CONDROSULF 800 mg - Tabletten Wirkstoff: Natriumchondroitinsulfat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Gebrauchsinformation: Information für Anwender CONDROSULF 800 mg - Tabletten Wirkstoff: Natriumchondroitinsulfat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
XGEVA 120 mg (Denosumab)
 München, 03.09.2014 XGEVA 120 mg (Denosumab) Wichtige aktualisierte Informationen für Angehörige der medizinischen Heilberufe, um die Risiken für das Auftreten von n und n zu minimieren. Sehr geehrte Frau
München, 03.09.2014 XGEVA 120 mg (Denosumab) Wichtige aktualisierte Informationen für Angehörige der medizinischen Heilberufe, um die Risiken für das Auftreten von n und n zu minimieren. Sehr geehrte Frau
Gebrauchsinformation: Information für den Anwender. APOZEMA Bluthochdruck Crataegus complex Nr.10-Tropfen
 Gebrauchsinformation: Information für den Anwender APOZEMA Bluthochdruck Crataegus complex Nr.10-Tropfen Wirkstoffe: Crataegus Dil. D4, Arnica Dil. D4, Aurum chloratum natronatum Dil. D5, Barium jodatum
Gebrauchsinformation: Information für den Anwender APOZEMA Bluthochdruck Crataegus complex Nr.10-Tropfen Wirkstoffe: Crataegus Dil. D4, Arnica Dil. D4, Aurum chloratum natronatum Dil. D5, Barium jodatum
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Tantum Verde - Lösung zum Gurgeln Wirkstoff: Benzydaminhydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tantum Verde - Lösung zum Gurgeln Wirkstoff: Benzydaminhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tantum Verde - Lösung zum Gurgeln Wirkstoff: Benzydaminhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Gebrauchsinformation: Information für Patienten
 Gebrauchsinformation: Information für Patienten Esberitox -Tabletten Trockenextrakt aus einer Mischung von Lebensbaumspitzen und -blättern, Purpursonnenhutwurzel, Blassfarbener Sonnenhutwurzel und Färberhülsenwurzel
Gebrauchsinformation: Information für Patienten Esberitox -Tabletten Trockenextrakt aus einer Mischung von Lebensbaumspitzen und -blättern, Purpursonnenhutwurzel, Blassfarbener Sonnenhutwurzel und Färberhülsenwurzel
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Pentasa 1 g - Zäpfchen Wirkstoff: Mesalazin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Anwender Pentasa 1 g - Zäpfchen Wirkstoff: Mesalazin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. VITALIPID Novum Adult / Infant Konzentrat zur Herstellung einer Infusionslösung
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER VITALIPID Novum Adult / Infant Konzentrat zur Herstellung einer Infusionslösung Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER VITALIPID Novum Adult / Infant Konzentrat zur Herstellung einer Infusionslösung Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Behandlung von Migräne-Anfällen (insbesondere sehr lange Anfälle), wenn andere Therapien nicht wirksam oder nicht indiziert sind.
 Gebrauchsinformation: Information für Patienten Ergo-Kranit Migräne 2 mg Tabletten Wirkstoff: Ergotamintartrat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Gebrauchsinformation: Information für Patienten Ergo-Kranit Migräne 2 mg Tabletten Wirkstoff: Ergotamintartrat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Chronisch entzündliche Darmerkrankungen. Prof. Dr. Tamás Decsi Kinderklinik, UNI Pécs
 Chronisch entzündliche Darmerkrankungen Prof. Dr. Tamás Decsi Kinderklinik, UNI Pécs Häufigkeit: Morbus Crohn In den letzten Jahren haben die Inzidenz und die Prävalenz (verbesserte Lebenserwartung) stetig
Chronisch entzündliche Darmerkrankungen Prof. Dr. Tamás Decsi Kinderklinik, UNI Pécs Häufigkeit: Morbus Crohn In den letzten Jahren haben die Inzidenz und die Prävalenz (verbesserte Lebenserwartung) stetig
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Methylprednisolonaceponat
 1 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Advantan - dermatologische Lösung Methylprednisolonaceponat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
1 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Advantan - dermatologische Lösung Methylprednisolonaceponat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
O f f e n e S t u d i e n - August 2013 -
 Sehr geehrte Patientinnen und Angehörige, sehr geehrte Ärztinnen und Ärzte, Klinische Studien zur Behandlung des Ovarial-, Tuben-, Endometrium- und Peritonealkarzinoms: bevor antihormonelle, chemotherapeutische
Sehr geehrte Patientinnen und Angehörige, sehr geehrte Ärztinnen und Ärzte, Klinische Studien zur Behandlung des Ovarial-, Tuben-, Endometrium- und Peritonealkarzinoms: bevor antihormonelle, chemotherapeutische
Angriffspunkte bei der Behandlung von Autoimmunerkrankungen
 Angriffspunkte bei der Behandlung von Autoimmunerkrankungen Dr. Ilse Zündorf Institut für Pharmazeutische Biologie Goethe-Universität Frankfurt zuendorf@em.uni-frankfurt.de Autoimmunerkrankungen Grundlagen
Angriffspunkte bei der Behandlung von Autoimmunerkrankungen Dr. Ilse Zündorf Institut für Pharmazeutische Biologie Goethe-Universität Frankfurt zuendorf@em.uni-frankfurt.de Autoimmunerkrankungen Grundlagen
Anwendungsgebiete: Infektionen durch Nystatin-empfindliche Hefepilze (z. B. Candida albicans) im Mund (Mundsoor) und Magen-Darm-Bereich.
 Gebrauchsinformation: Information für Patienten Mykundex Suspension, 100.000 I.E./ml, Suspension zur Anwendung in der Mundhöhle und zum Einnehmen Wirkstoff: Nystatin Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Patienten Mykundex Suspension, 100.000 I.E./ml, Suspension zur Anwendung in der Mundhöhle und zum Einnehmen Wirkstoff: Nystatin Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Cefuroxim Hexal 500 mg - Filmtabletten Wirkstoff: Cefuroximaxetil Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Cefuroxim Hexal 500 mg - Filmtabletten Wirkstoff: Cefuroximaxetil Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Livostin 0,5 mg/ml Augentropfensuspension. Levocabastin
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER suspension Levocabastin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel ist
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER suspension Levocabastin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel ist
Gebrauchsinformation: Information für Anwender. Azyter 15 mg/g Augentropfen im Einzeldosisbehältnis Azithromycin 2 H 2 O
 Gebrauchsinformation: Information für Anwender Azyter 15 mg/g Augentropfen im Einzeldosisbehältnis Azithromycin 2 H 2 O Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Gebrauchsinformation: Information für Anwender Azyter 15 mg/g Augentropfen im Einzeldosisbehältnis Azithromycin 2 H 2 O Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Tannalbin-Tabletten
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Tannalbin-Tabletten Tanninalbuminat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Tannalbin-Tabletten Tanninalbuminat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel
Fallvorstellung M. Bechterew
 & Institut für Röntgendiagnostik Fallvorstellung M. Bechterew G. Pongratz, F. Poschenrieder 12. RIF 27.06.2007 Anamnese 2 22-jähriger Patient (1994) Seit 2 Jahren Schmerzen i. B. der LWS, v.a. nachts in
& Institut für Röntgendiagnostik Fallvorstellung M. Bechterew G. Pongratz, F. Poschenrieder 12. RIF 27.06.2007 Anamnese 2 22-jähriger Patient (1994) Seit 2 Jahren Schmerzen i. B. der LWS, v.a. nachts in
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Humira 40 mg/0,8 ml Injektionslösung zur Anwendung bei Kindern und Jugendlichen 2. QUALITATIVE UND QUANTITATIVE
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Humira 40 mg/0,8 ml Injektionslösung zur Anwendung bei Kindern und Jugendlichen 2. QUALITATIVE UND QUANTITATIVE
Gebrauchsinformation: Information für Patienten. Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench)
 Gebrauchsinformation: Information für Patienten Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Gebrauchsinformation: Information für Patienten Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Humira 40 mg-injektionslösung in Fertigspritze 2. Qualitative und quantitative Zusammensetzung Jede Einzeldosis-Fertigspritze mit 0,8 ml enthält 40
 Humira 40 mg-injektionslösung in Fertigspritze 2. Qualitative und quantitative Zusammensetzung Jede Einzeldosis-Fertigspritze mit 0,8 ml enthält 40 mg Adalimumab. Adalimumab ist ein rekombinanter humaner
Humira 40 mg-injektionslösung in Fertigspritze 2. Qualitative und quantitative Zusammensetzung Jede Einzeldosis-Fertigspritze mit 0,8 ml enthält 40 mg Adalimumab. Adalimumab ist ein rekombinanter humaner
Simponi 50 mg/100 mg Injektionslösung in vorgefülltem Injektor
 1. BEZEICHNUNG DER ARZNEIMITTEL Simponi 50 mg Injektionslösung in vorgefülltem Injektor. Simponi 100 mg Injektionslösung in vorgefülltem Injektor. 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Simponi
1. BEZEICHNUNG DER ARZNEIMITTEL Simponi 50 mg Injektionslösung in vorgefülltem Injektor. Simponi 100 mg Injektionslösung in vorgefülltem Injektor. 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Simponi
Natriumchlorid 1 molar 5,85% Infusionslösungskonzentrat
 Gebrauchsinformation und Fachinformation SERAG-WIESSNER GmbH & Co. KG Zum Kugelfang 8-12 95119 Naila Natriumchlorid 1 molar 5,85% Infusionslösungskonzentrat Diese Packungsbeilage beinhaltet: 1. Was ist
Gebrauchsinformation und Fachinformation SERAG-WIESSNER GmbH & Co. KG Zum Kugelfang 8-12 95119 Naila Natriumchlorid 1 molar 5,85% Infusionslösungskonzentrat Diese Packungsbeilage beinhaltet: 1. Was ist
Zentrum. Visitenblatt. akut nicht akut Wiedervorstellung erfolgt
 Zentrum Ansprechpartner E Mail Telefon Zentrumsnummer Art der Routine ungeplant Krankheitsstatus zur akut nicht akut erfolgt ambulant stationär falls stationär, wie viele Tage? Tage Körpergröße cm Körpergewicht
Zentrum Ansprechpartner E Mail Telefon Zentrumsnummer Art der Routine ungeplant Krankheitsstatus zur akut nicht akut erfolgt ambulant stationär falls stationär, wie viele Tage? Tage Körpergröße cm Körpergewicht
Neu aufzunehmende Passagen sind kursiv gesetzt und unterstrichen, zu löschende Passagen sind kursiv und durchgestrichen.
 ANHANG III 1 IN DIE ENTSPRECHENDEN ABSCHNITTE DER ZUSAMMENFASSUNG DER PRODUKTMERKMALE NIMESULIDHALTIGER ARZNEIMITTEL (SYSTEMISCHE DARREICHUNGSFORMEN) AUFZUNEHMENDE ÄNDERUNGEN Neu aufzunehmende Passagen
ANHANG III 1 IN DIE ENTSPRECHENDEN ABSCHNITTE DER ZUSAMMENFASSUNG DER PRODUKTMERKMALE NIMESULIDHALTIGER ARZNEIMITTEL (SYSTEMISCHE DARREICHUNGSFORMEN) AUFZUNEHMENDE ÄNDERUNGEN Neu aufzunehmende Passagen
Boehringer Ingelheim RCV GmbH & Co KG / Mes GI Finalgon - Salbe Version PACKUNGSBEILAGE
 Finalgon - Salbe Version 3.3 1 PACKUNGSBEILAGE Finalgon - Salbe Version 3.3 2 Gebrauchsinformation: Information für Anwender Finalgon - Salbe Wirkstoffe: Nonylvanillamid, Nikotinsäure-β-butoxyethylester
Finalgon - Salbe Version 3.3 1 PACKUNGSBEILAGE Finalgon - Salbe Version 3.3 2 Gebrauchsinformation: Information für Anwender Finalgon - Salbe Wirkstoffe: Nonylvanillamid, Nikotinsäure-β-butoxyethylester
Ihr Wegweiser zur. Therapie mit YERVOY (Ipilimumab)
 Ihr Wegweiser zur Therapie mit YERVOY (Ipilimumab) Informationsbroschüre für Patienten Yervoy unterliegt einer zusätzlichen Überwachung. Dies ermögicht eine schnelle Identifizierung neuer Erkenntnisse
Ihr Wegweiser zur Therapie mit YERVOY (Ipilimumab) Informationsbroschüre für Patienten Yervoy unterliegt einer zusätzlichen Überwachung. Dies ermögicht eine schnelle Identifizierung neuer Erkenntnisse
