Sehr geehrte ärztliche Anwender des RePneu Coil-Systems von PneumRx,
|
|
|
- Hinrich Böhler
- vor 5 Jahren
- Abrufe
Transkript
1 30. April 2018 Sehr geehrte ärztliche Anwender des RePneu Coil-Systems von PneumRx, Mit diesem Rundschreiben möchten wir Sie über Aktualisierungen der Gebrauchsanweisung (LBL0139, aktualisiert von Rev. I auf Rev. J, mit Datum 2017/12) für das PneumRx RePneu Coil-System zur Lungenvolumenreduktion informieren. Die Aktualisierung der Gebrauchsanweisung erfolgte im Rahmen der strukturierten Langzeitbeobachtung von PneumRx und vor dem Hintergrund der kürzlich abgeschlossenen Benutzerfreundlichkeitsstudie sowie der Gebrauchsanweisung, die mit dem Antrag von PneumRx bei der FDA (Pre-Market Approval) eingereicht wurde. Die für die Patientensicherheit relevanten Aktualisierungen sind im Folgenden zusammengefasst. Eine vollständige Liste aller Änderungen enthält Anhang 1. Änderungen in Abschnitt 3.0 Kontraindikationen Überarbeitung der Kontraindikationen bezüglich: Riesenbullae durch Bereitstellung einer spezifischeren Beschreibung der Kontraindikation. Pulmonale Hypertonie durch Hinzufügen eines neuen Hinweises (Hinweis: Weitere Informationen enthält Abschnitt Pulmonale Hypertonie). Immunsuppressiva zur Klarstellung der sprachlichen Formulierung. Streichung der Kontraindikationen bezüglich: Gefäßgröße, mit Umwandlung in einen neuen Warnhinweis in Abschnitt Pulmonale Hypertonie mit konkreten Beispielen dazu, wie durch den Anwender das Vorliegen einer Hypertonie ausgeschlossen werden kann. Die spezifische Kontraindikation bezüglich pulmonaler Hypertonie (8. Aufzählungspunkt) ist weiterhin Bestandteil von Abschnitt 3.0 Kontraindikationen. CAL-SB
2 Änderungen in Abschnitt 4.0 Warnhinweise Abschnitt 4.2 Warnhinweise zur Coil-Entfernung Erstellung eines neuen Abschnitts: Abschnitt 4.2 Warnhinweise zur Coil- Entfernung Wiederholung der Warnhinweise zur Coil-Entfernung aus Abschnitt 13.0 Bronchoskopische Coil-Entfernung nach der Implantation, mit dem Ziel der Förderung der sicheren Produktanwendung. Hinzufügung eines neuen Hinweises bezüglich des Mindest-Innendurchmessers (2,0 mm) des therapeutischen Bronchoskops, das für die Coil-Entfernung nach der Implantationsprozedur zur Anwendung kommt. Dieser informiert die Benutzer, dass für die Coil-Entfernung ein Bronchoskop mit geringerem Innendurchmesser erforderlich ist (selbe Änderung in Abschnitt 8.1). Abschnitt 4.3 Warnhinweise zu Vorerkrankungen des Patienten Überarbeitung des Titels von Allgemeine Warnhinweise zu Warnhinweise zu Vorerkrankungen des Patienten. Neuerstellung von: - Unterabschnitten (siehe im Folgenden), um die Aufmerksamkeit auf Warnhinweise zu Vorerkrankungen des Patienten zu lenken: Hämoptyse und Antikoagulation Bronchiektase und Atelektase Kanzeröse Lungenrundherde/Sonstige Erkrankungen der Lunge Asthma-Prädominanz Pulmonale Hypertonie - Warnhinweis in Unterabschnitt Asthma-Prädominanz als Klarstellung zur Unterstützung einer angemessenen Patientenauswahl, unter Einschluss aller aus randomisierten klinischen Studien ausgeschlossenen Patienten. - Warnhinweis in Unterabschnitt Pulmonale Hypertonie (Umwandlung aus einer ehemaligen Kontraindikation) zur Bereitstellung spezifischer Beispiele von evtl. anzutreffenden Bildgebungsbefunden, die einer weiteren Eruierung bedürfen, um zu ermitteln, ob ein kontraindizierter Zustand gegeben ist. Modifizierung der Warnaussage bezüglich Bronchiektasie und Atelektase, zur Darlegung des Risikos der Coil-Implantation bei Patienten mit diesen Zuständen, bevor angeraten wird, in den betroffenen Lappen keine Coils zu implantieren. CAL-SB
3 Hinzufügung eines neuen Hinweises (Hinweis: Weitere Aspekte der Patientenauswahl enthält Abschnitt 6.0 Individuelle Anpassung der Behandlung). Abschnitt 4.4 Warnhinweise zur RePneu Coil und zum Einführsystem Änderung zweier Warnhinweise zu Vorsichtsmaßnahmen, da es sich um Vorsichtsmaßnahmen bzgl. der Behandlung handelt (keine Angaben zur Patientensicherheit): - Den Katheter nicht ohne Schienung durch den Führungsdraht vorschieben. - Beim Vorschieben des Katheters stets den Führungsdraht als Schiene verwenden. Die Komponenten des RePneu Systems nur unter Fluoroskopie aus dem Sichtbereich des Bronchoskops herausschieben. Die Fluoroskopie einschalten, wenn der schwarze proximale Markierungsstreifen der Fasszange in die Einführhülse eintritt. Änderungen in Abschnitt 5.0 Vorsichtsmaßnahmen Abschnitt 5.1 Allgemeine Vorsichtsmaßnahmen Überarbeitung des zweiten Aufzählungspunkts, um anzugeben, dass die endobronchiale RePneu Coil-Therapie in zwei separaten Sitzungen durchzuführen ist. Abschnitt 5.2 Verfahrensspezifische Vorsichtsmaßnahmen Überarbeitung der vorliegenden einzelnen Vorsichtsmaßnahme bezüglich der Coil-Platzierung, sodass nunmehr zwei separate Vorsichtsmaßnahmen existieren: - Coils sind so zu platzieren, dass sich benachbarte Coils nicht berühren, um Reibung zwischen den metallenen Komponenten zu vermeiden. - Die Platzierung von zwei Coils im selben Atemweg ist zu vermeiden. Änderungen in Abschnitt 6.0 Individuelle Anpassung der Behandlung Streichung von niedriger FEV1, da es sich hierbei nicht um eine zweckmäßige spezifische Beschreibung handelt. Abschnitt 6.1 Einsatz bei besonderen Populationen Hinzufügung von Patienten mit FEV1-Veränderung von > 20 % nach Bronchodilatation (oder bei Patienten mit FEV1 von weniger als 1 l vor Bronchodilatation und einer Veränderung von > 200 ml), sofern Asthma nicht durch andere Methoden vom Arzt ausgeschlossen wurde, um alle CAL-SB
4 erforderlichen Angaben bezüglich nicht untersuchter Populationen an einer Stelle zusammenzufassen. Änderungen in Abschnitt 7.0 Mögliche unerwünschte Ereignisse Hinzufügung von Lungenabszess und Pneumonitis, um eingegangenen Beanstandungen Rechnung zu tragen. Überarbeitung des Hinweises bezüglich CAO zur Bereitstellung zusätzlicher Informationen zur Diagnose von CAO auf der Grundlage der Bildgebung und der Notwendigkeit eines umgehenden Eingreifens. Änderungen in Abschnitt 8.0 Informationen zum klinischen Einsatz Abschnitt 8.2 Periprozedurale Betreuung Umformulierung der Nachbeobachtungsaussage, um anzugeben, dass nach der Behandlung eine fluoroskopische Aufnahme/Röntgenaufnahme zu erstellen ist. Änderungen in Abschnitt 11.0 Gebrauchsanweisungen Hinzufügung von 7 Vorsichtsmaßnahmen (aus Abschnitt 5.2 Verfahrensspezifische Vorsichtsmaßnahmen) und eines Warnhinweises (aus Abschnitt 4.4 Warnhinweise zur REPNEU Coil und zum Einführsystem), mit dem Ziel der Unterstützung der sicheren Produktanwendung. Überarbeitung von Schritt 29(b) mit dem Ziel der Bereitstellung konkreter Anweisungen bezüglich der Coil-Platzierung und der Notwendigkeit einer Coil- Umpositionierung, falls sich das proximale Ende der Coil in das Gewebe drückt. Änderungen in Abschnitt 13.0 Bronchoskopische Coil-Entfernung nach der Implantation Überarbeitung des 1. Warnhinweises durch Hinzufügung von (bspw. anhaltende Pleuraschmerzen) als konkretes Beispiel eines Grundes für eine Coil-Entfernung und zur Verdeutlichung für den Leser. Fettdruck der Worte 2 oder mehr Monate in der Warnaussage bezüglich der Coil- Entfernung. Bitte nehmen Sie sich etwas Zeit, um die neue Gebrauchsanweisung in Ruhe durchzulesen, da die obige Liste nicht vollständig ist. Die überarbeitete Gebrauchsanweisung kann in 14 Sprachen unter heruntergeladen werden. CAL-SB
5
6 Anhang 1 Änderungen der Titelseite Streichung der Faxnummer und Hinzufügung der E- Mail-Adresse FAX wird selten verwendet und E- Mail ist ein zeitgemäßer Kommunikationsweg. Änderungen in Abschnitt 1.0 Produktbeschreibung Im ersten Absatz, Änderung von REPNEU Coil zu Als Entsprechung zu dem im Plural REPNEU Coils. stehenden Hauptwort im anschließenden Text. Änderungen in Abschnitt 3.0 Kontraindikationen Überarbeitung des 6. Aufzählungspunkts bezüglich Riesenbullae: Von: Patienten mit Riesenbullae > 1/3 des Lungenvolumens Zu: Patienten mit fortgeschrittener bullöser Erkrankung (charakterisiert durch Bulla > 1/3 des Volumens des Lungenflügels, oder einzelnen bullösen Defekt > 8 cm) oder signifikantem paraseptalem Lungenemphysem (charakterisiert durch zahlreiche große [> 1 cm] paraseptale Defekte im zu behandelnden Lappen, die > 5 % des gesamten Volumens des Lungenflügels ausmachen). Überarbeitung des 8. Aufzählungspunkts bezüglich pulmonaler Hypertonie durch Hinzufügung von Hinweis: - Weitere Informationen enthält Abschnitt Pulmonale Hypertonie. Verdeutlichung durch Bereitstellung einer konkreteren Beschreibung der Kontraindikation, einschließlich der Bedeutung von signifikantem paraseptalem Lungenemphysem. Verweis des Lesers auf den Abschnitt mit weiteren Informationen zur Notwendigkeit von Messungen im Hinblick auf pulmonale Hypertonie. CAL-SB
7 Streichung des 9. Aufzählungspunkts bezüglich der Gefäßgröße und Hinzufügung eines neuen Warnhinweises. (Abschnitt Pulmonale Hypertonie). Überarbeitung des 10. Aufzählungspunkts bezüglich Immunsuppressiva: Von: Patienten unter Immunsuppression zur Behandlung von Krebs, rheumatoider Arthritis, Autoimmunerkrankungen oder zur Verhinderung einer Gewebe- oder Organabstoßung Zu: Patienten, die Immunsuppressiva einnehmen, mit Ausnahme von Steroiden (bspw. zur Behandlung von Krebs, rheumatoider Arthritis, Autoimmunerkrankungen oder zur Verhinderung einer Gewebe- oder Organabstoßung) Streichung der Leerstelle zwischen 20 und mg in der 11. Kontraindikation. Diese sprachliche Formulierung war für eine Kontraindikation ungeeignet. Eine Sichteinschätzung ist nicht ausreichend für die Diagnostizierung einer pulmonalen Hypertonie. Vielmehr sollte eine Sichteinschätzung ein Warnzeichen sein, das durch eine physiologische Messung zu bestätigen ist. Die sprachliche Formulierung wurde in einen neuen Warnhinweis in Abschnitt mit weiteren Beispielen potenzieller Sichtbefunde umgewandelt, der den Benutzer außerdem anweist, eine Hypertonie auszuschließen. Die spezifische Kontraindikation bezüglich pulmonaler Hypertonie (8. Aufzählungspunkt) ist weiterhin Bestandteil von Abschnitt 3.0 Kontraindikationen. Klarstellung der sprachlichen Formulierung. Niedrig dosierte Steroide können eine gewisse immunsupprimierende Wirkung haben, sind jedoch akzeptabel. Hoch dosierte Arzneimittel, die speziell zur Supprimierung des Immunsystems eingenommen werden (wie bspw. Arzneimittel für Krebs, Autoimmunerkrankungen etc.) sind nicht akzeptabel. Korrektur eines typografischen Fehlers. Änderungen in Abschnitt 4.1 Warnhinweise zum klinischen Einsatz Hinzufügung von durch einen Vertreter von Klarstellung der sprachlichen PneumRx zur Schulungsaussage. Formulierung CAL-SB
8 Abschnitt 4.2 Warnhinweise zur Coil-Entfernung Neuerstellung von Abschnitt 4.2 Warnhinweise zur Coil-Entfernung zwecks Wiederholung der Warnhinweise zur Coil-Entfernung in Abschnitt 13.0 Bronchoskopische Coil-Entfernung nach der Implantation. Hinzufügung eines neuen Hinweises: Hinweis: Für die Durchführung einer bronchoskopischen Coil-Entfernung nach der Implantationsprozedur muss ein therapeutisches Bronchoskop mit einem Arbeitskanal- Innendurchmesser von mindestens 2,0 mm und einer maximalen Nutzlänge von 65 cm verwendet werden. Wiederholung von bereits in Abschnitt 13.0 vorhandenen Informationen, jedoch vorverlegt in den Warnhinweise-Abschnitt. Hinweis mit Beschreibung des Bronchoskops (einschließlich Angaben zum Innendurchmesser), das für die Coil-Entfernung nach der Behandlung im Unterschied zur Umpositionierung der Coil während der Implantation benötigt wird. Änderungen in Abschnitt 4.3 Warnhinweise zu Vorerkrankungen des Patienten Überarbeitung des Abschnitt-Titels von Allgemeine Warnhinweise zu Warnhinweise zu Vorerkrankungen Benutzerfreundlichkeit für den des Patienten. Leser beim Auffinden der Hinzufügung der folgenden Unterabschnitte, um die Aufmerksamkeit auf Warnhinweise bezüglich spezifischer Vorerkrankungen des Patienten zu lenken: Hämoptyse und Antikoagulation Bronchiektase und Atelektase Kanzeröse Lungenrundherde/Sonstige Erkrankungen der Lunge Asthma-Prädominanz Pulmonale Hypertonie Bronchiektase und Atelektase Modifizierung der Warnaussage, sodass der letzte Satz an den Anfang gerückt wird. Von: Die REPNEU Coils dürfen nicht in Lungenbereichen implantiert werden, die Bronchiektasen oder eine signifikante Atelektase aufweisen. Um das Risiko von schwerwiegenden pulmonalen Blutungsereignissen zu verringern, ist eine Coil-Implantation bei Patienten mit Bronchiektasen nur nach sorgsamer Überlegung durchzuführen. Dabei sind alle verdächtigen Lungenbereiche zu vermeiden. benötigten Informationen. Benutzerfreundlichkeit für den Leser beim Auffinden der benötigten Informationen. Schilderung des Risikos durch Bronchiektasie und Atelektase vor dem Ratschlag, im betroffenen Lappen keine Coils zu implantieren. CAL-SB
9 Zu: Um das Risiko von schwerwiegenden pulmonalen Blutungsereignissen zu verringern, ist eine Coil- Implantation bei Patienten mit Bronchiektasen nur nach sorgsamer Überlegung durchzuführen. Dabei sind alle verdächtigen Lungenbereiche zu vermeiden. Die REPNEU Coils dürfen nicht in Lungenbereichen implantiert werden, die Bronchiektasen oder eine signifikante Atelektase aufweisen Kanzeröse Lungenrundherde/Sonstige Erkrankungen der Lunge Überarbeitung des verbleibenden Aufzählungspunkts unter Streichung von oder und Ersatz durch in Erwägung gezogen Asthma-Prädominanz Neuer Abschnitt mit einem Aufzählungspunkt: Bei Patienten mit Asthma-COPD-Overlap Syndrom muss der behandelnde Arzt Asthma als prädominante Erkrankung ausschließen. Patienten mit signifikanter FEV1-Reversibilität (Abweichung des FEV1-Wertes um > 20 % nach Bronchodilatation) wurden noch nicht klinisch untersucht. In Abschnitt 6.1 Einsatz bei besonderen Populationen sind alle Patientenpopulationen aufgeführt, die noch nicht in klinischen Studien untersucht wurden Pulmonale Hypertonie Neuer Abschnitt mit einem Aufzählungspunkt: Patienten, deren Bildgebungsbefunde auf eine schwere pulmonale Hypertonie hindeuten (bspw. ein Verhältnis zwischen segmentalen Arterien und Bronchien von mehr als 1:1 in drei von vier Lungenlappen) sollten weiteren Tests unterzogen werden, um eine schwere pulmonale Hypertonie (die eine Kontraindikation darstellt) auszuschließen. Klarstellung zur Hervorhebung der Notwendigkeit einer behandlungsvorbereitenden Abwägung der Risiken und Vorteile für den betreffenden Patient durch den Benutzer. Klarstellung zur Unterstützung einer angemessenen Patientenauswahl, unter Einschluss aller aus randomisierten klinischen Studien ausgeschlossenen Patienten. In Übereinstimmung mit den Indikationen und den Einschlusskriterien der RENEW- Studie zur Eliminierung von Patienten, die Asthma und kein Lungenemphysem haben. Neuer Warnhinweis, in den die gestrichene 9. Kontraindikation (bezüglich der Gefäßgröße), umgewandelt wurde. Neuer Wortlaut mit Bereitstellung spezifischer Beispiele von evtl. anzutreffenden Bildgebungsbefunden, die einer weiteren Eruierung bedürfen, um zu ermitteln, ob eine Kontraindikation gegeben ist. CAL-SB
10 4.3 Warnhinweise zu Vorerkrankungen des Patienten Hinzufügung eines neuen Hinweises, der den Leser bezüglich weiterer Aspekte der Patientenauswahl auf Abschnitt 6.0 Individuelle Anpassung der Behandlung verweist: Hinweis: Bezüglich weiterer Aspekte der Patientenauswahl, siehe Abschnitt 6.0 Individuelle Anpassung der Behandlung. 4.4 Warnhinweise zur REPNEU Coil und zum Einführsystem Änderung des 1. Warnhinweises in eine Vorsichtsaussage: Den Katheter nicht ohne Schienung durch den Führungsdraht vorschieben. Beim Vorschieben des Katheters stets den Führungsdraht als Schiene verwenden. Benutzerfreundlichkeit für den Leser beim Auffinden der benötigten Informationen. Änderung der Warnaussage in eine Vorsichtsaussage, aufgrund ihres Bezugs zu Vorsichtsmaßnahmen bei der Behandlung (keine Angaben zur Patientensicherheit). Verlegung der Aussage in Abschnitt 5.2 Verfahrensspezifische Vorsichtsmaßnahmen (5. Aufzählungspunkt) und Hinzufügung zu Abschnitt 11 Gebrauchsanweisungen, Schritt Warnhinweise zur REPNEU Coil und zum Einführsystem Änderung des 2. Warnhinweises in eine Vorsichtsaussage: Die Komponenten des REPNEU Systems nur unter Fluoroskopie aus dem Sichtbereich des Bronchoskops herausschieben. Die Fluoroskopie einschalten, wenn der schwarze proximale Markierungsstreifen der Fasszange in die Einführhülse eintritt. Änderung der Warnaussage in eine Vorsichtsaussage, aufgrund ihres Bezugs zu Vorsichtsmaßnahmen bei der Behandlung (keine Angaben zur Patientensicherheit). Verlegung der Aussage in Abschnitt 5.2 Verfahrensspezifische Vorsichtsmaßnahmen (15. Aufzählungspunkt) und Hinzufügung zu Abschnitt 11 Gebrauchsanweisungen, Schritt 24. CAL-SB
11 Verlegung des 4. und 5. Warnhinweises zur Coil- Entfernung in Abschnitt 4.2 Warnhinweise zur Coil- Entfernung (und Aufteilung eines Warnhinweises in zwei, sodass sich drei separate Warnhinweise ergeben). Die bronchoskopische Coil-Entfernung muss medizinisch indiziert sein (bspw. anhaltende Pleuraschmerzen). Der mögliche Nutzen einer Coil-Entfernung muss gegen den möglichen Schaden, einschließlich der bekannten Risiken der Bronchoskopie, abgewogen werden. Die bronchoskopische Coil-Entfernung kann sich 2 oder mehr Monate nach der Implantation je nach Umfang des vorhandenen Granulationsgewebes zunehmend schwierig gestalten. Wenn eine bronchoskopische Entfernung nicht möglich ist, kann eine chirurgische Entfernung mit einem thorakoskopischen Ansatz in Betracht gezogen werden. Siehe den Abschnitt 13.0 Bronchoskopische Coil-Entfernung nach der Implantation für weitere Informationen. Ist eine Coil-Entfernung notwendig, darf nicht versucht werden, die Coil auf irgendeine Art und Weise zu durchtrennen, zu verbiegen oder zu brechen. Ein unsachgemäßer Umgang mit der Coil in einer solchen Art und Weise kann dazu führen, dass das Produkt korrodiert und scharfkantige Oberflächen entstehen, die eine Gesundheitsschädigung, Erkrankung oder den Tod des Patienten zur Folge haben können. Benutzerfreundlichkeit für den Leser beim Auffinden der benötigten Informationen. Änderungen in Abschnitt 5.1 Allgemeine Vorsichtsmaßnahmen Überarbeitung des 2. Aufzählungspunkts: Klarstellung, dass es zwei Prozeduren gibt. Von: Bei der endobronchialen REPNEU Coil- Behandlung handelt es sich um eine bilaterale Therapie, die in separaten Sitzungen durchzuführen ist. CAL-SB
12 Zu: Bei der endobronchialen REPNEU Coil-Therapie handelt es sich um eine bilaterale Therapie, die in zwei separaten Sitzungen durchzuführen ist. Änderungen in Abschnitt 5.2 Verfahrensspezifische Vorsichtsmaßnahmen Umstellung der Reihenfolge der Vorsichtsmaßnahmen gemäß der Reihenfolge ihrer Benutzerfreundlichkeit für den Leser Aufführung Abschnitt 11 Gebrauchsanweisungen beim Auffinden der benötigten und Abschnitt 13 Bronchoskopische Informationen. Coil-Entfernung nach der Implantation. Modifizierung der Vorsichtsmaßnahme durch Änderung von hängenbleibt zu eingeklemmt wird zwecks Übereinstimmung mit der Vorsichtsaussage in Abschnitt 11 Gebrauchsanweisungen: Von: Wird der Führungsdraht bei erhöhtem Widerstand über eine plötzlich auftretende Krümmung in einem distalen Atemweg hinaus vorgeschoben, kann dies dazu führen, dass im gekrümmten Abschnitt des Führungsdrahts Gewebe hängenbleibt. Korrektur zur Gewährleistung der Einheitlichkeit. Zu: Wird der Führungsdraht gegen erhöhten Widerstand über eine abrupte Krümmung in einem distalen Atemweg hinaus vorgeschoben, könnte dies dazu führen, dass Gewebe im gekrümmten Abschnitt des Führungsdrahts eingeklemmt wird. Änderung der vorliegenden Vorsichtsmaßnahme: Von: Coils so platzieren, dass sie sich nicht berühren und sich nicht gegenseitig überlappen. Große Sorgfalt walten lassen, damit nicht zwei Coils in denselben Atemweg platziert werden. Klarstellung mit Bereitstellung konkreter Beispiele und Begründung des Vermeidens von Berührungen und Überlappen. Zu (zwei Vorsichtsmaßnahmen): Coils sind so zu platzieren, dass sich benachbarte Coils nicht berühren, um Reibung zwischen den metallenen Komponenten zu vermeiden. CAL-SB
13 Die Platzierung von zwei Coils im selben Atemweg ist zu vermeiden. Streichung einer Vorsichtsmaßnahme (nicht aufgeführt in Abschnitt 11 Gebrauchsanweisungen): Wenn die Komponenten des Einführsystems außerhalb des Sichtbereichs des Bronchoskops liegen, dürfen sie nur unter Fluoroskopie bewegt werden. Streichung der Vorsichtsaussage aufgrund von Redundanz mit der folgenden Vorsichtsaussage: Die Komponenten des REPNEU Systems nur unter Fluoroskopie aus dem Sichtbereich des Bronchoskops herausschieben. Die Fluoroskopie einschalten, wenn der schwarze proximale Markierungsstreifen der Fasszange in die Einführhülse eintritt. Änderungen in 6.0 Individuelle Anpassung der Behandlung Im zweiten Absatz, Änderung von RENEW Studie Klarstellung des Status der zu FDA-Zulassungsstudie RENEW. RENEW-Studie. Streichung von Folgendem: Bei niedriger FEV1 handelt es sich - niedriger nicht um eine zweckmäßige FEV1 spezifische Beschreibung.Patienten mit FEV1-Sollwerten (%) im Bereich von 12,9 % bis 43,6 % wurden im Rahmen der RENEW-Studie untersucht. Diese Information wurde modifiziert und ebenfalls in Abschnitt 6.1 Einsatz bei besonderen Populationen, verschoben. Änderungen in Abschnitt 6.1 Einsatz bei besonderen Populationen Folgendes wurde hinzugefügt: Patienten mit FEV1-Veränderung von > 20 % Benutzerfreundlichkeit durch nach Bronchodilatation (oder bei Patienten mit Zusammenfassung aller FEV1 von weniger als 1 l vor Bronchodilatation, erforderlichen Angaben bezüglich und einer Veränderung von > 200 ml), sofern nicht untersuchter Populationen an Asthma nicht durch andere Methoden vom Arzt einer Stelle, in Abschnitt 6.1 ausgeschlossen wurde. Einsatz bei besonderen Populationen. CAL-SB
14 Änderungen in Abschnitt 7.0 Mögliche unerwünschte Ereignisse Überarbeitung unter Hinzufügung von Folgendem: Lungenabszess Überarbeitung unter Hinzufügung von Folgendem: Pneumonitis Überarbeiteter Hinweis: Von: Hinweis: Eventuell sind weitere interventionelle Verfahren notwendig, wenn bei Patienten einige dieser möglichen unerwünschten Ereignisse nach der REPNEU Coil-Therapie auftreten. * Es sind Fälle einer nicht infektiösen, lokalisierten Gewebereaktion, auch Coil Associated Opacity (CAO) genannt, im Bereich der implantierten REPNEU Coils dokumentiert. Hierbei handelt es sich vermutlich um eine entzündliche Reaktion, die mit pneumonie-ähnlichen Symptomen, u. a. mit Thorax- oder Pleuraschmerzen/- beschwerden, verstärkter Dyspnoe, Erschöpfung und/oder sichtbaren Verschattungen oder Infiltraten in Thorax- Röntgenaufnahmen auftreten kann und sich nur schwer von einer Pneumonie abgrenzen lässt. Daher sind Patienten bei der Entlassung anzuweisen, sich an den implantierenden Arzt zu wenden, falls sich bei ihnen Symptome einstellen, die eventuell auf eine Pneumonie oder CAO hindeuten können. Zu: Hinweis: Eventuell sind weitere interventionelle Eingriffe notwendig, wenn bei Patienten einige dieser möglichen unerwünschten Ereignisse nach der REPNEU Coil-Therapie auftreten. * Eine beobachtete, nicht infektiöse, auch als Coil-assoziierte Opazität (Coil Associated Opacity, CAO) bezeichnete lokalisierte Gewebereaktion kann im Bereich der implantierten REPNEU Coils auftreten; die Diagnose erfolgt normalerweise bei der Bildgebung (Thorax-Röntgenaufnahme oder CT- Scan). Hierbei handelt es sich vermutlich um eine entzündliche Reaktion, die mit pneumonie-ähnlichen Symptomen, u. a. mit Thorax- oder Pleuraschmerzen/- beschwerden, verstärkter Dyspnoe, Erschöpfung und/oder sichtbaren Verschattungen oder Infiltraten in Thorax- Röntgenaufnahmen einhergehen kann und sich evtl. nur schwer von einer Pneumonie abgrenzen lässt. In klinischen Studien gab es zwar bis zu 2 Monate nach der Coil- Behandlung eine gewisse Anzahl an CAO Ereignissen, Hinzufügung von Lungenabszess infolge einer Beschwerde über Lungenabszess (CAL-PC ). Hinzufügung von Pneumonitis infolge einer Beschwerde über Pneumonitis ( ). Einfügung eines weiteren Details entsprechend des aktuellen Verständnisses von PneumRx bezüglich CAO und der angemessenen Behandlung. CAL-SB
15 jedoch sind viele dieser Ereignisse asymptomatisch oder von leichter Symptomatik, klingen mit begrenzter Intervention ab und entwickeln sich nicht zu schwerwiegenden unerwünschten Ereignissen (SUE) weiter. Eine CAO kann jedoch einen schwerwiegenden Verlauf nehmen und eine sofortige und spezifische Intervention erforderlich machen. Daher wird den Patienten angeraten, sich unverzüglich zur Nachsorge an den behandelnden Arzt zu wenden, wenn sie pneumonie-ähnliche Symptome bemerken. Änderungen in Abschnitt 8.1 Erforderliche Materialien Hinzufügung eines neuen Hinweises: Hinweis mit Beschreibung des Hinweis: Für die Durchführung einer Bronchoskops (einschließlich bronchoskopischen Coil-Entfernung nach der Angaben zum Innendurchmesser), Implantation muss ein therapeutisches Bronchoskop das für die Coil-Entfernung nach der mit einem Arbeitskanal-Innendurchmesser von Behandlung im Unterschied zur mindestens 2,0 mm und einer maximalen Nutzlänge Umpositionierung der Coil während von 65 cm verwendet werden. der Implantation benötigt wird. Änderungen in Abschnitt 8.2 Periprozedurale Betreuung Umformulierung der Nachbeobachtungsaussage: Klarstellung, die angibt, dass nach der Behandlung eine Von: Nach dem Verfahren anhand einer fluoroskopische Aufnahme zu Röntgenaufnahme des Brustkorbs die Coil- erstellen ist und eine zweite Platzierung bestätigen und sicherstellen, dass kein Röntgenaufnahme des Brustkorbs Pneumothorax vorliegt. Mindestens 4 Stunden nach vor der Entlassung vorzunehmen ist der ersten Röntgenaufnahme des Brustkorbs eine (nicht unbedingt innerhalb eines zweite Röntgenaufnahme durchführen. bestimmten Zeitraums). Zu: Nach der Behandlung eine Röntgenaufnahme des Brustkorbs erstellen, um die Coil-Platzierung zu bestätigen und um sicherzustellen, dass kein Pneumothorax vorliegt. Vor Entlassung eine zweite Thorax-Röntgenaufnahme vornehmen. Diese sollte mindestens 4 Stunden nach der ersten erfolgen. Änderung von dem behandelnden Arzt zu dem behandelnden Arzt im 5. Absatz. Grammatikalische Verbesserung. CAL-SB
16 Änderungen in Abschnitt 9.1 Implantatausweis für den Patienten und Patientenbroschüre Änderung der -Adresse: Falsches Routing bisherige - Adresse. Von: Zu: Änderungen in Abschnitt 11.0 Gebrauchsanweisungen Hinzufügung von 7 Vorsichtsmaßnahmen (aus Abschnitt 5.2 Verfahrensspezifische Vorsichtsmaßnahmen) und eines Warnhinweises (aus Abschnitt 4.4 Warnhinweise zur REPNEU Coil und zum Einführsystem). Achtung: Die Behandlung stets mit einem Bronchoskop durchführen. Das REPNEU System ist zur Verwendung mit einem therapeutischen Bronchoskop mit einem Arbeitskanal mit einem Innendurchmesser von 2,8 mm und einer Nutzlänge von maximal 65 cm bestimmt. Eine Verwendung des REPNEU Systems mit Bronchoskopen, die diesen Kriterien nicht entsprechen, kann zu Geräte- oder Produktschäden führen. Begründung der Aktualisierung Wiederholung von Vorsichtsmaßnahmen aus Abschnitt 5.2 Verfahrensspezifische Vorsichtsmaßnahmen und eines Warnhinweises aus Abschnitt 4.4 Warnhinweise zur REPNEU Coil und zum Einführsystem. Diese Vorsichtsaussagen und Warnung fehlten in Abschnitt 11.0 Gebrauchsanweisungen. Achtung: Geknickte Einführsysteme oder geknickte Coils nicht verwenden. Achtung: Coils sind so zu platzieren, dass sich benachbarte Coils nicht berühren, um Reibung zwischen den metallenen Komponenten zu vermeiden. Achtung: Die Platzierung von zwei Coils im selben Atemweg ist zu vermeiden. CAL-SB
17 Achtung: Den Katheter nicht ohne Schienung durch den Führungsdraht vorschieben. Beim Vorschieben des Katheters stets den Führungsdraht als Schiene verwenden. Begründung der Aktualisierung Achtung: Die Komponenten des REPNEU Systems nur unter Fluoroskopie aus dem Sichtbereich des Bronchoskops heraus vorschieben. Die Fluoroskopie einschalten, wenn der schwarze proximale Markierungsstreifen der Fasszange in die Einführhülse eintritt. Achtung: Coils dürfen nur unter Fluoroskopie eingebracht werden. WARNUNG: Um eine Punktion der Pleura oder ein Atemwegstrauma zu vermeiden, den Führungsdraht, den Katheter oder alle anderen Komponenten des REPNEU Systems auf keinen Fall gegen Widerstand vorschieben. Wird auf Widerstand gestoßen, die Ursache hierfür bestimmen und entsprechende Abhilfemaßnahmen ergreifen, bevor ein Vorschieben der REPNEU Systemkomponente erneut versucht wird. Sprachliche Umformulierung der Aussage in Schritt 4(b), wie folgt: Von: In dem Segment, das am schwierigsten zugänglich ist, mit dem Freisetzen der Coils beginnen, und dann weniger schwierige Segmente behandeln. Sprachliche Umformulierung, die der Tatsache Rechnung trägt, dass der Benutzer zu diesem Zeitpunkt der Verfahrensbeschreibung noch keine Coils freisetzt. Zu: Die Freisetzung der Coils sollte in dem am schwierigsten zugänglichen Segment beginnen, wonach weniger schwierige Segmente behandelt werden können. CAL-SB
18 Sprachliche Umformulierung der Aussage in Schritt 6, wie folgt: Von: Die Spitzen des Führungsdrahts und des Katheters aufeinander ausrichten. Zu: Die Spitze des Führungsdrahts vorschieben, so dass sie etwa 1 mm aus dem Ende des Katheters herausragt. Modifizierung von Abbildung 3 in Form der Änderung des Abbildungstitels zu Führungsdraht etwas über die Katheterspitze hinaus vorschieben und Integration einer Bildbeschriftung zur Identifizierung Führungsdrahtspitze, Hinzufügung von (siehe Abbildung 3) am Ende von Schritt 6. Entsprechende Änderung der Nummerierung anschließender Abbildungen. Hinzufügung einer neuen Abbildung 4 (Den Katheter und den Führungsdraht gemeinsam einführen) unmittelbar im Anschluss an Schritt 7 und Hinzufügung von (siehe Abbildung 4) am Ende von Schritt 7. Entsprechende Änderung der Nummerierung anschließender Abbildungen. Umpositionierung der Pfeilspitze in Abbildung 5, sodass sie eindeutiger zum Katheter weist. Verschiebung von Schritt 13 unmittelbar unterhalb Schritt 12 und Aufteilen von Schritt 13 in zwei separate Sätze, wie folgt: Von: Den Führungsdraht unter Beibehaltung der Katheterposition aus dem Katheter entfernen und das Fluoroskop ausschalten. Zu: Den Führungsdraht unter Beibehaltung der Katheterposition aus dem Katheter entfernen. Die Fluoroskopie nach dem Entfernen des Führungsdrahts aus dem Katheter ausschalten. Begründung der Aktualisierung Klarstellung. Streichung des Begriffs aufeinander ausrichten und Erteilung der Anweisung, sicherzustellen, dass der Führungsdraht etwas aus dem Ende des Katheters herausragt. Bessere Verständlichkeit des Abbildungstitels und Bereitstellung eines Bilds mit Bildbeschriftung zur Hervorhebung der Führungsdrahtspitze. Benutzerfreundlichkeit durch Bereitstellung eines neuen Bilds, das das gemeinsame Einführen von Katheter und Führungsdraht in das Bronchoskop zeigt. Sicherstellung, dass der Pfeil zum Katheter weist und nicht zum Bronchoskop. Benutzerfreundlichkeit beim Auffinden der benötigten Informationen durch Optimierung der Sichtbarkeit von Schritt 13 (da er nicht mehr unter Tabelle 1 versteckt ist). Modifizierung des Satzes, um klarzustellen, dass die Fluoroskopie nach dem Entfernen des Führungsdrahts aus dem Katheter auszuschalten ist. CAL-SB
19 Hinzufügung einer neuen Abbildung 9 (Öffnen der Fasszange) unmittelbar im Anschluss an Schritt 17 und Hinzufügung von (siehe Abbildung 9) am Ende von Schritt 17. Entsprechende Änderung der Nummerierung anschließender Abbildungen. Hinzufügung einer neuen Abbildung 10 (Die Coil durch Schließen der Backen der Fasszange fassen) unmittelbar im Anschluss an Schritt 18 und Hinzufügung von (siehe Abbildung 10) am Ende von Schritt 18. Entsprechende Änderung der Nummerierung anschließender Abbildungen. Schritt 19 Streichung der Klammern um den Satz Die blaue Arretierungslasche in Richtung Griff drücken, bis ein Klicken hörbar ist, um eine Freigabe der Coil zu verhindern. Hinzufügung einer neuen Abbildung 11 (Schließen der Fasszange) und Abbildung 12 (Arretieren der Fasszange) unmittelbar im Anschluss an Schritt 19 und Hinzufügung von (siehe Abbildung 11 und Abbildung 12) am Ende von Schritt 19. Entsprechende Änderung der Nummerierung anschließender Abbildungen. Änderung des Titels von Abbildung 13: Von: Einziehen der Coil in die Einführhülse Begründung der Aktualisierung Benutzerfreundlichkeit durch Bereitstellung eines neuen Bilds, das das Öffnen der Fasszange veranschaulicht. Benutzerfreundlichkeit durch Bereitstellung eines neuen Bilds, das das Fassen der Coil mit Hilfe der Fasszangenbacken veranschaulicht. Klarstellung des Satzes für den Leser. Benutzerfreundlichkeit durch Bereitstellung neuer Bilder, die das Schließen und Arretieren der Fasszangenbacken veranschaulichen. Zur korrekten Entsprechung des in der Abbildung gezeigten Vorgangs. Zu: Die Einführhülse in das Gehäuse vorschieben Hinzufügung einer neuen Abbildung 14 (Die Coil in die Einführhülse ziehen) unmittelbar im Anschluss an Schritt 21 und Hinzufügung von (siehe Abbildung 14) am Ende von Schritt 21. Entsprechende Änderung der Nummerierung anschließender Abbildungen. Hinzufügung einer neuen Abbildung 15 (Die Coil vorschieben, bis der Fluoroskopie-Markierungsstreifen in die Einführhülse eintritt) unmittelbar im Anschluss an Schritt 23 und Hinzufügung von (siehe Abbildung 15) am Ende von Schritt 23. Benutzerfreundlichkeit durch Bereitstellung eines neuen Bilds, das das Ziehen der Coil in die Einführhülse veranschaulicht. Benutzerfreundlichkeit durch Bereitstellung eines neuen Bilds, das das Vorschieben der Coil in den Katheter veranschaulicht. CAL-SB
20 Entsprechende Änderung der Nummerierung anschließender Abbildungen. Überarbeitung von Schritt 24 wie folgt: Von: Bei Eintreten des Fluoroskopie- Markierungsstreifens (am Schaft der Fasszange) in die Einführhülse das Fluoroskop einschalten. Zu: Beim Eintreten des schwarzen Fluoroskopie- Markierungsstreifens (am Schaft der Fasszange) in die Einführhülse die Fluoroskopie einschalten. Überarbeitung von Schritt 29(b) wie folgt: Von: Wenn die Coil-Position nicht optimal ist, siehe Abschnitt 12 Umpositionierung von Coils nach der Freisetzung. Begründung der Aktualisierung Hinzufügung des Wortes schwarzen als zusätzliche Klarstellung im Hinblick auf den Markierungsstreifen an der Fasszange. Verdeutlichung der ordnungsgemäßen Coil- Positionierung für den Leser. Zu: Wenn die Coil proximal zum Atemweg platziert wurde, mit dem Platzieren weiterer Coils fortfahren und die Platzierung der fraglichen Coil nach der Platzierung der letzten Coil erneut beurteilen. Wenn sich das proximale Ende der Coil in das Gewebe drückt, wie in Abbildung 18 dargestellt, die Coil umpositionieren oder nach Bergung erneut freisetzen. Außerdem Verlegung des vorhergehenden Schritts 29(b) und Umwandlung desselben in den neuen Schritt 29(c), mit Integration eines Verweises auf Abbildung 19. Neue Abbildung 19 (Beispiel einer optimalen Coil- Platzierung), die eine weiter distal gelegene Platzierung der Coil zeigt, sodass die proximale Kugel der Coil nicht sichtbar ist. Verdeutlichung für den Leser; besseres Foto. Änderungen in Abschnitt 13.0 Bronchoskopische Coil-Entfernung nach der Implantation Entfernung des Tabellenformats und Umwandlung in Textformat. Benutzerfreundlichkeit. CAL-SB
21 Überarbeitung des 1. Warnhinweises durch Hinzufügung von (bspw. anhaltende Pleuraschmerzen) als konkretes Beispiel eines Grundes für eine Coil-Entfernung. Aufteilung des Warnhinweises bezüglich der Coil- Entfernung in zwei separate Warnhinweise für eine bessere Präsentation der Informationen und Fettdruck der Worte 2 oder mehr Monate. Streichung von Granulation und Hinzufügung von nachgewachsen. Außerdem Hinzufügung von Wenn eine bronchoskopische Entfernung nicht möglich ist, kann eine chirurgische Entfernung mit einem thorakoskopischen Ansatz in Betracht gezogen werden. Streichung des vorliegenden Hinweises ( Hinweis: Nach Möglichkeit stets versuchen, die Coil mittels bronchoskopischer Technik zu entfernen, bevor andere Methoden in Erwägung gezogen werden. ) aufgrund von Redundanz, angesichts des hinzugefügten neuen Textes zum Warnhinweis ( Wenn eine bronchoskopische Entfernung nicht möglich ist, kann eine chirurgische Entfernung mit einem thorakoskopischen Ansatz in Betracht gezogen werden ). Überarbeitung von Verfahrensschritt 1: Von: Für die Coil-Entfernung ist ein Bronchoskop mit einem 2,0-mm-Arbeitskanal und einer maximalen Nutzlänge von 65 cm erforderlich. Zu: Für die Durchführung einer bronchoskopischen Coil-Entfernung nach der Implantation muss ein therapeutisches Bronchoskop mit einem Arbeitskanal- Innendurchmesser von mindestens 2,0 mm und einer maximalen Nutzlänge von 65 cm verwendet werden. Außerdem Streichung der Leerstelle zwischen 20 und mm. Verdeutlichung für den Leser durch Hinzufügung eines konkreten Beispiels für eine Coil- Entfernung. Verdeutlichung für den Leser. Lesbarkeit durch Reduzierung von Redundanz. Übereinstimmung mit Hinweis (bezüglich der Notwendigkeit eines therapeutischen Bronchoskops) in Abschnitt 4.2 Warnhinweise zur Coil- Entfernung und Abschnitt 8.1 Erforderliche Materialien. CAL-SB
22 Änderungen in Abschnitt 15.0 Handelsmarken Änderung der -Adresse: Von: Falsches Routing bisherige - Adresse. Zu: CAL-SB
WICHTIGE RISIKOINFORMATIONEN
 WICHTIGE RISIKOINFORMATIONEN EM-PxC-2017-0598 Allgemeine Informationen Wie jedes medizinische Verfahren ist auch die Behandlung mit dem endobronchialen RePneu Coil-System von PneumRx mit Risiken und Komplikationen
WICHTIGE RISIKOINFORMATIONEN EM-PxC-2017-0598 Allgemeine Informationen Wie jedes medizinische Verfahren ist auch die Behandlung mit dem endobronchialen RePneu Coil-System von PneumRx mit Risiken und Komplikationen
RePneuTM Coil-System (zur Lungenvolumenreduktion)
 RePneuTM Coil-System (zur Lungenvolumenreduktion) GEBRAUCHSANWEISUNG 1 MPS Medical Product Service GmbH Borngasse 20 35619 Braunfels Deutschland Tel.: (+49) 6442 962073 Fax: (+49) 6442 962074 PneumRx,
RePneuTM Coil-System (zur Lungenvolumenreduktion) GEBRAUCHSANWEISUNG 1 MPS Medical Product Service GmbH Borngasse 20 35619 Braunfels Deutschland Tel.: (+49) 6442 962073 Fax: (+49) 6442 962074 PneumRx,
RePneu Coil-System Bedienungsanleitung
 RePneu Coil-System Bedienungsanleitung 0086 MPS Medical Product Service GmbH Borngasse 20 35619 Braunfels Deutschland Tel (+49) 6442.962073 Fax (+49) 6442.962074 PneumRx, Inc. 530 Logue Avenue Mountain
RePneu Coil-System Bedienungsanleitung 0086 MPS Medical Product Service GmbH Borngasse 20 35619 Braunfels Deutschland Tel (+49) 6442.962073 Fax (+49) 6442.962074 PneumRx, Inc. 530 Logue Avenue Mountain
Anhang III. Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage
 Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
RePneu Coil- Lungenvolumenreduktionssystem Bedienungsanleitung
 RePneu Coil- Lungenvolumenreduktionssystem Bedienungsanleitung 1 MPS Medical Product Service GmbH Borngasse 20 35619 Braunfels Deutschland Tel.: (+49) 6442 962073 Fax: (+49) 6442 962074 PneumRx, ein Unternehmen
RePneu Coil- Lungenvolumenreduktionssystem Bedienungsanleitung 1 MPS Medical Product Service GmbH Borngasse 20 35619 Braunfels Deutschland Tel.: (+49) 6442 962073 Fax: (+49) 6442 962074 PneumRx, ein Unternehmen
fortgeschrittenem Lungenemphysem
 PneumRx Coils: Neue randomisierte klinische Studien bestätigen wiederholt positive Ergebnisse bei Pa PneumRx Coils Neue randomisierte klinische Studien bestätigen wiederholt positive Ergebnisse bei Patienten
PneumRx Coils: Neue randomisierte klinische Studien bestätigen wiederholt positive Ergebnisse bei Pa PneumRx Coils Neue randomisierte klinische Studien bestätigen wiederholt positive Ergebnisse bei Patienten
Anhang III. Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale
Anhang III Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale
Patientenleitfaden. Ventiltherapie für Patienten mit Emphysem
 Patientenleitfaden Ventiltherapie für Patienten mit Emphysem Das Emphysem gehört zu einer Gruppe von Erkrankungen, die chronisch-obstruktive Lungenerkrankung genannt wird, kurz COPD (abgeleitet vom engl.
Patientenleitfaden Ventiltherapie für Patienten mit Emphysem Das Emphysem gehört zu einer Gruppe von Erkrankungen, die chronisch-obstruktive Lungenerkrankung genannt wird, kurz COPD (abgeleitet vom engl.
Lang wirksame Beta-Mimetika Long Acting Beta Agonists (LABAs) erhöhtes Risiko einer Exazerbation der Asthmasymptome
 Lang wirksame Beta-Mimetika Long Acting Beta Agonists (LABAs) erhöhtes Risiko einer Exazerbation der Asthmasymptome Basisinformation FACHINFORMATION Lang wirksame Beta-Mimetika - Long Acting Beta Agonists
Lang wirksame Beta-Mimetika Long Acting Beta Agonists (LABAs) erhöhtes Risiko einer Exazerbation der Asthmasymptome Basisinformation FACHINFORMATION Lang wirksame Beta-Mimetika - Long Acting Beta Agonists
LEBEN MIT AML: MEINE PERSÖNLICHE CHECKLISTE
 LEBEN MIT AML: MEINE PERSÖNLICHE CHECKLISTE Leitfaden für Ihr Gespräch mit dem Arzt und praktische Informationen rund um die Erkrankung und ihre Behandlung Was Sie fragen sollten, was Sie wissen sollten
LEBEN MIT AML: MEINE PERSÖNLICHE CHECKLISTE Leitfaden für Ihr Gespräch mit dem Arzt und praktische Informationen rund um die Erkrankung und ihre Behandlung Was Sie fragen sollten, was Sie wissen sollten
Anhang III. Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale des Arzneimittels, der Etikettierung und
Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale des Arzneimittels, der Etikettierung und
behördlich genehmigtes Schulungsmaterial (Adalimumab) Patientenpass für Erwachsene
 behördlich genehmigtes Schulungsmaterial HUMIRA (Adalimumab) Patientenpass für Erwachsene Juli 2017 Liebe Patienten, lieber Patient, Ihr behandelnder Arzt hat Ihnen HUMIRA verordnet. Dieser Patientenpass
behördlich genehmigtes Schulungsmaterial HUMIRA (Adalimumab) Patientenpass für Erwachsene Juli 2017 Liebe Patienten, lieber Patient, Ihr behandelnder Arzt hat Ihnen HUMIRA verordnet. Dieser Patientenpass
LEBEN MIT AML: MEINE PERSÖNLICHE CHECKLISTE
 LEBEN MIT AML: MEINE PERSÖNLICHE CHECKLISTE Leitfaden für Ihr Gespräch mit dem Arzt und praktische Informationen rund um die Erkrankung und ihre Behandlung Was Sie fragen sollten, was Sie wissen sollten
LEBEN MIT AML: MEINE PERSÖNLICHE CHECKLISTE Leitfaden für Ihr Gespräch mit dem Arzt und praktische Informationen rund um die Erkrankung und ihre Behandlung Was Sie fragen sollten, was Sie wissen sollten
ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION
 ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION Diese Änderungen von SPC und Packungsbeilage treten zum Zeitpunkt der Kommissionsentscheidung in Kraft.
ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION Diese Änderungen von SPC und Packungsbeilage treten zum Zeitpunkt der Kommissionsentscheidung in Kraft.
Akute venösen Thromboembolien (VTE) oder VTE in der Vorgeschichte, einschließlich tiefer Venenthrombose und Lungenembolie.
 Aktualisierte Indikation Behandlung der schweren Osteoporose: bei postmenopausalen Frauen, bei erwachsenen Männern, mit hohem Frakturrisiko, für die eine Behandlung mit anderen für die Osteoporosetherapie
Aktualisierte Indikation Behandlung der schweren Osteoporose: bei postmenopausalen Frauen, bei erwachsenen Männern, mit hohem Frakturrisiko, für die eine Behandlung mit anderen für die Osteoporosetherapie
ANHANG III. Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 ANHANG III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Die zuständigen Behörden der Mitgliedstaaten müssen die Zusammenfassung der
ANHANG III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Die zuständigen Behörden der Mitgliedstaaten müssen die Zusammenfassung der
LEBEN MIT AML: MEINE PERSÖNLICHE CHECKLISTE
 LEBEN MIT AML: MEINE PERSÖNLICHE CHECKLISTE Leitfaden für Ihr Gespräch mit dem Arzt und praktische Informationen rund um die Erkrankung und ihre Behandlung Was Sie fragen sollten, was Sie wissen sollten
LEBEN MIT AML: MEINE PERSÖNLICHE CHECKLISTE Leitfaden für Ihr Gespräch mit dem Arzt und praktische Informationen rund um die Erkrankung und ihre Behandlung Was Sie fragen sollten, was Sie wissen sollten
RoACTEMRA (Tocilizumab) i.v. und s.c. Patientenpass
 RoACTEMRA (Tocilizumab) i.v. und s.c. Patientenpass Dieser Patientenpass enthält wichtige Sicherheitsinformationen, über die Patienten bzw. deren Eltern/ Erziehungsberechtigte Bescheid wissen müssen, bevor,
RoACTEMRA (Tocilizumab) i.v. und s.c. Patientenpass Dieser Patientenpass enthält wichtige Sicherheitsinformationen, über die Patienten bzw. deren Eltern/ Erziehungsberechtigte Bescheid wissen müssen, bevor,
MYCOPHENOLAT-MOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN. Information über die Risiken für das ungeborene Baby
 MYCOPHENOLAT-MOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN Information über die Risiken für das ungeborene Baby Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen
MYCOPHENOLAT-MOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN Information über die Risiken für das ungeborene Baby Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen
RePneu Coils Hilfe beim Lungenemphysem
 RePneu Coils Hilfe beim Lungenemphysem Revive. Rebound. Renew. Die Lunge Die Lunge ist für die Sauerstoffversorgung des menschlichen Körpers zuständig. Sie besteht aus zwei von einander unabhängigen Lungenflügeln
RePneu Coils Hilfe beim Lungenemphysem Revive. Rebound. Renew. Die Lunge Die Lunge ist für die Sauerstoffversorgung des menschlichen Körpers zuständig. Sie besteht aus zwei von einander unabhängigen Lungenflügeln
Zenith Alpha T HORACIC ENDOVASCULAR GRAFT
 Entfaltungssequenz Zenith Alpha T HORACIC ENDOVASCULAR GRAFT www.cookmedical.com Vorbereitung und Spülung Proximale und distale Komponenten Das Innenstilett mit dem gelben Ansatz aus der Dilatatorspitze
Entfaltungssequenz Zenith Alpha T HORACIC ENDOVASCULAR GRAFT www.cookmedical.com Vorbereitung und Spülung Proximale und distale Komponenten Das Innenstilett mit dem gelben Ansatz aus der Dilatatorspitze
MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN
 MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN Informationen über das Risiko für das ungeborene Baby Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln (Mycophenolat Mofetil
MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN Informationen über das Risiko für das ungeborene Baby Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln (Mycophenolat Mofetil
Anhang III. Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des
Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des
Anhang I. Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen
 Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang III. Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen
 Anhang III Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen Anmerkung: Diese Änderungen der entsprechenden Abschnitte der Zusammenfassung
Anhang III Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen Anmerkung: Diese Änderungen der entsprechenden Abschnitte der Zusammenfassung
AMGEVITA (Adalimumab)
 AMGEVITA (Adalimumab) Patientenpass für Ihr Kind behördlich genehmigtes Schulungsmaterial Dieser Pass enthält wichtige Sicherheitsinformationen über AMGEVITA. Alle, die an der medizinischen Versorgung
AMGEVITA (Adalimumab) Patientenpass für Ihr Kind behördlich genehmigtes Schulungsmaterial Dieser Pass enthält wichtige Sicherheitsinformationen über AMGEVITA. Alle, die an der medizinischen Versorgung
Verschärfung der Warnungen um die Anwendung in der Schwangerschaft zu verhindern
 Mycophenolat (z.b. CellCept ) Verschärfung der Warnungen um die Anwendung in der Schwangerschaft zu verhindern Bonn (26. Oktober 2015) - Die Europäische Arzneimittel Agentur (EMA) warnt, dass der in der
Mycophenolat (z.b. CellCept ) Verschärfung der Warnungen um die Anwendung in der Schwangerschaft zu verhindern Bonn (26. Oktober 2015) - Die Europäische Arzneimittel Agentur (EMA) warnt, dass der in der
AMGEVITA (Adalimumab)
 AMGEVITA (Adalimumab) Patientenpass behördlich genehmigtes Schulungsmaterial Dieser Pass enthält wichtige Sicherheitsinformationen über AMGEVITA. Alle, die an Ihrer medizinischen Versorgung beteiligt sind,
AMGEVITA (Adalimumab) Patientenpass behördlich genehmigtes Schulungsmaterial Dieser Pass enthält wichtige Sicherheitsinformationen über AMGEVITA. Alle, die an Ihrer medizinischen Versorgung beteiligt sind,
RePneu Coils Hilfe beim Lungenemphysem
 RePneu Coils Hilfe beim Lungenemphysem Revive. Rebound. Renew. Die Lunge Die Lunge ist für die Sauerstoffversorgung des menschlichen Körpers zuständig. Sie besteht aus zwei von einander unabhängigen Lungenflügeln
RePneu Coils Hilfe beim Lungenemphysem Revive. Rebound. Renew. Die Lunge Die Lunge ist für die Sauerstoffversorgung des menschlichen Körpers zuständig. Sie besteht aus zwei von einander unabhängigen Lungenflügeln
RoACTEMRA (Tocilizumab) Patientenpass
 RoACTEMRA (Tocilizumab) Patientenpass Dieser Patientenpass ist eine Auflage im Rahmen der Zulassung von RoACTEMRA und enthält wichtige Sicherheitsinformationen, über die Patienten bzw. deren Eltern/gesetzliche
RoACTEMRA (Tocilizumab) Patientenpass Dieser Patientenpass ist eine Auflage im Rahmen der Zulassung von RoACTEMRA und enthält wichtige Sicherheitsinformationen, über die Patienten bzw. deren Eltern/gesetzliche
ANHANG III ÄNDERUNGEN DER ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND PACKUNGSBEILAGE
 ANHANG III ÄNDERUNGEN DER ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND PACKUNGSBEILAGE 25 KORREKTUREN, DIE IN DIE JEWEILIGEN ABSCHNITTE DER ZUSAMMENFASSUNG DER PRODUKTEIGENSCHAFTEN FÜR BROMOCRIPTIN-HALTIGE
ANHANG III ÄNDERUNGEN DER ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND PACKUNGSBEILAGE 25 KORREKTUREN, DIE IN DIE JEWEILIGEN ABSCHNITTE DER ZUSAMMENFASSUNG DER PRODUKTEIGENSCHAFTEN FÜR BROMOCRIPTIN-HALTIGE
Gebrauchsinformation: Information für Patienten. Osanit Hustenkügelchen Wirkstoff: Drosera D6
 Osanit Hustenkügelchen Seite 1 von 5 Gebrauchsinformation: Information für Patienten Osanit Hustenkügelchen Wirkstoff: Drosera D6 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Osanit Hustenkügelchen Seite 1 von 5 Gebrauchsinformation: Information für Patienten Osanit Hustenkügelchen Wirkstoff: Drosera D6 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
DRINGENDER SICHERHEITSHINWEIS
 DRINGENDER SICHERHEITSHINWEIS Fehlaktivierung der Sicherung des internen Akkus der Astral kann zu einem Stromausfall führen BRIEF FÜR PATIENTEN/PFLEGEPERSONEN Referenz: FSN1706001 Datum: 27. Juni 2017
DRINGENDER SICHERHEITSHINWEIS Fehlaktivierung der Sicherung des internen Akkus der Astral kann zu einem Stromausfall führen BRIEF FÜR PATIENTEN/PFLEGEPERSONEN Referenz: FSN1706001 Datum: 27. Juni 2017
Anhang III. Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage
 Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
Endoskopische Lungenvolumenreduktion mit Ventilen für Patienten mit. Lungenemphysem. Patientenratgeber
 Endoskopische Lungenvolumenreduktion mit Ventilen für Patienten mit Lungenemphysem Patientenratgeber Emphysem Das Emphysem gehört zu einer Gruppe von Krankheiten, die als chronisch obstruktive Lungenerkrankung
Endoskopische Lungenvolumenreduktion mit Ventilen für Patienten mit Lungenemphysem Patientenratgeber Emphysem Das Emphysem gehört zu einer Gruppe von Krankheiten, die als chronisch obstruktive Lungenerkrankung
Über die Mitralinsuffizienz und die Mitralklappen-Clip-Therapie
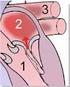 Über die Mitralinsuffizienz und die Mitralklappen-Clip-Therapie Hilfsmittel für Ärzte für die Patienteninformation. Über Mitralinsuffizienz Mitralinsuffizienz oder auch MI - ist eine Erkrankung, die eine
Über die Mitralinsuffizienz und die Mitralklappen-Clip-Therapie Hilfsmittel für Ärzte für die Patienteninformation. Über Mitralinsuffizienz Mitralinsuffizienz oder auch MI - ist eine Erkrankung, die eine
Meine persönliche Checkliste
 Meine persönliche Checkliste Leitfaden für Ihr Gespräch mit dem Arzt und praktische Informationen rund um die Erkrankung und ihre Behandlung. Was Sie fragen sollten, was Sie wissen sollten Der Umgang mit
Meine persönliche Checkliste Leitfaden für Ihr Gespräch mit dem Arzt und praktische Informationen rund um die Erkrankung und ihre Behandlung. Was Sie fragen sollten, was Sie wissen sollten Der Umgang mit
Im Anhang finden Sie das Rechtsdokument und das Antwortformular, das an uns zurückgesendet werden muss, um die Empfangsbestätigung zu bezeugen.
 Sehr geehrte Damen und Herren, im Rahmen seines Grundsatzes der kontinuierlichen Verbesserung ist Hill-Rom bei der Verbreitung von Sicherheitsanweisungen und Informationen zu den Medizinprodukten von Hill-Rom
Sehr geehrte Damen und Herren, im Rahmen seines Grundsatzes der kontinuierlichen Verbesserung ist Hill-Rom bei der Verbreitung von Sicherheitsanweisungen und Informationen zu den Medizinprodukten von Hill-Rom
1. Was ist Tantum Rosa und wofür wird es angewendet?
 Gebrauchsinformation: Information für Patienten Tantum Rosa - Vaginallösung Wirkstoff: Benzydaminhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
Gebrauchsinformation: Information für Patienten Tantum Rosa - Vaginallösung Wirkstoff: Benzydaminhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
Linksherzunterstützungssystem HeartMate 3 Katalog-Nr INT HM3 LVAS KIT
 Wichtige Information zu einem Medizinprodukt Aktualisierung Linksherzunterstützungssystem HeartMate 3 Katalog-Nr. 106524INT HM3 LVAS KIT 25. Mai 2018 Sehr geehrte Frau Doktor, Sehr geehrter Herr Doktor,
Wichtige Information zu einem Medizinprodukt Aktualisierung Linksherzunterstützungssystem HeartMate 3 Katalog-Nr. 106524INT HM3 LVAS KIT 25. Mai 2018 Sehr geehrte Frau Doktor, Sehr geehrter Herr Doktor,
Gebrauchsinformation: Information für Anwender. Osanit Zahnungskügelchen
 Gebrauchsinformation: Information für Anwender Osanit Zahnungskügelchen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält
Gebrauchsinformation: Information für Anwender Osanit Zahnungskügelchen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält
WAS SIE ÜBER RIXATHON (RITUXIMAB) WISSEN SOLLTEN
 WAS SIE ÜBER RIXATHON (RITUXIMAB) WISSEN SOLLTEN WICHTIGE SICHERHEITSINFORMATIONEN FÜR PATIENTEN, DIE MIT RIXATHON BEHANDELT WERDEN Dieses Informationsmaterial zur Anwendung von Rixathon (Rituximab) wurde
WAS SIE ÜBER RIXATHON (RITUXIMAB) WISSEN SOLLTEN WICHTIGE SICHERHEITSINFORMATIONEN FÜR PATIENTEN, DIE MIT RIXATHON BEHANDELT WERDEN Dieses Informationsmaterial zur Anwendung von Rixathon (Rituximab) wurde
Wichtige Feldkorrekturmaßnahme (CHC A.OUS.DM)
 , HC CEMEA GER QT LD, Ludwig Erhard Str. 12, 65760 Eschborn Abteilung QM Deutschland Telefon 0800 5806 900 10 Telefax +49 6196 7713 8899 E Mail Unser Zeichen KK Datum 13. Juli 2017 Wichtige Feldkorrekturmaßnahme
, HC CEMEA GER QT LD, Ludwig Erhard Str. 12, 65760 Eschborn Abteilung QM Deutschland Telefon 0800 5806 900 10 Telefax +49 6196 7713 8899 E Mail Unser Zeichen KK Datum 13. Juli 2017 Wichtige Feldkorrekturmaßnahme
Was Sie über MabThera wissen sollten
 Die Gesundheitsbehörden der Europäischen Union haben die Markteinführung des Medikaments MabThera an bestimmte Bedingungen gebunden. Der vorgeschriebene Plan zur Risikominimierung in Belgien und im Großherzogtum
Die Gesundheitsbehörden der Europäischen Union haben die Markteinführung des Medikaments MabThera an bestimmte Bedingungen gebunden. Der vorgeschriebene Plan zur Risikominimierung in Belgien und im Großherzogtum
[auf den Kopfbogen von RTI Surgical/Tutogen Medical GmbH, Neunkirchen, zu übernehmen] Dringende Sicherheitsinformation
![[auf den Kopfbogen von RTI Surgical/Tutogen Medical GmbH, Neunkirchen, zu übernehmen] Dringende Sicherheitsinformation [auf den Kopfbogen von RTI Surgical/Tutogen Medical GmbH, Neunkirchen, zu übernehmen] Dringende Sicherheitsinformation](/thumbs/92/108197783.jpg) [auf den Kopfbogen von RTI Surgical/Tutogen Medical GmbH, Neunkirchen, zu übernehmen] Dringende Sicherheitsinformation Art der Aktion: Prüfung des Warenbestands und Rücksendung der betroffenen Medizinprodukte
[auf den Kopfbogen von RTI Surgical/Tutogen Medical GmbH, Neunkirchen, zu übernehmen] Dringende Sicherheitsinformation Art der Aktion: Prüfung des Warenbestands und Rücksendung der betroffenen Medizinprodukte
Wesentliche Änderung EN 9100:2016 / EN 9120: München/Hamburg Michael Rotzsche/ Wolfgang Bott
 Wesentliche Änderung EN 9100:2016 / EN 9120:2016 Wesentliche Änderung EN 9100:2016 / EN 9120:2016 15.-16.03.2017 München/Hamburg Michael Rotzsche/ Wolfgang Bott 4.3 Festlegung des Anwendungsbereiches des
Wesentliche Änderung EN 9100:2016 / EN 9120:2016 Wesentliche Änderung EN 9100:2016 / EN 9120:2016 15.-16.03.2017 München/Hamburg Michael Rotzsche/ Wolfgang Bott 4.3 Festlegung des Anwendungsbereiches des
EVIDENZ KOMPAKT. Lungenfunktionstestung mittels Spirometrie bei asymptomatischen Erwachsenen
 EVIDENZ KOMPAKT Lungenfunktionstestung mittels Spirometrie bei asymptomatischen Erwachsenen Stand: 14.02.2017 Autoren Stefanie Butz (M. Sc. Public Health) Dr. med. Dagmar Lühmann (Oberärztliche Koordinatorin
EVIDENZ KOMPAKT Lungenfunktionstestung mittels Spirometrie bei asymptomatischen Erwachsenen Stand: 14.02.2017 Autoren Stefanie Butz (M. Sc. Public Health) Dr. med. Dagmar Lühmann (Oberärztliche Koordinatorin
Empfehlungen des PRAC zu Signalen für die Aktualisierung der Produktinformationen
 23 April 2015 EMA/PRAC/273924/2015 Pharmacovigilance Risk Assessment Committee Empfehlungen des PRAC zu Signalen für die Aktualisierung der Produktinformationen Verabschiedet im Rahmen der PRAC-Sitzung
23 April 2015 EMA/PRAC/273924/2015 Pharmacovigilance Risk Assessment Committee Empfehlungen des PRAC zu Signalen für die Aktualisierung der Produktinformationen Verabschiedet im Rahmen der PRAC-Sitzung
Neuer Order Manager für NobelProcera Software
 Neuer Order Manager für NobelProcera Software Kurzanleitung Version 1 Der neue Order Manager vereinfacht die Prozesse und Verfahren bei Bestellungen über das NobelProcera System. Dazu zählen das Erstellen,
Neuer Order Manager für NobelProcera Software Kurzanleitung Version 1 Der neue Order Manager vereinfacht die Prozesse und Verfahren bei Bestellungen über das NobelProcera System. Dazu zählen das Erstellen,
Gebrauchsanweisung Ösophagus-Stent Danis Seal (Danis Seal) Nicht-aktive implantierbare Vorrichtung
 Hergestellt von: ELLA CS, s.r.o. Milady Horakove 504 500 06 Hradec Kralove 6 Tschechische Republik Telefon: +420 49 527 91 11 Fax: +420 49 526 56 55 E-Mail: volenec@ellacs.eu Lieferumfang: Gebrauchsanweisung
Hergestellt von: ELLA CS, s.r.o. Milady Horakove 504 500 06 Hradec Kralove 6 Tschechische Republik Telefon: +420 49 527 91 11 Fax: +420 49 526 56 55 E-Mail: volenec@ellacs.eu Lieferumfang: Gebrauchsanweisung
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Nr. 6 Heuschnupfentropfen Mag. Doskar Gelsemium sempervirens D6, Euphorbium D6, Echinacea D1, Kalium chromosulfuricum (Alumen chromicum) D4 Lesen Sie die
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Nr. 6 Heuschnupfentropfen Mag. Doskar Gelsemium sempervirens D6, Euphorbium D6, Echinacea D1, Kalium chromosulfuricum (Alumen chromicum) D4 Lesen Sie die
Implantation eines ICD- oder CRT-Systems
 Implantation eines ICD- oder CRT-Systems Patient: Sehr geehrte Patientin, sehr geehrter Patient, bei Ihnen ist die Implantation eines ICD- (implantierbarer Kadioverter- Defibrillator) oder CRT-(cardiale
Implantation eines ICD- oder CRT-Systems Patient: Sehr geehrte Patientin, sehr geehrter Patient, bei Ihnen ist die Implantation eines ICD- (implantierbarer Kadioverter- Defibrillator) oder CRT-(cardiale
Erratum. zu CT/MRT-gestützten interventionellen schmerztherapeutischen Leistungen umfasst u. a. die CT-gesteuerte Intervention(en) nach der neuen
 Erratum zum Beschluss des Bewertungsausschusses nach 87 Abs. 1 Satz 1 SGB V in seiner 290. Sitzung (schriftliche Beschlussfassung) mit Wirkung zum 1. April 2013 Der Beschluss des Bewertungsausschusses
Erratum zum Beschluss des Bewertungsausschusses nach 87 Abs. 1 Satz 1 SGB V in seiner 290. Sitzung (schriftliche Beschlussfassung) mit Wirkung zum 1. April 2013 Der Beschluss des Bewertungsausschusses
Gebrauchsinformation: Information für Patienten. Hedelix s. a. Tropfen zum Einnehmen. Wirkstoff: Efeublätter-Auszug
 Gebrauchsinformation: Information für Patienten Hedelix s. a. Tropfen zum Einnehmen Wirkstoff: Efeublätter-Auszug Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Gebrauchsinformation: Information für Patienten Hedelix s. a. Tropfen zum Einnehmen Wirkstoff: Efeublätter-Auszug Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung, max. 200 Zeichen)
 NUB 1/4 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung, max. 200 Zeichen) Magenschrittmacher 1.2 Alternative Bezeichnunge(en) der Methode Enterra 1.3 Beschreibung der Methode Die
NUB 1/4 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung, max. 200 Zeichen) Magenschrittmacher 1.2 Alternative Bezeichnunge(en) der Methode Enterra 1.3 Beschreibung der Methode Die
Richtlinie. (Erprobungs-Richtlinie MM-pul-art-Druck- Herzinsuff)
 Richtlinie des Gemeinsamen Bundesausschusses zur Erprobung der Messung und des Monitorings des pulmonalarteriellen Drucks mittels implantierten Sensors zur Therapieoptimierung bei Herzinsuffizienz im Stadium
Richtlinie des Gemeinsamen Bundesausschusses zur Erprobung der Messung und des Monitorings des pulmonalarteriellen Drucks mittels implantierten Sensors zur Therapieoptimierung bei Herzinsuffizienz im Stadium
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Nr. 31 Schwindeltropfen Mag. Doskar Conium maculatum D4, Veratrum album D4, Anamirta cocculus D4, Secale cornutum D4, Cinchona pubescens D3. Lesen Sie die
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Nr. 31 Schwindeltropfen Mag. Doskar Conium maculatum D4, Veratrum album D4, Anamirta cocculus D4, Secale cornutum D4, Cinchona pubescens D3. Lesen Sie die
RePneu Coil-System (zur Lungenvolumenreduktion) Bedienungsanleitung
 RePneu Coil-System (zur Lungenvolumenreduktion) Bedienungsanleitung 1 MPS Medical Product Service GmbH Borngasse 20 35619 Braunfels Deutschland Tel.: (+49) 6442 962073 Fax: (+49) 6442 962074 PneumRx, Inc.
RePneu Coil-System (zur Lungenvolumenreduktion) Bedienungsanleitung 1 MPS Medical Product Service GmbH Borngasse 20 35619 Braunfels Deutschland Tel.: (+49) 6442 962073 Fax: (+49) 6442 962074 PneumRx, Inc.
COVERSUM Arginin 2,5 mg Filmtabletten
 Gebrauchsinformation: Information für Patienten COVERSUM Arginin 2,5 mg Filmtabletten Perindopril-Arginin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
Gebrauchsinformation: Information für Patienten COVERSUM Arginin 2,5 mg Filmtabletten Perindopril-Arginin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
System zur Stimulation des unteren Ösophagussphinkters. MRT Leitlinien mit EndoStim LES-Stimulator Modell 1002
 System zur Stimulation des unteren Ösophagussphinkters MRT Leitlinien mit EndoStim LES-Stimulator Modell 1002 EndoStim ist eine eingetragene Handelsmarke von EndoStim B.V. Vor der Verwendung des Geräts
System zur Stimulation des unteren Ösophagussphinkters MRT Leitlinien mit EndoStim LES-Stimulator Modell 1002 EndoStim ist eine eingetragene Handelsmarke von EndoStim B.V. Vor der Verwendung des Geräts
Gebrauchsinformation: Information für Patienten. Schlaf- und Entspannungstropfen Similasan Avena sativa D1, Passiflora incarnata D1
 1/5 Gebrauchsinformation: Information für Patienten Schlaf- und Entspannungstropfen Similasan Avena sativa D1, Passiflora incarnata D1 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
1/5 Gebrauchsinformation: Information für Patienten Schlaf- und Entspannungstropfen Similasan Avena sativa D1, Passiflora incarnata D1 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
Lungenvolumen- Reduktion mit RePneu Coils
 Lungenvolumen- Reduktion mit RePneu Coils Eine neue Behandlung für das Emphysem Revive. Rebound. Renew. Der Atem des Lebens Beim Atmen nimmt Ihre Lunge Sauerstoff auf und gibt Kohlendioxid aus dem Körper
Lungenvolumen- Reduktion mit RePneu Coils Eine neue Behandlung für das Emphysem Revive. Rebound. Renew. Der Atem des Lebens Beim Atmen nimmt Ihre Lunge Sauerstoff auf und gibt Kohlendioxid aus dem Körper
Gebrauchsinformation: Information für Patienten. Osanit Blähungskügelchen Wirkstoff: Matricaria recutita (Chamomilla) D12
 Seite 1 von 5 Gebrauchsinformation: Information für Patienten Osanit Blähungskügelchen Wirkstoff: Matricaria recutita (Chamomilla) D12 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
Seite 1 von 5 Gebrauchsinformation: Information für Patienten Osanit Blähungskügelchen Wirkstoff: Matricaria recutita (Chamomilla) D12 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
Datum: Kontakt: Abteilung: Tel. / Fax: Unser Zeichen: Ihr Zeichen:
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 25.10.2017 Ing. Veronika Iro, B.Sc. REGA +43 (0) 505 55 36247 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 25.10.2017 Ing. Veronika Iro, B.Sc. REGA +43 (0) 505 55 36247 pv-implementation@ages.at
Gebrauchsinformation: Information für Patienten Tabletten gegen Lampenfieber Similasan Wirkstoffe: Argentum nitricum D15, Strophanthus gratus D12
 1/5 Gebrauchsinformation: Information für Patienten Tabletten gegen Lampenfieber Similasan Wirkstoffe: Argentum nitricum D15, Strophanthus gratus D12 Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
1/5 Gebrauchsinformation: Information für Patienten Tabletten gegen Lampenfieber Similasan Wirkstoffe: Argentum nitricum D15, Strophanthus gratus D12 Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Rehabilitationsklinik. Unsere Leistungen
 Rehabilitationsklinik Unsere Leistungen Rehabilitationsklinik Sehr geehrte Patientin, sehr geehrter Patient, sehr geehrte Damen und Herren, die Rehabilitationsklinik St. Blasien ist eine Fachklinik zur
Rehabilitationsklinik Unsere Leistungen Rehabilitationsklinik Sehr geehrte Patientin, sehr geehrter Patient, sehr geehrte Damen und Herren, die Rehabilitationsklinik St. Blasien ist eine Fachklinik zur
MAVENCLAD. Informationsmaterial für Patienten. Version 1.0, [Stand Juli 2017]
![MAVENCLAD. Informationsmaterial für Patienten. Version 1.0, [Stand Juli 2017] MAVENCLAD. Informationsmaterial für Patienten. Version 1.0, [Stand Juli 2017]](/thumbs/78/78512222.jpg) MAVENCLAD Informationsmaterial für Patienten Version 1.0, [Stand Juli 2017] Wichtige Informationen für Patienten, die eine Therapie mit Mavenclad beginnen Inhalt Einführung Wie erfolgt die Behandlung mit
MAVENCLAD Informationsmaterial für Patienten Version 1.0, [Stand Juli 2017] Wichtige Informationen für Patienten, die eine Therapie mit Mavenclad beginnen Inhalt Einführung Wie erfolgt die Behandlung mit
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Nr. 19 Aknetropfen Mag. Doskar Kalium iodatum D3, Juglans regia D2, Berberis vulgaris D3
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Nr. 19 Aknetropfen Mag. Doskar Kalium iodatum D3, Juglans regia D2, Berberis vulgaris D3 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Nr. 19 Aknetropfen Mag. Doskar Kalium iodatum D3, Juglans regia D2, Berberis vulgaris D3 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
Neufassung des Wortlauts der Produktinformationen Auszüge aus den Empfehlungen des PRAC zu Signalen
 25 January 2018 EMA/PRAC/35610/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Neufassung des Wortlauts der Produktinformationen Auszüge aus den Empfehlungen des PRAC zu Verabschiedet im Rahmen
25 January 2018 EMA/PRAC/35610/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Neufassung des Wortlauts der Produktinformationen Auszüge aus den Empfehlungen des PRAC zu Verabschiedet im Rahmen
Verordnung über die ausserkantonalen Hospitalisierungen
 Verordnung über die ausserkantonalen Hospitalisierungen vom..07 (Stand 0.0.08) Der Staatsrat des Kantons Wallis eingesehen Artikel 4 des Bundesgesetzes vom 8. März 994 über die Krankenversicherung (KVG);
Verordnung über die ausserkantonalen Hospitalisierungen vom..07 (Stand 0.0.08) Der Staatsrat des Kantons Wallis eingesehen Artikel 4 des Bundesgesetzes vom 8. März 994 über die Krankenversicherung (KVG);
Gebrauchsinformation: Information für Patienten. Arnica montana D 6, Camphora D 10, Naja naja D 10, Viscum album D 6
 Tropfen gegen Kreislaufbeschwerden Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Kreislaufbeschwerden Similasan Arnica montana D 6, Camphora D 10, Naja naja D 10, Viscum album
Tropfen gegen Kreislaufbeschwerden Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Kreislaufbeschwerden Similasan Arnica montana D 6, Camphora D 10, Naja naja D 10, Viscum album
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Nr. 22 Stärkungstropfen für Kinder Mag. Doskar Ferrum phosphoricum D12, Calcium phosphoricum D12, Cinchona pubescens D4 Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Nr. 22 Stärkungstropfen für Kinder Mag. Doskar Ferrum phosphoricum D12, Calcium phosphoricum D12, Cinchona pubescens D4 Lesen Sie die gesamte Packungsbeilage
DELEGIERTE VERORDNUNG (EU).../... DER KOMMISSION. vom
 EUROPÄISCHE KOMMISSION Brüssel, den 24.3.2017 C(2017) 1951 final DELEGIERTE VERORDNUNG (EU).../... DER KOMMISSION vom 24.3.2017 zur Änderung der Delegierten Verordnung (EU) 2016/1675 zur Ergänzung der
EUROPÄISCHE KOMMISSION Brüssel, den 24.3.2017 C(2017) 1951 final DELEGIERTE VERORDNUNG (EU).../... DER KOMMISSION vom 24.3.2017 zur Änderung der Delegierten Verordnung (EU) 2016/1675 zur Ergänzung der
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Zovirax 3%-Augensalbe Wirkstoff: Aciclovir
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Zovirax 3%-Augensalbe Wirkstoff: Aciclovir Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Zovirax 3%-Augensalbe Wirkstoff: Aciclovir Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
Irreversible Überblähung der kleinsten luftgefüllten. Emphysem aus dem Griechischen bedeutet Aufblähung
 Das Lungenemphysem Irreversible Überblähung der kleinsten luftgefüllten Strukturen (Lungenbläschen, Alveolen) der Lunge. Emphysem aus dem Griechischen bedeutet Aufblähung Pathogenese Durch Entzündungsreaktionen,
Das Lungenemphysem Irreversible Überblähung der kleinsten luftgefüllten Strukturen (Lungenbläschen, Alveolen) der Lunge. Emphysem aus dem Griechischen bedeutet Aufblähung Pathogenese Durch Entzündungsreaktionen,
Patientenantrag zur Immunapherese bei aktiver rheumatoider Arthritis nach der Richtlinie Methoden vertragsärztliche Versorgung
 Postanschrift: KV Nordrhein Abteilung Qualitätssicherung 40182 Düsseldorf Kontakt: Julia Jansen Telefon: (0211) 5970-8223 Telefax: (0211) 5970-9796 E-Mail: apheresen@kvno.de Patientenantrag zur Immunapherese
Postanschrift: KV Nordrhein Abteilung Qualitätssicherung 40182 Düsseldorf Kontakt: Julia Jansen Telefon: (0211) 5970-8223 Telefax: (0211) 5970-9796 E-Mail: apheresen@kvno.de Patientenantrag zur Immunapherese
Dringend - Sicherheitshinweis
 S und Verehrter Kunde, im Rahmen der Anstrengungen von Samsung Electronics zur kontinuierlichen Verbesserung der Zuverlässigkeit und Sicherheit führen wir kontinuierlich Maßnahmen zur Überwachung der Leistung
S und Verehrter Kunde, im Rahmen der Anstrengungen von Samsung Electronics zur kontinuierlichen Verbesserung der Zuverlässigkeit und Sicherheit führen wir kontinuierlich Maßnahmen zur Überwachung der Leistung
Einleitung und Leseanweisung
 VII Einleitung und Leseanweisung Für wen ist dieses Buch? Der Pocket Guide ist für alle klinisch tätigen Psychiater geschrieben, denen das Kompendium der Psychiatrischen Pharmakotherapie für die Kitteltasche
VII Einleitung und Leseanweisung Für wen ist dieses Buch? Der Pocket Guide ist für alle klinisch tätigen Psychiater geschrieben, denen das Kompendium der Psychiatrischen Pharmakotherapie für die Kitteltasche
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER RELAX Nerven-Tabletten Wirkstoffe: Ambra grisea Trit. D6, Aurum metallicum Trit. C7, Myristica fragrans Trit. D12, Scutellaria lateriflora Trit. D6, Strychnos
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER RELAX Nerven-Tabletten Wirkstoffe: Ambra grisea Trit. D6, Aurum metallicum Trit. C7, Myristica fragrans Trit. D12, Scutellaria lateriflora Trit. D6, Strychnos
Gebrauchsinformation: Information für Patienten. Graphites D 12, Jodum D 15, Petroleum rectificatum D 12, Thallium sulfuricum.
 Tropfen gegen Haarausfall und brüchige Nägel Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Haarausfall und brüchige Nägel Similasan Graphites D 12, Jodum D 15, Petroleum rectificatum
Tropfen gegen Haarausfall und brüchige Nägel Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Haarausfall und brüchige Nägel Similasan Graphites D 12, Jodum D 15, Petroleum rectificatum
Gebrauchsinformation: Information für Patienten
 Tropfen gegen Akne Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Akne Similasan Acidum arsenicosum D 12, Clematis recta D 8, Graphites D 12 Lesen Sie die gesamte Packungsbeilage
Tropfen gegen Akne Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Akne Similasan Acidum arsenicosum D 12, Clematis recta D 8, Graphites D 12 Lesen Sie die gesamte Packungsbeilage
Globale Harmonisierung der Absorb und Absorb GT1 Indikation
 DRINGENDE SICHERHEITSINFORMATION / MASSNAHMENEMPFEHLUNG FÜR ÄRZTE Globale Harmonisierung der Absorb und Absorb GT1 Indikation 27. July 2016 HANDELSNAME: Bioresorbierbare vaskuläre Gerüstsysteme (BVS) Absorb
DRINGENDE SICHERHEITSINFORMATION / MASSNAHMENEMPFEHLUNG FÜR ÄRZTE Globale Harmonisierung der Absorb und Absorb GT1 Indikation 27. July 2016 HANDELSNAME: Bioresorbierbare vaskuläre Gerüstsysteme (BVS) Absorb
Gebrauchsinformation: Information für Patienten. Tropfen gegen nervöse Herzbeschwerden Similasan
 1/5 Gebrauchsinformation: Information für Patienten Tropfen gegen nervöse Herzbeschwerden Similasan Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
1/5 Gebrauchsinformation: Information für Patienten Tropfen gegen nervöse Herzbeschwerden Similasan Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
ANTRAG AUF EINTRAGUNG DER ERTEILUNG EINER PATIENTENVERFÜGUNG (*)
 ANTRAG AUF EINTRAGUNG DER ERTEILUNG EINER PATIENTENVERFÜGUNG (*) Vorname und Nachnamen der beantragenden Person: Herr/Frau Nr. des Personalausweises, Ausweises oder anderer Identitätsausweis: Anschrift:
ANTRAG AUF EINTRAGUNG DER ERTEILUNG EINER PATIENTENVERFÜGUNG (*) Vorname und Nachnamen der beantragenden Person: Herr/Frau Nr. des Personalausweises, Ausweises oder anderer Identitätsausweis: Anschrift:
Datum: Kontakt: Abteilung: Tel. / Fax: Unser Zeichen: Ihr Zeichen:
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 25.06.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 25.06.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Basistherapie mit Abatacept
 PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Basistherapie mit Abatacept Sehr geehrte Patientin! Sehr geehrter Patient! Sie leiden an einer chronischen Polyarthritis (Rheumatoiden Arthritis). Ihr
PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Basistherapie mit Abatacept Sehr geehrte Patientin! Sehr geehrter Patient! Sie leiden an einer chronischen Polyarthritis (Rheumatoiden Arthritis). Ihr
Name der Einrichtung Zu Händen des Beauftragten für Medizingerätesicherheit Adresse 2. Postleitzahl Stadt
 Page 1 sur 5 Name der Einrichtung. Zu Händen des Beauftragten für Medizingerätesicherheit Adresse 1 Adresse 2 Postleitzahl Stadt Ivry le Temple, 5. April 2017 DRINGEND FREIWILLIGE SICHERHEITSKORREKTURMASSNAHME
Page 1 sur 5 Name der Einrichtung. Zu Händen des Beauftragten für Medizingerätesicherheit Adresse 1 Adresse 2 Postleitzahl Stadt Ivry le Temple, 5. April 2017 DRINGEND FREIWILLIGE SICHERHEITSKORREKTURMASSNAHME
Leben mit. LEMS.com LAMBERT-EATON- MYASTHENIE-SYNDROM
 PATIENTENINFORMATION Leben mit LAMBERT-EATON- MYASTHENIE-SYNDROM Sie haben diese Broschüre erhalten, da man bei Ihnen die Diagnose Lambert-Eaton-Myasthenie-Syndrom, bzw. kurz LEMS, gestellt hat. Diese
PATIENTENINFORMATION Leben mit LAMBERT-EATON- MYASTHENIE-SYNDROM Sie haben diese Broschüre erhalten, da man bei Ihnen die Diagnose Lambert-Eaton-Myasthenie-Syndrom, bzw. kurz LEMS, gestellt hat. Diese
Gebrauchsinformation: Information für Patienten
 1/5 Gebrauchsinformation: Information für Patienten Tropfen gegen Rheuma und Gicht Similasan Arnica montana D 8, Ledum palustre D 6, Pulsatilla pratensis D 8, Rhus toxicodendron D 6, Filipendula ulmaria
1/5 Gebrauchsinformation: Information für Patienten Tropfen gegen Rheuma und Gicht Similasan Arnica montana D 8, Ledum palustre D 6, Pulsatilla pratensis D 8, Rhus toxicodendron D 6, Filipendula ulmaria
Geplante Änderungen an den relevanten Abschnitten der Packungsbeilage
 Geplante Änderungen an den relevanten Abschnitten der Packungsbeilage 1 B. Packungsbeilage 1. Was ist und wofür wird es angewendet? [Dieser Abschnitt soll wie folgt gefasst werden:]
Geplante Änderungen an den relevanten Abschnitten der Packungsbeilage 1 B. Packungsbeilage 1. Was ist und wofür wird es angewendet? [Dieser Abschnitt soll wie folgt gefasst werden:]
rund 200 ausgewählte Wirkstoffe
 rund 200 ausgewählte Wirkstoffe Von der Wirkstoffverordnung sind insbesondere folgende Darreichungsformen ausgeschlossen: - Arzneimittel, die auf die Haut aufgetragen werden (z.b. Salben, Gele) - Arzneimittel
rund 200 ausgewählte Wirkstoffe Von der Wirkstoffverordnung sind insbesondere folgende Darreichungsformen ausgeschlossen: - Arzneimittel, die auf die Haut aufgetragen werden (z.b. Salben, Gele) - Arzneimittel
Wichtige Sicherheitsinformationen zur Minimierung des Risikos von immunbedingten Nebenwirkungen
 BAVENCIO (Avelumab) Version 1.6, Juli 2017 Wichtige Sicherheitsinformationen zur Minimierung des Risikos von immunbedingten Nebenwirkungen Patientenpass Dieses Arzneimittel unterliegt einer zusätzlichen
BAVENCIO (Avelumab) Version 1.6, Juli 2017 Wichtige Sicherheitsinformationen zur Minimierung des Risikos von immunbedingten Nebenwirkungen Patientenpass Dieses Arzneimittel unterliegt einer zusätzlichen
Gebrauchsinformation: Information für Patienten
 1 Gebrauchsinformation: Information für Patienten Globuli gegen stockenden Schnupfen Similasan Wirkstoffe: Hydrargyrum sulfuratum rubrum D10, Kalium bichromicum D8, Luffa operculata D8 Lesen Sie die gesamte
1 Gebrauchsinformation: Information für Patienten Globuli gegen stockenden Schnupfen Similasan Wirkstoffe: Hydrargyrum sulfuratum rubrum D10, Kalium bichromicum D8, Luffa operculata D8 Lesen Sie die gesamte
Gebrauchsinformation: Information für Patienten. Entzündete Augen Augentropfen Similasan
 1 Gebrauchsinformation: Information für Patienten Entzündete Augen Augentropfen Similasan Wirkstoffe: Atropa bella-donna D6, Euphrasia 3c D6, Hepar sulfuris D12 Lesen Sie die gesamte Packungsbeilage sorgfältig
1 Gebrauchsinformation: Information für Patienten Entzündete Augen Augentropfen Similasan Wirkstoffe: Atropa bella-donna D6, Euphrasia 3c D6, Hepar sulfuris D12 Lesen Sie die gesamte Packungsbeilage sorgfältig
